





















PHIFH ỈFFủ'TNi PTV ( MTẺIl AIỦTRAẢ IA
.I
.…- … …… ……g.… .. .…m.… ..
CAFITON ỉ Camplo' 1 100mg/5mL I Vietnam |
ũr-JÙO—ù WA ẺKMI OMuv Funcmn…
45 x 45 x 60mm ²50gsm Curta Solid: | za…i nla | ma1om
we'cdnn Sửu."ự Cáout cnb.ưl tam… Wuả
I Bluck . PMS 541 PMS m I …s Vìolet I PMS atzs
'tuw … :… V Ide .'w ; m…mM u…
1 [ PMS 159 . PMS m nla nla ] Laydmun
P , __ …J’Ữ'ỊĐercỉvals \ F…“ onvns cs cn’rem r… P80172 l’*-… ]
) k ' * ' “
,
íìÊ -ịè`ẩ “Lũ'iĩị
Lí… ũảuz.......J.…
.ỉ.… .…………
, \
' KEEP CƯT OF FIEACN OF
C'HlLfflEN
READ THE PACKAGE !NSEFIT
CAHEFLLLY HEFORE USE
lnúcnlỉnơe. douoe.
ldmmatnũm cemưoca'ons
md om: 'rlơmdon Hana
1 l
. @ Thuốc bán theo đơn |
ỆCAMPTO ị
ínnotecan hydrochlnrlde .
mhỵume
|
100mg/5mL .
Mn…huuac by. ,
Pllzef (Futh Pty Ud
Tnchrulcqv Puk
VS BơJda Hdl ũlu
Gmhy WMvoa. Ausun»:` u…g mơ m,, dk & uh:
" 1 mm m DIđ'r Iilmịruyuuírứv
mựh
Hỏp \ ^ọ Sua…
« Sũ< vu›xxxx-xx
3 unm nn
v nnum
u unum
. ,__..Ị
»
\
\—
DRVIE CS CRT61O
PAR-20l 4-0027998
cExựanym EM,
eecvaưóuc n Nsu
. oums muơc KHI nùụe
CH dinh, cidị mìnc. cqu di
@ vi cả: … m mic ìGn
… lè hrỏnq dn ú dụm
xùrn …
Bù:
wa
Trkh ’
Mị Ổq1ưhthòc
Sảmnuất ịa:
Ph'Iu (th) Fty le
Yocfmlogy Pưk
. \SEm Hdle
Bmdcy wnmz úa,
cmmc xxxx
uxtmn
DRAFT“ 4
- 1 U dỏkhòng Í
ĐẠl_DiỆN _.
m _THAgiH PHO
HỔ CHI MINH
… .Đwwvln L
'1W SIỒUIOO I—
ameÁuuị
apuouampẤư usasmuu;
o…devoỆ
@
. ® Pneuríptiun nnly medlclne
CCỄCAM PTơ
.
I
|
\
|
Innolecan hydvcchlcrice .
mhydmlc ,
ị
|
I
100mg/5mL
Cenaenlrlư :duhmluư
nhvonou: tuluw .
and v wí SmL '.
f\
05 Oct 2015
@
PFIZER (PERTH) PTV LIMITED. AUSTRAL IA
hcm Cuu
llcm Docucl Nan» Dosage/Vmum Cumlry/Gommclot
LABEL Campto® 1 OOmg/ãmL Vietnam
Dưnaruion: an Dimuwcns Mneunl Adhzslve Wnnrg Fmshnd Produc1 Cudlll
60 x 20mm 60 x 27mm Polypropylene Permanent 0/S R/H Lead 840470²1
Nu. nl r.olmu Col… 1 Cduư 2 Cobư 3 Colnư I Gobuơ 5
I Black I PMS 541 I PMS Violet I PMS 3425 I PMS 159
6 Coi… G Coiuur 7 Culou a Cnlw D Normnmmg slmer-Ls
| PMS 123 nla n/a nla [] Laydown
Pmiculu lnsnunỉmn
Barcode continuous, not die-cut. Dìgital print.
…… Supa Stik |°…â “" DRVI CP L1OO [WWM
llllllilllllllll
DRVI CP L1OO
PAR-2014-0022622
ỆCAMPTO
i'ẵỀẵ'ẵả'f hyctochlunde
1 OOmg/5mL
Cenomvde mion foư
Intravunoua Muskm
Fnr irưuvmous inlulnn. Stuu below
wr. Proled Imrn l›ghl. Du ml
Cuu Mmullcbmd nyi inv
mcmiz
DRAFT" 2
XXXX
Ha BblllQ/VV
tnlunm WfflMIVY
VĂN PHÒNG
ĐAI DIỆN
TẬÍJHÀNH PH
HO CHÍ MINH
O›
05 Aug 2014
LPD Date March ':5. 2010
Country Vicmam
Reference UK SP(` daiedz Febmary, 2016
vỉ… PHỘNG ỒẶ
ĐAI DIẸN ' \
TAI THANH PHỐ Ễf
HỒ CHÍ MINH Ế
CAMPTO®
Irinotecan hyđrochlorid trihydrat `
( Dung dịch đậm đặc đê pha dung dịch tìêm tmyên)
Rx
CẢNH BÁO ĐẶC BIỆT:
Thuốc nây chỉ dùng theo đơn của bác sĩ.
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Không dùng quá liều chỉ định.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Nếu cãn thêm thông tin xin hỏi y kiến bảc sĩ
Không sử dụng thuốc đã quá hạn dùng.
Để xa tầm tay trẻ em.
1. TÊN THUỐC
CAMPTOB' 20 mgx’ml. dung dịch đậm đặc để pha dung dịch tiêm truyền.
2. THÀNH PHẨN ĐỊNH LƯỢNG VÀ ĐỊNH TÍNH
Dung dịch đậm đặc chứa 20 mng irinotecan hydrochlorid, trihydrat (tương đương vởi 17,33
mglml irinotecan). Lọ CAMPTO chứa 40 mg hoặc 100 mg irinotecan hydrochlorid, trihydrat.
Thông tin về tá dược, xỉn xem mục 6.1.
3. DẠNG BÀO CHẾ
Dung dịch đậm đặc để pha dung dịch tiêm truyền.
4. ĐẶC TÍNH LÂM SÀNG
4.1. Chỉ định điếu trị
CAMPTO được chỉ định để điều trị cho bệnh nhân ung thư ruột kết - trực trảng tiến trìển:
o Phội họp với 5-fiuorouracil vả acid folinic ở bệnh nhân ung thư ruột kết - trực trảng tiến
triên chưa hóa trị liệu trước đó,
0 Là lỉệu phảp đon trị liệu cho bệnh nhân không thảnh công với phác đồ điếu trị chứa 5-
fluorouracil đã thiết lập.
CAMPTO phối hợp vởì cetuximab được chỉ định 'điều trị cho bệnh n " bị ung_thư ruột kết -
trực trảng di cản vói gen KRAS wild- -type, có bỉêu hiện cùa thụ thê tố/tấng sinh biểu bì
(EGFR— epìdermal growth factor receptor), chưa được điếu trị ung thư di căn trước đó hoặc
sau khi thất bại vói liệu pháp thuốc gây độc tế bảo chứa irinotecan (xem mục 5.1).
CAMPTO phối họp với 5—fiuọrouracil, acid folinic vả bevacizumab được chỉ định điều trị đầu
tay cho bệnh nhân ung thư biêu mô ruột kêt hoặc trực trảng di căn
CAMPTO phối hợp với capecitabin, có hoặc không có bcvacizumab đế điếu trị đầu tay cho
bệnh nhân ung thư biếu mô ruột kết- trục trảng di căn
Trang I J’ 23
l.PD Dale: March 15, 2016
Country Vietnam
Ref'etence UK SPLĨ dated i-`cbruary, 3016
4.2. Liều dùng và cảch dùng
Chi dùng thuốc cho người lớn. Dung dịch tiêm truyền CAMPTO nên được truyền vảo tĩnh
mạch ngoại biên hoặc trung tâm.
Liều dùng khuyến nghị:
Trong điều trí đon đôc (cho bênh nhân đã đuơc điều trì truớc đó): Liều khuyến nghị oùa
CAMP ] O lả 350 mgirn² dùng qua đuờng truyền tĩnh mạch trong khoảng thời gian từ 30 đến
90 phủi, ha tuần một lằn (xem mục 6. 6 vả mục 4 4)
Trong điếu tri phối hon ícho bênh nhân chua đươc điếu tri truớc đó): Sự an toản và hiệu quả
của CAMPTO khi phối hợp với 5- Fluorouracil (SFU) vả acid folinic (FA) đã đuợc đánh giả
qua liệu trình điếu trị sau đây (xem mục 5.1):
. CAMPTO phối hợp với SFU/FA trong Iìệu [rình dùng thuốc 2 tuần một lần
Liều khuyến nghị cùa CAMPTO là 180 mg/m² dùng 2 tuần một lần qua đường truyền tĩnh
mạch trong khoảng thòi gian từ 30 đên 90 phủt, sau đó truyên acid folinic vả 5-fìuorouraci].
Đê biểt Iiếu lượng vả cảoh dùng cùa cetuximab đùng dồng thời, tham khảo thông tin kê toa
của cetuximab.
Thông thường, iiều irinotecan được dùng tương tự như iiếu đã dùng trong chu kỳ cuối cùng
cùa phác đô chứa irinotecan trưởc đó. Irinotccan chi được dùng sớm hon 1 giờ sau khi kêt
thúc lruyên cetuxỉmab.
Để biết liều lượng vả cách dùng cưa bevacìzurnab, tham khảo thông tin kê toa cùa
bevacizumab.
Để biết Iiếu lượng và cảoh dùng khi phối hợp với capecỉtabìn, xem mục 5.1 vả tham khảo các
thông tin thích hợp trong thông tin kê toa của capecỉtabin.
Điều chỉnh liều:
CAMP’FO nên được dùng sau khi tất cả các tảc dụng không mong muốn hồi phục về dến cấp
0 hoặc ] theo phân loại cùa NCl-CTC (Tỉêu chuân vê Độc tính Chung cúa Viện Ung thư
Quôc gia Uc) và khí linh trạng tìếu chảy liên quan đên điêu trị đã được giải quyêt hoản toản.
Khi bắt đầu liệu pháp điếu trị tiếp theo, liếu CAMPTO, vả SFU nếu dùng n đuợc giảm theo
oắp xấu nhất của lác dụng khộng mong muốn quan sảt thấy trong lẩn tì` ru , trưởc. Nên
đìếu trị chậm lại từ ì đến 2 tuân để hồi phục tù cảc tảo dụng không mong muôn liên quan đến
điếu lrị.
Với các tác dụng không mong muốn sau đây nên giảm liếu từ 15 đến 20% CAMPTO vả/hoặc
SFU nêu cân:
* Độc tính về huyết học (giảm bạch cầu trung tính cấp 4, giảm bạch cầu trung tính kèm sốt
(giảm bạch câu trung tính câp 3 4 vả sốt câp 2 4)… ơiảm tiêu cẩu và gỉảm bạch cầu (cắp
4),
o ĩ)ộc tính không phải huyết học (cấp 3 — 4).
Khuyến nghị sưa đổi liếu cetuxìmab khi dùng kết hợp vởi irinotccan phải tuân theo thông tin
thông tin kê toa oủa cetuxìmab.
Kết họp với capecitabỉn cho bệnh nhân từ 65 tuối trở lên, nên giảm lìếu capecitabin khởi đầu
xuống 800 mg/Ểm hai iần mỗi ngảy theo thông tin kê toa cùa capecitabìn "Iham khảo khuyến
Trang 2 23
LPD Date. March IS. 201t1
Country. Vietnam
Reference UK SPC datcd. February, 2016
nghị sửa đổi liếu trong phác đồ đỉều trị kết họp được cung cấp trong thông tin kê toa cùa
capecitabin.
Khoảng thời gian điều trị:
Nên tỉếp tục điếutrị bằng CAMPTO đến khi bệnh đạt được mức tiến triến mục tỉêu hoặc có
độc tính không thế châp nhận.
Cảc nhóm đặc biệt:
Bênh nhân bi suv chức năng Ean: Trong điếu trị dơn độc: Nồng độ bilirubin huyết {iên đến 3
lần giới hạn trên của phạm vi bình thường (ƯNL)) ở bệnh nhân có tinh trạng hoạt động 5 2,
nên xác định [iếu Campto khởi đầu. Ở những bệnh nhân bị tăng bilirubin huyết và thời gian
prothrombin nhiếu hơn 50%, độ thanh thải irinotec-an giảm (xem mục 5.2) và do đó nguy cơ
nhiễm độc huyết tăng lên. Do đó nên tiến hảnh theo dõi hảng tuần công thức mảu trong nhóm
bệnh nhân nảy.
o` Ở bệnh nhân có bilirubin lên đến 1,5 lần giởi hạn trên cùa phạm vi bình thường (ULN),
liêu CAMPTO khuyên nghị là 350 mg/m²,
. 0 bệnh nhân có bilirubin từ 1,5 đến 3 lần ULN, liếu CAMPTO khuyến nghị là 200 mg/m²,
. Bệnh nhân có bìlìrubìn vượt quá 3 lần ULN không nên được điều trị bầng CAMPTO (xem
mục 4.3 vả mục 4.4).
Không có gsẵn dữ liệu ở bệnh nhân bị sưy gan được điều trị bằng CAMP'I`O trong liệu pháp
điêu trị phỏi hợp.
Bênh nhân bị suv Hiảm chức năng thân: CAMPTO không được khuyến cản sử dụng ở bệnh
nhân bị suy chúc năng thận, do các nghiên cửu trong nhóm nảy chưa được thực hiện (xem
mục 4.4 và mục 5.2).
Người cao tuối: Chưa thực hiện nghiến cứu dược dộng học cụ'Ữể ớ nguời cao tuối. Tuy
nhỉên, liêu dùng nên được chọn lựa cân thận trong nhóm nảy do tâ Ễịât/giảm chức năng sinh
học cúa họ cao hơn. Nhóm nảy phải được giám sảt chặt chẽ hơn (xem mục 4.4).
4.3. Chống chỉ định
0 Bệnh viêm ruột mạn tĩnh vảx'hoặc tắc ruột (xem mục 4.4).
o Tiền sử có phản ứng quả mẫn nghiêm trỌng với irinotecan hydrochlorid trihydrat hoặc một
trong các tả dược cưa CAMPTO.
0 Phụ nữ cho con bú {xem mục 4.6 và mục 4.4).
0 Bilirubìn > 3 lần giới hạn trên cùa phạm Vì bình thường (xem mục 4.4).
0 Suy tủy xương nặng.
0 Tinh trạng hoạt động WHO > 2.
0 Sử dụng đồng thời với St John’s Wort (xem mục 4.5).
Đế biết thêm thông tin chống chỉ định của cetuximab hoặc bevacỉzurnab hoặc capecitabin,
tham khảo thông tin kê- toa cùa các sản phâm nảy.
Trang 3 J' 23
LPD Date March 15. 201o
Country Vietnam
Reference UK SPC dated February. 2016
4.4. Cãnh báo và thận trọng đặc biệt khi sử dụng
Chỉ nến sủ dụng CAMPTO ở các đcm vị chuyên về hóa trị iiệu các chẩt gây độc tế bảo vả chỉ
nên được dùng duới Sụ giám sảt cúa một thằy thuốc đủ năng lực trong việc sử dụng hóa trị
iiệu chống ung thu'
Do tính chất và tỷ lệ tác dụng không mong muốn, CAMPTO sẽ chỉ đuợc kê đơn trong các
truờng họp sau đây sau khi cân nhắc những iợi ich dụ kiến mang lại vuợt trội so vởi cảc nguy
cơ có thế có khi trị liệu:
0 Ở bệnh nhân có một yếu tố nguy cơ, đặc biệt lả những người có tinh trạng hoạt động WHO
= 2.
0 Trong một số it trường hợp hiếm gặp khi mà bệnh nhân dường như không theo được
những chỉ dẫn kiếm soát c-ảc tác dụng không mong muốn (cần điếu trị tiêu chảy ngay lập tức
vả kéo dải kết hợp uống/truyến nhiếu nước khi bắt đầu xuất hiện tiêu chảy muộn). Khuyển
cáo cẩn có giám sát chặt chẽ tại bệnh viện cho cảc bệnh nhân nảy.
Khi sư dụng trong điếu trị đon độc, CAMPTO thường được kê đợn vời liệu trinh dùng 3 tuần
một lân. Tuy nhiên, liệu trình dùng hảng tưân (xem mục 5) có thêđu'ợc cân nhăc ở bệnh nhân
cân theo dõi chặt chẽ hơn hoặc bệnh nhân có nguy cơ giảm bạch câu trung tinh nghiêm trọng.
Tiêu chảy muộn
Bệnh nhân cần được cho biết về nguy cơ bị tiêu chảy muộn xảy ra sau hơn 24 giờ sau khi
dùng CAMPTO vả vảo bất cứ iúc nảo trưởc chu kỳ tiếp theo. Trong điều trị đơn độc, thời
gỉan trung bình cùa tình trạng bắt đầu đi phân lóng đầu tiên lả vảo ngảy thử 5 sau khi truyền
CAM P'Ì`OIẸ. Bệnh nhân phải nhanh chóng thông báo cho bác sĩ của họ khi bị tiêu chảy và bắt
đầu đỉếu trị thích hợp ngay iập tức.
Bệnh nhân có nguy co tiêu chảy tãng lả nhũng người đã đuợc xạ trị bụng’chậu trưởc đó
nhũng nguời đã bị tăng bạch câu tù ban đầu, những nguời có tình trạng hoạt động > 2 vả phụ
nũ. Nếu không đuợc điều trị thích họp, tỉêu chảy có thể đe dọa tính mạng, đặc biệt là nêu
bệnh nhân đồng thòi cũng bị giám bạch cầu trung tính.
Ngay sau lần di phân lòng đẩu tiên, bệnh nhân nên bắt đầu uống một luợng lớn để uống có
chúa chắt điện giải và thục hiện ngay lập tức liệu phảp điếu trị tỉêu chảy hích họp Biện pháp
điều trị tiêu chảy nảy phải đuợc chỉ định bòỉ khoa phòng đã cho dùng CAÌỂ’TO jau khi xuất
viện, cần cấp cho bệnh nhân các thuốc theo đon để họ có thế điếu tn ti ngay khi bị.
Ngoài ra, họ phải thông báo cho bảo sĩ cùa họ hoặc khoa cho dùng CAMP O khi/nếu bị tiếu
cháy.
Biện pháp điếu trị tỉêu cháy hiện đang được khuyến các lá sủ dụng liếu !operamỉd cao (4 mg
cho lần uông đầu tiên và 2 mg sau môi 2 giò) Nên tiếp tục liệu pháp điếu trị nảy trong 12 giờ
sau iần đi phân iOng cuối cùng vả không nên điếu chỉnh irong mọi trường hợp ioperamid
không nên được dùng hon 48 giờ liên tục ở những liếu điếu trị nảy, và cũng không nên dùng ít
hon 12 giờ do nguy cơ bị iiệt ruột.
Ngoài điếu trị chống tiêu chảy, nên dùng một kháng sinh phố rộng dự phòng, khi tiêu chảy có
iiên quan vởi gỉảm bạch câu trung tính nghiêm trọng (lượng bạch câu trung tính < 500 tế
bảofmm²).
Ngoài đỉều trị bằng khảng sinh, khuyến cáo bệnh nhân nhập viện để kiếm soát tiêu chảy, trong
cảc trường hợp sau đây:
— Tiêu chảy kết hợp với sốt,
Trang 4 23
IPi'J Datc' March ]5, 2016—
Counuy Vicmam
Reference UK SPC datcd' Fcbruaq 2016
— Tiêu cháy nặng (cần truyền nước qua đường tĩnh mạch),
- Tỉêu chảy kéo dải hơn 48 giờ sau khi bắt đầu điều trị bằng lopcramid iiều cao.
Khỏng nên đùng ioperamid để dự phòng, ngay cả ở bệnh nhân tùng bị tiêu chảy muộn trong
cảc chu kỳ trước đó.
Ở bệnh nhân bị tiêu chảy nặng, nên gỉảm iìều ở các chu kỳ tiếp theo (xem mục 4.2).
Huyết học
Trong các nghiên cứu lâm sâng, tần suất giảm bạch cầu trung tính cấp 3 và 4 theo NCI CTC
cao hon rỏ rảng ở bệnh nhân được xạ trị vùng chậu/bụng trước đó so vói nhũng người đã
không được xạ trị. Bệnh nhân có tổng nồng độ bilirubin trong huyết thanh ở thời điếm ban
đầu lả 1,0 mg/dL hoặc cao hon cũng có khả năng cao hơn đáng kể bị giảm bạch cầu trung tính
cắp 3 và 4 trong chu kỳ đầu tiến so vói nhũng người có nổng độ bỉlirubin thấp hon 1,0 mg/dL
Nên theo dỏi hảng tuần công thúc máu toản phần trong quả trinh điếu trị bằng CAMPTO.
Bệnh nhân cần phái được biết truớc nguy cơ giảm bạch cầu trung tỉnh vả sốt. Giảm bạch cầu
trung tinh kèm sốt (nhiệt độ / 38°C vả luợng bạch cầu trung tính < 1.000 tế bảofmm°) nến
đuợc điếu trị khẩn câp tại bệnh viện bằng khảng sinh phố rộng qua đường tĩnh mạch.
Ó bệnh nhãn có các phản ửng huyết học nặng, nên giảm liều dùng cho Iần dùng tiếp theo
(xem mục 4.2).
Nguy cơ nhiễm trùng vả nhiễm độc huyết tăng ở bệnh nhân bị tiêu chảy nặng. Ở bộnh nhân bị
tiêu chảy nặng, nên kiêm tra công thức máu toản phân.
Suy gan
Nên thực hiện xét nghiệm chức nãngg oan lúc ban đầu vả truớc mỗi chu kỳ
Nên thco dõi hảng tuần công thức máu toản phần ở bệnh nhân có bilirubin từ l,5 đến 3 iần
ULN, do giâm độ thanh thai irìnotecan (xem mụcj.2) và do đó tăng nguy co nhiêm độc huyêt
trong nhóm nảy. Với bệnh nhân có bilirubin > 3 iân ULN (xem mục 4.3).
Buôn nôn vả nôn
Nên điếu trị dự phòng bằng thuốc chống nôn trước mỗi lần điếu trị bằng CAMPTO Buồn nôn
vả nỏn đã đuợc báo cáo thường xuyến. Bệnh nhãn bị nôn kèm tiêu chảy muộn cẩn phải nhập
viện cảng sóm cảng tốt để điếu trị.
Hội chứng cholinergic cấp
Nếu xảy ra hội chứng cholỉnergic cấp tính (được xác định gồm tiêu chảy sớm vả nhiều dẩư
hiệu và các triệu chứng khảc nhau như vả mồ hôi, đau quặn bụng, co đồng tử và tiết nước
bọt), nên cho dùng atropin suiphat (0,25 mg tiêm dưới da) trừ khi bị chống chỉ định trên lâm
sảng (xem mục 4.8).
Có thế quan sát thấy những triệu chửng nảy trong hoặc ngay sau khi trtlyần irỉnoteoan, các
.… , , , , … g , , . . /
triẹu chung nay được cho la co hen quan đcn hoạt tinh khang cholmcs ase,ơua chẩt gốc
irỉnotecan, vả được cho lả. sẽ xảy ra thường xuyên hơn với các liều irinotecarrẽấo hơn
Cần thận trọng ở bệnh nhân bị hen suyễn. Ở bệnh nhân bị hội chứng choiincrgic nặng và cấp
tính, nên sử dụng atropin suiphat dự phòng vởi cảc liêu C AMPTO tiêp theo.
Rối loạn hô hẩp
Bệnh phồi mô kẽ xuất hiên dưới dạng thâm nhiễm phối không hay xảy ra trong điều trị bằng
irinotecan. Bệnh phổi mô kê có thể gây tử vong. Các yếu tố nguy cơ có thể liến quan tới sự
Trang >” t`23
LPD Dam Manh ]5. 2016
Country Victnam
Reference UK SPC datcđ February 2016
tìến triến cúa bệnh phối mô kẽ bao gồm việc sử dụng cảc ioại thuốc nhiễm độc phối, xạ trị vả
các yêu tô kích thích khuân lạc. Bệnh nhân có yêu tô nguy cơ cân được theo dõi chặt chẽ đôi
với các triệu chúng hô hâp trước vả trong khi điêu trị băng irinotecan.
Thoát mạch
Mặc đù irinotccan không phải là chắt lảm rộp da, cần thận trọng dế tránh thoát mạch và cần
theo dõi dâu hiệu viêm Ở vị trí tiêm truyền. Nèu xảy ra hiện tượng thoảt mạch, nên tứa sạch vị
trí tiêm truyên vả chưòm đả.
Người cao tuôi
Do tần suất lảm giảm chúc nãng sinh học cao hơn ở bệnh nhân cao tuối, đặc biệt là chúc năng
gan, nên thận trọng lụa chọn iiều CAMPTO cho nhóm nảy (xem mục 4 2)
Bệnh viêm ruột mạn tính vả/hoặc tắc ruột
Bệnh nhân không được điều trị bằng CAMPTO nếu chưa diếu trị xong tắc ruột (xem mục
4.3).
Chức nãng thận
Đã quan sảt thấy có sụ tãng creatinin trong huyễt thanh hoặc nitơ urê trong mảu. Đã có những
truờng họp suy thận câp. Cảo tảc dung nảy thường đuợc cho lả do bỉến chúng nhiễm trùng
hoặc do mất nuớc liếm quan đến buồn nôn, nôn, hoặc tiêu chảy. Các trường hợp hiếm gặp bị
rối ioạn chức năng thận do hội chúng ly giải khối u cũng đã đuợc bảo cảo
Liệu phảp xạ trị
Bệnh nhân mà tru'ởc đó đã được xạ trị vùng chậu/bụng có nguy cơ suy tủy cao hon sau khi
cho dùng irinotecan. Bác sĩ nên thận trọng khi điều trị bệnh nhân được xạ trị nhiếu trước đó
(ví dụ >25% tùy xuong được xạ trị và trong vòng 6 tuần trước khi bắt đầu đìều trị bằng
ịrinotecan). Có thế áp dụng điếu chỉnh liếu cho nhóm nảy (xem mục 4.2).
Rôi loạn tim
Đã quan sảt thấy các tảc dụng thiểu máu cục bộ cơ tim sau đìều trị bằng irinotccan xuất hiện
chủ yếu ơ nhưng bệnh nhân có bệnh tim tiếm ẩn, cảc yếu tố nguy co bệnh tim mạch khác đã
biết, hay bệnh nhân đã được hóa trị liệu gây độc tế bảo trước đó (xem mục 4.8).
Do đó bệnh nhân có các yếu tố nguy cơ đã biết cằn đuợc theo dõi chặt chẽ, và cần có hảnh
động để cố gắng giảm thiếu tất cả các yếu tố nguy co có thế điếu chỉnh dược (ví dụ như hút
thuốc lá, tăng huyết ảp, vả tăng mỡ máu).
Rôi loạn mạch mảu
Irinotecan hiếm khi liên quan đển cảc tác dụng nghẽn mạch do huyết khối (nghẽn mạch phối,
huyết khối tĩnh mạch và nghẽn huyết khối động mạch) ở bệnh nhân có nhiếu yêu tố nguy cơ
ngoải khối u tiềm ẩn gây nên.
Tảc dụng ức chế miễn dịch/tăng nguy cơ bị nhiễm khuẩn
Cho dùng vắc xin sống hay vẳc xin sống đã được lảm suy yếu ở bệnh nhả suy giảm miễn
dịch do các tác nhân hóa trị liệu bao gồm irỉnotecan, có thể dẫn đến nhi kổ nghiêm
trỌng hoặc gây tử vong. Nên tránh tiêm chủng vẳc xỉn sống cho bệnh nhâh ng irinotecan.
Có thế cho dùng văc xin chết hoặc bất hoạt; tuy nhiên, đảp úng vói các vắc xin nảy có thế bị
suy yếu
'l`rang 6 4 23
LPD Date \4arch [5,2016
Counth Victnam
Reference UK SPC datcđ Fcbmanr. 2016
Các thận trọng khác
Do thuốc nảy có chưa sorbitol, nó không thích họp cho bệnh nhân không dung nạp fructose di
truyên.
Không thuờng xuyên quan sát thắy cảc trường họp bị suy thận, hạ huyết áp hoặc suy tuần
hoản ở bệnh nhân có các giai đoạn mất nước liên quan đến tỉêu chảy vả/hoặc nôn, hoặc nhiễm
trùng huyết.
Phải thực hiện các biện pháp tránh thai trong quá trinh điều trị và trong it nhất ba tháng sau
khi ngưng điêu trị.
Nên tránh dùng đổng thời irinotecan với một chất úc chế mạnh (ví dụ như ketoconazol) hoặc
chẳt gây cám ứng (ví dụ như rifampicin, catbamachin, phenobarbital, phenytoin, cây St
John' 5) của CYP3A4 do có thể lảm thay đối sụ chuyến hóa irinotecan (xem mục 4 5).
4.5. Tương tác với các thuốc khác và cảc ìoại tương tảc khảc
Tương tảo giữa ỉrinotecan vả các chất chặn thần kinh cơ không thể được loại trừ. Do
C AMPTO có hoạt tinh kháng cholinesterase, các loại thuốc có hoạt tính khảng cholincstcrasc
có thế kéo dải tác dụng chặn thằn kinh cơ của suxamethonium và đối kháng tảo dụng chặn
thần kinh cơ cùa các loại thuốc không khứ cục.
Một số nghiên cửu đã cho thấy dùng đồng thời các thuốc chống co giật gây cảm úng CYP3A
(vi đụ như carbamazepìn, phenobarbital hoặc phenytoin) dẫn dến giảm phoi nhiễm ỉrinotecan,
SN- 38 và glucmonid SN- 38 vả giảm tác dụng dược lục. Cảo tác đụng cùa các loại thưốc
chống co giật nảy được phán ảnh bời mức giảm AUC cùa SN-38 vả SN—38G 50% hoặc nhiếu
hơn. Ngoài cám ứng enzym cytochrom P450 3A, tinh trạng tăng cuờng glucuroniđ hóa và
tăng cường bải tỉết mặt có thể đóng một vai trò trong việc lảm giảm phoi nhiễm irinotecan và
các chất chuyến hóa cùa nó
Một nghiên oứu đã cho thấy dùng đồng thời ketoconazol đẫn đến giảm AUC cùa APC 87% vả
tăng AUC cùa SN-38 109% so với khi chi dùng irinotecan.
Cần thận trọng Ở những bệnh nhân uống đồng thời các thuốc đã biểt iả gây ức chế (ví dụ như
ketoconazoi) hoặc gây cảm ứng (ví dụ như rifampicin, carbarnachin phenobarbital hoặc
phenytoin) chuyển hóa thuốc bởi cytochrom P450 3A4. Nên tránh đùng đồng thời irỉnotecan
vởi chất ưc chế/cảm úng con đuờng chuyến hóa nảy do khả năng lảm thay đồi sự chuyền hóa
irinotccan (xem mục 4.4).
Trong một nghiên cúu dược động học nhờ (n=5), trong đó irinotec1}mẵổOm /m2 được dùng
kết họp với St. John's Won (Hypcricum perforatum) 900 mg, đãNỹịns được mức giảm
42% nông độ chẳt chuyến hóa có hoạt tính cưa irinotecan Ế -.t8f trong huyết tương
St. John s Wort lảm giam nông độ trong huyết tương cùa SN- 38. Do đó, không nên đùng St.
.lohn's Wort vởi irinotecan txern muc 4. 3).
Dùng đồng thời 5- fiuorouracihacìd folinic trong phảc đồ phối hợp không lâm thay đối cảc
tính chất dược động học của irinotecan.
Atazanavir suiphat. Dùng đồng thời atazanavir sulfat, một chất ửc chế CYP3A4 vả UGTIAI,
có thế sẽ iảm tăng mức phơi nhiêm toản thân của SN—38, chât chuyên hóa có hoạt tính của
irinotecan. Bảo sĩ nên cân nhăc điêu nảy khi cho dùng đông thời các loại thuôc nảy.
Tương tác thường gặp với tầJĩ ca’ các chầt gáy độc tế bảo
Việc dùng thuốc chống đông là phổ biến do tãng nguy cơ gặp các biến cố huyết khồi ở bệnh
ưng thư. Nếu có chỉ định dùng cảc thuốc chống đông kháng vitamin K, phải tăng tần suất theo
dõi [NR (Chi số Bỉnh thường hóa Quốc tế) đo chỉ sô diều trị hẹp của các thuốc nảy, khả năng
`l`rưng 7 23
LPD Datc~ Mamh tS, 2016
Country. Victnam
Rcfci'cncc UK SPC datcđ Fcbruaq. 20£6
biến thiên cao cùecsự đông máu tùy theo cả thế và khả năng tương tác giữa các thuốc chống
đông qua đường uõng với hoa trị liệu chông ung thư.
Thuốc chống chỉ đinh sử dung ẩồns,7 thời
— Vắc xin sốt vâng da: ngụy cơ bị phản ứng toản thân gây tử vong với vắc xin
Thuốc khỏng đươc: khuyến cảo khi sử dunE đồng thởí
- Vắc xỉn sống đã dược lảm suy yếu (trừ vắc xin bệnh sốt vảng da): nguy cơ mắc bệnh toản
thân, có thế gây tử vong (ví dụ như nhiêm trùng). Nguy cơ nảy tăng iên ở những dôi tượng dã
bị ức chế miên địch do bệnh đã có từ trước.
Sử dụng một vắc xin đã dược bất hoạt trong trường họp tồn tại nguy co nảy (bại liệt).
- Phenytoin: Nguỵ cơ bị co gìật nặng hơn do giảm hấp thu phcnytoin qua đường tiêu hóa bởi
thuôc gây độc tế bảo hoặc nguy cơ bị tăng cường độc tính do tăng chuyên hóa ở gan bởi
phenytoin.
T huốc cần cán nhắc khi sử đunz đồng thời
- Ciclosporin, 'I`acrolimus: Ửc chế miễn dịch quá mức với nguy cơ bị tăng sinh lympho
Không có bằng chứng cho thẳy rằng tinh an toản cùa irinotecan bị ảnh hưởng bới cctuximab
hoặc ngược lại.
Kết quả từ một thử nghiệm tượng tảo thuốc - thuốc chuyên bỉệt cho thẳy bcvacizumab không
có ảnh hướng rõ rảng lên đặc tính dược động học cưa irinotccan vả chât chuyên hóa có hoạt
tính SN-38 cùa nó. Tưy nhiên, điêu nây không ngăn ngừa được tình trạng tăng độc tính do đặc
tính dược lý cùa chúng.
4.6. Ánh hưởng đến khả năng sinh sản, phụ nữ có thai và cho con hú
Phu nữ có khá nảng mang thai,i Trảnh thai ở nam và nữ
Phụ nữ có khả năng mang thai và nam giới phải sử đụng biện pháp ngừa thai hiệu quả trong ]
thảng vả iên đên 3 thảng sau điêu trị.
Mang thai
Không có dữ liệu từ vỉệc sử dụng irinotecan ớ phụ nữ mang thai. lrinotccan đã được chứng
minh là gây nhiêm dộc phôi thai vả gây quải thai ở động vật. Do đó, dựa trên kêt quả từ
nghiên cửu dộng vật và cơ chế hoạt động cùa ỉrinotecan, không nến dùng CAMPTO trong khi
mang thai trừ khi việc dùng thuôc rõ rảng lả cân thiêt.
Phu nữ cho con bú
Ở chuột cống cho con bủ, 14C—irinotccan đã được phảt hiện trong 8 Chưa ;được biết
irinotecan có được bải tìêt vảo sữa người không. Do đó, vì khả năng có ph 'Jìg/bât lợi ở trẻ
bú mẹ, nên ngừng cho con bú trong thời gian điêu trị băng CAMP'I`O (xem niỆc 4.3)
Khát năng sinh sản
Không có dữ iiệu trên người về ảnh hướng của ỉrinotecan lên khả năng sinh sản. Ở động vật
đã ghi nhận ảnh hướng bãt lợi của irinotecan lên khả năng sỉnh sản cúa con con (xcm mục
5.3).
4.7. Ánh hưởng lên khả năng lải xe và vận hânh mảy móc
Bệnh nhân nên dược cảnh báo về khả năng bị chóng mặt hoặc rối loạn thị giác có thể xảy ra
trong vòng 24 giờ sau khi dùng CAMPTO, và nên được khuyên không lái xe hoặc vận hảnh
máy móc nêu các tríệu chứng nảy xảy ra.
Trang 8 «' 23
LPD Date March 15, 20…
Country Vlôinỉti'n
Reference UK SI’C đated: February, 2016
4.8. Cảc tác dụng không mong mưổn
CÁC NGHIÊN CỨU LÂM SÀNG
Dữ liệu về các tác dụng không mong muốn đă được thu thập rộng rãi tư cảc nghiến cứu về
ung lhu đại trục trảng di căn với tần suất như ở dưới Cảo tác dụng không mong muốn cho các
chỉ định khảc được dự bảo lả tương tư như dối với cảc tác dụng không mong muốn cho ung
thư đại trực trảng
Các tác dụng không mong muốn có giói hạn iiệu thường gặp nhất (>ƯiO) cùa irinotccan lả
tĩêu chảy muộn (xáy ra hơn 24 giờ sau khi dùng thuốc) và rôi loạn về máu bao gồm giảm bạch
cầu trung tính thiếu máu và giảm tiểu cầu.
Giám bạch cầu trung tỉnh là một tác dụng không mong muốn có giới hạn liếu. Giảm bạch cầu
trung tính có thề hồi phục vả không tích lũy; số ngảy trung binh cho dến thời diểm giảm bạch
cằn nghiêm trọng nhất là 8 ngáy bẩt kế dùng trong điều trị dơn độc hay diếu trị phối hợp
Hội chứng cholỉnergic cấp thoáng qua nghiêm trỌng đã được ghi nhận rất thường gặp.
Cảc triệu chứng chính được xác định là tiêu chảy sớm và các triệu chứng khảo nhau khác như
đau bụng, ra mồ hôi, co đồng tử vả tăng tiết nước bọt xảy ra trong khi truyền hoặc trong vòng
24 giờ dần tiến sau khi tỉêm truyền CAMP' [ O. Cảc triệu chúng nảy biến mất sau khi cho dùng
atropin (xem mục 4.4).
TRỊ LIỆU ĐON ĐỘC
Cảc tảo đụng không mong muốn sau đây dược xem là có thế hoặc có khả năng liên quan đến
việc cho dùng CAMPTO đã được bảo cáo từ '765 bệnh nhân ở iiồu khưyến cáo là 350 mglm²
trOng điếu trị đơn độc. Trong mỗi nhóm tần suất, các tác dụng không mong muốn được thế
hiện theo thủ tự mức độ nghiệm trọng giảm dần. Tần suất được xác định lả: rất thường gặp
(>1 10), thường gặp (>l/IOO đến 1’1.000 đến <1 100), hiếm gặp (>1/10.000
đỗn > 7 ;
4(<.1954) c42,9; 51,0) (34,8; 42,8) (51,6; 66,7) (35,8; 50,9)
Giá trị p 0,0038 0,0025
PFS _
Tỷ lệ hiêm nguy __ c _ ,
(C195%) 0,85 (0,726, 0,9)8) 0,68 (0,501, 0,234)
Gìả trị p 0,0479 0,0167
C] = khoảng tín cậy, FOTFIRIĩ irinotccan kốt hợp 5- -FUJFA tiêm truyền ORR (objectivc response rate)= lệ dáp ứng
khách quan (bệnh nhân có dáp ứng hoản toản hoặc dáp ứng một phần), PFS (prog1 ession-free survival time)- - thòi gỉan sống
không bệnh tiên triên
Trong phác đồ điều trị phối hợp vởi capecitabin
Dữ liệu từ một nghiên cửu pha III, ngẫu nhiên, có đối chứng (CAIRO) chúng minh cho việc
sử dụng capccitabin với lỉếu khỏi đầu là 1000 mgtm² phối họp với irinotecan iiệu trình 5 thần
một 1ần, diếu trị trong 2 tuần 1ảm iiệu pháp điều trị hảng đằu cho bệnh nhân bị ung thư ruột
kết - trực trảng di căn. 820 bệnh nhân được chọn ngẫu nhiến đế được đi L trị tuần tự (n=410)
hoặc diếu trị phối hợp (n=410). Điếu trị tuần tự bao gồm điều trị bướcỉĩ bằng’capccitabin
(1250 mgf'm2 hai iần mỗi ngảy trong 14 ngảy), bước hai lả irinotccan (35 2vảo ngảy 1),
và bước ba 1ả kết hợ capccitabin (1000 1nglm²hai iằn mỗi ngảy trong 14 ngảy) với
oxalipiatin (130 mg/m vảo ngảy 1). Điều nị phối hợp bao gồm điếu tri bưởc đẩu bằng
capccitabin (1000 mg!²m hai 1ần mỗi ngảy trong 14 ngảy) phối hợp với irinotccan (250 mg/m2
vảo ngảy 1) (XELIRI) và bước hai lá capecitabin (1000 mg/m2 hai lần mỗi ngảy trong 14
ngảy) kết hợp với oxaliplatin (130 mglm vảo ngảy 1) Tẩt cả cảc chu kỳ điếu trị được ảp
Trang 18 1' 23
1PD Daic~ Murch 15, 2016
Country V1cmam
Rei-crcncc UK SPC daicd. Fcbmaiy, 2016
dụng trong khoáng lhò~i gian 3 tuần. T1~ong điếu trị bước đầu thời gian sống không bệnh` tỉến
triên trung hình trong nhóm dự định điêu trị lả 5,8 tháng (CI 95%, 5,1 — 6,2 tháng) cho điếu trị
đơn độc băng capecitabin và 7,8 tháng (Cl 95%, 7,0 — 8,3 thảng) cho nhóm XELIRI
(p=0,0002).
Dữ Iỉệu từ một phân tích tạm thời của một nghiên cứu pha 11(A10 KRK 0604), da trung tâm,
ngẫu nhiên, có đối chứng đã chứng mỉnh cho việc sử dụng capccitabin với liếu khởi đầu là
800 mgjm2 3 tuần một iần, điều trị trong 2 tuần kết hợp với irinotccan vả bcvacizumab đế diếu
trị háng đằu cho bệnh nhân bị ung thư ruột kết- trực trảng di căn. 115 bệnh nhân được chọn
ngẫu nhiến đế điếu trị bằng capccitabin kết hợp với irinotccan (XELIRI) vả bcvacizumab:
capecitabin (800 mg/m2 hai lần môi ngảy trong hai tuần tiếp theo là một khoảng thời gian
nghỉ 7 ngảy) irinotccan (200 ng'2111 tiêm truyền trong 30 phút vảo ngảy 1, liệu trình 3 tưần
một lằn), vả bcvacizumab (7, 5 mgfkg tiêm truyền từ 30 đến 90 phủt vảo ngảy 1, iiệu trinh 3
tuần một lần); tổng số 118 bệnh nhân đuợc chợn ngẫu nhiên dế điếu trị bằng capecitabin kết
hợp với oxaliplatin cộng với bcvacizưmab: capccitabin (1000 mg/m2 hai lằn môi ngảy trong
hai tuần tiếp theo lá một khoảng thời gian nghỉ 7 ngảy), oxalỉplatỉn (130 mg/m liêm truyền
trong 2 giờ vảo ngảy i, liệu trình” 3 tuần một lằn), vả bcvacìzumab (7, 5 mglkg tiếm truyền từ
30 đến 90 phút vảo ngảy 1,1iệu trinh 3 tuần một lần). Tỷ lệ sống không hệnh tiễ ,1iếnẮthời
diếm 6 tháng trong nhóm dự định điều trị iả 80% (XELIRI kết hợp với bevaciự 1ẫzố) so với
74% (XELOX kết hợp với bcvacizumab). Tỷ lệ đảp úng toản bộ ( đáp ửng hoân toản cộng Với
dáp ứng một phần) 1â 45% (XELOX kểt hợp với bevacizumab) so vởi 47% (XELIRI kết hợp
với bcvacizumab).
Trong liêu pháp điều tri đớn đôc để điều tri bâc hai ung, thư ruôt kết - trưc trâng di căn:
Nghiên cưu iâm sảng pha [l/ili được thực hiện liệu trinh dùng thưốc 3 tuần một lần vởi hon
980 bệnh nhân bị ung thư ruột kêt - trực trảng di căn đã thât bại với phác đô 5-FU trước đó.
Hiệu quả cùzi CAMPTO dược dánh giả trong 765 bệnh nhân có tiến triến được ghi nhận so
với 5-FU ò~ đâu vảo nghiến cứu.
Giai đoạn 111
CAMP'I`O so với chăm sóc hỗ trợ CAMPTO so với 5FU
CAMPTO Chăm sóc CAMPTO SFU
hỗ trợ giá trị p giá trị p
n=183 n=90 n=127 n=129
Tỷ iệ sống
không bệnh tiến NA NA 33,5 * 26,7 p=0,03
triến (PFS) ở
thời điếm 6
thảng (%)
Tỷ lệ sông còn
ở thời điếm 12 36,2 * 13,8 p=0,0001 44,8* 32,4 p=0,0351
thảng (%)
Thời gian sông
trung bình 9.2* 6,5 p=0,0001 10,8* 8,5 p=0,0351
(thảng)
NA: Không áp dụng
* : (Jhênh lệch đáng kể có ý nghĩa thống kê
1“tang 19 .J' 23
1PD Date March 15, 2016
Country. Vietnam
Reference L`K SPC datcđ February. 2016
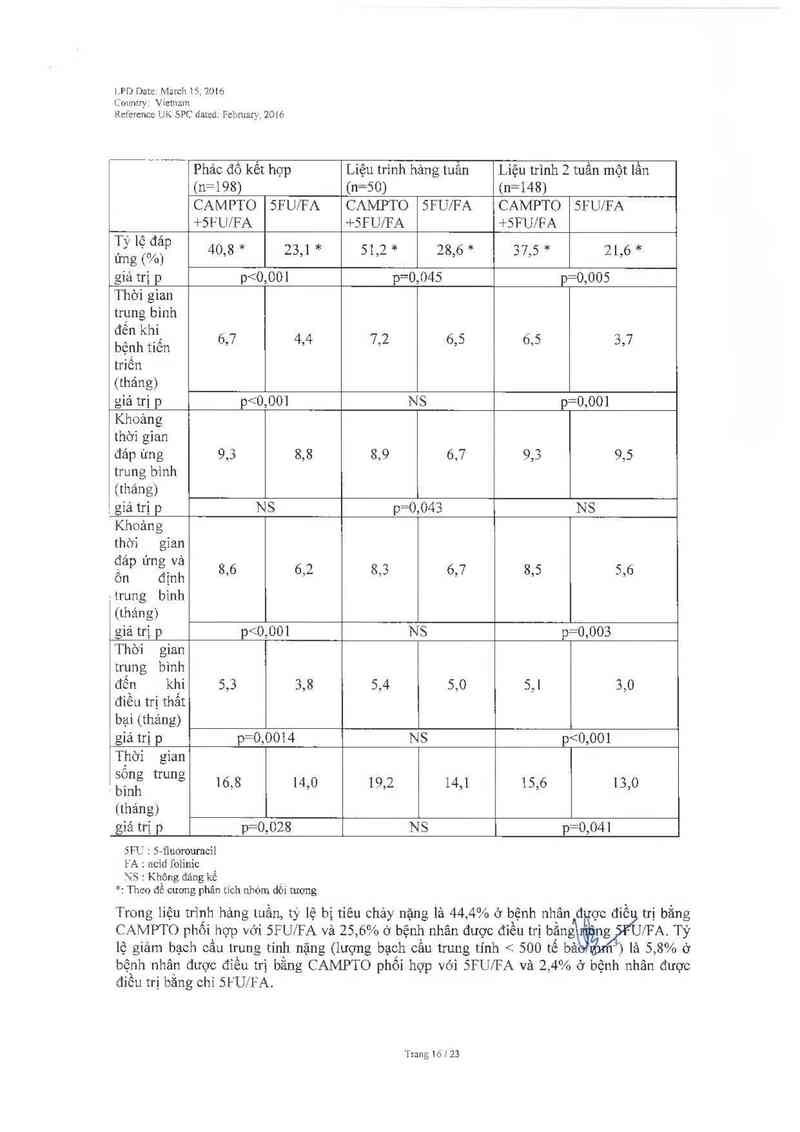
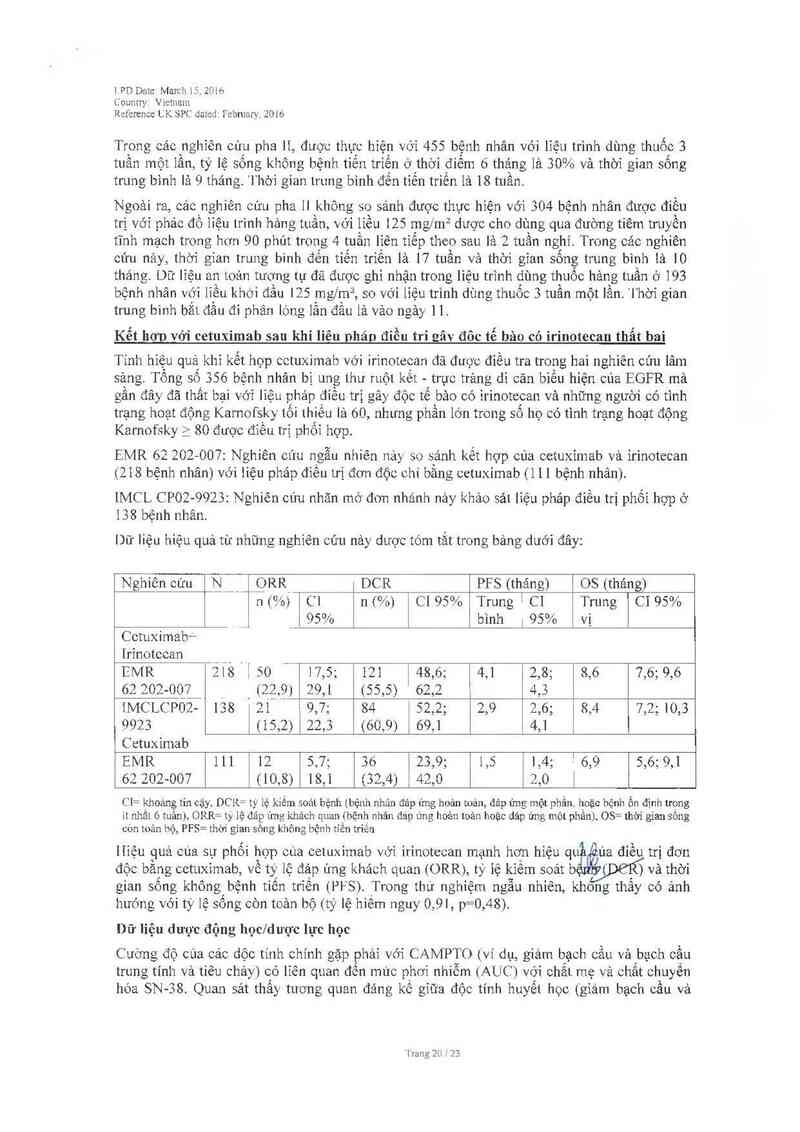
Trong các nghiên cứu pha 11, được thưc hiện với 455 bệnh nhân với liệu trình dùng thuốc 3
tuần một lần, tỷ lệ sống không bệnh tíển triến ở thời điểm 6 thảngl ả 30% và thời gian sống
trưng binh lả 9 tháng. '1` hới gian trung bình đến tiến triến 181 18 tuần.
Ngoài ra, các nghiên cưu pha 11 không so sánh được thực hiện với 304 bệnh nhân được điếu
trị với phác đồ liệu trình hảng tuần, với iiều 125 mg/m² dược cho dùng qua đường tiêm truyền
tĩnh mạch trong hơn 90 phút trong 4 tuần liên tiếp theo sau là 2 tuần nghỉ. Trong cảc nghiên
cứu nảy, thời gian trung bình đến tiến triến lả 17 tuần và thời gian sống trung bình 121 10
tháng. Dữ liệu an toản tương tự đã được ghi nhận trong lỉệu trình dùng thưốc hảng tưần ở 193
bệnh nhân với liếu khới đầu 125 mg/m², so với liệu trình dùng thuốc 3 tuần một lần. ’1`hời gian
trung bình bắt đầu đi phân lóng lần đẩu 1ả vảo ngảy 11.
Kết hơn với cetuximab sau khi liêu Dhán điếu tri Eâv đôc tế bảo có irinotecan thẩt bai
Tinh hiệu quả khi kết hợp cctuximab với irinotecan đã được điếu tra trong hai nghiến cún lâm
sảng Tổng 56 356 bệnh nhân bị ung thư ruột kết - trục trảng di căn biếu hiện của EGFR mả
gân đây đã thất bại với liệu phảp điều trị gây độc tế bảo có irinotecan và những nguời có tình
trạng hoạt động Karnofsky tối lhiếu lả 60, nhưng phần lớn trong số họ có tinh trạng hoạt động
Karnofsky ì 80 được điếu trị phối hợp.
EMR 62 202—007: Nghiên cứu ngẫu nhiên náy so s`ánh kết hợp của cetuximab vả irinotccan
(218 bệnh nhân) với liệu pháp điêu trị đơn độc chi băng cetuximab ( 1 1 1 bệnh nhân).
IMC L CPO2-9923: Nghiên cứu nhãn mớ đơn nhánh nảy khảo sải liệu phảp điếu trị phối hợp ở
138 bệnh nhân.
Dữ liệu hiệu quả từ nhũng nghiên cứu nảy dược tóm tắt trcng bảng dưới đây:
Nghiên cưu Tj __ __ỌRR_ DCR PFS (tháng) OS (tháng)
n (9²6) C] n (%) C] 95% Trưng 1 C] Trung (3195%
_ 95% bình ) 95% vị
Cctuximab—
1rinotccan _____ _
EMR 218 1 50 17,5; 121 1 48,6; 4,1 2,8; 8,6 7,6; 9,6
62 202-00’L , (22 Ế) 29,1 (55,5) 62,2 4,3
iMCLCPOZ- 138 21 9, 7: 84 52,2; 2,9 2,6; 8,4 7,2; 10,3
9923 (15, 2) 1 22, 3 (60,9) 69,1 4,1
Cetuximab
EMR 111 12 5,7; 36 23,9; 1,5 1,4; ! 6,9 5,6; 9,1
62 202-007 (10, 8) 18,1 (32, 4) 42,0 2,0 1
C1 khoang tin cậv, DCR= ty lệ kiếm soát bệnh (bệnh nhân đảp’ ưng hoan toản, đáp ưng một phần, hoặc bệnh òn định trong
ít nhầt 6 tuần), ORR= ty lệ đáp img khảch quan ( benh nhân đáp ứng hoèn toản hoặc dảp ửng một phần), OS= thời gian sông
còn toản bộ, PFS= thời gian sông khõng bộnh tiến trìên
Hiệu quả cùa sự phối hợp cúa cetuximab với irinotecan mạnh hơn hiệu un11 )ủa điều trị đo'n
độc bằng cctưximab, về tỷ] ệ đảp ửng khách quan (ORR), tý 1ệ kiếm soát b ) và thời
gian sông không bệnh tiến triến (PiS). Trong thư nghiệm ngẫu nhiên, khong thẩy có ảnh
hướng với tỷ lệ sống còn toản bộ (tỷ lệ hiêm nguy 0, 91, p=0, 48).
Dữ liệu dược động hợc/dược lực học
Cường độ cùa các dộc tinh chĩnh gặp phải với CAMPTO (vi dụ, giảm bạch cầu vả’bạch cậu
trung tính và tiêu chảy) có liên quan đên mức phơi nhiêm (AUC ) với chât mẹ và chât chuyên
hóa SN-38. Quan sát thây tương quan đáng kê giữa độc tính huyêt học (giám bạch câu vả
'1’rang 21123
LPD Date, March 15_ 2016
Countn` V'1ctnam
Ret'crcncc UK SPC datcđ. February, 2016
bạch cẩu trung tĩnh ở điếm thắp nhất) hoặc cướng độ tiêu chảy vả các giá trị AUC của
irinotccan vả chât chưyên hớa SN-38 trong điêu trị đớn độc.
Bénh nhán có UGT 1AI bi Eiam hoai linh:
Uridin diphosphat—glucuroncsyl transfcrasc 1Al (UGT1AI) có tham gia vảo việc khử hoạt
tính chuyến hóa cùa SN—38, là sản phẩm chuyển hóa có hoạt tính của ìrinotccan, thảnh
giucuronid SN—38 (SN—3SG) không hoạt tính. Gcn UG'i`1AI rất đa hình, dẫn đến nhiều khả
nãng trao đổi chất khảo nhau giũa các cá thể. Một hiến thể cụ thể cưa gen UGTiAl có một
thế đa hình trong vùng hoạt hóa được gọi là biến thể 1161! A 1 *28. Biến thể nảy vả cảc khiểm
khuyết bẩm sinh khác trong biền hiện UGT1AI (như hội chứng Crigler-Najjar vả Gitbert) liên
quan đến việc giảm hoạt tính cùa cnzym nảy. Dữ liệu từ một phân tích tống họp cho thấy
những người có hội chứng Criglcr-Najjar (tuýp 1 vả 2) hoặc những người đồng họp tử đối với
gien đắng vị UGTIA1*28 (hội chứng Gilbert) có nguy cơ tăng độc tính hưyết hợc (cấp 3 và 4)
sau khi cho dùng irinotccan ớ liếu trung binh hoặc cao 1›150 mg/m2). Không thiết lập được
mối quan hệ giữa kiến gen U GTI A1 và sự phát sinh bệnh tìêu cháy gây ra bới ii~inotcczin.
Bệnh nhân được biết là đồng hợp từ đối với UG"I`1A1*28 nên được cho đùng liều khới đầu
irinotccan thông thường được chỉ định. '1'uy nhiên, những bệnh nhân nảy nên được theo dõi
độc tính huyết học. Nên xcm xét giảm liếu khới đầu ỉrinotecan cho bệnh nhân đã bị nhiễm độc
máu trước đó với lìệư pháp điếu trị trước đỏ. Chưa thiết lập được mức độ gia… chính xác lỉếu
khới đẩu trong nhóm bệnh nhân nảy vả bất kỳ việc thay đối Iỉều dùng tiếp theo nảo cũng phải
được dựa trên kha năng dung nạp thuốc điều trị cùa bệnh nhân (xem mục 4.2 vả 4.4)
Iliện không có dữ liệu đầy đủ đế kết luận về lợi ích lâm sảng cúa việc xác định kiếu gcn
UGTIAI.
5.2. Cảc đặc tính được động học
'I`ron g một nghiên cưu pha 1 6 60 bệnh nhân có phác đồ liều dùng tiêm truyền tĩnh mạch trong
30 phút tư 100 đến 750 mgi'm² ba tuần một lần, irinotecan cho thấy có tính chắt đâo thải theo
hai gỉai đoạn hoặc ba giai đoạn. Độ thanh thải trung bình trong huyết tượng là 15 l…-"f,giỜ/m2 vả
thê tỉch phân bố 6 trạng thải Ổn định (Vss): 157 L/m². Thời gỉan bản thải trung bình trcng
huyết tương cùa giai đoạn đầu tiên cùa mô hinh ba giai đoạn 181 12 phút, của giai đoạn thứ hai
là 2,5 gìờ, vả thời gian bán thải của giai đoạn cuối lả 14,2 giờ. SN-38 cho thấy tinh chắt đảo
thải hai giai đoạn với thời gian bản thải cuối trung vị là 13,8 giờ. Sau khi kết thúc tiêm truyền,
ớ liều khuyến cáo là 350 mg/m², nồng độ đinh trung bình trong huyết tương của irinotccan vả
SN- 38 tương ứng iả 7, 7 ụg/ml và 56 ngfml, vả giá trị trung binh của diện tích dưới đường
cong (AUC) tương ú~ang lả 34 ụg himl và 451 ng.hlml. Có sự biến thỉên lớn giữa các cá thế về
cảc thông sô dược Ộđộng học đối với SN— 38
Một phân tich dược động học cùa irinotccan đă đuợc thuc hiện ở 148 bệnh nhân bị ung thư
ruột kết- trục trảng dì căn, được diếu trị với cảc liệu trình khác nhau và ở cả 1Àều khác nhau
trong cảc thư nghiệm pha 11. C ac thông số duợc động học được ước tínhb mô,hinh ba
vùng tuơng tự như các thông số dược động học quan sảt thấy trong các nghiến pha 1. Tất
ca các nghiên cứu đã cho thẳy mức phơi nhiễm irinotccan (C PT 11) và SN 38 tăng tướng ửng
với liếu dùng CPT-l 1; tính chất dược động học cùa chúng độc lập với số lượng các chu kỳ
trước đó vả liệu trình dùng thuốc.
ln vitro, iiên kết protein trong huyết tướng cùa irinctccan vả SN-38 tương ứng [ả khoảng 65%
vả 95%.
Các nghiên cưu cân bằng về chuyến hóa khối với thuốc được đảnh dấu bằng đồng vị carbon
C14 đã cho 1hây hon 50%1iê11 được cho dùng qua tĩnh mạch cùa irinotecan được bải tiêt dưới
dạng thuốc không thay đôi, với 339² 0 trong phân chủ yếu qua mật và 22% trong nước tiếu.
Trang 21 23
LPD Dntc March 15,201t'1
(“ountrgc Vietnam
Reti—Jrence lÌK SPC datcd: February, 21116
Có hai dường chuyến hóa, mỗi đường đảm trách it nhất 12% iiều:
0 Thủy phân vbới carboxyicstcrase thảnh chất chuyến hóa có hoạt tinh SN-38, SN-38 được
đảo thải chư yêu bới quá trình glucuronid hóa, vả tiêp theo bới bải tiêt qua mật vả thận (it hơn
0,5% liêu irinotccan) Cảo SN-38 giucuroniđ sau đó có lẽ bị thùy phân trong ruột.
c Các phản ứng oxy hớa phụ thuộc cmym Cytochrom P450 3A dẫn đến mớ vòng piperidin
ngoải với sư hình thảnh APC (dẫn xuất acid aminopentanoic) vả NPC (dẫn xuất amin chính)
(xem mục 4.5).
Chẳt mẹ irinotccan không đổi 1ả dạng tồn tại chính trong huyết tương, tiếp theo lá APC, SN-
38 glucuronid vả SN-38. Chi SN-38 mới có tác dụng gây độc tế bảo mạnh.
Dộ thanh thải irinotccan giảm khoảng 40% ở bệnh nhân bị giảm bilirubin máu từ 1,5 đến 3
lần giới hạn bình thường trên. Ở những bệnh nhân nảy iiềư irinotccan 200 mgÍm² dẫn đến
mức phơi nhiễm của thuốc trong hnyết tương tương tự với giá trị quan sát được khi dùng liếu
350 mg/mE ở bệnh nhân ung thư có cảc thông số gan binh thường.
5.3. Dữ liệu an toản tiền lâm sảng
Irinotecan vặ SN-ỳ38 đă được chứng minh iả gây đột biến in virro trong các thử nghiệm sai
lệch nhiêm săc thế trên tế bảo C HO cũng như trong thử nghiệm vi nhân in vivo ở chuột.
Tuy nhiên, chúng đã được chứng minh lá không có bất kỳ khả năng gây đột biến nảo trong
thử nghiệm Ames.
Ở chuột cống được điếu trị một 1ần một tuần trong 13 tuần ở liều tối đa 150 mg/m² (ít hơn một
nửa liếu khuyên cáo ở người), không có báo cảo vê khôi 11 liên quan đên liệu phảp điêu trị nảo
ở 91 tuân sau khi kêt thúc điếu trị.
Các nghiên cún độc tinh liếư đon vả liếm nhắc lại với CAMPTO đã được tiến hảnh ở chuột
nhắt, chuột cống và chó. Các tảo dụng gây độc chinh đã đuợc thấy trong hệ mảu vả hệ bạch
huyết. Ở chó, tiếu chảy muộn liến quan đến tcc vả hoại tù 6 của niêm mạc một đã được báo
cảo. Rụng 1ông cung dược quan sát thấy ở chó.
Mức độ nghiếm trọng của các tảc dụng nảy 1iến quan đên Iiêu vả có thế hôi phục được.
Sinh san
Irinctccan gây quái thai ớ chuột cống vả thò với iiều thấp hon liều đỉều trio ongưới. Ở chuột
cống, chuột con sinh ra từ động vật được điếu trị có ngoại hỉnh bất thường ữt thẳ_v ảm khả
năng sinh sản. Không thẩy điều nảy c chuột con có hỉnh thải binh thường OẾu cống mang
thai có tinh trạng giảm trợng lượng nhau thai và ở đới con có tình trạng giảm khá nặng tồn tại
cua thai nhi vả tăng hảnh vi bất thường.
6. CÁC ĐẶC TÍNH DƯỢC HỌC
6.1. Danh mục tá dược
Sorbitol, acid lactic, natri hydroxid vả acid hydrochlorid (đế điếu chinh pH), nước cất pha
tiếm.
6.2. Tương kỵ
Không có trường họp tương kỵ nảo được biết đến.
Không được pha thuốc vởi các thưốc khác ngoại trừ nhũng thuốc được đề cập trong mục 6.6
6.3. Hạn dùng
Campto 40mg/2m1: 24 thảng kế từ ngảy sản xuất.
Trang 22 .J' 23
LPD Date Manh 15,2016
Country chtnam
Reference IíK SPC daĩed' February 20l6
Campto lOOmg/Sml: 36 tháng kể từ ngảy sản xuất.
Hạn dùng của dung dịch sau khi pha: 28 ngảy báo quản trong tủ lạnh (xem mục 6.4)
Đê giảm nguy cơ nhíễm khuần, nên pha dung dịch tiêm truyền ngay trước khi sử dụng và tíến
hânh truyền cảng sớm cảng tốt sau khi pha. Nếu không sử dụng ngay, người dùng có trảch
nhỉệm bảo đảm cho thời gian bảo quản để sử dụng không quá 24 gỉờ và ở điều kiện 2— 8°C
trước khi sử dụng, trừ khi đã được pha loãng trong đỉều kiện vô trùng được kiểm soát vả xác
nhận hợp lệ.
6.4. Thận trọng đặc biệt khi bảo quãn
Không báo quản ơ nhỉệt độ trên 30°C. Tránh ảnh sảng. Không để đông lạnh.
Các dung dịch pha loãng. Dung dịch nảy đă được chứng minh là ổn định về mặt vật lý và hóa
học khi pha loãng vđ~ỉ cảc dung dịch tiêm truyên (dung dịch natri clorid 0,9% vả’dung dịch
glucose 5%) trong tôi đa 28 ngảy khi bảo quản tgong lọ polyethylen tỷ trọng thâp (LDPẸ)
hoặc polyvinyl clorid (PVC) ở 5°C hoặc 30°C/độ âm môi trường vả trảnh ánh sảng. Khi tiêp
xúc vởi ánh sảng, dung dịch ổn định về mặt lý hóa trong vòng 3 ngảy Lâm đông lạnh lọ
thuốc ỉrinotecan hoặc dung dịch pha loãng irinotecan có thề lảm kết tủa thuốc, vì vậy phải
tránh đông lạnh. (Xem mục 6. 3. Hạn dùng)
6.5. Tính chẫt và dung lượng bao bì đóng gói
Lọ polypropylen mảu hổ phách chứa liều đơn, 40 mg/2 mL, 100 mg/S mL, hộp 1 lọ.
6.6. Hướng dẫn sử dụng và pha chế
Cũng như những thuốc chống ung thư khác, CAMPTO phải được pha chế và xử lý một cách
thận trọng Cấn sử dụng kính, mặt nạ vả gãng tay khi thao tác.
Nếu dung dịch thuốc CAMF'TO hoặc dung dịch tiêm truyền tiếp xúc với da, cần rùa sạch da
ngay lập tức và kỹ bằng xả phòng và nước. Nếu thuốc CAMPTO hoặc dung dịch tỉêm truyền
tiếp xúc vởi nỉêm mạc, phải rừa ngay vởi nước.
Pha thuốc để tiêm truyền qua tĩnh mạch:
Như vởỉ bất kỳ Ioạì thuốc tiêm nảo khảo, dung dịch CAMPTO phải được pha trong điều kỉện
vô trùng (xem mục 6.3. Hạn dùng).
Nếu quan sát thấy bất kỳ lgết tùa nảo trong lọ hoặc 'sau khi pha loãng, sản phẩm cần được loại
bỏ theo quy trình tìêu chuân cho các chât gây độc tê bảo.
hiệu chuẩn và tìêm vảo tủi hoặc chai truyền 250 ml chứa dun dịch n 0 ,9% hoặc
dung dịch glucose 5%. Sau đó, trộn đều dung dịch tiêm truyền băng cảch y vòng băng tay.
Thãi bó:
Tất cả các vật lỉệu được sử dụng để pha loãng vả truyền thuốc phải được thải bỏ theo quy
trình tiêu chuân cùa bệnh viện ảp dụng cho chât gây độc tê bảo.
Dùng kỹ thuật vô trùng, rủt luọng dung dịch CAMPTO cần dùng ra từll bằng óng tiêm đã
êỄc clgnd'
Tiêu chuẩn kỹ thuật: Nhà sản xuất
Nhà sản xuất: Pfizer (Perth) Pty Ltd, Technology Pa _ ~ - [ Drive Bentley WA
6102,U0. " '~`
Ĩ`~Nhãn hiệu đã đăng ký
LPD Date: March 15, 2016
Reference UK SPC date: February, 2016
_ TUQ. CỤC TRUộNG
n… 23 J23 P.TRUỦNG PHONG
Jỷuyễn JÍểgy Jfẽìnfạ
v
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng