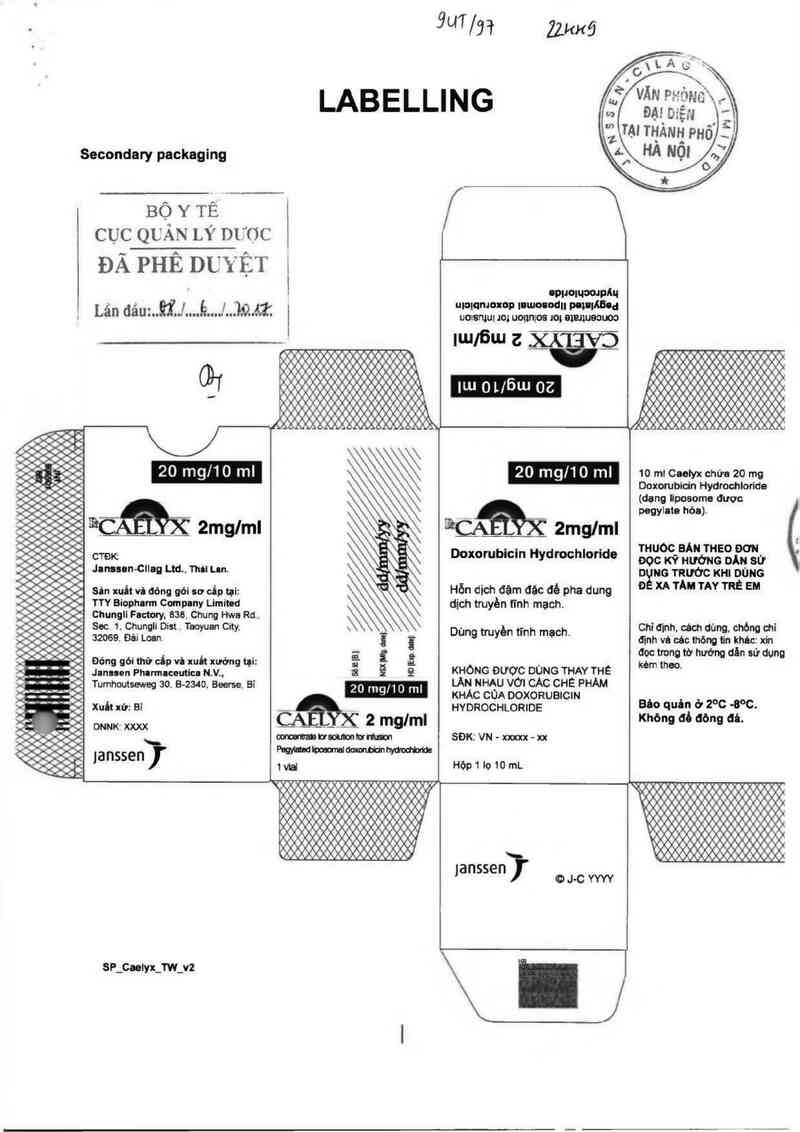


















Secondary packaging
LABELLING
BỘYTÊ
CỤC QUẢN LÝ mfợc
ĐÃ PHÊ DUYỆT i
Lãn đẩu:..QÍJ....Ẻ...J…JiQAZ '
201ng/101nl
IỀỆỦZ“ 2mg/ml
CTĐK
Jlnlson-Clleg m.. Thil Lm.
Sin xui! vi dõng gỏi sơ cấp tại:
TTY Biopharm Company Limited
Chungll Factory. 838. Chung Hwa Rd .
See 1. Chunin Dist.. Taoyuan City.
32069. Đủí Loan
Đóng gói thứ dn vì nui't xưởng tụi:
Januen Phurmucouticn N.V..
Tumhwtseweg 30. B-2340. Beerse. Bỉ
Xuất xử: Bỉ
DNNKĨ Xm
lanssenj’
VVVVVVVVVVVVVVVVV
ùủổỞỞWWƯỞÂẢẢhỔỔỞỞ
~ ~~~~~~ ~ ~t
›~~~~~~~~~~~~~~~~~~
~ ~~~~~~ ~~
›~~~~~~~~~~~~~~~~~~t
~~~~~~~~~~~~~ ~~
›~~~~~~~~~~~~~~ ~~ ~
~~ ~ «
›~~~~~~~~~~~~~~~~~~m
›~~~~~~~gfiâp~~~~~~~~~
~qaay~gg gp~quqụụ
unnt ỄệệÝ’
nsxm.ur
WĐỤỜI
Ẹzị_.-_…_ 2 mglml
…uuommiưm
%ngme
tvu
9UT/ai
ZZ.Lm5
_
wumuompkq
umqmoxop lnuioeodu pomAùa
umsnwi .iot uoumos mt eumueouoo
1…16w z XẮỆvỆ
i… ou6uu oz
vavvvvvvvvvvvvvv
ỢỒỢỒOÔỢỒQỒÒÔỢÔ.ÔỢỒỌỎỢÒOÒỌỘOÔỢỒOỒƠỒ
IỒỒỒỒỒ ỒỒÒỒOỒỒỒỒỒ
ỒỒÔÒÒỒỒỒỒỒỒỒÔỒỒỒÒ
~~~~~~~~~~~~~~~
›~~~~~~~~~~~~ ~
~~~~~~~~~~~~~~~~~~
~~~~ ~~ ~~
› ~ ~~~~~
J~~~~~~~~~~~~~~~~~~
Ồ
J~'~°~ ~°~~~~~~~~°~°~°~ ~'~'~'~
~~ ~~ ~~ ~~~ n~~~~
2Orng/101nl
mủ 2mg/m|
Doxorubicin Hydrochloride
Hỗn dich đậm dặc để pha dung
dich truyền tinh mach.
Dùng truyền tĩnh mach.
KHONG ĐƯỢC DÙNG THAY THỂ
LẦN NHAU VỚI cAc CHE PHAM
nnAccùAooxonumcm
HYDROCHLORDE
SĐKỊVN-xxxxx-iot
HwimiOmL
10 ml Cnelyx chứa 20 mg
Doxorubldn Hydrochloride
(dang iposome đuợc
pegylate hói).
THUOCBẤNTHEOĐON
oocxÝnườnenAusử
DỤNGTRƯỚCKHIDÙNG
ĐỂXATAMTAYTRÉEM
Ghỉđmh. … dùng. chóng chi
ơmh vù cúc thòng Iin khủc: x`n
doc trong từ hướng dấn sử dung
kèm theo.
Bỏo quăn ở 2°C -B°C.
Khỏng đổ đỏng đả.
5P_Caelyx_TW_v²
lanssenj'
0 J-C YYYY
\
ởWửâhùùừỞởổểổỡửửâf
~~~~~~~~~~~~~~~~~~~
~~ ~~~~~~ ~~
~~ ~~ ~~~~~~
~ ~~~~~~~~~~~~~~~
~~~~ ~~~~~ ~~ ~
~~~ ~
~~~~~~~~~~~~~~~~~~
~ ~~~
~ ~ ~ ~ ~ ~ ~°~°~°~°~°~°~V~ ~
qagggaaggggggagaa.
O
LABELLING
Primary packaging
0 _— Wỳ 20 r11g1“1 0 m! | _
CAELYX® 2 mglml ị
_ Doxofubtcln hydrochlorldc (dụng IIposome
`Ể được …như hóc)
Hỏn diott ơem dặc ơé pha dung dich truyèn
nnh mach
… Đóng gò] thứ cấp vì xuất xưởng tụt:
Janum Fhamnuum:a N.V.. BI.
0 J…n-Ci'tag YYYY /
PP_QeỒyx_TW_vZ
CAELYX®
Doxorubicin hydrochloride, dạng liposome dược pegylate hóa.
Dùng truyền tĩnh mạch
THÀNH PHÀN sò LƯỢNG VÀ CHẤT LƯỢNG
Mỗi lọ CAELYX được trình bảy dưới dạng hỗn dịch mảu đò, trong mờ vô trùng, chửa 2 mng
doxorubicin hydrochloride dạng bảo chế liposome được pegylate hóa và cung câp 10 ml (20 mg)
hoặc 25 ml (50 mg) ở dạng hỗn dịch đậm đặc để truyền tĩnh mạch dùng một lằn.
CAELYX ! dạng bảo chế liposome, lả doxorubicin hydrochlorid được bao trong cảc liposomc
vởi bề mặt được gắn vởi methoxypolyethylene glycol (MPEG). Quá trình nảy được gọi là sự
pegylate hóa và bảo vệ cho cảc liposome khỏi bị hệ thống bạch câu đơn nhân (MP5) phảt hiện,
do đó lảm tăng thời gian lưu chuyến trong mảu của chủng.
Tá dược: xin xem phẳn Danh sảch cảc tá dược. CD1
MÔ TẢ DẠNG CHẾ PHẨM
CAELYX ở dạng hỗn dịch đậm đặc phân tản dưới dạng liposome mảu đò. trong mờ, vô trùng chi
đê truyền tĩnh mạch.
CÁC ĐẶC TÍNH LÂM SÀNG
Chỉ định điều trị:
Ung thư vú:
CAELYX dược chi dịnh để điều trị:
— Ung thư vú di căn từ phụ nữ có thế cân nhắc dùng anthracycline.
— Ung thư vú di căn ở phụ nữ đã thất bại với phảc đồ đỉều trị có taxan.
LJ_ngctlurlmồ_ngủưg
CAELYX được chỉ định để điều trị ung thư buồng trứng tiến triển ở phụ nữ đã thắt bại với phảc
đồ hóa iiệu pháp bước một chứa platin.
Đa u tủv
CAELYX được chỉ định kết hợp vởi bonezomỉb để điều trị đa u tùy tiến triền ở những bệnh nhân
đặ nhận được it nhất một điều trị trước đó và những người đã trái qua hoặc không phù hợp để
cắy ghép tùy xươn g
Bẽnh nhân sarcôm Kaoosi iiên quan đến AIDS (AIDS- KS)
CAELYX cũng được chỉ định để điều trị cho bệnh nhân sarcôm Kaposi liên quan đến AIDS
(AlDS— KS) với số lượng CD4 thắp (< 200 tế bảo lympho CD4/mm ) vả bệnh niêm mạc da hoặc
bệnh nội tạng lan rộng.
CAELYX có thể được sư dụng như lá hóa trị liệu toản thân bước một hoặc như là hóa trị liệu
bước hai cho bệnh nhân AIDS- KS với tình trạng bệnh tiến triến hoặc với bệnh nhân khôn dung
nạp với liệu phảp hóa trị liệu toản thân kết hợp trước đó bao gồm ít nhẩt hai trong số thuoc sau:
vinca alkaloid. bleomycin vả doxorubicin chuẩn (hoặc cảc antharacyclỉne khác).
LIÊU LƯỢNG VÀ cÁcn DÙNG
P! C`ael_tar_ r1r__ccos 08Mar2013_v1 |_124
…ẩĩỉì
fJ... Ĩ`
Ir~r
SẦi
CAELYX có tinh chắt dược động học riêng biệt vả không được thay thể lẫn nhau Vởi các công
thức khác của doxorubicin hydrochloridc.
Chỉ dùng CAELYX dưới sự theo đõi chặt_chẽ của thằy thuốc chuyên khoa về ung bướu có đảo
tạo chuyên biệt dê sử dụng các thuôc độc tê bảo.
Ung thư vú/buồng trứng: Truy ẻn tĩnh mạch C AELYX với liêu 50 mg/m dùng một lấn trong
môi 4 tuần, kéo dải cho đển khi bệnh không còn tiến triến và bệnh nhân còn dung nạp dược vởi
thuốc điều trị
Vởi liều < 90 mg: pha loãng CAELYX trong 250 ml dung dịch dextrosc 5%. '…
Vởi liễu ì 90 mg: pha loãng CAELYX trong 500 mi dung dịch dextrose 5%.
Để hạn chế các nguy cơ phản ứng do tiêm truyền, lỉều khớỉ đầu cẩn truyền với tốc độ không lớn
hơn ] mg cho môi phút. Nêu không gặp phản úng do truyền, sẽ truyền tiẻp CAELYX trong thời
gian 60 phút.
Trong chương` trình thử nghiệm về ung thư vú, có thể thay đối cảch truyền với bệnh nhân đã có
phán ứng truyền như sau:
5% tống liều được truyền chậm trong 15 phút đằu tiên. Nếu bệnh nhãn dung nạp mả khỏng có
phản ứng Sẽ truyền với tốc độ gâp đôi trong 15 phút tiếp theo. Nếu dung nạp dược, sẽ kết thúc
truyền trong giờ tiếp theo và tồng thời gian truyền lả 90 phút
Những lần truyền tiếp theo của CAELYX đuợc tiến hảnh trong thời gian 60 phút.
Đa u tủy: Truyền tĩnh mạch CAELYX với liều_3O mg/mỉ truyền trong 1 giờ ngay sau khi truyền
bortezomib vảo ngảy thứ 4 cùa phác đỏ 3 tuân bortczomib. Phác đô bortczomib vởỉ liêu 1,3
mg/m² vảo cảc ngảy l, 4, 8 và 1 1 môi 3 tuân.` Liêu đùng nên được lặp lại miễn lả bệnh nhân đáp
ứng thóa đảng và dung nạp được với thuỏc diêu trị.
VớiJiều < 90 mg: pha ioãng CAELYX trong 250 mL dung địch glucose 5% (50 mglml) đế
truvẽn.
Với liều > 90 mg: pha loãng CAELYX trong 500 mL dung dịch glucose 5/ o (50 mgfml) đế
truvền.
Tráng ống và dãy truyền tĩnh mạch bằng dung dịch tiêm trux ền giucose 5% gìữa lúc truyền 2
thuốc Liều ngảy 4 của cả hai thuốc có thể bị trì hoãn đến 48 giờ nếu có vấn đề y khoa cân thiết.
Những liều bortezomib nên cách nhau ít nhất 72 giờ. Lần truyền dầu tiên cùa CAELYX nên
được truyền trong 90 phút, như sau:
- 10 ml trong 10 phút dầu tiên
… 20 ml lrong 10 phủt tiếp theo
— 40 ml trong 10 phủt tiếp theo
- sau đó hoản thảnh lruyền thuốc trong tống thời gian 90 phút.
Cảc lìều tiếp theo của CAELYX sẽ được truyền trong 1 giờ, nếu dung nạp đuợc Nếu có một
phản ứng do truvền với CAELYX xảy ra, dừng truyền và đợi đến khi cảc triệu chứng đuợc giải
quyểt, tìm cảch đề truyền dung dịch CAELYX còn lại trong 90 phút, như sau:
- 10 ml trong 10 phủt đầu tiên
- 20 ml trong 10 phủt tỉếp theo
- 40 ml trong 10 phủt tỉếp theo
— sau đó, hoản thảnh truyền thuốc trong lồng thời gian 90 phút.
Việc truyền thuốc có thể thực hiện qua một tĩnh mạch ngoại vi hay đường truyền trung tâm.
Bệnh nhân AIDS- KS: Nên truyền tình mạch CAELYX với liều 20 mg/m mỗi 2 tới 3 tuần. C an
tránh các khoáng cảoh truyền ngản hơn 10 ngảy vi không loại trừ được sự tích lũv thuốc và tăng
độc tinh. Bệnh nhân phải dược diều trị trong thời gian 2- 3 thảng đế dạt dược đẫp úng điều trị.
Khi cần sẽ tiếp tục điều trị để duy tri đảp úng điều trị.
Pl_t`Ểaeỉyx_ ĩiit'_(`C`DS 08Mar2013_1'1 21'24
…)“I
CAELYX được pha loãng trong 250 ml dung dịch dextrose 5% rồi truyền tĩnh mạch trong 30
phút. (Tại cảc nước Châu Áu, dung dịch glucose 5% (50 mg/ml) được sử dụng cho truyền dịch.)
Với mọi bệnh nhân: Khi bệnh nhân có cảc dấu hiệu hoặc triệu chứng sớm cùa phản ứng truyền,
cần ngừng truyền ngay, dùng thuốc điều trị thích hợp (khảng histamin vả/hoặc corticoid tác dụng
ngắn) và bắt đầu truyền lại với tốc độ chậm hơn.
Không được phép tiêm tĩnh mạch nhanh hoặc dùng dung dịch chưa pha loãng. Khuyến cáo nối
dây truyền CAELYX qua cống bên của đường truyền tĩnh mạch dung dịch dextrose 5% để có thể
pha loãng thêm nữa vả gỉảm thiểu nguy cơ huyết khối vả thoát mạch. Có thể truyền qua tĩnh
mạch ngoại vi. Không dược tiêm CAELYX vảo trong cơ hoặc dưới da. Không được dùng với
dụng cụ lọc trên đường truyền.
Để hạn chế cảc tảc dụng ngoại ý như vết ban dò mất cảm gỉảc ở lòng bản tay—bản chân (palmar-
plantar erythrodysesthesia- PPE), viêm miệng hoặc độc tính về huyết học, cần giảm liều hoặc trì
hoãn lỉều. Bản hướng dẫn thay đổi thứ cắp liều CAELYX đối với cảc tác dụng ngoại ý trên sẽ
được nêu ở cảc bảng dưới đây. Mức dộ xếp loại độc tính trong những bảng nảy dựa vảo tiêu
chuẩn Độc tính chung của Viện ung thư quốc gia (NCI-CTC).
Cảc bảng về PPE (bảng !) vả vỉêm miệng (bảng 2) cung cấp lịch trình đối với sự điều chinh lỉếu
lượng ở cảc thử nghíệm lâm sảng trong điều trị ở bệnh nhân bị ung thư vú hoặc ung thư buồng
trứng (điều chinh cùa phảc đồ điều trị chu kỳ 4 tuần). Nếu những độc tính nảy lá ở bệnh nhân bị
sarcôm Kaposi líên quan đến AIDS, thì chu kỳ điều trị từ 2 tới 3 tuần cũng có thể điều chính theo
cảoh tương tự.
Bảng về độc tính huyết học (bảng 3) cung cấp lịch trình tỉếp theo sự điều chinh liều lưọng ở cảc
thử nghiệm lâm sảng khi điều trị với bệnh nhân chỉ bị ung thư vú hoặc buổng trứng. Sự điều
chỉnh lỉều lượng ở bệnh nhân AIDS- KS được đề cập trong phần "Tảc dụng ngoại ý".
®1
PI_(` ael_ư_TWj` (` DS 08Mar20/ 3 vl 31'24
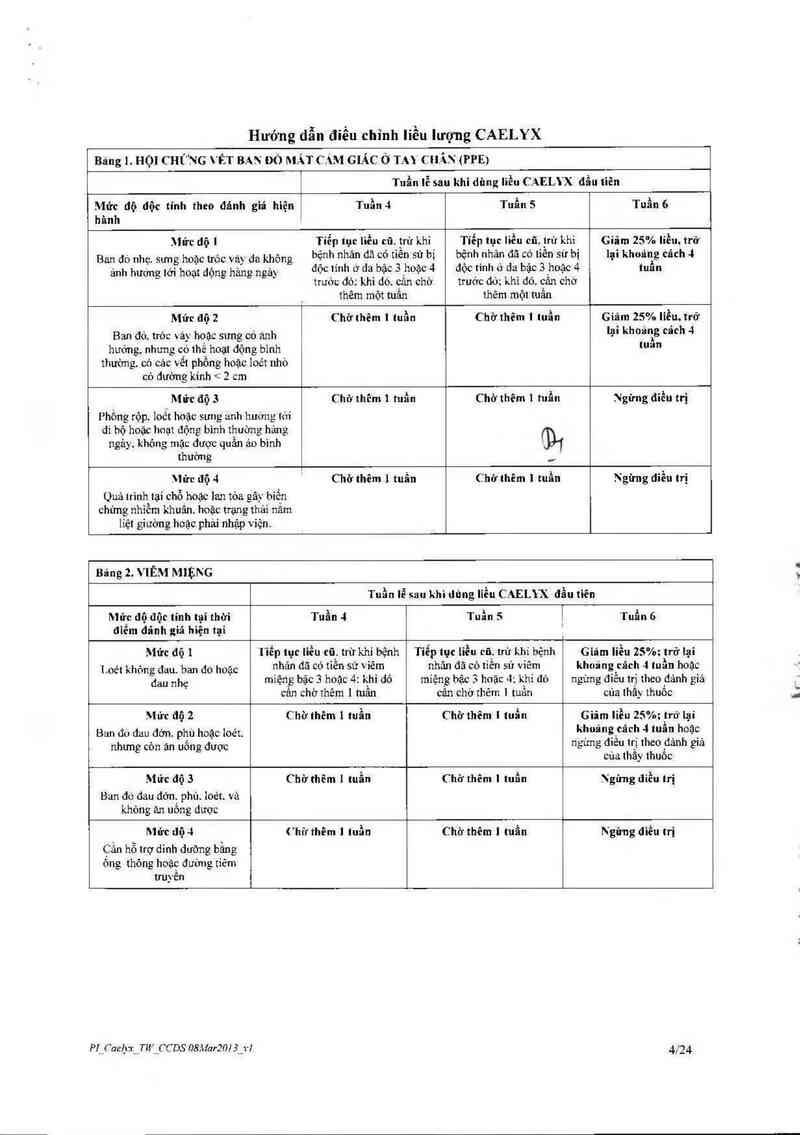
Hướng dẫn điều chỉnh liều lượng CAELYX
Bảng !. HỌ] CHỮNG VỀT BAN ĐÓ MẤT cm GIÁC ở TAY CHÂN (PPE)
Tuần lễ sau khi dùng liều CAELYX đầu tiên
Mức độ độc tính theo đánh giá hiện
hânh
Tuần 4
Tuần 5
Tuần 6
Mức dộ |
Ban đò nhẹ. sưng hoặc trớc vảy đa không
ánh hướng tới hoạt dộng hảng ngảy
Tiễp tục liều cũ. trừ khi
bệnh nhân dã có tiên sử bí
độc tính ở da bậc 3 hoặc 4
trước đỏ: khi dò. cần chờ
thêm một tuấn
Tiếp tục liều cũ. `[rủ khi
bệnh nhân dã có liên sử bị
độc tỉnh ở da bậc 3 hoặc 4
truớc dó; khi dỏ. cần chờ
thêm một tuần
Giãm 25% liều. trở
lại khuâng cách 4
tuần
Mức độ 2
Ban đỏ. tróc vả_v họac sưng có anh
hưởng. nhưng có thế hoạt dộng binh
thường. có các vê! phông hoặc loét nhỏ
có dường kính < 2 cm
Chờthêm I luẫn
Chờthẽm I tuần
Giâm zs% liễu. trở
lại khoáng cách 4
luần
M ửc độ 3
Phồng rộp. ]oỏt hoặc sung anh huơng tới
di bộ hoặc hoạt động bình thường háng
ngảy. không mặc dược quân áo bình
thuờng
Chờ thêm 1 tuần
Chờ thêm 1 tuần
%
_
Ngừng đỉều trị
\lửc dộ 4
Quá trình_tại chỗ_hoặc lan tóa gây biến
chứng nhìêm khuân. hơặc trạng thái nám
liệt giường hoặc phải nhập víện.
Chờ thêm 1 tuần
(Ihờthêm ] tuần
Ngừng diễu trị
Bãng z. VIÊM MIẸNG
m“… lẽ sau khi dùng liễu CAELiX đẫu tiên
Mức dộ độc lính tại thời
điềm dảnh giá hiện tại
Tuẫn 4
Tuần 5 i
›
Tuần 6
Mức độ 1
Loét không đau. ban do hoặc
đau nhẹ
“I'ỉếp tục liễu cũ. trừ khi bệnh
nhân aa có tiền sử vỉêm
miệng bặc 3 hoặc 4: khi dó
cán chờ thêm 1 tuân
Tiếp tục liều cũ. trừ khi bệnh
nhân đã có tiền sử viêm
miệng bậc 3 hoặc 4; khi đó
cân chờ thẻ… 1 tuần
Giãm liễu 25%: ườ lại
khuâng cách 4 tuần hoặc
ngừng đỉểu trị theo đảnh gìá
của thẩ_v Ihuôc
Mức độ 2
Ban đo đau đởn. phủ hoặc ioẻt.
nhưng còn ản uông được
(Ihờlhêm ! tuần
Chờthẽm I …ần
Giãm liều 25%: trở lại
khuâng cách 4 luẩn hoặc
ngừng đỉếu trị theo đảnh giả
cùa thầy thuõc
Mức dộ 3
Ban đo đau dớn, phù. loét. vả
khỏng ân uông dược
Chờ thêm 1 tuần
Chờthẽm I …ần
Ngừng điều lrị
Mức dộ 4
Cần hỗ trợ dinh dưỡng bầng
õng thông hoặc đưimg tỉêm
truyền
(`hỉr thêm | luần
Chờ thêm ] tuần
Ngímg điều trị
Pl_f`ael_tx_TW_FCDS 08.41ar2013J'1
4/24
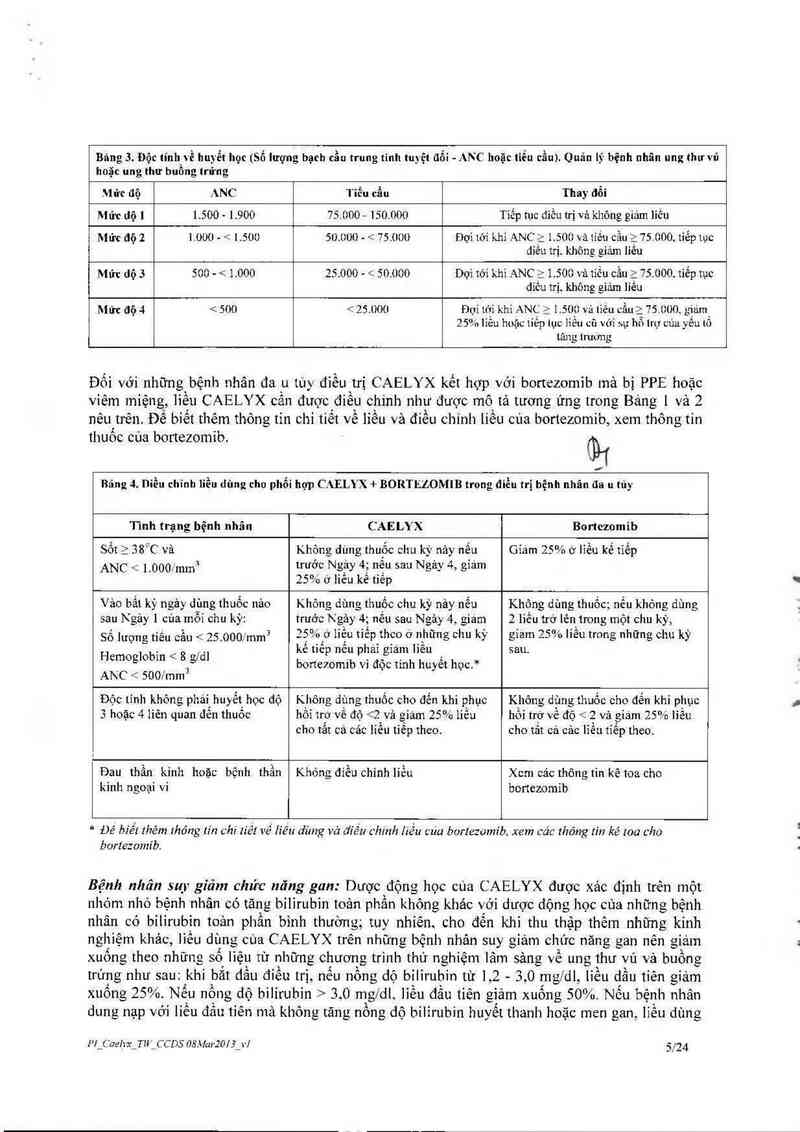
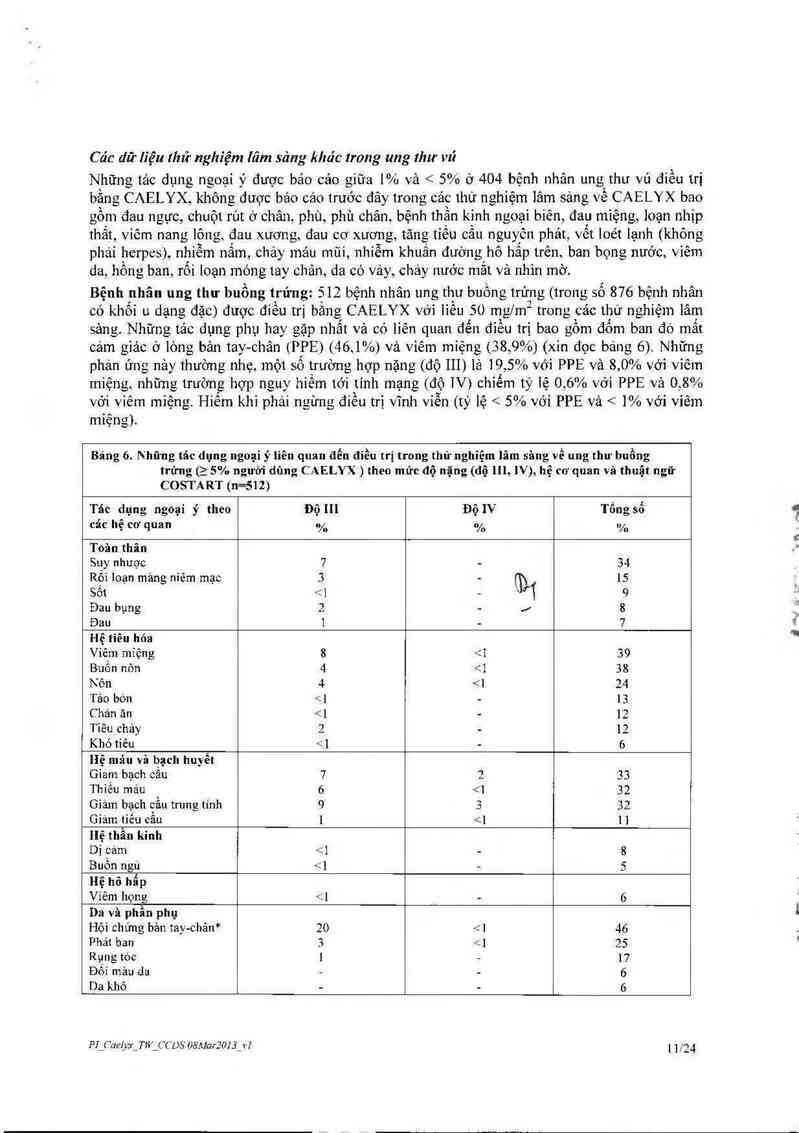
Bâng 3. Độc tính_về huyễt học (Số lượng bạch cầu trung tính tuyệt đổi - ANC hoặc tiễu cầu). Quãn lý bệnh nhân ung thưi'ủ
hoặc ung thư buông trứng
Mức aạ ANC TiẺu cầu Thay đổi
Mức dộ ] 1.500 - 1.900 75.000 — 150.000 Tíếp tục điều trị vả không giám liều
Mức độ 2 1.000 - < 1.500 50.000 - <. 7s.oou Đợi mi khi ANC ; 1.500 và tíếu cầu ạ 75.000, tiếp tục
diêu trị. không giảm liêu
Mức dộ 3 500 - < 1.000 25.000 - < 50.000 Dợì tới khi ANC ỉ 1.500 và tiếu cầu Ẹ 75.000.t1ếp tục
díêu trị. không eiả.m liêu
Mức độ 4 < 500 <: 25.000 2Đợỉ tới khi ANC > 1.500 vả liếu cằu> 75. 000 giairn
% liều huẸic tiếp lục liều cũ với sự ho tro cùa yêu lố
tảng iruơng
Đối với những bệnh nhân đa u tùy điều trị CAELYX kết hợp với bortezomib mà bị PPE hoặc
viêm miệng, ]ỉều CAELYX cần đuợc điều chinh như được mô tả tương ứng trong Bảng ] và 2
nêu trên. Đê biết thêm thông tỉn chi tiết về liều và điều chinh liều của bortezomib, xem thông tin
thuốc cùa bortezomib. (Dj
I
Bảng 4. Diều chĩnh lỉều dùng cho phổi hợp CAELYX + BORTEZOMIB trong diều trị bệnh nhân đa u tủy
Tình trạng bệnh nhãn
CAELYX
Bortezomib
Sốt a ss°c vả
ANC < 1.000fmm²
Không dùng thuốc chu kỳ nảy nếu
trước Ngảy 4; nêu sau Ngảy 4, giám
25% (1 liêu kê tiêp
Gỉám 25% o lỉều kế tiếp
Vảo bất kỳ ngảy dgng thuốc nảo
sau Ngảy ] của môi chu kỳ:
Số lượng tiêu cầu < 25.000ỉmm3
Hemoglobỉn < 8 gJ'd]
ANC < 500/mm²
Không dùng thuốc chu kỳ nảy nếu
trước Ngảy 4; nếu sau Ngảy 4, giám
2°5 o ớ liều tiếp theo ở những chu kỳ
kế tiếp nếu phai gĩám liều
bortezomib vì độc tinh huyềt hỌC.*
Không dùng thuốc; nểu không dùng
2 liều trở lên trong một chu kỳ,
giam 25²3” m liều trong những chu kỳ
sau
Độc tỉnh không phái huyết học độ
3 hoặc 4 liên quan đến thuốc
Không dững thuốc cho đến khi phục
hỏi tro vê độ <2`vả giám 25°43 liêu
cho tât cả các lỉêu tiêp theo.
Khỏng dịmg thuốc cho đến khi phục
hỏi trớ vê độ < 2 vả giám 25% liêu
cho tât cả cảc liêu tiêp theo.
Đau thần kinh hoặc bệnh thần
kinh ngoại vi
Không điều chinh liều
Xem các thông tin kẽ toa cho
bortezomib
* Để biết lhẻm Ihóng lin chí ziểl vế Ỉi'ẽu dùng vả điều chmh liểu cu'a bortezomỉb. xem cảc thông tin ké ma cho
bortezomr'b.
Bệnh nhân suy gỉăm chức năng gan: Dược động học cúa CAELYX được xảc định trên một
nhỏm nhỏ bệnh nhân có tăng bilirubin toản phần không khảo với dược dộng học của những bệnh
nhân có bilirubin toản phần binh thường; tuy nhíên cho đến khi thu thập thêm những kính
nghiệm khảo, lỉều dùng của CAELYX trên nhũng bệnh nhản suy giảm chức năng gan nên giảm
xuống theo những. sô liệu từ nhũng chương trình thử nghiệm lâm sảng về ung thư vú và buồng
trúng nhu sau: khi bắt dằu điều trị, nêu nông độ bilirubin từ 1,2 - 3,0 mg/dl, liễu dầu tiên giảm
xuông 25% Nếu nồng dộ bìlírubin > 3.0 mg/dl lỉẽu đầu tiên giảm xuông 50% Nếu bệnh nhân
dung nạp với liều đầu tiên mà không tảng nông dộ bilirubin huyết thanh hoặc men gan liều dùng
PI_CỈ`ơEIỄILY_ TW_ C C DS 08Mar201 3_vf 5 12 4
cho chu kỳ 2 có thế được tăng lên mức liều tiếp theo, ví dụ như nếu đã giám 250/o đối với liều
đầu tỉên, sẽ tăng lên liếu dầy đủ ở chu kỳ 2; còn nểu đã giám 50% đối với liếu đầu tiên, sẽ tăng
lên bằng 75% liếu đầy đủ ở chu kỳ 2. Liếu dùng có thể tăng lên liều đầy đủ ở cảc chu kỳ tiếp
theo nêu dung nạp tốt. CAELYX có thể dùng cho bệnh nhân di cãn gan với nồng độ bilirubin vả
men gan tăng lên gấp 4 lần so với mức cao nhắt trong giới hạn bình thường cho phép. Trưởc khi
dùng CAELYX. phải kiếm tra chức năng gan bằng các xét nghiệm cận lâm sảng quy ước như
ALT/AST, alkalin phosphatase vả bilirubin.
Bệnh nhân suy chức năng thận: Do doxorubicin được chuyến hóa qua gan và bải tiết qua mật,
không cẳn thay đồi liếu dùng CAELYX. Những phân tích trên quân thế đã khắng định rằng
những thay đổi chức năng thận trong phạm vi thừ (độ thanh thải creatinin ước tính là từ 30 - 156
ml/phút) không lảm thay đổi dược động học của CAELYX. Không có sẵn số liệu dược động học
cùa những bệnh nhân có độ thanh thải creatinin < 30 ml/phủt).
Bệnh nhân AIDS-KS đã cắt bỏ lách: Do không có kinh nghiệm điếu trị CAELYX trên bệnh
nhân đã cắt bỏ Iảch nên không khuyến cảo điếu trị bằng CAELYX.
Bệnh nhi: Có ít số liệu về tính an toản trong pha 1 cho thấy rằng với lỉều lên tới 60 mg/m² mỗi 4
tuần cũng được dung nạp tốt ở bệnh nhi; tuy nhiên, hiệu quả ở bệnh nhân dưới 18 tuổi chưa được
xảc định.
Bệnh nhân cao tuổi: Số liệu phân tích từ quần thể cho thấy rằng tuối tảc trong phạm vi nghiên
cứu (từ 21 - 75 tuối) không lảm thay đối đảng kế dược động học của CAELYX.
CHỐNG cni ĐỊNH ,
CAELYX chống chỉ định ở bệnh nhân có phản ứng quả mẫn cảm với cảc thânh phần cùa thuốc
hoặc với doxorubicin hydrochloride. Không được sử dụng CAELYX cho phụ nữ đang cho con
bủ.
CẠELYX không được sử đụng đế đỉếu trị sarcôm Kaposi lỉên quan tới AIDS mã có thế được
điêu trị hiệu quả với phảc đô tại chỗ hoặc interferon alfa toản thân.
CẢNH BÁO VÀ THẶN TRỌNG ĐẶC BlẸT KH] SỬ DỤNG
Nguy cơ tim mạch: Tất cả bệnh nhân điếu trị với CAELYX phải kiểm tra thường quy diện tâm
đồ. Những thay đối thoảng qua về điện tâm đồ như sóng T phẳng. đoạn S-T lõm vả loạn nhịp
lảnh tính không được coi là chỉ định bắt buộc để ngừng điều trị với CAELYX. Tuy nhiên, giảm
phức hợp QRS thường được coi là chỉ dấu cúa độc tinh tim hơn. Nếu sự thay đối nảy xuất hiện,
nên xem xét sinh thiết nội mạc cơ tim vì là biện phảp xác định tôn thương cơ tim do
anthracycline rõ nhất. (xem phần Tác dụng ngoại ý).
Những phương phảp chuyên biệt hơn để đánh giá và theo dõi chức nảng tim so sánh được với
điện tâm đồ là đo phân suất tống mảu thắt trải bầng phương phảp siêu âm tim hoặc tốt hơn là
chụp phóng xạ mạch mảu (.MUGA) Những phương phảp nảy nên được tiến hảnh thường quy
trước khi bắt đầu điều trị bằng CAELYX vả lặp lại định kỳ suốt trong quá trình điều trị.
Trong một nghiên cứu lâm sảng pha III so sảnh gìữa CAELYX (SO mg/m2 mỗi 4 tuần) với
doxorubicin (60 mg/m mỗi 3 tuần), nguy cơ phảt triến cảc biến cố trên tim do liều tích lũy cùa
anthracyclỉne là thấp hơn đảng kế ở CAELYX so với doxorubicin (HR
[doxorubicin/CAELYX]= —,3 16; p 5% bệnh nhân được điều trị kết hợp
CAELYX vả bortezomỉb.
Các tảc dụng ngoại ý về huyết học như giảm bạch cầu trung tính, gíám tiểu cầu vả thiếu mảu
đu ọc bảo cáo thường xuyên nhất với cả hai phảc đồ điều trị kểt họp CAELYX cộng bortezomìb
P] roeụ-x TH' CCDS os.ưarzmj_vl 12124
vảhortezọmib đơn trị liệu. Tỷ lệ giảm bạch cầu trung tinh độ 111 và cịộ [Y xảy ra cao hơn ở nhóm
diêu trị kêt hợp (28%) so vởỉ nhóm đơn trị lìệu (14%). Tỷ lệ giảm tỉêu câu dộ 111 và độ [V xảy ra
cao hơn ở nhóm đỉêu trị kêt hợp (22%) so với nhóm đơn trị Iỉệu (14%). Tỷ lệ thiểu mảu 1ảtương
tự nhau ở cả hai nhóm điều trị (7% so với 5%).
Viêm miệng được báo cảo thường xuyên ở nhóm diều trị kết hợp ( 16%) so với nhóm đon trị liệu
(3%), và hâu hêt cảc trườpg hợp ở độ 11 hoặc thâp hơn. Viêm miệng độ 111 dã dược bảo cảo ở 2%
bệnh nhân trong nhỏm đỉêu trị kết hợp. Không trường hợp viêm miệng độ IV nảo được bảo cảo.
Buổn nôn vả nôn được báo cảo thường xuyên hơn ở nhóm điều trị kết hợp (40% và 28%) so vởi
nhóm đơn trị liệu (32% và 15%) Vẻ chủ yếu là độ ] và độ 11.
Ngừng điều trị một hoặc cả hai thuốc do tác dụng ngoại ý được ghi nhận ở 38% số bệnh nhân.
Các tảc dụng ngoại ỷ phổ biến dẫn đển ngừng điếu trị bortezomỉb vả CAELYX lả PPE, đau dây
thần kinh, bệnh thần kinh ngoại biên, bệnh lý thần kinh cảm giảc ngoại biên, giảm tiều cầu, giảm
phân suất tống mảu vả mệt mòi.
Pl Cael_ư_ TW_CCDS 08Mar2013 vl 13124
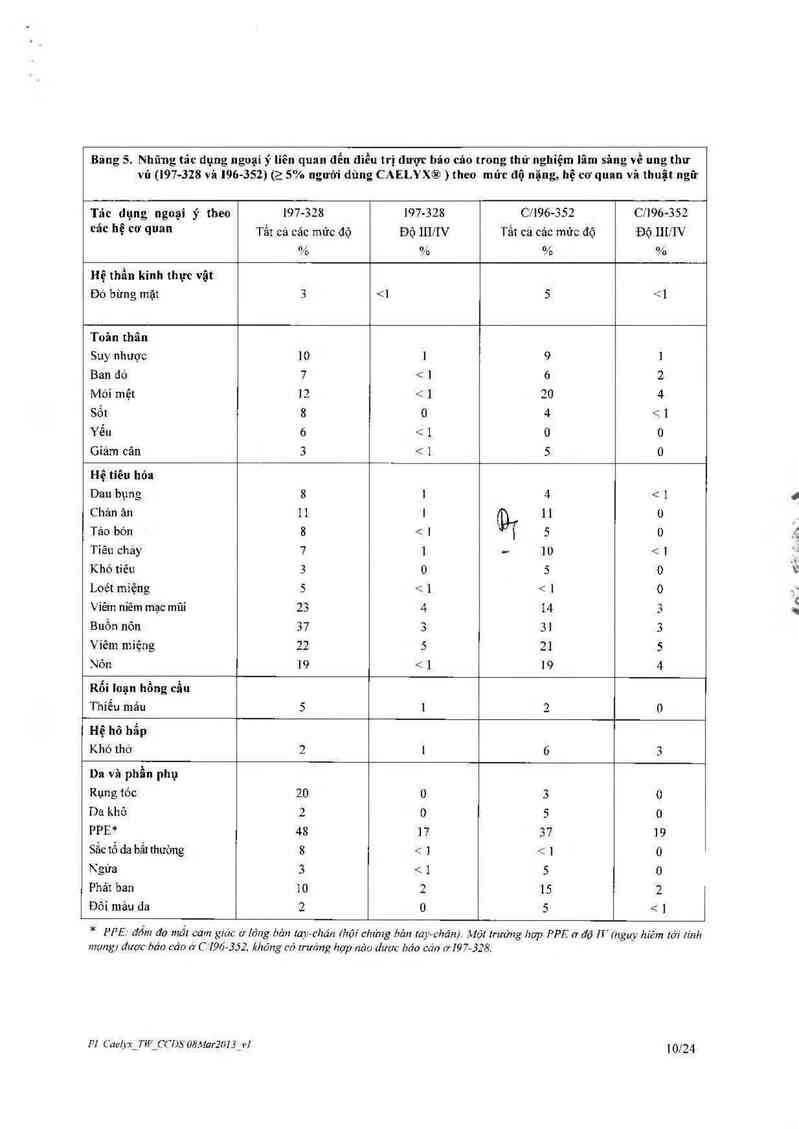
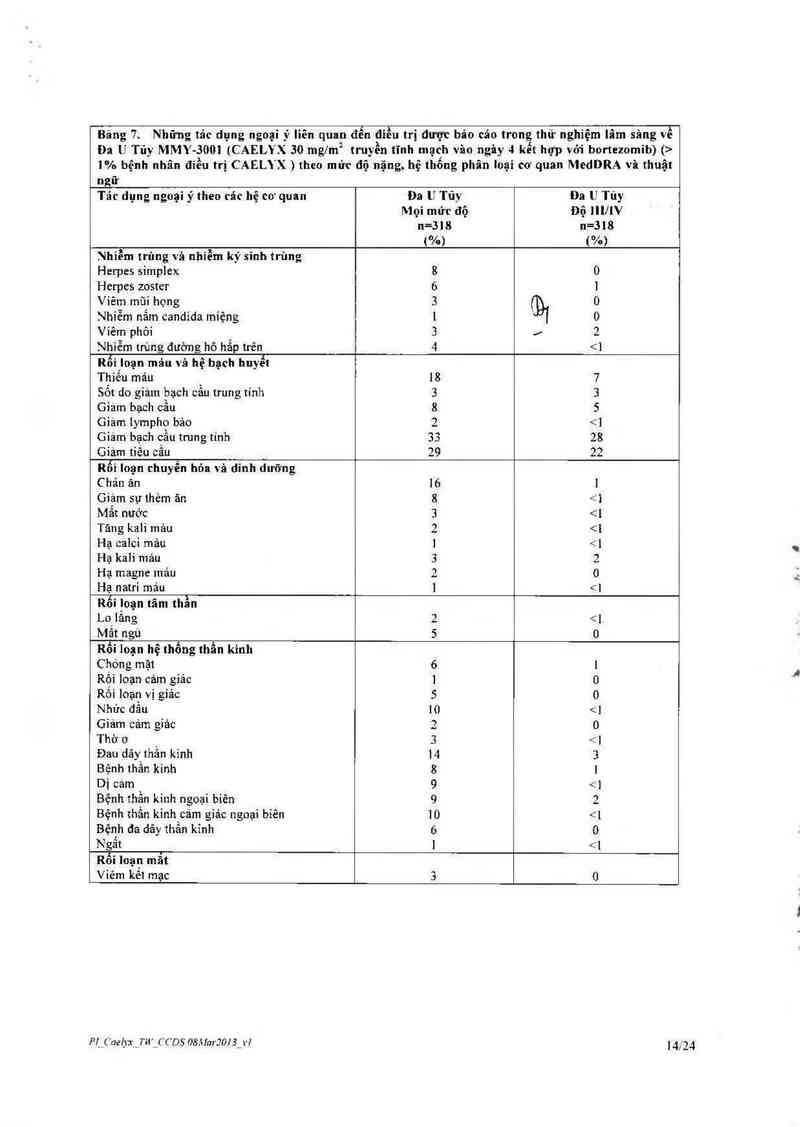
Bảng 7. Những tảc dụng ngoại ỷ liên quan đễn điều trị được báo cảo trong thử nghiệm lâm sâng về
Đa U Tủy MMv-sooi (CAELYX 30 mglm² truyền tĩnh mạch văo ngây 4 kết họp với bortezomib) (›
1% bệnh nhân điểu trị CAELYX ) theo mửc dộ nặng, hệ thống phân loại cơ quan MedDRA và thuật
ngư
Tác dụng ngoại ý theo các hệ cơ quan Đa U Tũ_v Đa U Tủy
Mọi mứt độ Độ mnv
n=318 n=318
(%) ("/o)
Nhiễm trùng và nhiễm ký sinh trùng
Herpes simplex 8 0
Herpes zoster 6 ]
Viêm mũi họng 3 0
Nhiễm nắm candỉda miệng 1 1D1 0
Viêm phôi 3 _, 2
Nhiễm trùng đường hô hẳp trên 4 <]
Rối loạn máu và hệ bạch huyết
Thiểu máu 18 7
Sốt do giam bạch cằu trung tính 3 3
Giảm bạch cẩu 8 5
Giảm lympho bảo 2 <]
Giam bạch cẩu tmng tinh 33 28
Giảm tiếu cấu 29 22
Rối loạn chuyển hỏa và dinh dưỡng
C hán ăn 16 ]
Giảm sự thèm ãn 8 ả'1
Mắt nước 3 <1
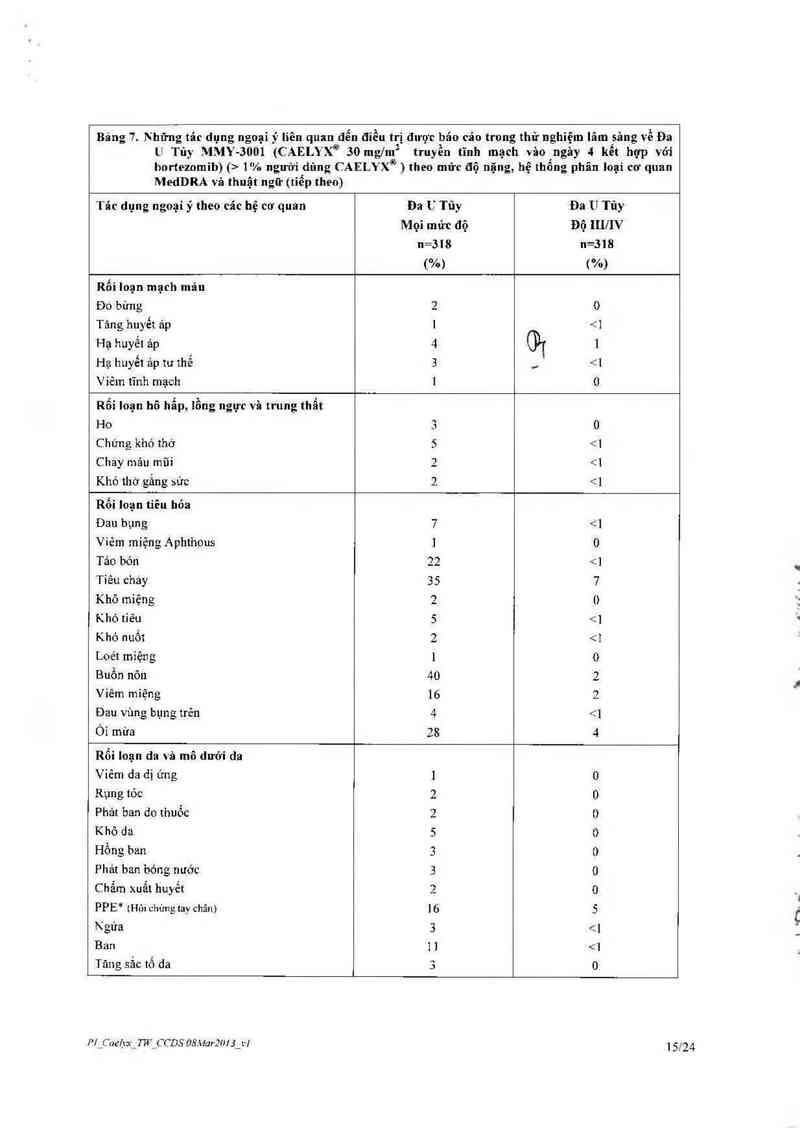
Tăng kali mảu 2 1% người dùng CAELYX® ) theo mửc độ nặng, hệ thống phân loại cơ quan
MedDRA và thuật ngữ (tiễp theo)
Tác dụng ngoại ý theo cảc hệ cơ quan Đa U Tũy Đa U Tủy
Mọi mức độ Độ III/IV
n=318 n=318
(%) ("/o)
Rối loạn mạch máu
Đo“ bửng 2 0
Tảng huyết ảp 1 <1
Hạ huyết ảp 4 1
Hạ huyết ảp tư thế 3 <1
Viêm tĩnh mạch 1 0
Rối loạn hô hẳp, lồng ngực vẫn trung thẫt
Ho 3 0
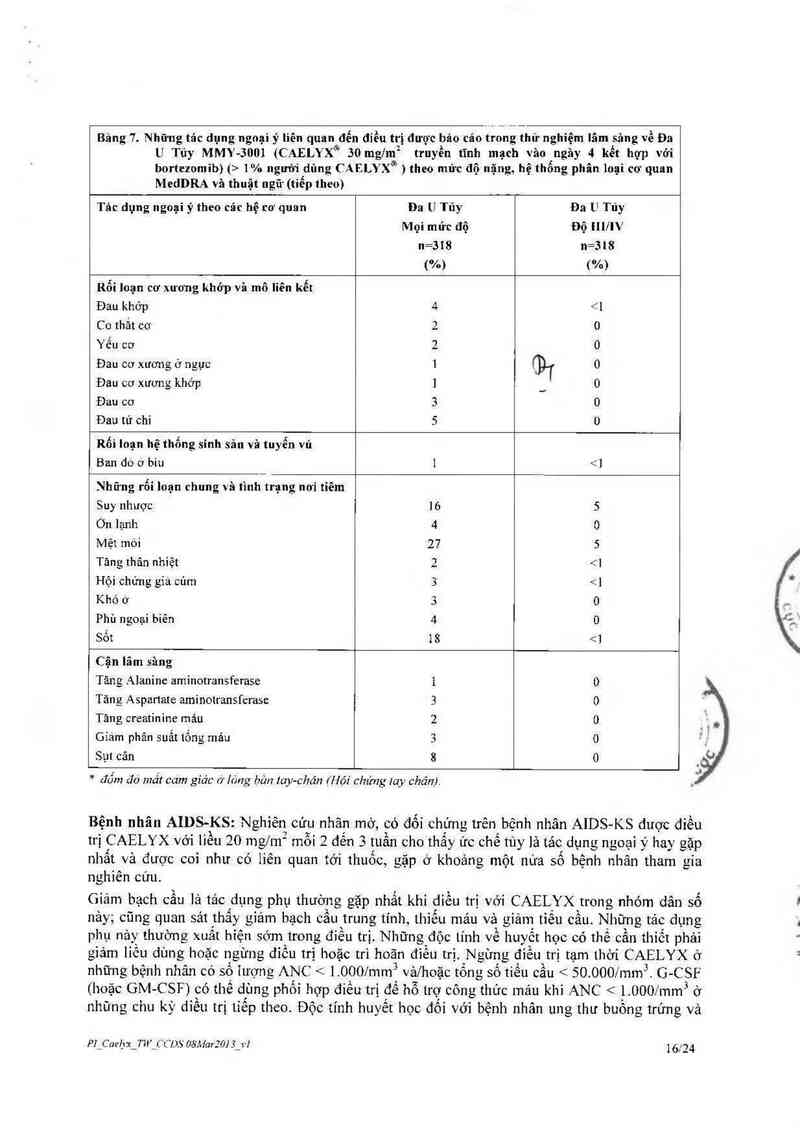
Chứng khó thứ 5 1% nguời dùng CAELYX® ) theo mức độ nặng, hệ thống phân loại cơ quan
MedDRA và thuật ugữ (tỉếp theo)
Tâc dụng ngoại ý theo các hệ cơ quan Đa U Tủy Đa U Túy
Mọi mức độ Độ nmv
n=318 n=318
("/n) (%)
Rối Ioạn cơ xương khớp vả mô liền kết
Đau khớp 4 < ]
Co thắt cơ 2 0
Yếu cơ 2 0
Đau cơ xương ở ngực 1 {91 0
Đau cơ xương khớp ] __ 0
Đau cơ 3 0
Đau tứ chi 5 0
Rối loạn hệ thống sỉnh sản vả tuyến vú
Ban do ơ bìu 1 <]
Những rổi loạn chung và tình trạng nơi tiêm
Suy nhược 16 5
Ớn lạnh 4
Mệt mòi 27 5
Tăng thân nhiệt 2 <1
Hội chứng gỉả củm 3 _ 5%) trong nghiến
cứu lâm sảng CAELYX. Những bất thường nảy bao gôm tăng phosphatase kiêm, tăng AST vả
bilirubin mã được xem là có liên quan đến bệnh nến chứ không phải do CAELYX 1t gặp (< 5%)
truờng hợp giảm Hb, giảm tiếu câu. Cũng hiếm gặp (< 1%) nhiễm khuấn huyết do giảm bạch
câu Một số nhũng bắt thường trên có 1iến quan tởỉ bệnh HIV đang mắc, chứ không phải do
CAELYX.
Tẫt cả bệnh nhân: 100/929 bệnh nhân (10, 8%) có u đặc gặp phản ứng do truyền CAELYX và
mô tả theo thuật ngữ Coztart gổm: phản ứng dị ủng, phản ứng dạng phản vệ, hen, phù mặt, hạ
huyết’ ap, gỉận mạch, mảy day, đau lưng, đau ngục, ởn lạnh, sốt, tăng huvết áp, nhịp tim nhanh,
khó tiêu, buồn nôn, chóng mặt, khó thở, víêm hầu họng, phảt ban, ngứa, để mô hôi, phản ửng nơi
truyền, tương tảc thuốc. Tỷ lệ ngừng thuốc vĩnh viên không thường được bảo cáo (2%) Tỷ lệ
tương tự vẽ các phản úng do truyên (12,4%) gặp ở các thử nghiệm chính về ung thu vú. Tỷ lệ
ngừng thuốc vĩnh vìên cũng tuong tự (1,5%). Ở bệnh nhân đa u tùy đỉếu trị CAELYX Vả
Bortezomib, phản úng clo truyền đuợc bảo cảo với tỷ lệ 3%. Ở bệnh nhân AIDS- KS, thấy các
phản ứng do truyền đặc trung bơi đò bùng mặt, thở ngắn, phù mặt, nhúc đầu, ớn lạnh, đau lung,
căng ở ngực vả họng vả/hoặc hạ huvết ảp, chỉếm tỷ lệ 5%- 10% Rất hiếm thắy chứng co giật liên
quan tới phản ưn g truyền 0 mọi bệnh nhân, phản úng do truyền thuờng Jgặp trong lằn truyền đẩu
tiên Tạm ngùng truyền thuong sẽ `giải quyết được cảc tảc dụng phụ nây mã không cần thêm trị
liệu khác Ở hầu hết bệnh nhân, điếu trị bằng CAELYX có thế tìêp tục lại sau khi cảc tảo dụng
phụ đã được giai quyết mã không có tái phát. Cảc phán ứng do truyền híếm khi lặp lại sau chu kỳ
đẩu tiên dìều trị vởi CAELYX
Ức chế tưy đi kèm vởi thiếu mảu. giảm tỉếu cầu, giảm bạch cầu và hiếm khi có sốt do giảm bạch
cầu trung tính đã duợc báo cáo trong bệnh nhân điều trị CAELYX. Vìêm míẹng được báo cáo ở
bệnh nhân truyền liên tục doxorubicin hydrochloride quy ước vả hay gặp ở bệnh nhân truvến
CAELYX. Viêm miệng không ánh huóng dến bệnh nhân đã kết thúc điếu trị và nói chung không
cẩn chinh liếu, trù khi viêm miệng ]ảm ảnh hưởng đến khả nãng ăn uống cùa bệnh nhân Khi đó,
cần giảm lỉếu hoặc tăng khoảng 7vcảch giữa hai lần truyền lhêm 1—2 tuân nữa
PPE có đặc điếm lả phảl ban đỏ da đạng dảt phẳng và rất đau. Ở bệnh nhân bị PPE, triệu chứng
PPE thuong gặp sau 2- 3 chu kỳ điếu trị. Ở phần lớn bệnh nhân triệu chứng sẽ qua khoi sau 1 -2
tuần, có hoặc không có điếu trị bằng corticoỉd. Có thể dùng pyridoxine môi ngảv 50-150 mg dế
ngăn ngừa vả đìếu trị PPE. Các biện pháp khảc để ngăn ngùa vả điếu trị PPE có thể khởi dằu sau
4— 7 ngảv điếu trị CAELYX, bao gồm gỉủ~ chân tay thoảng mảt, bằng cảch nhúng vảo nước mát
(tắm, boi ngâm nước), trảnh nuớc quả ấm/ nóng vả giữ chân tay không bị bó chặt (không dùng
găng tay, bít lất, giảy quá chật khít). PPE dưòng như có liên quan tới ]iếu dùng và vởi 1ịch trình
điếu trị vả có thế giám bớt dộ trẳm trọng bằng giảm lỉếu hoặc tăng khoáng cách đỉều trị lhêm 1-2
H_(`aelyx_ TW_CCDS 08Mar2013_r1 | 7,124
AQ
tuần nữa. Ở một số người, phán ứng nảy có thế nghỉêm trọng và lảm suy nhược vả có thế cẳn
ngừng thuốc.
Việc tăng tỉ lệ suy tim sung huyết có liên quan với điếu trị doxorubicin. ở liều tích lũy suốt đời
>450 mg/m2 hoặc với liều thấp hon đối với bệnh nhản cớ cảc vếu tố nguy cơ cho tim. jSinh thỉểt
nội mạc cơ tim trên 9/10 bệnh nhân AIDS- KS có liều tích lũy CAELYX >460 mglm2 cho thắy
không có bằng chứng bệnh cơ tim do anthracyclinc Liều khuyến cáo CAELYX cho bệnh nhân
AIDS-KS lả 20 mg/nn2 mỗi 2-3 tuần. Liều tỉch 1ũy có thể gây ra độc tính vởi tim ơ cảc bệnh nhân
AIDS-KS nảy (> 400 mg/mz) đòi hòỉ hơn 20 liệu trinh CAELYX trong 40—60 tuần.
Thêm vảo đó, sinh thiết nội mạc-cơ tim đuợc thực hỉện trên 8 bệnh nhân có u đặc với liếu tích
lũy anthracycline là 509 mg/m2 — 1680 mglml. Biên độ điếm độc tỉnh tỉm theo thang Billingham
được phân theo mức độ 0-1,5. Thang điếm nảy lả tương ứng với không có hoặc có độc tinh mức
nhẹ với tim.
Trong thư nghiệm chính, pha 111 so sảnh với doxorubicin, 10/254 bệnh nhân được phân phối
ngẫu nhỉên dùng CAELYX (SO mg/m2 mỗi 4 tuần) so với 48/255 bệnh nhân chợn ngẫu nhiên
dùng doxorubicin (60 mglrn2 mỗi 3 tuần), phủ hợp tiêu chuẩn đã xảc định trong đề cương nghiên
cứu đối với độc tính trên tim trong thới gian điều trị vảf' hoặc theo dõi sau điều trị. Độc tỉnh với
tim được định nghĩa là giám> 20 phẩn trăm điềm (pcrcentage points) so vởi lúc ban đầu nếu
phân suất tống máu cùa tâm thẳt trái (LVẸF) lúc nghỉ ngơi vân trong giới hạn bình thường hoặc
gỉảm_ > 10 phần trảm điếm nếu LVEF bất thường (thẩp hơn giới hạn dưới của bình thường).
Nguy cơ phát triển cảc biến cố tim do tích lũy liếu anthracycline lả thấp hơn có ý nghĩa ớ nhóm
dùng CAELYX so với doxorubicin (HR [doxorubicin/CAELYX}=3, 16, p <0 ,.001)
Bệnh nhân cũng được đánh giả về những dấu hiệu và triệu chứng cùa suy tim sung huyết (CHF)
Trong số 10 bệnh nhân dùng CAELYX có độc tính với tim dựa vảo tiêu chuẩn LVEF, không có
bệnh nhân nảo có dẳu hiệu và triệu chứng CHF Nguợc lại, 10148 bệnh nhân dùng doxorubicin
có độc tinh với tim dựa vảo tiêu chuẩn LVEF lại có dấu hỉệu và triệu chứng của CHF.
Ở bệnh nhân có u đặc. bao gồm phân nhóm bệnh nhản ung thư vú vả buồng trứng,2 được điều trị
với liều 50 mglml cho mỗi chu kỳ vởi lìếu tỉch lũy anthracyclinc đến 1532 mg/m2, tỉ lệ các rối
Ioạn chức năng tim có ý nghĩa lảm sảng lả thẩp. Trong số 929 bệnh nhân dùng CAELYX 50
mg/m2 cho mỗi chu kỳ có 418 bệnh nhân đuợc đo giá trị LVEF lúc ban đầu và ít nhắt một lằn do
để theo dõi và được đánh giá bới MUGA. Trong sô 418 bệnh nhảm nảy, có 88 người có liếu tích
lũy anthracyclỉne >400 mg/m' lả mừc phơi nhiễm liên quan với tăng nguy cơ độc với tim mạch
cùa công thức doxorubicin quy ước. Chỉ 13 ngưới trong số 88 bệnh nhân nảy (15%) có ít nhất
một sự thay đổi có ý nghĩa lâm sảng vế LVEF, mả được định nghĩa lả giá trị LVEF< 45% hoặc
có sự giảm it nhắt 20 phần trăm điếm so với lúc ban dẳu. Hơn nữa, chỉ có ] bệnh nhân (dùng lỉều
tích lũy 944 mng ) phai ngùng nghiên cứu do có triệu chứng lâm sảng cùa suy tim sung huyết.
Mặc dầu rẳt hiếmv gặp hoại tư tại chỗ do thoảt mạch, vẫn cằn coi CAELYX lả chắt gây kich ứng.
Nghiên cúu trên động vật cho thấy dùng doxorubicin hydrochloride dưới dạng bảo chế liposome
sẽ lảm giảm nguy cơ tốn thương do thoảt mạch Khi bắt kỳ dấu hiệu hoặc triệu chứng thoát mạch
nảo xáy ra (ví dụ: nhức nhối ban đò), phải ngừng truyền ngay và bắt đằu truyền qua tĩnh mạch
khảo. Đẳp nước đá vảo nơi bị thoảt mạch khoảng 30 phủt có thể giúp lảm thuyên giảm phản ứng
tại chỗ. Không được tiêm CAELYX vảo trong cơ hoặc dưới da.
Gặp lại phân ứng ngơảỉ da do liệu phảp chiếu xạ trưởc đây hiếm gặp khi dùng CAELYX.
Dữ Iỉệu sau Ichi đua thuốc ra thị lrưòug
Cảc phản ứng có hại cúa thuốc được xảc định theo kỉnh nghiệm sau khi dua ra thị trường với
CAELYX được mô tả duởi đây. Cảo tần suất được cung câp theo quy ước sau đây;
Rắt thường gặp 21110
P] Cael_ư , TW CCDS 08.1far2013_r1 18124
Thường gặp 21(100 and < 1/10
Không thường gặp 21(1,000 and <1/100
Hiếm gặp zmo.ooo. 1,00).
UNG THƯ BUÒNG TRÚNG: Một nghiên cứu lâm sảng ngẫu nhiên pha 111 so sảnh giữa
CAELYX với topotecan trên bệnh nhân ung thư biếu mô buồng trứng sau khi thất bại với hóa trị
liệu bước một có platinum đã được tiến hảnh trên 474 bệnh nhân.
Có một lợi ích về sống còn toản bộ (OS) cho cảc bệnh nhân được đỉễu trị với CAELYX so với
bệnh nhân được điếu trị với topotecan được chứng minh bởi ti số nguy cơ (HR) lả 1,216 (95%
C1,1,000— 1,478), p = 0,050. Cảc tỉ lệ sống còn vảo cảc năm 1, 2 và 3 ở nhóm điều trị với
CAELYX tương ứng lả 56,3%, 34, 7% và 20, 2% so với 54,0%, 23 6% và 13,2% ở nhóm
topotecan.
Đối với phân nhóm bệnh nhân nhạy cảm với platinum, sự khác biệt là lớn hơn: tỉ số nguy cơ HR
1,432 (95% C1, 1, 066- 1,,923) p= 0,017. Cảo tỉ lệ sống còn ớ cảc năm 1, 2 và 3 ở nhóm điều trị
với CAELYX là 74,1%, 51,2% vả 28 4% so với 66,2%, 31,0% và 17, 5% ở nhóm topotecan.
Điều trị lả tương tự ở phân nhóm bệnh nhân kháng platỉnum: tỉ số nguy cơ HR 1,069 (95% C1,
0,823-1,,387) p= 0,618. Cảc tỉ lệ sỏng sót ở cảc nãm !, 2 và 3 ở nhóm điều trị với CAELYX lả
41 ,°5 /o, 21,1% và 13, 8% so với 43,2%, 17,2% vả 9 ,5% trên nhóm topotecan.
ĐA U TỦY: Một nghiên cứu Iảm sảng ngẫu nhiên pha 111, nhóm song song, nhãn mở, đa trung
tâm so sảnh tính an toản vả hiệu quả cùa liệu pháp kểt hợp CAELYX cộng bortezomib với đơn
trị liệu bortezomib ở những bệnh nhân đa u tủy, mả đã nhận được ít nhất 1 điều trị trước đó,
P] Cnel_ư rwrros 08.11ar2013 rl 20/24
được tiến hảnh ớ 646 bệnh nhân. Tiếu chí chính về thời gian cho đến khi bệnh tiến triến (TTP) đã
được cải thỉện đáng kể ở cảc bệnh nhân đuợc điếu trị bằng liệu phảp kết hợp CAEI YX cộng
bortezomib so với cảc bệnh nhân được điếu trị với bortezomib đơn trị liệu với giám nguy cơ
tương đối (RR) 35% (95% Cl; 21-47%), p <0, 0001, dựa trên 407 biến cố TTP Giá trị trung vị
TTP là 6 9 thảng đối với các bệnh hhân đơn trị liệu bortezomib so với 8, 9 thảng ở cảc bệnh nhân
đíếu trị kết họp CAELYX cộng với bortezomib. Một phân tích gỉữa kỳ được xảc định trong đề
cương nghiên cứu (dụa trên 249 biến cố TTP) đã thủc đắy vìệc chấm dứt nghiên cứu sớm do tính
hiệu quả. Phân tich giữa kỳ nảy cho thắy giảm nguy cơ về l`TP 45% (95% CI, 29 57%),p
<0, 0001. TTP trung vị là 6,5 thảng đối với cảc bệnh nhân đơn trị lỉệu bortezomib so với 9 .)
thảng đối với bệnh nhân đìếu trị kết hợp C AELYX với bortezomib Những kết quả nảy, mặc dù
chua hoản chinh, vẫn mang lại kết quả phân tích cuối cùng theo định nghĩa của đề cưong
Đặc tinh dược động học
Dược động học của quần rhể: Dược động học cùa CAELYX đã được đảnh giả qua 120 bễnh
nhân từ 10 thử nghiệm lâm sảng khảc nhau bằng cách đánh giá được động học quần thế. Dược
động học cùa CAELYX với liếu lớn hớn 10 mg/m’ đến 60 mg/m2 được mô tả tốt nhất bằng mô
hình hai ngản không tuyến tính với dữ liệu đưa vảo từ mức 0 và phương phảp loại trừ Michaelis-
Mentezn. Sự thanh thải thục tế trung binh cùa CAELYX là 0, 030 LJ’h/m2 (từ 0,008 đến 0,152
LJ’h/m2 ) và thể tích phản phối trung tâm trung bình lả ] 9,3 L/m' (từ 0,96 — 3, 85 L/m’ ) tương
đương với thể tích huyết tương. Thời gỉan bán hủy từ 24 đến 231 giờ, với thời gian bản hủy trung
bình là 73,9 giờ.
Bệnh nhân ung thư vú: Dược động học cùa CAELYX được dánh giả qua 18 bệnh nhân ung thư
vú tưong tự như dược động học được xảc định trên nhỏ… quần thể lớn hơn từ 120 bệnh nhân
mắc cảc loại 2ung thư khảc nhau Sự thanh thái thưc tế trung bình là 0,016 L/h/’m (từ 0,009 đến
0,027 Lỉhi'2m ) vả thể tích phân phối tịrung tâm trung bình là 1,46 L/m2 (từ 1,10 — 1,64 L/m’ )
Thời gian bản hưy trung bỉnh là 71,5 giờ (từ 45,2 đến 98 5 gìờ)
Bệnh nhân ung #… buồng rrửng: Dược động học cùa CAELYX đánh giả qua 11 bệnh nhân
ung thư buồng trứng tương tự như dược động học được xảc định trên nhóm quần thể lớn hơn từ
120 bệnh nhân mãc cảc loại ung thư khảc nhau Sự thanh thải thực tế trung bình là 0, 2021 thlm2
(tù 0, 0092 đến 0,041 ifh/m’ ) và thế tich phân phối trung tâm trung bình là 1, 95 L/m2 (từ 1,67 -
2 40 L/m2 ). Thời gian bản hùy trung bỉnh là 75 giờ (từ 36,1 đến 125 giờ).
Bệnh nhân AIDS- KS: Dược động học cùa CAELYX trong huyết tương đã được đảnh giả qua 23
bệnh nhân bị sarcôm Kaposỉ được truyền tĩnh mạch một liếu duy nhất 20 mgỉ²m trong 30 phút.
Cảc thông số về dược động học của CAELYX (Chủ yếu lả doxorubicin hydrochoioride được bao
bọc trong cảc liposome và 1 lưọng nhớ doxorubicin hydrochloride khỏng được bao bọc) quan sảt
được sau khi dùng liều 20 mg/m’ được trình bảy trong bảng 8.
PJ_Caetư_ rw CC'DS (18,11ar2013_1~1 2 1 1,124
Bảng 8: Các thông số về dược động hợc ở hệnh nhân AlDS-KS được điều trị bằng
CAELYX
Giá trị trung bình : Sai sổ chuẩn
Cảc thông số 20 mgfm² (n=23)
Nồng độ tối đa trong huyết tương* (pgr’ml) 8,34 i 0,49
Hệ số thanh thai huyết tương1Lf'hx'mồ 0,041 J_r 0.004
Thê tích phân bố (Lfm²J 2,72 J_r 0,120
AUC (ug=’ml—h) 590,00 i 58,7
Thời gian bản húy À. (gíờ) 5,2 i 1.4
Thời gian bản hưy Az(gìờ) ss,o i 4_s
* Đo 0" giai đoạn cuối cua 30 phút truyền
DỮ LIỆU AN TOÀN TIÊN LÂM SÀNG (D 1
Cảo nghiên cúu liều lặp lại trên động vật cho thấy hồ sơ dộc tính cùa CAELYX rắt giống với hồ
sơ độc tính ghi nhận trên người đuợc truvến doxorubicin HC1 chuẩn trong một thời gỉan dải. Vởi
C AELYX việc bao doxorubicin hydrochloride vảo trong các liposome pegylate hóa đã lảm cho
độc tính cùa nó thay đối về mức độ như sau:
Độc lmh tgên tim. Nghiên cứu trên 1116 cho thẫy độc tính trên tim cùa CAELYX giảm đi so với
các chê phâm doxorubicin hydrochloride thông thường.
Độc n'nh trên da: Trong cảc nghiên cúu được tiến hảnh sau khi sử dụng CAELYX nhắc lại trên
chuột và chó quan sát thấy cảc đạng loét da vả hiện tượng viêm da nghiêm trọng ở cảc liếu tưong
úng trên lâm sảng Nghiên cứu trên chó cho thấy sự xuât hiện và mức độ nặng tốn thương trẽn da
sẽ giám đi khi giảm lỉếu hay kéo dải khoảng cảoh giũa cảc lần dùng thuốc. Cảc tỏn thưong da
tương tự như đổm ban đỏ mât cám giác ở lòng bản lay- bản chân củng thắy xuất hìện ở cảc bệnh
nhân sau khi truyền tĩnh mạch thời gian dải (xem Phản ứng có hại).
Phản ửng phản vệ: Trong cảc nghiên cứu độc tính liều lặp lại trên chó quan sát thắy một đáp
úng câp tính đặc trưng bởi tụt huyết áp niêm mạc nhọ1,tăngtiết nước bọt, nôn vả gỉai đoạn tăng
hoạt động sau đó là giảm hoạt động và hôn mê đã xuất hiện sau khi sử đụng liposome pegylatc
hóa (giá dược). Đảp úng tương tự nhưng nhẹ hơn cũng đã thấv ở trên chó được điều trị bằng
CAELYX vả doxorubicin. Phán ứng lụt huyết ảp giảm cường độ khi được điếu trị truớc bằng
thuốc khảng histamin Tuy vậy, cảc đảp' ung nảy không đe dọa đến tính mạng vả cảc con chó đếu
hồi phục nhanh chóng sau khi ngừng điều trị.
Độc n'nh tại chỗ: Cảc nghiên cứu về sự dung nạp thuốc dưới da cho thấy CAELYX, ngược lại
vởi doxorubicin hydrochloride chuẩn, gây kích thích tại chõ hoặc tôn thương mõ nhẹ hơn sau khi
thoát mạch.
Gây đột bỉến gen va` ung thư: Mặc dù chưa có nghiên cứu nảo được thực hiện vởi C AELYX
doxorubicin hydrochloride, thảnh phần có hoạt tính dược lý cùa CAELYX, có khả năng gây đột
biển gen vả ung thu Cảc giả duợc liposome pegylate hóa khỏng gây đột biển gen hoặc độc tính
trên gen.
Độc tinh trên sự sính sản: CAELYX gây tco buồng trúng và tinh hoản từ mức độ nhẹ đến vừa
trên chuột nhắt sau ] liều duy nhắt 36 mglkg Gìzìm trọng lượng tinh hoản vả thiếu sán tinh trùng
xuất hỉện trên chuột cống sau các liếu lặp lại >0, 25 mg/kgmgảy và hiện tuợng thoái hóa lan tỏa
của cảc ổng sinh tinh cùng với sự giảm rõ rệt khả năng sình tinh đã được thắy ở chó sau cảc liếu
lặp lại 1 mg;kg/ngảy.
PI_C`aeb x_ 71'i '_ C (.` DS 08Mm'2013_v1 22Í24
Độc tính trên thận: Một nghiên cứu đã Ch] ra rằng CAELYX tiếm tĩnh mạch lỉều đon gắp hai
lần liếu lâm sảng gây ra độc tính thận 6 khi. Độc tính thận đã được quan sát với thậm chí liếu
đơn thắp hơn cưa đoxorubicin hydrochloride ở chuột và thỏ. Do đảnh giả của cơ sở dữ Iíệu an
toản sau khi lưu hảnh CAELYX ra thị trường đã không thấy eợi ý độc tính thận có ý nghĩa cùa
CAELYX, những phát hiện nảy ở khi có thể khỏng có liên quan đển đảnh giả nguy cơ trên bệnh
nhảm
NHỮNG ĐẶC TỈNH RIÊNG CỦA THUỐC
Danh sách cảc tả dược:
Các tá duợc sau đãy được chứa trong mỗi lọ thuốc:
a-(2-[1.2—distcaroyl-sn-glycero(3)phosphooxy]ethylcarbamovl)-m-methoxypoly(oxyethylen) -
40 dạng muỏi natri (MPEG DSPE) [hay dạng N- (carbamoyl - methoxypolyethyleneglycol
2000)- 1 ,—2—distearoyl-sn- g1y-ccro--3-phosphoethanolamine dạng muôi natri (MPEG- DSPE)]
Phosphatidylcholine đặu nảnh được hydro hóa hoản toản (HSPC).
C holestcrol,
Amoni Sulfat, %
Sucrose, '
Histídỉnc,
Nước pha tiêm,
Acid hydrochloric,
Natri hydroxid,
Tính tqu kị: KHÓNG ĐƯỢC TRỌN VỚI CÁC THUỐC KHÁC
Hạn dùng:
20 thảng kế từ ngảy sản xuất. Không dùng thuốc đã quá hạn sử dụng.
Sau khi pha loãng:
- Tính ốn định hóa lý trong sử dụng đã được chửng minh là 24 giờ ở 2°C đến 8°C .
- Lọ thuốc đã được sử dụng một phằn phải được loại bò.
Thận trọng đặc biệt khi bâo quản
Lưu trữ trong tủ lạnh (2°C - 8°C).
Khỏng để đông đá.
Đối với cảc điều kiện bảo quản cùa sản phẳm thuốc đã pha loãng, xem phần Hạn dùng.
Quy cảch đỏng gỏi:
Hộp ] lọ 10 mL.
Hướng dẫn sử dụng, xử lý và hủy thuốc
KHÔNG SỬ DỤNG THUỐC NỂU CÓ HIỆN TƯỢNG KẾT TÚA HOẶC BÁT KÝ VẤN ĐỀ
TAO HAT KHAC.
Cần thận trọng trong việc xử lý dung địch CAELYX. Việc sử dụng gãng tay lả bắt buộc. Nếu để
CAEI YX tiêp xúc với da hoặc niêm mạc, cần rùa thật kỹ ngay lập tức với xã phòng vả nước
CAELYX nên được xư lý và hùy thuốc một cách thống nhẩt như với cảc thuốc chống ung thư
khảc.
Xác định liếu lượng cúa CAELYX để sử dụng (dụa theo liều khuyến cảo vả diện tỉch bề mặt cơ
lhế cùa bệnh nhân)- Lắy một lượng thích hợp CAELYX vảo một õng tiếm vô trùng Kỹ thuật vô
P] (` uelyx TW (` (` DS 08.11ar3013_v1 231"24
. lì`a I
__. .…
\o -,
trùng phải được thực hiện nghiêm ngặt vi không có chất bảo quản hoặc thuốc khảng khuấn nâo
hiện diện trong C AELYX
CAELYX phải được pha loãng trong dung dịch Dextrose 5% trưởc khi sử dụng. Đối với liều <90
mg, pha loãng CAELYX trong 250 ml và với liều >90 mg pha loãng CAELYX trong 500 ml
dun g dịch Dextrose 5%.
Việc sư dụng bất kỳ dung môi pha loãng nảo khảc ngoải dextrose 5% để truyền thuốc hoặc sự
hiện diện cùa bất kỳ tảc nhân kìm khuẩn như benzyl alcol có thể gây kểt tủa CAELYX.
CAELYX được khuyến cảo truyền thông qua cổng phụ của đường truyền tĩnh mạch dung dịch
Dextrose 5%. Việc truyền thuốc có thế thông qua một tĩnh mạch ngoại vi. Không sử dụng dây
truyền dịch có bộ lọc.
Thuốc chỉ bán theo đơn.
Đọc kỹ hướng dẫn sử dụng trước khi dùng. (DT
Nếu cẩn thêm thông tin, xỉn hỏi bác sĩ hoặc dược sĩ
Để ngoăỉ tầm tay trẻ em.
Sản xuất và đóng gói sơ cấp tại:
TTY Biopharm Company Limited Chungli F actory
838, Chung Hwa Rd., Sec. 1, Chunin Dist., Taoyuan City, 32069 Đải Loan
Đóng gói và xuất xưởng tại:
Janssen Pharmaceutica N.V.
Tumhoutseweg 30, B-2340. Beersc, Bi
Công ty đãng ký: JANSSEN-CILAG Ltd. ,Thải Lan
Mọi câu hỏilBáo cáo tảc dụng ngoại ý] Than phiền chất lượng sản phẩm xin liên hệ:
VPĐD Janssen- Cilag Ltd., TP Hồ Chí Minh.
ĐT: +84 8 38214828
E-mail: iacvndruesafetv’íìitsjni.com
Phíẻn bản: C C DS 08 Mar 2013
PI_Caelyx_IW_CCDS O8Mar20] 3_v1
Ngảy sứa đói: ] 9/05/201 6
PI_Cae/_ư_TW_CCDS oeu…con vi 24)24
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng