
















.Ýẵ/9d [bMD
ẵỄm .….Ễ88
C C. Ểiiii .….. .... ..….m .ỄỄÊỗ ..….u ẫnư.
" … …
Ơ. T . . .ỄEỄ... ...ẵ
U .E . . … .s ....…u.…uẫẵ.…a….a...u..ổưwử
D Y … ..ẵẵ. uE 8 mc.n.ẵo .o…nu. Su…
. . -/. u. .wm: …Ễmn Ễễễ o.oễ o. no.:umzũm >MẾ.DN
.
. il 1 l Ill
/ _ …ao. ạ... …z…o
/. iii\i
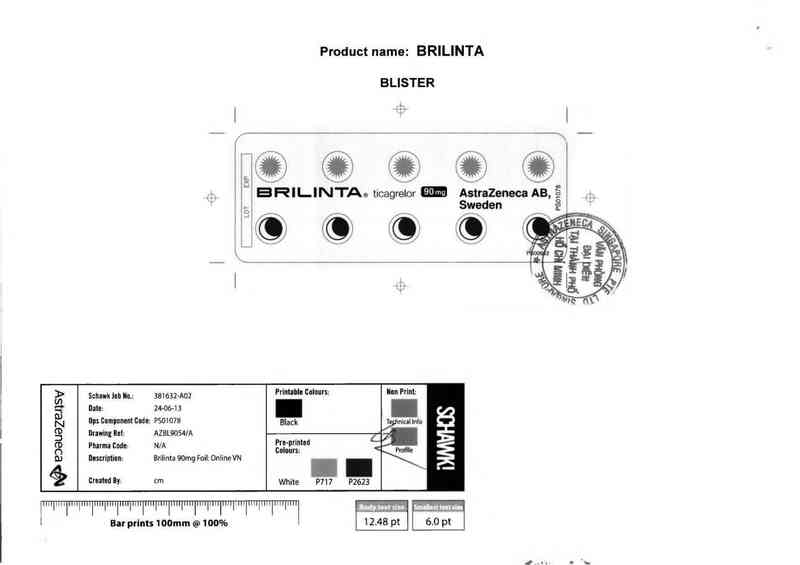
Product name: BRILINTA
BLISTER
…ằỵ_
@)
ERII-lN
\
x \ ,
… J
*
©
Ae ticagrelor AstraZeneca AB,
&
J
._\
/
l`
Sweden
P501078
J> smm luh m.: 381632-A02 Pfimb" c°'°"'s²
ẫ nata: 24-06-1 3
N Dps Bompnnent Code: P501078 Black ỷnical Info
ẵ Drawinz … AZBL9OS4/A
CD Ph _ Pre-printed
O anna Code. N/A Colours~ mme
:» Doscriptiun: Brilinta 90mg Foil: Online VN ' \
@ Cremd Bv= cm White P717 Pzezs
" |"" |""I""|""l'"|""l'"|""""|"'l"|"'l '| "|' l"ì
Ỉ Bar prints 100mm @ 100%
12.48 pt
Rx
BRILINTA 90 mg
ticagrelor
Viên nén bao phim
THÀNH PHẢN ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
Mỗi viên nẻn bao phim chứa 90 mg ticagrelor.
Danh sách đầy đủ các tá dược, xem Danh mục tả dược.
DẠNG BÀO CHẾ
Viên nén bao phim.
Viên nén mảu vảng, hai mặt lồi. hinh tròn. một mặt có khắc '90' trên 'T' vả một mặt
trơn.
CHỈ ĐỊNH ĐIỀU TRỊ
BRILINTA, dùng đồng thời với acid acetylsalicylic (ASA), được chỉ định để phòng
ngừa các biến cố huyết khối do _xơ vữa động mạch ở bệnh nhân người lớn bị Hội
Chứng Mạch Vánh cáp (đau thăt ngực không ổn định, nhồi máu cơ tim không có ST
chênh lên [non ST elevation Myocardial lnfarction - NSTEMI], hoặc nhồi máu cơ tim
có ST chênh lên [ST elevation Myocardial lnfarction - `l gồm bệnh nhân được
điều trị nội khoa, vả bệnh nhân được can thiệp mạch vần a da (percutaneous
coronary intervention - PCI) hoặc phẫu thuật bắc cầu mạch vảnh (coronary artery
by-pass grafting - CABG).
Các thông tin khác, xin tham khảo phần Đặc Tính Dược Lục Học.
LIỀU DÙNG vÀ CẢCH DÙNG
Liều dùng
Nên khởi đầu điều trị với chỉ một iiệu nạp 180 mg BRILINTA (hai viên 90 mg) và sau
đó duy trì với liều 90 mg hai Iản môi ngảy.
Bệnh nhân dùng BRILINTA cũng nên uống ASA hằng ngảy, trừ khi có chống chỉ
định cụ thể. Sau một iiều khởi đầu với ASA, nên dùng BRILINTA với liều duy trì 75-
100 mg ASA (xem phần Đặc Tính Dược Lực Học)
Khuyên cáo điêu trị lẻn đến 12 tháng trừ khi có chỉ định lâm sảng ngưng dùng
BRILINTA (xem phần Đặc Tinh Dược Lực Học). Kinh nghiệm điều trị sau 12 tháng
còn giới hạn.
Ở bệnh nhân bị Hội Chứng Mạch Vảnh cảp, việc ngừng sớm bảt kỳ liệu pháp chống
kêt tập tiêu cầu náo, kể cả BRILINTA. có thể gây tảng nguy cơ tử vong tim mạch,
hoặc nhôi mảu cơ tim do bệnh lý tiềm ần cùa bệnh nhân. Do đó, nên tránh ngưng
điêu trị sớm.
Nên tránh quên dùng thuốc khi điêu trị. Bệnh nhân quên 1 liều BRILINTA nên dùng
chỉ 1 viên 90 mg (liều kế tiếp) vảo đủng giờ thông lệ.
Bệnh nhân đã được điều trị với clopidogrel có thể chuyển thẳng sang dùng
BRILINTA nếu cần thiêt (xem phần Đặc Tính Dược Lực Học). Chuyển từ prasugrel
sang dùng BRILINTA chưa được nghiên cứu.
Cảc nhóm dân số đãc biêt
Nguớr' cao tuổi
Không cần điều chỉnh Iièu ở người cao tuổi (xem phẩn Đặc Tính Dược Động Học).
Bệnh nhân suy thận
Không cần điều chinh liều ở bệnh nhân s`uy thận (xem phần Đặc Tính Dược Động
Học). Chưa có thông tin liên quan đên điêu trị cho bệnh nhân lọc thặn nhân tạo và vì
vậy không khuyên cáo dùng BRILINTA ở những bệnh nhân nảy.
Bệnh nhán suy gan
Không cần điều chỉnh liều cho bệnh nhân suy gan nhẹ. BRILINTA chưa được
nghiên cứu trên bệnh nhản suy gan v\ừa hoặc nặng. Vi vặy chớng chỉ định ở bệnh
nhân suy gan vừa đên nặng (xem phân Ghông Chỉ Định, Lưu Y vá Thận Trọng Đặc
Biệt Khi“ Dùng vả Đặc Tính Dược Động Học).
Trẻ em
Chưa xảo định được tinh an toán vá hiệu quả cùa BRILINTA ở trẻ em dưới 1ộ tuồi
trong chỉ định đã được phê duyệt ở người lớn. Hiện chưa có dữ iiệu (xem phân Đặc
Tính Dược Lực Học vả Đặc Tính Dược Động Học).
Cảch dùng
Dùng đường uống. RILINTA có thể dùng cùng hoặc không cùng với thức ăn. Đối
với bệnh nhân không hề nuốt nguyên viên thuốc, có thề nghiền viên BRILINTA (1
viên 90 mg và 2 v 90 mg) thảnh bột mịn và phân tản trong nửa ly nước vả uõng
ngay lập tức Trả g ly bằng nửa ly nước và uống hết. Hỗn dịch củng có thế được
dùng qua ống thông dạ dáy (Ioại CH8 hay lớn hơn). Điều quan trọng lá phải tráng
ống thông dạ dảy với nước sau khi đã dùng hỗn dịch thuốc.
CHỐNG CHÍ ĐỊNH
0 Quá mẫn cảm với hoạt chắt hoặc với bắt kỳ tả dược náo được liệt kê ở mục tả
dược (xem phần Phản ứng không mong muốn).
o Đang bị chảy máu do bệnh lý.
o Tiên sử bị chảy mảu trong sợ (xem phần Phản Ứng Khỏng Mong Muốn).
o Suy gan vừa đến nặng (xem phần Liều dùng và cách dùng, Lưu Ý vả Thận
Trọng Đặc Biệt Khi Dùng vả Đặc Tính Dược Động Học).
o Chống chỉ định dùng đồng thới ticagrelor vởi chất ức chế manh CYP3A4 (như
ketoconazol clarithromycin nefazodon ritonavir vá atazanavir) vì dùng đồng
thới có thể dẫn đền lâm tăng đáng kể mức độ tiêp xúc với ticagrelọr (xem
phần Lưu Ý vá Thận Trọng Đặc Biệt Khi Dùng vá Tượng Tác Thuốc vả Các
Dạng Tương Tảo Khác).
LƯU Ý VÀ THẬN TRỌNG ĐẶC BIỆT KHI DÙNG
Nquv cơ chảv máu
Trong thử nghiệm chủ chốt pha III (PLATO - [PLATelet Inhibition and Patient
Outcomes]: ức chế tiếu cầu và kềt cục lâm sảng được thực hiện trẻn 18.624 bệnh
nhân) tiêu chỉ loại trừ chính gồm có một nguy cơ bị chảy máu gia tăng, thiếu máu
hoặc giảm tiễu cầu cóý nghĩa lâm sảng. chảy mảu năo trưởc đó, chảy mảu đường
tiêu hóa trong vòng 6 tháng vừa qua hoặc đại phẫu thuật trong vòng 30 ngảy qua.
Trên nhóm bệnh nhân bị Hội Chứng Mạch Vảnh Cầp được điều trị với BRILINTA vả
A\SA cho thắy tăng nguy cơ chảy mảu nặng trên phân nhóm không phẫu thuật bắc
câu mạch vảnh vả cũng bị chảy máu thường hơn cần đên chăm sóc y khoa ví dụ ở
nhóm có chảy máu nhẹ và nặng trong nghiên cứu PLATO, nhưng không phải chảy
máư gây tử vong hoặc đe dọa mạng sống (xem phần Phản Ứng Không Mong
Muôn).
Vì vậy, nên cân bằng việc sử dụng BRILINTA ở bệnh nhân đã biêt bị tăng nguy cơ 4
chảy máu với lợi ich phòng ngừa các biến cổ do huyềt khối do xơ vữa động mạch. `“
Nếu được chỉ định trên lâm sảng, nên lưu ý Khi dùng BRILINTA ở những nhóm bệnh
nhân sau đây:
o Bệnh nhân có xu hướng bị chảy máu (ví dụ do chần thương gần đây, phẫu
thuật gần đây, rối loạn đông máu, đang hoặc vừa bị chảy máu đường tiêu hóa). ,
BRILINTA chống chỉ định ở bệnh nhản đang bị chảy máu do bệnh lý, có tiền sử `
chảy mảu trong sọ, và bệnh nhân suy gan vừa đền nặng (xem phần Chổng Chỉ
Định).
0 Bệnh nhân dùng chung cảc thuốc Iảm tăng nguy cơ chảy máu (như thụốc
kháng viêm không steroid (NSAIDS), thuôo chống đông máu đướng uông
vảlhoặc cảc thuốc tiêu sợi huyêt) trong vòng 24 giờ trước khi dùng BRILINTA.
Chưa có dữ liệu về BRILINTA liên quan tới lợi ich cầm máu khi truyền tiẻJcầu; sư
tưần hoản BRILINTA trong máu có thề ức chẻ cảc tiểu cầu được tr 0. Vì dùng
đòng thời BRILINTA với desmopressin không lảm giảm thời gian chẮ áu,
desmopressin rât có thệ không ảnh hưởng đên kiếm soát các biên cổ`do chảy mảu
trên lâm sảng (xem phân Tương Tác Thuôo vè Các Dạng Tương Tác Khác).
Điêu trị bằng thuốc chống tiêu sợi huyêt (acid aminocaproic hoặc acid tranexamic)
vảlhoặc yêu tô tái tổ hợp Vlla có thể giúp táng cầm máu. Sau khi xảo định vả kiểm
soát được nguyên nhân gây chảy mảu có thể dùng lại BRILINTA.
Phẫu thuât
Nèn khuyên bệnh nhân thông báo cho bác sĩ vả_nha sĩ biết rằng họ đang dùng
BRiLINTA trước khi ấn định bât kỳ một cuộc phâu thuật hoặc trước khi uống bất kỳ
thuôc mới nảo.
! n Ừhd-th
Trong nghiên cứu PLATO trên phân nhóm bệnh nhân phẫu thuật bắc cầu mạch
vảnh (CABG), BRILINTA gãy chảy máu nhiều hơn clopidogrel khi ngưng điều trị 1
ngảy trước khi phẫu thuật nhưng có cùng tỷ lệ gây chảy máu nặng so với
clopidogrel sau khi ngưng thuốc trên 2 ngảy trước khi phẫu thuật (xem phần Phản
Ứng Khóng Mong Muốn). Nếu một bệnh nhân sắp trải qua cuộc phẫu thuật không
cấp thiết vả khỏng muốn ảnh hưởng của chốngkết tập tiều cầu, nèn ngưng dùng
BRILINTA 7 ngảy trước khi phâu thuật (xem phân Đặc Tính Dược Lực Học).
Bènh nhân có nđuv cơ bi các biến cố nhin tim châm
Dựa vảo quan sát mô tả hầu hêt các trường hợp ngưng thắt không triệu chưng trong
một nghiên cứu lảm sảng trước đây. những bệnh nhân có nguy cơ cao bị biên có
chậm nhịp tim (như bệnh nhân bị hội chứng suy nút xoang không được đặt máy tạo
nhịp. blồc nhĩ thắt độ 2 hoặc 3 hoặc bị ngắt liẻn quan đến nhịp tim chặm) đă được
loại trừ khỏi nghiên cữu PLATO khi đánh giá tinh an toản vả hiệu quả của
BRILINTA. Do đó, vi kinh nghiệm lâm sảng hạn chế, nên thận trọng khi dùng
BRILINTA cho những bệnh nhân nảy (xem phần Đặc Tính Dược Lực Học).
Thêm vảo đó, nên thận trọng khi dùng BRILINTA chung với cảc thuốc lảm chậm
nhịp tim. Tuy nhiên không có bằng chứng ghi nhặn các phản ứng ngoại ý đáng kể
trên iâm sảng trong thử nghiệm PLATO sau khi dùng chung với một hoặc nhiêu
thuốc Iảm chậm nhịp tim (ví dụ, 96% ca dùng chẹn bêta. 33% ca dùng thuốc chẹn
kênh calci diltiazem vả verapamil, và 4% ca dùng digoxin) (xem phần Tương Tác
Thuốc và Các Dạng Tuợng Tác Khác).
Suốt quá trình nghiên cữu trên phân nhóm bệnh nhân chạy Holter trong thử nghiệm
PLATO, có nhiêu bệnh nhân ngưng thắt trên 3 giây với ticagrelor hơn so với
clopidogrel trong giai đoạn cẩp cùa Hội chứng mạch vảnh cắp Sự gia tăng số ca
ngưng thắt xảo định bằng Holter khi dùng ticagrelor cao hơn ở nhóm bệnh nhân suy
tim sung huyết so với tổng dân số nghiên cứu trong giai đoạn cầp của Hội chứng
mạch vảnh cắp, mã không xảy ra trên nhóm dùng ticagrelor trong một tháng hoặc
khi so sánh với clopidogrel. Không có hậu quả lâm sảng ngoại ý náo liên quan đến
sự mắt cân bằng nảy (bao gộm ngẩt hoặc đặt máy tạo nhịp) trong dân số bệnh nhân
nảy (xem phần Đặc Tính Dược Lực Học)
K_hó thở
Có 13 8% bệnh nhân dùng BRILINTA ghi nhận bị khó thở so với 7 8% bệnh nhân
dùng clopidogrel. Trong 2 % bệnh nhán các nhả nghiên cứu đã cân nhắc thắy khó
thờ có liên quan đến việc d \ng BRILINTA. Triệu chứng nảy thông thường ở mức độ
từ nhẹ đên vừa và tư hồi phuc mã không cần ngưng điêu trị. Bệnh nhân hen
suyễnlCOPD tăng ngmGỀ~tồ khó thở khi dùng BRILINTA (xem phần Phán Ứng
Không Mong Muốn). Phần+ìận trọng khi dùng ticagrelor cho bệnh nhân có tiền sử bị
hen suyên vảlhoặc COPD Cơ chế chưa được rõ. Nêu bệnh nhân báo cáo bị cơn
khó thở mới, kéo dải hoặc nặng lên, phải theo dõi kỷ vả nêu không chịu đựng được
nữa, phải ngưng dùng BRILINTA.
Tảnu Creatinin
Nồng độ Creatinin có thể tăng khi điều trị với BRILINTA (xem phần Phản Ứng Không
Mong Muốn). Cơ chế chưa được rõ. Nên kiểm tra chức năng thận sau một tháng và
sau đó cản cứ váo thực tế điều trị hảng ngảy, lưu ý đặc biệt đẻn bệnh nhân 2 75
tuổi bệnh nhân suy thận vừalnặng vả những bệnh nhân đang điều trị đồng thới với
một thuốc chẹn thụ thể angiotensin.
Tăng acid uric
Trong nghiên cừu PLATO, bệnh nhân dùng ticagrelor có nguy cơ tảng acid uric
huyết cao hơn bệnh nhân dùng clopidogrel (xem phần Phản Ứng Không Mong
Muốn). Thận trọng khi dùng ticagrelor cho bệnh nhản có tiền sử tảng acid uric huyêt
hoặc bệnh gout. Đế để phòng, không nên sử dụng ticagrelor cho bệnh nhân bị bệnh
thận do acid uric.
Khác
Dựa trên mối liên hệ quan sát được trong nghiên cứu PLATO giữa liẻu duy trì ASA
vá hiệu quả tương ứng cùa ticagrelor so sánh với clopidogrel, khuyên các không
dùng đồng thới BRILINTA với liều duy tri cao ASA (>300 mg) (xem phần Đặc Tính
Duợc Lực Học).
Chống chỉ định dùng đồng thời BRILINTA vởi các chât ức chế mạnh CYP3A4 (ví dụ,
ketoconazol, clarithromycin, nefazodon, ritonavir vả atazanavir) (xem phần Chổng
Chi“ Định và Tuợng Tác Thuốc và Các Dạng Tương Tác Khác). Dùng đồng thời có
thế lảm tặng đáng kể nồng độ và thời gian tiếp xúc với BRILINTA (xem phần Tương
Tác Thuốc vả Các Dạng Tương Tảc Khác).
Không nên dùng đồng thời ticagrelor với các chât cảm ứng mạnh CYP3A4 (như
rifampicin, dexamethason, phenytoin carbamazepin vả phenobarbital), vì dùng đồng
thời có thể lảm giảm mức độ tiếp xúc vá hiệu quả của ticagrelor (xem phần Tương
Tác Thuốc và Các Dạng Tương Tác Khác).
Không khuyến cáo dùng chung BRILINTA và các cơ chất enzym CYP3A4 có chỉ số
trị liệu hẹp (như cisaprid vả các alkaloid cưa lúa mạch), vỉ ticagrelor có thề Iám tăng
mức độ tiếp xúc với những thuốc nảy (xem phần Tương Tác Thuốc vả Các Dạng
Tương Tác Khác). Không khuyến Cảo dùng đồng thời BRILINTA với simvastatin
hoặc Iovastatin Iièu cao hơn 40mg (xem phần Tương Tảo Thuốc vả Các Dạng
Tương Tác Khác).
Khuyến cáo nên theo dõi chặt chẽ lâm sảng và cận lâm sảng khi dùng digoxin chung
với BRILINTA (xem phần Tương Tác Thuốc và Các Dạng Tuơng Tác Khác).
Không có đủ dữ liệu chứng tỏ dùng chung BRILINTA với vẹrapamil vả quinidin các
chắt ức chế P-glycoprotein (P- -gp) mạnh và các chắt ức chế CYP3A4 trung bỉnh có
thể gây tăng mức độ tiềp xúc với ticagrelor. Nếu không tránh khỏi việc kết hợp, thận
trọng khi dùng chung (xem phần Tương Tác Thuốc và Các Dạng Tương Tác Khác).
Ngừnđ sử dung thuốc BRILINTA
Tránh đột ngột ngừng sử dụng thuốc BRILINTA. Nếu phải tam thờẾ ngưng thuốc
BRILINTA (ví dụ như để điều trị xuắt huyết hoặc phẫu thuã'txửgg câp thiết) thì sau
đó tải sữ dụng thuốc cảng nhanh cảng tốt Ngừng dùng thuê NLINTA sẽ lảm
tăng nguy cơ nhồi máu cơ tim, huyết khối ở ông stent, và tử vong.
TươNG TÁC THUỐC VÀ cÁc DANG TươNG TÁC KHÁC
Ticagreior cơ bản là một cơ chất của enzym CYP3A4 vả ức chế yếu CYP3A4.
Ticagreior cũng lả một cơ chất cùa P- g-lycoprotein (P- gp) vá ức chế yêu P- -gp vá có
thế gảy tăng nồng độ vả thời gian tiếp xúc các cơ chất P-gp
Ành hưởng cùa cảc thuốc khác đẻn BRILINTA
Các thuốc chuyền hóa qua enzym CYP3A4
Các chẩt ức chế CYP3A4
c Các chắt ức chế mạnh CYP3A4 - Dùng đồng thời ketoconazol với ticagrelor
Iảm tảng 2,4 lần Cmax vả 7,3 lần AUC của ticagrelor. Lâm giảm 89% C,… vả
56% AUC của chắt chuyển hóa có hoạt tính Các chắt ức chế mạnh CYP3A4
khảo (clarithromycin, nefazodon, ritonavir vả atazanavir) cũng có tảo động
tương tư và chống chỉ định dùng đồng thời với BRILINTA (xem phần Chống chỉ
đình, Lưu Ý vả Thận Trọng Đặc Biệt Khi Dùng).
«- Các chât ức chế vừa CYP3A4— Dùng đổng thời diltiazem với ticagrelor lảm
tăng 69% Cmax và 2, 7 lần AUC của ticagrelor, lảm giảm 38% C…… vá không đối
AUC của chầt chuyền hóa có hoạt tinh. Ticagrelor không ảnh hưởng đến nồng
độ diltiazem trong máu. Các chất ức chế vừa CYP3A4 khác (vi dụ, amprenavir,
T - f' IÌIA
li!
aprepitant, erythromycin vả fluconazol) củng dự kiến có tác động tương tư vả
được dùng đông thời với BRILINTA.
Các chẩt cảm ửng CYP3A
Dùng đồng thời rifampicin với ticagrelor Iảm giảm 73% Cmaxvả 86% AUC của
ticagrelor. Khỏng đổi Cmax và giảm 46% AUC của chắt chuyển hóa có hoạt tính. Các
chắt cảm ứng CYP3A khảo (ví dụ, dexamethason, phenytoin, carbamazepin vả
phenobarbital) cũng lảm giảm nống độ vả thời gian tiếp xúc với BRILINTA. Dùng
đồng thời ticagrelor với chầt cảm ứng CYP3A mạnh có thể Iám giảm mức tỉếp xúc
vả hiệu quả cùa ticagrelor (xem phần Lưu Ý vá Thận Trọng Đặc Biệt Khi“ Dùng).
Cyclospon'n (chất ửc chế P-gp vả CYP3A)
Dùng đồng thời cyclosporin (600 mg) với ticagrelor lảm tăng nồng độ tối đa của
ticagrelor (C……) gắp 2,3 lần và diện tích dưới đướng cong (AUC) gắp 2,8 lần. Chắt
chuyến hòa có hoạt tinh tăng 32% diện tich dưới đường cong (AUC) vả giảm 15%
nồng độ tối đa khi có sự hiện diện của cyclosporin.
Chưa có dữ liệu về việc sử dụng đồng thời BRiLINTA với cảc thuốc khác có tảo
dụng ức chế P-glycoprotein (P-gp) mạnh vả ức chế CYP3A4 trung binh (như
verapamil, quinidin), cũng có thế gảy tăng nồng độ và thời gian tiếp xức của
ticagrelor. Nếu không thể tránh dùng chung với các thuốc nảy, cần thận trọng khi
dùng (xem phần Lưu ý vả thận trọng đặc biệt khi dùng).
Những chẩt khác
Các nghiên cứu tương tằc dược lý trên lâm sảng chứng minh dùng đồng thời
ticagrelor với heparin, enoxaparin vả ASA hoặc desmopressin không ảnh hưởng
đến dược động học cùa ti grelor hoặc chắt chuyên hóa có hoạt tinh hoặc sự kết
tập tiểu cầu kich thĩc \' ' 4 P so với ticagrelor riêng lẻ. Nêu có chỉ định lâm sảng,
thận trọng khi kết hợ c huốc lảm biến đổi quá trinh đông máu với BRILINTA
(xem phần Lưu Ý vả Thận Trọng Đặc Biệt Khi Dùng).
Đã có ghi nhận nồng độ ticagrelor tăng gắp 2 iần sau khi tiêu thụ một tượng lớn
nước ép bưởi hâng ngảy (3 x 200 m|). Mức độ nghiêmtrọng của sự gia tăng nồng
độ nây được cho iả không liên quan trên iâm sâng ở hâu hệt bệnh nhân.
Ánh hưởng cùa BRILINTA đên các thuốc khác
Thuốc chuyển hóa bởi enzym CYP3A4
o Simvastatin - Dùng đồng thời ticagrelor với simvastatin Iảm tăng 81% C,…)( vả
56% AUC của simvastatin, lám tăng 64% C…ax vả 52% AUC của acid
simvastatin ở một vải cả thể có thể tăng lên 2 đên 3 lần. Dùng đồng thời
ticagrelor với liệu simvastatin vượt quá 40 mg mỗi ngảy có thể gây ra các phản
ưng ngoại y của simvastatin vả cân cân nhắc với lợi ích tiềm nảng. Simvastatin
không ánh hướng đến nồng độ ticagrelor trong huyết tương. BRILINTA cũng
có tảo động tương tự đối Vởi Iovastatin. Không khuyến cáo dùng chung
BRILINTA với simvastatin vả lovastatin liều cao hơn 40 mg (xem phần Lưu Ý
vá Thận Trọng Đậc Bíệt Khí Dùng).
o Atorvastatin - Dùng đồng thời atowastatin vả ticagrelor Iảm tảng 23% Cmax và
36% AUC của acid atorvastatin. Các mức tăng AUC vả Cmax tương tự cũng ghi
nhận được ở tất cả cảc chất chuyển hóa acid atorvastatin. Sự gia tăng náy
khộng có ý nghĩa lâm sảng.
o Không loại trừ ảnh hưởng tương tư của BRILINTA đến những statin khảo cùng
chuyến hóa qua enzym CYP3A4. Bệnh nhân trong nghiên cứu PLATO dùng
nhiều Ioại statin khác nhau, nhưng không có quan ngại về tính an toản của
statin trên 93% cả thể dùng những thuốc nảy.
Tioagrelor là một chắt ức chế nhẹ CYP3A4. Không khuyến cảo dùng đồng thời
BRILINTA vả các cơ chắt CYP3A4 có chỉ số trị liệu hẹp (như lá cisaprid và các
alkaioid cưa lúa mạch) vi ticagrelor có thể gây tăng mức tiếp xúc với những thuốc
nảy (xem phần Lưu Ý và Thận Trọng Đặc Bíệt Khí Dủng).
Các thuốc chuyển hóa qua enzym CYP2C9
Dùng đồng thời BRILINTA với tolbutamid không lảm thay đối nồng độ cả 2 thuốc
trong huyết tương, cho thấy ticagrelor không phải là chắt ức chế CYPZC9 vả rất có
thể không lảm thay đồi sự chuyển hóa của các thuốc qua enzym CYP2C9 như
warfarin vả tolbutamid.
Thuốc viên uổng ngửa thai
Dùng đồng thời BRILINTA vả Ievonorgrestrel vả ethinyl estradiol Iám tảng khoảng
20% mức tiếp xúc của ethinyl estradiol nhưng không lảm thay đối dược động học
oùa levonorgrestrel. Trên lâm sảng, không ảnh hưởng hiệu quả cùa thuốc viên uống
ngữa thai khi dùng đồng thời levonorgrestrel vả ethinyl estradiol với BRILINTA.
Các cơ chắt của P-glycoprotein (P-gp) (bao gồm digoxin, cyclosporin)
Dùng đồng thời với BRILINTA lám tăng 75% Cmax và 28% AUC của digoxin. Nồng
độ đáy trung binh của digoxin tăng 30% khi dùng chung với ticagrelor, ở vải cá thể
có thể tăng tối đa lện gắp đôi. Sự có mặt digoxin không lảm ảnh hướng đến cmax vả
AUC của ticagrelor vả các chắt chuyến hóa có hoạt tính. Do đó, khuyến ổáo nên
theo dõi kỹ lâm sảng vảlhoặc cản lâm sảng khi dùng đồng thời BR! N A với các
thuốc có cửa sổ trị liệu hẹp phụ thuộc P-gp như digoxin (xem ph` yẫẩể Ý vá Thận
Trọng Đặc Biệt Khi Dùng). Ticagrelor không ảnh hướng nồng độ c porin trong
mảu. Tác động của ticagrelor trên cảc cơ chât của P-gp chưa được nghiên cứu.
Các liệu phảp phối hợp thuốc khác
Các thuốc gây nhịp tim chậm
Do có ghi nhận các trường hợp ngưng thầt hầu như không triệu chứng và nhịp tim
chậm, nên thận trọng khi dùng đồng thời BRILINTA với thuốc gây nhịp tim chậm
(xem phần Lưu Ý vả Thận Trọng Đặc Biệt Khi Dùng). Tuy nhiên không có bằng
chứng vẽ các phản ứng ngoại ỷ đáng kể trèn lăm sảng được ghi nhận trong nghiên
cứu PLATO sau khi dùng đồng thời với một hoặc nhiều thuốc gây nhịp tim chậm (ví
dụ, 96% ca dùng chẹn beta, 33% ca dùng chẹn kênh calci diltiazem vả verapamil vả
4% ca dùng digoxin).
Trong nghiên cứu PLATO, BRILINTA thường được phối hợp với ASA, thuốc ức chế
bơm proton, statin, chẹn bêta, thuốc ức chế enzym chuyến angiotensin và thuốc ức
ohế thụ thể angiotensin khi cần dùng chung dải hạn vả cũng được phối hợp với
heparin Iheparin trọng lượng phân tử thắp vả ohất ức chế Gpllb/llla tiêm tĩnh mạch
dùng ngăn hạn (xem phần Đặc Tính Dược Lục Hoc). Không quan sát thấy bằng
chứng về cảc tương tác bắt lợi đảng kế trên lâm sảng với những thuốc nảy.
Dùng đồng thời BRILINTA với heparin. enoxaparin hoặc desmopressin khõng ánh
hướng đến thời gian kich hoạt thromboplastin bán phần (activated partial
thromboplastin time- aPTT), thời gian kích hoạt đông máu (activated coagulation
time- ACT) hoặc phép phân tích yệu tố Xa. Tuy nhiên, do các tựơng tảo dược lực
có thể xảy ra, nên thận trọng khi kềt hợp BRILINTA với các thuốc biến đỗi sự đông
mảu (xem phần Lưu Ý vả Thận Trọng Đặc Biệt Khi Dùng).
Đã có báo cáo các trường hợp chảy máu trong da bất thường với các thuốc tái hắp
thu chọn lọc serotonin (SSRI) (vi dụ, paroxetin, sertralin vá citalopram), nên thận
trọng khi dùng SSRI với BRILINTA do có thể gây tăng nguy cơ chảy máu.
KHẢ NĂNG SINH SÀN, có THAI VÀ CHO CON BÚ
Phu nữ có thể có thai
Phụ nữ có thế có thai nên dùng cảc biện phảp trảnh thai thich hợp suốt thời gian
dùng BRILINTA.
Phu nữ có thai
Chưa có hoặc còn giới hạn dữ liệu về việc dùng ticagrelor cho phụ nữ có thai.
Những nghiên cưu trên sủc vặt đã chứng tỏ thuốc có độc tính trên hệ sinh sản (xem
phần Dữ Líệu An Toản Tiền Lám Sáng). Khuyến cáo không dùng BRILINTA khi
đang mang thai.
Phu nữ cho con bú
Các dữ liệu về độc tính] dược lực học trện súc vặt cho thắy ticagrelor và các chắt
chuyển hóa có hoạt tính được bải tỉêt qua sữa (xem phần Dữ Liệu An Toán Tiền
Lám Sèng). Không Ioại trừ nguy oơ đối với trẻ sơ sinhlnhủ nhi Cần quyệt định liệu
có nên ngưng cho con bú hoặc ngưngltránh dùng BRILINTA khi cản nhắc kỳ giữa
lợi ích cho con bú vả lợi | h khi điều trị cho bả mẹ.
Khả năng sinh sản
Ticagrelor khôngảỄẤjj g đến khá nặng sinh sản ở giống đực hoặc giống cái trên
sủc vật (xem phârt”Dữ Liệu An Toản Tiẻn Lám Sâng).
ÀNH HƯỞNG TRÊN KHẢ NĂNG LÁI XE vÀ VẬN HÀNH MÁY
Chưa có nghiên cứu về ảnh hướng cùa BRILINTA trện khả nảng lái xe vả vận hảnh
máy. Dự kiến BRILINTA không có hoặc ảnh hướng không đảng kế trên khả năng lải
xe và vận hảnh mảy. Đã có báo cáo chóng mặt trong quá trình điều trị hội chứng
bệnh mạch vánh cắp. Vì thế, bệnh nhản đã từng bị chóng mặt nên cẩn thận khi lái
xe hay ván hảnh mảy móc.
PHẢN ỨNG KHÓNG MONG MUÔN
Tóm tắt sơ Iươc độ an toản
Độ an toản của BRILINTA trên bệnh nhân có hội chứng mạch vánh cấp (đau thắt
ngực khỏng ốn định, nhồi máu cơ tim không ST chênh lên vá nhồi máu cơ tim ST
chệnh lên) được đánh giá trong thử nghiệm chủ chốt pha III PLATO (nghiên cứu ức
chế tiếu cầu vả kêt cuc lâm sảng được thực hiện trên 18.624 bệnh nhân |PLATelet
Inhibition and Patient Outcomesl), so sánh bệnh nhân điêu trị Với BRILINTA (liều
nạp 180 mg BRILINTA vả một iiều duy trì 90 mg hai lần một ngáy) với bệnh nhân
dùng clopidogrel (liều nạp 300- 600 mg theo sau liều duy trì 75 mg mỗi ngảy) cả hai
nhóm điều trị kết hợp chung với acid acetylsalicylic (ASA) vả oảo phương pháp điêu
tri chuẩn.
Phản ứng ngoại ýthường gặp nhắt trên bệnh nhân dùng ticagrelor lả khó thờ, bầm
da, chảy máu cam vả những phản ứng nảy xảy ra với tỷ lệ cao hơn nhóm điêu trị
clopidogrel.
Bảng tóm tắt các ohân ứng nooai v
Các phản ứng ngoại ý sau đây được ghi nhận trong các nghiên cứu hoặc được bảo
các trong quả trinh lưu hảnh thuốc BRILINTA (Bảng 1).
Các phản ứng ngoại y được phân loại theo tằn suất vả hệ cơ quan. Cảo Ioại tần suất
được xảo định theo quy ước như sau: Rắt thường gặp (21110), Thường gặp
(z…oo đến <1/10), it gặp (21/1000 đến <1/100), Hiếm gặp
(.>.1110.000 đến <1/1.000), Rắt hiếm gặp (<1/10000), Chưa biết (chưa xảo định
được từ những dữ iiệu hiện có).
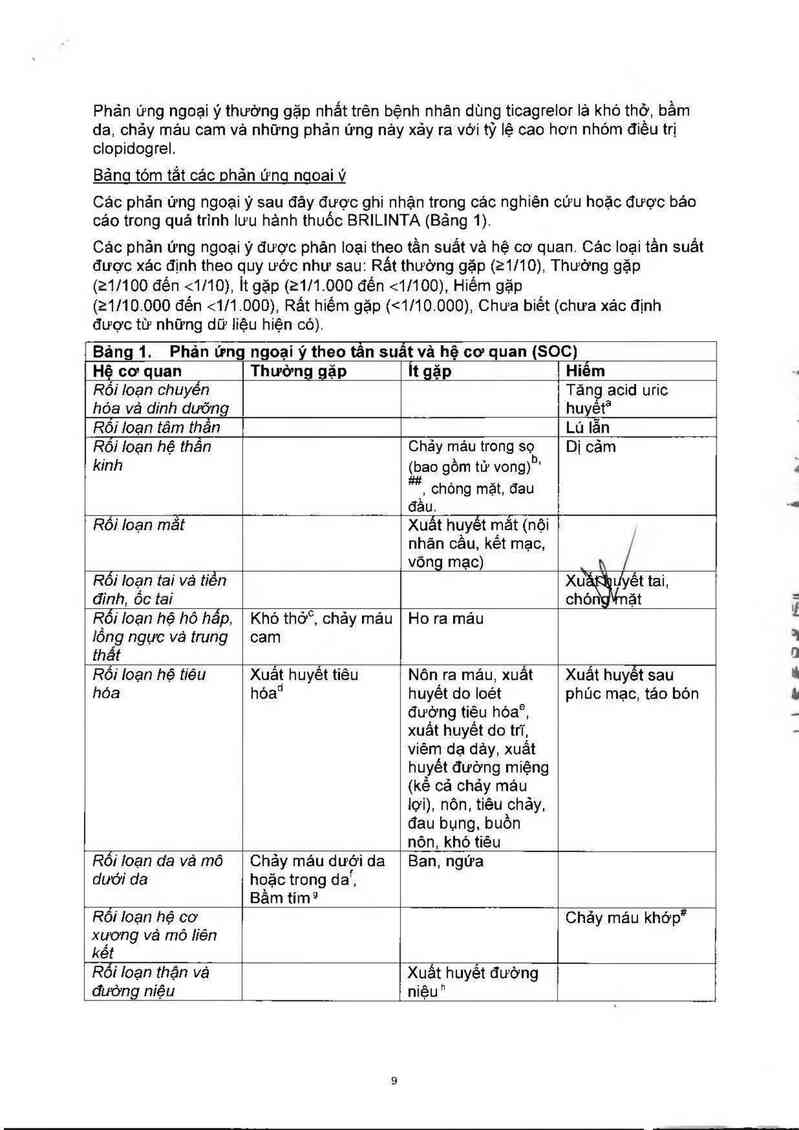
Bảng 1. Phản ứng ngoại ý theo tần suất và hệ cơ quan (SOC) ,
Hệ cơ quan Thường gặp 'lt gặp Hiêm
Rối Ioạn chuyển Tăng acid uric
hóa Vả dinh dưỡng huyếta
Rối loan tâm thần Lủ lẫn
Rối loạn hệ thần Chảy máu trong sọ Di cảm
kinh
(bao gồm từ vong)b’
# . -
`, chong mạt, đau
đâu.
Rối loạn mắt
Xuất hụyết mẩt (nội
nhản câu, kẻt mạc,
võng mạc) _ (\
Rối loạn tai và tiển Xu ' Lfyết tai,
đinh, ổc tai chón ặt
Rối“ loạn hệ hô hầp, Khó thớ°, chảy mảu Ho ra mảu
iồng ngực vả trung
thất
cam
Rối“ loạn hệ tiêu
hóa
Xuẩt huyết tiêu
hớad
Nôn ra mảu, xuất
huyết do Ioét
đường tiêu hóae,
xuất huyết do trĩ,
việm dạ dảy, xuất
huyêt đường miệng
(kể cả chảy máu
iợi), nôn. tiêu chảy.
đau bụng, buồn
Xuất huyêt sau
phúc mạc, táo bón
nộn, khó tiệu
Rối loạn da vá mô Chảy mảu dưới da Ban, ngứa
dưới da hoặc trong daf,
Bầm tỉm °
Rối loạn hệ cơ Chảy máu khớp'ẫe
xương và mỏ fién
kểt
Rối loạn thận vả Xuất huyết đường
đường m'ệu niệu "
iE'IDJ
Báng 1. Phản ứng_ngoại ý theo tần suất và hệ cơ quan (SOC)
Hệ cơ quan Thường_gặp it gặp Hiếm
Rối“ loạn hệ sinh Chảy máu âm đạo
sản vè vú (kể cả xuất huyềt
trong tử cung ngoại
chu kỳ)
Thông số xét
nghiệm cận lâm
sảng
Tăng creatinine
máu
Chân thuơng, ngộ
độc vả các biển
chứng sau khi i'èm
thủ thuật
Xuất huyết tại vị trí
lảm thủ thuậtỉ
Xuất huyết sau thủ
thuật, xuất huyết
Chảy mảu vết
thương, chảy mảu
vùng chắn thương
Rối ioạn hệ miễn
dịch
Quả mẫn cảm bao
A \
gom phu mạch
Các thuật ngữ về phản ứng ngoại ý được xếp nhóm trong bảng vả bao gồm cả oảo thuật
ngữ được mô tả bên dưới:
a
0
Tăng acid uric huyết
Chảy máu năo, ohảy máu trong sọ, đột quỵ xuất huyết,
° Khóthở, khóthở iúc gắng sức. khỏthở lúc nghỉ, khóthở về đẽm
“ Xuấthuyếttièu hóa, xuầt huyết trựctrảng, xuất huyềtđường ruột, tiêu phân đen, xuất
huyết nội tạrtg
° Xuất huyet Io`ét tiêu hóa, Xuất huyết loét dạ dảy, Xuất huyết ioét tá trảng, Xuắt huyết
loét hệ thỏng 'êu hóa
f Tụ mảuẵằđưt, xuất huyết da, chảy máu dưới da, đốm xuất huyết
° Giập, …
h Tiểu ra mảu, mảu trong nước tiều, xuất huyết đường niệu
áu bầm, tăng nguy cơ bị bầm tím, tụ máu chấn thương
' Xuất huyết vùng tiêm mạch máu, tụ máu vùng tiêm mạch, xuất huyết vùng tiêm, xuất
huyết vùng đặt ống thõng
” Không có bảo oảo vế oác phản ứng ngoại ý do thuốc liên quan đến chảy máu khớp trên
nhánh dùng ticagrelor (n= 9235) trong nghiên cứu PLATO, tần suất tinh theo giới hạn
trên của 95% khoảng tin cậy đối với điểm ước lượng (tính bằng 3i'X, với )( đại diện cho
tổng cỡ mẫu, ví dụ: 9235). Tính bằng 3l9235 tương ứng phân loại tần suất lá 'hiẻm'.
““ Các trường hợp chảy máu trong sọ dẫn đến từ vong đã được bảo các trong quá trinh
lưu hảnh thuốc
Mô tả các phản ứng nqoai ỷ chon loc
Chảy máu
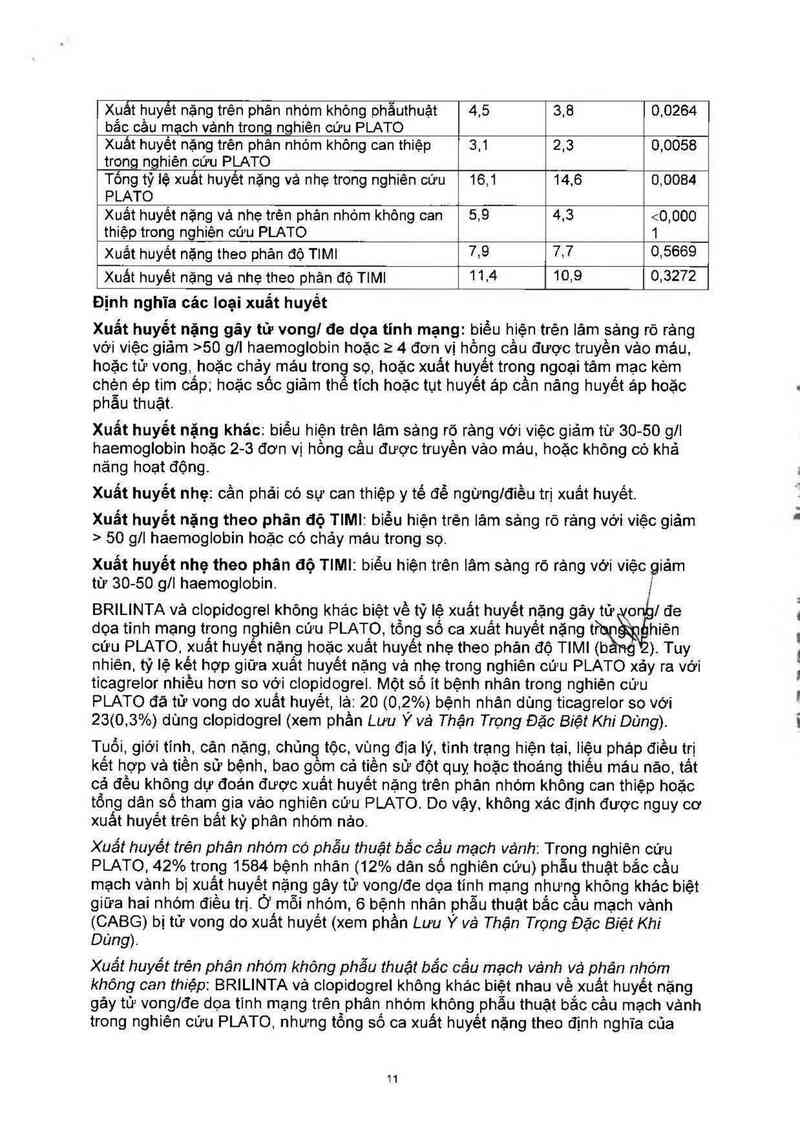
Tỗng quan về tỷ lệ xuất huyết trong nghiên cứu PLATO được trinh bảy trong bảng 2.
Bảng 2 — Bảng ước tính Kaplan-Meier về tỷ lệ xuất huyết trong điều trị
BRILINTA Clopidogrel
(%!năm) (%!năm) P
N=9235 N=9186
Tống tỷ iê xuất huyết nặng trong nghiên cứu PLATO 11,6 11,2 0,4336
Xuảt huyết nặng gảy tử vonglđe dọa tĩnh mạng 5,8 5,8 0.6988
trong nghiên cứu PLATO
10
Xuất huyết nặng trên phân nhớm khỏng phẫuthuật 4,5 3,8 0,0264
bắc cằu mạch vánh trong nghiên oứu PLATO
Xuắt huyềt nặng trên phân nhóm không can thiệp 3,1 2,3 0,0058
trong nghiên cứu PLATO
Tống tỷ lệ xuất huyết nặng vả nhẹ trong nghiên cứu 16,1 14,6 o,oos4
PLATO
Xuắt huyết nặng vá nhẹ trện phân nhóm khõng oan 5,9 4,3 <0,000
thiệp trong nghiên cứu PLATO 1
Xuất huyết nặng theo phản độ TIMI 7.9 7.7 0,5669
Xuất huyết nặng vá nhẹ theo phân độ TIMI 11.4 10.9 033272
Định nghĩa cảc Ioại xuất huyết
Xuất huyết nặng gây tử vong/ đe dọa tỉnh mạng: biểu hiện trện lâm sảng rõ rảng
với việc giảm >50 gll haemoglobin hoặc E 4 đơn vị hồng cầu được truyền vảo mảu,
hoặc tử vong, hoặc chảy mảu trong sọ, hoặc xuât huyết trong ngoại tâm mạc kèm
chèn ép tim cắp; hoặc sốc giảm thể tĩch hoặc tụt huyết áp cần nâng huyềt áp hoặc
phẫu thuật
Xuất huyết nặng khác: biểu hiện trện lâm sảng rõ rảng Với việc giảm từ 30- 50 gll
haemoglobin hoặc 2- 3 đơn vị hồng cầu được truyền vảo mảu, hoặc không có khả
năng hoạt động.
Xuất huyết nhẹ: cần phải có sự can thiệp y tế để ngững/điều trị xuất huyết.
Xuất huyết nặng theo phân độ TIMI: biểu hiện trên lâm sảng rõ rảng với việc giảm
> 50 g/l haemogiobin hoặc có chảy mảu trong sọ.
Xuất huyết nhẹ theo phân độ TIMI: biểu hiện trên lâm sảng rõ rảng với việc giảm
từ 30-50 gll haemoglobin
BRILINTA vả clopidogrel không khác biệt về tỷ lệ xuất huyêt nặng gảy từ o Ílđe
dọa tỉnh mạng trong nghiên cứu PLATO, tỗng số ca xuất huyết nặngr tỀpg hiên
oứu PLATO xuất huyết nặng hoặc xuất huyết nhẹ theo phân độ TIMI (b ) Tuy
nhiên. tỷ lệ kêt hợp giữa xuất huyêt nặng vả nhẹ trong nghiên cứu PLATO xảy ra với
ticagrelor nhiều hơn so với ciopidogrel Một số it bệnh nhân trong nghiện cứu
PLATO đã tử vong do xuất huyết, iả: 200 (0 ,2%) bệnh nhân dùng ticagrelor so với
23(0, 3%) dùng clopidogrel (xem phần Lưu Ý vè Thận Trọng Đặc Biệt Khi Dung).
Tuổi, giới tinh, cân nặng, chủng tộc, vùng địa lý, tinh trạng hiện tại, liệu pháp điều trị
kết hợp vả tiền sử bệnh, bao gôm oả tiền sử đột quỵ hoặc thoáng thiếu máu nảo tầt
cả đèu không dự đoản được xuất huyết nặng trên phân nhóm không can thiệp hoặc
tống dân số tham gia vảo nghiện cứu PLATO Do vậy không xác định được nguy cơ
xuảt huyêt trện bắt kỳ phân nhóm nảo
Xuất huyềt trén phân nhóm có phẫu thuật bắc cẩu mạch vánh: Trong nghiện cửu
PLATO, 42% trong 1584 bệnh nhân (12% dân số nghiên cứu) phẫu thuật bắc cầu
mạch vảnh bị xuât huyêt nặng gây tử vonglđe dọa tính mạng nhưng không khác biệt
giữa hai nhóm điều trị. Ở môi nhóm, 6 bệnh nhản phẫu thuật bắc oảu mạch vảnh
(CABG) bị tử vong do xuất huyêt (xem phần Lưu Ý và Thận Trọng Đặc Biệt Khi
Dùng)
Xuất huyết trén phân nhóm khỏng phẫu thuật bắc cẩu mạch vânh và phân nhóm
không can thiệp: BRILINTA vả clopidogrel không khác biệt nhau về xuất huyết nặng
gáy từ vongiđe dọa tinh mạng trên phân nhóm không phẫu thuật bắc cầu mạch vảnh
trong nghiên cứu PLATO, nhưng tổng số oa xuất huyết nặng theo định nghĩa của
11
`_mnn—n
PLATO, xuất huyêt nặng theo phân độ TIMI vả tồng số ca xuất huyết nặng và nhẹ
theo phân độ TIMI trong nghiên cứu PLATO, thường gặp hơn vởi ticagrelor. Tương
tự,Ikhi loại trừ tât cả cảc ca xuât huyêt có liên quan đên can thiệp, tỷ lệ xuât huyết
xuât hiện ở nhóm dùng tioạgrelor cao hơn nhóm dùng ciopidogrel (bảng 2). Việc
ngưng điều trị do xuầt huyêt trên phân nhỏm không can thiệp thường gặp ở nhóm
dùng ticagrelor (2,9%) hơn clopidogrel (1,2%; p<0,001).
Chảy máu trong sọ: chảy máu trong so ở phân nhóm khỏng can thiệp khi dùng
ticagrelor (n=27 ca xuất huyết trẻn 26 bệnh nhân, 0,3%) cao hơn clopidogrel (n=14
ca xuất huyết, 0,2%), trong đó có 11 ca xuât huyết do dùng ticagrelor và 1 ca xuất
huyêt do dùng clopidogrel bị tử vong. Khỏng có sự khảo biệt về xuất huyết dẫn đến
tử vong trên tổng dân số nghiên cứu.
Khó thở
Khó thở, cảm giác không thể thờ được, được bảo cáo từ các bệnh nhân dùng
BRILINTA. Các ioại biến cố ngoai ý (AES) khó thở (khó thở, khó thở lúc nghỉ, khó
thở khi gắng sức, khó thở kịch phát vè đệm vả khó thở về đêm) được báo cảo đã
xuất hiện ở 13,8% bệnh nhân dùng ticagrelor và 7,8% bệnh nhân dùng clopidogrel.
Các nhà nghiên oứu đã xem xét lá khó thờ ở 2,2% bệnh nhân dùng ticagrelor và
0,6% bệnh nhân dùng clopidogrel có liên quan đến việc điều trị trong nghiên cứu
PLATO vả chỉ một số ĩt trường hợp được coi lả nghiêm trọng (0,14% với ticagrelor;
0,02% với clopidogrel), (xem phần Lưu Ý vá Thận Trọng Đặc Biệt Khi Dùng). Phần
lớn các triệu chứng khó thờ được báo cáo ở mức độ từ nhẹ đến vừa vả hầu hết các
bảo các đều bị khó thở chỉ một lần ngay sau khi bắt đầu điêu trị.
So với clopidogrel, bệnh nhân bị hen suyễn/bệnh phỗi tắc nghẽn mạn tinh sử dụng
ticagrelor có thế bị gia tăng nguy cơ khó thở không nghiêm trọng (3,29% dùng
ticagrelor so với 0,53% dùng clopidogrel) và khó thở nghiêm trọng (0,38% dùng
ticagrelor so với 0% dùng clopidogrel). Tính theo nguy cơ tuyệt đối, nguy cơ nảy cao
hơn nguy oơ trên tồnadân số bệnh nhân trong nghiên cứu PLATO. Cần thận trọng
khi sử dụng ticagrelor rèn những bệnh nhân có tiền sử bị hen suyễn vảlhoặo bệnh
phổi tắc nghên mạn tinh (xem phần Lưu Ý và Thận Trọng Đặc Biệt KhiDủng).
Khoảng 30% trướẫệtợồ tự hồi phục trong vòng 7 ngảy. Nghiên cứu PLATO được
thực híện trên _ nhân ban đầu đã bị suy tim sung huyêt, bệnh phổi tắc
nghẽn mạn tính hoặc hen suyễn, những bệnh nhân nảy vả người oao tuối có khuynh
hướng bị khó thở nhiều hơn. Trẻn nhóm dùng BRILINTA, có 0,9% bệnh nhân ngưng
dùng thuốc do khó thở so với 0,1% bệnh nhân dùng clopidogrel. Tỷ lệ khó thở cao
hơn trên nhòm dùng BRILINTA không |iên quan đên bệnh tim hoặc bệnh phổi mới
mắc hoặc trở nặng (xem phần Lưu Ý vả Thận Trọng Đặc Biệt Khi Dùng). BRILINTA
không gây ảnh hưởng đến các xét nghiệm chức năng phổi.
cÁc THÔNG SỐ XÉT NGHIỆM CẬN LÂM SÀNG
Tăng Creatinine: Trong nghiên cứu PLATO, nồng độ creatinin huyêt thanh tăng đáng
kể >30% trong 25,5% bệnh nhân dùng ticagrelor so với 21,3% bệnh nhân dùng
ciopidogrel vá >50% trong 8,3% bệnh nhản dùng ticagrelor so với 6,7% bệnh nhân
dùng clopidogrel. Creatinin tảng >50% thường được thông bảo trên những bệnh
nhân lớn hơn 75 tuồi (13,6% ở nhóm dùng ticagrelor so với 8,8% nhóm dùng
clopidogrel), ở bệnh nhân bị suy thận nặng ban đầu (17,8% ở nhóm dùng `
ticagrelor so với 12,5% nhóm dùng clopidogrel) và những bệnh nhân điêu trị đông
thời với oác thuốc ức chế thụ thể angiotensin (ticagrelor 11,2% so với
clopidogrel 7,1%). Trên cảc phân nhóm nảy, biện có ngoại y nghiêm trọng có liên
12
quan đến thận và cảc biến cố ngoại ý dẫn tới ngừng sử dụng thuốc tương đương
nhau giữa các nhóm điều trị. Tống các biến cố ngoại ý trên thận được bảo cáo có
4,9% khi dùng ticagrelor so với 3, 8% khi dùng clopidogrel tuy nhiên các nhà nghiên
cứu cân nhắc liệu sự tương đương về tỷ lệ phần trăm bệnh nhân gặp biên có có liện
quan đến điều trị hay không; 54 (0,6%) trường hợp dùng ticagrelor vả 43 (0,5%)
trường hợp dùng clopidogrel.
Tăng acid un'c: Trong nghiên cứu PLATO, nồng độ acid uric trong huyết thanh tăng
hơn giới hạn trên của bình thường ở 22% bệnh nhân dùng ticagrelor so vời 13%
dùng clopidogrel. Nồng độ acid uric trung bình tăng khoảng 15% khi dùng ticagrelor
so với khoảng 7, 5% dùng clopidogrel vả sau khi kết thúc điều trị, giảm khoảng 7%
khi dùng ticagrelor nhưng không thấy giảm trên nhóm bệnh nhân dùng clopidogrel.
Các biến cố ngoại ý liên quan đến tăng aoid uric huyết được báo cáo 0,5% ở nhóm
ticagrelor so với 0,2% ở nhóm clopidogrel. Trong các biến có ngoại ý nảy, có 0 05%
nhóm dùng tioagrelor và 0,02% ở nhóm dùng clopidogrel được xem là có liên quan
đến việc điều trị Trèn bệnh nhân viêm khớp do Gout biến có ngoại ý được báo cáo
0,2% khi dùng ticagrelor so với 0,1% khi dùng clopidogrel; oác nhà nghiên cứu oho
rằng không có bất kỳ bỉến oố ngoại ý nảo có liên quan đến việc điều trị.
Báo các nghi ngờ các phản ứng có hại
Việc báo cảo nghi ngờ các phản ứng oó hại sau khithuốc được lưu hảnh là quan
trọng. Việc náy cho phép giảm sát liên tục sư cản băng lợi ích | nguy cơ cũa thuốc.
Các chuyên gia y tế được yêu cầu báo cáo bât kỳ phản ứng nảo nghi ngờ có hại.
QUÁ LIỀU
Ticagrelor được dung nạp tốt khi dùng cảc liều đơn Iện đến 900mg. Độc tĩnh trên hệ
tiệu hóa bị giới hạn theo liếu trọng một nghiên cứu đơn tăng dần Iièu dũng Các
phản ứng ngoại ý có ý nghĩa vẻ mặt lâm sảng có thể xuất hiện khi dùng/quá liếu bao
gồm khó thở vả ngưng thất (xem phần Phán Ưng Không Mong Moủf
xay ra va
Khi bị quá liều, nên ghi nhận những tác dụng không mong muốn co
cản theo dõi điện tâm đô (ECG).
Hiện nay chưa có thuốc giải độc để đảo ngược tác động cùa BRILINTA và không
thể phân tách BRILINTA (xem phần Lưu Ý vè Thận Trọng Đặc Biệt Khi Dùng). Xử trí
khi quá liều nên tuân theo thực hảnh y khoa chuẩn. Ành hưởng của việc dùng quá
liều BRILINTA lảm kéo dải thời gian chảy máu liên quan đên ức chế tiểu cầu. Nếu
có xuất huyết, nến tiên hảnh các biện pháp hỗ trợ thích hợp.
ĐẶC TÍNH DƯỢC LỰC HỌC
Nhóm dược lý trị liệu: Ức chế kêt tập tiều cầu không gồm heparin, mả ATC:
BO1AC24
Cơ chế tảo đông
BRILINTA chứa ticagrelor, một thảnh phần của nhóm hóa học
cyclopentyltriazolopyrimidin (CPTP), một thuốc dạng uống, oó tảo động trực tiêp, đối
kháng thụ thể P2Y12 chọn lọc vả tương tảo thuận nghịch, ngăn cản quá trinh hoạt
hóa và kết tập tiều cầu phụ thuộc P2Yịz qua trung gian ADP adenosin diphosphat.
Ticagrelor không ngăn cản gắn kết với ADP, nhưng khi gắn với thụ thể P2Y1z sẽ
ngăn chặn việc dẫn truyền tin hiệu cảm ứng ADP. Vi tiểu cầu tham gia vảo quá trinh
khởi phảt vảlhoặc phảt triển cảc biến chứng huyết khối của bệnh xơ vữa động
-—-n
mạch, việc ức chế chức náng tiếu cầu đã được chứng minh là Iảm giảm nguy cơ tai
biên tim mạch như tử vong, nhôi máu cơ tim hoặc đột quỵ.
Ticagrelor, củng Iệm tăng nồng độ adenosin nội sinh tại chỗ bằng cách ức chế chât
vận chuyền cân băng nucleoside -1 (ENT—1).
Tioagrelor đã được ghi nhận là lảm tăng tác động cảm ứng adenosin sau đây ở
người khỏe mạnh vả bệnh nhân ACS: giăn mạch (xác định bằng oảoh tăng lưu
lượng máu mạch vánh ở người tinh nguyện khỏe mạnh vả bệnh nhản ACS; đau
đằu), ức chế chức nảng tiểu cầu (máu toản phần của người khi quan sát trong
phòng thí nghiệm) và khó thở. Tuy nhiên, mối liên hệ giữa các ca ghi nhận tăng
adenosin và kết quả lâm sảng (ví dụ: tỷ lệ mắc bệnh- tử vong) chưa được lảm sáng
tỏ rõ rảng.
Tác đông dươc lưc hoc
Khởi phát tác động
Trên những bệnh nhân bị bệnh động mạch vảnh Ổn định sử dụng ASA, ticagrelor
cho thắy khởi phảt nhanh tác động được lý với khả năng ưc chế kết tập tiêu cầu
(IPA) trung binh ở nhóm dùng ticagrelor sau 0,5 giờ sử dụng liều nạp 180 mg vảo
khoảng 41%, hiệu quả ức chế kết tập tiểu cầu (IPA) tồi đa là 89% sau khi dùng
thuốc 2-4 giờ vả duy tri tiếp 2-8 giờ. 90% bệnh nhân có mức độ ức chế kẻt tập tiểu
cầu (IPA) ouối cùng lả ›70% sau hai giờ dùng thuốc.
Tác động tồn dư
Nếu có kế hoạch phẫu thuật bắc cầu mạch vảnh, có tăng nguy cơ xuất huyết so với
clopidogrel nêu ngưng dùng ticagrelor chưa đủ 96 giờ trước khi tiên hảnh phẫu
thuật.
i
Dữ liệu về chuyển đồi thuốc
Việc chuyển từ clopi ogrel sang dùng ticagrelor lám tăng 26, 4% sư ức chế kết tập
tiêu cầu (IPA) vả chu ền từ ticagrelor sang dùng clopidogrel Iảm giảm 24, 5% sự ức
chế kết tập tiếu A). Bệnh nhân có thể chuyến tứ clopidogrel sang dùng
ticagrelor mả kh ị gián đoạn hiệu quả kháng tiếu cầu (xem phần Liều Lượng và
Cách Sử Dụng).
Hiêu ouả vả an toản trên lâm sảng
Nghiên cứu PLATO được thực hiện trên 18.624 bệnh nhản có triệu chứng của đau
thắt ngực không Ổn định (UA) trong vòng 24 giờ, nhồi máu cơ tim không có ST
chênh iên (NSTEMI) hoặc nhồi máu cơ tim có ST chênh lên (STEMI) vả đã bắt đầu
điếu trị nội khoa, hoặc có can thiệp mạch vảnh qua da (PCI), hoặc phẫu thuật bắc
cầu mạch vảnh (CABG) (xem phần Chỉ Định Đíều Trị).
Trên nèn điều trị ASA hằng ngảy, dùng ticagrelor liều 90mg hai iần mỗi ngảy cho
thẩy hiệu quả vượt trội hơn sử dụng ciopidogrel liều 75 mg mỗi ngảy trên tiêu chỉ
chinh bao gôm tử vong tim mạoh [CV], nhồi máu cơ tim [MI] hoặc đột quỵ, với sự
khác biệt rõ rệt về tiêu ohi tử vong tim mạch và nhồi máu cơ tim Bệnh nhân sử dụng
liều nạp 300 mg clopidogrel (có thể lện đến 600mg nếu có can thiệp mạch vảnh qua
da (PCI)) hoặc 180 mg ticagrelor.
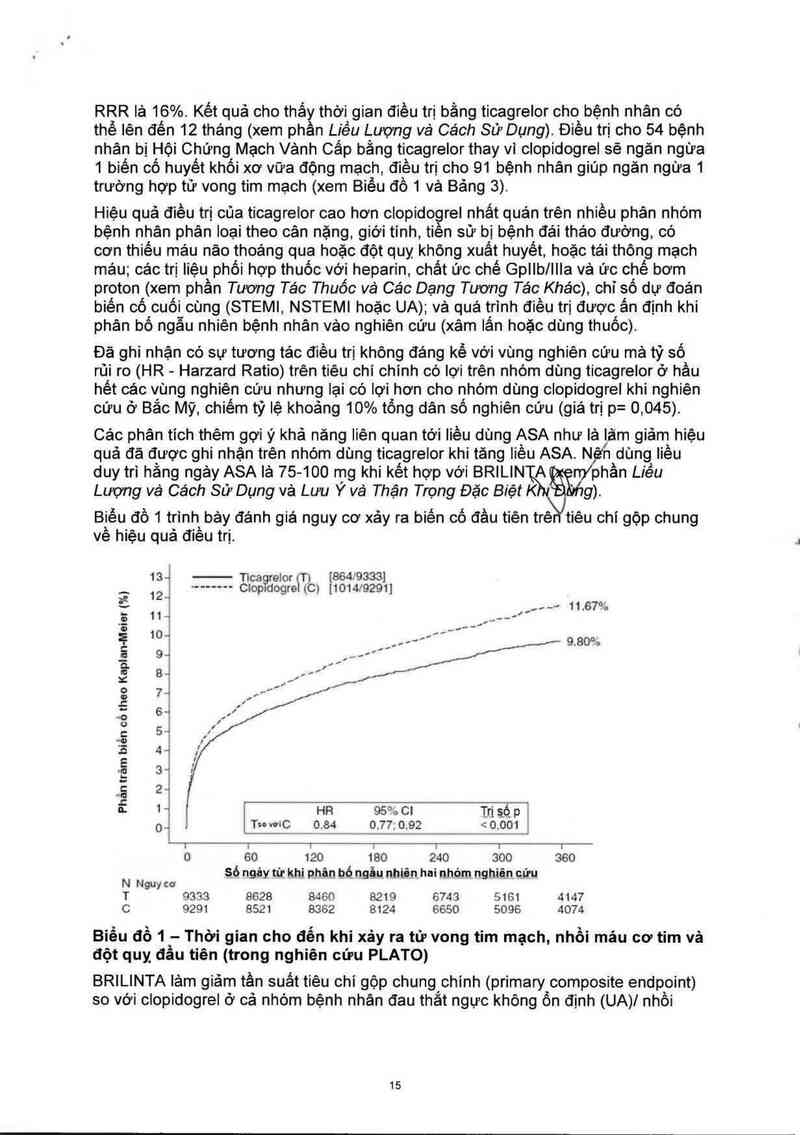
Kết quả nghiên cứu đến sởm (giảm 0,6% nguy cơ tuyệt đồi [absolute risk reduction-
ARR] và giảm 12% nguy cơ tương đối [Relative risk reduction-RRR] sau 30 ngảy)
với hiệu quả điều trị hằng định suốt 12 tháng, tính theo ARR lả 1,9% mỗi năm và
14
RRR là 16%. Kết quả cho thắy thời gian điều trị bằng ticagrelor cho bệnh nhân có
thể lên đến 12 tháng (xem phần Liều Lượng và Cách Sử Dụng). Điều trị cho 54 bệnh
nhân bị Hội Chứng Mạch Vảnh Cấp bằng ticagrelorthay vì clopidogrel sẽ ngăn ngừa
1 biên cố huyết khối xơ vữa động mạch, điều trị cho 91 bệnh nhân giúp ngăn ngừa 1
trường hợp tử vong tim mạch (xem Biêu đồ 1 và Bảng 3).
Hiệu quả điều trị của ticagrelor cao hơn clopidogrel nhắt quản trên nhiều phân nhóm
bệnh nhân phân loại theo cân nặng, giới tinh, tiền sử bị bệnh đái tháo đường, có
cơn thiếu máu não thoáng qua hoặc đột quỵ không xuât huyêt, hoặc tái thông mạoh
mảu; các trị liệu phối hợp thuốc với heparin, chất ức chế Gpllb/llla vả ức chế bơm
proton (xem phần Tương Tác Thuốc và Các Dạng Tượng Tác Khác), chỉ số dư đoản
biên có cuối oùng (STEMI, NSTEMI hoặc UA); vả quá trinh điều trị được ấn định khi
phân bổ ngẫu nhiên bệnh nhân vảo nghiên cứu (xâm Iắn hoặc dùng thuốc).
Đã ghi nhận có sự tương tác điều trị không đáng kể với vùng nghiên cứu mã tỷ số
rủi ro (HR - Harzard Ratio) trên tiêu chỉ chỉnh có lợi trên nhóm dùng ticagrelor ở hầu
hết các vùng nghiên cứu nhưng lại có lợi hơn cho nhóm dùng clopidogrel khi nghiên
cứu ở Bắc Mỹ, chiêm tỷ lệ khoảng 10% tổng dân số nghiên cứu (giá trị p= 0 ,.045)
Các phân tich thêm gợi ý khả năng liên quan tởi liều dùng ASA như lá lăm giảm hiệu
quả đã được ghi nhận trên nhóm dùng ticagrelor khi tăng iiều ASA. Nện dùng liều
duy trì hằng ngảy ASA lả 75-100 mg khi kết hợp với BRILIN A n/phần Liều
Lượng vả Cách Sử Dụng vả Lưu Ý và Thận Trọng Đặc Biệt K ` g)
Biểu đồ 1 trình bảy đánh giá nguy cơ xảy ra biến có đầu tiên trẻ tiêu chí gộp chung
về hiệu quả điều trị.
13-1 Ticagreior (T) [864 9333]
__ 12 --~-—-- CIopndogre (C) {1014'92911
ì ___ - 11.67°…
.ẽ … —
o ỷ_f_ -
Ẹ 10~ _ gggggg g.sov>o
ẵ 9 4 ’ ” 'l /
Q. J"í
g 8~ l_,ư » ___/.
g 7“ 'fffÍ z/J
ẵ ' /
_0 64 , /
0
c 5“
*D
“3 4 —
.E 3…
…Ễ ² “
m 1 - Hn 95% 01 T_rị s,ó_ p
0… Tu vơỉC 0.84 0.77; 0.92 < 0.001
1 i 1 T 1 Ỉ l
0 60 120 180 240 300 360
Số ngảy từ khi phản bố ngẩu nhìẽn hai nhóm nghièncứu
N Nguycơ
T 9333 8628 8460 8219 6743 S161 4147
C 9291 8521 8362 8124 6650 5096 4074
Biểu đồ 1 - Thời gian cho đến khi xảy ra tử vong tim mạoh, nhồi máu cơ tim và
đột quỵ đẩu tiên (trong nghiên cứu PLATO)
BRILINTA Iảm giảm tần suất tiêu chí gộp chungchính (primary composite endppint)
so với clopidogrel ở cả nhóm bệnh nhân đau thăt ngực không ổn định (UA)] nhội
15
máu cơ tim không có ST chênh lẻn (NSTEMI) vả nhồi máu cơ tim có ST chênh lên
(STEMI) (Bảng 3).
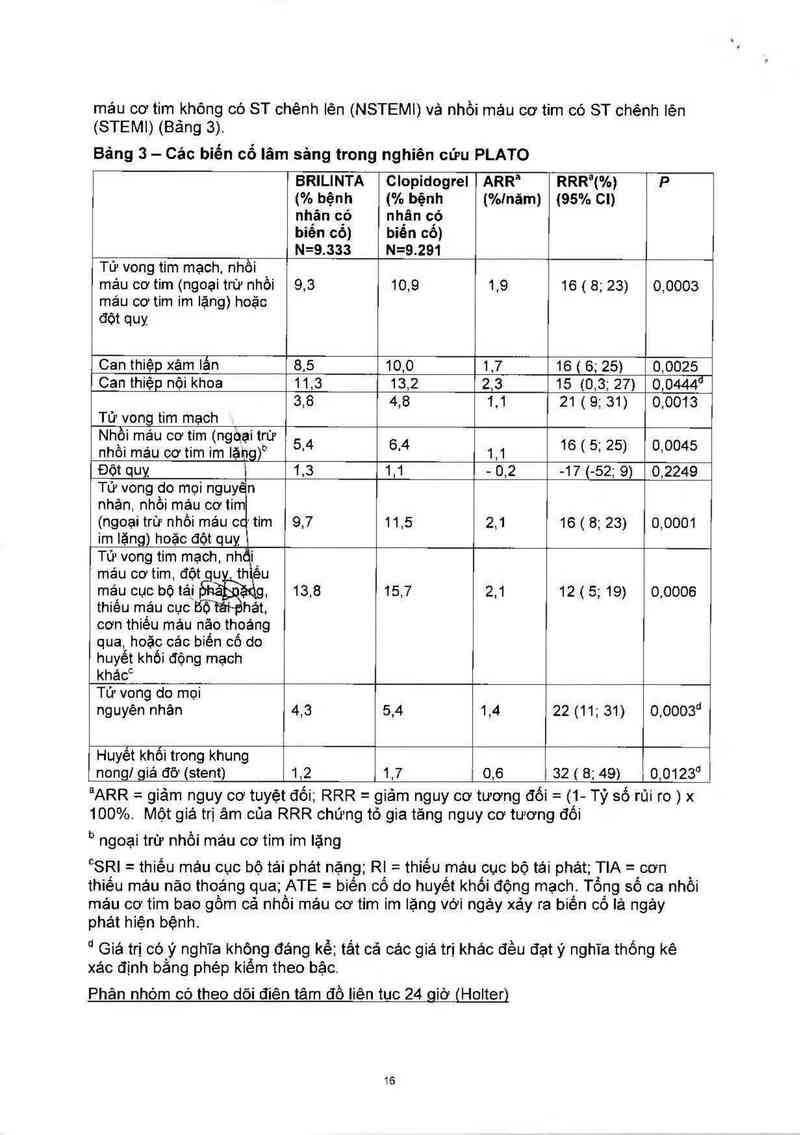
Bảng 3 - Các biến cố lâm sảng trong nghiên cửu PLATO
BRlLINTA Clopidogrel iĐiRRa RRR²(%) P
(% bệnh (% bệnh (%lnăm) (95% CI)
nhị… có nhân c'ỏ
biên cỏ) biển cô)
N=9.333 N=9.291
Tử vong tim mạch, nhồi
máu cơ tim (ngoại trừ nhồi 9,3 10,9 1,9 16 ( 8; 23) 0,0003
máu cơ tim im lặng) hoặc
đôt quy
Can thiệp xảm lắn 8 5 10,9 1,7 16 ( 6; 25) 0,0925
Can thiệp nội khoa 11, 3 13,2 ,3 15 (0,3; 27) 0,0444CỈ
3,8 4,8 1,1 21 (9; 31) 0,0013
Tử vong tim mạch
Nhồi máu oơtim (ngoại trừ 5 4 64 16 5_ 25 0 0045
nhồi máu cơ tim im lặị1g)b ' ’ 1,1 ( ' ) '
Đột quy ị 1,3 1,1 - 9,2 -17 (-52; 9) 9,2249
Tử vong do mọi nguy“n
nhân, nhồi máu cơ tim
(ngoại trừ nhồi máu c 'tim 9,7 11,5 2,1 16 ( 8; 23) 0,00…
im lặng) hoặc đột quỵ
Tử vong tim mạch, nhdi
mảu cơ tim, đột u thịếu
máu cục bộ tái 13,8 15,7 2,1 12 ( 5; 19) 0,0006
thiếu máu cục ốộ`tãi~phát,
oơn thiếu máu não thoáng
qua, hoặc cảc biến cổ do
huyết khói động mạch
khác°
Tử vong do mọi
nguyên nhân 4,3 5,4 1,4 22 (11; 31) o,oooscl
Huyết khối trong khung
nongJ giá đỡ (stent) 1,2 1,7 9,6 32 i 8; 49) 9,0123° l
alARR = giảm nguy cơ tuyệt đối; RRR = giảm nguy cơ tương đối = (1- Tỷ số rủi ro ) x
100%. Một giá trị âm của RRR chứng tỏ gia tăng nguy cơ tương đôi
b ngoại trừ nhổi máu cơ tim im lặng
°SRI— - thiếu máu cục bộ tái phảt nặng; Ri — thiều máu cục bộ tái phát; TIA= cơn
thiếu máu não thoáng qua; ATE= biến cổ do huyết khối động mạch. Tồng số ca nhồi
máu cơ tim bao gõm cả nhồi mảu cơ tim im iặng VỞi ngảy xảy ra biến có lá ngảy
phảt hiện bệnh.
“ Giá trị có_ý nghĩa không đáng kể; tắt cả các giá trị khác đếu đạt ý nghĩa thồng kê
xác định băng phép kiểm theo bậc.
Phân nhòm có theo dõi điên tâm đồ liên tuc 24 qiờ (Holter)
16
Nhằm khảo sát tần suất ngưng thắt vả loạn nhịp tim trong nghiên cứu PLATO, cảc
nhả nghiên cứu đã tiến hảnh theo dõi điện tâm đồ liên tục 24 giờ (Holter) trên một
phân nhóm gần 3000 bệnh nhân, trong đó có khoảng 2000 bệnh nhân được ghi
nhận ở cả giai đoạn oập của hội chứng mạch vảnh câp vả sau 1 tháng. Biến sô
quan tâm đầu tiên lá tần suất ngưng thảt 2 3 giây. Nhiêu bệnh nhân bị ngưng thắt
khi sử dụng ticagrelor (6%) hơn so với dùng clopidogrel (3,5%) trong giai đoạn câp
vả 2, 2% ở nhóm dùng ticagrelor so với 1,6% dùng clopidogrel sau 1 tháng (xem
phần Lưu Ý và Thận Trọng Đặc Biệt Khi Dùng). Việc gia tăng ngưng thắt trong giai
đoạn cắp của Hội Chứng Mạch Vảnh Cấp được ghi nhận ở oác bệnh nhân dùng
ticagrelor có tiền sử bị suy tim sung huyết (9,2% so vời 5,4% bệnh nhân không có
tiền sử suy tim sung huyết); với bệnh nhân sử dụng clopidogrel, 4% ở bệnh nhân có
tiền sử suy tim sung huyết so với 3,6% bệnh nhân không có tiến sử suy tim sung
huyết). Sự mầt cân bằng nảy không xuất hiện sau 1 tháng: lằn lượt lả 2% so với
2 1% trên bệnh nhân sử dụng ticagrelor có vả không có tiền sử suy tim sung huyết,
3, 8% so với 1,4% ở nhóm bệnh nhản dùng clopidogrel. Khộng có tác động khỏng
mong muốn trện lâm sáng liện quan tới sự mất cản bằng nảy (ngay cả việc đặt máy
tạo nhịp) trên nhóm bệnh nhân nghiên cứu
Phân nhóm theo kiến di truyền trong nohiên cứu PLATO
Phân tích kiểu gen cùa CYP2C19 vả ABCB1 trên 10. 285 bệnh nhân trong nghiên
cứu PLATO cho thấy mối liên hệ giữa các nhóm kiểu gen với kết quả nghiên cứu
Sự vượt trội oủa ticagrelor so với clopidogrel trong việc giảm oác biến có tim mạch
ohinh khỏng bị ảnh hưởng đáng kế bởi kiểu gen CYPZC19 vá ABCB1 của bệnh
nhân. Tương tư như trên tống bệnh nhân trong nghiên cứu PLATO, không có/sự
khác biệt giữa ticagrelor vả clopidogrel trên tỗng sô ca xuất huyết nậngk o/nghiên
oứu PLATO, bắt kế kiểu gen CYP2C19 hoảc ABCB1 Xuất huyết nặng hân
nhóm bệnh nhản khỏng oó phẫu thuật bắc cầu mạch vảnh (non- CABG) ttc'ng nghiện
cứu PLATO tăng khi dùng ticagrelor so với clopidogrel ở những bệnh nhân bị mât
một hoặc nhiếu hơn các alen chức năng quy định CYP2C19, nhưng lại tương tự
như clopidogrel ở những bệnh nhân không bị mất alen chức năng.
Tiêu chỉ kết hơn về hiêu quả và an toản
Tiêu chỉ kết hợp về hiệu quả và an toán (tử vong tim mạch, nhồi mảu cơ tim, đột quỵ
hoặc tống sô ca xuất huyết nặng theo định nghĩa của nghiện cứu PLATO) oho thấy
lợi ích về hiệu quả của BRILINTA so với clopidogrel không bị ảnh hưởng bởi các
biến cô xuất huyết nặng (ARR 1,4%, RRR 8%, HR 0,92; p=-0,0257) suốt 12 tháng
sau Hội Chứng Mạch Vảnh Cấp.
Đối tương trẻ em
Cơ quan Quản iý Thuốc Châu Âu đã miễn trừ việc bắt buộc nộp các kết quả nghiên
cứu về BRILINTA trên tắt cả oác phân nhóm trẻ em trong chỉ định được phê duyệt
(xem Liều Lượng và Cách Sử Dụng và ĐặcTính Dược Động Học).
ĐẶC TỈNH DƯỢC ĐỘNG HỌC
Ticagrelor cho thắy dược động học tuyến tính. Nồng độ và thời gian tiếp xúc với
ticagrelor vả chất chuyên hóa có hoạt tỉnh (AR- C124910XX) tỷ lệ theo liều lện đến
khoảng 1260 mg.
H_ảp__ thu
Ticagrelor hắp thu nhanh với tmax trung binh khoảng 1 ,5 giờ. Chắt chuyền hóa
chinh tuân hoản trong mảu AR- C124910XX (oũng có hoạt tính) từ ticagrelor được
tạo thảnh nhanh với tmax trung binh khoảng 2 ,5 giờ. Sau khi uống 90 mg ticagrelor
lúc đói, nồng độ đỉnh Cmax đạt 529 nglml và diện tich dưới đường cong AUC là
3,451 ng*hlml Tỷ lệ chuyển hớa lả 0,28 đối với nồng độ đỉnh Cmax và 0,42 đối với
diện tích dưới đường cong AUC.
Sinh khả dụng tuyệt đối trung binh của ticagrelor ước lượng khoảng 36%. Tiêu thụ
một bữa ăn giảu chảt béo Iảm tăng 21% diện tich dưới đường cong AUC oủa
ticagrelor và giảm 22% nồng độ đỉnh Cmax của chầt chuyền hóa có hoạt tính nhưng
không ảnh hưởng đến nồng độ đỉnh Cmax cúa ticagrelor hoặc diện tích dưới đường
cong AUC của chắt chuyến hóa có hoạt tinh. Những sự thay đổi nhỏ nảy được xem
là ít có ý nghĩa lâm sáng, do đó, ticagrelor có thể sử dụng cùng hoặc không cùng với
thức an. Ticagrelor cũng như chắt chuyền hóa có hoạt tinh là những cơ chắt của P—
9D
Ticagrelor dưới dạng viên bị nghiến rồi phân tán trong nước, được uống hoặc dùng
qua ống thông dạ dảy, có sinh khả dụng có thế so sảnh được với dạng viên nguyên
vẹn về cảc chỉ số AUC vả Cmax của ticagrelor vá các chẳt chuyến hóa có hoạt tinh.
Nồng độ khởi đầu (0, 5 vả 1 giờ sau khi uống) của viên bị nghiền rồi phân tán trong
nước cao hơn so với viên nguyên vẹn, với số liệu về nồng độ hầu như giống hệt sau
đó (sau 2 - 48 giờ).
Phân bố
Thể tích phân bố ở trạng thái hằng định của ticagrelor iả 87,5 L. Ticagrelor vả chắt
chuyển hóa có hoạt tính liên kết cao với protein huyết tương (›99,0%).
Chuyển hóa
CYP3A4 iả enzym chinh chịu trách nhiệm chuyến hóa ticagrelor vả hinh thảnh nên
chát chuyển hóa có hoạt tính vệ sự tương tác với oác cơ chât khảo của enzym
CYP3A có thẻ đi từ hoạt hóa đẻn ức chê.
Chắt chuyển òa chinh của ticagrelor lả AR-C124910XX, chắt náy cũng có hoạt tinh
khi nghiên cứ in vitro gắn kết với thụ thể i321712 ADP của tiểu cầu. Thời gian và
nồng đó tiếp x c với chất chuyển hóa có hoạt tính bằng khoảng 3040% thời gian vả
nồng độ tiếp xử với ticagrelor.
Thải trừ
Đường thải r chính của ticagrelor thông qua chuyển hóa ở gan. Khi uống ticagrelor
được đảnh dấu phóng xạ, hoạt tính phóng xạ được hoán hồi trung bình khoảng 84%
(57,8% ở phân, 26,5% ở nước tiểu). sư hoán hồi ticagrelor và chất chuyển hóa có
hoạt tinh trong nước tiếu đếu thắp hơn 1% so với liều dùng. Đường thải trư chinh
của chất chuyền hóa có hoạt tinh rắt có thể qua đường mật. Tịị2 trung binh khoảng 7
giờ đối với ticagrelor vả 8,5 giờ đối với chắt chuyển hóa có hoạt tinh.
Các nhóm dân số đăc biêt
Người“ cao tuổi
Quan sát thắy nồng độ vả thời gian tiếp xúc với ticagrelor (khoảng 25% đối Với cả
Cmax vả AUC) vả chắt chuyển hóa có hoạt tính ở những bệnh nhân cao tuổi (2 75
tuổi) bị Hội Chứng Mạch Vánh Cắp cao hơn so với nhóm bệnh nhân trẻ hơn theo
phân tích dược động học trêncác cá thể nghiên cứu. Sự khác biệt nảy khỏng có ý
nghĩa lâm sảng (xem phân Liêu Lượng vả Cách Sử Dụng).
Trẻ em
Ticagrelor chưa được nghiện cứu trẻn đối tượng trẻ em (xem phần Liều Lượng vè
Cách Sử Dụng vá Đặc Tính Dược Lực Học).
Giới tính
Quan sát thắy nồng độ và thời gian tiếp xúc với ticagrelor và chất chuyển hóa có
hoạt tinh ở phụ nữ cao hơn nam giới. Sự khảo biệt nảy không có ý nghĩa lâm sảng.
Bệnh nhán suy thận
Nồng độ vả thời gian tiếp xúc với ticagrelor vả chầt chuyến hóa có hoạt tinh thấp
hơn khoảng 20% vả nồng độ tiêp xúc các chắt chuyển hóa có hoạt tính cao hơn
khoảng 17% ở những bệnh nhân bị suy thận nặng (độ thanh thải creatinin <
30mllphút) so với những bệnh nhân có chức năng thận bình thường (xem phần Liều
Luong vả Cách Sử Dụng).
Bệnh nhân suy gan
Nống độ đỉnh G…ax vả diện tỉch dưới đường cong AUC của ticagrelor ở những bệnh
nhân suy gan nhẹ cao hơn lần lượt lả 12% vả 23% so với những người khỏe mạnh
binh thường (xem phần Liều Lượng và Cách Sử Dụng) Ticagrelor không được
nghiên cứu trện những bệnh nhân bị suy gan vừa hoặc nặng và chống chỉ định trên
những bệnh nhân nảy (xem phần Chổng Chỉ Định vá Lưu Ý và Thận Trọng Đặc Biệt
Khi Dùng).
Chủng tộc
Bệnh nhân có nguồn gốc châu Á có sinh khả dụng trung binh cao hờn 39% so với
nhóm bệnh nhân da trắng. Bệnh nhân da đen có sinh khả dụng “ ticếgrelor thắp
hơn 18% so với bệnh nhân da trắng. Theo các nghiên cứu dược | n lâm sảng,
nồng độ và thời gian tiếp xúc (Cmax vả AUC) cúa ticagrelor ở bệnh nhân Nhật Bản
cạo hơn khoảng 40% (20% sau khi điều chỉnh trọng lượng cơ thể) so với người da
trăng.
DANH mục TẢ DƯỢC
Nhán viên ,"
. r .,
Manitol (E421), dibasic calci phosphat, magnesi stearat (E470b), natri starch ễfi
glycoiat, hydroxypropylcellulose (E463) fí° ~
Q
Bao viên
Tale, titan dioxyd (E171), sắt oxyd vảng (E172), polyethylen glycol 400,
hypromellose (E464).
TÍNH TƯỜNG KY
Không ảp dụng
HẠN DÙNG
36 tháng kể từ ngảy sản xuất.
LƯU Ý ĐẶC BIỆT KHI BÀO QUÁN
Không bảo quản quả 30°C.
DẠNG TRÌNH BÀY:
Vĩ PVC-PVDC/AI (với biếu tượng mặt trời/mặt trăng) chứa 10 viên; hộp 6 vỉ x 10
viên.
19
NGÀY HIỆU ĐỈNH TOA THUỐC
472015 .
NHÀ SẢN XUÁT
AstraZeneca AB
Gảrtunavảgen, \SE-151 85, Sỏdertălje, Thụy Điền.
eockỸ HướịủG D_AN TRƯỞC KHI DÙNG. NÉU CẦN THÊM THÔNG TIN, x…
HÒI Y KIÉN B Si.
THUỐC Nầẵỉ DÙNG THEO TOA CỦA BÁC SỸ.
THỘNG B ` o BÁC sĩ NHỮNG TÁC DỤNG KHÔNG MONG MUÔN GẶP
PHAI KHI DUNG THUỐC.
ĐỂ XA TÀM TAY TRẺ EM.
BRILINTA is a trademark of AstraZeneca Group of companies.
@ AstraZeneca 2015.
Doc ID:
TUQ CUC TR'~ĨỞNG
P.TRUONG PH›’ ưfc
Jịẫzuả.ển Jfưy Ji n …j
20
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng