











M N
Jeiđ,g
, : BỌ Y TẾ
,———J² ; CUC QUAN LÝ nmc
, MM _, ~ -~————;——…… ~
1 , bA PHE DUYET
, Bum: uoimlu1 … uoimios .
, …… ……l — … —Lán n…đm, _ ),)… , — ,
Ế V3CIIWHVHd , 1
i , 1, ' ,
€ GIWOZELHOG 1 1 1 1 1
l 1 1" i_ r'J (
Rx only 1 vhl 1 Each vid oontains: Rx onìy 1 VU
ìBonezomìb 3.5mg
BORTEZOMIB ỉỄ“,ỂẾỆỀ… “' BORTEZOMIB
Raccnstttutewith 3.5de 0 9%
PHARMIDEA 1…diumchmhiecim PHARMIDEA ____________________
ỉLyophlllzed powder for ,sromeE ơ’ Lyophilized powder tot Ế
*Do notstom above3 C solution for In tion 3.
;solution for Injectlon 3 511191Pmíecưrcun ,… 100 5…9 8
. For 1.v. orS.C. 1K°°°°"'°mmwimị For l-V… ofS-C- n: .
, Indication Cm1saindicaiim. Usage: Ế i
' tsee package insat. j
, , Read package men before use. ị
f ,miuiachirec NHẢN PHỤ , """""""""" '
ỉ ,'sn Phamlda ,
'Rupnicuiela4, Ế
j Oiaine. LV-2114. =
, 1Latvia. '
1 i ,1
1 , 1, ,
1 , …
1` ` `, '
, , 1 ,
1 Reg No ` , 1
We …)… i 1
_ EX,, , __ -
1 ị
\ ,
Ể |
1
Rx— Mu `
, Đocưwigủmam , ,;
… … …………… . … Ten thuốc: nonnzom : . , 1
R: onIy Eachvialcmtains. stouee: 1 1 Houtchất …ibJảnf/lo
mzomn …… ²… °…meamưc 1 imwi. Hộpllobộtâìngkhõphtiủn
p…ưmmn ỄỊỆẸẸ… , °~’~ PW'T'W ,, ,; inhiđanđmiđi
|Lmùlu ,... …ẵnww ửẵckaộĨiẵbúitủi Bủqửở“hi°mủwc T’ffl'i’hử-
,……ủ,m …như…an n., No , , Dmujẵhỉvplẵuplmhoqtủnởrluèđòìs'c
1— … s
F LV. S.C. Manuladumr Lm'j Dếmrấulayơc'm!
M N _ ưễỆỆ'mu" 'ẩị … ì ỂthỀn S!APhumlden un-viu
, .............................................
` SĐK: ..….………; bòSX: ..............
,:NSX đơmnưyyyy; HSD ddlminlyyyy
Cảodủlglbllhưểnghiun wma
-Pantone 300 C ,_ …ủwwh-ốclfêfflhra . .
Thuốc~ bán theo đơn! _ ._
ĐIọc kỹ hướng dân sử dụng trước k_hi dùng
Nêu cân thêm thông tin xin hỏi ý kiên bác sỹ
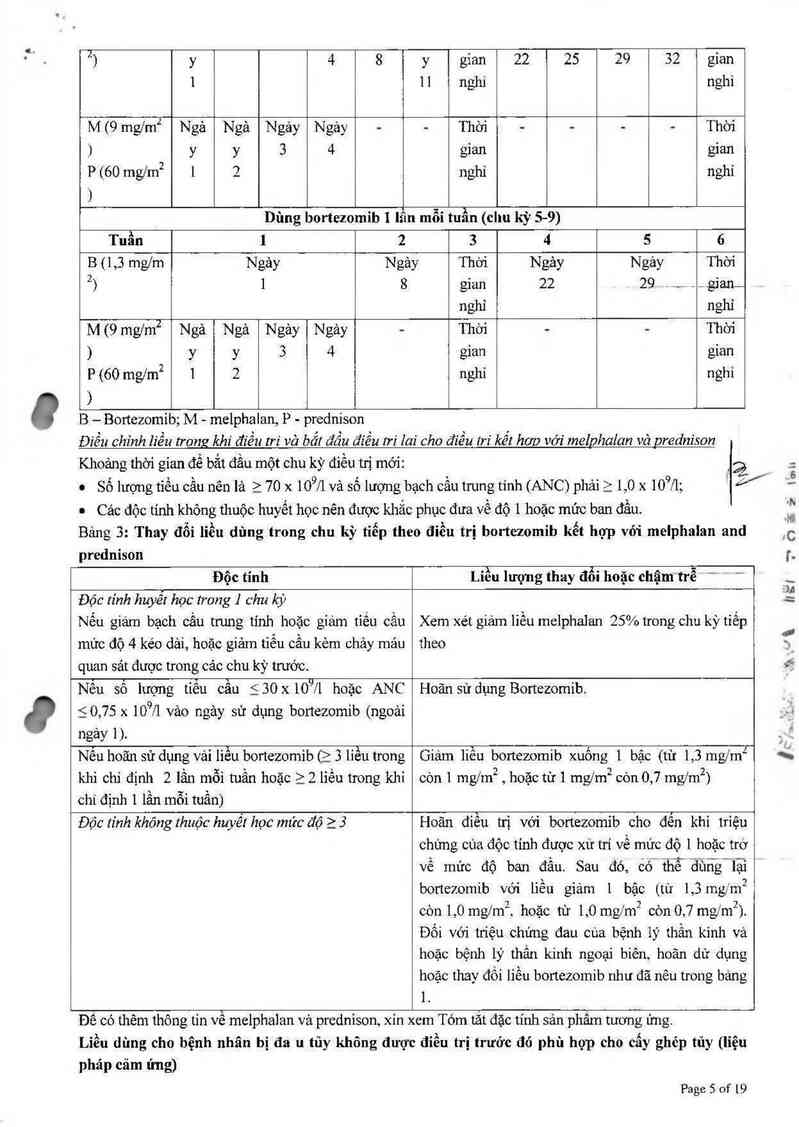
Bortezomib Pharmidea
THÀNH PHÀN:
Mỗi lọ Bortezomib Pharmỉdea bao gồm:
Hoạt chất: Bortezomib 3,5 mg
Tá dược: Manitol 35 mg, nitrogen vừa đủ.
DƯỢC LỰC HỌC
Nhóm tác dụng dược lý: thuốc chống ung thư, mã ATC: LOIXX32
Cơ chế tác dụng
Bortezomib là một chất ửc chế proteasom. Nó được thiết kế đặc biệt để ức chế hoạt tính giống chymotrypsin _
cùa proteasom 268 trong tế bảo động vật có vú. Proteasom 268 là một phức hợp protein lớn lảm thoái biến
protein ubiquitin. Con đường ubiquitin-proteasom đóng vai trò thiết yếu trong điều hòa nồng độ nội bảo của
cảc protein đặc hiệu, do đó duy trì cân bằng nội mô bên trong tế bảo. Ức chế cùa proteasom 268 ngăn chặn
sự phân giải cảc protein đích mã có thể ảnh hưởng dòng thảc tín hỉệu bên trong tế bảo, cuối cùng dẫn đến
gây chết tế bảo ung thư.
Bortezomib là chất ức chế proteasom có tính chọn lọc cao vả có hồi phục. Quá trình ức chế proteasom
bởi tác động lên cảc tế bảo ung thu theo một số cách, bao gồm, thay đối các protein diều hòa, kiếm soát
tiến triển chu kỳ tế bảo và kích hoạt cảc yếu tố hạt nhân kappa B (NF—kB). sự ức chế proteasom dẫn tới
lảm ngừng chu trình tế bảo và tế bảo chết theo chương trình. NF-kB là một yếu tố phiên mã mà hoạt
động cùa nó là cần thiết cho nhiều mặt của quá trình tạo khối u, bao gồm sự sống sót và tăng trưởng tế
bảo, sự tạo mạch, sự tương tác tế bảo—tế bảo, và di căn. Trong u tùy, bortezomib ảnh hưởng đến khả
nảng cùa cảc tế bảo u tủy đề tương tác với vi môi trường tùy xương.
Kinh nghiệm đã chứng minh rằng bortezomib là gây độc cho 1 loạt tế bảo ung thư và tế bảo ggg _thư_nhạỵ
cảm hon với cảc ảnh hướng tiền chết theo chương trình cùa chất ức chế proteasom hơn các tế bảo bình
thường. Bortezomib lảm giảm sự phát triển khối u in vivo trong nhiều mô hình khối u tiền lâm sảng, bao
gồm đa u tủy.
Dữ liệu từ in vítro, ex-vỉvo vả cảc mô hình động vật với bortezomib cho thấy nó lảm tăng sự biệt hóa và
hoạt động cùa tạo cốt bảo và ức chế chức năng hùy cốt bảo. Những ảnh hướng nảy dã được quan sát thấy ớ
nhũng bệnh nhân đa u tủy bị ảnh hướng bởi một bệnh hùy xương tiến triền và được điều trị bằng
bortezomib.
DƯỢC ĐỌNG HỌC /
Hấp thu
Sau khi tiêm bolus tĩnh mạch liều 1,0 ngm² và 1,3 mg/m² cho 11 bệnh nhân bị đa u tùy vả giá trị độ thanh
thải lớn hơn 50 ml/phút nồng độ trong huyết tương tối đa trung bình sau liều đầu tiên cùa bortezomib tương
ứng lả 57 vả 112 ng/ml. Những liều sau đó, nồng độ tối đa trung bình q2uan sát được trong khoảng từ
67 đền 106 nglml cho liều 1,0 ngm2 vả 89 đến 120 nng cho liều 1,3 mg/m².
Sau khi tỉêm bolus tĩnh mạch hoặc dưới da liều 1,3 mg/m2 cho bệnh nhân bị da u tùy (n = 14 trong nhóm
tiêm tĩnh mạch, n = 17 trong nhỏm tiêm dưới da), tồng nồng độ toản thân sau khi dùng liều lặp lại (diện tích
dưới đường cong cuối cùngAUCcuối) là tương đương nhau ở nhóm tiêm dưới da và tiêm tĩnh mạch. Nồng
độ tối đa Cmax sau khi tiêm dưới da (20.4 ng/ml) thấp hơn so với tiêm tĩnh mạch (223 ng/ml). Tỷ số trung
bình nhân cua AUC…Ổ, là 0,99 vả với khoảng tin cậy 90% là 80,18% -122,80%.
Phân bổ
Page 1 of 19
Thể tích phân bố tmng bình (vd) của bortezomib trong khoảng từ 1659 1 đến 3294 1 sau khi tiêm tĩnh mạch
liều đơn hoặc liều lặp lại 1,0 mg/m² hoặc 1,3 ngm² cho bệnh nhân bị đa u tủy. Điếu nảy cho thấy
bortezomib phân bố rộng rãi tới các mô ngoại vi. Trong khoảng nổng độ của bortezomib 0,01 tới 1,0 ụg/ml,
liên kết với protein trong huyết tương người ín vitro trung bình là 82,9% . Liên kết của bortezomib với
protein huyết tương không phụ thuộc nồng độ.
Sinh chuyển hóa
Cảo nghỉên cứu in vilro với microsom gan người và các isozym cytochrom P450 chỉ thị cDNA người
chỉ ra rằng bortezomib được chuyến hóa oxi-hóa chủ yếu qua enzym cytochrom P450, 3A4, 2C19, vả
1A2. Con đường chuyến hóa chính là khử boron để hình thảnh hai chất chuyển hóa, sau đó trải qua quá
trình hydroxyl hóa thảnh một số chất chuyển hóa. Cảo chất chuyển hóa của bortezomib đã được khử
boron không có hoạt tính ức chế proteasom 268.
T hải trừ
Thời gian bán thải (tuz) trung bỉnh của bortezomib đa liếu dao động trong khoảng từ 40-193 giờ.
Bortezomib được thải trừ nhanh hơn sau liều đầu tiên so với những liều tiếp theo. Độ thanh thải toản
thân trung bình tương ứng là 102 tới 1 12 lít/giờ đối với các liều đầu tiên tương ứng là 1,0 mg/m2 và 1,3
mg/m², và trong khoảng 15 … 32 lít/giờ và 18-32 lít/gỉờ sau khi dùng các liều tiếp tương ứng là 1,0
mg/m2 và 1,3 mg/m2
Các đối tượng đặc biệt
Suy gan
Ành hưởng của suy gan trên dược động học của bortezomib đã được đảnh giả trong nghiên cứu pha 1
trong chu kỳ điều trị đầu tiên, bao gồm 61 bệnh nhân chủ yếu với khối u rắn và các mức độ khảc nhau
của tổn thương gan ở mức lỉều bortezomib trong khoảng 0,5 đển 1,3 mg/mz.
Khi so sánh với bệnh nhân chức năng gan bình thường, suy gan nhẹ không lảm thay đổi AUC cùa
bortezomib mức liều bình thường. Tuy nhiên, giá trị AUC trung bình cùa bortezomib mítchềmbinh
thường tăng khoảng 60% ở những bệnh nhân suy gan vừa hoặc nặng. Ở những bệnh nhân suy gan nặng
hoặc vừa được khuyến cảo dùng liều khởi đầu thấp hơn và những bệnh nhân nảy nên được theo dõi chặt
chẽ.
Suy thận
Nghiên cứu dược động học dược thực hiện trên những bệnh nhân với các mức độ suy thận khác nhau,
được phân Ioại theo giá trị thanh thải creatinin (CLCr):
Bình thường (CLC, a 60 ml/phút/l,73 m², n = 12), nhẹ (CLCr = 40-59 ml/phút/l,73 m², n = 10), trung bình
(CLCr = 20-39 ml/phútl 1,73 m², n = 9), và nặng (CLCr < 20 ml/phút/ 1,73 m², n = 3). Một nhóm bệnh nhân
lọc máu được định liều sau khi lọc mảu cũng được bao gồm trong nghỉên cứu (n=18). Bệnh nhân được tiêm
tĩnh mạch bortezomib liều 0,7 đến 1,3 ngm² hai lần mỗi tuần. Nồng độ của bortezomib (C,… và AUC ở
mức liều bình thường) là tương đương giữa các nhóm.
T uồi
Dược động học cùa bortezomib được biếu hiện sau khi tiêm bolus tĩnh mạch hai lần một tuầnliều…lằ
ngm² cho 104 bệnh nhi (tuổi từ 2-16) bị bệnh bạch cầu cấp tính nguyên bảo lympho (ALL) hoặc bệnh
bạch cầu myeloid cấp tính (AML). Dựa trên phân tích dược động học dân số. độ thanh thải cùa
bortezomib tăng cùng với sự gia tăng diện tích bề mặt cơ thể (BSA). Trung bình hình học (% CV) của
độ thanh thải là 7,79 (25%) L/giờ/m², thể tích phân bố 0 trạng thải ổn định là 834 (39%) L/m², vả nứa
đời thải trừ là 100 <44%) giờ. Sau khi hiệu chinh ảnh hướng của BSA, nhân khẩu học khác như tuối tảc,
trọng lượng cơ thế và giới tính không có tảc dụng đảng kể về mặt lâm sảng về độ thanh thải cùa
bortezomib. Độ thanh thải bình thường hóa BSA của bortezomib ở bệnh nhi là tương tự như ở người
lớn.
Page 2 of 19
\
"/- ULN Không
› 1,0 x-1,5 x ULN Bẫt kỳ Không
Trung bình > 1,5 x-3x ULN Bất kỳ Giảm liều còn 0,7 mg/m²
› 3 x ULN Bất kỳ trong chu kỳ điều trị đầu tiên.
Xem xét tãng lên đến
1,0 mg/m2 hoặc giảm liều
thấp hơn xuống-— còn 2 -
0,5 mg/m2 trong các chu kỳ
tiếp theo dựa trên mức độ
dung nạp cùa bệnh nhân.
Tù viết tắt: SGOT - glutamic oxaloacetic transaminase trong huyết thanh; AST - aSpartatc aminotransferasc;
ULN — cao hơn giới hạn bình thưòng.
* Dựa trên phân nhỏm nhóm cơ quan mất chức nãng NCI cho sự phân loại suy gan (nhẹ, trung bình, nặng)
Suy thận
Dược iực học của bortezomib không bị ảnh hưởng cho bệnh nhân suy thận nhẹ tởi trung bình (Độ thanh thái
creatinin (CLCT) > 20 ml/phút/l ,73 m²); do đó, điều chinh liều lá không cần thiết cho những bệnh nhân nảy.
Dược lực học của bortezomib bị ảnh huởng trên bệnh nhân suy thận nặng không lọc mảu
(CLCr < 20 ml/phút/l ,73 m²) chưa được biết. Lọc máu có thể lảm giảm nồng độ bortezomib, vì vậy nên
dùng bortezomib sau khi lọc mảu. _ ~ — 2_
Bệnh nhi
Tinh an toản và hiệu quả của bortezomib trên tre' em dưới 18 tuổi vẫn chưa được thiết lập. Không có dữ liệu
sẵn có.
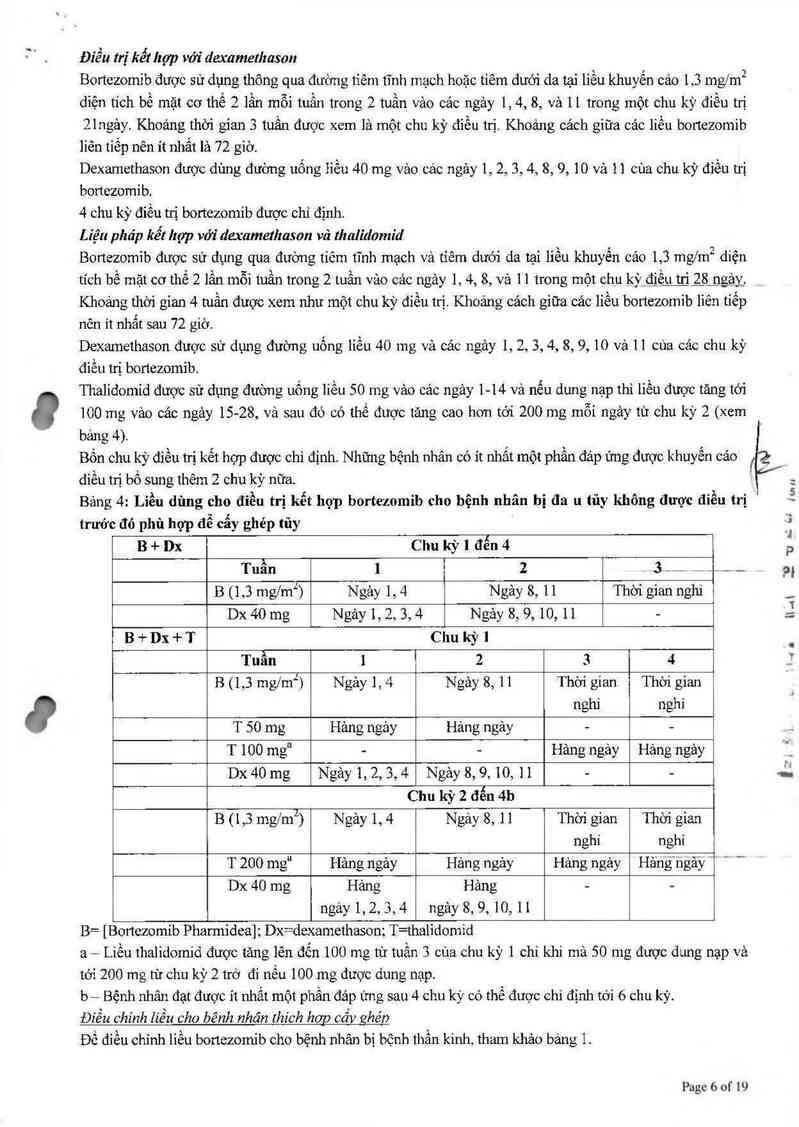
Cách dùng
Bortezomib sử dụng cho tiêm tĩnh mạch và tiêm dưới da
Bortezomib không được sử dụng cho cảc đuờng khảo.
Dùng tiêm tủy sống sẽ dẫn đến tư vong.
Tiêm tĩnh mạch
Page 7 of 19
\ b'NỔỊ I`u
v
K
| \\
:.
*.Atzs
`:`
Dung dịch hoản nguyên bortezomib 3,5 mg được sử dụng tiêm bolus tĩnh mạch trong 3-5 giây qua catheter
tĩnh mạch trung tâm hoặc ngoại biên sau đó tráng lại với đung dịch tiêm natri chlorid 9 mg/ml (0,9%).
Khoảng cảch giữa cảc lỉều bortezomib liên tiếp nên ít nhất là 72 gìờ.
T iêm dưóư' da
Dung dịch hoản nguyên 3,5 mg bortezomib được dùng tiêm dưới da đùi (trải hoặc phải) hoặc bụng (trái
hoặc phải). Dung dịch cần tiêm dưới đa 1 góc 45-900. Vị trí tiêm nên được luân chuyến cho lần tiêm kế tiếp.
Nếu xuất hiện phản ứng tại vị trí tiêm thuốc sau khi tiêm dưới da bortezomib, dung dịch bonczomib nồng độ
thấp (Bmtezomib nồng độ 3,5 mg được pha loãng tới 1 mng thay vì 2,5 mg/ml) có thế được dùng tiêm
tĩnh mạch hoặc chuyền sang tiêm tĩnh mạch được khuyến cảo.
cưórgc CHỈ ĐỊNH , ` ,
Quá mân với bortezomib, boron hoặc bât cứ thảnh phân nảo cùa thuôc.
Bệnh mảng ngoải tim và bệnh phối thâm nhiễm lan tòa cấp tinh.
Khi bortezomib được sử dụng kết họp với các thuốc khác, tham khảo tóm tắt đặc tính sản phẩm của cảc
thuốc đó cho chống chỉ định bổ Sung. , 2
CẢNH BÁO VÀ THẬN TRỌNG ` ' . _ .
Khi bortezomib được kêt hợp với cảc sản phâm thuôc khảo, tóm tăt đậc tính sản phâm của các thuôc nảy
phải được tham khảo trưởc khi bắt đầu điều trị với bortezomib. Khi thalidomid được sử dụng, đặc biệt chú ý
kiểm tra mang thai và yêu cầu tránh thai cẳn thiết.
Dùng tỉẽm tủy sổng
Đã có trường hợp tử vong do vô ý đùng bortezomib theo đường tiêm tủy sống. Bortezomib chỉ được dùng
theo đường tiêm tĩnh mạch hoặc dưới da. Bortezomib không được dùng tiêm tủy sống.
Độc tính tiêu hóa
Độc tính tiêu hóa, bao gồm nôn, tiêu chảy, buồn nôn và táo bón lả rắt phổ biến khi điều tư với bortezomib.
Cảo trưòng hợp tắc ruột được báo cảo là không phổ biến. Do đó, bệnh nhân có tiền sử tảo bón cần được theo
dõi chặt chẽ.
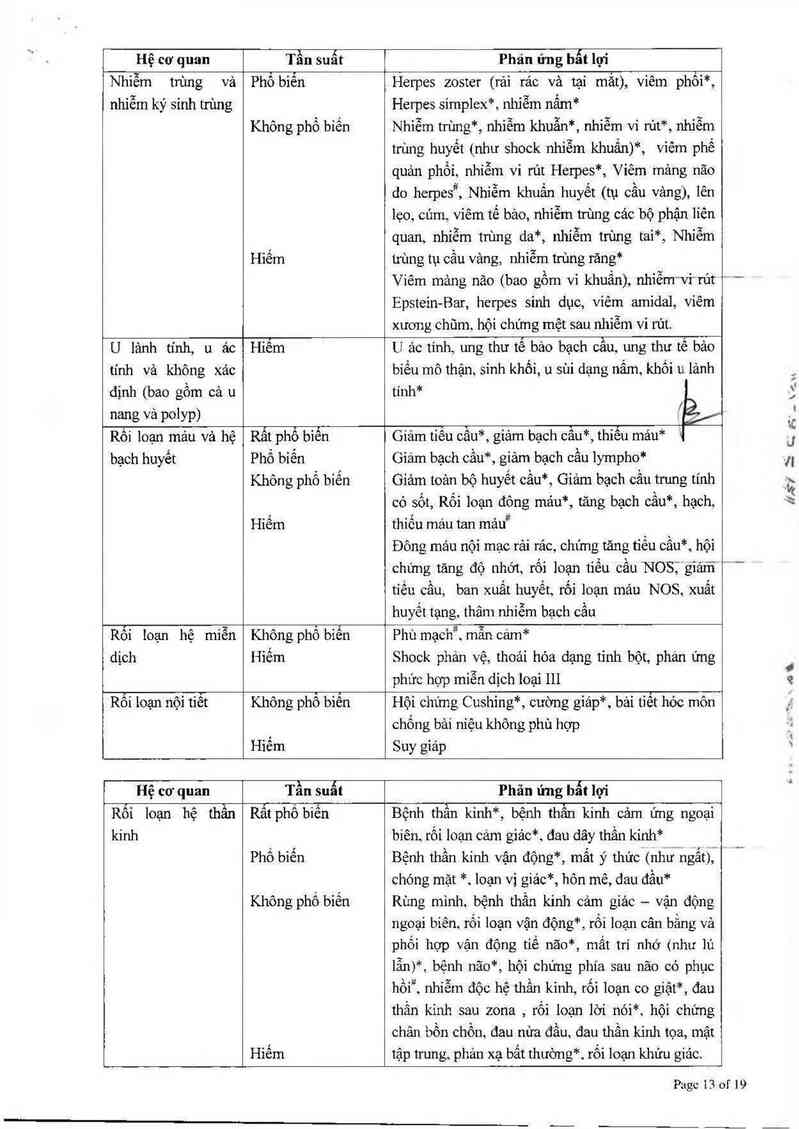
Độc lính huyết học
Điều trị với bortezomib liên quan với độc tinh huyết học là rất phổ bíến (gìảm tỉểu cầu, giảm bạch cầu vả
thiếu máu). Trong đảnh giá nghiên cứu gíai doạn III bortezomib (đưòng tiêm tĩnh mạch) so với
dexamethason, độc tinh huyết học phổ biến nhất là giảm tiểu cầu thoảng qua. Trong pha II cùa nghiên cứu,
tiếu cầu it nhất ở ngảy thứ 11 của mỗi chu kỳ điều trị bortezomib. Không có bằng chứng về giám tiếu cầu
tích lũy, kể cả trong nghiên cứu pha 11 mở rộng. Số lượng tiếu cằu thấp nhẳt đo được trung binh khoảng
40% mức cơ bản. Ở nhũng bệnh nhân đa u tủy tíến triển mức độ nghỉẽm trọng cùa giảm tiễu cầu liên quan
đến số lượng tiểu cầu trước khi điều trị: ở số lượng tiểu cầu ban đầu < 75000/ư1, 90% của 21 bệnh nhân có
số lượng 5 25000/ụ] trong khi nghiên cún, trong đó có 14% < 10000l 111; ngược lại, với số lượng tiếu cầu ban
đầu › 75000/ư1, chi 14% của 309 bệnh nhân có số lượng tiểu cầu 5 25x10971 trong khi nghiên cửu.
Số lượng tiếu cầu cần được theo dõi chặt chẽ trước mỗi liều điều trị bortezomib. Cần ngừng điều ttị với
bortezomib khi số lượng tiểu cầu < 250001ư1 hoặc khi kết hợp với melphalan vả prednison khi số lượng tiêu
cầu 5 30000/ụ1 và bắt đầu điều trị lại tại mức lìều giảm sau khi tỉếu oầu tăng. Lợi ích tiềm năng của diều trị
cẳn được cân nhắc cấn thận ngăn ngừa rủi ro, đặc biệt trong trường hợp giảm tiếu cấu trung binh đến nặng
và các nhân tố nguy cơ chảy mảu.
Do độ, số lượng máu toản phần (CBC) với khả năng thay đối và bao gồm cả số lượng tiếu cầu cần được theo
dõi thưởng xuyên trong suốt quá trình điều t1ị vởi bortezomib.
Ví rút Herpes zoster tái hoạt động
Dự phòng vi rủt cần được xem xét ở những bệnh nhân đang điều trị với bortezomib. Trong pha III cùa
nghiên cứu. ở những bệnh nhân bị đa u tùy chưa được điều trị trước dó, tỷ lệ tái hoạt động cùa vi rút Herpes
Page 8 of 19
IhJ,
zoster đường mỉệng phổ biến hơn ở những bệnh nhân điều trị với Bortezomib + Mephalan + Prednison so
với Mephalan + Prednison (tương ứng 14% so với 4%).
Chẩt trắng não đa ổ tiến triển (PML)
Rắt hiếm các trường hợp với quan hệ nhân quả chưa được biết cùa lây nhiễm vi rút John Cunningham (JC)
dẫn đến PML và tử vong, dã được báo cảo ở những bệnh nhân điều trị với bortezomib. Bệnh nhân được
chấn đoản bị PML đã hoặc đang động thời có điều trị ức chế miễn dịch.
Phằn lớn cảc trường hợp của PML được chẳn đoản trong vòng 12 tháng của liều bortezomib đầu tiên.
Những bệnh nhân nảy cần được theo dõi chặt chẽ định kỳ cho bất kỳ tiiệư chứng thằn kinh mới hoặc xấu đi
hoặc cảc dấu hiện có thể gợi ý cùa PML như một phần của chấn đoán phân biệt của cảc vấn đề về hệ thần
kỉnh trung ương (CNS). Nếu ] chấn đoản PML bị nghi ngờ, cẩn tham khảo chuyên gia PML vả nhĩmg biện
đoán. _ _ 7 _
Thẩn kỉnh ngoại biên
Điều trị với bortezomib liên quan đến bệnh thần kinh ngoại biên rất phổ biến, chủ yếu là cảm giác. Tuy
nhiên, cảc trường hợp bệnh thần kinh vận động nghiêm trọng kèm hoặc không kèm theo bệnh thần kinh
ngoại biên cảm giảc đã được bảo cáo. Tỉ lệ bệnh thần kinh ngoại biên tăng sớm trong quá trình điều trị
và đã được quan sảt đạt đinh trong chu kỳ 5.
Bệnh nhân được khuyến cáo theo dõi chặt chẽ những triệu chứng thần kinh như cảm giác bòng rát, tăng
cảm, giảm cảm giảc, dị cảm, bất an, dau thần kinh hoặc ốm yếu.
Trong pha II của nghíên cứu so sánh sử dụng bortezomib đường tiêm tĩnh mạch so với tiêm dưới da, tỷ lệ
biến chứng bệnh thần kinh ngoại biên mức độ 2 là 24 % cho nhóm tiêm dưới da và 41 % cho nhóm tiêm
tĩnh mạch (p = 0,0124). Bệnh thần kinh ngoại biên mức độ ì 3 xuất hiện ở 6% bệnh nhân trong nhóm điều
trị đường tiêm dưới da so với 16 % nhóm điều trị đường tỉêm tĩnh mạch (p = 0,0264). Tỷ lệ của tất cả cảc
mức độ bệnh thần kinh vởi điều trị boưezomib đường tĩnh mạch 1ảthấp hơn trong lịch sử nhđng_nghien cú;u
sử dụng bortezomib tĩnh mạch so với nghiên cứu MMY—302l.
Bệnh nhân có tiền sử bệnh lý thần kinh mới hoặc xắn đi nên được đảnh giả thần kinh vả có thế cần thay đối
liều, kế hoạch hoặc đường dùng thảnh tiêm dưới da. Bệnh thần kinh có thể được kiếm soát với biện pháp
chăm sóc hỗ trợ hoặc đỉềư trị khảc.
Kiếm soát thường xuyên và sởm triệu chứng của điều mị cấp cứu bệnh thần kinh với sự đảnh giả thần kinh
nên được xem xét ở những bệnh nhân điều trị với bortezomib kểt hợp với cảc sản phẩm thuốc liên quan
đến bệnh thần kinh (như thalidomid) và giảm liều thích hợp hoặc ngừng điều trị cần được xem xét.
Ngoài bệnh lý thần kinh, có thể góp phần vảo bệnh thần kinh tự động một số phản ứng bất 1ợi như hạ huyết
áp tư thế và tảo bón nặng với tắc ruột. Thông tin về bệnh thần kình tự động và sự góp phần cùa nó vảo
nhũng tảc dụng không mong muốn là giới hạn.
Co giật
Chứng co gìật được bảo cáo không thường xuyên ở bệnh nhân không có tiền sử co giật hoặc động kinh.
Cần quan tâm đặc biệt tới bệnh nhân đang điều trị khi có bất kỳ yểu tố nguy co co gìặt nảo.… _ _ _ - …_
Hạ huyết áp
Điểu trị với bortezomib liên quan với hạ huyết ảp tư thế 1ả phổ biến. Hầu hết cảc tảc không mong muốn
là nhẹ đến vừa và được quan sảt thấy suốt thời gian điều trị. Bệnh nhân bị hạ huyết áp tư thế đứng trên
bortezomib (tiêm tĩnh mạch) không có bầng chứng bị hạ huyết ảp tư thế trước khi điều trị với
bortezomib. Phần lớn bệnh nhân cần đỉềư trị hạ huyết áp tư thế đứng. Một phần nhỏ trong số các bệnh
nhân bị hạ huyết áp tư thế từng bị ngất. Hạ huyết áp tư thế đứng không liên quan chặt chẽ vởỉ truyền
tĩnh mạch bolus bortezomib. Cơ chế cùa những tác dụng nảy chưa được biết mặc dù một phần có thể do
bệnh thần kinh tự động. Bệnh thần kinh tự dộng có thể liên quan đến bortezomib hoặc bortezomib có
thể lảm trầm trọng thêm tình trạng có sẵn như tiều đường hoặc bệnh thần kinh do thoải hóa tinh bột.
Page 9 of 19
nu Zr a/
\\ …
\UJ.~
Cần thận trọng khi điều trị với bệnh nhân có tiền sử ngất dang sử dụng cảc thuốc có liên quan đến hạ
huyết ảp, hoặc người bị mất nước do mới bị nôn hoặc tiêu chảy. Kiểm soát hạ huyết ảp tư thế có thế bao
gồm điều chỉnh cảc thuốc chống tăng huyết ảp, bù nước hoặc dùng mineralocorticosteroid vả/hoặc giao
cảm. Bệnh nhân cần được hướng dẫn để tìm kiếm tư vấn y khoa nếu họ có triệu chứng chóng mặt,
choáng hoặc ngất xỉu cơn ngắn.
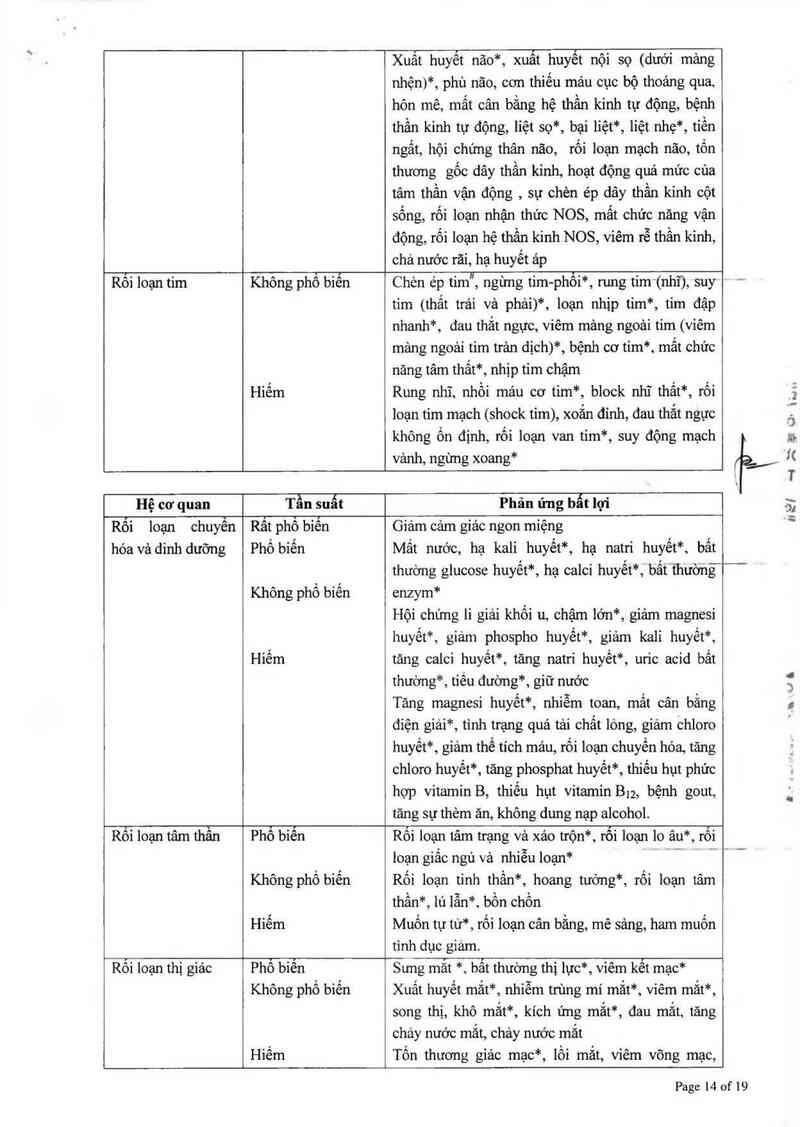
Hội chửng tổn thương não phía sau có thể hồi phục (PRES)
Đã có các báo cáo của hội chứng PRES ở bệnh nhân điều trị với bortezomib. Hội chứng PRES lả một
bệnh lý thần kinh hỉếm gặp, tiến triển nhanh và thường có khả năng phục hồi, có thế có các biểu hiện
như động kinh, cao huyết áp, đau đầu, hôn mê, Iú lẫn, mù, rối loạn thị giác và thằn kinh Hinh ảnh não
chụp cộng hướng từ (MRI) được sử dụng để xác nhận chẩn doán Ở những bệnh nhân phát triển PRES,
cần ngừng điều trị với bortezomib “
Suy tỉm
Sự phảt triển cấp tính hoặc trầm trọng thêm của suy tim sung huyết, vải hoặc giảm phân suất tống máu
thất trái đã được bảo các trong khi điều trị với bortezomib. Giữ nước có thể lả một dấu hiệu và triệu
chứng dẫn đến suy tỉm. Những bệnh nhân có yếu tố nguy cơ hoặc bệnh tim cần được theo dõi chặt chẽ.
Khảo sát điện tâm đồ
Đã phát hiện được các trường hợp cá biệt kéo dải khoảng QT trên nghiên cứu lâm sảng, tuy nhiên quan
hệ nhân quả chưa được thiết lập.
Rối Ioạn chức năng phổi
Hiếm có các báo cáo của bệnh phối thâm nhiễm lan tỏa cấp tính không rõ nguyên nhân như: viêm thảnh
phế nang, viêm phổi kẽ, thâm nhiễm phổi và hội chửng suy hô hấp cấp (ARDS) ở bệnh nhân diều trị với
bortezomib. Một số trong những trường nảy hợp đã tư vong. Chụp X-quang lồng ngực trước khi điều trị
được khuyến cảo để xác dịnh xem có cẩn thêm cảc biện phảp chẩn đoán và như một cơ sở cho những
khả năng thay dối chức năng phổi sau điều trị. “ "Ý”
Trong trường hợp xuất hiện các triệu chứng mới hoặc xắu đi (ví dụ như ho, khó thờ), một chân đoản
đảnh giả kịp thời cần được thực hiện vả điều trị thích hợp cho bệnh nhân.Tỷ lệ lợi ich/ nguy cơ nên
được xem xét trước khi tiếp tục điều trị với bortezomib.
Trong một thử nghiệm lâm sảng, hai bệnh nhân (trong số 2) được điều trị cytarabin liều cao (2 g/m2 mỗi
ngảy) bằng cách truyền liên tục trong hơn 24 giờ với daunorubícin vả bortezomib để tải phát bệnh bạch cầu
nguyên tùy bảo cấp tử vong do ARDS trong giai đoạn đầu cùa điểu trị và nghiên cứu kết thủc. Do đó, chế độ
trị liệu đặc biệt nảy với điều trị kết hợp liều cao cytarabin (2 g/m2 mỗi ngảy) bầng cảch truyền liên tục trong
hơn 24 giờ không được khuyến cảo.
Suy thận \
Biến chứng thận thường gặp ở bệnh nhân đa u tủy. Bệnh nhân suy thận nên được theo dõi chặt chẽ.
Suy gan J
Bortezomib được chuyền hóa bới các enzym ở gan. Nồng dộ của bortezomib tăng lên ở những nh
nhân suy gan vừa hoặc nặng.Vì vậy, cần giám liều và theo dõi chặt chẽ độc tính ở những bệnhnhẩn
nảy.
Phản ứng gan
Trường hợp hiếm cùa suy gan đã được bảo cảo ở bệnh nhân điều trị đồng thời với bortezomib vả nhiều
loại thuốc khảo và với cảc bệnh lý tiềm ấn nghiêm trọng. Các phán ứng gan khảo được bảo cảo bao gồm
tãng enzyme gan. tăng bilirubin mảu, và viêm gan. Những thay đồi nảy có thể phục hồi sau khi ngừng
bortezomib.
Hội chứng ly giải khổi u
Bới vì bortezomib là một tảc nhân gây độc tế bảo và có thể nhanh chóng tiêu diệt tế bảo huyết tương ác
tính, do đó các biến chứng của hội chứng ly giái khối u có thể xảy ra. Bệnh nhân có nguy cơ bị hội
Page 10 of 19
i )
chứng ly giải khối u là những người có khối u lớn trước khi điều trị. Những bệnh nhân nảy cần được
theo dõi chặt chẽ và có biện phảp phòng ngừa thích hợp.
Các thuốc kết họp
Bệnh nhân cằn được theo dõi chặt chẽ khi được điều trị với bortezomib kết hợp với các thuốc có khả
năng ức chế mạnh CYP3A4. Cần thận trọng khi bortezomib được kết hợp với cảc chất nền CYP3A4
hoặc CYP2C 1 9.
Cần xảc nhận chức năng gan bình thường vả thận trọng ở những bệnh nhân dùng thuốc hạ glucose
huyết hypoglycemic đường uống.
Các phăn ứng qua trung gian phức họp miễn dịch
Cảo phản ửng qua trung gian phức hợp miễn dịch như phản ứng kiến bệnh huyết thanh, viêm đa khớp
với phảt ban và viêm cầu thận tăng sinh được bảo các không thường xuyên. Nên ngừng điều trị với
bortezomib nếu cảc phản ứng nghiêm trọng xảy ra.
có THAI VÀ cnc CON BÚ
Biện pháp tránh thai ở nam và nữ
Bệnh nhân nam và nữ có khả năng sinh con phải có biện phảp tránh có hiệu quả trong và sau 3 thảng sau khi
điều trị
Mang thai
Không có dữ liệu lâm sảng sẵn có về phơi nhiễm với bortezomib trong khi mang thai. Khả năng gây quái
thai của bortezomib vẫn chưa được khảo sảt.
Trong cảc nghiên cứu tiền lâm sảng, bortezomib không ảnh hưởng lên sự phảt triển bảo thai ở chuột và thỏ ở
cảc liều được dung nạp cao nhất ở mẹ. Những nghiên cứu trên dộng vật để xác định ảnh hướng cùa
bortezomib trên sự sinh sản và sự phát triền sau khi sinh chưa được thực hiện. Bortezomib không được sử
dụng trong khi mang thai trừ khi tình trạng lâm sảng của người mẹ cần điều tn“ với bortezomib. Nếu
bortezomib được sử dụng trong khi mang thai, hoặc nếu bệnh nhân bắt đầu mang thai trong khi đang đỉều trị
với bortezomib, bệnh nhân cần được thộng báo những nguy hiếm tiềm ấn đối với thai nhi.
Thalidomid được biết là hoạt chất gây quái ở ngưòi thai người mà gây di tật bấm sinh đe dọa nghiêm trọng
cuộc sống. Thalidomid chống chỉ định trong khi mang thai và ở phụ nữ có khả năng mang thai trừ khi tất các
điều kiện của Thailidomid Celgene Pregnancey Prevention Programme được đáp ứng. Những bệnh nhân
điều trị với bortezomib kết hợp với thailidomid cần tôn trọng triệt để chương trình trảnh thai cùa thalidomid.
Tham khảo tóm tắt đặc tính sản phẩm của Thailidomid để bỉết thêm thông tin.
Cho con bú
Không được biết bortezomib có bải tiết qua sữa mẹ hay không. Bởi vì những tảc dụng không mong muốn
nghiêm trọng có khả năng ảnh hướng đến trẻ bú sữa mẹ, cần ngưng cho con bú trong khi điều trị với
bortezomib.
Khả năng sình sản
Những nghiên cứu trên khả năng sinh sản không được thực hiện với bortezomib. _ — - _ —- ~
ÁNH HƯỞNG T_RÊN KHẢ NĂNG LÁ! XE VÀ VẶN HÀNH MÁY MÓC
Bortezomib có thẻ ảnh hưởng vừa phải trên khả năng lái xe và vận hảnh máy móc. Bortezomib thường
gây mệt mới. chóng mặt, đội khi ngất, thường xuyên hạ huyết ảp tư thế và giảm thị lực. Do đó, bệnh
nhân phải thận trọng khi lảì xe hoặc vận hảnh mảy móc.
TƯỚNG TÁC THUỐC
Những nghiên cứu in vitro chi ra rằng bortezomib ửc chế yếu P450 (CYP) trên các
isozym 1A2, 2C9, 2C19, 2D6 vả 3A4. Dựa trên tỷ lệ thấp (7%) của CYP2Dô tham gia trong quá trình
Page 11 of 19
.\c
Me
’—o`
/t
chuyển hóa bortezomib, chất chuyến hóa yếu dạng CYP2D6 được coi như không ảnh hưởng đến sự chuyển
hóa chung của bortezomib.
Một nghiên cứu về tương tác thuốc đánh giá ảnh hướng của ketoconazol, một chắt ức chế mạnh CYP3A4,
trên dược lực học của bortezomib (đường tiêm tĩnh mạch), đã chi ra diện tích dưới đường cong AUC tăng
trung bình 35% -
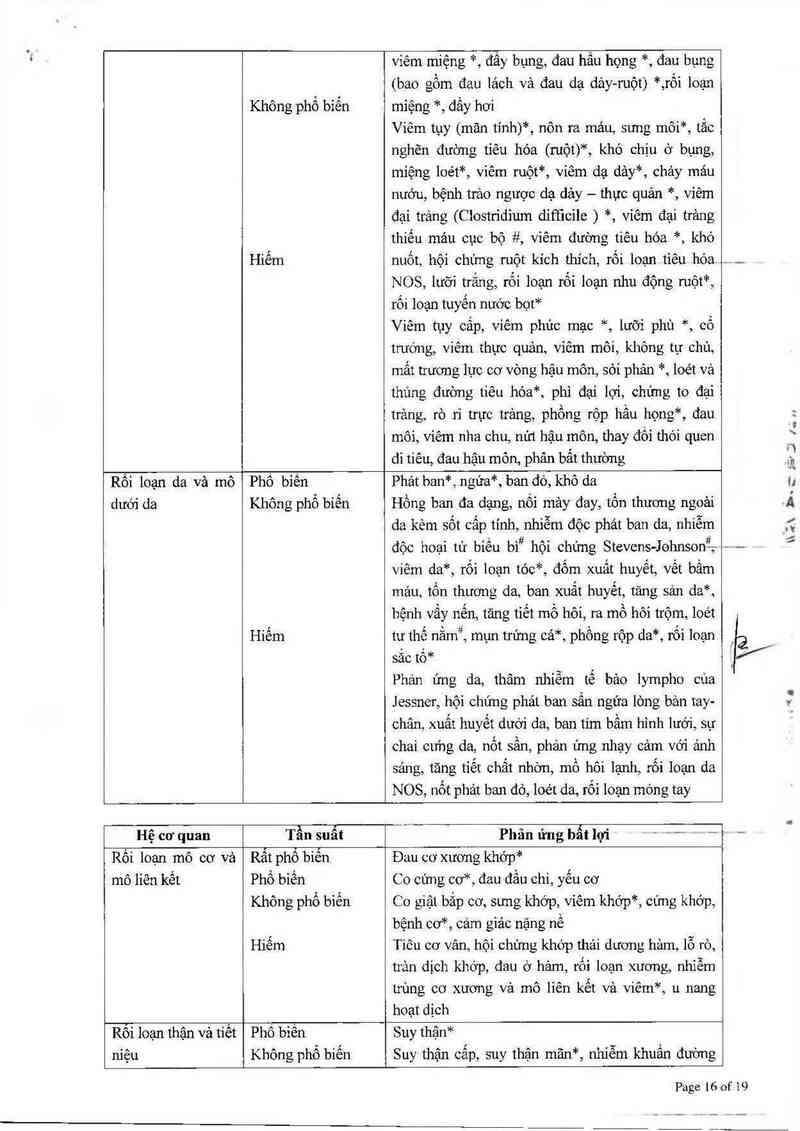
Rối loạn mô cơ vả Rất phổ biến Đau cơ xương khớp*
mô liên kết Phổ biến Co cúng cơ*, đau đầu chi, yếu cơ
Không phổ biến Co giật bắp cơ, sưng khớp, viêm khớp*, cứng khớp,
bệnh cơ*, cảm giác nặng nề
Hiếm Tiêu cơ vân, hội chưng khớp thải đượng hảm, lỗ rò,
trản dịch khớp, đau ở hảm, rối loạn xương, nhiễm
trùng cơ xương và mô lìên kết và viêm*, u nang
hoạt dịch
Rôi loạn thận và tiết Phổ biến Suy thận*
niệu Không phổ biến Suy thận cấp, suy thận mãn*, nhiễm khuẩn đường
72
.1c
Page 16 of 19
Hiếm
tiết niệu*, dấu hiệu và triệu chứng đường tiết niệu*,
đái ra máu*, bí tiếu, rối loạn tiểu tỉện*, protein niệu,
tăng ure huyết, thiểu niệu*, đải rắt
Kích thích bằng quang.
Rối loạn tuyẵ vú
và hệ sinh sản
Không phố biển
Hỉêm
Xuất huyết âm đạo, đau bộ phận sinh dục*, rễ loạn
chức năng cương dương
Rối loạn tinh hoản*, viêm tuyến tiền liệt, rối loạn
tuyến vú ở phụ nữ, mảo tinh đau, viêm mảo tinh
hoản, đau vùng chậu, viêm Ioét âm hộ.
Rối loạn bẩm sinh,
gia đình vả di
truyền
Hỉêm
Bất sán, dị tật đường tiêu hóa, bệnh vấy cớ __ __ — —
Rối loạn chung và
rôỉ loạn tại vị trí
tiêm thuôc
Rất phổ biến
Phổ bìến
Không phổ biến
Hiem
Sốt*, mệt mỏi, suy nhược
Phù (ngoại vì), ớn lạnh, đau*, khó chịu*
Nói chung suy giảm sức khỏe về thể chất*, phù
mặt*, phản ứng tại chỗ tiêm*, rối loạn niêm mạc*,
đau ngực, dáng đi mất cân bằng, cảm thấy lạnh,
thoát mạch*, biến chứng liên quan đến catheter*, sự
thay đổi chửng khảt nước*, tức ngực, cảm giảc thay
đổi nhiệt độ của cơ thể* , đau chỗ tiêm*
Tử vong (đột ngột), suy đa cơ quan, xuất huyết tại
chỗ tiêm*, thoảt vị ( khe)*, suy giảm khả năng lảnh
vết thương*, viêm, viêm tĩnh mạch tại chỗ tiêm*; '
đau ngực không liên quan dến tim, khó chịu, loét,
đau nhẹ, đau tại vị tn' catheter, cảm giác của cơ thể
đi mượn
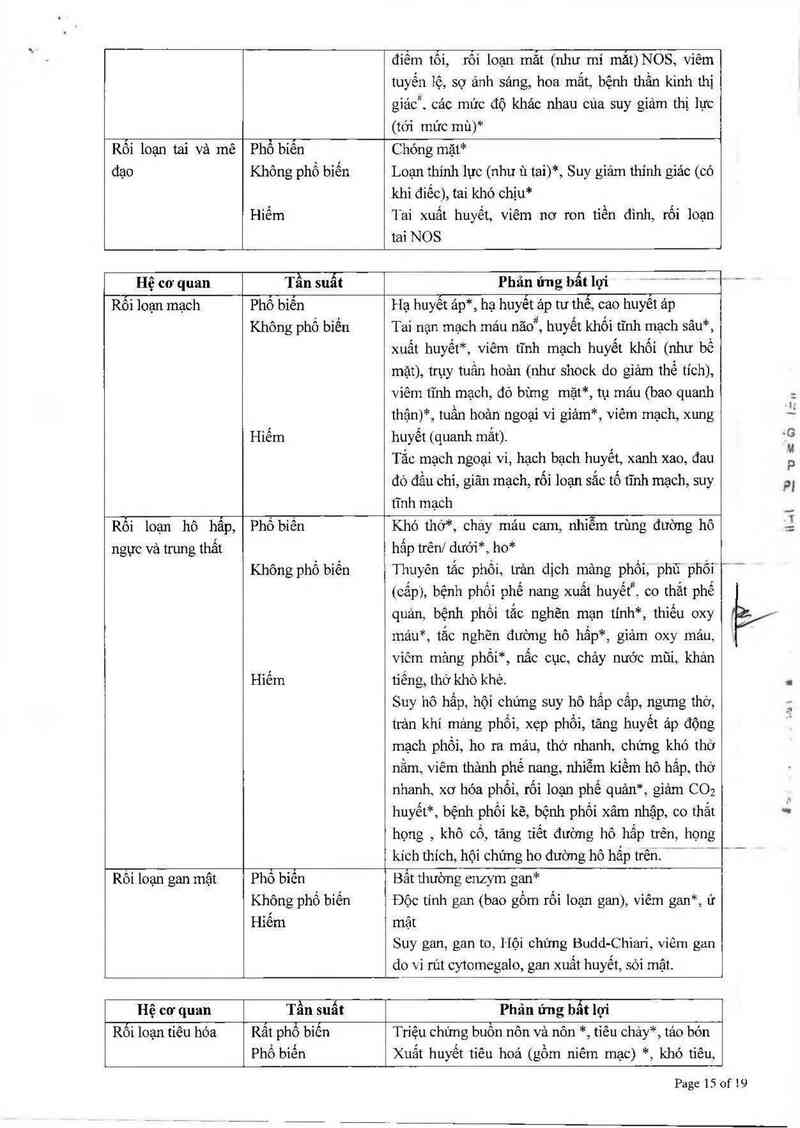
Hệ cơ quan
Tần suất
Phản ửng bẩt lợi
Tiêu hóa
PhỈbiến
Không phố biển
Hiêm
Giảm cân
Tăng bilirubin mảu*, phân tích protein bất thường*,
trọng lượng tăng iên, xét nghiệm máu bất thường*,
protein phản ứng C tăng
Khí mảu bất thường*, điện tâm đồ bất thướng (QT
kéo dải)*, tỷ lệ chuẩn hóa quốc tế bất thường*, pH
dạ dảy giảm, kết tập tiễu cầu tăng lên, troponin 1
tăng, nhận dạng vi rủt và xét nghiệm huyễt thanhỂ '
phân tích nước tiếu bất thường*
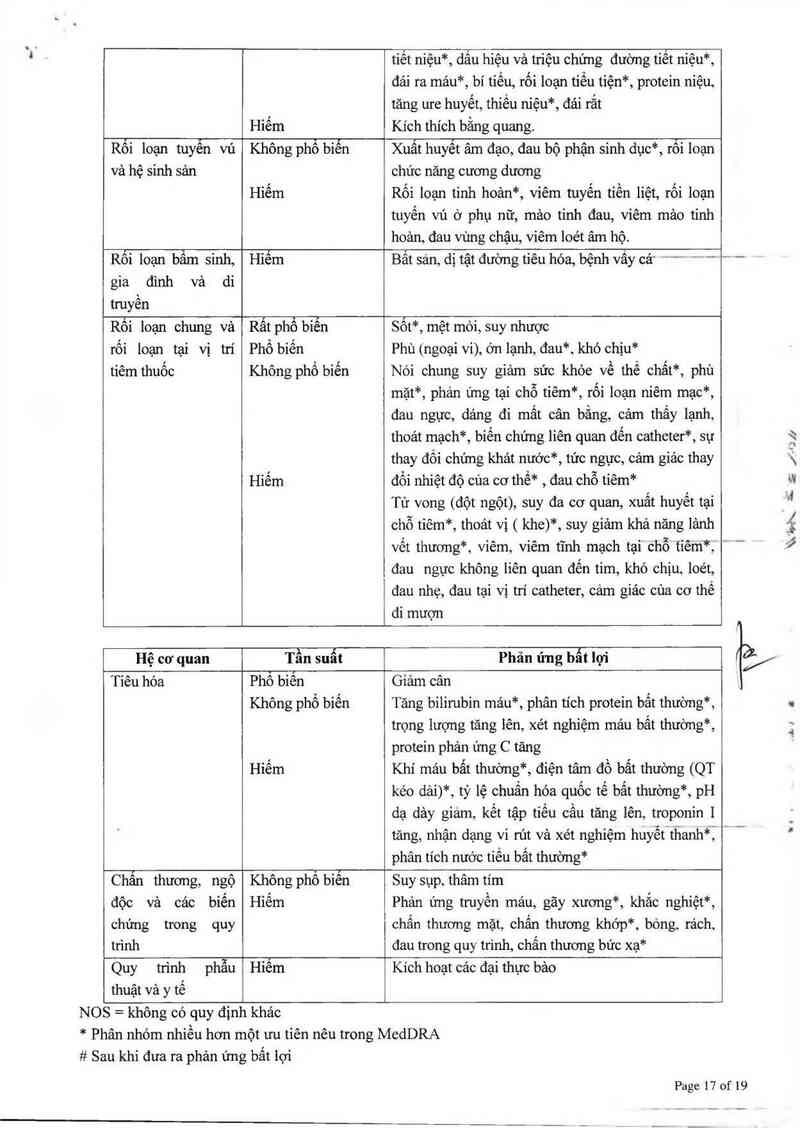
CiỈân thương, ngộ
độc vả các biển
chứng trong quy
trình
Không phổ biến
Hiếm
Suy sụp, thâm tím
Phản ứng truyền mảu, gãy xương*, khẳc nghiệt*,
chấn thương mặt, chấn thương khớp*, bóng, rách,
đau trong quy trình, chấn thương bức xạ*
Quy trình phẫu
thuật và y tế
Hiêm
Kích hoạt các đại thực bảo
\\“ìw\ S & /'-'.'ll
NOS = không có quy đinh khác
* Phân nhóm nhiều hơn một ưu tiên nêu trong MedDRA
# Sau khi đưa ra phản ứng bất lợi
Page 17 of 19
Mô tả về phản ứng bẩt lợi được lựa chọn
Vi rút Herpes zoster vỉrus tái hoạt động
Dự phòng khảng vi rủt được sử dụng cho 26% bệnh nhản ở nhóm Vc + M + P. Tỷ lệ mắc herpes zoster ở
những bệnh nhân trong nhóm điều trị Vc+ M + P là 17% đối với bệnh nhân không dùng kháng vi rút dự
phòng so với 3% đối với bệnh nhân điều trị dự phớng kháng vi rút.
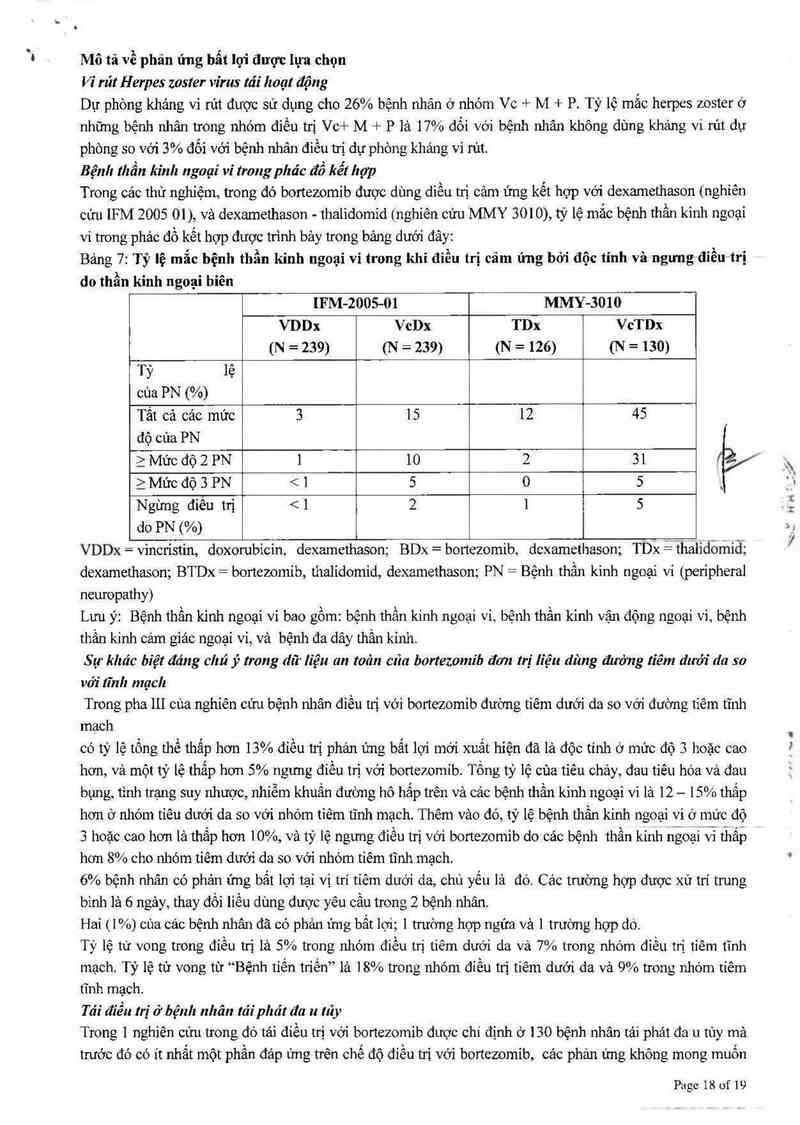
Bệnh thẩn kinh ngoại vi trong phác để kể! họp
Trong cảc thử nghiệm, trong đó bortezomib được dùng diều trị cảm ứng kết hợp với dexamethason (nghiên
cửu IFM 2005 01), và dexarnethason - thalidomid (nghiên cửu MMY 3010), tỷ lệ mắc bệnh thần kinh ngoại
vi trong phác đồ kết hợp được tn`nh bảy trong bảng dưới đây:
Bảng 7: Tỷ lệ mẩc hệnh thẩn kinh ngoại vi trong khi điều trị cảm ứng bởi độc tính vả ngưng điều trị
do thần kinh ngoại biên
IFM-ZOOS-Ủl MMY-3OIO
VDDx VcDx TDx VcTDx
(N = 239) (N = 239) (N = 126) (N = 130)
Tỷ lệ
cùa PN (%)
Tắt cả cảc mức 3 15 12 45
dộ của PN
ì Mức độ 2 PN ] 10 2 31
2 Mức độ 3 PN < 1 5 0
Ngừng điêu trị < 1 2 1
do PN (%)
VDDx = vincristin, doxorubicin, dexamethason; BDx = bortezomib, dcxamethason; TDx =Ẹthaliđomiđ:
dexamethason; BTDx = bortezomib, thalidomid, dexatnethason; PN = Bệnh thần kinh ngoại vi (peripheral
neuropathy)
Lưu ỷ: Bệnh thằn kinh ngoại vi bao gồm: bệnh thằn kinh ngoại ví, bệnh thẩn kinh vận động ngoại vi, bệnh
thần kinh cảm giác ngoại ví, vả bệnh đa dây thần kinh.
Sự khác biệt đáng chú ý trong dữ Iỉệu an torìn của bortezomib đơn trị liệu dùng đuờng iiêm dưới da so
với tĩnh mạch
Trong pha 111 của nghiên cứu bệnh nhân điều trị với bortezomib đường tiêm dưới da so với đường tiêm tĩnh
mach
có tỷ lệ tổng thể thẳp hon 13% điều tnị phản ứng bất lợi mới xuất hiện đã là độc tinh ớ mức độ 3 hoặc cao
hơn, và một tỷ iệ thẳp hợn 5% ngưng điều trị vởi bortezomib. Tống tỷ lệ cùa tiêu chảy, đau tiêu hóa và đau
hưng, tinh trạng sưy nhược, nhiễm khuẩn đường hô hấp trên và cảc bệnh thần kinh ngoại vi là 12 - 13% thấp
hơn ở nhóm tiêu dưới da so với nhóm tiêm tĩnh mạch. Thêm vảo đó, tỷ lệ bệnh thần kinh ngoại vi ở mửc độ
3 hoặc cao hơn là thấp hơn 10%, và tỷ lệ ngưng điều trị với bonezomib do cảc bệnh thần kinh ngoại vi thấfJ
hơn 8% cho nhóm tỉêm dưới da so với nhóm tiêm tĩnh mạch.
6% bệnh nhân có phản ứng bất lọi tại vị trí tiêm dưới da, chủ yếu lá đỏ. Cảc trường hợp được xử trí trung
binh lả 6 ngảy, thay đối liều dùng được yêu cầu trong 2 bệnh nhân.
Hai (1%) cùa cảc bệnh nhân đã có phản ứng bất lợi; 1 trướng hợp ngứa và 1 trường hợp dó.
Tỷ lệ tử vong trong điều trị là 5% trong nhóm điều trị tiêm dưới da vả 7% trong nhóm điều trị tiêm tĩnh
mạch. Tỷ lệ tử vong từ “Bệnh tiến triển” lả 18% trong nhóm đíếu trị tiêm đưới da và 0% trong nhóm tiêm
tĩnh mạch.
Tải điều trị ở bệnh nhân lái phát đa u tủy
Trong 1 nghiên cửu trong đó tái điều trị với bortezomib được chỉ định ở 130 bệnh nhân tái phát đa 11 tủy mà
trước đó có ít nhất một phần đảp ứng trên chế độ điều trị với bortezomib, cảc phản ứng khỏng mong muốn
Page 18 of 19
rt`n'
\.“
phổ biến nhất ớ tất cả cảc mức độ xuất hiện it nhất ở 25% số bệnh nhân là giảm tiểu cầu (55%), bệnh thần
kinh (40%), thiếu mảu (37%), tiêu chảy (35%), và táo bón (28%). Tất cả cảc mức đó bệnh thần kinh ngoại
biên và mức độ bệnh thần kinh ngoại biên 2 3 quan sảt được tương ứng ở 40% vả 8,5% cảc bệnh nhân.
Thông báo cho bác sỹ những tác dụng không mong muốn gặp phải khi dùng thuốc!
QUA LlEU
Ở những bệnh nhân quá liều nhiều hơn gấp đôi lỉều khuyến cảo có liên quan với sự khởi đầu cấp tính có
tn'ệu chửng hạ huyết ảp và giảm tiếu cầu với dẫn đến gây tử vong.
Không có thuốc giải độc đặc hiệu cho quá liều bortezomib. Trong các biến chứng quá liều, cảc dấu hiện sinh
tồn của bệnh nhân cẩn được theo dõi chặt chẽ và có các biện pháp chăm sóc hỗ trợ thích hợp để duy trì
huyết ảp (như truyền dịch, cảc chất gây tăng huyết ảp và co bóp cơ tim) vả nhiệt độ cơ thể.
TƯỚNG KY , , … ———=——
Sản phâm nảy không được trộn với các thuôc khảc ngoại trừ những thuôc được kê ra trong phân Hướng
dẫn sử dụng.
ĐÓNG GÓI
Hộp ] lọ. /
. . %;
BAO QUAN: 613
Bảo quản ớ nhiệt độ dưới 30°C. Tránh ánh sáng. , - ;) z(
Dung dịch sau khi pha bảo quản ở nhiệt độ 25°C trong vòng 8 giờ. \ `_'_*Ô
Để xa tầm tay trẻ em! Ị\\t
HẠN DÙNG:
Lọ chưa mở: Hạn dùng 36 thảng kể từ ngảy sản xuất.
Dung dịch sau khi pha: Dùng thuốc ngay sau khi pha. Nếu không dùng ngay, thời gian và điều kiện bảo
quản là trảch nhiệm cùa người dùng. Tuy nhiên, độ ổn định hóa - lý cùa dung dịch sauĨhiỉhẵtrỗiỈg—8
giờ ở 25°C được bảo quản trong lọ ban đầu và / hoặc bơm tiêm.
Không dùng thuốc đã quá hạn in trên bao bì.
TIÊU CHUẨN: Nhà sản xuất.
NHÀ SẢN XUẤT:
SlA,,Pharmidea
Rupnicu iela 4., Olaine, LV-2114, Lảt-vi-a.
TUQ. CỤC TRUỞNG
P.TRUỜNG_PHÒNG
fflẩHấễĩl vffl(2j tjẳìny
Page 19 of 19
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng