










Ắffl/gỵ
t—J
BỘ Y TẾ
cục QUẢN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
Lân dâu/ỮĨ/ẤẨJ/lỉ
Bonw '0®3 mg/3 m|
lbandronic Acid solution for i.v Injection
7ầkzda
One pre-filled syringe contains 3 mg
of ibandronic acid (as 3.375 mg of
ibandronic acid, monosodium sait.
monohydrate). sodium chloride.
glacial acetic acid. sodium acetate,
water for injections.
For i.v injection
Keep out of reach of children
l… EIÔW e ODAỊAUOS
Dosage and administration: see
package insert
m…… A1 … WM Ầwv …Jwem
Jo; uoumos Ì ppv JỊuoquequ
|… 816… E ®D/NAUOg
Store below 30°C
/Í / l
Rx SĐK: XX-XXXXX-XX
Thuốc bln theo đơn
Bonvlva
lbandronlc add 3 mgI3 ml. Hõp 1 bơm tiêm › .
_ đóng săn dung didi ne… ưnn mach. ' \
Báo quản dười 30°C. Đế xa tảm tay trẻ em. Đọc ~ `
kỹ huớng dăn sử dụng trước khi dùng. Chỉ
định. ca'dt dùng. chóng chỉ định vả rác thông tin
Imảc: xln đọc trong tờ huớng ơân sủ dụng kem
thoo. sò lô SX, NSX, HD xem LotlBatch, Mtg,
Exp trèn bno bi.
Nhã sán xuất; Vetter Pharma-Femgung GmbH
& Co KG, Eisenbahnstnsse 24. aeoas
Langenargen. Đức
Đóng gói thủ cáp vè xuất xuởng: Roche
Diagnustics GmbH, Sandholer Strasse 116,
68305 Mennheim. Đức
DNNK: xmxmxx
aịpaau uomeỊufflm g JO aõuụÁs panụ-eud [
paỊug A'I
SIN13328P
uonaaluị n 10; uqmịos pm awwtqn ị
l… £/ỐW e,,opxuuoa
-.'›
a
80er 0'
›…emuuq
3 mg [3 ml
For I.v. Inịectlon
Stum below ao'c
Innuhcmm:
Vctur Phnmt ung GmbH I. Co m.
Elanbihnstmsơ 2
oaaoas ungunrgeu. Germany
smianư scp 1p51 ap…
gg… @
@
\".-'J-~xỂ.-A .ở \
IPJ
A
Bva injection (RO 200-5450) C DS v. 90 Jan2015
Bonviva®
Acid ibandronic
Bisphosphonate - Thuốc aề điều trị các bệnh xương (M05)
1. MÔ TẢ
1.1 Phân loại thuốc điều trị] theo dược học
Bonviva là một bisphosphonate có chứa nitrogen.
1.2 Dạng bâo chế
Bơm tiêm đóng sẵn.
1.3 Đường dùng
Tiếm tĩnh mạch.
1.4 Sản phẫm vô trùng] có hoạt tính phóng xạ
Sản phẳm vô trùng.
1.5 Thânh phần định tính và định lượng
Hoạt chất chính:
lbandronic acid, muối monosodium, monohydrate.
Dung dịch tiêm:
Mỗi bơm tiêm đóng sẵn có chứa 3,375mg acid ibandronic, muối monosodium, monohydrate tương đương vởi
3mg acid ibandronic trong 3 ml dung dịch.
2. CÁC ĐẶC TÍNH LÂM SÀNG
2.1 Chỉ định điều trị
Bonviva được chi định để điều t11' loãng xuơng ở phụ nữ sau mãn kinh, lảm giảm nguy cơ gãy xương.
Điểu trị loãng xương: Loãng xương có thể được khắng định bởi cảc bằng chứng về mật dộ xương thẩp (điếm
T < - 2,0 SD) và hiện tại hoặc tiền sử có gãy xương do Ioãng xương, hoặc mật độ xương thấp (điềm T < -2,5
SD) tiền sử không có gãy xương do ioãng xuơng đã được ghi nhận.
z.z Liều lượng và Cách sử dụng
Ậg
Liều khuyến cảo của Bonviva cho điều trị lả 3mg tiêm tĩnh mạch (tiêm tĩnh mạch trong [5-30 giây) mỗi ba
tháng.
Bệnh nhân phải được bổ sung calci vả vitamin D.
Nếu bị nhỡ một liều, nên tiêm lại liều đó cảng sớm câng tốt. Vì vậy, nên lến kế hoạch tiêm mỗi 3 thảng từ
ngảy tiêm cuối cùng.
2.2.1 Các hướng dẫn liều dùng đặc biệt
Bệnh nhân bị suy gan
Không cần thiểt phái điều chỉnh liều (xem phần 3.2.4 Dược động học ở những đối tượng đặc biệt).
lll²
""Y\ẦRMACẸỒ
ẢWQ.
Bonviva injeclion (RO 200-5450) C DS v. 9.0 Jan2015
Bệnh nhán bị suy thận
Không cần thiết phải điều chỉnh liều cho những bệnh nhân có creatinine huyết thanh 5 200 ụmolll (2,3 mg/dl)
hoặc độ thanh thải creatinine (được đo hoặc ước tính) 2 30 ml/phủt.
Tiêm tĩnh mạch Bonviva 3 mg mỗi 3 thảng không được khuyến cáo để sử dụng cho những bệnh nhân có
creatinine huyết thanh >200 pmolll (2,3 mg/dl) hoặc có độ thanh thải creatinine (được đo hoặc ước tính) < 30
mI/phủt do không có các số iiệu lâm sảng từ cảc nghiên cứu trên những bệnh nhân nảy (xem phân 3.2.4 Dược
động học ở những đối tượng đặc biệt).
Người giá
Không cần thiết phải thay đổi liếu.
Trẻ em
Tính an toản và hiệu quả chưa được xảc định trên những bệnh nhân dưới 18 tuổi.
2.3 Chống chỉ định
Bonviva được chống chỉ định trên những bệnh nhân được biết quá mẫn với acid ỉbandronic hoặc với bất cứ tả
. dược nảo.
Bonviva 3 mg tiêm tĩnh mạch mỗi 3 tháng được chống chỉ định trên những bệnh nhân bị giảm calci mảu
không điều chỉnh được.
2.4 Cảnh báo và Thận trọng
2.4.1 Tổng quát
Bonviva giống như cảc bisphosphonate khác được dùng để tiêm tĩnh mạch, có thể gây giảm hảm lượng calci
huyết thanh thoáng qua.
Giảm calci mảu vả các rối loạn khảc về chuyến hóa xương và chất khoảng nên được điều trị một cách hữu
hiệu trước khi bãt đâu liệu trinh tiêm Bonviva. Ăn uống đầy đủ calci vả vitamin D là quan trọng vởi tất cả các
bệnh nhân. Bệnh nhân phái được bổ sung calci vả vitamin D.
Bonviva 3 mg tiếm tĩnh mạch mỗi ba thảng không được khuyến cáo cho sử dụng trên những bệnh nhân có
creatinỉne huyết thanh >200 umol/l (2,3 mg/dl) hoặc có độ thanh thải creatinine (được đo hoặc ước tính) < 30
ml/phủt do không có các số liệu lâm sâng từ các nghiên cứu trên những bệnh nhân nảy (xem phần 3.2.4 Dược
động học ở những đối tượng đặc biệt).
Bệnh nhân có bệnh phối hợp hoặc dùng cùng các thuốc có nguy cơ bị các tảc dụng ngoại ỷ lên thận nên được
khảm lại một cách đều đặn phù hợp với thực hảnh y tế tốt trong khi điều trị
Đã có bảo cáo các trường hợp phản ứng phản vệ/sốc, bao gốm cả cảc biến cố gây tử vong ở bệnh nhân được
điều trị bằng acid ibandronic tiêm tĩnh mạch.
Phải Iuôn có sẵn các biện pháp hỗ trợ y tế vả theo dõi thích hợp khi sử dụng Bonviva tiêm tĩnh mạch. Nếu xảy
ra phản ứng phản vệ hoặc phản ứng quá mẫnjdị ứng nặng khảc, ngừng tiêm ngay lập tức và bắt đầu điểu tn_
thích hợp /ẮQ
Phải cần thận không được tiêm Bonviva vảo trong động mạch hoặc tiêm cận mạch bởi vì đỉềư nảy có thể dẫn
tới hùy hoại mô.
Tiêu xương hảm được ghi nhận ở những bệnh nhân điều trị với biphosphonate. Phần lớn các trường hợp là
những bệnh nhân ung thư đang lãm các thủ thuật về rãng, nhưng một vải trườngịgpẳy ra trên những bệnh
nhân bị loãng xương sau mãn kinh hoặc có cảc chấn đoán khảc. Các yếu tố,_nỄaịẵểỂfđ `ết với tiêu xương
hảm bao gồm chẩn đoán ung thư, các liệu pháp điều trị phối hợp (ví dụ, hóậẵrịlịịệgHồủ 03 icosteroid), vã
cảc bệnh kèm theo (ví dụ thiếu mảu, bệnh mảu đông, nhiễm trùng, bệnh số cảc trường
hợp ở những bệnh nhân được điểu trị với bisphosphonate tiêm tĩnh mạchz hợp ở những
bệnh nhân điều trị bằng đường uống. \»,ẳá T.P HÓ CHÍ MINH
2/12
“|
Bonviva irýeclion (RO 200—5450) CDS v. 9.0.1an2015
Với những bệnh nhân bị tiêu xương hâm (ONJ) trong khi điều trị bisphosphonate, phẫu thuật răng có thế lảm
tình trạng nảy nặng lến. Với những bệnh nhân cần phải Iảm cảc thủ thuật về rãng miệng, không có dữ liệu cho
rằng liệu việc ngửng điếu trị bisphosphonate sẽ lảm giảm nguy cơ bị ONJ. Việc đánh giá iâm sảng của bảo sĩ
điều trị nên chi ra kế hoạch điểu trị cho từng bệnh nhân dựa trên việc đảnh giả lợi ích/ nguy cơ của tửng cả
nhân.
2.4.2 Khả năng lái xe và vận hânh máy móc
Chưa có nghiến cứu nảo được tiến hảnh về khả năng lải xe và vận hânh mảy móc.
2.4.3 Tương tác với cảc thuốc khác và các hình thức tương tác khác
T uơng tác thuốc-thuốc
Về mặt tương tảc thuốc, không có tương tảo thuốc nảo được xem là có ý nghĩa lâm sảng, bới vi acid
ibandronic không ức chế phần lớn các isoenzyme P450 ở gan người và cũng được thấy iâ không ửc chế hệ
thống cytochrome P450 ở gan chuột. Ngoài ra, khả năng gắn kết protein huyết tương thấp tại nồng độ điều trị
và vì vậy acid ibanđronic không thế chỗ cảc thuốc khảo. Acid ibandronic được đảo thải chỉ bới sự bâi tiết ở
thận và không trải qua bắt cứ biến đổi sinh học nảo. Con dường đâo thải dường như không bao gồm các hệ
thống vận chuyến acid hoặc ba zơ đã biết có liên quan đến sự bải tiết của các thuốc khác.
Cảc nghiên cứu tuơng tác dược động học ở những phụ nữ sau mãn kinh đã chứng minh không có bất kỳ nguy
cơ tương tảc nảo với tamoxifen hoặc liệu phảp điều trị thay thế hormon (oestrogen).
Không ghi nhận tương tác nâo khi acid ibandronic tiêm tĩnh mạch được dùng cùng với
melphalan/prednisolone trên những bệnh nhân đa u tủy.
z.s Sử dụng ở những đối tượng đặc biệt
2.5.1 Phụ nữ có thai
Phụ nữ có thai, loại C
Bonviva không nên dùng cho phụ nữ có thai vả đang cho con bủ.
Phụ nữ có thai
Cảo nghiên cứu chuyên biệt về chế dộ điều trị mỗi ba thảng chưa được tiến hảnh. Trong các nghiên cứu với
chế độ điều trị tiêm tĩnh mạch hảng ngảy, không thấy bằng chứng về nhiễm độc thai trực tiếp hoặc tác động
gây quái thai của acid ibandronic lên chuột và thỏ. Giảm sự tăng cân ở thế hệ F 1 ở chuột. Các tác động ngoại
ý khảo của acid ibandronic trong cảc nghiên cứu độc tính sinh sản ở chuột là những tác động ngoại ý được ghi
nhận ở nhóm biphosphonate. Chủng bao gồm giảm vị trí lảm tổ, ảnh hưởng đến quá trình chuyến dạ tự nhiên
(đè khỏ), vả tăng sự biến đổi phủ tạng (hội chứng thận khung chậu niệu quản).
Không có kinh nghỉệm lâm sảng với Bonviva ở phụ nữ có thai.
2.5.2 Các bã mẹ đang cho con bú %
Thởi kỳ cho con bú ~/ /
Chuột đang cho con bú được điểu trị acid ibandronic 0,08mg/ kg] ngảy tiêm tĩnh mạch, nồng độ acid
ibandronic cao nhât trong sữa mẹ iả 8,1 nglml và được thấy trong hai giờ đầu tiến sau khi tiêm thuốc. Sau 24
giờ, nổng độ trong sữa và huyết tương là tương đương, và phù hợp với khoảng 5% nồng độ đo được sau hai
giờ.
Người ta chưa biết liệu Bonviva được bải tiểt vảo trong sữa mẹ hay không.
2.6 Các tác dụng không mong muốn
Hãy thông báo cho bác sĩ của bạn bất kỳ phản ứng ngoại ý nảo có liên qu
3/12
.- bl \`J n
@
Il .Ỹ'l
Bonviva irịieclion (RO 200-5450) CDS v. 9.0 Jan2015
2.6.1 Cảc thử nghiệm lâm sảng
Đíều trị loãng xương sau mãn kinh
Liều 2.5 me uống hảng ngảỵ
Tính an toản của Bonviva 2,5mg dùng hảng ngảy được đảnh giá trên 1251 bệnh nhân trong 4 nghiên cứu lâm
sảng có đối chứng với giả dược; 73% những bệnh nhân nảy đến từ nghiên cứu điều trị chủ chốt 3 năm
(MF4411). Hồ sơ an toản chung của Bonviva 2,5mg dùng hảng ngảy trong tất cả các nghiên cứu nảy là tương
tự như với giả dược. Tỉ lệ toản bộ những bệnh nhân có cảc phản ứng ngoại ỷ, nghĩa lả phản ứng ngoại ý có thể
hoặc có khả năng 1iên quan đến thuốc thử nghiệm, trong nghiên cứu điều trị chủ chốt (MF4411) là 19,8% đối
với Bonviva và 17,9% với giả dược.
Liều 3 mg tiêm tĩnh mach mỗi 3 tháng
Trong một nghiên cửu chủ chốt hai năm ở những phụ nữ loãng xương sau mãn kinh (BM16550), tính an toản
chung cùa Bonviva 3mg mỗi 3 thảng tiêm tĩnh mạch và Bonviva 2,5mg uống dùng hảng ngảy được thấy là
tương đương. Tỉ lệ toản bộ những bệnh nhân có phản ứng ngoại ý là 26,0% và 28,6% cho Bonviva 3mg mỗi
3 tháng tiêm tĩnh mạch và 20,4% vả 22,6% cho Bonviva 2,5mg dùng hâng ngây tương ứng sau một nãm vả
hai năm. Phần lớn các phản ứng ngoại ý ở mức độ nhẹ đển trung bình. Đa số các trường hợp gặp phản ứng
ngoại ý không dẫn đến ngừng điều trị. )
Bảng 1 và bảng 2 liệt kê cảc phản ứng ngoại ý tương ứng sau một năm và hai năm, từ nghiên cứu chủ chốt pha
III BM16550, được ghi nhận là có thế hoặc có khả năng liên quan đến thuốc thử nghiệm, trong hơn 1% số
bệnh nhân được điếu trị với hoặc Bonviva 3mg tiêm tĩnh mạch mỗi ba thảng hoặc giả dược tiêm tĩnh mạch kểt
hợp với Bonviva 2,5mg uống mỗi ngây. Cảc phản ứng ngoại ý ở những bệnh nhân điều trị với Bonviva 3mg
tiêm có tần suất tương đương hoặc ít hơn những bệnh nhân dùng thuốc dạng uống được Io_ai trừ. Bảng 1 và 2
cũng trình bảy cảc phản ứng ngoại ý trên những bệnh nhân được điều trị trong 3 nãm với Bonviva 2,5mg
uống hảng ngây trong nghiên cứu chống gãy xương (MF441 1). Đối với cả hai nghiên cứu, các phản ứng ngoại
ý được liệt kê khi xảy ra với tỉ lệ cao hơn ở bệnh nhân điều trị với Bonviva so với những bệnh nhân điều trị
với giả dược trong nghiên cứu MF441 1. Trong mỗi nhóm tần suất, các tảc dụng ngoại ý được trinh bảy theo
thứ tự gìảm dẩn mức dộ nghiêm trọng.
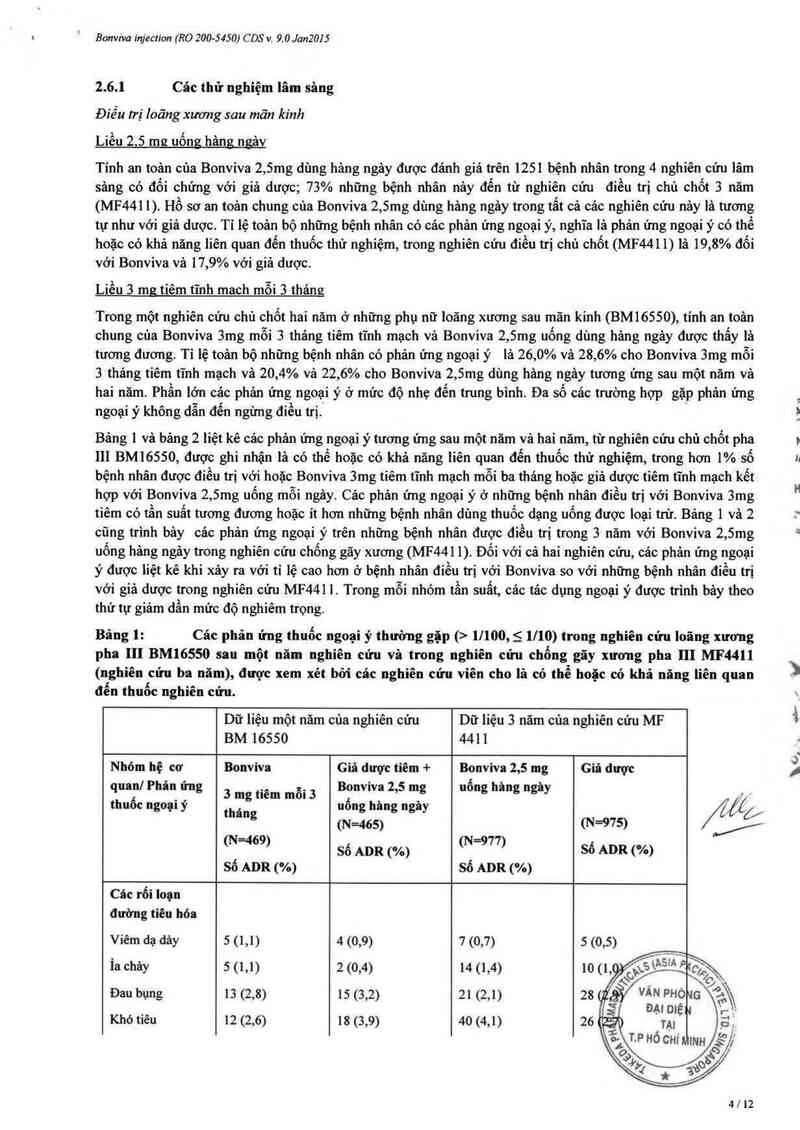
Bảng 1: Các phản ứng thuốc ngoại ý thường gặp (> 1l100, S 1l10) trong nghiên cứu loãng xương
pha III BM16550 sau một năm nghiên cứu và trong ughiên cửu chống gãy xương pha III MF4411
(nghiên cứu ba năm), đuợc xem xét bởi các ughiêu cứu viên cho là có thể hoặc có khả năng liên quan
đến tbuốc nghiến cửu.
Dữ liệu một năm của nghiên cửu Dữ liệu 3 năm của nghiên cứu MF
BM 16550 441 1
Nhóm hệ cơ Bonviva Giả được tiêm + Bonviva 2.5 mg Giả duợc
quan/ Phân ưng 3 mg tiêm mỗi 3 Baniva 2,5 mg uống hâng ngảy __
thuốc ngoạn ý tháng uong hâng ngây /Ịlế/
(N=465› _/
(N=469) (N=977) .
sỏ ADR (v.) sô ADR ( A)
sớ ADR (%) sớ ADR (%)
Các rối loạn
đường tiêu hóa
Viêm dạ dảy 5 (1,1 ) 4 (0,9) 7 (0,7)
Íachảy 5(1,1) 2(0,4) 14(1,4)
Đau bụng 13 (2,8) 15 (3,2) 21 (2,1)
Khó tiêu 12 (2,6) 18 (3,9) 40 (4,1)
4/12
\O.
Bonviva injecrion (RO 200.5450) CDS v. 9.0 Jan20l5
Buồn nôn 8 (1,7) 12 (2,6) 18 (1,8) 22 (2,3)
Tảo bỏn 5 (1,1) 7 (1,5) 3 (0,3) 9 (0,9)
Các rối Ioạn cơ
xuơng khởp
Đau cơ xương 5 (1,1) 2 (0,4) - -
khớp
Đau khớp 11 (2,3) 4 (0,9) 4 (0.4) 4 (0.4)
Đau cơ 8 (1,7) 4 (0,9) 18 (1,8) 8 (0,8)
Các rối loạn hệ
thống tổng quát
0… giống củm' 22 (4,7) 4 ( 0,9) 3 (0,3) 2 (0,2)
Mệt mói 5 (1,1) 2 (0,4) 3 (0,3) 4 (0,4)
Các rối Ioạn hệ
thần kinh
Đau đầu 5 (1 ,1) 3 (0,6) 8 (0,8) 6 (0,6)
Các rối Ioạn về
da
Ban đỏ 4 (0,9) 3 (0,6) 12 (1,2) 7 (0,7)
M“edDRA phiên bản 7.0
’ Đã có báo cáo các triệu chứng giống củm thoáng qua ở bệnh nhân tiêm tĩnh mạch Bonviva 3 mg mỗi 3 tháng, thường
liên quan với liều đầu tiên. Bệnh giống cúm_kề cả các phán ứng phụ đã được báo cáo là phản ứng hoặc triệu chứng giai
đoạn cấp tinh, bao gồm đau cơ, đ_au khớp, sôt, ớn lạnh, mệt mỏi, buồn nôn, chản ăn và đau xương. Các triệu chứng nảy
thường xảy ra trong thời gian ngăn, mức độ nhẹ hoặc trung bình và qua đi khi tiếp tục điều trị mà không cần các biện
pháp xử 1ỷ.
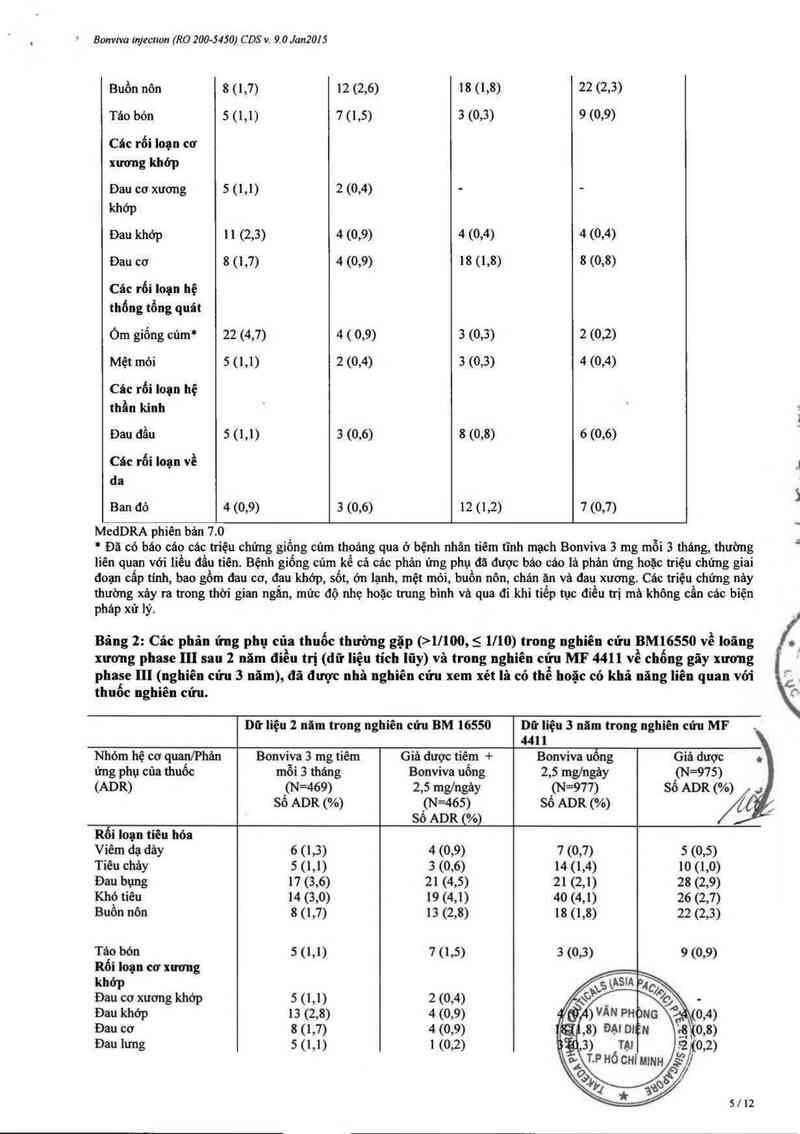
Bảng 2: Cảc phân ứng phụ của thuốc thường gặp (>l/100, S 1/10) trong nghiên cứu BM16550 về loãng
xương phase II] sau 2 năm điều trị (đữ liệu tích lũy) vả trong nghiên cứu MF 4411 về chống gãy xương
phase III (nghiên cứu 3 năm), đã được nhà nghiên cứu xem xét là có thể hoặc có khả nảng liên quan với
thuốc nghiên cửu.
Dữ liệu 2 năm trong nghiên cứu BM 16550 Dữ liệu 3 năm trong nghiên cứu MF
441 1
Nhóm hệ cơ quan/Phản Bonviva 3 mg tiêm Giả dược tiêm + Bonviva uổng Giả dược .
ứng phụ của thuốc mỗi 3 tháng Bonviva uống 2,5 mg/ngảy (N=975)
(ADR) (N=469) 2,5 mg/ngảy (N=977) Số ADR (%) .;
sô ADR (%) (N=465) sớ ADR (%) /
Sô ADR (%)
Rối Ioạn tiêu hóa
Viêm dạ dảy 6 (1,3) 4 (0,9) 7 (0,7) 5 (0,5)
Tiêu cháy 5 (1,1) 3 (0,6) 14 (1,4) 10 (1,0)
Đau bụng 17 (3,6) 21 (4,5) 21 (2,1) 28 (2,9)
Khó tiêu 14 (3,0) 19 (4,1) 40 (4,1) 26 (2,7)
Buồn nôn 8 (1,7) 13 (2,8) 18 (1,8) 22 (2,3)
Táo bón 5 (1,1) 7 (1,5) 3 (0,3) 9 (0,9)
Rối loạn cơ xương
khớp
Đau cơ xương khớp 5 ( 1,1) 2 (0,4)
Đau khớp 13 (2,8) 4 (0,9)
Đau cơ 8 (1,7) 4 (0,9)
Đau lưng 5 (1,1) 1 (0,2)
5l12
Bonviva injection (RO 200—5450) CDS v. 90 Jan20l5
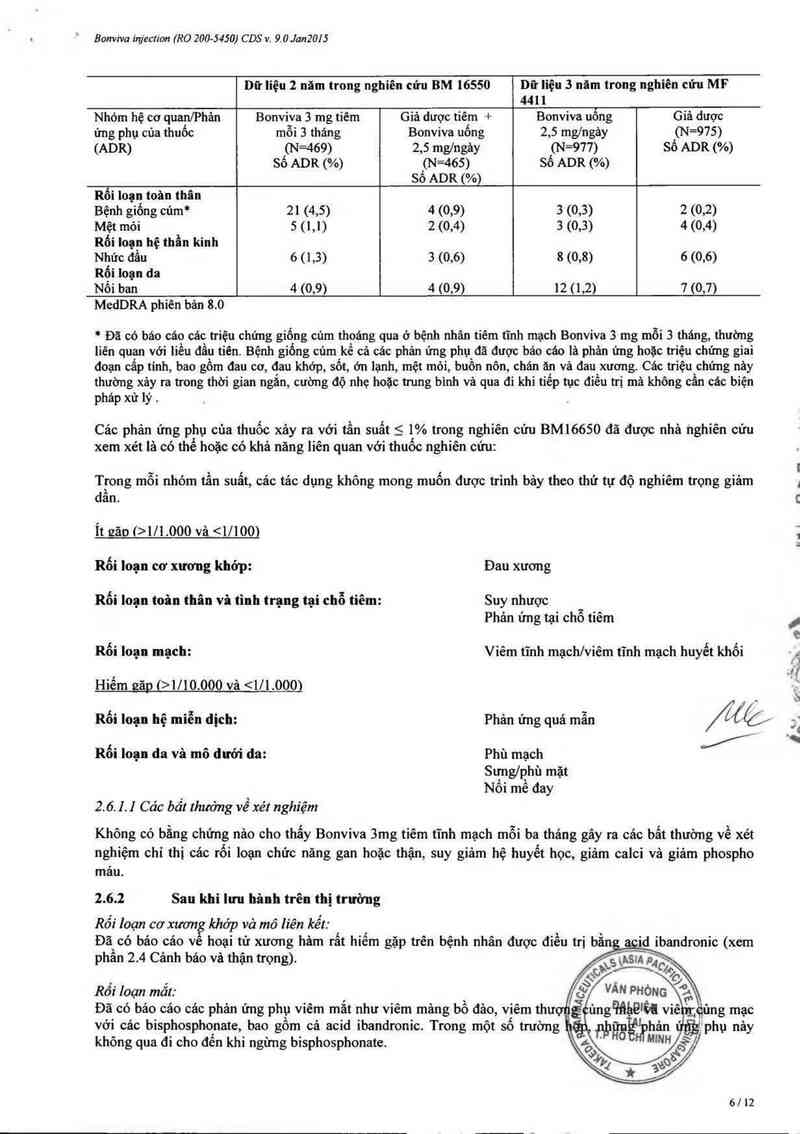
Dữ liệu 2 năm trong nghiên cứu BM 16550 Dữ liệu 3 nãm trong nghiên cửu MF
4411
Nhóm hệ cơ quan/Phản Bonviva 3 mg tiêm Giả dược tiêm + Bonviva uống Giả dược
ứng phụ của thuốc mỗi 3 tháng Bonviva uống 2,5 mg/ngảy (N=975)
(ADR) (N=469) 2,5 mg/ngảy (N=977) Số ADR (%)
Số ADR (%) (N =465) Số ADR (%)
sớ ADR (%)
Rối loạn toân thân
Bệnh giống cúm* 21 (4,5) 4 (0,9) 3 (0,3) 2 (0,2)
Mệt mòi 5 (1,1) 2 (0,4) 3 (0,3) 4 (0,4)
Rối loạn hệ thần kinh
Nhức đầu 6 (1,3) 3 (0,6) 8 (0,8) 6 (0,6)
Rối loạn da
Nối ban 4 (0,9) 4 (0,9) 12 ( 1,2) 7 (0,7)
MedDRA phiên bản 8.0
’ Đã có báo cáo các triệu chứng giống cúm thoáng qua ở bệnh nhân tiêm tĩnh mạch Bonviva 3 mg mỗi 3 thảng, thường
liên quan với Iiếu đẩu tiên. Bệnh giống cúm kể cả các phản ứng phụ đã được báo cáo là phản ứng hoặc triệu chửng giai
đoạn câp tính, bao gổm đau cơ, đau khớp, sốt, ớn lạnh, mệt mòi, buổn nôn, chán ăn và đau xương. Các triệu chứng nảy
thường xảy ra trong thời gian ngắn, cường độ nhẹ hoặc trung binh và qua đi khi tiểp tục đìều trị mà không cần cảc biện
pháp xử lý .
Cảc phản ứng phụ cùa thuốc xáy ra với tần suất 5 1% trong nghiên cứu BM16650 đã được nhà nghiên cứu
xem xét lá có thể hoặc có khả nảng liên quan với thuốc nghiên cứu:
Trong mỗi nhóm tần suất, các tác dụng không mong muốn được trinh bây theo thứ tự độ nghiêm trọng giảm
dần.
Ít gão (>1/1000 vả <17100)
Rối loạn cơ xương khớp: Đau xương
Rối loạn toân thân vì tình trạng tại chỗ tiêm: Suy nhược
Phản ứng tại chỗ tiêm
Rối loạn mạch: Viêm tĩnh mạch/viêm tĩnh mạch huyểt khối
Hiểm gặp (>1/10000 vả <171.0001
A › n . . . , J :
R01 loạn hẹ miễn dịch: Phan ưng qua man
Rối loạn da và mô dưới da: Phù mạch
Sưng/phù mặt
Nối mề đay
2.6.1.1 Các bất thường về xét nghiệm
Không có bằng chứng nảo cho thẩy Bonviva 3mg tiêm tĩnh mạch mỗi ba thảng gây ra cảc bất thường về xét
nghiệm chỉ thị các rối loạn chức năng gan hoặc thận, suy giảm hệ huyết học, giảm calci và giảm phospho
mau.
2. 6. 2 Sau khi lưu hân]: trên thị trường
Rối” loạn cơ xương khóp vả mô liên kết.
Đã có báo cáo về hoại từ xương hảm rất hiểm gặp trên bệnh nhân được điểu trị bằn
phần 2. 4 Cảnh báo và thận trọng).
id ibandronic (xem
Rối" Ioạn mắt:
Đã có bảo cảo các phản ứng phụ viêm mắt như viêm mảng bồ đảo, viêm thư
với các bisphosphonate, bao gôm cả acid ibandronic. Trong một số trường
không qua đi cho đến khi ngừng bisphosphonate.
6/12
/22
/_
Bonviva injection (RO 200-5450) CDS v. 9.0 Jan20l5
Rối Ioạn hệ miễn dịch:
Đã có báo cảo các trường hợp phân ứng phản vệ/sốc, bao gồm cả các biến cố gây tử vong ở bệnh nhân được
điếu trị bằng acid ibandronic (xem phần 2.4 Cảnh báo và thận trọng).
Cảc phản ứng dị ửng bao gồm hen phế quản đã được báo cảo.
Phản ửng phụ trên da nghiêm trọng bao gổm hội chứng Stevens-Johnson, hồng ban đa dạng và viêm da bóng
nước đã được bảo cáo.
Chấn thương, ngộ độc và biến chúng thủ thuật
Gãy thân xương đùi vả dưới mấu chuyến không điển hình đã được báo cảo khi điểu trị với bisphosphonate,
bao gồm acid ibandronic, tuy nhiên nguyên nhân chưa được xảc định.
2.7 Quá liều
Không có thông tin chuyên biệt về điều trị quá liều Bonviva.
Dựa vâo kiến thức về nhóm hợp chất nây, quá liều dạng tiêm có thể gây giảm calci mảu, gỉảm phospho mảu,
và giảm magnesi mảu. Nồng độ huyết thanh của calci, phospho, vả ma-giê giảm có liên quan đến lâm sảng
nên được điều chinh bằng cách dùng đường tĩnh mạch calcium gluconate, kali hoặc natri phosphate, vả
magnesi sulfate, một cách tương ứng.
3. CÁC ĐẶC TÍNH VÀ HIỆU QUẢ DƯỢC HỌC
3.1 Các đặc tinh dược lực học
Hoạt động dược lực học của acid ibandronic lả ửc chế sự hủy xương. In vivo, acid ibandronic ngăn ngừa sự
hủy xương được kích thich về mặt thực nghiệm gây bới sự ngừng chức năng tuyến sinh dục, retinoid, các
bướu hoặc chiết xuất bướu. Ở chuột còn bé (tãng trướng nhanh), sự hủy xương nội sinh cũng bị ức chế, dẫn
đến mật độ xương tăng so với các động vật không được điều trị.
Cảc mẫu động vật khắng định rằng acid ibandronic có khả nãng ức chế mạnh hoạt tính hủy cốt bảo. Ở chuột
đang tãng trường, không có bằng chửng về suy giảm sự khoáng hóa thậm chí tại liều cao hơn 5000 lần lỉều
điếu trị loãng xương.
Hiệu lực cao vả giới hạn điều trị của acid ibandronic cho phép các chế độ liếu điều trị linh hoạt hơn và điểu ni,.
không liên tục tại những liếu thấp tương đối với những khoảng nghi dải không dùng thuốc. '
Cả hai cảch dùng dải ngảy dùng hâng ngây và dùng ngắt quãng (khoảng nghi dải không dùng thuốc) ở ếhẵt,
chó và khi đều có tảc dụng hình thảnh xương mới với chất lượng bình thường vả] hoặc cường độ chuyến hóa
tăng thậm chí ở những liều vượt quá bất cứ liễu mong đợi về mặt dược học, bao gồm những liều trong phạm
vi độc. Ở người, hìệu quả của cả hai cảch dùng đường uống dùng hảng ngảy vả dùng ngắt quãng với acid
ibandronic có khoảng thời gian là 9-10 tuần không dùng thuốc được khẳng định trong thử nghiệm lâm sâng
(MF441 1), trong đó Bonviva đã chứng minh hiệu quả chống gãy xương.
Dùng liều uống hảng ngảy, ngắt quãng (với khoảng thời gian không dùng thuốc là 9… tuần mỗi 3 thảng)
cũng như liêu tiêm Bonviva cho những phụ nữ sau mãn kinh tạo những thay đối hóa sinh cho thấy ức chế sự
hủy xương phụ thuộc Iiếu.
Bonviva tiêm tĩnh mạch lảm giảm nồng độ CTX huyết thanh trong vòng 3-7 ngảy kế từ khi bắt đầu điều trị vả
nông độ osteocalcin giảm trong vòng 3 tháng.
sau mãn kinh.
Phân tích mô học các mảnh sinh thiết xương sau hai và ba năm điều trị ở nh
Bonviva liếu 2,5mg uông mỗi ngây vả Bonviva tiêm tĩnh mạch dùng ngắt quãn
xương có chât lượng bình thường vả không có dấu hiệu về sự giảm khoáng hóa x
g mỗĩba thản
* P Hô CHI MINH
tỆẵiio thấy
7/12
Bonviva injecrion (RO 200-5450) CDS v. 9.0 Jan2015
3.1.1 Cơ chế tác động
Acid ibandronic lả bisphosphonate hỉệu lực cao thuộc nhóm bisphosphonate có chứa nitrogen, tảo động lên
mô xương và ức chế hoạt tinh hủy xương một cảch chuyên biệt. Nó không ảnh hưởng tới sự huy động tế bảo
hủy xương. Hoạt động chọn lọc của acid ibandronic lên mô xương dựa vâo ải lực cao của hợp chất nảy với
hydroxyapatite, đại diện cho chất khoáng cơ bản của xương.
Acid ibandronic lảm giảm sự hùy xương, không tảc động lên sự hinh thảnh xương. Ở phụ nữ sau mãn kinh, nó
lảm giảm tốc độ tăng chuyền hóa xương về nồng độ trước mãn kinh, dẫn đển tãng mật độ xương thực.
Uống acid ibandronic hảng ngảy hoặc ngắt quãng lảm giảm sự hủy xương thể hiện ở nồng độ giảm của các
chất đánh dấu sinh hóa của sự chuyển hóa xương trong huyết thanh và nước tiếu, mật độ khoảng hỏa BMD
tăng và giảm tỉ lệ gãy xương.
3.1.2 Các nghiên cứu lâm sângl hiệu quả
Điều Irị Ioãng xương sau mãn kinh
Bonviva 2.5 mg dùng hảng ngảỵ
Một nghiên cứu về gãy xương trong vòng ba năm, ngẫu nhiên, mù đôi, có đối chứng với giả dược (MF 4411)
đã chứng minh sự giảm ti 1ệ gãy xương đốt sống mới xác định bằng đo hình thải phóng xạ và trên lâm sảng có
có ý nghĩa y học và thống kê. Bonviva được đảnh giả tại liều 2,5mg uống hảng ngây vả 20mg dùng ngắt
quãng (20mg dùng mỗi ngảy trong 12 ngảy bắt đầu của mỗi liệu trinh 3 tháng, sau đó là 9-10 tuần không dùng
thuốc). Bonviva được dùng 60 phủt trước bữa ăn hoặc uống đầu tiên của ngảy (ăn sau uống thuốc). Nghỉên
cứu gồm có 2946 phụ nữ tuối từ 55 tới 80 tuối (2928 người điều trị có hiệu quả), những người có ít nhất 5
năm sau mãn kinh, có BMD xương đốt sống thẳt lưng thấp hơn 2 đến 5 SD giá trị trước mãn kinh (điểm T) ở
it nhẩt một đoạn cột sống [Ll-L4], và những người có một đển bốn lần gãy xương đốt sống thường thấy. Tẩt
cả những bệnh nhân được dùng 500mg calcium và 400 IU vitamin D hảng ngảy.
Bonviva cho thẩy giảm tỉ lệ gãy xương đốt sống mới có ý nghĩa về mặt y học vả có ý nghĩa thống kẽ với cả
hai chế độ điều trị được thử nghiệm. Chế độ điều trị dùng 2,5mg mỗi ngảy lảm giảm hiện tượng gãy xương
đốt sống mới xác định bắng X-quang khoảng 62% trong quá trinh nghiên cứu 3 nảm. Gãy xương đốt sống trên
lâm sảng cũng giảm khoảng 49%. Ngoài ra tảc động mạnh iên hiện tượng gãy xương đốt sống được phản ảnh
bời việc gìảm sự mất chiều cao có ý nghĩa thống kê so với giả dược
Híệu quả chống gãy xương ổn định trong suốt nghiên cứu Không có dấu hiệu nảo phải lưu ý về tảc động
trong suốt thời gian đó. @
. f '
Mặc dẩu thử nghiệm gãy xương trên lâm sảng cho acid ibandronic không được thiêt kế đặc trưng để ch g
minh hiệu quả trên gãy xương ở những trường hợp gãy xương không phải xương sống, giảm nguy cơ tương
đối với mửc độ tương tư (69%) như đã được chứng minh trong các trường hợp gãy xương đổt sống, được ghi
nhận cho các trường hợp gãy xương không phải đốt sống ở phân nhóm bệnh nhân có nguy cơ gãy xương cao
hơn (BMD cố xương đùi chỉ số T<-3,0 SD). Ghi nhận hiệu quả lên những trường hợp gãy xương không phải
đốt sống ở những phân nhóm bệnh nhân có nguy cơ cao phù hợp với những nghiên cứu thử nghiệm lâm sâng
cho những bisphosphonate khảc.
BMD cột sống thẳt lưng trong nghiên cửu ba nãm với chế độ điều trị hảng ngảy tăng so với giả dược là 5,3%.
So với lủc ban đầu tăng 6,5%.
Các chất đánh dấu hóa sinh của sự chu chuyến xương (như CTX niệu vả osteocalcín) cho thẩy sự ức chế đã
đến mức mong đợi của thời kỳ tiển mãn kinh và đạt mức ức chế tối đa trong vòng 3—6 tháng. Cảo chất đảnh
dấu hóa sinh của sự hủy xương giảm 50% và 78% có ý nghĩa lâm sảng được ghi nhận ngay từ một thảng sau
khi bắt đầu điều trị, tương ứng với Bonviva 2 ,5mg dùng hảng ngảy vả 20mg dỀẳt Ễag_._ Việc gỉảm các
chất đánh dẩu hóa sinh của sự hủy xương là rõ rảng trong vòng 7 ngảy bắt đẩu
« `“.-
ò .o
Bonviva 3 me tiêm mỗi 3 tháng ở VẢN PHỒNG f..
; 041 DIỆN
— ~ . . % m =
Mạt đọ khoang cua xương (BIƯD) Ề T P H ỏ CHÍ MINH :Ìị'"
0 4.
& ụ .
*iv <>,»
’1 * ẨỆX'
8112
11
Bonviva injeclion (RO 200-5450) C DS v. 9.0 Jan20/5
Bonviva 3 mg tiêm tĩnh mạch, được dùng mỗi 3 thảng đã cho thẩy it nhất là có hiệu quả như khi uổng
Bonviva 2, 5 mg/ngảy trong một nghiên cứu không thua kém, ngẫu nhiên, mù đôi, đa trung tâm trong 2 nãm
(BM16550) trên phụ nữ sau mãn kinh (1386 phụ nữ từ 55— 80 tuổi) bị loãng xương (thang điếm T (T-score)
vê mật độ khoáng của xương cột sống thắt lưng dưới -2, 5 SD (độ lệch chuẩn) 1ủc ban đầu). Tất cả cảc bệnh
nhân được bổ sung 400 IU vitamin D vả 500 mg caici mỗi ngảy. Điều nảy đã được chứng minh
trong cả phân tỉch ban đầu vảo thời điểm kết thủc 1 năm và trong phân tích xảo nhận vâo thời điếm kết thủc 2
năm (Bảng 3).
Phân tích ban đầu về cảc dữ liệu từ nghiên cứu BM16550 tại thời điểm phân tích lúc 1 năm vả phân tích xảo
nhận lúc 2 năm đã chứng minh sự không thua kém của chế độ điều trị dùng liều tiêm 3 mg mỗi 3 tháng so với
chế độ điều trị dùng liều uống 2, 5 mg/n ảy về mặt tăng mật độ khoảng của xương cột sống thắt lưng, toản bộ
xương hông, cổ xương đùi vả mấu chuyen (Bảng 3).
Bảng 3: Thay đỗi tương đối trung bình so vởi mức ban đầu về mật độ khoáng của xương cột sống thắt
lưng, toân bộ xương hông, cổ xương đùi vã mấu chuyển sau 1 năm điều trị (phân tich ban đầu) và sau 2
năm điều trị (nhóm đối tượng theo đề cương nghiên cứu) trong ughiên cứu BM 16550.
Dữ liệu ] nảm trong nghiên cứu BM Dữ liệu 2 năm trong nghiên cứu
16550 BM 16550
Thay đổi tương Bonviva Bonviva 3 mg tiêm Bonviva Bonviva 3 mg tiêm
đối trung binh so 2,5 mg/ngảy mỗi 3 thảng 2,s mg/ngảy mỗi 3 thảng
với mức ban đầu (N=377) (N=365) (N=334) (N=334)
% [khoảng tin
cậy (CI) 95%]
Mật độ khoáng 3,8 [3,4, 4,2] 4,8 [4,5, 5,2] 4,8 [4,3, 5,4] 6,3 [5,7, 6,8]
cùa xương cột
sống thẳt lưng
L2-L4
Mật độ khoáng 1,8 [1,5, 2,1] 2,4 [2,0, 2,7] 2,2 [1,8, 2,6] 3,1 [2,6, 3,6]
của toản bộ
xương hông
Mật độ khoáng 1,6 [1,2, 2,0] 2,3 [1,9, 2,7] 2,2 [1,8, 2,7] 2,8 [2,3, 3,3]
của cổ xương đùi
Mật độ khoảng 3,0 [2,6, 3,4] 3,8 [3,2, 4,4] 3,5 [3,0, 4,0] 4,9 [4,1, 5,7]
của mâu chuyên ẬQ
Hơn nữa, tiêm Bonviva 3 mg mỗi 3 thảng đã chứng tỏ trội hơn uống Bonviva 2, 5 mg/ngảy về sự tăng mật độ
khoáng của xương cột sổng thắt lưng trong một phân tích được hoạch định theo thời gian vảo lủc 1 năm, p <
0,001 vả vảo lủc 2 nãm, p < 0,001.
Đối với mật độ khoáng của xương cột sống thắt lưng, 92,1% bệnh nhân được tiêm 3 mg mỗi 3 thảng có tăng
hoặc duy trì mật độ khoảng của xương sau 1 nãm điểu trị (tức là những người đáp ứng) so với 84, 9 % bệnh
nhân uông 2 ,5 mg/ngảy (p= 0 ,.002) Sau thời gian điếu trị 2 năm, 92,8% bệnh nhân được tiếm 3 mg vả 84,7%
bệnh nhân được điều trị bằng 2, 5 mg đường uông có tảng hoặc duy trì mật độ khoáng của xương cột sống thắt
lưng (p= 0,001
Đối với mật độ khoảng của toân bộ xương hông, 82, 3% bệnh nhân được tiêm 3 mg mỗi 3 tháng lả những
người đáp ứng vảo lúc 1 năm, so với 75,1% bệnh nhân uống 2, 5 mg/ngảy (p— = 0,02). Sau 2 nãm điều trị,
85, 6% bệnh nhân nhận được các mũi tiêm 3 mg và 77, 0% bệnh nhân được điêu trị bằng 2, 5 mg đường uống
có tảng hoặc duy tri mật độ khoáng của xương hông (p = 0,004).
Tỷ lệ bệnh nhân tãng hoặc duy tri mật độ khoảng của xương tại thời điếm 1
lưng và toản bộ xương hông là 76, 2% ở nhóm tiêm 3 mg môi 3 thảng và 67 «' -
đường uống (p= 0 ,00.7) Vảo lủc 2 nãm, 80,1% và 68, 8% bệnh nhân đảp ', ~
3 mg môi 3 tháng và nhóm dùng 2, 5 mg/ngảy (p= 0 ,.001) ’
9/12
ìunb\ n“.
`f tbhv
Bonviva irịjection (RO 200-5450) C DS v. 9.0 Jan2015
Các chất đánh dẩu hóa sinh của sự chu chuyến xương
Nồng độ CTX huyết thanh giảm có ý nghĩa lâm sảng được ghi nhận tại tắt cả các thời điểm đo. Sau 12 tháng
những thay đổi có liên quan trung bình so với lúc ban đẩu lả -58,6% đối với chế độ điều trị tiêm tĩnh mạch
3mg mỗi ba thảng vả -62,6% đối với chế độ điều ưị 2,5mg dùng hảng ngảy. Thêm vảo đó, 64,8% số bệnh
nhân dùng 3mg mỗi ba tháng tiêm tĩnh mạch được xảo định là những người đáp ứng (được xác đinh khi giảm
250% so với lủc ban đẳu), so với 64,9% số bệnh nhân dùng 2,5mg uống mỗi ngảy. Sự giảm CTX huyết thanh
được duy trì trong khoảng 2 năm, với hơn một nữa số bệnh nhân được xác định là người đảp ứng trong cá hai
nhóm điều trị
Dựa vảo kết quả cùa nghiên cứu BM 16550, Bonviva tíêm tĩnh mạch 3mg mỗi ba tháng được mong đợi là ít
nhất có hiệu quả trong việc phòng gãy xương như Bonviva 2,5 mg uống hảng ngây.
3.2 Các đặc tính dược động học
Tảc dụng dược lý của acid ibandronic không liên quan trực tiếp tới nồng độ huyết tương thực tế tại nơi tảc
dộng là xương. Điều nảy được chứng minh bởi rất nhỉều nghiên cứu khảc nhau trên động vật vã trên người,
trong đó hiệu quả tương đương của acid ibandronic được chứng minh cả khi theo chế độ điều trị hâng ngảy
hoặc dùng ngắt quảng, bao gồm khoảng thời gian vâi tuẩn không dùng thuốc (it nhất 6 tuần ở chuột, ít nhẩt 11
tuần ớ chó, ít nhẫt 30 ngảy ở khỉ, và it nhất 9,5 tuần ở người) với điếu kiện là tổng liều như nhau được dùng
trong suốt khoảng thời gian nảy.
Nồng độ huyết tương của acid ibandronic tăng tỉ lệ theo liều sau khi tiêm tĩnh mạch liều 0,5mg tới 6mg.
3.2.1 Hấp thu
Không ảp dụng
3.2.2 Phân bố
Sau khi phân bố khới đẩu toản thân, acid ibandronic gắn kết nhanh chóng với xương hoặc được bải tiết vảo
nước tiếu. Ở người, thể tích phân bố biếu kiến cuối ít nhất là 901 vả lượng thuốc tới xương ước tinh là 40-
50% liều lưu hảnh trong máu. Khả năng gắn kết protein ở huyết tương người là thấp (khoảng 85% gắn kết tại
nồng độ điều trị), vả vì vậy khả năng tương tảc thuốc-thuốc do sự thế chỗ là thấp.
3.2.3 Chuyển hóa
Không có bằng chứng cho rằng acid ibandronic được chuyến hóa ở động Vật hoặc người. /Zậ
3.2.4 Đao that ./
Sau khi tiêm tĩnh mạch, acid ibandronic ra khỏi vòng tuần hoản thông qua sự hấp thụ vảo xương (40-50%) và
phần còn lại được đảo thải dưới dạng không đổi bới thận.
Khoảng thời gian bản thải biều kiến quan sát được thi phụ thuộc vảo liền và độ nhạy của xét nghiệm, nhưng
thời gian bán thải biểu kiến pha cuối nhin chung trong khoảng 10-72 giờ. Nổng độ huyết tương giảm sớm
nhanh đạt 10% giá trị đinh trong vòng 3 giờ sau khi tiêm hoặc uống.
Độ thanh thải acid ibandronic toản phần thẩp với các giá trị trưng bình trong khoảng 84-160m1/phủt. Độ thanh
thải thận (khoảng 60ml/phủt ở những phụ nữ sau măn kinh khỏe mạnh) chiếm khoảng 50-60% độ thanh thải
toản phân và cỏ liến quan tới độ thanh thải creatinine. Sự khác biệt giữa độ thanh thải biểu kiến toản phần và
độ thanh thải thận được xem là phản ánh sự hấp thụ vảo xương.
3.2.5 Dược động học ớ những đối tượng đặc bỉệt
Giới tính
Dược động học của acid ibandronic tương đương ở nam và nữ.
Chủng tộc VĂN pHộNG
ĐẠI DIEN
10l12
\\ ỢL.\
nu.
Bonwva i`nỵecưon (RO 200-5450) C DS v. 90 Jan2015
Không có bằng chứng cho thấy sự khác biệt giữa cảc chủng tộc có ý nghĩa lâm sảng giữa chùng người Châu Á
và chủng người da trắng về sự hấp thu acid ibandronỉc. Có it số liệu trên những bệnh nhân có nguồn gốc Châu
Phi.
Bệnh nhân bị suy thận
Độ thanh thải thận của acid ibandronỉc trên những bệnh nhân với các mức độ suy thận khác nhau có liên quan
tuyến tính với độ thanh thải creatinine (Cbcr).
Không cần điếu chinh liếu trên những bệnh nhân bị suy thận mức độ nhẹ hoặc trung bình (CLcr Z30ml/phút).
Ở những bệnh nhân bị suy thận nậng (CLcr .<. 30 ml/phủt) tiêm tĩnh mạch 0,5mg, độ thanh thải toản phần,
thận, và không phái thận giảm tương ứng khoảng 67%, 77% và 50%. Tuy nhiên, khả năng dung nạp không
giám lảm tăng nồng độ thuốc trong mảu.
Bệnh nhân bị suy gan
Không có số liệu dược động học của acid ibandronỉc trên những bệnh nhân bị suy gan. Gan không đóng vai
trò đảng kế trong việc thanh thải acid ibandronỉc vốn không bị chuyến hóa nhưng được đảo thải bởi thận và sự
hẳp thu vảo xương. Vì vậy không cần điếu chinh liều trên những bệnh nhân bị suy gan. Ngoài ra, vì khả năng
gắn kết protein của acid ibandronỉc thẩp (85%) tại nồng độ điểu trị, giảm protein mảu trong bệnh gan nặng
không thể dẫn đển tăng nồng độ tự do trong huyết tương có ý nghĩa lâm sảng.
Người giả
Acid ibandronỉc được biết là không bị chuyền hóa, sự khác biệt duy nhất trong sự đâo thải acid ibandronỉc ở
những bệnh nhân lớn tuồi so với những bệnh nhân trẻ tuối được cho lá có liên quan tới những thay đổi chức
năng thận do tuổi tảc (xem phần “Bệnh nhãn bị suy thận”). Không cần phải điểu chinh liếu khi dựa trên tuối.
T rẻ em
Không có số liệu sử dụng Bonviva trên những bệnh nhân dưới 18 tuổi.
3.3 Tinh an toân tiền lâm săng
Tảc dụng độc trên động vật được ghi nhận tại nổng độ được xem là vượt quá nồng độ tối đa ở người cho thẳy
có liên quan it tới việc sử dụng trên lâm sâng.
3.3.1 Tinh gây ung thư
Không ghi nhận cảc bằng chứng cho thấy khả năng gây ung thư và nhiễm độc gen. /Ở
/
4. CÁC ĐẶC TÍNH DƯỢC HỌC
4.1 Danh sách tá dược
Sodium chloride, ,
Acetic acid, glacial
Sodium acetate
Nước đế tiêm
4.2 Tinh không tương thích
Không nên trộn Bonviva với ca’c dung dịch có chứa calci hoặc cảc thuốc tiêm tĩnh mạch khảc.
4.3 Độ ốn định
Hạn dùng: 24 tháng
Không nên dùng thuốc sau ngảy hết hạn (EXP) ghi trên hộp.
11112
’011 g~.
\\”We`
` 'ii'nJ'ìl
Bonviva injection (RO 200-5450) CDS v. 9.0 Jan2015
4.4 Lưu ý khi bảo quản
Không bảo quản ở nhiệt độ trên 30°C.
4.5 Các hướng đẫn đặc biệt khi sử đụng, xử lý và hủy bỏ
Thuốc tiêm chỉ sử dụng một lẩn duy nhất. Chỉ sử dụng những bơm tiêm chứa dung dịch trong suốt không có
cặn.
Tuân thủ nghiêm ngặt cách dùng đường tĩnh mạch đã được khuyến cảo.
Khi sản phẩm được tiêm vâo một đường truyền tĩnh mạch, dung dịch truyền tĩnh mạch nên tuân thủ hoặc dung
dịch muối đẳng trương hoặc dung dịch dextrose 5%.
Dung dịch tiêm, bơm tiêm và kim tiêm không sử dụng nên được hùy bỏ theo tiêu chuẩn địa phương.
Hủy bỏ ống tiêm/vật sẳc nhọn
Cần tuân thủ nghiêm ngặt cảc điếm sau đây liên quan đến việc sử dụng và hủy bỏ cảc ống tiêm và những vật
sẳc nhọn khảc của thuốc:
0 Không bao giờ được sử dụng lại kim và ống tiêm.
0 Đặt tẩt cả cảc kim và ống tiêm đã qua sử dụng vảo một thùng chứa vật sẳc nhọn (thùng chứa dùng
một lần chống đâm thủng).
o Giữ thủng chứa nảy xa tầm tay trẻ em.
9 Phải tránh đặt thùng chứa vật sẳc nhọn đã qua sử dụng nảy vảo chẩt thải gia đình.
0 Hủy bỏ thùng chửa đầy theo quy định của địa phương hoặc theo hướng dẫn của nhà cung cấp dịch ụ
chăm sóc sức khỏe của bạn.
Để sử dụng trong nhả, cầu cung cấp cho bệnh nhân một thùng chứa chống đâm thủng để hủy bỏ cảc ốngt1êm
và kim đã qua sử dụng.
Hủy bỏ thuốc không sử dụng/hết hạn //ử
Nên giảm thiều việc đưa thuốc vảo môi trường. Không được hủ
qua rảc thải gia đinh. Sử dụng “hệ thông thu gom” nểu được 1 '
Y _ ua nước thải và cần trảnh hủy bỏ
4.6 Đóng gỏi
Bơm tiêm đóng sẵn 3 mg/ 3 ml. Hộp 1 bơm tiêm.
'/
Đế xa tẩm tay của trẻ
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần biết thêm thông tin xin hỏi ý kiến bác sĩ của 11 30
Chỉ sử dụng theo sự kế đơn cũa báqu,Q , , C TPUỞNC
Sản xuất bới: Vetter Pharma-Fertigung GmbH & Co KG P TRUỞNVG PHÒNG
Eisenbahnstrasse 24, D-88085 Langenargen, Đức /iỷayen ffll_ấ 'Ífẳìng
Đóng gói thứ cấp và xuất xướng bởi: Roche Diagnostics GmbH
Sandhofer Strasse 116, 68305 Mannheim, Đức
12|12
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng