












/M qu—f
|10.3mm }— iMmm › ~,L
Ul'nn
NE.LXVỪIE
i—ị
i
w…wvxmdm
Wylml
ưngoomuqu’xu
i
J__
. I
|
. Pantone 144C I Pantone 30050 . Pantone 032C
. Pantone 541 C . Black
IPM number: 2013MEN-258-1
Product name: BILAXTEN bilastine 20mg x 4 tablets
Countries: Vietnam
Version: 6
Date: 22 May 2013
' ---—mmm j
meds vs mun sau An pamaB asuaau ABpun '
mun amơeũuis Am ssmisne a=Jiaidew ze—aov ’pecu Bumed Jisva oc
… au amđiũu.s IWBIFÚN'V ~.Lư õuw Au Guọouenon uuunsummv 6uuwm
Bum»
unaomlủnnnnuwủọnuóưaoa manuảmwmaae o.oewnnumoưe
Guitn ns ugp
tìm:… 01 Buon … uu A MI ne… m … EA uuịu mo Mua 6uon um …» mo
wamu s… ne mun ueu ua… um
'esn ampq
Álnmm um aũapưd oeou uamuuo to uaBa: to mo (13% “3.09 MN atots
“Un!
Bumaed aas aseap suũns papu pun unummuumpum 'uogmlsmnupu uoueomui
°…FWQ I° 6… 02 WỂW°° BI®I WB
Manmncmmd hy/Sx m.
A. Mnnm'm Hmulntming Loguun end Snmn: s |.L
VIB Camp di Ho LAqull (A0) HI'IDO, lidy
dei enwtdhd bleám Muơm bới:
A. Menmni Mmuinuudng I.onmiu nnd Snnncm: S ri MENA RINl
Vn Scile Snm. 3 50131 Funzo Ian
Fix. Thuốc bán theo đơn
' EILAKTEN°
biunindOm
1 blister x 4 tablets
Hộp 1 vi x 4 viên nen
ImpoderlDNNK MENARINỈ
EILAX'I'EN°
hilutim 20 mg
. _-_- __… …,. ____-…._JƯ
ẤMFDJNgay sx
expmo
\
r……~mga uẹ1
91l -60- 90
lẸĂHG Hd YG
. ..._._J
O.
I'ỜẶR'NỂWỂLOZ: ĩ-,-LmMIO SX
gi A ớa
ofmu A1 wn'b aqa
Ai
J›bJ NY
| i0.3mm }— ia.emm ;
ỈIWI 0! ' … C
.NEJ.XV'IIE
uwmmxmm
mmmmum
. Pantone 144c I Pantone soosc I Pantone oazc
. Pantone 5410 . Black
IPM number: 2013MEN-272—1
Product name: BILAXTEN bilastine 20mg x10 tablets
Countries: Vietnam
Version: 3
Date: 22 May 2013
:Mmm : … ²8.6mm i 10.3mm [
vleđs v s kuva sava Aq oai…an asua:m mpun
mị u amdeõuss Mo samsng amdew zc-eon Pmu &mlund qsed oc ,
pn and amdetủs mueuaưv Ặư Bum Ki Wmmou uounesuoulnvdunaụen
'ỦJllp \
m Jomi Bunp ns uw 6uọnq An aog wa au Ẩ²l um u ao :Lot: mm UBnb oee
Mo JJS upo *
õunnu … Buon ooo uu Ặnni nên nlD Jvn BA wb iu: Bu M… qua uulo iuQ i
'ĩwMul 02 W.… uw uw nọw
><
asn a›qaq ỗ ư›
Alanin uasu aõmẹczd oeeu ueao|up io unan «› mo daa>ọ 'g..oe M0teq mms , Ế 9 ẳ`
um . °”
6uuped aas aseaỵđ suũs paxm put uonmpu—enuo: uoụensmnupl uoneaipm _[Ềẳ ẳ
auqsnuu lo 5… oa smimo: iaitm tmq , Ề Ề
J “ị …
m…nụẹmm bwsx im i Ỉ—
A Mem… Munuiactndng Lngm›cs um Scmms S r.l. 5
Vụ Carmoú Plb | Aqdl(ADL la7mc My ã
Bum mnimlod blenãm onm bơi“ “› ạ: _ _
A. Mmum M…ldumu Lnninìs mơ ScMin: s rl NIENA RIN| Ệ
Vu Scm Snnl›. 3 501… Futsz Ilnty
i_
Rx. Thuõc bán theo dơn
ElLAX'TEN’
bỉlutim20mg
1 blister x 10 tablets
HỌp 1 vi x 10 viên nen . 47 s……
' 7.8mm
Reg.anSĐK “_
lmponerIDNNK MENARINI
EII.A>< ổ
Amenm um Bõeaoed peau uamtp po «0an in mc daeỵ o.oz uooan sms if 2 ã
u… _ — °
bumned aas asearl suũs pan… puw uu;mupu—equno umeasmuune uoumgpul iiẵ ẫ
a…sz io 5… oz sum… mm: um | 6 Ề
_ _ _ _ _ _ J T -"f`
MuuAtclunul thx' bơ› il\ý
A. Menmm Mlnulnctmtng Lum… und Sorvm su v Ễ
v… CampodtPilc LAqu'latAO). l-67100 um Ễ
Buch mm…m byndm nduom hởl M ] ạ _
A. Monadm Mumùdurim; Lngimcs and Serqu S Il '“
v… Scllu Sanh` !! 901]\ Fnrưa My NIENARINI ' Ế .. _
f
Fix. Thuóc ban theo dơn
El ụA>< T “ N '
bilastine 20 mg
2 blister x 10 tanlets
Hộp 2 vi x 10 viên nèn
!
Reg.NolSĐK MI Ể 73……
lmponer/DNNK MENARINI
i "~_
EILAX'I' :' N ’
' |
| .
bluhne 20 mg f…JJ
@
\
aunmmq ôm oz enuo uẹu uwt lọw
18.6mm —~i 10.3mm
11 nm
475mm
'!
JxlE-LXV'IIEỵ
……onmcm
mmnu uwp
`E’“!
*:
uwmnmn-m '»
. Panlone 1440 I Pantone 30050 I Pantone 0320
I Pantone 5410 . Black
IPM number: 2013MEN-274—1
Product name: BILAXTEN bilastine 20mg x 30 tablets
Countries: Vietnam
Version: 4
Date:22 May 2013
Mù vưwMưwcleuwbnanưnmn
_v'hủhi—vinủ— ….
… w—nnun ln nh:—…
…
NINMMWIỤNDNAIDN'I qunwuum u…uymnug
hnnwu
WnkmM—JJWMImum=wmuuwh *hluưmnma
-uau …ounnwmw
unum
… IWÚI'Ị'M :uu …Dưm nmn»A na…
… .
Dnnr … nup :… mu: mu W-OIỤD . Wwwu \…
M D 0… n: mnưonuunra
...nmuu
uuuuuanunxm
A WiMnmlnb:útmuhai
~Aưuuụwi |th W.» ưnm uu , _
humủllnmnụuomb v
I Uunnnulwwmtubuunsawusn
vuqu alo… anlhlt Ầ'ỈENARINÌ
i~DIMằIKWG
Rt. Thuõc bùn meo dơn
EII.A>YAẮMZ
ra.. {
VL
«ỄZlỉ.
NẺẫZ
ffĨ
&
ỂỄỄ.
. mxw
.,0. 8
m…fvau-ìnluz
fll
K
s…... .n.í
mgxt1mz
fl :]
«
ấÀẩãn
5… E
%! a
m.ngnmz
Ỉl :]
N
tFlỉỉ.
u:levAJu NZ
ft II
«
:. ẫsZ
:.ả E
ỉ mui
Ễn1fflZ
t: : | «
Ễlẵĩ.
. m.gxl.umz
Ẹnll
«
ỄZ
Ồ… Qv …
Ổa `…ề
ỂJuNZ
Ịư!
K
:..1 âu!
mỉ Yan.va
t.:l
«
fHIEI-
5— E
rũ. mxv
ỄJJMZ
fÌII 4
ắ- J?aìlnl.
.ỊSVA .1lũZ
ỊƯI.
M
l) :Ễ.
.0— E
i ~g :—
ỆYAJuỮZ
Ỉlut 4
t
ẩiẵĩ.
_I:I)XJIIZ
Ĩlu u : {
›lurh: 4
Ồ… Q.
_
_
_ :.ă Ễ
Ễdlmz.
…ỈÍ u !
«
:) ::t
m.Ẹi1mz
ỈỈ Un…
«
pl.f Ễl.
L— E
Ổ… Ê-
…ỄJnNZ
_ị II
K
ỂV.Ết
ẸẫZ
fl I!
K
t. : …l).
… S
Ổ… mắ
mzlầe1fiz
[. Il «
ẫ,!ỉẵ.
ễQ
ttlt] . _
5— a›! :.
Ổ. ĩ. _
EXẦNZ
Íul 4
ẫulpl-Í
m,.ẵmz
ỈỈII
íflnấ
ÍÍIJ 4 … ỈỈZI
[ _
ấlưì _
'...ẳl
t::l
«
ẾRI!Iẩ
Ễ
WF>X4Ẻc
FỈII
K
5.1:3.
ễYa.1me
ặ›I.cl-
a.ẵg
flag
«
ẫtIIn.
G… 2,
ê. Ệ
ml>x « ÙZ
f! ::
«
ẵaI—I—
Ở.
ẫũ7
r Ưl 4
…F1ỂĨ
flll
……
ảẵla.
Product Name: BILAXTEN Alufoil bilastinum 20 mg (Common Pack)
Country: SG. MY. TH
IPM No: 2012|NV-406-1
Version: 2
Date: 23 January 2013
. Black
BILAXTEN® 20 m viên , … -
Bilastinc g “ VẨNPHÒNG
DẠI DIỆN
TÊN SẢN PHẨM
BILAXTEN 20 mg viên nén
THÀNH PHẦN ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
Mỗi viên nén chứa 20 mg Bilastine.
DẠNG TRÌNH BÀY
Viên nén mảu trắng hình bầu dục, hai mặt lồi. Giữa viên có vạch chia để bé đôi giúp dễ nuốt
hơn nhưng không có giá trị để chia đôi iiếu lượng thuốc.
ĐẶC TÍNH LÂM SÀNG
Chỉ định
Điếu trị triệu chứng trong trường hợp viêm mũi dị ứng (quanh năm hoặc theo mùa) và mảy
đay.
Liều lượng và cảch sử dụng
Sử dụng cho người lớn và trẻ em trên 12 tuổi.
Liều dùng 20 mg (] viên) một iần/ngảy để điều trị triệu chứng viêm mũi dị ứng (thường
xuyên hoặc theo mùa) và mảy đay.
(ẫần uống thuốc vảo thời điểm 1 giờ trước hoặc 2 giờ sau ăn. Nên uống toản bộ liều trong 1
iân duy nhât trong ngảy.
Người cao tuối
Không cần chinh liều trên người cao tuổi (xem phần đặc tinh dược động học và dược iực
học). Chưa có nhiễu bằng chứng về việc sử dụng thuốc ở bệnh nhân trên 65 tuổi.
Trẻ cm dưới 12 tuổi
Thông tin về độ an toản vả hiệu quả của bilastine trên trẻ em dưới 12 tuổi vẫn chưa được
nghiên cửu đầy đủ.
Bênh nhận suỵ thân` `
Không cân chinh iiêu trên bệnh nhân suy thận (Xem phân Đặc tỉnh dược động học).
Bênh nhân suỵ gan
Chưa có dữ liệu lâm sảng về việc dùng thuốc trên bệnh nhân suy gan. Do bilastine không
chuyến hóa qua gan mà chủ yếu thải trừ qua thận, tình trạng suy gan có thế không Iảm nông
độ thuốc trong máu vượt quá giới hạn an toản Do đó, không cân chinh iiếu trên bệnh nhân
suy gan (Xem phần đặc tính dược động học).
Đô dải đơt điếu tri:
Trong điếu trị viêm mũi dị ứng, việc điều trị chỉ giới hạn trong khoảng thời gian có tiếp xúc
với yêu tố dị nguyên. Cụ thể iả, trong điều trị viêm mũi dị ứng theo mùa, có thề ngứng thuốc
khi hết triệu chứng và sử dụng lại khi triệu chứng xuất hiện trở lại. Trong điếu trị viêm mũi dị
ứng quanh năm, nên sử dụng thuốc liên tục trong suốt thời gian tiếp xúc với dị nguyên.
Trong điều trị mảy đay, thời gian điểu trị phụ thuộc vảo dạng mảy đay, thời gian và diễn biến
cùa triệu chứng.
Chổng chỉ định
Chống chỉ định cho các bệnh nhân quả mẫn Với bilastine hoặc bất cứ thảnh phần tá dược nâo
trong chế phẩm.
Lưu ý và thận trọng khi sử dụng
Thông tin về hiệu quả và độ an toản của bilastine trên trẻ cm duói 12 tuổi vẫn chưa đuợc
nghiên cứu đầy đù.
Trên bệnh nhân suy thận nặng hoặc trung bình, việc sử dụng đồng thời bilastine vởi các chất
ức chế glycoprotein P như ketoconazol, erythromycìn, cyclosporin, rỉtonavir hoặc diltiazem
có thể lảm tăng nông dộ bilastine trong huyết tương, do đó iảm tăng nguy cơ xảy ra phản ứng
bất lợi. Vì vậy, cân tránh sử dụng đồng thời bỉlastine và các chất ửc chế giycoprotcin P trên
bệnh nhân suy thận nặng hoặc trung binh.
Tương tảc thuốc và cảc tương tác khả_c có liên quan ,
Tương tác vói thức ăn: Thức ăn có thế lảm gìảm sinh khả dụng đường uông cùa bilastine
khoảng 30%.
Tương tác với nước bưởi chùm: uống bilastine 20 mg vởỉ nước buờỉ chùm lảm giảm sinh khả
dụng cùa thuốc 30%. Hiện tượng nảy có thể xảy ra với cảc loại nước quả khác. Mức độ giảm
sinh khả dụng có thế dao động giữa cảc chế phẩm và các loại hoa quả khác nhau. Cơ chế cùa
tương tảc nảy là thông qua quá trình ức chế OATPIA2, một chắt vận chuyến bilastine từ
đường tiêu hóa vảo mảu (xem mục Đặc tính dược động học). Các thuốc là cơ chất hoặc chất
ức chế OATPIAZ như ritonavir hoặc rifampicin có thể lảm giảm nồng độ bilastine trong
hu ết tương.
\.
Tương tảo với kctoconazol hoăc crvthromvcin: Uống đồng thời bilastine vả ketocónazol hoặc
erythromycin có thế lảm tăng AUC cùa bilastine 2 lần, tăng Cmax 2—3 lần. Điều nảy có thể
giải thich do tương tác vởi cảc chất vận chuyền dưa thuốc trở lại lòng ống tiêu hóa, do
bilastine iả cơ chẳt cúa P-gp vả không bị chuyến hóa (xem phần Đặc tính dược động học).
Những thay đồi nảy có thể không ảnh hưởng đến mức độ an toản cùa bilastine cũng như
kctoconazol hoặc erythromycin. Cảc thuốc khảo cũng lả cơ chất hoặc chẳt ức chế P-gp, ví dụ
như cyclosporine, cũng có nguy cơ lảm tăng nồng độ huyết tương của bilastine.
Tương tác với diltìazem: Uống đồng thời bilastine 20 mg vả dìltiazem 60 mg lảm tăng nồng
độ Cmax của bilastine lên 50%. Đỉếu nảy có thề lí giải do tương tảo với cảc chẳt vận chuyền
đưa thuốc trở lại lòng óng tiêu hóa (xem phần Đặc tính duợc động học), và có thế không ảnh
hưởng đển mức độ an toản cúa bilastine.
Tương tác vởi rươu: Trạng thải tâm thần vận động sau khi uống đồng thời rượu vả 20 mg
bilastine tương tự như kêt quả ghi nhận sau khi uông đông thòi rượu và giả dược.
Tương tác với lorazegam: Uống đờng thời bilastine 20 mg vả loracham 3 mg trong 8 ngảy
không lảm tăng tác dụng trên hệ thân kinh trung uong cùa loracham.
Tác động trên khả nãng sinh sản, phụ nữ có thai và cho con bú
Tảo đông trên khả năng sinh sản: Chưa có hoặc rất ít bằng chứng lâm sảng. Một nghiên cứu
trên chuột cho thắy không có tảo động tỉêu cực nảo trên chức năng sinh sản (xem phần Dữ
iiệu an toản tiền lâm sáng).
Phu nữ có thai: Không có hoặc có rất ít dữ liệu về việc sử dụng bilastine trên phụ nữ có thai.
Nghiên cứu trên động vật không cho thấy tảo động có hại trực tiếp hoặc giản tiếp lên khá nảng
sinh sản, sự phảt triến của bảo thai và sau sinh (xem phần Dữ liệu an toản tiền lâm sảng). Tuy
nhiên để đảm bảo an toản, tránh sử dụng BILAXTEN trong giai đoạn mang thai.
Phu nữ cho con bú: Thông tin về khả năng bải xuất qua sữa mẹ của bilastine vẫn chưa được
biết rõ. Đặc điếm nảy cũng chưa được nghiên cứu trên động vật. Trên thực tế, cần quyết định
tiếp tục/ngừng cho con bú hay tiếp tục/ngừng sử dụng BILAXTEN dựa trên tương quan giữa
lợi ích cùa việc bú mẹ cho trẻ và lợi ích của mẹ khi sử dụng bilastine.
Tác động lên khả năng lái xe và vận hânh mảy móc
Một nghiên cứu được thực hiện để đánh giá tác động của bilastine lên khả năng iái xe đã cho
thấy việc sử dụng liều 20 mg không ảnh hưởng đến khả năng lái xe. Tuy nhiên, bệnh nhân cần
được thông báo rằng có một số trường hợp hiếm gập có thể thấy buồn ngủ và ảnh hưởng đến
khả năng vận hảnh máy móc tảu xe.
Tác dụng không mong muốn q7ì/
Trong cảc thử nghiệm lâm sảng, số lượng tảo dụng không mong muốn gặp phải ở bệnh nhân
viêm mũi dị ứng hoặc mảy đay nguyên phảt mãn tính được điều trị bằng bilastine 20 mg
tương tự với số lượng ghi nhận trên bệnh nhân sử dụng giá dược (12,7% so với 12,8%).
Cảc phản ứng bất lợi của thuốc (ADRs) thường ghi nhận được trên bệnh nhân sử dụng
bilastine 20mg trong thử nghiệm lâm sảng pha II và pha III là đau đầu, buồn ngủ, chóng mặt
vả mệt mòi. Các phản ứng nảy xuất hiện với tuần suất tương tự tần suất ghi nhận được trên
bệnh nhân sử dụng giá dược.
Cảc phản ứng bất lợi ít nhất có thể liên quan đến biiastine vả được báo cảọ trong hơn 0,1%
bệnh nhân dùng bilastine 20mg trong giai đoạn phát triên lâm sảng của thuôc được phân loại
dưới đây.
Tần suất ghi nhận như sau:
Rất phổ biễn (2… 0)
Phổ biến (ì1/100m <…0)
Không phổ biến (21/1000 to <…00)
Hiếm gặp (21/1000010 <… .000)
Rât hiếm gặp (<1/10000)
Không rõ (không thể ước tinh được từ cảc dữ liệu hiện có)
Cảc phản ứng hiếm gặp, rất hiểm gặp vả không rõ không được ghi vảo bảng.
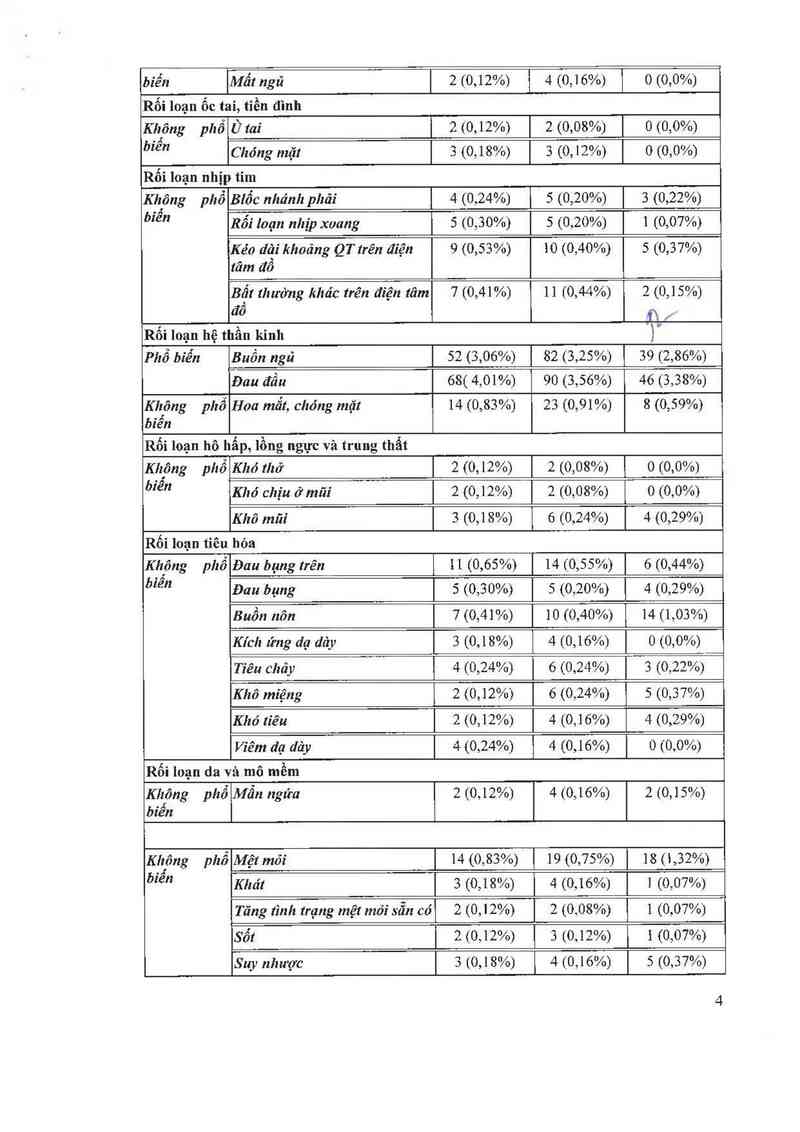
Hệ cơ quan Bilastine All Bilastine Placebo
Tần suất Phản ứng bẩt lợi 20 mg Doses N=1362
N=1697 N=2525
Nhiễm trùng và nhiễm kí sinh trùng
Không phổ Herpes miệng 2 (0,12%) 2 (0,08%) 0 (0,0%)
biến
Rối loạn chuyển hóa và dinh dường
Không phổ Tăng cảm giác thèm ãn IO (0,59%) 1 1 (0,44%) 7 (0,51%)
biến
Rối Ioạn tâm lý
Không phổ Lo lẳng ] 6 (0,35%) | 8 (0,32%) | 0 (0,0%)
biển Mất ngủ 2 (0,12%) 4 (0,16%) 0 (0,0%)
Rối loạn ốc tai, tiền đình
Khtông phổ Ù tai 2 (0,12%) 2 (0,08%) | 0 (0,0%)
bíê” Chóng mặt 3 (0,18%) 3 (0,12%) 0 (0,0%)
Rối loạn nhịp tim
Kh_ông phổ Blổc nhánh phải 4 (0,24%) 5 (0,20%) 3 (0,22%)
bfê” Rối Ioạn nhịp xoang 5 (0,30%) 5 (0,20%) 1 (0,07%)
Kéo 11111 khoảng QT trên điện 9 (0,53%) 10 (0,40%) 5 (0,37%)
tâm đô
Bặt thường khác trên điện tâm 7 (0,41%) 11 (0,44%) 2 (0,15%)
đô ĩLj.
Rối loạn hệ thần kinh )“
Phổ biển Buồn ngủ 52 (3,06%) 82 (3,25%) 1 39 (2,86%)
Đau đầu 68( 4,01%) 90 (3,56%) 46 (3,38%)
Kh'ông phố Hoa mắt, chóng mặt 14 (0,83%) 23 (0,91%) 8 (0,59%)
biên
Rối loạn hô hẫp, lồng ngực và trung thất
Kh_ông phổ Khó thở 2 (0,12%) 2 (0,08%) 1 0 (0,0%)
biên Khó chịu ở mãi 2 (0,12%) 2 (0,08%) 0 (0,0%)
Khô mũi 3 (0,18%) 6 (0,24%) 4 (0,29%)
Rối loạn tiêu hóa
thông phổ Đau bụng trên 11 (0,65%) 14 (0,55%) l 6 (0,44%)
biê” Đau bụng 5 (0,30%) 5 (0,20%) 4 (0,29%)
Buồn nôn 7 (0,41%) 10 (0,40%) 14 (1,03%)
Kích ứng dạ dảy 3 (0,18%) 4 (0,16%) | 0 (0,0%)
Tiêu chảy 4 (0,24%) 6 (0,24%) | 3 (0,22%)—
Khô miệng 2 (0,12%) 6 (0,24%) 5 (0,37%)
Khó tiêu 2 (0,12%) 4 (0,16%) 4 (0,29%)
Viêm dạ dảy 4 (0,24%) 4 (0,16%) 0 (0,0%)
Rối loạn da và mô mềm
K]tịông phổ Mẫn ngứa 2 (0,12%) 4 (0,16%) 2 (0,15%)
biên
Kngông phổ Mệt mõi 14 (0,83%) 19 (0,75%) 18 (1,32%)
biẽ” Khát 3 (0,18%) 4 (0,16%) 1 (0,07%)
Tăng tình trạng mệt mỏi sẵn có 2 (0,12%) 2 (0,08%) 1 1 (0,07%)
Sổt 2 (0,12%) 1 3 (0,12%) 1 (0,07%)
Suy nhược
3 (0,18%)
1 4 (0,16%)
5 (0,37%)
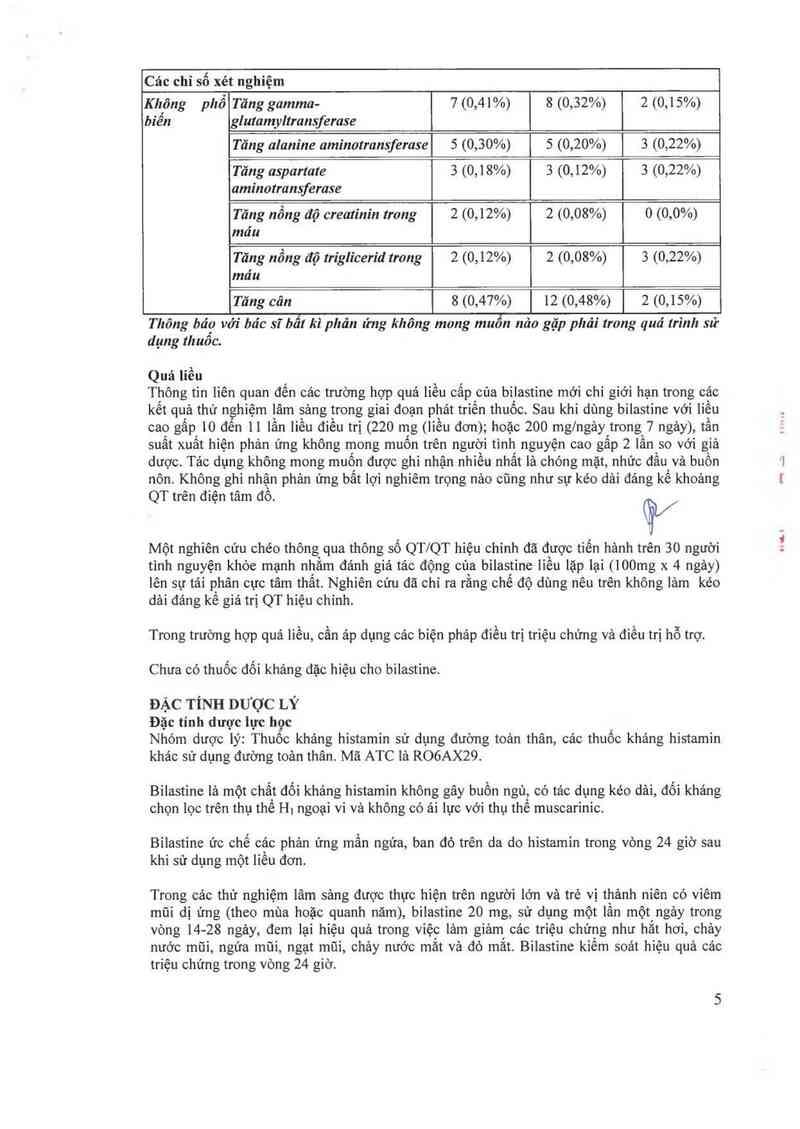
Các chỉ số xét nghiệm
Kh'ông phổ Tăng gamma- 7 (0,41%) 8 (0,32%) 2 (0,15%)
biên glutamyltransferase
Tăng alam'ne aminotransferase 5 (0,30%) 5 (0,20%) 3 (0,22%)
Tăng aspartate 3 (0,18%) 3 (0,12%) 3 (0,22%)
aminotransferase
Tăng nồng độ creatinin trong 2 (0,12%) 2 (0,08%) 0 (0,0%)
máu
Tăng nổng độ triglicerid trong 2 (0,12%) 2 (0,08%) 3 (0,22%)
máu
T ăng cân 8 (0,47%) 12 (0,48%) 2 (0,15%)
Thông báp với bác sĩ bẩt kì phản ửng không mong muốn nảo gặp phải trong quá trình sử
dụng thuôc.
Quá liêu
Thông tin liên quan đến cảc trường hợp quá liều cấp cùa bilastine mới chỉ giới hạn trong các
kết quả thử nghiệm lâm sảng trong giai đoạn phát triến thuốc. Sau khi dùng bilastine với liều
cao gâp 10 đến 11 lần liều điều trị (220 mg (liều đơn); hoặc 200 mg/ngây trong 7 ngảy), tần
suất xuât hiện phản ứng không mong muôn trên người tình nguyện cao gâp 2 lần so với giả
dược. Tảo dụng không mong muốn được ghi nhận nhiều nhất là chóng mặt, nhức đầu và buồn
nôn. Không ghi nhận phản ứng bất lợi nghiêm trọng nảo cũng như sự kéo dải đảng kế khoảng
QT trên điện tâm đồ. (Ệ/
Một nghiên cứu chéo thông qua thông số QT/QT hiệu chỉnh đã được tiến hảnh trên 30 người
tình nguyện khỏe mạnh nhằm đảnh giả tác động cùa bilastine liều lặp lại (lOOmg x 4 ngảy)
lên sự tái phân cực tâm thất. Nghiên cứu đã chỉ ra rằng chế độ dùng nêu trên không lảm kéo
dải đáng kẻ giá trị QT hiệu chỉnh.
Trong trường hợp quá liều, cần ảp dụng cảc bỉện pháp điều trị triệu chứng và điều trị hỗ trợ.
Chưa có thuốc đối kháng đặc hiệu cho bilastine.
ĐẶC TÍNH DƯỢC LÝ
Đặc tính dược lực học
Nhóm dược lý: Thuôc kháng histamin sử dụng đường toản thân, cảc thuốc khảng histamin
khảo sử dụng đường toản thân. Mã ATC lả ROGAX29.
Bilastine là một chất dối khảng hỉstamin không gây buồn ngủ, có tảc dụng kéo dải, đối khảng
chọn lọc trên thụ thể H. ngoại vi và không có ải lực với thụ thể muscarinic.
Bỉlastine ức chế cảc phản ứng mấu ngứa, ban đỏ trên da do histamin trong vòng 24 giờ sau
khi sử dụng một liêu đơn.
Trong các thử nghiệm lâm sảng được thực hiện trên người lớn và trẻ vị thảnh niên có viêm
mũi dị ứng (theo mùa hoặc quanh năm), bilastine 20 mg, sử dụng một lần một ngảy trong
vòng 14- 28 ngảy, đem lại hiệu quả trong vỉệc lảm giảm các triệu chứng như hắt hơi, chảy
nước mũi, ngứa mũi, ngạt mũi, chảy nước mắt vả đỏ mắt. Bilastine kiềm soát hiệu quả cảc
triệu chứng trong vòng 24 giờ.
Trong hai thử nghiệm lâm sảng được thực hiện trên bệnh nhân mảy đay nguyên phảt mãn
tính, bilastine 20 mg, uống một lần/ngảy trong 28 ngảy chứng mình được hiệu quả trong lảm
giảm mức độ ngứa và gỉảm sô lượng, kích thước cùa các vết sần cũng như cảm giảc khó chịu
của bệnh nhân do mảy đay Bệnh nhân cải thiện được chất lượng giâc ngủ vả do đó, cải thiện
chất lượng cuộc sống.
Không có trường hợp nảo kéo dải khoảng QT hiệu chinh hoặc tảc dụng không mong muốn
trên tim mạch được ghi nhận trong các thử nghiệm lâm sảng của bỉlastine, ngay cả với liều
200 mg mỗi ngây (gấ 10 lần Iiểu điều trị) trong vòng 7 ngảy trên 9 bệnh nhân, hoặc thậm chí
ngay cả khi cùng phoi hợp với các thuốc ức chế P-gp, như ketoconazole (24 bệnh nhân) và
erythromycin (bệnh nhân). Thêm vảo dó, một nghiên cứu theo dõi khoảng QT cũng đã được
thực hiện trên 30 người tình nguyện.
Trong cảc thử nghiệm lâm sảng có kiếm soát, khi sử dụng lỉều khuyến cáo là 20 mg một
lần/ngây, dữ liệu về tính an toản trên hệ thần kinh trung ương cùa bilastine tương đương với
giả dược vả ti suất ghi nhận tình trạng buồn ngủ không khác biệt có ý nghĩa thống kê so với
giả dược. Các thử nghiệm lâm sảng cho thấy bilastine với lìều 40 mg một lấnlngảy không ánh
hưởng đến hoạt tính tâm thần vận động cũng như khả năng lái xe được đảnh giả thông qua
một bải kìểm tra lải xe quy chuẩn.
Người cao tuồì (2 65 tuồỉ) được lựa chọn trong nghiên cứu pha 1] vả pha III, kết quả cho thấy
không có sự khác biệt trong hiệu quả cũng như độ an toản khi so sánh với nhóm bệnh nhân trẻ
tuôi hơn.
Đặc tính dược động học Cỉp
Hâp thu
Bilastine dược hấp thu nhanh sau khi uống và đạt nổng độ tối đa trong huyết tương sau
khoảng 1,3 giờ. Thuốc không bị tích lũy. Giá trị sinh khả dụng đường uống trung bình của
bilastine là 61%.
Phân bô
Nghiên cứu in vỉtro và in vivo cho thấy bilastine là một cơ chất của P-gp (xem mục Tương tảc
thuốc và các tương tảc cỏ lìên quan, tương tảc với ketoconazol, erythromycin vả diltiazem) và
cơ chất của OATP (xem mục Tương tác thuốc và các tương tác có Iỉên quan, tương tác với
nước bưởi chùm). Bilastinc không phải là cơ chất của các chất vận chuyền BCRP hoặc chất
vận chuyển tại thận OCT2, OATl vả OAT3. Theo các nghiên cứu in vitro, bilastine không
được dự đoản lả ức chế cảc chất vận chuyền trong toản hệ thống, bao gồm: P-gp, MRP2,
BCRP, BSEP, OATPIBI, OATP] BB, OATP28], OATl, OAT3, OCTI, OCT2, vả NTCP, do
chi có mức độ ức chế thấp được ghi nhận với P-gp, OATP2B1 vả OCTl, với gìả trị IC,o ước
tính > 300 ụM, cao hơn rất nhiều so với nồng độ tối đa ước tính trong huyết tương Cmax. Vì
thể, cảc tương tảc nảy không có nhiều ảnh hưởng trên lâm sảng Tuy nhiên, cũng theo cảc
nghiên cứu nảy, không thế loại trừ tảc dụng ức chế cùa bilastine lên các chất vận chuyển trên
niêm mạc ruột.
Ó liều điểu trị, tỉ lệ gắn vởi protein huyết tương của thuốc là 84-90%.
Chuyền hóa '
Kêt quả các nghiên cứu in vitro cho thây bilastine không cảm ứng hoặc ức chê hoạt tính của
CYP4SO.
Thải trừ
Trong một nghiên cứu cân bằng khối được thực hiện trên người tình nguyện khỏe mạnh, sau
khi uông một liều đơn 20 mg MI-C bilastine, gần như 95% liều dùng được tìm thấy trong nước
tiếu (28, 3%) vả phân (66, 5%) dưới dạng bilastine không biến đổi. Điều nảy cho thấy bilastine
không được chuyển hóa nhiều trong cơ thể người. Thời gian bản thải trung bình tính trên
người tình nguyện khỏe mạnh là 14,5 giờ.
Mức độ tuyến tính
Bilastine biểu hiện mô hình dược động học tuyến tỉnh trong khoảng liều nghiên cứu (5 đến
220 mg), với mức độ dao động nhỏ giữa cảc cá thế.
Bệnh nhân suy thận:
Trong một nghiên cứu trên các bệnh nhân suy thận, giá trị trung bình (SD) của AUCo. m tăng
từ 737,4 (i260,8) ng x giờ/mi trên bệnh nhân chức năng thận bình thường (độ lọc cầu thận: >
80 ml/phútll, 73 m 2) lên 967, 4 (i140, 2) ng x giờ/ml trên bệnh nhân suy thận nhẹ (Độ lọc cầu
thận: 50- 80 ml/phút/l, 73 m ), 1384, 2 (:|:263, 23)2 ng x giờ/mi trên bệnh nhân suy thận trung
bình (Độ lọc cẩu thận: 30- <50 ml/phủtl], 73 m ), và 1708, 5 (i699, 0) ng x giờ/ml trên bệnh
nhân suy thận nặng (Độ lọc cầu thận: < 30 ml/phủt/l, 73 m 2). Giá trị trung bình (SD) cùa thời
gian bản thải cùa bilastine là 9,3 h (i 2,8) trên cảc bệnh nhân bình thường, 15,1 h (i 7,7) trên
bệnh nhân suy thận nhẹ, 10,5 h (i 2,3) trên bệnh nhân suy thận trung bình và 18,4 h (:1: 11,4)
trên bệnh nhân suy thận nặng. Quả trinh bải xuất qua nước tìếu gần như được hoản tất sau 48
-72giờ trên tất cả cảc đối tượng Những thay đồi về dược động học nảy không cho thấy ảnh
hưởng rõ rệt trên lâm sảng trên độ an toản của bilastine, do nông độ thuốc trong huyết tương
trong trường hợp bệnh nhân suy thận vẫn nằm trong khoảng điều trị. Ở/
Bệnh nhân suy gan:
Không có dữ liệu về dược động học trên bệnh nhân suy gan. Ở người, bilastine không bị
chuyển hóa. Do kểt quả trong những nghiên cứu trên bệnh nhân suy thận cho thắy dường thải
trừ qua thận là đường thải trừ chính, quá trình bải xuất qua mật chỉ đóng góp một phẩn rất nhỏ
vảo sự thải trừ cùa bilastine. Sự thay đổi chức năng gan có thể không lảm thay đổi đáng kể
dược động học của bilastine trên 1âm sảng.
Người cao tuổi:
Có rất ít dữ liệu về việc sử dụng thuốc cho người trên 65 tuối. Chưa có khác bỉệt có ý nghĩa
thống kê nảo được ghi nhận giữa đặc tính dược động học cùa bilastine trên người cao tuôi và
trên người trẻ tuồi.
Dữ liệu an toân tịền lâm sảng `
Các nghiên cứu về độ_an toản dược lý, độc tính khi dùng liêu lặp lại, độc tính trên gen, nguy
cơ gây ung thư cho thây không có nguy cơ đặc biệt khi sử dụng bilastine.
Trong cảc nghiên cứu về độc tính của bilastine trên sinh sản (nghiên cứu trên chuột trước và
sau khi trứng lảm tổ, nghiên cứu trên nguy cơ hình thảnh không hoản chinh xương sọ, xương
ức và xương chi của thò), cảc bất thường chỉ ghi nhận ở liều gây độc tỉnh trên mẹ. Nồng độ
thuốc tương ứng với NOAELs rất cao (> 30 lần) so với nổng độ tương ứng ở liều điều trị
khuyến cảo trên người.
Trong một nghiên cứu về tảo động cùa thuốc trên khả năng sinh sản cùa chuột, bìlastine được
sử dụng với iiều lên tới 1000 mg/kglngảy không gây ra tảc động trên các cơ quan sinh sản đực
và cái. Các chỉ số liên quan đến khả năng giao phối, sỉnh sản và mang thai đều không bị ảnh
hướng.
\\’k\ ố " ẽi /®7/
Một nghiên cứu đảnh giặ sự phân bố của thuốc trên chuột bằng cách đo nồng độ thuốc có gắn
chất phóng xạ đã cho thây bilastine không bị tích lũy trong hệ thân kinh trung ương.
ĐẶC TÍNH DƯỢC PHẨM
Các tá dược
Microcrystalline Cellulose, Sodium Starch Glycolate (Type A) (nguồn gốc từ khoai tây),
Colioidal Anhydrous Silica, Magnesiưm Stearate.
Các chẩt tương kị
Chưa ghi nhận
Thời hạn sử dụng
5 năm
Bảo quản
Bảo quản ở nhiệt độ dưới 30°C.
Tránh tấm tay với vả tấm mắt cùa trẻ nhò. TUO' CỤC TRUONG
P.TRUỜNG PHÒNG
., ," . ĩ ' li ' J Ilf \ ` ,
Đọc kĩ hướng dẫn sử dụng trước khi dùng. Đê biếểiffliiảifẩỗhg' Ểấfiiây' tiẵấẩiắfchảo ý kiên bảc sĩ
của bạn. Thuốc nây cần được kê đơn.
Bản chất và thânh phần của bao bì .ẨỆ/
Thuốc được đóng gói trong vi gồm 2 phần:
Lớp vỏ bao, có chứa polyamide (mặt ngoải của vỏ), nhôm và PVC (mặt trong của vò)
Lá nhôm
Lá nhôm được bịt kín bằng nhiệt sử dụng lớp dính nhiệt (polymer kết hợp PVC-PVAC’ '
nhựa butylmethacrylate) để gắn vảo lớp vỏ bao sau khi đã đủc khuôn và đặt viên thuốc.
Hộp ] vỉ x 4 viên, ] v1x 10 viên, 2 vì x 10 viên, 3 vi x 10 viên, 4_vỉ x 10 viên, 5 vi x 10 viên.
Các vì được đóng gói trong hộp bìa cứng. Không phải dạng nảo kê trên cũng được bán trên thị
trường.
Lưu ý khi sử dụng , q ' `
Không có lưu ý gì đặc biệt. Tât cả các sản phâm không sử dụng nữa hoặc vỏ thuôc bỏ đi cân
được xử [ý theo quy định tại từng địa phương.
NGÀY DUYỆT NỘI DUNG
Thảng 5 năm 2013
SẢN XUẤT BờI
A. Menarỉni Manufacturing Logistics and Services S.r.l.
Via Campo di Pile, L’Aquila (AQ), 1—67100, Ime
KIỀM NGHIỆM BờI
A. Menarini Manufacturing Logistics and Services S.r.l.
Via Sette Santi, 3 50131 Firenze Italy
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng