







g c: …2
s=—. >° Ổ
Ễầ gg 9 m
~51-G
\ m’ 2 —<
. t~ _
,… ễ <` a
:` U
Ể n
ẵ.
ả lẵl
ẳ
ẵ«
ằẽ lì
ẫ BICAIVIED 150
` Bicalutamide Tablets 150 mg
ẳ 30 Tablets
s @
x Mỗi viên nén bao phim chứa Bicalutamid 150mg.
ẫ Chỉ _ ,cảch dùng, chống chỉ định và cảc thông tin khác: Xem Hướng dẫn sử
ẫ dụng k ] theo. Đọc kỹ Hướng dẫn sử dụng trước khi dùng. Để thuốc ngoải tầm
tay trẻ em. Bảo quản ở nhiệt độ dưới 30 C, tránh ảm.
' Ẹ ; l
[
v
lv
alAẹlnpanlrln
li'dCh l'ilứl uuáfè'ủ Iầ'Blè't fflằlHễ
150 mg of Bicalutamide.
Dosage : As directed by the physician.
Store below 30° C. protect from moisture.
Keep out of reach of children.
Route of administration: Oral
Therapeutic category: Anti neoplastic
Refer product insert for more information.
Bt - 'l'huôc bán theo đơn
BICADIED 150
Viên nén Bicalutamid 150 mg
Carton Size : 155 X 25 X 65 mm
f`.nrtnn Tvnn ' Rida nnnn
Nnỵ. LIU. lJU.. :.»:thle IAU lvn lu
Batch No.lSố lô SX:
Mfg.DatelNSX:
Exp.DatelHDz
VN Reg.No.lSố ĐK:
Doanh nghiệp nhập khảu:
Manufactured by/Cơ sở sán xuất:
HETERO LABS LIMITED
Unit-Vl. Survey No.410. 411. APIIC
Formulatíon SEZ. Polepally Wlage. Jadcherla
Mandal. Mahaboobnagar District. Andhra
Pradesh. An dộ
150
BicaIutamide Tablets 50 mg
10 h
Hộp 3 ví x [0 viên
30 Tablets
Foil Width: 156 mm
Blister Size: 150 x 60 mm
Repeat length: 40 mm
Colour: Single colour PANTONE 582 C
( 8
BICABIED 150
Bicalutarnide Tablets 150 mg
Each Nrn coated [ablel conta ns 150 mg of Bicalutarnide
Dosnge As drrected by the phystman
Slore beíow 30“ C` pmtect from mcusture
Keep out ol reach of children.
&
BICAMED 150
\ Bicalutamide Tablets 150 mg
Route of admmxstratmn Oral
Therapeutsc category Anti neoplashc
Refer product Insert “or more mĩormanon
Mfg. LIC. NO . 26-'MNJAPIZO1OJPG
2xxxxxx
Manufactured by
'] HETERO LABS LIMITED
Umi VI. Survey No,MO 411` APHC
Formulahon SEẮ. PoiepaHy \laMage.
Jadcherla Mandai. Mahaboobnagar
DiSlnci. Andhra Pradesh, Àn-đo
Refer product mserl for rnore Wovmauon
Min Llf Nn ` ?Br'MN/APPOfflJFJG
Dosage As dưecteơ by t're physician
Store beiow 30“ C. protect ĩrom 'novstufe
Keep oul of reach of ChIỈÚÍÊP
&
BICAMED 150
BicaiUiâfflìdê Tablets 150 mg
Each fvim coated '.ablet comams
Dosage As directed by the ohysxcuan
Store betow 30'* C. orotecl from mmslure.
Keep out of reach of chvtdren.
Ra
chMED 150
iiamìde Tabiets 150 mg
med tablei ooma
~teđ by \he ọhvsuuan.
~lecl from mo«sture
“\dren
fflì1ll—
ms 150 mg Of Bioamì
/ tach mm coaĩed Iablei co~tams 150 mg oi B caiutameơe
150 mg oi B ca…tamxde
anvde
2xxxxxx
Manufactured by
“]i HETERO LABS LIMITED
l_ẩ Um! VI. Survey NOJHO. 411` APIIC
Formulatton SEZ, Polepaiiỵ VAI.age`
Jadc'nerla Manda… Mahaboobnagar
District. Andhra Pradesh. Àn—ỔO
' ' i ' rmaton
Refer product mseri for mote mo ]
Mfg Ltc NO 26]MNfAPJZOiOIPG
2xxxxxx
Manulaciured by,
HETERO LABS LIMITED HC
Unì\ VI. Survey No.4\O. 411_AP
Formuialnon SEZ. Polepaily Vmage
DiSƯICi, Andhra Pradesh, Amiò
Refer product insert for more informauon
Mfg. LiC. No 26ẢMNIAPJ'ÊO1WFfG
2xxxxxx
…— lư '. iiv;~ẫ ' v
uÓf~uẮeieno LABS UmJỄỆ. . . ;…
` N___ 4 , , ~_ .-
FẺẵ u…t Vìỉrrvẳye : PJ›~uaHy Wage
Ẹầ`nịưr 3 '~`iJ"'ỔĨ’
Òisinct. Andhra Pfacư
.:ảl _ụ. …,w ygì'i
\\
oi
Z
…
›-
…
Jz
i
|8i
lo
-…
ẫ
Ắ² I
am c
!0 _`— ›
z E'?'z“
:… c aỉ
`Il .ỄỂỄ
`ẵỉ-Jỉ /
\
3 '—
::
…
2
<
9
m!
1
IU
`P-
W
l:
0
[1
N
|.-
ầẺ
`
… d
c;`
'ẳ.
tẩu
ID
BICAMED 150
(Viên nén Bicalutamid 150 mg)
HƯỚNG DĂN SỬ DỤNG
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tìn, xin hỏi ý kỉến bác sỹ.
Thuốc bản theo đơn.
Thảnh phần: Mỗi viên nén bao phim chứa 150 mg bicaiutamỉd.
Tả dược: Lactose monohydrate, crospovỉdone, povidone, magnesium stearate, opadry white Y-l-
7000.
Dược lực học: Antiandrogen, ATC code L02 B 803
Bỉcalutamid là chất khảng androgen thuộc nhóm không steroid, không có các hoạt tính nội tỉết khảo.
Nó gắn kết với các thụ thể androgen mã không có biếu hiện hoạt hoá gen và vì thế ức chế sự kích
thích androgen Sự thoải trìển của cảc khối u (1 tuyến tiền Iíệt là do sự ức chế nảy. Trên lâm sảng,
ngưng dùng thuốc bicalutamid có thể dẫn đến hội chứng cai thuốc khảng androgen ở một số bệnh
nhân. Bỉcalutamid 150 mg đã được nghiên cứu điều trị trên những bệnh nhân ung thư tuyến tiến liệt
khu trú (Tl-T2, NO or NX, MO) hoặc tỉến triến tại chỗ (T3-T4, vởi mọi N, MO; Tl—T2, N+, MO) chưa
di cãn trong các phân tích phối hợp với ba gíả dược có kiểm soát, các nghiên cứu mù đôi trên 8113
bệnh nhân, bỉcalutamid đã được chỉ dịnh như liệu pháp hormone tức thì hoặc liệu pháp hỗ trợ phẫu
thuật cắt bỏ tuyển tiến liệt hoặc xạ trị liệu, (xạ trị tia ngoải ban đầu). Thời gian theo dõi trung bình 9, 7
năm, 36, 6% và 38,17% đã xuất hỉện bệnh tiến trìển trên những bệnh nhân được điểu trị riêng rẽ với
bicalutamid vả giả dược. Đã quan sảt thây sự giảm thiều nguy cơ dẫn đến bệnh tiến triến ở hầu hết
bệnh nhân ở hai nhóm nhưng đã có hầu hết bằng chứng về các nguy cơ bệnh tỉến triển. Do đó, bác sỹ
điều trị có thể quyết định chỉến lược điều trị tối ưu cho bệnh nhân với nguy cơ bệnh tiến triển thấp
nhất, dặc bỉệt trong điểu trị hỗ trợ sau khi phẫu thuật cẳt bỏ tuyến tỉền liệt, có thế trì hoãn liệu phảp
hormone cho đến khi có các dấu hiệu cùa bệnh đang tiến triển. Không thấy có sự khảo nhau về tổng
thời gìan sống sót sau theo dõi trung bình 9, 7 năm với 31,4% tử vong (Tỷ số rủi ro HR= 1,01; 95%
CI 0,94 đến 1,09). Tuy nhiên, đã cho thấy một số xu hướng rõ rệt trong cảc phân tích hóm đỉều tra.
Dữ lìệu về sống sót bệnh không tiểu triến và thời gian sông sót toản bộ dựa vảo d ldoáeraplan-
Meier trên những bệnh nhân có bệnh tiến trỉến tại chỗ đã được tóm tắt trong cảc bảng W
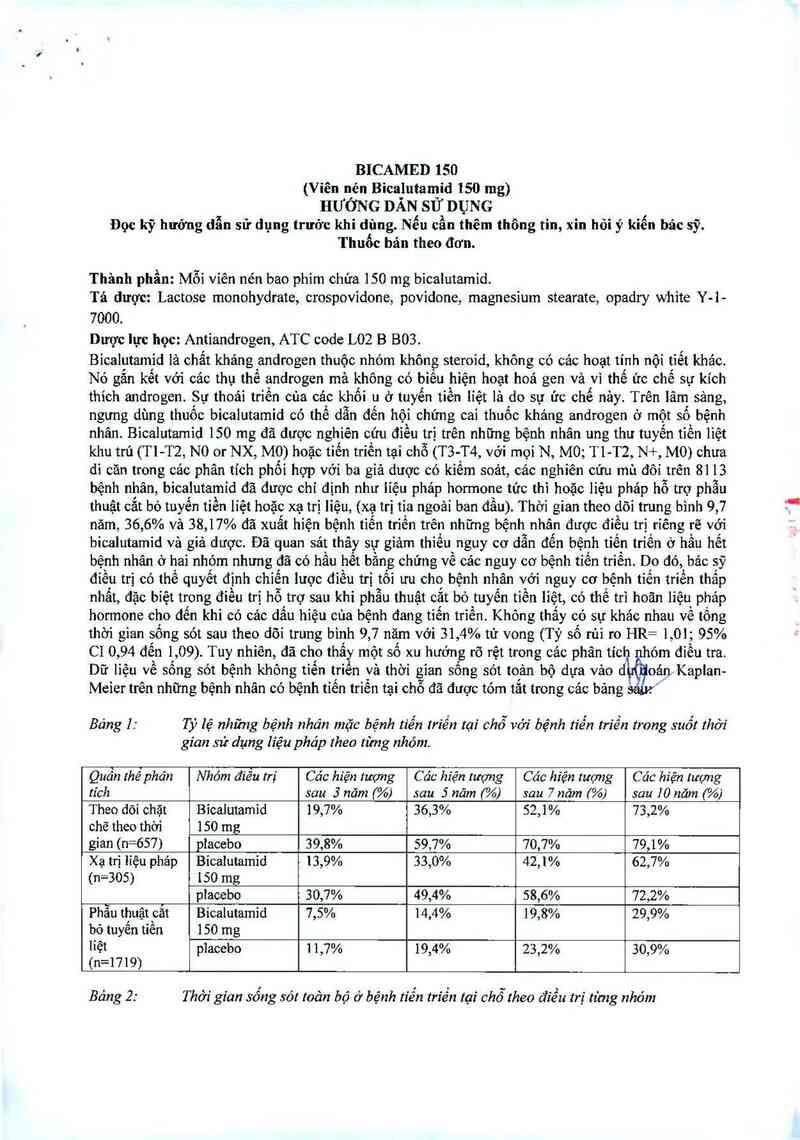
Báng ]: Tỷ lệ những bệnh nhân mặc bệnh tỉến triển tại chỗ với bệnh tiến triền trong suốt rhờí
gian sử dụng liệu pháp theo từng nhóm.
Quần fhểphân Nhóm điều trị Các hiện tượng Các hiện tượng Căc hiện mọng Các hiện lượng
tích sau 3 năm (%) sau 5 năm (%) sau 7 năm (%) sau 10 năm (%)
Theo dõi chặt Bỉcalutamỉd 19,7% 36,3% 52,1% 73,2%
chẽ theo thời 150 mg
gian (n=657) placebo 39,8% 59,7% 70,7% 79,1%
Xạ trị líệu pháp Bícalutamid 13,9% 33,0% 42,1% 62,7%
(n=305) ISO mg
placebo 30,7% 49,4% 58,6% 72,2%
Phẫu thuật cẳt Bícalutamid 7,5% 14,4% 19,8% 29,9%
bỏ tuyển tiền 150 mg
liệt placebo 1 1,7% 19,4% 23,2% 30,9%
(n=1719)
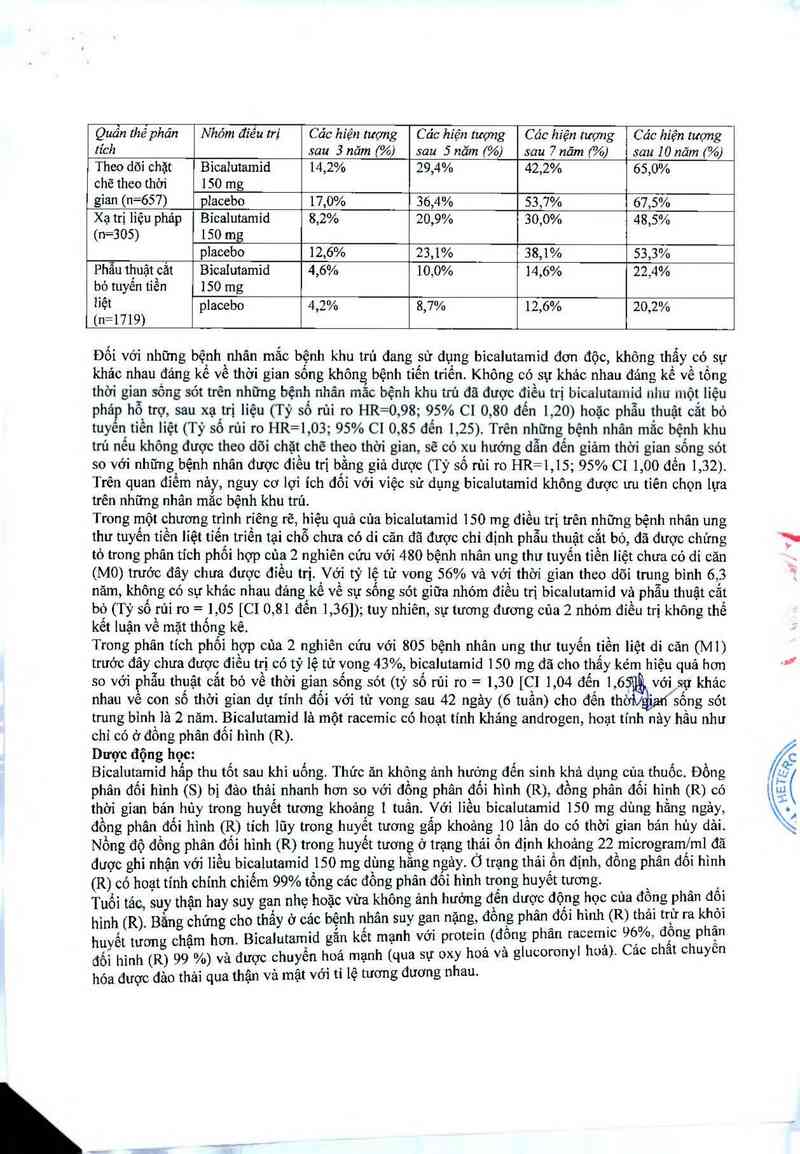
Bảng 2: Thời gian sống sót toân bộ ở bệnh tiển triển lại chỗ theo điều trị từng nhóm
Quần thếphân Nhóm điêu tri Các hiện tượng Các hiện tượng Các hiện tượng Các hiện lượng
tích sau 3 năm (%) sau 5 năm (%) sau 7 năm (%) sau 10 năm (%)
Theo dõi chặt Bicaiutamid 14,2% 29,4% 42,2% 65,0%
chẽ theo thời 150 mg
gian (n=657) piacebo 17,0% 36,4% 53,7% 67,5%
Xạ trị liệu phảp Bicalutamid 8,2% 20,9% 30,0% 48,5%
(n=305) 150 mg
placebo 12,6% 23,1% 38,1% 53,3%
Phẫu thuật cắt Bicaiutamid 4,6% 10,0% 14,6% 22,4%
bò tuyến tiền 150 mg
liệt placebo 4,2% 8,7% 12,6% 20,2%
(n=1719)
Đối với những bệnh nhân mắc bệnh khu trú đang sử dụng bicalutamỉd đơn độc, không thẩy có sự
khảo nhau đảng kể về thời gian sổng khôn bệnh tiến triền. Không có sự khác nhau đảng kể về tống
thời gian sông sót trên những bệnh nhân măc bệnh khu trú đã được điều t1ị bic- alutamid như một liệu
pháp hỗ trợ, sau xạ trị liệu (Tỷ số rùi ro HR= 0, 98, 95% CI 0,80 đến 1,20) hoặc phẫu thuật cắt bỏ
tuyên tiền liệt (Tỷ số rùi ro HR=l ,;03 95% C] 0,85 dển ] ,.25) Trên những bệnh nhân mắc bệnh khu
trú nếu không được theo dõi chặt chẽ theo thời gian, sẽ có xu hướng dẫn đến giảm thời gian sống sót
so với những bệnh nhân được điếu trị bằng giá dược (Tỷ số rủi ro HR=I ,;15 95% CI 1,00 đến 1 ,.32)
Trên quan điếm nảy, nguy cơ lợi ích đối với việc sử dụng bicalutamid không được ưu tìên chọn lựa
trên những nhân mắc bệnh khu trú.
Trong một chương trình riêng rẽ, hiệu quả cùa bicalutamid 150 mg điếu trị trên những bệnh nhân ung
thư tuyến tiến lỉệt tiến triền tại chỗ chưa có di căn đã được chỉ định phẫu thuật cẳt bò, đã được chứng
tỏ trong phân tích phối hợp của 2 nghiên cứu với 480 bệnh nhân ung thư tuyến tiền líệt chưa có di căn
(MO) trước đây chưa được điều trị. Với tỷ lệ tử vong 56% và với thời gỉan theo dõi trung binh 6, 3
năm, không có sự khác nhau đảng kể về sự sống sót gỉữa nhóm điều trị bicalutamid vả phẫu thuật cẳt
bỏ (Tỷ sô rùi ro — 1,05 [CI 0,81 đến 1 ,36]); tuy nhiên, sự tương đương của 2 nhóm điều trị không thế
kết luận về mặt thống kê.
Trong phân tích phối hợp của 2 nghiên cứu vởi 805 bệnh nhân ung thư tuyến tiền liệt di căn (MI)
trước đây chưa được đỉều trị có tỷ lệ tử vong 43%, bỉcalutamid 150 mg đã cho thấy kém hỉệu quả hơn
so với phẫu thuật cắt bỏ về thời gian sông sót (tỷ số rủi ro = 1,30 [C] 1,04 đến 1 ,631 với 811 khác
nhau vế con số thời gian dự tính đối vói tử vong sau 42 ngảy (6 tuần) cho đến th` gịarĩ sống sót
trung bình là 2 năm. Bicalutamid lả một racemic có hoạt tính kháng androgen, hoạt tính nảy hầu như
chỉ có ở đồng phân dối hình (R).
Dược động học:
Bỉcalutamìd hẳp thu tốt sau khi uống. Thức ãn không ảnh hưởng đến sinh khả dụng của thuốc. Đồng
phân đối hình (S) bị đảo thải nhanh hơn so với đồng phân đối hình (R), đồng phân đối hinh (R) có
thời gian bán hùy trong huyết tương khoảng 1 tuân. Với liều bicalutamid 150 mg dùng hằng ngảy,
đồng phân đối hình (R) tích lũy trong huyết tương gấp khoảng 10 lần do có thời gian bản hùy dải.
Nồng độ đồng phân đối hinh (R) trong huyết tương ở trạng thái on định khoảng 22 mỉcrogramlml đã
được ghi nhận với liều bicalutamid 150 mg dùng hằng ngảy Ở trạng thải on định, đồng phân dối hỉnh
(R) có hoạt tính chính chiếm 99% tổng cảc đồng phân đối hình trong huyết tương.
Tuổi tác, suy thận hay suy gan nhẹ hoặc vừa không ảnh hưởng đến dược động học cùa đổng phânkẳối
hình (R) Bằng chửng cho thấy Ở các bệnh nhân SUY gan nặng, đồng Phân đối hinh _(Rễễẵải Ểẵ ra hậỉ
huyết tương chậm hơn. Bỉcalutamid gắn kết mạnh vởi protein (đồng phân ralcẵmic Cảcohhấtnẵhỉ ẽn
đối hinh (R) 99 %) va được chuyến h0ả mạnh (qua Sự oxy hoá Và glucorony Oả) y
hóa được đảo thải qua thận vả mật với tỉ lệ tương đương nhau.
I
Bicalutamid ức chế cytochrom P450 (CYP 3A4), do vậy nên thận trọng khi dùng chung với những
thuốc chuyển hóa chủ yêu bằng CYP 3A4. Bệnh nhân có vấn để di truyền hiếm gặp vẽ không dung
nạp galactose, thiếu hụt Lapp lactase hoặc kẻm hấp thu glucose—galactose không nên dùng thuốc nảy.
Mang thai và cho con bú
Bicalutamid chống chỉ định ở phụ nữ vả không được dùng cho phụ nữ có thai hoặc cho con bú.
Tác dụn không mong muốn
Trong phan nảy, cảc tảo dụng không mong muốn được định nghĩa như sau: Rất thường gặp (>1/ 10);
thường gặp (›1/100 đến <1/10); ít gặp (›1/1.000 dến <1/100); hiếm (>1/10.000 đến <1/1.000); rất
hiếm (<1/10.000); Chưa biết (không thể dự doản theo dữ lỉệu hiện có)
Rất thường gặp: Nổi ban, chứng vú to ở đản ong và cãng tức vủb, suy nhược.
Thường gặp: mất ngủ, biếng ăn, suy giảm tình dục, trầm cảm, chóng mặt, ngủ gả, nóng bừng, dau
bụng, táo bón, khó tỉêu, đầy hơi, buồn nôn, nhiễm độc gan, vảng da, transaminasesa tăng cao, rụng
tóc, chứng rậm lông, khô da, ngứa, đái máu, rối loạn cương, dau ngực, phù, tăng cân.
Ít gặp: Phản ửng nhạy cảm, phù mạch và mảy đay, bệnh phối kẽ. Đã có báo cáo về hậu quả gây tử
vong.
Hiếm gập: Suy gan Đã có bảo cáo về hậu quả gây tử vong.
a. Các thay đối trăm trọng ở gan rất hiếm gặp vả thường dai dẳng, khả năng phục hồi hoặc cải thíện khi tiếp
tục liệu pháp hoặc sau khi ngừng liệu pháp
b. Chủ yêu các bệnh nhân đang dùng bỉcalutamid 150 mg như một đơn trị liệu đã bị chứng to vú ở đản ông
vả/hoặc đau vú. Trong các nghiên cứu về những triệu chứng nảy đã được xem là sẽ dẫn đến trấm trọng lên
đến 5% otr0ng tống sô các bệnh nhân Chửng to vú ở đản ông không thể phục hồi một ca'ch tự nhíên sau khi
ngừng liệuphảp, đặc biệt sau điểu trị keó dải.
Ảnh hưởng lên khá nãng lái xe và vận hânh máy mỏc:
Bỉcalutamid không ]ảm suy giảm khả năng lải xe hay vận hảnh máy của các bệnh nhân.
Tuy nhiên, cần lưu ý buồn ngủ thỉnh thoảng có thể xảy ra. Bất kỳ bệnh nhân nảo bị ảnh hưởng nên
cần thận trọng.
Quá liều:
Chưa có trường hợp nảo quá lỉều ở người.
Không có thuôc giải độc dặc hỉệu, biện pháp xử trí là điều trị triệu chứng. Thấm phân có thể không
hữu ích vì bicalutamid gắn kết mạnh với protein và không trở lại dạng không đổi trong nước tiếu.
Cần chỉ định điều trị nâng đỡ toản thân kể cả theo dõi thường xuyên các dấu hiệu sinh tồn
Hạn dùng: 24 thảng kể từ ngảy sản xuất. Không dùng thuốc sau ngảy hết hạn được ghiịy n vỏ hộp.
Bảo quản: Bảo quản thuốc ở nhiệt độ dưới 300C, trảnh ảm. Để thuốc xa tầm tay trẻ em.
Đỏng gói: Hộp chứa 3 ví x 10 viên.
Tiêu chuẩn thânh phẫm: Tỉêu chuẩn nhà sản xuất.
Tên và địa chỉ nhà sản xuất: Hetero Labs Limited, Unit — VI, Sy. No. 410, 411 APIIC Formuiation
SEZ, Polepally vỉllage, Jadcherla Mandal, Mahaboobnagar District, Andhra Pradesh, Án-độ.
TUQ. cục TRUỞNG
P.TRUỜNG PHÒNG
Jiỷayễn Jf“afy JfễìnỢa
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng