




















2 mm zauìu -
uus 11.023 3 m -
mns me a 1211 -
me xonioau -
mznfam _
²0 Z g >
III E % 2 ổ
ỉẵ² ẵ ² & C
ẽ .. 9 O .. n.
ẫ Ể Ể ẵ Ễ Ế ỉ Ju a 0 >
H“ < 3 m g ` rẵẵỗ
~ 3 2 … ẳ 9— 8 9
g … .. ỗ… c_n. z
m `l 8 o Ễ Ế ""
3 3 co 0 ẵ ffl c-nt
3 “' ả i 8
~ 3 "a“ Ẹì’ễ
ẵ E ả” a %
n 3 Ui
ả 3 2
2—-á
`lìllu!liẫ
P UIll Wl # i'm le iil diU
…meycm ga ư:q"lấẵể
uufaiwđ uu…mwnsytủm & LAMTM
_ ,… … 'ủvoum'" AVỌ
.ulllm.ưưlloa.ln›uouỉ TABLETS 150 mg TABLETS 150 mg
'. 4… 1: ~>
1 :: ị ỄỄ LAMIVUDINE TABLETS
'" Ễ ơ
ỉ
Ễ® a ẳ “
E ả Visa No.: xxxxxx
… …… Mfg. Lic. No.: MNB/95/2
““““ Ềĩẳ'fflẵ’h
V1saNc'xxzxxx XY
mg. Lic, …:… Mnerssn LABORATORIES LIMI
…E … …… Paonta Sahib, Dist. Sirmo
fflẳẵẵẩẵẵẵ Himachal Pradesh ~ 173 015
Paonta Sahm. Dut Smmur
Hưnth Pradesh ~ 173 025
;3 ỉặẳẳ
=² !ễỆẳ
ẳậ ẳểẳ_
: g aảgg'
' ỄỄ: ẵ²-²ã
nẹp um
ạu
!
C Ổ
» ã
”0 0
E CCD
m)>ựO’
2—<
Ơ !“..g
c Ễ`m"
ổ
Ô
l/ÀL
N`S
ÀÀIWWIOOl `de1
ANWW/OO~ PJW
XXXXXXĨ`ON H
ĩNllS
——›
6… on sms…
…wv10Avm
’*AVOLAM’“
nsms 150 mg
Each iilm—coated tablet contains :
Lamwudine USP 150 mg
, Dosage : As directed by the physician.
Store below 30"C. protected irom rnoisture.
Keep all medicines out ot the reach
oi children.
R'AVOLAM“
TABLETS 150 mg
LAMIVUDINE TABLETS
… - muờc EAN TNEO oơu
Mõi vì0n nén hlo ph … chứa [ nmwudnne USP 150 mg
Hop 1 chu x 50 win SĐK: XXXXXX 56 lô SX. NSX. HD
xam 'B.No ; Mid ; Exp ' trũn bl0 bi BAo quán dưới 30²0,
trtnh ấm Chi đinh. Clch đủng, Chóng dií dinh, Clc thớng tin
khlc: xem iờ hướng dln sử dung um Ihno
Đoc kỹ hườrg dăn trước kh: nữ cung, ĐA lhuóc xu tâm my
lÃrấ em.Sấn xuất bò RANBAXV LABORATORIES LIMITED,
@
DNNK XXXXX
RANBAXY
60 Tablets
_:
(1ELLIWI'I samowuọav1
ẮXVHNVH ?
“72 |; %
Imưfaln _
am… -
agăg
:; ẽ ẵ :.
s ạ 3 g
i 1
II r²—ỉ ả gz
E_ a: g O
Ê ẵ ẵ 2 m Ẹ
.".' .'.’ Q " z
H ị ị Ể ;1 - ẵẳẩ?ằ
Ỉỉ … 8 ; gaăO
ẵ >< x a = E
9 N " ® < ỂỄ Z
a ;8 aễeg
g aã Ểẵs_
: “’ ễ ìễ
ả ã ả :xă
ế 3 9
(__—P\
.uNpụp É
in ua… cm 10 im uuụJpow rl 4…
…… D°De;md “I.Dt ~oẵỉỉlg
uuụmnumlcaisuipiy:moo & | E nnTM
ủi… asr au~Mwn B(AVỌLAMW Avo
:iuluiuuaioumuwcwuwuị TABLETS 150 mg TABLETS 150 mg
__ ; q› _
:; g ễẳ LAMIVUDINE TABLETS
- ỉ
Ế E 5 =
m El 0
E® g Visa No.: ›oocxxx
… u… Mfg. Lic. No.: MNBI95/Z
mg m…v
;… mun… MADE IN INDIA
…,… …… BANBAXY “
Mlg Lic No… uueasn LABORATORIES LIMIT lò
…ne……n… Paonta Sahib. Dist. Sirmo r
ỀẺỆÍỆỄỂY Himachal Pradesh -1730 a
HỂa'canuap ln'nelssnễ 1 n ouzs _ _ A
ụ—J U
N s
AMWWIOCI : 'dxa
›
ẳẳlẵ
ậả .… ẽ
ả ẵ
'uuuimủumm
nuong nam…m
ÀNWINIOCI Í `PJW
XXXXXX ĩ`°N '8
ÌNI.LĐ
6… om smuvx
…wv1mwm
'*AVOLAMm
TABLETS 150 mg
Each iilm-coated tabiet contains :
Lamivudine USP 150 mg
Dosage : As direcled by the physician.
Slore beiow 30'C. protected irom moisture
Keep all medicines out oi the reach
oi children
Rvwon.mW”
TABLETS 150 mg 1
LAMIVUDINE TABLETS
Ru - THUOC BAN meo nơN
Mỏi vien nen blc phim chủ: Lumivuuino USP 150 mg
Hộp 1 chli x 60 vion. som xxxxxx sô io sx. MSX. HD:
( xnm ~s.No.; Mid ; Exp.’ Mn … bi BAo quAn dướl ao“c.
( tecm ẻm.cni đinh. cm oùng. Chóng chi đinh. Cóc thong «…
khư. xem tớ huớng dn sủ dụng «… ihoc.
Doc kỹ hướng ơin mm. khi lữ aụngv oC ihuóc n «… tuy
lrỒ om Sln xuti bời: RANBAXY LABORATORIES LIMITED.
GĐ \
1
( RANBAXY `
__
[ AnDớ
DNNK. xxxxx _
cmuwn same…wnọaýđ
ẮXVHNVH
ĐỌC KỸ HƯỚNG DẨN _SỬ DỤNG TRƯỚC KHI DÙNG
HÃY HÒI BÁC sĩ mỉ BIÊT THÊM THÔNG TIN
CHỈ ĐƯỢC DÙNG KHI có CHỈ DỊNH CỦA BÁC sĩ
A THÔNG TIN KÊ ĐơN
VIEN NEN AVOLAM 150 mg
(Viên nén Lamivudine)
CẢNH BÁO
NGUY co NHIÊM ACID LACTIC, ĐỢT KỊCH PHÁT VIÊM GAN B 61 BỆNH NHÂN
ĐÔNG NHIÊM VỚI HIV-l, KHI DỪNG SỬ DỤNG LAMIVUDINE, CÁC CÔNG THỨC
BÀO CHẾ KHÁC NHAU CÙA LAMIVUDINE.
Nhiễm acid Iactic và phi đại gan có kèm theo nhiễm mỡ, kể cả những trường hợp có thể dẫn (
đến tử vong, đã được bảo cáo khi dùng những chẩt đồng đẳng nucleoside dạng riêng rẽ hoặc
phối hợp, kể cả Lamivudine và những chẩt kháng retrovirus khác. Tạm thời dừng điều trị nốu
các biểu hiện lâm sâng huặc xẻt nghiệm cận lâm sảng cho thấy nhỉễm acid lactic hoặc xảc định
là nhiễm độc gan (xem CẢNH BÁO VÀ THẬN TRỌNG).
Đã có báo cáo về đợt kịch phảt viêm gan siêu vi B cẫp tỉnh ở những bệnh nhãn bị nhiễm đồng
_! thời hai loại virus là viêm gan siêu vi B (HBV) vả HIV đã ngưng dùng lamivudine. Cần phâi
theo dõi chặt chẽ chức nãng gan trên lâm sảng cũng như xẻt nghiệm ở những bệnh nhân
nhiễm đồng thời hai loại vỉrus HIV và an ít nhẩt iả một vải thảng sau khi ngưng sử dụng
lamivudine. Nếu có thể, nên tiến hảnh điều trị viêm gan sỉêu vi B cho bâo đã… (xem CẢNH
BÁO VÀ THẬN TRỌNG).
Bệnh nhân nhiễm mv-1 chỉ dùng cảc dạng bâo chế thích hợp của Iamivudine để điều trị mv-
1 (xem CANH BÁO VÀ THẬN TRỌNG).
THÀNH PHÂN ạ
VIÊN NÊN AVOLAM 150 mg
Mỗi viên nén bao phim có chứa: Lamivudine USP ........ 150 mg
Tá dược: Microc›ystallíne Cellulose, Sodium Starch Glycolale, Magnesium Sterate, Opadry
03458900 while, Nước cất.
MÔ TẨ’
VIÊN NÉN AVOLAM chứa Iamìvudìne, còn gọi là 3TC, lả chất tổng hợp thuộc đồng dẳng
nucleoside có hoạt tính khảng virus gây suy giảm miễn dịch ở người nhóm 1 (HlV-l) và virus gây
viêm gan sỉêu vi B (HBV). Danh pháp hoá học cùa nó là 2(111)-Pyrimidinone, 4-amino—l-[2-
(hydroxymethyl)~l,3-oxathỉoian~S-yl]-2R-cis)-. Công thức phân tử cùa lamivudìne lả CngleOJS
và phân tử lượng là 229,26. Cấu trúc phân từ như sau:
i/22
NH2
ịộ
…o/YjN
S
LAMIVUDINE
cni ĐỊNH "²
VIÊN NÉN AVOLAM 150 mg chứa 150 mg lamìvudinc (đồng đẳng nucleoside) dược chi dịnh
phối hợp cảc thuốc khảng retrovirus khảo để diều trị nhỉễm virus gây suy giảm mỉễn dịch ở người
(HlV-l).
Hạn chế sử dụng: Liều lượng cùa thuốc nảy chi dược sử dụng cho bệnh nhân nhiễm HIV-l và không
sử dụng cho bệnh nhân nhiễm HBV.
LIÊU LƯỢNG vÀ CÁCH DÙNG "²
VIÊN NÉN AVOLAM 150 mg (Viên nén Lamivudine lSOmg) có thể không thích hợp cho tất cả
cảc phảc đổ liều dùng khuyến cáo dặc biệt ở một số đối tượng như bệnh nhi vả bệnh nhân bị suy
chức năng thận; và vi vậy, cảc dạng bảo chế thích hợp đã được phê duyệt khảc vả/hoặc hảm lượng
của iamivudine nên dược sử dụng trong cảc trường hợp nảy.
Nên khời đầu đìều trị bởi một chuyên gỉa có kinh nghiệm trong việc kiềm soát nhiễm HIV. Có thể
dùng lamivudine kèm hoặc khỏng kèm thức ản.
Để đảm bảo dùng toản bộ liều thuốc, iý tưởng nhất lả nuốt trọn viên nén mã không dược nghiền viên
thuốc. Hoặc có thế nghỉền viên thuốc và thêm một ít thức ãn hơi sệt hoặc chất lòng, tẩt cả hỗn hợp
nảy được dùng ngay lập tức. R-f`
Khuyển cáo Iiểu dùng !hỏng thường của Iamivudine được trình bây như sau:
Người rrưởng thảnh vả Ihanh Ihiếu niên >]6 !uồi: Liều uống khuyến cáo cùa lamìvudỉne ở người
trưởng thảnh và thanh thiếu niên > 16 tuổi nhiễm HIV— ] iả 300 mg hằng ngảy, dùng theo cách hoặc
150 mg ngảy 2 lần hoặc 300 mg ngảy ] iẩn, phối hợp với cảc thuốc kháng retrovìrus khảc Nếu dùng
Iamivudine cho bệnh nhân nhiễm HIV- ] vả HBV, liều lượng chỉ dịnh cho trị lìệu HIV~ ] nên được sử
dụng như lá thảnh phần cùa phác đồ phối hợp thích họp.
Bệnh nhi: Liều uống khuyến cáo cùa lamivudine cho bệnh nhi nhiễm HlV-l từ 3 tháng tuối dến 16
tuốì lả 4 mglkg ngảy 2 lân (tối da ISO mg ngảy 2 lân), được dùng phối hợp với cảc thuốc kháng
retrovìrus khác.
Lamivudine cũng có dang vìên nén có rãnh ở gỉữa dảnh cho bênh nhi nhiễm HlV-l có cân năng 2 14
kg vả dans bảo chế rắn lả thích hơn cho đối tương nảv. Trưởc khi kẻ đon viên nén lamìvudine cho
trẻ em. đánh giá khả năng nuốt cùa trẻ. Nếu trẻ không thế nuốt vìên nén Iamivudỉne. nên kê đơn
dang dung dìch uống.
\gOfỡtoộ
Liều dùng lamivudine khuyến cáo cho đường uống cho bênh nhì nhiễm Hi @ bảy trong
bảng bên dưới. ktẵ New Deihi ẵ
ở
Q
\®
cỳ
2/22
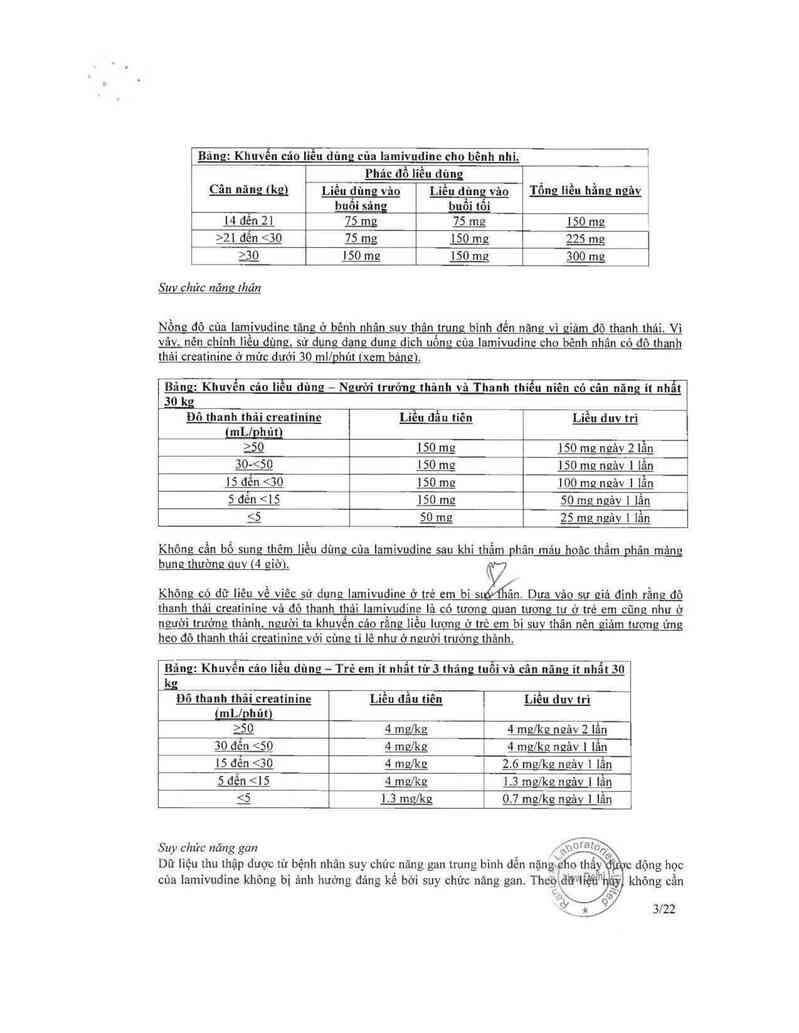
Bảng: Khuvển cáo liều dùng của lamivudinc cho bênh nhi. '
“ Phác đồ liều dùng
, buổi sá_ng buổi tối
14 dên 21 75_mg Ẹfflg 150 mg
›21 đên <30 75_mg 150 mg 225 mg
` _ a 150 mg 150 mg soo me
Suv chức nãng lhân
Nồng đô cùa lamivudine tăng ở bênh nhân suv thân trung bình đền năng vì giảm đô thanh thải. Vi
vây. nên chinh liêu dùng. sử dung dang dung dich uômz của lamỉvudìne cho bênh nhân có đô thanh
thải creatinine ở mức dưới 30 mllnhút ixem bảneì.
Đô thanh thải creatinine
ìịQ ]
30-<50 |
< [
< ]
<5 @
Không cần bổ sum: thêm liều dùng cùa lamivudine sau khi thấm phân máu hoãc thẩm Dhân mảan
bung thường guv (4 giời. \
Không có dữ liêu về viêc sử dung Iamivudine ở trẻ em bi smMỄn. Dưa vảo sư giả đinh rằng dô
thanh thải creatinỉne vả đỏ thanh thải Iamivudỉne lá có tương ouan tương tư ở trẻ em cũng như ở
người trưởng thảnhl neười ta khuyến cảo rầnp. Iiếu lương` ở trẻ em bi suv thân nên eiảm tương ứng
heo đô thanh thải creatinine với cùng ti lê như ở mzười trường thảnh.
Bá : Kh n cả |
Đô thanh thải creatinine
zg
<
1 sỉễỉa 0
<
15
Suy chức năng gan .
Dữ liệu thu lhập được từ bệnh nhân suy chức năng gan trung bình dên nặngÌf _ c dộng học
cùa lamỉvudine không bị ảnh hưởng đảng kế bởi suy chức năng gan, Thcộiểi'ữWiềẵih ` ' không cần
3/22
thiết chinh liều ở bệnh nhân suy chức năng gan trung bình đến nặng trừ khi có kèm suy chức năng
thận. Bệnh nhân dã có sẵn suy chức nảng gan, gồm viêm gan hoạt động mãn tính, tãng tẳn suất bất
thường chức năng gan khi trị liệu phối hợp với thuốc khảng retrovirus, và phải được giảm sát theo
thực hảnh chuẩn. Nếu có bằng chứng bệnh gan xấu di ở các bệnh nhân nảy, tạm thời dừng điếu trị
hoặc dừng điều trị vĩnh viễn.
SỬ DỤNG ở CÁC ĐÓI TƯỢNG ĐẶC BIỆT "²
Thai kỳ
Thai kỳ US—FDA nhỏm C. Không có cảc nghiên cứu thỉch hợp vả có đối chửng tốt cùa lamivudine ở
phụ nữ có thai. Cảo nghiên cứu sinh sản ở động vật tiến hảnh ở chuột cống và thỏ cho thấy không có
bằng chứng quải thai. Tăng chết phôi giai đoạn sớm đã xảy ra ở thò ờ nồng độ phơi nhiễm tương tự
như phơi nhiễm ở người. Chỉ sử dụng lamivudine trong thai kỳ khi lợi ích rõ rệt cao hơn nguy cơ
cho thai nhi.
Đối với bệnh nhân dồng thởi bị viêm gan và đang dược điều trị với lamivudine, và sau đó có thai,
xem xét khả năng tải phát viêm gan khi dừng sử dụng lamỉvudinc.
Dược động học cùa lamìvudìne dã được nghỉên cứu ở phụ nữ có thai trong 2 nghỉên cứu lâm sảng
được tiến hảnh ở Nam Phi. Nghiên cứu đảnh giả dược động học ở: 16 phụ nữ ở tuần thai thứ 36 đùng
ISO mg iamivudine ngảy 2 lẳn kèm với zidovudine, 10 phụ nữ ở tuần thai thứ 38 sử dụng 150 mg
lamivudine 300 mg ngảy 2 lần mà không kèm các thuốc khảng retrovirus khảc. Cảo nghiên cứu nảy
không được thiết kế hoặc đuợc tải trợ nhằm cung cấp thông tin hiệu quả. Dược động học iamivudinc
ở phụ nữ có thai tương tự như dược động học quan sảt dược ở người trường thảnh không có thai và ở
phụ nữ sau khi sinh.
Nổng độ Iamìvudine thường tương tự ở người mẹ, trẻ sơ ẵvả mẫu huyết thanh cuống rốn Trong
một nhóm người, mẫu lamivudine trong dịch ỏi được thu thập sau khi cắt dây rốn. Nồng độ dịch ối
cùa lamivudine cao hơn 2 lần nồng độ huyết thanh người mẹ và nằm trong khoảng từ 1,2 đến 2, 5
mcg/mL (150 mg ngảy 2 lẩn) và 2,1 đển 5,2 mcg/mL (300 mg ngảy 2 lần). Không biết nguy cơ tảc
dụng phụ liên quan đến Iamivudine có thay dối ở phụ nữ có thai so với bệnh nhân nhiễm HlV-l khảo
hay không.
Cảo nghiên cứu sinh sản ở động vật dùng liều uống lần lượt lên dến l30 vả 60 lần liều dùng cho
người trường thảnh ở chuột cống và thỏ, cho thẳy không có bằng chứng quải thai do lamivudine.
Tăng chết phôi giai đoạn sớm đã xảy ra ở thò ờ nồng độ phơi nhiễm tương tự như nổng độ phơi
nhiễm ở người. Tuy nhiên, không có sự cố nảy ở chuột cống ở nổng độ phơi nhiễm lên đến 35 lằn
nổng độ phơi nhiễm ở người. Theo cảc nghiên cứu nảy, lamivudine qua nhau thai và truyền vảo thai
nhì.
Rối Ioạn chức năng ty lạp thế: Nucleoside vả cảc đồng đẳng nucleotide đã được chứng minh in vitro
và in vivo lả gây tôn thương ty lạp thể ở nhiều mức độ khảo nhau Có những bảo cảo về rối loạn chức
năng ty lạp thể ở trẻ nhỏ phơi nhiễm các đồng đắng nucleoside từ trong tử cung vả/hoặc sau khi sinh.
Cho con bú
4122
Lamivudine bải tiết vảo sữa người. Mẫu Sĩra thu thập từ 20 bả mẹ dùng đơn trị liệu bằng lamivudine
(300 mg ngảy 2 lần) hoặc trị liệu phối hợp (150 mg Iamivudine ngảy 2 lần vả 300 mg zidovudine
ngảy 2 lần) có nồng độ iamivudine có thể đo lường được trong sữa.
Trung tâm kiểm soát Vả dự phòng dịch bệnh Hoa Kỳ khuyến cáo rằng cảc bả mẹ nhiễm HlV-l
không dược cho con bú sữa mẹ để trảnh truyền HlV-I sau khi sinh. Vì cả hai khả năng truyền HIV-i
vả xảy ra phản ứng phụ trầm trọng ở trẻ bú sữa mẹ, cảc bả mẹ không được cho con bú sữa mẹ.
Nhi khoa
Tính an toản vả hỉệu quả của lamivudine dùng ngảy 2 lẩn phối hợp với các thuốc kháng retrovỉrus
khảc đã được thiêt iập ở bệnh nhi từ 3 tháng tuôi trở lên (xem TÁC DỤNG KHÔNG MONG
MUÔN).
Lão khoa
Những nghiên cứu lâm sảng cùa iamìvudine đã không tích lũy đủ số bệnh nhân trên 65 tuổi để xảc
định xem họ có dáp ứng với thuốc khác với nhóm người trẻ hơn hay không. Thông thường, cần phải
thận trọng khi chọn liều dùng cho bệnh nhân cao tuối và phải nghĩ đến việc nhóm dân số nảy có tần
suất suy gan, suy thận, bệnh tim mạch. các bệnh khác hoặc đang dùng thuốc khác cao hơn. Dặc biệt,
vì lamivudỉne được đảo thâi chủ yểu qua thặn, và bệnh nhân cao tuổi thì thường bị suy gỉảm chức
năng thận nên cằn theo dõi chức năng thận và điểu chỉnh liều cho phù hợp (xem phần LIÊU
LƯỢNG vÀ cẤcn DÙNG).
Bệnh nhãn suy chức nãng thận
Khuyến cảo giảm liễu lượng của Iamivudỉne ở các bệnh nhân bị suy chức năng thận (xem LIÊU
LƯỢNG VÀ CÁCH DÙNG). ỷ
Bệnh nhân suy chức năng gan
Dữ liệu thu thập từ cảc bệnh nhân suy chức năng gan trung binh đến nặng cho thấy Iamivudỉne
không bị ảnh hưởng đảng kế do suy chức năng gan. Theo cảc dữ lìệu nảy, không cần thíểt chinh liều
ở bệnh nhân suy chức nãng gan trung binh đến nặng trừ khi họ có kèm suy chức năng thặn Bệnh
nhân có sẵn suy chức năng gan, gôm viêm gan hoạt động mãn tinh, tăng tần suất bất thường chức
năng gan trong khi tri iiệu khảng retrovirus phối hợp, và nên được giám sảt theo thực hânh chuẩn.
Nếu có bằng chứng bệnh gan xẩu đi ở cảc bệnh nhân nảy, điều trị gián đoạn hoặc dừng diển trị nên
được xem xét.
CHỐNG CHÍ ĐỊNH "²
VIÊN NẺN AVOLAM (Viên nén Lamivudinc) chống chi dịnh sử dụng cho bệnh nhân trước đây
quả mẫn đáng kể trên lâm sảng (sốc phản vệ) đối với iamivudinc hoặc bất cứ thảnh phần nảo trong
sản phấm nảy.
CẨNH BÁO VÀ THẬN TRỌNG ’—²
VIÊN NEN AVOLAM (Vìên nén Lamivudine) không được khuyến cảo sử dụng iả đơn trị liệu.
Nhiễm acid Iactic vả phì dại gan kèm nhiễm mỡ
Nhiễm acid Iaciic/Phi đại gan nhiễm mỡ trầm IrỌng/Suy gan
Nhiễm acid Iactic và phi dại gan có kèm theo nhiễm mỡ, kể cả nhũng trường hợp có thể dẫn đến tử
vong, đã được bảo cáo khi dùng nhũng chất đồng đẳng nucleoside dạng riêng rẽ hoặc phối hợp, kể
cả Lamivudine vả những chất khảng retrovirus khác. Phần lớn những trường hợp nảy xảy ra ở phụ
nữ. Béo phì và sự kéo dải thời gian thuốc đồng đắng nucleoside tồn tại trong cơ thể là những nguy
cơ. Cần thặn trọng đặc biệt khi chỉ định Iamivudine cho bất kỳ bệnh nhân nảo có nguy cơ bệnh gan;
tuy nhiên, cũng dã có bảo cảo cảc trường hợp tác dụng phụ đã xảy ra trên những bệnh nhân không có
dấu hiệu nguy cơ nảo.
Tạm thời ngưng diếu trị với Iamivudine ở bất kỳ bệnh nhân nảo tiến triền cảc biếu hiện trẽn lâm sảng
hoặc xét nghiệm cận lâm sảng cho thây nhiêm acid Iactic hoặc được xảc định là độc tính trên gan (có
thế gôm phi đại gan vả nhiễm mỡ ngay cả khi không tăng transaminases đảng kê).
Nhiễm acid lactic, thường kèm với phi đại gan và nhiễm mỡ gan, đã được bảo cáo khi sử dụng cảc
đồng đẳng nucleoside. Cảc triệu chứng sớm (tãng lactate huyết có triệu chứng) gồm triệu chứng nhẹ
trên tiêu hóa (buổn nỏn, ói mùa và đau bụng), khó chịu, mất cảm giảc ngon miệng, sụt cân, các triệu
chửng về hô hấp (thờ nhanh vả/hoặc thờ sâu) hoặc cảc triệu chứng thần kinh (gồm yếu vận dộng).
Nhiễm acid Iactic có tỉ lệ tử vong cao vả có thể có liên quan với viêm tụy, suy gan, hoặc suy thận.
Nhiễm acid lactic thường xảy ra sau một vải thảng hoặc nhìều thảng sau diếu trị. Nên dừng diều trị
với cảc đồng đẳng nucleoside khi tăng Iactatc huyết có triệu chứng vả nhiễm acid lactỉc hoặc nhiễm
toan chuyền hóa, phi đại gan tiến triến, hoặc nồng độ aminotransferase tăng nhanh chóng. Thận
trọng khi dùng đổng đẳng nucleoside cho bất kỳ bệnh nhân (đặc biệt lả phụ nữ béo phỉ) bị phì đại
gan, viêm gan hoặc có cảc yểu tố nguy cơ đã được biết về bệnh gan và gan nhiễm mỡ (gồm thuốc
nảo đó vả alcohol). Bệnh nhân đồng nhiễm viêm gan C và được điếu trị với aipha interferon vả
ribavirin có thể có nguy cơ đặc biệt. Bệnh nhân có nguy cơ tăng nên được theo dõi chặt chẽ.
Bệnh nhân đồng nhiễm IIIV—I vả Virus gây viêm gan B và có bệnh gan
Đợt kịch phát viêm gan siêu vi B sau điểu trị: Trong những thử nghiệm lânưăng trên những bệnh
nhân không nhiễm HIV được điều trị viêm gan siêu vi B bằng iamivudinc, có bằng chứng lâm sảng
và xét nghiệm về sự bùng phát virus viêm gan sìếu vi B sau khi ngưng dùng lamivudine. Cảo đợt
kịch phảt nảy được phảt hiện trước hết là do tăng nồng độ ALT huyết thanh kèm theo sự xuất hiện
trở lại cùa HBV DNA. 'l`uy rằng phẩn lớn cảc trường hợp có vẻ như tự khòi nhưng cũng đã có một
vải trường hợp từ vong đảng tiểc xảy ra đã được báo cáo. Những trường hợp tương tự cũng dã được
báo cáo từ việc theo dõi hậu mãi, sau khi đổi phảC đồ trị HIV-l có lamivudine sang phảc đổ không
có lamivưdine cho bệnh nhân nhiễm cả HIV-l lẫn HBV. Mối quan hệ nhân quả của việc ngưng
lamivudine với hiện tượng nảy chưa dược biết rõ. Cần phải theo dõi bệnh nhân chặt chẽ cả về lâm
sảng và xét nghiệm it nhắt lả vải thảng sau khi ngưng điều trị. Chưa có bằng chúng đầy đủ để xác
định việc tải sử dụng lamivudine có thể can thỉệp vảo đợt kịch phảt viêm gan sau điểu trị hay không.
Bệnh gan: Bộnh nhân viêm gan B hoặc c mãn tính được điều trị bằng trị liệu kháng retrovỉrus phối
hợp lả bệnh nhân tăng nguy cơ về cảc biến cố nặng trên gan và có khả năng tử vong. Trong trường
hợp trị liệu khảng virus đồng thời với viêm gan B hoặc C, vui lòng tham khảo thông tin sản
phấm/thông tin kê đơn tương ứng cùa từng thuốc. Bệnh nhân sẵn bị rối loạn chức năng gan, gồm
viêm gan hoạt động mãn tính. tăng tần suất bất thường chức năng gan khi trị liệu bằng khảng
retrovirus phối hợp, và nên được theo dõi dựa theo thực hảnh chuẩn. Nếu có bangợìmngìbgnh gan
xấu đi điều trị giản đoạn hoặc dửng điều trị ở cảc bệnh nhân nảy.
Sự khác biẹt quan Irọng giữa cảc sản phẩm chứa lamivudine VÍỂN NẾN AVOLAM 150 mg chứa
hoạt chất lamivudine (ISO mơ D) khảo nhau/cao hơn so với các công thức chứa Iamivudine dùng cho
điều trị nhiễm HBV. Công thức và dạng bâo chế cùa Iamivudine cho điếu trị nhiễm HBV không
thích hợp cho bệnh nhân nhiễm đồng thời HIV và HBV. Tinh an toản vả hiệu quả của lamivudine
chưa dược nghiên cứu một cảch thòa đảng về điếu trị viêm gan B mãn tính ở cảc bệnh nhân nhiễm
đồng thời HIV và HBV. Nếu điếu trị vởi công thức lamivudine dảnh cho điều trị nhiễm HBV được
kê đơn cho bệnh nhân vỉêm gan B mãn tinh kèm nhiễm HIV không dược nhận biết và không được
điều tri, kết quả là nhanh chóng bùng phảt đề khảng HIV iả do dưới liếu diều trị và không thích hợp
cho điều trị 111v đơn trị liệu. Nếu quyết định dùng lamivudine cho bệnh nhân nhỉễm đồng thời HIV
và HBV, nên sử dụng các công thức chứa lamivudine như là một thảnh phần trong phác đồ phối hợp
thích hợp.
Bùng phải HBV đề kháng Iamivudine: c'J cảc bệnh nhân không nhiễm HIV-] được đìều tii với
lamivudine dảnh cho viêm gan B mãn tính, đã phảt hiện bùng phảt HBV đề khảng lamivudine và có
liên quan đến giảm đảp ửng điếu trị. Bùng phát cảc chũng virus gây viêm gan B có liên quan đến đề
khảng iamivudine cũng đã được báo cảo ở các bệnh nhân nhiễm HIV-l dùng phảc đố khảng
retrovirus có chứa lamivudine khi nhiễm đổng thời với vìrus viêm gan B,
Sử dụng vởi các sản phẩm chửa emtrỉcitabine vả lamivudine khác
Không dược dùng viên nén lamivudine dống thời với cảc sản phẳm khảo có chứa iamivudine gồm cả
cảc công thức iiếu lamivudine thẳp dảnh cho nhiễm HBV, các công thức khảo cùa lamivudine gồm
các công thức phối hợp có liều đùng cố định của lamivudine, hoặc các sản phấm chứa emtricitabine,
gồm các công thức phối hợp có liều dùng cố định của emtricitabine. iỆ
Sử dụng Iamivudine với phác đồ có ribavirt'ne vả ỉnterferon
Cảc nghiên cứu ín vilro cho thẳy rìbaVÌrin có thề lâm gìảm phosphoryl hóa của đồng đắng
nucleoside pyrìmidine như lamivudine. Mặc dù không có bằng chứng cùa một tương tác được động
học hoặc dược lực học (ví dụ mất sự ức chế virus HIV/HCV) được quan sảt khi ribavirin được dùng
đồng thòi vởi lamivudine ớ bệnh nhân cùng nhiễm HlV/HCV, mất bù gan (một số tử vong) đã xảy ra
ở bệnh nhân nhiễm đồng thời HlV/HCV dùng trị liệu khảng retrovirus phối hợp cho HIV và
interferon alfa kèm hoặc không kèm ribavirin. Bệnh nhân dùng interferon alfa kèm hoặc không kèm
ribavỉrin vả lamivudine nên được theo dõi chặt chẽ về cảc độc tính liên quan đến việc điều trị, đặc
biệt mắt bù gan. Xem xét dừng lamivudine khi thich hợp. Giảm liều hoặc dừng interferon alfa,
ribavirin, hoặc cả hai nên dược xem xét nếu độc tính lâm săng xẩu đi, gồm mắt bù gan (ví dụ Childs
Pugh >6) (xem thông tin kê đơn hoản chỉnh cho interferon vả ribavirin).
Viêm tụy
Các truờng hợp viêm tụy hiếm khi xảy ra. Tuy nhiên không rõ lả cảc trường hợp nảy là do điều trị
với thuốc khảng retrovirus hay iả do bệnh [IIV sẵn có Ở bệnh nhi có tiền sử phơi nhiễm với
nucleoside khảng retrovirus, tiển sử viêm tụy, hoặc cảc yểu tố đáng kể khảo dối với sụ tiến triến cùa
viêm tụy, thận trọng khi sử dụng lamivudine. Dừng diều trị với lamivudine ngay lập tức nếu các dấu
hiệu, triệu chứng lâm sảng hoặc cảc bắt thường xét nghiệm cận lâm sảng cho thấy xảy ra viêm tụy.
Hội chứng tái lập mỉễn dịch
Hội chứng tải lập miễn dịch đã dược báo cảo ở bệnh nhân được điêt tii vởi tr`
nhiễm trùng cơ hội tiềm ẩn (như nhiễm Mycobacterìum avium, cytomegalovirus, viêm phối do
Pneumocystisjiroveci (PCP), hoặc nhiễm lao) có thẻ cân thiêt phải đảnh giả và điêu trị sâu hơn.
Nhiễm trùng cơ hội
Bệnh nhân dược diếu trị với iamivudine hoặc trị liệu với bắt kỳ thuốc khảng retrovirus khảo có thể
tiếp tục phảt triến nhiễm trùng cơ hội vả cảc biến chứng khác cùa nhiễm HIV, vả vì vậy nên duy tri
chặt chẽ việc theo dõi lâm sảng bời cảc chuyến gia có kinh nghỉệm trong diếu trị cho bệnh nhân có
bênh HIV.
Sự truyền III V
Nên khuyên bệnh nhân rằng trị liệu kháng retrovirus đồng thời, gồm lamivudine, không được chứng
minh là dự phòng nguy cơ lây truyền HIV cho người khảc qua tiếp xúc giới tỉnh hoặc mảu bị nhìễm.
Nên tìếp tục thận trọng.
Tải phân bổ mỡ] Loạn dưỡng mỡ
Trị Iỉệu khảng rctrovirus phối hợp có lìên quan đến tái phân bố chất béo trong cơ thể (ioạn dưỡng
mỡ) ở bệnh nhân nhỉễm HiV. Tải phân bố mỡltích tụ mỡ trong cơ thể gồm béo bụng, tăng tích tụ mở
ở cồ~iưng (bướu trâu), tay chản khẳng khiu, mặt hốc hảc, tích tụ mở ở ngực vả “biếu hiện cushing”
đã được quan sát ở bệnh nhân dùng trị liệu khảng retrovirus. Cơ chế và hậu quả lâu dải của cảc biến
cố nảy hiện tại không biết. Mối liên hệ nhân quả chưa được thiết lập.
Mối lỉên kết giữa bệnh u mỡ nội tạng vả cảc chất ức chế protease (Pls) vả teo mô mỡ vả các chất ức
chế enzyme phiên mã ngược nucleoside (NRTIs) đã được đặt giả thiết. Một nguy cơ cao hơn về loạn
dưỡng mở có liên quan đến cảc yếu tố cả nhân như tuồi tảc cao hơn, và các yếu tố liên quan đển
thuốc như thời gian điều trị với khảng retrovirus lâu hơn và có iiên quan đển rối loạn chuyền hóa.
Kiềm tra lâm sảng đánh giá cảc dấu hiệu cơ thể về tải phân bố mỡ. Xem xẻt đảnh giả lipid huyết
thanh và glucose huyết khi đói. Rối loạn mỡ nên được giải quyết thích hợp trên lâm sảng.
Hoạỉ từ xương: Mặc dù nguyên nhân được xcm xét về nhiều yểu tố (gồm sử dụng corticosteroid,
dùng rượu, suy giảm miễn dịch trầm trọng, chỉ số khối cơ thể cao hơn), cảc trường hợp hoại từ
xương đã được báo cảo, đặc biệt ở bệnh nhân bệnh HIV tìến triển vả/hoặc phơi nhiễm lâu dải với
thuốc phối hợp khảng retrovirus (CART). Nên khuyên bệnh nhân đi khảm bệnh nếu họ bị đau và
nhức khớp, sưng khớp hoặc khó di chuyển.
Độc lính trên ty lạp thể
Cảc đồng đắng nucleoside vả nucleotide đã dược chứng minh in vilro và in vivo là gây tổn thương ty
lạp thể ở nhìều mức độ khảo nhau. Có cảc bảo các về rối loạn chức năng ty iạp thể ở trẻ nhỏ âm tinh
với HIV mã có phơi nhiễm vởi đồng đẳng nucleoside từ trong tử cung vảlhoặc sau khi sinh. Tác
dụng phụ chủ yếu được báo cảo là rối ioạn huyết học (thiểu mảu, giảm bạch cầu trung tinh). Các tảc
dụng phụ nây thường lả tạm thời. Một số rối loạn thần kình khời phảt muộn đã dược bảo cảo (tăng
trương lực, co gỉật, cư xử bất thường). Hiện tại không biết là cảc rối loạn thần kỉnh lả thoáng qua hay
vĩnh viễn. Bất kỳ trẻ em nảo phơi nhiễm với các đổng đằng nucleoside vả nucleotide trong tử cung,
ngay cả trẻ em âm tính vởi HIV, nên được theo dõi lâm sảng và xét nghiệm cận lâm sảng vả được
nghiên cừu kỹ lưỡng về khả nãng xảy ra rối loạn chức năng ty lạp thế trong trườ ' dấu hiệu
vả triệu chủng liẻn quan. Cảc biếu hiện nảy không ảnh hưởng cảc khuyến cảo hiện tại trong việc sử
dụng trị liệu khảng retrovirus ở phụ nữ có thai đề đự phòng truyền HIV tn_xc tiếp.
Trị lỉệu nucleoside bộ ba
Có những bảo cảo về tỉ lệ cao thẳt bại virus học và bùng phảt đề kháng ở giai đoạn sớm khi phối hợp
Iamivudine với tenofovir disoproxil fumarate vả abacavir cũng như với tenofovir disoproxìl fumarate
vả diđanosine như lá phảc đồ ngảy ] iằn.
Suy chức nãng thận
Ở bệnh nhân suy chức năng thận trung binh đến trầm trọng, thời gian bản thải huyết tương cuối cùng
cũa Iamivudine tăng là do giảm thanh thải; vì vậy nên điều chinh liều dùng (xem LIÊU LƯỢNG
vÀ CÁCH DÙNG).
T ác động trên khả năng lái xe và vận hânh máy móc
Không có cảc nghiên cứu trên sự tảc động trên khả năng lải xe vả vận hảnh máy móc.
Thông Iin hưởng dẫn bệnh nhãn
Thóng tin về trị liệu vởì lamivudine
Lamivudine không phải là thuốc điếu trị nhiễm i-IIV-l và do dó bệnh nhân tiếp tục bị bệnh liên quan
đến nhỉễm HlV-l, gồm cảc nhiễm trùng cơ hội. Bệnh nhân nên được chăm sóc bời chuyên gia khi sử
dụng lamivudine. Nên khuyên bệnh nhân rằng sử dụng lamivudine không được chứng minh lảm
giảm nguy cơ truyền lIIV-l cho người khác qua tiếp xúc giới tính hoặc mảu bị nhiễm.
Nên khuyên bệnh nhân rằng hỉện tại không biết tảc động lâu dải của lamivudine.
Nẽn khuyên bệnh nhân về tầm quan trọng của việc dùng lamivudine với trị liệu phối hợp theo liệu
trình liêu dùng thường lệ và trảnh quên dùng thuôo.
Không được dùng lamivudine kèm với các sản phẳm có chửa lamivudine hoặc cmtricitabine, gổm'
các phôi hợp với cảc thuôc khảc có iiêu dùng có định.
Tải phản bố/Tích lũy mỡ trong cơ thể
Nên thông báo cho bệnh nhân rằng tải phân bố hoặc tích lũy mỡ trong co thể có thể xảy m ở bệnh
nhân dùng trị liệu khảng retrovirus, gồm Iamivudine, và nguyên nhân và tảo động lâu dải trên sức
khỏe cùa các tình trạng nảy hiện tại không biết.
Sự khác biệt về cỏng lhức của lamivudine
Nên khuyên bệnh nhân rằng VIÊN NẺN AVOLAM 150 mg chứa hoạt chất iamivudine (lSOmg)
với lỉều dùng khảc nhaulcao hơn so với các công thức khác chứa iamivudine dùng để điều trị nhiễm
HBV. Công thức và iiều lượng của lamivudine trong các công thức lamivudine dùng dễ diển trị
nhiễm HBV lả không thich hợp cho bệnh nhân nhíễm đổng thời HIV và HBV. Nếu quyết định dùng
iamivudine cho bệnh nhân nhiễm đồng thời IIIV vả HBV, nên dùng VIÊN NÉN AVOLAM 150 mg
chứa lamivudine với liều [50 mg.
Nhiễm đồng thời với HIV-I vù HBV
9/22
Nên thông bảo cho bệnh nhân nhiễm dồng thời HIV] và HBV rằng sự xấu đi của bệnh gan xảy ra ở
một số trường hợp khi đã dừng điểu trị vởỉ lamivudine. Nên khuyên bệnh nhân nên thông bảo cho
chuyên gia bất kỳ cảc thay đôi nảo vê phảc đô điêu trị.
Viêm lụy
Nên khuyên cha mẹ hoặc người chăm sóc bệnh nhi theo dõi bệnh nhi cảc dắu hiệu vả triệu chứng
cùa viêm tụy.
TƯỚNG TÁC THUỐC "²
(xem ĐẶC TÍNH DƯỢC ĐỌNG nọc vÀ DƯỢC LỰC HỌC: Tương tảc thuốc)
Cảc nghiên cứu tương tảc chỉ được tiến hảnh ở người trướng thảnh,
Khả năng xảy ra tương tảc chuyển hóa iả thấp do chuyến hỏa bị hạn chế và gắn kết với protein, và
hầu hết được thanh thải qua thặn hoản toản. Chuyển hóa lamivudine không qua CYP3A, dường như
không có tương tảc với cảc thuốc được chuyến hóa bời hệ thống nảy (ví dụ thuốc ức chế protease).
Phần iớn iamivudine dược đảo thải trong nước tiểu bới bải tiểt cation hữu cơ tích cực. Nên xem xét
khả nảng tương tảc với cảc thuốc dùng đồng thời, đặc biệt khi đường đảo thải chinh lả bải tiết qua
thận tich cực thông qua hệ vận chuyển cation hũu cơ (ví dụ trimethoprim). Các thuốc khác (ví dụ
ranitidine, cimetidìne) được đảo thải chỉ một phẩm bằng sự chuyển hóa nảy vả được chứng minh lá
không gây tương tác với lamivudine. Cảc đồng đẳng nucleoside (ví dụ didanosine) như zidovudine,
không được đảo thải bới sự chuyến hóa nảy vả dường như không tương tảo với lamivudine. Không
có dữ liệu về sự tương tác với cảc thuốc khác có cơ chế thanh thải qua thận tương tự như cơ chế
thanh thải cùa lamivudine.
Phác để chứa Interjeron vả Ríbavirin: Mặc dù không có bằng chứng của một tương tảc dược động
học hoặc dược iực học (ví dụ mất sự ức chế virus HIV -1 lHCV) dược quan sảt khi ribavirin được
dùng dồng thời vởi iamivudine cho các bệnh nhân đồng nhiễm HIV—l/HCV, mất bù gan (một số bị
tử vong) đã xảy ra ở bệnh nhân nhiễm đồng thời HlV-l/HCV dùng trị liệu khảng retrovirus phối hợp
đối với nhiễm lIlV-l vả interferon alfa kèm hoặc không kèm ribavirin (sec xem CẨNH BÁO VÀ
THẬN TRỌNG). w
Zalcitabine: Lamivudine vả zalcitabine có thề ức chế phosphoryl hóa nội bảo iẫn nhau. Vì vậy,
không khuyến cáo sử dụng lamivudine phôi hợp với zalcitabine.
Trimerhoprim/SuƯamelhoxazole (T MP/SMX): Không khuyến cảo thay đối liểu dùng cùa từng thuốc.
Khỏng có thông tin liên quan đến tảc động trên dược động học cùa lamivudine ở cảc liều cao hơn
của TMP/SMX như lá TMP/SMX dùng để điều trị viêm phối do Pneumocystis carinii. Dùng
trimethoprim/sulfamethoxazole 160 mg/BOO mg dẫn đến tăng 40 % phơi nhiễm lamivudine, iả do
thảnh phẩn trimethoprim; thảnh phần sulfamethoxazolc khỏng tương tác. Tuy nhiên, trừ khi bệnh
nhân bị suy chức nảng thận, không cằn thiểt chinh liếu cùa iamivudine Lamivudine không tác động
trên dược động học của trimethoprim hoặc sulfamethoxazole. Khi đảm bảo việc dùng chung, bệnh
nhân nên được giảm sảt trên lâm sảng. Nên tránh dùng đồng thời Iamivuđine với co-trỉmoxazole liều
cao dùng điều trị viêm phối do Pneumocyslis carinii (PCP) và điều trị tox0plasmosis.
Zidovudine: Một nghiên củu tương tảc thuốc cho thắy không có tương tảc rên lâm sảng
giũa iamivudine vả zidovudine. Tăng mức độ vùa phải vẽ Cmax (28 %) cùa ỊẦđợũid in “được dùng
ỄÍNeWDe'hiễ i 10/22
-_ạị ro"
.r,y * Q
với lamivudine, tuy nhiên, sự phơi nhiễm (AUC) tống thế thì không bị thay đổi đáng kề. Zidovuđine
không tác động đến dược động học của Iamivudine.
TÁC DỤNG KHÔNG MONG MUÔN "²
Các trường hợp nhiễm acid lactic, một số bị tử vong, thường có liên quan đến phì đại gan nặng vả
kèm gan nhiễm mỡ, đã được bảo cáo khi sử dụng cảc đồng dắng nucleoside.
Trị liệu khảng retrovirus phối hợp có iiẻn quan đến tải phân bố chắt béo trong cơ thể (Ioạn dưỡng
mỡ) ở bệnh nhân HIV gổm mất lớp mỡ dưới da ở tứ chi và ở mặt, tăng tich tụ mỡ ở bụng và nội
tạng, phì đại vú và tích tụ mở ở vùng cổ-lưng (bướu trâu).
Trị iiệu khảng retrovirus phối hợp có Iiẽn quan đến bắt thường chuyền hóa như tăng triglycerỉde
huyết, tăng cholesterol huyết, đề khảng insulin, tăng glucose huyết vả tăng lactatc huyết.
Ở bệnh nhân nhiễm HIV bị suy giảm miễn dịch trằm trọng tại thời điềm khời đầu dùng trị liệu khảng
retrovirus phối hợp (CART), một phản ưng viêm không triệu chứng hoặc nhiễm trùng cơ hội tiềm ân
có thế gia tăng.
Các trường hợp hoại từ xương đã được bảo cản, đặc biệt ở bệnh nhân có cảc yếu tố nguy cơ đã được
biết, bệnh HIV tiến triền hoặc phơi nhiễm lâu dải với trị liệu kháng retrovirus phối hợp (CART).
Không biết tần suất của hoại từ xương.
KỈHỈI nehiêm !hủ' nglrỉẽm lâm sântJ
v1 cảc thừ nghỉệm lâm sảng được tiến hảnh ở nhiều điều kiện khác au; tỉ lệ phản ứng phụ quan sảt
dược trong cảc thử nghiệm lâm sảng của một thuốc không thế so sánh trực tiếp với tỉ iệ trong cảc thử
nghiệm lâm sảng cùa thuốc khác và có thể không phản ảnh tỉ lệ quan sát được trên thực tế.
Cảo phản ứng phụ sau đây được thảo iuận chi tiết hơn trong các phần khác cùa thông tin kê đơn nảy:
. Nhiễm acid lactic vả phi đại gan trầm trọng (xem CẢNH BÁO ĐẶT TRONG KHUNG;
CẢNH BÁO VÀ THẬN TRỌNG)
. Đợt kịch phảt trầm trọng cấp tinh cùa viêm gan B (xem CẢNH BÁO ĐẶT TRONG KHUNG;
CÀNH BÁO VÀ THẬN TRỌNG)
. Mất bù gan ở cảc bệnh nhân đồng thời nhiễm HtV…i và viêm gan c (xem CẢNH BÁO VÀ
THẬN TRỌNG)
. Viêm tụy (xem CẨNH BÁO vÀ THẬN TRỌNG).
Người rrưởng rhảnh — Ihử nghiệm lãm sảng ở HIV-I
Dữ iiệu tính an toản của lamivudine ở người trướng thảnh chủ yểu dựa vảo 3568 bệnh nhãn nhiễm
HlV-l trong 7 thử nghiệm lâm sảng. Phản ửng phụ xảy ia thường xuyên nhất lả nhức đầu, buổn nôn,
mệt mỏi, cảc dẩu hiệu vả triệu chứng ở mũi, tiêu chảy vả ho. Cảc tảc dụng phụ lâm sảng được chọn
iọc với tần suất 25% trong thời gian điều trị với iamivudine 150 mg ngảy 2 lần + zidovudine 200 mg
ngảy 3 iần cho đến 24 tuần dược liệt kê trong bảng bên dưới.
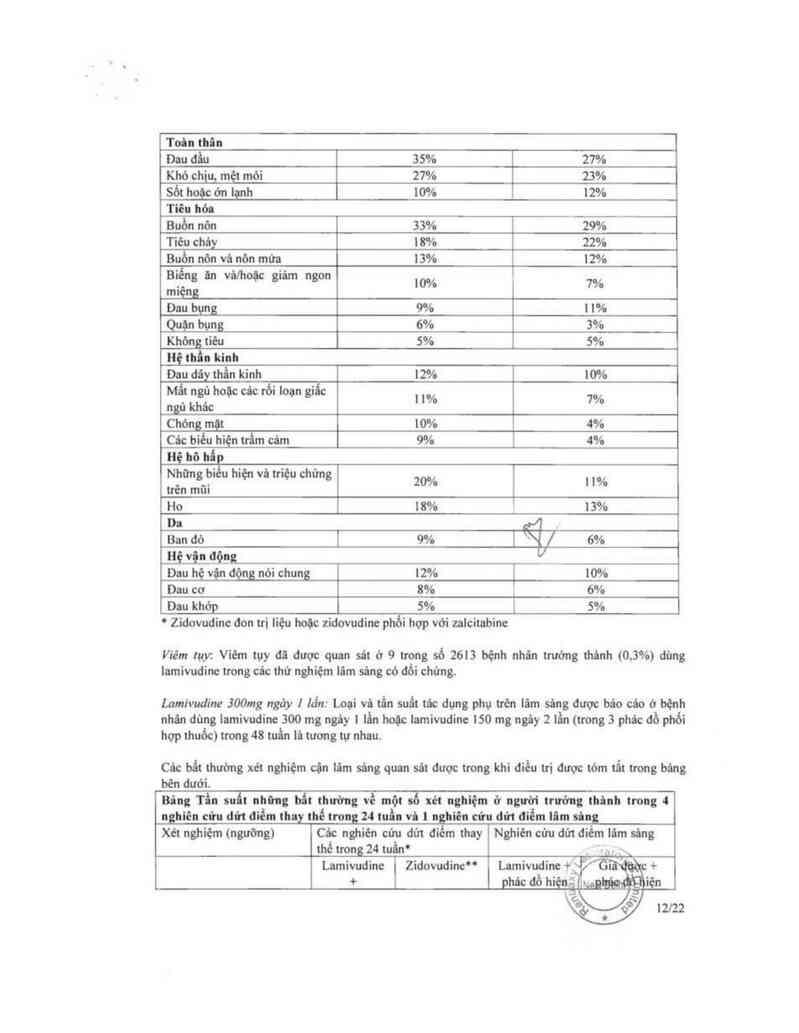
Bảng: Những trường họp có tác dụng phụ trên lâm sảng (tần suất 2 5%) trong 4 nghiên
cứu lâm sảng có đối chửng
Lamivudinc lSOmg x
, A 4 x. , . ' ởo`ẳtOf
Tac dụng phụ Zianlngay pho: họp VO'I
zidovudine mm Ế
NÊ' "” Ụỉí
be Ill22
a›5 x 7%
AST x [ 7%
Bilirubin > x
x
°ng vi thời gian nghiện cứu lù II thủng.
" Ziđơvudine đon tti liẹu hoộc phói hợp với nlcitlbine
°"Phủc dỗ hiện hữu có thẻ lả zidovudine. zidovudine + điđanosine hoặc zidovudine + nlciubine
ULN: giới hạn trên của mút: blnh thuủng.
ND: không thục hiện
Tần suất bất thường xét nghiệm cận lâm sủg được chọn lọc dược báo cáo ờ cảc bệnh nhân dùng
lamivudine soc mg ngảy 1 lần hoặc lamivudine 150 mg ngảy 2 lẩn (trong 3 phải: đổ phổi hợp thuốc)
lá tương tự nhau.
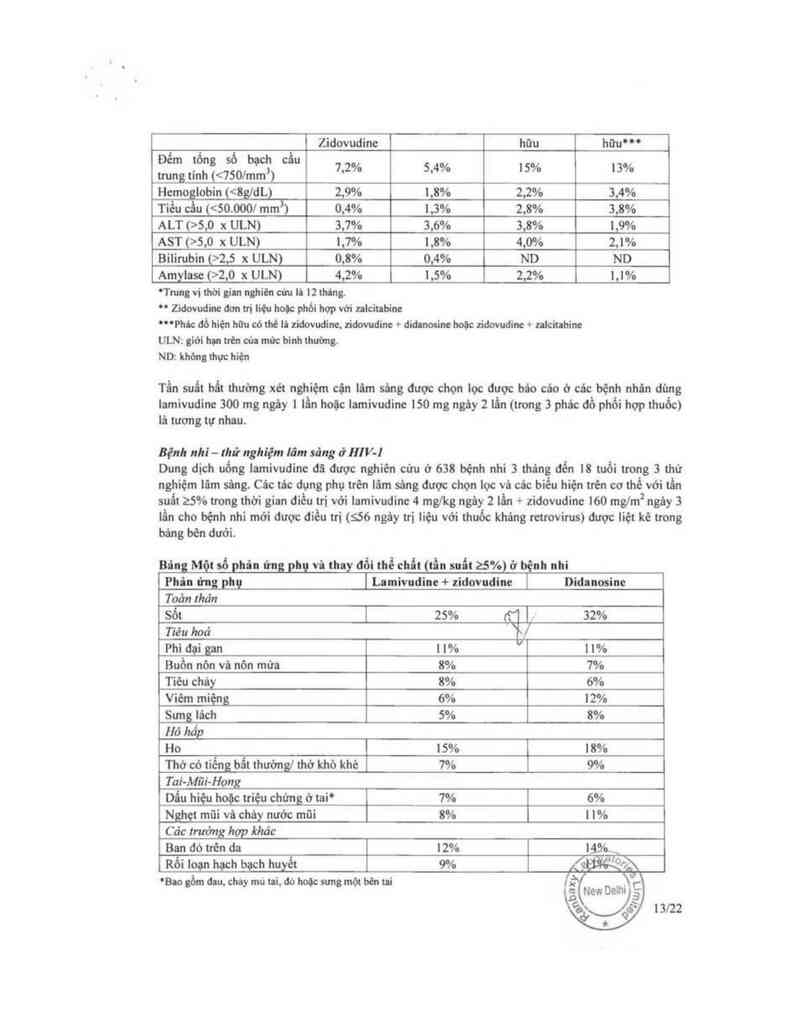
Bệnh nhì — thừ nghìệm lãm sảng ở HỈV-I
Dung dịch uống iamivudine đã dược nghiên cửu ở 638 bệnh nhỉ 3 tháng đến 18 tuồi tmng 3 thử
nghiệm lâm sảng. Các tảc dụng phụ trên lãm sảng được chỌn lọc vả các biểu hiện trén co thể với tẩn
suất 25% trong thời gian điều trị với lamivudine 4 mg/kg ngùy 2 lần + zidovudine I60 mglm2 ngây 3
iần cho bệnh nhi mới được điều trị (s56 ngây trị liệu với thuốc kháng retrovírus) được liệt kê trong
báng bén dưới.
Bâng Một số phia ứng phụ vit thay 1181 thẻ chẩt (tẩu suất 25%) ở bệnh nhi
Phân ứng phụ ỈLamivudine + zidovudine [ Didunosine
Toản thản
Sốt | 25% nợ ] 32%
Tĩẻu hoả /
Phidạigan tl% il%
Buồn nòn vi nôn mửa 8% 1%
Tiêu chảy 8% 6%
Viêm miệng 6% 12%
Sưng lách 5% 8%
Hô hấp
Ho 15% 18%
Thờ có tiếng bất thường] thờ khờ khè 1% 9%
Tai-Mũi~Họng
Dấu hiẹu hoặc triệu chửng ờ taỉ° 1% 6%
_Ngh_ẹt mũi vả cháy nước mũi 8% | 1’
Cảc :mờng hợp khảo
Ban đó trên da 12% 14th
Rối loạn họch bạch huyết 9% Ắfflfề
°Bao gồm đou. chay mu tai. đó hoộcstmgmột bẻnni
I 3l22
GỀ(New Delrồ ẫ
°e\jể
ở * Q
Viêm tụy, một số trường hợp nặng có thể gây chết, đã được quan sát thẩy ở những bệnh nhi đã từng
dùng thuốc khảng retrovirus nhóm đồng đẳng nucleoside khi điều trị bằng lamivudine riêng rẽ hoặc
phối hợp với một thuốc kháng retrovirus khác. Trong một nghiên cứu mờ nhãn dũng liều tăng dần,
14 bệnh nhân (14%) đã xảy ra viêm tụy trong khi dùng liệu phảp lamivudine riêng rẽ Ba bệnh nhân
trong số nảy đã tử vong do biến chửng viêm tụy. Trong một nghiên cứu mờ thứ hai, dã xảy ra viêm
tụy ở 12 bệnh nhân (18%). Trong một thử nghiệm lâm sảng có 236 bệnh nhân dược cho đùng ngẫu
nhiên lamivudine phối hợp zidovudine, người ta đã không thẳy xảy ra viêm tụy. Viêm tụy đã đuợc
quan sảt thấy trên 1 bệnh nhân cùa nghiên cứu nảy khi người ây dùng lamivudine phối hợp với
zidovudine vả ritonavir sau khi ngưng liệu phảp chi dùng dỉđanosine (xem CẢNH BÁO VÀ THẬN
TRỌNG)
Dị cảm và bệnh lhần kinh ngoại bíẻn: dược bảo cảo ở 15%, 9% và 1% bệnh nhân trong 3 nghiên cứu
lãm sảng.
Cảc bất thường xét nghiệm cận lâm sảng dược chọn lọc xảy ra ở bệnh nhi mới được điều trị (556
ngảy trị liệu với thuốc kháng retrovirus) được liệt kê trong bảng bên dưới.
Bãng: Tần suất cảc bẩt thường xét nghiệm cận 1âm sảng cẩp độ 3 đến 4 được chọn lọc ở
bệnh nhi trong một nghiên cứu.
Xét nghiệm (Nồng độ ngưỡng) Lamivudìne + Zidovudine Didanosine
số lượng bạch cằu trung tính tuyệt dối (<400/mm²) 8% 3%
Hemoglobin (<7.0 g/dL) 4% 2%
Tiều cầu (10 x ULN) 1% 3%
AST (> 10 x ULN) 2% cư 4%
Lipasc (>2,5 x ULN) 3% \i/ 3%
Amyiasc toản phẳn (›2,5 x ULN) 3% _ __ 3%
ULN=Giới hạn trên cùa mức bình thường
Trẻ sơ sinh — thử nghiệm lâm sảng ở HIV—I: Thông tỉn tính an toản ngắn hạn bị hạn chế có được từ 2
nghiên cứu nhò, không có đối chứng ở Nam Phi tiến hảnh ở trẻ sơ sinh dùng lamivudine kèm hoặc
không kèm zidovudine trong tuần đầu tiên sau khi sinh sau khi điều trị cho người mẹ bắt đầu ở tuần
thai 38 hoặc 36. Các tác dụng phụ được chọn lọc được bảo cảo ở cảc trẻ sơ sinh nảy gồm tăng cảc
xẻt nghiệm chức năng gan, thiếu máu, tiêu chảy, mẩt cân bằng diện giải, hạ dường huyết, văng da và
phi đại gan, phát ban, nhiễm trùng hô hấp và nhiễm trùng mảu; 3 trẻ sơ sinh tử vong (1 tử vong do
viêm dạ dây ruột kèm nhiễm toan và co giật, ] tử vong do chấn thương vả [ từ vong không rõ
nguyên nhân). Hai trường hợp khảc không từ vong bị viếm dạ đảy ruột hoặc tiêu chảy đã được báo
cáo, gồm 1 trường hợp bị co giật, vả 1 trường hợp suy chức năng thận thoáng qua iiến quan đến mất
nước. Không có cảc nhóm đối chứng nên iảm hạn chế sự dảnh giá nguyên nhân; nhưng cho rằng trẻ
phơi nhiễm chu sinh có thế có nguy cơ tác dụng phụ so với tảc dụng phụ được báo cáo ở bệnh nhi và
người trường thảnh nhiễm HIV được điều trị với các phảc đồ phối hợp có chứa iamivudine. Không
biết tảc động iâu dải cùa sự phơi nhiễm lamivudine trong tử cung và ở trẻ em.
Theo dõi hậu mãi
Cùng với những tác dụng phụ dã dược báo cảo trong các thử nghiệm lâm
sau đây đã được xảc định trong quá trình sử dụng Iamivudine sau khi đượD`
ảc dụng phụ
Vì chúng
14/22
chi được bảo cảo một cảch tự nguyện nến không rõ là nó xuất hiện trong bao nhiêu người dùng
thuốc, do dó không ước lượng được tỷ lệ. Những tảc dụng nảy được chọn để liệt kê vảo danh sảch
tác dụng phụ vi tinh nghiêm trọng, tẳn suất bảo cảo nhận được và tiềm ẳn nguy cơ mối liên hệ với
việc dùng lamivudine:
Toản thán: tải phân bốl tỉch lũy mỡ (xem CẨNH BÁO VÀ THẬN TRỌNG)
Tiéu hoá: viêm miệng
Nội tiết vả chuyến hoá: tăng đường huyết.
Tống thế: mệt mỏi.
Máu và hệ bạch huyết: thiếu mảu (kể cả thiếu mảu bẩt sản và thiếu máu tiến trìền trong thời gian
điều trị), rối Ioạn hạch bạch huyết, sưng lảch.
Gan vả tụy: nhiễm acid lactic vả nhiễm mỡ gan, viêm tụy, bùng phảt viêm gan siêu vi B sau đỉều trị
(xem CÁNH BÁO ĐẶT TRONG KHUNG; CẢNH BÁO vÀ THẬN TRỌNG)
Quá mẫn: phản vệ và nổi mảy đay.
Hệ vận động: yếu cơ, tăng CPK, phân hủy cơ.
Hệ thồn kinh: dị cảm ở da, rối Ioạn thần kinh ngoại biên.
Hệ hô hấp: Thở có tiểng bất thường/ thớ khờ khè.
Da: rụng lông, tóc, ngứa.
Cảc lác dụng phụ khác đã được bản cáo: phù mạch, rối loạn cơ, viêm gan, gỉảm bạch cằu trung
tính, giảm tiều cầu.
THÔNG BÁO cno BÁC sĩ CÁC TÁC DỤNG KHÔNG MONG MUÔN GẶP PHẢI KHI sữ
DỤNG THUỐC.
QUÁ LIỆUl /
Chưa biết chất giải độc đặc hiệu cho Iamivudine. Có 1 trường hợp đã được báo cảo một người
trường thảnh đã uống 6g iamivudìne; không có dắu hiệu hoặc triệu chửng nảo được ghi nhận và xét
nghiệm mảu binh thường. Hai trường hợp trẻ em bị quá liều đã được báo cảo. Một trường hợp lả
dùng liều ] lần 7mglkg, trường hợp thứ hai iả đùng lamivudine 5mg/kg x 2 lần/ngảy trong vòng 30
ngảy. Không có dắu hiệu lãm sảng nảo được ghi nhận. Vì một lượng không đáng kể lamivudine
được loại khới cơ thể qua thẩm phân mảu (4 giờ), thấm phân phủc mạc liên tục nhưng có thế đi lại
được, và thẩm phân phức mạc tự động, không bỉết là thẩm phân liên tục có mang lại lợi ích iâm sảng
khi xảy ra biến cố quả liếu lamivudine hay không. Nểu xảy ra quá liều, nên giảm sảt bệnh nhân và
điều trị hỗ trợ chuẩn được đùng theo yêu cằn.
ĐẶC TỈNH DƯỢC ĐỌNG HỌC vÀ DƯỢC LỰC HỌC '
Cơ chế tác dụng
Lamivudine là chắt đồng đẳng nucleoside tổng hợp, kháng virus. Lamivudine bi phosphoryl hoá bên
trong tế bảo thảnh chất chuyển hoá có hoạt tính S’-triphosphate cùa nó lả iamivudine triphosphate
(L…TP). Cảch tảc động chinh cùa L-TP lả ức chế men phiên mã ngược cùa HlV-l (RT) thông qua
việc chấm dứt sự kéo dải cùa chuỗi DNA sau khi chèn được phãn tử L-TP vảo DNA cùa virus, đối
với động vật có vú thì L—TP lả một chắt ức chế yếu đối với men DNA polymerase o, B và y cùa ty
thê.
Hoạt tính kháng virus
Hoạt tinh in vitro của lamivudine kháng HlV-l được đảnh giá ở nhiều dòng tế
dơnýnhân to vả iympho bảo mảu ngoại biên mới lấy ở ngưòi) sử dụng địn V '
chuân. Giá trị ECso (nông độ có hiệu quả 50%) lá trong khoảng 0,003 đêlrix
3)
ổm bạch cầu
mcg/mL). HlV-i từ bệnh nhân mới được điều trị không có các gốc thay thế amino acid Iiẽn quan đền
sự đề kháng cho giá trị ECso trung binh là 0,429 ụM (khoảng: 0,200 đến 2,007 ụM) từ Virco (n = 92
mẫu trước khi điều trị từ COLA402ó3) và 2,35 ụM (1,31 đến 3,68 ụM) từ Monogram Biosciences (n
= 135 mẫu trước khi điếu trị từ ESSBOOO9). Giá trị ECso cùa lamivudine khảng các chủng IiIV-l (A~
G) thay đối từ 0,001 đến 0,120 ttM, vả khảng cảc chùng phân lập HIV-2 từ 0,003 đến 0,120 pM
trong các tế bảo đơn nhân cùa máu ngoại biên. Ribavirin (50 ụM) lảm giảm hoạt tinh khảng HIV-l
cùa lamivudine 3,5 lần trong tế bảo MT-4, lamivudine phối hợp với zidovudine ở nhiều tỉ lệ khảo
nhau cho hoạt tinh hỉệp lực kháng virus. Vui lòng xem thông tin kê đơn đầy đủ của công thức
lamivudine dảnh cho điều trị HBV về thông tin liên quan đến sự ức chế hoạt tính cũa iamivudine
khảng HBV.
Sự đề kháng thuốc
Nhiều biến thể HIV-i kháng iamivudine in víer đã được chọn lọc. Những phân tỉch gen đã cho thấy
tinh để khảng là do sự thay thế một amino acid cụ thể trong men sao mã ngược ở vị trí codon 184
bằng cảch thay thế methionine thảnh isoieucine hoặc valine.
Những dòng HlV-l khảng cả lamivudine lẫn zidovudine cũng đã được phân lập từ nhiều bệnh nhân.
Độ nhạy cảm đối vởi lamivudine vả zidovudine cùa cảc dòng phân lập trên lâm sảng đã được theo
dõi trong những thứ nghỉệm lâm sảng có kiềm soát. Ở những bệnh nhân dược áp dụng liệu phảp đơn
trị liệu bằng lamivudine hoặc liệu phảp phối hợp lamivudine vả zidovudine, HIV-l phân lập từ hầu
hết bệnh nhân đều đã trở nên đề khảng với lamivudine cả kiều hinh vả kiều gen trong vòng 12 tuần.
Ở một số bệnh nhân mang virus đế khảng với zidovudine ngay từ đầu, kiểu hình nhạy cảm với
zidovudine được phục hồi sau 12 tuần điếu trị bằng zidovudine phối hợp iamivudine. Liệu phảp phối
hợp lamivudine vả zidovudine lảm kéo dải thời gian bùng phảt những đột biến liên quan đến đề
khảng với zidovudine. Cảo chùng phân lập HBV đề khảng lamivudine phát triền cảc gốc thể
(rtM204V/l) trong phân đoạn YMDD của phạm vi xúc tảo cùa mcn phiên mã ngược của vi khuẩn.
Cảo gốc thế nM204V/I thường được đi kèm bới các gốc thế khảc (rtVI73L, rtLISOM) iảm tãng
cường mức độ để khảng iamivuđine hoặc hoạt động như lá cảo đột biến bù cải thiện hiệu lực sao
chép. Cảo gổc thể khảo phảt hiện cảc chùng HBV đề kháng lamivudine gổm: rtL80l vả rtAlSl T.
Cảo chũng đột biến HBV tương tự đã được bảo cáo ở bệnh nhân nhìễm HIV-l dùng các phác đồ
khảng retrovirus chứa lamivudine khi nhiễm đồng thời với virus gây viêm gan B (xem CẨNH BÁO
VÀ THẬN TRỌNG). w
Để kháng chéo
Cảo dòng HIV-l đề kháng lamivudine do đột biến cũng đề khảng chéo với didanosine (dđI) vả
zalcitabine (ddC). Ở một số bệnh nhân được điếu trị bằng zidovudine phối hợp với didanosine hoặc
zalcitabine, đã xuất hìện những đột biến đa để khảng với cảc chất ức chế men phiên mã ngược, kể cả
lamivudine.
Phân rích kỉểu gen vả kiểu hinh cũa các chủng HIV-I Irong khi điều trị rừ các bệnh nhân t/zẩz
bại vê mặ! virus học
Nghiên cứu ] đã được báo cáo: Thử nghiệm lâm sảng có liên quan đến sự thay đồi kiếu gen và kiến
hình kèm theo liệu pháp trị liệu dùng lamivudìne chưa được xác lập hoản chỉnh. Trong một nghiên
cứu lâm sảng, 53 trong số 554 người (10%) tham gia thử nghiệm đã được xác định là thất bại về mặt
virus học (mức RNA cùa HiV—i trong huyết tương ì 400 phiên bảnlmi) vảo tuặưỀ~lầhân bố ngẫu
… A . t , v , : . . : , . . "ổỘ TỌrx ,
nhien 28 bẹnh nhan vao nhom dung phao đo lamtvudme [ lan/ngay va 25 bi; n
phảc đồ lamivudine 2 lẩn/ngảy. Thống kê trung vị mức RNA cùa HIV~I trong huyết tương ở cảc
nhóm dùng lamivudine 1 lẳnlngảy vả 2 lằn/ngảy lân lượt 121 4,9 login phiên bản/mL và 4,6 Iogio
phiên bản/mL vảo thời điếm khời đầu nghiên cứu.
Phân tích gen trong thời gian điều trị từ các chủng phân lập từ 22 bệnh nhân được xem lả thắt bại
virus học trong nhỏm đùng lamivudine ] Iần/ngảy cho thấy mẫu phân lập từ 0/22 bệnh nhân mang
virus đột biển trong quá trình điều tii liên quan đển đề kháng zidovudine (M4IL, D67N, K7OR,
L210W, T215Y/F hoặc K2l9Q/E), những mẫu phân lặp từ 10/22 bệnh nhãn mang virus đột biến
trong quá trình điều trị liên quan đến đề khảng efavirenz (L1001, KIOIE, K103N, V1081 hoặc
1181C), vả những mẫu phân lập từ 8/22 bệnh nhân mang virus đột biến trong quá trình điều trị liên
quan đến đề khảng lamivudine (M1841 hoặc M184V).
Phân tích gen trong thời gian điếu trị từ cảc chủng phân lập từ bệnh nhân (n=22) trong nhóm dùng
lamivudine 2 lằnlngảy cho thắy mẫu phân lặp từ 1l22 bệnh nhân mang virus đột biến trong quá trình
diều trị liên quan đến đề khảng zidovudine, những mẫu phân lập từ 7l22 bệnh nhân mang virus đột
biển trong quá trinh điều trị liên quan đến đề khảng efavirenz, mẫu phân lập từ 5/22 bệnh nhân mang
virus đột biến trong quả trinh điều trị liên quan đến đề khảng lamivudine.
Phân tích kiểu hình trong thời gian điếu trị những mẫu IIIV—l phân lập từ những bệnh nhân dùng
lamivuđine [ lằn/ngảy theo ngưỡng nhạy cảm cho thấy: mẫu phân lập từ 12/ 13 bệnh nhân còn nhạy
cảm với zidovudine; mẫu phân lặp từ 8/13 bệnh nhân giảm độ nhạy cảm với efavirenz từ 25 đến 295
lần vả mẫu phân lập từ 7/13 bệnh nhân giảm độ nhạy oảm vởi lamivudine từ 85 dển 299 lần.
Phân tich kiều hinh trong thời gian điều trị những mẫu HlV—l phân lập từ những bệnh nhân dùng
lamivudine 2 lần/ngảy theo ngưỡng nhạy cảm oho thắy: mẫu phân lập từ tất cả 13 bệnh nhân còn
nhạy cảm với zidovudine; mẫu phân lập từ 3/13 bệnh nhân giảm dộ nhạy cảm với efavircnz từ 21
đến 342 lần vả mẫu phân 1ập từ 4/13 bệnh nhân giảm độ nhạy cảm với lamivudine từ 29 đến 159 lấn.
Nghiên cứu 2 đã được bảo cáo: Trong một nghiến cứu lâm sảng khảo, 50 bệnh nhân đã được chỉ
định dùng zidovudine 300mg x 2 lằnlngảy phối hợp abacavir 300mg x 2 lần/ngảy + lamivudine
300mg x 1 Iầnlngảy và 50 bệnh nhân dùng zidovudine 300mg + abaoavir 300mg + 1amivudine
300mg tất cả đếu dùng 2 lần/ngảy. Thống kê trung vị mức RNA của HIV-l trong huyết tương ở 2
nhóm lằn lượt 1ả 104,79 phiên bản/mL vả 104,83 phiên bản/mL. 14 bệnh nhân trong số 50 bệnh nhân
ở nhóm dùng Iamivudine 1 lần/ngảy vả 9 trong số 50 bệnh nhân 6 nhóm dùng lamivudine 2 lầnlngảy
được xác định là thất bại về mặt virus học.
Phân tich gen trong thời gian điếu trị của cảc mẫu HlV-l phân lập từ nhỏm bệnh nhân (n=9) dùng
Iamivudỉne ] Iần/ngảy cho thấy mẫu phân lặp từ 6 bệnh nhân có đột biến 1iẽn quan đển đề kháng
abacavir vảfhoặc lamivudine chỉ ở M184V. Những mẫu phân lặp trong thời gian diếu trị từ nhóm
bệnh nhân (n=6) dùng lamivudine 2 lầnlngảy cho thấy mẫu phân lập từ 2 bệnh nhân có đột biến chỉ
ở MI84V vả mẫu phân lập từ 2 bệnh nhân mang đột biến M184V đồng thời với dột biến dề kháng
zidovudine.
Phân tích kiều hinh cảc mẫu phân lập trong thời gian điều trị ở nhóm bệnh nhân (n=6) dùng
lamivudine 1 lầnl'ngảy cho thấy những mẫu HiV-l phân lập từ 4 bệnh nhân giảm độ nhạy oảm vói
lamivudine từ 32 đến 53 lần, mẫu HlV-l phân lập từ 6 bệnh nhân nây nhạy cảm vớifzạiđovudinc.
ICỒ.ỒLI ' (');
Phân tích kiều hinh cảc mẫu phân lặp trong thời gian điếu trị ở nhóm bệnh nhân dùng lamivudine 2
lẳnlngảy cho thấy HIV-1 phân lập từ 1 bệnh nhân giảm độ nhạy cảm với lamivudine 45 lẩn, và giảm
độ nhạy cảm với zidovudine 4,5 iân.
Dược động học
Người trưởng thònh
Đặc tinh dược động học cùa lamivudine đã được nghiên oứu ở bệnh nhân là người trưởng thảnh
nhiễm HIV-l không triệu chứng sau khi tiêm tĩnh mạch cảc liếu đơn từ 0,25 đến 8 mg/kg, cũng như
dùng đường uống liều dơn và liều đa (phảc đồ ngảy 2 lẩn) từ 0,25 đến 10 mg/kg.
Đặc tính dược động học của lamivudine cũng đã được nghiên cứu khi bệnh nhân nhiễm HBV uống
liếu đơn và liều đa từ 5 mg đến 600 mg/ngảy.
Đặc tinh dược động học ở tinh trạng ổn định cùa viên nén lamivudine 300 mg ngảy 1 lẩn trong 7
ngảy so với viên nén lamivudine 150 mg ngảy 2 lằn trong 7 ngảy được đảnh giả trong 1 nghiên cứu
chéo ở 60 người tinh nguyện khỏe mạnh. Lamivudỉne 300 mg ngảy 1 lần cho sự phơi nhiễm
lamivudine tương tự như lamivudine 150 mg ngảy 2 lẩn về AUC24_ss huyết tương, tuy nhiên, Cmaxss
cao hơn 66% và giá trị vùng lõm thấp hơn 53% so với phảc dỗ 150 mg ngảy 2 lần. Phơi nhiễm
lamivudine triphosphate nội bảo trong các tế bảo đơn nhân máu ngoại biên cũng tương tự về
AUC… vả cmm,_,,; tuy nhiên, các giả tii vùng lõm thấp hơn so với phảc đồ 150 mg ngảy 2 lần. Sự
khác biệt giữa các bệnh nhân về nồng độ lamivudine triphosphate nội bảo cao hơn so với nồng độ
lamivudine huyết tương vùng lõm. Không biết ý nghĩa lâm sảng của sự khảo biệt quan sảt được ở cả
nồng độ lamivudine huyết tương và nồng độ lamivudine triphosphate nội bảo.
Lamivudỉne được hấp thu nhanh chóng sau khi bệnh nhân nhiễm HIV-l dùng thuốc đường uống.
Sinh khả dụng tuyệt dối ở 12 bệnh nhân là người trưởng thảnh là 86% i 16% (trung bình i độ lệch
chuẩn) dối với viên nén 150 mg và 87% 1 13% đối với dung dịch uống. Sau khi 9 người trưởng
thảnh nhiễm HIV uống liếu 2 mg/kg ngảy 2 lẫn, nống độ đinh trong huyết thanh cùa Iamivudine
(C……) lả 1,5 i 0,5 ụg/mL (trung binh i độ lệch chuẩn). Dìện tích dưới đường cong nổng độ huyết
tương so với thời gian (AUC) vả Cmax tăng theo tỉ lệ đối với lìều uống ở trên khoảng từ 0,25 đến 10
mg/kg.
Ti 1ệtích lũy lamivudine ở người trướng thảnh dương tinh với H1V-l có chức năng thận binh thường
là 1,50 sau 15 ngảy uống liếu 2 mg/kg ngảy 2 lần <, /
Trong một nghiên cứu đã được bảo các nghiên cứu dạng bảo chế 25 mg 1 ivudine dùng đuờng
uống oho 12 bệnh nhân nhiễm 111V— 1 không triệu chúng trong 2 điều kiện, một lần khi đói và một
lần có thức ăn (1.099 kcal; 75 grams chất bẻo, 34 grams protein, 72 grams carbohydrate). Sự hắp thu
của Iamivudine chậm hơn khi có thức ăn (me: 3,2 zi: 1,3 giờ) so vởi tình trạng đói (me: 0,9 3: 0,3
giờ); cm… khi có thức ăn 15 40% i 23% (trung binh 4 độ lệch chuẩn) thắp hon khi ở tinh trạng dóì.
Không có sự khảo biệt đảng kể về phơi nhiễm toản thân (AUC…) khi có thức ăn và khi đói; vì vậy,
Iamivudine có thế được dùng khi có hoặc không có thức ăn.
Thể tích phân phối biều kiến sau khi tiêm tĩnh mạch lamivudine 6 20 bệnh nhân là 1, 3 :t: 0 4 leg,
cho thấy lamivudine phân phối vảo các khoảng ngoại mạch. Thể tích phân phối phụ thuộc 1iểu dùng
và không tương quan với cân nặng cơ thể. Lamivudine gắn kết thấp với protein huyết tương ở người
(<36%). Các nghiên cứu in vitro cho thắy, ở trên khoảng nồng độ 0,1 đển 100 ụglmL, lượng
lamivudine liên hợp với hồng cầu thay đối tù 53% đến 57% và không phụ thuộc v“ora
o“ 0
Sự chuyến hóa của lamivudine lả một đường đảo thải thứ yếu, ó người, chỉ chẩt ohuyển hóa được
biết của lamivudỉne lả chất chuyền hóa trans-sulfoxide. Trong vòng 12 giờ sau khi dùng liều đcm
Iamivudine cho 6 người trướng thảnh nhiễm HIV—1, 5,2% i 1,4% (trung bình 5: độ Iêch chuẩn) iiều
dùng được bải tiết ở dạng chất chuyển hóa trans—sulfoxide trong nước tiếu. Nồng độ huyết thanh của
chẩt chuyển hớa nảy không được xảo định.
Phần lớn lamivudine được đảo thải ở dạng nguyên vẹn trong nước tiểu bằng cảch bải tiết cation hữu
cơ tich cực. Trong 9 người khỏe mạnh dùng liều đơn 300 mg lamivudine, thanh thải thận là 199,7 i
56,9 mL/phứt (trung bình 1- độ lệch chuẩn). Ở 20 bệnh nhân nhiễm HIV-1 được tiêm tĩnh mạch liều
đơn, thanh thải thận là 280,4 i 75,2 lephủt (trung bình i độ lệch chuẩn), thế hiện 71% 1 16%
(trung binh i độ lệch chuẩn) cùa độ thanh thải toản phần cùa Iamivudine.
Trong hằư hết cảc nghiên cứu dùng liều đơn ở bệnh nhân nhiễm 1—11V-1, bệnh nhân nhiễm HBV,
hoặc người khỏe mạnh với mẫu huyết thanh 24 giờ sau khi dùng thuốc, thời gian bán thải (tv,) trung
binh quan sát được nằm trong khoảng 5 đến 1 giờ. ở cảc bệnh nhân nhiễm HIV, độ thanh thải toản
phẳn lả 398,5 36 69,1 mL/phút (trung binh t độ lệch chuẩn). Độ thanh thải và thời gian bán thải
đường uống không phụ thuộc vảo 1iếu dùng vả cân nặng ở trên khoảng liều dùng từ 0,25 đến 10
mglkg.
Dươc đông hoc ở các đổi tương_đjg bìêt
Trẻ em
Trong một nghiên cứu đã được bảo cảo, đặc tính dược động học cùa Iamivudine được đảnh giả trong
một nhóm gồm 57 bệnh nhi nhiễm HIV (độ tuồi: 4,8 thảng đến 16 tuối, khoảng cân nặng: 5 dến 66
kg) sau khi uống và tiêm tĩnh mạch vởi các liều l, 2, 4, 8, 12, và 20 mglkg/ngảy. Ở 9 trẻ nhỏ vả trẻ
em (độ tuổi: 5 thảng đến 12 tuổi) dùng dung dịch uống 4 mg/kg ngảy 2 iần (liếu dùng khuyến cảo
thông thường cho nhi khoa), sinh khả dụng tuyệt đối lả 66% 3. 26% (trung binh t độ lệch chuẩn),
thẩp hơn so với 86% 1“ 16% (trung binh i độ lệch chuẩn) quan sảt được ở người trường thảnh.
Không biết cơ chế cùa sinh khả dụng tuyệt đối bị giảm cùa lamivuđìne ờ trẻ nhỏ và trẻ em,
Độ thanh thải toản thân giảm khi tuổi tăng ở bệnh nhi,
Sau khi cho 11 bệnh nhi từ 4 tháng đến 14 tuồi uống lamivudine với liếu 4 mg/kg ngảy 2 iẳn, c,… lả
1,1 i 0,6 ụg/mL và thời gian bản thải là 2,0 i 0,6 giờ. (Ở người trường thânh với mẫu mảu tương tự,
thời gian bán thải lả 3,7 i 1 giờ). Phơi nhiễm toản phần đối với lamivudine, phản ảnh qua giá trị
AUC, có thể so sảnh được giữa bệnh nhi dùng liếu 8 mg/kglngảy và người trưởng thảnh dùng liều 4
mglkg/ngảy. w
Sự phân phối của lamivudine vảo dịch não tủy được đảnh giả ở 38 bệnh hi sau khi uống liều đa.
Mẫu dịch não tùy được lấy giữa 2 và 4 giờ sau khi dùng thuốc. Ớ liểu 8 mg/kg/ngảy, nổng độ
lamivudine trong dịch não tùy ở 8 bệnh nhân ở trong khoảng từ 5,6% đến 30,9% (trung bình t độ
lệoh chuẩn cùa 14,2% 1 7,9%) nồng dộ trong mẫu huyết thanh lắy cùng lức, với nồng dộ lamivudine
trong dịch não tủy ở trong khoảng từ 0,04 đến 0,3 ụg/mL.
Dữ liệu tinh an toản vả dược động học bị hạn chế, không có đối oht'mg từ việc dùng lamivudine (vả
zidovudine) ở 36 trẻ em đủ 1 tuần tuối trong 2 nghiên cứu đã được bảo cảo ở Nam Phi. Trong cảc
nghiên oứu nảy, độ thanh thải lamivudine thực chẳt gìảm ở trẻ sơ sinh 1 tuần tuổi có liẽn quan với
bệnh nhi (>3 thảng tuồi) đã được nghiên cứu trước đây. Không có thông tin thích hợp đề thiết lập đợt
Người cao !uổi
Dược dộng học cùa lamivudine không được nghiên cứu ở bệnh nhân >65 tuối (xem SỬ DỤNG Ở
CÁC ĐÓI TƯỢNG ĐẶC BIỆT: Lão khoa).
Suy chức năng thận
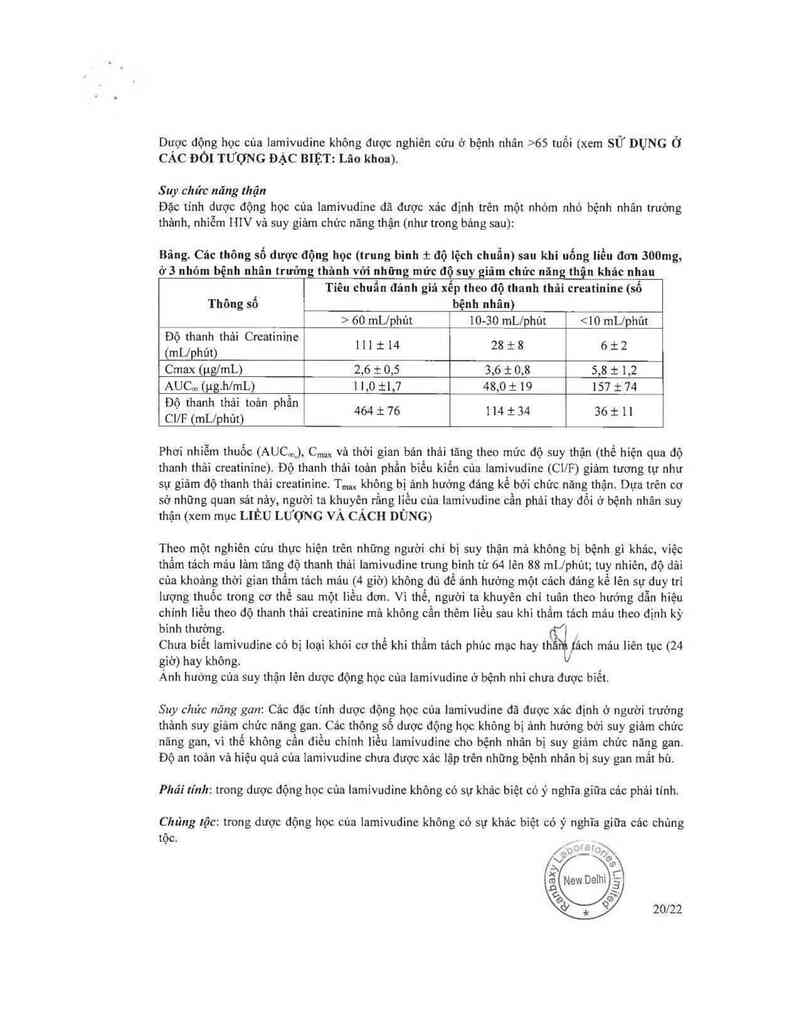
Đặc tinh dược động học cùa lamivudỉnc dã được xảo định trên một nhóm nhỏ bệnh nhân trường
thảnh, nhiễm HIV vả suy giảm chức nảng thận (như trong bảng sau):
Bãng. Các thông số dược động học (trung binh 1 độ lệch chuẩn) sau khi uống liều đơn 300mg,
ở3 nhóm bệnh nhân trưởng thânh với những mức độ suy giâm chức nãng thận khác nhau
Tiêu ohuẩn đảnh gỉá xếp theo độ thanh thải creatinine (sổ
Thông số . bệnh nhân)
7 1 > 60 lephủt 10—30 mL/phủt <10 mL/phủt
Đô thanh thải Croatinine
- + +
(mL/phút) 111 1 14 28_8 6_2
Cmax (ụg/mL) 2,6 t 0,5 3,6 1 0,8 5,8 1 1,2
AUC… (PE.h/mL) 1 1,0 i1,7 48,0 1; 19 157 i 74
Đô thanh thải toản phần
- + +
CI/F (mL/phút) 464_76 114-34 36i11
Phơi nhìễm thuốc (AUC… _), c…,, và thời gian bán thải tăng theo mức độ suy thận (thế hiện qua độ
thanh thải creatinine). Độ thanh thải toản phần biếu kiến oũa lamivudine (Ci/F) giảm tương tự như
sự giảm độ thanh thải creatininc. T,… không bị ânh hướng đảng kể bời chức nâng thận. Dựa trên cơ
sở những quan sảt nảy, người ta khuyên rằng liều cùa lamivudine cần phải thay đối ở bệnh nhân suy
thận (xem mục LIÊU LƯỢNG VÀ CÁCH DÙNG)
Theo một nghiên oứu thực hiện trên những người chỉ bị suy thặn mã không bị bệnh gì khảo, việc
thẳm tách máu lảm tăng độ thanh thải lamivudine trung bình từ 64 lên 88 mL/phút; tuy nhiên, độ dải
cùa khoảng thời gìan thẩm tảch mảu (4 giờ) không đủ để ảnh hướng một cách đáng kể lện sự đuy tri
lượng thuốc trong oơ thế sau một liều dơn. Vì thế, người ta khuyên chi tuân theo hướng dẫn hỉệu
chinh liếu theo độ thanh thải creatinine mã không cẳn thêm liều sau khi thẳm tách máu thco định kỳ
bình thường. ,
Chưa biết lamivudine oó bị Ioại khỏi cơ thể khi thẩm tảoh phủc mạc hay thâhttách mảu 1iên tục (24
giờ) hay không.
Ảnh hướng cùa suy thận lên dược động học cùa lamivudine ở bệnh nhi chưa được biểt.
Suy chức nãng gan: Các đặc tinh dược dộng học của lamivudine dã được xảo định ở người trường
thảnh suy giảm chức năng gan. Cảo thông số dược động học không bị ảnh hướng bới suy giảm chức
nãng gan, vì thế không cần điều chinh lìều lamivudine cho bệnh nhân bị suy giảm chức năng gan.
Độ an toản vả hiệu quả của Iamivudine chưa được xác lặp trên những bệnh nhân bị Suy gan mất hù.
Phái tính: trong dược dộng học cũa Iamivudine không có sự khảo biệt có ý nghĩa giũa cảc phải tính.
Chủng tộc: trong dược động học cũa iamivudine không có sự khảo biệt có ý nghĩa giữa các ohùng
tộc. _
20122
Cảc unơng lảc thuốc (xem them ờ phẩn TƯO'NG TẮC THUOC; vả CÀNH BÁO vA THẬN
TRỌNG)
lnterferon Alfa: Không có tường tác dược động học đâng kể giữa lamivudine vả interferon alfa trong
một nghiên cứu 19 nam giới khỏe mạnh (xem CANH BẢO VÀ THẬN TRỌNG).
Ríbavirín: Dữ liệu in vỉtro oho thắy ribavirin Iám giâm sự phosphoryl hỏa của lamivuđine, stavudine,
vã zidovudine. Tuy nhiên, không có các tượng tác dược động học (ví dụ nồng độ huyết tương hoặc
nồng độ chất chuyền hỏa có hoạt tính được triphosphoryi hóa nội bâo) hoặc không oó cảc tương tác
dược lực học (vi dụ mất đáp ứng virus HIV—IIHCV) quan sát được khi dùng đồng thời ribavirin vè
lamivudine (n = 18), stavuđinc (n = 10), hoặc zìdovudine (n = 6) như lá thânh phẫn cũa phải: đổ đa
thuốc cho bệnh nhãn đồng thời nhiễm HIV-I/ HCV (xem cÀnn BÁO VÀ THẬN TRỌNG).
Trimethoprìm/Sulj'amethoxazole: Lamivudỉne vả TMP/SMX được dùng oho 14 bệnh nhân dương
tinh với H1V-l trong một nghiên cứu chéo ở một trung tãm, mờ nhãn, ngẫu nhiên. Mỗi bệnh nhân
được điều trị với lamivudine liều duy nhẩt 300 mg vả TMP 160 mg/SMX 800mg ngảy 1 lẩn trong 5
ngảy kèm dùng đồng thời Iamivudinc 300 mg ở liều thứ năm trong một thiềt kể chẻo. Dùng đồng
thời TMPISMX với lamivuđine iâm tăng 43% 5 23% (trung binh 1 độ iệoh chuẩn) về AUC… của
Iamivudine, giảm 29% 2 13% về độ thanh thái lamivudine đường uống, vả giảm 30% 3 36% về độ
thanh thái lamivudine qua thặn. Dặc tinh dược động học của TMP vả SMX khỏng bị thay đối khi
dùng đồng thời với Iamivudine (xem TƯỢNG TẢC THUOC).
Zidovudine: Khỏng có sự thay đối đáng kể trên lãm sảng về dược động học của lamivuđine hoặc cùa
zidovudine ở 12 bệnh nhăn 1ả người trường thânh nhiễm HIV-i khỏng triệu chửng dược đủng liều
đơn zidovudine (200 mg) phối hợp với đa liều 1amivudinc (300 mg mỗi 12 giờ) (xem TƯỢNG TẢC
THUOC).
DỮ LIẸU TÍNH AN TOÀN TIÊN LÂM SÀNG '~² ỂỄ/
sn dụng Iamivudine trong các nghiên cứu độc tinh ở các 1ièu oao không ten quan đển bất kỳ độc
tinh nảo ở cơ quan chinh. Ó cảc mửc liều lượng cao nhẩt, tảo động nhỏ ưên các chỉ thị chức năng
gan vả chức nảng thận quan sát được củng với thinh thoáng giảm ưọng lượng gan. Tảo động tương
ứng ttện 13… sảng được ghi nhận 13 giám số lượng hồng oẩu vả giám bạoh oẩu trung tính.
Khả nãng gẩy ung thư/ Gây đột biển gcnl Giỉm khi ning thụ thai
Những nghiên cửu độc tinh trường diễn gây ung thư của 1amivuđino trên chuột nhắt vâ chuột oống
cho thấy không có bằng chửng gây ung thu khi dùng liều (lẩn Iưọt ờ chuột nhắt vả chuột cổng) oao
gấp 101ần vả 58 lần so với iiều dùng ớièu tri nhiẽm HIV ở người.
Lamivưdine khòng thẻ hiện hoạt tinh trong khi sảng lọc khả nảng gãy đột bién «3 bảo vi khuẩn hoặc
thi nghiệm biến đổi tế bản in vilro nhưng thế hiện tinh gtiy đột biến yếu trong một thử nghiệm di
ttuyèn học tế bảo đùng lympho bảo của người được nuôi cấy vả trén mới thử nghiệm dũng lympho
bâo của ohuột nhẳt. Tuy nhiên Iamivudine không cho thẩy bằng chứng về độc tinh tien gen in vivo ở
chuột cống với liều đến 2.000mglkg tạo ra nồng độ huyết thanh khoáng 35 — 45 lẩn so với ở người
dùng lỉều điều trị HIV.
Trong một nghiên cửu về khả năng sinh sản, Iamivudine dược dùng cho chuộ}- ' ~
4.000 mglkg/ngảy oho nồng dộ huyết tương gáp 41 - 10 lần so với hưyết ttlt
hiện ra bằng chứng nảo về rối loạn thụ thai vả không có ảnh hướng gi 1ên sự sống sót, sư phải triển
và khả năng trướng thảnh cùa cảc con vật con.
Các nghiên cưu độc tính trên sinh sán: Cảo nghiên cứu sinh sản đã được tiến hảnh ở chuột oống vả
thờ ở các Iiếu uống iần lượt lên đến 4. 000 mg/kg/ngảy và 1. 000 mg/kg/ngảy, cho nồng độ trong
huyết tương lên đến gấp khoảng 35 lần nồng độ trong huyết tương ở người đối với liếu dùng oho
người trường thảnh nhiễm HIV. Không có bằng chủng quải thai do lamivudine. Bằng chứng chết
phôi sớm đã được quan sảt ở thò ở cảc nồng độ phơi nhiễm tương tự như quan sát dược ở người,
nhưng không có biểu hiện tảo động nảy ở chuột cống ớ nồng độ phơi nhiễm gấp 35 nồng độ phơi
nhiễm ở người. Các nghiên cứu ở ohuột oống có thai và thỏ oó thai oho thẫy lamivudine qua thai
thông qua nhau thai.
BÁO QUẢN: Bảo quản dưới 30°C, trảnh ấm.
GIỮ THUỐC XA TÀM TAY TRE EM.
HẠN DÙNG: 24 tháng kể từ ngảy sản xuất.
KHÔNG DÙNG THUỐC QUÁ HẠN DÙNG GHI TRÊN NHÂN.
QUY CÁCH ĐÓNG GÓI: Hộp 1 Chai HDPE 60 viên. W
THAM KHẢO
l. US Prescribing information ofEPIVIR, GlaxoSmithKline, USA; US-FDA approval to Pl teỹ
in February 2008.
2. UK Summary of Product Characteristics of EPIVJR Tablets, ViiV Healthoare UK Ltd, UK;
text revised in October 2010.
Thỏng Iỉn được biên soạn vảo thá'ffflẺ
Í, :. 'í—Ệli _ Ìf~ \
SẢN XUẢT TẠI ẤN DÒ
RANBAXY
LABORATORIES LIMITED
PAONTA 51411113, 131s1. SIRMOUR
H.P. - 113 025
.~ .—ĩ ; cfa
i/Ĩáugmi Ĩ’an Joỉưmẫ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng