



















9WU%D
Ự
~A
V
D—
›—
bơ.
`.'i' .
= "?
l—I …
)“ ['
C =.
, ..J
32 A'l
V
_Ụ
u-l'
ư
`4,
qa›5)
[\
A
11`DtYlT
2
ĐA P
êị
.omi hn… m; ox
..6`
g _
'c \1 IM IA
: u _ 1 ,._.« ' E- u_-
“73 tơ Ư`ZF(Ìĩ›iJ1
..i 1
mi m di-a lũùmq ²«muuui Meu i Iu
\ … I MI M1qmph: M'f Dâng oqu ulm
' iMli FM lim íJil' hih, :qu dil div…
@ ửi'ic & ddi di~c u di: [hê'u Un
m: Xem lqu m nm; eln sử dung nm
ihn uh quAr & MIN Iqu mưc
ne"…Amuyuiom emkýmmguk
ú rpgínlơt kh ninq SW. :: nu ::
som SX NSX, HD,i~ nem `Lof 'Uỉu, dIo`
'Fư' Mn mun“ SI bù E: L y
MIIIJII [ IPJ 052L5 My
nu som
… a…wia uơzwư-nmmưm no.
lie '.tu hl Mn
.fflỉ.
| …… J|
IỦII
f\l IM IA
eiiw
'il'iiPCllOii
ALIM1A
Each vid c:th uutimơ IIiSM:IT
wma… iu iod Tu nemmm, mũ Im d
m…mi. mưiv : »… anw am… m
uwioxinc may hm ti… IING to uui uu
Tu lnnuilllec 42 M. ul 0,9% ,
F_ctmnnulun nnụ
Suiiun Cìmiu ›npctm imeem… im;
bmilu » mmm nơiislr *n 25 mg-“m,
ptm:im. Remnsnm soLơi mt hư
m… ci:ec Wo… … ',seu lctaMpm,wg
Iumm
MuinW củsmf sơmn wltm 24 in…
JM mủ 1mntảumu. Dìũ(lrd mm!
nor…
Su mMparymg ineralu Im đcme ,
ÍỦĨ
Slouu.
Unomned ui Do not … am Jũ’c.
onoo.: c-sm ic-íla_izni
… … no: zsim
um; HIMED !! ư
me L~L1M.WAAm. n n…
….
v
For intravenous use after
' moonstitutỉon and diiution.
Do not stnro above 30°C.
Manufactured by
Eli Lilly and Company.
N
i~'…lH. 'i FibầÙle JA1E
D 7020 LEỦi
a
2
Ế WPmmc Ễ FINISHINGLWENO 1C229 …
Ẹ ' D… 3; mcmtmme APPROVAL SievenM Sorenson
%
Ế ẳ DATF 11 June 201C
: PPM.A DME E ENTERED BY 01 llJuiie 2010 Non Varnish
O i`H'J1J: LB…
Ui£NL ›7iizu u .`ilị't" i2Ai. g WWW… AmlHargm
.~ 'ii1NiiìHỉ’iRA'lílNủNO …. ả
U viEw °RiNỈi.iiỏiĩeầklP E [)A11 `11une2010
Liva F.Ê1OMb “ =7 Wrn W 28 …… P * hmm
vEẽìS:m , FNTFPED BV DL11June20ffl Amicounteriemnẹfmi _
_, L `ễỊ`1iitliị`
ẵ iiiiisiniiii, , INF ~ii: 1(.`Ĩ?9 i '3
* FMĨJINFỂRINLỊAOWDVÀL sim… M soienscn
Ế CA'E … ỊifU
Ệ… EHĩí~ư ại~ DLH .i.irwịèoii SCIGPI'iWME
MERSAPPROVM
i’) 7020-1104
FINISHING L1NE NC 111229 L ` i
ENGINEE HING APPHOVAL MMW
UATE ti'i mnnzãlllb
ENĨERED BV JlLtT" _mnlifflllli
liiiuriiif. Btack _
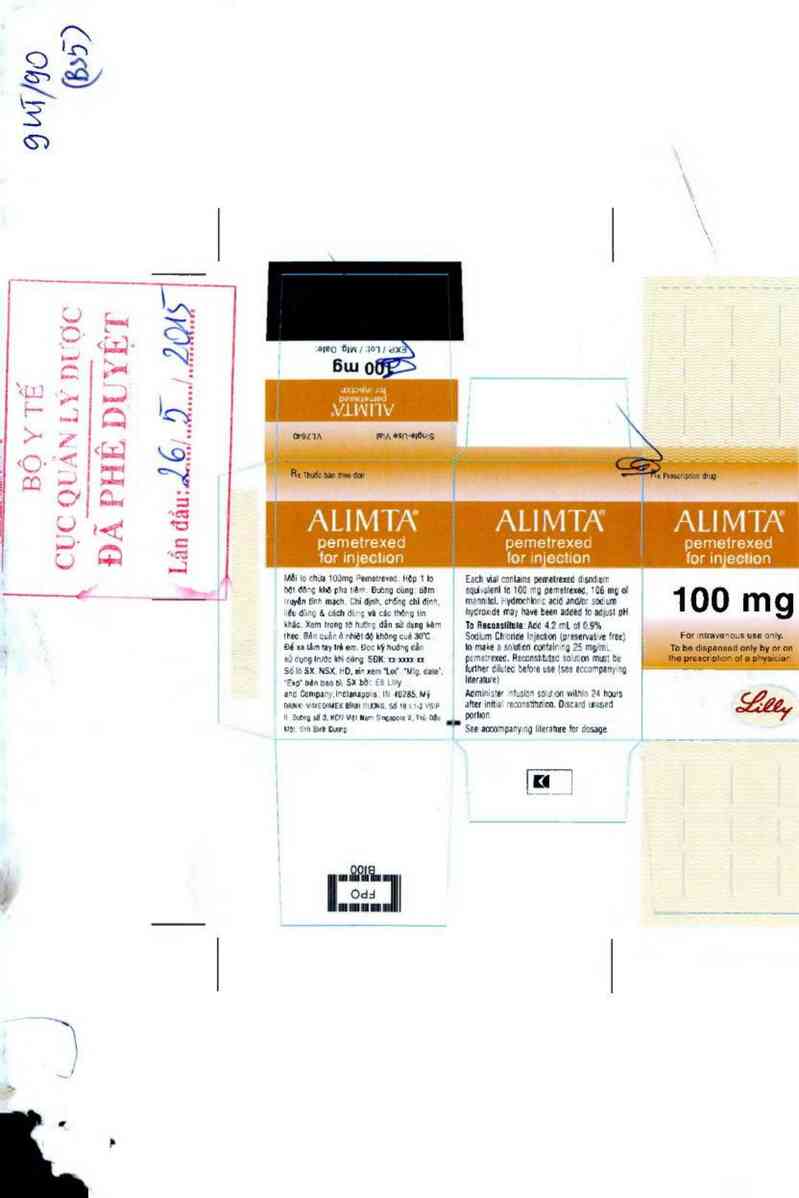
Rx thuốc bán theo đơn
ALIMTA
Bột đông khô để pha dung dịch tiêm truyền
Thânh phần /
Hoai chất: Mỗi lọ chứa lOOmg pemetrexed (dưới dạng pemetrexed dina ' e ahydrat).
Tá dươc: Manitol, acid hydroc1oric 10%, natri hydroxyd 10%, nước p tiêm, nitrogen, Iow-
Oxygen
Dạng bảo chế
Bôt đông khô để pha dung dịch tỉêm truyền.
Bột đỏng khô mảu trắng đến vảng nhạt hoặc vảng xanh lá cây.
Quy cảch đóng gói
Bột đông khô trong lo thùy tinh Ioại I, nút cao su.
Hộp 1 lọ lOOmg pemetrexed.
Chỉ định điều trị
U trung biểu mô mảng phổi ác tính
ALIMTA kết hợp với cisplatin được chỉ định để điều trị cảc bệnh nhân có u trung biều mô mảng
phối ác tính không thể cắt bỏ chưa được dùng hóa trị liệu.
Ung thư phối không tế bảo nhỏ
ALIMTA kết hợp với cisplatin là trị liệu được lựa chọn hảng đầu trong điếu trị cho cảc bệnh
nhân ung thư phổi không tế bảo nhỏ khu trú giai đoạn muộn hoặc đã di căn, không phải loại chủ
yếu là tế bảo hình vảy theo mô học (xem phần “Đặc tính dược lực học”)
ALIMTA đơn độc là tri 1iệu thay thế (hảng thứ hai) chỉ định trong điều trị cho các bệnh nhân ung
thư phối không tế bảo nhỏ khu trú giai đoạn muộn hoặc đã di căn, không phải loại chủ yếu là tế
bảo hình vảy theo mô học (xem phần “Đặc tính dược lực học”)
Liều lượng và cách dùng
Chỉ dùng ALIMTA dưới sự giám sảt của bảc sĩ có kinh nghiệm sử dụng hóa trị liệu chống ung
thư.
Phải pha dung dịch ALIMTA theo chỉ dẫn ở phần “Thận trọng đặc biệt về tiêu huỷ và lưu thông"
ALIMTA phối hg với cisolatin: liều khuyến cáo của ALIMTA lả 500mg/m² diện tích bề mặt cơ
thể (BSA), tiêm truyền tĩnh mạch trong 10 phủt ở ngảy thứ nhất của mỗi chu kỳ 21 ngảy, Liều
khuyến cáo của cisplatin lả 7Smg/m2 BSA tiêm truyền trong hai giờ, khoảng 30 phút sau khi
tiêm truyền xong pemetrexed ở ngảy thứ nhất của mỗi chu kỳ 21 ngảy. Bênh nhân ghải đươc
nhân liêu oháo chống nôn đầv đủ và đươc bù nước thích hơp trước vảlhoăc sau khi tiêm tru ền
cisplatin (xem thêm thông tin về sử dụng cisplatin trong Tóm tắt đặc tí - _g ấm của thuốc).
1`c Vủ ~
ALIMTA dùng đơn đôc: ó bệnh nhân ung thư phối khỏng tế bảo nhớ đã tim ùnthớả trị liệu
. \ r _ * Í
ỈTƯỚC đó, liêu khuyên cảm của ALIMTA lả 500mg/m2 BSA, tiêm truyên tĩnh m,
ở ngảy thứ nhất của mỗi chu kỳ 21 ngảy.
rong 10 phủt
Chế đô tn` liêu chuẩn bi:
Để giảm tần xuất và mức độ nặng cùa cảc phản ứng da, cần cho bệnh nhân sử dụng một
corticosteroid vảo ngảy trước, ngảy tiêm truyền, và ngảy sau khi tiêm truyền pemetrexed. Sử
dụng corticosteroid với liều tương đương dexamethason 4mg uống 2 lần mỗi ngảy (xem phần
“Cảnh bảo đặc biệt và thận trọng khi dùng”)
Để giảm độc tính cùa thuốc, bệnh nhân điều trị với pemetrexed phâi dùng bổ sung vitamin (xem
phần “Cảnh báo đặc biệt và thận trọng khi dùng”). Bệnh nhân phải uống acid folic hoặc một chế
phẩm nhiều vitamin có chứa acid folic (350 đến 1.000 microgam) hảng ngớy, Ít nhất phải uống 5
liều acid folic trong 7 ngảy trước khi dùng liều pemetrexed đầu tiên, và phải tiếp tục uống trong
toản bộ đợt điều trị và trong 21 ngảy sau liều pemetrexed cuối cùng. Bệnh nhân củng phải được
tiêm bắp vitamin Biz (1.000 microgam) trong tuần tnrớc liều pemetrexed đầu tiên và cứ 3 chu kỳ
một lần sau đó. Những lẩn tiêm vitamin Biz tiếp sau có thể vảo cùng ngảy với pemetrexed.
Theo dõi:
Trước mỗi liều dùng pemetrexed, bệnh nhân phải được kiểm tra toản bộ số 1ượng tế bảo mảu bao
gồm công thức bạch cầu và số lượng tiểu cầu. Trước mỗi đợt dùng hóa trị liệu, cần 1ảm xét
nghiệm hóa sinh máu để đánh giá chức năng thận vả gan. Trước khi bắt đằu mỗi chu kỳ hóa trị
1iệu, tiêu chuẩn bệnh nhân cẩn phải đạt được như sau: số lượng bạch cầu trung tính (ANC) phải
z i.SOOJmm² và số lượng tiểu cẩu phải g 100.0007 mm².
Hệ Số thanh thải creatinin phải ì 45m1/phút.
Bilirubin toản phần phải í 15 lần giới hạn trên của binh thường. Phosphatase kiềm (AP),
aspartat transaminase (AST hoặc SGOT) vả alanin transaminase (ALT hoặc SGPT) phải _<_ 3 lần
giởi hạn trên của bình thuờng. Phosphatase kiềm, AST vả ALT j 5 lẳn giới hạn trên cùa bình
thường có thế chấp nhận được trong trường hợp có di căn tới gan.
Điều chính liều:
Sự điều chính liều lúc bắt đẳu một chu kỳ tiếp sau phải dựa trên số lượng tế bảo mảu thấp nhất
hoặc độc tính tối đa trên cảc cơ quan khác ngoải máu từ chu kỳ điều trị trước. Việc điều trị có thể
hoãn lai để bệnh nhân có đủ thời gian hồi phục. Khi hồi phục, bệnh nhân phải được tiếp tục điều
trị theo cảc chỉ dẫn ở các Bảng 1, 2 và 3, có thể áp dụng cho ALIMTA dùng đơn độc hoặc kết
hợp với Cìsplatin.
Bảng 1. Bảng hiệu chĩnh liều cũa ALIMTA (dùng đơn độc hoặc kết hợp) và Cisplatin
dựa trên độc tính trên huyết học
ANC thâp nhất < 500/nm? vả tiêu cầu thấp 15% của liều truớc (cả ALIMTA vả cisplatin)
nhất ì 50.0007mm3
sộ lượng tiểu cầu thấp nhỂtt < 50,000/mm3 75%củaliềutrước (cã ALIMTA vả cisplatin)
không tính đến ANC thấp nhất
Sô luợng tiêu câu thấp nhãt < so.oooxmmỉ có 50% của liêu trước (cả 2 thuốc)
\»-
chảy máua, không tinh đến ANC thấp nhất
Theo tiêu chuẩn độc tính chung (CTC) của Viện Ung thư Quốc gia (CTC W, NC1 1998)
quy định chảy mảu 2 C TC mức độ 2
Nếu bệnh nhân xuất hiện cảc độc tính khảo ngoải mảu ỉ mức độ 3 (không kể đôc tinh trên thần
kinh), phải ngừng dùng ALIMTA cho tới khi thuyên giảm tới mức thấp hơn hoặc bằng tnị số
trước điều trị của bệnh nhân. Việc điều trị sẽ lại được tiếp tục theo các chỉ dẫn ở Bảng 2.
Bâng 2. Bảng hiệu chỉnh liều của ALIMTA (dùng đơn độc hoặc kết hợp) và Cisplatin
dựa trên độc tỉnh khác ngoâi huyết học “'b
Liều ALIMTA (mglml)
Liều cisplatin (mglml)
Bât cứ độc tính nảo, trừ viêm niêm
mạc, ở mức độ 3 hoặc 4.
75% liêu trước
75% liều trước
Tiêu chảy cần điều trị tại bệnh viện
(không kể mức độ) hoặc tiêu chảy
độ 3 hoãc 4
75% liều trước
75% liều trước
Viêm niêm mạc mức độ 3 hoặc 4
50% liều trước
lOO%Ỉều trước
“ Tiêu chuẩn độc tính chung của Viện Ung thư Quốc gia (CTC v2.0; NC1 1998)
b Không kế độc tính thẩn kinh
Trong trường hợp có độc tính thần kinh, điều chinh liều ALIMTA vả cisplatin theo hướng dẫn ở
Bảng 3. Bệnh nhân phải ngừng điều trị nếu quan sảt thấy độc tính thần kinh mức độ 3 hoặc 4.
Bảng 3. Bảng hiệu chỉnh lỉều của ALIMTA (dùng đơn độc hoặc kễt hợp) và Cisplatin
dựa trên độc tính thần kinh
Mức độ CTC“ Lữ… ALIMTA (mglml) Liều cisplatin (mglml)
0—1 100% liều trước 100% liều trước
2 100% liều trước 50% liều trước
“ Tiêu chuẩn độc tính chung của Viện Ung thư Quốc gia (CTC v2.0; NC1 ]998)
Phải ngừng điều trị với ALIMTA sau 2 lần giảm liều nếu bệnh nhân có bất cứ độc tinh nảo trên
mảu hoặc ngoải mảu mức độ 3 hoặc 4, hoặc ngay lập tức nếu quan sải thấy độc tính thần kinh
mức độ 3 hoặc 4.
Người giả: Trong nghiên cứu lâm sảng, không có dấu hiệu là bệnh nhân từ 65 tuổi trở lên có
nguy cơ về tác dụng không mong muốn nhiều hơn so với bệnh nhân dưới 65 tuổi. Không cẩn sự
giảm liều nảo khảc ngoải chế độ giảm liều được khuyến cáo chung cho tất cả bệnh nhân.
Trẻ em và Ihiếu niên: ALIMTA không được khuyến cáo dùng cho bệnh nhân dưới 18 tuổi vì
chưa xảo định sự an toản và hiệu quả trong nhóm bệnh nhân nảy.
Bệnh nhản suy thận: (Công thức Cockcroft vả Gault chuẩn hoặc tốc độ lọc cầu thận đo bằng
phương pháp thanh thải huyết thanh Tc99m-DPTA): pemetrexed được thải trừ chủ yếu dưới
dạng không đổi bởi sự bải tiết của thận. Trong nghiên cứu lâm sảng, bệnh nhân có hệ số thanh
Q.-I~nn~`vd
thải creatinin ì 45m1/phút không cần sự điều chỉnh liều nảo khảc ngoải Sự điều chinh được
khưyến cáo cho tất cả bệnh nhân. Không có đủ dữ liệu về sử dụng pemetrexed " bệnh nhân có độ
thanh thải creatinin dưới 45mlfphủt; do đó không khuyến cấm dùng pem`ễỀxễd (xem phần
“Cảnh báo đặc biêt và thân trọng khi dùng”).
Bệnh nhân suy gan: Không tim thấy có sự liên quan giũa AST (SGOT), ALT (SGPT), hoặc
bilirubin toản phẩn và dược động học của pemetrexed. Tuy nhiên bệnh nhãn bị suy gan với
hilirubin > 1,5 lần giới hạn trên của bình thường vảfhoãc transaminase > 3,0 lần giới hạn trên của
bỉnh thường (không có di căn gan) hoặc > 5,0 lần giới hạn tTên của binh thường (có di căn gan)
chưa được nghiên cứu nêng biệt.
Chống chỉ định
Mẫn cảm với pemetrexed hoặc với bất cứ tả dược nảo,
Phải ngừng cho con bú trong khi điều trị với pemetrexed (xem phần “Thời kỳ mang thai và cho
con bú”).
Dùng đồng thời vaccin sốt vả.ng (xem phần “Tương tảc với cảc thuốc khác vả. các dạng tương tác
khác”).
Cảnh bảo đặc bỉệt và thận trọng khi dùng
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cẩn thêm thông tín xin hóỉý kiển bác sĩ hoặc
dược sĩ
Thuốc nảy chỉ dùng theo đơn của bác sĩ
Pemetrexed có thế ửc chế chức năng tủy xương biểu hiện bằng giảm bạch cầu trung tính, giảm số
lượng tiếu cầu và thiếu mảu (xem phần “Các tác dụng không mong muốn”). Sự ửc chế tủy
thường lả. độc tính giới hạn liều lượng. Phải theo dõi tác dụng ức chế tuỳ trong quá trình điều trị
cho bệnh nhãn và không được cho bệnh nhãn dùng pemetrexed cho tới khi số lượng bạch cầu
trung tỉnh (ANC) đạt mức ì 1.500/mm3 và số lượng tiếu cầu đạt mức ì 100.000/mm3. Sự giảm
liều trong các chu kỳ tiếp sau dưa trên ANC, số lượng tiếu cầu thấp nhất và độc tinh ngoảí máu
tối đa nhận thấy từ chu kỳ điều trị trước (xem phần “Liều lượng và cảch dùng”).
Khi được điều trị trước với acid folic vả vitamin Btz, bệnh nhân ít gặp độc tính hơn và giảm
được các độc tính trên máu và ngoải máu mức đó 374 như giảm bạch cầu trung tỉnh, sốt giảm
bạch cầu trung tính và nhiễm khuẳn kèm giảm bạch cầu trung tính đó 3/4. Do đó phải hướng dẫn
bệnh nhân điều trị với pemetrexed rằng dùng acid folic vả vitamin Btz lả biện phảp dự phòng để
giảm độc tính liên quan tới thuốc (xem phần “Liều lượng và cảch dùng”).
Các phản ưng da đă được báo cảo ở bệnh nhãn không được điều trị trước với corticosteroid. Việc
điều tti trước với dexamethason (hoặc tương đương) có thể lảm giảm tần xuất và mức độ nặng
cũa phản ứng da (xem phần “Liều lượng vả cảch dùng”).
Một số lượng hạn chế cảc bệnh nhãn được nghiên cưu có độ thanh thải creatinin dưới 4SmI/phút
Do đó, khỏng khuyến cảo dùng pemetrexed cho bệnh nhân có độ thanh thái creatinin <
45m1/phút (xem phần “Liều lượng và cách dùng”).
'f'lI-
Bệnh nhân suy thặn nhẹ đến vừa (độ thanh thải creatinin từ 45 đến 79ml/phủt) phải trảnh dùng
cảc thuốc chống viêm không-steroid (NSAIDs) như ibuprofen, vả aspirin (> v ng'ảy) trong 2
ngảy trước ngảy dùng, và 2 ngảy sau khi dùng pemetrexed (xem phần 4.5), Tửbệnh nhân đủ
tiêu chuẩn để điều trị với pemetrexed phải tránh dùng NSAID có nứa đời thải trừ dải trong it
nhất 5 ngảy trước ngảy dùng, và ít nhất 2 ngảy sau khi dùng pemetrexed (xem phằn “Tương tải:
với các thuốc khác và cảc dang tương tảc khảo”).
Các biến cố nghiêm trọng trên thận, bao gồm cả suy thặn cấp đã được bảo cảo khi sử dụng
pemetrexed đơn độc hoặc phối hợp với các hoá chất trị liệu khác. Nhiều trong số những bệnh
nhân gặp các biến cố nảy đều có cảc yếu tố nguy cơ tiềm ẳn của bệnh thận như mất nước hay bị
tăng huyết áp hoặc đải thảo đường từ trước.
Ảnh hưởng của dich ở khoang thứ ba, như dịch trản mảng phổi hoặc cố trướng (bảng) đối với
pemetrexed không được biềt. Ở bệnh nhân có dich ở khoang thứ ba có ý nghĩa lãm sảng, phải
xem xét việc dẫn h… dịch trước khi dùng pemetrexed.
Do độc tinh trên tiêu hóa của pemetrexed dùng kết hợp với cisplatin, mất nước nặng đã được ghi
nhận. Vì vậy, bệnh nhân phải được chống nôn đầy đủ và được bù nước thích hợp trước vả/hoặc
sau khi điều trị,
Các biến cố không mong muốn nghiêm trọng trên tim mạch gồm nhồi mảu cơ tim và biến cố
mạch mảu não ít xảy ra trong cảc nghiên cứu lâm sảng với pemetrexed, thường xảy ra khi dùng
kết hợp với một thuộc độc hại tế bảo khác. Phần lớn bệnh nhân gặp cảm tác dụng nảy đã có các
A & t › A “ › | A Á »
yeu to nguy cơ tim mạch tư trươc (xem phan Cac tac dụng khong mong muon ).
Tình trạng suy giảm miễn dịch thường gặp ở bệnh nhân ung thư. Do đó, không khuyến cảo dùng
đồng thời với vaccin sống giảm độc tính (trừ vaccin sốt vảng bị chống chỉ định) (xem phần
“Chống chỉ định” vả “Tương tảc với cảc thuốc khảc vả cảc dạng tương tảc khảc”).
Pemetrexed có thể gây tổn hại Về di truyền. Nam giới tTưởng thảnh về sinh dục được khuyên
không thụ tinh trong khi điều trị và tới 6 thảng sau đó. Cảo biện phảp trảnh thai hoặc kiêng giao
họp được khuyến cảo. Do trị liệu với pemetrexed có thể gây vô sinh không hồi phục, nam giới
được khuyên tim sự hướng dẫn về cắt trữ tinh trùng trước khi bắt đầu điều trị.
Phụ nữ có khả năng mang thai phải dùng cảc biện pháp tránh thai hữu hiệu trong khi điều trị vởi
pemetrexed (xem phẩn “Thời kỳ mang thai vả cho con bú").
Cảo truờng hợp viêm phỗi khu trú do xạ trị đã được báo cảo ở cảc bệnh nhân điều trị tia xạ ' c,
trong hoặc sau khi dùng pemetrexed. Cẩn đặc biệt chú ý tới cảc bệnh nhân nảy và thận trọn hi
sử dụng các hoá chất nhạy cảm tia xạ khác.
Một số t1~ường họp thu hồi bức xạ đă được báo cảo ở cảc bệnh nhân điều trị tia xạ vải tuần hoặc
vải năm trước đó.
Tương tảc với các thuốc khảc và các dạng tương tác khác
u1,1 JJ.JÌJt jtfit ...….F . ịtl
Pemctrexed được thải trù chủ yếu ở dạn g không đối qua thân nhờ bải tiết ớ ống thận và một phần
nhờ lọc ở cẩn thận. Việc dùng đổng thời vởi các thuốc độc trên thận (như aminogl cosid, thuốc
Iợi tiếu quai, hợp chắt platin, cyclosporin) có thề lảm chậm sự thanh thải pemetrề . Cần thận
xì
trọng khi phối hợp các thuốc nảy. Nếu cần dùng, phải theo dõi chặt chẽ độ thanh that creatinin.
Việc dùng đồng thời với các chất cũng được bải tiềt bới ống thận (như probenecid, penicilin) có
khả năng lảm chậm sự thanh thải pemetrexed Phải thận trọng khi dùng cảc thuốc nảy kết hợp
vói pemetrexed. Nếu cần dùng, phải theo dõi chặt chẽ độ thanh thải creatinin.
Ở bệnh nhân có chừc nãng thận bình thường (độ thanh thải creatinin ì 80ml/pht'it), liều cao cảc
thuốc chống viêm không steroid (NSAID, như ibuprofen > '1.600mg/ngảy) vả aspirin ở liều cao
(ì 1,3g/ngảy) có thể lảm giảm sự thải trù pemetrexed, và do đó lảm tăng cảc tác dụng không
mong muốn của pemetrexed. Vì vậy, phải thận trọng khi dùng liều cao NSAID, hoặc aspirin
đổng thời với pemetrexed cho bệnh nhân có chức năng thận bình thường (độ thanh thái creatinin
ỉ 80m1/phút).
ớ bệnh nhân có suy thận nhe đến vừa (độ thanh thải creatinin từ 45 đến 79mllphút), phải tránh
dùng đồng thời NSAID (như ibuprofen), hoặc aspirin ở liều cao trong 2 ngảy trước, ngảy dùng,
và 2 ngảy sau khi dùng pemetrexed (xem phần “Cảnh báo đặc biệt và thận trọng khi dùng”).
Trong khi không có dữ liệu về nguy cơ tương tác với NSAID có nửa đời thải trừ dải hcm như
piroxicam hoặc rofecoxib, phải trảnh dùng đồng thời vói pemetrexed trong it nhất 5 ngảy trước
ngảy dùng, và ít nhất 2 ngảy sau khi dùng pemetrexed (xem phẩn “Cảnh báo đặc biệt và thận
trọng khi dùng”).
Pemctrexed ít được chuyền hóa ở gan. Các kết quả nghiên cứu in vitro với mỉcrosome gan người
cho thấy pemetrexed có thế không gây ưc chế có ý nghĩa lâm sảng sự chuyền hóa cùa cảc thuốc
được chuyền hóa bới CYP3A, CYP2DG, CYP2C9, vả CYP1 A2.
Tương tảc hay gặp với Iất cả lhuốc độc hại tế bảo:
Vì nguy cơ huyềt khối tăng lên ở bệnh nhân ung thư, liệu pháp chống đông thường được dùng.
Do có sự dao đông lớn giữa các cá thể về tinh trạng đông mảu trong cảc bệnh vả do khả năng
tương tác giữa cảc thuốc chống đông máu đường uống với hóa trị liệu chống ung thư nên cần
phải theo dõi LNR (International Normalised Ratio: tỷ số bình thường hóa quốc tế) thường xuyên
hơn, nếu quyết định sử dụng cảc thuốc chống đông đưòng uống cho bệnh nhân.
Chống chỉ định dùng đồng ĩhỜÍ.` vaccin sốt vảng: nguy cơ tử vong vì bệnh do vaccin phảt triển
toản thân (xem phẩn “Chống chỉ định”).
Khóng khuyến cáo dùng đồng thời: vaccin sống giảm tính độc (trừ sốt vảng): nguy cơ bệnh toản
thân, có thể gây tử vong. Nguy cơ tảng lên ở các đối tượng đã bị suy giảm miễn dịch bởi bệnh
căn bản. Dùng vaccin bẩt hoạt nều có (bệnh bại liệt) (xem phần “Cảnh bảo đặc biệt và thận trọng
khi dùng”).
. ;, u…,-,_
' ì
Phụ nữ có thai và cho con bú
Không có dữ liệu từ việc sử dụng pemetrexed ở phụ nữ mang thai nhưng pemetrexed, củng như
cảc chắt chống chuyển hóa khảo, bị nghi lả gây những khuyết tật bẩm sinh ngh“ trọfig khi
dùng trong thời kỳ mang thai. Nghiên cứu trên động vật cho thấy có độc Ẹ inh sản.
Pemctrexed khỏng được dùng trong thời kỳ mang thai trừ khi thật sự cần thiết sau khi đã cân
nhắc kỹ sự cần thiết điều trị cho mẹ và ngưy cơ đối với thai (xem phần “Cảnh báo đặc biệt và
thận trọng khi dùng”).
Phụ nữ có khả năng mang thai phải dùng biện pháp trảnh thai hữu hiệu trong khi điều trị với
pemetrexed.
Pemctrexed có thể gây tốn hại di truyền. Nam giới trưởng thảnh về sinh dục được khuyên không
nên lảm cha trong khi điều trị và tới 6 tháng sau đó. Cảo biện phảp trảnh thai hoặc kiêng quan hệ
tình dực được khuyến cản. Do trị liệu với pemetrexed có khả năng gây vô sinh không hồi phục,
nam giới được khuyên tim sự tư vẳn về cẳt trữ tinh trùng trước khi bắt đầu điều trị.
Không biết pemetrexed có bải tiết vảo sữa ngưòi hay không vả không thể loại trừ các tảo dụng
không mong muốn trên trẻ bú sữa mẹ. Phải ngừng cho con bú trong khi điều trị với pemetrexed
(xem phần “Chống chỉ đinh”)
Tác dụng trên khả năng lái xe vả điều khiển máy mỏc
Không có nghiên cứu về tảo dụng trên khả năng lái xe vả điều khiến mảy móc. Tuy nhiên, đã có
báo cáo là pemetrexed có thể gãy mệt mỏi. Vì vậy bệnh nhân phải đuợc nhắc nhở đối với việc lải
xe hoặc vận hảnh mảy móc nếu tảc dựng nảy xảy đến.
Tác dụng không mong muốn
Tóm tắt hồ sơ an toân
Các tác dung không mong muốn đã được bảo cảo thường gặp nhất liên quan với pemetrexed,
được sử dụng dưới dạng đớn tri liệu hoặc phối hợp, gồm ức chế tủy xương với biều hiện như
thiếu máu giảm bạch câu trung tính, giảm bạch câu, giảm tiểu cằu và độc tính đường tiêu hóa
với biểu hiện như chán ăn, buồn nộn, nôn, tiêu chảy, táo bón, viêm họng, viêm niêm mạc vả
viêm miệng. Cảc tác dụng không mong muốn khác bao gồm độc tính đối với thận, tăng
aminotransferase, rụng tóc, mệt mỏi, mất nước, nối ban, nhiễm trùnglnhiễm khuấn vả bệnh thần
kinh.
Các tảo dựng phụ híếm gặp bao gồm hội chứng Stevens-Johnson vả hoại tử biều bi nhiễm độc.
Bảng Iiệt kê các tác dụng không mong muốn
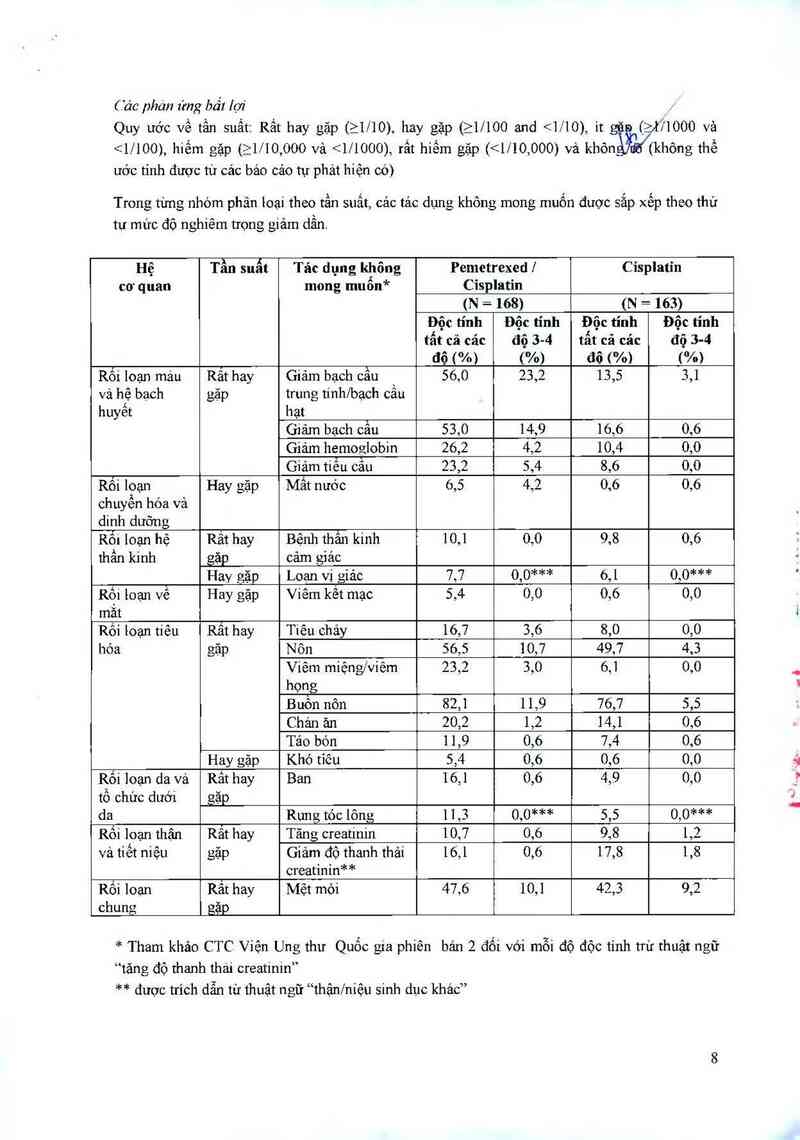
Bảng dưới đây cung cấp tần suất và mức độ nghiêm trọng của cảc tảc dụng không mong muốn
đã được báo cáo ở > 5% của 168 bệnh nhân có u trung biểu mô dùng cisplatin vả pemetrexed, vả
163 bệnh nhân có u trung biểu mô dùng cisplatin đớn độc được phân bố ngẫu nhiên vảo hai
nhóm. Trong cả hai nhóm điều trị, các bệnh nhân chưa từng dùng hóa trị liệu nảy được bổ sung
đầy đủ acid folic vả vitamin B .2.
( ác phán img bất lợi
Quy uớc về tần suất: Rất hay gặp (>1/10), hay gặp (>1/100 and <1/10),1t găn (2171000 vả
<1/100), hiếm gặp (21l10,000 vả <111000), rất hiếm gặp (<1Í10,000) vả khônjttũákhỏng thể
ước tính được từ cảc bảo cảo tự phảt hiện có)
Trong timg nhóm phân 1oại theo tần suất, các tác dụng không mong muốn được sắp xếp theo thứ
tự mức độ nghiêm trọng giảm dẳn,
Hệ Tần suất Tác dụng không Pemctrexedl Cisplatin
cơ quan mong muốn* Cỉsplatin
(N = 168) (N = 163)
Độc tính Độc tỉnh Độc tính Độc tỉnh
tất cả các độ 34 tất cả các độ 34
độ ("/0) (%) đô Wo) ("/o)
Rối loạn mảu Rẳt hay Giảm bạch cẩu 56,0 23,2 13,5 3,1
vả hệ bạch gặp trung tínhfbạch cầu
huyết hạt
Giảm bạch cẩu 53,0 14,9 16,6 0,6
Giảm hemoglobin 26,2 4,2 10,4 0,0
Giảm tiểu câu 23,2 5,4 8,6 0,0
Rối loạn Hay gặp Mất nước 6,5 4,2 0,6 0,6
chuyến hóa và
dinh dưỡng
Rối loạn hệ Rất hay Bệnh thân kinh 10,1 0,0 9,8 0,6
thần kinh gặp cảm giác
Hay gặp Loạn vị giảc 7,7 0,0*** 6,1 0,0***
Rội loạn về Hay gặp Viêm kềt mạc 5,4 0,0 0,6 0,0
măt
Rôi 1oạn tiêu Rât hay Tiêu chảy 16,7 3,6 8,0 0,0
hóa gặp Nôn 56,5 10,7 49,7 4,3
Viêm miệng/viêm 23,2 3,0 6,1 0,0
họng
Buôn nôn 82,1 11,9 76,7 5,5
Chán ản 20,2 1,2 14,1 0,6
Táo bón 11,9 0,6 7,4 0,6
Hay gặp Khó tiêu 5,4 0,6 0,6 0,0
Rối loạn da vả Rât hay Ban 16,1 0,6 4,9 0,0
tổ chức dưới gặp
da Rưng tóc lông 11,3 0,0*** 5,5 0,0***
Rối loạn thân Rẳt hay Tăng creatinin 10,7 0,6 9,8 1,2
và tiết niệu gặp Giảm độ thanh thải 16,1 0,6 17,8 1,8
creatinin**
Rối loạn Rât hay Mệt mỏi 47,6 10,1 42,3 9,2
chung gặp
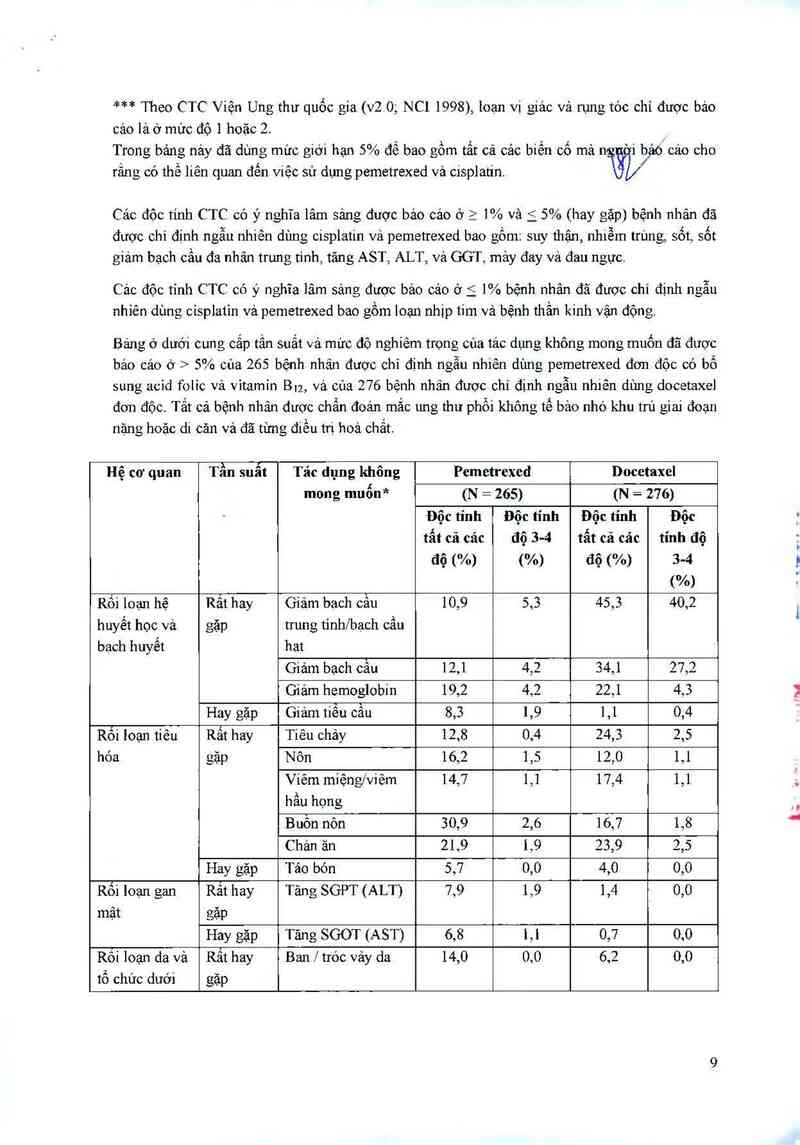
* Tham khảo CTC Viện Ung thư Quốc gla phiên bản 2 đối với mỗi độ độc tính trừ thuật ngữ
“tăng độ thanh thái creatinin”
** được trich dẫn từ thuật ngư
ữí€
thận/niệu sinh dục khác”
~
*** Theo CTC Viện Ung thư quốc gia (v2.0; NC1 1998), Ioạn vị giảc và tung tóc chỉ được bảo
cảo lá ở mức độ 1 hoặc 2.
Trong bảng nảy đã dùng mức giới hạn 5% để bao gồm tất cả các biến cố mả ng `i b' ' cảm cho
rằng có thể liên quan đến việc sử dụng pemetrexed vả cisplatin. ẳqV
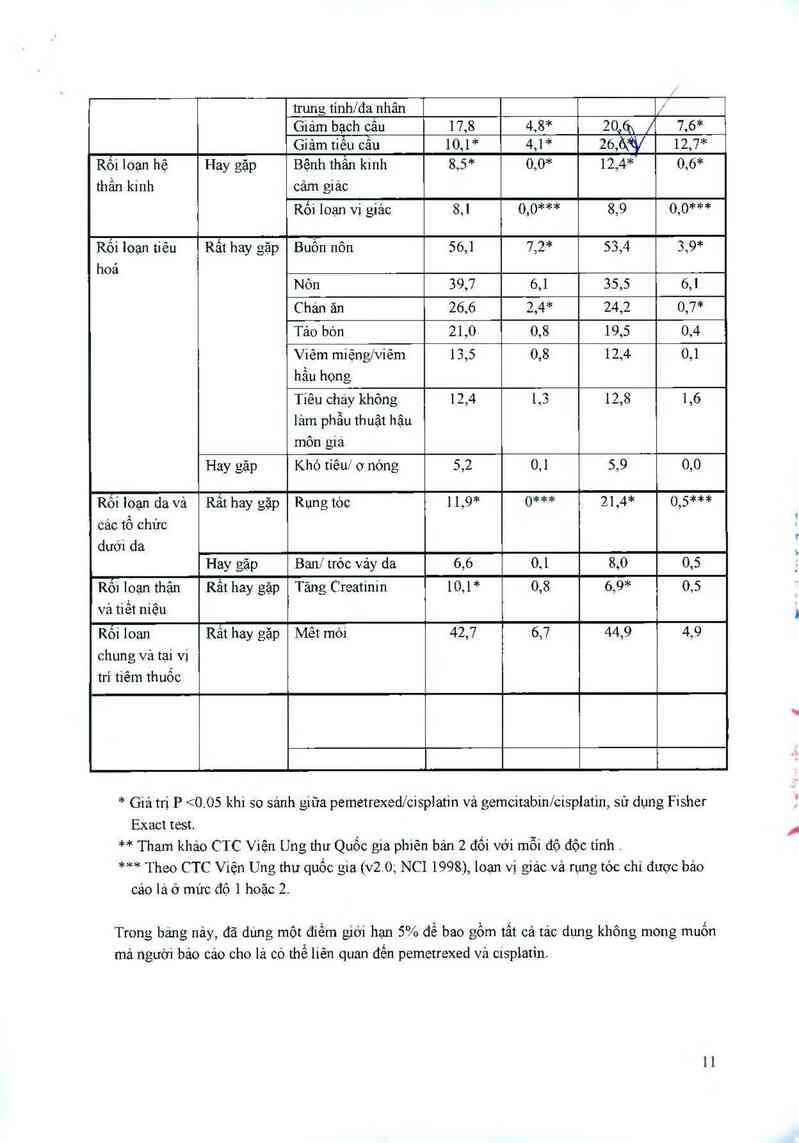
Cảo đôc tính CTC có ý nghĩa lâm sảng được bảo cảo ở 2 1% và S 5% (hay gặp) bệnh nhân đã
được chỉ định ngẫu nhiên dùng cisplatin vả pemetrexed bao gồm: suy thặn, nhiễm trùng, sốt, sốt
giám bạch cẩu đa nhân trung tinh, tăng AST, ALT, vả GGT, mảy đay và đau ngực,
Cảo độc tinh CTC có ý nghĩa lâm sảng được bảo cảo ở 5 1% bệnh nhân đã được chỉ định ngẫu
nhiên dùng cisplatin vả pemetrexed bao gồm loạn nhịp tim và bệnh thần kinh vận động.
Báng ở dưới cung cắp tần suất và mức độ nghiêm trọng của tác dụng không mong muốn đã được
báo cáo ở > 5% của 265 bệnh nhân được chỉ định ngẫu nhiên dùng pemetrexed đơn độc có bổ
sung acid folic vả vitamin Btz, vải của 276 bệnh nhân được chỉ định ngẫu nhiên dùng docetaxel
đơn độc. Tắt cả bệnh nhân được chấn đoán mắc ung thư phồi không tế bảo nhỏ khu trú giai đoạn
nặng hoặc di căn Vả đã từng điều trị hoá chất.
Hệ cơ quan Tần suất Tác dụng không Pemctrexed Docetaxel
mong muốn* (N = 265) (N = 276)
Độc tính Độc tính Độc tính Độc
tẩt cả các độ 3-4 tẩt cả cảc tính độ
độ (%) (%) độ (%) 3-4
("/0)
Rối loạn hệ Rât hay Giảm bạch cầu 10,9 5,3 45,3 40,2
huyết học vả gặp trung tinhfbạch cầu
bạch huyết hạt
Giảm bạch câu 12,1 4,2 34,1 27,2
Giảm hemoglobin 19,2 4,2 22,1 4,3
Hay gặp Giảm tiểu cầu 8,3 1,9 1,1 0,4
Rối loạn tiêu Rất hay Tiêu chảy 12,8 0,4 z4,3 2,5
hóa gặp Nôn 16,2 1,5 12,0 1,1
Viêm miệngỉviêm 14,7 '1,1 17,4 1,1
hầu họng
Buôn nỏn 30,9 2,6 16,7 1,8
Chản ăn 219 1,9 23,9 2,5
Hay gặp Táo bón 5,7 0,0 4,0 0,0
Rỏi loạn gan Rât hay Tăng SGPT (ALT) 7,9 1,9 1,4 0,0
mật gảiJ
Hay gặp Tãng SGOT (AST) 6,8 1,1 0,7 0,0
Rỏi loạn da và Rẳt hay Ban | tróc vảy da 14,0 0,0 6,2 0,0
tổ chức dưới gặp
1
da Hay gặp Ngứa 6,8 0,4 1,8 /010
Rựng tóc 6,4 0,4** 3'(, j/ 2,2**
Rới loạn Rất hay Mệt mới 34,0 5,3 35, 1/ 5,4
chung gặp
Hay gặp Sốt 8,3 0,0 7,6 0,0
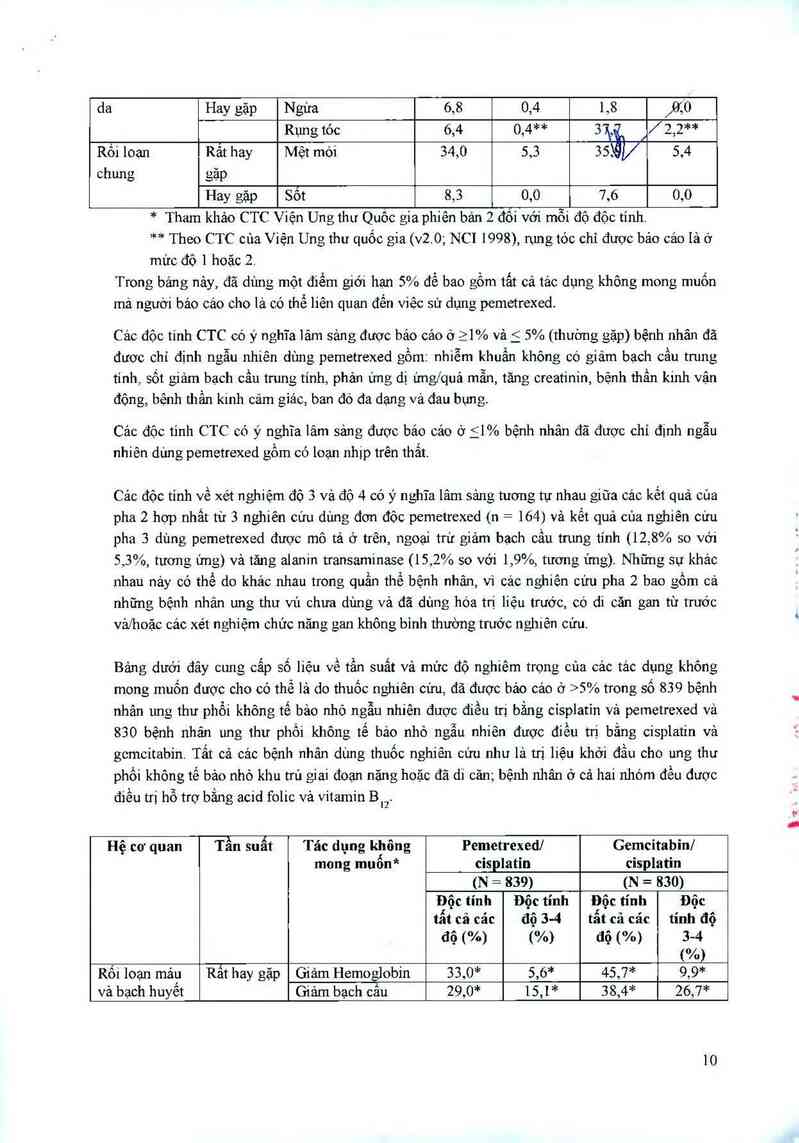
* Tham khảo CTC Viện Ung thư Quôc gia phiên bản 2 đồi với mỗi độ độc tính.
** Theo CTC cùa Viện Ung thư quốc gia (v2.0; NC1 1998), rụng tóc chỉ được bảo cảo lá ở
mừc độ 1 hoặc 2,
Trong bảng nảy, đã dùng một điểm giới hạn 5% để bao gồm tất cả tác dụng không mong muốn
mà người bảo cáo cho lá có thể liên quan đến việc sử dựng pemetrexed.
Cảo độc tỉnh CTC có ý nghĩa lãm sảng được báo cáo ở ìl% vả j 5°Ải (thuờng gặp) bệnh nhân đã
được chỉ định ngẫu nhiên dùng pemetrexed gồm: nhiễm khuẩn khỏng có giảm bạch cẩu trung
tính, sốt giảm bạch cầu trung tính, phản ửng dị ửng/quả mẫn, tăng creatinin, bệnh thẩn kinh vận
động, bệnh thần kinh cảm giảc, ban đó đa dạng về đau bụng.
Cảc độc tinh CTC có ý nghĩa lâm sảng được báo cảo ở f 1% bệnh nhân đã được chỉ định ngẫu
nhiên dùng pemetrexed gổm có loạn nhịp trên thẳt.
Cảo độc tinh về xét nghiệm độ 3 vả độ 4 có ý nghĩa lâm sảng tương tự nhau giũa cảc kết quả của
pha 2 hợp nhất từ 3 nghiên cứu dùng đơn độc pcmetrcxed (n = 164) và kết quả của nghiên cứu
pha 3 dùng pemetrexed được mô tả ở trên, ngoại trừ giảm bạch cầu trung tỉnh (12,8% so với
5,3%, tương ứng) và tăng alanin transaminase (15,2% so với 1,9%, tương ứng). Những sự khác
nhau náy có thể do khảo nhau trong quần thể bệnh nhân, vì cảc nghiên cứu pha 2 bao gồm cả
những bệnh nhân ung thư vú chưa dùng vả đã dùng hóa trị liệu trước, có di căn gan từ trước
vả/hoặc cảc xét nghiệm chức năng gan không bỉnh thường trước nghiên cứu.
Bảng dưới đây cung cẳp số liệu về tần suất và mức độ nghiêm trọng cũa cảc tảc dụng khõng
mong muốn được cho có thế lả do thuốc nghiên cứu, đã được bảo cảo ở >5% trong số 839 bệnh
nhân ung thư phổi không tế bảo nhỏ ngẫu nhiên được điều trị bằng cisplatin vả pemetrexed và
830 bệnh nhãn ung thư phối không tế bảo nhỏ ngẫu nhiên được điều trị bằng cisplatin vả
gemcitabin. Tẩt cả cảc bệnh nhân dùng thuốc nghiên cứu như là trị liệu khởi đầu cho ung thư
phổi không tế bảo nhỏ khu trú giai đoạn nặng hoặc đã di cãn; bệnh nhân ở cả hai nhóm đều được
điều trị hỗ trợ bằng acid folic vả vitamin Bư
Hệ cơ quan Tần suất Tác dụng không Pemctrexed/ Gemcitabin/
mong muốn* cisplatin cisplatin
(N = 839) (N = 830)
Độc tính Độc tính Độc tính Độc
tất cả các độ 3-4 tẩt cả các tính độ
độ (%) (%) độ (%) 3-4
(%)
Rối loạn mảu Rất hay gặp Giảm Hemoglobin 33,0* 5,6* 45,7²“ 9,9*
và bạch huyết Giảm bạch cấu 29,0* 15,1* 38,4* 26,7*
10
trung tính/đa nhân
zo,ộ /
Giám bạch câu 17,8 4,8* 7,6*
Giảm tiểu cầu 10,1 * 4,1 * 26,6,W 12,7*
Rỏi loạn hệ Hay gặp Bệnh thân kinh 8.5* 0,0* 12,4°F 0,6*
thần kinh cảm giác
Rối loạn vị giác 8,1 0,0*** 8,9 0,0***
Rối loạn tiêu Rất hay gÌp Buồn nôn 56,1 7,2* 53,4 3,9*
hoả
Nôn 39,7 6,1 35,5 6,1
Chản ăn 26,6 2,4* 24,2 0,7*
Tảo bón 21,0 0,8 19,5 0,4
Viêm miệngfviêm 13,5 0,8 12,4 0,1
hầu hỌng
Tiêu cháy không 12,4 1,3 12,8 1,6
lảm phẫu thuật hậu
môn gia
Hay gặp Khó tíêui' ợ nòng 5,2 0,1 5,9 0,0
Rối ioạn da và Rât hay gặp Rụngtóc ii,9* o*** 21,4* 0,5***
các tổ chức
dưới da
Hay gặp Ban! tróc vảy da 6,6 0,1 8,0 0,5
Rối loạn thận Rất hay gặp Tăng Creatinin 10,1* 0,8 6,9* 0,5
và tiềt niệu
Rối loạn Rât hay gặp Mệt mới 42,7 6,7 44,9 4,9
chung và tại vị
trí tiêm thuộc
* Giá trị P <0.05 khi so sánh giữa pemetrexeđ’cisplatin vả gemcitabin/cisplatin, sủ dụng Fisher
Exact test.
** Tham khảo CTC Viện Ung thư Quốc gia phiên bản 2 đối với mỗi độ độc tính .
*** Theo CTC Viện Ung thư quốc gia (v2.0; NC1 1998), loạn vị giấc vả rụng tóc chi được bảo
cảo lá ở mức độ 1 hoặc 2.
Trong bảng nảy, đã dùng một điếm giới hạn 5% để bao gồm tất cả tác dụng không mong muốn
mả người báo cáo cho lá có thể liên quan đến pemetrexed vả cisplatin.
11
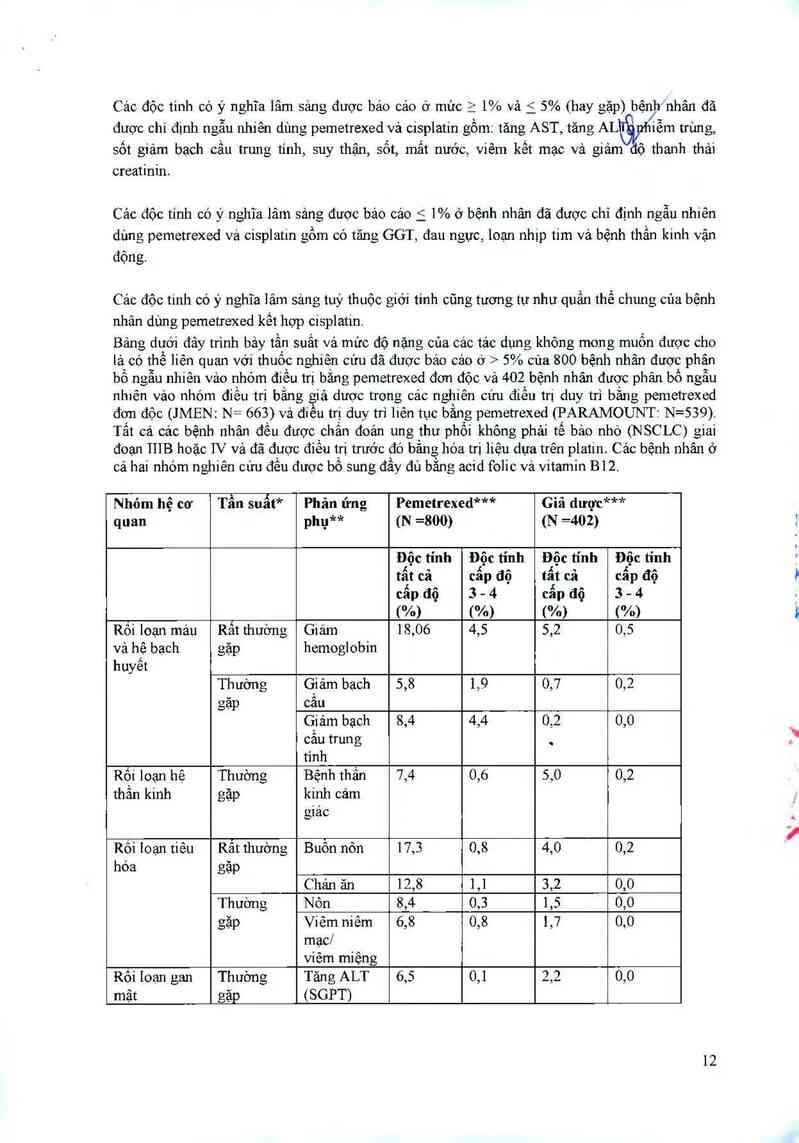
Cảo độc tinh có ý nghĩa lâm sảng được bảo cáo ở mức 2 1% và í 5% (hay gặp) bệnh nhân đã
được chỉ định ngẫu nhiều dùng pemetrexed vả cisplatin gổm: tăng AST, tăng AL iễm trùng,
Sốt giảm bạch cầu trung tính, suy thặn, sốt, mất nước, viêm kềt mạc và giảm độ thanh thải
creatinin.
Các độc tính có ý nghĩa lâm sảng được bảo các i 1% ở bệnh nhân đã được chỉ định ngẫu nhiên
dùng pemetrexed vá cisplatin gồm có tăng GGT, đau ngực, loạn nhip tim và bệnh thần kinh vận
động.
Các độc tinh có ý nghĩa lâm sảng tuỳ thuộc giới tinh cũng tương tự như quần thể chung của bệnh
nhân dùng pemetrexed kềt hợp cisplatin.
Bảng dưới đây trình bảy tẳn suất và mức độ nặng của cảc tác dụng không mon g muốn được cho
là có thế liên quan với thuốc nghiên cứu đã được báo cáo ớ > 5% của 800 bệnh nhân được phân
bố ngẫu nhiên vảo nhóm điều trị bằng pemetrexed đơn độc vả 402 bệnh nhân được phân bổ ngẫu
nhiên vảo nhóm điều trị bằng giả dược trong cảc nghiên cứu điều trị duy trì bằng pemetrexed
đơn độc (JMEN: N= 663) và điều trị duy trì liên tục bằng pemetrexed (PARAMOUNT: N=539).
Tất cả các bệnh nhân đều được chẳn đoán ung thư phối không phải tế bảo nhỏ (NSCLC) giai
đoạn 111B hoặc IV và đã được điều trị trưởc đó bằng hóa trị liệu dựa trên platin. Cảc bệnh nhân ở
cả hai nhóm nghiên cứu đều được bổ Sung đầy đủ bằng acid folic vả vitamin B12.
Nhỏm hệ cơ Tần suất* Phân ứng Pemctrexed*** Giã dược***
quan phụ“ (N =800) (N =402)
Độc tính Độc tính Độc tính Độc tỉnh
tất cả cấp độ tất cả cẩp độ
cấpđộ 3-4 cẩpđộ 3-4
(%) (%) (%) (%)
Rối loạn máu Rất thường Giảm 18,06 4,5 5,2 0,5
vả hệ bạch gặp hemoglobin
huyết
Thường Giảm bạch 5,8 1,9 0,7 0,2
gặp cầu
Giảm bạch 8,4 4,4 0,2 0,0
cầu trung _
tinh
Rôi loạn hệ Thường Bệnh thắn 7,4 0,0 5,0 0,2
thần kinh gặp kinh cảm
giảc
Rôi Ioạn tiêu Rât thường Buồn nôn 17,3 0,8 4,0 0,2
hóa gặp
Chản ăn 12,8 1,1 3,2 0,0
Thường Nôn 8,4 0,3 1,5 0,0
găp Viêm niêm 6,8 0,8 1,7 0,0
mạcf
việm miệng
Rối Ioan gan Thường Tăng ALT 6,5 0,1 2,2 0,0
mật gặp (SGPT)
12
Tăng AST 5,9 0,0 1,7 0,0
, (S…GOT) , in /
Rội loạn da và Thường Nôi banf 8,1 0,1 3,7 W
mô dưới da gặp Tróc vảy da
Rôi loạn toản Rất thường Mệt mỏi 24,1 5,3 10,9 0,7
thân và tình gặp
trạng tại chỗ
dùng thuốc Thường Đau 7,6 0,9 4,5 0,0
găp Phù 5,6 0,0 1,5 0,0
Rối loan thận Thường Rối loạn 7,6 0,9 1,7 0,0
gặp fflậnaiuiuiuh
Các chữ viềt tắt: ALT = alanin aminotransferasc; AST = aspartat aminotransferase; CTCAE =
Tiêu chuẩn thuật ngữ chung về cảc tảo dụng phụ (Common Terminology Criteria for Adverse
Event); NC1 = Viện Ung thư Quốc gia Mỹ (National Cancer Institute); SGOT = glutamic
oxaloacectic aminotransferase huyết thanh; SGPT = glutamic pyruvic aminotransfcrase huyết
thanh.
* Định nghĩa về thuật ngữ tần suất: Rắt thường gặp - 2 10%; Thường gặp - > 5% và < 10%. Về
mục đích của bảng nảy, một ngưỡng 5% đã được sử dụng để bao gồm tất cả các tác dụng phụ mà
người bấc cảo đã xem xét là có thể liên quan với pemetrexed.
** Tham khảo tiều chuẩn của NC1 CTCAE (Phiên bản 3.0; NC1 2003) đối với mỗi cấp độ đôc
tinh. Tỷ lệ bảo cáo đã được trình bảy theo CTCAE phiên bản 3.0.
*** Bảng tổng hợp các phản ứng phụ kết hợp các kết quả cùa nghiên cứu JMEN điều trị duy trì
bầng pcmetrexed (N=663) và nghiên cứu PARAMOUNT điều trị duy tn liệu tuc bằng
pemetrexed (N=5 39).
**** Thuật ngữ kết hợp bao gồm tăng creatinin huyết thanhtcreatinin huyết, giảm tốc độ lọc của
cầu thận, suy thận và thận/cơ qutm sinh dục niệu - khảo.
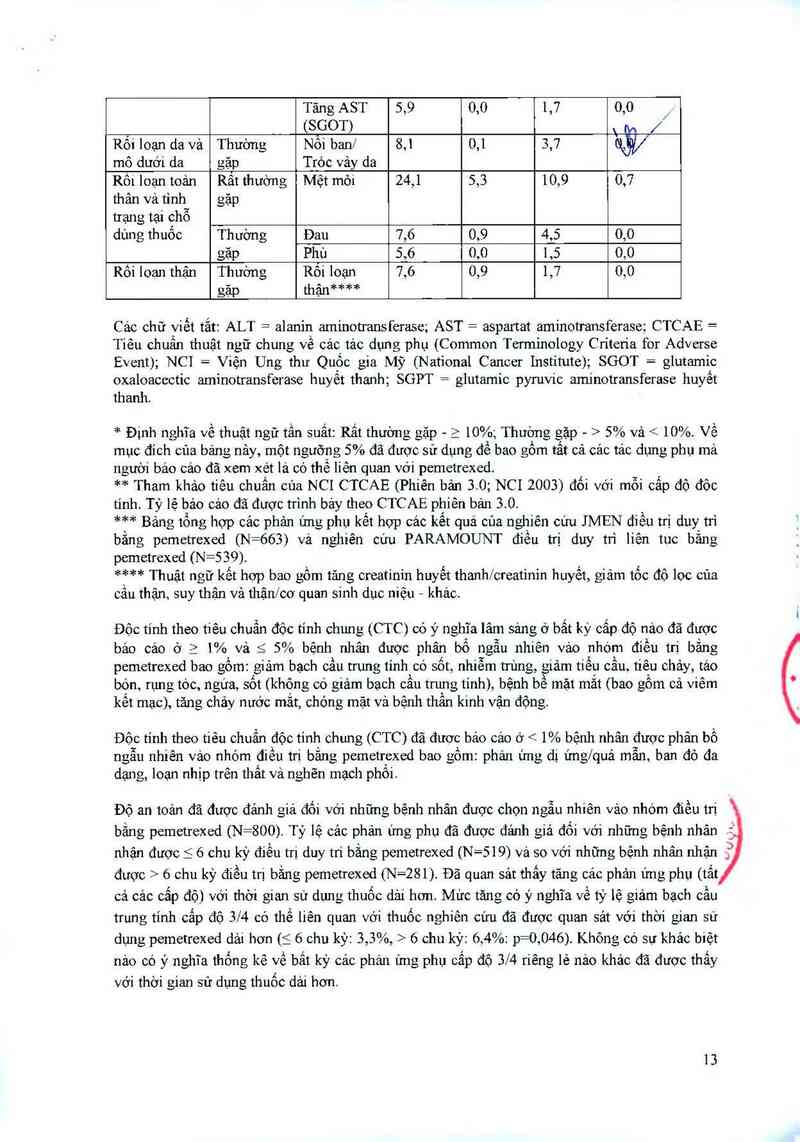
Độc tính theo tiêu chuẩn đôc tính chung (CTC) có ý nghĩa lâm sảng ớ bất ký cấp độ nảo đã được
bảo cảo ở a 1% và S 5% bệnh nhân được phân bổ ngẫu nhiên vảo nhóm điều trị bắng
pemetrexed bao gồm: giảm bạch cầu trung tỉnh có sốt, nhiễm tn`mg, giảm tiều cẳu, tiêu chảy, tảo
bón, rưng tóc, ngứa, sốt (không có giảm bạch cẩu tnmg tính), bệnh bề mặt mắt (bao gồm cả viêm
kềt mạc), tảng chảy nước mắt, chóng mặt và bệnh thẩn kinh vận động.
Độc tính theo tiêu chuẩn độc tinh chung (CTC) đã tiuớc báo cản ở < 1% bệnh nhân được phân bổ
ngân nhiên vảo nhóm điều trị băng pemetrexed bao gôm: phán ứng dị ửng/quá mãn, ban đó đa
dạng, loạn nhịp trên thât vả nghẽn mạch phôi.
Độ an toản đã được đánh giá đối vởi những bệnh nhân được chon ngẫu nhiên vảo nhóm điều trị
bằng pemetrexed (N=800). Tỷ lệ cảc phản ứng phụ đã được đánh giá đối với những bệnh nhân
nhận được 5 6 chu kỳ điều trị duy tn' bằng pemetrexed (N=519) vả so với những bệnh nhân nhận
được > 6 chu kỳ điều trị bằng pemetrexed (N=281). Đã quan sải thẳy tăng các phản ứng phụ (tất
cả cảc cắp độ) với thời gian sử dung thuộc dải hơn. Mưc tăng có ý nghĩa về tỷ lệ giảm bạch cầu
trung tính cấp đó 3/4 có thể liên quan với thuốc nghiên cứu đã được quan sát với thời gian sử
dụng pemetrexed dải hợn (S 6 chu kỳ: 3,3%, > 6 chu kỳ: 6,4%: p=0,046). Không có Sự khảo biệt
nảo có ý nghĩa thống kê về bắt kỳ các phản ứng phụ cẳp đó 3/4 riêng lẻ nảo khảo đã được thấy
với thời gian sử dụng thuốc dải hớn.
13
… , , A, …: ›<- , , …. … ~
Co it bao cao ve cac bien co tim mạch va mạch mau nao nghiem trọng bao gồm Ăi ỹtI/cơ tim,
đau thắt ngưc, tai biền mạch mảu não vả cơn thiếu máu cục bộ nhắt thời trong nghiên cứu
lâm sảng với pemetrexed, thường xảy ra khi dùng phối hợp với một thuốc độc hại tế bảo khác.
Phần lớn bệnh nhân gặp các tác dụng nảy đã có cảc yểu tố nguy cơ tim mạch từ trước.
Hiêm có các báo cáo về viêm gan, có nguy cơ trâm trọng, trong các nghiên cứu lãm sảng với
pemetrexed.
Giảm toản thế huyết cẩu ít khi được báo cáo trong cảc thử nghiệm lâm sảng với pemetrexed.
Trong cảc thử nghiệm lâm Sảng, các trường hợp viềm đại trảng (bao gồm chảy mảu tuột và trực
trảng, đôi khi gây tử vong, thùng ruột, hoại tử ruột và viềm ruột tịt) it khi được bảo cáo ở bệnh
nhân sử dụng pemetrexed.
Trong cảc thử nghiệm lâm sảng, viêm phổi mô kê và suy hô hấp, đôi khi gây tử vong, ít khi được
báo cáo ở bệnh nhân điều trị bằng pemetrexed.
Cũng it có báo cảo về cảc trường hợp phủ ở bệnh nhân dùng pcmetrexcd.
Viêm thực quảnfviêm thưc quản do phóng xạ đã được bảo các ít gặp trong cảc thử nghiệm lâm
sán g với pemetrexed.
Nhiễm khuẩn, đôi khi gây tử vong, đã được bảo cảo thường gặp trong các thử nghiệm lâm sảng
với pcmetrexed.
Trong quá trình theo dõi hậu mãi, cảc phản ủng không mong muốn sau đã được bảo cảo ở bệnh
nhân dùng pemetrexed:
Có ít trường hợp bảo các về suy thận cắp ở bệnh nhân dùng pemetrexed đơn độc hoặc phối họp
với cảc hoả trị liệu khác (xem phần “Cảnh bảo đặc biệt và thận ttọng khi dùng”).
Có ít tTườiig hợp báo cáo về viêm phổi khu trú do tia xạ ớ bệnh nhân có xạ tn; trước, trong và sau
khi điều trị bằng pemetrexed (xem phần “Cảnh bảo đặc biệt và thặn trọng khi dùng”).
Hiếm có trường hợp báo cáo về thu hội bức xạ ớ bệnh nhân đã xạ trị tmớc đó (xem phẳn “Cảnh bảo
đặc biệt và thân trọng khi dùng”)
Có ít trường hợp thiếu máu ngoại vi đôi khi dẫn tới hoại tứ chi đã được báo cảo.
Các tỉnh tiạ.ng bọng nước hiếm gặp đã được báo cáo bao gồm cả hội chứng Stevens-Johnson vả
hoại tử biêu bì nhiêm độc, trong một số trường hợp đã gây tử vong.
14
Đã cớ bảo cản hiếm gặp về bệnh thiếu máu tan huyềt ở bệnh nhân đuociỀệíi trị bẳng
pemetrexed.
Cảo trường hợp hiềm gặp Về sốc phản về đã được báo cản.
Thông báo với bác sĩ các iác dụng không mong muốn gặp phải trong khi sử dụng thuốc.
ĐẶC TÍNH DƯỢC LÝ
Đặc tính duợc lực học
Nhớm dược tii liệu: cảc chất đồng đẳng cùa acid folic, mã ATC: LO lBAO4.
ALIMTA (pemetrexed) lả một thuốc chống folat chống ung thư nhiều mục tỉêu, có tác dụng nhờ
phá vỡ các quá trình chuyền hóa chủ yếu phụ thuôo folat cẩn thiết cho sự sao chép tế bảo.
Các nghiền cứu in vitro cho thấy pemetrexed có tác dụng của một thuốc chống folat nhiều muc
tiều bằng cách ức chế thymidylat synthase (TS), dihydrofolat reductase (DHFR), vả glycinamid
ribonucleotid formyltransferase (GARFT), là những enzym phụ thuộc folat chủ chốt đối với sinh
tổng hợp của thymidin và các pun'n nucleotid Pemctrexed được vận chuy ền vảo trong tế bản bởi
cả các hệ thống chất mang folat khứ và vận chuyển protein gắn kết folat mảng Một khi ở trong
tế bầm, pemetrexed được chuyền đồi nhanh và với hiệu suất cao thảnh cảc dạng polyglutamat bởi
enzym folylpolyglutamat synthetase. Cảo dạng polyglutamat được giữ trong tế bảo và còn là
những chắt ức chế TS vả GARFT mạnh hợn . Sự đa glutamat hóa là một quá trình phụ thuộc vảo
thời gian về nồng đó xảy ra trong cảc tế bảo ung thư, vả ở mức độ hạn chế hơn, trong các mô
binh thường. Các chất chuyền hóa đa-glutamat hóa có sự tăng nửa đời trong tế bảo dẫn đến sự
kéo dải tảo dụng của thuộc trong các tế bảo ung thu.
Hiều nuả lâm sảng;
U trunil biều mô : _ ,
EMPHACIS, một nghiên cứu pha 3 đa trung tấm, ngâu nhiên, mù đớn so sảnh ALIMTA kêt hợp
cisp1atin với cisplatin đơn độc ớ bệnh nhân có u trung biếu mô mảng phội ảc tinh chưa dùng hóa
trị liệu, cho thắy bệnh nhân điều tti với ALIMTA vả cisplatin có lợi thể sống sót trung bình cớ ý
nghĩa lâm sảng 2,8 thảng so với bệnh nhân chỉ dùng cisplatin.
Trong nghiên cứu, bệnh nhân được bổ sung thêm acid fo1ic vả vỉtamin Btz liều thấp để lảm giảm
độc tinh. Phân tich chính của nghiên cứu nảy được thực hiện trền quần thế tất cả bệnh nhân được
chi đinh ngẫu nhiên vảo một nhóm điều trị, dùng thuộc nghiên cứu (ngẫu nhiên vả điều trị). Phân
tích phân nhớm được thục hiện trên bệnh nhân được dùng bổ sung acid folic vả vitamin Biz
trong toản bộ nghiên cứu (đuợc bổ sung đầy đủ). Kết quả của các phân tích về hiệu quả nảy đuợc
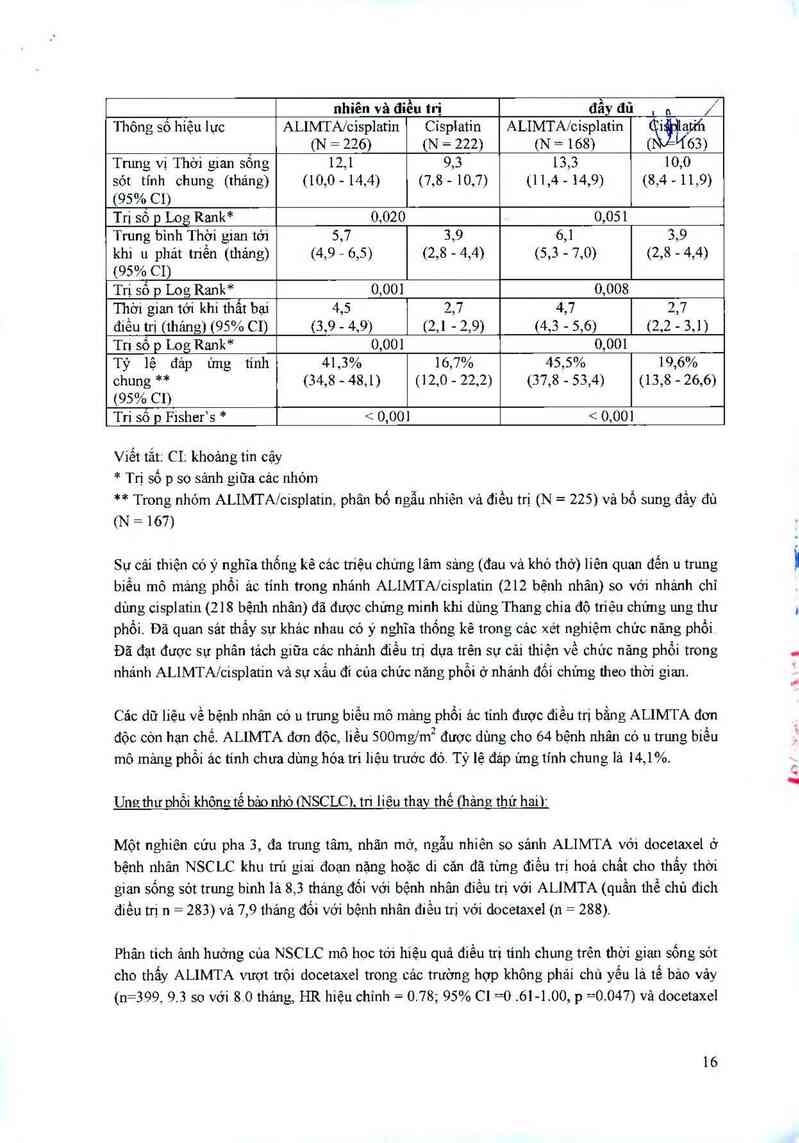
tớm tắt trong bảng dưới đây:
Hìệu quả cũa ALIMTA phối hợp cisplatin soỵó'i cisplatin ở
bệnh nhân có 11 trung biên mô mâng phôi ảc tính
] Bệnh nhân được phân bố ngẫu ] Bệnh nhân được bổ sung
15
nhỉên và điều trị đầy đủ , ,, /
Thông số hiệu lực ALIMTA/cisplatin CiSplatin ALIMTA/cisplatin i ạtih
(N = 226) (N = 222) (N = 168) ( 63)
Tnmg vị Thời gian sông 12,1 9,3 13,3 10,0
sớt tính chung (tháng) (10,0 - 14,4) (7,8 - 10,7) (11,4 - 14,9) (8,4 … 11,9)
(95% C1)
Trị sô p Log Rank* 0,020 0,051
Trung binh Thời gian tới 5,7 3,9 6,1 39
khi 11 phát triễn (tháng) (4,9 - 6,5) (2,8 - 4,4) (5,3 - 7,0) (2,8 - 4,4)
(95% C1)
Trị số p Log Rank* 0,001 0,008
Thời gian tới khi thất hại 4,5 2,7 4,7 2,7
điều trị (thảng) (95% C1) (3,9 - 4,9) (2,1 - 2,9) (4,3 - 5,6) (2,2 - 3,1)
Tri số p Log Rank* 0,001 0,001
Tỷ lệ đáp ứng tính 41,3% 16,7% 45,5% 19,6%
chung ** (34,8 - 48,1) (12,0 - 22,2) (37,8 - 53,4) (13,8 — 26,6)
(95% C1)
Trị số p Fisher’s * < 0,001 < 0,001
Viết tắt; CI: khoảng tin cậy
* Trị số p so sảnh giữa cảc nhóm
** Trong nhóm ALIMTAÍcispIatin. phân bố ngẫu nhiên và điều trị (N = 225) và bổ sung đằy đủ
(N = 167)
Sư cải thiện 66 ý nghĩa thống kê các triệu chứng lâm sảng (đau và khó thở) liên quan đền u trung
biều mô mảng phối ác tinh trong nhảnh ALIMTA/cisplatin (212 bệnh nhân) so với nhảnh chỉ
dùng cisplatin (218 bệnh nhân) đã được chửng minh khi dùng Thang chia độ triệu chứng ung thư
phối. Đã quan sát thấy sự khảo nhau có ý nghĩa thống kê trong các xét nghiệm chức năng phối
Đã đạt được sự phân tảch giữa cảc nhánh điều trị dựa trên sự cải thiện về chửc năng phối trong
nhảnh ALIMTAIcispIatin và sự xấu đi của chức năng phối ở nhánh đối chứng theo thời gian.
Các dữ liệu về bệnh nhãn cớ u trung biều mô mảng phối ảc tính được điều trị bẳn g ALIMTA đơn
độc cớn hạn chế. ALIMTA đon độc, liều 500…g/m² được dùng cho 64 bệnh nhân có u trung biền
mô mảng phổi ảc tính chưa dùng hóa tri liệu trước đó. Tỷ lệ đảp ứng tính chung lả 14,1%.
Ung thư ohội khộnctộ bảo nhỏ (NSCLC), tri liêu thav thế (hảnc thứ haii:
Một nghiền cứu pha 3, đa trung tâm, nhãn mở, ngẫu nhiên so sánh ALIMTA với docetaxel ở
bệnh nhân NSCLC khu trú giai đoạn nặng hoặc di căn đã từng điều tti hoá chẳt cho thấy thời
gian sống sót trung binh lả 8,3 thảng đối với bệnh nhân điều trị với ALIMTA (quần thể chủ đich
điều tti n = 283) và 7,9 thảng đối với bệnh nhân điều trị với docetaxel (n = 288).
Phân tich ảnh hưởng của NSCLC mô hoc tới hiệu quả điều tti tính chung trên thời gian sống sót
cho thấy ALIMTA vượt trội docetaxcl trong các trường hợp không phải chủ yếu là tế bảo vảy
(n=399, 9.3 so với 8.0 thảng, HR hiệu chỉnh = 0.78; 95% C1=0.61-1.00, p =0.047) vả docetaxel
16
vượt trội hơn trong carcinoma tế bảo vảy (n=172, 6.2 so với 7.4 thảng, HR hiệu dhíhh= 1256;
95% CI =1.08-2.26, p =0.018). Không nhận thắy có sự khảo biệt lâm sảng về độ aỤiốễn của
ALIMTA trong tìm g phân nhớm theo mô học.
Các dữ liệu lâm sảng còn hạn chế từ một nghiền cứu pha 3 ngẫu nhiên có đối chứng độc lập cho
thẳy hiệu quả lâm sảng (thời gian sống sót tỉnh chung, thời gian sống sớt không mắc bệnh) của
pemetrexed tương tự nhau ở các bệnh nhân trước đó đã điều trị bằng docetaxel (n=41) và các
bệnh nhân chưa được điểu tn; bằng docetaxel (n=540).
Hỉệu quả của ALIMTA so sánh với docetaxel ở bệnh nhân NSCLC - quần thể điều trị
ALIMTA 1 Docetaxel
Thời gìan sông sót (tháng) (n = 283) (11 = 288)
Trung vị (m) 8,3 7,9
95 % c1 cua trung vị (7,0 - 9,4) (6,3 - 9,2)
HR 0,99
95 % c1 cua HR (,82 - 1,20)
Giá trị p không thua kém (HR) ,226
Thội gỉan sộng sót không tiến triến bệnh (thảng) (n = 283) (n = 288)
Trung vị 2,9 2,9
0,97 (,82 — 1,16)
HR (95 % C1)
Thời gỉan tới khi thẩt hại dìều trị (TTTF — tháng) (n = 283) (n = 288)
Trung vị 2,3 2,1
0,84 (,71 - ,997)
HR (95 % C1)
Đáp ứng (n: số bệnh nhân đạt tỉêu chuẩn về đảp (n = 264) (n = 274)
ứng) 9,1 (5,9 - 13,2) 8,8 (5,7 - 12,8)
11 lệ dáp ứng (%) (95 % cn 45,8 46,4
Bệnh ôn dịnh (%)
Viết tắt: C1 = khoảng tin cậy; HR: tỉ số nguy cơ; ITT = chủ định điều trị; n = tống số lượng quần
thể
Unu thư ohội không tế bảo nhỏ tri liều hảne đầu:
Một nghiên cứu ngẫu nhiên, đa trung tãm, nhãn mớ pha 3 so sảnh ALIMTA phội hợp cisplatin
với gemcitabin phối hợp cisplatin điều trị cho bệnh nhân ung thư phổi không tế bảo nhỏ
(NSCLC) khu trú giai đoạn nặng hoặc đã di căn (Mức độ HIb hoặc IV) cho thấy ALIMTA phối
hợp với cisplatin (số1ượng bệnh nhân chủ định điều trị [ITT] n = 862) đạt được chi tiều điều trị
chính và có hiệu quả lâm sảng tượng tự như gemcitabin phối hợp cisplatin (ITT n = 863) về thời
gian sống sót nới chung (ti số nguy cơ hiệu chính 0,94, 95% C10,84105). Tất cả cảc bệnh nhân
tham gia trong nghiền cứu nảy có khả năng thực hiện công viềc ECOG tình trạng 0 hoặcl.
Phân tích hiệu quá chủ yếu được dựa trên quần thể ITT, Phân tich độ nhạy cảm của chỉ tiều hiệu
quá chủ yếu cũng được đánh giá trên quần thể đạt được đủng đề cương nghiên cứu (quần thể
PQ). Phân tich hiệu quả trên quần thể PQ cho kềt quả đồng nhất với khi phân tích quẩn thề ITT
vả cho thẳy AC khỏng thua kém GC.
17
|xo —c
Thời gian sống sót không tiến triển bệnh (PFS) và tỉ lệ đảp ứng nói chung tương tự nha giữa citớ'
nhảnh điều trị: trung vị PFS là 4,8 tháng đối với ALIMTA phối hợp cisplatin và lá 511 ' /đối
với gemcitabin phối hợp cisplatin (tỷ số nguy cơ hiệu chĩnh 1,04; 95% C1 0,94-1,15), va tỉ lệ đảp
ứng chung là 30,6% (95% CI 27,3- 33,9) với nhớm ALIMTA + cisplatin và là 28,2% (95% CI
25,0-314) với nhóm gemcitabin + cisplatin. Dữ liệu PFS phần nảo đó được khẳng định bằng một
đảnh giả độc lập (400/1725 bệnh nhân được 1ựa chọn ngẫu nhiên để phỏng vấn).
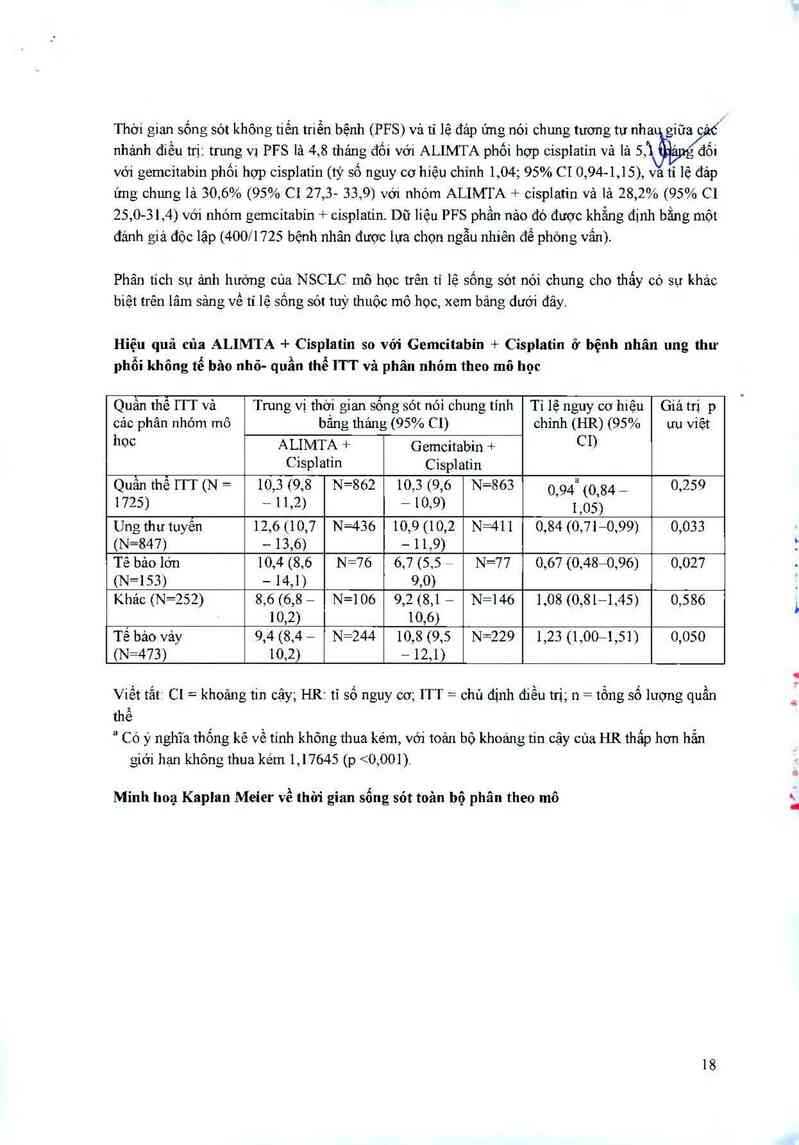
Phân tích sự ảnh hướng của NSCLC mô học trên tỉ lệ sống sót nói chung cho thấy có sự khác
biệt trên lâm sảng về tỉ lệ sống sót tuỳ thuộc mô học, xem bảng dưới đây.
Hiệu quả của ALIMTA + Cisplatin so với Gemcitabin + Cisplatin ở bệnh nhân ung thư
phổi không tễ bâo nhỏ- quần thể ITT và phân nhóm theo mô học
Quấn thê ITT vả Trung vị thời gian sống sót nói chung tỉnh Tỉ lệ nguy cơ hiệu Giá trị p
cảc phân nhóm mô bẳng thảng (95% C1) chỉnh (HR) (95% ưu viềt
hoc ALIMTA + Gemcitabin + CD
Cisplatin CiSplatin
Quần thể ITT (N = 10,3 (9,8 N=862 10,3 (9,6 N=863 0941 (0,84 _ 0,259
1725) - 11,2) — 10,9) 1,05)
Ung thư tuyền 12,6 (10,7 N=436 10,9 (10,2 N=411 0,84 (0,71—0,99) 0,033
(N=847) — 13,6) — 11,9)
Tề bảo lớn 10,4 (8,6 N=76 6,7 (5,5 = N=77 0,67 (0,48=0,96) 0,027
(N=153) — 14,1) 9,0)
Khảc (N=252) 8,6 (6,8 - N=106 9,2 (8,1 — N=146 1,08 (0,81—1,45) 0,586
10,2) 10,6)
Tế bảo vảy 9,4 (8,4 — N=244 10,8 (9,5 N=229 1,23 (1,00—1 ,51) 0,050
(N=473) 10,2) — 12,1)
Viết tắt C1 = khoảng tin cậy; HR: tỉ số nguy cơ; ITT = chủ định điều trị; 11 = tổng số lượng quần
thể
² Có ý nghĩa thống kê về tinh không thua kém, với toản bộ khoảng tin cậy cùa HR thấp hơn hẳn
giới hạn không thua kém 1,17645 (p <0,001)
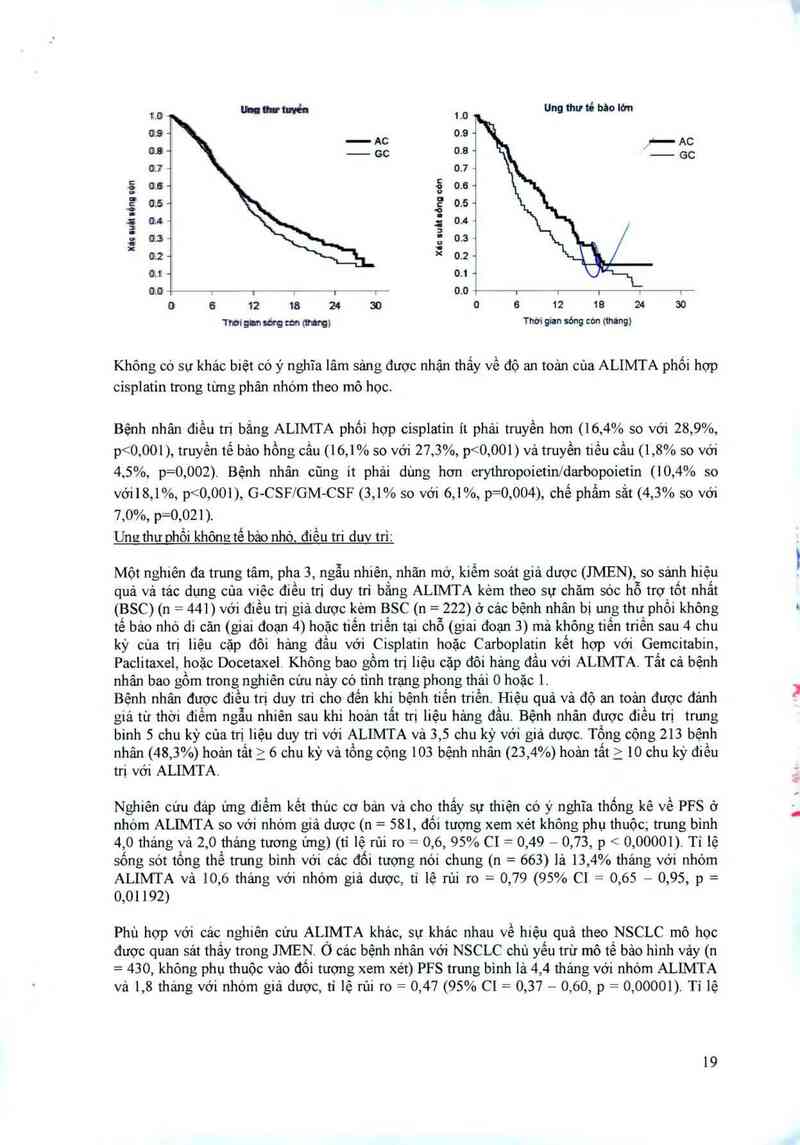
Minh hoạ Kaplan Meier về thời gian sổng sót toản bộ phân theo mô
18
II.
Ihllưtnẻu Ungthưtẻbâolởn
lữ 4 1.0
0.9 - 0.9 ~
— AC _ AC
0.8 - _ sc 0-8 “ ' — GC
117 - 0.7 -
Ễ °“-° ~ 5 0.6 4
0 O
_ _Ể 0.5 - ẵ o_5 4
'Ế 01.0 « ẵ 0.4 ,
3
.Ệ me , ; o.a ,
X Ở
012 — * 0.2 -
01.0 ~ 0.1 ~
ỦLỎ ' r —r' ' 0.0 | . | 1 |
0 6 12 18 24 m 0 6 12 18 24 30
Thơ! ghfisófg mu M) Thởi gian sóng cỏn (thủng)
Không có sự khảc biêt có ý nghĩa lâm sảng được nhận thấy về độ an toản của ALIMTA phối hợp
cisplatin trong từng phân nhóm theo mô học.
Bệnh nhân điều mị bằng ALIMTA phối hợp cisplatin ít phải truyền hơn (16,4% so với 28,9%,
p<0,001), truyền tế bảo hồng cầu (16,1% so với 27,3%, p<0,001) và truyền tiểu cầu (1,8% so với
4,5%, p=0,002). Bệnh nhân cũng it phải dùng hơn erythropoietin/darbopoietin (10,4% so
với18,i%, p<0,001), G—CSFIGM-CSF (3,1% so với 6,1%, p=0,004), chế phẩm sắt (4,3% so với
7,0%, p=0,021).
Um: thư ohổi không tế bảo nhỏ, điều tri duỵ trì:
Mộtngh1ên đa trung tâm, pha 3, ngẫu nhiên, nhãn mở, kiểm soát giá dược (JMEN), so sảnh hiệu
quả vả tác dụng của việc điều trị duy trí bằng ALIMTA kèm theo sự chăm sóc hỗ trợ tốt nhất
(BSC) (n = 441) với điều trị giá dược kèm BSC (n = 222) 6 cảc bệnh nhân bị ung thư phối không
tế bảo nhỏ di căn (giai đoạn 4) hoặc tiến triến tại chỗ (giai đoạn 3) mã không tiến triển sau 4 chu
kỳ của trị liệu cặp đôi hảng đằu với Cisplatin hoặc Carboplatin kết hợp với Gemcitabin,
Paclitaxel, hoặc Docetaxel. Không bao gồm trị liệu cặp đôi hảng đầu với ALIMTA. Tất cả bệnh
nhân bao gồm trong nghiên cứu nảy có tình trạng phong thái 0 hoặc 1.
Bệnh nhân được điều trị duy trì cho đến khi bệnh tiến triến. Hiệu quả và độ an toản được đảnh
giả từ thời điếm ngẫu nhiên sau khi hoản tất trị liệu hảng đầu. Bệnh nhân dược điều trị trung
bình 5 chu kỳ của th liệu duy trì vởi ALIMTA và 3,5 chu kỳ vởi giả dược. Tổng cộng 213 bệnh
nhân (48,3%) hoản tất ì 6 chu kỳ và tổng cộng 103 bệnh nhân (23,4%) hoản tất ì 10 chu kỳ điều
trị với ALHVITA.
Nghiên cừu đáp ứng điểm kết thùc cơ bản vá cho thấy sự thiện có ý nghĩa thống kê về PFS ở
nhóm ALIMTA so với nhóm giả dược (n = S81, dối tượng xem xẻt không phụ thuộc; trung bình
4,0 thảng và 2,0 thảng tương ứng) (tỉ lệ rủi ro = 0,6, 95% CI = 0,49 — 0,73, p < 0,00001). Tỉ lệ
sống sót tổng thể trung bình với cảc đối tượng nói chung (n = 663) lả 13,4% thảng với nhóm
ALIMTA và 10,6 thảng với nhóm giả dược, tỉ lệ rùi ro = 0,79 (95% CI = 0,65 — 0,95, p =
0,01192)
Phù hợp với cảc nghiên cứu ALIMTA khác, sự khảc nhau về hiệu quả theo NSCLC mô học
được quan sát thấy trong JMEN. ở cảc bệnh nhân với NSCLC chủ yếu trừ mô tế bảo hình vảy (n
= 430, không phụ thuộc vảo đối tượng xem xét) PF S trung bình là 4,4 thảng với nhóm ALIMT A
và 1,8 tháng vởi nhóm giả dược, tỉ lệ rủi ro = 0,47 (95% c1 = 0,37 — 0,60, p = 0,00001). Tỉ lệ
19
sống sót tồng thể trung bình 6 cảc bệnh nhân với NSCLC chủ yếu trừ mô tế bảo hình vảy (n =
481) là 13,3% thảng với nhóm ALIMTA và 10,3 tháng với nhóm giả dược, tỉ lệ ni' … =/0,70
(93% c1 = 0,36 — 0,88, p = 0,002). Bao gồm pha cảm ứng tỉ lệ sống sót tổng thể ' ' bệnh
nhân NSCLC chủ yếu trư mô tế bảo hinh vảy lả 18,6 thảng với nhóm ALIMTA và\i ,6 thảng
với nhóm giả dược, tỉ lệ rủi ro = 0,71 (93% c1 = 0,36 — 0,88, p = 0,002).
Cảc kết quả PFS vả os 6 các bệnh nhân với mô tế bảo hình vảy không cho thẩy lợi ích cùa
ALIMT A so với giả dược
Không thấy có sự khác biệt có ý nghĩa lâm sảng về độ an toản của Alimta trong các phân nhóm
theo mô học.
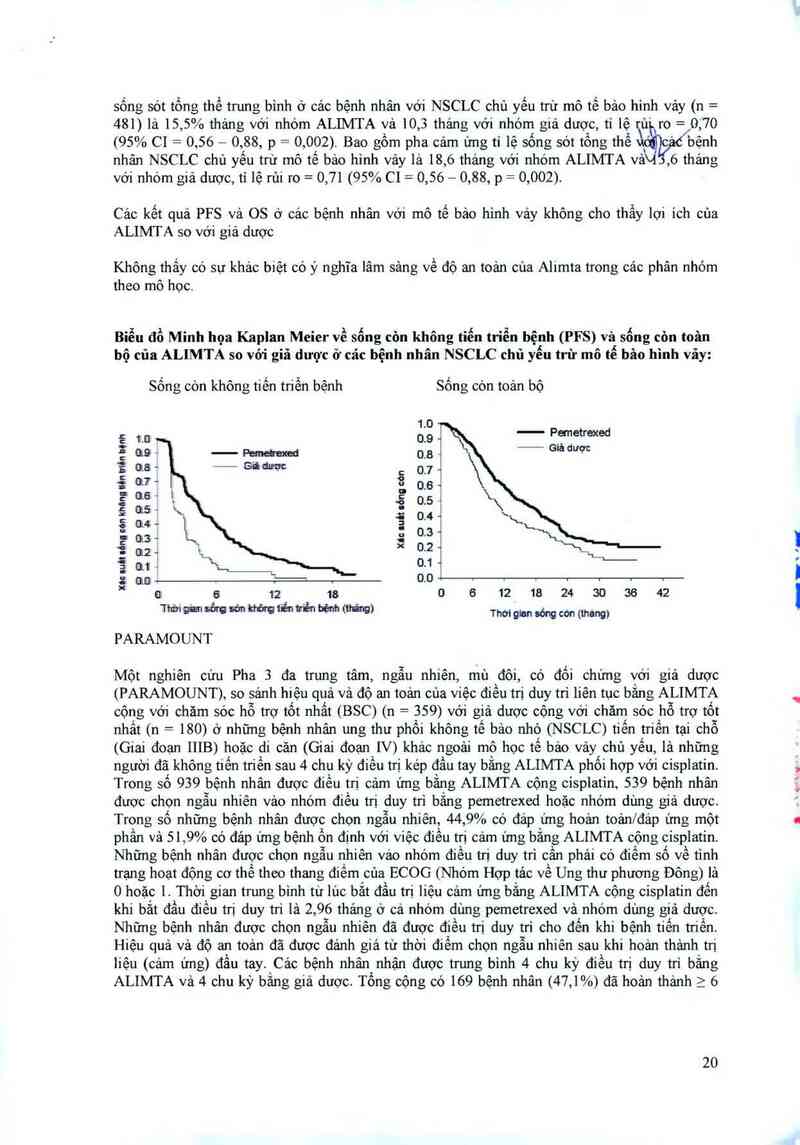
Biểu đồ Minh họa Kaplan Meier về sống còn không tiến trìển bệnh (PFS) và sống còn toân
bộ của ALIMTA so với giả dược ở cảc bệnh nhân NSCLC chủ yếu trừ mô tế bâo hình vảy:
Sốn còn khôn tiến triến bệnh Sống còn toản bộ
g g
1.0
Ế 1111 0.9 — Pemetrexed
Ễ ủg. 0.8 _ Giấdượt
Ề ®“ c 0.7
ỉ M° ỉ 0.6
1 ảỆị ẽ 0-5
Ễ 04J Ế 0'4
Ế 03 8 0~3
3 (12- * 0.2
Ể Q1 0.1
3 mm 0.0 . . , , .
"0 6 12 18 06121824303642
Wigimsủusùnkfòrutầưtriềnbètủ <…) Thơ! giun sõng còn (mang)
PARAMOUNT
Một nghiên cứu Pha 3 đa trung tâm, ngẫu nhiên, mù đôi, có đối chứng với giả dược
(PARAMOUNT), so sánh hiệu quả và độ an toản của việc điều trị duy trì liên tục bằng ALIMTA
cộng với chăm sóc hỗ trợ tốt nhất (BSC) (n = 359) với giả dược cộng với chăm sóc hỗ trợ tốt
nhất (n = 180) ở những bệnh nhân ung thư phối không tế bảo nhỏ (NSCLC) tiến triển tại chỗ
(Giai đoạn 11113) hoặc di cãn (Giai đoạn [V) khác ngoải mô học tế bảo vảy chủ yếu, là những
người đã không tiến triến sau 4 chu kỳ điều trị kép đầu tay bằng ALIMTA phối hợp với cisplatin.
Trong số 939 bệnh nhân được điều trị cảm ứng bằng ALIMT A cộng cisplatin, 539 bệnh nhân
được chọn ngẫu nhiên vảo nhóm điều trị duy trì bằng pemetrexed hoặc nhóm dùng giả dược.
Trong số những bệnh nhân được chọn ngẫu nhiên, 44,9% có đáp ứng hoản toản/đảp ứng một
phần và 51,9% có đáp ửng bệnh ổn định với việc điều trị cảm ứng bằng ALIMTA cộng cisplatin.
Những bệnh nhân được chọn ngẫu nhiên vảo nhóm điều trị duy trì cần phải có điếm số về tình
trạng hoạt động cơ thể theo thang điểm cùa ECOG (Nhóm Hợp tảc về Ung thư phương Đông) là
0 hoặc 1. Thời gian trung binh từ lúc bắt đẩu trị liệu cảm ứng bằng ALIMTA cộng cisplatin đến
khi bắt đầu điếu trị duy tri là 2,96 tháng ở cả nhóm dùng pemetrexed và nhóm dùng giả dược.
Những bệnh nhân được chọn ngẫu nhiên đã được điều trị duy trì cho đến khi bệnh tiến triền.
Hiệu quả vả độ an toản đã được đánh giá từ thòi điểm chọn ngẫu nhiên sau khi hoản thảnh trị
liệu (cảm ứng) đẩu tay. Cảc bệnh nhân nhận được trung bình 4 chu kỳ điều trị duy trì bằng
ALIMTA và 4 chu ký bằng giá dược. Tổng công có 169 bệnh nhân (47,1%) đã hoản thảnh a 6
20
’-
_-ì
chu kỳ điểu trị duy tri bằng ALIMTA, đại diện cho ít nhất tổng cộng 10 chu kỳ ALIMTA.
Nghiên cứu đã đáp ứng tiêu chí đánh giá chinh và cho thấy sự cải thiện có ý nghĩa thống kê về
thời gian sống sót không tiến triển bệnh (PFS) ở nhóm ALIMTA nhiều hơn nhóm _c/n =
472, nhóm được xem xét đôc lập; trung bình 3, 9 tháng và 2, 6 thảng, theo thứ tự tươn ’g) (tỷ
số nguy cơ= 0,64, khoảng tin cậy (C1) 95%- — 0, 51 -0, 81, p= 0 ,.0002) Xem xét độc lập về chụp
hinh ảnh bệnh nhân đã xảc nhận các kết quả đánh giá của nhà nghiên cứu về thời gian sống sót
không tiến triển bệnh. Đối với những bệnh nhân được chọn ngẫu nhiên, như đã được đánh giá từ
lúc bắt đầu điều trị cảm ứng đầu tay bằng ALIMTA cộng cisplatin, thời gian sống sót không tiến
triển bệnh trung binh theo đánh giá cùa nhà nghiên cứu lả 6,9 thảng đối với nhóm dùng
ALIMTA và 5,6 thảng đối với nhóm dùng giả dược (tỷ số nguy cơ = 0,39, khoảng tin cậy (C1)
93% = 0,47-0,74)
Sau khi trị liệu cảm ứng bằng ALIMTA cộng cisplatin (4 chu kỳ), việc điều trị bằng ALIMTA
trôi hơn có ý nghĩa thống kê so với giả dược về thời gian sống còn toản bộ (OS) (trung bỉnh 13,9
thảng so với 11, 0 thảng, tỷ số nguy co= 0,78, khoảng tin cậy (C1) 95% — 0, 64- 0, 96, p= 0 ,0195)
Tai thời diểm phân tích sống còn cuối cùng, 28, 7% bệnh nhân còn sống hoặc mất theo dõi ở
nhóm ALIMTA so với 21,7% ở nhóm giả dược. Hiệu quả điều trị tương đối của ALIMTA lả
nhất quản giữa các phân nhóm (bao gồm giai đoạn bệnh, đáp ứng với trị liệu cảm ứng, tình trạng
hoạt động cơ thể theo thang điểm của ECOG, tình trạng hút thuốc lá, giới tính, mô học và tuổi)
và giống như đã quan sảt thấy trong phân tích thời gian sống oòn toản bộ (OS) vả thời gian sống
sót không tiến triển bệnh (PFS) chưa điều chỉnh. Tỷ lệ sống còn 1 năm và 2 nãm đối với bệnh
nhân đang dùng ALIMTA là 58% và 32% theo thứ tự tương ứng, so với 45% và 21% đối với
bệnh nhân dùng giả. dược. Từ 1úc bắt đầu điều tii cảm ứng đầu tay bằng ALIMTA cộng cisplatin,
thời gian sống còn trung bình của bệnh nhân là 16,9 tháng đối với nhóm ALIMTA và 14,0 tháng
đối với nhóm giả dược (tỷ số nguy cơ = 0,78, khoảng tin cậy (C1) 93% = 0,64-0,96). Tỷ lệ phẩn
trăm bệnh nhân nhận được điều trị sau nghiên cứu là 64,3% đối với nhóm ALIMTA và 71,7%
đối với nhóm giả dược.
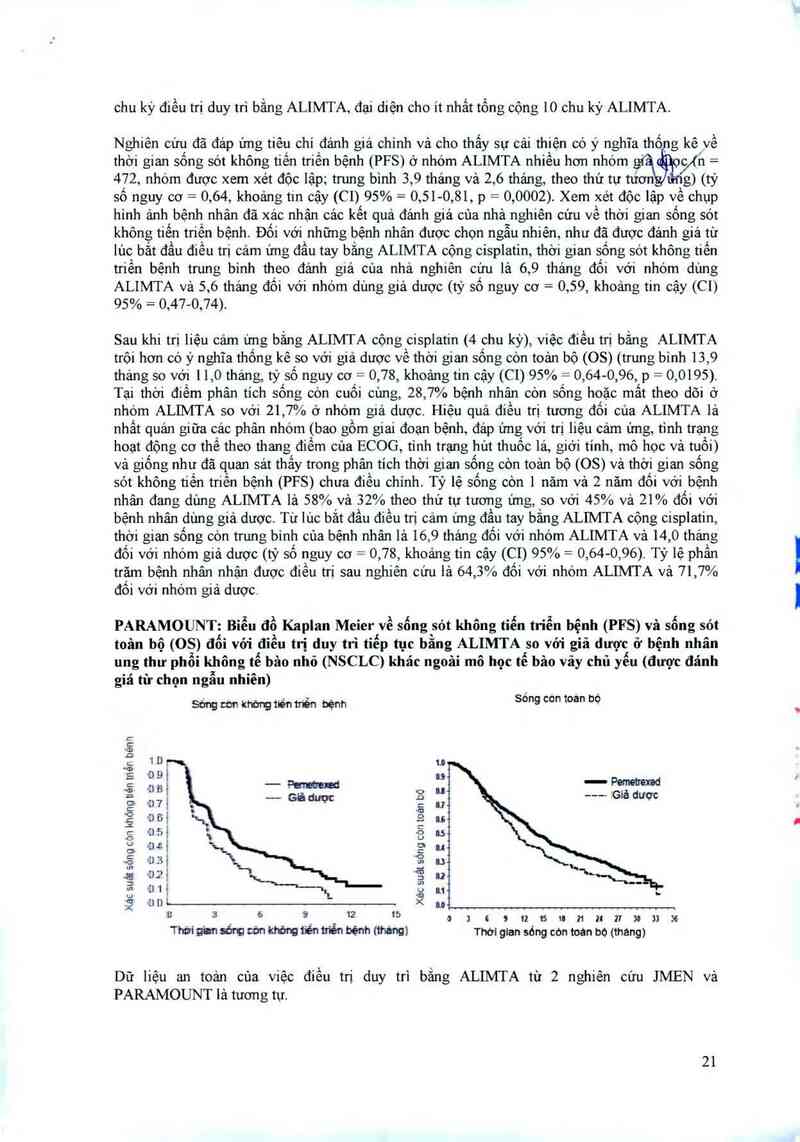
PARAMOUNT: Biểu đồ Kaplan Meier về sống sót không tiểu triễn bệnh (PFS) và sống sót
toản bộ (OS) đối với điều trị duy trì tiếp tục bằng ALIMTA so với giả dược ơ bệnh nhân
ung thư phổi không tế bảo nhỏ (NSCLC) khác ngoâi mô học tế bâo vãy chủ yếu (được đánh
giá từ chọn ngẫu nhiên)
Sóng con toan bộ
Sòngnonkhỏngùénttển bệnh
,
C
=®
D
r. ỈJ
“'ẵ u p 1 |
OC
“Ê 8 “ ---- 'Giè dược
gi : II
to a
.: 9 li
1 :
.8 8 15
ă % u
'Ể `Ệ u
a Ế u
3 ư)
8 ổ l1
? _ >< 10. ,
“ ².6 9,_1² "’ oaesnoưnuvunze
Thửỉ #… sòng mn khóm tiên triẻn bệnh nhángi Thời glan sóng còn ioan bo (tháng)
Dữ liệu an toản của việc điều trị duy trì bằng ALIMTA từ 2 nghiên cứu JMEN vả
PARAMOUNT là tương tự.
21
Đặc tính dược động học
Đặc tính dược động học của pemetrexed sau khi dùng đơn liều đã được đảnh giả trên 426 bệnh
nhân ung thư có u rắn khác nhau với cảc liều từ 0,2 đến 838mg/m2 được tiêm truyề t g thời
gian 10 phút. Pemetrexed có thề tich phân bố ở trạng thái cân bằng lá 9lit/mz, Cảo nghỉ` ứu in
vitro cho thấy pemetrexed liên kết với protein huyết tương khoảng 81%. Sự kết hợp không bị
ảnh hưởng đảng kế bởi cảc mức đó suy thận khác nhau. Pemctrexed ít chuyến hóa ở gan.
Pemctrexed được bải tiết chủ yếu qua nước tiểu, với 70% đến 90% của liều dùng được thu hồi ở
dạng không đổi trong nước tiếu trong vòng 24 giờ đẩu sau khi tiêm truyền. Hệ số thanh thải tổng
cộng của pemetrexed lả 91,8m1/phút và nửa đời thải trừ khỏi huyết tương là 3,5 giờ ở bệnh nhân
có chức năng thận bình thường (độ thanh thải creatinin lả 90mllphút). Sự dao động về độ thanh
thải giữa các bệnh nhân ở mức độ vừa, là 19,3% Mức độ phơi nhiễm hệ thống (AUC) của
pemetrexed vả nồng độ tối đa trong huyết tương tăng tỷ lệ với 1iều. Dược động học cùa
pemetrexed không thay đồi trong nhiều chu kỳ điều trị
Cảo đặc tinh dược động học cùa pemetrexed không bị ảnh hưởng bởi cisplatin dùng đồng thời.
Bổ sung acid folic đường uống vả vitamin Biz tiêm bắp không ảnh hưởng tới dược động học cùa
pemetrexed.
QUÁ LIÊU
Cảo triệu chứng của quá liều được báo cáo gồm giảm bạch cầu trung tinh, thiếu máu, giảm số
lượng tiến cầu, viêm niêm mạc, đa bệnh lý thần kinh cảm giác và ban da, Cảc biến chứng dự
đoán của quá liều gồm ức chế tùy xương được biểu hiện bời giảm bạch cầu trung tính, giảm số
lượng tiểu cầu và thiếu mảu. Ngoài ra, có thể gặp nhiễm khuẩn có hoặc không có sốt, tiêu chảy,
vả/hoặc viêm niêm mạc. Trong trường họp nghi quá liều, phải theo dõi bệnh nhân, kiểm tra cõng
thức mảu và thực hiện liệu phảp hỗ trợ khi cần. Cân nhắc việc sử dụng calci folinat / acid folinic
trong điều trị quá liều pemetrexed.
HẠN DÙNG
24 tháng kế từ ngảy sản xuất.
Dung dịch hoản nguyên và dung dịch để truyền: Khi được tiến hảnh theo đúng chỉ dẫn, dung
dịch hoản nguyên vả dung dịch để truyền ALIMTA không có chất bảo quản kháng khuẩn. Độ
bền vững vật lý vả. hoá hoc của dung dịch hoản nguyên và dung dịch để truyền ALIMTA vừa
chuẩn bị đã đuợc chứng minh trong 24 giờ nếu bảo quản trong tủ lạnh hoặc ở nhiệt độ 25°C. Xét
theo khía cạnh vi sinh vật, sản phẳm phải được sử dụng ngay. Nếu không dùng ngay lập từc,
điều kiện bảo quản và thời gian bảo quản trưóc khi sử dụng lá trách nhiệm của người sử dụng
thuốc vả thông thường không được quả 24 giờ 6 nhiệt độ 2 đến 8°C, trừ khi việc hoả.n
nguyên/pha loãng thuốc được tiến hảnh trong khu vực vô trùng được kiểm soát vả đảm bảo.
22
THẬN TRỌNG ĐẶC BIỆT TRONG BẢO QUẢN
Lọ chưa mở: Bảo quản ở nhiệt độ không quá 30°C. _ /1
Chế phẫm sau khi đã hoãn nguyên: Xem điều kiện bảo quản của chế phẩm sả
jhoản
nguyên trong phần Hạn dùng
Để xa tầm tay trẻ em.
THẬN TRỌNG ĐẶC BIỆT VỀ TIÊU HỦY VÀ LƯU THÔNG
Dùng kỹ thuật vô khuẩn trong khi hoản nguyên và pha loãng thêm pemetrexed đề tiêm truyền
tĩnh mạch.
1.
SẢN XUẤT BỞI:
ELI LILLY AND COMPANY
Indianapolis, IN 46285, USA
Tính liều và số lọ ALIMTA cần dùng. Mỗi lo chứa một lượng dôi pemetrexed để dễ lấy
lượng thuốc ghi nhãn.
Hoản nguyên lọ lOOmg với 4,2 ml dung dịch natri clorid 9mg/ml (0,9%) để tiêm, không
có chất bảo quản, tạo thảnh dung dịch chứa 2Smg/ml pemetrexed. Lắc xoáy lọ nhẹ nhảng
tới khi bột hòa tan hoản toản. Dung dịch thu được trong và có mảu thay đối từ không mảu
đến vảng hoặc xanh lá cây—vảng mà không ảnh hưởng đến chất lượng của sản phẳm.
Dung dịch hoản nguyên có pH giữa 6,6 và 7,8. Cần có sự pha loãng thêm.
Thể tích thích hợp của dung dịch hoản nguyên pemetrexed phải được pha loãng thêm
thảnh 100m1 bằng dung dịch natri clorid 9mg/ml (0,9%) để tiêm, không có chất bảo quản,
và được tiêm truyền tĩnh mạch trong 10 phủt.
Các dung dịch tiêm truyền pemetrexed được pha như chỉ dẫn ở trên tương hợp với các bộ
tiêm truyền vả các túi tiêm truyền trảng polyvinyl clorid vả polyolefin.
Các sản phẩm thuốc tiêm phải được kiểm tra bằng mắt về chất lạ và sự đổi mảu trước khi
dùng. Nếu quan sát thấy chất lạ, không được dùng.
Các dung dịch pemetrexed chỉ để dùng một lần. Phần sản phấm không dùng hoặc vật
liệu thải phải vứt bỏ theo đúng cảc yêu cầu của địa phương.
Thận trọng trong pha chế và dùng thuốc: Cũng như với các thuốc chống ung thư có
khả nãng gây độc khảo, phải thận trọng khi thao tảc và pha các dung dịch tiêm truyền
pemetrexed. Nên sử dụng găng tay. Nếu dung dịch pemetrexed tiếp xúc với da, rứa da
ngay thật kỳ với nước và xả phòng. Nếu cảc dung dịch pemetrexed tiếp xúc với niêm
mạc, giội nước cẳn thận để rửa. Pemctrexed không phải là chất 1ảm giộp da. Không có
thuốc giải độc đặc hiệu cho sự thoảt mach pemetrexed. Một số ít trường hợp thoảt mạch
pemetrexed đã được bảo cảo, tuy nhiên không được nhà nghiên cứu đảnh giá là nghiêm
trọng. Sự thoát mạch cần được điều trị theo thực hảnh chuẩn ở địa phương giống như với
các thuốc không gây giộp da khác.
TUQ. CỤC TRUỘNG
p_TRUÙNG PHÙNG
.Jli/IỊJYIỌ'Ỉ'Ì' ìHf"l …ỷÍi…ẹ 23
Ẻ.
F=~ỉõở
#
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng