













HH )` 'i [`
("i`í'iJi \\'1 \'171'-:
’i-ỉií i`ẩ
i .
\ I,,intiitii:Ảaf…ẳ… eẮỬẤỹ `
ALIMTA
500 mg
:›eic… i’.’
n,: mluvencm t…- cltei
th:ntiituhrm er at utth
Ht-eư the :›ctncqe ie_ mức độ 3 (không kế độc tinh
trẻn thần kinh), phải ngừng dùng ALIMTA cho tới khi thuyên giảm tới mưc thấp hơn
hoặc băng trị số trước điều trị cùa bệnh nhân. Việc điều trị sẽ lại dược tiếp tục theo các
chỉ dẫn ớ Bảng 2.
Bảng 2. Bảng hiệu chỉnh Iiều của ALIMTA (dùng đơn độc hoặc kểt hợp) và
Cisplatin
dựa trên độc tinh khác ngoải huyết học ²"’
Liều ALIMTA (ngm²) Liều cisplatin (mglm²)
Bắt cư độc tinh nảo, trù viêm 75%liềutrước 75%11êutrước
niêm mạc, ở mức độ 3 hoặc 4.
Tiêu chảy cằn điều trị tại bệnh 75% Iiều trước 75% liêu trước
viện (không kể mừc độ) hoặc tiêu
chảy độ 3 hoặc 4
Viêm niêm mạc mức độ 3 hoặc 4 50% liều trước 100%!1ềutrước
“#
²' Tiêu chuẩn độc tinh chung cùa Viện Ung thư Quốc gia (CTC v2.0; NC1 1998)
b Khỏng kẻ độc tính thẩn kinh QiỰJ
Trong trường hợp có độc tính thằn kinh, điều chình liều ALIMTA vá cisplatin theo
hướng dẫn ớ Bảng 5. Bệnh nhân phải ngừng điếu trị nếu quan sảt thắy độc tinh thẳn kinh
mưc độ 3 hoảc 4.
Bãng 5. Bãng hiệu chỉnh Iiều của ALIMTA (dùng đơn độc hoặc kết hợp) và
Cisplatin đựa trên độc tỉnh thần kỉnh
’bỉức độ CTC“ Liều ALIMTA (ngm²) Liều cisplatin (mg/m²)
O-l 100% liêu trước 100% liêu trước
2 100% liêu trước 50% liêu trước
“` Tiêu chuẩn độc tính chung cùa Viện Ung thư Quốc gia (CTC v2.0; NC1 1998)
Phải ngừng điều trị với ALIMTA sau 2 lần giảm liều nếu bệnh nhân có bất cớ độc tinh
nảo trên máu hoặc ngoải máu mức độ 3 hoặc 4, hoặc ngay lập tức nếu quan sảt thắy độc
tính thần kinh mửc độ 3 hoặc 4.
Người giả: Trong nghiên cứu lâm sảng, không có dấu hiệu là bệnh nhân từ 65 tuốt trớ
lẻn có nguy cơ về tác dụng không mong muốn nhiều hơn so với bệnh nhân dưới 65 tuổi.
Khỏng cần sự giám liếu nảo khác ngoải chế độ giảm liều được khuyến cáo chung cho tât
cả bệnh nhân
'l`rc em và lhiếu niên: ALĨMTA không được khuyến cáo dùng cho bệnh nhân dưới 18
tuổi vì chưa xảc định sự an toản và hiệu quả trong nhóm bệnh nhân nảy.
Bệnh nhân suy ihận: (Cỏng thức C ockcroft vả Gault chuẩn hoặc tốc độ lọc cầu thận đo
bẳng phương pháp thanh thải huyết thanh Tc99m—DPTA): pemetrexed được thái trừ chủ
yếu dưới dạng không đối bới sự bải tiết cùa thận. Trong nghiên cứu lâm sảng, bẻnh nhân
có hệ số thanh thải creatinin ỉ 45 mI/phút không cần sự điều chỉnh liếu nảo khảc ngoải
sự điếu chinh được khuyến cáo cho tất cả bệnh nhân. Không có đủ dữ liệu về sử dụng
pemetrexed 0 bệnh nhân có độ thanh thải creatinin dưới 45 ml/phùt; do đó không khuyến
cảo dùng pemetrexed (xem phần “Cánh bảo đặc biệt vả thận trọng khi dùng”).
Bệnh nhân suy gan: Không tim thấy có sự liên quan giữa AST (SGOT), ALT (SGPT),
hoặc bilirubin toán phần và dược động học cùa pemetrexed. Tuy nhiên bệnh nhân bị suy
gan với bilirubin > 1,5 lần giới hạn trên cùa binh thường vảlhoặc transaminase > 3,0 lần
giới hạn trẽn cua binh thường (khòng có dl cãn gan) hoặc > 5,0 lằn giới hạn trên cưa binh
thường (có di căn gan) chưa được nghiên cứu riêng biệt.
CHỐNG CHỈ ĐỊNH
Mẫn cảm với pemetrexed hoặc với bất cứ tá dược nảo.
Phụ nữ cho con bú (xem phần “Thời kỳ mang thai vả cho con bit”)
Dùng đồng thới vaccin sốt vảng (xem phần “Tuong tác với cảc thuốc khảo vả các dạng
tượng tảc khác”). ỔW/c
CẢNH BÁO ĐẶC BIỆT vÀ THẬN TRỌNG KHI DÙNG
Pcmctrcxcd có thề ưc chế chức năng tùy xương biếu hiện bắng giảm bạch cầu trung tinh,
giảm số lượng tiều cầu vá thiếu máu (xem phần “Các tác dụng không mong muốn"). Sự
ưc chế tủy thường lả độc tinh glỚl hạn liều lượng. Phải theo dõi tảo dụng ức chế tuỳ trong
quá trình điều trị cho bệnh nhân vả không được cho bệnh nhân dùng pemetrexed cho tới
khi số lượng bạch cẩu trung tinh (ANC) đạt mức ỉ 1.500/mm3 vả số luợng tiều cấu đạt
mưc `: 100.0001’mm3. Sự giảm liều trong cảc chu kỳ tiếp sau dựa trên ANC, số iượng tiều
cầu thấp nhắt vá độc tinh ngoéu mảu tối đa nhận thấy từ chu kỳ điều trị trước (xem phần
“Liều lượng vả cảch dùng").
Khi được điều trị trước với acid folic vá vitamin Blz, bệnh nhân it gặp độc tinh hơn vả
giám được các dộc tinh trẻn mảu vả ngoải mảu mức đó 3/4 như giảm bạch cẩu trung tinh,
sốt giảm bạch cẩu trung tính và nhiễm khuẩn kèm giám bạch cằn trung tính đó 3/4, Do
đó phai hướng dẫn bệnh nhân điều trị với pemetrexed rầng dùng acid folic vả vitamin
Big lả biện phảp dự phớng để giảm độc tinh liên quan tới thuốc (xem phần “Liều lượng
và cảch dùng").
C ác phán ưng da đã được báo cáo ở bệnh nhân không được điều trị trước với
corticosteroid. Việc điều trị trước với dexamethason (hoặc tương đương) có thế lảm giảm
tần suất vả mức độ nặng cùa phan img da (xem phẳm “Liều lượng và cách dùng”).
Mòt số lượng hạn chế cảc bệnh nhân được nghiên cưu có độ thanh thải creatinin dưới 45
mi/phủt Do đó, không khuyến cáo dùng pemetrexed cho bệnh nhân có độ thanh thải
creatinin < 45 mlt'phút (xem phần “Liều iượng vả cảch dùng”).
Bệnh nhãn suy thặn nhẹ đến vưa (độ thanh thải creatinin từ 45 đền 79ml/phủt) phải tránh
dùng các thuốc chống viêm không—steroid (NSAIDs) như ibuprofen, vá aspirin (> 1,3
g,f"ngảy) trong 2 ngảy, trước ngảy dùng, vả 2 ngảy sau khi dùng pemetrexed (xem phấn
“Tương tác với cảc thuốc khảc vả các dạng tương tác khảo"). Tất cả bệnh nhân đủ tiêu
chuẩn để điếu trị VỚI pemetrexed phải tránh dùng NSAID có 11118 đời thải trư dải trong it
nhắt 5 ngảy trước, ngảy dùng, và it nhất 2 ngáy sau khi dùng pemetrexed (xem phần
“Tuong tác với các thuốc khác và các dang tương tác khác”).
Các biến cố nghiêm trọng trên thận, bao gốm cả suy thận cấp đã được báo cáo khi sự
dụng pemetrexed đớn độc hoặc phối hợp với các hoá chẳt trị iiệu khác. Nhiều trong số
nhũng bệnh nhân gặp các biến cố nảy đều có cảc yếu tố nguy cơ tiềm ẩn cưa bệnh thân
op—
như mắt nước hay bị tãng huyết áp hoặc đải thảo đường từ trước.
Anh hướng cùa dịch ở khoang thứ ba, như dịch trản mảng phôi hoặc cố trướng (báng)
dối với pemetrexed không được biết. (5 bệnh nhân có dich ớ khoang thứ ba có ý nghĩa
lâm sảng, phải xem xét việc dẫn lưu dịch trước khi dùng pemetrexed /\ JV’
t/
Do độc tinh trên tiêu hóa của pemetrexed dùng kết họp với cisplatin, mất nước nặng đã
đươc ghi nhận. Vi vặy, bệnh nhân phải được chống nôn đầy đủ và được bù nước thích
hợp trước vảfhoặc sau khi điều trị.
(`ảc biến cố không mong muốn nghiêm trọng trên tim mạch gồm nhồi máu cơ tim và
biến cố mạch mảu não ít xảy ra trong các nghiên cứu iảm sảng với pcmetrexcd, thường
xảy ra khi dùng kết hợp với một thuốc độc hại tế bảo khác. Phần lớn bệnh nhân gặp các
tác dung nảy đã có cảc yếu tố nguy cơ tim mạch từ trước (xem phần “Các tác dụng
không mong muốn").
Tinh trạng suy giảm miễn dịch thướng gặp ở bệnh nhân ung thư. Do đó, khỏng khuyến
cáo dùng đồng thới với vaccin sống giảm độc tinh (trừ vaccin sốt vảng bị chống chỉ định) _1
(xem phần “Chống chi định” và “Tương tảc với các thuốc khảc vả các dạng tương tác |
khảc”). .
Pemctrexed có thể gây tốn hại về di truyền. Nam giới trướng thảnh vế smh duc được
khuyên khỏng thụ tinh trong khi điều tri và tới 6 tháng sau đó, Các biện pháp tránh thai
hoặc kiêng giao hợp được khuyến cảo, Do trị liệu với pemetrexed có thể gây vô sinh
không hồi phục, nam giới được khuyên tim sự hướng dẫn về cất trữ tinh trùng trước khi
bắt đầu điều trị.
Phụ nữ có khả năng mang thai phải dùng cảc biện pháp trảnh thai hữu hiệu trong khi điều
trị với pemetrexed (xem phần “Thời kỳ mang thai vả cho con bú”).
Cảc trường hợp viêm phổi khu trú do xạ trị đã được bảo cảo ớ cảc bệnh nhân điều trị tia
xạ trước, trong hoặc sau khi dùng pemetrexed Cần đặc biệt chú ý tới các bệnh nhân nảy
vả thận trọng khi sử dụng các hoá chất nhạy cảm tia xạ khác.
Môt số trường hợp thu hồi bưc xa đã được báo cảo ớ cảc bệnh nhân điếu trị tia xạ vải
tuần hoặc vải năm trước dó.
TƯONG TẢC VỚI CÁC THUỐC KHÁC vÀ CÁC DẠNG TƯONG TÁC KHÁC
Pemctrexed được thải trù chủ yếu ớ dang không đổi qua thận nhớ bải tiết ở ống thận vả
một phần nhờ loc ớ cẩu thận. Việc dùng đồng thòi với các thuốc độc trên thận (như
aminoglycosid, thuốc iợi tiều quai, hợp chất piatin, cyclosporin) có thế lảm chậm sư
thanh thải pemetrexed. Cần thận trong khi phối hợp các thuốc nảy. Nếu cẳn dùng, phái
theo dõi chăt chẽ độ thanh thải creatinin.
Việc dùng đồng thời với cấc chất củng được bải tiết bời ống thận (như probenecid,
penicilin) có khả năng Iảm chậm sự thanh thải pemetrexed. Phải thận trọng khi dùng cảc
thuốc nấy kết hợp với pemetrexed. Nếu cấn dùng, phái theo dõi chặt chẽ độ thanh thải
creatinin. A ,Vt/
fẬV
Ở bẽnh nhân có chức năng thân binh thường (độ thanh thải creatinin ỉ 80 ml/phút), iiều
cao cảc thuốc chống viêm không steroid (NSAID, như ibuprofen > 1.600 mg/ngảy) vả
aspirin ở liều cao (ỉ 1,3 g/ngấy) có thề lảm giảm sư thái trư pemetrexed, vả do đó lảm
tăng các tác dụng khỏng mong muốn cua pemetrexed. Vì vậy, phái thận trọng khi dùng
liều cao NSAID, hoặc aspirin đồng thời với pemetrexed cho bệnh nhân có chưc năng
thận binh thường (độ thanh thái creatinin z 80 ml/phút).
Ở bệnh nhân có suy thận nhe đến vưa (độ thanh thải creatinin từ 45 đến 79 ml/phủt), phái
tránh dung đống thời NSAID (như ibuprofen), hoặc aspirin ớ Iiếu cao trong 2 ngảy trước,
ngảy dùng, vả 2 ngảy sau khi dùng pemetrexed (xem phần “Cánh báo đặc biệt và thân
trong khi dùng”).
Trong khi không có dữ iiệu về nguy cơ tường tác với NSAID có nưa đời thái trư dải hơn
như piroxicam hoặc rofecoxib, phải tránh dùng đồng thời VỚI pemetrexed trong it nhất 5
ngấy trước, ngảy dùng, vả it nhất 2 ngảy sau khi dùng pemetrexed (xem phần “Cảnh bảo
đặc biệt và thận trọng khi dùng“).
Pemctrexed it được chuyền hờa ờ gan. Cấc kết quả nghiên cứu in vitro với microsome
gan người cho thấy pemetrexed có thể khỏng gây ưc chế có ý nghĩa lâm sảng sự chuyền
hóa cưa các thước đươc chuyến hóa bới (` YP3 A, C YP2D6, C YP2C 9, vả CYP] A2,
Tmmg lảc hay gặp với lẩl ca lhuốc độc hại Iế bảo:
Vi nguy cơ huyết khối tảng lên 0 bệnh nhân ung thư, liệu phảp chống đỏng thường được
dùng. Do có sự dao động lớn giữa cảc cả thế về tinh trạng đông mã… trong các bệnh vả
do khả nãng tương tác giữa cảc thuốc chống đông máu đường uống với hóa trị liệu chống
ung thư nẻn cấn phái theo dõi INR (International Normalised Ratio: tỷ số binh thường
hờa quốc tế) thường xuyên hơn, nếu quyết định sử dụng cấc thuốc chống đòng đường
uống cho bệnh nhân.
( `hống Ch! định dùng đồng lhở7': vaccin sốt vảng: nguy cơ tử vong vi bệnh do vaccin phảt
triền toấn thân (xem phấn “Chống chi định”).
Khỏng khuyến cáo t/1'ihg đồng lhời: vaccin sống giảm tinh độc (trù sốt vảng): nguy cơ
bệnh toản thân, có thể gây tử vong. Nguy cơ tăng lên ở cảc đối tượng đã bị suy giấm
I… 4\-
,.x .
miễn dịch bới bệnh cản bản. Dùng vaccin bất hoạt nếu có (bệnh bại liệt) (xem phần
“Cảnh báo đặc biệt và thận trọng khi dùng”).
A1
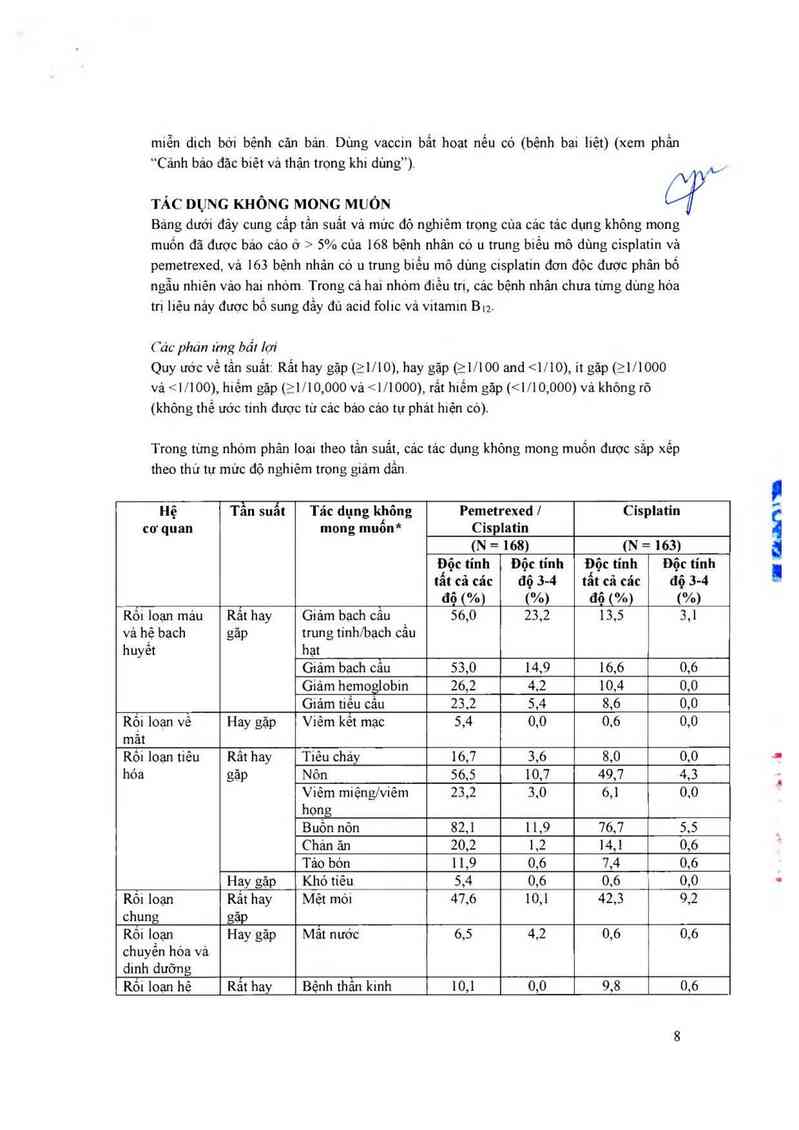
TÁC DỤNG KHÔNG MONG MUÔN Ậẫỳ
Bảng dưới đây cung cẳp tấn suất và mức độ nghiêm trợng của các tác dụng không mong
muốn đã được bảo cảo ờ > 5% của 168 bệnh nhân có 11 trung biền mô dùng cisplatin vả
pemetrexed, và 163 bệnh nhân có u trung biền mô dùng cisplatin đơn đôc được phân bố
ngẫu nhiên vảo hai nhóm. Trong cả hai nhờm điều trị, các bệnh nhân chưa tưng dùng hóa
trị iiệu nảy được bổ sung đầy đủ acid folic vả vitamin Biz.
ơn,— phản ửng bất lợi
Quy ước về tần suất: Rất hay gặp (21110), hay gặp (211100 and <1/10), it gặp (2111000
vả <1/100),h1ếm gặp (a1/10,000 vả <1/1000), rất hiếm gặp (<1/10,000) vả không rõ
(không thể ước tinh được từ các báo cáo tự phát hiện có).
Trong từng nhóm phân loại theo tấn suất, cảc tảc dụng không mong muốn được sẳp xếp
theo thứ tự mức độ nghiêm trọng giảm dần.
u…vụ
Hệ Tần suất Tác dụng không Pemetrexed | Cỉsplatin
co' quan mong muốn* Císplatin
(N = 168) (N = 163)
Độc tính Đột: tính Độc tính Độc tính
tất cả cảc độ 3-4 tẩt cả cảc độ 3-4
_ độ ("/9) (%) độ (%) (%)
Rối loạn mảu Rất hay Giảm bạch cầu 56,0 25,2 15,5 5,1
vả hệ bạch gặp trung tínhfbạch cầu
huyết hạt
Giảm bạch cẫu 55,0 14,9 16,6 0,6
Giảm hemoglobin 26,2 4,2 10,4 0,0
Giảm tiểu cầu 23,2 5,4 8,6 0,0
Rối loạn vê Hay gặp Viêm kểt mạc 5,4 0,0 0,6 0,0
mắt
Rõi loạn tiêu Rât hay Tiêu chảy 16,7 3,6 8,0 0,0
hóa gặp Nôn 56,5 10,7 49,7 4,3
Viêm miệng/viẽm 23,2 3,0 6,1 0,0
họng
Buồn nôn 82,1 11,9 76,7 5,5
Chán ăn 20,2 ],2 14,1 0,6
Tảo bón 11,9 0,6 7,4 0,6
Hay gặp Khó tiêu 5,4 0,6 0,6 0,0
Rối loạn Rât hay Mệt mòi 47,6 10,1 42,5 9,2
chung gặp
Rôi Ioạn Hay gặp Mât nước 6,5 4,2 0,6 0,6
chuyển hóa và
dinh dưỡng
Rối loạn hệ Rẳt hay Bệnh thần kinh 10,1 0,0 9,8 0,6
thân kinh gặp cảm giác
Hay gặp Loạn vi giác 7,7 0,0'" 6,1 0,0…
Rôi loạn thận Rất hay Tăng creatinin 10,7 0,6 9,8 1,2
vả tiết niệu gãp Giảm độ thanh thải 16,1 0,6 17,8 1,8
creatinin**
Rỏi loạn da vả Rẳt hay Ban 16,1 0,6 4,9 0,0
tố chưc dưới gặp Rụng tóc 1ông 1 1,5 0,0'“ 5,5 1 0,0'"
da 1
* Tham khảo CTC Viện Ung thư Quốc gia phiên bản 2 đối với mỗi độ độc tinh trừ thuật
ngữ “tăng độ thanh thải creatinin”. / v/
** được trich dẫn từ thuật ngữ “thận/niệu sinh dục khảc" i )
*** Theo CTC Viện Ung thư Quốc gia (v2.0; NCI 1998), loan vị giác và rụng tóc chi
được báo cáo lá ở mưc độ | hoặc 2.
Trong báng nảy đã dùng mưc giới hạn 5% để bao gồm tất cả các biến cố mả người bấo
cấo cho rằng có thế liên quan đến việc sử dụng pemetrexed vả cisplatin.
Các độc tính CTC có ý nghĩa lâm sảng được bảo cáo ở > 1% vả í 5% (hay gặp) bệnh
nhân đã được chỉ định ngẫu nhiên dùng cisplatin vả pemetrexed bao gồm: suy thặn,
nhiễm trùng, sốt, sốt giảm bạch cầu đa nhân trung tính, tăng AST, ALT, vả GGT, mảy
đay và đau ngực.
Các độc tỉnh CTC có ý nghĩa iảm sảng được bấo cáo ở Ẹ 1% bệnh nhân đã được chỉ định
ngẫu nhiên dùng cisplatin vả pemetrexed bao gốm ioạn nhịp tim và bệnh thấn kinh vận
động
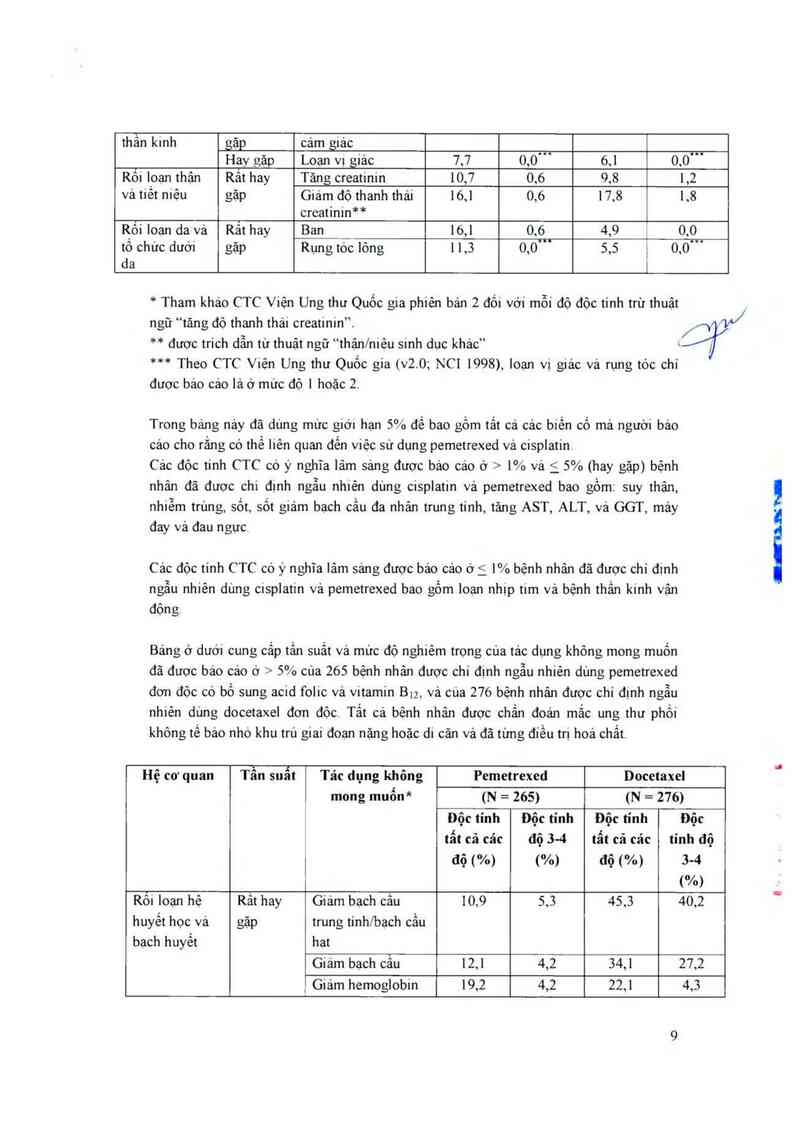
Bảng ở dưới cung cẳp tẩn suất và mưc độ nghiêm trong của tác dụng không mong muốn
đã đươc báo cảo ớ > 5% của 265 bệnh nhân được chi đinh ngẫu nhiên dùng pemetrexed
đơn độc có bổ sung acid folic vả vitamin Biz, vả cua 276 bệnh nhân được chỉ định ngẫu
nhiên dùng docetaxel đơn độc. Tất cả bệnh nhân được chẩn đoán mắc ung thư phồi
không tế bảo nhờ khu trú giai đoạn nặng hoặc di căn vả đã từng điều trị hoá chất.
Hệ cơ quan Tần suất Tác dụng không Pemctrexed Docetaxel
mong muốn* (N = 265) (N = 276)
Độc tinh Độc tinh Độc tinh Độc
tất cả cảc độ 34 tất cả các tính độ
i độ (%) (%) độ (%) 5-4
(%)
Rỏi loạn hệ Rât hay Giảm bạch câu 10,9 5,3 45,3 40,2
huyết học và gặp trung tỉnh/bạch cầu
bach huyết hạt
Giảm bạch cẫu 12,1 4,2 54,1 27,2
, Giảm hemoglobin 19,2 4,2 22,1 4,3
ỮL/
Hay gặp Giam tiêu câu 8,3 1,9 1,1 ' 0,4
Rôi ioạn tiêu Rât hay Tiêu chảy 12,8 0,4 24,3 2,5
hóa gặp Nôn 16,2 1,5 12,0 1,1
Viêm miệng/viêm 14,7 1,1 17,4 1,1
hầu hợng
Buồn nõn 50,9 2,6 16,7 1,8
Chém ăn 21,9 1,9 23,9 2,5
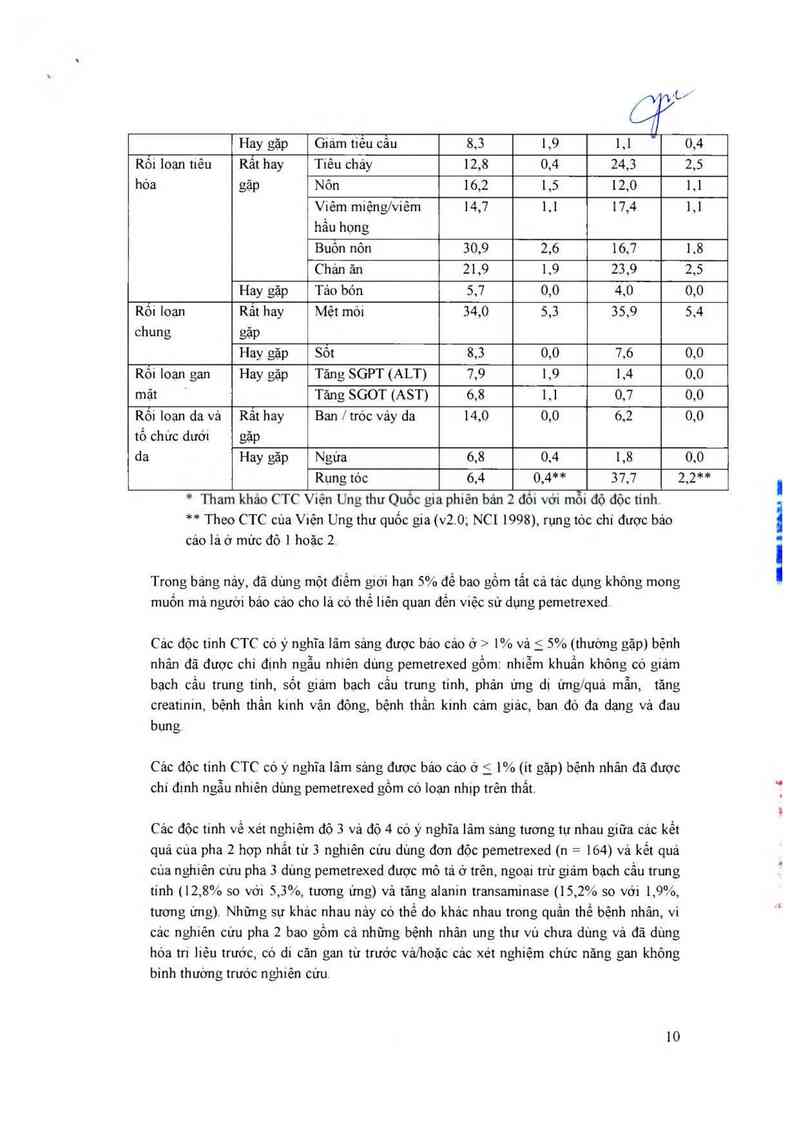
Hay gặp Tảo bón 5,7 0,0 4,0 0,0
Rối loạn Rảt hay Mệt mới 54,0 5,5 55,9 5,4
chung gặp
Hay gặp Sôt 8,3 0,0 7,6 0,0
Rôi loạn gan Hay gặp Tăng SGPT (ALT) 7,9 1,9 1,4 0,0
mật Tăng SGOT (AST) 6,8 1,1 0,7 0,0
Rối loạn da vả Rất hay Ban /tróc vảy da 14,0 0,0 6,2 0,0
tố chưc dưới gặp
da Hay gặp Ngứa 6,8 0,4 1,8 0,0
Rung tóc 6,4 0,4** 37,7 2,2**
* Tham khấo CTC Viên Ung thư Quớc gia phiên bản 2 đổi với mỗi độ độc tinh.
** Theo CTC của Viện Ung thư quốc gia (v2.0; NC1 1998), rụng tóc chi được bảo
cáo iả ở mức độ ] hoặc 2.
Trong bảng nảy, đã dùng một điếm giới hạn 5% để bao gốm tắt cả tảc dụng không mong
muốn mà người bảo cảo cho lá có thể liên quan đến việc sử dung pemetrexed
Các độc tinh CTC có ý nghĩa iảm sảng được bấo cảo ở > 1% và í 5% (thướng gặp) bệnh
nhân đã được chỉ định ngẫu nhiên dùng pemetrexed gồm: nhiễm khuấn không có giảm
bạch cằn trung tinh, sốt giảm bạch cấu trung tinh, phản ứng dị ửng/quả mẫn, tãng
creatmin, bệnh thẩn kinh vận động, bệnh thẳn kinh cảm giác, ban đó đa dạng và đau
bụng.
Các độc tinh CTC có ý nghĩa lâm sảng được bảo cảo ờ i 1% (ít gặp) bệnh nhãn đă được
chi đinh ngẫu nhiên dùng pemetrexed gồm có loạn nhịp trên thắt.
Các độc tính về xét nghiệm độ 3 và độ 4 có ý nghĩa lâm sảng tương tự nhau giữa các kểt
quả của pha 2 họp nhất từ 3 nghiên cứu dùng đơn độc pemetrexed (n = 164) và kết quả
cùa nghiên cứu pha 3 dùng pemetrexed được mô tả ở trên, ngoại trừ giảm bạch cầu trung
tính (12,8% so với 5,3%, tương ửng) vả tãng alanin transaminase (15,2% so với 1,9%,
tương ứng). Những sự khác nhau nảy có thế do khác nhau trong quần thể bệnh nhân, vì
các nghiên cưu pha 2 bao gồm cả những bệnh nhân ung thư vú chưa dùng và đã dùng
hóa trị iiệu trước, có di cản gan từ trước vả/hoặc các xét nghiệm chức năng gan khỏng
binh thường trước nghiên cứu.
10
IA x
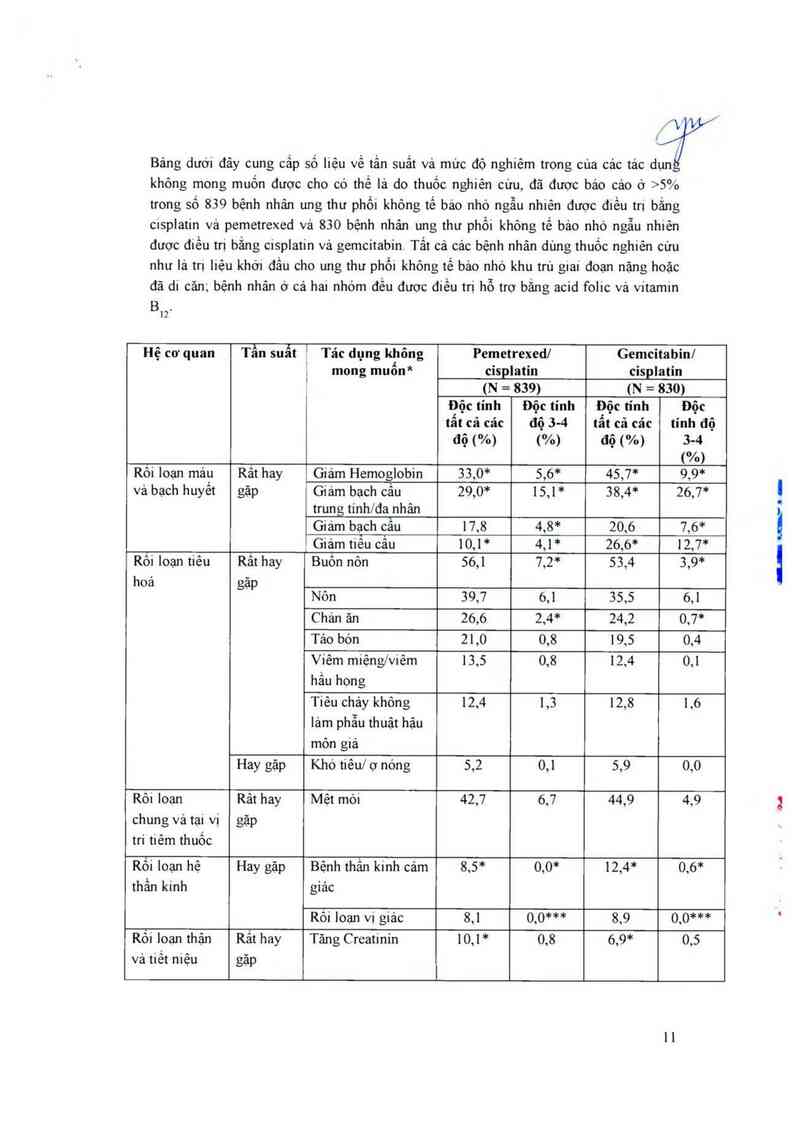
Bảng dười đây cung cấp số Iiệu về tắn suất và mức độ nghiêm trợng của cảc tác dụn
không mong muốn được cho có thế lả do thuốc nghiên cứu, đã được báo cảo ở >5%
trong số 839 bệnh nhân ung thư phối khỏng tế bảo nhỏ ngẫu nhiên được điều trị bắng
cisplatin vả pemetrexed và 830 bệnh nhân ung thư phối không tế bảo nhỏ ngẫu nhiên
được điều trị bằng cisplatin vả gemcitabin. Tắt cả cảc bệnh nhân dùng thuốc nghiên cưu
như là trị liệu khời đầu cho ung thư phổi không tế bảo nhỏ khu trú giai đoạn nặng hoặc
đã di căn; bệnh nhân ở cả hai nhóm đều được điếu trị hỗ trợ bằng acid folic vả vitamin
Bu.
Hệ cơ quan Tần suất 1 Tác dụng không Pemctrexed/ Gemcitabỉnl
ị mong muốn* cisplatin cisplatin
(N = 839) (N = 830)
Độc tính Độc tỉnh Độc tính Độc
tất cả cảc độ 3-4 tẩt cả các tính độ
độ (%) (%) độ (%) 5-4
(%)
Rôi Ioạn máư Rât hay Giảm Hemoglobin 33,0* 5,6* 45,7* 9,9*
và bạch huyêt gặp Giám bạch câu 29,0* 15,1 * 38,4* 26,7’“
trung tính/đa`nhân
Giám bạch câu 17,8 4,8* 20,6 7,6*
_ Giảm tiêu câu 10,1* 4,1* 26,6* 12,7*
Rỏi loạn tiêu Rât hay Buôn nôn 56,1 7,2* 53,4 3,9*
hoá gặp
Nôn 39,7 6,1 35,5 6,1
Chán ăn 26,6 2,4* 24,2 0.7*
Táo bón 21 ,0 0,8 19,5 0,4
Viêm miệng/viêm 13,5 0,8 12.4 0,1
hắu họng
Tiêu chảy không 12,4 1,3 12,8 1.6
lảm phẫu thuật hậu
mỏn giả
Hay gặp Khó tiêu/ ợ nóng 5,2 0,1 5,9 0,0
Rôi Ioạn Rât hay Mệt mò1 42,7 6,7 44,9 4,9
chung và tại vị gặp
tri tiêm thuốc
Rỏi loạn hệ Hay gặp Bệnh thần kinh cảm 8,5* 0,0* 12,4* 0,6*
thần kinh gíảc
Rôi loạn vị giảc 8,1 0,0*** 8,9 0,0***
Rối loạn thận Rắt hay Tăng Creatinin 10,1 * 0,8 6,9* 0,5
vả tiết niệu gặp
ẩư/
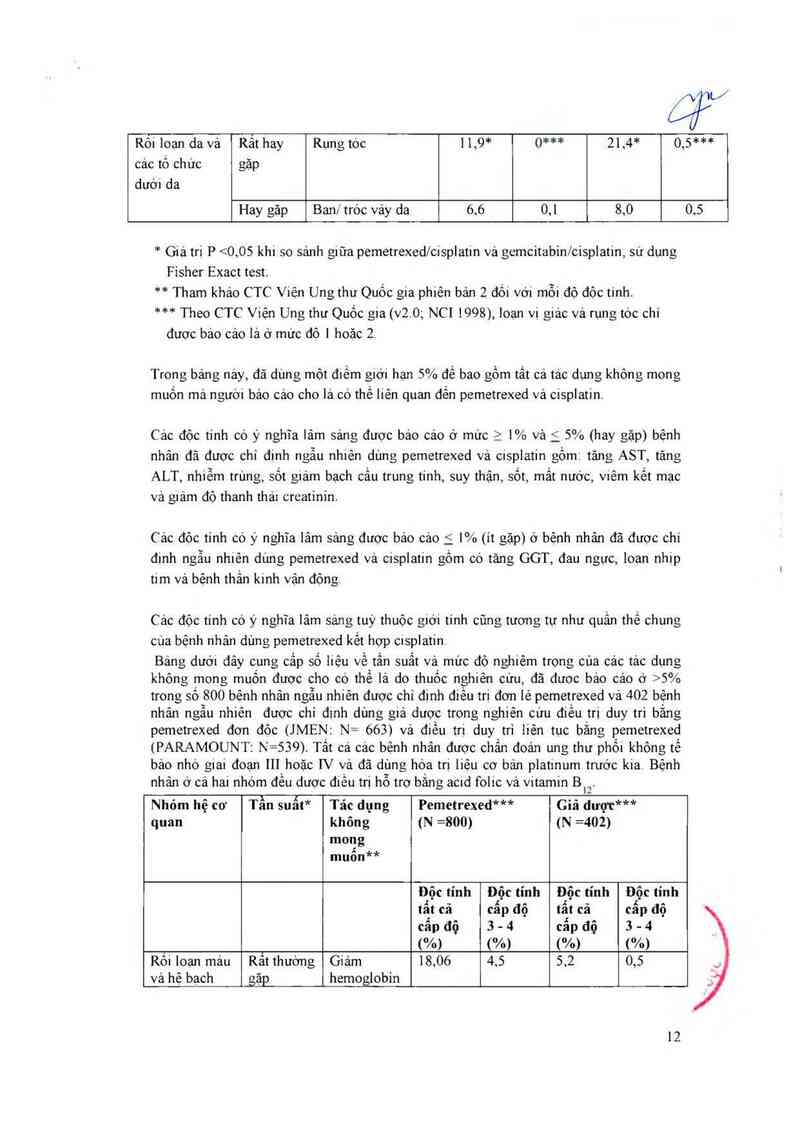
Rối loan da và Rảt hay Rụng tóc 11,9* 0*** 21.4* 0,5***
các tổ chức gặp
dưÓ'l da
Hay gặp Bam" tróc vảy da 6.6 0,1 8,0 0.5
* Giá trị P <0,05 khi so sánh giữa pemetrexed/cisplatin vả gemcitabin/cisplatm, sư dụng
Fisher Exact test.
** Tham khảo CTC Viện Ung thư Quốc gia phiên bản 2 đối vởi mỗi độ độc tinh.
*** Theo CTC Viện Ung thư Quốc gia (v2.0; NC1 1998),10ạn vi giảc vả rụng tóc chỉ
được bảo cảo lá ở mức độ 1 hoặc 2.
Trong bảng nảy, đã dùng một điếm giới hạn 5% để bao gồm tất cả tảc dụng không mong
muốn mà người bảo cáo cho là có thể liên quan đến pemetrexed vả cisplatin.
Các độc tinh có ý nghĩa lâm sảng đuợc báo cảo ở mức 2 1% và f_ 5% (hay gặp) bệnh
nhân đã được chỉ định ngẫu nh1ẻn dùng pemetrexed vả cisplatin gồm: tảng AST, tăng
ALT, nhiễm trùng, sốt giảm bạch cầu trung tính, suy thận, sốt, mất nước, viêm kết mạc
vả g1ảm độ thanh thải creatinin.
Các độc tính có ý nghĩa lâm sảng được báo cáo 5 1% (ít gặp) ở bệnh nhãn đã được chỉ
định ngẫu nhiên dùng pemetrexed vá cisplatin gồm có tăng GGT, đau ngực, loạn nhip
tim và bệnh thần kinh vận động
Các độc tính có ý nghĩa lảm sảng tuỳ thuộc giới tinh cũng tương tự như quần thể chung
cùa bệnh nhản dùng pemetrexed kết hợp cisplatin
Bảng dưới đây cung cẳp số liệu về tần suất vả mức độ nghiêm trọng cùa các tảc dụng
không mong muôn được cho có thề lả do thuốc nghiên cứu, đã được bảo cáo ở >5%
trong sỏ 800 bệnh nhân ngẫu nhiên được chi đinh diều tri đơn lẻ pemetrexed vả 402 bệnh
nhân ngẫu nhiên được chỉ đinh dùng giả dược trong nghiên cứu điều trị duy tri bằng
pemetrexed đơn đỏc (JMEN: N= 663) vả điều trị duy trì liên tục bằng pemetrexed
(PARAMOUNT: N=539). Tất cả các bệnh nhân được chẳn doản ung thư phồi khỏng tế
bảo nhỏ giai đoạn 111 hoặc IV vả đã dùng hóa trị liệu cơ bản platinum trước kia. Bệnh
nhân ở cá hai nhóm đều dược điều trị hỗ trợ bằng acid folic vả vitamin Bư
Nhỏm hệ cơ Tần suẫt* Tác dụng Pemctrexed*** Giả dược***
quan không (N =800) (N =402)
mong
muốn**
Độc tính Độc tính Độc tính Độc tính
tất cả cẩp độ tẩt cả cẩp độ
cẩpđộ 5-4 cấpđộ 5…4
("/o) (%) ("/o) ("/o)
Rôi loan mảu Rất thường Giảm 18,06 4.5 5,2 0,5
vả hệ bạch gặp hemoglobin
12
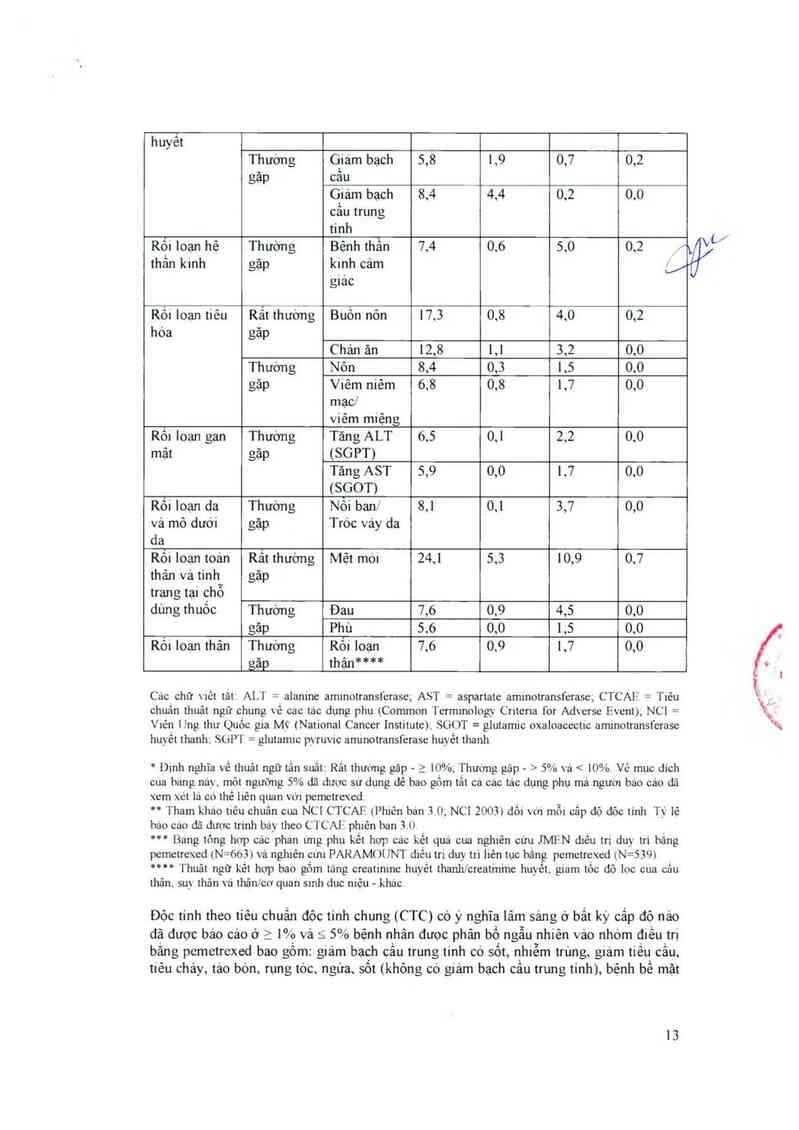
huyềt
Thưởng Giám bạch 5,8 1,9 0,7 0,2
gãp cẳu
Giảm bạch 8,4 4,4 0,2 00
cầu trung
tinh
Rối Ioạn hệ Thường Bệnh ihẵn 7,4 0,6 5,0 0.2 /
thần kinh gặp kinh cảm _//
giac
Rốt toạn tiêu Rẳt thường Buôn nôn 17.5 0.8 4.0 02
hóa gặp
Chản ãn 12,8 1,1 5,2 0,0
Thường Nôn 8,4 0,5 1.5 0.0
gập Viêm niêm 6,8 0,8 1,7 0,0
mạc/
viêm miệng
Rối loạn gan Thường Tăng ALT 6,5 0,1 2,2 0,0
mât gặp (SGPT)
Tăng AST 5,9 0,0 1,7 0,0
(SGOT)
Rối loạn da Thường Nỏi ban/ 8.1 01 5,7 0,0
vả mò dưới gặp Tróc váy da
da
Rối loạn toản Rât thưởng Mệt mói 24,1 5,5 10,9 0,7
thân vả tinh gặp
trạng tại chỗ
dùng thuòc Thường Đau 7,6 0,9 4,5 0,0
gặp Phù 5,6 0,0 1,5 00
Ròi loạn thận Thường Rối loạn 7,6 00 1.7 0,0
găp thận*#Jlnk
Các chữ \1ồt tăt. ALT = alanme am1notransferase; AST = aspartate aminotransferasc; CTCAlỉ = Tiêu
chuẩn thuât ngữ chung về các tác dụng phụ (Common Termmology Cmena for Adverse Event), NC1 =
Viện Ung thư Quốc gia Mỹ ( National Cancer Institute). SGOT = glutamic oxaloacectic aminotransferase
huyết thanh; SUPT = glutamnc p_vruvic armnotransferasc huyết thanh
* Dinh nghĩa về thuât ngữ tần suất: Rắt thường gặp - 3 10%, Thương gập - > 5% vá < 10%. Về mục dích
cua bang nảy, môt ngưỡng 5% dã dược sư dụng dê bao gốm tắt ca các tác dụng phụ mả người báo cảo dã
xem xét lá có thẻ liên quan vơi pemetrexed.
… Tham khao tiêu chuân cua NC1 CTCAE (phlẽn ban 5 0; NC1 2005) dối v(n mỗi cắp dộ dòc tính Tỷ lệ
hảo cáo đã dược trinh bá_v theo C’1'CAI-Ĩ phiên ban 3.0.
“* Bang tông hợp các phan ưng phu kết hợp các kết qua cua nghiên cứu MFN diếư tri du_) tri hăng
pemetrexed (N— 66.3) vả nghiên cưu PARAMOUNT diếu trị duy tri liên tục bằng pemetrexed (N= 5,39)
"*** Thuât ngữ kềt hợp bao gốm táng creatinine huyết thanhlcreatmme huyêt giam lôc dộ lợc cua cẩu
thân. su_x thân xá thận/cơ quan smh duc n1ệu-khác
Độc tính theo tiêu chuẩn độc tinh chung (CTC) có ý nghĩa lâm sảng ở bẩt ký cấp độ nảo
đã được báo cáo ở_ > 1% vả- < 5% bệnh nhân được phân bố ngẫu nhiên vảo nhóm điều trị
bắng pemetrexed bao gồm: giảm bạch cẩu trung tinh có sốt, nhiễm trùng, giám tiều cấu,
tiêu chảy, tảo bón, rụng tòc ngứa, sốt (khỏng có giảm bạch cầu trung tinh), bệnh bề mặt
mắt (bao gồm cá viêm kết mạc), tăng chảy nước mắt, chóng mặt và bệnh thần kinh vận
động.
Độc tính thgo tiêu chuẩn độc tinh chung (_CTC) đã được báo các ô < 1% bệnh nhân được
phân bộ ngâu nhiên vảo nhóm điêu trị băng pemetrexed bao gôm: phản ứng di ửng/quá
mẫn. ban đó đa dang, loạn nhip trèn thất và nghẽn mạch phối. _//Nẫy`/
Độ an toản đã được đánh giá đối với những bệnh nhân được chợn ngẫu nhiên vảo nhóm
điều trị bằng pcmctrcxcd (N=8001. Tỷ lệ cảc phản ứng phụ đă được đánh giá đối với
những bệnh nhân nhận được 5 6 chu kỳ điều trị duy tri bằng pemetrexed (N=519) và so
với nhũng bệnh nhân nhận được > 6 chu kỳ điều trị bẳng pemetrexed (N=281 ). Đã quan
sảt thắy tãng các phán ứng phụ (tất cả các cấp độ) với thới gian sử dụng thuốc dải hơn.
Mưc tảng có ý nghĩa về tỷ lệ giảm bạch cãu trung tính cấp đó 3/4 có thề Iiên quan với
thuốc nghiên cưu dã được quan sảt với thời gian sử dụng pcmctrcxed dải hơn (5 6 chu
kỳ: 3,3%, > 6 chu kỳ: 6.4%: p=0,046). Không có sư khác biệt nảo có ý nghĩa thống kê về
bắt kỳ các phan ứng phụ cẳp độ 314 riêng lẻ nảo khảc đã được thấy với thời gian sử dụng
thuốc dải hơn.
Có it báo cáo về cảc biến cố tim mạch và mạch mảu não nghiêm trợng bao gồm nhồi
máu cơ tim, đau thắt ngực, tai biến mạch máu não và cơn thiếu mảu cục bộ nhất thời
trong các nghiên cưu lâm sảng với pemetrexed, thường xảy ra khi dùng phối hợp với một
thuốc độc hại tế báo khác. Phần lớn bệnh nhân gặp các tảc dụng nảy đã có các yếu tố
nguy cơ tim mạch từ trước
Hiếm có cảc báo cáo về viêm gan, có nguy cơ trằm trọng, trong các nghiên cưu lâm sảng
với pemetrexed.
Giảm toản thê huyết cầu ít khi được bảo cảo trong các thử nghiệm lảm sảng với
pemetrexed.
Trong các thử nghiệm lâm sảng, các trường hợp viêm đại trảng (bao gồm cháy mảu ruột
vả trực trảng, đội khi gây tử vong, thủng ruột, hoại tử ruột vả viêm ruột tit ) ít khi được
báo cáo ớ bệnh nhân sư dụng pcmetrexed
Trong cảc thử nghiệm lâm sảng, viêm phối mỏ kẽ vả suy hô hấp, đôi khi gây tử vong, it
khi được báo cảo 0 bệnh nhân điều trị bằng pemetrexed.
Cũng it có bảo Cảo về cảc trường hợp phù ớ bệnh nhân dùng pemetrexed
Viêm thực quảnl’ wêm thực quản phóng xạ được bảo cảo khỏng thường xuyên trong quá
trinh thử nghiệm lảm sảng với pemetrexed
Nhiễm khuẩn, đòi khi gây tử vong, dã được bảo cáo thường gặp trong các thử nghiệm
lãm sảng với pemetrexed.
14
“l- 0—
') l\
Trong quá trinh theo dõi hậu mãi, các phán ưng khóng mong muốn sau đã được báo cảo
0 bệnh nhãn dùng pemetrexed:
Có ít trướng hợp báo cáo về suy thận cấp ở bệnh nhãn dùng pemetrexed đơn độc hoặc
phối hợp với cảc hoá trị liệu khác (xem phần “Cánh báo đặc biệt và thận trợng khi
dung”). /W
/
Có ít trường hợp báo cáo về Viêm phối khu trú do tia xạ ớ bệnh nhân có xạ tri trước,
trong vả sau khi điều tri bằng pemetrexed (xem phẳm “Cảnh bảo đặc biệt vả thặn trợng
khi dùng”).
Hiếm cộ trướng hợp bảo cảo về thu hồi bức xạ ở bệnh nhân đã xạ tri truớc đó (xem phần
“Canh báo đặc biệt vả thận trợng khi dùng”)
(.`ó ít trường hợp bảo cảo về thiều máu ngoại VI đỏi khi dẫn tới hoại tứ chi.
Các tinh trạng bọng nước hiếm gặp dã dược bảo cảo bao gồm cai hội chưng Stevens-
Johnson vả hoai tứ biều bì nhiễm độc, trong một số truớng hợp đã gây tử vong.
Dã có bảo cảo hiếm gặp về bệnh thiếu máu tan huyết ở bệnh nhân dược điều trị bắng
pemetrexed.
Cảc trướng hớp hiếm gặp về sốc phán vệ đã được bảo cáo.
Thông báo vởi bác sĩ các tác dụng không mong muốn gặp phải trong khi sử dụng
rhuốc.
PHỤ NỮ CÓ THAI VÀ CHO CON BỦ
Khỏng có dữ liệu từ việc sử dụng pemetrexed ở phụ nữ mang thai nhưng pemetrexed,
cũng như các chẳt chống chuyển hóa khác, bị nghi lả gây những khuyết tật bẩm Smh
nghiêm trợng khi dùng trong thời kỳ mang thai. Nghiên cứu trên động vật cho thấy có
độc tính sinh sản. Pemctrexed khỏng được dùng trong thời kỳ mang thai trừ khi thật sự
cần thiềt sau khi đã cân nhắc kỳ sự cần thiết diều tri cho mẹ và nguy cơ đồi với thai (xem
phần “Cảnh báo đặc biệt vả thận trợng khi dùng”).
Phụ nữ có khả nảng mang thai phai dùng biện pháp trảnh thai hữu hiệu trong khi điều trị
VÓ1 pemetrexed.
Pemctrexed có thể gây tộn hại di truyền. Nam giới trướng thánh về sinh dục được
khuyên không nên 1ảm cha trong khi điều trị và tới 6 thảng sau đớ. Các biện phảp tránh
thai hoặc kiêng quan hệ tình dục được khuyến cảo. Do trị liệu với pemetrexed có khả
năng gảy vò Sinh không hồi phục, nam giới được khuyên tìm sự tư vấn về cắt trữ tinh
trùng trước khi bắt đầu điều tri.
Không biềt pemetrexed cớ bải tiết vảo sữa nguời hay khỏng vả khỏng thể loại trừ cảc tảc
dụng không mong muốn trên trẻ bú sữa mẹ. Phải ngùng cho con bú trong khi điều trị với
pemetrexed (xem phẩn “Chống chí đinh”)
15
TẢ(' Dt_ NG TRÊN KHẢ NĂNG LÁ! XE VÀ ĐiỂti KHIEN MÁY MÓC
1x’hỏng co nghiên cưu vẻ tac dung trẻn kha nã.ng lái xe xa diều khiên may moc Tuy
nhiên, đã có bao cáo 10 pemetrexed có thẻ gả) mêt mới Vì vậy bệnh nhản phai được
\ %1L
nhảc nho đội VOI viẻc im xe hoảc vản hanh may moc nẻu tac dung nay xay đẻn
DẠC' TỈNH DL"ỌC L)’
Dặc tính dược lực học
\1hom dược tri liẻu cac chất đỏng đảng cua aCid folic, mả ATC 1.0113A0—1
AL1M 1 A (pcmeirexcd) la môi thuòc chộng folat chỏng ung thư nhiẻu muc tiêu, có tác
dung nhợ phá vỡ cac qua trinh chuyên hoa chu yêu phu ihiiòc fo1at cần ihiẽi cho sư sao
cth tẻ hao
Cac nghiên cưu … ifi'im cho thảy pemetrexed co tac dung cua một thuốc chỏng folat
nhiêu muc tiẻư bảng cach ưc chẻ thyItlldylỉìl synthase (TS), dihydrợfợlat reductame
([)HFR), va glycnimind ribonuclcotid formyltransfcrasc (GARFT), la những enzym phu
thuỏc 1`olat chu chỏt đòi vợi Rth tòng hợp cua thynndtn va các punn nucleond
Peiiietrexeđ đuợc vân chuyên vao trong tế bao bợi ca cac hè thống chải mang folat khư
xa vản chuyên protein gản kêt 1`olat máng. \f1ỏt khi 0 trong tế bao, pcmctrcxcd được
chuyên đội nhanh va )… hiêu suât cao thanh các dang polyglutamat bơi cnz_vm
lbly1pol_Yg1utẽìtĩìẽìl synthetase. Cac dang polyglutamat được giữ trong tẻ bao va còn 1a
những châi uc chẻ TS vả CJARFT manh hon Sư polyglutamat hoa la một qua trinh phu
thuộc xao thoi giam xá nỔng đỏ my ra trong cac tế bao ung thư, va 0 mưc đỏ han chế
1iợn, irong cac mộ binh thưong Cac chầt chuyên hOa polyg1utamat hoa co sư tảng nưa
dợi trong tế bao dẫn đên su keo dái tac dung cua thuộc trong cac tế bao ung thư
Hiẻii Qua1ảm sang
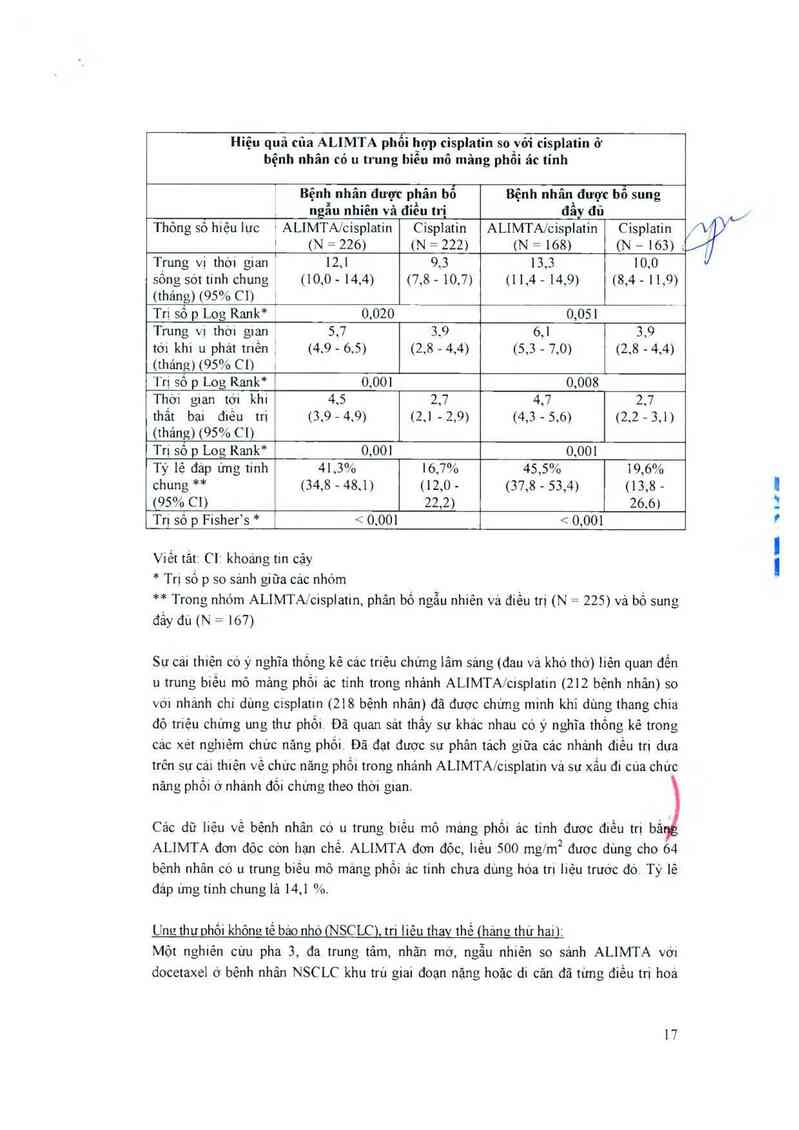
LÍ trung biẻii mỏ :
E\v1 PHACIS, mỏi nghièn cưu pha 3 đa trung tzìm` ngẫu nhiẻn, mu dơn so sánh A LIM'1`A
kết hợp cisp1atm vợi CiSp1atin đớii đôc ợ bênh nhản co ii trung bièu mỏ mang phôi ác tinh
chưa dung hoa … liẻii, cho thắy bẻnh nhân điêu … vợt ALIMTA vá ctsplatm có lợi thế
Sòng sot trung binh co _)ĩ' nghĩa lảm sang 2,8 thang so )… bẻnh nhản chi dưng CiSplatin
Trong nghiẻii cưu. bênh nhân được bỏ sung thẻin acid t`ohc vả vitamin Biz ỉiều thắp đế
láiii gium đóc iinh Phản tich chinh cua nghiên cưu náy được thưc hiên trên quân thẻ tât
ca bẻnh nhản được Chi đinh ngẫu nhiẻn vao mỏi nhom điều tri, dung thuộc nghiên cưu
(iigẵu nhiên vá điêu in) Phân tich phân nhom được thực hiên trẻn bẻnh nhảm đươc dưng
bo sung actd 1`olic xa vitamin B); irong toan hô nghiên cưu (đươc hò sung đây đu) Kềt
qua cua cac phân tich vẻ hiêu qua nay được tớm tắt trong bang duới đả)»:
Hiệu quả của ALIMTA phổi hợp cisplatin so_vói cisplatin ở
bệnh nhân có 11 trung biêu mô mâng phôi ác tính
ỷfi“
(
Bệnh nhân được phân bố Bệnh nhân được bô sung
, ngẫu nhiên và điều trị đầy đủ
Thỏng sô hiệu lưc ' ALIMTA/cisplatin Cisplatin ALIMTA/cisplatin Cisplatin
. (N = 226) (N = 222) (N = 168) (N —163) ,
Trung vị thòi gian 1 12,1 9.5 15,5 10,0
sống sót tinh chung (10,0 - 14,4) (7,8 - 10,7) (11,4 - 14,9) (8,4 - 11,9)
(thảng) (05% C1) _
Tri số p Log Rank* 0,020 0,051
Trung vị thới gian 5,7 3.9 6,1 3,9
161 kh] u phảt …ẻn _ (4.9 - 6,5) (2,8 — 4,4) (5,5 - 7,0) (2,8 - 4,4)
(thảng) (95% CI)
Trị số p Log Rank* 1 0,001 0,008
Thới g1an tới khi 4,5 2,7 4,7 2,7
thất bại điếu 111 (5,9 -4,9) (2,1 - 2,9) (4,5 - 5,6) (2,2 -5,1)
(tháng) (95% Ci)
Tri số p Log Rank* 0,001 0,001
Tỷ lệ đáp ứng tính 41,5% 16,7% 45,5% 19,6%
chung ** (34,8 - 48.1) (12,0 - (57,8 - 55,4) (13,8 —
(95% CI) , 22,2) 26.6)
Tri sỏ p Fisher’s * 1’ < 0,001 < 0,001
Viết tắt (`lr khoáng tin cậy
* Tri số p so sánh giữa các nhóm
** Trong nhóm ALIMTAXcisplatin, phân bố ngẫu nhiên vả điều trị (N = 225) và bổ sung
đẳy đL1(N = 167)
Sư cái thiện có ý nghĩa thống kê các triệu chững 1âm sảng (đau và khó thớ) liên quan đến
11 trung b1ẻu mỏ mảng phồi ác tinh trong nhánh ALIMTAJ'cispIatin (212 bệnh nhân) so
với nhánh chi dùng c1splatin (218 bệnh nhân) đã được chưng minh khi dùng thang chia
độ triệu chứng ung thư phối. Đã quan sát thấy sự khảc nhau có ý nghĩa thống kê trong
các xét nghiệm chưc năng phỏi Đã đạt được sự phản tảch giũa các nhảnh điều trị dựa
trên sự cải thiện về chức năng phối trong nhánh ALIMTA/cisplaiin và sự xấu đi cùa chưc
năng phồi ớ nhảnh đối chứng theo thời gian.
Các dữ liệu về bệnh nhân có u trung biều mô mảng phổi ác tính dược diều trị bả
ALIMTA đơn đỏc còn hạn chế. ALIMTA đơn độc, liều 500 mgfm² được dùng cho 64
bệnh nhãn có u trung biều mỏ máng phổi ác tính chưa dùng hớa trị liệu truớc đớ. Tỷ lệ
đáp ưng tính chung là 14,1 %.
Ung thư nhối không tế bảo nho (NSCILĨ), tri 1iẽu thav thế (hảniz thứ hai):
Một nghiên cứu pha 3, đa trung tâm, nhãn mơ, ngẫu nhiên so sánh ALIMTA với
docetaxel ớ bệnh nhân NSCLC khu trú giai đoạn nặng hoặc di căn đã từng điều trị hoá
17
- `II-
chất cho thẳy thời gian sống sót trung binh lả 8,3 tháng đối với bệnh nhân điều trị với
ALIMTA (quần thể chủ đích điều tri n = 283) vả 7,9 tháng đối với bệnh nhân điều m với
docetaxel (n = 288).
Phân tich ánh hướng của NSCLC mô hợc tới hiệu quả điểu tri tinh chung trên thời gian/xẤPA/
sống sót cho thấy ALIMTA vượt trội docetaxel trong các trường hợp không phải chủ yếu`/Ổ
lả tế bảo vảy (n=399, 9,3 so với 8.0 thảng, HR hiệu chinh = 0,78; 95% C1 =0,61-1.00, p
=0,047) vả docetaxel vượt trội hơn trong carcmoma tế bảo vảy (n=172, 6,2 so với 7,4
tháng, HR hiệu chinh= 1,56; 95% C] =1,08-2,26, p =0,018). Không nhận thẳy có sự khác
biệt lâm sảng về độ an toản của ALIMTA trong từng phân nhóm theo mô học.
Cảc dữ Iiệu lâm sảng còn hạn chế từ một nghiên cứu pha 3 ngẫu nhiên có đối chứng độc
lập cho thấy hiệu quả lâm sáng (thời gian sống sót tỉnh chưng, thời gian sống sót không
mắc bệnh) của pemetrexed tuợng tự nhau ở các bệnh nhân trước đó đã điều trị bẳng
docetaxel (n=41) vả các bệnh nhân chưa được điều trị bằng docetaxel (n=540).
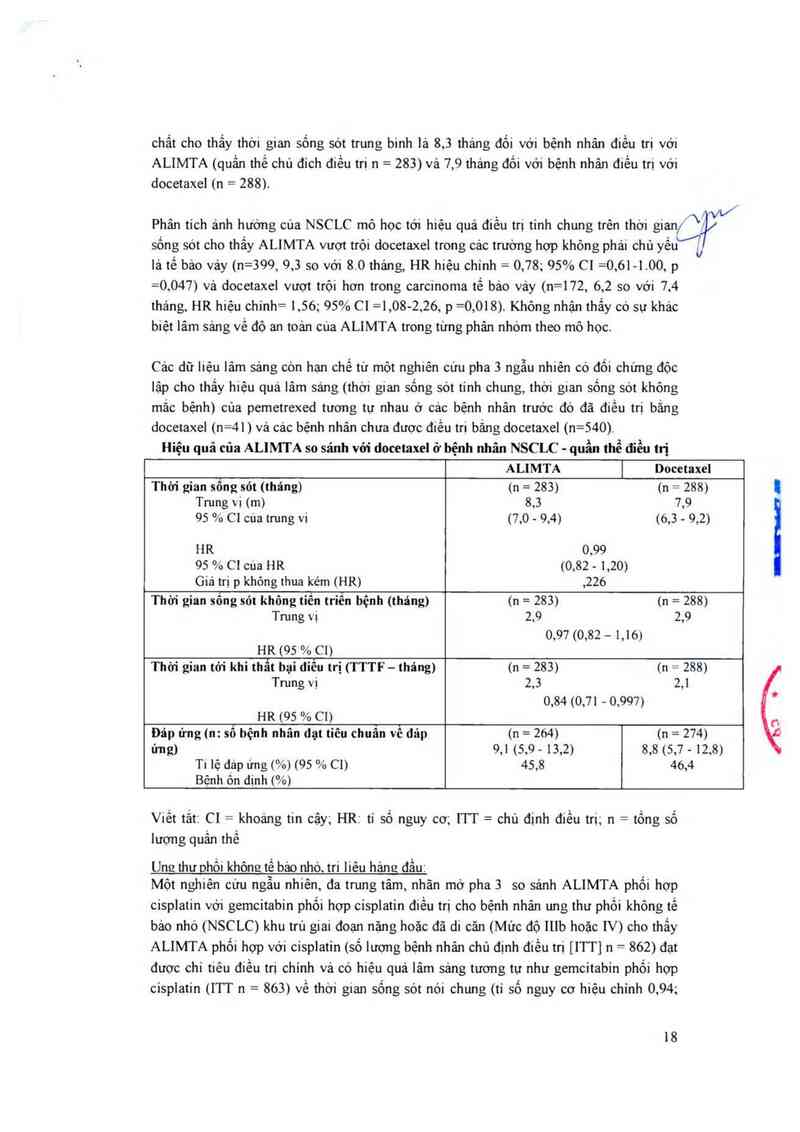
Hiệu quả của ALIMTA so sánh vói docetaxel ở bệnh nhân NSCLC - quần thể điều trị
ALIMTA [ Docetaxel
Thời gỉan sông sót (tháng) (n = 283) (11 = 288)
Trung vị (m) 8,3 7,9
95 % C1cuatrung vi (7,0 - 9,4) (6,3 - 9,2)
HR 0,99
95 % CI cua HR (0,82 - 1,20)
Giá trị p khỏng thua kém (HR) ,226
Thời gian sông sót không tiên triên bệnh (tháng) (11 = 283) (11 = 288)
Trung vị 2,9 2,9
0,97 (0,82 — 1,16)
H_R (95 % C1)
Thời gian tó1' khỉ thât bại điêu trị (TTTF — thảng) (n = 283) (11 = 288)
Tmng vi 2,3 2,1
0,84 (0,71 — 0,997)
HR (95 % C1)
Đáp ứng (11: số bệnh nhân dạt tiêu chuân vê dáp (n = 264) (11 = 274)
ứng) 9,1 (5,9 - 13,2) 8,8 (5,7 - 12,8)
T1 lệ đáp ứng (%) (95 % C1) 45,8 46,4
Bệnh ôn dịnh (%)
Viết tắt CI = khoáng tin cậy; HR: tỉ số nguy cơ; 111“ = chủ định điều trị; n = tống số
lượng quần thể
Ung thư ghối không tế bảo nhờ. tri liêu hảnE đầu: _
Một nghiên cưu ngân nhiên, đa trung tâm, nhăn mớ pha 3 so sảnh ALIMTA phỏi hợp
cisplatin với gemcitabin phối hợp cisplatin điều trị cho bệnh nhân ung thư phối không tế
bảo nhỏ (NSCLC) khu trú giai đoạn nặng hoặc đã di cãn (Mức độ 111b hoảc IV) cho thấy
ALIMTA phối hợp với cisplatin (số lượng bệnh nhân chủ định điều trị [ITT] n = 862) đạt
được chi tiêu điều trị chính vả có hiệu quả lâm sảng tương tự như gemcitabin phối hợp
cisplatin (ITT n = 863) về thời gian sống sót nói chung (tỉ số nguy cơ hiệu chỉnh 0,94;
18
95% C1 0,84-1,05) Tắt cả các bệnh nhân tham gia trong nghiên cứu nảy có khả nảng
thực hiện công việc ECOG tinh trạng 0 hoặcl.
Phân tich hiệu quá chủ yếu được dựa trên quẩn thề ITT. Phân tich dộ nhạy cảm cùa chi
tiêu hiệu quá chủ yếu cũng được đánh giá trèn quằn thể đạt được đùng đề cương nghiên
cưu (quần thể PQ), Phản tich hiệu quả trên quẩn thề PQ cho kết quả đồng nhất với khi
phân tich quần thể [TT và cho thấy AC không thua kém GC
Thới gian sống sòt không tiến triến bệnh (PFS) và tỉ lệ đáp ưng nói chung tương tự nhau
giữa các nhánh đtềU m: trung vi st là 4,8 tháng đối với ALIMTA phới hợp cisplatin vả
lả 5,1 tháng đối với gemcitabín phối hợp cisplatin (tỷ số nguy cơ hiệu chỉnh 1,04; 95%
CI 0,944,15), vả ti lệ đảp ứng chung là 30,6% (95% c1 27,5- 55,9) với nhóm ALIMTA
t cisplatin và là 28,2% (95% C1 25,0—31,4) với nhớm gemcitabin + cisplatin. Dữ liệu
… phấn nảo đó được khằng định bằng một đánh glá độc lập (400/1725 bệnh nhân được
lựa chon ngẫu nhiên để phóng vấn).
Phân tich sự ánh hướng cùa NSCLC mô học trên tỉ lệ sống sót nới chung cho thấy có sự
khác biệt trên lâm sảng vế ti tệ sống sót tuỳ thuộc mô hợc, xem bảng dưới đây.
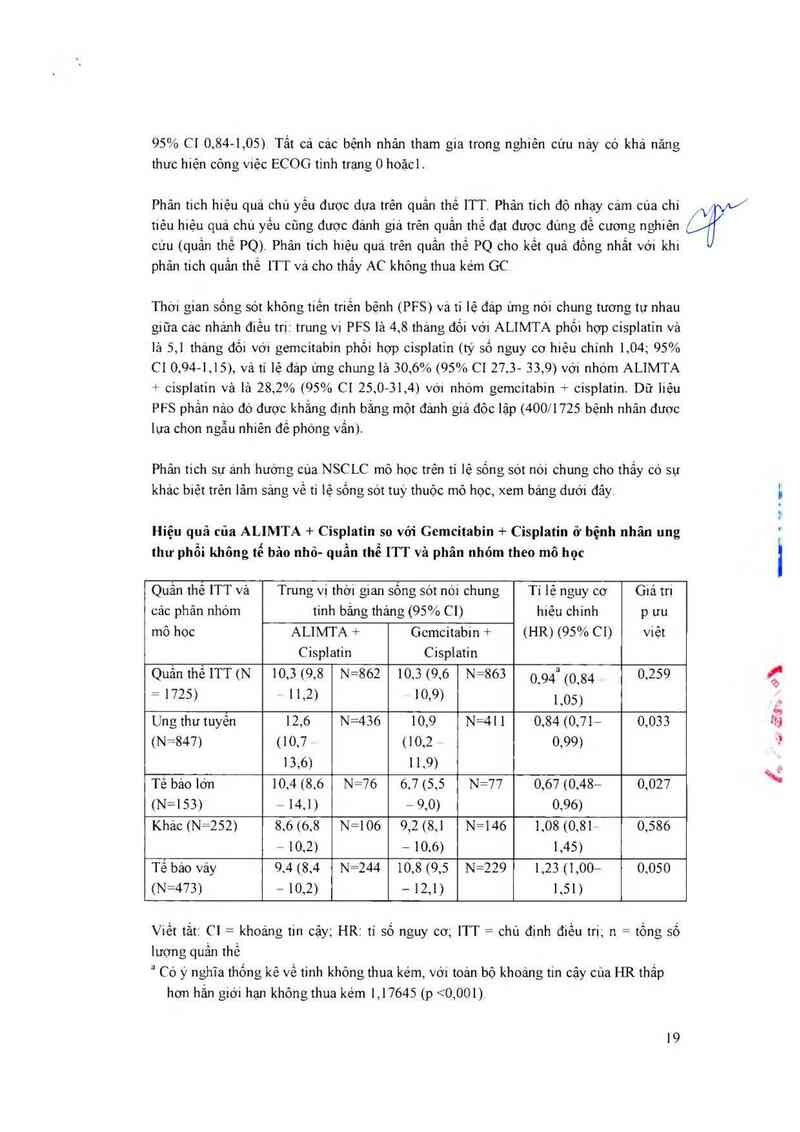
Hiệu quả của ALIMTA + Cisplatin so với Gemcitabin + Cisplatin ở bệnh nhân ung
thư phổi không tế bâo nhỏ— quần thể ITT và phân nhóm theo mô học
cffl“
Quân thê ITT và Trung vị thời gian sống sót nới chung Tỉ lệ nguy cơ Giá trị
cảc phân nhóm tinh bắng tháng (95% C1) hiệu chinh p ưu
mô hoc ALIMTA + Gcmcitabin + (HR) (95% C1) việt
Cisplatin Cisplatin
Quắn thề ITT (N 10,5 (9,8 N=862 10,5 (9,6 N=863 0`94² (0`84 0,259
= 1725) 11,2) 10,9) 1,05)
Ung thư tuyển 12,6 N=436 10,9 N=41 1 0,84 (0,71- 0,055
(N=847) (10,7 (10,2 0,99)
13,6) 11,9)
Tê báo lớn 10,4 (8,6 N=76 6,7 (5,5 N=77 0,67 (0,48— 0,027
(N=153) - 14,1) — 9,0) 0,96)
Khác (N=252) 8,6 (6.8 N=106 9,2 (8,1 N=t 46 1,08 (0,81= 0,586
— 10,2) — 10,6) 1,45)
Tê bảo vảy 9.4 (8,4 N=244 10,8 (9,5 N=229 1,23 (1,00— 0,050
(N=473] — 10,2) — 12,1) 1,51)
Viết tắt: Cl = khoảng tin cậy; HR: tỉ số nguy co; ITT = chủ đinh điều m, n = tồng số
luợng quấn thề
“ Có ý nghĩa thống kê về tinh không thưa kém, vời toản bộ khoảng tin cậy cùa HR thấp
hơn hẳn giới hạn không thua kém 1,17645 (p <0,001)
19
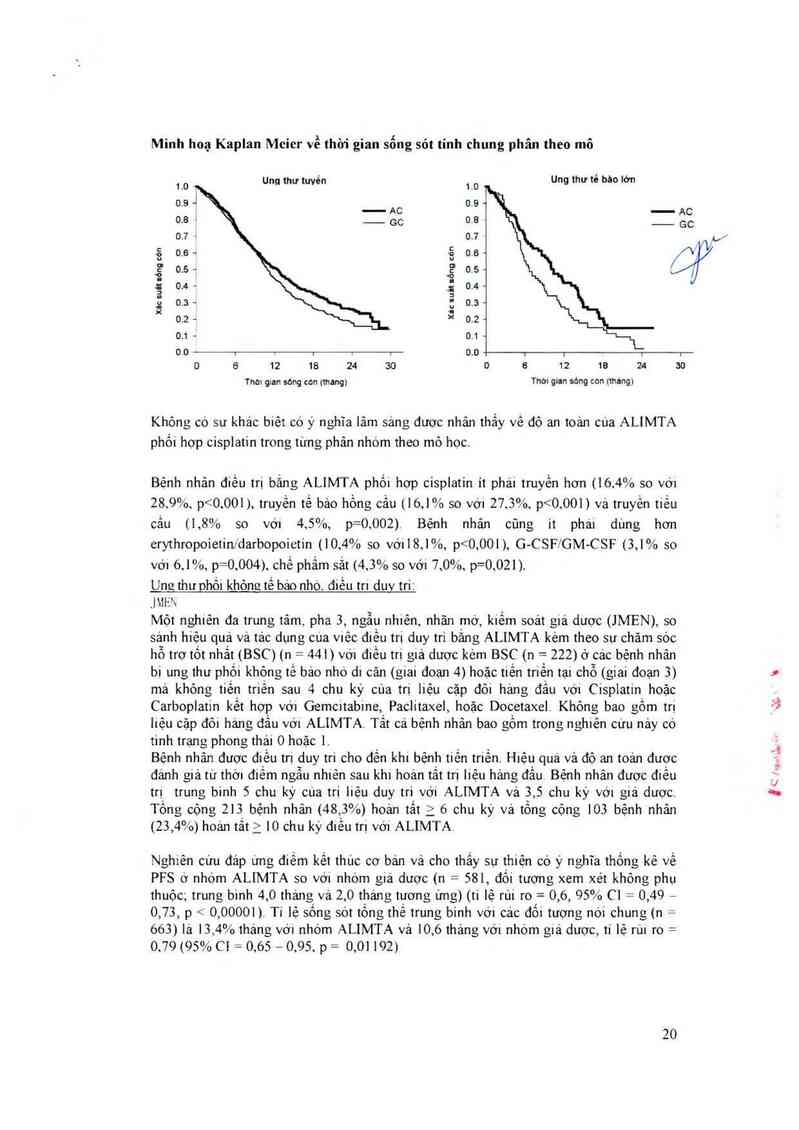
Minh hoạ Kaplan Mcicr về thời gian sống sỏt tinh chung phân theo mô
Ung) thư tuvến Ung thư té bâo lớn
10 1.0 )
0.9 7
_ AC
0,8 GC
07 ,,
_ả_ ẵ 0.6 ~ /\
u u _
.ẵ "ẵ 0.5
ị _g 0.4 -
u Ễ
ệ .: 0.5 -
x 0.2 —
0.1 = 0.1 ~
0.0 i i 1 … 1 0,0 1 1 l
0 6 12 18 24 30 0 6 12 19 24 30
Thơ1 glll'1 sóng c0n (thang) Thời gian sóng con (_thảng)
Không có sư khảc biẽt có ý nghĩa lâm sảng đuợc nhân thắy về độ an toản cùa ALIMTA
phối hợp cisplatin trong từng phân nhớm theo mô hợc.
Bệnh nhân diẽu 111 bằng ALIMTA phối hợp cisplatin it phải truyền hơn (16,4% so với
28,9%. p<0,001 ), miyèn tế bảo hồng cầu (16,1% so với 27,5%. p<0,001) và truyền tiều
cằu (1,8% so với 4,5%, p=0,002). Bệnh nhân cũng it phái dùng hơn
crythropoietim'darbopoictin (10,4% so vớ118,1%, p<0,001), G-CSFKìM-CSF (3,1% so
với 6,1%, p=0,004), chế phẩm sắt (4.5% so với 7,0%, p=0,021 ).
Ung thư phới khớmz tế bảo nhớ, đlều … duv tri:
l\-1FN
Một nghiên đa trung tâm, pha 3, ngẫu nh1ên,nhãn mớ, kiềm soát giá dược (JMEN), so
sánh hiệu quả vả tảc dụng cưa Việc điều trị duy tri bắng ALIMTA kèm theo sự chăm sóc
hỗ trợ tốt nhất (BSC) (n — 441) với điều trị giá dược kèm BSC (n = 222) 0 các bệnh nhân
bị ung thư phối khộng tế bảo nhờ di cản (giai đoan 4) hoặc tiến triến tại chỗ (giai đoạn 3)
mà không tiên triên sau 4 chu kỳ cùa trị liệu cặp đôi hảng đầu với C1sp1atin hoặc
C arboplatm kết hợp với Gemcitabine, Paclitaxel, hoặc Docetaxel. Không bao gôm tri
Iiệu cặp đôi háng đẩu với ALIMTA. Tất cả bệnh nhân bao gồm trong nghiên cưu nảy có
tinh trạng phong thái 0 hoặc 1.
Bệnh nhân được điều trị duy trì cho đến khi bệnh tiền triền. Hiệu quả vả độ an toả.n được
đánh giá từ thời điếm ngẫu nhiên sau khi hoản tắt trị liệu hảng đầu. Bệnh nhân được điều
tri trung binh 5 chu kỳ cua trị liệu duy tri với ALFMTA vả 3,5 chu kỳ VỚI giả dược.
TỔng cộng 215 bệnh nhân (48,3%) hoản tắt ì 6 chu ky vả tổng cộng 105 bệnh nhân
(25,4%) hoản tẩt z 10 chu kỳ điều m với ALIMTA.
Nghiên cứu đáp ưng điềm kết thủc cơ bản và cho thấy sự thiện có ý nghĩa thống kê về
PFS 6 nhóm ALIMTA so với nhóm giả dược (n — 581, đối tượng xem xét khỏng phụ
thuộc; trung binh 4 ,0 tháng vả 2 ,0 tháng tương ưng) (ti lệ rùi ro = 0, 6, 95% Cl= 0 49 -
0 73, p< 0 ,00001) Tỉ lệ sông sớt tỏng thề trung binh với các đối tượng I1Ó1 chung (11 —
663) là 13 4% thảng với nhóm ALIMTA và 10, 6 thảng với nhóm giả dược ti lệ rùi ro— =
0,79(95%C1= 0,65— 0,95, p= 001192)
20
Im…c. -
Phù hợp với các nghiên cứu ALIMTA khảc, sự khác nhau về hiệu quả theo NSCLC mỏ
hợc được quan sát thấy trong J MEN. Ở các bệnh nhân với NSCLC chủ yếu trừ mô tế bảo
hinh vảy (n = 430, không phụ thuộc vảo đôi tượng xem xét) PFS trung binh là 4,4 thảng
với nhóm ALIMTA và 1,8 thảng với nhóm giá dược, tỉ lệ rùi ro= 0,47 (95% CI= 0,37
0,60, p= 0 ,00001) Ti le sông sót tống thể trung binh ở cảc bệnh nhân với NSCLC chu
yếu trừ mộ tế bảo hinh vảy (n= — 481) lả 15,5% tháng với nhóm ALIMTA và 10, 3 tháng
với nhóm giả dược, tỉ lệ rủi ro = 0,70 (95% CI= 0 56— 0,88, p= 0,.002) Bao gồm pha
cảm ưng tỉ lệ sống sót tổng thể với cảc bệnh nhân NSCLC chủ yếu trừ mô tế bảo hinh
vảy lả 18 ,6 tháng vời nhóm ALIMTA và 13,6 thảng với nhóm giả dược, tỉ lệ rủi ro =
0,71 (95%C1= 0,56— 0,88, p= 0,.002)
Cảo kết quả PFS vả OS ở cảc bệnh nhân với mô tế bảo hình vảy không cho thẳy lợi ich
của ALIMTA so với giả dược
Không thấy có sự khảc biệt có ý nghĩa lâm sảng về độ an toản cùa Alimta trong cảc phân
nhóm theo mô học.
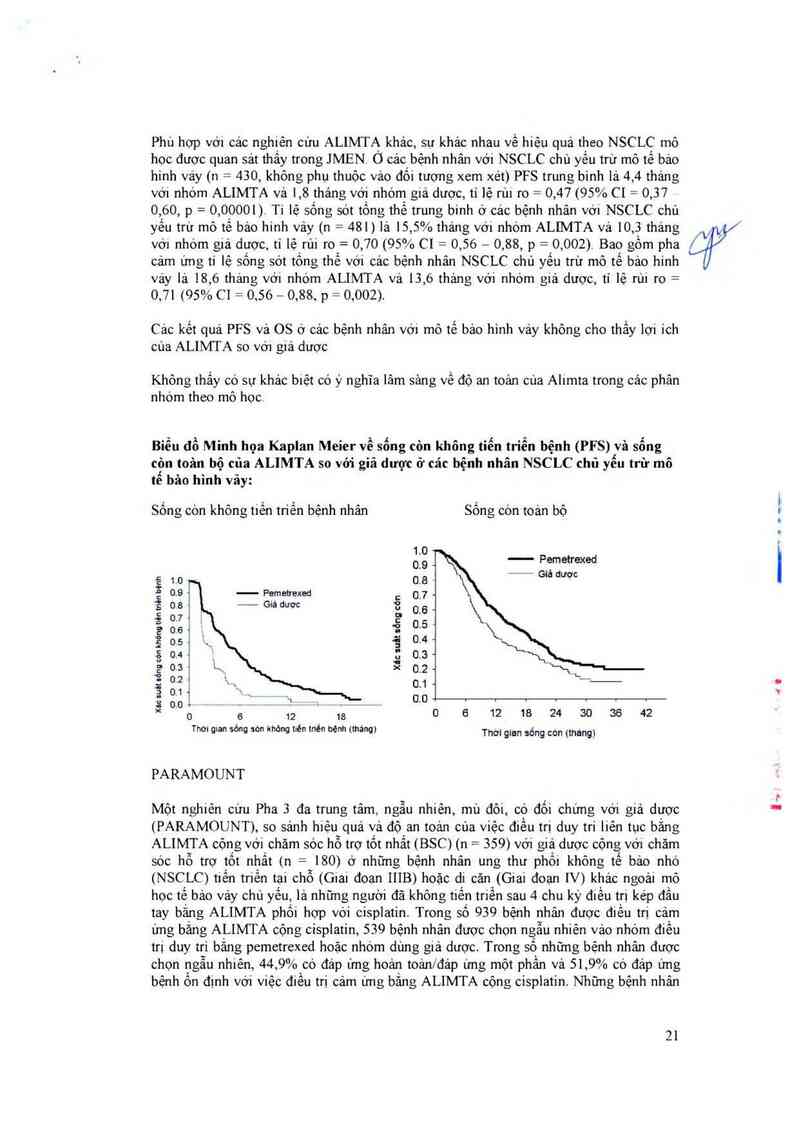
Biểu đồ Minh họa Kaplan Meier về sống còn không tỉến triễn bệnh (PFS) vã sổng
còn toân bộ cũa ALIMTA so với giả dược ở cảc bệnh nhân NSCLC chủ yếu trừ mô
tể bâo hình vảy:
Sống còn không tiến triển bệnh nhân Sống cớn toản bộ
1.0
0.9
1.0 0.8
Pernetrexed 0_7
—— Giá dươc
— Pemetrexed
Giả duợc
0.6
0.5
0.4
0.3
0.2
0.1
' 0 6 12 18 0 6 12 18 24 30 36 42
Thơ: man sòng sòn khan tiên tnén benh (tháng)
Xtc suât sóng còn
xac wlt ơông cen knong tlòn trth bỷnh
Thơi gian sống còn (tháng)
PARAMOUNT
Một nghiên cứu Pha 3 đa trung tâm, ngẫu nhiên, mù đôi, có đối chứng với giả dược
(PARAMOUNT), so sánh hiệu quả vả độ an toản của việc điều trị duy tri liên tục bằng
ALIMTA cộng với chăm sóc hỗ trợ tốt nhất (BSC) (n = 559) với giả dược cỏng với chăm
sóc hỗ trợ tốt nhất (n = 180) ở những bệnh nhân ung thư phổi khỏng tế bảo nhỏ
(NSCLC) tiến tn'ền tại chỗ (Giai đoạn 11115) hoặc di cãn (Giai đoạn IV) khác ngoải mò
hợc tế bảo vảy chủ yếu, là những người đã không tiến triền sau 4 chu kỳ điều trị kép đầu
tay bắng ALIMTA phối hợp vói cisplatin. Trong số 939 bệnh nhân được điều trị cảm
ưng bằng ALIMTA cộng CÌSplatin, 539 bệnh nhân được chọn ngẫu nhiên vảo nhóm điều
trị duy tri bắng pemetrexed hoặc nhớ… dùng giả dược. Trong số những bệnh nhân được
chọn ngẫu nhiên, 44,9% có đáp ửng hoản toảnl'đáp ứng một phẩn và 51,9% có đảp ưng
bệnh ốn định với việc điều trị cảm ứng bằng ALIMTA cộng cisplatin. Những bệnh nhân
21
CẩWj
~:
được chon ngẫu nhiên vảo nhóm điều trị duy tri cần phải có điếm số về tinh trạng hoạt
đỏng cơ thể theo thang điêm cùa ECOG (Nhóm Hợp tảc về Ung thư phương Đõng) lả 0
hoặc 1. Thời gian trung binh từ lùc bắt đấu trị liệu cám ứng bằng ALIMTA cộng
cisplatin đến khi bắt đầu điều tri duy tri lả 2,96 tháng 6 cả nhóm dùng pemetrexed và
nhớ… dùng giá dược. Những bệnh nhân được chon ngẫu nhiên đã được điếu tn duy tri
cho đến khi bệnh tiến triến. Hiệu quả vả độ an toản đã được đảnh giả từ thời điềm chọn
ngẫu nhiên sau khi họán thánh tri 1iệu (cám ưng) đẳu tay. Cảc bệnh nhân nhận được
trung binh 4 chu kỳ điêu trị duy tri bằng ALIMTA và 4 chu ký bằng giá dược. Tống cộng
có 169 bệnh nhân <47.1%› đã hoán thảnh a 6 chu kỳ điều mị duy … bắng ALIMTA, đại
diện cho it nhất tống cộng 10 chu kỳ ALIMTA.
Nghiên cứu đã đảp ưng tiêu chí đánh giá chinh vả cho thấy sự cải thiện có ý nghĩa thống
kê về thời gian sống cờn không tiến triền bệnh (PFS) ở nhóm ALIMTA nhiều hơn nhóm
giả dược (n = 472, nhớmâ được xem xét đòc lập; trung binh 3,9 tháng và 2,6 tháng, theo
thứ tự tương ưng) (tỳ sô nguy cơ= — 064, khoảng tin cậy (C1) 95%= — 0,51 -,,081 p= =
0 0002) Xem xe't đỏc 1ập vê chụp hinh ánh bệnh nhân đã xác nhận các kềt quả đảnh giả
cùa nhà nghiên cưu vẻ thời gian sống cờn không tiến triến bệnh. Đối với những bệnh
nhân được chọn ngẫu nhiên như đã được đảnh giá từ lùc bắt đầu điều tn cảm ưng đẳu
tay băng ALIMTA cộng cisp1atin. thời gian sông còn khỏng tiến triền bẻnh trung binh
theo đảnh giả cúa nhả nghiên cưu là 6,9 thảng đối với nhóm dùng ALIMTA vả 5,6 thảng
đối với nhóm dùng giả dược (ty số nguy cơ = 0,59, khoáng tin cậy (C1) 95% = 0,47-
0,74),
Sau khi trị liệu cảm ứng bằng ALIMTA cộng cisplatin (4 chu kỷ), việc điều tri bắng
ALIMTA trội hơn có ý nghĩa thống kê so VỚI giả dược vẽ thời gian sòng cờn toản bộ
(OS) (tnmg binh 13,9 thảng so với 11 ,0 tháng, tỳ sô nguy cơ= 0, 78, khoảng tin cậy (C1)
95% — 0, 64- 0, 96, p= -0 ,.0195) Tai thời điếm phân tich sông còn cuối cùng, 28,7% bệnh
nhãn cờn sống hoặc mất theo dõi ớ nhớm ALIMTA so với 21,7% ở nhóm giả dược Hiệu
qua` điều tri tương đối của ALIMTA lả nhắt quán giữa cảc phân nhóm (bao gồm giai
đoạn bệnh đáp ưng với trị liệu cảm ứng, tinh trạng hoạt động cơ thể theo thang điềm cùa
ECOG tinh trạng hùt thuốc lá. giới tính mô học vá tuối) vả giống như đã quan sảt thấy
trong phân tich thời gian sống còn toản bộ (OS) và thời gian sỏng con không tiến triên
bệnh (PFS) chưa điều chinh Tỷ lệ sống còn 1 nảm và 2 năm đối với bệnh nhân đang
dùng ALIMTA lả 58% vả 32% theo thư tự tương ứng, so với 45% vả 21% đối với bệnh
nhân dùng giả dược. Từ lùc bắt đẩu điều trị cảm ứng đầu tay bắng ALIMTA cỏng
ClSplatin, thời gian sống cờn trung binh cùa bệnh nhân lả 16,9 tháng đối với nhóm
ALIMTA và 14, 0 tháng đối với nhóm giả dược (tỷ số nguy cơ= 0 ,78, khoáng tin cậy
(C1) 95% = 0,64-0,96) Tỷ lệ phần trăm bệnh nhân nhận được điều tri sau nghiên cứu lả
64,3% đối với nhóm ALIMTA và 71,7% đối với nhóm giả dược.
PARAMOUNT: Biểu đồ Kaplan Meiet về sống còn không tiểu triễn bệnh (PFS) vả
sống còn toản bộ (OS) đối với điều ti1 duy tiì tiểp tục bằng ALIMTA so với giả
dượt 6 bệnh nhãn ung thư phổi không tế bảo nhỏ (NSCLC) khác ngoải mô học tế
bâo vảy chủ yếu (được đảnh giả từ chọn ngẫu nhiên)
22
Sóng con Khòng tiên triến bệnh Sóng cớn toan bộ
' 0 iii
0 9 | 03
0 8 l _ Pemetrexed
… Glè dược
— Pemeừexed
, -~-— Giả dược
0 7 !
o 6 1
o s «}
o 4 {
o 3 1
o 9 {
o 1 1
o 0 L
G ² 6 ² 1² 15 ons1zisioziunmnis
Thời gian sổng còn khóng tiên triền bệnh íac suâtsỏng CÙI' khòng tiẻn :r ền bẻnh
Xac 5uảt sỒng cùn toan bó
e
ồ
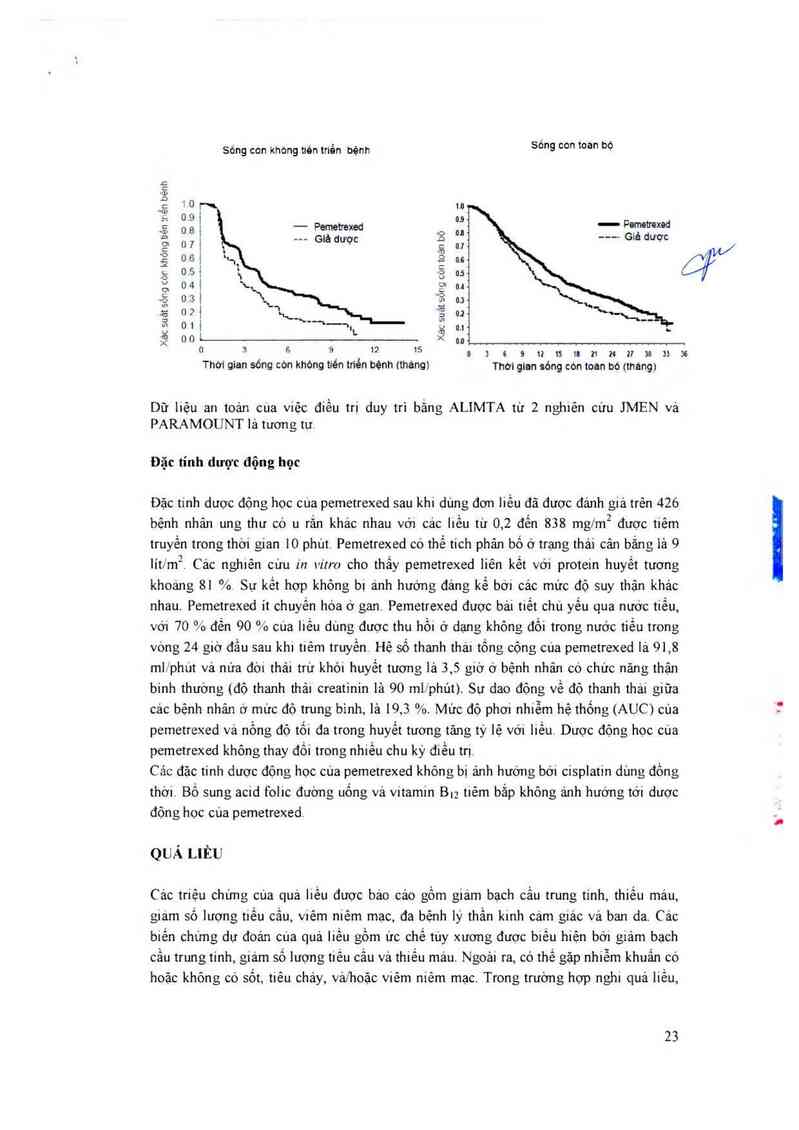
Dữ liệu an toản cùa việc điều trị duy trì bằng ALIMTA từ 2 nghiên cứu JMEN vả
PARAMOUNT 1ảtương tự.
Đặc tinh dược động học
Đặc tinh dược động hoc cùa pemetrexed sau khi dùng đơn liều đã được đảnh giá trên 426
bệnh nhân ung thư có u rắn khảc nhau với cảc Iiều tư 0,2 đến 838 mglm2 được tiêm
truyền trong thời gian 10 phút. Pemctrexed có thể tích phân bố ở trạng thái cân bằng lẻ 9
líti`mz. Các nghiên cứu [n vitro cho thấy pemetrexed liên kềt với protein huyết tương
khoang 81 % Sự kểt hợp khỏng bi ánh hưởng đáng kể bời cảc mức đó suy thận khảc
nhau. Pemetrexed ít chuyến hớa ớ gan. Pemctrexed đuợc bải tiết chủ yếu qua nước tiểu,
với 70 % đến 90 % cưa liều dùng được thu hồi ớ dạng không đối trong nước tiểu trong
vờng 24 giờ đầu sau khi tiêm truyền. Hệ số thanh thái tồng cộng cùa pemetrexed lả 91,8
m1i'phưt vả nứa đòi thải trừ khói huyết tương 1ả 3,5 giờ ở bệnh nhân có chừc năng thận
binh thường (độ thanh thải creatinin là 90 mlfphút). Sự dao động về độ thanh thái giữa
cảc bệnh nhân ở mưc độ trung bỉnh, là 19,3 %. Mức độ phoi nhiễm hệ thống (AUC) cùa
pemetrexed vả nống độ tối da trong huyết tương tãng tỷ lệ với liều. Dược động học cùa
pemetrexed không thay đối trong nhiều chu kỳ điều tri.
Cảo đặc tinh dược động hoc cưa pemetrexed khỏng bị ảnh hướng bời cisplatin dùng động
thời. Bô sung acid folic đuờng uống và vitamin B.; tiêm bắp khỏng ánh hướng tới dược
động hoc cùa pemetrexed.
QUÁ uÊu
Các triệu chứng cua quá liều được báo cảo gồm giám bạch cẳu trung tinh, thiếu mảu,
giam số lượng tiếu cầu, viêm niêm mạc, đa bệnh lý thần kinh cám giác vả ban da. C ảc
biền chưng dự đoản cùa quá Iiều gồm ưc chế tuy xương được biền hiện bới giảm bạch
cầu trung tinh, giám số lượng tiêu cầu và thiếu máu. Ngoài ra, có thể gặp nhiễm khuẩn có
hoặc không có sốt, tiêu chảy, vả/hoặc viêm niêm mạc. Trong trường hợp nghi quá liều,
23
phải theo dõi bệnh nhân, kiềm tra công thức máu vả thực hiện liệu phảp hỗ trợ khi cần.
Cân nhắc việc sử dung calci folinat / acid folinic trong điều trị quá liểu pemetrexed.
TƯONG KY ' _ ›
Pemetrexed tương kỵ vật lý với chât pha loãng chửa calci, bao gôm Thuôc tiêm Ringer
lactat vả Thuốc tiêm Ringer Vi khòng có các nghiện cứu về tương hợp (với cảc thuốc vả
chất pha loãng khảc), không được trộn lẫn sán phẳm thuốc nảy với cảc sản phẩm thuốc
khảc.
HẠN DÙNG Ốýy/
Lọ chưa mở nắp
36 thảng kể từ ngảy sản xuất.
Dung dịch hoản nguyên và dung dịch để truyền: Khi được tiến hảnh theo đùng chỉ
dẫn, dung dịch hoản nguyên vả dung dich đề truyền ALIMTA không có chất bảo quản
khảng khuấn. Độ bền vững vật lý và hoá học cùa dung dịch hoản nguyên vả dung dich để
truyền ALIMTA vừa chuẩn bị đã được chứng minh trong 24 giờ nếu bảo quản trong tủ
lạnh hoặc ở nhiệt độ 25°C. Xét theo khía cạnh vi sinh vật, sản phấm phải được sử dung
ngay. Nếu khỏng dùng ngay lập tức, điều kiện bảo quản và thời gian bảo quản trước khi
sử dung là trảch nhiệm của người sư dụng thuốc vả thông thường không được quá 24 giờ
ớ nhiệt độ 2 đến 8°C , trừ khi việc hoản nguyẻn/pha loãng thuốc được tiến hảnh trong khu
vực vô trùng được kiếm soát vả đảm bảo.
THẬN TRỌNG ĐẶC BIỆT TRONG BẤO QUẢN
Lọ chưa mở: Bảo quản dưới 30°C.
Chế phẩm sau khi đã hoản nguyên: Xem điều kiện bảo quản của chế phẳm sau khi
hoản nguyên trong phần Han dùng
Để xa tầm tay trẻ em,
THẬN TRỌNG ĐẶC BIẸT VỀ TIÊU HÙY VÀ LƯU THÔNG
1. Dùng kỹ thuật vỏ khuẩn trong khi hoản nguyên và pha loãng pemetrexed đề tiêm
truyền tĩnh mạch.
2. Tính Iiều vả số lọ ALIMTA cằn dùng. Mỗi lọ chứa một lượng dôi pemetrexed để
dễ lấy lượng thuốc ghi nhãn.
3. Hoản nguyên lọ 500 mg với 20 ml dung dịch natri clorid 9 mng (0,9 %) đế
tiêm, không có chẳt bảo quản, tạo thảnh dung dịch chứa 25 mg/ml pemetrexed.
Lắc xoáy lọ nhẹ nhảng tới khi bột hòa tan hoản toản. Dung dịch thu được trong
vả có mảu thay đồi từ khỏng mảu đến vảng hoặc xanh lá cây—vảng mả không ánh
hướng dến chất lượng cùa sản phấm. Dung dịch hoản nguyên có pH giữa 6,6 và
7,8. Cần có sự pha Ioãng.
24
_v
4. Thế tich thích hợp cùa dung dịch hoản nguyên pemetrexed phải được pha loãng
thảnh 100 ml bằng dung dich natri clorid 9 mg/ml (0,9 %) đế tiêm, không có chẳt
bảo quản, và được tiêm truyền tĩnh mạch trong 10 phút.
5. Các dung dich tiêm truyền pemetrexed được pha như chỉ dẫn ở trên tương hợp
với cảc bò tiêm truyền vả cảc túi tiêm truyền trảng polyvinyl c1orid vả polyoletìn.
o. Cảc sản phẩm thuốc tiêm phải được kiểm tra bắng mắt về chất lạ và sự đổi mảu w/
trước khi dùng. Nếu quan sảt thẳy chất lạ, không được dùng. Cý/
7. Các dung dich pemetrexed chỉ để dùng một lần. Phần sản phẳm khỏng dùng hoặc
vặt liệu thái phải vưt bỏ theo đímg cảc yêu cầu cùa địa phương.
Thận trọng trong pha chế và dùng thuốc: Cũng như với các thuốc chống ung
thư có khả năng gây độc khác, phải thận trong khi thao tảc và pha các dung dich
tiêm truyền pemetrexed. Nên sử dụng găng tay. Nếu dung dịch pemetrexed tiếp
xúc với~da, rửa da ngay thật kỳ với nước và xả phòng. Nếu cảc dung dịch
pemetrexed tiếp xúc với niêm mạc, giội nước cẳn thận để rừa. Pemctrexed khỏng
phải lả chẳt lảm giộp da, Không có thuốc giải độc đậc hiệu cho sự thoát mạch
pemetrexed. Một số ít trường hợp thoát mạch pemetrexed đã được bảo cảo, tuy
nhiên không được nhà nghiên cứu đảnh giá lả nghiêm trong Sự thoát mạch cần
được điều trị theo thực hảnh chuẩn ớ địa phướng giống như với các thuốc không
gây giộp da khác.
SÁN XUẤT BỜ]:
LILLY FRANCE
2 rue du Colonel Lilly
67640 Fegersheim
FRANCE
PHÓ cục TRUỞNG
25
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng