
























BỘ Y TẾ _
CỤC QUẦN LÝ DỄ—_
……—-———-_
ĐIẮ PHÊ DU K › ~
Lản dáuỚtijj/íg
ALIMTA
pumetrexeci
fOr uuectưon
mm
-opcneđ vn]: Do not none above Jo'C
ct recmm'naion: Ston- ni 2'C - 8'C.
st be used ưithia 24 hours.
ummmm
Lilly and Company
hmpolh. [N 46285. USA.
'MCODE
ALRP INFORMATION
ẸXPJJATE EXP
BATCH NQ ……
MFẹ DATE Mfg Dạiẹ› …
AFF BARCODE TYPE' .] UPC .J EAN .] DATAMATRIX
._J R_ss ụ… .: omen __
PACKAGING SÍTE .! INDY DRY ] PDA? J OTHER
OỈHER REGULATED ITEMS N"A
@
GRAPHICS
COLORS:
Btack
485
1 4 …!
CREATED BY SKC Date 22 Apr 2016
ITEM CODE & VERSION NO NLOOBIPVNOO P2Vl
SUPERSEDES NIA
DIE NO C—5726 (C-5726 l2.Ali
VENDOR DRAWING NO 261010
VIEW PRINTED SIDE UP
DIMENSIONS' L—43 mm. W<46 mm. D-66 mm
VERSION
DIE ID
ENG|NEERING ID
\
fi
/_ẤJẢN PHONG
DAIDIÉN Ẹ}
IAITP HA NÒI `ỵ
ALIMTA
pemetrexed
for m;ection
Bỏtđỏngkhỏpiuđtmgdưhtứmtmyẻn.
ÙIÍ đùng tiêm truyền tỉnh mạch
Mổi lọ chín Im mg pemclmeđ
tdưới đạng pemcưexeđ dnmn
heptahydmì
Chi dịnh. cách đủng. chông chi đmh
u cic thóng tin khảc
xin xem tò Hường dẳn sử dụng
ut XATẢM TA\ TRẺ EM
ALIMTA'
pemetrexed
for injectcon
Bin qnil:
LọC chua mơ Bao quan u nhuẻt Jỏ khủng qua'
Sauckhipha Báoquánởlb RC Phai…
dunnưmz~ỏnsN ĐỎ
sátasxmsx un. xm ư… Loi ur; o…
Exp nénbuub bi
SDK: XXXX
Sinmítbởl:lỉlc Lilly lnd Company“
lndmmpolu. IN mas. Ms
ALIMTA”
pemetrexed
tor injection
DỌC KỸ nướxc nh sử DỤNG DNNK: xxxx
mước K… DỦ xc.
THUỐC DỌC .
\
r//i
' u
i i '
ì _ |
6622 lì ỷ r
|
, _1
ỷ" vbAr—t PHÒNG
__ hmbjịnhẹ
'_ \JA' :' P … Nồi
\ &
z " .
\~Y " __Ạ_/\ĨJ
\
o
ALIMTA®
Không dùng thuốc sau ngây hết hạn ghi trên vỏ hộp.
Thuốc nây chi đùng theo đơn cũa bác sỹ.
Đọc kỹ hướng dẫn sử đụng trưởc khi dùng.
Nếu cần thêm thông tin. vui lòng liên hệ bảc sỹ cũa bụn.
Thông bảo ngay cho bảc sỹ hoặc dược sỹ những tảc đụng không mong muốn gặp phâi khi sử
dụng thuốc.
muộc ĐỌC.
]. TÊN THUỐC
ALIMTA"
z. THÀNH PHẢN ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
Thảnh phần hoạt chẳt: Mỗi lọ chứa 100 mg pcmctrcxed (dạng pemetrexed dinatri heptahydrat).
Sau khi hoản nguyên (xem mục 7.4 “Thận Irọng đăc biệt Irong liêu hủy vả các lhao tác khác“”)t mỗi
lọ chứa 25 mglml pemetrexed.
Thảnh ghần tả dưỵ: Manitol. dung địch acid hydrocloric 10%. dung dich natri hydroxyd 10%. nước
pha tiêm.
3. DẠNG BÀO cui:
Bột đông khô để pha dung dịch tiêm truyền.
Bột đông khô mảu trắng đến vảng nhạt hoặc vâng xanh lá cây.
4. QUY cÁcn ĐÓNG GÓI
ALIMTA đóng trong hộp ] lọ.
s. cÁc ĐẶC TÍNH DƯỢC LỰC HỌC VÀ DƯỢC ĐỌNG HỌC
5.1. Câc đặc tính dược lực học
Nhóm dược trị liệu: cảc chắt tương tự acid folic. mã ATC : LOI BAO4.
ALIMTA (pemetrexed) là một thuốc khảng folat chống ung thư nhắm vảo da đich. có tác đụng là
nhờ phá vỡ cảc quá trình chuyến hóa chủ yếu phụ thuộc folat cần thiết 0 sa chép tế bảo.
Cảc nghiên cứu in virro cho thẩy pemctrexed có tác dụng của một thuốc folat nhắm vảo da
đích bầng cảch ức chế thymidylat synthase (TS). dihyđrofolat reductase (DHFR). vả glycinamid
ribonucleotid formyltransferase ( GARFT)` lả những enzym chủ chốt phụ thuộc folat cho con đường
de novo sinh tống hợp thymidin vả các purin nucleotid. Pcmctrcxed được vận chuyền vảo trong tế
.\
,› v' "
ỉ“f“
lắJ
bảo bời cảc hệ thống chẩt mang khử folat vả vận chuyến protein gắn kết folat qua mảng. Một khi ở
trong tế bảo. pemetrexed được chuyển đổi nhanh vả vởi hiệu suất cao thảnh các đạng polyglutamat
bời enzym folylpolyglutamat synthetase. Cảc dạng polyglutamat được giữ trong tế bảo vả còn là
nhũng chẩt ức chế TS vả GARFT mạnh hơn. Sự đa glutamat hóa là một quá trình phụ thuộc vâo
thời gian vả nồng độ xảy ra trong cảc tế bảo u. vả ở mức độ ít hơn. trong cảc mô binh thường. Cảo
chẳt chuyển hòa đa—glutamat hóa có sự tâng nửa đời trong tế bảo dẫn đểu sự kéo đải tảc dụng cùa
thuốc trong cảc tế bảo ung thư.
Cơ quan y tế châu Ẩu đã hoãn nghĩa vụ nộp các kểt quả nghiên cửu của ALIMTA trên tẩt cả các
phân nhóm trẻ cm trong các chỉ định điều trị đã được phê duyệt (xem mục 6.2 "Liều dùng vả cách
dùng ").
Hiệu gui lâm sùng:
U trung biền mô:
EMPHACIS. một nghiên cứu pha 3 đa trung tâm, ngẫu nhiên, mủ đơn so sánh ALIMTA kết hợp
cisplatỉn vởi cisplatin đơn độc ở bệnh nhân có n trung biền mô mảng phối ảc tính chưa dùng hỏa trị
liệu, cho thẩy bệnh nhân điều trị với ALIMTA vả cisplatin có trung vị thời gian sống còn có ý nghĩa
lâm sảng vuợt trội 2.8 tháng so với bệnh nhân chi dùng cisplatín.
Trong nghiên cứu. bệnh nhân được bổ sung thêm acid folic vả vitamin Bu liều thấp để iảm giảm
độc tinh. Phân tích chính cùa nghiên cứu nảy được thực hiện trên quần thể tẩt cả bệnh nhãn được
chỉ định ngẫu nhiên vảo một nhóm điểu tri. đùng thuốc nghiên cứu (ngẫu nhiên vả đìếu ui). Phân
tích phân nhóm được thực hiện trên bệnh nhân được dùng bổ sung acid folic vả vitamin B); trong
toản bộ nghiên cứu (được bổ sung đầy đủ). Kết quả của các phân tích về hiệu quả nảy được tỏm tắt
trong bảng dưới đây:
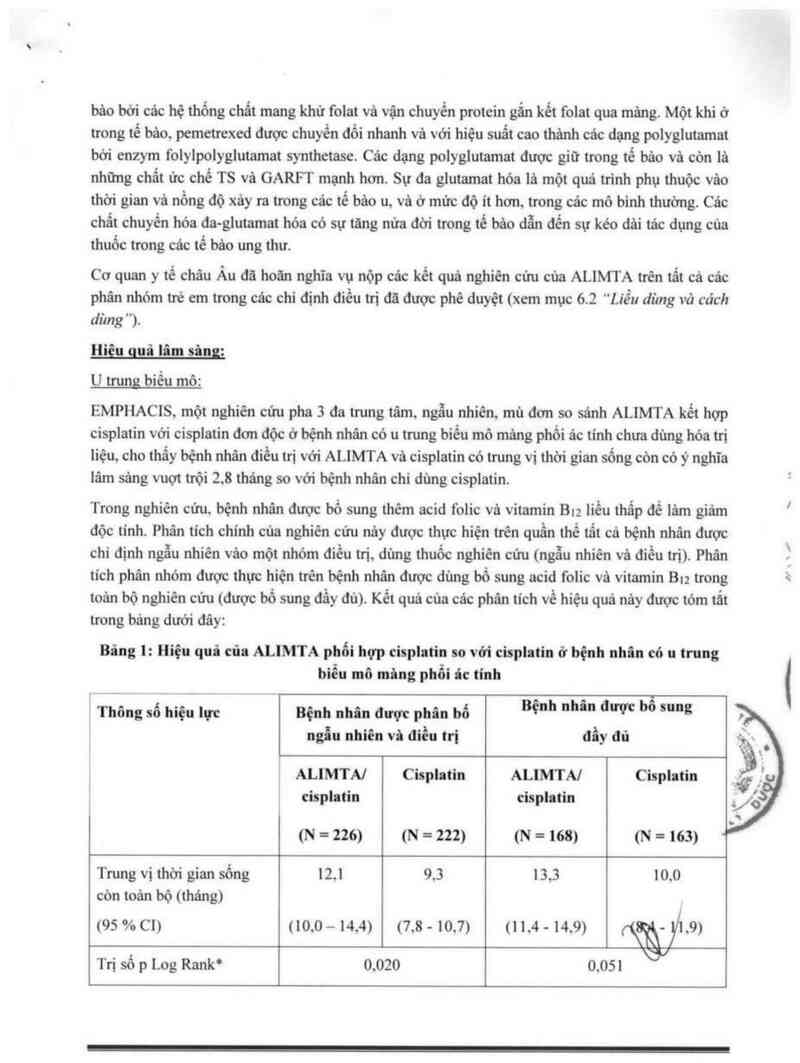
Bâng 1: Hiệu quả cũa ALIMTA phối hợp cisplatin so vởi cỉsplatin ờ hệnh nhin cỏ u trung
biểu mô mâng phổi ác mm
Thông số hiệu lực Bệnh nhân được phân bố Bệnh nhân được bỏ sung
ngủ nhiên vù điều trị đẩy đủ
ALIMTA] Cisplatỉn ALIMTA] Cisplatin
cisplatin cisplntin
(N = 226) (N = 222) (N = 168) (N = 163) 4
Trung vị thời gian sổng 12.1 9.3 13.3 10.0
còn toản bộ (tháng)
(95 % c1 ) uo.o … 14.4) (7.8 - 10.7) u 1.4 - 14.9) (\aẦ yi .9)
. W
Tn số p Log Rank“ 0.020 0.051
Tmng vị thời gian tới khi 5,7 3,9 6.1 3,9
11 phát triên (tháng)
(95 % C1) (4,9 — 6,5) (2,8 - 4,4) (5,5 - 1.0) (2.8 - 4.5)
Tri số p Log Rank° 0,001 0,008
Thới gian tới khi thẳt bại 4,5 2,7 4,1 2.7
điêu tri (thảng)
(95 % Cl) (3,9 … 4,9) (2.1 — 2.9) (4.3 - 5,6) (2,2 - 3,1)
Trị số p Log Rank* o,om 0,001
Tỷ lệ đáp ứng toân bộ" 41,3 % 16,7 % 45,5 % 19,6 %
(95 % Cl) (34,8 … 48,1) (12,0 - 22,2) (37,8 - 53,4) (13,8 … 26.6)
Trị số p Fisher’s° < o,oo1 < 0.001
Viết tắt: Cl: khoảng tỉn cậy
’ Trị số p để cập đến so sảnh giữa các nhóm
“ Trong nhỏm ALIMTAIcisplatin, phân bố ngẫu nhiên và điểu trị (N = 225) vả bổ sung đẩy đủ (N
= 167).
Sư cải thiện có ý nghĩa thống kê cảc triệu chứng lâm sảng (đau vả khó thở) liên quan đển 11 trung
biền mõ mảng phổi ác tính tmng nhóm ALIMTAJcisplatin (212 bệnh nhân) so với nhỏm chỉ dùng
cisplatin (218 bệnh nhân) đã được chứng minh khi đùng Thang chia độ triệu chứng ung thư phối.
Đã quan sảt thấy sự khảc nhau có ý nghĩa thống kê trong các xét nghỉệm chửc năng phổi. Đã đạt
được sự phân tách giữa các nhỏm điều trị dựa trên sự cái thiện về chức nảng phổi trong nhỏm
ALIMTA/cisplatin và sự xẩu đi cùa chức nâng phổi ớ nhỏm đối chửng theo thời gian.
Các đữ liệu về bệnh nhân có 11 trung biền mô mảng phối ác tỉnh được điểu trị bằng ALIMTA đơn
độc còn hạn chế. ALIMTA liều soo mglm² được nghiên cứu như trị liệu đơn trí cho 64 bệnh nhân
có u trung biéu mô mảng phối ác tính chưa dùng hóa trị liệu trước đó. Tỷ lệ đảp ứng toản bộ tớ
14.1%.
Ung thư ghổi khỏng tế bảo nhỏ {NSCLC ), trị liệu bước hai
Một nghiên cửu pha 3. đa trung tãm. nhãn mớ. ngẫu nhiên so sánh ALIMTA với docctaxel ở bệnh
nhân NSCLC giai đoạn muộn tại chỗ hoặc di căn đã từng điều tri hoá chất cho thẩy thời gian sống
còn trung vị lả 8,3 tháng đối với bệnh nhân điều ui với ALIMTA (quần thể dự đinh đỉề 1 n
= 283) và 7,9 tháng đối vởi bệnh nhân điều trị với docetaxel (… n = 288). Hóa tri IWỎ
không có ALIMTA. Một phân tích ảnh hướng của mô học của NSCLC tới hiệu quả điều trị trên
thời gian sống còn toản bộ cho thấy ALIMTA vượt trội docetaxel trong cảc trường hợp mô bệnh
học không phái loại chủ yếu lả tế bảo vảy (n=399; 9,3 so với 8.0 tháng; HR (tỉ số nguy cơ) hiệu
chinh = 0.78; 95% C! = 0,61 — 1,00; p = 0.047) vả docetaxel vượt trội hơn trong carcinoma tế bảo
vảy (n = 172; 6,2 so với 7,4 tháng; HR hiệu chỉnh = 1,56; 95% C] = 1,08 — 2.26; p = 0,018). Không
nhận thẩy có sự khác biệt lâm sảng về độ an toân của ALIMTA trong tửng phân nhỏm theo mô học.
Các dữ liệu lâm sảng còn hạn chế từ một nghiên cửu pha 3 ngẫu nhiên có đối chửng độc lập cho
thẩy hiệu quả lãm sảng (thời gian sổng còn toản bộ, thời gian sống bệnh không tiến triền) của
pemetrexed tương tự nhau ở các bệnh nhân trước đó đã điều trị bằng docetaxel (n = 41) và cảc bệnh
nhân chưa được diều trị bằng docetaxel (n = 540).
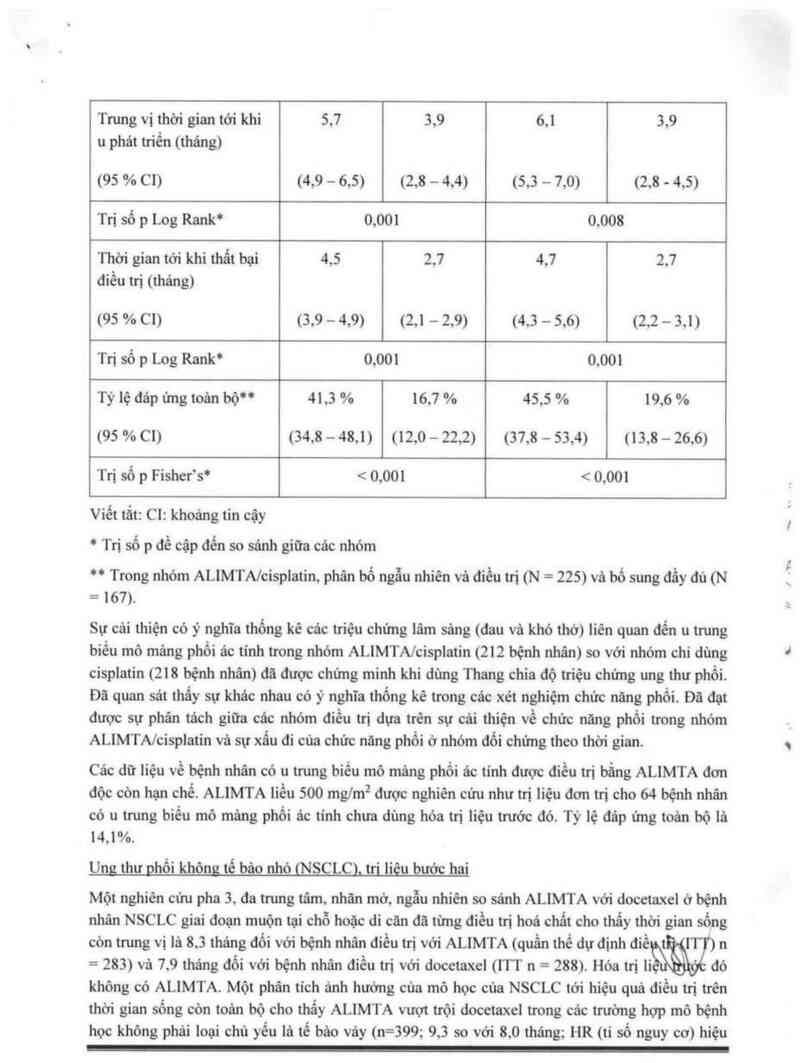
Bâng 2: Hiệu quả của ALIMTA so sảnh vởi đocetaxel ở bệnh nhân NSCLC —
quần thể đự định điều trị
ALIMTA Docetaxcl
1 Thời gian sổng còn (thủng) (n = 283) 1 (n = 288)
1 ' Trung vị (m) \ 8.3 | 7,9
' 95 % C [ cùa trung vị (7,0 — 9,4) , (6,3 — 9,2)
' Tỷ số nguy cơ 0.99
' 95 % C! của HR (,82 — 1,20)
' Giá trị p không thua kẻm (HR) .226
Thời gian sống hệnh không tiến triển (tháng) (11 = 283) (11 = 288)
' Trung vị 2.9 2.9
~ Tỷ số nguy cơ (95 % CI)
0.97 (,82 — 1.16)
Thời gian tởi khi thẩt hại điều trị (TTTF - thảng)
' Trung vị
~ Tỷ số nguy cơ (95 % CI)
(n = 283) (11 = 288)
23 2,1
0,84 (,71 - .997)
Đủp ứng (… số bệnh hhah đạt tiêu chuẩn về dảp ứng) (11 = 264) (11 = 274)
- Tỷ lệ đáp ửng (%) (95 % Cl) 9,1 (5,9 - 15.2) 8.8 (5.7 … 12.8)
- Bệnh ổn đinh (%) 45.8 46,4
- |
Viết tắt: Cl = khoảng tin cậy; HR: tỷ số nguy cơ; 11T = chủ đinh điểu trị; 11 = số lượnWân
cùa quần thể.
Ung thư Dhối khôngtể bảo nhò, tri liêu bước một
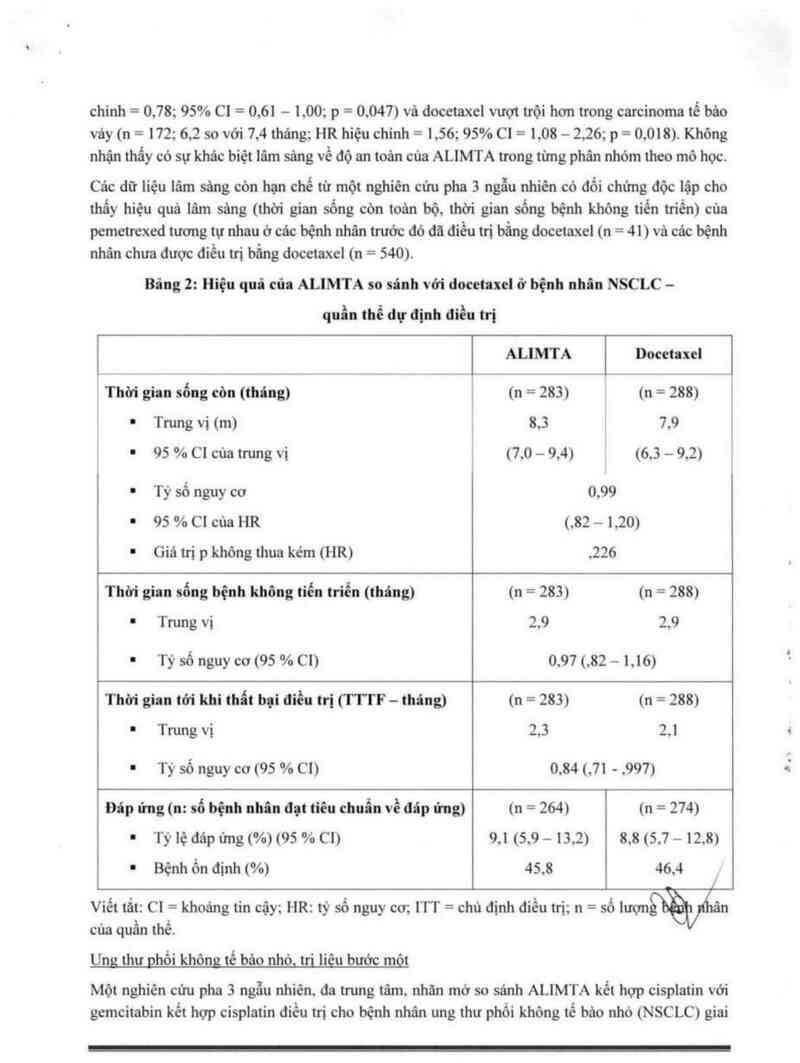
Một nghỉên cứu pha 5 ngẫu nhiên. đa trung tâm. nhãn mớ so sảnh ALIMTA kết hợp cỉsplatin với
gemcitabìn kểt hợp cisplatin điểu ưi cho bệnh nhân ung thư phổi không hề bảo nhỏ (NSCLC) giai
đoạn muộn tại chỗ hoặc đã di căn (Giai đoạn 111b hoặc IV) vả chưa dùng hỏa trị liệu cho thấy
ALIMTA kết hợp với cisplatin (số lượng bệnh nhân dự định điều trị [ITT] n = 862) đạt được tiêu
chí điều trị chính vả có hiệu quả lâm sâng tương tự như gemcitabin kểt hợp cisplatin (ITT n = 863)
về thời gian sống còn toản bộ (tỷ số nguy cơ hiệu chỉnh o,94; 95% c1 = 0,84 = 1.05). Tất cả cảc
bệnh nhân tham gia trong nghiên cửu nảy có điểm số về tinh trạng sửc khóe theo thang điểm cùa
ECOG (Nhỏm Hợp tác về Ung thư phương Đông) 0 hoặc 1.
Phân tích hiệu quả chính được dựa trên quẩn thề l'I'l'. Phân tích độ nhạy của kết diểm hiệu quả chủ
yểu cũng được đánh giá trên quần thể đạt được tiêu chuẩn cùa đề cương nghiên cứu (quần thể PQ).
Phân tích hiệu quả trên quần thể PQ cho kểt quả đồng nhất với khi phân tich quần thể 1'IT vả cho
thẩy AC khỏng thua kém GC.
Thời gian sống bệnh không tiến mẻ… (PFS) vả tỷ lệ đảp ứng toản bộ tương tự nhau giữa các nhỏm
điều tri: trung vị PFS là 4.8 tháng đối với AL1MTA phối hợp cisplatin so với 5,1 tháng dối với
gemcitabin phối hợp cisplatin (tỷ số nguy cơ hiệu chinh 1.04; 95% c1 = 0,94 - 1,15), và tỷ lệ đáp
ứng toản bộ là 50,6% (95% c1 27.5 - 55.9) với nhóm ALIMTA + cisplatin so với 28,2% (95% Q
25,0 — 51 ,4) với nhóm gemcitabin + cisplatin. Dữ liệu PFS phấn nảo đỏ được khắng định bằng một
đảnh gỉá độc 1ập (400/1725 bệnh nhản được lựa chọn ngẫu nhiên để đánh giá).
Phân tích sự ảnh hưởng cùa mô học NSCLC trẽn tỷ lệ sổng còn toản bộ cho thấy có sự khác biệt
ưên lâm sảng về tỷ lệ sống còn tuỳ thuộc loại mô học, xem bảng dưới đãy.
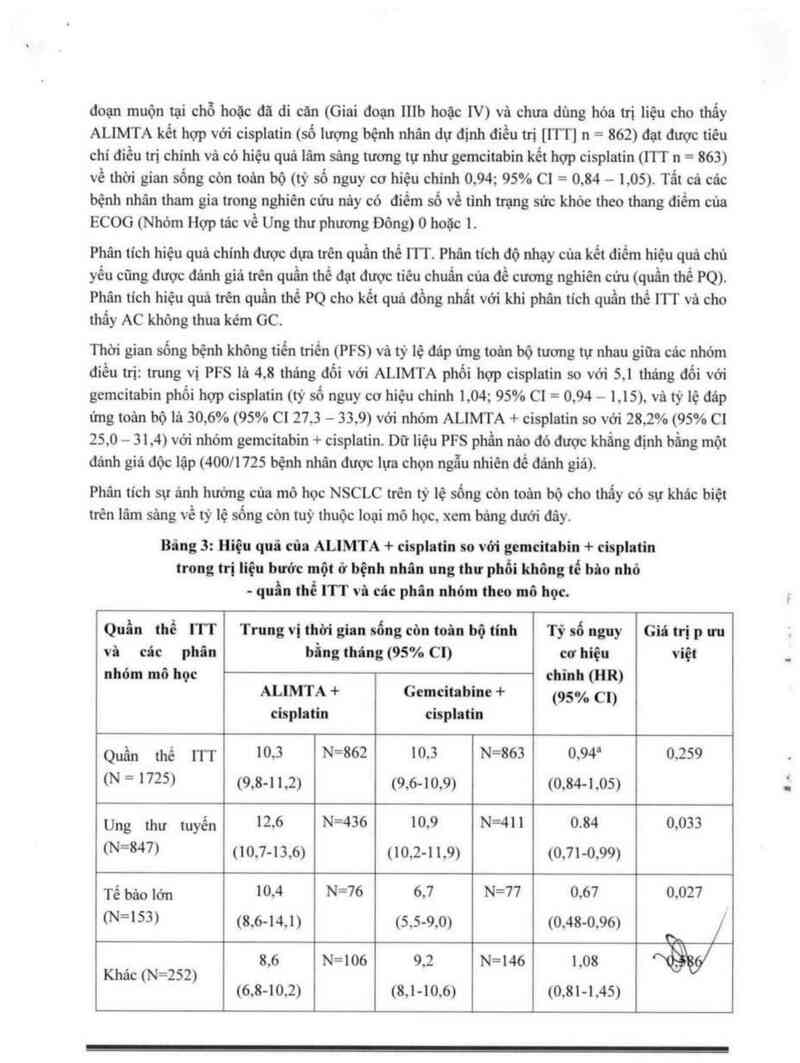
Bâng 3: Hiệu quả của ALIMTA + cisplatin so vởi gemcitabỉn + cisplatin
trong tri liệu bưởc một ớ bệnh nhân ung thư phổi không tế hi… nhỏ
— quẩn thể ITT vì các phân nhóm theo mô học.
Quần thể 111 Trung vị thời gian sống còn toi… bộ tính Tỷ số nguy Giá tri p ưu
vã câc phim hẵng tháng (95% Cl) cơ hiệu việt
nhỏm mô học chinh (HR)
ALIMTA + Gemcỉtabine + (95% Cl)
cisplatin cisplatin
Quần thể m 105 N=862 10.5 N=863 0.94² 0,259
(N = 1725) (9,8-11.2) (9,6-10,9) (0,84—1,05)
Ung thư tuyến 12.6 N=456 10.9 N=411 0.84 0,055
1N=8471 (10,7-156) (10,2-11,9) (0,71099)
Tế bào lở,, 10,4 N=76 6.7 N=77 0,67 0.027
tN=153› (8,6-14.1) (5.590) (0.48—096) “
8,6 N=106 9.2 N=146 1.08 ửL
Khác (N=252)
(6,8—10,2) (8,1-10.6) (0,81-1.45)
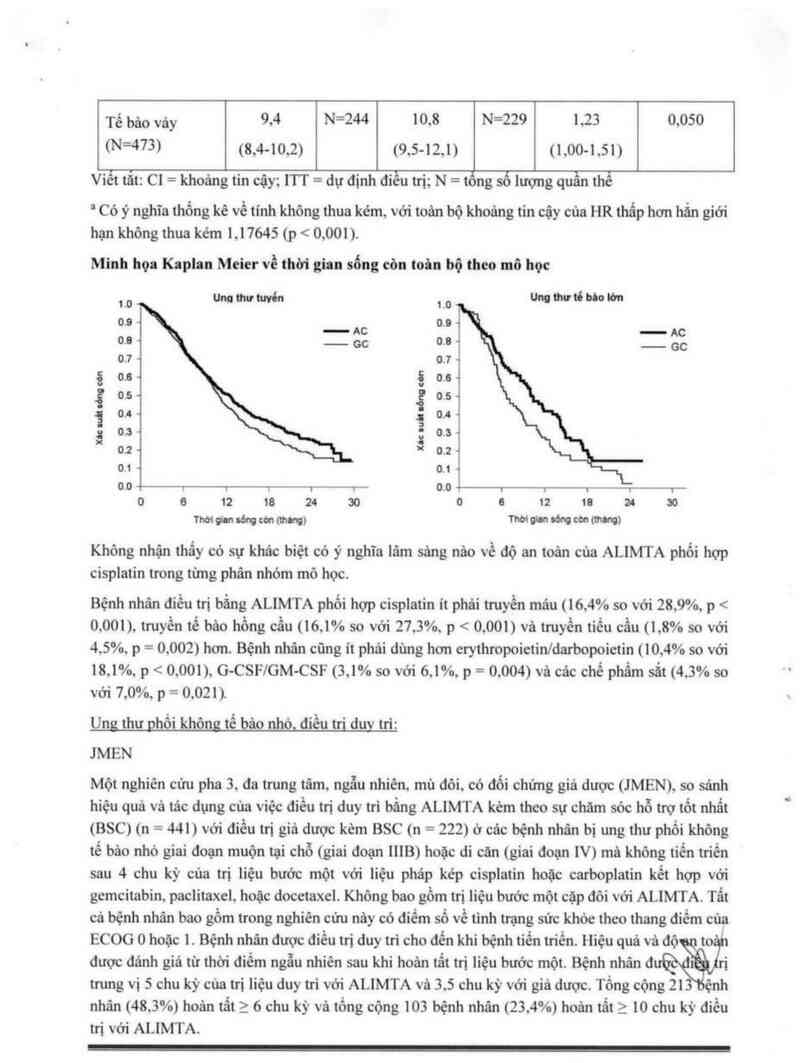
Tế bào ,,ảy 9.4 N=244 10.8 N=229 1.25 0,050
(N²m) <8,4—10.2) (9.5~12.1) (1,00—151)
Viết tắt: C1 = khoảng tin cậy; ITT = đự đinh điều trị; N = tong số lượng quần thể
= Có ý nghĩa thống kê về tính không thua kẻm, với toản bộ khoảng tin cậy của HR thấp hơn hắn giới
hạn không thua kém 1.17645 (p < 0,001 ).
Minh họa Kaplan Meier về thời gian sống còn toán bộ theo 1116 học
m_ ttmthưhuõn 1.0 Unnmưtểbòolởn
0.0 ~ _ AC 0.0 ~
03 ~ _ GC 0.8 ~
0.1 ~ 0.1 ~
g 0.0 ~ g 0.04
ỉ 0.5 ~ ’ẵ 0.5 ~
1 0.4 * ã 0.4 4
8 0: ~ * 0.5 ~
" 02 ~ 5 0.2 ,
0.1 ~ 01 ~
00 , , , , = 00 , , , , †
o 6 12 18 24 50 o 0 12 10 24 so
T…wsónotmmam T…wmcmmmi
Không nhận thẩy có sự khác biệt có ý nghĩa lâm sảng nảo về độ an toản cùa ALIMTA phối hợp
cisplatin trong từng phân nhỏm mô học.
Bệnh nhãn điều trí bằng ALIMTA phối hợp cisplatin ít phải truyền máu (16,4% so với 28.9%. p <
0.001). truyền tế bảo hồng cầu (16,1% so với 27,3%. p < 0,001) và truyền tiếu cầu (1,8% so với
4,5%, p = 0,002) hơn. Bệnh nhân cũng ít phải dùng hơn erythropoietin/darbopoìetin (10.4% so vói
18.1%. p < 0,001 ), G-CSF/GM—CSF (5.1% so với 6.1%. p = 0.004) vả các chế phấm sắt (4.5% so
với 7,0%, p = 0,021 ).
Ung 11… phới không tế bảo nhớ, điều ui duỵ m:
JMEN
Một nghiên cứu pha 3, đa trung tâm, ngẫu nhiên. mù đôi. có đối chứng giá dược (JMEN). so sánh
hiệu quả vả tác dụng của việc điểu trị duy trì bằng ALIMTA kèm theo sự chăm sóc hỗ trợ tổt nhất
(BSC) (n = 441) với điểu trị gỉả dược kẻm BSC (n = 222) ở các bệnh nhân bị ung thư phổi không
1é bảo nhỏ giai đoạn muộn tại chỗ (giai đoạn 11115) hoặc di căn (giai đoạn 1V) mã không tiển triển
sau 4 chu kỳ của trị liệu bước một với liệu pháp kép cisplatin hoặc carboplatin kểt hợp với
gcmcitabin, paclitaxel, hoặc docetaxel. Không bao gổm trị liệu bước một cặp đôi với ALIMTA. Tất
cả bệnh nhân bao gổm trong nghiên cứu nây cỏ điếm số về tinh trạng sức khỏe theo thang điểm cùa
ECOG 0 hoặc 1. Bệnh nhân được điều trị dưy tri cho đến khi bệnh tiến triền. Hiệu quả và độ 10
được đảnh giả từ thời điểm ngẫu nhiên sau khi hoản tẳt trị liệu bước một. Bệnh nhân đưỀẵĩii
trưng vi 5 chu kỳ cùa tri liệu duy trì với AL1MTA và 3.5 chu kỳ với giả dược. Tổng cộng 21 ệnh
nhân (48.5%) hoản tắt 2 6 chu kỳ và tống cộng 105 bệnh nhân (25.4%) hoản tẩt z 10 chu kỳ điếu
trị với ALIMTA.
Nghiên cứu đạt được mục tiêu cơ bản và cho thấy sự cái thiện có ý nghĩa thống kê về PFS ớ nhỏm
ALIMTA so với nhỏm giá dược (n = 581, nhớm đánh giá độc lập; trung vị 4,0 tháng và 2.0 thảng
tướng ứng) (tỷ số nguy cơ = 0,6; 95% C! = 0,49 — 0,73, p < 0,00001). Kểt quả đánh giá từ những
nhỏm nghiên cứu độc lập đã khắng định kết quả đánh giá cùa cuộc khảo sát về PFS. Tỷ lệ sống còn
trung vị với toản bộ các đổi tượng (11 = 663) lả 13,4 thảng với nhóm ALIMTA vả 10.6 tháng với
nhóm giả dược. tỷ số ngưy co = 0,79 (95% C! = 0,65 — 0.95; p = 0,01 192).
Phù hợp với các nghiên cứu ALIMTA khác, sự khảc biệt về hỉệu quả theo mô học NSCLC đã được
ghi nhặn ớ JMEN. ó những bệnh nhân NSCLC trư mô tế bảo hinh vảy (n = 450. nhỏm đánh giá
độc lập) PFS trung vị lả 4,4 tháng với nhỏm ALIMTA và 1,8 thảng với nhóm giả dược tỷ số nguy
cơ = 0,47 (95% Cl = 0,37 — 0,60; p = 0.00001 ). Tỷ lệ sống còn toản bộ trung vị ở những bệnh nhân
NSCLC trừ mô tế bảo hinh vảy (n = 481) lả 15.5 tháng với nhóm ALIMTA vả 10,3 thảng với nhỏm
giả dược, tỷ số nguy cơ = 0,70 (95% c1 = 0,56 - 0,88; p = 0,002). Bao gổm pha khới đầu tỷ 115 sống
còn toản bộ trung vị với nhũng bệnh nhãn NSCLC trù mô tế bảo hinh váy là 18,6 tháng với nhóm
ALIMTA và 13,6 tháng với nhóm giá dược. tỷ số nguy cơ = 0,71 (95% C] = 0,56 — 0,88; p = 0,002).
Cảc kểt quả PFS vả os ớ những bệnh nhân với mô tế bảo hình vảy không cho thẳy lợi ích cùa
ALIMTA so với giả dược.
Không ghi nhận thấy có sự khác biệt có ý nghĩa lâm sảng về độ an toản của ALIMTA trong cảc
phân nhóm theo mô học.
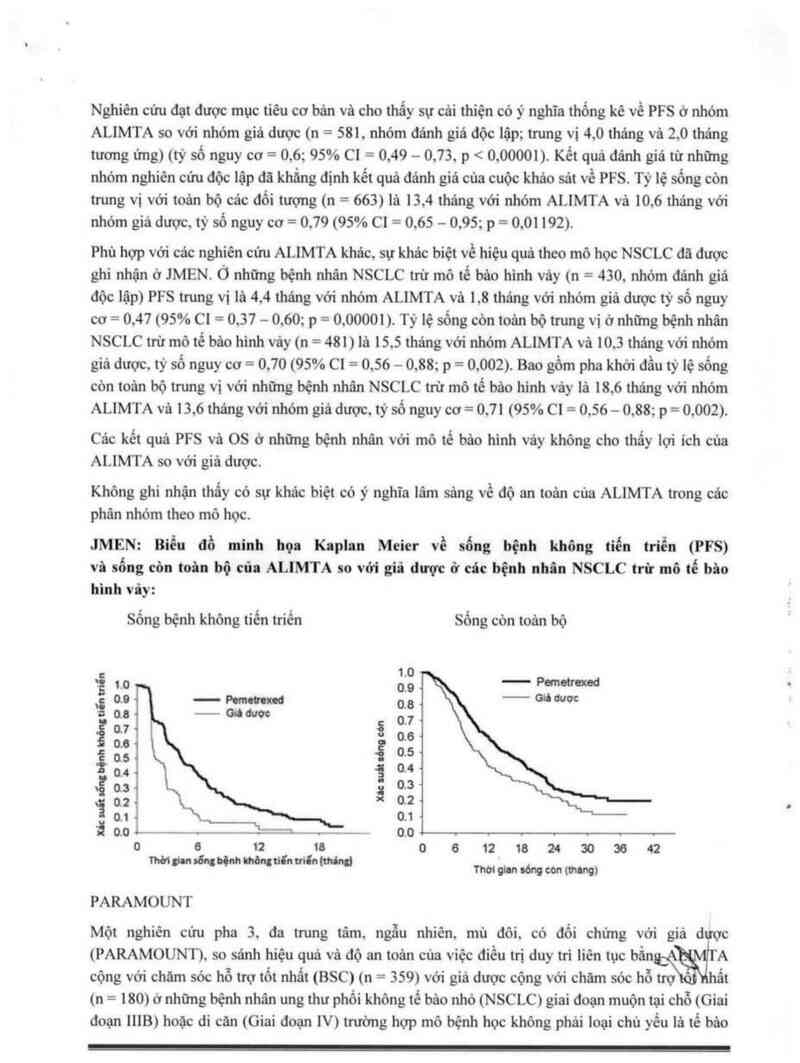
JMEN: Biểu đồ minh họa Kaplan Meier về sống bệnh không tiến triển (PFS)
vả sống còn toân bộ của ALIMTA so vởi giả được ở cảc bệnh nhân NSCLC trừ mô tế bio
hình vây:
Sổng bệnh không tiển triến Sống cỏn toản bộ
*Ễ 1.0 ổịẵ — Puneimoớ
\ 0.0 — M… 0.0 _ wm°
~ 0; — Gich 07
ẵ07 ã 06
0.8 '
ị05 Ẹ 0.5
04 3 04
vĩ 05 ỉ 0.5
02 0.2
01 0.1
“3 0,0 . - 0.0 .
0 ge izủumia 06121824505842
WWMMN'“ M'i'd Thớigtansớngcớa(m)
PARAMOUNT
Một nghiên cửu pha 3. đa trung tãm, ngẫu nhiên. mù đôi, có đối chứng với giả d
(PARAMOUNT), so sánh hiệu quả vả độ an toản cùa việc điểu trị duy tri liên tục bằnủlì
cộng với chăm sỏc hỗ trợ tốt nhất (BSC) (n = 359) với giả dược cộng với chăm sỏc hỗ trợ ắt
(n = 180) ở những bệnh nhân ung thư phổi không tế bảo nhỏ (NSC LC ) giai đoạn muộn tại chỗ (Giai
đoạn 11113) hoặc đi căn (Giai đoạn IV) trường hợp mô bệnh học không phải Ioại chủ yếu là tế bâo
vảy. là những người dã không tiển triến bệnh sau 4 chu kỳ điều 1rị kép bước một bằng ALIMTA
phối hợp với cisplatin. Trong số 959 bệnh nhân được điều trị khới đầu bằng ALIMTA cộng cisplatin,
539 bệnh nhân được chọn ngẫu nhiên vảo nhóm điểu trị duy tri bằng pcmetrexed hoặc nhóm dùng
giả dược. Trong số những bệnh nhân được chọn ngẫu nhiên, 44,9% có đảp ứng hoân toản/đáp ứng
một phần vả 51,9% có đáp ứng bệnh ổn dinh với việc điều trị khời đằu bằng ALIMTA cộng
cisplatin. Những bệnh nhân được chọn ngẫu nhiên vảo nhỏm điều trị duy tri cần phải có điềm số về
tình trạng sửc khóc theo thang điểm của ECOG (Nhỏm Hợp tảc về Ung thư phương Đông) là 0 hoặc
1. Thời gian tmng hinh từ lủc bắt đầu trị liệu khời đầu bằng ALIMTA cộng cisplatin đến khi bắt
đầu điểu trị duy trì 15 2,96 tháng 6 cả nhóm dùng pemetrexed và nhóm đùng giả dược. Những bệnh
nhân được chọn ngẫu nhiên đã được điều trị duy trì cho đến khi bệnh tiến triền. Hiệu quả vả độ an
toân đã được đảnh giá từ thời điềm chọn ngẫu nhiên sau khi hoản thảnh trị liệu (khời đầu) bước
một. Bệnh nhân nhận được trung vị 4 chu kỳ điểu trị duy tri bằng ALIMTA vả 4 chu ký bằng giá
dược. Tồng cộng có 169 bệnh nhân (47. 1 %) đă hoản thảnh 2 6 chu kỳ điểu trị duy tri bằng ALIMTA.
đại diện cho it nhẳt tống cộng 10 chu kỳ ALIMTA.
Nghiên cửu đã đạt được mục tiêu cơ bản vá cho thấy sự cải thiện có ý nghĩa thống kê về thời gian
sống bệnh khõng tiển triến (PFS) ớ nhóm ALIMTA nhiều hơn nhớ… gíả dược (n = 472. nhóm được
đảnh giả độc lặp; trung bình 3,9 thảng vả 2.6 tháng. theo thứ tự tương ứng) (tỷ số nguy cơ = 0.64,
95% C 1 = 0.51 — 0.81; p = 0.0002). Đảnh giả độc lập hình ảnh chụp của bệnh nhân đã khắng đinh
ca'c kết quả đánh giá của nhà nghiên cữu về thời gian sổng bệnh không tiểu triến. Dối với nhũng
bệnh nhân được chọn ngẫu nhiên, như đã được đánh giá từ lủc bắt đầu điều trị khới đằu bước một
bằng ALIMTA cộng cisplatin, thời gian sổng bệnh không tiến triển trung binh theo đảnh giả của
nhà nghiên cứu lả 6.9 thảng đối với nhỏm dùng ALIMTA vả 5.6 thảng đổi với nhóm dùng giả dược
(tỷ số nguy cơ = 0,59: 95% 0 = 0.47 — 0.74).
Sau khi t1ị Iiệư khới đầu bằng ALIMTA cộng cisplatin (4 chu kỳ), việc điều trị bằng ALlMTA vượt
trội hơn có ý nghĩa thống kê so với giả dược về thời gian sống còn toản bộ (OS) (trung binh 139
tháng so với 1 1,0 thảng, tỷ số nguy cơ = 0,78; 95% C 1 = 0,64 — 0,96; p = 0.0195). Tại thời diềm
phân tich sổng còn cuối cùng, 28,7% bệnh nhân còn sổng hoặc mất theo dội ớ nhỏm ALIMTA so
với 21,7% ớ nhóm giá dược. Hiệu quả điều trị tương đối của ALIMTA lả nhẩt quán giữa các phân
nhòm (bao gồm giai đoạn bệnh, đảp ứng với trị liệu khới đầu. tinh trạng sức khòe theo thang điểm
của ECOG. tinh ưạng hủt thuốc lả. giới tính, mô học vả tuổi) vả giống như đã quan sát thẳy trong
phân tich thời gian sống còn toản bộ (OS) vả thời gian sống bệnh không tiến triển (PFS) chưa điểu
chinh. Tỳ 1ộ sống thêm 1 năm và 2 nãm đối với bệnh nhân đang dùng ALIMTA lằn lượt lả 58% và
52%, so với 45% vả 21% dối với bệnh nhân đùng giả dược. Từ lủc bắt đầu điếu tri khới đầu bước
một bằng ALIMTA cộng cisplatin, thời gian sổng còn trung binh cùa bệnh nhãn là 16,9 thảng đối
với nhòm ALIMTA vả 14.0 tháng đổi với nhóm giá dược (tỷ số ngưy cơ = 0,78; 95% C1 = 0,64 —
0.96). Tỷ lệ phẩn trăm bệnh nhân nhận được điểu trị sau nghiên cữu là 64,5% dối với nhỏm
ALIMTA vả 71 .7% đối với nhóm giá dược.
PARAMOUNT: Biểu đồ minh họa Kaplan Meier về sống bệnh không tiến triễn (PFS)JỀỆ
còn toân bộ (05) đối với điều tri dưy tri tiểp tục bẵng ALIMTA so với gỉâ dược ở bệ h
ung thư phổi không tổ bâo nhỏ (NSCLC) khảc trừ mô học tế bâo vãy (được đảnh giả từ chọn
ngẫu nhiên)
sớuhộnhmtiớiuibt m……»
n
n
8 a
3 n
n
ẽ 05
° u
ẳ u
3 n
! 8 '
° ’ ° ’ '² " n»connnaunnnn
Mghnsủuhenhưtớtutiatuiẽntm) TdeMc°nWbỌM)
Dữ liệu an toản cùa việc điểu trị duy tri bằng ALIMTA tử 2 nghiên cứu JMEN vả PARAMOUNT
111 tương tự nhau.
5.2. Cảc đặc tính dược động học
Đặc tính dược động học cùa pemetrexed sau khi dùng đớn liều đã được đánh giá trên 426 bệnh nhân
ung thư có 11 đặc khác nhau với các liền từ 0,2 đến 838 mglm2 được truyền trong thời gian 10 phút.
Pemetrexed có thể tích phân bố ở trạng thải cân bằng lá 9 lít/m². Các nghiên cửu in vitro cho thẩy
pemetrexed liên kểt với protein huyết tương khoảng 81%. Sự liên kểt không bị ảnh hướng đảng kề
bới các mức độ suy thận khác nhau. Pemetrexeđ it chuyến hỏa ở gan. Pemetrexed được bâi tiết chủ
yếu qua nước tiểu. với 70% đến 90% của liều dùng được tải hiện ở dạng không đổi trong nước tiếu
trong vòng 24 giờ đầu sau khi ưuyền. Cảc nghiên cửu in vilro đã chi ra rằng pemetrexeđ được chủ
động bải tiểt bời OAT3 (anion vận chuyến hữu cơ). Hệ số thanh thải tống cộng của pemetrexed lả
91,8 mllphủt và nửa đời thải trừ khỏi huyết tương là 3.5 giờ ở bệnh nhân có chức năng thận binh
thường (độ thanh thải creatinin là 90 ml/phút). Sự dao động về độ thanh thải giữa cảc bệnh nhân ở
mức độ vừa, là 19.3%. Diện tích dưới đường cong (AUC ) cùa pemetrexed vả nổng độ tổi đa trong
huyểt tương tăng tỷ lệ với liễu. Dược động học của pemetrexed không thay đối trong nhiều chu kỳ
điếu tri.
Các đặc tính dược động học của pemetrexed không bị ảnh hướng bới cisplatin dùng đồng thời.
sung acid folic đường uổng vả vitamin Bu tiêm bắp không ảnh hướng tới dược động học cf
pemetrexed. '
5.5. Dữ liệu an toiin tiền lâm sâng
Dùng pemetrexed cho chuột nhắt mang thai lảm giảm khả năng sống được cùa thai. giảm trọng
lượng thai, lảm hóa xương không hoản toản cùa một số cắu trúc của bộ xương và hớ hảm ếch.
Dùng pemetrexed cho chuột nhắt đực gây độc tinh với sinh sán thế hiện bằng giảm khả nảng sinh
sản và teo tinh hoản. Trong một nghiên cửu tiểu hảnh với giống chó săn tiêm tĩnh mạch n 0 ăng
trong 9 tháng, đã phát hiện thấy các rổi loạn về tinh hoân (thoải hoálhoại từ biểu mô ốngửh).
Điều nảy gợi ý rằng pemetrexed có thế lảm giâm khả năng sinh sản cùa nam giới. Ành hưởng trên
khả năng sinh sản cùa giống cải chưa dược nghiên cứu.
Pemetrexed không gây đột biển trong xét nghiệm về sai khác cẩu trủc nhiễm sẳc thể in vitro ở tế
bâo buổng tn'mg chuột đồng Trung Quốc. hoặc xét nghiệm Ames. Đã chửng minh pemetrexeđ
không gây găy trong thử nghiệm trên cảc nhân sinh sản in vivo ở chuột nhắt trắng.
C hưa cỏ cảc nghiên cửu về khả năng gây ung thư của pemetrexeđ.
6. cni ĐỊNH, LIÊU DÙNG VÀ cÁcn DÙNG. CHỐNG cni ĐỊNH
6.1. Chỉ đinh
U trung biếu mô mảng phổi ảc tính
ALIMTA kểt hợp với cisplatin được chi đinh để điều trị các bệnh nhân có u trung biền mô mâng
phổi ác tính không thể cắt bỏ chưa được dùng hỏa ưi liệu.
Ung thư phới không tế bảo nhỏ
ALIMTA kết hợp với cisplatin lả tri lìệu bước một trong điểu trị cho các bệnh nhân ung thư phổi
không tế bảo nhỏ giai đoạn muộn tại chỗ hoặc đã di cãn, trường hợp mô bệnh học không phải loại
chủ yếu lả tế bảo vảy (xem mục 5.1 “Các đặc n'nh dược lực học ").
ALIMTA được chi đinh đề điểu trị duy tri ớ những bệnh nhân hi ung thư phối không tế bảo nhò,
không phải tế bảo vảy, gini đoạn muộn tại chỗ hoặc di căn mả bệnh không tiến triển ngay sau hỏa
trị Iiệu đựa trên platinum (xem mục 5.1 “('ác đặc tính dược lực học ").
ALIMTA được chi đinh như một đơn trị Iiệu bước hai trong điếu trị cho các bệnh nhân ung thư phồi
không tế bảo nhỏ giai đoạn muộn tại chỗ hoặc đã đi cản, trường hợp mô bệnh học không phải loại
chủ yểu là tế bảo vảy (xem mục 5.1 “Các đăc lính dược lực học ").
6.2. Liều dùng vit cảch dùng
Liều dùng
Chỉ dùng ALIMTA dưới sự giám sát cùa bác sĩ có kinh nghiệm sử đụng hớa trị liệu chống un '—
A LIMT A phối hợp với cisplalin
Liều khuyến cáo của ALIMTA là 500 mglm2 diện tích bề mặt cơ thể (BSA), truyền tĩnh mạch trong
10 phút ở ngảy thứ nhắt cùa mỗi chu kỳ 21 ngảy. Liều khuyến cảo cùa cisplatin lả 75 mglm² BSA
truyền trong hai giờ, khoảng 30 phủt sau khi tiêm truyền xong pemetrcxed ở ngảy thứ nhất cùa mỗi
chu kỳ 21 ngảy. Bệnh nhân phái được nhận liệu pháp chổng nôn đầy đủ và được bù nước thích hợp
trước vá/hoặc sau khi tiêm truyền cisplatin (xem thêm thông tin hướng dẫn sữ dụng của cisplatin để
biểt liểu cụ thế).
A LIMT A dùng đơn trị
ớ bệnh nhân ung thư phối không tế bảo nhỏ đã từng dùng hoá trị Iiệu trước đó, liền khu ' áo ủa
ALIMTA là 500 ngm² BSA, truyền tĩnh mạch trong 10 phủt ớ ngảy thứ nhẩt của mỗi 21
ngảy.
(.'huần bi rrưởc khi tri Iiệu
Để giảm tần xuất và mức độ nặng của các phán ứng da, cần cho bệnh nhân sử dụng một
corticosteroid vảo ngây trước, ngây tiêm truyền, và ngảy sau khi tiêm truyền pemetrexed. Sử dựng
corticosteroid với liều tương đương dexamethason 4 mg uống 2 lần mỗi ngảy (xem mục 7.1 “Cánh
báo đặc biệt vả rhản trọng khi dùng ").
Để giảm độc tinh cùa thuốc, bệnh nhân điều trị với pemetrexed phải dùng bổ sung vitamin (xem
mục 7.1 “Cảnh báo đặc bỉệl vả thận lrọng khi dùng"). Bệnh nhân phải uống acid folic hoặc một
chế phẩm nhiều vitamin có chửa acid folic (350 đển 1.000 microgam) hảng ngảy. Phâi uống it nhẫt
5 liểu acid folic trong 7 ngảy trước khi dùng liễu pemetrexed đầu tiên, vả phải tiếp tục uổng trong
toản bộ đợt điều tri và trong 21 ngảy sau liều pemetrexed cuối cùng. Bệnh nhân cũng phải được
tiêm bắp vitamin 812 (1.000 microgam) trong tuần trước liểu pemetrexed đầu tiên vả sau đó một lần
mỗi 3 chu kỳ. Những lẳn tiêm vitamin Bu tiếp sau có thể vảo cùng ngảy với pemetrexed.
Theo dõi
Trước mỗi liều dùng pemetrexed, bệnh nhân phải được kiếm tra toản bộ số lượng tế bảo máu bao
gổm công thức bạch cẩu và số lượng tiếu cầu. Trước mỗi đợt đùng hóa trị liệu, cẩn lảm xẻt nghiệm
sinh hỏa máu để đánh giá chức nãng thặn vả gan. Tmớc khi bắt đầu mỗi chu kỳ hỏa trị liệu, bệnh
nhân cần phải dạt được những yêu cằn như sau: số lượng bạch cầu trung tính tuyệt đối (ANC ) phải
2 1.500 tể bảolmm3 và số lượng tỉểu cầu phải 2 100.000 tể bảo/mm’.
Hệ số thanh thải creatinin phải 2 45 mllphủt.
Bilirubin toản phần phải 5 1,5 lần giới hạn trén cùa mửc binh thường. Phosphatase kiểm (AP),
aspaxtat aminotransaminase (AST hoặc SGO'D vả alanin aminotransaminase (ALT hoặc SGPT)
phải 5 5 lẩn giới hạn trên cùa mức bình thường. Phosphatase kiềm, AST vả ALT s 5 lần giới hạn
trên của mức binh thường có thế chẫp nhận được trong trường hợp có di căn tới gan.
Điều chinh Iiều
Sự điểu chinh liều lủc bắt đầu một chu kỳ tiểp sau phải dựa trên số lượng tế bảo mảu thấp nhẩt hoặc
độc tinh cao nhẩt trên các cơ quan khảc ngoải máu từ chu kỳ điều trị trước. Việc điều tri có thề hoãn
lại đề bệnh nhân có đủ thời gian hổi phục. Khi hối phục. bệnh nhân phải được tiểp tục điểu trị theo
cảc chỉ dẫn ớ cảc Bảng 4, 5 vả 6. có thề ảp dụng cho ALIMTA dùng đớn trị hoặc kểt hợp với
cisplatin.
Bâng 4 - Bâng hiệu chinh iièu cớn ALIMTA (dùng dơn tri hoộc phối hợp) vi cisplatin -
Cảc độc tinh trên huyết học
ANC thắp nhất < 500/mm3 vả tiều cẩu thẩp
nhất z 50.0001mmJ
l
² | '² ² ' ²t < 50.000/ *
Ễẵ kưểợỊiỄ IỂ`ẦỂỂ ỆỆỂ Ệẫ mm 75% của liều trước (cả ALIMTA vaử)
75% của liểu trước (cả ALIMTA vả cisplatin)
Số lượng tiếu cầu thấp nhất < 50.000/mm3, 50% của liền trước (cả ALIMTA vả cisplatin)
cỏ chảy máu'. bẩt kẻ giá trị ANC thẩp nhẩt
' Theo tiêu chuẩn độc tinh chung (CTC) của Viện Ung thư Quốc gía (CTC v2.0; NC1 1998) quy đinh cháy
máu 2 crc mửc độ 2.
Nếu bệnh nhân xuất hiện cảc độc tính khác ngoải máu 2 mức độ 3 (không kế độc tính trên thằn
kinh). phải ngùng dùng ALIMTA cho tới khi thưyên giảm tới mửc thắp hớn hoặc bằng trị số trước
điều trị của bệnh nhân. Việc điều trị sẽ lại được tiếp tục theo các ehi đẫn ớ Bảng 5.
Bing 5 - Bâng hiệu chỉnh liều cũa ALIMTA (đùng đơn trị hoic phối hợp) vả cisplatin —
ctie độc tinh tthtic ngoâi huyết học “ "
Liền ALIMTA _, , , ,
(mglmz) L1eu cisplattn (mg/m )
B't ’d“ tí . ` '“ ' .~ .
a CLĨ ợc Ếh nảo W v1em ntêm 75%11êu trước 75%11ều trước
mạc, ớ mưc đọ 3 hoặc 4
Tiêu cháy cẩn điểu tii tại bệnh viện
(bẩt kề mức độ) hoặc tiêu chảy độ 5 75% liều ttước 75% liều trước
hoặc 4
Viêm niêm mạc mức độ 3 hoặc 4 50% liều trước 100% liều trước
' Tiêu chuẩn độc tinh chung cùa Viện Ung thư Quốc gia (CTC v2.0; NC1 1998)
° Khòng kế độc tinh thần kinh
Trong trường hợp có độc tinh thần kinh, điểu chình liều ALIMTA vả cisplatin theo hướng dẫn ở
Bảng 6. Bệnh nhân phải ngừng điểu tri nếu quan sát thẳy độc tinh thằn kinh mửc độ 5 hoặc 4
Bãng 6. Bâng hiệu chỉnh liền của ALIMTA (dùng đơn trị hoặc phối hợp) vì cisplatin - Độc
tinh thẩn kinh
Mức độ CTC' Liều ALIMTA (mglmz) Liều cisplatin (mgmz)
01 100% liều trước 100% liếu trước
2 100% liểu trước 50% liều trước
' Tiêu chuẩn độc tinh chung của Viện Ung thư Quốc gia (CTC v2.0; NC1 1998) _,
Phải ngừng điều trị với ALIMTA nếu bệnh nhân có bẩt cứ độc tính nảo trên máu ho ' áu
mức độ 3 hoặc 4 sau 2 lằn giảm liễu. hoặc ngay lập tức nếu quan sảt thẩy độc tinh ức
độ 3 hoặc 4
Người giả
Trong nghiên cửu lâm sảng, không có dắu hiệu cho thấy bệnh nhân từ 65 mối trở lên có nguy cơ về
tảc dụng không mong muốn nhiểu hơn so với bệnh nhân dưới 65 tuối. Không cần chế độ giảm Iiều
nảo khảc ngoải chế độ giảm liền được khuyến cáo chung cho tất cả bệnh nhân.
Trẻ em vả thiếu niên
ALIMTA không được khuyến cáo dùng cho bệnh nhân dưới 18 tuổi vì chưa xảc định được tính an
toản và hiệu quả trong nhóm bệnh nhân nảy. Không có dữ liệu liên quan đến việc sử dụng ALIMTA
ở nhóm trẻ em 11 trung biểu mô mảng phổi ảc tinh và ung thư phổi không tế bảo nhò.
Bệnh nhđn suy thận (Công thửc Cockcroft vả Gault chuẩn hoặc tốc độ lọc cầu thận đo bằng phường
phảp thanh thải huyết thanh Tc99m-DPTA)
Pemetrexed được thái trừ chủ yếu dưới dạng không đổi bời sự bải tiết của thặn. Trong các nghiên
cửu lâm sảng. bệnh nhân có hệ số thanh thải creatinin z 45mllphủt không cần sự điểu chinh liều nảo
khác ngoải sự điều chinh được khuyến câo cho tất cả bệnh nhân. Không có đủ đữ liệu về sử dựng
pemetrexed ở bệnh nhân có độ thanh thải creatinin dưới 45 ml/phút; do đó không khuyến cáo dùng
pemctrexed (xem mục 7.1 “Cảnh báo đặc biệt vả rhận trọng khi dùng ").
Bệnh nhăn suy gan
Không tim thẳy sự liên quan giữa AST (SGOT), ALT (SGPT), hoặc bilirubin toản phần vả được
động học cùa pemetrexed. Tuy nhiên bệnh nhân bị suy gan với bilirubin > 1,5 lần giới hạn trén cùa
mức binh thường vả/hoặc transaminase > 3,0 lần giới hạn trên của mửc binh thường (không có di
căn gan) hoặc > 5.0 lẩn giới hạn trên của mức binh thường (có di cãn gan) chưa được nghiên cứu
riêng biệt.
Cảch đùng
Thận trọng cần thiết trước khi chuẩn bị hoặc sử dụng ALIMTA, xem mục 7.4 “”Thận trọng đặc biệt
trong liêu hủy vả các thao lác khác".
ALIMTA được khuyến cáo dùng để truyền tĩnh mạch trong 10 phủt ở ngảy thứ nhất của mỗi chu
kỳ 21 ngảy. Xem hướng dẫn về cách hoán nguyên vả pha loãng ALIMTA trước khi truyền, mục 7.4
“Thận lrọng đăc biệt rrong liêu hủy vả các rhao rác khác
6.3. Chống chỉ định
Mẫn cảm với hoạt chất hoặc với bẩt cứ tả dược nảo liệt kê trong mục 2.
Đang cho con bú (xem mục 7.2 “Khả nảng sinh sán. mang rhai vả cho con bú ").
Dùng đổng thời vaccin sốt vảng (xem mục 8 “Tương tác với các lhuốc khác vả các dạng tương tác
khác ").
7. cÀxvu BÁO vÀ THẬN TRỌNG
7.1. Cânh bảo đặc biệt vả thận trọng khi sử dụng
Pemetrexed có thề ức chế chửc nảng tủy xương biền hiện bằng giảm bạch cầu trung tí ²
lượng tiểu cằn vả thiếu mảu (giảm toản bộ huyết cầu) (xem mục 9 “Các lác dụng ỏn g
muốn "). Sự ức chế tùy thường lả độc tinh giới hạn liều lượng. Phải theo đõi tác dụng ức chế tuỳ
Alimta lOOmg_vial_EU SmPC_I7 lan 2017_VNJan 2018_proposed truth_vOl Page 13
trong quá trình điều trị cho bệnh nhân và không được cho bệnh nhân dùng pemetrexed cho tới khi
số lượng bạch cầu trung tính (ANC) đạt mức 2 1.500 tế bảolmm3 và số lượng tiểu cẩu đạt mức 2
100.000 tế bảolmmẵ Sự giảm liền trong cảc chu kỳ tiểp sau dựa trên ANC, số lượng tiều cẩu thẩp
nhẩt vả độc tính ngoâi mảu cao nhất ghi nhặn từ chu kỳ điều trị trước (xem mục 6.2 "Liều dùng vả
cảch dùng ").
Khi được điều trị trước với acid folic vả vitamin 312, bệnh nhân it gặp độc tinh hơn vè giảm được
các độc tính trên máu vả ngoâi máu mức độ 314 như giảm bạch cầu trung tính. sốt giảm bạch cầu
trung tính vả nhiễm khuẩn kèm giảm bạch cầu trung tinh đó 3/4. Do đó phái hướng đẫn bệnh nhân
điều trị với pemetrexed rằng dùng acid folic vả vitamin 81; lá biện phảp dự phòng để giảm độc tỉnh
liên quan tới thuốc (xem mục 6.2 "Liếu dùng võ cách dùng ").
Các phân ứng da đã được báo cáo ở bệnh nhân không được điều tti trước với corticosteroid. Việc
điều trị trước với dexamethason (hoặc tương dương) có thề lảm giảm tần suất vả mức độ nặng cùa
phản ứng da (xem mục 6.2 “Liều dùng vì: cách dùng ").
Một số lượng hạn chế các bệnh nhân được nghiên cửu có độ thanh thải creatinin dưới 45 mllphủt.
Do đó, không khuyến cáo dùng pemetrexed cho bệnh nhân có độ thanh thải creatinin < 45 milphủt
(xem mục 6.2 "Liều dùng vả cách dùng ").
Bệnh nhân suy thận nhẹ đến vừa (độ thanh thải creatinin từ 45 đền 79 mllphủt) phới trânh dùng cảc
thuốc chống viêm không-steroiđ (NSAIDs) như ibuprofen, vả acetylsalicylic acid (> 1,3 g/ngảy)
trong 2 ngảy trước ngảy dùng, vảo ngảy dùng và 2 ngảy sau khi dùng pemetrexed (xem mực 8
“Tương tác vởi cảc thuốc khác vả các dạng lương tác khác ").
Ở những bệnh nhân suy thận nhẹ đến vừa. đủ tiêu chuẩn để đỉếu trị với pemetrexed phải trảnh dùng
NSAID có nửa đời thải trữ dải trong ít nhất 5 ngây trước ngảy dùng, vảo ngảy dùng. và ít nhắt 2
ngảy sau khi dùng pemctrexed (xem mục 8 “Tương lác vởi các thuốc khác vả các dạng tương rác
khác ").
Cảo biến cố nghiêm trọng trên thận, bao gồm cả suy thận cấp đã được bảo cáo khi sử dụng
pemetrexed đơn trị hoặc phối hợp với các hoá chẳt trị Iiệu khảc. Nhiều trong số những bệnh nhản
gặp cảc biến cố nảy đều có các yểu tố nguy cơ tiểm ẩn của bệnh thận như mẳt nước hay bị tăng
huyết ảp hoặc đái thảo đường từ trước.
Ánh hướng của dịch ở khoang thứ ba. như trản dich mảng phối hoặc cố trướng (báng) đối với
pemetrexed chưa được xác định đầy đủ. Một nghiên cứu pcmetrexed giai đoạn 2 trên 31 bệnh nhân
có khổi 11 đặc với dịch ở khoang thử 3 ốn đinh đã cho thẩy không có sự khảc biệt về nồng độ trong
huyết tương binh thường hoặc độ thanh thải so với những bệnh nhân không có địch ở khoang thứ
ba. Vi thế, cân nhắc việc dẫn lưu dịch ớ khoang thứ ba trước khi dùng pemetrexed. nhưng có thế
không cần thiết.
Do độc tinh trên tiêu hóa của pemetrexed kết hợp với cisplatin, mẩt nước nặng đã được ghi nhận.
Vì vậy. bệnh nhân phải được chống nôn đầy đủ và được bù nước thỉch hợp trước vảlhoặc sau khi '
điểu trị.
Các biến cố không mong muốn nghiêm trọng trên tim mạch gồm nhối máu cơ tim và biển cố
máu não ít xảy ra trong các nghiên cứu lâm sảng với pemetrexeđ, thường xảy ra khi dùng kết hợp
với một thuốc gây độc tế bâo khác. Phần lớn bệnh nhân gặp các tác dựng nảy đă có các yểu tố nguy
cơ tim mạch tử trước (xem mục 9 ““Các rác dụng khỏng mong muốn ").
Tình trạng suy giâm miễn dịch thường gặp ở bệnh nhân ung thư. Do đỏ, không khuyến cảo dùng
đổng thời với vaccin sống giảm độc tính (xem mục 6.3 “Chống chi đinh " và mục 8 “Tương lác vởi
cảc thuốc khảc và các dạng lương lác khác ").
Pemetrexed có thể gây tổn hại về di truyền. Nam giới trướng thảnh về sinh đục được khuyên không
nên lảm cha trong khi điều trị vả tới 6 tháng sau đỏ. Cảc biện pháp tránh thai hoặc kiêng giao hợp
được khuyến cáo. Do trị liệu với pemetrexed có thể gây vô sinh không hổi phục, nam giới được
khuyên tìm sự hướng dẫn về cất trữ tinh trùng trước khi bắt đầu điều tri.
Phụ nữ có khả nãng mang thai phái dùng các biện pháp tránh thai hữu hiệu trong khi điểu trị với
pemetrexed (xem mục 7.2 “Khả năng sính sán, mang Ihai vã cho con bú ").
Các trường hợp viêm phối khu trú đo xạ tri đã được báo cáo ớ các bệnh nhân điểu trị tia xạ trước,
trong hoặc sau khi dùng pemetrexed. Cẩn đặc biệt chủ ý tới các bệnh nhân nảy vả thặn trọng khi sử
dụng cảc hoá chất nhạy cảm tia xạ khảc.
Một số trường hợp nhiễm xạ dã được báo cáo 6 cảc bệnh nhân điếu tri tia xạ vải tuần hoặc vải năm
trước đó.
fflưiẸ
Mỗi lọ thuốc nảy có chứa ỉt hơn 1 mmol natri (23 mg). được coi là “không chứa natri".
7.2. Khả ning sinh sân, mang thai vì cho con bú
Biện pháp ưánh thai ở nam vả nữ
Phụ nữ có khả năng mang thai phải dùng biện phảp tránh thai hữu hiệu trong khi diển tri với
pemetrexed.
Pemeưcxed có thể gây tổn hại di trưyển. Nam giới trướng thảnh về sinh dục được khuyên không
nên lảm cha trong khi điều tri về tới 6 thảng sau dỏ. Cảc biện pháp trảnh thai hoặc kiêng quan hệ
tinh dục được khuyến cáo.
Mang thai
Không có dữ liệu từ việc sử dụng pemetrexed ở phụ nữ mang thai nhưng pemetrexeđ, cũng như cảc
chất chống chuyển hóa khác, bị nghi lả gây những khuyết tật bấm sinh nghiêm trọng khi đùng trong
thời kỳ mang thai. Nghiên cứu trên động vật cho thấy có độc tính trên hệ sinh sản (xem mục 5.3
“Dữ liệu an loản liền Iám sảng"). Pemetrexed không được dùng trong thời kỳ mang thai trừ khi
thật sự cần thiết, sau khi đã cân nhắc kỳ sự cẳn thiểt điếu trị cho mẹ vả nguy cơ đối với thai (xem
mực 7.1 “Cánh báo đăc biệt vả thận trọng khi dùng ").
C ho con bú
Không biết pemetrexed có bải tiết vảo sữa người hay không và không thế loại trừ cảc g
không mong muốn trên trẻ bú sữa mẹ. Phái ngimg cho con bú trong khi điều trị với pemetr e
( xem mục 6.3 “Chống chỉ định ").
Khả năng sinh sản
Do trị liệu với pemctrexeđ có khả nãng gây vô sinh không hồi phục, nam giới được khuyên tim sự
tư vẩn về cất trữ tinh trùng trước khi bắt đầu điều tri.
7.3. Tảc đụng trên khi ning lái xe vì vặn hânh mảy mỏc
Khỏng có nghiên cứu về tác dựng trên khả năng lái xe vả điều khiển máy móc. Tuy nhiên, đã có
báo cáo là pemetrexeđ có thể gãy mệt mòi. Vi vậy bệnh nhân phâi được nhắc nhớ đổi với việc lái
xe hoặc vận hảnh máy móc nểu tác dụng nảy xáy ra.
7.4. Thận trọng đặc biệt về tiêu hủy vì câc thao tíc khác
1. Dùng kỹ thuật vô khuẩn trong khi hoản nguyên vả pha loãng pemetrexed dế tiêm truyền tĩnh
mạch.
2. Tính liểu và sổ in ALIMTA cần đùng. Mỗi lọ chim một lượng dư pemetrexed để dễ lẩy lượng
thuốc ghi trên nhãn.
3. Hoản nguyên lọ 100 mg với 4,2 ml dung dịch natri clorid 9 mg/ml (0,9%) để tiêm, không có chất
bảo quản. tạo thảnh dung dich chứa 25 mglml pemetrexeđ. Lắc xoáy lọ nhẹ nhâng tới khi bột hòa
tan hoản toản. Dung dich thu được trong vả có mã… thay đối từ không mảu đển vâng hoặc xanh lá
cây—vâng mã không ánh hướng đển chất lượng cùa sản phẩm. Dung dịch hoản nguyên có pH giữa
6,6 và 7,8. Cẩn có sự pha loãng thêm.
4. Thể tich thích hợp của đung dịch hoản nguyên pemetrexed phải được pha loãng thêm thảnh 100
ml bảng dung dich natri clorid 9 mglml (0,9%) đề tiêm, không có chẩt bảo quán, và dược truyền
tĩnh mạch trong 10 phủt.
5. Cảc dung dich truyền pemetrexed được pha như chỉ dẫn ở trên tương hợp với các bộ tiêm truyền
và các tủi tiêm truyền tráng polyvinyl clorid vả polyoleiin.
6. Các sản phẩm thuốc tiêm phải được kiếm tra bằng mắt về chất lạ và sự đối mảu trước khi dùng.
Nếu quan sát thẳy chất lạ. không được dùng.
7. Cảc dung dịch pemetrexed chi để dùng một lẩn. Phần sản phẩm không dùng hoặc vật liệu thải
phải vứt bỏ theo đủng các yêu cằn cùa đia phương.
Những thặn trọng trong pha chế vù đùng thưốc:
Cũng như với cảc thuốc chống ung thư có khả nâng gây độc khảc, phải thận trọng khi thao tảc vả
pha các dung dịch tiêm truyền pemetrexed. Nên sử dụng găng tay. Nếu dưng dich pemetrexed tiểp
xúc với đa, rửa da ngay thật kỳ với nước và xả phòng. Nếu các đung dich pcmetrcxed tiếp xúc với
niêm mạc. giội nước cẩn thận để rứa. Pemetrexed không phải lả chất lảm rộp da. Không có thuốc
giải độc đặc hiệu cho sự thoát mạch pemetrexed. Một số ít ttường hợp thoát mạch pemetrc đã
được bảo cảo, tuy nhiên không được nhà nghiên cứu đánh giá 1â nghiêm trọng. Sự thoát `
được điều trị theo thực hảnh chuẩn ở địa phưcmg giống như với các thuốc không gây rộp da
8. TƯỢNG TẢC VỚI cÁc THUỐC KHẨC VÀ cÁc DẠNG TƯONG TÁC KHÁC
Pemetrexed được thải trừ chủ yếu 6 đạng khỏng đồi qua thặn nhờ bải tiểt ớ ống thận vả một phần
nhớ lọc ở cầu thận. Việc đùng đổng thời với các thuốc độc trẽn thặn (như aminoglycosid, thuốc lợi
tiếu quai, hợp chất platin, cyclosporin) có thể lâm chậm sự thanh thải pemetrexed. Cẩn thận trọng
khi phối hợp các thuốc nity. Nếu cằn dùng, phải theo dỏi chặt chẽ độ thanh thải creatinin.
Việc dùng đổng thời với cảc chất cũng được bải tiết bới ống thận (như probenecid, pcnicilin) có khả
nãng lảm chậm sự thanh thải pemetrexed. Phải thận trọng khi dùng các thuốc nảy kết hợp với
pemettexed. Nếu cần dùng, phải theo dõi chặt chẽ độ thanh thải creatinin.
Ó bệnh nhân có chức nãng thận binh thường (độ thanh thải creatinin 2 80 mllphủt), liều cao cảc
thuốc chổng viêm không steroid (NSAID, như ibuprofen > 1.600 mglngảy) vả acetylsalicylic ở liều
cao (> 1 ,3 g/ngây) có thể 18… giảm sự thải trừ pemetrexed, và do đó Iảm tăng các tác dụng không
mong muốn của pemetrexed. Vì vậy. phải thận trọng khi dùng liều cao NSAID, hoặc acetylsalicylic
đồng thời với pemetrexed cho bệnh nhân có chức năng thặn bình thường (độ thanh thải creatinin 2
80 mllphủt).
ớ bệnh nhân có Stty thận nhẹ đến vừa (độ thanh thải creatinin tử 45 đến 79 ml/phủt), phải tránh
đùng đổng thời pemetrexed với các NSAID (như ibuprofen), hoặc acetylsalicylic ớ Iiều cao trong 2
ngảy trước, trong ngảy đùng, vả 2 ngảy sau khi dùng pemetrexed (xem mực 7.1 "Củnh bảo đặc biệt
vả lhản lrọng khi dùng ").
Trong khi không có dữ liệu về nguy cơ tướng tác với NSAID có nửa đời thải tn'x dải hơn như
piroxicam hoặc rofecoxib, phải tránh dùng đồng thời với pemettcxeđ ở những bệnh nhân suy thận
mức độ nhẹ đến vữa trong it nhẩt 5 ngảy trước ngảy dùng, vảo ngây dùng vả ít nhất 2 ngảy sau khi
dùng pemetrexeđ (xem mục 7.1 “Củnh báo đặc biệt vả lhận lrọng khi dùng"). Nếu cần phải dùng
đống thời với các thuốc NSAID. bệnh nhân cần được theo dỏi chặt chẽ độc tính, dộc biệt lả suy tùy
vả nhiễm độc đường tiêu hóa.
Pemetrexed ít được chuyền hỏa ở gan. Cảc kểt quả nghiên cứu in vilro với microsom gan người cho
thắy pemetrexed có thế không gây ức chế có ý nghĩa lâm sảng sự chuyền hóa cùa các thuốc được
chuyến hóa bời CYP3A. CYP2D6, CYP2C9. vả CYPIA2.
Tương túc hay gặp vởỉ tất cả thuốc gây độc tố bùo:
Vì nguy cơ huyết khổi tăng lên ớ bệnh nhãn ung thư. liệu pháp chống đỏng thường được dùng. Do
có sự đao động lớn giữa cảc cả thể về tinh trạng đỏng máu trong cảc bệnh và do khả năng tương tảc
giữa các thuốc chống đông máu đường uổng với hỏa trị liệu chống ung thư nên cẩn phải theo dõi
iNR (lntematìonal Normaliseđ Ratio: tỷ số bình thường hóa quốc tể) thường xuyên hơn. nếu quyết
đinh sử dụng các thuốc chổng đông đường uống cho bệnh nhân. '
Chống chỉ định dùng đồng thời: vaccin sốt vảng: nguy cơ tử vong vì bệnh do vaccin phát triền toản
thân (xem mục 6.3 “Chống chỉ định ").
Không khuyến cảo dùng đồng thời: vaccin sống giảm tính độc (trữ sốt vảng, chống chỉ đi g
đổng thời): nguy cơ bệnh toản thân. có thể gây tử vong. Nguy cơ tâng lẻn ở cảc dối tượng đã b
giảm miễn dịch bới bệnh tiếm ấn. Dùng vaccin bẩt hoạt nếu có (bệnh bại liệt) (xem mực 7.1 “Cảnh
báo đặc biệt vả lhận lrọng khi dùng ").
TÍNH TƯỢNG KY
Pemetrexed tương kỵ vật lý với chẳt pha loãng chửa calci, bao gổm thuốc tiêm Ringer lactat vả
thuốc tiêm Ringer. Vì không có các nghiên cứu về tương hợp (với các thuốc vả chất pha loãng
khảc), không được trộn lẫn sản phẩm thuốc nảy với cảc sản phẩm thuốc khác.
9. cẮc TÁC DỤNG KHÔNG MONG MUÔN
Tg'm tắt hồ sơ an toản
C ảc tác dụng không mong muốn đã được bảo cảo thường gặp nhất liên quan với pemetrexed, được
sử đụng dưới dạng đơn tri liệu hoặc phối hợp, gổm suy tủy với biều hiện như thiểu máu. gỉảm bạch
cẳu trung tinh, giảm bạch cầu, giảm tiều cầu vả độc tính trên đường tiêu hóa với biểu hiện như chản
ăn, buồn nôn, nỏn, tiêu cháy, táo bỏn, viêm họng, viêm niêm mạc vả viêm miệng. Cảc tác dụng
không mong muốn khảc bao gồm độc tinh đối với thận, tãng aminotransfcrase, rựng tóc, mệt mòi,
mẩt nước, nổi ban. nhiễm trùng/nhiễm khuẩn và bệnh thần kinh.
Cảc tác đụng phụ hiếm gặp bao gổm hội chững Stevens-Johnson vả hoại từ biểu bì nhiễm độc.
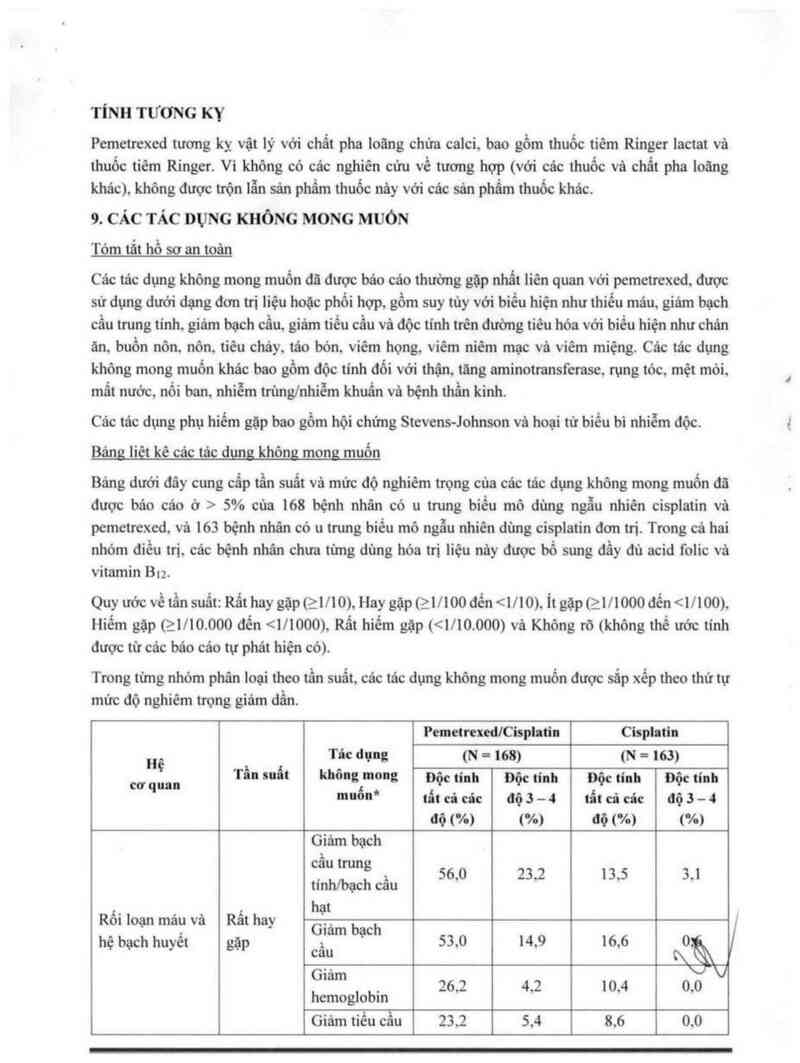
Bảng liệt kê các tảc dựng không mong muốn
Bảng dưới đây cung cấp tằn suất và mức độ nghiêm trọng của các tác dụng không mong muốn đã
được báo cáo ở > 5% của 168 bệnh nhân có 11 trung biếu mô dùng ngẫu nhiên cisplatin vả
pemetrexed, và 163 bệnh nhân có 11 trung biểu mô ngẫu nhiên dùng cisplatin đơn trị. Trong cả hai
nhóm điều trị. các bệnh nhân chưa từng đùng hóa trị liệu nảy được bổ sung đầy đủ acid folic vả
vitamin Bu.
Quy ước về tần suất: Rắt hay 849121110), Hay gặp tzmooớén <1l10).1t8ỗP(21/1000 đến <…00).
Hiếm gặp (“21710000 đển <171000), Rất hiểm gặp t<1710.000) vả Không rõ (không thể ước tính
được từ các bảo các tự phát hiện có).
Trong từng nhỏm phân loại theo tần suất, cảc tác dụng không mong muốn được sắp xếp theo thứ tự
mức độ nghiêm trọng giảm dần.
PcmetrcxeđlCisphtin Cisphtin
11“ Tác đọng (N = 168) (N = 163)
9
cơ qua Tổn suốt khõnclmonc Độc tinh Độc tinh oộc tinh Độc tinh
mm" tát cã cớc ớộ 5 = 4 tất cả cảc tiộ 5 - 4
độ (%) (%) độ (%) (%)
Giám bạch
cầu tnmg
, 56,0 25,2 ,5 5,1
tinhfbạch câu 13
R“ 1 ' ả R“t h hạ
01 oạn mau V 8 ay .
Glâm ch
hệ bạch huyềt gặp , bạ 55.0 14,9 16,6 OẦ
cau {\
… V
6… , 26,2 4,2 10,4 0,0
hemoglobm
Giảm tiểu cầu 252 5.4 8,6 0,0
Rỗi loạn chuyển
hóa vả dinh Hay gặp Mất nước 6,5 4,2 0,6 0,6
dưỡng
_ _ , Rẫt hay Bệnh thần
Ẹỉihloạn hẹ than gặp kinh cám g1ảc 10,1 0,0 9.8 0,6
Hay gặp Loạn vị giác 7,7 0,0*“ 6,1 0.0“*
Rối loạn về mắt Hay gặp Viêm kểt mạc 5,4 0,0 0,6 0,0
Tiêu chảy 16,7 3,6 8,0 0,0
Nôn 56,5 10.7 49,7 4,5
Viêm
Rẩt hay miệnngiêm 25.2 5.0 6,1 0,0
Rối loạn tiêu hỏa gặp họng
Buồn nôn 82,1 1 1,9 76,7 5,5
Chán ăn 20,2 1,2 14,1 0,6
Tảo bỏn 11.9 0,6 7,4 0,6
Hay gộp Khó tiêu 5.4 0,6 0,6 0,0
Rối loạn đa vả tổ Rất hay Ban lỔ—l 016 4~9 0~0
chức dưới da gặp Rụng tóc lông 1 1.5 0,0… 5,5 0,0…
Tăng creatinin 10,7 0,6 9,8 1,2
Rối loạn thận vả Rất hay Giảm đó
tiết niệu gặp thanh thải 16.1 0,6 17,8 1,8
creatininMI
Rôi loạn chua .
và tinh trạng tẵi Râ' hay Mệt mỏi 47,6 10,1 42,5 9,`
chỗ tiêm truyền gặp ĩ
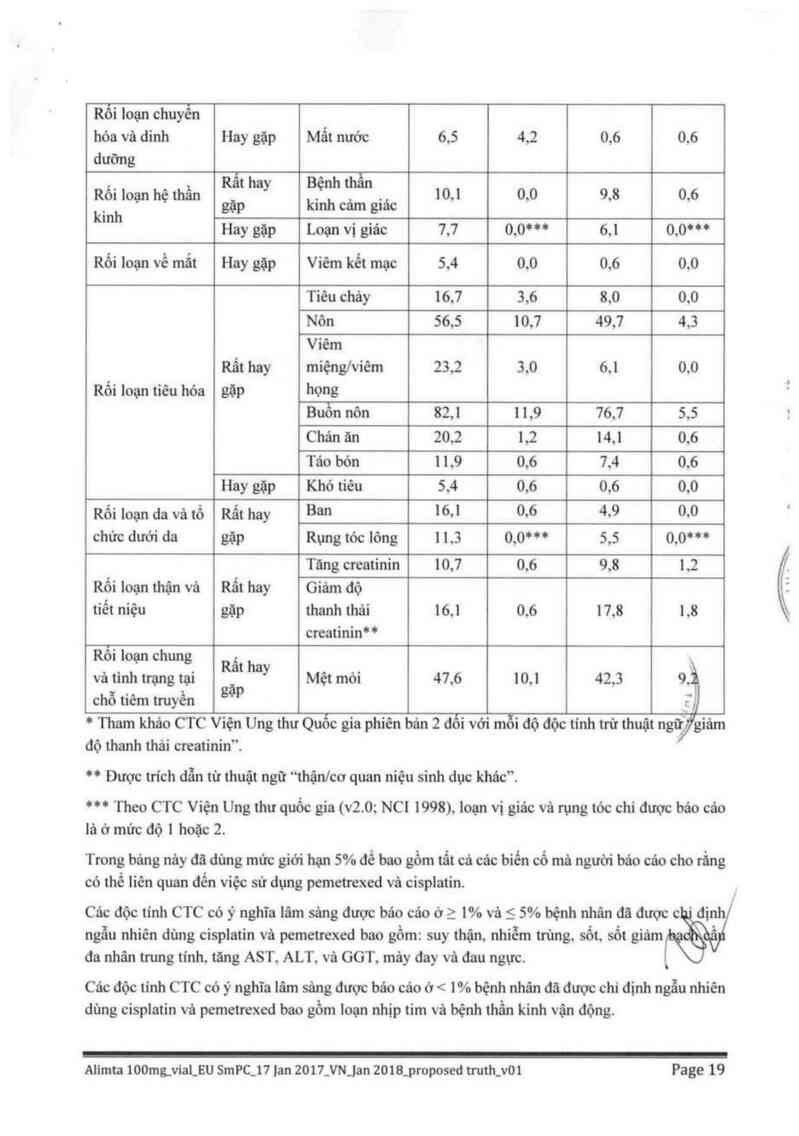
* Tham kháo CTC Viện Ung thư Quốc gia phiên bản 2 đối với mỗi độ độc tinh trừ thuật ngữJgiám
độ thanh thải creatinin’.
“ Được trich đẫn từ thuật ngữ “thậnlc0 quan niệu sinh dực khác”.
*“ Theo CTC Viện Ung thư quốc gia (v2.0; NC1 1998), loạn vị giác và rụng tóc chi được báo các
lá ở mửc độ 1 hoặc 2.
Trong báng nảy đã đùng mức giới hẹn 5% để bao gổm tất cả các biến cổ mà người báo cáo cho rầng
có thế 1iên quan đển việc sử dụng pemetrexcd vả cisplatin. `
Các độc tính CTC có ý nghĩa lâm sâng được báo cáo ở > 1% vả < 5% bệnh nhân đã được c đinh
ngẫu nhiên dùng cisplatin vả pemetrexed bao gổm: suy thặn, nhiễm trũng, sốt sốt giám
đa nhân trung tinh. tãng AST, ALT, vả GGT, mảy đay và đau ngực.
Các độc tỉnh CTC có ý nghĩa lâm sâng được bảo cáo ở < 1% bệnh nhân đã được chỉ định ngẫu nhiên
dùng cisplatin vả pemetrexed bao gồm loạn nhịp tim và bệnh thần kinh vận động.
Alimta lOOmg_vialjU SmPCJ7 lan 2017_VNJan ZOIS_proposeđ truth_vOl Page 19
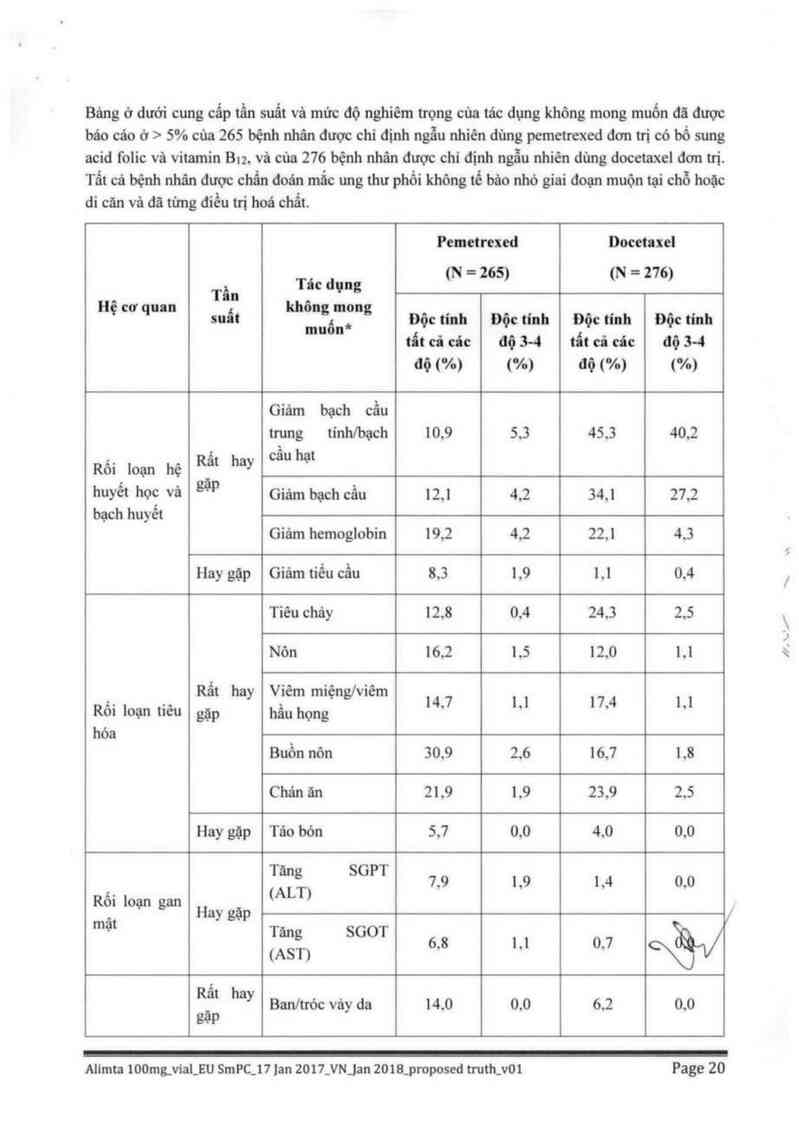
Bảng ở dưới cung cấp tẩn suất và mửc độ nghiêm trọng cùa tác dựng không mong muốn đă được
báo cáo ở > 5% của 265 bệnh nhân được chỉ định ngẫu nhiên dùng pemetrexed đơn trị có bổ sung
acid folic vả vitamin Btz, vả cùa 276 bệnh nhân được chỉ định ngẫu nhiên dùng docetaxel đớn tri.
Tẩt cả bệnh nhân được chẩn đoán mắc ung thư phổi không tế bâo nhỏ giai đoạn muộn tại chỗ hoặc
di căn và đã từng điều tti hoá chẩt.
Pemetrexeđ Docetaxel
= 26 N = 276
Tác đọng (N 5) ( )
Tấn
Hệ cơ quan không mong
suất muốn* Độc tinh Độc tinh Độc tinh Độc tinh
tát cỉ củc độ 54 tất eti cớc t1ộ 5-4
độ (%) (%) độ (%) (%)
Giảm bạch cầu
trung tinhlbạch 10,9 5,3 45,3 40,2
. cầu hạt
Rôỉ loạn hệ Rẩ' hay
huyêt học vả gặp Giảm bạch cẩu 12,1 4,2 54,1 27,2
bạch huyết
Giâm hemoglobin 19.2 4.2 22,1 4,3
Hay gặp Giảm tiểu cằn 8.3 1.9 1.1 0.4
Tiêu chảy 12.8 0,4 24.3 25
Nôn 162 1,5 12,0 1,1
Rất hay Viếm miệng/viêm
._ .. 4.7 , 7.4 ,
RỒI lOẸn 1161] gặp hẩu họng 1 l 1 1 l 1
hỏa .
Buôn nôn 30.9 2,6 16,7 1,8
Chán ãn 21,9 1,9 23.9 2.5
Hay gặp Táo bón 5,7 0,0 4,0 0,0
Tăng SGPT 7,9 1,9 1,4 0,0
1 . (ALT)
Rm loạn gan _
m.t Hay sặp v
ạ Tăng SGOT 6 8 1 1 0 7
(AST) ' ’ '
ắ
ỆỆ hay Banltróc vảy da 14.0 00 6,2 0,0
Alimta lOOmg_viaLI-IU SmPCJ7 lan 2017_VNJan 2018_pmposed truth_vOl Page 20
l/. \.`x'
Rối loạn da Ngứa 6,8 0,4 118 0,0
và tổ chừc Hay gặp
duới da Rựng tớc 6,4 0,4… 57.7 2,2…
x. *
R°' '°ạn Rat hay Mệt mới 54,0 55 55,9 5,4
chung và tình gễP
trạng tại chỗ
tiêm truyền Hay gặp Sốt 8.3 00 7.6 0.0
’ Tham khảo CTC Viện Ung thư Quốc gia phiên bán 2 đối với mỗi độ độc tinh.
“ Theo CTC của Viện Ung thư quốc gia (v2.0; NC1 1998), rựng tóc chi được báo cáo lá ở mửc độ
1 hoặc 2.
Trong bảng nảy, đã dùng một điểm giới hạn 5% để bao gồm tẩt cả tác dựng không mong muốn mả
người báo cáo cho là có thể liên quan đển việc sử dựng pemetrexed.
Cảc độc tính CTC có ý nghĩa lâm sảng được báo cáo ở 2 1% và S 5% bệnh nhân đã được chi đinh
ngẫu nhiên dùng pemetrexed gồm: nhiễm khuẩn không có giảm bạch cầu trung tính, sốt giảm bạch
cầu trung tính, phản ứng dị ửng/quá mẫn, tảng creatinin, bệnh thần kinh vận động, bệnh thần kinh
cảm giác, ban đó đa đạng vả đau bụng.
Các độc tinh CTC có ý nghĩa lâm sảng được báo cảo ớ < 1% bệnh nhân đã được chỉ định ngẫu nhiên
dùng pemetrexed gồm có loạn nhip trên thất.
Cảc độc tính về xét nghiệm độ 5 vả độ 4 có ý nghĩa lâm sảng tương tự nhau giữa cảc kết quả của
pha 2 hợp nhẩt từ 3 nghiên cứu đủng đơn trị pemetrexed (n = 164) vả kết quả của nghiên cứu pha 3
dùng pemetrexed đơn trị được mô tả ở trên, ngoại trừ giảm bạch cầu tmng tính (12,8% so với 5,3%.
tương ứng) vả tăng alanin transaminase (15,2% so với 1,9%, tương ứng). Những sự khác nhau nảy
có thể do khác nhau trong quần thể bệnh nhân, vi các nghiên cửu pha 2 bao gổm cả những bệnh
nhân ung thư vú chưa dùng vả đã dùng hóa trị liệu trước, có di cân gan từ trước vả/hoặc các xét
nghiệm chức nảng gan bất thường truớc nghiên cửu.
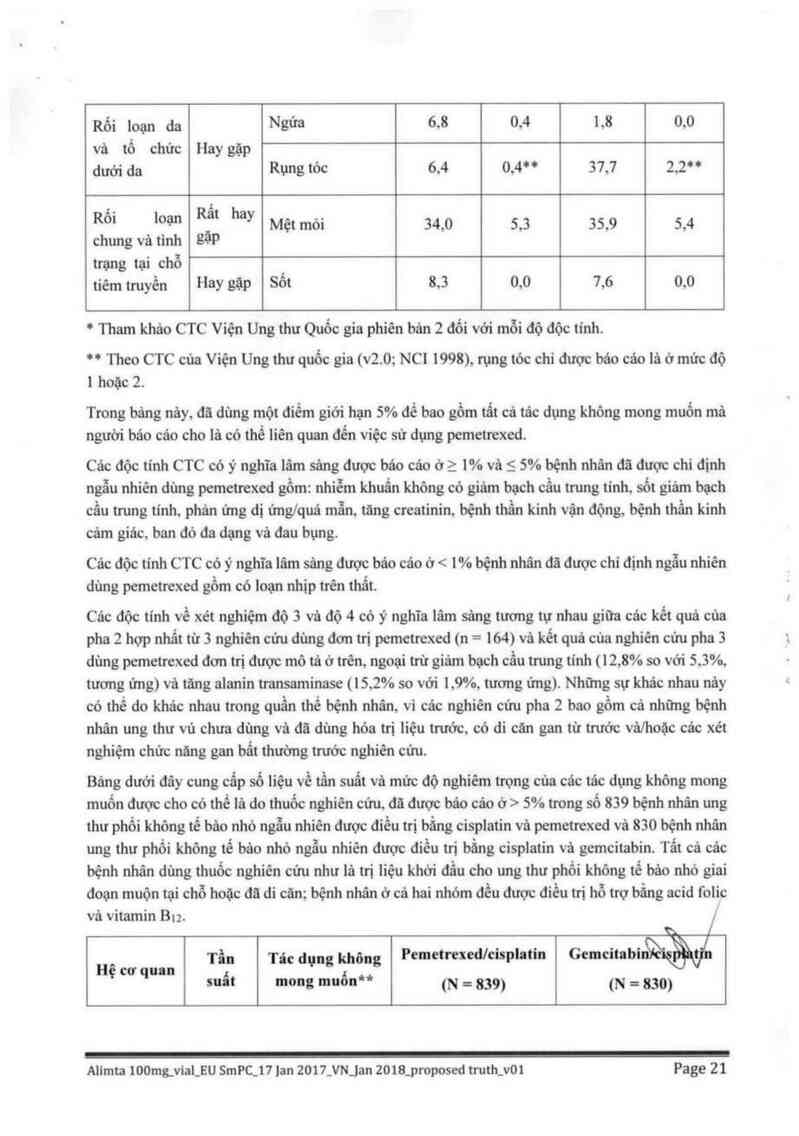
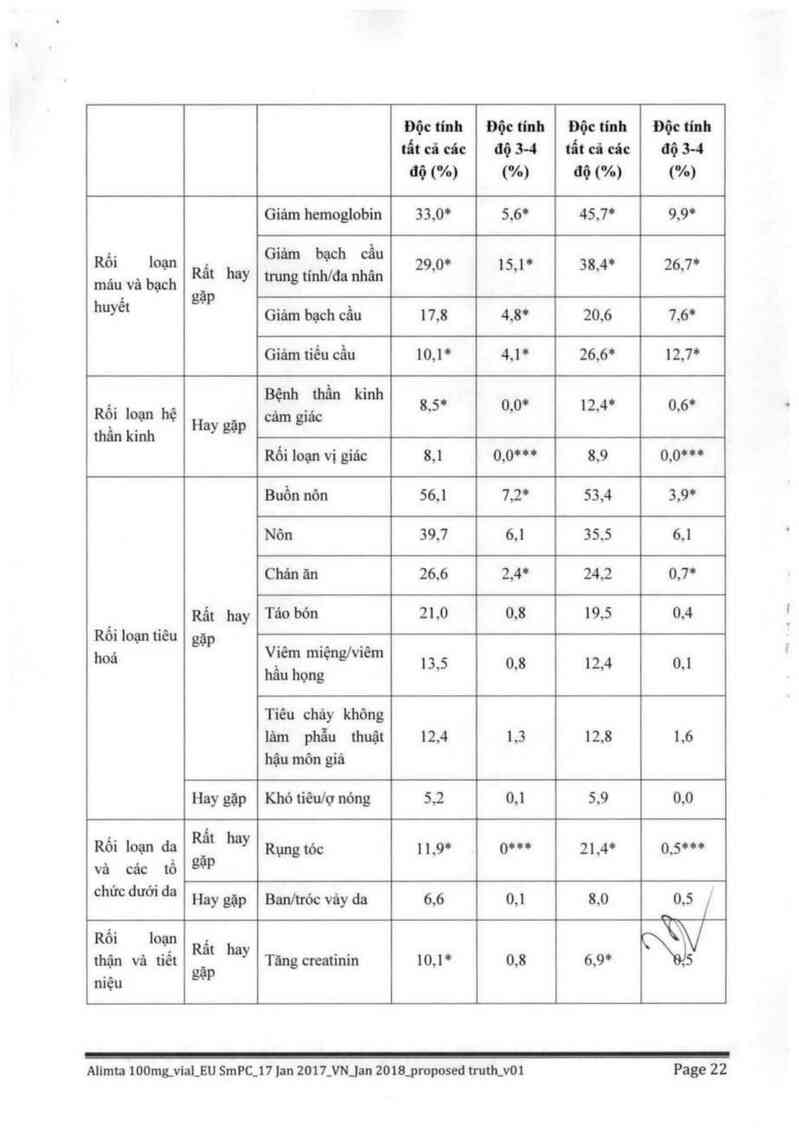
Báng đười đây cung cấp số liệu về tẩn suất và mức độ nghiêm trọng của cảc tác dụng không mong
muốn được cho có thể lả do thuốc nghiên cứu, đã được báo cáo ở > 5% trong số 859 bệnh nhân ung
thư phổi không tể bâo nhỏ ngẫu nhiên được điểu trị bằng cisplatin vả pemetrexed và 830 bệnh nhân
ung thư phổi không tế bảo nhỏ ngẫu nhiên được điều trị bắng cisplatin vả gemcitabin. Tất cả các
bệnh nhân đùng thuộc nghiên cữu như là trị liệu khời đầu cho ung thư phổi không tế bảo nhỏ giai
đoạn muộn tại chỗ hoặc đã đi cãn; bệnh nhân ở cá hai nhóm đều được điều trị hỗ trợ bằng acid folic
vả vitamin Bu. /
n
Tần Tác đụng không Pentetrcxeđlcisplatin GcmcitabỉnỀlềtỉh
Hệ cơ quan ấ ố “
su t mong 11111 11 (N ~: 839) (N = 830)
Alimta lOOmg_vial_EU SmPC_I7 lan 2017_VNJan 2018 _proposed trưth_vOl Page 2 1
Độctính Độctính Độc tinh Độc tinh
tẩt cả các độ 54 tất ci cảc t1ộ 5-4
độ 1%) 1… độ (%) 1%)
Giảm hemoglobin 55,0— 5,6° 45,7… 9,9…
Rối loạn - Giàm bạCh Cà“ 29 02 151* 58 4… 26 7*
máu và bạch Rât hay trung t1nh/đa nhân
hu ết gặp 1.
y Giám bạch cau 17,8 4,8° 20,6 7,6"
Giảm tiều cẩu 10,1* 4,1 * 26,6* 12,7—
Bệnh thần kinh
Rối ioạn hệ Ha ặ cámgiác 8*5* 0’0' '2'4i 0'6'
thần kinh " ² P
Rối ioạn vi giớc 8,1 0,0… 8,9 0,0…
Buồn nôn 56,1 7,2* 55,4 5,9—
Nôn 59.7 6.1 55.5 6.1
Chán ăn 26,6 2,4— 24,2 0,7…
Ri, hay Tớo bón 21,0 0,8 19,5 0,4
Rốiloạn tiêu gặp
v~ . .
hơá .'êm m'ệng’v'ẽm 15,5 0,8 12,4 0.1
hâu họng
Tiêu chảy không
111… phẫu thuật 12,4 1,5 12,8 1,6
hậu môn giả
Hay gặp Khó tiêulợ nóng 52 0,1 59 0.0
Rối ioạn dc Rất hay Rụngtóc 11,9* 0… 21,4— 0,5…
và các tô gặp
°hức dưở'd° Hay gộp Banltrỏc vây da 6,6 0,1 8,0 0.5 /
Rối loạn Rẩt ha [Ổ]
thặn vả tiểt y Tăng creatinin 10,12 0,8 6,9° ,5
niệu gặp
Alimta lOOmgviaLlĩU SmPCJ7 lan 2017_VNJan 2018_proposeđ truth_vOl
Page 22
Rối loạn
chung vả
tình ưạng tại
chỗ tiêm
truyền
Rất hay
Mệt mỏi 42.7 6.7 44.9 4,9
EặP
* Giá trị P < 0,05 khi so sảnh giữa pemetrexedlcisplatin vả gemcitabin/cisplatin, sữ đụng Fisher
Exact test.
“ Tham khác CTC Viện Ung thư Quốc gia phiên bản 2 đối với mỗi độ độc tinh.
*" Theo CTC Viện Ung thư quốc gia (v2.0; NC1 1998), loạn vị giác và rụng tóc chi được báo các
lá ở mức độ 1 hoặc 2.
Trong bảng nảy, đã dùng một đỉềm giới hạn 5% để bao gồm tất cả tác dựng không mong muốn mả
người báo cáo cho lá có thế lién quan đến pemetrexed vả cisplatin.
Các độc tinh có ý nghĩa lâm sảng được bảo cáo ở mửc 2 1% và S 5% bệnh nhân đã được chỉ định
ngẫu nhiên dùng pemetrexed vả cisplatin gồm: tăng AST, tăng ALT, nhiễm trùng, sổt giảm bạch
cầu tmng tính, suy thận, sổt, mất nước, viêm kết mạc và giám độ thanh thải creatinin.
Các độc tinh có ý nghĩa lâm sảng được bảo cáo < 1% ở bệnh nhân đã được chi định ngẫu nhiên
dùng pemetrexeđ vả cisplatin gổm có tăng GGT, đau ngực, loạn nhịp tim và bệnh thần kinh vận
động.
Cảc độc tinh có ý nghĩa lâm sảng tuỳ thuộc giởi tính cũng tương tự như quằn thề chung cùa bệnh
nhân đùng pemetrexed kết hợp cisplatìn.
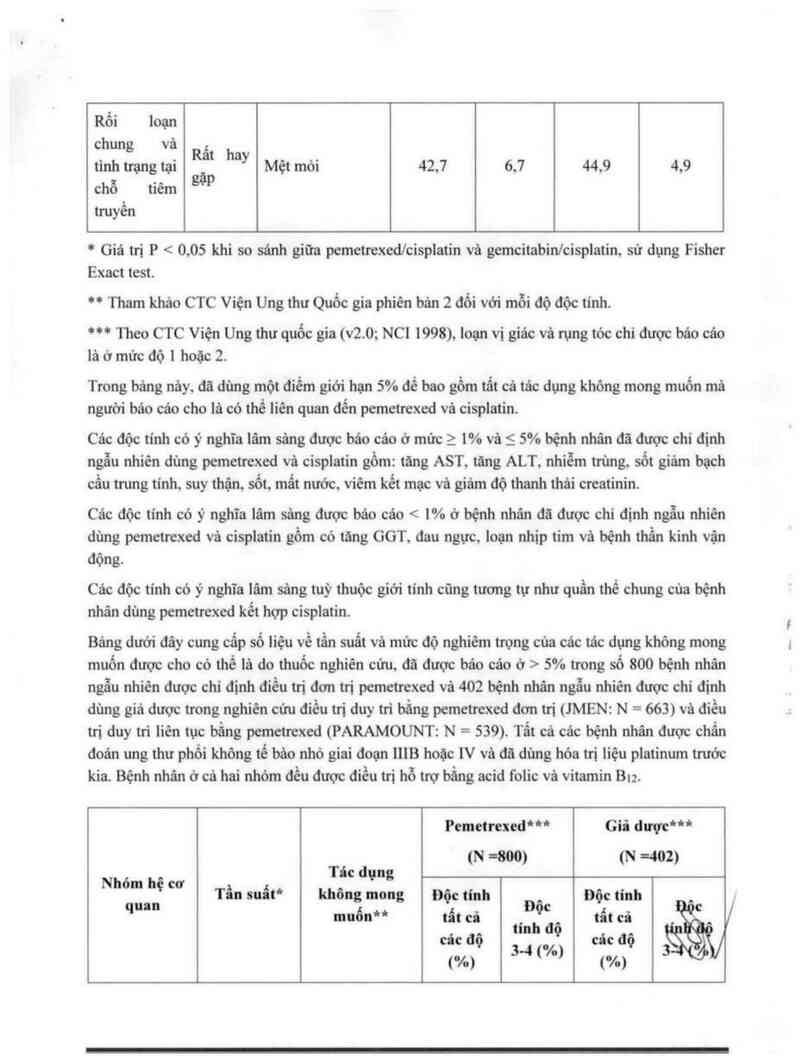
Bảng dưới đây cung cẩp số liệu về tần suất và mức độ nghiêm trọng của các tác dựng không mong
muốn được cho có thế lả do thuốc nghiên cứu, đã được báo cáo ở › 5% trong số 800 bệnh nhân
ngẫu nhiên được chỉ định điếu trị đơn trị pemetrexeđ vả 402 bệnh nhân ngẫu nhiên được chỉ định
dùng giả dược trong nghiên cứu điếu trị dưy tri bằng pemetrexed đơn trị (JMEN: N = 663) và điều
trị duy … liên tực bắng pemctrexed (PARAMOUNT: N = 559). Tất cả các bệnh nhân được chẩn
đoán ung thư phổi khòng tể bèo nhớ giai đoạn 1118 hoặc 1V vả đã đùng hỏa trị liệu platinum trườc
kia. Bệnh nhân ớ cả hai nhóm đễu được điều trị hỗ trợ bằng acid folic vả vitamin B….
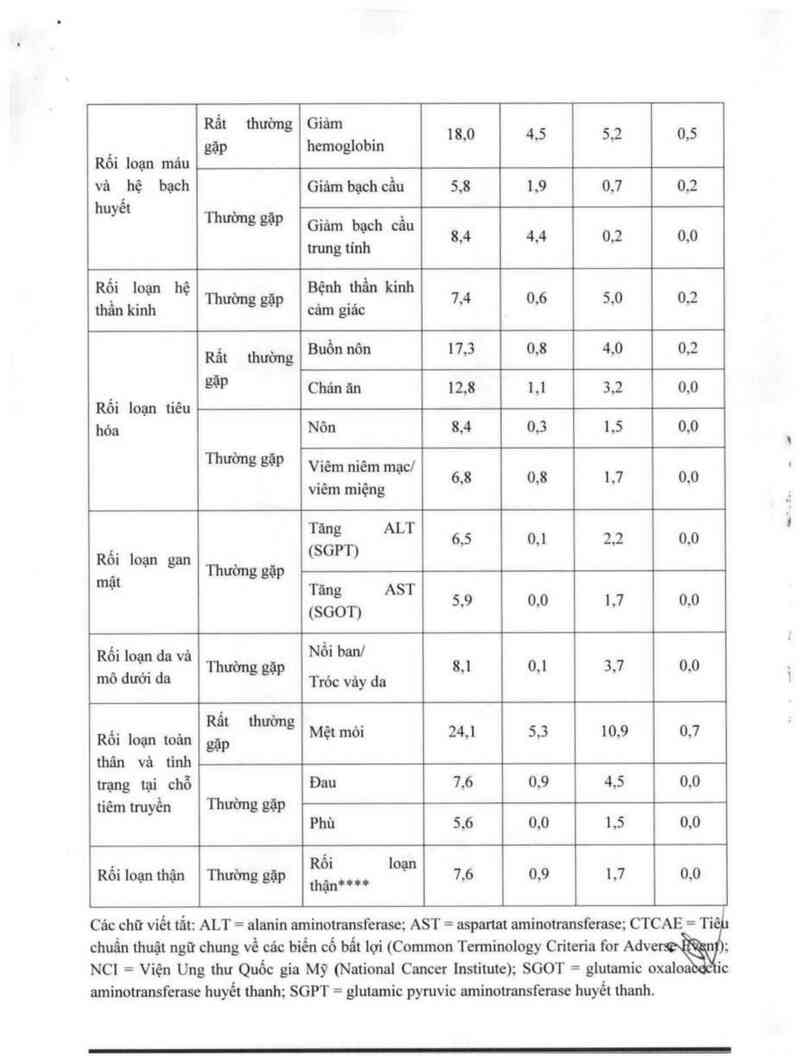
Pemetrexe *** Giã được***
i u … =8001 (N =402)
T c ụng
Nhỏm hệ cơ Tẫn suất* không mong Độc tinh Độc tính ,
quan H Độc , c
muốn tất cả tính đ“ tất ca
câc độ 34 (°/ọ) câc độ 3
1%) ' 1%)
Rẩ' thường G'ảm . 18,0 4,5 5,2 0,5
gặp hemoglobm
Rối loạn mảu
và hộ bạch Giám bạch cầu 5,8 1,9 0,7 0,2
huyết
Thường gặp .
G'àm bạCh Cẩu 8,4 4,4 0,2 0,0
trưng tính
Rối loạn hệ Bệnh thần kinh
. 4 ,
thânkinh Thườnggặp càm giác 7, 0,6 5,0 02
Rất mường Buồn nôn 17,5 0,8 4,0 0,2
' gặp Chán ăn 12,8 1,1 5,2 0,0
Rôi loạn tiêu
hóa Nôn 8,4 0,5 1,5 0,0
Thường gặp ., ..
V_'Ềm “',em mạc' 6,8 0,8 1,7 0,0
v1ern miệng
Tà“² ALT 6,5 0,1 2,2 0,0
Rối Ioạn gan (SGPT)
mật Thường sặp
Tăng AST
09 9 \ !
( 8 001) 5 o 0 1 7 0 0
- Nổi ban]
Rố' l°Ễẵ'daVà Thuớng sim 8,1 0,1 5,7 0,0
mô dươi da Tróc vày da
Rất thường . .
Rối loạn toản gặp Mẹt mò1 24,1 5,3 10,9 0,7
thân và tỉnh
trạng tại chỗ Đau 7,6 0,9 4,5 0,0
tiêm truyền Thường EễP
Phù 5,6 0,0 1,5 0,0
Rố'
Rối loạn thận Thường gặp thậịl_… loạn 7,6 0,9 1,7 0,0
Các chữ viết tắt: ALT = alanin aminotmnsferase; AST = aspartat aminotmnsferase; CTCAE = Ti
chuẩn thuật ngữ chung về các biến cố bắt iợi (Common Terminology Criteria for Adve
NC1 = Viện Ung thư Quốc gia Mỹ (National Cancer institute); SGOT = glutamic oxal
aminoưansferase huyết thanh; SGPT = glutamic pyruvic aminotransferase huyết thanh.
’ Định nghĩa về thuật ngữ tần suất: Rất thường gặp - a 10%; Thường gặp - > 5% vả < 10%. Trong
bảng nảy, một điềm giới hạn 5% đã được sử dụng để bao gổm tất cả các biển cổ mà người bảo cảo
đã xem xét là có thề liẽn quan với pemetrexed.
** Them khảo tiêu chuẩn của NC1 CTCAE (Phiên bán 50; NC1 2005) đối với mỗi cẩp độ độc tỉnh.
Tỷ lệ báo cáo đã được trình bảy theo CTCAE phiên bản 3.0.
… Báng tổng hợp các phản ứng bẩt lợi kết hợp cảc kết quả ctio nghiên cửu JMEN điều trị duy tri
bằng pemetrexeđ (N = 665) và nghiên cứu PARAMOUNT điểu trị duy tri liên tuc bắng pemetrexed
(N = 559).
““ Thuật ngữ kết hợp bao gồm tảng creatinin huyết thanhlcreatinin mảu, giảm tốc độ lọc của cầu
thận, suy thận và thặn/cơ quan sinh dục niệu — khác.
Độc tính theo tiêu chuẩn độc tính chung (CTC) có ý nghĩa lâm sảng ờ bẩt kỳ cắp độ nâo đã được
bảo cảo ớ a 1% vả s 5% bệnh nhân được phân bổ ngẫu nhiên vảo nhỏm điểu trị bằng pemeưexeđ
bao gồm: giảm bạch cẳu trung tính có sốt, nhiễm trùng, giảm tiểu cầu, tiêu chảy, táo bỏn, rựng tóc,
ngủa, sốt (không có giảm bạch cầu trung tinh), bệnh bề mặt mắt (bao gốm cả viêm kết mạc). tăng
chảy nước mắt, chóng mặt vả bệnh thần kinh vận động.
Độc tinh theo tiêu chuẩn độc tính chung (CTC) đã được báo cảo ớ < 1% bệnh nhân được phân bố
ngẫu nhiên vảo nhóm điều trị bằng pemetrexed bao gổm: phán ứng dị ủnglquả mẫn, ban đó đa đạng,
loạn nhịp trẽn thắt vả nghẽn mạch phổi.
Độ an toản đã được đánh giá đối với những bệnh nhân được chọn ngẫu nhiên vâo nhỏm điểu trị
bằng pemetrexed (N = 800). Tỳ hộ các biến cố bẩt lợi đã được đảnh giá đối với những bệnh nhân
nhận được $ 6 chu kỳ điểu trị duy tri bằng pemetrexed (N = 519) và so với những bệnh nhân nhận
được > 6 chu kỳ điếu trị bằng pemetrexed (N = 281 ). Đã ghi nhận thấy tảng cảc phản ủng bất lợi
(tất cả các cấp độ) với thời gian sử dựng thước dải hơn. Mức tãng có ý nghĩa về tỷ lệ giảm bạch cầu
trung tính cấp độ 3l4 có thế liên quan với thuốc nghiên cửu đã được ghi nhận với thời gian sử dựng
pemetrexed đâỉ hơn (5 6 chu kỳ: 3.3%, > 6 chu kỳ: 6,4%: p = 0,046). Khỏng có sự khác biệt nảo có
ý nghĩa thống kê về bẩt kỳ các phản úng bắt lợi cẩp độ 57475 riêng 1e nảo khác đã được thấy với thời
gian sử dụng thuốc dải hơn.
Có 11 bảo cáo về các biến cố tim mạch và mạch mảu não nghiêm trọng bao gổm nhổi máu cơ tim,
đau thắt ngực. tai biển mạch máu não và cơn thiếu mảu cực bộ nhẩt thời trong các nghiên cửu lâm
sảng với pemetrexed, thường xảy ra khi dũng phối hợp với một thuốc gây độc tế bản khác. Phấn
lớn bệnh nhân gặp các tác đựng nảy đã có cảc yếu tố nguy cơ tim mạch từ trước.
Hiếm cớ cảc bảo cảo vế viêm gan. có nguy cơ trầm trọng, trong các nghiên củu lâm sảng với
pemetrexed.
Trong các thử nghiệm lâm sảng, cảc trường hợp viêm đại trâng (bao gồm chảy máu ruộ
trâng, đôi khi gây tử vong, thủng ruột, hoại tử một và viếm manh trảng) hiếm khi được
bệnh nhãn sữ dựng pemetrexed.
Giảm toản bộ huyết cầu it khi được bảo các trong cảc thử nghiệm lâm sảng với pemetrexed. ,
bảo Ễosớ
Allmta lOOmg_vial_EU SmPC_I7 lan 2017_VNJan 2018_proposeđ truth_v01 Page 25
/.jĩj\
'Ù’
Trong cảc thử nghiệm 1âm sảng, viêm phổi mô kê và suy hô hấp, đôi khi gây tử vong, ít khi được
báo cảo ở bệnh nhân điểu trị bằng pemetrexed.
Cũng ít có bảo cáo về các trường hợp phủ ở bệnh nhân đùng pemetrexed.
Viêm thực quản/viêm thực quản phóng xạ được bảo cảo không thường xuyên trong qua' trinh thử
nghiệm lâm sảng với pemetrexed.
Nhiễm khuẩn, đôi khi gây tử vong, đã được báo cáo thường gặp ttong các thử nghiệm 1âm sảng với
pemetrexed.
Trong quá trinh theo đõi hậu mãi, cảc phân ứng bẩt lợi sau đã được báo cáo ở bệnh nhân dùng
pemetrexed:
Cỏ it trường hợp báo cáo về suy thận cấp ở bệnh nhân dùng pemetrexed đơn trị hoặc phối hợp với
cảc hoả trị liệu khác (xem mục 7.1 “Cánh báo đặc biệt vả lhản lrọng khi dùng ").
Có ít ttường hợp báo cảo về viêm phổi do nhiễm xạ ở bệnh nhân có xạ trị trước, trong vá sau khi
điếu trị bằng pemetrexed (xem mực 7.1 “Cánh báo đặc biệt vả Ihặn lrọng khi dùng ").
Hiếm có trường hợp báo cáo về nhiễm xạ ở bệnh nhân đã xạ trị trước đó (xem mục 7.1 “Cảnh báo
đặc biệt vù lhặn lrọng khi dùng ”).
co it trường hợp báo cáo về thiểu mảu ngoại vi đôi khi đẫn tới hoại từ chi.
Các tinh trạng bọng nước hiếm gặp đã được bảo cảo bao gổm cả hội chứng Stevens-Johnson vả
hoại tử biền bi nhiễm độc, trong một số trường hợp đã gây tử vong.
Đã có bảo cáo hiếm gặp về bệnh thiếu máu tan huyết qua trung gian miễn địch ớ bệnh nhân được
đỉếư trị bằng pemetrexed.
Cảc trường hợp hiếm gặp về sốc phản vệ đã được báo cáo.
Viêm phù nề ban trợt chủ yếu ở chi dưới đã được bảo các nhưng không rõ tần suất.
10. QUÁ LIÊU VÀ CÁCH xử TRÍ
Cảc triệu chứng cùa quá 1iều được bảo cáo gồm giảm bạch cẩu trung tính, thiếu máu, giảm số lượng
tiếu cầu. viêm niêm mạc, đa bệnh lý thần kinh cảm giảc và ban da. Cảc biến chứng đự đoản cùa quá
liều gồm ửc chế tủy xương được biền hiện bới giảm bạch cằn trung tính. giám số lượng tiểu cầu vả
thiểu máu. Ngoài ra, có thể gặp nhiễm khuẩn có hoặc không có sổt, tiêu chảy, vả/hoặc viêm niêm
mạc. Trong trường hợp nghi quá liểu, phâi theo dõi bệnh nhân, kiềm tra công thức máu vả thực hiện
liệu pháp hỗ trợ khi cần. Cân nhắc vỉệc sử dụng calci folinat/acid folinic trong điếu trị quá Iiềư
pemetrexed.ll. 111120 K1ẸN BÀO QUẨN, HẠN DÙNG
11.1. Điều kỉện bâo quin
Lg chưa mở: Không báo quản trên 30°C.
Sau khi hoản nguỵên: Xem điểu kiện bảo quản cùa thuốc đã hoản nguyên trong mục 1 11
dùng".
11.2. Hạn đùng
Alimta lOOmg_vial_EU SmPC_I7 lan 2017_VNJan 2018_proposed tmth_vOl Page 26
Lg chưa mờ: 36 tháng kế từ ngảy sản xuất.
Dung dịch hoản nguỵẽn và dung gịch đề truỵền:
Khi được tiến hảnh theo đủng chỉ dẫn. dung dịch hoản nguyên và dung dịch để trưyền ALIMTA
không có chất bâo quản kháng khuẩn. Độ bển vững vật lý vả hoá học của đung dịch hoản nguyên
và dung dịch để truyền pemetrexeđ đã được chứng minh trong 24 giờ nếu bảo quản ' 1
Xét theo khía cạnh vi sinh vật, sản phẩm phải được sử đựng ngay. Nếu không dùng ng tức,
điều kiện bâo quản vả thời gian bảo quán trước khi sử dụng lá ưảch nhiệm của người sử đựng thuốc
và không được quả 24 giờ ớ nhiệt độ 2 đến soc.
12. TÊN VÀ 1114 cni NHÀ SẢN XUẤT
Sản xuất bời:
Eli Lilly and Company
Indianapolis. IN 46285, MỸ.
15. NGÀY XEM XÉT SỬA 1101 VÀ CẬP NHẬT
{MMfDD/YYYY}
Alimta lOOmg_vial_EU SmPCJ7 lan 2017_VNJan 2018_proposeđ truth_v01 Page 27
hướng đẫn sử dụng thuốc dânh cho người bệnh
ALIMTA'.
. KHUYẾN cAo:
Thuốc bân theo đơn.
Đọc kỹ hướng đẫn sữ dụng trước khi đủng.
Để xa tẩm tay trẻ em.
Thông báo ngay cho bác sỹ hoặc được sỹ những tủc dụng không mong muốn gặp phâi
khi sử dụng thuốc. Cồn thông bảo cả những tảc dụng không mong muốn không được
Iiệt kê trong từ hướng đẫn sữ đụng nây.
Nếu cổn thêm thông tin xin bỏi ý kiến bảc sỹ hoặc dược 81.
. THÀNH PHÀN, HÀM LƯỢNG CỦA THUỐC:
Hoạt chắt lả pemetrexed.
Mỗi lọ chứa 100 mg pemetrexed (dưới đạng pemetrexeđ dinatri heptahydrat).
Sau khi hoản nguyên. dung dịch chứa 25 mg/ml pemetrexed. Cần pha tmớc khi
dùng bới nhân viên y tể.
Các thảnh phần tả dược khảc gồm manitol, acid hydrocloric vả natri hydroxyd.
. MÔ TẢ SÀN PHẨM:
ALIMTA là bột đông khó đựng trong lọ để pha dung địch tiêm truyền. Bột đông khô có
mảư trắng đến vảng nhạt hoặc vảng xanh lá cây.
. QUY cAcn ĐÓNG GÓI:
Mỗi hộp ALIMTA có chứa 1 lọ ALIMTA.
. 111110c DÙNG cno BẸNH ci:
ALIMTA dùng để điều trị:
9 U trung biền mô mâng phổi ác tinh.
Leqlletfor palienl_ALlMTA_l 00 mg_£ U SmP(' | 7 Jan 20] 7_ VN_Apr ! 7 __proposed trulh_vlil ~DL
Loại ung thư nảy ánh hướng dển lớp mảng của phổi. ALIMTA được dùng phối hợp với
cisplatin, một thuốc chống ung thư khác (hớa trị liệu).
Ung thư phổi không tế bâo nhỏ không tế bâo vãy:
Loại ung thư nây lả một bệnh trong đó các tế bảo ác tinh hinh thânh trong mô phổi. Nếu
bạn đang điều trị bước đầu cho ung thư phối cùa mình, thì ALIMTA có thể được sử đựng
một minh hoặc kết hợp với một thuốc hóa trị khảc.
- Nếu đây lả lẳn đẩu tiên bạn được điếu trị, thì ALIMTA có thế được dùng chung với một
thưốc chống ung thư khác, gọi là cisplatin.
- Nếu bạn đã hoản tất điếu trị bước đầu cho bệnh ung thư phổi, thì ALIMTA có thể đùng
một mình ngay sau điều trị bước đầu đỏ.
- Nếu bạn đang được điều trị do ung thư của bạn tiến triển trở lại hoặc bạn có vấn đề về
dung nạp phác đồ điều trị trước đó, thi ALIMTA có thế được dùng một minh.
Bác sĩ điều trị sẽ cho bạn biết lả Iỉệu ALIMTA có phù hợp với Ioại tế bảo cụ thể trong ung
thư phổi không tế bâo nhỏ cùa bạn không.
. cAcn sử DỤNG ALIMTA
Liều ALIMTA 18 500 mg cho mỗi m2 diện tích bề mặt cơ thế. Đo chiều cao và cãn nặng
của bạn để tính diện tich bề mặt cơ thế. Bác sỹ điều trị cho bạn sẽ dựa trẽn diện tich nảy để
tính toán đủng Iiều lượng thuốc cho bạn. co thể điều chỉnh liều, hoặc có thể lùi việc điểu trị
theo số lượng tổ bâo máu vả tình trạng cơ thể bạn. Dược sỹ khoa dược, y tá h 'c 8 `sẽ
trộn bột ALIMT A với dung dịch natri clorid 9 mglml (0,9 %) thânh dung dịfflĂ
khi dùng cho bạn.
ớc
ALIMTA sẽ được truyền vảo tĩnh mạch của bạn. Thời gian truyền khoáng 10 phủt.
Khi dùng ALIMTA phối hợp với cisplatin:
Bác sỹ hoặc dược sỹ khoa dược sẽ tinh toản liều cẩn dùng cho bạn dựa trên chiều cao và
cãn nặng của bạn. Cisplatin cũng được truyền vảo tĩnh mạch bạn, vả được truyền khoáng
50 phút sau khi truyền xong ALIMTA. Thời gian truyền cisplatin kéo dải khoảng 2 giờ.
Bạn sẽ cần truyền một lần mỗi 3 tuần.
Thuốc bổ snng thêm:
14
Leafielfor patienl_ALlMTA_l 00 mg_E U SmPC [7 Jan 20] 7_ VN_Apr ] 7 _proposed lrulh_v0l -DL
Các corticosterìod: bác sỹ điếu trị sẽ kê thuốc viên steroid cho bạn (tương đương với 4 mg
đexamethason hai lần một ngảy) để uống vảo ngảy trước, ngảy truyền, và ngây sau khi
truyền ALIMTA. Kê thuốc nây nhằm giúp lảm giám tẩu suất vả mửc độ nặng của các phản
ửng trên da có thể xáy ra trong quá trinh diều trị thuốc chống ung thư.
4
Bo sung Vitamin: bác sỹ điểu trị sẽ kê acid folic dạng uống (vitamin) hoặc một thuốc hỗn
hợp nhiều vitamin trong đó có chứa acid folic (350 đến 1000 ựg) để bạn ưống ngây một lần
khi bạn đang dùng AL1MTA. Bạn phải uống ít nhất 5 liền trong vòng 7 ngảy trước khi
dùng liếu ALIMTA đẩu tiên. Bạn phải tiếp tục dùng acid folic trong vòng 21 ngảy sau liếu
ALIMTA cuối cùng. Bạn cũng được tiêm vitamin Bư (1.000 ịig) trong tuẩn trước khi dùng
ALIMTA vả sau đó khoảng mỗi 9 tuấn (tương đương với 5 chu kỳ điều trị ALIMTA).
Dùng Vitamin Btzvả acid folic để giảm cảc độc tính có thể xảy ra khi điều trị ung thư.
Nếu bẹn có thêm bất kỳ cãu hòi nâo về cảch sử dụng thuốc, liên hệ với bảc sỹ hoặc được sỹ
điều trị cho bạn.
8. KH] NÀO KHÔNG NÊN DÙNG TiitJOC NÀY:
Không dùng ALIMTA
— Nếu bạn bị dị ứng (quá mẫn) với pemetrexed hoặc bẩt kỳ thânh phần tá dược nảo khác
cùa ALIMTA (đã Iiệt kê trong mục 3).
- Nếu bạn đang cho con bủ; bạn phải chẩm dứt việc cho con bú trong qua trinh điều trị
ALIMTA.
— Nếu gẩn đây bạn có tỉêm vắc xin sốt vảng hoặc sắp tới sẽ tiêm vắc xin nây.
9. TÁC DỤNG KHÔNG MONG MUÔN:
Giống như tất cả cảc thuốc, thuốc náy có thề gáy cảc tảc dụng không mong Mc dù
không phải tất cả mọi người đều gặp phái.
Bạn phãi Iiên hệ ngay với bác sỹ điều trị nếu bạn nhận thấy một trong những dẫu
hiện sau:
9 Sốt hoặc nhiễm trùng (phổ biến): nểu bạn sốt 38°C hoặc cao hơn, dổ mồ hôi hoặc
có các dấu hiện nhiễm trùng khảc (do bạn có thế có số lượng tế bảo bạch cẩu ít
hơn binh thường — điều nảy rất thường gặp). Nhiễm trùng (nhỉễm trùng huyết) có
thể nặng và có thể dẫn đến tử vong.
Leajĩetfor patient_ALlMTA_/OO mg_EU SmPC [ 7 Jan 20! 7_ VN_Apr ] 7 _proposed lrulh_v0l —DL
Nếu bạn bắt đầu cảm thấy đau ngực (phổ biến) hoặc có nhịp tim nhanh (không
phổ biến).
Nếu bạn bị đau. đò, sưng hoặc loét miệng (rẩt phổ biến).
Phán ủng dị ứng: nểu bạn bị phát ban (rẩt phổ biến)! nóng nit hoặc cảm giác châm
chích (phổ biến), hoặc sổt (phổ biến). Híếm khi các phán ứng da có thể nặng và
có thể dẫn dến tử vong.
Liên hệ với bác sỹ điều trị nếu bạn bị phát ban nặng, hoặc ngứa, hoặc phồng rộp
(hội chửng Stevens—Johnson hoặc hoại từ biểu bì nhiễm độc).
Nếu bạn bị mệt mò1, cảm giảc muốn ngẩt xin, dễ bị khó thở hoặc nhin có vé nhọt
nhạt (do hemoglobin của bạn có thể thấp hơn bình thường - điều nây lả rắt phố
biển).
Nếu bạn bị chảy máu nướu răng, mũi hoặc miệng hoặc bất kỳ chảy máu không
cấm được, nước tiến đỏ hoặc hồng nhạt, các vết bầm tím không rõ nguyên nhân
(đo bạn có thẻ có ít tỉểu cầu hơn hinh thường - đỉếu nảy rất phố biển).
Nếu bạn đột ngột khó thờ, đau ngực dữ dội hoặc ho có đờm có máu (không phố
biển) (có thể chi như một cục máu đông trong mạch máu phối).
Tần suất có thể xây ra các tảc đụng không mong muốn được chi ra dưới đây như sau:
Rất phổ biến (có thề ánh hướng đển nhiều hon 1 bệnh nhân trên tổng số 10 bệnh
nhãn).
Phổ biến (cớ thể ảnh hướng 1 ttén 10 bệnh nhân trên tổng số 100 bệnh nhân).
Không phổ biến (có thể ảnh hướng 1 đến 10 bệnh nhân trên tống số 1.000 bệnh
nhân).
Hiếm (có thể ảnh hướng 1 đển 10 bệnh nhân trên tổng số 10.000 bộ ân J
Rất hiếm (có thể ảnh hướng ít hơn 1 bệnh nhân trén tống số 10.000 ân).
Các tảc đụng không mong muốn vởi ALIMTA có thế bao gồmz
. 1111: phổ biến
' Số lượng bạch cầu thẩp.
' Nồng độ haemoglobin thấp (thiếu máu).
' Số lượng tiếu cầu thấp.
' Tiêu cháy.
Leajletfor palienl_A LIMTA_I 00 mg_E U SmPC [ 7 Jan 20! 7_ VN_Apr | 7 _propused Innh_ v01-DL
' Nõn.
' Đau, đỏ, sưng hoặc loét miệng.
' Buồn nôn.
' Ăn mất ngon.
' Mệt mói.
' Phát ban da.
' Rụng tóc.
' Táo bón.
' Mất cảm giác.
' Thận: bắt thường trong xét nghiệm máu.
. Ph iến
' Phản ứng dị ứng: phát ban da! nóng rát.
' Nhiễm trùng bao gồm nhiễm trùng huyết.
' Sốt.
~ Mất nước.
' Suy thận.
' Kích thích da vè ngứa.
' Tức ngực.
' Yếu cơ.
' Viêm kểt mạc (viêm mắt).
' Dau bụng.
' Đau bựng bất thường.
' Thay đổi vị giảc.
' Gan: bất thường trong xẻt nghiệm máu.
' Cháy nước mắt.
o Không ghổ giến
' Suy thặn cấp.
' Nhịp tim nhanh.
' Đã từng xảy ra viêm niêm mạc thực quản khi điều ti~ị TA! xạ trị.
Leaflelfor palienl_ALlMTA_l 00 mg_E U SmPC | 7 Jan 20] 7_ VN_Apr ] 7 _proposed trulh_vOI-DL
Viêm đại trâng (viêm niêm mạc ruột giả, có thể kèm chảy máu đường ruột
hoặc trực trảng).
Viêm phổi kẽ ( lảm seo các tủi khi cùa phối).
Phù nề (giữ nước quá mức ớ cảc mõ cơ thế, gây sưng). Một số bệnh nhân
đã tửng bị đau tim, dột quỵ hoặc “đột quỵ nhẹ” khi dùng ALIMTA thường
xuyên trong phối hợp với cảc liệu phảp điều trị ung thư khác.
Giám toản bộ huyết cầu - số đểm bạch cầu, hồng cầu vả tiều cầu cùng
thấp.
Viêm phổi đo xạ trị (lâm seo tủi khí 0 phối do điều trị xạ ui) có thể xuất
hiện ở những người đã từng điều trị xạ trị trước, trong hoặc sau khi điểu trị
ALIMTA.
Đã có báo cảo về đau đớn tột độ, nhiệt độ thấp và rối loạn sắc tố.
Cực máu đông trong mạch máu phối (thuyên tắc phổi).
Tái nhiễm xạ (phát ban da như bị cháy nắng nặng) có thể xuất hỉện lại trên
da mả trước đó dã từng bị khi điếu tri xạ trị, kể cả từ nhiều ngtiy đến nhiếu
năm sau khi xạ trị.
Những tinh trạng bọng nước (những bệnh phồng rộp ngoải da) — bao gồm
cá hội chững Stevens-Johnson vả hoại từ biểu bì nhiễm độc.
Thiếu máu tan huyết qua trung gian miễn dịch (kháng thể phá hủy các tế
bảo hồng cầu).
Viêm gan.
Sổc phản vệ (phản ứng đi ứng nghiêm trọng).
9 Kluõn 15! su ~! s ! `că dữliuhinc
Sưng, đau vả đỏ ở chi dưới
Bạn có thế mắc một số triệu chửng vảlhoặc tình trạng trên. P ' v ' bảc sỹ
điều trị cảng sởm cãng tốt khi bạn bắt đẩu mắc bất kỳ những tảc dụng không
L
mong muon nây.
Nếu bạn lo lẳng vế bắt cứ tác dụng bất lợi nảo, hăy nói chuyện với bác sỹ đỉều trị.
Leajlelfor palienl_ALlMTA_/OO mg_E U SmPC ! 7 Jan 20] 7_ VN_Apr I7_proposed muh_vOI—DL
10.
12.
Nếu bạn bị bất kỳ tảc dụng bất iợi nâo. hãy báo với bảc sỹ hoặc dược sỹ. Kể cả
các tác đựng khỏng mong muốn chưa được liệt kê trong tờ hướng dẫn sữ dựng
nảy.
NÊN TRẢNH DÙNG NHỮNG THUÔC HOẶC mực PHÁM NÀO Km 11th sử
DỤNG muớc NÀY?
Hãy báo với bác sỹ điếu trị nếu bạn đang uống bất cứ thuốc giảm đau hoặc chống viêm
(sưng). như các loại thuốc được gọi lá “thuốc chống viêm khỏng steroid" (NSAIDs), bao
gồm cá cảc loại thuốc mua không theo đơn cùa bác sỹ (như ibuprofen). Có rẩt nhiểu các
loại NSAIDs với thời gian tác dụng khảc nhau. Dựa trên thời gian đự định truyền ALIMTA
vả] hoặc dựa trên tình trạng chức năng thặn, bác sỹ điều trị cần khuyên bạn loại thuốc bạn
có thể dùng và khi nảo bạn có thể dùng cảc Ioại đó. Nếu bạn không chắc, hỏi bảc sỹ hoặc
dược sỹ nếu bẩt kỳ loại thuốc nảo bạn đang dùng lá NSAIDs.
Hãy báo với bác sỹ hoặc dược sỹ khoa dược nếu bạn đang dùng hoặc vừa dùng bất cứ
thuốc nảo. bao gồm cả các thuốc không cẩn kê đớn.
cÁcn BẢO QUÀN ALIMTA:
Không dùng thuốc sau ngảy hết hạn ghi trên vỏ hộp.
Lg chưa mỡ: Bảo quản ở nhiệt độ không quá 30°C.
Dung gljch gffln nggỵẽn vả dung dich đế tran Thuốc cẩn được dùng ngay lặp tức. Khi
chuẩn bị theo hướng dẫn, độ ổn định về mặt hỏa học vả vặt lý của dung dịch hoản nguyên
và dung dịch để truyền đă đuợc chứng minh trong 24 giờ khi bảo quản trong tủ lạnh (ở
nhiệt độ 2°C — 8°C ).
Thuốc nảy chỉ sử dụng một lẩn duy nhẩt; đung dịch không sử dựng phải được xử lý theo
quy đinh của địa phương.
NHỮNG nẤu HIẸU vA 11111:u CHỨNG KH! DÙNG Tiiuoc QUÁ 1.111…
Những triệu chửng quá liều đã được báo cáo gổm giảm bạch cằn trung 1 1 in tế bảo
bạch cẳu thấp), thiếu mảu (nồng độ hemoglobin thấp), giám tiếu cầu (so ợng tiểu cầu
thắp). viếm niêm mạc (đau, sưng tẩy đỏ hoặc lờ Ioét miệng). đa bệnh lý thằn kinh cảm giác
(rổi loạn nhỉều đây thần kinh cảm giác) vả phát ban. Các biển chứng có thể lường trước của
7
Lcufielfor paliơnl_A LIMTA_ | 00 mg_EU SmPC ] 7 Jan 20] 7_ VN_Apr ] 7 _proposed lruth_v0bDL
13.
quá liều gồm ức chế tủy xương với biếu hiện giảm bạch cẩu trung tinh, giâm tiểu cầu và
thiếu máu. Ngoài ra, có thế mắc nhiễm trùng có hoặc không kèm với sốt, tiêu cháy, vâ/
hoặc viêm niêm mạc.
NHỮNG mtu CÀN THẬN TRỌNG KHI DÙNG THUỐC NÀY:
Trao đối với bịc sỹ đ_i_ểự tri hoặc dược sỹ khoa_d_ưQc trước 1_thi dùng ALIMTA.
Nếu bạn đang hoặc đã từng có vấn đề về thặn, trao đổi với bảc sỹ điểu trị hoặc dược sỹ
khoa dược vì bạn có thế không đùng được ALlMTA.
Trước mỗi lần truyền, bạn cần lấy mảu để đánh gỉá chữc năng thận vả gan và kiếm tra xem
bạn có đủ số lượng tế bảo máu để dùng ALIMTA. Bác sỹ điều trị có thể quyết định thay
đổi liều dùng hoặc hoãn điều trị dựa trên tinh ttạng chung của bạn vả nếu số lượng tế bảo
máu của bạn quá thấp. Nếu bạn cũng đạng dùng cisplatin, bác sỹ điều trị sẽ cần biết rõ bạn
đã được bù nước đủng mức vả được điều trị thich hợp trước và sau khi dùng cispiatin đề
phòng ngữa nôn mừa.
Nếu bạn đã tửng hoặc đang chuẩn bị xạ trị, hãy nói với bác sỹ, do xạ trị có thể gáy ra các
phản ửng sớm hoặc muộn với ALIMTA.
Nếu bạn vừa mới tiêm chủng, hây nói với bác sỹ. do việc nảy có thể gãy tác dụng xẩu khi
dùng ALIMTA.
Nếu bạn mắc bệnh tim hoặc có tiền sử bị bệnh tim, hãy nói với bác sỹ.
Nếu bạn có dịch 0 phồi, bác sỹ có thể quyết định hủt dịch trước khi dùng ALIMTA.
Trẻ em vì thanh thiếu niên
Khỏng có đữ liệu liên quan đến việc sử dụng ALIMTA cho đối tượng trẻ em.
Mang thai. cho con bú vả khả ning sinh sân
Mang Ilmi
Nếu bạn đang mạng thai, hoặc có dự định mang thai, hiy bảo với bâc sỹ. ùng
ALIMTA khi đang mang thai. Bác sỹ điếu trị sẽ thảo luận với bạn những nguy c ẩn
khi dùng ALIMTA trong thai kỳ. Phụ nữ cẩn phải sử dựng biện pháp tránh thai hiệu quả
trong khi điểu trị với ALIMTA.
Leajletfor palienl_A LIMTA_I 00 mg_E U SmPC I 7 Jan 20] 7_ VN_Apr I "_proposed truth_vOI-DL
14.
15.
16.
Cho con bú
Nếu bạn đang cho con bủ, hãy báo với bảc sỹ.
Phtii chẩm dt'rt cho con bú uong khi điều trị ALIMTA.
Khả nđng sinh săn
Nam giới được khuyến cáo không có con trong và đến 6 tháng sau điều trị ALIMTA và vì
thế cần phải dùng biện phảp ưánh thai hiệu quả trong khi điều trị với ALIMTA vả cho đến
6 thảng sau điểu trị. Nếu bạn muốn có con trong quá trinh đỉều trị hoặc trong 6 thảng sạn
khi điếu trị, hãy hòi ý kiến bác sỹ điều trị hoặc được sỹ khoa dược. Bạn có thể đùng biện
pháp cất trữ tinh trùng trước khi bắt đầu điếu trị.
Lải xe vì vân hènh máy móc
ALIMTA có thế lảm bạn cảm thấy mệt mòi. Cần cẳn thận khi đạng lái xe hoặc vận 11“ h
máy móc.
ALIMTA có chứa natri
1 lọ ALIMTA 100 mg chứa 11 hơn 1 mmol natri (23 mg), được coi lá “không chửa natri“.
HẠN DÙNG CỦA THUỐC:
- Lg chưa mở. 36 tháng kể từ ngây sản xuất.
— Dung dịch hoảg ggg_ệg vg` dỵng glch để tmển: Sử dụng ngay lập ' hông qu'
24 giờ khi báo quán trong tủ lạnh (ờ nhiệt độ 2nc đến 8°C).
s
JỆ
C
NHÀ SÂN XUẨT: v
EU uu.v AND COMPANY
lndianapolis, IN 46285, MỸ.
NGÀY XEM XÉT SỬA 1101, CẬP NHẬT LẠI NỘI DUNG HƯỚNG DÃN sử DỤNG
THUỐC:
xx—xx-xxxx
Leajìelfor pafỉenl_ALlMTA_l 00 mg_£ U SmPC ! 7 Jan 20l 7_ VN_Apr ] 7 _propased truth_v0|—DL
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng