













A0 | 09 1153 |ĐảỸ
, \ Ở
1 i iili «
_
A
>o<>d… 38 E
ẫẵliễỡnễỡnẳ ,
ẫoỈ.ễẫ . :!ẵ _.
… nẵồô.ỉẵỉẫẩ… J
cn: 20MAR2019
… 0400874_1_VL_0mn
M… 130: 21t+ 2mmpeet—ctt'ị
… lhmec SGK Renmonu I 6th Cote
T… … L50400614
… Anwonz Awrovư outsuơe ttte St… Management System
..............................................................
'Cưuụmnmmmd
top label | front side
top label | reverse side
base label I tront side
position
LE-07-44885
S²8…iỉèầ
…
…xụxuo
~…»o m!
.Ỉ. Ỉn… SỄ_ _ ỂnI… _ ẫẵ
ị ÌoỗổLtSỉơẫ qỄ ẵ ..…oểỗễ
ỉ ễ % …. …… 33
9.128 ỉ mmx …Ễẵầ ` mẳ >aễ .
Ỉẵ Ễzẵổ SuỂn ` :! ẵỄ
ể ›:ẫẽ Ể3ẵ 836… 3… msầ ẫ:ẵi ẵẫ… ,
En Il… _!Iỉp. Ea Nm—dn
, .Ổ tÉi
Ểỉ….ẵsẵẳẳ nẵnẵ…ẵ uẵỄ…noầ aauềaẵẵnầ.
No 9 z> oẾẺS z>
ễso oằo » 8 » ma! ` m›z.ổ ai.
z> z> z>
DO \.Mit .3 i lAi:Ni
GJ _, ả: …ẳẫ ,,
3: Em...
Wc
ị …
m…ẵẩẵ sồỄ Ể .:….oẫoẫ.
ZQQn ổ 5.5o %… oỂ ẫẵ.
ẵzon In:ổỉ 03ư2
. rmỗo… nợỉ ồ. o.fflổo I…ẫoĩ. ..….ẵùềffl
_, Ooẵmaí OGn. mmxm_nm
ft
Thông
RxADVATE
Th uốc miỵ chi dùng lheo dơn thuốc.
Đê xa lẩm lay !ré em.
Đọc kỹ hướng dẩn sử dụng trmớc khi dùng.
Thuoc liêm lĩnh mạch.
báo ngay cho bảc @ hoặc duực sỹ những rác dụng Ithôug mong muốn gặp phái khi sử dụng Ihuốc.
THẨNH PHẨN CÔNG mú'c THUỐC
Thảnh phẩn hoạt chẩt
ADVA TE (250 IU): Mỗi lọ chứa 250 IU yếu tố đõng mảu VIII người tái tổ hợp (rDNA). octocog tal.fa
ADVAT E chứa trong mỗi ml khoảng 125 IU yếu tố đông máu VIII người tái tô hợp (rDNA). octocog
alfa sau khi hoản nguyên.
ADVA TE (500 IU): Mỗi lọ chứa 500 IU yếu tố _đông mảu VIII người tải tổ hợp (rDNA) octocog alt`a
ADVATE chửa trong mỗi ml khoảng 250 IU yêu tô đông mảu VIII ngưởi tái tô hợp (rDNA). octocog
alfa sau khi hoản nguyên.
ADVATE (1000 IU): Mỗi lọ chứa 1000 IU yểu tố đỏng máu VIII người tải tổ hợp (rDNA) octocog
alfa. ADVATE chửa trong mỗi ml khoáng 500 IU yếu tố dõng máu VIII người tái tô hợp (rDNA)
octocog aifa sau khi hoản nguyên
ADVA TE (l500 IU): Mỗi lọ chứa 1500 IU yểu tổ đỏng máu VIII người tái tổ hợp (rDNA). octocog
alfa. ADVATE chứa trong mỗi ml khoảng 750 IU yếu tố đông mảu VIII người tải tỏ hợp (rDNA).
octocog alfa sau khi hoân nguyên.
Hoạt lực (bầng đơn vị quốc tế International Unit. viểt tắt lả IU) dược xác dịnh theo phương phảp định lượng
chẩt nhiễm sãc theo Dược Diều Châu Ảu Hoạt độ cụ thể của ADVATE là khoáng 4. 000-10. 000 lU/mg
protein.
Octocog alfa (Yếu tố đòng máu VIII người tái tổ hợp (rDNA)) iả một protein tinh chế có 2332 axit amin Chẩt
nảy được sán xttẩt bới công nghệ DNA tái tổ hợp trong tế bảo buồng ttứ_ng cua chuột hamstcr Trung Ọuổc
(CHO).
Được chế tạo_ mả khóng cẩn thêm bẳt cứ ptotein (ngoại sinh) chiết xuất từ người hoặc động vặt nảo
trong quá trinh nuôi cắy tế bảo tinh lợc hoặc chọn lọc cỏng thức cuõi
Thanh phần tả được
Tốchu ủt
Mannitol
Natri clorid
Histỉdin
Trehalose V
. . , ,
Calci clond ,
Trometamol ẺQ
Polysorbate 80
Glutathionc (dạng dễ hẳp thu)
Dung mỏi
Nước cẩt pha tíêm
Tả dươc với tảc đợng đã biết:
0.45 mmol natri (10 mg) trong mỗi lọ.
DAN G
BÀO CHẾ
Thuốc bột đỏng khô vả dnng môi đề p_ha dung địch tiêm
Bột: Ioạ
Dung …
l bột tới min mảu trăng đển trắng ngả.
ỏi: Dung địch trong vả khỏng mảu.
cni ĐỊNH
Để điều
trị vả phòng ngừa xuất huyết ở bệnh nhân bị bệnh Hemophiiia nhớm A (một chứng bệnh do thiếu yểu
7'rcmg l IZ
.'n
@
tố v… bâ… sinh). ADVATE được chỉ định cho tất cả các nhóm tuồi.
cÁcn DÙNG. ut:u DÙNG
Việc điều trị nên được tiến hânh dưới sự giảm sát của một bảc sĩ có kinh nghiệm điếu trị bệnh Hemophilia vả
có sự chuẩn bị sẳn sảng thiết bị hỗ trợ hổi sức tim phối ngay lập tức trong trường hợp bị sốc phản vệ.
Liều lưgr_tg _ _ _ _ _
Liều lượng vả thời lượn điêu_trị thay thế tùy thuộc vảo mưc độ nghiêm trọng cùa tinh trạng thiêu yêu tô VIII.
vảo vị trí và phạm vi xuat huyêt vá theo tinh trạng lám sâng của bệnh nhân.
Số đơn vị yếu tố VIII được thế hiện bầng đơn vị quốc tế lnte_mational Unit (IU). liên quan đến tiếu chuẩn của
WHO vẽ các sán phấm có chứa yếu tố VIII. Hoạt dộ của yếu tố VIII trong huyết tương dược thế hỉện bằng
một_ tỷ lệ phẩn trăm (tưan quan với huyết tương binh thường ở người) hoặc bằng lU (tương quan với tiêu
chuẩn quốc tế cho yếu tố VIII trong huyết tương).
Một đơn vị quốc tế lntcrnational Unit (IU) cho hoạt độ cùa yếu tố VIII tương đương với số lượng yếu tố VIII
trong một ml huyết tương binh thường ở người.
Điều lrị Iheo nhu cồn
Việc tính toản Iiểu lượng cần thiết của yếu tố VII_I dựa trên phát hiện qua kinh nghiệm rầng 1 [U yếu tố VIII
cho mỗi kg trọng lượng cơ thế lảm tăng hoạt độ yểu tố VIII huyết tương thêm lẽn 2 |Uldl Liều lượng cần thỉết
được xác định băng cỏng thức sau đãy:
Đơn vị cần thiểt (IU) = trọng lượng cơ thể (kg) x mức tăng Yếu tố VIII mong muốn (%) x 0.5
Trong trường hợp có xuất huyết. hoạt độ của yếu tố VIII khỏng được thắp dưới mức hoạt độ của huyết tương
đã cho biết (bằng tỷ lệ % cùa mức thỏng thường hoặc lUlđl) trong thời gian tương ứng. Co thể dùng báng 1
sau đây để hướng đẫn cảch định iiều trong những trường hợp xuất huyết và phẫu thuật:
Bâng 1 Hướng dẫn cách định liên trong nhữn ữngtrường_hgg xuất huyết vả phẫu thuật:
Cấp độ xuất huyểtlloại thủ Mức Yếu tố VIII cnn thiễt Tần suất đùng thuoc (số giờ)
thuật phẫu thuật (% hoặc lUldl) ltllời gian trị liệu (_ngịy)
Xuẫt huyết
Trản máu trong khớp sớm xuất 20 — 40 Tiêm lặp lại mỗi 12 đến 24 tiếng
huyết trong cơ hoặc chây mảu (8 dến 24 tiếng cho bệnh nhãn
răng miệng. dưới 6 tuối) trong tối thiếu 1
ngảy_ cho đển khi tinh trạng xuất
huyết biến hiện qua cảm giảc
đau đớn đã được khắc phục hoặc
đã hồi phục.
Trản mảu trong khởp. xuất huyết 30 — 60 T têm lặp lại mỗi 12 đến 24 tiểng
trong cơ hoặc ỏ tụ máu. (8 đểu 24 tiếng cho bệnh nhân
dưới 6 tuồi) trong 3— 4 ngảy
hoặc lâu hơn cho tới khi đau đớn
vả tinh trạng suy chức nãng cấp
W tính đã được khắc phục.
. . v
Xuất huyêt nguy hiêm đến tinh 60— 100 Ở Tiếm lặp lại mỗi 8 đến 24 tiếng
mạng. (6 dến 12 tiếng cho bệnh nhân
dưới 6 tuối) cho tới khi khắc
ỵhục đượcn n_guỵ cơ.
Trang 2 U
< v.v… \r v
|| le
Phẫu thuật
Tiếuphẫu 30 — 60 Ti_êm mỗi 24 tiếng ( 12 đển 24
Bao gổm nhố rãng. ti_ếng cho bệnh nhản dưới 6 tuổi)
tối thiếu trong | ngả» cho tới khi
dã hồi phục.
Đại phẫu so - mo Tiẻm lập 1ại mỗi 8 đến 24 tiếng
(giai đoạn trưởc vả sau phẫu (6 đểu 24 tiểng cho bệnh nhân
thuật) dưới 6 tuối) cho tởi k_hi đã lảnh
vết thương. sau dó tiếp tục ưị liệu
trong tối thiểu 7 ngảy nữa để duy
trì hoạt dò của yếu tỏ VIII từ
30% đến 60%(1U/d1).
Nên diếu chinh liều lượng vả tẩn suất dùng thuốc theo dáp ứng lâm sảng ở tửng trưởng hợp cả nhân. Trong
những hoân cảnh nhẩt đinh (ví dụ có chất ức chế nồng dộ thấp) có thế cẩn sử dụng cảc Iiểu lớn hơn những
liều được tính bắng công thức nây
Trong quá trinh diếu trị. việc _xảc djnh cảc mức yểu tố VIII huyết tương thích hợp được khuyến nghị để hướng
dẫn liều lượng cẳn dùng vả tằn suât tiêm lặp lại. Trong trường hợp can thiệp đại _phẫ_u cụ thế. k_hông thế thiểu
sự giám sảt chính xảc việc đỉếu trị thay thế bằng cảc phương pháp thứ hoạt d_ộ yếu tô VIII huyết tương Timg
bệnh nhãn có thế có đáp ứng khác nhau vởi yếu tố VIII đạt đểu các mức hồi phuc in iim khác nhau vả thế
hiện thời gian bán thải khảc nhau.
DỈể_I_JI Ir' ___ỊpịĩQỤgljgựg
Dê phòng ngừa lâu dai tinh trạng xuất huyết ở bệnh nhân bị bệnh Hemophilia nhóm A dạng nặng. các Iiếu '
thỏng thưởng là 20 đến ~10 IU yêu tổ Vỉll cho môi kg trọng lượng cơ thế dùng cách nhau khoảng… 2 dến` J ngảy. Q;
8 nh nhi
Đối với điều trị theo nhu cẩ_u việc phân chia liếu ở hệnh nhỉ (0 đến 18 tuối) khòng khác vó_i bệnh nhản người
lớn. Ở bệnh nhán dưới 6 tuổi để điều trị _phòng ngửa thì nên dùng các liều 20 đến 50 IU vếu tố VIII cho mỗi
kg trọng lượng cơ thể. 3 dển 4 lẩn mỗi tuần. _ _
Chưa có tải liệu ghi chép về vìệc dùng dạng bảo chế 2 ml cho đỏi tượng bệnh nhi dưới 2 tuòi.
C ách sử dụng
ADVATE nên được tiêm _qua đường tĩnh mạch. T_rong trường hợp việc tiêm thuốc do một người không có
chuyến môn chăm sóc y tế thực hi_ện phải có sự huấn luyện thich hợp cho người dó.
Tốc dộ tiêm phải dược xảc dinh dể đâm bảo sự thoải mái của bệnh nhân vả khòng vượt quá IOmllphủt.
Sau khi hoản nguyên. dung dịch sẽ trong suốt. khỏng mảu. không có cảc hạt lạ và có độ pH từ 6.7 dến 7.3.
Để biết hướng dẫn cảch hoân nguyên dược phẳm nây trước khi tiêm. vui lòng xem mục Thận lrọng dặc biệt
cho liêu hủy vả lhao lác khác.
CHỐNG cai ĐlNH
Mẫn cảm vởi hoạt chất hoặc tá dược hẩt kỳ dược liệt kê trong mục Tha`nh phẩn lả dược hoặc mẫn cảm với
protein chuột hoặc hamster.
…ấM
CANH BẢO VA THẶN TRỌNG KHI DUNG THUỐC \ỵ
Cânh bản vá thận trọng đặc biệt khi sử dụng
Inmg 3 12
Mản c a'm
Dã có báo cảo về các phản ủng mẫn cảm loại dị t'mg. bao gổm sốc phán vệ vởi ADVATE. Sản phẩm nảy có
chứa yếu tố protein của chuột và hamster. Nếu triệu chứng mẫn cám xuất hiện bệnh nhân nên ngưng dùng
thuốc ngay lặp tức và Iiẽn_ lạc với bảc sĩ của minh. Bệnh nhản phải được bảo cho biết về cảc dẳu hiện sớm của
phân ứng mân cảm bao gổm phảt ban máy đay toản thân tửc ngực. thờ khó khế hạ huyết áp vả sỏc phản vệ.
Trong trường hợp có sốc. nến áp dụng điểu trị y khoa tiêu chuẩn.
Do việc giảm thế tich tỉếm đối với ADVATE được hoán nguyên trong.. 2 ml nước cắt pha tiếm. nếu có các
phản ửng mân cám xảy ra, sẽ có ít thởi gia_n phản ửng để _dừng việc tiêm Do đó. cần thận trợng trong khi tiêm
ADVATE hoản nguyên trong 2 ml nước cẩt pha tỉếm. nhắt lá ở trẻ em.
Chấl g ghế:
Sự hình thảnh các kháng thể trung hòa (chất ức chế) chống lại yểu tố VIII là một loại hiến chửng đã biết trong
việc điểu tri cảc cả nhân bị bệnh Hemophilia nhòm A. Những chất ức chế nảy_ thường 1ả IgG immunoglobulin
chống lại hoạt động thủc đẩy đông mảu của yếu tố VIII được đinh lượng bằng Đơn vị Bethesda Unit (BU_)
cho ư_iôi ml huyết tương theo phương pháp định lượng điếu chinh. Ó bệnh nhân hinh thảnh những chắt ức chế
yểu tố VIII tình trạng đó sẽ bỉếư hiện bắng giảm đáp ưng lảm sảng. Trong trường hợp như _vậy. nếu liẻn lạc
với một trung tâm chưyẻn khoa điếu tiị hệnh Hemophilia. Nguy cơ hinh thảnh chất ức chế tương quan vởi
mức độ tiểp xủc với yêu tổ VHI ngux cơ cao nhẩt lá trong vòng 20 ngây ti_ểp xúc đầu tiên. vả tương quan với
các yếu_ tố gen và môi trường khác. Hiếm khi có trường hợp nảy nhưng chẩt ức chế có thế hinh thảnh sau 100
ngảy tiếp xúc đẩu tiên.
Đã quan sảt thấy các trường hợp chất ức chế ( nong độ thấp) tái phải sau khi chuyền từ sản phẳm y_ếu tố VIII
nảy sang một loại khảc ở các bệnh nhán_ tùng được điếu trị trong hơn 100 ngảy tiêp xúc và có tiền sử hình
thánh chẳt ức chế Do đỏ. nến giám sảt cẩn thặn tắt ca bệnh nhân để phát hiện sự phát sinh chắt ủc chế sau khi
thay đổi sản phẩm bắt kỳ
Nhin chung tẩt cả bệnh nhân được điều trị bằng vếu tố đỏng mảu VIII nên được giám sát cắn thặn đề phát
hiện sự hinh thảnh _chẳt ức chế bằng cách quan sát lâm sảng và xét n hỉệm thích hợp Nếu khỏn_g đạt đển các
mức hoạt độ yểu tố VIII huyết tương. hoặc nên tình trạng x_uất _huyet không được kiếm soát bằng liếu thỉch
hợp thì nẻn xét nghiệm xem _có sự hiện diện chẩt ức chế yếu tố VIII. Ô _bệnh nhân có các mức chất ức chế
cao liệu phảp thay thế yểu tố VIII có thế khóng hiệu quả và nén cân nhắc các lựa _chọn điểu trị khác. Việc
điếu trị những bệnh nhân như vặy_ nên có sự hướng dẫn của bác sĩ có kinh nghiệm về chăm sòc bệnh nhãn bị
bệnh Hemophilỉa vả chẩt ức chế yếu tố VIII.
Dỉ_mg sai ADVA TE
Dối với ADVATE được hoản nguyên với.. "ml nước chẩt p_ha tiêm. việc dùng sai cách (tiếm vảo động mẹch
hoặc gần tĩnh mạch) có thể dẫn đến các phản ửng nhẹ ngắn hạn tại chỗ tiêm chắng hạn như bầm tim vả hổng
ban.
Các biện chung lrong điếu Irị liên guan đến ống calheler
Nếu cân dùng dụng cụ tiếp cận tĩnh mạch trung tãm (C _VAD), nến cân nhắc nguy c_ơ biến chứng liẻn quan đến
C VAD bao gôm nhỉễm trùng cục bộ. nhiễm khuẩn huyết và huyểt khổi tại chỗ đặt ong cathcter.
Cân nhắc Iỉên guan lá dthc
Sau khi hoèn nguyên _dược phẩm nảv chứa 0 45 mmol natri (10 mg) trong mỗi lọ Nén lưu ý điếu nảy nếu
bệnh nhân đang có chế độ an có kiểm soát lượng natri.
Có khuyến cáo mạnh mẽ rằng mỗi khi đùng ADVATE cho bệnh nhân cằn ghi lại tẽn và số lô của sản phẩm
để duy trì sự liến hệ giữa bệnh nhân vả lô dược phẳm sử dụng. w
Bệnh nhi:
Cảc cảnh báo và thận trọng đã nếu áp dụng cho cả người trưởng thảnh vả trẻ em.
'l`rung 4 [2
1.1'11
H1
11!
_\1
H!
\
\1`
sử DỤNG THUỐC cuo PHỤ NỮ có THAI VÀ CHO CON BÚ
Cảc nghiên cứu về sinh sán trến động vặt chưa được tiến hảnh vởi y_ếu_ tố VIII. Căn cứ vảo việc bệnh
Hemophỉlia A hiếm khi phát sinh ở phụ nữ. khỏng có kinh nghiệm nâo về việc sử dụng yếu tố VIII trong thời
kỳ mang thai và cho con bủ. Do đỏ. vếu tố VIII chi nẻn được dùng trong thời kỳ mang thai vả cho con bú nếu
có chi định rõ rảng.
ẢNH HƯỞNG CỦA THUỐC LÊN KHẢ NĂNG LẢI xa, VẬN HÀNH MÁY MÓC
ADVATE khỏng gây ảnh hướng đển khả năng lái xe và vận hânh mảy móc.
TƯỜNG TÁC. TƯỚNG KY CỦA THUỐC
Chưa tiểu hảnh nghiên cửu về tương tác với ADVATE.
Do khòng có các nghiên cứu về tỉnh tương kỵ của thuốc. không trộn lẫn thuốc nảy với các thuốc khác.
TÁC DỤNG KHÔNG MONG MUÔN
T om !ắl dữ líệu về an Ioủn
Các nghiên cứu lãm sảng vởi ADVA TE đã bao gồm 418 đối tượng_ với ít nhất một tiếp xúc với ADVATE dã
báo cáo 93 hản ưng bất lợi với thuốc (AỌR). ADR đã xảy ra với tần suất cao nhẫt lả sự hinh thảnh kháng thể
trung hòa _veu tố VIII (chất' ưc chế). đau đầu vả phát sốt
Hiếm khi quan sát thắy các phán ứng mẫn cảm _hay phản ứng dị ứng (có thế bao gổm phủ mạch _bóng rảt vả
nhức ở vị trí sử dụng. ớn lạnh khó thở trảo huyết mảy đay toản thân. đau đẩu phảt ban hạ huyết' qp. ngủ lim
buổn nôn. thao thức tỉm đập nhanh. tức ngực. đau nhói dãy thẩn kinh. nôn. thờ khô khè) vả có thế trong một
số trường hợp chuyển thảnh phản ứng phản vế nghiếm trọng (bao gổm sốc phán vệ).
Hình thảnh kháng thể khảng protein của chuột vảlhoặc hamster với cảc phản ửng mẫn cảm có thể quan sát
thắy.
Bệnh nhân bị bệnh_ Hemophilia A có thế hinh thảnh k_hảng thề trung hòa (chắt ức chế) yếu tố VIII. Nều chất
ửc chế như vậy xuất hiện tình trạng đó sẽ biểu hiện bằng g_iảm đáp ứng lâm sảng. Trong tnrờng hợp như vậy.
nến liên lạc với một trung tâm chuyến khoa đỉều trị bệnh máu khó đóng.
Ban Iómlẳl các hc'm ửn bẩt I_ơi
Bảng 2 sau đây cho bỉết tản suất xáy ra ph_ản ứng bắt lợi vởi thuốc trong các thử nghiệm lâm sảng vả từ các
bảo cảo tự phảt. Bảng được lặp theo hệ thống phân Ioại hệ cơ quan McdDRA ( Mưc SOC vả Thuật ngữ Uu
tiên).
Nhóm tần suất được xác định theo cảch _chuyến đối sau đây: rắt phố biển (>_ Il 10) phố biển (2 1/100 đển <
1l10) it gặp (>_ 1/1.000 đến < 1/100) hiếm găp (> 1l10 000 đ_ến < _… .000) rẩt hiểm gap (< 1l10 000) khỏng
biểt (khỏng thể ước tính từ dữ liệu sẵn cỏ). Trong mỗi nhóm tần suất. các tảc dụng ngoại ý được trình bả) heo
thứ tự mức nghiêm trọng giâm dằn ỞĨO
\]
Bảng 2 Tần suất xảy ra phản ứng bẩt lợi với thuốc (ADR) trong các thử nghiệm lảm sảng vả tử các bảo cảo
tự phát.
Phân loại_ Hệ Cơ quan trong Cơ thể Phân ứng bẫt lợi Tần suất'
theo Chuẩn MedDRA _
Nhiễm trùng vả nhiễm ký sinh trùng Cảm củm lrtgặp
Viêm thanh quản It gặp
'I`rang 5 IZ
/. ||
16
Ễ
\\\
Bãng 2 Tần suất xáy ra phản ứng bẩt lợi với thuốc (ADR) trong cảc thư nghỉệm Iảm sâng vả từ các báo cáo
tự phát.
Phân loại Hệ Cơ quan trong Cơ thể Phân ửng bẫt lợi Tẫn suẫtI
u… Chuẩn MeđDRA
Rối Ioạn hệ máu và bạch huyết Ức chế Yếu tố v…c Phổ biển
Viêm hệ bạch huyết Ít gặp
Rôi loạn hệ miễn đich Phản ứngLản vệ Không rõ
Man cảm Không rõ
Rối Ioạn hệ thần kinh Đau đẫn Phó biến
Choáng vảng It gặp
Suỵ giảm trí nhớ ịt gặp
Jiaảl !t sẽP
Coỉiặt cơ _lt_gặp
Đau nửa đẩu it gặp
Rối loạn vị gỉác Ỉt gịg
Rối Ioạn ở mắt Viếm mắt Ĩt gặp
Rối Ioạn ở tỉm Đânh trống_ngực Ít gặp
Rồi loạn mạch Tụ máu Ít gặp
Trảo huyết Ít gặp
Tim tải It gặp
Rối loạn hô hấp. ngưc vả trung thất Khó thờ It gặp
Rối Ioạn dạ dảy ruột Tiếu chảy Ít gặp
Dau bụ ụng trẻn It gặp
Buồn nôn Ỉt gặp
Nỏn It
Rối loạn trến da và mỏ dưới da _ỉjgứa It gặp
Phát ban It gặp
_Iã_ngiểt mồ hói ỈLg_ặ_p
Mảy đay It gặp
Rối Ioạn chung vả các tỉnh trạng tại vị trí Sổt Phổ biển
tiếm Phù ng@biẻn Ệgặp
Đau ngực It gặp
Khó chịu ở ngực It gặp
Ốn lẹnh Ít gặp
Cảilgiác bất thường I_t gặp
Tụ máu ở vị trí tiêm vảo mgch It gặp
Mệt mỏi KliõJg rõ
Phản MVÍ tri tiêm Không rõ
Khó chịu_ Không_rõ_
TỄn lâm sảng Lượng_ Tế bâo monocyte tâng thặp
Mức yếu tô đôn máu Vllịiám Jt_gặp
Thể tich hỗng cau giâm It gặp
Kết quả xét tffl__ệ_m bẵt thươn ương It gặp
Thương tổn. ngộ độc và các biến chứng Biển chứng sau thủ thuật Ít gặp
ương thủ thuật Xuất huyết sau thủ thuật Ỉt gặp
PhảnẺggtgi vi tri thực hiện thủ thuật
a) Được tính toán dựa trẻn tổng số bệnh nhãn đã dùng ADVATE (418).
b) Hỉện tượng sụt giâm bẩt ngờ các mửc yếu tố đông mảu VIII xảy ra ở một bệnh nhân trong quả trinh
truyền liên tục ADVATE sau khi phẫu thuật (ng_ảy 10-14 sau phẫu thuật). Hỉệu qua' cẩm máu đã được
du_y trì mọi lủc trong quá trình nảy vả cá mửc yếu tố VIII huyết t_ương vả tỉ lệ th_anh thái đã trở lại các
mức bình thưi_mg vảo ngảy 15_ sau phẫu thuật. Các phân tích chắt ức chế yêu tồ VIII được thực hiện
sau khi hoản tất giai đoạn truyền liên tục vả đến khi kết thủc nghiên cứu đã cho kết quả âm tỉnh.
Trang 6 … IZ
.\
<>
\
/
c) ADR được giải thích trong mục đưới đảy.
Mỏ lá các phán ửng bối lơi chon Ioc
Hình lhảnh Chất ức ché
Đã có bảo cáo về sự hình thảnh chất ức chế ở những bệnh nhân từng được điếu trị (PTP) và ở những bệnh
nhân chưa từng điếu tri (PU P). Để bỉết thếm chi tiểt hãy tham khảo mục Các đặc llnh duợc lực học vả Cảnh
bản vá thận Irọng đậc biệt khi sử dạng.
Phản úmz bẩl ÌỢÍ đjc híéu với dư chốt n_`o;gỵá trình sc`m xuất
Trong số 229 bệnh nhân điều trị đã được kỉếm tra kháng thể với protein tế báo buồng trứng chuột hamster
Trung Quốc (CHO). 3 bệnh nhân đã cho thấy xu hướng ưn nổng đó đáng kể. 4 bệnh nhân cho thẩ_v nổng dộ
đỉnh duy tri hoặc tảng thoáng qua và một bệnh nhân cho thay cá hai kết quả nhưng khỏng có triệu chứng trên
lâm sảng. Trong số 229 bệnh nhân điếu trị đã được kỉếm tra khảng thế với lgG chuột. 10 bệnh nhân đã cho
thấy xu hướng tăng nổng đó đáng kê. 2 bệnh nhãn cho thắy nồng độ đinh duy trì hoặc tăng thoáng qua và một
bệnh nhận cho thắy cả hai kểt quả. Bốn hệnh nhán trong số nảy đã báo các tinh trạng riêng biệt gôm mảy đay.
ngửa. nôi mân. vả tảng nhẹ lượng bạch câu ái toan trong những lẩn tiếp xúc lặp lại với thuôc thử nghiệm.
Mẫn cam
Các phản ứng dạng dị ứng bao gổm phản ứng phản vệ vả đã biên hiện bầng choáng váng` di cám. nỏi mẩn.
trảo huyết. sưng mật. mảy đay vả ngửa.
Bệnh nhi _
Ngoài vỉệc hinh thânh chẩt ức chế ở các bếnh nhỉ chưa được điếu tri trước đó (PUPL và các biến chứng liến
quan ống catheter. không có sự khác biệt đặc hiệu theo tuổi nảo vế phán ứng bắt lợi đã được nhắc đến trong
các nghiên cứu lâm sảng.
Bảo cảo các phán ứng bắt lợi nghi ngờ
Việc báo cáo về các phản ứng bẩt lợi nghi ngờ sau khi dược phẩm nảy được cho phép lưu hảnh lả rất quan
trọng. Nó cho phép giảm sải liên tục mối quan hệ cân bằng lợi ichlngưy cơ cùa dược phầm nảy. Chuyên viến
chăm sóc y tế được yếu cầu báo cáo những tác dụng phụ bât kỳ nảy thỏng qua hệ thống báo cáo quốc gia.
QUÁ LIÊU VÀ CÁCH xửmi
Chưa có bảo cảo nảo về các triệu chửng quá liếu yếu tố đóng máu VIII tái tổ hợp.
cÁc ĐẶC TÍNH DƯỢC LÝ
|
Cảc đặc tinh dược lực học _ Ổ/
Nhóm dược học điếu trị: chống cháy máu, yếu tố đông máu VIII. Mã ATC: B02BD02. Ở
Hợp chất yểu tố VllllYếu tố von Willcbrand gổm hai phân từ (yếu tố VIII vả Yếu tố von Willebrand) với cảc
chức nãng sỉnh lý học khác nhau. ADVATE chửa yêu _tò đỏng máu VIII tái tô hợp (octocog alfa). một
glycoprotein tương đương sinh học vởi glycoprotein cùa yêu tố VIII có trong huyết tương của người.
Octocog alfa lẻ một glycoprotein gổm 2332 axit amin có khối lượng phân tư khoảng 280 kD. Khi truyền vảo
bệnh nhân bị bệnh lie:mophilia` octocog alfa liến kết với Yếu tố von Wiliebrand nội sinh trong tuần hoân của
bệnh nhân. Yếu zô v… hoạt hòa đóng vai trò như một Yếu xỏ phối hợp cho Yếu tố 1x hoạt hóa. lảm ư…g tốc
quá trình chuyến Yếu tố X sang Yếu tố X hoạt hóa. Yếu tố X hoạt hỏa chuyến prothrombin thảnh thrombin.
Thrombin sau đó chuyến fibrinogen thảnh fibrin và một cục máu đông có thế hinh thảnh. Bệnh Hemophilia
nhóm A là một rối loạn đông máu di truyền theo gỉới tính do sự sựt giảm các mức hoạt độ của yếu tố Vlll vả
dẫn đến sự xuất huyết nhiếu vảo ca'c khớp. co vả cơ quan nội tạng. cả tự phải hoặc lả vi tồn thương do tai nạn
hoặc phẫu thuật. Cảc mức huyết tương của yếu tố VIII tăng lên nhờ liệu pháp thay thế. từ đó giúp khắc phục
Trang 7 l2
tạm thời tinh trạng thiếu hụt yếu tố VIII vả khẳc phục xu hướng xuất huyết.
Hinh thảnh Chẩt ức chế
Sự miễn dịch với ADVATE đã được đảnh giả ở những bệnh nhản tửng được điếu trị. Trong các nghiến cửu
lâm sảng vế ADVATE trên 233 bệnh nhán là trẻ em vả người lớn [bệnh nhỉ (0 ~ 16 tuối) vả bệnh nhân người
lớn (16_ tuốỉ trớ 1_ến)] đă được chẩn đ_oán _bị bệnh Hemophilia nhòm A dạng nặng (vếu tố VIII < 1%). từng
được tìếp xúc với các dạng nỏng độ vếu tố VIII từ 150 ngảỵ trở lên cho người lớn vả trẻ lớn vá tử 50 ngảy trớ
lẻn cho trẻ em dưới 6 tuôi. một bệnh nhân đã hình t_hảnh chắt ửc chế nổng độ thắp (2 4 BU tr_ong phư_ơng pháp
định lượng Bethesda đã điếu chinh) sau 26 ngảy tiếp xúc với ADVATE. C_ảc xét nghiệm chắt ủc chế th_eo dõi
ở bệnh nhân nảy sau khi rủt khỏi nghiên cứu cho kết q_uá âm tính. Trong tẩt cả các nghiến cứu. chỉ số tíếp xúc
trung vị với ADVATE là 97 ngảy tiếp xúc cho mỗi đối tượng nghiến cửu (khợảng 1 đến _709_) cho bệnh nhân
từng điếu trị. Tv lệ phát sinh tống thế đối với sự hình thảnh (thắp hoặc cao) chẩt ức chế yếu tố VIII lả 0 4% (I
trong 233).
Trong nghiên cửu 060103 khỏng đối chiếu đã hoản tẩt 16 bệnh nhân trong số 45 (35 6%) từng điểu trị bệnh
Hemophilia nhóm A dạng nậng _(FVIII < 1%) vả it nhẩt 25 ngảy tiếp _xủc (ED_) đ_ối với FVIII đã hinh thảnh
chẩt ức chế FVIII: 7 (15. 6%) đối t_ượng nghiên cửu đã hình thảnh _chắt ức chế nổng độ cao vả 9 (20%) đối
tượng nghiên cứu đã hinh thảnh chẩt ức chế nổng độ thẩp 1 trong số đó đã được phân loại chắt ức chế thoáng
qua.
Yếu_ tố n_guy cơ liến quan đến sự hinh thảnh chất ửc chế trong nghiến cứu nảy bao gổm chùng tộc khỏng có
n uổn gõc Tây Ảu. tiến sử gia đinh có chẩt ức chế và điếu _trị tăn cường bắng liếu cao trong 20 ngáy tiếp xúc
đâu tiên ( ED) Không có sự hinh thảnh chẩt' ưc chế trong số 20 đoi tượng khỏng có những yếu tố nguy cơ nảy
Dữ liệu đã thu thập vế Cảm ứng Dung nạp Miễn dich (ITI) ở bệnh nhân có chắt ức chế. Trong một nghiến cửu
phụ của nghiên cứu trẻn bệnh nhi chưa tửng điếu trị 060103 điếu trị 1T1 trên 1 1 bệnh nhi chưa tt'mg điếu trị đã
được chỉ chép lại. Đánh giá hồ sơ hổi cứu đã được thực hỉện cho 30 đối tượng về 1T1 (nghiến cứu 060703) và
việc thu thặp dữ liệu Đảng kỷ đang được tiếp diễn
Trong nghiên cứu 060201 hai chế độ điếu trị đự phòng đã được so sánh trẻn 53 b_ếnh nhân từng điếu trị: một
phác đồ đinh liếu theo dược động học cả nhân hỏa (trong khoảng 20 đến 80 IU yếu tố VIII cho mỗi kg trọng
lượng cơ thể được _dùng cách nhau 72 1 6 tiếng._ n= —23) với một phảc đổ dịnh liếu dự phòng tiêu chuẩn (20 đển
40 lU_fkg dùng mỗi 48 t_6 ti_ếng n= 30). Phảc đồ định liều theo được động học (theo một công thửc đặc hiệu)
đã nhắm đến các mửc yếu tố VIII đảy_ > 1% ở tần suất dùng thuốc cách nhau 72 tiếng. Dữ 1_iếu từ nghiến cừu
nảy thế hiện hai phảc đồ định liếu dự phòng tương đương nhau xẻt về hiệu quả giảm tỷ lệ xuất huyết.
Cơ quan Quán 1_v' Dược phẩm Châu Ảu đã miễn trừ nghĩa vụ đệ_ trình các kết quả nghiến cứu với ADVATE
trong tắt cả cảc nhóm bệnh nhi bị bệnh Hemophilia nhóm A (thiếu_ yếu tố _V111 bầm sinh) về "Cảm ửng Dung
nạp Miễn dịch (ITI) ở bệnh nhân bị bệnh Hemo_philia_ nhỏm A (thỉếu yếu tố VIII bẩm sinh) đã hình thảnh _chấ_t
ức chế yếu tố VIII" vả "điểu trị vá dự phòng xuât huvết ở bệnh nhân bị bệnh Hemophilia nhóm A (thiếu yếu tố
VIII bấm sinh)". (xem mục Ca'ch dùng, liểu dùng đế biết thêm thông tin về việc sử dụng cho bệnh nhi).
Câc đặc tinh dược dộng học
Tất cả các nghiên cứu dược động học với ADVA TE đặ được tiến hảnh trến bệnh nhân tửng được điều trị bệnh
Hemophilia nhóm A dạng vừa dến nặng (mốc cơ sở yếu tố VIII < 2%) Dã tiến hảnh phân tich các mẫu huyết
tương trong phòng thí nghiệm trung tâm bằng phương pháp thử máu đông một giai đoạn.
Tổng cộng _195 đổi tượng bị bệnh Hemophilia nhóm A dạng nặng (mốc cơ sở yếu tố VIII < 1%) đã cung cắp
các thông số PK đã được thêm vảo tập hợp phân tỉch PK theo Đề cương nghỉẻn cứu. C ac nhớm phân tích nảy
cho trẻ sơ sinh (1 tháng tuối đến <2 tuối), trẻ nhỏ (2 đến < 5 tuối). tre“ _lớn (5 đến <1_2 tuối). thanh thiếu níến
(12 đến < 18 tuối) vit người lớn (18_ tuối trớ lến) đă được dùng để tóm tắt cảc thông số PK. trong đó tuổi được
định nghĩa là tuối tại thời điếm truyền PK
N\v*
Trang 8 IZ
“` \\
D
|
/ z
||
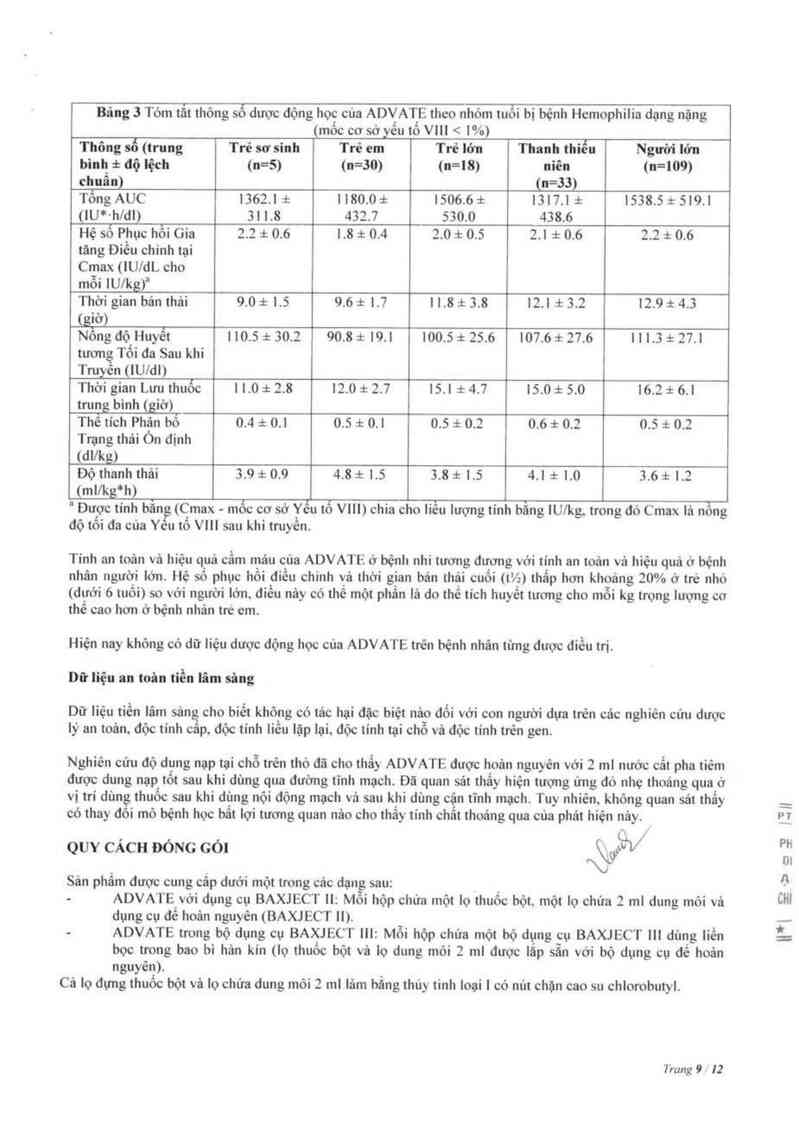
Bâng 3 Tóm tẵt thông số dược động học của ADVATE theo nhóm tuối bị bệnh Hemophilia dạng nặng
(mổc cơ sớyếu tổ VIII < 1%)
Thông số (trung Trẻ sơ sinh Trẻ em Trẻ lởn Thanh tbiếu Người lớn
bình # độ lệch (n=5) (n=30) (n=18) niên (u=109)
chuẩn) (n=33)
Tông AUC 1362.1i 1180.0i 1506.6t 1317.1i 1538.5t 519.1
(IU*-hldl) 31 1.8 4317 S30.0 4386
Hệ số Phục hồi Gia 2.2 i 0.6 1.8 i 0.4 2.0 t 0.5 2.1 :1: 0.6 2.2 :1: 0.6
tãng Đỉếu chinh tại
Cmax (IUIdL cho
mỗi lU/kg)“
Thời gian bân thải 9.0 :1: 1.5 9.6 :t 1.7 11.8 :t 3.8 12.1 1 3.2 12.9 1 4.3
Jgiờ)
Nổng độ Huyết | 10.5 =t 30.2 90.8 t 19.1 1005 t 25.6 107.6 :t 27.6 111.11 :1: 27.1
tương Tổí đa Sau khi
Truyến (lUldl)
Thời gian Lưu thuốc 11.0 :1: 2.8 12.0 at 2.7 15.1 i 4.7 15.0 ² 5.0 16.2 x 6.1
trung binh (giờ )
Thê tich Phân bổ 0.4 t 0.1 0.5 =t 0.1 0.5 :t 0.2 0.6 * 0.2 0.5 :t 0.2
Trạng thái Ón dịnh
(deg)
Độ thanh thái 3.9 t 0.9 4.8 * 1.5 3.8 1 1.5 4.1 i 1.0 3.6 t 1.2
(ml/kgj)
“ Được tinh bằng (C_max mốc cơ sở Yếu tố VIII) chia cho liếu lượng tinh bằng lU/kg. trong đó Cmax lả nỗng
độ tối đa của Yếu tố VIII sau khi truyền.
Tính an toản vả hiệu q_uâ cẩm mảu của ADVAT E ở bệnh nhi tương đương với tỉnh an toản vả hiệu quả ở bệnh
nhân người lớn. Hệ sô phục hổi điếu chinh vả thời g_ian bán thải cuối (t’/_z) thẩp hơn khoftng 2.0% ở trẻ nhỏ
(dưới 6 tưối) so với người lớn. đỉều nảy có thế một phẩn lả do thể tich huyết tướng cho mỏi kg trọng lượng cơ
thể cao hơn ở bệnh nhân tre em.
Hiện nay khỏng có dữ liệu dược động học của ADVATE trên bệnh nhân tửng được điếu trị.
Dữ liệu an toân tiếu lâm sâng
Dữ liệu tiền lâm sảng cho biết không có tác hại đặc bỉệt nâo đối với con người dựa trẻn các nghiên cứu dược
lý an toân. độc tinh cắp. độc tính liếu lặp lại. độc tính tại chỗ và độc tinh trẻn gen.
Nghiên cửu độ dung nạp tại chỗ trẻn thỏ đã cho thẳy ADVA TE được hoản nguyên với.. 2 ml nước cắt pha tiếm
được dung nạp_ tốt sau khi dùng qua đường tĩnh mạch. Đã quan sát thấy hiện tượng ửng đó nhe thoảng qua_ ở
vị trí dùng thuốc sau khi đủng nội động mạch vả sau khi dùng cận tĩnh mạch. Tuy nhiên khỏng quan sát thắy
có thay đôi mô bệnh học bẫt lợi tượng quan nâo cho thấy tính chắt thoảng qua của phảt hiện nảy.
ỉỂM
Sán phẩm được cung _cấp dưới một trong các dạng sau:
— ADVATE với dụng cụ BAXJECT 11: Mỗi hộp chửa một lọ thuốc bột một lọ chửa 2 ml dung mói vá
dụng cụ để hoản nguyên (BAXJECT Il)
- ADVATE trong bộ dụng cụ BAXJEC T 111: Mỗi hộp chứa một bộ dựng cụ BAXJECT III dùng liến
bọc trong bao bì hãm kín (lọ thuốc bột và lọ dung môi 2 ml được lắp sẵn với bộ dụng cụ để hoản
nguyên).
Cả lọ đựng thuốc bột và lo chứa dung mỏi 2 ml iảm bằng thủy tinh Ioại 1 có nút chặn cao su chlorobutyl.
QUY CÁCH ĐÓNG GÓI
Trung 9 IZ
Wiẵ>eằiW
ĐIỀU KIỆN BẢO QtJẨN. HẠN DÙNG. TIÊU CHUẨN cnfvr LƯỢNG CỦA muớc
Hạn dùng
2 năm kế từ ngây sán xuất.
Sau khi hoản nguyên. về mặt vi sinh vật học. cẩn phải sử dụng sản phẳm ngay lập tức. Tuy nhiẽn. độ ổn định
hỏa tinh vả lý tinh khi sử dụng đã được chứng minh trong 3 giờ ớ nhiệt độ 25°C.
Trong thời hạn sử dụng có thể được báo quán sản phẩm ở nhiệt độ phòng (tối đa 25°C) trong thời hạn khỏng
quả 6 tháng. Nên ghi lại ngảy cuõi cùng của giai đoạn 6 tháng khi bảo quản ở nhiệt độ phòng lẻn thủng đựng
sản phẩm Khóng thể đưa sán phẳm nảy vảo tủ lạnh để bảo quản lại
Thận trọng đặc biệt khi bão quân
Bảo quản thuốc ở 2°C— 8°C. Không đề đỏng lạnh Tránh ảnh sáng.
ADVATE với dụng cụ BAXJECT 11: Báo quản lọ thuốc _trong hộp đựng ngoải để trảnh ánh sáng.
ADVATE trong bộ dụng cụ BAXJECT 111: Bảo quản gói sán phẳm hản kin trong hộp đựng ngoải để tránh ánh
sáng.
Để biết điếu kiện bảo quán sau khi hoản nguyên dược phẳm nảy. vui lòng xem mục Hạn dùng.
Tiêu chuẩn chẩt lượng: Tiếu chuẩn cơ sớ.
Thận trọng đặc biệt cho tiêu hủy vả thao tảc khảc
ADVATE lá để sử dụng q_ua đướng tĩnh mạch sau khi đã hoản nguyên.
Phâi kiếm tra cảc sản phẩm đã hoản nguyên bắng mắt thường đề phát hiện cảc tiếu phản vâ/hoặc bỉến đối
mảu.
Sau khi hoản nguyên dung dịch phải trong suốt không mảu vả khỏng cỏ các tiếu phân. Không được sử dụng
các đung dịch vãn đục hoặc có cặn lắng.
- Đế đùng thuốc thì cẩn sử dụng xylanh Iuer-Iock.
- Sử dụng trong vòng 3 tiếng sau khi hoản nguyên.
- Không bảo quán dung dịch đã hoản nguyên trong tủ lạnh
- Cần tiêu hủy bẩt kỳ dược phẩm nảo khỏng dùng tới hoặc chẩt thải theo các quy định của địa phưtmg.
Hgản nguyên bằng dựng cụ BAXJECTI Il.
- Chỉ dùng nước cẩt pha tiêm vả dụng cụ hoản nguyên cung cấp kèm trong mỗi gói đế hoản nguyên
thuốc.
- Khỏng sư dụng nểu dụ_ng cụ BAXJEC T 11. hệ thống bao vô trùng của dụng cụ hoặc bao hi của dụng cụ
đã bị hư hại hoặc có bất cứ đẳu hỉệu hòng hóc
- Phải dùng Kỹ thuật vô khuẩn
1. Nếu sản phẩm vẫn được báo quân trong tủ lạnh. hãv Iặy lọ bột ADVATE vả lọ dung môi khoị tủ lạnh
vả để chủng trở về nhiệt độ phòng (khoảng từ 15 °C đến 25 °C ) qƯ
Rứa tay_ kỹ lưỡn bầng xà phòng vả nước ấm Ả)”
Thảo nắp lọ thuoc bột và lo dung mỏi.
Vệ sinh nút chặn lọ bằng bõng tảm cổn Dật cảc l_ọ lẻn _một bề mặt sạch và b_ằng phảng.
Mở gói dụng cụ BAXJECT 11 bằng cách bóc nắp giấy mã không chạm vảo bến trong gòỉ (Hinh a).
Không Iẩy dụng cụ ra khỏi gỏi. Khỏng sử dụng nêu dụng cụ BAXJEC1 11 hệ thống bao vô trùng của
dựng cụ hoặc bao bì của dụng cụ đã bị hư hại hoặc có bất cứ dắu hiệu hòng hỏc.
6. Lặt gói_ đụng cụ _xuống vả đâm đinh nhọn bằng nhựa trong qua nút chặn 1ọ dung môi. Nắm vảo ria gói
đựng rồi kéo gói đựng tảch ra khói dụng cụ BAXJECT Il (Hinh b). Khỏng tháo nắp mảu xanh khòi
đụng cụ BAXJECT 11.
E^PP.N
Trqu M 12
SaÌ\
F
/._
Hình a
Hoân n
b)
Chỉ _dùng nước cắt pha tỉêm vả d_ụng cự hoân nguyên cung cẳp kèm _tron mỗi gòi dế hoản nguỵến
thuốc Đế dụng cụ BAXJECT 11 gắn vảo lọ dung mỏi. lật ngược khối gắn ket sao cho lọ dung môi nắm
trến bộ dụng cụ hoản nguyên. Đâm đinh nhọn bằng nhựa trắng qua nút chặn lọ thuốc bột ADVATE
Lực hủt chân không sỹ hủt đu_ng môi vảo trong lọ thuốc bột ADVAT E (Hinh c)
L_ắc nhẹ cho tới khi tẩt cá chẩt đã được hòa tan. Phái đảm báo thuốc bột ADV ATE hòa tan hoản toản.
nếu không dung dịch đã hoản nguyên sẽ không chảy hết qua mảng lọc của dụng cụ. Sản phẩm nảy tan
nhanh (thường chưa tới ] phủt). Sau khi hoản nguyên. dung dịch phải trong suốt. không mảu vả không
có cảc tiều phân.
Hình b Hình c
u én bắn ' dun c BAXJECT 111:
Không dùng nểu năp đậy không được hản kín trên gòi bao bì
Nếu sản phẩm vẫn được bâo quán trong tủ lạnh hãy lắy gòi bao bì hản kỉn (chứa lọ bột và lo dung môi
đã Iẳp sẵn với bộ dụng cụ hoản nguyên) khói tủ lạnh vả để chủng trở về nhiệt độ phòng (khoảng từ
15°C đển 25°C)
Rửa tay k_ỹ lướ_ng bắng xả phòng và nước ấm
Mờ gói sán phẩm ADVATE bằng cách bóc nắp đậy. Tháo nắp bộ dụng cụ BAXJEC T 111 khỏi bao bi.
Đặt ADVATE lến n_tột bề mặt bằng phẳng với lọ dung mói ớ trén (Hinh 1). Lọ dung mỏi có vạch mảu
xanh. Không thảo nắp xanh cho tới khi được hướng dẫn tháo nắp ở bước sau.
Dùng một tay giữ lọ AD_VATE tro_ng bộ dụng cụ BAXJECT 111 ắn ch_ặt xuống lọ dung môi bằng tay
còn lại cho tới khi hệ thống hạ xuống hoản toản vả dung môi cháy xuống vảo lọ ADVATE ( thh 2).
Không nghiêng bộ đụng cụ cho tới khi dung mỏi chậy qua hết lọ thuốc.
Kiếm tra xem dung môi đã cháy hết qua lợ thuốc. L_ắc nhẹ cho tới khi tẳt cả chất đã được hòa tan. Phái
đảm bảo thuốc bột ADVATE hòa tan hoản toản nếu khỏng dung dịch đã hoản nguyên sẽ khỏng chảy
hết qua mâng lọc của dụng cự. Sản phẩm nảy tan nhanh (_thường chưa tới 1 phủt). Sau khi hoản
nguyên, dung dịch phái trong suốt. không mảu và không có các tiêu phản.
`Ứ
Hình | Hình 2 Hình 3 \\sz
ủiÌ-ụ
;)
_è.
Ẹ ịf"
. I`.
/
]
[
Trong !! IZ
\VJự.
%
oV
Nhưnuld
\,ơ
JxỂâ.\
// `ỉ.—v
Sư dụng _
Cân dùng kỹ thuật vô khuân
Các dược phẩm dạng tỉêm phải dược kiểm tra về tiều phân trưởc khi dùng. bắt cứ khi nảo dung dịch vá lọ
chứa cho phép. Chi nẽn dùng dung dịch trong vả không mâu.
I. Tháo nắp mảu xanh khỏi dụng cụ BAXJECT III BAXJECT IN. Không rủt không khí vâo trong
xylanh. Đẩy đẩu kim xylanh vảo dụng cụ BAXJECT II | BAXJECT III.
2. Lật ngược khối dụng cụ ( lọ chứa dung dich đã hoản nguyên phải ở phỉa trén). Rủt dung dich đã hoản
nguyên vảo trong xylanh bằng cảch kéo từ từ pit-tông cúa xylanh.
3. Lây xylanh khỏi lọ thuốc.
4. Gắn kim bướm vảo xylanh. Tiẻm đường tĩnh mạch. Phải tiêm dung dịch từ từ theo tốc độ được xác
đinh bằng mức độ thoải mái của bệnh nhân và không vượt quá IOmI mỗi phủt. Phải xác định nhịp
mạch trước vả trong quả trinh dùng ADVATE Nếu thẩy có biểu hiện tăng dáng kế giám tổc độ tiêm
hoặc tạm thời dừng tiêm sẽ Iảm cảc triệu chứng biến mất nhanh chóng (xem mục Cảnh báo vả thận
trọng đặc biệt khi sử dụng và Tác dụng không mong muon)
TÊN vÀ ĐỊA cui CỦA cơ sở SẢN qu1 ủy
Nhã sản xuất: Baxalta Mauufacturing Sârl
Roule de Pierre—ă-Bot I II. 2000 Neuchâtel. Switzerland/ Thụy Sĩ
Đóng gói vả xuất xướng bởi: Baxalta Belgium Manufacturing S.A.
Boulevard René Branquarl 80. 7860 Lessines. Belgith Bi
Cơ sở sản xuất dung mòi: Siegl'rieđ Hameln Gmbl-l
Langes Fcld 13. D-31 789 Hameln. Germany/ Đủt'
TUQ CỤC TRƯỜNG
PTRƯỜNG PHÒNG
JV ’) JV ,ỹỌf ỸocJý/mpi
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng