

















BỘ Y TẾ ›
CỤC QLỤ\N LY DUOC
ĐÃ PHÊ DUYỆT
Lản đfiưligỡ1 …Ú…
LABE
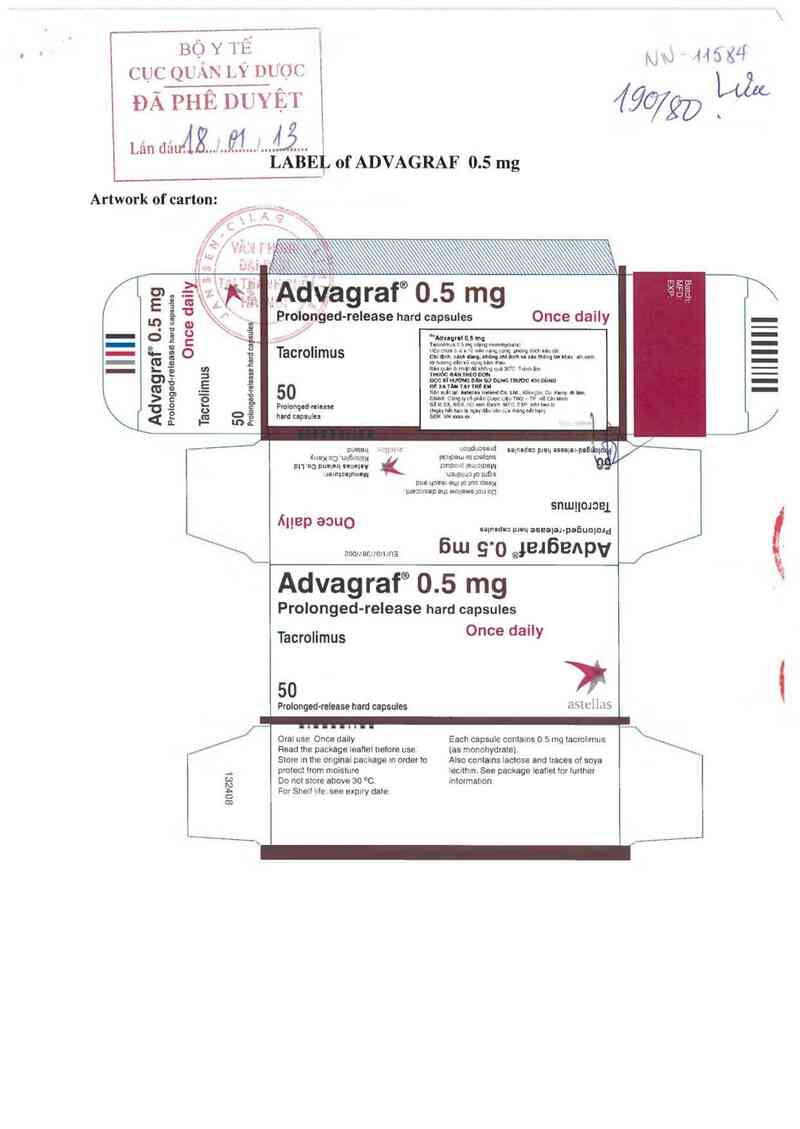
Artwork of carton:
of ADVAGRAF 0.5 mg
Once daily
50
Pmlongedweluu
t…d ccpsulu
Advagraf“ 0.5 mg
Prolonged-release ham cnpcuiu
Tacrolim us
50
Probnged-mluu hard u . mlu
pumm,
Áncỵ og 'uqumỵ
Pl`l 'na WI…1 unIlW
: ni moununw
…vịị iN:
ẤlỊBD aouo
ZOOII Êf..'lOlllnị
ặ,; , _,AdvagraP 0.5 mg
g Prolonged-release hard capsuies
(Ê __ V ",nvagmosmg
o Tacrolimus
pun uatm W] po mo dnnỵ
iưmman au1uoụuunou on
nmctmq ohboụihk huOudll
cniunn. nu lum… mmnnvnn mMgnn mi: Ium
w…ẹdnninụng Y h
mc mo…ẹmunoqmncc …… n
tmẫ:nAnmzooou
lư… nm iửnunG mm m nimc
dc :… uu nv … Ell
SInmliul uuuuurdmoe.tu. mc m. Cc Klry uu
Du…t cenọtyzđọnln OmuOu Wiz TP ›oecmmm
sAmsx nsx nomrmn MM FIP uuưnnu
imyhhnnnuquydu … unlnghhhợn)
i.onducsaid
lIJtomu ơi min…
ionccie ịeu1:npơưq
nmdn pm, uunppan _.
uâiDiiuã ›0 luõis
snmuomel
lilnìdiẫ Flill ầBEầlồJ-pĐBUO ỊOJd
6… g'o ,,JEJBEApV
t… …
/Íýớng
Tacrolimus
50
Prolonged-feiease hard capsules
Orai use Once daily
Read me package leailei beiore use.
Store tn the onginal package II'1 ordeư to
protect irom moisture
Do not slore above 30 °C.
For Shen Me. see expưy date.
807881
Advagraf® 0.5 mg
Prolonged-release hard capsules
Once daily
ji
nstciiưs
Each capsule contains 0 5 mg tacroltmus
(as mcnohydưate).
Also ccntams lactose and haces oi soya
1ecolhm. See package Ieailet ior Iuither
iniotmation
/
11584
Lc2ac
fổ
ADVAGRAF® 0.5 mg Prolonged-
release hard capsules
Tacrolimus
Oral use.
50 prolonged-release hard capsules
ADVAGRAF® 0.5 mg Prolonged-
release hard capsules
Tacrolimus
n Oral use.
50 prolonged-release hard capsules
Read the package leailet before use.
Do not store above 30 °C.
For shelf life: see expiry date.
Once daily.
Read the package leaflet beiore use.
" " Do not store ab0ve 30 °C.
For shelf life: see expiry date.
Once daily.
EXP bbbbbb
Batch aaaaaaa
Ì Manufacturer:
astcllủS Asteilas Ireland Co. Ltd.
CO?ZE L
: ! Manufacturet:
astellas Astellas Ireland Co. Ltd.
CO?ZÊ L
:s.tansuq g puno.t SUỊdde mnmgunmc J0 apomsv
-Auep cauo
ZOVZSL
Batch: aaaaaaa
EXP: bbbbbbb
-l _c> '
ẵỄcnẵg
c, __
Ể>ẫảỂ
cQ>m—…Ễ
"'ỄCJÌ’z`
<'H<
-n>°'
®ẫẩẵ
P>g
ẵ'iổ'°
ÍDp>
-u°'o
ỗẵẵ
—°°n
%>;
«=Ễ
«› >Ệ
n.o°
ảẫ’ủ €
gas c
Cẳ’Tẫjỗ ã
,3_ Ế ã
ặ›ẳ E
0 :
ỦỄ-n D.
>o o
QF: 0
_Dun '
% ặa C
° F
,.anwnomu " -
\
::.1ajan ;o' ›ị.iom.iv
8… sn ưvưovmv Jo ’IEIHVT « _
samsdeo pmq aseaịai-paõuomid 6… go ®Jy'ủg`vfflv
: JaJnịoaịnuaw
DU Msa~r _ bsdtẹl
TÊN THUỐC /i Ổng
AD\ịAGRAF®O mg viên nang cứng phóng thích kéo dải
f/Củ hiịN\z /\I\`Ĩ' BỘ Y ’i`Ế
MH PHA Đ_ỊNH TÍNH VÀ ĐỊNH LƯỢNG cuc QUAN Lý DƯỢC
eị viên nang cutng…phong thích kéo dải chứa: ' _ -—--—,—-—- A,
"*- “ “ ĐA PHE DUYẸT
0, 5\mg tacrohmus(monohydrate)
. Lãn datágớịi'ịỹ
Đối với`tiĩảĩtfi phần tá dược, xem Danh sách thảnh phần tả dư_ o
MÔTẢ
Viên nang cứng phóng thích kéo dải.
Viên nang gelatin mảu đỏ có ohữ “0.5 mg” trên phần nắp mảu vảng nhạt và "’ 647" trên
phần thân mảu cam, chứa thuốc bột mảu trắng.
CÁC ĐẶC TÍNH LÂM SÀNG
Cảo Chỉ Định Điều Trị
Phòng ngừa thải ghép gan hay thận ở người nhận trưởng thảnh.
Điếu trị những trường hợp thải ghép dị sinh khảng với cảc ioại thuốc ức ohế miễn dịch khác ở
người trưởng thảnh.
Liều dùng và Phương Pháp Sử Dụng Thuốc
Advagraf 1ả dạng bảo chế uông ngây một lằn cùa tacrolimus Điều trị Advagraf đòi hòi phải
Có sự giảm sảt cân thận bởi cảc nhân viên được trang bị kiến thức và dụn ích hợp. Loại
thuốc nảy chi được dùng khi bảo sỹ kê toa, và những thay đồi trong diếu trị jchế/miễn dịch
chỉ được thực hiện bởi các bác sỹ oó kinh nghiệm trong điếu trị ức chế mi iiích và xử trí
những bệnh nhân ghép tạng.
Sự ngừng sử dụng không thận trọng, không có chủ ý hoặc không được giảm sát của cảc dạng
bảo chế thuốc taorolimus phóng thích nhanh hay kéo dải lá không an toản. Điếu nây có thế
dẫn đến sự thải ghép hay tăng tần suất cùa các tảo dụng phụ, bao gôm ức chế miễn dịch không
đủ hoặc quá mức, do những khảo biệt có ý nghĩa lâm sảng ở các nông độ thuốc tacrolimus
Bệnh nhân nên được duy trì với một dạng bảo chế cùa tacroiimus với chế độ liếc hảng ngảy
tương ứng; những thay đổi về dạng bảo chế hay phảc đồ chỉ được thực hiện dưới sự giảm sảt
chặt chẽ của một chuyên gia thải ghép (xem phần Lưu ý quan trợng và thận trọng khi sử dụng
vả phần Các tác dụng ngoại ý). Sau khi chuyến qua dạng bảo ohế khác, theo dõi diều trị thuốc
phải được thực hiện và điếu chỉnh liều để đảm bảo duy tri nồng độ toản thân của tacrolimus.
Liều dùng
Liều dùng khuyến cảo ban đầu thế hiện bên dưới chỉ nên xem như hưởng dẫn. Advagraf được
cho dùng thường quy kết hợp với oác thuốc ức ohế miễn dịch khảo trong giai đoạn đấu sau
phẫu thuật. Liều dùng có thể thay đối phụ thuộc vảo phác đồ ức chế miễn dịch được chọn.
Liều Advagraf nên chủ yếu dựa vảo đảnh giả lâm sảng của sự thải ghép và khả nảng dung
nạp cùa mỗi cá nhân bệnh nhân dựa trên theo dõi nông độ thuốc trong máu (xem “Theo dõi
thuốc điều trị” bên dưới). Nếu dắu hiện lâm sảng của thải ghép trở nên rõ rảng, thi phải xem
xét việc thay đổi phảc đồ ức chế miễn dịch.
Ở những bệnh nhân mởi ghép gan và thận, AUCO- 24 cùa tacrolimus cùa Advagraf trong Ngảy
] thì thâp hơn lần iượt là 30% và 50% so với viên nang phóng thích lập tức (Prograi) ở cùng
Iiếu. Vảo ngảy 4, đảp ứng hệ thống được đo lường bởi nông độ đáy thì tương tự đoi với cả
những bệnh nhân ghép gan và thận vởi cả hai dạng bảo chế. Theo dõi oân thận và thường
1
xuyên nồng độ đáy của tacrolimus được khuyến cảo trong hai tuần đầu tiên sau ghẻp với
Advagraf để đảm bảo nổng độ thuốc đầy đủ trong khoảng thời gian ngay sau ghép tạng. Vi
taorolimus là một chất oó độ thanh thải thẳp, điếu chinh chế độ liếu Advagraf Có thế cẩn vải
ngảy để đạt được giai đoạn ổn định.
Đế ức _chế sự thải ghép, ức chế miễn địch phải được duy trì; vì vậy, không có giới hạn về thời
gian đôi với phảc đô thuôc uông eó thế được sử dụng.
Phòng ngừa thải ghép thân
Điếu trị Advagraf nên khời đầu vởi liếu 0,20- 0,30 mg/kg/ngảy, dùng ngảy một lần vảo buồi
sáng Dùng thuốc nên bắt đầu trong vòng 24 giờ sau khi hoản tắt phẫu thuật
Liều Advagraf thường được giảm trong thời gian sau ghép Trong một số ca có thế ngưng
điếu trị thuốc ức chế miễn địch đi kèm, ohỉ sứ đụng Advagraf đơn trị liệu. Những thay đối về
tinh trạng của bệnh nhân sau ghép có thể thay đồi tinh chẳt dược lý cùa tacrolimus và có thế
ủủfflủủổmủmử.
Phòng ngừa thải ghép gan
Điếu trị Advagraf nên khởi đầu vởi liếu 0,10- 0,20 mg/kglngảy, dùng ngảy một lằn vảo buối
sảng Dùng thuốc nên bắt đầu khoảng 12- 18 giờ sau khi hoản tất phẫu thuật.
Liều Advagraf thường được giảm trong thời gian sau ghép. Trong một số ca có thế ngưng
điếu trị thuốc ức ohế mìễn dịch đi kèm, chỉ sử dụng Advagraf đơn trị liệu Những thay đối vê
tình trạng oùa bệnh nhân sau ghẻp CÓ thể thay đổi tính ohất dược 1ỷ oùa taoroiimus vả Có thể
ủửfflửủfflửfflửmủ.
Chuyến những bênh nhân đang điều tri Prograf sang Advaaraf
Những bệnh nhân ghép tạng dị sinh đang được duy trì liếu ngảy 2 iần với viên nang Prograf
oân chuyến qua ngảy một lần Advagraf nên được chuyến theo tỉ lệ 1: 1 (mg: mg ) trên tồng liếu
hảng ngảy. Advagraf nên được uông vảo buổi sảng .
Ở những bệnh nhân ộn—đièi được chuyến tư viên nang Prograf (ngảy hai 1ằn) sang Advagraf
(ngảy một lằn) thêợ-h-rảế’kl (mg: mg) theo tống liến hằng ngảy, nồng độ toản thân đối với
tacrolimus [AUCO›Z-4ẫ'dổiấfới Advagraf thi thấp hơn khoảng 10% so với Prograf. Mối tương
quan giữa cảc nòng độ đảy cùa taoroiimus (C24) và nông độ toản thân (AUCO- 24) đối với
Advagraf thì tương tự như nhau. Khi chuyến từ viên nang Prograf sang Ađvagraf, nồng độ
đáy nến được đo trước khi chuyến qua và trong vòng hai tuần sau khi chuyến thuốc. Sau khi
chuyến thuốc, nồng độ đảy tacrolimus phải được theo dõi và ohinh liếu nêu oần thiết để duy
trì nồng độ toản thân tương tự.
Chuyền từ céclosgợorin sang zacrolimus
Phải thận trọng khi chuyến bệnh nhân tư liệu phảp điếu trị chủ yếu dựa trên ciciosporin sang
chủ yếu dựa trên tacrolimus (xem phần Lưu ý đặc biệt và thận trọng khi sử dụng vả phần
Tương tảo với các thuốc khảo vả các hình thức tượng tảo khảo). Sử dụng kết hợp giữa
ciclosporin vả tacrolimus không được khuyến cảo Điếu trị với Advagraf chỉ nên bắt đầu sau
khi xem xét nồng độ oiclosporin mảu và tinh trạng iâm sảng oùa bệnh nhân. Nên hoãn dùng
thuốc nếu có mửc nồng độ ciclosporin trong mảu tăng. Trong thực hảnh, liệu phảp điếu trị chủ
yếu dựa trên tacrolimus được khởi đầu 12— 24 giờ sau khi ngưng ciclosporin. Theo dõi nồng
độ ciolosporin mảu nên được tiếp tục sau khi chuyến thuốc vì độ thanh thải oủa oiclosporin oó
thế bị ảnh hưởng.
Điều tri chống thải ghép
Tảng iiếư tacrolimus, bổ sung trị iiệu corticosteroid, vã đưa vảo một iiệu trình ngắn của
kháng thể đơn/đa dòng, tẩt oả đã từng được dùng để xử trí những giai đoạn thải ghép Nếu oó
dấu hiệu độc tính như các phản ứng thuốc nặng đã được ghi nhận (xem phần Cảo tác dụng
2
ngoại ỷ), liếu Advagraf có thế oẳn phải gíảm.
Đỉểu trị chổng thải ghép dị sinh sau ghép gan hoặc thận
Đối với việc ohưyến từ cảc thước ức chế míễn dịch khảo sang Advagraf ngảy một lần, việc
điếu trị nên bắt đầu với liếu uống khới đẩu như liếu được khuyến cáo tương ứng cbo trường
hợp phòng ngừa thải ghép ớ ghe'p gan hoặc thận
Ọ1'ều trị chống lház' ghép dị sinh sau ghép lim ~
0 những bệnh nhân trướng thảnh được chuyện sang Advagraf, liêu uông ban đâu 0,15
mg/kg/ngảy nên được dùng ngảy một lân vảo buôí sảng
Điều trị chống rháí ghép dị sinh sau ghép những zạng khảc
Mặc dù không có kinh nghiệm lâm sảng với Advagraf ơ những bệnh nhân được ghép phổi,
tụy hay ruột, Prograf đã được sử dụng trên nhũng bệnh nhân được ghép phồí với liếu khới đầu
bằng đường uông lả 0,10- 0,15 mglkg/ngảy, trên những bệnh nhân ghép tụy liếc khời đầu
đường uông là 0, 2 mgfkg/ngảy vả trong ghép ruột với liếu khới đầu lả 0,3 mg/kglngảy.
Chinh 1iếu trong dân số đăo biết 1 D
Suy gan Gíảm liếu có thế cẳn thiết trên những bệnh nhân có suy gan nặng để iìỗntrì nếrĩg độ
đảy của taorolímus trong khoảng đích được khuyến cảo. > V
Suy thận. Vì oác đặc tính dược lý hợc của taorolimus không bị ảnh hưởng bới ohức năng thận
(xem phần Cảo đặc tính Dược lý học), không oần thiết phải điếu ohỉnh liều. Tuy nhiến, do
tacrolimus có khả năng độc thận nên cân theo dõi cẩn thận chức năng thận (bao gôm nồng dộ
creatinine huyết thanh đo lảm nhiếu lần, tinh toản độ thanh thải creatinine và theo dõi lượng
nước tiều).
Chủng rộc: Khi so sánh với người da trắng, bệnh nhân da đcn oần liếu tacrolimus cao hon để
đạt được nông độ đáy tương đương.
Giới tính: Không oó bằng chứng oho thấy rằng những bệnh nhân nam vả nữ cần những liều
khảo nhau đế đạt được nông độ đảy tương đương.
Bệnh nhân lớn tuổi; Hiện không oó bầng chứng cho thấy rằng oần chỉnh liếu thuốc trên những
bệnh nhân 1611 tuôi.
Bệnh nhán trẻ em: Thông tin vê an toản, hiệu quả của Advagraf ở trẻ em dưới 18 tuôi chưa
được xảo lập. Dữ liệu hiện có giới hạn nên không có khưyên oáo về chế độ liên cho đôi tượng
nảy.
Theo dõi điếu tri thuốc
Liều đùng nên ohù yếu dựa trên đánh giá lâm sảng sự thải ghép và khả năng dung nạp trên
từng bệnh nhân riêng biệt và được hỗ trợ bới theo dõi nồng độ đảy cùa tacrolimus trong mảu
toản phần.
Để hỗ trợ ohọn liếu thuốc tối ưu, nhiếư xét nghiệm miễn dịch hiện có được dùng để xảo định
nồng độ tacrolimus trong máu toản phần So sảnh các nồng độ từ những tải liệu đã được xuất
bản với những nồng độ đơn lẻ trong thực hảnh lâm sảng phái được đảnh giá với sự cấn trợng
vả am hiếu cùa oác phương phảp xét nghiệm míễn dịch được' ap dụng Trong thực hảnh lâm
sảng hiện nay, nồng độ trong mảu toản phần được theo đõi bằng các phượng phảp xét nghiệm
miên dịch. Mối tương quan gìữa nồng độ đảy cùa tacrolimus (C24) và nông độ toản thân
(AUC 0- 24) là tương đương nhau giữa hai thuốc Advagraf vả Prograf.
Nồng độ đảy của tacrolimus phẻ_ti được theo dõi trong suốt thời gian sau ghép tạng. Nồng_ độ
đảy oủ_a tacrolimus phải được xác định khoảng 24 giờ sau liếc Avagraf, ngay trước khi uống
1iếu tiếp theo Khuyến cảo theo dỏi nồng độ đảy thường xuyến trong hai tuần đằu sau ghép
tạng, sau đó theo _dõi định kì trong suốt thời gian điếu trị duy trì. Nồng độ tacroiimus đảy
trong mảu cũng cần được theo dõi sát sau khi chuyến tù Prograf sang Advagraf, sau điếu
chinh liếu, các thay đối trong phác đồ điếu trị ức ohế miễn dịch, hoặc đồng sử dụng những
thuốc mà nó Có thể thay đối nông độ taorolimus trong máu toản phần (xem Tương tảo với oảc
thuốc khảo và oảc hinh thức tương tảo khảo). Tần suât của theo dõi nông độ thuốc _trong máu
phải được dựa trên như oầu lâm sảng. Taoroiimus là một ohẳt oó độ thanh thải thấp, sau khi
điếu chỉnh ]iếu Advagraf có thế cân vải ngảy để đạt được tinh trạng ốn định cùa nồng độ
đich.
Dữ iiệL_l từ các nghiên cứu lâm sảng cho thấy phẩn lớn bệnh nhân oó thế được xử trí thảnh
công nếu nồng độ đảy oủa tacrolimus trong mảu được duy trì đưới 20 ng/ml. Cần quan tâm tới
tình trạng lâm sảng oùa bệnh nhân khi phân tích ý nghĩa oảc nồng độ thuốc trong mảu toản
phần. Trong thực hảnh lâm sảng, nồng độ đáy trong mảu thường ở khoảng 5- 20 ng/ml ở
những người ghép gan và 10- 20 ng/ml ở những người ghép thận và ghép tim ở giai đoạn sớm
sau ghép tạng Trong suốt giai đoạn đìếu trị duy trì sau đó, nồng độ trong máu thường trong
khoảng 5- 15 nglmi ở những người được ghép gan, thận và tim.
Phương ohán sử dung thuốc
Advag_raf là dạng bảo ohế của tacrolimus dùng đường uống ngảy một iần. Khuyến cáo rằng
liếc uông hảng ngảy cùa Advagraf nến được sư dụng ngảy một lần vảo bưối sáng. Viên nang
cứng Advagraf tảo __dụng kéo dải nện được dùng ngay sau khi lẳy ra khỏi vị thuốc. Bệnh nhân
nên được hướng đẫn đế không nuốt ohất hút ảm. Viên nang phải được nuốt nguyên viến với
chắt lòng (tốt nhất là với nước). Advagrat_` thường nên uông khi đạ đảy trống hoặc ít nhắt 1 giờ
trước bữa an hoặc 2- 3 giờ sau bữa an, để đạt được sự hắp thu tối đằ (xem Phần đặc tính dược
động học) Nến quên một liếc bưổi sảng thi phải uống lại cảng1ặớmpảng tốt trong oùng ngảy.
Không được uống liếu gấp đôi vảo buồi sảng hôm sau. \
Ở những bệnh nhân không thế đùng thuốc đường uống trong thời gian ngay sau ghép tạng,
điếu trị với tacrolimus cớ thế khới đầu bằng đường tiêm tĩnh mạch (xem Tóm tắt Đặc tinh sản
phẩm đối với Prograf nồng độ 5 mg/ml cho địch đế tỉêm truyền) ở iiếu xấp xỉ IIS oùa iiếu
uông được khuyến oảo cho chỉ định tương ứng.
Chổng Chỉ Định
Quả mân cảm đối với tacrolimus, hoặc với bất kì thảnh phần tả dược nảo của thuốc (xem
Danh sảoh thảnh phần tá dược)
Quá mẫn cảm với cảc macrolide khảo
Lưu ý và thận trọng đặc biệt khi sử dụng
Cảo sai 1ầm khi dùng thưốo, bao gồm thay đồi các đạng bảo chế oùa thuốc tacrolimus phớng
thích nhanh hay kéo dải một oảch không cẩn thận, không chủ đích hay không được giảm sảt,
đã từng xảy ra. Điếu nảy đă đẫn đến các tác dụng ngoại ý nghiêm trọng, bao _gồm thải ghép,
bay oác tảo dụng phụ khác mả nó có thế là hệ quả của việc đùng tacrolimus thiếu hay quả iiếu
Bệnh nhân nến được điếu trị đuy trì với một dạng bảo cbế dụy nhẳt cùa thuốc tacrolimus với
liếu hảng ngảy tương ứng; những thay đối vê đạng bảo chế hay phảc đồ sử dụng chỉ được
thực hiện dưới sự giám sát chặt chẽ oùa một chuyên gia ghép tạng (xem phần Liều dùng vả
phương pháp sử đụng vả phần Các tảo dụng ngoại ý).
Advagraf không được khuyến oác sử dụng ở trẻ em dưới 18 tuổi do có ít dữ iiệu về hiệu quả
vả/hoặc tính an toản.
Đế điếu trị thải ghép dị sinh kháng với cảc thuốc ức ohế mỉễn dịch khác ở người trường thảnh
thi những dữ iiệu lâm sảng chưa có đối với thuốc Advagraf phóng thích kéo dải.
Đối với việc phòng ngừa thải ghép ở những người nhận tim ghép trưởng thảnh thi dữ liệu lâm
sảng cũng ohưa có đôi với Advagraf.
Trong thời kì đầu sau ghép, phải thực hiện theo dõi cảo thông số sau một cảch thường qui vả
định kỳ: Đo huyết áp, điện tim, trạng thái thần kính và thị gỉác, đường _huyết 1ủc đói, điện giải
(đặc biệt lả kali máu), xét nghiệm chức năng gan vả thận, cảc thông sò huyết học, chức năng
đông mảu vả iượng protein huyết thanh Nếu thấy có cảc thay đối quan trọng về mặt lâm sảng,
nên xem xét việc điếu chinh cảc thuốc ức chế miên dịch
Khi oó cảc chất có khả năng tương tảo khi sử dụng chung với tacrolimus (xem Tương tảo với
oác thuốc vả các hinh thức tương tác khác)— đặc biệt những chất ức ohế mạnh CYP3A4 (như
ketoconazole, voriconazole, itraconazole, telithromycin hay olarithromycin) hay cảo đẫn chắt
cùa CYP3A4 (như rifampin, rifabutín)- nông độ tacrolimus trong mảu phải được theo dõi để
điều chinh liếu taorolimus cho phù hợp để duy tri nồng độ taorolimus tương đương
Cảo thuốc dạng thảo dược kể cả St John’ s Wort (Hype_ cum perfo lum) phải trảnh dùng khi
đang uống Advagraf bời nguy cơ cảo tương tác thuốc cỏ. ] * antới giảm nồng độ thuốc
trong mảu và hiệu quả điếu trị cùa tacrolimus (xem Tươn ac với oảc thuốc khác và cảc hinh
thức tương tảo khảo).
Phải trảnh điếu trị kết hợp ciolosporin vả tacrolimus và cẩn trợng khi sử dụng taorolimus trên
nhũng bệnh nhân trước đó có sử dụng ciolosporin (’xem phân Liêu dùng và phương pháp sư
dụng và Tương tảo với oảc thuôo khác và các hình thức tương tác khác).
Tránh sử dụng kali uống ]iếu oao hoặc oảo thuốc lợi tiểu giữ kali (xem Tương tảo với cảc
thuốc khảo vả oác hinh thức tương tác khảo).
Một số sự kết hợp nhất định giữa tacrolimus với cảc thuốc mà đã bỉết có thể gây độc thận hay
độc thấm kinh oó thế lảm tăng nguy cơ cùa những ảnh hưởng nảy (xcm Tương tảo với oác
thuốc khảo vả cảc hinh thức tương tác khác).
Cảo thuốc ưc chế miễn dịch có thể tác động đến sự đáp' ưng với chùng ngừa và trong suốt thời
gian điếu trị với tacrolimus việc chùng ngừa oớ thế kém hiệu quả. Tránh sư dụng các loại vắc-
xin sống giảm độc lực
Vì nồng độ taorolimus trong mảu oó thể thay đổi đáng kể trong lúc tiêu ohảy, thco dõi thêm
nông độ tacrolimus được đê nghị trong các đọt tiêu chảy.
Cảo bênh 1v hê tim mach _
Phì đại thất hay phì đại vảch ngãn, được bảo cảo lzi bệnh l_ý cơ tim, đã được quan sảt thây ở
những bệnh nhân điếu trị vói Progra_f trong một số ca hiếm gặp và oũng có thể xảy ra với
Advagraf. Hầu hết oác trường hợp có thể phục_ hồi được, xảy ra vởi nồng độ đảy trong máu
cùa tacrolimus cao hon nhiếu so với nồng độ tối đa được khuyến cảo. Cảo yếu tố khảo được
thẳy lảm tăng nguy cơ cùa những tinh trạng lâm sảng nảy bao gôm bệnh tim mạch có trước
đó, sử dụng oorticostcroid, tăng huyết ảp, suy ohức năng gan hoặc thận, nhiễm trùng, quá tải
dịch vả phù Vì vậy cho nên, những bệnh nhân nguy cơ oao mả được điếu trị ức chế miễn dịch
mạnh thì phải được theo dõi, bằng cách sử dụng những oận lâm sảng như siêu âm hoặc điện
tim_ trước và sau khi ghép tạng (ví dụ khới đầu lủc 3 tháng và sau đó 9—121hảng) Nếu thấy có
xuất hiện bất thường, gíảm liếu Advagraf hay thay đổi điếu trị qua những thuốc ức chế miễn
5
dịch khảo phải được xem xét Tacrolimus có thế lảm kéo đải khoảng QT nhưng tại thời điếm
nảy vẫn thiếu những bằng chứng rằng thuốc có thể gây ra xoắn đỉnh (T orsades de Poìnles)
Phải thận trọng trên những bệnh nhân có ohấn đoản hay nghi ngờ oó hội ohứng QT kéo dải
bâm sinh.
Bênh lv tãng sinh lvmoho bảo vả các bếnh lv ác tinh
Những bệnh nhân được điếu trị với taorolimus được bảo cáo oó bệnh lý tãng sinh lympho bảo
liên quan với nhiễm EBV (xem phần Cảo tảo dụng ngoại ý). Một sự kết hợp của cảc thuốc ức
chế miên dịch như các khảng thế khảng lympho (ví dụ basiliximab, daciizumab) cho dùng
đống thời 1ảm tăng nguy oơ cảo bệnh lý tăng sinh lympho bảo liên quan với nhiễm EBV.
Những bệnh nhân oớ EBV-VCA (EBV-Viral Capsid Antigen) âm tính đã được bảo cảo có
tăng nguy cơ phát triến cảc bệnh lý tăng sinh iyrnpho bảo. Vì thế, trong nhóm bệnh nhân nảy,
xét nghiệm huyết thanh EBV-VCA nến được xảo định trước khi bắt đầu điếu trị với Advagraf.
Trong suốt quá trình điếu trị, khuyến cáo phải theo dõi cẩn thận với xét nghiệm PCR- EBV.
PCR-EBV dương tính có thế tồn tại nhiếu tháng vả vì vậy không phải lả chỉ điếm cùa bệnh
tảng sình lympho hoặc lymphoma.
Như với cảc thuốc ức chế miễn địch mạnh khảc, nguy oơ ung thư thứ phải chưa được biết
(xem cảc tảo dụng ngoại ý)
Như với các thuốc ức chế miễn dịch khảo, do oó khả năng gây cảc thay đồi ảo tinh ở da, vì
vậy phải hạn chế phoi nắng vả trảnh tia UV bằng cảch mặc quân ảo bảo vệ vả sử đụng kem
chống nảng có yếu tế bảo vệ cao. ,
Những bệnh nhân được điếu trị với thước ức chế miễn địch, bao gồm A F thi có tăng
ngưy oơ nhiễm trùng cơ hội (vi trùng, nấm, vi_ rút vả _đơn bảo). Trong ca,c~tÌếĨỄfflầỳ thì bệnh
thận do nhiễm vi rút BK và bệnh não chất trắng đa 0 tiến triến có liên quan_ VỀỦPJC (PML).
Những nhiễm trùng nảy thường liên quan tới tống liếu cao cùa thuốc ức chế miễn dịch và có
thế dẫn tới các tình trạng bệnh lý nghiêm trọng hay nguy hiếm tới tinh mạng, mà bảo sỹ phải
xem xét trong phần chần đoản phân biệt trên những bệnh nhân đang điều trị ức ohế miên dịch
mà oó tình trạng xảo đi trong chức năng thận hay có cảc triệu ohứng thần kinh
Bệnh nhân được điếu trị với tacrolimus được bảo cảo có hình thảnh hội chứng bệnh não sau
có phục hồi (Posterior Reversible Enchphalopathy Syndrom- PRẸS). Nếu bệnh nhân đang sử
dụng tacrolimus có biến hiện cảc triệu chứng PRES như đau đầu, thay đổi trạng thải thần
kinh, động kinh, rối loạn thị giảc, thì nên _lảm xét nghiệm hinh ảnh (ví dụ như MRI). Nếu có
chẩn đoản PRES, thì phải kiếm soát huyết ảp vả động kinh thích hợp và ngưng ngay thuốc
taorolimus Hầu hết oảo bệnh nhân hồi phục hoản toản sau khi thực hiện cảc biện phảp điếu
chinh thich hợp
Bất Sản Nguvên Hồng Cầu:
Cảo trường hợp bắt sản nguyên hồng cầu (PRCA) đã được bảo cảo ở những bệnh nhân điếu trị
với Tacrolimus. Tất cả cảc bệnh nhân đã bảo oáo oảc yếu tố nguy cơ đối với PRCA như
nhiễm virus parvo B19, bệnh nến hay kết hợp dược phấm liên quan tới PRCA_
Dân số dăo biêt
Không có nhiếu kinh nghiệm trên những bệnh nhân không _phải da trắng vả những bệnh nhân
có tăng nguy cơ miễn dịch (ví dụ tải ghép, có bằng chứng cùa phản ứng khảng thế, PRA).
Giảm liếu có thế cần thiết trên những bệnh nhân có suy giảm chức năng gan nặng (xem Liều
dùng và phương phảp đùng thuôo)
Viên nang Advagraf ohứa lactose Những bệnh nhân có cảc bệnh lý di truyến hiếm như không
dung nạp galactose, suy giảm chức năng men lactase, hoặc kém hẳp thu glucose- galactose thi
không nên dùng thuốc nảy. Mực' … dung để đóng dắu trên viên nang Advagrat có chứa soya
lecithin. Ở những bệnh nhân bị quá mân cảm với đậu phộng hay đậu nảnh, nguy cơ vả mức độ
cùa sự quá mân cảm phải được cân nhắc so với 1ợi ích khi dùng Advagrai.
Tương tảo vm ' ' mcác thuốc khác và các hình thửc tuơng tác khác
Tacrolimus dùng đường toản thân được chuyến hóa bởi CYP3A4 cùa gan Cũng oó bằng
chứng cùa sự chuyến hóa ở dạ dảy ruột bới men CYP3A4 trong thânh ruột. Sử dụng các thuốc
đi kèm mả nó có ức chế hay cảm ứng CYP3A4 có thể ảnh hưởng tới sự chuyến hóa của
taorolimus vả vi vặy lâm tăng hay giảm nồng độ tacrolimus trong mảu.
Theo dõi nồng độ tacrolimus trong mảu đir_ợịẵễPẩyến cáo khi sử dụng oảc thuốc đi kèm có
khả năng thay đối chuyến hóa CYP3A h_ayiả hướnấtới nồng độ tacrolimus trong mảu, vả
để điếu chỉnh iiếu tacrolimus thích hợp để d tri riỗng độ tacrolimus tương đương (xem phần
Liều dùng vả phương phảp sử dụng và phần Lưu ý và thận trọng đặc biệt khi sử dụng)
Những chất ức chế CYP3A4 có khả năng lờm tăng nồng độ tacrolimus Irong máu
Về mặt lâm sảng những chất sau cho thẩy lảm _tãng tacrolimus trong mảu: cảc tương tác mạnh
đã được quan sát thấy với cảc thuốc khảng nấm như ketoconazole, iiuconazoie, itraconazole
vả voriconazolc, khảng sinh maorolide erythxomyoin hay thuốc ức ohế protease HIV ( ví dụ
ritonavir). Sử dụng đi kèm những thuốc nảy có thế cân phải giảm liếu tacrolimus trên hầư hết
cảc bệnh nhân. Nghiên cứu dược động học cho thấy rằng tăng nông độ trong mảu chủ yếu là
kết quả cùa tãng sinh khả dụng oủa taorolimus đường uông dựa vảo sự ức chế chuyến hóa ở
đuờng tiêu hóa. Híệu quả trên thanh thải ở gan thì ít đảng kế hon.
Cảo tương tảo yếu hơn đã được quan sảt thấy ở clotrimazole, clarithromycin, josamycin,
nifedipine, nicardipine, díltiazem, verapamil, danazol, ethinylestradiol, omeprazole vả
nefazodone.
Trong thực nghìệm (in vitro) thi cảc thuốc sau cho thấy oó khả nảng ức chế chưyến hóa đối
với tacrolimus: bromocriptine, cortisone, dapsone, ergotamíne, gestodene, lidocaine,
mephenytoin, miconazole, midazolam, nilvadipine, norethindrone, quinidine, tamoxifen,
(triacetyl) oieandomycin.
Nước bười đã được bảo cảo lảm tảng nồng độ taorolimus trong mảu và vì vậy nên trảnh dùng.
Lansoprazole vả ciolosporin có thế có khả năng ức chế sự chưyến_ hóa qua trung gian
CYP3A4 của tacrolimus vả vì vậy lảm tăng nồng độ tacrolimus trong mảu toản phần.
Những tuơng_ tác khác có thể dẫn ÍỚÍ tăng nồng độ racrolimus trong máu
Tacrolimus gắn kết rất mạnh với protein huyết tương Cảo tương tảo oớ thể xảy ra với cảc hoạt
ohất khảo mã được biết oó ải tính_ oao vởi protein _huyết thanh cần phải được xem xét (ví dụ
như NSAID, kháng đông đường uống, hay cảc thuốc đái thảo đường dạng uống).
N_hững tương tảo tiếm tảng khảo mã có thể tăng nồng độ toản thân cùa tacrolimus bao _gồm
cảc thuốc tãng như động ( Vi dụ metociopramide vả cisapride), cimetidíne vả magnesium—
aluminium-hydroxide.
Các dẫn chất C YP3A4 có khả năng lòm giảm nồng độ tacrolimus Irong máu
Về mặt lâm sảng những thuốc sau đã cho thẩy lảm giảm nồng độ taorolimus trong mảu:
Tương tảo mạnh đã được quan sát thấy ở rifampicin, phenytoin, St J ohn s Wort (Hypericum
perforatum) mả có thế cằn tăng líếu tacrolimus ở hầu hết bệnh nhân. Những tương tảo có ý
nghĩa vê mặt lâm sảng cũng được quan sảt thấy với phenobarbital. Liếu corticosteroid dưy trì
cho thấy lảm giảm nông độ tacrolimus trong mảu.
Prenisolone hay methylprednisolone líếu cao sử dụng để điếu trị thải ghép cấp có khả năng
iảm tăng hay giảm nông độ tacrolimus trong mảu.
Carbamazepin, mctamizoi vả isoniazid oó tìêm năng lảm giảm nông độ tacrolimus.
Tảo đông cùa taorolimus trên oảc thuốc khảo
Tacrolimus lả một ohẳt ức chế CYP3A4; vì vậy việc dùng kèm tacrolimus với cảc thuốc được
biết 1ả được chuyến hóa bới CYP3A4 có thể ảnh hướng đến sự chuyến hớa cùa những thuốc
nảy.
Thời gian bản hùy oùa oiclosporin kéo đải khi sử dụng kèm với tacrolimus. Hơn nữa, tảo dụng
độc thận cộng hưởng/thếm vảo có thể xảy ra. Đối với những lí do nảy, sứ đụng kết hợp
tacrolimus vả ciolosporin không được khuyến oảo vả việc theo dõi sát phải được thực hiện khi
sử dụng tacrolimus cho những bệnh nhân mà có sử đụng cioiosporin trước đó (xem phần Liều
dùng và phương phảp sứ đụng vả phần Lưu ý và thận trọng đặc biệt khi sử dụng).
Tacrolimus cho thấy tăng nông độ của phenytoin trong_ mảu
Tacrolimus oó thế lảm giảm độ thanh thải cùa các thuốc ngừg thai có gốcqsteroỉd đẫn tới lảm
tăng nồng độ hormone, cân phải thận trọng đặc biệt khi quyết định chợn phu phảp ngừa
thai.
Cảo hiếu bìết về tương tảo giữa tacrolimus vả statin thi còn hạn chế. Dữ iiệu lâm sảng gợi ý
rằng dược động học cùa nhóm Statin thì phần lớn không thay đổi khi sử dụng ohung với
tacrolimus.
Dữ liệu trên động vật oho thấy rằng tacrolimus có thế oó lảm giảm thanh thải và lảm tăng thời
gian bản hùy cùa pentobarbital vả antipyrine.
Cảo tương tác khảo dẫn tới cảc hiêu quả bất lơi trên lâm sảng
Việc sử dụng đồng thời taorolimus với cảc ioại thuốc khảo mả được bìết iả có ảnh hướng độc
thặn hay độc thẳn kinh có thế lảm tăng những tảo động nảy (ví dụ như aminoglycoside, chất
ức chế gyrase, vancomycin, cotrimoxazole, NSAID, ganoiciovir hoặc nciclovir).
Tăng độc thặn được quan sảt thắy sau khi dùng amphotericin B và ibuprofen chung với
tacrolimus.
Vì điếu trị tacrolimus có thế _lảm tảng kali mảu, hoặc lảm tảng mức kali mảu cao đã có trước
đớ; vi vặy phải trảnh ăn ưống chắt có nhiếu kali, hay cảc thuốc lợi tìếu giữ kali (ví dụ
amiloride, triamterene, hay spironolactone) (xem phần Lưu ý và thận trợng đặc biệt khi sử
dụng).
Cảo thuốc ức ohế miễn địch có thể ảnh hưởng đến sự đảp ứng đối với ohứng ngừa và việc
chùng ngừa trong s_uốt thời gian điếu trị với tacrolimus có thế kém hiệu quả hơn. Nên trảnh sữ
đụng cảo văc xin sống giảm độc lực (xem phần Lưu ý vả thận trọng đặc biệt khi sử đụng)
Phụ nữ có thai và cho con bú
Sử dụng irong thai kỳ
Dữ liệu trên người oho _thấy rầng tacrolimus quạ được hảng rảo nhau thai Những dữ liệu còn
hạn ohế từ những người nhận tạng ghép cho thấy không oó bằng ohứng của tăng nguy cơ các
tảo dụng ngoại ý trên tiến trình vả kết quả thai kỳ khi được điếu trị với tacrolimus so với cảc
thuốc ức chế miên __dịoh khảo Tuy nhiên, các trường hợp sảy thai tự phảt đã được bảo cáo.
Cho tới hiện nay, vẫn ohưa có cảc đư liệu dịch tễ nảo khảo cớ iiên quan Điếu trị tacrolimus có
thế được xem xét dùng ở những phụ nữ có thai, khi không có điếu trị thay thế nảo khác z_m
toản hơn vả khi lợi ích nhiếu hơn khả năng nguy cơ đối với bảo thai. Trong trường hợp có tiếp
xúc thuốc trong tư oung, khuyến cảo cân theo đõi trẻ mới sinh về cảc tác dụng ngoại ý oớ thế
có cùa tacrolimus (nhất iả tảo động lên thận). Có nguy cơ sinh sớm [< 37 tuần) (tỉ lệ 66 trong
123 trường hợp, tương ứng 53 7%; tuy nhiến, cảc đữ iiệu cho thấy răng nhiếu trẻ sơ sinh có
cân nặng binh thường đối với tuồi thai cùa chủng) cũng như đối với tăng kaii mảu ở trẻ sơ
sinh (tỉ lệ lả 8 trong 111 trẻ, tương ứng vởi 7. 2%) tny nhiên sau đó đã tự trở về mức bình
thường.
Ở ohuột vả thó, tacrolimus đã gãy độc tính phôi thai ở những liếu biến hiện độc tinh ở thủ mẹ
(xem phần dữ liệu an toản tiến lâm sảng).
Dùng lhuốc trong zhời kì cho c_on bú
Cảo dữ liệu trên người oho thấy rằng tacrolimus được bải tiết qua sữa mẹ. Vì không thế loại
trừ cảc tác dụng có hại đối với trẻ sơ sinh, người mẹ đang sử dụng thuốc Advagraf không nên
cho con bú
Khả năng sính sản
Tác động tiến cực của tacrolimus trên khả năng sinh sản ở giống đực do lảm giảm số iượng và
sự di chuyến của tinh trùng đã được quan sát thấy ở chuột (xem phần các Dữ Líệu An Toản
Tiến Lâm Sảng)
Các Tác Động tr_ên Khả Năng Lái Xe vã Sử Di_ing Máy Móc
Tacrolimus có thể gây ra cảc rôi loạn về thị gỉác ivaứhẳn kinh Cảo tảo dụng nảy có thể tăng
hơn nếu sử dụng taorolimus chung với rượu
Không oó nghiên oứu nảo về tác động oùa tacroliimưs ĩAvagraf) trên khả năng lải xe và sử
dụng máy móc đã từng được thực hiện.
Các tác dụng ngoại ỷ
Hồ sơ oác tảo dụng ngoại ý liên quan vởi việc dùng cảc thưốc ức chế miễn dịch thì thường
khó thiết lập do bản chất oùa bệnh nên vả việc dùng kèm nhiếu thuốc khảo
Những tảo dụng ngoại ý do thuốc thường được bảo oảo nhất (xảy ra > 10% bệnh nhân) là run,
sưy thận, cảc t_ình trạng tăng đướng huyết, đảỉ tháo đường, tăng kali máu, nhiễm trùng, tăng
huyết' ap và mất ngù.
Tần sưắt cùa cảc tác dụng ngoại ý được định nghĩa như sau: rất thường gặp (>1/ 10) thường
gặp (>1/100 vả <1/10); ít gặp (> 1/1000 và <1/100); híếm gặp (> 1/10000 vả <1/1000); rât
hiếm gặp ( 98. 8%) với cảc protein huyết tương, chủ yêu là albumín vả
glycoprotein
Tacrolimus được phân bố rộng khắp trong cơ thể. Thể tích phân bố tron
dụa trên nồng độ huyết tương xâp xỉ 1300 1 (ở người khỏe mạnh). Cảo dữ liệu
trên mảu toản phần trung bình là 47, 61.
Chuvến hóa
Tacrolimus được chuyến hóa nhiếu ở gan, chủ yếu bời cytochrome P450-3A4. Tacrolimus
còn được chuyến hóa đảng kế ở trong thảnh ruột. Có nhiếu chắt chuyến hóa đã được xác định
Chỉ có một trong số cảc chất nảy cho thấy có hoạt tính ức chế miên dịch in vilro tương tự
tacrolimus. Những chất chuyến hóa khảo chỉ có hoạt tính ức chế miễn dịch yếu hoặc không
có. Trong hệ thống tuần hoản chỉ có một trong số cảc chất chuyền hóa bất hoạt hiện diện ở
các nống độ thấp. Vì vậy, cảc chất chuyến hóa không góp phần vảo hoạt tính dược lí cùa
tacrolimus.
Thải trừ
Tacrolimus là một chất có độ thanh thải kém. Ở người khóc mạnh, độ thanh thải toản thân
trung binh được ước tính từ cảc nồng độ trong mảu toản phần là 2, 25 l/giờ Ở bệnh nhân
trưởng thảnh ghép gan, thận hay tim, thì có giá trị thanh thải lần lượt được quan sảt lần lượt là
4,1 l/giờ, 6, 7 l/giờ vả 3,91/giờ. Cảo yếu tố như nồng độ haematocrit hay protein thấp, kết quả
là lảm tăng tỉ lệ tacrolimus không găn kết, hay tăng chuyến hóa khởi phảt bởi corticosteroid,
được xem là chịu trảch nhiệm cho tỉ lệ thanh thải cao hơn của thuốc được thấy sau Ighép tạng.
Thời gian bản hùy của tacrolimus kéo dải và thay đổi. Ở người khóe mạnh, thời gian bản hùy
trung binh trong mảu toản phần xấp xỉ 43 giờ.
Sau khi dùng dường tiêm tĩnh mạch và dường uống tacrolimus có đảnh dấu dồng vị 14C, đa
số hoạt tính phóng xạ được thải trừ trong phân. Khoảng 2% hoạt tính phóng xạ thải trừ trong
nước tiến ít hơn 1% tacrolimus ở dạng không đồi được phảt hiện trong nước tiếu và phân, cho
thấy rằng tacrolimus dược chuyển hóa hầu như hoản toản trước khi thải trừ: mật là đường thải
trừ chính.
Dữ Liệu An Toản Tiến Lâm Sảng
Thận vả tụy là những cơ quan chính bị tảc động trong cảc nghìên cứu độc tính được thực hiện
trên chuột và khi đầu chó. Ở chuột, tacrolimus gây tảo động độc tính trên hệ thần kinh và mắt.
Tác động độc tính trên tim có thể hồi phục dược quan sảt thấy ở thò sau khi sử dụng
tacrolimus đường tĩnh mạch.
Độc tính phôi thai dược thấy ở chuột và thô và được gỉới hạn đến các liếu vì có thể gây độc
tính đảng kế trên động vật mang thai. Ớ chuột, chức năng sinh sản ở chuột cải gồm cả khả
nãng sinh đẻ bị rối loạn tại liếu độc vả con sinh ra bị giảm cân, ảnh hưởng tới khả năng phảt
triến và lớn lên.
Tảc dụng có hại của tacrolimus trên khả năng sinh sản cùa chuột đực được thế hiện qua giảm
số lượng và khả năng di chuyến của tinh trùng.
NHỮNG ĐẶC TÍNH RIÊNG CỦA THUỐC
Danh Sách Thảnh Phần Tá Dược
Viên nang chứa
Hypromellose
Ethylceliulose
Lactose monohydrate
Magnesium stearate.
Vỏ viên nang
Titanium dioxide (E 171)
Yellow iron oxide (E 172)
Red iron oxide (E 172)
Sodium laurilsulfate
Gelatin.
Mưc in trên thuốc (Opacode S-1-15083)
Shellac
Leoithin (soya)
Simetioone
Red íron oxide (E 172)
Hydroxypropylcellulose.
Tính Tương Kị , ,
Taogolimus tương kị với PVC (polyvinylohloride). ông, xi lanh và oảc dụng cụ khảo dùng đê
chuân bị huyến dịch cùa viên nang Advagraf không dược chửa PVC.
Thời Hạn Sử Dụng
3 nảm kế từ ngảy sản uất.
1 năm sau khi mở bao`
Thận trọng đặc biệt «: 0 b quỉ
Bảo quản ở nhiệt độ kh 'quả 30°C. Tránh ấm.
Để xa tầm tay trẻ em.
Bản chất và chất chứa bên trong bao bì
Vi nhôm PVC/PVDC trong suốt được gói trong một bao nhôm với chất hủt ẩm chứa 10 viên
nang trong một vi.
Quy cảch đóng gói: Hộp chứa 5 vỉ, mỗi vỉ chứa 10 viên nang cứng phóng thích kéo dải.
Hướng Dẫn Sử\Dụng, Xử trí và Hủy thuốc
Không oó yêu câu đặc biệt.
Thuốc nảy chỉ dùng theo sự kê đơn của thầy thuốc.
Không dùng thuốc vượt quá hạn dùng ghi trên bao bì đóng gói
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Nếu cần thêm thông tin, xin hỏi ý kíến bác sĩ.
Sản xuất bởi: Astellas Ireland Co., Ltd, ỢV
'²²²a
Killorglin, Co. Kerry, Ai- len
PHÓ cục TRUỜNG
JVMn %… sa…
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng