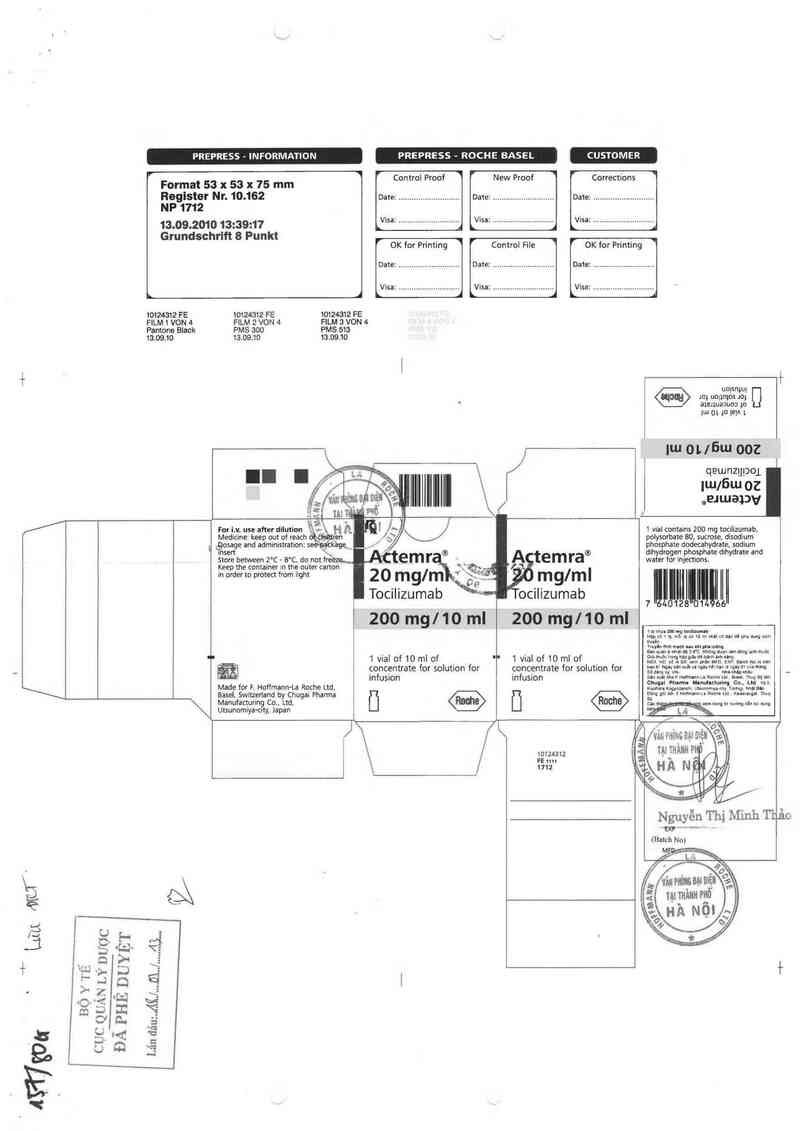

















PREPRESS - INFORMATION PREPRESS - ROCHE BASEL CUSTOMER
Control Proof New Proof Corrections
Format 53 x 53 x 75 mm
Register NI'. 10.162 Date: ............................ Date: ............................ Date: ............................
NP 1712
13.09.2010 13:39:17 Vlsa: ............................ Vlsa: ............................ Visa: ............................
Grundschrlft 8 Punkt
OK for Printing Control File OK for Printing
Date: ............................ Date: ............................ Date: ............................
Visa: ............................ Visa: ............................ Visa: ............................
1012431² FE 1012431² FE 101²4312 FE
FILM 1 VON 4 FILM 2 VON 4 FILM 3 VON 4
Pantone Black PMS 300 PMS 513
13.09.10 13.09.10 13.09.10
II I ,/. .
fì
ầlq
lã …
For i.v. use after dilution ») H A
Medicine: keep out of reach `cẸ_iirtiren
Lgosage and administration: seèaạtk'agq_
msert \\
Store between 2°C ~ 8°C. do not fr- :: -
Keep the container in tne outer carton
in order to protect irom iight
Made for F. Hoffmann-La Roche Ltd,
Basel. Switzerland by Chugai Pharma
Manufacturing Co., Ltd.
@>
uogsniui
Jo; uonngos Jo;
aienuaauoa in
|… 01 ;o |EỊA L
0
l… ow6m ooz
qeumzupol
l…l6w oz
,emzapv
ị mi
Utsunomiya-city, Japan
",
1 Ut.. !
Ể~z \
|
— anu actmtn o.. ..
(ủ) UISunomiya-cigty, )apdĩní '
Nguyễn Thị Minh Thảo
’—
ACTEMRA® Á 511, / w _ ZS
Tocilizumab
1. MÔ TẢ
1.1 Nhóm Điều trị | Dược Lí
Actemra lả kháng thể đơn dòng khảng thụ thể interleuldn—õ (IL-6) ở nguời được nhân hoá tái tổ hợp là thảnh phần của
phân nhóm globulin mỉễn dịch (Ig) IgG,.
ATC code: LO4ACO7
1.2 Dạng Trình Bảy
Chất cô đặc pha dung dịch truyền.
1.3 Đường dùng
Truyển tĩnh mạch.
1.4 Sản phẫm vô trùng] có hoạt tính phóng xạ
Sản phẩm vô trùng.
1.5 Thảnh phần định tính và định lượng
Hoạt Chất: Tocilizumab.
Actemra lả chất lỏng trong đến ưẳng dục, không mảu đến vảng nhại, đóng trong lọ liếu đơn, không chất bảo quản,
không chẩt gây sốt.
Actemxa được cung cấp trong ống 10 ml và 20 ml đung dịch tìêm chứa 4m1, ]0m] hoặc 20m1 Actemra (20mg/ml).
Tá dược: Polysorbate 80, sucrose, disodium phosphate dodecahydrate, sodium dihydxogen phosphate đihydrate vả
nước pha tiêm.
z. ĐẶC TỈNH LÂM SÀNG 3
2.1 Chỉ định điều trị
Actemra, phối hợp với Methotrexate (MTX), được chỉ định cho điều ưi bệnh viêm khớp dạng thấp (RA) tìến
triền từ trung bình đến nặng ở bệnh nhân trường thảnh đảp ứng không đầy đủ hoặc không dung nạp với điều m
ưước đó bằng một hoặc nhiều thuốc chống thẳp khớp điều trị cơ bản bệnh (DMARDs) hoặc chẳt chống yểu tố
hoại từ khối u (TNF). Ở những bệnh nhân nảy, Actemra có thể được dùng đon tti trong trưòng hợp không dung
nạp vói MTX hoặc việc tiểp tục điều trị vói MTX là không phù hợp.
2.2 Liều lượng và cảch dùng
Hướng dẫn chung
Liều khuyến cảo cùa Actemra cho bệnh nhân trường thảnh là 8 mglkg dùng mỗi 4 tuần bằng cảch truyền tĩnh mạch.
Actemra có thể được dùng đơn trị hoặc kết hợp với MTX vả/hoặc DMARDs khác.
Nên pha loãng actcmra trong 100 ml dung dịch NaCl 0,9% vô trùng dùng kỹ thuậx vô khuẳn bởi nhân viên y tế (xem
phần 4.2 Hướng dẫn đặc biệt khi sử dụng, thao tảo, thải bò).
Actemra được khuyến cáo truyền tĩnh mạch trong một giờ trở lên.
2.2.1 Cảc hướng dẫn liều dùng đặc biệt
Tỡ'e' em: Tính an toản vả hỉệu quả cùa Actemra ở trẻ em chưa dược xác lập.
Người gỉâ: (3 những bệnh nhân lởn tuổi không cần chỉnh iièu.
1
Sưy thận: Không cần chỉnh liều ở nhũng bệnh nhân suy thận (xem phần 3.2.3 Dược động học ở dân số đặc biệt).
Suy gan: Tỉnh an toản vả hiệu quả cùa Actemra chưa được nghìên cún ở bệnh nhân suy gan (xem phần 2.3.1 Cảnh bảo
và thận trỌng chung).
2.3 Cảnh bảo vả thận trọng
2.3.1 Cánh bảo và thặn trọng chung
th'ễm trùng
Không nên khời đẳu điều trị Actemra ở nhũng bệnh nhân nhiễm ưùng tiến triển. Nếu bệnh nhân bị nhiễm trùng nặng
nên tạm ngùng truyền Actcmra cho đến khi tinh trạng nhiễm trùng được kìểm soát. Cảc bảc sĩ diều n-ị nên thận trọng
khi cân nhắc sử dụng Actcmra & bệnh nhân có tiền sử nhiễm trùng tái phát hoặc nhũng điều kiện sẵn có (như viêm túi
thừa, đái thảo đường) có thế lảm cho bệnh nhân dễ bị nhiễm trùng.
Khuyến cảo theo dõi chặl để phảt hiện kịp thời nhỉễm trùng nặng ở nhũng bệnh nhân bị RA từ trung bình đển nặng
điểu trí với các thuốc sinh học vì cảc dấu hiệu vả triệu chứng của viêm cẳp có thể được giảm bớt, liên quan đển sự ức
chế của phản ứng giai đoạn cấp. Nên huớng dẫn bệnh nhân lập tức liên hệ với bác sĩ điểu m; khi có bất kỳ dẳu hiệu
năo cho thấy nhiễm trùng xuất hiện để đảm bảo đánh giá nhanh chóng và đìều trị thích hợp.
T iêm chủng
Không nên dùng vắc xin sống và bất hoạt đồng thời với Actemra vi tinh an toản lâm sâng chưa được xảc lập.
Hiện tại chưa có đủ liệu việc truyền nhiễm thứ phảt từ người được tiêm vắc xin sống cho bệnh nhân điều m“ bằng
Actemra.
Phản ứng qua' mẫn
Phản úng quá mẫn nặng đã được báo cáo là có Iỉên quan đến truyền Actamra ở 0,3% bệnh nhân (xem phần 2.6.1 Cảo
tảc dụng ngoại ỷ, Thử nghiệm lâm sảng). Nên có sẵn đỉều trị thích hợp để sử dụng ngay lập tức trong imờng họp có
phản ứng phản vệ ưong quá trình dùng Actemra.
Bệnh gan tiến triển vã suy gan ffl
Điều trị với Actcmra đặc biệt khi dùng đồng thời với MTX, có thể kết hợp với iảng transaminases gan (xem phần
2.6.1.1 Các bẩ1 thường về xét nghìệm). Do đó cần thận trọng khi cân nhắc điều trị cho bệnh nhân 06 bệnh gan tiến
triến hoặc suy gan (xem phần 2.2.1 Cảc hướng dẫn lìều dùng đặc biệt).
2.3.2 Tính lệ thuộc và lạm dụng thuốc
Chưa có nghiên cứu về tác động cùa Actanrura gây lệ thuộc thuốc được tiến hảnh. Tưy nhiên, hiện tại không có bằng
chúng cho thắy điều trị Actemra gây lệ thuộc thuốc.
2.3.3 Khả năng lải xe vả vận hảnh mảy móc
Không có nghiên cứu trình bảy về tác động cùa Actcmra lên khả năng lái xe vả vận hảnh mảy móc. Tuy nhiên, hiện
tại không có bằng chứng điểu ni Actemra ảnh hưởng lên khả năng lái xe và vận hảnh mảy móc.
2.3.4 Xét nghiệm
Giảm bạch cầu đa nhán trung tính
Nên thận nọng khi cân nhắc khởi đầu đìều ni Actemra ở cảc bệnh nhãn có số lượng bạch cầu trung tính thẳp. Giảm số
lượng bạch cầu trung tính dưới 1 x 10°J1 xuất hiện ở 3,4% số bệnh nhân, số lượng bạch cầu trung tính 3xULN ở 2,1 % bệnh nhân điều ln' Actemra 8 mg/kg so với 4,9% bệnh nhân
điều mị MTX, vả 6,5% bệnh nhân điều ưi Actemra 8 mglkg + DMARD so với 1,5% bệnh nhân điều trị giá dược +
DMARD. Bổ sung các thuốc có khả nảng gây độc tinh lên gan (ví dụ MTX) với Actemra đơn trị iảm tăng xuất độ các
bất thường nảy. Tăng ALT/AST › 5 x ULN được ghi nhận ớ 0,7% bệnh nhân điều ưị Actcmra đơn ni vả 1,4% bệnh
nhân điều trị Actemra + DMARD, phần lớn những bệnh nhân nảy ngùng điều mị với Actemxa. Những thay đổi không
kểt hợp với bất kì tình ưạng tăng bilirubin trực tiếp có ý nghĩa lâm sảng, chúng cũng không kết hợp bằng chứng lâm
sảng cùa viêm gan hoặc suy gan.
Tăng các thông số lipid w
Tăng các thông số lipid (cholesterol toân phần, HDL, LDL, triglycerides) được ghi nhận ớ bệnh nhân điều trị với
Actcmra Ở phần lớn bệnh nhân không có tăng các chí số gây xơ vữa động mạch, vả tăng cholesterol toản phẳn đảp
úng điều ni với các thưốc hạ iipid.
2.6 Quá Iìều
Hiện tại có rất it dữ liệu của việc dùng Actemm quá liều. Một trường hợp quá liễu do vô ý được bảo cảo ở một bệnh
nhân bị đa 11 tùy dùng liều đơn 40 mg/kg. Không có tảo dụng ngoại ý nảo cùa thuốc được ghi nhận. Không có tác
dụng ngoại ý nặng nảo của thưốc được ghi nhận ở cảc người tinh nguyện khoẻ mạnh khi nhận liều đơn lên đến 28
mglkg, mặc dù giảm bạch cẩu trung tinh giới hạn liểu dùng được ghi nhận.
3. cÁc ĐẶC ĐIẺM VÀ TÁC DỤNG DƯỢC LÍ
3.1 Đặc điềm dược lực học
Trong cảc thử nghiệm lâm sảng với Actemra, đã ghi nhận có sự giâm nhanh chóng C-reactive protein (CRP), tốc độ
mảu lắng (ESR) vả amyloid A huyết thanh (SAA). Ghi nhận có tăng nồng độ hcmoglobin, qua việc Acternra iảm
gìảm tác động chi phối bởi IL-6 lên sự sản xuất hepcidin đề lâm tăng tạo sắt.
3.1.1 Cơ chế hoạt động
Actemra lả khảng thể đơn đòng nhân hóa tái tổ hợp kháng thụ thể interieukin-õ (IL-6) ở người là thảnh phần của phân
nhóm globulin miễn dịch (Ig) IgGi. Actemra gắn chuyên biệt với cả phần thụ thể gắn kết hòa tan và thụ thể gắn kểt
mâng cùa 1L-6 (siL-6R, mIL-6R), và đã cho thấy ức chế được tỉn hiệu điều hòa bởi sIL-6R vả mIL-6R. IL—6 lả
cytokine đa chức năng, được sản xuất bởi nhiều ioại tế bảo lìên quan đến chức năng cận tiết tại chỗ cũng như sự điều
hòa của cảc tiểu trình bệnh học vả sinh lý học cùa cơ thể như sự kích thích tiết ra giobưlin miễn dịch, hoạt hóa tế bảo
T, kích thích các protein giai đoạn cấp cưa gan vả kich thích tiến ưinh tạo máu. IL-6 có liên quan đến bệnh sinh cùa
các bệnh bao gồm bệnh lý viêm, loãng xương và ung thư.
3.1.2 Cảc nghiên cứu Hìệu quả | Lám sảng
Hiệu quả cùa Actemra lảm giảm bói cảc triệu chửng vả dấu hiệu cùa viêm khớp dạng thấp được đánh giả qua 5 thử
nghiệm ngẫu nhỉên, mù đôi, đa trung tâm. Nghiên cứu I-IV đòi hòi bệnh nhân phải .>. 18 tuổi được chấn đoán là viêm
đa khởp dạng thấp tiến triền dựa vảo tiêu chi cùa Hội Khớp Học Hoa Kỳ (ACR) có it nhẫI s khớp đau và 6 khớp Slmg
so với 1ủc vảo nghiên cứu.
Actemra dùng đc… ư—i ưuyển tinh mạch mỗi 4 tuần (Nghiên cứu 1), kết hợp với MTX (Nghiên cứu 11, 111, V) hoặc với
cảc thưốc chống thảp khóp iảm cải thiện bệnh (DMARD) khác (Nghiên cứu IV).
Nghiên cứu 1 đánh giá 673 bệnh nhân chưa được điểu trị với MTX trong 6 tháng ưước khi được chọn ngẫu nhiên, và
những bệnh nhân ưước đó chưa ngừng điều trị với MTX vì nhũng độc tính quan trọng về mặt lâm sảng hoặc đảp ứng
kém. Phần 1ớn bệnh nhân (67%) chưa điều tư với MTX. Actemra được dùng đơn ưi với liểu 8 mglkg mỗi 4 mần.
Nhóm so sánh lả MTX mỗi tuần (iiềư được chinh từ 7,5 đến liều tối đa hảng tuần là 20 mg ưong chu kỳ 8 tuần). Kết
cục chính lả tỉ lệ bệnh nhân đạt đảp ứng theo tiêu chí ACR20 ớ tuẫn thứ 24.
Nghiên cứu 11, tiến hânh trong 2 năm vả tiếp diễn với phân tich sơ bộ theo kế hoạch ớ tuần thứ 24 đánh giá 1196 bệnh
nhân đáp ủng lâm sảng kém vói MTX. Điểu ưi_ mù đôi với Actemra với liểu 4 mg/kg hoặc 8 mg/kg hoặc giả dược
được dùng mỗi 4 tuần trong 52 tuần, kết hợp với MTX ở liều ổn định (10 mg - 25mg hảng tưằn). Kết cục chinh 1ảti lệ
bệnh nhân đạt đảp ưng theo tiêu chi ACR20 ớ tuần thứ 24.
Nghiên cứu 111 đánh giá 623 bệnh nhân đáp ứng lâm sảng kém với MTX. Actemra với liền 4 mglkg h0ặc 8 mg/kg
hoặc giả dược mỗi 4 mần ưong 52 tuần, ưong kểt hợp với MTX ớ liều ổn định (10 mg - 25 mg hảng tuần).
Nghiên cứu rv đánh giá 1220 bệnh nhân đảp ứng kém với điều trị chống thấp hiện tại cùa họ, bao gồm một hoặc
nhiều DMARD. Actemra với 1iều 8 mglkg được dùng mỗi 4 tuần trong 52 tuần, kết hợp với DMARD ớ 1iểư ổn định.
Nghiên củu v đánh giá 499 bệnh nhân đảp ứng lâm sảng kém hoặc không dung nạp với 1 hoặc nhiều iiệư pháp chống
TNF (Yếu tố hoại tử ư). Thưốc kháng TNF phải được ngùng nước khi chia nhóm ngẫu nhiện. Actemra với liều 4
mglkg hoặc 8 mg/kg hoặc giả dược được dùng mỗi 4 mần trong 52 tuần, ưong kết hợp với MTX ờ liễu ồn định
(10 mg — 25 mg hảng tuần). Kểt cục chính cùa nghiên cứu III, IV là tỉ lệ bệnh nhân đại đáp úng theo tiêu chí ACR20
ở tuần thứ 24.
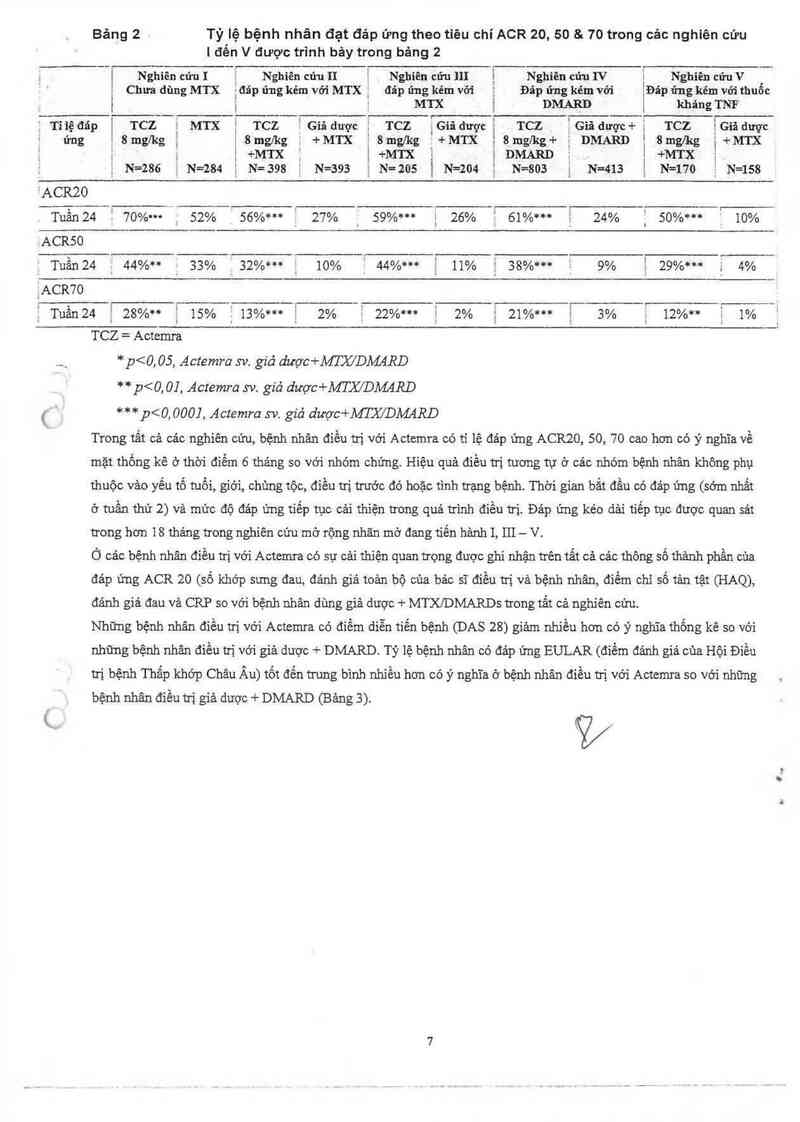
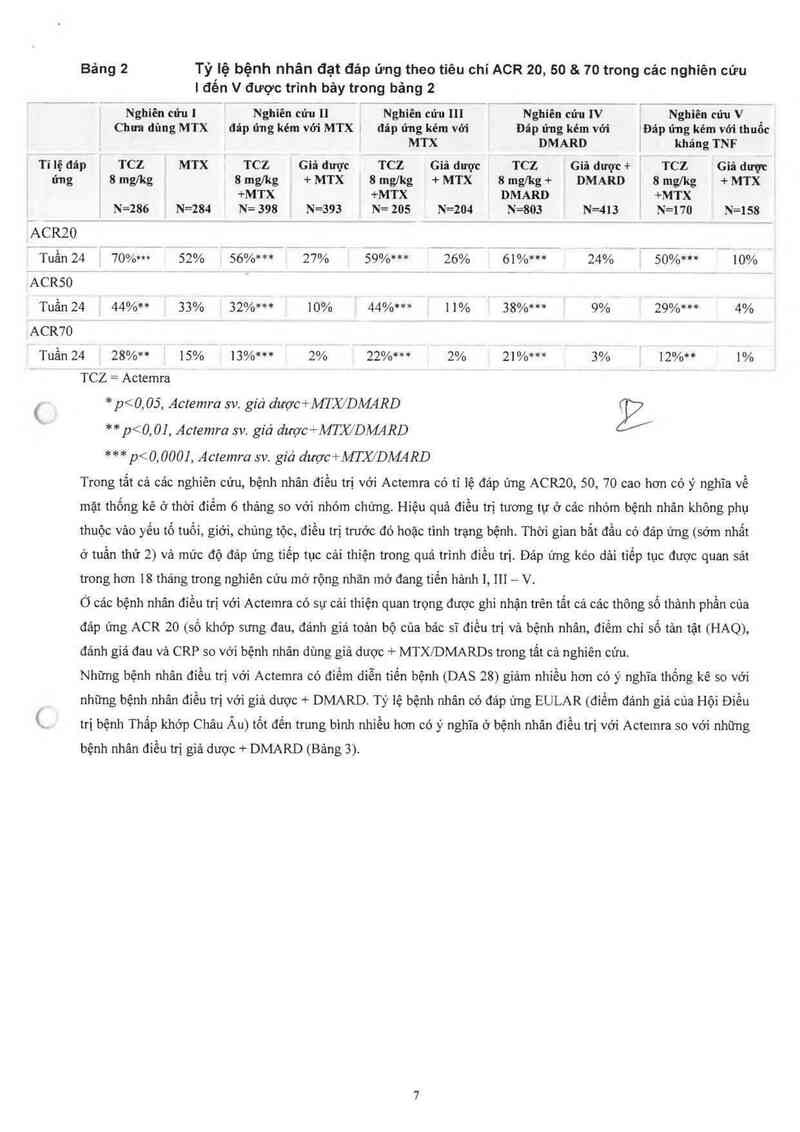
Bảng 2 Tỷ lệ bệnh nhân đạt đảp ứng theo tiêu chí ACR 20, 50 & 70 trong các nghiên cứu
| đến V được trình bảy trong bảng 2
Ỉ
[ Nghiên củ-uI ị Nghiên cửu n Nghiên cứu]lI ị Nghiên cứuIV | Nghiên cứưV
i Chim dùng MTX iđ`áp ửng kém vởi MTXị đảp ứng kém vỡi ; Đảp ứng kém với iĐãp ửng kém với thuốc
] i ị MTX ị DMARD 1 khảngTNF
' T1 iệ đáp 1 TCZ . MTX ị TCZ ỀGiâ dược E TCZ ỈGiđ đượcị rcz ịGiâ dược+ặ TCZ ỄGiă dược
~ ứng ,8mglkg`, Ể8mglkg a +er Ể8mg/kg Y+MTX ;8mglkg+ ỉ DMARÉD i 8mg/vkg ị+MTX
ị , i+MTx; [+er 1DMARDE |+MTX ị
N=286 N=284 N=398 N=393 ; N=205 ị N=204 ị N=803 i N=413 Ị N=170 Ẹ N=158
²ACRZO
Tuần24 '70%… 52% 56%… ị 27% ; 59%… 1 26% ' 61%… 24% 1 50%… Ẩ 10%
ACRSO
Tuần24 _44%** 33% 32%… - 10% Ặ44%… { 11% j 38%… 1; 9% 1 29%… -. 4%
vACR7O
ịTuần24 Ịzs%n ; 15% j13%… 2% Ẹ 22%… ị 2% ; 21%… 1 3% 12%… 1%
TCZ=Actemra
., * _p<0, 05, Actemra sv. giả dược+MTX/DMRD
** p<0,01. Actemra sv. giả dược+MTJC/DMđffl
( *** p<0, 000], Actemra sv. giả dược+MTX/DMARD
Trong tât cả cảc nghỉên cứu, bệnh nhân điêu ưị vói Actcmra có ti lệ đảp ứng ACR20, 50, 70 cao hơn có ý nghĩa về
mặt thống kê ở thời điếm 6 tháng so với nhóm chứng. Hiệu quả điểu ưi tương tư ở các nhóm bệnh nhân không phụ
thước vảo yếu tố tưới, giởi, chùng tộc, điều ưi trước đó hoặc tinh ưạng bệnh. Thời gian bẳl đầu có đáp ứng (sớm nhất
ở tuần thứ 2) và mức độ đảp ủng tiếp tục cải thiện trong quá trình điều ưi. Đảp ứng kéo dải tiếp tục được quan sát
trong hon 18 thảng trong nghiên cứu mở rộng nhăn mở đang tiển hảnh 1, 111 — V.
Ó cảc bệnh nhân điều trị với Actemra có sự cải thiện quan trọng được ghi nhận trên tất cả cảc thông số thảnh phần của
đảp ứng ACR zo (số khớp sưng đau, đảnh giả toản bộ của bác sĩ điều ni và bệnh nhân, điểm chi số tản tệt (HAQ),
đảnh giá đau và CRP so với bệnh nhân dùng giả dược + MTXIDMARDS trong 1211 cả nghiên cửu.
Những bệnh nhân điều ưi với Actenưa có điềm diễn tiến bệnh (DAS 28) giảm nhiều hon có ý nghỉa thống kê so với
những bệnh nhân điều trị với giả được + DMARD. Tỷ lệ bệnh nhân có đảp ứng EULAR (điểm đảnh giá cùa Hội Điểu
trị bệnh Thấp khớp Châu Âu) tốt đển trung bình nhiễu hon có ý nghĩa ớ bệnh nhân điều trị với Actemra so với những
bệnh nhân điều ưi giả được + DMARD (Bảng 3).
&. w
l
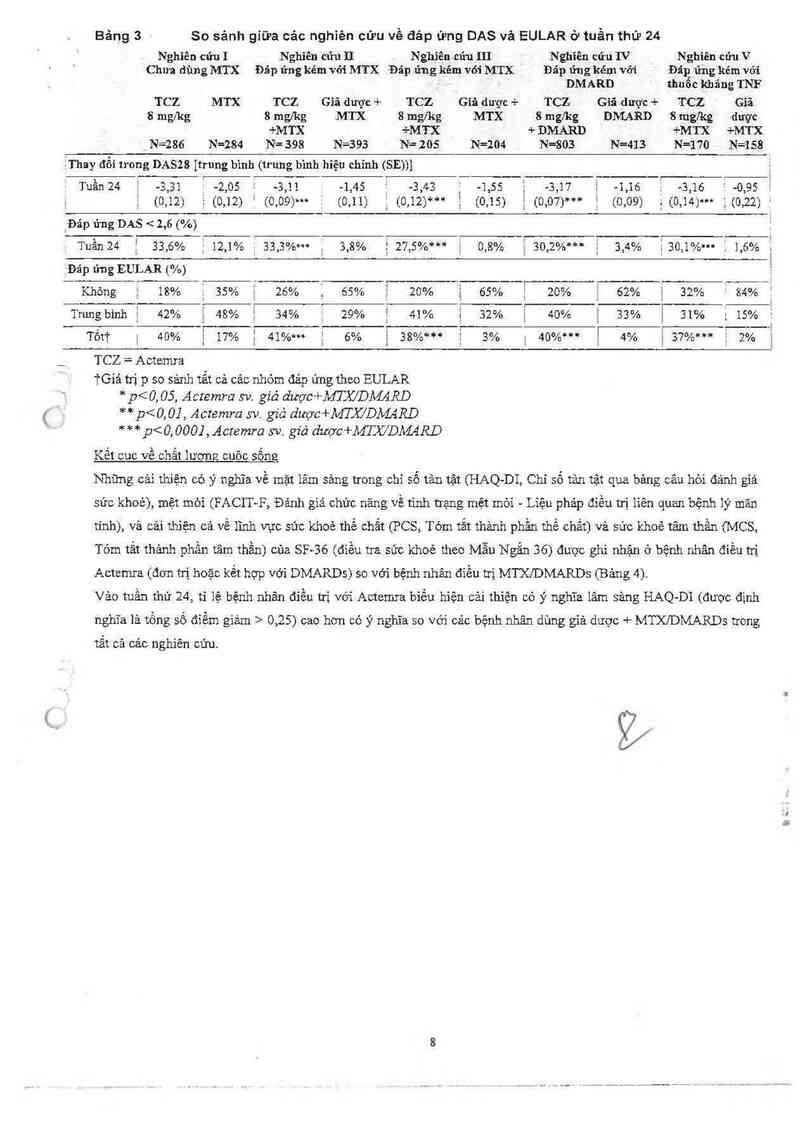
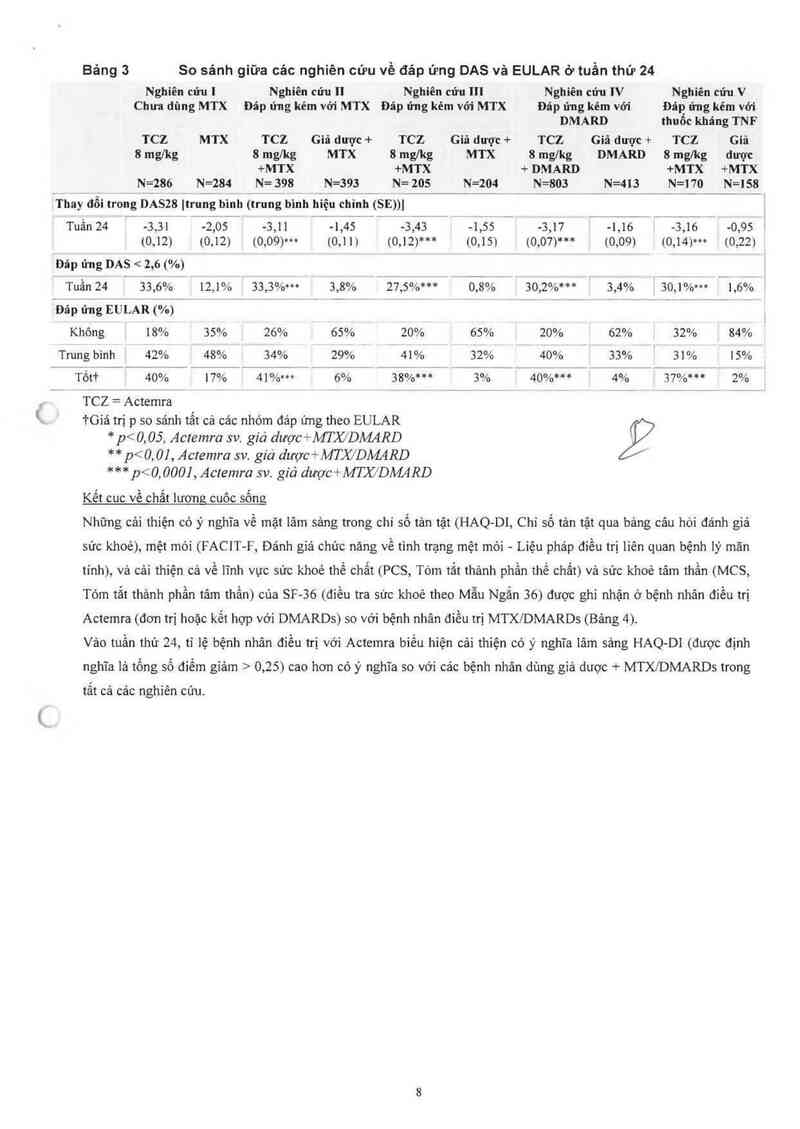
Bảng 3 So sánh giữa cảc nghiên cứu về đảp ứng DAS vả EULAR ở tuần thứ 24
Nghìên cứu 1 N ghiền cũu II Nghiên cửu III Nghĩên cứu IV N ghiền cứu V
Chưa dùng MTX Đảp ứng kém vởi .'MTX Đáp ứng kém vói MTX Đãp ứng kém vởi Đãn ửng kém với
DMARD thuôc k-hãng TNF
TCZ MTX TCZ Giã được + TCZ Giã dược -F TCZ G-ìâ dược + TCZ Gỉã
8 mg/kg 8 mg/kg MTX 8 mgỉkg MTX 8 mg/kg Dh'4ARD 8 mgíkg được
+MTX +M TX + DMARD +M TX +MTX
N=286 N=284 N= 398 N=393 N= 205 N=204 N=803 N=413 N=170 N=158
ẳThay đổi trong DASZB Itrung binh (trưng bình hiệu chinh (SE))I ,
. . l
Tưần 24 -3,31 . -2,05 -3,11 -1,45 , -3,43 -1,55 , -3,17 1 -1,16 . -3,16 ~ 0,95
, : (0112) Ể (0112) (0109)… (0,11) ; (0.12ì'i'“ Ế (0315) i (0107)“* Ế (0309) 1; (03141'" } (Ủi22) '
`Đảp ứng DAS < 2,6 (%) 1
Tuần 24 ' 33,6% 12,1% ị 33,3%… 3,8% : 27,5%*** 0,8% 1 30,2%… ậ 3,4% 3 30,1%… 1 1,6% Í
. ` ' 1
~Đáp ứng EULAR (%) 1
Không 18% 35% J 26% 65% 20% 65% ! 20% i 62% 1 32% ; 84%
Trung bình 42% 1 48% ! 34% 29% f 41% Ế 32% | 40% E 33% i 31% 15%
Tốt'ì' | 411% ị 17% ; 41%… ị 6% 38%*** J 3% 1 40%… Ị 4% ; 37%… 2%
TCZ = Actcmra
iGiá tnị p so sảnh tất cả cảc nhóm đảp úng theo EULAR
* p< 0, 05, Acremra sv. giả dược+MTX/DÀMRD
** p<0, 0] , Actemra sv. giả dược+fflJỬDM4RD
*** p< 0. 000] , Acremra sv. giả dược+MTX/DAMRD
Kết cuc về chất lương cưôc sốne
Nhũng cải thiện cớ ý nghĩa về mặt lâm sảng trong chỉ số tản tệt (HAQ-DI, Chỉ số tản tật qua bâng câu hòi đánh giá
sức khoẻ), mệt mòi (FACIT—F, Đánh giá chức năng Về tinh trạng mệt mòi — Liệu phảp điều trị liên quan bệnh lý mãn
tính), vả cải thiện cả về 1ĩnh vực sức khoẻ thể chất (PCS, Tóm tắt thảnh phần thể chất) và sức khoẻ tâm thần (MCS,
Tóm tắt thảnh phần tâm thần) cùa SF—36 (điều tra sức khoẻ theo Mẫu Ngắn 36) được ghi nhận ở bệnh nhân điều trị
Actemra (đon h~ị hoặc kết hợp với DMARDs) so với bệnh nhân đìều ưi MTX/DMARDS (Bảng 4).
Vảo tuần thư 24, ti iệ bệnh nhân điều ưi_ với Actcnưa biểu hiện cải thiện có ý nghĩa lâm sâng HAQ—DI (được định
nghĩa là tồng số đỉểm giảm > 0,25) cao hơn có ý nghĩa so với cảc bệnh nhân dùng giả dược + MTXI'DMARDS trong
tắt cả các nghiên cứu.
ffl'
`
Bảng 4 So sánh đảp ứng của SF—36, HAQ vả FACiT—F ở tuần 24
Nghiên cửu I Nghìên cửu II Nghiên cửu III Nghiên cửu IV Nghiên cứu V '
Chưa đùng MTX Đáp ửng kém với MTX Đảp ửng kém với MTX Đâp ửng kém với DMARD Đảp ứng kém với thuôc
kháng TNF
ị TCZ i er ' TCZ ẶGiớ được+J, TCZ ịGiớ được [ TCZ ; Giã dược Ẹ TCZ ìGiđ đuợc ,
8mglkg j 8mglkg 4 MTX . Smg/kg Ễ+MTX _ 8mg/kg ' +DMARD ; 8mg/kg l+MTX .
' ; ² +MTX . +MTX ỉ ; + DMARD T 1 +MTX 1
N=286 ; N=284 . N=398 , N=393 N=205 . N=204 ; N= 803 { N=413 ; N=170 . N=158
Thay đổi PCS [trung bình (trung bình hiệu chỉnh (SE))]
10,2 8,4 ị 8,1 5,6 9,5 ' 5,0 8,9 1 4,1 8,0 _ 2,2
(0.7) ` (0.7) ỉ (0.6)“ z (0.7) (0.8)*** ; (1.0) 1 (0.4)… ' (0.6) 'ỵ (0.91“ (1.3)
=Thay đỗi MCS [trung bình (trung bình hiệu chỉnh (SE))]
1 6,7 . 5,0 ² 4,2 ; 2,8 , 7,3 = 2,7 ~ 5,3 , 2,3 ; 4,1 1 4,1
’ (0.9) (0.9) , (0.8) 1 (0.9) i (1.1)** , (1.3) ! (0.6)** ; (0i7) (113) ì (1.9)
_Thay đỗi HAQ-DI [trung bình (trung bình hiệu chĩnh (SE))]
ẽ-0,70 (0,05) ệ-0,52 ,-0,5 -0,3 g-0,55 ²-0,34 f-0,47 ị - …0,2 ; -0,39 1 0,05
ị i(o,os) 1(0,04)M _j(0,04) j(0,06)** ,(0,07) ;(0,03)… . (0,03) ; (0,05)*** [ (0,07)
,'Thay đỗi FACIT-F [trung bình (trung bình hiệu chinh (SE))]
’ 1 9,3 11 7,0 1 6,4 1 5,4 ? 8,6 ẳ 4,0 ỉ 8,0 | 3,6 1 8,8 1 4,2
' (0.8) ' (018) ị (017) ỉ (0.8) ì (0,9)W' Ệ (1.0) % (0.5)*** 1 (0.7) 1 (110)* (1.6)
TCZ = Actemra
*
p<0, 05, Actemra so với giả dược + MTX/DMARD
** p<0,01, Actemra so với giả dược + MTX/DMARD
***p<0,0001, Actemra so với giả dược + MTX/DAMRD
Về xét nelziêm
Điều ưi Actemra kềt hợp với DMARD/MTX hoặc đơn trị đem lại cải thiện rẩt có ý nghĩa về mặt thống kê về nổng độ
hcmoglobin so với giả dược + DMARD/MTX (p< 0,0001) ở tuần thứ 24. Sự cải thiện lớn nhất được ghi nhận ở bệnh
nhân thiểu mảu mãn tính do viêm ichớp dạng thấp; nổng độ trưng bình của hemogiobin tăng từ tuần thứ 2 và duy trì 0
mức binh thường ưong suốt tuần 24. Sự giảm đáng kể nồng độ trung binh của những chất phản ửng giai đoạn cẩp,
CR.P, ESR, vả amyloid A hưyết thanh (SAA) xuất hiện một cảch nhanh chóng sau khi truyền Actemra. Vả điều nảy
phù hợp với tảc động cùa thuốc lên các chất phản ứng giai đoạn cấp, điều trị với Actcmra có liên quan đến giảm số
lượng tiếu cầu trong giới hạn binh thường.
3.2 Đặc tính dược động học `Ễ 7/
Dược động học cùa Actemra được xảo định bằng phân tich dược động học dân số trên bộ dữ liệu bao gồm 1793 bệnh
nhân viêm khớp dạng thấp điều trị với 4 mg/kg và 8 mglkg trưyền tinh mạch tnột giờ mỗi 4 mần trong 24 tuần
Các thông số dược động học cùa Actemra không thay đổi theo thời gian. Khi dùng liều 4 mg/kg và 8 mg/kg mỗi 4
tuần, diện tích dưới đưong cong (AUC) và nồng độ đảy (C…) tăng nhiều hơn mức tỳ iệ với liều. Nồng độ tối đa
(C,…) tăng theo tỉ iệ theo liều. ó trạng thái ồn định, AUC vả cmin lần iượt tăng cao hợn 2,7 và 6,5 lần 6 lỉều 8 mg/kg
so với 1iểu 4 mg/kg.
Các thông số sau có giá trị với liền 8 mg/kg Actemra mỗi 4 tuần. Giá trị ưung bình dự kiến ở trạng thái ổn định của
AUC, cm,, và cmax cùa Actemra 1ần iưọt 13 35000 3 15500 h~nglmi, 9,74 3: 10,5 ung1, vả 183 : 85,6 ng/mi. Tỉ số
tich lũy của AUC vả cm,, có giá trị thấp; lần 1ượt là 1,22 và 1,06. Tỉ số tích lũy với c,… (2,35) cao hơn, điểu nây dự
kiến được vai ướ cùa sự thanh thải không tuyển tính 6 nỗng độ thấp. Trạng thải ổn định cho c…, AUC, vả cmin đạt
được lần 1ượt sau khi truyền liều đầu tiên sau 8 tuần và 20 mần.
3.2.1 Phân bố
Sau khi truyền tinh mạch, Actemra qua thải trừ 2 pha từ vòng tuần hoản. ở bệnh nhân vỉêm khởp dạng thấp thế tich
phân bố trung tâm iả 3,5 L, thể tích phân bố ngoại biên lả 2,9 L, dẫn đển thề tich phân bố 6 trạng thái ổn định 181 6,4 1…
3.2.2 Đảo thải
Độ thanh thải hoản toả.n cùa Actenưa phụ thuộc vảo nổng độ và lá tổng cùa độ thanh thải myến tính vả không tưyến
tính. Độ thanh thải tuyến tỉnh được ướct1'nhlả thông số trong phân tích dược động học dân số nghiên cứu và 1ả 12,5
mllgiờ. Độ thanh thâi không tuyến tinh phụ thuộc nồng độ đóng vai trò chủ yểu khi nồng độ Actemra thấp. Một khi
đướng thanh thải tuyến tinh hi bão hòa, ở nồng độ Acteưưa cao hơn, thanh thải được quyết định chủ yểu bới thanh
thải tuyến tinh.
Thời gian bán thải cùa Actemra phụ thuộc nồng độ. Ở trạng thái ổn định sau khi truyền liều 8 mg/kg mỗi 4 tuần, thời
gian bán thải hiệu quả giảm khi giảm nổng độ giảm trong quảng liểu từ 14 — 8 ngây.
3.2.3 Dược động học ở dân số đặc biệt
Suy gan
Chưa có nghiên cứu chính thức nâo được tiểu hảnh ảnh hưởng cùa suy gan iên dược động học cùa Actemra.
Suy thận
Chưa có nghiên cứu chính thức nảo được tiến hảnh ảnh hưởng cùa suy thận lên được động học của Actomra. Hầu hết
các bệnh nhân trong phân tích dược động học đâu số có chức năng thận bình thường hoặc sưy thận nhẹ. Suy thận nhẹ
(thanh thải creatininc tính theo Cockcroft-Gault < 80 mllphút và 2 50 mllphút) không ảnh hưởng dược động học cùa
Acternra
Các đối tượng đặc biệt khác
Các phân tích dân số đảnh giá khả nảng ảnh hướng của đặc tính dân số lên dược động học cùa Actcmra ở bệnh nhân
viêm khớp dạng thẳp ưuớng thảnh. Kết quả của cảc phân tich nảy cho thẳy không cần thay đối iiễu theo tuồi, giới,
hoặc chùng tộc.
3.3 An toản tỉền lâm sảng
3.3.1 Khả năng sinh ung thư ạ
Nghiên cứu về khả nãng sinh ung cùa Actamra chưa được tiển hảnh Dữ liệu tỉển iâm sảng hiện tại cho thấy sự góp
phần cùa cytokine [L—6 đa tảc dụng vảo sự tiển tn'ển ảc tinh vả đề kháng với chết tế bâo theo lập trình của nhiều ioại
ung thư. Nhũng dữ liệu nảy không gọi ý có nguy cơ lìên quan với khới phảt tiến triển ung thư sau khi điều trị với
Actemxa. Phù hợp với điềm vừa nêu cảc tổn thương tãng sinh chưa được ghi nhận trong một nghiên cứu độc tinh kéo
dải 6 tháng ở khi đầu chó cũng như không thẳy mô tả ưong chuột bất hoạt 1L-6 ưong điều kiện iảm giảm 11.-6 mãn
tinh.
3.3.2 Khả năng đột bỉến gen
Nghiện cứu về độc tính di truyền chuẩn với Actemra ưền cảc tế bảo cùa sinh vật có nhân và không nhân điền hình đều
cho kết quả âm tinh.
3.3.3 Giảm khả nảng sinh sản
Các nghiên cứu về khả năng sinh sản cùa động vật ở cảc ioải liên quan chưa được tiến hảnh. Tuy nhiên, dữ liệu tiền
lâm sảng hiện có không gợi ý cho thấy có ảnh hưởng khả năng sinh sản khi điều trị với Actemra. Ành hưởng ưền co
quan hoạt động nội tiểt hoặc cảc cơ quan cùa hệ sính sản đã không được ghi nhận trong một nghiên cứu độc tính kéo
dải của khi đầu chớ, cũng không thấy ảnh hưởng ưền khả năng sinh sân cùa chuột thiểu 1L-6.
10
. 3.3.4 Khả năng sinh dị dạng thai
Khi truyền Actemra tĩnh mạch vảo ]oải khi đầu chó trong giai đoạn sớm thai kỳ, không ghi nhận có ảnh hướng có hại
trực tìếp, hoặc giản tiếp lên thai kỳ hoặc sự phát triến của phôi thai.
3.3.5 Đặc tỉnh khác về an toản
Một nghỉên cứu độc tinh trên phôi thai tỉến hảnh trên khi đầu chó ghi nhận có tăng nhẹ tinh trạng chết phôi thai/sảy
thai với nồng độ tiếp xúc toản thân cao (>100 lần nồng độ tiếp xúc ở người) ở nhóm liều cao 50 mg/kg/ngảy so với
giả được vả cảc nhóm iiều thấp khác. Mặc dù IL-6 dường như không lả cytokine chinh cho cả sự phảt triền thai hoặc
kiềm soát miễn dịch cùa mẹ/bảo thai, mối liên hệ của bầng chứng trên với Actcmra không thể loại trừ.
4. ĐẶC ĐIỂM DƯỢC PHẨM
4.1 Bảo quản
Hạn dùng: 30 tháng kể từ ngảy sản xuất
Không nên dùng thuốc sau ngảy hết hạn (EXP) ghi trên hộp thuốc.
Với ống tỉêm: giữ 6 2 - soc, không giữ đông. Giữ lọ thuốc nguyên trong hộp để trảnh ảnh sáng.
Dung dịch truyền Actemra sau khi pha ổn đinh về mặt vật lý vả hóa học trong dung dịch muối sinh lý 0,9% ở 30°C
trong 24 giờ.
Về phương diện vi sỉnh học, dung dịch truyền sau khi pha nên được dùng ngay lập tức. Nếu không dùng ngay, thời
gian bảo quản và cảc điều kiện trước khi dùng phải được người sử dụng đặc biệt quan tâm và không quá 24 giờ ở 2 -
8°C, trừ khi thao tảc pha thuốc được tiến hảnh ở những đỉều kiện vô trùng được công nhận và kiểm soát.
4.2 Hưởng dẫn đặc biệt cho sử dụng, thao tác, hủy bỏ
Rủi iượng thuốc Actemra cẩn thiết (0,4 mllkg) dưới điều kiện vô trùng và pha nồng độ Actemra đã tính trong ]00 ml
túi dịch truyền chứa dung dịch nước muối sinh iý 0,9% vô trùng không chất gây sốt. Đế trộn dung dịch, nhẹ nhảng
đảo ngược túi dung dịch đã pha để trảnh tạo bọt. Chỉ nên truyền các dung dịch trong không mảu hoặc vảng nhạt
không chứa cận.
4.3 Đóng gói Số ống thuốc
Óng 80 mg/4ml ] ỄZ
Óng 200 mg/lOml 1
Óng 400 mgl20ml 1
Thuốc: đề xa tầm tay cùa trẻ em
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin, xin hói ý kiến bác sĩ
Chỉ sử dụng thuốc nảy khi được bảo sĩ kê đơn.
Lưu hảnh tháng 1 1 năm 2007
Sản xuất tại Chugai Pharma Manufacturing Co., Ltd. Thãnh phố Utsunomiya, Nhật bản.
16-3, Kiyohara Kogyodanchi, Utsunomỉya-city, Tochigi, Jaan
vit: 140110 141 01Ệ1
141 11141111 PHỐ
` guyễn Thị Mình "ỦìảQ
il
ACTEMRA®
Tocilizumab
1. MÔ TẢ
. ứ /4/`V
1.1 Nhỏm Điêu trị ! Dược Lí \“`~———_—/f
Actemra lả kháng thể đơn dòng kháng thụ thể interleukin—ó (lL-6) ở người được nhân hoá tái tổ hợp là thảnh phần cùa
phân nhóm globulin miễn dịch (Ig) IgGl.
ATC code: LO4ACO7
1.2 Dạng Trình Bảy
Chất cô đặc pha dung dịch truyền.
1.3 Đường dùng
Truyến tĩnh mạch. 2
1.4 Sản phẩm vô trùng] có hoạt tính phóng xạ
Sản phẩm vô trùng.
1.5 Thảnh phần định tính và định lượng
Hoạt C hẩt: Tocilizumab.
Actemra lả chẩt lóng trong đển trắng đục, không mảu đến vảng nhạt, đóng trong iọ liều đơn, không chẩt bảo quản,
không chất gảy sốt.
Actemra được cung cấp trong ống 10 ml vả 20 ml dung dịch tiêm chứa 4ml, 10m1 hoặc 20111] Actemra (20mg/ml).
Tá dược: Poiysorbate 80, sucrose, disodium phosphate dodecahydrate, sodium dihydrogen ph05phate dihydrate vả
nước pha tiêm.
2. ĐẶC TỈNH LÂM SÀNG
2.1 Chỉ định điều trị
Actemra, phối hợp với Methotrexate (MTX), được chỉ định cho điều trị bệnh viêm khớp dạng thắp (RA) tiến
triền từ trung bình đến nặng ở bệnh nhân trướng thảnh đáp ứng không đầy đủ hoặc không dung nạp với điều trị
trước đó bằng một hoặc nhiều thuốc chống thắp khớp điều trị cơ bán bệnh (DMARDs) hoặc chắt chống yếu tố
hoại từ khối u (TNF). Ở những bệnh nhân nảy, Actemra có thể được dùng đon trị trong trường họp không dung
nạp với MTX hoặc việc tiếp tục điều trị với MTX 18 không phù họp.
2.2 Liều lượng và cách dùng
Hướng dẫn chung
Liều khuyến cáo cùa Actemra cho bệnh nhân trướng thảnh iả 8 mg/kg dùng mỗi 4 tuần bằng cảch truyền tĩnh mạch.
Actemra có thế được dùng đơn trị hoặc kết hợp với MTX vả/hoặc DMARDs khảo.
Nên pha loãng actemra trong 100 mi dung dịch NaCl 0,9% vô trùng dùng kỹ thuật vô khuẩn bời nhân viên y tế (xem
phần 4.2 Hướng dẫn đặc biệt khi sử dụng, thao tác, thải bò).
Actemra được khuyến cáo truyền tĩnh mạch trong một giờ trở lên.
2.2.1 Các hưởng dẫn liều dùng đặc biệt
T re' em: Tinh an toản và hiệu quả của Actemra ở trẻ em chưa được xác iập.
Người giả: Ở những bệnh nhân lớn tuối không cần chinh liều.
]
Í`.Jir
Suy rhận: Không cần chinh iiều ớ nhũng bệnh nhân suy thận (xem phần 3.2.3 Dược động học ở dân số đậc biệt).
Suy gan: Tính an toản và hiệu quả của Actemra chưa được nghiên cứu ở bệnh nhân suy gan (xem phần 2.3.1 Cảnh bảo
vả thận trọng chung).
2.3 Cảnh báo vả thận trọng
2.3.1 Cảnh báo vả thặn trọng chung
Nhiễm Irùng
Không nên khởi đầu điều trị Actemra ớ những bệnh nhân nhiễm trùng tiến triền. Nếu bệnh nhân bị nhiễm trùng nặng
nên tạm ngừng truyền Actemra cho đến khi tình trạng nhiễm trùng được kiểm soát. Các bác sĩ điều trị nên thận trọng
khi cân nhắc sư dụng Actemra ở bệnh nhân có tiền sử nhiễm trùng tái phải hoặc những diều kiện sẵn có (như viêm tủi
thừa, đải tháo đường) có thế lảm cho bệnh nhân dễ bị nhiễm trùng.
Khuyến cáo theo dõi chặt để phát hiện kịp thời nhiễm trùng nặng ở những bệnh nhân bị RA từ trung binh đến nặng
điều trị với cảc thuốc sinh học vi các dấu hiệu vả triệu chứng cùa viêm cắp có thể được giảm bởt, liên quan đến sự ức
chế của phản ứng giai đoạn cẳp. Nên hướng dẫn bệnh nhân lập tức liên hệ với bác sĩ điểu trị khi có bẩt kỳ dẳu hiệu
nảo cho thấy nhiễm trùng xuất hiện để dảm bảo đánh giá nhanh chỏng vả điều trị thích hợp.
Tiêm chủng
Không nên dùng vắc xin sống và bất hoạt đồng thời với Actemra vi tính an toản lâm sảng chưa được xác lập.
Hiện tại chưa có dữ liệu vỉệc truyền nhỉễm thứ phát từ người được tiêm vắc xin sống cho bệnh nhân điểu trị bằng
Actemra.
Phản ứng qua' mẫn Z
Phản ứng quá mẫn nậng đă được bảo các lá có iiên quan đến truyền Actemra ở 0,3% bệnh nhân (xem phần 2.6.1 Các
tác dụng ngoại ý, Thử nghiệm iâm sảng). Nên có sẵn điều trị thỉch hợp để sử dụng ngay iặp tức trong trường hợp có
phản ứng phản vệ trong quả trinh dùng Actemra.
Bệnh gan tiến n-iến vả suy gan
Điều trị với Actemra đặc biệt khi dùng đồng thời với MTX, có thể kết hợp với tăng transaminases gan (xem phần
2.611 Các bất thường về xét nghiệm). Do đó cần thận trọng khi cân nhắc đỉều trị cho bệnh nhân có bệnh gan tiến
triền hoặc suy gan (xem phần 2.2.1 Cảo hướng dẫn liều dùng đặc biệt).
2.3.2 Tính lệ thuộc vả lạm dụng thuốc
Chưa có nghiên cứu về tảc động cùa Actemra gây lệ thuộc thuốc được tiến hảnh. Tuy nhiên, hiện tại không có bằng
chứng cho thắy điều trị Actemra gây lệ thuộc thuốc.
2.3.3 Khả năng lái xe vả vặn hảnh máy móc
Không có nghiên cứu trình bảy về tảc dộng của Actemra lên khả năng iái xe và vận hảnh máy móc. Tuy nhỉên, hiện
tại không có bằng chứng điều trị Actemra ảnh hướng lên khả năng iải xe vả vận hảnh máy móc.
2.3.4 Xét nghiệm
Giảm bạch cấu đa nhân rrung tính
Nên thận trọng khi cân nhắc khới dầu điều trị Actemra ờ cảc bệnh nhân có số iượng bạch cầu trung tinh thẳp. Giảm số
lượng bạch cầu trung tính dưới 1 x 109/1 xuất hiện ở 3,4% số bệnh nhân, số iượng bạch cầu trung tinh <0,5x109/1 xuất
hiện ở 0,3% số bệnh nhân dùng Actemra 8 mg/kg + DMARD mã không có liên quan rõ rảng vởi nhiễm trùng nậng
(xem phần 2.6.1 .1 Cảc bắt thường về xét nghiệm). Không khuyến cáo diều trị ở những bệnh nhân có số lượng bạch
cầu trung tính tuyệt đối < 0.5 x 109/1.
2.3.5 Tương tác vởi cảc thuốc nội khoa khác và các dạng tương tác khác
Phân tích được động học cho thắy rằng sử dụng đổng thời thuốc nội khoa cho viêm khớp dạng thấp không ảnh hướng
lên dược động học của Actemra, như metrotrcxate, chloroquine vả cảc dẫn xuất, chẳt ức chế miễn dịch (azathioprine,
lef1unomide), corticosteroids (prednisonc vả cảc dẫn xuất), acid folic vả dẫn xuất, cảc thuốc kháng viêm non-steroid
(diclofenac, ibuprofen, naproxen, meloxicam, ức chế COX-2 (celccoxib), cảc thuốc giảm dau (paracetamol, codein vả
cảc dẫn xuất, tramadoi).
Actemra chưa được nghiên cứu trong điểu trị kết hợp với cảc DMARDs sinh học khảc.
Sự hinh thảnh của cảc men CYP4SO bị ức chế bởi các cytokine kich hoạt các quá trình viêm mản. Vi vặy có thể dự
kiến iả đối với bất kỳ thuốc nảo vởi khả năng tảc động chống viêm mạnh như Actemra, sự hình thảnh cảc men
CYP4SO có thể được bình thường hóa. Đây lả tương quan về lâm sảng cho cảc hợp chắt CYP4SO với 1 hướng dẫn
điều trị hẹp, mà 0 đó liều được chinh theo tùng bệnh nhân. Khi khởi đầu với Actemra 6 bệnh nhân đang được điều trị
với những loại thuốc nội khoa nảy, nên tiến hảnh theo dõi tác động lên điều trị (như warfarin) hoặc nổng độ thuốc
(như cyclosporine) vả đìều chỉnh liều cùa thuốc nội khoa trên từng bệnh nhãn khi cần.
2.4 Sử dụng ở dân số đặc biệt Z
2.4.1 Thai kỳ
Không có dữ liệu đầy đủ về việc dùng Actemra ở phụ nữ mang thai. Một nghiên cứu trên những động vật đã cho thắy
tảng nguy cơ của sẩy thai tự nhiênlchết hoặc đe dọa phôi thai ớ liều cao (xem phần 3.3.5 Đặc tinh khác về an toản).
Nguy cơ tiềm tảng ở người chưa được rõ.
Không nên dùng Actemra trong thai kỳ trừ khi cần thiết thật sự.
2.4.2 Phụ nữ cho con bú
Chưa rõ iiệu Actemra có bải tiết qua sữa mẹ hay không. Mặc dù globulin miễn dịch nội sinh của khảng nguyên lgG
được tiết ra vảo sữa mẹ, sự hấp thu toản thân của Actemra thông qua việc cho bú sữa khó có thể xảy ra do sự thoái
hoá nhờ thủy phân nhanh những ioại protein nảy ở hệ thống tiêu hóa. Nên quyết định iiệu có nên tiếp tục/ngimg cho
bú hoặc tìễp tụclngừng diều trị với Actemra, xét đến lợi ích cùa việc cho con bú và lợi ích cùa người phụ nữ khi điều
trị với Actemra.
2.4.3 Sử dụng ở trẻ em
Xem phần 2.2.1 Các hướng dẫn iiều dùng đặc biệt.
2.4.4 Sử dụng ở người giá
Xem phần 2.2.1 Các hướng dẫn iiều dùng đặc biệt, xem phần 3.2.3 Dược động học o dân số đặc bíệt.
2.4.5 Suy thặn
Xem phần 2.2.1 Các hướng dẫn lìều dùng đặc biệt, xem phần 3.2.3 Dược động học ở dân số đặc biệt.
2.4.6 Suy gan
Xem phần 2.2.1 Các hướng dẫn iiều dùng đặc biệt, xem phần 3.2.3 Dược dộng học ở dân số dặc biệt.
2.5 Các tác dụng không mong muốn
Thông bảo cho bác sĩ cảc tác dụng không mong muốn gặp phải khi sử dụng thuốc
2.5.1 Các thử nghiệm lâm sảng
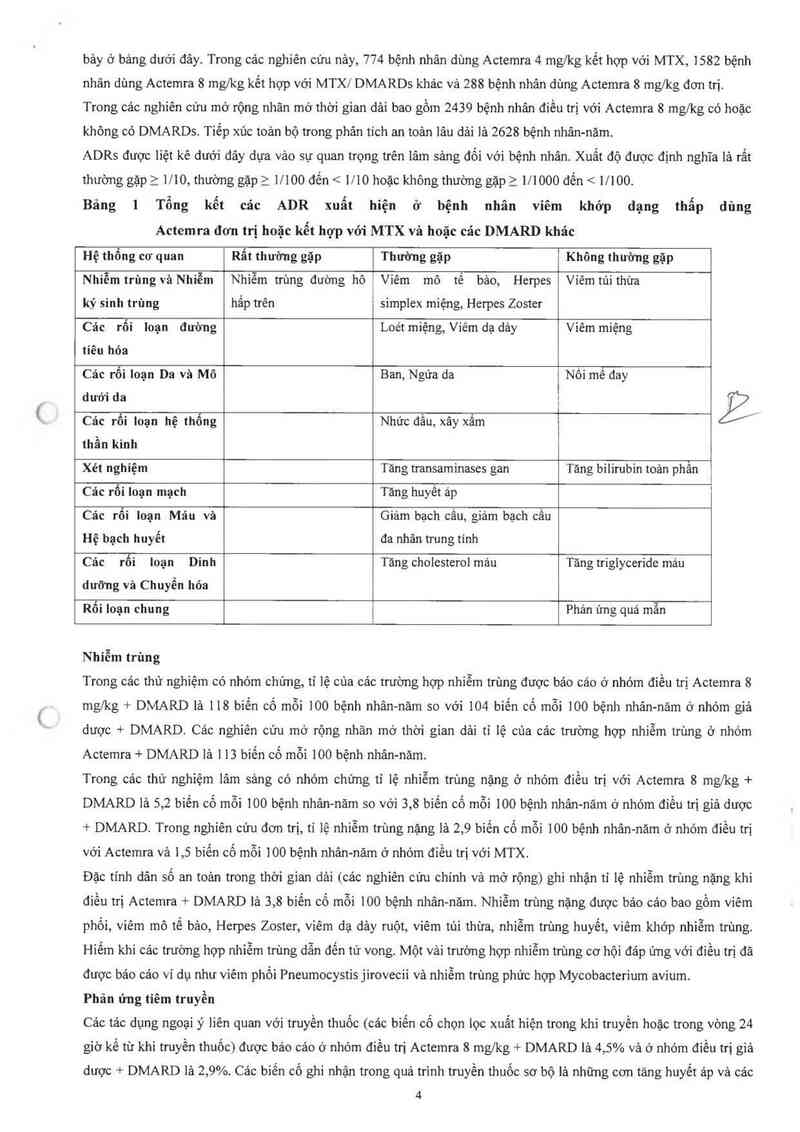
Tổng cộng 3728 bệnh nhân đã dùng it nhất 1 liều đỉều trị Actemra. Cảc phản ứng bắt iợi của thuốc (ADRs) dựa vảo
đặc tính an toản cùa Actemra nghiên cứu trong 4 thử nghiệm với giả dược và 1 với MTX có nhóm chứng được trinh
3
bảy ở bảng dưới đây. Trong các nghiên cứu nảy, 774 bệnh nhân dùng Actemra 4 mg/kg kết hợp với MTX, 1582 bệnh
nhân dùng Actemra 8 mg/kg kết hợp với MTX/ DMARDs khảc vả 288 bệnh nhân dùng Actemra 8 mg/kg đơn tri.
Trong cảc nghiên cứu mở rộng nhãn mờ thời gian dải bao gồm 2439 bệnh nhân điều trị với Actemra 8 mg/kg có hoặc
không có DMARDS. Tiếp xúc toản bộ trong phân tích an toản lâu dải lả 2628 bệnh nhân-nãm.
ADRs được liệt kê dưới đây dựa vảo sự quan trọng trên lâm sảng đối với bệnh nhân. Xuất độ được định nghĩa lả rất
thường gặp 2 1710, thướng gặp 2 17100 đến < 1710 h0ặc không thường gặp 2 171000 đến < 1/100.
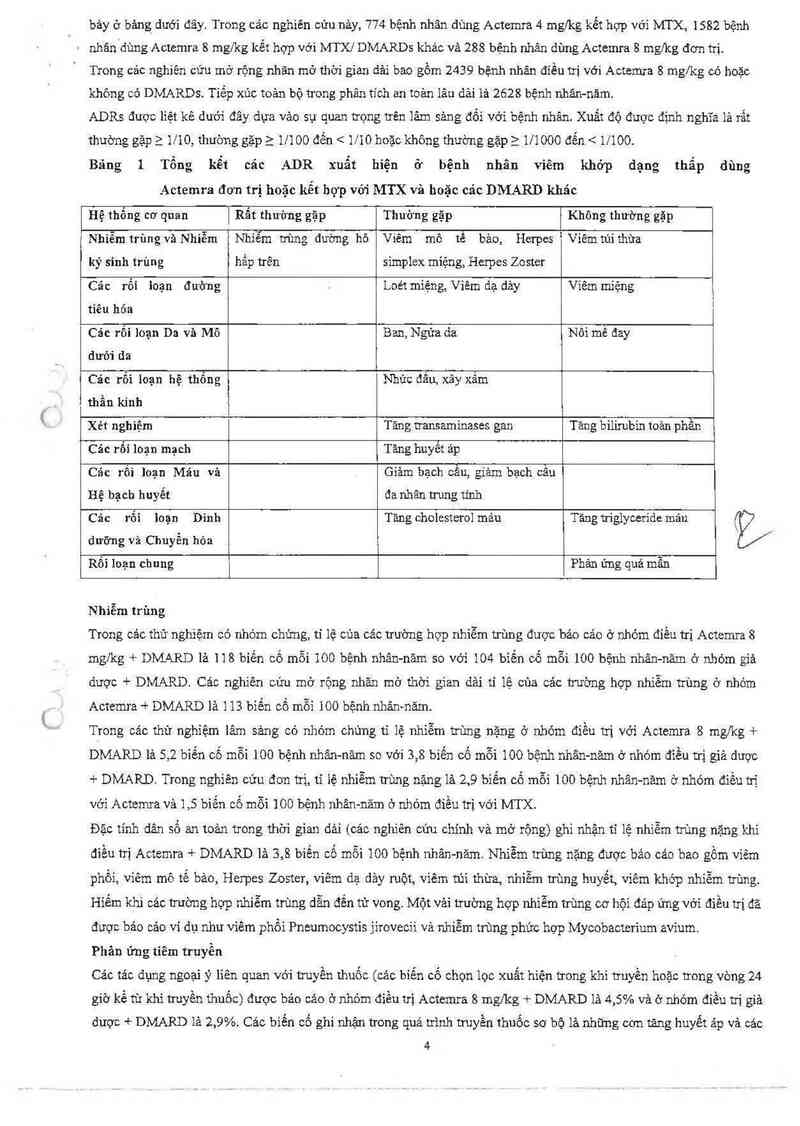
Bảng 1
Tổng kết các
ADR xuất
hiện
ở bệnh
nhân viêm khớp dạng thẩp dùng
Actemra đơn trị hoặc kễt hợp với MTX và hoặc các DMARD khác
Hệ thổng co' quan
Rất thường gặp
Thường gặp
Không thường gặp
Nhiễm trùng và Nhiễm
ký sinh trùng
Nhiễm trùng dường hô
hẩp trên
Viêm mô tế bảo, Herpes
simplcx miệng, Herpes Zoster
Viêm túi thừa
Các rối Ioạn đưòng
tiêu hỏa
Loét miệng, Viêm dạ dảy
Viêm miệng
Các rối loạn Da vả Mô
dưới da
Ban, Ngứa da
Nối mẽ đay
Cảc rối loạn hệ thống
thần kinh
Nhức đầu, xây xẳm
Xét nghiệm
Tăng transaminases gan
Tăng bilirubin toản phân
Cảc rối Ioạn mạch
Tăng huyết áp
Các rôi Ioạn Máu và
Hệ bạch huyết
Giảm bạch cẩu, giảm bạch cầu
đa nhân trung tinh
Các rối
dưỡng và Chuyển hỏa
loạn Dinh
Tảng cholesterol máu
Tăng irígiyceride máu
Rối loạn chung
Phản ủng quá mân
Nhiễm trùng
Trong các thử nghiệm có nhóm chứng, tỉ lệ của các trường hợp nhiễm trùng được báo cáo ở nhóm điểu trị Actemra 8
mg/kg + DMARD là 118 biến cố mỗi 100 bệnh nhân—năm so với 104 biến cố mỗi 100 bệnh nhân-năm ở nhóm giả
dược + DMARD. Cảc nghiên cứu mở rộng nhăn mớ thời gian dải tỉ lệ cùa cảc trường hợp nhiễm trùng ở nhóm
Actemra + DMARD lãi 1 13 biến cố mỗi 100 bệnh nhân-nảm.
Trong các thử nghỉệm lâm sảng có nhóm chứng tỉ lệ nhiễm trùng nặng ở nhóm điều trị với Actemra 8 mg/kg +
DMARD lả 5,2 biến cố mỗi 100 bệnh nhân—năm so với 3,8 biến cố mỗi 100 bệnh nhân—năm ờ nhớ… điều trị giá được
+ DMARD. Trong nghiên cứu đơn trị, ti 1ệ nhiễm trùng nặng lả 2,9 biến cố mỗi 100 bệnh nhân-năm ở nhóm điều trị
với Actemra vả 1,5 biển cố mỗi 100 bệnh nhân-năm ở nhóm điều trị với MTX.
Đặc tinh dân số an toản trong thời gian dải (cảc nghiên cứu chinh và mở rộng) ghi nhận tỉ lệ nhiễm trùng nặng khi
diểu trị Actemra + DMARD là 3,8 biến cố mỗi 100 bệnh nhân-năm. Nhiễm trùng nặng dược bảo cảo bao gồm viêm
phổi, viêm mô tế bảo, Hcrpes Zoster, viêm dạ dảy ruột, viêm túi thừa, nhỉễm trùng huyết, viêm khớp nhiễm trùng.
Hiếm khi cảc trường hợp nhiễm trùng dẫn đến tử vong. Một vải trường hợp nhiễm trùng cơ hội đảp úng với điều trị đã
được bảo cáo ví dụ như viêm phổi Pneumocystis jirovecii và nhiễm trùng phức hợp Mycobacterium avìum.
Phân ứng tiêm truyền
Các tác dụng ngoại ỷ liên quan với truyền thuốc (cảc biến cố chọn lọc xuất hiện trong khi truyền hoặc trong vòng 24
giờ kể từ khi truyền thuốc) được báo cảo ở nhóm điều trị Actemra 8 mg/kg + DMARD iả 4,5% và ở nhóm điểu trị giá
dược + DMARD là 2,9%. Các biến cố ghi nhận trong quá trình truyền thuốc sơ bộ là những cơn tăng huyết ảp vả cảc
4
biển cố ghi nhận trong vòng 24 gỉờ từ khi kết thủc truyền thuốc iả phản ứng ở da (phảt ban, mề đay). Những biến cố
nảy không hạn chế víệc điều trị.
Cảc phản ứng phản vệ (6 bệnh nhân) hOặc các cảc phản ứng quá mẫn nậng khác liên quan điều trị Actemra khiến phải
ngừng điều trị, đã được ghi nhận 12 trên tổng số 3728 bệnh nhân (0,3%) điều trị với Actemra trong cảc thử nghiệm
lâm sảng nhăn mờ vả có nhóm chứng. Nhũng phản ứng nảy được ghi nhận trong quá ưinh truyền Actemra ớ lần thứ 2
đến thử 5 (xem phần 2.4.1 Cảnh báo và thận trọng chung).
Tính sinh miễn dịch
Tổng cộng 1747 bệnh nhân đã được xét nghiệm khảng thể kháng Actemra trong cảc thử nghiệm lâm sảng có nhóm
chứng. 24 bệnh nhân (1,4%) phảt hiện dương tính với cảc khảng thể kháng Actemra trong đó có 4 bệnh nhân (0,2%)
có phản ứng dị úng. Trong 18 bệnh nhản (1%) sinh các khảng thề trung hòa, hiệu quả được duy trì cho đến 96 tuần
điều trị.
2. 5.1.1 Các bẩt thường về xét nghiệm Ê
Các bẫt thường về huyễt học
Giảm số lượng bạch cằu trung tính dưới 1 x lngL xuất hiện (7 3,4% bệnh nhân điều trị Actemra + DMARD so với <
0,1% khi điểu trị với giả được + DMARD. Giảm dưới 0,5 x 10971. được ghi nhận ở 0,3% bệnh nhân điều trị Actemra 8
mg/kg + DMARD (xem phẳn 2.3.4 Xét nghiệm).
Không có mối liên hệ rõ rảng giữa giảm bạch cầu trung tính dưới 1 x 109/L vả sự xuất hiện của nhiễm trùng nặng.
Tăng men gan
Ghi nhận có tăng thoảng qua ALT/AST > 3xULN 01 2,1% bệnh nhân điểu trị Actemra 8 mg/kg so với 4,9% bệnh nhân
điếu trị MTX, và 6,5% bệnh nhân điều trị Actemra 8 mg/kg + DMARD so với 1,5% bệnh nhân điều trị giá dược +
DMARD. Bổ sung cảc thuốc có khả năng gây độc tính lên gan (ví dụ MTX) với Actemra đơn trị 181… tăng xuất độ các
bất thường nảy. Tăng ALT/AST › 5 x ULN được ghi nhận ớ 0,7% bệnh nhân điều trị Actcmra đơn trị và 1,4% bệnh
nhân điểu trị Actemra + DMARD, phần iớn những bệnh nhân nảy ngùng đìều trị với Actemra. Những thay đối không
kết hợp với bất kì tình trạng tăng biiirubin trực tiểp có ý nghĩa lâm sảng, chúng cũng không kểt hợp bằng chứng lâm
sâng của viêm gan hoặc suy gan.
Tăng các thông số lipid
Tảng cảc thông số lipid (cholesterol toản phần, HDL, LDL, trỉgiycerides) được ghi nhận ở bệnh nhân điều trị với
Actemra. Ở phần lớn bệnh nhãn không có tãng cảc chỉ số gây xơ vữa động mạch, vả tăng cholesterol toân phần đáp
ứng điều trị với cảc thuốc hạ lipid.
2.6 Quá liều
Hiện tại có rất ít dữ liệu cùa vìệc dùng Actemra quá iìều. Một trường hợp quá liều do vô ý được báo cáo ở một bệnh
nhân bị đa u tùy dùng liều đơn 40 mg/kg. Không có tảc đụng ngoại ý nảo của thuốc được ghi nhận. Không có tác
dụng ngoại ý nặng nảo cùa thuốc được ghi nhận ở các người tình nguyện khoẻ mạnh khi nhận iỉều dơn lên đến 28
mg/kg, mặc dù giảm bạch cẩu trung tính giới hạn iỉều dùng được ghi nhận.
3. cÁc ĐẶC ĐIẺM VÀ TÁC DỤNG DƯỢC Li
3.1 Đặc điềm dược lực học
Trong cảc thử nghiệm lâm sảng vởi Actemra, đã ghi nhận có sự giảm nhanh chóng C-reactive protein (CRP), tốc độ
máu lắng (ESR) vả amyioid A huyềt thanh (SAA). Ghi nhận có lãng nồng độ hemoglobin, qua việc Actemra lảm
giảm tớc động chi phối bới lL-6 lên sự sản xuất hepcidin đề iảm tãng tạo sẳt.
3.1.1 Cơ chế hoạt động
Actemra lả khảng thề dơn dòng nhân hóa tái tổ hợp kháng thụ thể interleukin—ó (iL—6) ở người iả thảnh phần cùa phân
nhóm globulin miễn dịch (Ig) 1gG,. Actemra gắn chuyên biệt với cả phần thụ thể gắn kết hòa tan vả thụ thể gắn kết
mảng cùa lL-6 (SIL-óR, mIL-6R), và đã cho thẳy ức chế được tín hiệu điều hòa bới le—6R vả miL—6R. lL-6 lả
cytokìne đa chức năng, được sản xuất bới nhiều loại tế bảo liên quan dến chức nãng cận tiết tại chỗ cũng như sự đỉều
hòa cùa các tiến trình bệnh học và sỉnh lý học cùa cơ thể như sự kich thich tiết ra globulìn miễn dịch, hoạt hóa tế bảo
T, kich thích các protein giai đoạn cẳp cùa gan vả kích thich tiến trinh tạo mảu. lL-6 có liên quan đển bệnh sinh cùa
cảc bệnh bao gồm bệnh lý viêm, loãng xương vả ung thư.
3.1.2 Các nghỉẽn cứu Hiệu quả | Lâm sảng g
Hiệu quả của Actemra lảm giảm bót cảc triệu chứng vả dấu hiệu của viêm khởp dạng thẳp được đánh giả qua 5 thử
nghiệm ngẫu nhiên, mù đôi, đa trung tâm. Nghiên cứu I-IV đòi hỏi bệnh nhân phải ì 18 tuổi được chẩn đoán iả viêm
đa khởp dạng thấp tiến tríền dựa vảo tiêu chi cùa Hội Khớp Học Hoa Kỳ (ACR) có 11 nhắt 8 khớp đau vả 6 khóp sưng
so với lúc vảo nghiên cứu.
Actemra dùng đơn ưị truyền tĩnh mạch mỗi 4 tuần (Nghiện cưu 1), kết hợp với MTX (Nghiên cửu 11, 111, V) hoặc với
cảc thuốc chống thắp khớp lảm cải thiện bệnh (DMARD) khác (Nghiên cứu IV).
Nghiên cứu 1 đánh giá 673 bệnh nhân chưa được điều trị với MTX trong 6 thảng trước khi được chọu ngẫu nhiên, và
nhũng bệnh nhân trước đó chưa ngùng điều trị với MTX vì những độc tính quan trọng về mật lâm sâng hoặc đáp úng
kém. Phần lớn bệnh nhân (67%) chưa điều trị với MTX. Actemra được dùng đơn trị với liều 8 mg/kg mỗi 4 tuần.
Nhóm so sánh lả MTX mỗi tuần (liều được chỉnh từ 7,5 đến liểu tối đa hảng tuần lả 20 mg ưọng chu kỳ 8 tuần). Kết
cục chinh lả ti iệ bệnh nhân đại đảp ửng theo tiêu chí ACR20 ở tuần thứ 24.
Nghiên cứu 11, tiến hảnh trong 2 năm và tiếp diễn với phân tích sơ bộ theo kế hoạch (7 tuần thứ 24 đảnh giá 1 196 bệnh
nhân đáp ứng lâm sảng kém với MTX. Điều trị mù đôi với Actemra với iiều 4 mglkg hoặc 8 mg/kg hoặc giả dược
được dùng mỗi 4 tuần trong 52 tuần, kết hợp với MTX ớ iỉều ổn định (10 mg — 2Smg hảng tuần). Kết cục chính lả tỉ lệ
bệnh nhân đạt đáp ứng theo tiêu chí ACR20 từ tuần thứ 24.
Nghiên cứu III đảnh giá 623 bệnh nhân đảp ứng lâm sảng kém với MTX. Actemra với liều 4 mglkg hoặc 8 mg/kg
hoặc giả dược mỗi 4 tuần trong 52 tuần, trong kết hợp với MTX ở liều ồn định (10 mg — 25 mg hảng tuần).
Nghiên cứu 1v đảnh giá 1220 bệnh nhân đáp ứng kém với điều 61 chống thẳp hiện tại cùa họ, bao gồm một hoặc
nhiều DMARD. Actemra với liều 8 mg/kg được dùng mỗi 4 tuần trong 52 tuần, kết hợp với DMARD ở liều ổn định.
Nghiên cứu V đảnh giá 499 bệnh nhân đảp ứng lâm sảng kém hoặc không dung nạp với 1 hoặc nhỉều liệu phảp chống
TNF (Yếu tố hoại tư u). Thuốc kháng TNF phải được ngùng trước khi chia nhóm ngẫu nhiên. Actemra với liều 4
mg/kg hoặc 8 mg/kg hoặc gíả dược được dùng mỗi 4 tuần trong 52 tuần, trong kết hợp với MTX ở liều ốn định
(10 mg — 25 mg hảng tuần). Kết cục chính cùa nghiên cứu III, IV lả tỉ lệ bệnh nhân đại đảp ứng theo tiêu chỉ ACR20
8 tuần thứ 24.
Bảng 2 Tỷ lệ bệnh nhân đạt đáp ứng theo tiêu chí ACR 20, 50 & 70 trong các nghiên cứu
1 đến V được trình bảy trong bảng 2
' ýNghiên cứu] › NgĨiên cưuìl Nghiện cửu … Nghiên cứu 1v ' ỉghiện ct'nfv
Chua dùng MTX dáp ửng kém vởỉ MTX đáp ửng kém với Đáp ứng kém với 'Đáp ửng kém với thuốc
MTX DMARD . kháng TNF
Tỉ lệ dápr TCZ MTX TCZ Giả dược TCZ Giả được TCZ Giã được + TCZ Giả được
ứng 8 mg/kg 8 mglkg + MTX 8 mg/kg + MTX 8 mglkg + DMARD 8 mglkg + MTX
+MTX +MTX DMARD +MTX
N=286 N=284 N= 398 N=393 N= 205 N=204 N=803 N=413 N=170 N=158
ACR20
ý Tuầh24 70%—Ỉ 52% 56%… 27% 59%… —26% 61%… 24% A 50%… 10%
ACRSO ' 0
Tuần 24 44%... 33% 32%… 10% 44%… 1 1% 38%… 9% 29%… 4%
ACR7O
Tuần 24 28%… 15% 13%… 2% 22%… 2% 21%… 3% 12%" 1%
TCZ % Actemra
( * p<0, 05, Actemra sv. gỉả dược+MTX4’D/iMRD Z
** p<0,01, Actemra sv. gíả dược—MTAO'DAMRD
*** p< 0,000], Actemra sv. giả dược+MTX/DAMRD
Trong tất cả cảc nghiên cứu, bệnh nhân điều trị với Actemra có ti 1ệ đảp ứng ACR20, 50, 70 cao hơn có ý nghia về
mặt thống kê ở thời điểm 6 thảng so với nhóm chửng. Hiệu quả điểu trị tương tự ở các nhóm bệnh nhân không phụ
thuộc vảo yếu tố tuối, giới, chùng tộc, đìều ưị trước đó hoặc tình trạng bệnh. Thời gian bắt đầu có đảp ưng (sớm nhất
ở tuần thứ 2) vả mức độ đáp ửng tiếp tục cải thiện trong quá trình điều trị. Đáp ứng kéo dải tiếp tục được quan sảt
trong hơn 18 tháng trong nghiên cứu mở rộng nhãn mở đang tiển hảnh 1, 111 — v.
Ở các bệnh nhân điều trị với Actemra có sự cải thiện quan trọng được ghi nhận trên tất cả cảc thông số thảnh phần của
đáp ứng ACR 20 (số khóp sưng đau, đánh giá toản bộ của bác sĩ điều trị vả bệnh nhân, điếm chỉ số tản tật (HAO),
đảnh giá đau và CRP so với bệnh nhân dùng giả dược + MTX/DMARDS trong tẩt cá nghiên cứu.
Những bệnh nhân điều trị với Actemra có điếm diễn tiến bệnh (DAS 28) giảm nhiều hơn có ý nghĩa thống kê so với
nhũng bệnh nhân điều trị với giả được + DMARD. Tỳ iệ bệnh nhân có đảp úng EULAR (điềm đảnh giả cùa Hội Điều
(
111 bệnh Thấp khớp Châu Âu) tốt đến trung bình nhiều hơn cớ ý nghĩa ở bệnh nhân điều trị với Actemra so với những
bệnh nhân điểu trị giá được + DMARD (Bảng 3).
Bảng 3 So sánh giữa các nghiên cứu về đáp ửng DAS vả EULAR ở tuần thứ 24
Nghiên cứu | Nghiên cứu Il Nghiên cửu III Nghiên cứu IV Nghiên cửu V
Chưa dùng MTX Đảp ửng kém với MTX Đáp ứng kém với MTX Đảp ứng kém với Đáp ửng kém vởi
DMARD thuốc kháng TNF
TCZ MTX TCZ Giả dược + TCZ Giã duợc + TCZ Giả dược + TCZ Giá
8 mg/kg 8 mg/kg MTX 8 mg/kg MTX 8 mglkg DMARD 8 mglkg dược
+MTX +MTX + DMARD +MTX +MTX
N=286 N=284 N= 398 N=393 N= 205 N=204 N=803 N=413 N=170 N=158
Thay đối trong DASZS |trung bình (trung bình hiệu chinh (SE))Ị
Tuần24 -3,31 -2,05 -3,11 -1,45 -3,43 -1,55 -3,17 ỷ-1Ĩ1Ỉ Ấ3,16 0,95
(0,12) (0,12) 10,09)… (0.11) (0,12)… (0,15) 10,07)… (0,09) 10,14)… (0,22)
Đáp úng DAS < 2,6 (%)
Tuần24 33,6%ỳ 12,1% 33,3%… 3,8% 27,5%… Ủ% 30,2%… 3,4% 30,1%… À1,6%
Đáp ứng EULAR (%)
Không 18% 35% 26% 65% 20% 65% 20% 62% 32% 84%
Trung binh 42% 48% 34% 29% 41% 32% 40% 33% 31% 15%
Tớt+ 40%ỳ 17% 41%—'… 6% 38%1*Ỉ 3% ý ẮJ%M Í Ở 4% ỳ37%… ' 2%
TCZ = Actemra
1016 trị p so sánh tắt cả cảc nhóm đảp ửng theo EULAR
* p< o. 05. Actemra sv. giả dược+MTX/DMARD ý
** p< 0,01, A ctemra sv. giả dược+MTX/DMARD
*** p<0,0001, Aclemra sv. giả dược+MTX/DM4RD
Kết cuc về chắt lưoỵc_uôc sống
Những cải thiện có ý nghĩa về mặt lãm sảng trong chỉ số tản tật (HAQ-Di, Chỉ số tản tật qua bảng câu hòi đảnh giá
sửc khoẻ), mệt mòi (FAClT-F , Đánh giá chức năng về tình trạng mệt mòi — Liệu phảp điều trị liên quan bệnh lý mãn
tinh), vả cải thiện cả về lĩnh vực sức khoẻ thể chất (PCS, Tóm tắt thảnh phần thể chất) vả sức khoẻ tâm thần (MCS,
Tóm tắt thảnh phần tâm thần) của SF-3ó (điều tra sức khoẻ theo Mẫu Ngắn 36) được ghi nhặn 6 bệnh nhân điều trị
Actemra (đơn trị hoặc kết hợp với DMARDs) so với bệnh nhân điều trị MTX/DMARDS (Bảng 4).
Vảo tuần thư 24, ti lệ bệnh nhân điều trị với Actcưưa biền hiện cải thìện có ý nghĩa lâm sảng HAQ-Di (được định
nghĩa lả tồng số điềm gỉảm > 0,25) cao hơn có ý nghĩa so với các bệnh nhân dùng giả duợc + MTX/DMARDS trong
tât cả các nghiên cún.
Bảng 4 So sảnh đáp ứng cùa SF-36, HAO vả FAClT-F ở tuần 24
Nghiên cứu 1 Nghiên cứu II Nghiên cứu lll Nghiên cứu IV Nghiên cửu V '
Chưa đùng MTX Đáp ứng kẻm vởi MTX Đáp ứng kém với MTX Đáp úng kẻm vởi DMARD Đáp ửng kém với thuộc
ý _ _ _ _ .. ý _ _p _ khảng TNF
TCZ MTX TCZ Giã đuợc + TCZ Giả được TCZ Giã đuợc TCZ Giả được
8 mglkg 8 mg/kg MTX 8 mglkg + MTX 8 mglkg +DMARD 8 mg/kg + MTX
+MTX +MTX + DMARD +MTX
N=286 N=284 N= 398 N=393 N= 205 N=204 N= 803 N=413 N=170 N=158
Thay đổi PCS ịtrung bình (trung bình hiệu chỉnh (SE))I
10,2 8,4 8,1 5,6 9,5 5,0 8,9 4,1 8,0 2,2
10.71 (0.71 (0.61“ (0.7) (0.81"* (1.0) (0.41'" (0.61 (0.91" (1.3)
Thay đổi MCS [trung bình (trung 1… hiệu chỉnh (SE))]
Ậỳ6,7 " ý ' 5,0 4,2 k 2,8 7,3 ý ' Í ỳ2,7 Í Í 5,3 2Ĩ vẵ,1 4,1
(0,9) (0,9) (0,8) (0,9) (1,1)… (1,3) (0,6)… (0,7) (1,3) (1,9)
Thay đồi HAQ-DI [trung bình (trung hinh hiệu chinh (SE))l
-0,70 (0,05) 0,52 0,5 0,3 0,55 0,34 0,47 0,2 0,39 0,05
(0,05) (0,041M (0,04) (0,06)“ (0,07) (0,03)… (0,03) (0,05)… (0,07)
`Thay đổi FACIT-F [trung bình (trung bình hiệu chinh (SE))I
9,3 7,0 6,4 5,4 8,6 4,0 8,0 ' 3,6 8,8 4,2
(0.8) (0.8) (0.71 (0.81 (0.91"* (1101 (0.51“* (0.71 (1.01* 11.61
TCZ = Actemra
* p<0,05, Acremra so với giả dược + MTX-’DAJARD
** p<0, 01, Actemra so vởi gía dược -— MTXf’DAMRD Ẹ
*** p< 0, 0001 , Actemra so vởi giả dược + MTX/DMARD
Về xét nghiêm
Điều trị Actemra kết hợp với DMARD/MTX hoặc đơn trị đem lại cải thiện rất cóỷ nghĩa về mặt thống kê về nồng độ
hemoglobin so với giả dược + DMARD/MTX (p< 0,0001) ờ tuần thứ 24. Sự cải thiện lớn nhất được ghi nhận ở bệnh
nhân thiếu mảu mãn tính do viêm khớp dạng thấp; nồng độ trung binh cùa hemoglobin tăng từ tuần thứ 2 và duy tri Ở
mức binh thường trong suốt tuần 24. Sự giảm đảng kế nồng độ trung binh cùa nhũng chất phản ứng giai đoạn cắp,
CRP, ESR, vả amyloid A huyết thanh (SAA) xuất hiện một cảch nhanh chóng sau khi truyền Actemra. Vả điều nảy
phù hợp với tác động của thuốc lên cảc chắt phản ứng giai đoạn cẳp, điều 011 với Actemra có liên quan đển giảm số
lượng tiếu cầu trong giới hạn binh thường.
3.2 Đặc tinh dược động học
Dược động học của Actemra được xác định bằng phân tích dược động học dân số trên bộ dữ iiệu bao gồm 1793 bệnh
nhân viêm khớp dạng thẳp điều trị với 4 mg/kg và 8 mg/kg truyền tĩnh mạch một giờ mỗi 4 tuần trong 24 tuần.
Các thông số dược động học của Actemra không thay đổi theo thời gian. Khi dùng liều 4 mglkg và 8 mglkg mỗi 4
tuần, diện tích dưới đường cong (AUC) vả nồng độ đảy (C…) tăng nhiều hơn mửc tỷ lệ với liều. Nồng độ tối đa
(C.…) tãng theo tỉ lệ theo liều. Ở trạng thải ổn định, AUC và C…… lần lượt tãng cao hơn 2,7 và 6,5 lần ở liều 8 mglkg
so với liều 4 mg/kg.
Các thông số sau có giá trị với iiều 8 mg/kg Actemra mỗi 4 tuần. Giá trị trung bình dự kiến ở trạng thải ổn định của
AUC, Cmm vả C,… cùa Actemra iằn lượt 1121 35000 i 15500 h~ug/ml, 9,74 1 10,5 ụg/mi, vả 183 :t 85,6 ug/ml. Tỉ số
tích iũy cùa AUC vả c.… có giá trị thấp; lần 1ượt lả 1,22 vả 1,06. Tỉ số tích lũy với cmm (2,35) cao hơn, điều nảy dự
kiến được vai trò của sự thanh thải không tuyến tinh ở nồng độ thấp. Trạng thải ổn định cho Cmaxẹ AUC, vả Cmm đạt
được 1ần lượt sau khi truyền iiều đẩu tiên sau 8 tuần vả 20 tuần.
ì
3.2.1 Phân bộ
Sau khi truyền tĩnh mạch, Actemra qua thải trừ 2 pha từ vòng tuấn hoản. ớ bệnh nhân viêm khởp dạng thẩp thể tích
phân bố trung tâm lả 3,5 L, thể tích phân bố ngoại biên iả 2,9 L, dẫn đến thế tich phân bố ở trạng thái ổn định iả 6,4 L.
3.2.2 Đảo thải
Độ thanh thải hoản toản cùa Actemra phụ thuộc vảo nồng độ và lá tống cùa độ thanh thải tuyển tinh vả không tuyển
tính. Độ thanh thải tuyến tính được ước tinh là thông số trong phân tích dược động học dân số nghiên cứu và là 12,5
ml/giớ. Độ thanh thải không tuyến tính phụ thuộc nồng độ đóng vai trò chủ yểu khi nồng độ Actemra thấp. Một khi
đường thanh thải tuyến tính bị bão hòa, ở nổng độ Actemra cao hơn, thanh thải được quyết định chủ yểu bới thanh
thải tuyển tính.
Thời gian bản thải của Actemra phụ thuộc nồng độ. Ở trạng thải ốn định sau khi truyền liều 8 mg/kg mỗi 4 tuần, thời
gian bản thải hiệu quả giảm khi giảm nồng độ giảm trong quảng iỉểu từ 14 - 8 ngảy.
3.2.3 Dược động học ở dân số đặc biệt ạ
Suy gan
Chưa có nghiên cứu chính thức nảo được tiến hảnh ảnh hướng cùa suy gan iên dược động học cùa Actemra.
Suy thận
Chưa có nghiên cứu chính thức nảo được tiển hảnh ảnh hướng của suy thận lên dược động học của Actemra. Hầu hết
cảc bệnh nhân trong phân tích dược động học dân số có chức nảng thận binh thường hoặc suy thận nhẹ. Suy thận nhẹ
(thanh thải creatinine tính theo Cockcroft-Gault < 80 mi/phút vả 2 SO ml/phủt) không ảnh hưởng dược động học cùa
Actemra
C ảc đối tượng đặc biệt khảc
Cảc phân tích dân số đảnh giá khả năng ânh hướng của đặc tính dân số lên được động học của Actemra ở bệnh nhân
viêm khớp dạng thắp trướng thảnh. Kết quả cùa các phân tich nảy cho thắy không cẳn thay đổi iiều theo tuồi, giới,
hoặc chủng tộc.
3.3 An toản tiền lâm sảng
3.3.1 Khả năng sinh ung thư
Nghiên cứu về khả năng sinh ung của Actemra chưa được tiến hảnh. Dữ liệu tiền lâm sảng hiện tại cho thấy sự góp
phần của cytokỉne IL-6 đa tảc dụng vảo sự tiển trỉền ác tính vả để khảng với chết tế bảo theo lập trình của nhiều ioại
ung thư. Những dữ liệu nảy không gợi ý có nguy cơ iiên quan với khới phảt tiến triển ung thư sau khi điều trị với
Actemra. Phù hợp với điềm vừa nêu các tốn thương tăng sinh chưa được ghi nhận trong một nghiên cứu độc tính kéo
dải 6 tháng ở khi đầu chó cũng như không thắy mô tả trong chuột bất hoạt IL—6 trong điều kiện 1ảm giảm lL-6 mãn
tính.
3.3.2 Khả nảng đột biến gen
Nghiên cứu về độc tính di truyền chuẩn với Actemra trên cảc tế bảo của sinh vật có nhân và không nhân đỉến hinh đều
cho kết quả âm tính.
3.3.3 Giảm khả năng sinh sản
Cảc nghiên cứu về khả nảng sinh sản cùa động vật ở các loải iiên quan chưa được tiến hảnh. Tuy nhiên, dữ liệu tiền
lâm sảng hiện có không gợi ý cho thấy có ảnh hưởng khá nãng sinh sản khi điều trị với Actemra. Ảnh hướng trên cơ
quan hoạt động nội tiết hoặc cảc cơ quan của hệ sinh sản đã không được ghi nhận trong một nghiên cứu độc tính kéo
dải của khí đầu chỏ, cũng không thắy ảnh hướng trên khả nảng sinh sản cùa chuột thiếu IL—6.
10
'?
3.3.4 Khả năng sinh dị dạng thai
Khi truyện Actemra tĩnh mạch vảo loải khi đầu chó trong giai đoạn sóm thai kỳ, không ghi nhận có ảnh hưởng có hại
trực tiépỈhoặc gián tìếp lên thai kỳ hoặc sự phát triến của phôi thai.
3.3.5 Đặc tính khác về an toản
Một nghiên cứu độc tính trên phôi thai tiến hảnh trên khi đầu chó ghi nhận có tăng nhẹ tinh trạng chết phôi thai/sảy
thai với nồng độ tiểp xúc toản thân cao (>100 lần nồng độ tiểp xúc ở người) ở nhóm liểu cao 50 mg/kglngảy so với
giả dược vả các nhỏm liều thẳp khảc. Mặc dù IL—6 dường như không là cytokine chính cho cả sự phảt triến thai hoặc
kiềm soát miễn dịch của mẹlbâo thai, mối liên hệ cùa bằng chứng trẻn với Actemra không thể ioại trừ.
4. ĐẶC ĐIẺM DƯỢC PHẢM
4.1 Bảo quản Z
Hạn dùng: 30 thảng kế từ ngảy sản xuất
Không nên dùng thuốc sau ngảy hết hạn (EXP) ghi trên hộp thuốc.
Với ống tiêm: giữ ở 2 - 8°C, không giữ đông. Giữ lọ thuốc nguyên trong hộp để tránh ảnh sảng.
Dung dịch truyền Actemra sau khi pha ồn định về mặt vật lý vả hóa học trong dung dịch muối sính iý 0,9% ở 30°C
trong 24 giở.
Về phương diện vi sinh học, dung dịch truyền sau khi pha nên được dùng ngay lặp tức. Nếu không dùng ngay, thời
gian bảo quản vả các điểu kiện trước khi dùng phải được người sử dụng đặc biệt quan tâm vả không quá 24 giờ ở 2 -
8°C, trừ khi thao tác pha thuốc được tiến hảnh ở nhũng điều kiện vô trùng được công nhận và kiềm soát.
4.2 Hưởng dẫn đặc biệt cho sử dụng, thao tác, hủy bỏ
Rủt lượng thuốc Actemra cẳn thiết (0,4 ml/kg) dưới đìều kìện vô trùng và pha nồng độ Actemra đã tinh trong 100 ml
tủi dịch truyền chứa dung dịch nước muối sinh lý 0,9% vô trùng không chất gây sốt. Đề trộn dung dịch, nhẹ nhảng
đảo ngược túi dung dich đã pha để trảnh tạo bọt. Chỉ nên truyền các dung dịch trong không mảu hoặc vảng nhạt
không chứa cặn.
4.3 Đóng gói Số ống thuốc
Ông 80 mg/4ml l
Óng zoo mg/lOm] t
Óng 400 mg/ZOml 1
Thuốc: đế xa tầm tay cùa trẻ em
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin, xin hỏi ý kiến bảc sĩ
Chi sử dụng thuốc nảy khi được bảc sĩ kê đơn.
Lưu hảnh tháng 1 ] năm 2007
Sản xuất tại Chugai Pharma Manufacturing Co., Ltd. Thânh phố Utsunomiya, Nhật bản.
16- 3, Kiyohara Kogyodanchi, Utsunomiya— city, Tochigi, Japan
Đóng gói bới F .Hoffmann-La Roche Ltd. Kaiseraugst. Thuỵ sỹ.
Phò cuc muơne
] ] -Jiởệrểễỏẽ “Vãn ẫẨWẨ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng