














XXXXXXXX
ẮẨ/WWIPP r~dxa
ẨẨIWWPP z~qearoiw
11°1l'0N'8
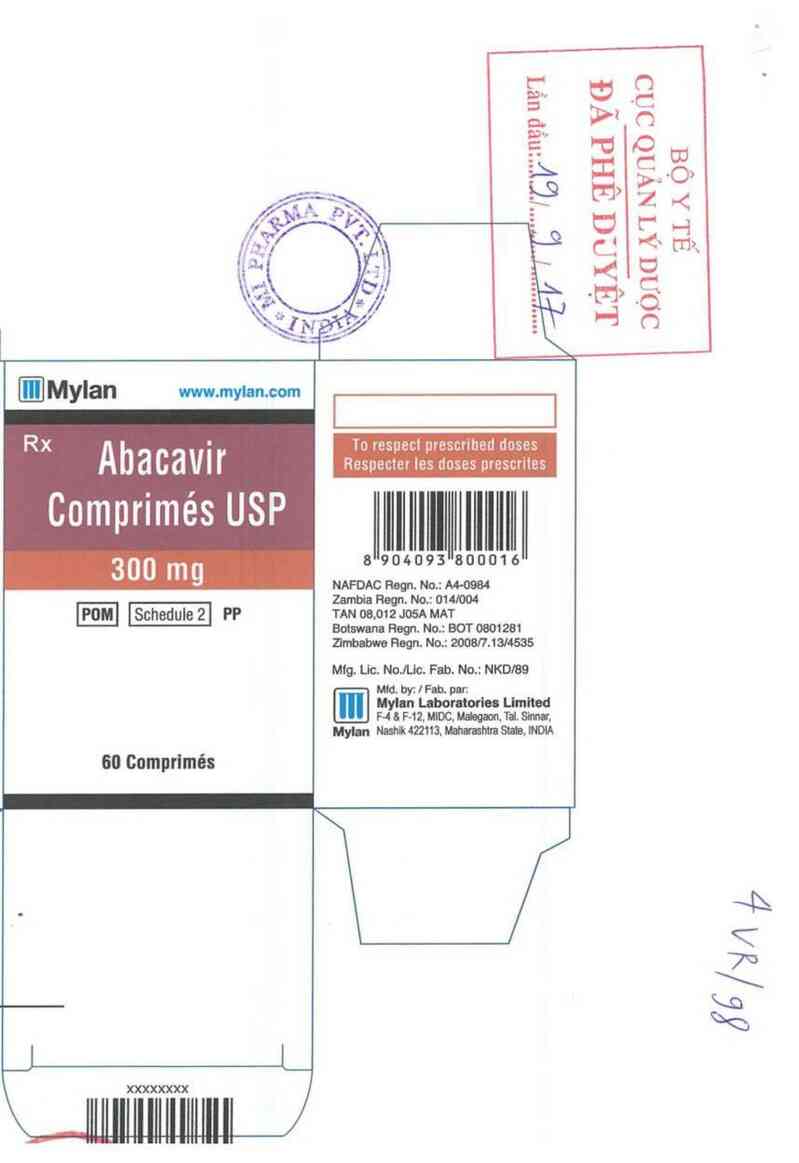
V …. wm_ Eich tiim coated tablnt contains:
.Mylan m cm Ablcavlr Suiilte USP lquivuiem to
AbicaVlr 300 mg
R )( _ Do not store ahove 30'C.
in e ong oontaner.
Ahacavư M *“ ""“ '
Duslue: As diected by the physidan.
NOT T0 EXCEED PRESCRIBED DOSAGE.
Tablets USP xeưoutưntsnacnmostem
OF CHILDREN.
300 mg
…»
60 Tablets
indiutions, Wunings & Procautions:
Read the package ieatlet betcm use
Chlque comprimé petttculẻ contienl:
Sultite d'Abueavh USP oquivatent á
Abncnvir 300 mg
À oonsetver è une termératưe ne
ộẻpassent pes 30°C.
A oonseiver dans i'emballage d'origine.
Pmtogie: Comme dingè par vove médecii.
NE PAS DẺPASSER LA DOSE PRESCRiTE.
TENIR HOHS DE LA PORTÉE ET DE LAVUE
DES ENFANTS.
tndiutiont, Ilim en glnh et Priuutim:
Lire Ia mtioe avant utiisatlon.
Rx -Thuẫ bán theodơn
ABACAVIR TABLETS LISP 300 mg
SĐK:
Mõi viện nen buc phim ohửa
Ameevir Sutfat tương 6wng Abaeavir 300 mg
Đong oói: Hoọ 1 lọ x eo vien
Chi mun. cảch dùng. chóng chi dlnh vả các thbng t’n khủc: xin
doctor huớng dln cửdung kèm thoo.
SỐ lô SX, NSX, HD: Xem 'B.NoJLot', 'Mtd.lFab'. 'Exp' Mn
bao bt
Bảo quân ở nơi khô mm. khong quá wc. Bảoquản trong
bao bì qóe
Đê x: tấm tay trù om.
Đoc kỹ hướng dln lữ dung trước khi dùng.
DNm:
Sản xuât bởi:
Mylln Lobontorln Llldtld
FALF—t 2, MIDC. Malegaon. TU. Stnnar, Nashik - 422113,
Manarusmra sute. An Độ
sub—label
…Í'GV'IIÌẸP UẸ’I
30,110 Ặ’l anò Ji'D
À(ỒG
Abacavh
ComphmésUSP
300 mg
PP
60 Gomprlmés
in iesueci [W’Stlilliíjtl doses
Rưsụectcr les ii(iS€S uresuntes
904093M800016
NAFDAC Reqn. No.: …
Zenibia Flegn. No.: 014/004
TAN 00.012 JosA MAT
Botswana Regn. No.: BOT 0801281
Zinbabwe Regn. No.: 2008|7.1314535
Mtg. Lic. No.]Uc. Fab. No.: NKDIBS
Mtd. by: | Fab. par:
Mylln Laboratorho Uth
F-4 & F-12. MIDC. m…. Tat. Simư,
um Nashik 422113. …ahtm Stain, INDiA
XXXXXXXX
ẨẾ/ìi/ig
40 mm
40 mm
40 mm
Base Layer
COWĩ Vlltll mun … WEAIJH CA!E FMVIDERIIIIRIIIIIBI MI
Ilưtel u Ilclm nu :lul nu tnltlu Ainudr Yúhll I:
ri] yuuutulnuhlilt l
2) ynu |cl un nf IIIII umpnms I… 11 mu … nt thu
'- …ỵ-g mm_ _________ !
|
Yun should imdlaely etmtnct yourdootor or hưlh cau uovinu li
u mmtc yuu … hamn : hypersensitivlly mctinn to Auacamr'
; uMzmnc Mnhgmn. … Slnnu. '
MU mwt-mm.mmm smu.mm |
!
E…tlESNITỂ ulnuzhlluuutm: IlmunItor lte_
niln I'AIueuil Mptmh. II:
lI_) vous mun… uu Inmttm unnh W. z
cii
.,
e…m-erĩ.’ “““ … ’’ : ²“i—ĩ“h… ’ ' ` “ “ Ủ
ua… , .. . ~…mwm==… °'e""e ("ai’e' ²'²ai
ỈOYIII EIỈWIÌMÚSMIH
Ềẵ-uzl n: nm unw u ou… | J ' M"
Mu
m ““:ỄẺ’Ệ ' . ~ 1 "* …… Text Area (for text matter and design)
Ề:Ih Innnndnhumd“ n… ' . . ả__ …
nk mổ“m“r l"““'“““ . Gi & BI k A (f t h ' i )
“”"“… ue an rea OF GC TÌICỒ process
Uylu Lu…lu unitcu
@ ~ , ::.-: ——…:………
I0 mm: | umutmửn , |
—————————— Multi Layer Label Size - 110 x 40 (254 x 40)
_ 1 10 mm
†
Front La er
Y Page - 6 Page 7
' ÌỊẸỊ'JMJỄỀẸLỈẸÌRLẶ J.,_ |_ ———————————— ,_ _ _ ũPõìffl —_ME_ ĨEỀỂHGAIIIIE _ ____ i _ _ _I…_ _ IĨ—WIE_ _ Itĩlĩỉtĩlt'ỉlllĩ _ _ l
ịt ỀỀ'ẸẶỀỀẢ… ` [ l ;2) … unutu lu .mnmm nmmuut | nu meiu nm: dnq LJtmiilez indiưueưci-Mwus iels ooumonm ne volre núdednl !
e m:eezrzư.zư… … cavư [ i _=;ẹ,ẹ;~'=nm=~ . f; u…isẹAẹgidmẹgẹg; ==eg,_ … t
ã ỈHPWỈƯMIỈICHAIDSIÊNỈƯỦIWỦ Tablets USP | I I! Il … ..........................................
i iẵẾu'ỗ'f'ừẫẵ'iẫiẳnúm An . [ i ~ esstemerl. maume aorne ou toun im; , _ |
F ƯlIỦ . u _ . .
.. , _ … a (; a V | r , ] …ms N wmlsswms … d…… °" M… mm"… n … nm… n nltl~cl, mu… m…… tmmmmmnl u
ễ ắnẸỉnyẵểĩ I’iẵưiiLểlẫiằpt'tlirwmỵịi Cũ m ỊJTỈ m ẺS U SP 1 : ' BL Ổx i i’Ý ' lst WM W°ẫịnilmnĩetjlm Wủffliỉlễ'luẳdffliml WW²L :th m minưln nm un uh mũlui (ur umnlu: nma IIIT'
. vous :… li : am pa mt mummnn cl ndưh illllt mm.
ễ ủ'pfflgmảtưf'mưa . , __ ] `muim mua u: ma mm nmnmus ni mm… c…mn … "_ Ể,.,,,u ' nm ' i
_ iỄanmỀỂỂỮỀỄỄỄ ỂLfẩềttfsfmts iiili 11 Li l i pucm meocmen cuntutal de l'atncm u ut: pm mtuluu um tzs’ Íffl Mytnn thurllurln Ltmtmt
hu: ou tui un une … dc vun nem: … i n luu r…4u-n.mncmbnm.uStnm |
ỉ it.“!“t'it2'tiL'titttlt' IE] … ' , ~,……… …. 3……… ”"““ ' “ " "' :… -=……~……… ,
' [__._.__ỉ iu mm [Winù ' ' pontnm immtnutnmmt vutr: mâu… nu lnumisseur t: uins du mm si mual
| - _ _ l ____________ ' i.…vlmỵwưưandzơueưewliufamỵ Ggơhm_ .. Ji ' _______________ i
- 254 mm 2
v r
Back La er
y Page — 1 Page - 2 Page - 3 Page - 4
mmun.umum " ““““ u ĩnưỈAuỈ-Aĩmĩcỉm_ _ _ _ __ '_ _ _ _ Ĩuĩttnrìttĩ-M _cỉan_ _ _ _ _ lưumưr-mneụgnume
., ' ' ~ !evu ' Wu your doctorlHultt cu: pmvtoer's uetaiis hdow ' ~_
ẨblfflVẩlỏẵiblũtấ USP ! - mrtues: oi tunth. som ttưoat orcmnh ' bomotlHemh cm provndur: ...l Abanvir COốỈÌPỈỈITIÓS USP
me | - namea ot vnmttnu ơ mnhoua or :hdom'nal min tiet [ I'm
'" ~ iỊmdttreĩĩt uịaAcịrịsỉ nịỉmịynto'etlzịsitl … I.wl F 'rnẳỀựẫ "'Ịị” “=f'f'ưă "Í “lằmlúh VW "I'm cn… ' … , , . ~n permanr-nrf
m … Abac m| de tu | [ you isc mo 1 : :B 0 te m | nm ve: uu : u nuuncyunl % W … w…g
tmẵỄ ỄlioỀc maỄm) wỀcfflu : ẳằằiẫ'ảĩi'ẫ ii'iằẵềi mm lffli WE Abacanr Tim ~ … °"… ²NCW Wilth "* ……l hWúìii M' iẳaiun ơ'mẸẵểiẫỄm (mam atitỉqỉĨnve) ui mt mmỀ 14
Ame Tatmts g linud gmdicu again es within Inm you nly emenence : ltte- tnremlnq | | B
pnth con ìmminu a W… htood Wa… or mm. mu by ln ụ…tc vttd en ca du potnute m tuihmunt.
@ “VW '~"’°'"°"“ “”"“ nunmz lumanumm VImIE nem ou muninsnin A
it
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Nếu cần thêm thông tin, xin hỏi ý kiến bác sĩ. ,;ỄfĨĨ'j—Ềạ
. ló /~ ử;Ồ
Thuỏc nảy chỉ dùng theo đơn bác sĩ. II ';._~l 'r*\`
. 4.14 . y \
ABACAVIR TABLETS USP 300 mg \-jẬ ẹíj
gỤ²>
Thảnh phẫn
Mỗi viên nén bao phim chứa abacavir sulfat tương đương abacavir 300 mg.
Tả dược: Ceilulose vi tinh thể, silica keo khan, magnesi stearat, tinh bột natri giycolat, vảng opadry
03B82849.
CÁC ĐẶC ĐIÊM DƯỢC LÝ
Các đặc điểm dược lực học
Nhóm trị liệu dược: chất ức chế enzym sao chép ngược nucleosid (NRTI)
Mã ATC: JOSAFOó
Cơ chế tảc dụng: Abacavir là một chất ức chế men sao chép ngược.Nó có khả năng ức chế có chọn
lọc HiV—l vả HIV-2, kể cả HIV-l giảm nhạy cảm với zidovudỉn, lamivudin, zalcitabin, didanosin
hoặc nevirapin. Abacavir được chuyển hóa trong tế bảo thảnh dạng hoạt động là carbovir 5’-
triphosphat (TP). Những nghiên cứu in vítro cho thấy cơ chế tảo động cùa thuốc lá ức chế men sao
chép ngược của HIV, dẫn đển kết thúc chuỗi vả lảm giản đoạn quá trình sao chép cùa virus.
Abacavir cũng thể hiện tảc dụng hiệp đồng vởi nevirapin vả zidovudỉn ìn vitro. Điều đó được thể
hiện khi kết hợp thêm với didanosin, zalcitabỉn, lamivudin vả stavudin.
Kinh nghiêm sử dung trong lâm sânz
Việc khẳng định lợi ich cùa abacavir chủ yếu dựa trên các kểt quả nghiên cứu được thực hiện trên
bệnh nhân trưởng thảnh chưa từng được điều trị khảng retrovirus sử dụng liệu phảp abacavir 300 mg
2 lần mỗi ngảy kết hợp với zidovudỉn vả lamivudin.
Uống hai lần (300mg) mỗi ngảy:
' Liêu phảp_đối với người trường thảnh chưa từng điều tri
Ở người trưởng thảnh được điều trị bằng abacavir kết hợp với lamivudin vả zidovudỉn, tỷ lệ bệnh
nhân có nồng độ virus dưới mức đo được (<400 bản sao/mL) xấp xỉ 70% (phân tich quá trình điếu
tri trong 48 tuần) với sự tăng tương ứng nồng dộ tế bảo CD4.
Một nghiên cứu ngẫu nhiên, mù kép có đối chửng placebo ở người trưởng thảnh đã so sảnh sự kết
hợp abacavỉr với lamivudin vả zidovudỉn với sự kết hợp indinavir, lamivudin vả zidovudỉn. Do tỷ lệ
cao cùa việc ngừng sớm (42% số bệnh nhân ngừng điều trị ngẫu nhiên ở tuần thứ 48), không có một
kết luận chắc chắn nảo về tương đương điều trị của .cảc liệu phảp ở tuấn 48. Mặc dù thấy có tảo dụng
kháng virus tương tự cùa hai liệu pháp chứa abacavir vả indinavir trong số các bệnh nhân có nồng
độ virus thấp dưới mức do được (S400 bản sao/mL); theo phân tích trước điều trị (ITT), là 47% so
với 49%; theo phân tich sau điều trị (AT), lả 86% so với 94% tương ứng với kết hợp thuốc chứa
abacavir vả indinavir).
Trong một nghiên cứu đa trung tâm, mù kép có đối chửng (CNA3OOZ4), 654 bệnh nhân nhiễm HIV
chưa từng điều trị khảng retrovirus được sử dụng ngẫu nhiên abacavir 300 mg hai lần mỗi ngảy hoặc
zidovudỉn 300 mg hai iần mỗi ngảy, cả hai đều được kết hợp với iamivudin 150 mg hai iần mỗi
ngảy vả cfavirenz 600 mg một iẩn mỗi ngảy. Thời gian điểu trị mù kép là 48 tuần. Trong cảc đối
tượng trước điều trị (ITT), 70% bệnh nhân thuộc nhóm abacavir, 69% bệnh nhân thuộc nhóm
zidovudin có đảp ứng khảng virus đạt nồng độ 5 so bản sao/rnL ở tuần thứ 48 (điếm đảnh giá về
khác biệt trong điều trị: 0,8; 95% CI — 6,3; 7,9). Theo phân tich sau điếu trị (AT), sự khảo biệt giữa
hai phương phảp điều trị là rõ rảng hơn (88% ở nhóm abacavìr, so với 95% ở nhóm zidovudỉn (điếm
đảnh giá về khảc biệt trong điều trị: -6,8, 95% Cl -11,8; -7.9). Tuy nhiên, cả hai phân tích ]ả tương
đồng với kết luận cả hai liệu pháp đều có tác dụng không thấp.
Liêu pháp dối vởi trẻ em chưa từng đỉều tri khảng retIovỉrus
Trong một nghiên cứu so sánh không mù (có hoặc không có mù nelfi.navir) cảc kết hợp thuốc NRTI
ở trẻ em, một tỷ lệ iớn được đỉều trị bằng abacavir vả iamivudỉn (71%) hoặc abacavỉr vả zidovudỉn
(60%) dạt được mức nồng độ HIVl RNA 400 bản sao/mL sau 48 tuần, so sảnh với nhũng trẻ cm
điều trị bằng lamivudin vả zidovudỉn (47%) [p=0,09, theo phân tích trưởc điều trị). Tương tụ, trẻ em
được điều trị bằng kết hợp thuốc có chứa abacavir đạt tới nồng độ HIVl RNA 50 bản sao/mL sau 48
tuần chiếm tỷ lệ lớn hơn (53%, 42% và 28%, tương ứng p=0,07].
Liêu ohán đối với bênh nhân đã tùng điều t_r_i khảng retrovìrus
Ở người lớn có phơi nhiễm t…ng bình với cảc iiệu pháp khảng retrovirus, việc bổ sung abacavir vảo
liệu phảp kết họp thuốc kháng retrovirus đã cho lợi ích vừa phải đối với nồng độ virus (biến dối
trung binh 0.44 log… bản sao/mL, sau 16 tuần điều trị)
ò nhũng bệnh nhân dã điều trị mạnh từ trưởc bằng NRTI thì hiệu quả của abacavir l'ất thấp. Mức giá
trị của iỉệu phảp đìều trị kết hợp mới sẽ tùy thuộc vảo bản chất và thời gỉan cúa quá trình đỉểu ti-i
trước đó mà có thế chỌn lọc đối với cảc chủng …v — 1 để khảng chéo với abacavir.
Uống một lần (600 mg) mỗi ngảy:
Liêu phản dối với người trưởng thânh
Liệu phảp abacavir một lần mỗi ngảy được thực hiện trong nghỉên cứu đa trung tâm, mù kép có đối
chứng trong 48 tuần (CNA3 002) trên 770 bệnh nhân trưỏng thảnh nhiễm HIV chưa từng được điếu
trị bằng khảng retrovirus. Những đối tượng nảy chủ yếu là nhũng bệnh nhân nhiễm HIV nhưng
không có triệu chứng (CDC mức độ A). Họ được uống ngẫu nhiên abacavir 600 mg một lẳn mỗi
ngảy hoặc 300 mg hai iần mỗi ngảy. Thảnh công trên iâm sảng thu được là tương đương ở cá hai
nhóm (điểm đảnh gỉá đặc biệt trong điều trị -1,7; 95% -8,4; 4,9)_ Từ những kết quả nảy, có thế kết
iuận với độ tin cậy 95% là sự khảo biệt thực tế không quá 8,4% với ưu thể thuộc về liệu pháp hai iần
mỗi ngảy. Sự khảo biệt nảy đủ nhỏ để rút ta kết Iuận h iệu quả của liệu phảp Sử dụng abacavir một
lần mỗi ngảy lâu dải (lâu hơn 48 tuần) hiện còn hạn chế.
Liêu pháp đối với bênh nhân đã điều tri khảng_rẹtrovirus
Trong nghiên cứu CAL3000I, 182 bệnh nhân đã gặp thất bại trong điều trị kháng virus từ trước
được uốn g ngẫu nhiên hoặc kết hợp iiễu cố định abacavirllamivudin một iần mỗi ngảy hoặc abacavir
300 mg hai lần mỗi ngảy kết hợp với iamivudin. 300 mg một lẩn mỗi ngảy, cả hai nhóm đều được
Mỹ
kết hợp với tenofovir và một thuốc PI hoặc một thuốc NNRTI trong 48 tuần. Những kết quả chỉ ta
rằng những nhóm dùng viên kết hợp liều cố định có hiệu quả không thắp hơn so với nhóm abacavir
hai iần mỗi ngảy, dựa trên sự giảm tương tự HIV-l RNA được đo bằng giá trị cơ sở tối thỉều cùa
diện tích dưới đường cong (AAUCMB, -1,65iogin bản sao/mL so với -1,8310g10 bản sao/mL, tương
ứng 95%C1 -0,13; 0,38). Cảo tỷ lệ đạt HIV-l RNA < 50 bản sao/mL (50% so vởi 47%) và <400 bản
sao/mL (54% so vởi 57%) cũng tương đương ở mỗi nhóm (nhóm cảc dối tượng ITT). Tuy nhỉên, do
trong nghiên cún nảy chí có nhũng bệnh nhân dã được điều trị múc độ trung bình cùng với sự mẩt
cân bằng nỗng độ vỉrus cơ sở giữa cảc nhóm dỉều tti, những kết quả trên cần được giải thich thận
trọng.
Các đặc tinh được động học
Hấp lhu; Abacavir được hấp thu tồt và nhanh khi dùng uống. Sinh khả dụng tuyệt đối là 83%. Thời
gian để đạt được nồng độ cao nhất trong huyết tương trung binh (Tmax) cửa abacavỉr là 1,5 giờ đối
vởi dạng viên và khoảng 1 giờ đối với dạng dung dịch.
Với liều điều tti 300 mg z iầningảy, trung bình (CV) trạng thái ổn định giữa cmax vả c…… cúa
abacavir xấp xỉ 3,00 ụg/mL (30%) vả 0,01 ụg/mL (99%) tương ứng. AUC trung binh (CV) đối vởi
một liều trong khoảng thời gian 12 giờ lả 6,02 ụg.gỉờ/mL (29%), tương đương Vởì AUC hằng ngảy
xấp xỉ 12,0 ụg.giờlmL. Giá trị Cnmx của đung dịch uống thì hơi cao hơn cùa Viên nén. Sau một liều
viên nén abacavir 600 mg, giá trị trung bình (CV) Cmax cùa abacavir xấp xỉ lả 4,26 ụg/mL (28%) và
AUC trung bỉnh là 11,95 ụg.giờ frnL (21%).
Thức ãn lảm chậm hấp thu và Iảm giảm Cmax nhưng không lảm ảnh hưởng đến nỗng độ trong huyết
tưong (AUC). Vì vậy có thể dùng abacavir kèm thức ăn hoặc không.
Phân bố: Sau khi tiêm tĩnh mạch, thể tich biểu kiến phân bố khoảng 0,8 l/kg, điều đó chứng tỏ rằng
abacavir thấm một cách tự do vảo cảc mô trong cơ thể.
Những nghiên cứu trên bệnh nhân nhiễm HIV đã cho thấy sự thấm rất tốt của abacavir vảo dich năo
tủy (SCF), với tỷ số dịch năo tủy/huyết tương từ 30 dến 44%. Nồng dộ đỉnh quan sảt được gấp 9 iần
le0 của 0,08 ụgx'mL abacavir hoặc [).26 ưM khi abacavir được dùng vởi liều 600 mg 2 lần/ ngảy.
Những nghiên cứu in vitro về gắn với protein huyết tương chỉ ra rằng abacavir gắn với protein huyết
tương rất thấp cho tởì trung bình (~49%) với nồng độ điều trị. Điều đó chỉ ra khả năng thấp về tương
tảo vởi cảc thuốc khảo thông qua sự chiếm chỗ trong protein huyết tương.
Chuyển hóa: Abacavir chuyển hóa chủ yểu tại gan, với xấp xỉ 2% liều uống được đảo thải qua nước
tiểu dưới dạng không đối. Những con dưòng chuyển hóa cơ bản ở người bởi alcohol dehydrogenase
và bởi sự glucuronyl hóa để tạo ra S’-glucuronid vả 5’-carboxyciic acid chiếm tới 66% liều uống.
Cảo chất chuyền hóa nảy được đảo thải qua nước tiếu.
Thải' trừ: Thời gian bản thải trung bình cùa abacavir là 1,5 giờ. Không có dấu hiệu tích tụ abacavir ở
những liều tiếp theo 300 mg 2 1ần/ngảy. Thải tttt abacavir thông qua chuyền hóa tại gan với sự đảo
thải tiếp theo của cảc chất chưyển hóa chủ yếu qua nước tiếu. 83% Abacavir được đảo thải qua nước
tiểu dưới dạng chuyến hóa hoặc không đối. Phần còn lại được đảo thải qua phân.
Wt’V
Các đăc tính dươc đông hoc trong tế bảo
Trong một nghiên cứu trên 20 bệnh nhân bị nhiễm HIV được điều trị bằng abacavir 2 lằn/ngảy với
dùng một liều soc duy nhẩt 24 giờ trước khi lấy mẫu. Thời gian bản thải trong tế bảo cùa dẫn chẳt
cuối cùng carbovir triphosphat trong trạng thái ốn định là 20.6 giờ, so với thời gian bản thải cấp số
nhân là 2.6 giờ của nghiên cửu. Liều 600 mg 1 lần/ngảy cũng được mong là có động học ttong tế
bảo như vậy_ Những dữ liệu nảy ủng hộ việc dùng abacavir 600 mg 1 ]ần/ngảy để điều tti bệnh nhân
nhiễm HIV. Hơn nữa hiệu quả cùa abacavir dùng 1 lần/ngảy đã được chứng minh trong môt nghiên
cứu quan trọng.
Cảo quần thể đặc biệt
Suy gan: Abacavir được chuyền hóa chủ yếu qua gan. Dược động học của abacavir dã được nghiên
cửu ở những bệnh nhân suy gan nhẹ (điềm Chiid-Pugh 5-6) được điều trị với lỉều 600 mg ]
lẩn/ngảy. Kết quả chỉ ra tằng, có sự tăng trung bình AUC lên L89 lần [1,32; 2,71 vả thời gian bản
thải tăng 1,58 lần [1222;2,041. Không có khuyến cảo giảm liều ở bệnh nhân suy gan nhẹ do sự phơi
nhiễm abacavir có sự thay đối đảng kể.
Suy thận: Abacavir được chuyến hóa cơ bản tại gan với khoảng 2% được đảo thải qua nước tiểu
dưới dạng không đối Dược động học cùa abacavir trên bệnh nhãn suy thận giai đoạn cuối thì tương
đương với bệnh nhân có chức năng thận binh thường. Vì vậy không cẳn giảm liều ớ bệnh nhân suy
thận. Do kinh nghiệm sử dụng còn hạn chế, nên trảnh dùng abacavir ở bệnh nhân suy thận giai đoạn
cuối.
Trẻ em: Theo những thử nghiệm lâm sảng đã được thực hiện ở trẻ em, dạng dung địch uống được
hấp thu nhanh và tốt. Cảo thông số về dược động học là tương đương giữa trẻ cm và người lớn, với
sự dao động lớn hcm về nồng độ trong huyết tương. Liễu khuyến cảo đối vởi trẻ em trên 3 thảng cho
tó'i 12 tuồì iả 8 mg/kg 2 iần/ngảy. Liều nảy sẽ iảm tăng nhẹ nồng độ trung bình trong huyết tương,
đảm bảo rằng phần iớn sẽ đạt được nồng độ đỉều trị tương đương với iiều 300 mg 2 lần/ngảy ở
người lớn.
Thỉếu cảc đủ iiệu an toản để khuyến cảo sử dụng viên nén abacavir suifat cho trẻ em dưới 3 thảng
tuối. Những dữ iiệu còn hạn chế chỉ ta rằng liều 2 mg/kg ớ trẻ mới sinh ít hơn 30 ngảy tuồi sẽ mang
lại AUCs tương đương hoặc lớn hơn, so với liều 8 mg/kg được dùng cho trẻ lớn hơn.
Người giải: Dược động học của abacavir chưa được nghiên củu ở nhũng bệnh nhân trên 65 tuổi.
Dữ liệu an toản tỉền iâm sảng
Abacavir không gây đột bĩến trên cảc thử nghiệm ở vi khuẩn nhưng có hoạt tính ín vitro với thử
nghiệm sai lệch nhiễm sắc thể của tế bảo lympho người, thử nghiệm khối u bạch huyết chuột nhắt vả
trong thử nghiệm vi nhân. Đỉều nảy phù hợp với cảc hoạt tính đã biết của các chất tương tự
nucleosid. Những kết quả nảy chứng tỏ rằng abacavir it có khả năng gây tốn thương nhiễm sẳc thế
cả trên Jĩn vitro vả in vivo ở nồng độ thù nghìệm cao.
Các nghiên cưu về tính gây ung thư của abacavir đường uống ở chuột nhắt thí nghiệm và chuột cống
cho thấy sự gia tăng ớớ liên quan của cảc khối u ảc tính và khối u không ác tinh. Các khối u ảc tính
xuất hiện ở tuyến bac qui đầu của giống đực và tuyến âm vật ở giống cái ở cả hai loảỉ, vả ở tuyến
giáp của chưột cống đực và ở gan, bảng quang, hạch lympho và mô dưới da của chuột cống cái.
_)m/Ờ
Phẩn lớn các u nảy xuất hiện khi dùng liều abacavir cao nhất 330 mg/kg/ngảy ở chuột cống vả 600
mglkg/ngảy ở khỉ, ngoại trừ khối 11 tuyến bao qui đầu xuất hỉện Ở liều 110 mg/kg ở chuột nhắt. Mức
độ phơi nhiễm với cơ thế mà không gây ảnh hưởng ở chuột cống và khi tưong đương 3 — 7 iần mức
độ phơi nhiễm ở người trong quá trình điều trị, những dữ liệu nảy gợi ý rằng nguy cơ gây ung thư ở
người thẳp' hơn iọi ích lâm sảng.
Trong nhũng nghiên cứu độc tính học lâm sảng, điều trị bằng abacavir lảrn tăng trọng lượng gan ở
chuột cống và khi. Sự liên quan về lâm sảng là chưa rõ. Không có những bằng chứng từ những
nghiên cứu cho thẳy abacavir gây độc với gan. Hơn nữa, sự tự cảm úng của chuyền hóa abacavir
hoặc sự cảm ủng chuyến hóa của cảc thuốc khảo được chuyển hóa qua gan chưa dược quan sảt ở
người.
Sự thoải hóa cơ tim nhẹ ở chuột thi nghỉệm và chuột cống đã được phảt hiện khi dùng abacavir
trong hai năm tiếp theo. Phơi nhiễm toản thân gắp 7 - 24 iẩn phơi nhiễm toản thân ở người. Mối liên
quan vởi iâm sảng của những phảt hiện nảy chưa được xác định.
Trong những nghiên cứu về độc tính với sỉnh sản, độc tinh với phôi vả bảo thai đă được phảt hiện ở
chuột cống nhưng không thấy ở thỏ. Những phát hiện bao gồm giảm trọng lượng bảo thai, phù bảo
thai, và sự gia tăng những thay ớộikiị dạng cột sống, chết luu trong tử cung và sinh thai chết. Không
thể kết luận về khả năng gây quải thai cùa abacavir vi độc tinh với phôi thai cùa nó. Một nghiên cứu
về khả năng sinh sản ở chuột cống chi ra rằng abacavir không ảnh hưởng đến khả năng sinh sản ở
giống đực và cái.
CHỈ ĐỊNH
Viên nén abacavir được chỉ định dùng kết hợp với cảc thuốc kháng retrovirus khác để điều trị bệnh
nhân nhiễm HIV.
LIÊU LƯỢNG VÀ CÁCH DÙNG
Abacavir nên dược kê dơn bởi bảc sỹ có kinh nghiệm điều trị HIV.
Người lón vả trẻ em trên 12 tuối: Liều khuyến cảo lả abacavìr 600 mg mỗi ngảy. Có thể uống mỗi
lằn 300mg (một viên) hai iần mỗi ngảy hoặc uống một lẩn 600 mg (hai viên).
Bệnh nhân chuyền sang phảc đổ ] Iần/ngảy nên uống 300 mg 2 lần/ngảy trong ngảy hôm trưởc và
chuyển sang viến 600 mg vảo buồi sáng tỉếp theo. Nếu hay dùng iỉều duy nhất vảo buối tối, nên
uống abacavir sulfat 300mg vảo buốì sảng đầu tiên, tiếp theo lá 600 mg vảo buổi tối. Khi thay đồi
ngược lại iiệu phảp 2 lầnfngảy bệnh nhân phải uống hết thuốc của ngảy hôm trước và bắt đầu bằng
300 mg 2 lần/ngảy vảo buối sáng tiếp theo.
Trẻ … lừ nt 3 lháng đến 12 tuổi: Liều khuyến cảo iả 8 tng.fkg 2 lầnlngảy cho tới liều cao nhất là 600
mg/ngảy.
Trẻ em dưới 3 tháng: Những dữ iiệu về sử đụng abacavir sulfat ở đối tượng nảy còn rất hạn chế.
Abacavir sulfat có thế được uống kèm theo thức ăn hoặc không kèm theo thức ăn.
Có sẵn dạng dung dịch uống dảnh cho trẻ em và những người không dùng được dạng thuốc viên.
Suy thận: Không cẩn thiết điều chỉnh liều abacavỉr ớ bệnh nhân suy thận Tuy nhiên trảnh dùng
abacavir ở người suy thận giai đoạn cuối.
Suy gan: Abacavir được chuyền hóa chủ yếu tại gan. Chưa có liều khuyến cảo cho bệnh nhân suy
gan nhẹ. Không có dữ liệu đối với những bệnh nhân suy gan mức độ trung bình, do vậy không
khuyến cảo dùng abacavir ở những bệnh nhân nảy trừ trường hợp thật sự cần thiết. Nếu bệnh nhân
bị suy gan mửc độ nhẹ và trung bình thì phải theo dõi thật sát, và nếu có thế thì nên theo dõi nồng độ
abacavir trong huyết tương. Chống chỉ định abacavir ở những bệnh nhân suy gan trung bình đến
nạng.
Người giả: Không có những dữ liệu về dược động học ở những bệnh nhân trên 65 tuối.
CHỐNG CHỈ ĐỊNH
Chống chỉ định dùng abacavir ở những bệnh nhân có tiến sử quá mẫn với abacavir hoặc với bất cứ
thảnh phần nảo của thuốc.
Chống chỉ định abacavir ở những bệnh nhân suy gan trung binh đến nặng.
CẢNH BÁO VÀ THẬN TRỌNG
Phản ứng quả mẫn
Trên iâm sảng khoảng 5% bệnh nhãn được điều trị bằng abacavir có xuắt hiện phản ửng quá mẫn,
một vải trường hợp có đe dọa đến tinh mạng và dẫn tới tử vong vì vậy phải thận trọng khi sử dụng.
Những phản ứng quả mẫn được mô tả bởi sự xuất hiện cùa những triệu chửng Iiên quan tới nhiều hệ
thống cơ quan. i-lằu hết tất cả cảc phản ứng quả mẫn đều có sốt vả/hoặc nồi ban.
Các dẳu hiệu vả triệu chứng khác có thế bao gồm nhũng dấu hiệu hô hẩp và những triệu chửng khó
thớ, đau họng, ho và những dẳu hiệu bất thường trên phim x quang (chủ yếu là thâm nhiễm ian tỏa,
có thể khu trú), triệu chưng dạ đảy ruột như buồn nôn, nôn, đi ngoải, hoặc đau bụng, và có thể dẫn
tới chẩn đoán nhầm phản ứng quả mẫn với một bệnh hô hấp khác (như viêm phổi, viêm phế
quản, vỉêm hầu họng), hoặc viêm dạ dảy ruột. Những dẩn hiệu và triệu chứng thường quan sảt
thấy ở phản ứng quả mẫn có thế bao gồm li bì, mệt mỏi và cảc triệu chửng cơ xương khớp (đau cơ,
hiếm khi tiêu cc, đau khớp).
Các triệu chứng do phản ửng quả mẫn sẽ nặng iên nếu tiếp tục đùng thuốc và có thể đe dọa tinh
mạng. Nhữn g triệu chúng nảy thường biến mất khi ngừng thuốc.
Những bệnh nhân được chấn đoán có phản ứng quả mẫn trong quá trình điều trị phải ngừng
abacavir ngay lập tửc.
Ahacavir KHÔNG BAO GIỜ được sử dụng lại ở những bệnh nhân trước đó đã phải ngừng
điều trị do phản ứng quả mẫn. Dùng iại abacavir sau một phản ứng quá mẫn thúc đẳy sự xuất hiện
triệu chứng trong vòng vải giờ. Sự tái phảt nảy thường nặng hơn iẩn xuất hiện đầu tiên, và có thể đe
dọa tính mạng và tử vong.
Đế trảnh chậm trễ trong chần đoản và giảm thiếu nguy cơ phản ứng quả mẫn đe đọa tính mạng, phải
ngừng abacavir vĩnh viễn nếu không ioại trừ được tinh trạng quá mẫn, thậm chí khi c-ảc chẩn đoản
khảo là có thể (bệnh hô hẳp, cảm cúm, viêm dạ dảy ruột hoặc phản ửng với cảc thuốc khác).
Cần thiết phải chăm sóc đặc bỉệt nhũng bệnh nhân được bắt đầu điều tư bằng abacavir vả cảc thuốc
khảc đã được gây độc da (như lá thuốc ức chế sao chép ngược không phải nucleosid-NNRTIs) bởi vì
khó phân biệt phảt ban là do những thuốc nảy hay do những phản ứng quả mẫu với abacavir gây ra.
Điều trí sau khi có sư Eiản đoan trong liêu pháo điều trí bằng viên nén abacavir sulfat
Nếu quá trình điều tti bằn g viên nén abacavir bị gián đoạn vì bất cứ lý do gì và bắt đầu điều trị iạỉ là
cần thiết, lý do ngừng thuốc phải được đánh giả xem iiệu bệnh nhân có bất cứ triệu chứng nảo của
phản ứng quá mẫn không. Nếu không thể` loại trừ được phản ửng quá mẫn thì không được dùng
lại abacavir hoặc bẩt cử thuốc nâo có chứa abacavir (chẵng hạn như Kivexa, Trizivir).
Những phản ứng quá mẫn xuất hiện rẩt nhanh, bao gổm những phản ứng đe dọa tinh mạng,
đã thấy khi dùng lại viên nén abacavir cho nhũng bệnh nhân mà chỉ có một trong những triệu
chứng chủ yếu cũa quả mẫn (nổi ban trên da, sốt, các triệu chứng dạ dảy ruột, hô hẫp hoặc
các triệu chứng toản thân như lơ mơ, mệt mỏi) trước khi phải ngùng viên nén abacavir suli'at.
Triệu chửng đơn độc phổ bỉến nhất của những phản ứng quả mẫn là nổi ban. Hơn thế nữa rẩt
hiểm có những phản ứng quả mẫn được báo cản ở những bệnh nhân được dùng lại thuốc, và ở
những người không có những triêu chứng của phãn ửng uuá mẫn trước đó. Trong tất cả các
trường họp, nếu dùng lại abacavir, thì bệnh nhân phải được uống thuốc tại một nơi có sẵn cảc biện
pháp cẩp cún.
Những thông tin cần thỉết cho bệnh nhân
Bảc sĩ kê toa Dhảỉ đảm bảo rằng bệnh nhân được thông bảo đẫy đủ những thông tin về phản
ứng quá mẫn. Bệnh nhân phải được cảnh báo Về khả năng xảy ra phản ứng quả mẫn với abacavir
và nó có khả năng đe dọa tính mạng hoặc tử vong.
Những bệnh nhân có xuất hiện những triệu chửng liên quan đến 1 phản ứng quả mẫn phải THÔNG
BÁO cho bảc sĩ cũa họ NGAY LẬP TỬC. Nhũng bệnh nhân quả mẫn với abacavir phải được
nhắc nhớ rằng họ không bao giờ được uống viên nén abacavir suifat hoặc bất cứ thuốc nảo có chửa
abacavir (chẳng hạn như Kivcxa, Trizivir). Để trảnh dùng lại Viên nén abacavir ở những bệnh nhân
có tiền sử quá mẫn với abacavir phải thu hồi iại số thuốc còn lại cùa bệnh nhân.
Khuyên nhũng bệnh nhân phải ngùng abacavir vì bắt cứ iỷ do nản, và đặc biệt ở những bệnh nhãn
do phản ứng phụ của thuốc hoặc đau ốm, phải liên iạc với bảc sỹ điều tti ttước khi dùng iại thuốc.
Bệnh nhân phải được thông báo thường xuyên Về tầm quan trỌng cùa việc uống thuốc abacavỉr
suifat.
Nhiễm acid lactỉc: Nhiễm acid iactic, thường liên quan đến gan to và hoại tử gan nhiễm mỡ đã được
thông bảo Với Việc dùng các chất giống nuclcosid. Cảc triệu chứng sớm (tăng iactat trong mảu có
triệu. chứng) bao gồm cảc triệu chứng tiêu hóa iảnh tinh (buồn nôn, nôn và đau bụng), mệt mới vô
cớ, ăn kém ngon, Sút cân, cảc triệu chứng hô hấp (thớ nhanh vảlhoặc sâu) hoặc những triệu chứng
thần kinh (bao gồm yếu bản vận động).
Nhiễm acid lactic có tỷ lệ tử vong cao và có thể liên quan đến vỉêm tụy, suy gan, suy thận. Nhiễm
acid lactỉc nói chung xuất hiện sau một vải thảng cho đến hản g thảng sau điều tti.
Nên ngừng điều trị các chắt tương tự nucicosid ở những bệnh nhân có tăng 1actat mảu vả toan
chuyến hóaỉlactic, gan to tiểu triền nhanh hoặc tăng nồn g độ aminotransferase nhanh chóng.
Nên thận trọng khi dùng cảc thuốc tương tự nucleosid cho bất kì bệnh nhân nảo (nhất iả những phụ
nữ béo) có gan to, viêm gan hoặc các yếu tố nguy cơ đã biết đối với bệnh gan và gan nhiễm mỡ (bao
gồm cảc sản phẩm thuốc nảo đó và rượu). Những bệnh nhân đồng nhiễm vìêm gan c và điều trị
bằng interfcron alpha vả ribavin có thể gây ra các nguy cơ đặc biệt khảo.
Bệnh nhân có nguy cơ cao nên được theo dõi sát.
Rối loạn chức năng cơ lhể: Các chắt tương tự nuclcosid vả nucleotỉd đã được chửng minh in vitro
và in vivo lả gây hủy hoại ty thể ớ nhiều mớc độ khảc nhau. Đã có những bảo cảo về rối loạn chức
năng ty thế ở trẻ nhỏ HIV âm tỉnh phơi nhiễm trong tử cung vả sau khi sinh với cảc chất tương tự
nucleosid. Cảo tác dụng bất lợi chính được bảo cảo lá các rối loạn huyết học (thiếu máu, giảm bạch
cầu trung tinh), các rối loạn chuyển hóa (tăng lactat mảue tăng lipasc máu). Những tảo đụng có hại
nảy thường in nhất thời. Đã có báo cáo một số rối ioạn thần kinh khới phảt muộn (tăng trươn g lực,
co giật, rối ioạn hảnh vi). Hiện vẫn chưa xác định được liệu cảc tối ioạn thần kinh là tạm thới hay
vĩnh viễn. Bất cứ trẻ nảo có phơi nhiễm trong tử cung vởi cảc chắt tương tự nucleosid vả nucleotid,
ngay cả với trẻ HIV âm tinh, đều phải được theo dõi về mặt lâm sảng và xét nghiệm và nên thăm dò
đầy đủ về khả năng rối ioạn chức năng ty thế trong trường hợp có cảc triệu chứng liên quan. Những
phát hiện nảy khớng ảnh hưởng đển các khuyến cảo quốc gia hiện nay về sử dụng điều tti khảng
retrovirus ở phụ nữ mang thai để phòng ngừa iây truyền HIV dọc.
Loạn dưỡng mỡ và các chất bẩt thường chuyển hóa; Điếu trị khảng rctrovirus kết hợp đã iiên quan
đến sự tải phân bố mỡ cơ thể (loạn dưỡng mỡ) ở cảc bệnh nhân HIV. Hậu quả lâu dải của những tảc
nhân bất lợi nảy hiện còn chưa rõ. Hiếu biết về cơ chế nảy vẫn còn chưa đầy đù. Đã có giả thuyết về
iiện quan giữa bệnh tích mỡ nội tạng với chất ức chế proteasc (Pi) vả teo mở với cảc chắt ức chế
men sao chép ngược (NRTI). Nguy cơ loạn dưỡng mỡ cao hơn liên quan đến cảc yếu tố cá nhân như
tuối giả và vởi cảc yếu tố liên quan đến thuốc như thời gian điều trị khảng rctrovirus lâu hơn vả cảc
rối ioạn chuyền hóa kèm theo. Thăm khảm lâm sâng nên bao gồm việc đánh giá cảc dấu hiện thưc
thế cùa sự tải phân bố mỡ. Nên xem xét đến việc định lượng lipid huyết thanh vả giucosc mảu lúc
đói. Nên xử trí các rối loạn lỉpid sao cho thích hợp về mặt lâm sâng.
Đã có những bảo cảo về tỉ lệ thất bại cao về mặt virus học vả cùa sự hiện điện của tình trạng kháng
virus trong giai đoạn sớm khi kết hợp abacavir vởi tenofovir dis0proxil fumarat vả lamivudin như iả
một iiệu PhãẸ điều trị 1 lần/ ngảy.
Nhổt' máu cơ Iim: Trong một thử nghiệm dịch tễ học, tiền cứu, quan sát được thiết kế để điều tra tỷ
lệ nhồi mảu cơ tim (MI) ở những bệnh nhân đang điều trị bằng thuốc kháng retrovirus kết liợp, việc
sử dụng abacavir trong vòng 6 tháng trước đó có tương quan với việc tăng nguy cơ MI. Trong một
phân tich gộp cảc thử nghiệm lâm sảng được thực hiện với sự tải trợ, cho thẳy không có nguy cơ
tăng MI ở nhũng bệnh nhân điều trị vởi abacavir so với nhóm chứng. Nhìn chung, những dữ iiệu thu
được từ nghiên cứu đoản hệ quan sảt và thử nghiệm lâm sảng không thuyết phục.
Như một biện pháp phòng ngừa, nguy cơ tiềm ẳn của bệnh tim mạch vảnh nên được xem xét khi chỉ
đinh điệu tti với thuốc khảng tcttovitus, bao gồm abacavir, vả hảnh động để giảm thiều tắt cả cảc
yếu tố nguy cơ có thể đỉều chinh được (ví dụ: tăng huyết áp, tăng lỉpỉd máu, đải thảo đưòng, hủt
thuốc lả).
Viêm tụy: Viêm tụy đã được bảo cảo, nhưng liên quan tới abacavir lá không chắc chắn.
Liệu pháp kết hợp 3 nucleosid: Những'bệnh nhân có nỗng độ virus cao (>100,000 bản sao/ ml) cân
nhắc kết hợp 3 loại nuclcosid abacavir, iamivudỉne vả zidowdine là thật sự cần thiết.
Đã có những báo cảo về ti lệ thất bại cao Về mặt virus học và của sự hiện dìện cùa tình trạng khảng
vỉrus trong giai đoạn sớm khi kểt hợp abacavir với tenofovir đisoproxil fumarat vả lamivudin như iả
một liệu phảp điều trị i Iần/ ngảy.
Uống ] lần mỗi ngảy (abacavír 600 mg): Lợi ích của việc dùng abacavir 1 iần/ ngảy chủ yếu dựa
trên nghiên cứu kết họp efavỉrcnz vả Iamivudỉn ở bệnh nhân trường ihảnh chưa được điểu trị khảng
retrovirus.
Bệnh gan: Độ an toản và tinh hiệu quả cùa viên nén abacavir chưa được xảc lập ở những bệnh nhân
eớ tới Ioạn bệnh lý nèn ở gan dảng kế. Chống chi định dùng viên nén abacavir ớ những bệnh nhân
suy gan nặng. Bệnh nhân víêm gan B hoặc C mạn tính và được điều trị bằng thuốc khảng rctrovirus
kết hợp có nguy cơ cao bị cảc tảo dụng bất lợi ở gan nặng và có nguy cơ tử vong. Trong trường hợp
điều trị kháng virus đồng thời cho viêm gan B hoặc C cũng xin xem thông tin sản phấm liên quan
đối với cảc sản phấm thuốc nảy.
Bệnh nhân có rối loạn chức nãng gan từ trước trcng đó có viêm gan mạn tính thể hoạt động có tần
suất rối loạn chức năng gan tăng cao khi điều trị khảng retrovirus kểt hợp vả nên theo dõi kỹ lưỡng.
Nếu có bằng chỉ… g bệnh gan xắu đi ở nhũng bệnh nhân nảy thì phải xem xét tạm ngừng hoặc ngừng
hẳn điều trị.
Một nghiên cứu về dược động học đã dược thực hiện trên nhũng bệnh nhân suy gan nhẹ. Tuy nhiên,
một khuyến cảo chắc chẳn về giảm liều lá không thể có bởi vì sự thay đồi đảng kế cùa phơi nhiễm
với thuốc trong quần thế bệnh nhân (xem phần 4.2). Những dữ iiệu an toản cùa abacavir ở bệnh
nhân suy gan còn rất hạn chế. Do sự gỉa tăng tiềm tảng phơi nhiễm (AUC) ớ một số bệnh nhân nên
cẩn phải theo dõi sảt. Không có những dữ liệu có giá trị đối vởi những bệnh nhân suy gan nhẹ và
trung bình. Nồng đô abacavir trong huyết tương tăng một cách thực chất ớ những bệnh nhân nảy. Vì
vậy không khuyến cảo dùng abacavir cho những hệnh nhân suy gan mức độ trung bình trừ trường
hợp thật sự cần thiết và phải theo dõi sảt. Chống chỉ định abacavir đối với những bệnh nhân suy gan
nặng.
Suy thận: Chống chỉ định abacavir đối với nhũng bệnh nhân suy thận giai đoạn cuối.
Hội chứngphục hồi mìễn dịch: Ở những bệnh nhân nhiễm HIV có suy giảm miễn dịch nặng tại thời
điểm bắt đầu được điều trị bằng iiệu phảp khảng virus kết hợp (CART), một phản ứng viêm không
triệu chứng hoặc với các tác nhân gây bệnh cơ hội còn lại có thể tăng lên vả gây ra tình trạng iâm
sảng trầm trọng, hoặc lảm nặng thêm triệu chứng. Thông thường những phản ứn g nảy thường được
phảt hiện trong vòng một vải tuần hoặc một vải thảng đằu khi bắt đầu điều trị bằng CART. Những ví
dụ có lìên quan iả viêm võng mạc do cytomegalovz'rus, nhỉễm Mycobacterium toản thân vảfhoặc cục
bộ, viêm phổi do Pneumocytis carz'nii. Bất cứ triệu chửng viêm nảo đều phải được đảnh giả, thăm
khám vả điều trị tương ứng khi cằn thiết.
iƯĨừ
Nhiễm nt:mg … hội: Những bệnh nhân đuợc điều trị bằng abaoavir hay bất kì thuốc khảng virus nảo
khác vẫn có thề mắc nhiễm trùng cơ hội vả cảc biến chứng khác của nhiễm mv. Vì vậy những bệnh
nhân nảy phải được theo dõi Sát bởi các bảo Sĩ có kinh nghiệm điểu trị nhũng bệnh có liên quan tởi
HIV.
Sự lan truyền bệnh: Phải khuyên bệnh nhân rằng, liệu phảp kháng virus hiện tại, bao gồm cả viên
nén abacavir sulfat, ohưa được chửng minh Về khả năng ngãn ngừa nguy cơ iây truyền HIV qua
quan hệ tình dục và máu bị nhiễm HIV. Nên có biện pháp dự phòng thích hợp.
TƯỢNG TÁC VỚI CÁC THUỐC KHÁC vÀ CÁC DẠNG TƯỚNG TÁC KHÁC
Dựa trên kết quả thực nghiệm in vitro và hiếu biết về oon đường ohuyến hóa chinh cùa abacavir, khả
năng tương tác qua trung gian P450 với cảo thuốc khảo liên quan tới abacavir iả thẳp. P450 không
đóng vai trò chinh trong chuyến hóa cùa abacavir vả abaoavir không ức chế chuyển hóa qua
CYP3A4. Abacavir cũng đã được chứng minh in vitro lá không ức chế cảo enzym CYP3A4,
CYP2C9 hoặc cvp2no với nồng độ liên quan với lâm sảng. Không thấy có cảm ứng chuyển hóa ớ
gan trong oảc thử nghiệm iâm sảng. Vì vậy rất ít khả năng abacavir tương tảo với cảc kháng vims ức
Chế protease vả cảo thuốc khảo được ohuyến hóa bởi Cảo enzym P450. Cảo nghiên cứu lâm sảng đã
ohứng minh rằng không Có sự tường tác đáng kể về mặt lâm sảng giữa abacavit, zidovudỉn vả
lamỉvudin. Những thuộc có ảnh hưóng đến hệ thống enzym như rifampicin, phcnobarbital vả
phenytoin Có thế lảrn giảm nhẹ nồng độ của abacavir trong huyết tương đối với UDP-glucuronyl
transfcrases.
Ethanol: Chuyến hóa cùa abacavir bị thay đổi khi dùng chung vởỉ cthanol kết quả là sự gia tăng
AUC oủa abacavir lên khoảng 41%. Nhũng phảt hiện nảy không quan trọng về mặt lâm sảng.
Abacavir không ảnh hưởng đến chuyển hóa của ethanol.
Methadon: Trong một nghiên oứu về dược động học, dùng chung abacavir 600 mg 2 lầnfngảy với
methadon iảm giảm 35% cmax vả ti—ẽ ] giờ Tmax nhưng AUC không thay đổi. Nhũng thay đối về
dược động học cùa abacavir không có ảnh hướng đến iâm sảng. Trong nghiên cứu nảy, abacavir lảm
tăng độ thanh thải toả.n thân trung bình cùa methadon iên 22%, vì vậy không loại trừ khả năng cảm
ửng các enzym ohuyển hóa thuốc. Bệnh nhân được điểu trị bằng methadon vả abacavir nên được
theo đội chặt chẽ để phát hiện cảc triệu chứng cai thuốc cho thắy liều methadon iả chưa đđ, đội khi
phải ohuẩn iại nồng độ methadon.
Retz'noid: Phức hợp retinoid được thải trừ bằng khử hydro chức rượu (với aicohol dchydrogenase).
Tương tảo với abacavir [ả có thế nhung chưa được nghiên cứu.
MANG THAI VÀ CHO BÚ
Mang thai: Không khuyến cáo sử dụng viên nén abacavir trong thòi kì mang thai. Tính an tcản của
abacavỉr ở phụ nữ có thai chưa được đảnh giả. Sự qua nhau thai oủa abacavir vả cảc chất chuyến hóa
trung gian đã đuợc phảt hiện ớ động vật. Đã thấy độc tinh đối với sự phát triển cùa phôi và bảo thai
ở ohuột cống, nhưng không thắy ở thò. Chưa đảnh giá được khả năng gây quải thai của abacavir từ
những nghiên cứu trên động vật.
Wiz
/
Cho con bú.“ Abacavir và chất chuyển hóa của nó được tiết ra trong sữa chuột. Người ta cho rằng nó
cũng sẽ đi vảo trong sữa người, mặc dù diều đó chưa được xảo nhận. Chưa có những dữ iiệu an toản
khi dùng abacavir oho trẻ dưới 3 tháng tLIỔÌ. Khuyến oảo người mẹ không cho con bú khi đang điều
trị bằng abacavir . Ngoài ta khuyến cáo rằng người tne bị nhiễm HIV thì không cho con bú dù bất cứ
iỷ do gì để trảnh lây truyền mv cho con.
ẢNH HƯỞNG TỚI KHẢ NĂNG LÁI XE VÀ VẬN HÀNH MÁY MÓC
Chưa có những nghiên cứu về ảnh hưởng cùa thuốc tới khả nãng vận hảnh tâu xe vả máy móc.
CÁC TÁC DỤNG KHÔNG MONG MUỐN: Quá mẫn
Trong oảc nghiên cứu iâm sảng, xấp xỉ 5% bệnh nhân được đỉều trị bằn g abacavir có phản ứng quả
mẫn. Tỉ lệ xuất hiện phản ứng quả mẫn được bảo cảo iả như nhau khi dùng abacavir 600 mg
] lần/ngảy và 300 mg 2 lầnf'ngảy.
Một Vải phản ứng quá mẫn đe dọa đến tính mạng và tử vong mặc dù đã được khuyến cảo là phải
thận trọrig. Nhũng phản úng nảy đặc trưng bời sự xuất hiện cùa những triệu chứng suy đa phủ tạng.
Hầu liết bệnh nhân bị phản ứng quả mẫn dếu oó sốt vảÍhoặc nồi ban. Thường lả những ban dát sần,
nồi mảy đay tuy nhiên có những phản ứng mà không có ban hay sốt.
Dấu hỉệu vả triệu ohúng của phản ủng quá mẫn được ]iột kê dưới đây. Những triệu chứng nảy được
tìm ra trong quả trính nghiên cứu hoặc do theo dõi sau khi sản phấm được dưa ra thị trường. Những
triệu chứng xuất hiện ở ít nhẩt 10% số bệnh nhân với dấu hiệu quả mẫn được in đậm.
_Ễường tiêu hóa Buồn nôn, nôn, đi ngoảỉ, đau bụng, loét miệng.
Đường hô hắp _ Khó thở, ho, đau họng, ARDS, suy hô hấp
Triệu chứng khác ; Sổt, ii hi, khó chịu, bệnh hạch bạch huýết’,’tụt huyết ảp.
Ể viêm kết mạc, sốc phản vệ.
Thần kinh/ Tâm thần " Ì Đau đầu, đi cảm`
Huyết học “ Giảm lympho bậio
_Gan/ Tụy : Tăng enzym gan, viêm gan, suỹ gan
cớ ’ ; Đau cơ, hiếm khi tẻớ eo, đau khớp, tãng CK
Tiết niệu i Tăng crehtinin, suy thận _
Nỗi ban (theo trình tự 81%ễớizới 67%) vả biễu hiện ớ đường tiêu hóa (theo trình tự 70% so
với 54%) thường được báo cảo ở trẻ em so vởi người lớn.
Một số hệnh nhân có phản ửng quả mẫn iúc đầu được cho in viêm dạ đđv tuột, bệnh hô hấp (viêm
phối, viêm phế quản, viêm họng) hoặc cảm cúm. Sự chặrn trễ trong chẩn đoản dẫn tới việc tiểp tục
dùng hay dùng lại viên nén abacavit sưlfat, dẫn tới phản ứng quả mẫn mạnh hơn hoặc tử vong. Vì
vậy với những bệnh nhân có trìệu chứng cùa những bệnh trên thì phải chú ý cẳn thận xem có phản
ửng quả mẫn hay không.
Những triệu chửng quá mẫn thường xuất hiện trong vòng 6 tuần đầu tiên (thời gian xuất hiện trung
bình iả 11 ngảy) sau khi điều trị bằng abacavir , tuy nhiên những phản ửng nảy có thể XUắt hiện bất
cứ khi nảo trong quả ttinh điều tti. Bệnh nhân phải được theo dõi sát, hội chẩn 2 tuần! lần đặc biệt
W
trong hai tháng đầu điều trị.
Chưa xảo định được cảc yếu tố nguy cơ có thể tiên đoán được sự xuất hiện hoặc mức độ nặng của
tinh trạng quá mẫn với abacavir. Tuy nhiện, có một sự chắc chắn lả điều trị ngắt quãng sẽ iảm tăng
nguy cơ hình thảnh sự mẫn cảm và vì vậy lảm xuất hiện các triệu chửng iâm sảng của những phản
ứng quá mẫn. Vì vậy phải khuyên bệnh nhân dùng thuốc đều đặn.
Dùng iại abacavir sau một phản ứng quá mẫn thúc đẳy sự tái xuất hiện triệu chứng trong vòng vải
gỉờ. Sự tái phát nảy thường nặng hơn lẩn xuất hiện đầu tiên, và oó thể đe dọa tính mạng và tử vong.
Phải ngừng ahacavir sulfat ở những bệnh nhân có tiền sử quá mẫn và không bao giờ được
dùng ]ạỉ.
Đế trảnh chậm trễ trong chấn đoán và giảm thiểu nguy cơ phản ứng quả mẫn đe dọa tính mạng, phải
ngùng dùng viên nén abacavir sulfat vĩnh viễn nếu không loại trừ được tình trạng quá mẫn, thậm chí
khi các chần đcán khảo lả có thể (bệnh hô hẩp, cảm cúm, viêm đạ dảy ruột hoặc phản úng với cảo
thuốc khảo).
Những phản ửng quả mẫn xuất hiện ngay iặp tửc, bao gồm những phản ứng đe dọa tinh mạng
xuất hiện ở những bệnh nhân được dùng lại viên nén abacavir, những người mã có một trong
những triệu chứng chủ yếu cũa quả mẫn (nổi ban trên da, sột, các triệu chứng dạ dăy ruột, hô
hẫp, hoặc cảc triệu chứng toản thân như li bì, mệt mỏi) trước khi phải ngừng viên nén
abacavìr sulfat. Triệu chửng đơn lẻ phổ hiến nhất của những phẩm ửng quá mẫn là nối ban.
Hơn thế nữa, rẫt hiểm có những phân ứng quá mẫn được báo cảo ở những bệnh nhân được
dùng lại thuốc, và những người không có những trìêu chứng của nhản ứng quả mẫn trước đó.
Tron g tắt cả cảc trường hợp, nếu ra y iệnh dùng 1ại abacavir, thì bệnh nhân phải được uống thuốc tại
một đơn vị có sẵn nhản viên y tế hỗ ttợ.
Phải khuyến cảo đối với mỗi bệnh nhân vê phản ứng quả mẫn cùa abacavir.
Do rắt nhiềưtảc dụng phụ đă được thông báo, rẩt khó xảo định xem nó có phải do abacavir gây ra
hay do các thuốckhảc được sử dụng để điếu tti HIV hay là hậu quả cùa quá trinh tiến triển cùa bệnh.
Nhiều triệu chứng đã đuợc hệt kê ở ttện thường xuất hiện (buồn nôn, nông đi ngoải, sốt, ii bi, nồi
ban) ở những bệnh nhân quả mẫn với abacavir. Vì vậy phải đảnh giả xem liệu hiện tại oó phản ưng
quá mẫn ở những hệnh nhân có những triệu chứng trên. Những bệnh nhân đã phải ngùng abaoavir
suifat do nhũng triệu chửng trên thì quyết định dùng lại cảc thuốc có chứa abacavir phải được thực
hiện tại nơi có sẵn hỗ trợ y tế. Rất hiếm trường hợp xuất hiện hồng ban đa dạng, hội chứng Steven
Johnson hoặc hoại tử da nhiễm độc được bảo cảo, không thế loại trừ tình trạng quá mẫn ở những
bệnh nhân nảy. Phải ngừng vĩnh viễn những thuốc có chứa abacavir ở những bệnh nhân nảy.
Tẩn suất các phản ứng bắt lợi liệt kê dưới đây được xảo định tth quy ước như sau: rắt hay gặp (2
1/100,<1f10); không hay gặp (21/1000,<1/100); hiếm (21/10000,<1/1000); rất hiếm (<1/10000).
Những rối loan dinh dưỡng và ohuvến hóa
Thường gặp: ohán ăn
Những rối loan thần kinh trung ương
Thường gặp: đau đầu
Những rôi loan tiêu hóa
Thường gặp: buồn nôn, nôn, đi ngoải
Hiếm gặp: viêm tụy
Cảo rối ioan da và mô dưới da
Thường gặp: nổi ban (không có triệu chứng hệ thống)
Rất hiếm: hồng ban đa dạng, hội chứng Steven Johnson hoặc hoại tử đa nhiễm độc
Cảo rối ioan toản thân và tai nơi dùng thuốc
Thường gặp: sốt, li bì, mệt mòi
Những trường hợp nhiễm acid lactic có thế tử vong thường gặp ở bệnh nhân gan to và hoại tử gan,
đă được bảo cảo ở những người sử dụng các chất tương tự nucleosid.
Loan dưỡng mỡ và các bất thường chuvến hóa: Điều trị kháng retrovirus kết hợp có liên quan đến sự
tải phân bố mở cơ thể (ioạn dưỡng mỡ) ở các bệnh nhân HIV bao gồm mất mỡ ngoại vi và mỡ dưới
da mặt, tăng mỡ bụng vả tạng, phì đại vú và tich tụ mỡ sau gáy (gù trâu).
Điều trị khảng retrovirus kết hợp liên quan tới những rối loạn chuyến hóa như tăng triglycerid mảu,
tăng cholestcro] mảu, khảng insulin, tăng đường máu và tăng Iactat máu.
Ở những bệnh nhân nhiễm HIV có suy giảm miễn dịch nặng tại thời điểm bắt đẩu được điều tii bằng
liệu phảp khảng virus kết hợp (CART), một phản ứng viêm không triệu chủng hoặc các nguồn bệnh
oơ hội còn lại có thể tăng lên.
QUÁ LIÊU
Những liều đơn abaoavir lên tởi 1200 mg và những liều hằng ngảy lên tới 1800 mg đă được dùng
oho bệnh nhân trong cảc thử nghiệm lâm sảng. Không Có phản ứng không mong muốn được bảo
cảo. Hiệu quả của iiều oao iả chưa rõ rảng. Nếu quá lỉều thì bệnh nhân phải được theo dõi cảo dấu
hiệu nhiễm độc, và điều trị hỗ trợ tiêu chuẩn phải được ảp dụng khi cần thiết. Chưa rõ liệu abaoavir
có thể ioại bò bằng thấm phân phúc mạc hay lọc mảu hay không.
HẠN DÙNG: 60 tháng kế từ ngảy sản xuất.
BẢO QUẦN : Bảo quản ở nơi khô mảt, không quá 30°C. Bảo quản trong bao bì gốc.
ĐÓNG GÓI: Hộp 1 lọ x 60 viên nén
ĐỀ IẺOầỈ tầm tay tyẻ em. Không đùng_thuốc quá hạn sử dụng.
Thông báo cho bảo sĩ những tác dụng bất lợi gặp phải khi sử dụng thuốc. Ẩ\`
Sản xuất bởi: .Ệ?
Myian Laboratories Limited ';
F—4 & F-12, MIDC, Maiegaon, Tal. Sinnar, Nashik 422113 Maharashtra State, Ấn Độ
TUQ.CỤC TRUỦNG
P.TRIỦNG PHÒNG
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng