









/
ỦY BAN NHÂN DÂN TP. HỒ CHÍ MINH
CÔNG TY CỔ PHẦN DƯỢC PHAM PHONG PHÚ
CỘNG HÒA XÃ HỘI CHỦ NGHĨA v1Ệr NAM
Độc lập - Ĩựdo - Hạnh phúc
Ngảy .›Zđ..tháng. .QỒ nảm 2013
DUYỆT at
°Ốfềfĩf/
DS. Hồ Vinh Hien
MẦU HỘP: 3 ví x 10 viên /,tt, A _ …
VIÊN NÉN BAO PHIM XELOCAPEC
KÍCH THƯỚC (D x R x c1: 120mm x 35mm x 70mm ,, BÒ Y TẾ
35mm 120mm CỤC QUẢN LÝ DƯỢC
_ ĐA PHE DUYỆT
x RX Thuốc bán theo đơn GMP-WHO
i 0 m Lân dâu:eeẠeẮjmoluujcuue/unAcễuuu
N :
ị ẹ, ổ Xelocapec …
\ Ế Ô Capecitabine 500mg ®1
5“ m FiIm-ooated tablets 70mm ’
“’ -c
01
O
ẵ g Ễ ` Hộp3vỉxtOvièn nén bao ph1m
Ể _
e * *~~* t * ,
. cơnemức: BẢOQUẦN:
Mỏivtènnónủơphlmchưũ Nơikhớhoáng.tránhánhsảngnhiộtđộ }
Capedene… . 500mg dưửiâữ’C. t
taớwc ............................................. mvđtvien _ _ _ g
cacthongtmknớoxtnơocttonghuớngơản 35mm .
Ễiiiẵịẫii: cAcn nùuc cnóue st’zdunơữmMoo. ỉ '
Xinđoctmngtờhướngdănsừđung. ỊỄắCHUANITCCS iầũ Ổ
_ 1' ìẶ_ .
o KÊ
'\
0 g Ễ 0 m ,
1 Ở 0 Ề Ô E 1
o 1 G 0 i
1 1²- … = 1 0. 8
1 m ẵ ẵ' ` tư 2
0 g ,< 0 Zõ
: 8
o 0 E 0 .õ
_ g @
0 @ _ ã
x 0 Ở o
o ,, * ><
Siuita':OifỏfflTiỹỏfflWỢtfflfflũffl ollAtAuuvntuì ý Í
muivsmxutmợcmiuuummm ……nzmư~…
I.ôll.dttờngsõớffliiầniạo,QữidtũnĩPi-ffl mu…m
Số!ô sx :
Cữgtytữqký:fflĩVĩtliltlfflffl NSX
563|38140th111ả11?14Q11ỡ110me HD
CN.CTY CP- DP PHONG PHÚ CỘNG HÒA XÃ HỌ! CHỦ NGHĨẠ VIẸT NAM
NHÀ MÁY SX DP USARICHPHARM Độc lập Tự do Hạnh phuc
MẦU: VÍ 10 viên
VIÊN NÉN BAO PHIM XELOCAPEC
105 mm
— 64mm
capec Xelocapec Xelocapec Xelocapec Xeloc
citabine Capecitabine Capecitabine Capecitabine Capecit
500 mg 500 mg 500 mg 500
CNCóngtyCồphầnDượtphẩmPhongPhủ c…
Nhã máy Sán tuát Dược Phấm us1mcnmmt Nhã máy
Capecitabine Capecitabine Capecitabìne
500 mg 500 mg 500 mg
Ngảy 715 tháng 7 năm 2013
DUYỆT
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Nếu cần thêm thông tin xin hoi ý kiến t/tẩy thuốc.
Chỉ dùng thuốc nảy t/teo sự kê dơn của thầy thuốc.
XELOCAPEC
(V ỉên nén dải bao phim Capecitabin)
THÀNH PHÀN:
Mỗi viên nén dải bao phim XELOCAPEC chứa:
Capecitabin ......................... 500 mg
Tá dược: Lactose. HPMC. Natri starch glycolat. Magnesi stearat, Microcrystallin cellulose HPMC 606. Titan
dioxyd, PEG 6000. Mău Erythrosin lake, Cồn 96" Nước Iinh khiết.. .vừa đủ ] viên.
ĐẶC TÍNH nuợc LỤC HỌC.
"° Cơ Chế Hogt Đảng
- Capecitabine lả dẫn xuất t1uoropyrimìdỉne carbamate dược đìều chế để dùng đường uống, lá thuốc độc tế
bâo được hoạt hóa bời khối u vả chọn lọc trên khối u.
- Capecitabine không phải lả chắt độc tế bảo trên invỉtro. Tuy nhiên, trên invivo, thuốc được biến đổi liên
tiếp thảnh chất gôc độc tế bảo iả 5— iiuorouracil (5- FU), chất nảy sẽ được chuyển hóa tiếp.
. - Sự hinh thảnh 5- FU tại khối u nhờ xức tảc một cách tối ưu của yêu tô tạo mạch liên quan tới khối u lả
thymidine phosphorylase (dTthase), nhờ đó lâm giảm tối đa mức độ cùa mô lânh với 5— FU trong cơ thề.
- Các tế bảo binh thường và cảc tế bảo khối u chuyển hóa 5- FU thảnh 5 — i1uoro- 2- deoxyuridine
monophosphate (FdUMP) và 5- fiuorouridine triphosphate (FUTP). Những chắt chuyển hóa nảy sẽ iảm tôn
thương tế bảo bằng hai cơ chế. Đầu tiên, FdUMP vả đổng yêu tô folate N5- 10- methylenetetrahydrofolate
gắn với thymidylate synthase (TS) tạo nên một phức hợp gôm ba yếu tố đồng hóa trị. Sự gắn kết nảy sẽ ức
chế sự hình thảnh thymidylate từ uracỉl Thymidylate lả một tiến chất cần thiết cùa thymidine triphosphate,
một chất cần thiết cho sự tông hợp DNA, vì vậy sự thiếu hụt hợp chất nảy có thế ức chế sự phân chia tế
bảo. Thứ hai, cảc men sao chép nhân có thế kết hợp một cảch nhẩm lẫn FUTP thay vì uridine triphosphate
(UTP) trong quá trình tồng hợp RNA. Lỗi chuyển hóa nảy có thể ảnh hướng tới sự tổng hợp RNA vả
protein.
ĐẶC TỈNH DƯỢC ĐỘNG HỌC:
.;. Hấe u…
- San khi uộng, capecitabine được hấp thu nhanh chóng và rộng khắp, sau đó được chuyển hóa mạnh thảnh
chât chuyên hóa 5’ -deoxy- --5 fluorocytidine (5' -DFCR) và 5 DFUR Dùng cùng với thức ân lảm giám tỉ lệ
hấp thu capecitabine, nhưng chỉ ảnh hưởng rất it tới diện tích dưới đường cong (AUC) cùa 5 DFUR và
chất chuyền hóa tiêp theo cùa nó là 5- FU Với liều 1250mg/m2 vảo ngảy thứ 14 sau khi ăn, nồng độ đinh
' huyết tương (C,… tính bằng ug/ml) cho capecitabine 5' -DFCR, 5' -DFUR, 5- FU vả FBAL tương ứng lả
4, 47, 3, 05, 12, 1, 0 95 và 5,46. Thời gian đẽ đạt tới nông độ đỉnh huyết tương (T.… tính bằng giờ) tương
ứng là 1,50, 2,00, 2,00, 2,00 và 3, 34. Giá irị AUCM tinh bằng ug-hlml tương ứng là 7,75, 7,24, 24,6, 2.03,
và 36,3.
02° Phân ehối
> Găn kẻI với protein
- Các nghiên cứu huyết tương trên ỉn — vitro đã chứng minh rầng tỉ lệ gắn kết protein của capecitabine, 5` -
DFCR, 5` -DFUR và 5- FU lẩn lượt là 54%. 10%. 62% và 10%, chủ yêu gắn với albumin.
v Chuỵển hóa
— Capecitabine được chuyền hóa đầu tiên bời men carboxylesterase ở gan thảnh 5’ -DFCR, chất nảy sau đó
được chuyền thảnh 5 -DFUR bới cytidine deaminase, lả men tập trung chủ yếu ở gan và mô khối u.
- Sự hình thảnh 5- FU xảy ra chủ yêu tại vi tri khối u bời yêu tố tạo mạch có liên quan đến khối u 1ả
dTthase, do đó Iảm giảm tối đa mức độ cùa mô lảnh với 5- FU trong cơ thể.
- AUC huyzết tương của 5- FU thấp hơn 6 đến 22 lần nồng độ sau khi truyền tĩnh mạch nhanh 5- FU (1ỉếu
600mg/mZ ). Các chất chuyền hóa của capecitabine chỉ trở nên có độc tính sau khi chuyển thảnh 5- FU vả
cảc chất đổng hóa của 5- FU.
5-FU được chuyến hóa tiếp thảnh cảc chất chuyển hóa khỏng có hoạt tính dihydro — S-t1uoruracil (FUHZ),
5-fluoro-ureidopropionic acid (FUPA) vả a-fiuoro-B-alanine (FBAL) thông qua dihydropyrímidine
dehydrogenase (DPD), chẳt nảy mang tính chuyển hóa chặm.
1/9
j)…ạ
l
0? Đâo thải
- Thời gian bản thải (t… tinh bằng giờ) cùa capecitabine, 5’-DFCR, 5’-DFUR, 5-FU vả FBA1_. tương t'mg iả
0,85; 1,1 1; 0,66; 0,76 và 3,23. Dược động học của capecitabine được đánh giá trên khoảng Iiêu lả 502-3514
mglmz/ngảy. Cảo thông số cùa capecitabine, 5’-DFCR vả 5’-DFUR được đo vảo ngảy đâu tiên và ngảy 14
1ả như nhau. AUC của 5-FU lả 30%-35% cao hơn vảo ngây 14, nhưng không tăng lên `sau đó (ngảy 22). Tại
Iiếu điếu tri, dược động học của capecitabine và các chất chuyên hỏạ cùa nó tỉ lệ với liêu, trừ _5-FU. `
- Sau khi uống. cảc chât chuyền hóa của capecitabine được tìm thây chủ yêu trong nước tiêu, 95,5% liêu
capecitabine được dùng tim thẩy trong nước tiểu. Bâi tiết trong phân rât ít (2,6%). Chât chuyên hóa chinh
có trong nước tiếu lả FBAL, chiếm 57% Iiều dùng. Khoảng 3% liêu dùng được đảo thải trong nước tiêu
dưới dạng thuốc không đối.
› Chế độ điều trị kết họp
- Các nghiên cứu pha ! đảnh giả tác động của Capecitabin lên dược động học cùa hoặc docetaxel hoặc
paclitaxel và ngược lại cho thẩy Capecitabin không tác động lên dược động học cùa docetaxel hoặc
paclitaxel (C,… và AUC) vả docetaxel hoặc paclitaxei cũng không tác dộng lên dược động học của 5`-
DFUR (chất chuyền hóa quan trọng nhắt của capecitabine).
.;. Dư_ơc đậng th ở dân số đặc biệt
- Phân tỉch dược động học dân số được tiến hánh sau khi diều trị Capecitabin ở 505 bệnh nhân bị ung thư đại
trực trảng ớ Iiêu 1250mg7m² hai lần mỗi ngảy. Giới tinh, có hoặc không có di căn ở gan lủc ban đâu, đánh
giá tống trạng Kamofsky, bilirubin toản phân, albumin huyết thanh, ASAT vả ALAT không có tác động có
ý nghĩa thống kê lẽn dược động học cùa 5'-DFUR, 5-FU vả FBAL.
> Bệnh nhân bị suy gan do di căn ở gan
- Không ghi nhặn tảc động có ý nghĩa lâm sảng cùa capecitabine lẽn hoạt tính sinh học vả dược động học
trẽn những bệnh nhân ung thư có chức năng gan giảm từ nhẹ dến trung bình do di cản ở gan .
- Không có dữ Iiệu dược động học trên những bệnh nhân suy gan nặng.
> Bệnh nhản bị suy thận
- Dựa vảo nghiên cứu dược động học trên những bệnh nhân ung thư bị suy thận mức dộ từ nhẹ đến nặng,
không thấy bằng chứng về sự tảc động cùa độ thanh thải creatinine lẻn dược động học của thuốc nguyên
thùy vả 5—FU. Nghiên cứu cho thấy độ thanh thải creatinine có ảnh hưởng đến mức đó tiếp xúc toản thân
với 5’- DFUR (AUC tãng 35% khi dộ thanh thải giảm 50%) và với FBAL (AUC tăng 1 14% khi độ thanh
thải `creatinine giảm khoảng 50%). FBAL là chất chuyển hóa không có hoạt tính chống tăng sinh; 5’-DFUR
lả tỉên chât trực tiểp cùa 5-FU .
› Ngườigiả
- Dựa vảo phântich dược động học dân số, baọ gồm những bệnh nhân có khoảng tuổi rộng ( từ 27 đến 86
tuõi) và bao gôm 234 (46%) bệnh nhân có tuôi 65 trở lên, cho thấy tuối không ânh hưởng dến dược động
học của 5’-DFUR vả 5'_-FU. AUC_ cùa FBAL tăng theo tuối ( tuổi tăng 20% lảm AUC cùa FBAL tăng
15%). Sự tăng nảy có thế do thay đôi chức nảng thặn.
> Chủng tộc
- Dựa vảo phân tích dược động học dân số cũa 455 bệnh nhân da trắng t90,1%), 22 bệnh nhân da đen t4,4%)
vả 28 bệnh nhân của cảc chủng tộc hoặc săc tộc khác (5,5%). dược động học của những bệnh nhân chùng
da đen không khác dược động học ở chủng người da trắng
cni ĐỊNH:
72° Ung thư vú '
… Xelocapec phôi hợp với docetaxel được chỉ định để điều trị những bệnh nhân ung thư vú tiển triển tại chỗ
hoặc di căn sau khi thât bại với hóa trị liệu độc tế bảo. Liệu pháp điều trị trước đây bao gồm anthracycline.
Xelocapec cũng được chi đinh như'đơn trị liệu cho điều trị những bệnh nhân ung thư vú tiến triển tại chỗ
hoặc di cãn sau khi thât bại với chê độ hóa trị bao gồm anthracycline vả taxane hoặc cho những ung thư
khảo mã không có chi đinh dùng anthracyline.
02° Ung thư đại trgg trảng
' Xelocapec được chi đình điều tri hổ trợ cho những bệnh nhân ung thư đại tráng sau phẫu thuật.
- Xelocapec được chi đinh điêu tri cho những bệnh nhân ung thư đại trực trảng di căn.
'2' Ung !hưdg dâỵ ' '
- Xelocnpecphôi hợp với hợp chât platin được chỉ định điều trị bưởc một cho nhũng bệnh nhân ung thư dạ
dảy tiên triên.
uèu DÙNG - CÁCH DÙNG:
#3 Liều chuẩn '
Nên uông Xelocapec với nước trong vòng 30 phút sau khi ăn.
2/9
> Đơn trị :
' Ung thư đại trục tròng và ung thư vú ` _ .
- Liều đơn trị được khuyến cảo của Xelocapec lả 1250mg/m2 dùng hai iân môi ngảy (sảng vả tỏi;
tương đương với 2500mg/mz tổng liều mỗi ngây) trong 14 ngảy sau đó là 7 ngảy nghi thuôo.
› Điểu tri kết họp
' Ung thư vú:
— Trong trường hợp phối hợp với docetaxel, liếu khời đầu khuyến cảo cùa Xelocapec lả 1250mg4m2 hai
lần mỗi ngảy trong hai tuẫn sau đó là một tuần nghi, phối hợp với docetaer 75mgim2 truyền tĩnh
mạch trong vòng 1 giờ mỗi ba tuần. ' `
- Theo hướng dẫn sử dụng của docetaxel, thuốc chuẩn bị nên băt đâu trước khi dùng docetaxel ở những
bệnh nhân dùng Xelocapec phối hợp với docetaxel.
' Ung thư dạ dảy và ung thư đại trực trăng:
- Trong trường hợp điều trị phối hợp, iiều khuyến cáo của Xelocapec là 800 tới 1000mg/m2 dùng hai
lần mỗi ngảy trong hai tuần sau đó 7 ngây nghi thuốc, hoặc 625mg/m2 , 2 lần mỗi ngảy khi điêu trị
Iiên tục. Các thuốc sinh phẩm khi điều trị kết hợp với Xelocapec không lảm ảnh huớng tới liêu khời
đầu của Xelocapec. `
- Thuốc chuẩn bị trước để on… bảo đủ nước và chống nôn phù hợp theo thông tin sản phâm `cisplatin
hoặc oxaliplatin nên dùng trước khi dùng cisplatin hoặc oxaliplatin cho những bệnh nhân điêu trị kêt
hợp Xelocapec với cisplatin hoặc oxaliplatin.
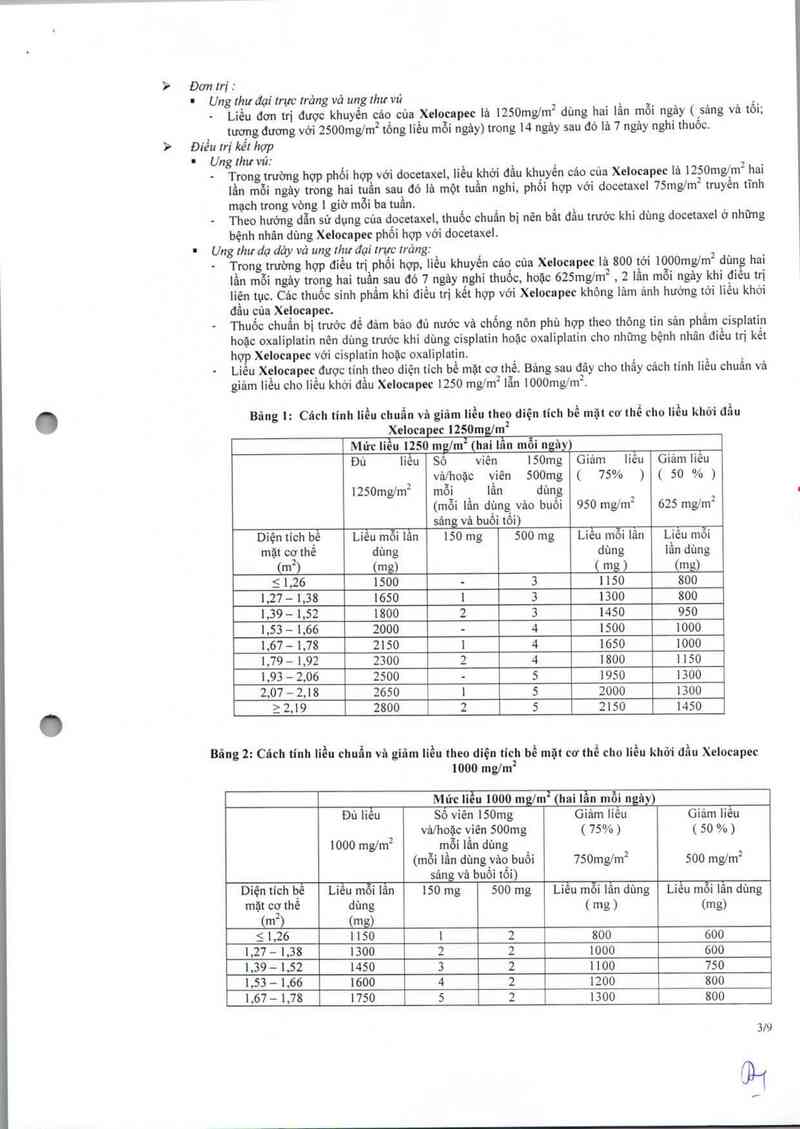
— Liều Xelocapec được tính theo diện tích bề mặt cơ thề. Bảng sau đây cho thấy cảch tính liều chuẩn và
giảm Iiều cho Iiều khởi đầu Xelocapec 1250 mg/m² lẫn 1000mg/m².
' Bảng 1: Cách tinh Iỉều chuẩn và giã… Iiều theo diện tich bề mặt cơ thể cho liều khởi đầu
Xelocapec 1250mg7m²
Mức liều 1250 ngm² (hai lần mỗi ngảy
Đủ liều Sô viên 150mg Giảm Iiêu Giảm liêu
vảlhoặc viên 500mg ( 75% ) ( 50 % )
1250mg/m2 mỗi lần dùng
(mỗi lần dùng vảo buối 950 mg/m² 625 mglm²
sảng vè buồi tối)
Dìện tích hệ Liêu mỗi lần 150 mg 500 mg Liêu mỗi lân Liêu môi
mặt cơ thê dùng dùng lần dùng
tm²1 (mJL ( ntg › (mg)
5 1,26 1500 - 3 1150 800
1,27- 1,38 1650 1 3 1300 800
1.39 - 1,52 1800 2 3 1450 950
1,53 — 1,66 2000 - 4 1500 1000
1,67 - 1,78 2150 1 4 1650 1000
1,79 - 1,92 2300 2 4 1800 1150
1,93 - 2.06 2500 - 5 1950 1300
2,07 — 2,18 2650 1 5 2000 1300
a 2.19 2800 2 5 2150 1450
Bảng 2: Cách tính Iiều chuẩn vã giãm liều theo diện tích bề mặt cơ thể cho liều khỏi đẫu Xelocapec
1000 mgltnz
Mức Iiều 1000Ẹg1m2 (hai lần mỗi ngây)
Đủ liễu Số viên 150mg Giảm liều Giảm liếu
vảlhoặc viên 500mg ( 75% ) ( 50 %)
1000 ngm² mỗi lần dùng
(mỗi lần dùng_vảo buổi 750mglm2 500 mg/m2
sángẸbuôi tối)
Diện tich b_é Liêu mỗi lân 150 mg 500 mg Liêu mỗi lân dùng Liêu mỗi iân dùng
mặt cơ thê dùng ( mg ) (mg)
(m2) (mg)
5 1,26 1 150 1 2 800 600
1,27 - 1,38 1300 2 2 1000 600
139 - 1,52 1450 3 2 1100 750
1,53 - 1,66 1600 4 2 1200 800
1,67 - 1,78 1750 5 2 1300 800
3/9
1,79 — 1,92 1800 2 3 1400 900
1,93 - 2,06 2000 - 4 1500 1000
2.07— 2,18 2150 1 4 1600 1050
Z 2.19 2300 2 4 1750 1100
4— Điều chỉnh Iiều trong quá trình điều trị
> Đíều chinh chung: ` ' `
- Độc tinh do dùng Xelocapec có thể kiếm soát bằng việc điêu trị triệu chứng vả ! hoặc sự thay đôi liêu
Xelocapec (ngừng điều trị hoặc giảm Iiều). Một khi liêu đã bị giảm thì không nến tăng ở lân sau đó,
Những độc tính được bác sĩ điều trí cân nhắc iả gân như không nghiêm trọng hoặc đe dọa mạng sông
thì điêu trị có thế được tiểp tục với Iiều ban đầu mà không cân giảm hoặc ngưng liều.
\ :
- Không khuyến cảo thay đổi Iiếu cho các tác dụng ngoại ý độ 1. Nên ngừng điêu trị vởi Xelocapec ne
cảc tác dụng ngoại ý độ 2 hoặc 3 xảy ra. Khi cảc tảc dựng ngoại ý được hỏiphục hoặc giảm ›tuông độ
1, nên bắt đâu điêu trị lại với Xelocapec với liêu ban đâu hoặc điều chinh liêu theo bảng 3. Nêu xảy ra
các tảc dụng ngoại ý độ 4, nên ngừng tạm thời hoặc ngữngyĩnh viễn điều trị cho đên_ khi cảc tác dụng
11 oai ý được hồi phục hoặc giảm xuống độ 1, và có thẻ điêu trị lại sau đó với liêu băng 50% liêu bạn
đau. Những bệnh nhân dùng Xelocapec nên được thông báo vê việc ngưng điêu trị ngay lập tức nêu
xuất hiện độc tinh mức độ trung bình hoặc xấu hơn. Không được thay thế liêu Xelocapec không dùng
vì độc tính.
- Huyết họ0: Không nên điều trị X_elocapec ở những bệnh, nhân có iượng bạch cầu đa nhân trung tinh
ban đầu < 1,5 x 10°71. vả lhoặc tiêu câu <100 x 10 lL. Nêu những đánh giá xẻt nghỉệm đột xuât t_rong
suốt một liệu trinh điều tri cho thấy độc tinh về huyết học là độ 3 hay độ 4, thì nên được ngùng điêu trị
. Xelocapec.
Bảng sau cho thấy sự thay đổi liều được khuyến cáo sau khi xuất hiện độc tính với Xelocapec:
Bản 3: Kế hoạch giảm liều Xelocapec
Mức độc tính Thay đỏi Iiêu trong một Iiệu trinh Điêu chinh liêu cho liệu trình
theo NC1C' điều trị tiếp theo(% của liều khời đẩu)
O Độ 1 Duy trì liêu Duy trì liêu
0 Độ 2
Xuât hiện lân đâu Ngừng cho đển khi hôi phục về mức 100%
Xuât hiện lân 2 độ 0-1
Xuất hiện iãn 3 75%
50%
Xuất hiện iần 4 Ngừng điểu trị vĩnh viễn
0 Độ 3
Xuât hiện lẫn đầu Ngừng cho đễn khi hôi phục về mức 75%
Xuât hiện lẫn 2 độ 01
` 50%
Xuât hiện lãn 3 Ng_ừẸg điều trị vĩnh viễn
' 0 Độ 4
xuât hiện lân đầu Ngừng đìểu tri vĩnh viễn hoặc nêu 50%
bảc sĩ cho rằng việc điếu trị sẽ mang
lại lợi ich tốt nhất cho bệnh nhân thì
tiểp tục, ngừng thuốc cho đến khi hồi
, phục về mửc độ 0-1
Xuât hiện lần 2 Nủg điêu trị vĩnh vỉễn
'Tìẽu chí độc tính thưởng gặp theo nhóm thử nghiệm lâm sảng của Viện ung thư quốc gia Canada
(NCIC CTG) ( phiên bản 1) hoặc Iiẻu chí thuật ngữ cghung cho !ác dụng ngoại ý (CTCAE) của
Chuơng trinh đảnh giá điêu tri Ung lhư, Víện ung lhư quóc gia Mỹ, phiên bán 3.0. Cho hội chứng băn
tay — bản chân vả tăng bìlìrubín máu.
> Điều trí kế! họp
Điều chỉnh liều cùa Xelocapec do độc tính khi Xelocapec kểt hợp với các thuốc khảo nên dựa theo
bảng 3 phia trên cho Xelocapec và theo thông tin kê toa cứa các thuốc khảc một cảch thích hợp nhẩt.
Khỉ băt đâu một Iiệu trình điêu trị, nêu hoãn điều trị được chỉ định cho cả Xelocapec hoặc cảc thuốc
khác, thì sau đó nên hoãn tất cả thuốc cho đến khi có những yêu cầu được dùng tất cả thuốc trở lại.
Ti'ong suôt một iiệu trình điều trị những độc tính được cân nhắc bời bác sĩ đỉểu trị mà không liên quan
đên Xelocapec ( ví dụ: độc tinh thân kinh, độc tinh ớ tai, độc tinh thần kinh cảm giảc, ứ dich {trản
dịch mảng phôi, trản dịch mảng ngoải tim} hoặc có chướng, chảy máu, thủng đường tiêu hóa,
4/9
%
1nl
protein niệu, tăng huyết ảp), điều trị Xelocapec nên được tiếp tục và điều chinh liếu của cảc thuôc
khác dựa vảo thông tin kê toa một cách thích hợp. _ . ` '
- Nếu cảc thuốc khác phải ngừng điếu tri vĩnh viễn, thì điều trị Xelocapec có thế được băt đãu lại nêu
có các yêu cầu để việc dùng trở lại Xlelocapec.
- Khuyen cảo nảy được ảp dụng cho tât cả những chỉ định và cho tất cả dân số đặc biệt.
4 Các huớng dẫn liều dùng đặc biệt
> Bệnh nhân bị suy gan do di căn gan _ ` _
' Những bệnh nhân bị suy gan nhẹ tới trung bình do di căn gan, không cân phải điêu chinh liêu khời
đầu. Tuy nhiên, nên theo dõi những bệnh nhân nảy một cách cân thặn
- Những bệnh nhân bị suy gan nặng chua được nghiên cứu.
> Bệnh nhân bị suy thận
- Trên nhũng bệnh nhân bị suy thận trung binh ( độ thanh thải creatinine: 30 — 50 ml/phủt [theo
Cockroft vả Gauitl), tại thời điếm bắt đầu điều tri, người ta khuyên cáo nên giảm còn 75% liêu bạn
đầu. trên những bệnh nhân suy thận nhẹ ( độ thanh thải creatinine: 51 — 80 mllphủt) không cân điêu
chỉnh liều ban đầu. _
- Nên theo dõi cần thận và ngừng điều trị ngay lập tức nêu bệnh nhân có các tảc `dụng ngoại ý độ 2,3,
hoặc 4 và sau đó điểu chinh liều như đã chỉ dẫn ở bảng 3 trên. Nên tạm ngừng điêu trị Xelocapec, nêu
độ thanh thải creatinine < 30 milphủt. Đỉều chinh liều cho những bệnh nhân bị suy thặn mức độ tmng
binh áp dụng cho cả việc điểu tti đơn thuần và kết hợp. Đề tinh toán liều lượng, xem bảng 1 và 2.
> Trẻ em
- Tính an toân và hiệu quả của Xelocapec ở trẻ em chưa được thảnh lập.
> Người giả
- Không cần điều chinh liều khởi đầu khi điều trị Xelocapec đơn trị. Tuy nhiên các tác dụng ngoại ý
nghiêm trọng có Iiên quan đến điều ni độ 3 hoặc 4 xuất hỉện thường xuyên hơn 6 những bệnh nhân
trên 80 tuổi so với những bệnh nhân trẻ hơn. ~ _
- Khi điều trị Xelocapec kết hợp với cảc thuốc khảo, bệnh nhân lớn tuôi 2 65 tuôì_từng trải qua những
tảc dụng thuốc ngoại ý (ADR,) độ 3 và độ 4 nhiều hơn những bệnh nhân trẻ tuõi, ADR, sẽ dẫn đên
ngừng tạm thời điều tri. Nên theo dõi cấn thận những bệnh nhân lớn tuôi. `
- Khi điều trị Xelocapec kểt hợp với docetaxel, tỉ lệ cảc tác dụng ngoại ý có liên quan đến điêu t_rị độ 3
hoặc 4 và các tảc dụng ngoại ý nghiêm trọng tăng được ghi nhận ở những bệnh nhân trên 60 tuôi hoặc
hơn. Với những `bệnh nhân 60 tuồi hoặc hơn được điều trì phối hợp Xelocapec với docetaxel, nên
giảm lỉêu khởi đâu xuống còn 75% (950mg/1112 hai lần mỗi ngảy). Đê tính toán liều lượng, xem bảng
2.
- Với những bệnh nhân 65 tuối hoặc hơn được điều trị phối hợp Xelocapec với irinotecan, nên giảm
liều khởi đầu xuống còn 800ngm² hai lần mỗi ngảy.
cnónc cni ĐINH
- Capecitabin được chống chỉ định trên những bệnh nhân được biết là quá mẫn với capecitabine hoặc với bất kỳ
thảnh phân nảo của thuôc.
- Capecitabin được chổng chỉ định trên những bệnh nhân có tiền sử cảc phản ửng nghiêm trọng và không dự
đoán trước với f1uorợpyrimidine hoặc được biết là quả mẫn với t1uorouracil.
- Capecitabin được chông chỉ định ở bệnh nhân bị suy thận nặng( độ thanh thải creatinin < 30 mllphút)
- Chống chỉ định cho các bệnh nhân trong tinh trạng dinh dưỡng kém, những bệnh nhân suy với chức năng cùa
tủyỊxương, những người bị nhiễm trùng nghiêm trọng
- Chông chỉ định trên những phụ nữ mang thai.
- Cũng như các tìuoropyrimidine, Capecitabin được chống chỉ định trên những bệnh nhân được biết lá có thiểu
hụt DPD (dihydropyrimidine dehydrogenase).
- Không nên dùng Capecitabin cùng với sorivudine hoặc cảc chất tương tự có liên quan về mặt hóa học, như lá
brivudine.
- Capecitabin được chổng chi đinh trên những bệnh nhân bị suy gan nặng (Child Pugh C)
- Nếu có chông chỉ định cùa bât ki thuốc nâo trong điều trị kết hợp, thì không dùng thuốc đó.
LƯU Ý ĐẶC BIỆT vÀ THẬN TRỌNG KHI sử DỤNG:
—:— 1… ý đặc biệt
› Tiêu chảy:
Capecitabin có thể gây tiêu chây, đôi khi nặng. Bệnh nhân bị tiêu chảy nặng nên được theo dõi cẩn
thận và nểu bị mất nước,. nên bù nước và điện giải. Nên bắt đẩu điểu trị tiêu chảy chuẩn ( ví dụ
. ioperamỉde), băng cảc thuôc thich hợp cảng sớm cảng tốt. Giảm liều nên được ảp dụng khi cần thiết.
› Mât nươ'cg
- Mât nước nên được ngăn chặn _hoặe điều chinh đủng lủc. Những bệnh nhân chản ăn, suy nhược, buồn
nôn, nôn hoặc tiêu chảy có thẻ mắt nước một cách nhanh chóng. Nếu mắt nước độ 2 ( hoặc cao
5l9
®i
(
hơn) xuất hiện, nên ngừng điều trị Capecitabin ngay iập tức vả mất nước được hiệu chinh. Không nên
điều trị iại cho đến khi bệnh nhân vẫn còn mât nước và bât kỷ nguyên nhân sớm nảo gây ta phai được
' À
hiệu chinh hoặc kiêm soát. Nên đieu chinh liều cho những tảc dụng ngoại ý đến sởm khi cân thiêt .
OZ~ Thận trọng
> Độc tính trên tim mạch:
- Ghi nhận được ở Capecitabin cũng tương tự độc tính ghi Inhận được ở các t'luorinated pyrimidine
khác. Những độc tính nảy bao gồm nhổi mảư cơ tim, đau thăt ngực, ròi loạn nhịp tim, ngừng tim, suy
tim và thay đổi về điện tâm đồ. Những tác dụng ngoại ý nảy thường gặp hơn ở những bệnh nhân có
tiễn sử bệnh mạch vảnh.
- Hỉếm. khỏng mong đợi. các iác dụngngoại ỷ nghiêm trọng: ( ví dụ như Viêm miệng, tiêu chảy, giảm
bạch cầu trung tính vả độc tinh về thân kinh) kêt hợp với sự thiêu hụt hoạt tinh của dihydropyrimidine
dehydrogenase (DPD) đuợc cho là do 5 — FU . Do vậy không thế ioại trữ có sự liên kêt giữa việc giảm
hảm lượng DPD vả tãng tảc động độc cũa 5 — FU gây tảc hại một cách tiêm ân.
- Capecitabin có thể gây ta hội chửng bản tay - băn chân ( tối loạn cảm giác đó da lòng bản tay — bặn
chân hoặc gây ban đó đầu chỉ do hóa trị liệu) là độc tinh da. Với những bệnh nhân bị di cãn đang điệu
trị Capecitabin đơn thuần. trung vị thời gian để xuất hiện độc tính là 79 ngảy ( trong khoáng 1 ] đên
360 ngảy ›. mức độ từ độ 1 đến 3. , _
0 Hội chứng bản tay — bản chân độ ] được xác định bởi , rôi ioạn cảm giác / dị cảm, kỉên bộ.
hoặc ban đỏ ở tay vảlhoặc chân và lhoặc không cảm thấy thoải mải nhưng không ảnh hướng đên
các hoạt động bình thường.
0 Độ 2 được xảc định là ban đỏ và sưng tay vảfhoặc chân gây đau vâfhoặc không thoải mải ảnh
. hưởng đến các hoạt động của cuộc sống hảng ngảy của bệnh nhân. `
0 Độ 3 được xác định là sự tróc vảy da, loét,_mụn nước hoặc đau nhiêu ở tay vả/hoặc chân
vảlhoặc rẩt khó chịu khiến bệnh nhân không thế lảm việc hoặc thực hiện cảc hoạt động thông
thường hâng ngảy.
- Nếu xảy ra hội chứng bản tay — bản chân độ 2 hoặc 3, nên ngừng dùng Capecitabin cho đến khi các
trường `hợp hối phục hoặc giảm xuống độ 1. Sau khi xuất hiện hội chứng bản tay — bản chân độ 3, nên
giảm Iiêu tiểp theo của Capecitabin. Khi sử dụng kết hợp Capecitabin vả cisplatin. sử dụng vitamin B6
(pyridoxine) không được khuyến khích cho triệu chứng hoặc điều trị dự phòng thử phải cùa hội chửng
bản tay — bản chân, bởi vì các báo cảo đã công bố có thế lảm giảm hiệu quả cùa cisplatin.
- Capecitabin có thể gây tăng bilirubin máu. Nên ngững dùng Capecỉtabin nếu bỉlirubin tăng > 3,0 x
ULN ( trên giới hạn bình thường ) có liên quan đến điều trị hoặc men gan aminotransferase( ALT,
AST) tăng > 2,5 x ULN có Iiên quan đến điểu trị. Có thể bắt đầu điều trị lại khi bilirubin gìảm xuống
5 3,0 x ULN hoặc aminotransferase gan giảm xuống 5 2,5 x ULN.
— Trong một nghiên cứu tương tác thuốc với warfarin liều đơn, AUC trung bình của S — warfarin tăng
nhiêu (+57%). Những kêt quả nảy cho thấy sự tương tảc thuốc có thể do capecitabine ức chế hệ thống
isoenzyme cytochrome P450 2C9. Những bệnh nhân dùng Capecitabin kết hợp với thuốc chống dông
dạng uống dẫn xuất của coumarin phải được theo dõi cẳn thận về hiệu quả chống đông cùa thuốc (
INR hoặc thời gian prothrombin) vả điểu chinh liều thuốc chống đông cho phù hợp.
> Cănh báo chung
- Bệnh nhân được điếu trị bằng Capecitabin nênđược theo dõi cẩn thặn về độc tính. Phấn lớn cảc tảc
. dụng ngoại ý có thẻ hôi phục và khỏng yêu câu phải ngừng thuốc vĩnh viễn, mặc dù vẫn cấn phải
ngừng thuôc hoặc giảm liêu .
ĐỂ XA TẮM TA Y TRẺ EM
TƯỢNG TẤC THUỐC, CÁC DẠNG TƯỚNG TÁC KHẢC:
.g. Tương tác với các thuốc nội khoa khác và cảc hinh thức tương tác khác
> Thuốc chống đỏng máu C oumarín
- Đã ghi nhặn các thông số đông máu thay đổi vả/hoặc chảy máu 6 những bệnh nhân dùng Capecitabin
cùng với các thuốc chống đông dẫn xuất coumarin như warfarin vả phenprocoumon. Những tảc dụng
phụ nây xảy ra trong vải ngây và kéo dải tới vải tháng sau khi điều trị Capecitabin vả, trong một số ít
trường hợp, trong một tháng sau khi ngừng Capecitabin. Trong một nghiên cứu tương tác lâm sảng,
sau khi dùng warfarin liêu đơn 20mg, việc điều trị Capecitabin lảm tăng AUC cùa S-Warfarin khoảng
57% và giá trị INR tăng 91%. Những bệnh nhân dũng các thuốc chống đông dấn xuất cùa coumarin
cùng với Capecitabin nên được theo dõi cân thận vẽ những thay đôi cảc thông sô đông máu của họ (
PT hoặc INR) và phải điều chinh liểu thuốc chống đông cho phù hợp.
> Cơ chất của Cytochrome P — 450 2C9
- Không có cảc nghiên cứu tương tảc thuốc với thuốc chính thức được tiến hảnh với capecitabine vả các
thuốc khác được biết iả chuyền hóa bởi isoenzyme cytochrome P450 2C9. Nên theo dõi cẩn thặn khi
Capecitabin dùng cùng với những thuốc nảy.
6l9
%
/
> Phenytoin _
- Nồng độ huyết tương cùa phenytoin tăng được ghi nhận, trong khi dùng Capeeitabin cùng với
phenytoin. Chưa có nghiên cứu tương tlác thuốc với thuôc chính thức nảo được/tiên hảnh với
phenytoin, nhưng cơ chế tương tảc thuôc được cho là capecitabine ức chế hệ thông isoenzyme
CYP2C9 ( xem phần cảc thuốc chống đông Coumarrin). Những bệnh nhân dùng phenytoin cùng với
Capecitabin nên được theo dõi cẩn thận vi nồng độ huyêt tương cùa phenytoin tăng.
› Tương tác thuốc— thức ăn _ .
- Trong tất cả các thử nghiệm lâm sảng, bệnh nhân được hướng dân uông Capecitabin trong vòng 30
phủt sau khi ãn. Vì dữ Iiệu hiện nay về tỉnh an toản vả hiệu quả dựa trên việc dùng cùng với thức ăn,
nên sử dụng Capecitabín cùng với thức ãn.
> Thuốc kháng acid
- Tảc động cùa hydroxide nhôm và thuốc khảng acid có chứa magnesium hydr_oxide lên dược động học
của capecitabine đă được nghiên cứu trên những bệnh nhân ung thư. Nông độ huyệt tương của
capecitabine và một chất chuyến hóa( 5`DFCR) tăng it; không thây tảc động lẽn ba chât chuyên hóa
chính (5’DFUR, 5 —- FU vả FBAL).
> Leucovorin (folinic acid)
- Tảc động của ieucovorin lên dược động học cùa capecitabine đã được nghiên cứu trên những bệnh
nhân ung thư. Leucovorin không tác động lên dược động học của capecitabine vả cảc chât chuyên hóa
cùa nó. Tuy nhiên, leucovorin có tảc động lên dược lực học eùa Capecitabin vả leucovorin có thẻ lảm
tăng độc tinh cùa Capecitabin .
> Sorìvudine vả các thuốc lương lự '
- Tương tảo thuốc — thuốc có ý nghĩa lâm sảng giữa sorivudine và 5 — FU, do sorivudine ức chế
dihydropyrimidine dehydrogenase, đã được mô tả trong y văn. Tương tác nảy, dẫn tới tăng độc tinh
của dihydropyrimỉdine dehydrogenase, có thể nguy hiêm đến tính mạng. Vì vậy, không nên dùng
Capecitabin với sorivudine hoặc cảc thuốc tương tự có iiên quan về mặt hóa học, như brivudine: Cân
đợi ít nhất 4 tuần sau khi kểt thúc điều trị với sorivudine hoặc các thuôo tương tự cao liên quan về mặt
hóa học như brivudine trước khi bắt đầu trị liệu với Capecitabin .
> Oxaliplatín
- Không có khác biệt có ý nghĩa lâm sảng khi tiếp xúc với capecitabine hoặc cảc chất chuyền hóa,
platinum tự do hoặc platỉnum toân phần xuất hiện khi capecitabine vả oxaiiplatin được dùng trong
điếu trị kết hợp, có hoặc không có bevacizumab.
> Bevacizumab
- Không có tác động có y nghĩạ iảm sảng của bevacizumab lên cảc thông số dược động học của
capecitabine hoặc cảc chât chuyên hóa cùa nó.
ĐỂ TRẢNH CẤC TƯO'NG TẢC THUỐC CÓ THỂ XẢY RA VỚI NHIÉU LOA] THUỐC. CẤN PHẢI THÔNG
BAO CHO CẤC BÁC sĩ HA r DƯỢC sỉ CÚA BAN BÁ T Kỳ THUỐC ĐIẾU TRỊ NÀO KHẢC HIỆN ĐANG SỬ
DỤNG.
sử DỤNG TRÊN PHỤ NỮ có THAI VÀ CHO CON BÚ:
.g. Phụ nữ có thai
- Anh hưởng tới phụ nữ có thai mức độ D
- Không có nghiên cửu nảo trẽn_phụ nữ có thai dùng Capecỉtabin; tuy nhiên, dựa vảo các đặc tính dược
học và độc tính, có thế thây răng Capecitabin có thể gây hại cho thai nếu được dùng cho phụ nữ có
thai. Trong cảc nghiên cứu độc tính sỉnh sản trên động vật, dùng capecitabine gây chết phôi vả quải
thai. Những băng chứng nây có thể xảy ra ở những dẫn xuất cùa tiuoropyrimidine. Capecitabine được
cho răng có khả năng gây quải thai ở người. Không nên dùng Capecitabin trong khi mang thai. Nếu
đùng Capecitabin trong khi'mang thai hoặc nếu bệnh nhân có thai trong khi dùng thuốc nảy, phải
thông bảo cho bệnh nhân biêt nguy cơ tiềm ẩn cho thai. Nên khuyên những phụ nữ trong độ tuồi sinh
đẻ tránh mang thai trong khi điều trị với Capecitabin .
.g. Phụ nữ cho con bú
- Không biết iiệu thuốc được bải tiết qua sữa mẹ hay không. Trong một nghiên cứu cho chuột đang cho
con bú uông Capecitabin liều đơn, một lượng đảng kế các chất chuyển hóa cùa capeccítabine được bải
tiẽt trong sữa. Nên ngửng cho con bú trong quả trinh điều trị Capecitabin.
sử DỤNG ở ĐÓ! TƯỢNG ĐẶC BIỆT:
.g. Người giã '
- Trong sô những bệnh nhân ung thư đại trực trảng tuối 60 - 79 nhận điều trị Capecitabin đơn thuần cho
di căn xa, xuât độ độc tính đường tiêu hóa tương tự trong dân số chung. Những bệnh nhân 80 tuối
hoặc hơn,có tỉ lệ lớn hơn những tác dụng ngoại ỷ đường tiêu hóa độ 3, độ 4, như tiêu chảy, buồn nôn
vả nôn ói.
7/9
607
|
02~ Suy thận
Ồ
- Khi điều trị Capecitabin kết hợp với các thuộc khác, bệnh nhân lớn tuổi 265 tttội tùng có qua những
phản ứng thuốc ngoại ý ( ADR,) độ 3 và độ 4 nhiều hơn những bệnh nhãn trẻ tuôi, ADR, sẽ dẫn đên
tạm ngửng điều trị. Khi điều trị Capecitabin kết hợp với docetaxel, ti lệ cảc tác_dụng ngoại ý có liên
quan đến điều trị độ 3 hoặc 4, các tác dụng ngoại ỷ nghiêm trọng và rủt lui diêu trị sớm do các tác
dụng ngoại ỷ tăng được ghi nhặn ở những bệnh nhân 60 tuôi hoặc hơn, so với bệnh nhân nhỏ hon 60
tuõi.
Các bảc sĩlnên kiếm tra cấthhận khi dùng Capccitabin cho những bệnh nhãn suy giảm chức năng thận.
Như đã thây với 5 — FU xuât độ những tảc dụng ngoại ý độ 3, độ 4 iiên quan đên điêu trị thì nhiêu hơn
ở bệnh nhân suy thận mức độ trung binh ( độ thanh thải creatinine: 30 — 50 ml/phút).
0.8 Suy gan
— Những bệnh nhân suy gan nên theo dõi cẳn thận khi điều trị với Capecitabin . Suy gan không do di
căn gan hoặc suy gan nặng do tác động cùa Capecìtabin thi không được biêt.
TÁC DỤNG KHÔNG MONG MUÔN:
020 Thường gặp
Hệ Tiêu l1óa: khô miệng, đầy bụng, tiếu chảy, cảc tảc dụng ngoại ý có liên quan đến viêm/loét niêm mạc như
viêm thực quản, dạ dảy, viêm tả trảng, viêm đại trảng, chảy máu dạ dảy.
Tim mạch: phù chi dưới, đau ngực do tim bao gồm đau thắt ngực. bệnh cơ tim, thiếu máu cục bộ/ nhồi máu
cơ tim, suy tim, đột tứ, nhịp tim nhanh, loạn nhĩ bao gồm rưng nhĩ và ngoại tâm thu thất.
Thần Kinh: rối loạn vị giác, mất ngù, nhầm lẫn, bệnh não, và các dấu hiệu về tiều não như thất điều tiếu não,
loạn vận ngôn, giảm thăng bằng, phối hợp bất thường.
Nhìễm trùng vả nhiễm liý sinh trùng: các phản ứng phụ Iiên quan tới suy tùy, tổn thương hệ miễn dịch,
vả/hoặc thùng niêm mạc, như cảc nhiễm trùng tại chỗ và nhiễm trùng toản thân có thể gây từ vong ( bao gồm
cảc nguyên nhân do vi khuẩn, vi rứt, nấm) và nhiễm khuẩn.
Máu vả bạch huyết thiếu mâu, suy tùy ( được ghi nhận lả một tác dụng ngoại ý), giảm ba dòng huyết cầu.
Da vã tổ chức dưới da: Nứt da, ngứa, tróc da khu trứ, cảc rối loạn móng, các phản ứng nhạy cảm với ánh
sáng, hội chửng xuất hiện iại cảc tác dụng phụ giống như khi xạ trị, bong mỏng, móng dễ gãy, loạn dưỡng
mỏng.
Toản thãn vả tinh trạng bản thân: suy nhược, đau chân, ngủ lim, đau ngực (không do tim).
Mắt: viêm kết mạc, kích thích mắt.
Hô Iiấp: khó thở, ho.
Cơxương: đau lưng, đau cơ, đau khớp.
Các rối !oạn râm thần: trầm cảm.
Suy gan vả viêm gan ứ mật được ghi nhận trong cảc thử nghiệm iâm sảng và sau khi lưu hảnh trẻn thị
trường. Môi quan hệ nhân quả với việc điều trị bằng Capecitabin chưa được thiết iập.
Viêm miệng, viêm họng thực quản ( dẫn tới tróc vẩy vả loét)
— Tiêu chảy, chản ăn vả buồn nôn
' Giảm bạch cầu sau mỗi đợt điều trị, số lượng bạch cầu giảm thấp nhất sau 11 ảy thứ 9 đến ngảy thứ 14
của đợt điêu trị đầu tiên, đôi khi kéo dải tới ngảy 20. Vảo ngảy thứ 30 bạch cau trở lại binh thường
- Rụng tóc và viêm dagcó thề gặp ở nhiều trường hợp
- Viêm da hay gặp nhât lả săn ngứa ở cảc chi, ở thân người ít gặp hơn, thường phục hồi khi điều trị triệu
chứng
Máu: Giảm cảc huyết cằu, giảm tiều cầu, mắt bạch cẳu hạt, thiếu mảư
- Tinh mạch: Thiêu máu cục bộ cơ tim, đau thắt ngực
— Tiêu hỏa: Loét và chảy máu dạ dảy ruột
- Dị ững: Choáng phản vệ_vâ dị ứng toản thân.
- Thân kinh: Hội chửng tiêu não câp ( có thể tồn tại khi ngưng thuốc), rung giật nhãn cầu, đau đầu.
- Da: 1_(hô, nứt nẽ, nhạy cảm với ảnh sảng được biếu hiện bằng ban đỏ hoặc tăng nhiễm sắc tố da, nhiễm
săc tô tinh mạch.
- Loạn ban đỏ ở bản tay và gan bản chân, đau nhới chân và tay ban đỏ phồng rộp
- Măt: hẹp ôngdẫn lệ, thay đôi thị lực, chảy nước mắt, sợ ánh sáng
- Tâm thân: Mât phương hưởng. lú lẩn, sảng khoải
›
- Tai biến khảo: viêm tinh mạch huyêt khổi, chảy mau cam. thay đổi móng.
8l9
ớă—t
> Các bất thường về Xét nghiệm
Thông sô Bệnh nhân có thế có những bât
thường về xét nghiệm độ 3 14 (%)
Tũng ALAT (SGPT) 1,6
Tăng ASAT (SGOT) 1 ,1
Tãng alkalìne phosphatase 3,5
Tăng calcium 1,1
Giảm calcium 2,3
Giâm bạch cầu hạt 0,3
Giảm hemoglobin 3,1
Giảm tế bảo iympho 44,4
Giâm bạch cằu trung tinh 3,6
Giảm bạch cầu trung tỉnhlbạch cầu hạt 2,4
Gìảm tiêu cầu 2,0
Giảm kali , 0,3
Tăng creatinin huyêt thanh 0,5
Giảm natri 0,4
Tăng đường huyết 4,4 _
- Các bất thường xét nghiệm được xếp ioại dựa theo bảng phân ioại của Hệ thống xếp Ioại NC1C CTC.
THÔNG BÁO CHO BẤC sĩ NHỮNG 74'c DỤNG KHÔNG MONG MUỐN GẶP PHẢI KHI SỬDỤNG
QUẢ 1.1Ếu VÀ cAcn xử TRÍ:
8 Quá liều
- Biểu hiện cùa quá liều cấp tính bao gồm buồn nôn. nôn, tiêu chảy, vìêm niêm mạc, kich thich và chảy mảư
đường tiêu hóa, vả suy tủy.
.:. Cách xử tri:
- Việc điều trị quá liều nên bao gổm điều trị thông thường và cảc can thiệp về y khoa hổ trợ nhằm chữa trị những
triệu chứng lâm sảng đang hiện diện và phòng những biến chửng có thể xảy ra.
Trong trường hợp quá IIều hoặc trẻ em uống nhẩm thuốc, chuyển ngay bệnh nhân đến Irung tâm Y tế
gần nhất vả mang theo toa rhuốc nảy.
ĐỘNG GỌI: Hộp 3 vì x 10 yiên.
BAO QUAN: Bảo quán thuôc ở nơi khô thoáng. trảnh ánh sáng, nhiệt độ dưới 30°C .
TIÊU CHUẨN CHÁT LƯỢNG: Tiêu chuẩn nhà sản xuất. ,
HẠN DÙNG: 36 thảng kể từ ngảy sản xuất. ’
Nhã mảy sản xuất:
Chi Nhánh CÔNG TY cò PHẨN DƯỢC PHẨM PHONG PHỦ
NHÀ MÁY SẢN xuỉư nu’ợc PHẨM USARICHPHARM
Lô 12, đường sô 8, KCN Tân tạo, Q.Bình tân, TPHCM, VIỆT NAM
g’ky'z
CÔNG TY TNHH SHINE PHARMA (Shine pharma Co., Ltd)
3/38/40 Thảnh Thải, P.14, Quận 10, TPHCM, VIỆT NAM
Ngảy 113 thảng Ềi nãm 2013
Duyệt
; “_fg'ttztoơữtg'ĩ _—,…g_
#ẩ/
9/9
JVèuyỗn 'Va'Jn ỉW \’ầừ__ Ự/Jx~è
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng