








4117”
MẤU NHÂN vỉ, HỘP ĐÃNG KÝ 11]
1. Mẫu nhãn vỉ
Ghi Chú: sô lô sx, ngảy sx, han dùng được in phun trên vỉ thuốc
2. Mảu nhán Hộp Tp. HCM, ngả 2210112013
~ G 61 MĐỎC
TYRACAN 100 Vlẻn nén bao phim
mmemmmnamaow Hộp 3 VI X 10 viên
BỘ Y TẾ
CL'C QL`ÁN ư 1)UỌ(J
ĐA PHÊ DUYỆT
Lản dauLĨỊ'Z/Ịỹ
& f…ócebưumaơu
TYRACAN 100
Erlotinib ...................................... 100.00 mg
(Dưới dạng Eriotinib hydroclorid 109,30 mg)
Wẻn nén bao phim 111/
Hộp 3 vỉ x 10 viên
_Ó snxuatụ:cmewco PHAN s.… NM_nMw…M
h WWW.Ọm.m.Vn . GMP _ WHO
Lb 51 , Đưừl'u 80 2, KCN Tũn Tẹo. . ISO gom; zooe
5 P M P. Ten Tqu o. 81… nn, Tp. HCM. vw Nlm ~1s014001:2004
TYRACAN ,19_9 Vtên nén bao phim
«M…Elmwmmmow Hộp 3 vi x 10 viên SPM
TYRACAN 100
Vlẻn nén bao phim
MÙnoẽ…hyùoubddiẵẵhẫ Hộp 3 VĨ X 10 viên
fmùm ……mm m. . . -
mẵủ... .…..wo'ổmmg Tnlbckh'ln suth _
(Dướidum Em… 109.30mg) - ~_.—_
Ttmzv.uvun mm m…… n t….I
ewmmwợr mmmmnụt m
nonmummmnmahùm … I—-——
Nnủnhyưionl
uóenùychỉdíunthnoựkllonffleahớgnl.
Ễẵẫnmmitnaẫhòtýutuẵihuủ “
KhùuiĩlloMchhụnsừùgng. …——__ ___—___
um…mnnụ. mthùu. maomư-m›
( m…]… Tcoe ,
… puAt
…ẫỂ'vcom vu…m
eư1ơseman P.14 Q m.Tucu
MẦỦẨ DT tm…- FI IIMfflW
001 NVDVƯÀl
Wd S tủ…oc'so: Wuwwaỏthmomt
5010 SX:
\…
sỏ ĐK.
Ngay sx:
Ư
Hưởng dẩn sử dgng thuốc TYRACAN 100 Trgg 1110
RX — Thuốc bán theo đơn ’ _
HƯỚNG DẤN SƯ DỤNG THUỐC
VIÊN NÉN BAO PHIM TYRACAN 100
THÀNH PHẦN:
Mỗi viên nén bao phim chứa:
Erlotinib .................................................... 100,00 mg
(Dưới dạng Erlotinib hydroclorid ................ 109.30 mg)
Tá dược: Vừa đủ 1 viên nén bao phim (Kollidon K90; Cellulose vi tinh thế; Lactose
monohydrat; Magnesi stearat; Natri starch glycolat; Natri Iauryl sulphat; Hydroxypropyl
oellulose; HPMC 615; PEG 6000; Titan dioxyd)
DƯỢC LỰC:
Cơ chế tác dụng
Erlotinib ức chế sự phosphoryl hóa nội bảo của tyrosine kinase bằng cách liên kết với các
thụ thể mang yếu tố tăng trưởng biềư bì. Nó được sử dụng để kiểm soát cục bộ ung thư phỏi
không phải tế bâo nhỏ tiên triến hoặc di căn mã không đáp ứng với điều trị khác. Nó cũng
được sử dụng kèm với gemcitabine trong điều trị lần đầu trèn các bệnh nhân ung thư tuyên
tụy cục bộ đang tiên triền, hoặc di căn mã không thế phẫu thuật cắt bỏ
Trong những mô hình phi lâm sảng, sự ức chế EGFR (epidermal growth factor receptor)
phosphotyrosine gảy kim hám vả] hoặc gây chét tế bảo.
DƯỢC ĐỌNG HỌC:
Nồng độ trong máu
Sau lièu uống 150mg Tyracan, ở trạng thái ổn định. Thời gian trung bình đến khi đạt nồng
độ đỉnh trong huyết tương vảo khoảng 4 giờ vởi thời gian trung bình nồng độ đinh huyêt
tương đạt được lá 1995nglmL. Ở thời điếm 24 giờ trước khi dùng liều kế tiếp, thời gian trung
binh nồng độ tối thiểu huyết tương lả 1238 nglmL. Thời gian trung bình AUC đạt được tron2/ \
suốt quáng thời gian giữa các liều ở trạng thái ồn định lè 41300mcg'giờlmL. [
Hấp thu
Erlotinib uóng được hấp thu tốt và có giai đoạn hấp thu kéo dải, vởi nòng độ đỉnh huyết
tương trung bình đạt được sau khi uống 4 giờ. Một nghiên cứu ở những người tình nguyện
khỏe mạnh binh thường cho thấy đó sinh khả dụng ước tính khoảng 59%. Nồng độ sau khi
uống có thể tăng bởi thức ăn.
Sau khi hấp thu, erionitib gắn kêt cao trong máu. khoảng 95% gắn với các thảnh phần máu,
chủ yếu với protein huyết tương (ví dụ albumin vả acid alpha-1-glycoprotein [AAG], khoảng
với 5% ở dạng tự do.
Phân bố
Eriotinib có thể tích phân bố trung binh 1.4 232 1. vả phân bố vảo trong mô khối u người.
Trong một nghiên cứu 4 bệnh nhân (3 bệnh nhản bị ung thư phổi không phải tế bảo nhỏ
(NSCLC), và một bệnh nhân bị ung thư thanh quản) uống Tyracan Iièu hảng ngảy lả 150mg,
mẫu bệnh phảm 1.1 có từ phẫu thuật cắt bỏ vảo ngảy điều trị thứ 9 cho thấy nồng ơo erlotinib ở
khối u đạt trung bình 1,185ng1g mô. Giá trị nảy tương ứng với giá trị trung binh nói chung cùa
63% các nồng độ đỉnh huyết tương ghi nhận ở trạng thái ồn định. Các chất chuyển hóa có
hoạt tính chính hiện diện trong khối u tại nồng độ trung blnh lả 160ng/g mô, tương ứng với giá
trị trung bình chung của 113% các nồng độ đĩnh huyết tương ở trạng thái ốn định. Các nghiên
cứu phản bố ở mỏ sử dụng cách chụp đồng vị phóng xạ toản thân sau khi uống erlotinib đánh
dáu bằng 140 ở chuột trụi khỏng có tuyến ức có sự cấy u khác loải HN5 cho thảy sự phân bố
ở mô rộng và nhanh với nồng độ tối đa của thuốc đã được đánh dấu phóng xạ (khoảng 73%
nồng độ trong huyết tương) quan sát được sau 1 giờ.
’
_íf
._.'J.
u,_(_
-_.,x
Hướng dẫn sử dgng thuỏc TYRACAN 100 Trang 2110
Chuyển hóa
Erlotinib được chuyền hóa tại gan bời các men cytochrome P450 tại gan ở
bởi CYP3A4 vả chuyển hóa ít hơn bởi CYP1A2. ChUyẻn hóa ngoải gan bở` 4
CYP1A1 ờ phối, và CYP1B1 ở mỏ khối u có khả nảng đóng góp vảo than ai
erlotinib. Các nghiên cứu in vitro chi ra khoảng 80 — 95% erlotinib chu ahG
CYP3A4.
Có ba con đường chuyến hóa chính được xác đinh: 1) sự khử O-methyl củ
bẻn hoặc cả hai sau đó được oxy hóa thảnh acid carboxylic; 2) oxy hóa một nửa acetylene
sau đó thùy phản thânh acid aryl carboxylic; vả 3) sự hydroxyl hóa vòng thơm cùa gốc phenyl-
acetylene. Những chát chuyến hóa chính của erlotinib tạo bởi sự khử O-methyl của từng
chuỗi bèn có hiệu lực tương đương với erlotinib trong các nghiệm pháp in vitro tiền lám sảng
vả các mẫu mộ in vivo. Chúng có mặt trong huyêt tương với nồng độ <10% eriotinib và có
dược động học tương tự như eriotinib.
Thải trừ
Các chất chuyển hóa và lượng rất nhỏ cùa erlotinib được bải tiêt chủ yếu qua phân (>90%),
với sự bâi tiét qua thận chỉ chiếm một lượng nhỏ Iiều uống vảo.
Độ thanh thải
Phân tích dược động học ở 591 bệnh nhân dùng Tyracan đơn thuần cho thấy độ thanh thái
trung binh lả 4,47 l/giờ với thời gian bán hũy trung bình là 36,2 giờ. Vì vậy, thời gian dự kiến
để đạt được nồng độ huyết tương ở trang thái ỏn định xảy ra trong khoảng 7 - 8 ngảy. Không
có mối quan hệ 60 ý nghĩa giữa độ thanh thải được dự đoán và tuổi cùa bệnh nhân, trọng
lượng cơ thẻ. giới tính, và chùng tộc. 111/
Các yếu tố cùa bệnh nhân có liên quan đến dược động học cùa eriotinib lá bilirubin huyết
thanh toản phần, nòng độ AAG vả tình trạng hút thuốc. Nồng độ bilirubin toân phần huyết
thanh tăng vả nồng độ AAG tảng đi kèm với tốc 00 thanh thải của erlotinib chậm hơn. Những
người hút thuốc có tốc 011 thanh thải erlotinib nhanh hơn.
Một phân tich thứ hai về dược động học được tiên hảnh trong đó số liệu của eriotinib được
tổng hợp từ 204 bệnh nhân ung thư tụy được dùng erlotinib phối hợp gemcitabine. Phân tích
nảy cho thấy các đồng biến số có ảnh hưởng đến độ thanh thải erlotinib ở những bệnh nhán
từ nghiên cứu tụy cũng giống như những gì ghi nhận được trong phân tích dược động học
thuốc dùng đơn chát trước đây. Không xác định thẻm có hiệu quả của các biến số mới.
Gemcitabine dùng đòng thời không tác động lên độ thanh thải huyết tương cùa erlotinib.
Dược động học ởnhững đối tượng đặc bỉệt
Khộng có các nghiên cứu chuyên biệt cho trẻ em hoặc bệnh nhản lớn tuổi.
Suy gan: Erlotinib được đáo thải chủ yếu bởi gan. Nòng độ erlotinib trong máu gióng nhau
ở những bệnh nhân bị suy giảm chức nảng gan trung bình (điềm ChiId-Pugh 7-9) so với
những bệnh nhán có chức năng gan bình thường trong đó có những bệnh nhán bị ung thư
gan nguyên phát hoặc di cản gan.
Suy thận: Eriotinỉb vả các chất chuyến hóa của nó khỏng được bải tiét qua thận một cách
đáng kể, dưới 9% liều đơn được tiết ở nước tiêu. Chưa có nghiên cứu lâm sảng nảo được
tiến hảnh ở những bệnh nhản có chức nảng thặn bị suy giảm.
Những ngưởi hút thuốc: Nghiên cứu dược động học ở những người khỏe mạnh khộng hút
thuốc vả còn đang hút thuốc cho thấy khói thuốc lá Iảm táng độ thanh thải vả giảm nòng độ
của erlotinib. AUCMỒ cục ở người hút thuóc vảo khoảng 113 so với người chưa bao giời đã
từng hút thuốc (n = 16 trong mỗi nhóm hút thuốc và chưa bao giờ] ơa từng hủt thuốc). Sự
giảm nồng độ nảy ở người còn hút thuốc có thể do kích thích men CYP1A1 ở phồi vả
CYP1A2 ở gan.
ffl,,4e3
Hưởng dẫn sử dgng thuốc TYRACA_N mo Tra_ng 3110
nồng độ đáy huyêt tương ở trạng thái ốn định là 0,65 mcglmL (n = 16) thấp
so với những người chưa từng hoặc đã từng hút thuốc (1,28 mcglmL, n = ,f ~
đi kèm với sự gia tãng 24% về thanh thải huyết tương cùa erlotinib. ' -,l . __
Trong một nghiên cứu tăng liều pha I ở bệnh nhân bị NSCLC còn đangghĩĩt fflẵW
dược động học ở trạng thái ồn đinh cho tháy có sự tăng nồng độ erlotinitìtỷ lệSJiEiMớ'
khi Iièu Tyracan được tăng từ 150mg Ièn đên liều tối đa được dung nạp |"I ` . - .1Ổ
nghiên cữu nảy lả 1.22 mcg/mL (n = 17).
An toản tiền lâm sảng
Khả năng sinh ung thư
Bằng chứng về khả năng sinh ung thư chưa được ghi nhận ở các nghiên cứu tiền Iảm
sảng. Erlotinib không gáy độc gene cũng như Iảm hư hại nhiễm sắc thể trong các nghiên cứu
gây độc gene. Các nghiên cứu về khả năng sinh ung lâu dải ở chuột iớn và chuột nhắt đã
được tiên hảnh, tuy nhiên ac sang thương táng sinh tiền ung thư chưa được ghi nhận trong
những nghiên cứu độc tính mãn tinh kéo dải đến 6 tháng.
Khả năng gây đột biển
Erlotinib cho kết quả âm tinh trong bộ mẫu thử chuẩn của nghiệm pháp gây độc gene.
Giảm khả năng sinh sản
Giảm khả năng sinh sản chưa được ghi nhận trong các nghiên cứu ở chuột đực vả chuột
cái ở các mức Iiều gần liều tối đa được dung nạp (MTD).
Khả năng gây dị dạng thai VV
Số Iiệu từ các thử nghiệm độc tính lẻn khả năng sinh sản ở chuột và thỏ cho thảy sau khi
dùng erlotinib Với liều gần MTD vá/ hoặc Iièu có độc tinh cho mẹ, có sự nhiễm độc phòi,
nhưng khỏng có bằng chứng cùa sự suy giảm khả năng sinh sản, tính gây quái thai, hoặc sự
phát triền bất thường về hảnh vi hoặc thể chất trước hoặc sau đẻ. Độc tính cho mẹ ở cả
chuột vả thỏ trong những nghiên cứu nảy xảy ra với nòng độ trong huyêt tương tương tư như
nồng ơo ở người sau khi dùng erlotinib liều 150mg. '
Khác
Hiệu quả khi dùng lâu dâi đã được ghi nhận ở it nhát một loải động vật hoặc nghiên cứu
bao gòm tác động lẻn giác mạc (teo, loét). da (thoái hóa và viêm nang lông, đồ da, vả rụng
tóc). buồng trứng (teo), gan (hoại tử gan). thận (hoại tử nhú thận vả giản ống thận), vả đường
tiêu hóa (chậm tiêu ở dạ dảy và tiêu chảy). Số lượng hòng cầu. hematocrỉt vả hemoglobin
giảm và reticulocytes tăng. Bạch cầu, chủ yếu là bạch cầu trung tính, lại tăng. Có sự tăng liên
quan đến điều trị về aianine aminotranferase (ALT), aspartate aminotransferase (AST), vả
bilirubin.
Các nghiên cứu in vitro về erlotinib đã chi ra sự ức chế kẻnh hERG tại nòng độ cao hơn ít
nhát 20 lần nồng ơộ thuốc ở trạng thải tự do ở người ở iièu điều trị. Các nghiên cứu ở chó
khỏng cho thấy có kéo dải khoảng QT. Sự xem xét lại một cách hệ thồng các số liệu ECG từ
152 đối tượng từ 7 nghiên cứu với những người tinh nguyện khỏe mạnh đã không tìm thấy
bằng chứng có kéo dải khoảng QT. vả cảc nghiên cứu iâm sảng không tìm thấy bằng chứng
loạn nhịp, đi kèm với kéo dải khoảng QT.
cui ĐINH:
— Ung thư phối không phải tế bảo nhò: Tyracan được chỉ định để điều trị những bệnh nhản
ung thư phối khòng phải tế bảo nhỏ tiến triển tại chỗ hoặc di căn sau khi thất bại ít nhất một
chế ơo hóa trị liệu trước đó.
— Ung thư tụy: Tyracan phối hợp với gemcitabine được chỉ đinh đê điều tri bước một cho
những bệnh nhân ung thư tụy tiên triền tại chỗ. khỏng cắt bỏ được hoặc di căn.
Hướng dẫn sử dụng thuốc TYRACAN 100 Trang mo
LIỀU DÙNG — CÁCH DÙNG:
Liều chuẩn
150mg dùng it nhảt một giờ trước hoặc hai giờ sau khi ăn. -`
- Ung thư tụy: Liêu hảng ngảy được khuyên các cùa Tyracan lả 100mg dù 1ỂÌIẵỄPYIM
trước hoặc hai giờ sau khi ăn, phối hợp với gemcitabine (xem hướng dã '
gemcitabine cho chỉ định ung thư tụy).
Các hưởng dẫn liều dùng đặc biệt
Có thể cấn phải điều chỉnh iiều khi dùng cùng với các cơ chảt vả chất điều hòa đối với hệ
CYP3A4 (xem phần Tương tác với các thuốc khác vả các hình thức tương tác thuốc).
Khi cần phải điều chĩnh liều, nèn giảm 50mg mỗi lần (xem phần Cảnh báo vả thặn trọng vả
Tương tác với các thuốc khác vả các hình thức tương tác thuốc).
Suy gan: Erlotinib được đảo thải bởi chuyền hóa ở gan vả sự bải tiét mặt. Mặc dù nông độ
eriotinib giống nhau ở những bệnh nhản bị suy chức năng gan mức trung binh (điêm Child-
Pugh 7-9) so với những bệnh nhân có chức nảng gan bình thường. nên thận trọng khi dùng
Tyracan cho những bệnh nhân bị suy gan. Nên cân nhắc giảm liều hoặc ngưng Tyracan néu
phản ứng ngoại ỷ nặng xảy ra. Tính an toán vá hiệu quả cùa Tyracan chưa được nghiên cứu
ở những bệnh nhân suy gan nặng (xem phần Cảnh báo vá thận trọng [viêm gan, suy gan] vả
Dược động học ở những nhóm bệnh nhãn đặc biệt).
Suy thận: Tính an toản và hiệu quả của Tyracan chưa được nghiên cứu ở những bệnh
nhân suy thặn (xem phần Dược động học ở những nhóm bệnh nhân đặc biệt).
Dùng cho trẻ em: Tính an toản và hiệu quả của Tyracan chưa được nghiên cứu ở những
bệnh nhân dưới 18 tuỏi.
Người hút thuốc Iá: Hút thuốc lá có thề iảm so - 60% giảm phân bỏ thuốc erlotinib. Liều
Tyracan tối đa được dung nạp ở bệnh nhân ưng thư phỏi không phải tế bảo nhỏ còn hút
thuốc lá 300mg. Hiệu quả vá tính an toản Iảu dải với liều cao hơn Iièu khởi đầu được khuyến
cáo vẫn chưa được xác định đối với những bệnh nhân tiếp tục hút thuốc (xem phần Tương
tác với các thuốc khác vả các hình thức tương tác thuốc và Dược động học ở những nhỏ
bệnh nhân đặc bỉệt).
CHỐNG CHI ĐINH: _
Tyracan được chống chỉ định ở những bệnh nhân quả mẫn trầm trọng với erlotinib hoặc Với?
bất kỳ thảnh phần nảo của Tyracan.
THẬN TRỌNG:
Tyracan có tiềm năng tương tác thuốc có ý nghĩa về mặt lảm sảng (xem phần Tương tác
với các thuốc khác vả các hinh thức tương tác thuốc).
Bệnh phối kẽ: Các trường hợp gióng bệnh phồi kẽ (ILD), bao gồm những trường hợp tử
vong, đôi khi được báo cáo ở những bệnh nhân dùng Tyracan đê điều trị ung thư phổi không
phải tế bảo nhỏ (NSCLC). ung thư tụy hoặc các khối u đặc tiến triền khác. Trong một nghiên
cứu then chốt BR 21 ở NSCLC, tỉ lệ biến có giống ILD nặng lả 0,8% trong nhóm dùng giả
dược lẫn nhóm dùng Tyracan. Trong nghiên cứu ung thư tụy phối hợp với gemcitabine, tỉ lệ
biên có giống ILD lả 2,5% trong nhóm Tyracan phối hợp với gemcitabine so với 0,4% ở nhóm
dùng giả dược phối hợp với gemcitabine. Tỉ lệ chung ở những bệnh nhân được điều tri bằng
Tyracan từ tất cả các nghiên cứu (bao gồm các nghiên cứu không đối chứng vả các nghiên
cứu dùng hóa trị liệu đồng thời) lả khoảng 0,6%. Chuẩn đoán được ghi nhận ở những bệnh
nhán bị nghi ngờ có bệnh giống ILD bao gồm viêm phối, viêm phối do xạ trị. viêm phỏi quá
mãn, viêm phối kẽ, bệnh phồi kẽ. viêm phế quản tắc nghẽn, xơ hóa phối, hội chứng suy hô
hảp cáp. thâm nhiễm phói, vả viêm phế nang. Các biên có giống ILD nảy bắt đầu từ một vải
ngảy đẻn một vải tháng sau khi bắt đầu điều trị Tyracan. Phần lớn các trường hợp đi kèm với
Hưởng dẫn sử dgng thuốc TYRACAN mo Tran 5110
các yếu tố gây nhiễu hoặc các yếu tố góp phần như là hóa trị liệu đồng thời h—: - _ .
trị trước đó. bệnh nhu mô phổi có từ trước. bệnh phối di căn. hoặc nhiễm trùng:hỄỌNG TY
Ở những bệnh nhân có xuất hiện cảc triệu chững mới cấp tinh vả! hoặc nhữncftễffldfflNt
về phói không giải thich được đang tiến triển, như lá khó thở, ho vả sót, nènr _gSJ
bảng Tyracan trong khi chờ đánh giá về chuẩn đoán. Nếu được chuẩn đ²Ý f—
ngừng dùng Tyracan vả điều trị thích hợp tùy tình hình. . .
Tiêu chảy, mất nước. rối Ioạn điện giải vả suy thận: Tiêu chảy đã xảy ra ở những bệnh
nhản dùng Tyracan vả tiêu cháy trung binh vả nặng nẻn được điều trị bằng loperamide. Trong
một vải trường hợp, nẻn giảm liều. Trong trường hợp tiêu chảy nặng hoặc dai dẳng. buồn
nôn, chán án hoặc nỏn gây mất nước, nèn ngừng dùng Tyracan và có các biện pháp thich
hợp để đỉèu tri mát nước (xem phần Các tác dụng không mong muốn). Đã có một số trường
hợp hiếm gặp bị giảm kali máu và suy thận (có cả tử vong). Một vải ca suy thận lả do mảt
nước nặng vì tiêu chảy, nôn vá] hoặc chán ăn trong khi những ca khác thòng tin bị nhiễu bởi
hóa trị đồng thời. Trong những trường hợp tiêu chảy nặng hoặc kéo dải. bệnh nhân bị mất
nước, đặc biệt ở những nhóm bệnh nhân có yếu tố nguy cơ lảm nặng bệnh (dùng thuốc khác
đòng thời. triệu chứng hoặc bệnh hoặc các tình trạng thúc đấy bao gồm cao tuối). nẽn tạm
ngưng Tyracan vả áp dụng các biện pháp thích hợp để bù nước tich cực cho bệnh nhãn bằng
đường tĩnh mạch. Ngoải ra, nẻn theo dội chức năng thận vả điện giải trong huyêt thanh bao
gồm kali ở những bệnh nhãn có nguycơ mất nước.
Viêm gan, suy gan: Một số trường hợp hiếm gặp bị suy gan (có thẻ tử vong) đă được báo
cáo trong khi dùng Tyracan. Các yếu tố gây nhiễu gồm bệnh gan có từ trước hoặc dùng thuốc
độc cho gan đồng thới. W vậy nẻn xét nghiệm chức năng gan đinh kỳ cho những bệnh nhân
như trẻn. Nên ngưng Tyracan nếu có thay đối nhiều về chức năng gan.
Suy gan Mi/
Nồng độ erlotinib trong máu gióng nhau ở những bệnh nhân bị suy giảm chức năng gan
trung binh (fflềm ChiId-Pugh 7-9) so với những bệnh nhân có chức năng gan binh thường
trong đó có những bệnh nhân bị ung thư gan nguyên phát hoặc di căn gan. Chưa có nghiên
cứu về tinh an toản và hiệu quả ở những bệnh nhân bị suy gan nặng.
Lái xe vả vận hảnh mảy móc: Không có nghiên cữu về tác động lẻn khả nảng lái xe vả
vận hảnh máy móc được tiến hảnh, tuy nhiên. erlotinib không gây giảm khả năng trí tuệ.
PHỤ Nữ có THAI VÀ CHO con BÚ
Phụ nữ có thai:
Khỏng có nghiên cữu thích hợp hoặc có đối chứng tốt ở những phụ nữ có thai đang dùng
Tyracan. Các nghiên cứu ở động vật đã cho thây một vái độc tính sinh sản Nguy cơ tiềm ấn
cho người chưa được biét. Những phụ nữ có khả năng mang thai phải được khuyên tránh có
thai khi dùng Tyracan. Nẻn dùng các biện pháp trảnh thai thich hợp trong quá trình điều tri, và
ít nhát 2 tuần sau khi kêt thúc điều tri. VỈệC điều trị chỉ nèn tiếp tục ở những phụ nữ có thai
nếu lợi ich mang lại cho mẹ cao hơn hẳn nguy cơ cho thai.
Phụ nữ cho con bú
Người ta không biết Iiệu erlotinib được tiêt qua sữa mẹ hay không. Do khả năng gây hại
cho nhũ nhi. người mẹ không nên cho con bú trong khi dùng Tyracan.
TƯỜNG TÁC THUỐC:
Eriotinib được chuyển hóa ở gan bởi hệ cytochrome gan ở người, chủ yêu bởi CYP3A4 vả
it hơn bời CYP1A2. vả CYP1A1 đòng dạng ở phổi. Khả năng tương tác có thể xảy ra với
những thuốc được chuyển hóa bởi, hoác là những thuốc ức chế hoặc kích thích những
enzyme nảy.
Hưởng dẫn sử dgng thuốc TYRACAN 100 Trang 6/10
Các chất ức chế mạnh hoạt tinh CYP3A4 iám giảm sự chuyến hóa cùa … . . ~' … e
nòng độ huyết tương của erlotinib. Ketoconazole ức chế sự chuyến hóa ` ỒNfi(I l ư
uống hai lần mỗi ngảy trong 5 ngây) lảm tãng nòng độ erlotinib (nồng độẵp`hÍârfiố BHn'bpi IOJ
eriotinib [AUC] tăng 86%) vả Cmax tăng 69% khi so sánh với việc dùng Ễri ir8>ợpr :. ’
Khi dùng Tyracan cùng lúc với ciprofloxacin. thuốc ức chế cả hệ CYP3A4 fi , » Pi '
độ phân bố erlotinib [AUC] vả nồng độ tối đa (Cmax) tăng lần lượt là 39% và .
thận trọng khi dùng Tyracan với những thuốc ức chế mạnh CYP3A4 hoặc ức chế phôi hợp
CYP3A4ICYP1A1. Trong những trường hợp nảy. nên giảm Iiều Tyracan khi ghi nhận có độc
tính.
Các thuốc kích thich mạnh hoạt tính CYP3A4 lám tăng chuyền hóa erlotinib vả lảm giảm
nồng độ huyêt tương erlotinib một cách đáng kè. Rifampicin kich thich sư chuyến hóa
CYP3A4 (600mg uỏng mỗi ngảy trong 7 ngảy) Iảm AUC trung bình của erlotinib giảm 69%,
sau khi dùng Tyracan Iièu 150mg, so sánh với khi dùng Tyracan đơn thuần.
Điều trị trước đó hoặc dùng đồng thời rifampicin với Iiều duy nhất 450mg Tyracan Iảm AUC
Với erlotinib giảm còn 57.5% so với giá trị khi dùng liều đơn 150mg Tyracan mã không dùng
kèm rifampicin. Néu có thẻ nèn cán nhắc chế độ điều trị thay thế khỏng dùng các thuốc kích
thích mạnh CYP3A4. Đối với những bệnh nhân cần điều trị đồng thời Tyracan với một thuốc
kích thich mạnh CYP3A4 như n'fampicin, nẻn cân nhắc tảng liều Ièn 300mg trong khi theo dói
sát tính an toản (xem phần Thận trọng). và nêu dung nạp tốt trong hơn 2 tuân thì có thể tăng
đén 450mg đồng thời theo dỏi chặt chẽ về an toản. Chưa có nghiên cứu dùng liều cao hơn
trong trường hợp nảy. Ựt/
Điêu trị trước đó hoặc dùng đồng thời với Tyracan khỏng lảm thay đổi thanh thải của các
cơ chát tiêu biều của CYP3A4 lả midazolam vả erythromycin. Vì vậy ít có khả năng tương tác
thuốc quan trọng xảy ra Với các cơ chất khác của CYP3A4. Độ khả dụng sau khi uống
midazolam có vẻ bị giảm tới 24%, tuy nhiên không phải là do tác dụng trẻn hoạt tính CPY3A4.
Tinh tan cùa erlotinib phụ thuộc vâo pH. Tinh tan cùa erlotinib giảm khi pH tăng. Dùng đòng
thời Tyracan với omeprazole, một chảt ức chế bơm proton, giảm nồng độ phân bố eriotinib
(AUC) vả nòng độ tối đa (Cmax) lần lượt iả 46% và 61%. Khỏng có thay đổi về Tmax vả thời
gian bán thải. Vì vậy, các thuốc Iảm thay đỏi pH đường tiêu hóa trẻn có thể thay đổi tinh tan
của erlotinib vả độ sinh khả dụng cùa thuốc nảy. Tảng Iiều Tyracan khi dùng cùng với các
thuốc như vặy khó có thể bù trữ cho sự giảm nồng ơộ phân bố.
Táng chỉ số chuẩn hóa quốc tế (INR) vá các trường hợp chảy máu bao gồm chảy mảu dạ
dảy đă được ghi nhận trong các nghiên cứu iảm sảng, một vái trường hợp dùng cùng với
warfarin. Bệnh nhân dùng warfarin hoặc các thuốc chống đỏng dẫn xuảt cùa coumarin nèn
được theo dỏi một cách thường xuyên để phát hiện bất kỳ sự thay đổi nảo về thời gian
prothrombin hoặc INR.
Những người hút thuốc lá nèn được khuyên ngưng hút vì khói thuôo lá, vốn kich thích
CYP1A1 vả CYP1A2, được nghiên cữu cho thấy iảm giảm nồng độ phân bố erlotinib khoảng
50 — 60%.
Trong một nghiên cứu pha Ib, không có tác dụng đáng kể cùa gemcitabine đối với dược
động học của erlotinib cũng như không có tác dụng đảng kè cùa erlotinib lên dược động học
cùa gemcitabine.
TẢC DỤNG KHÒNG MONG MUỐN:
Các thử nghiệm lâm sáng
Ung thư phối không phải tế bảo nhỏ (Tyracan được dùng đơn chất trong nghiên cửu
BR.21)
Trong một nghiên cứu mù đội ngẫu nhiên (BR.21) được tiến hảnh ở 17 nước, 731 bệnh
nhân bị NSCLC tiên triển tại chỗ hoặc di cản sau khi thất bại ít nhất một phát đồ hóa trị trước
Hưởng dẫn sử dgng thuốc TYRACAN 1oo
đó được chọn ngẫu nhiên 21 được điều trị bằng Tyracan 150mg hoặc gi. = ' «
nghiên cứu được uỏng hảng ngáy cho đén khi bệnh tiến triẻn hoặc khòng thì
tinh. ,
Nồi ban (75%) và tiêu chảy (54%) lá những tác dụng ngoại ỷ thường gặộ' - ; _.
nguyên nhân. Phần iớn ở mức ơo 1 hoặc 2 và có thể kiểm soát được mã k ~s.qĩzumm
thiệp. Nói ban vả tiêu chảy mức độ 314 xảy ra lần lượt trong 9% và 6% những _; ~
được điều trị bằng Tyracan vả mỗi tác dụng phụ lảm ngừng nghiên cữu ở 1% số bệnh nhân.
Cần phải giảm Iiều vì nỏi ban vả tiêu chảy, lần lượt trong 6% vả 1% số bệnh nhản. Ở nghiên
cứu B.R.21, Thời gian trung bình iâm xuất hiện nổi ban lá 8 ngảy. và Thời gian trung bình Iảm
xuất hiện tiêu chảy lả 12 ngảy.
Các phản ứng ngoại ỷ xảy ra thường xuyên hơn (2 3%) ở những bệnh nhãn được điều trị
bằng Tyracan hợn ở nhóm dùng giả dược trong nghiên cứu then chốt BR.21. và ở ít nhảt
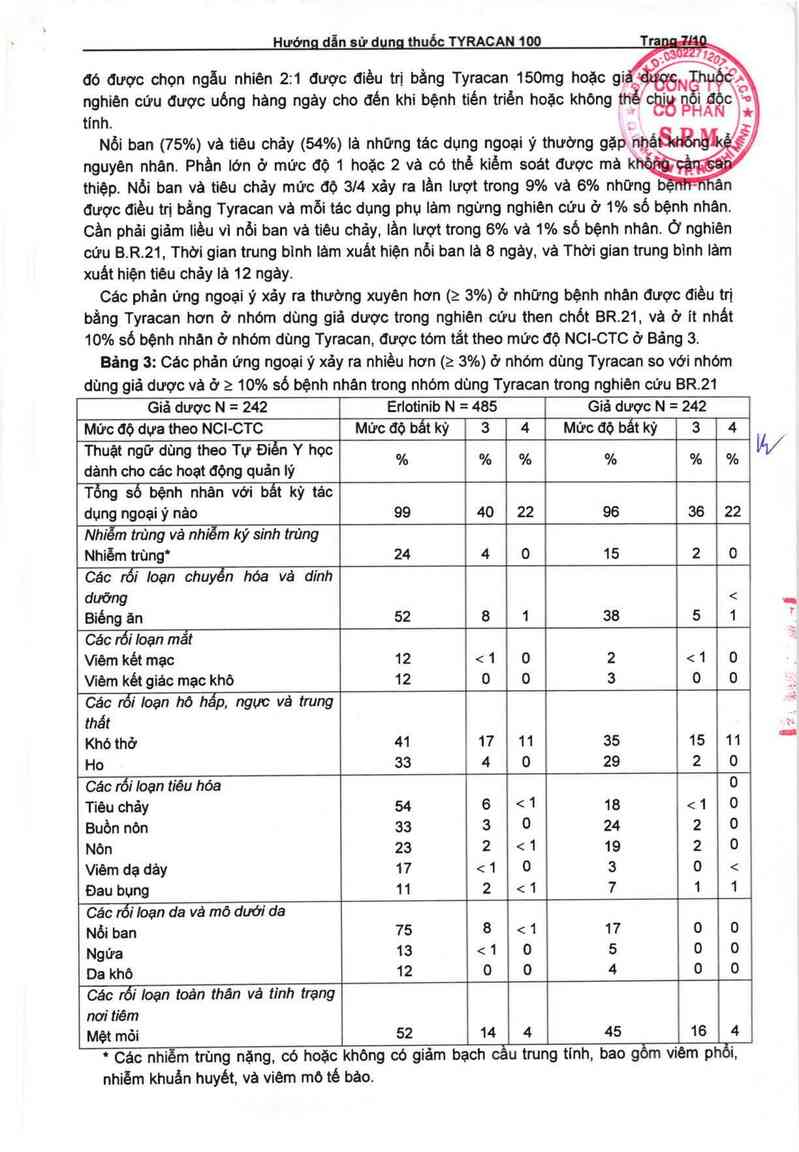
10% số bệnh nhân ở nhóm dùng Tyracan, được tóm tắt theo mức độ NCI-CTC ở Bảng 3.
Bảng 3: Các phản ứng ngoại ý xảy ra nhiều hơn (2 3%) ở nhóm dùng Tyracan so với nhóm
dùng gỉả dược và ở a 10% số bệnh nhãn trong nhóm dùng Tyracan trong nghiên cứu BR.21
Giả dược N = 242 Erlotinib N = 485 Giá dược N = 242
Mức độ dựa theo NCI-CTC Mức độ bất kỳ 3 4 Mức oộ bất kỳ 3 4 _
Thuật ngữ dùng theo Tự Điển Y học 0 W
. . Át % % % % %
danh cho các hoat động quản iy
Tổng số bệnh nhân với bát kỳ tác
dụng ngoại ỷ nảo 99 40 22 96 36 22
Nhiễm trùng và nhiễm ký sinh trùng
Nhiễm trùng" 24 4 0 15 2 0
Các rối Ioan chuyển hóa và dinh
dưỡng < _
Biềng ăn 52 8 1 38 5 1 '
Các rối Ioạn mắt
Vlẻm kết mac 12 < 1 0 2 < 1 0
Viêm kết giác mạc khô 12 0 0 3 0 0 _
Các rối Ioạn hô hấp, ngực vả trung ~ề
thất
Khó thở 41 17 11 35 15 11 "
Ho 33 4 0 29 2 0
Các rối Ioạn tiêu hóa 0
Tiẻu chảy 54 6 < 1 18 < 1 o
Buồn nỏn 33 3 0 24 2 o
Nỏn 23 2 < 1 19 2 O
Viêm da dảy 17 < 1 0 3 0 <
Đau bụng 11 2 < 1 7 1 1
Cảc rối Ioạn da vá mô dưới da
Nổi ban 75 8 < 1 17 o o
Ngứa 13 < 1 0 5 0 O
Da khô 12 0 0 4 0 0
Các rối Ioạn toản thân vả tình trạng
nơi tiêm
Mệt mỏi 52 14 4 45 16 4
* Các nhiễm trùng nặng, có hoặc không có giảm bạch cầu trung tinh, bao gồm vièm phối,
nhiễm khuấn huyết. vả viêm mộ tế bảo.
Hưởn dẫn sửd n thuốc TYRACAN 100 Tran 8110
Ung thư tụy (Tyracan được dùng đồng mời vói gemcitabine trong nghiã ,
Các phản ứng ngoại ý thường gặp nhất trong nghiên cứu then chót P
nhân ung thu tụy dùng Tyracan 100mg cùng với gemcitabine là mệt mòi, nổi Ứan
Trong nhóm Tyracan phối hợp với gemcitabine. nỏi ban vả tiêu chảy độ3/ ỔJ
nhận ở 5% số bệnh nhân. Thời gian trung binh để xuất hiện nối ban vả tiêu
10 ngảy và 15 ngảy. Mỗi phản ứng nồi mẩn vả tiêu chảy đều khiên phải giảm
bệnh nhân. vả phải ngừng nghiên cứu ở 1% số bệnh nhân dùng Tyracan phối hợp với
gemcitabine.
Nhóm bệnh nhân dùng Tyracan 150mg phối hợp với gemcitabine (23 bệnh nhản) có tỉ iệ
một số phản ứng ngoại ý đặc trưng cho nhóm thuốc cao hơn trong đó có nối ban vả đòi hỏi
phải giảm Iiều thường xuyên hơn hoặc ngừng điều trị.
Tác dụng ngoại ỷ xuất hiện thường xuyên hơn (2 3%) ở những bệnh nhán được điều trị
Tyracan 100mg phối hợp với gemcitabine so với nhóm dùng giả dược phối hợp với
gemcitabine trong nghiên cứu then chỏt PA.3, vả ở it nhảt 10% số bệnh nhân dùng Tyracan
phói hợp với gemcitabine. được tóm tắt bởi Tiêu chuẩn độc tính thường gặp cùa Vìện Ung
thư Quốc gia (NCI-CTC) ở bảng 2.
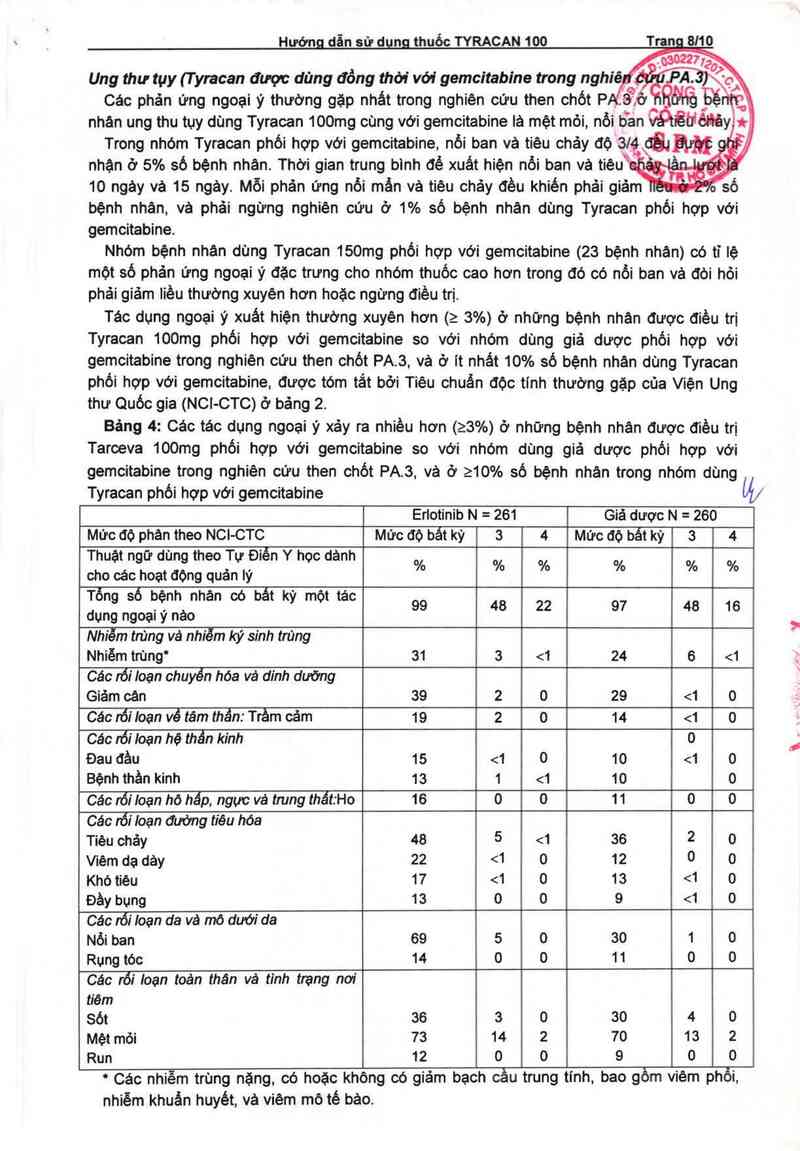
Bảng 4: Các tác dụng ngoai ý xảy ra nhiều hơn (23%) ở những bệnh nhân được điều trị
Tarceva 100mg phối hợp với gemcitabine so với nhóm dùng giả dược phói hợp Với
gemcitabine trong nghiên cứu then chót PA.3, vả ở 210% số bệnh nhân trong nhóm dùng
Tyracan phối hợp với gemcitabine lb
Erlotinib N = 261 Giá dược N = 260
Mức độ phân theo NCI—CTC Mức độ bất kỳ 3 4 Mức độ bất kỳ 3 4
Thuật n ữ dùn theo Tự Điển Y học dânh
cho cácghoat độgng quản lý % % % % % %
Tống sỏ bộnh nhân có bất ky một tảc 99 48 22 97 48 16
dụng ngoại y nảo
Nhiểm trùng vá nhiểm ký sinh trùng
Nhiễm tiùng' 31 3 <1 24 6 <1
Các rối Ioan chuyến hóa và dinh dưỡng
Giảm cân 39 2 0 29 <1 0
Các rỏi Ioan về tâm thần: Trầm cảm 19 2 0 14 <1 0
Các iối Ioạn hệ thần kinh 0
Đau đèu 15 <1 0 10 <1 0
Bệnh thần kinh 13 1 <1 10 0
Các rối Ioạn hô hấp, ngực vả trung thất:Ho 16 0 0 11 0 0
Các nối Ioạn đuờng tiêu hóa
Tièu chảy 48 5 <1 36 2 o
\Aẽm da dảy 22 <1 0 12 0 o
Khó tiêu 17 <1 0 13 <1 0
Đầy bụng 13 o o 9 <1 0
Các lối Ioạn da vả mô dưới da
Nổi ban 69 5 0 30 1 0
Rụng tóc 14 0 0 1 1 0 0
Các rối Ioan toán thán và tinh trạng nơi
tiêm
sót 36 3 o 30 4 o
Mệt mỏi 73 14 2 70 13 2
Run 12 0 0 9 0 O
' Các nhiễm trùng nặng, có hoặc không có giảm bach cầu trung tính, bao gồm viêm phồi,
nhiễm khuản huyêt, vả viêm mỏ tế bảo.
Hướng dẫn sử dgng thuốc TYRACAN 100
hoặc 150mg phối hợp với gemcitabine.
Các phản ứng ngoại ý sau được ghi nhận ở những bệnh nhân được dùng
đơn trị và Tyracan 100mg hoặc1SOmg phối hợp với gemcitabine.
Các thuật ngữ sau được dùng để xép các tác dụng ngoại ý bởi tần suất xuất hiện: Rất
thường gặp (› 1l10); thường gặp (› 1/100, < 1/10); it gặp (› 111000, < mom; hiếm gặp (›
1/10 000, < 1/1000); rất hiếm (< 1/10 000) bao gồm các báo các đơn lè.
Các tác dụng phụ rát phổ biến được trình bảy trong Bảng 1 vả 2, các biên có ở các tần suất
khác được tóm tắt dưới đây.
Các rối loạn đường tiêu hóa:
Các trường hợp chảy máu đường tiêu hóa được ghi nhận thường xuyên trong cảc thử
nghiệm lâm sảng, một vải trường hợp dùng cùng với warfarin vả một vải trường hợp dùng
cùng với NSAIDs.
Các rối Ioan gan mật:
Các bất thường về xét nghiệm chức năng gan (bao gồm tăng ALT, AST, bilirubin) được
quan sát thường xuyên trong các thử nghiệm lăm sảng cũa Tyracan. Trong nghiên cứu PA3,
những bất thường nảy xảy ra rảt thường xuyên. Những tác dụng ngoại ý nảy phần lớn ở mức
độ nhẹ đến trung binh, thoáng qua hoặc đi kèm với di căn ở gan. Một số ca hiém gặp bị suy
gan (có ca tử vong) đã được báo cáo trong khi dùng Tyracan. Các yếu tố gảy nhiễu gòm bệnh
gan có từ trước hoặc dùng thuôo độc cho gan đồng thời. W
Các rối Ioạn về mắt: L
Viêm giác mạc được ghi nhận thường xuyên trong các thử nghiệm lâm sảng của Tyracan.
Viêm két mạc được ghi nhặn thường xuyên trong các thử nghiệm ung thư tụy. Một trường
hợp đơn lẻ bi loét giác mạc, dưới hinh thức biền chứng viêm da niêm mạc, cũng được báo
cáo ở những bệnh nhân dùng Tyracan.
Các rối Ioạn về hô hấp, lồng ngực vè trung thất:
Có những báo cáo khỏng thường xuyên về biến cố nặng giống viêm phổi kẽ, (đã có ca tử
vong), ở những bệnh nhân dùng Tyracan đê điều trị NSCLC hoặc những khối u đặc tiến triền
khác.
Các trường hợp bị chảy máu cam cũng thường được báo cáo trong các thử nghiệm lâm
sảng NSCLC lẫn ung thư tụy.
Các rối Ioạn da vả mỏ duới da:
Da khô được ghi nhận thường xuyên trong nghiên cứu ung thư tụy. Rụng tóc thường xảy ra
trong nghiên cứu NSCLC. Các thay đổi khác về tóc và móng. đa phần khòng nghiêm trọng, đã
được báo cáo trong các thử nghiệm lâm sảng, ví dụ viêm quanh móng được ghi nhận thường
xuyên vả rậm lòng, thay đối iộng mi] lộng mảy, móng giòn dễ bong it khi gặp.
Sau khi thuốc được lưu hảnh
Các thay đổi khác về tóc vả móng, đa phần không nghiêm trọng, đã được ghi nhận xảy ra
khòng thường xuyên từ giám sát sau khi thuốc được lưu hảnh trèn thị trường: Rặm lòng, thay
đổi lông miliông mảy, viêm quanh móng, móng giòn dẽ bong.
Thông báo cho thầy thuốc những tác dụng không mong muốn gặp phải khi sử dụng
thuốc.
' heo lf\'t\lg .
__< Q
›. `
Hướng dẫn sử dgng thuốc TYRACAN 100 Trang 10/10
DÙNG QUÁ LIỂU:
Liều đơn Tyracan Ièn tới 1000mg ở những đối tượng khỏe mạnh và lèn tới 1600mg ở
những bệnh nhản ung thư đã được dung nạp. Liều nhắc Iai hai lần một ngáy 200mg ở những
đối tượng khỏe mạnh bị dung nap kém chỉ sau một vải ngảy dùng. Dưa váo các số liệu từ
những nghiên cứu nảy, cảc tác dụng ngoại ỷ nặng như tiêu chảy, nỏi ban, vả tăng men
transaminase gan có thể xảy ra ở liều trên Iiều khuyên cáo. Trong trường hợp nghi ngờ có
quá Iièu Tyracan, nèn ngừng dùng và điều trị triệu chứng.
BẢO QUẢN: Nơi khô thoáng, tránh ánh sáng, nhiệt 80 phòng ( ; 30°C).
HẬN DÙNG: 36 tháng kế từ ngảy sản xuất.
ĐÓNG GÓI: Hộp 3 vi x 10 viên nén bao phim
TIÊU CHUẨN CHẤT LƯỢNG: Tiêu chuẩn nhả sản xuất.
ĐỂ XA TẦM TAY CÙA TRẺ EM
THUỐC NÀY CHỈ DÙNG THEO ĐơN CỦA BÁC sĩ Ưư
ĐỌC KỸ HƯỞNG DẤN sữ DỤNG TRƯỞC KHI DÙNG
NÉU CÀN THÊM THÔNG TIN x… HỎI Ý KIỂM BÁC si
TÊN VÀ ĐỊA cui NHÀ SẢN qu7
còuc TY có PHẦN SPM tsm CORPORATION)
Ổ www.s m.com.vn
s pm Lộ 51. Đường số 2, KCN Tân Tạo, P. Tân Tạo A, Q. Binh Tân, Tp. HCM
ĐT: (08) 37507496 Fax: (08) 38771010
Tp. HCM, ngảy 22 tháng 01 năm 2013
Tống Giám Đốc
DS. Nguyễn Thế Kỷ
PHÓ CỤC TRƯỞNG
Jiỷugỵển “Vãn ỄỄỈổanắ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng