












“ ' ẮỔ/ẻốj
LABEL
BỘ Y TẾ
CỤC QUAN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
A Lẩn dauẩli'oĩfè
' . .
Piescmtior Only Meducmel Zyt I 9 a0 0 Zyt ' 9 a0
Venia hap recela , _ ' ,
abưaterone acetate acetato de abưaterona abưaterone acetate
uzuu ! IQ m nuun olqm um
ỄỄỀ²ẾẺcỀ…J…JIZTÊJZ * 250 mg 250 mg 250 mg
SĐK
ì“…ỂẵỂ’ỉ-"3'e-ệỹ“ " °"* °“*"“* tablets comprimidos tablets \
3'
ẵe
n…nmnuunnbml mc—m
un1xnuunulw Inmlmn-un '
Each tablet contains
250 mg abiraterone acetate
mmu-nnuuumỀn'tbnùwn Each tablet contains Cada comprimìdo contìene
250 mg abiraterone acetate , 250 mg de aoetato de abiraterona
Manuiaclưed hy/Fabncnơn por-
thecn Inc., 2100 Symex c… Oral administration only Administrar ủnicamente por vía oral Oral administratỉon only
Mrssissauga Omano. 1 SN 7149 Canada
Read me cackage ieailal beiđre use Lea et piospecm anins nc uwirar aste memcamerđn Raad tne package lealiei he'nra use
Keep cui oi reach oi chidưen. Mnntener iuars đơ aicance de tos n'I'ìos. Keep cut oi reach ot chilmen.
Packaged mc mlaseo bY' Women whu are ot may uc piegnanl shou d las mmues que esten o puđ›ersn estar Wnrnen whn aie … may he nregnant shnclu
Emnicado y ihmdo om nnl namic MIGA wưthout gtoves emharazadas no đebecđn manupulaf not hande ZYTIGA …mom qloves i
.ianssan-Czlag S.o A., v:a C Jansser 04010 ZYTIGA sn guanles _
Use as direcleđ hy vn… ohys cian Use as d—iecieư by your physmn
Botgo San Mlchele, lat…a Italy
,. umícelc segun las mstmccmnes ,
Store below 30 C, de su méd›co. Stove beiow 30 C,
Ahnacenar a una lemperatura
iniefioơ a Ios 30 'C
120 tablets 120 comprimldos 120 tablets
moc Ỏvl^ữuũssunĩ 0
Ý 1 uassuei
`
LABEL
packaging:
Zytigzr
ahlrntsronn acetatel
acetalo de nbintemm
250 mg
tabletslcomprimidos
120 tnhlels/ccmprìmidos
1811558n7
n u 1 … uu… 11 u
cnmmn, Women … n ot may ue meguni smmu nm nanelo
ZYT1C›A thul ư… Us: I! mm m you plwcun Em
IiHII…M ²50 mg ubưiơml amam Sims bntcw 301…
0… ……th nm Pfesenpt en Orly Mod cnc
Lu liprcsnccio anlu no uhl1ar au memnmnniu Manleru hnu ut me « bs
nvăm Lu n…ịuru que unrv o muon… um emunudas ne. dewnn ơnmwu
?VTIGA ;… guirles Uìltceie senín Iu mtvueccnu Bo su mch Cadn mmymdu
cuan 250 mg oe acalain oc nmumna. A'meu n um lln'clillnm man n ts
30 'C mmsuu tnielmemow ni onl Vonln hu;c r…
Manuhcunc uv/Fabncado uơ °aiheon Inc . 2100 Syniel Ceun
M:nusuơugl Onlan LsN 7K9. Cuudl
Pedunm am m… Wnaam y … mt
.unsnnCIag 54: A, va mưn oooic Bơm Snn Mơuln unm lưq
Jmuuvũanacd
m…
mun
t…
K ,
TÊN THUỐC ẵễ
ZYTIGA abim one acetate) viên nén 250 mg
\ \ ` -u
THẶĨSHPHAN Ẹộ LỰỢNG VÀ CHÁT LƯỢNG
Viê'nỈĩiẽn ẶYTIGA chỸr_đ 250 mg acetate abiraterone.
Về '…thèình ;phầìn— tả d,ươc²xem phần Danh sách cảc tả dược.
_ \ F: À … ’
DẠNÓ BÀo c1iẾ THUỐC
Viên nén , ,
Viên nén hình bầu dục, mảu trắng hoặc trăng mờ, khăc chữ AA250 trên một mặt.
ĐẶC TÍNH LÂM SÀNG
Chỉ định điều trị
ZYTIGA dùng kết hợp với prednisone hay prednisolone được chỉ định điều trị bệnh nhân ung
thư tiến liệt tuyến khảng cẳt tinh hoản di căn ở bệnh nhân nam người lớn mà bệnh đang tiến triến
trong khi hoặc sau một đợt hóa trị có chứa docetaxel.
Liều lượn và cách dùng
Liều khuyen cáo của ZYTIGA lả 1 g (4 viên nén 250 mg) liều duy nhất mỗi ngảy cách xa bữa
ãn. ZYTIGA nến được uống ít nhất hai giờ sau khi ãn và không nên ăn ít nhất trong vòng một
giờ sau khi uống ZYTIGA. Khi uống thuốc nên nuốt nguyên viên với nước (xem mục Hấp thu).
ZYTIGA được dùng với prednisone hay prednisolone Iiều thẩp. Liều khuyến cảo của prednisone
hoặc prednisolone là 10 mg mỗi ngảy.
Nên định lượng các men transaminase vả bilirubin trong huyết thanh trước khi bắt đằu điếu trị
với ZYTIGA, mỗi hai tuần cho 3 tháng đầu tỉên điếu trị và sau đó lả mỗi thảng. Cần kiếm tra
huyết' ap, kali trong huyết thanh và tình trạng giữ nước trong cơ thế định kỳ môi thảng (xem phần
Cảnh báo đặc biệt và thận trọng khi sử dụng)
Đỉều chỉnh liều cho bệnh nhân suy gan
Không cần điếu chỉnh liều cho bệnh nhân suy gan nhẹ. Không nên dùng ZYTIGA cho bệnh nhân
có suy gan mức độ vừa và nặng trước đó. (xem mục Trường hợp bệnh nhân đặc biệt).
Đối với các bệnh nhân có xuất hiện tình trạng độc tế bảo gan trong khi dùng ZYTIGA (alanine
aminotransferase (ALT) hoặc aspartate aminotransferase (AST) tãng hơn 5 lần cùa mức bình
thườn trên hoặc bilirubin tăng hơn 3 lần cùa mức bình thường trên) nên ngừng điếu trị ngay
cho đên khi các xét nghiệm chức năng gan trở về bình thường (xem phẩn Độc tính gan). Liều
điều trị lại sau khi chức năng gan hồi phục có thế giảm xuông mức 500 mg (hai viến) ngảy một
lấn. Đối vởí cảc bệnh nhân nảy nên theo dõi transaminases vả bilirubin huyết thanh ít nhất hai
tuấn một lẩn trong 3 thảng và mỗi tháng tiếp theo sau đó. Nếu tình trạng độc tế bảo gan lại xảy ra
với liếu đã giảm 500 mg mỗi ngảy, ngưng điếu trị ZYTIGA. Không nên dùng thuốc ở liếu giảm
chung với thức an (xem phần Liều lượng và cảch dùng).
Trong trường hợp bệnh nhân xuất hiện tình trạng độc tế bảo gan nặng (ALT hoặc AST tăng 20
lấn mức bình thường trên) vảo bất kỳ lủc nảo trong thời gian điếu trị, nên ngưng điếu trị và
không nên dùng lại ZYTIGA nữa.
Điếu chỉnh liếu cho bệnh nhân suy thận
Không cần điều chỉnh liều cho bệnh nhân suy thận (xem phần Trường hợp bệnh nhân đặc
biệt).
PI_ Zytiga_CCDS 25May2012_v1 1/ l 6
Chống chỉ định
Thai kỳ
ZYTIGA không dùng cho phụ nữ có thai hoặc có khả năng đang mang thai (xem phần Dùng
th uốc cho phụ nữ có lhai)
Cảnh bảo đặc biệt và thận trọng khi sử dụng
Cao huyết ảp, hạ kali máu vả gịũ nuóc do thừa corticoid khoáng
ZYTIGA có thế gãy ra cao huyết ảp, hạ kali máu vả giu nuớc co thể (xem phần Tác dụng ngoại
ỷ) do hậu quả cùa sụ ức chế CYP 17 lảm tăng nồng độ cảc corticoid chuyển hóa muối (xem phẳm
Co chế tác động) Việc sử dụng đồng thời một corticosteroid có tảc dung ức chế tiểt hormone
adrenocorticotropic (ACTH) dẫn đến ]ảm giảm xuất độ và độ nặng cùa cảc tảc dụng phụ nảy.
Cần chú ý khi điếu trị Cảo bệnh nhân có cảc bệnh nền kết hợp dễ bị ảnh hưởng xẳu bởi cao huyết
ảp, hạ kali mảu hay gỉữ nước cơ thể nhu suy tỉm, nhồi mảu cơ tim gần đây hay loạn nhịp thắt.
Nên cẩn thận khi dùng ZYTIGA cho bệnh nhân có tiến sủ bệnh tỉm mạch. Hiện chưa xảo lập
đuợc tính an toản cùa ZYTIGA trên bệnh nhân có phăn suất tống mảu thất trái (LVEF) < 50%
hay suy tim độ 111 hoặc IV theo phân loại cùa NYHA (trong nghiên cứu 301) hoặc suy tím độ II
đến độ IV theo phân loại cùa NYHA (trong nghiên cứu 302) (xem phẳu Tảc dụng ngoại ý và
Hiệu quả lâm sảng). Phải kiểm soát huyết áp và điều chỉnh tình trạng hạ kali mảu trước khi
dùng ZYTIGA. Nên theo dõi tình trạng huyết ảp, kaiỉ mảu và giữ nước cơ thể ít nhất mỗi thảng
môt lần
Độc tính gan
Các nghiên cứu lâm sảng đối chứng ghi nhận có tình trạng tăng mcn gan nhỉếu dẫn đến thay đồi
liều hoặc ngưng điều trị (xem phần Tác dụng ngoại ý). Nên định lượng transaminase vả
bilirubin huyết thanh trước khi khởi sự đỉếu trị với ZYTIGA, mỗi hai tuẫn trong ba thảng đầu và
mỗi thảng tiêp theo sau đó. Nên định lượng ngay các transaminase huyết thanh nếu có dấu hiệu
độc tế bảo gan xảy ra. Bất cú khi nảo ALT tăng cao hơn 5 lẳn hay bilirubin tâng trên 3 lẫn gỉởi
hạn bình thường trên phải ngưng ngay ZYTIGA và theo dõi sát chúc năng gan
Điếu trị lại vởi ZYTIGA chỉ khi xẻt nghìệm chức năng gan trở về múc ban đầu cùa bệnh nhân
và dùng ở mức Iiếu giảm. (xem phần Điều chình liều cho bệnh nhân suy gan).
Bất kỳ lủc nảo trong quá trình điều trị, nếu bệnh nhân bị độc tính gan nặng (ALT hoặc AST trên
20 lần giới hạn binh thường trên) phải ngưng ngay ZYTIGA vả không nến điều trị lại.
Nga ng corticosteroid vả khắc phục các tình huong stress
Cân để ý và theo dõi tỉnh trạng suy vỏ thuong thận khi bệnh nhân ngung prednisone hay
prednisolone Nên theo dõi cảc triệu chứng tăng corticoid chuyến hóa muôi nêu còn điều trị tiếp
tục ZYTIGA sau khi đã ngưng corticosteroid (xem phần Cao huyết ảp, hạ kali mâu và giữ
nước do thừa corticoid khoáng).
Có thể tăng liều corticosteroid trước, trong vả sau khi bị cảc tình huống stress cho cảc bệnh nhân
dang dùng prednisone hay prednisolone phải đối phó vởi với tinh trạng stress hỉếm nảy.
Sử dụng với hóa trị
Hỉện chưa xác lập được tính an toản và hiệu quả cùa việc sử dụng đồng thời ZYTIGA vởi hóa trị
lìệu độc tế bảo (xem Hiệu quả lâm sâng)
Tương tảc thuốc và cảc dạng tương tác khác
Thức ăn lảm gia tăng một cảch có ý nghĩa sự hấp thu abiratcrone acetate khi dùng chung thức ãn
với ZYTIGA. Chưa xác lập được tính hiệu quả vả an toản của ZYTIGA khi dùng chung với
thức ăn. Không được uống ZYTIGA cùng thức ăn (xem phần Liền lượng và cách dùng vả
Hâp thu).
Pl_ Zyriga_CCDS 25May2012_v1 2i`ló
Về mặt thực nghiệm, abiraterone có tảc dụng úc chế các men chuyến hóa thuốc ở gan CYPlA2,
CYP2D6 vả CYP2C8. Trong một nghiên cứu lâm sảng được thiết kế để xác định tảc động cùa
abiraterone acetate (phối hợp với prednisone) trên một liếu đơn theophylline vốn là cơ chẳt cùa
CYP1A2 người ta không ghi nhận sụ gia tâng nồng độ của theophylline trong cơ thể.
Một nghiên cứu tương tụ khảc nhằm xác dịnh tảc động cùa abiraterone acetate (phối hợp vởi
prednisone) trên lìếu đơn dextromethorphan cũng iả một cơ chắt chịu ảnh hướng bới CYP2D6,
ghi nhận nổng độ thuốc trong cơ thể (AUC) cúa dextromethorphan gỉa tăng tới gần 200%. Trị số
AUCụ cùa dextrorphan, một chắt chuyển hóa có hoạt tính cùa dcxtromethorphan, cũng tăng
khoảng 33%.
Cần chủ ý khi sử dụng ZYTIGA với cảc thuốc được chuyến hỏa hay được hoạt hóa bời
CYP2D6, nhất lả cảc thuốc có chỉ số diếu trị hẹp. Nên cân nhắc gỉảm liều các thuốc nảy.
Không có dữ liệu lâm sảng về việc sử dụng ZYTIGA với cảc thuốc là chắt nến cùa CYP2C8.
Phụ nữ có thai và cho con bú
Dùng thuốc cho phụ nữ có !hai
Chống chỉ định dùng ZYTIGA cho phụ nữ có thai hoặc có khả năng đang mang thai (xem phần
Chổng chỉ định).
Hiện không có dữ liệu liến quan đến việc dùng ZYTIGA trên phụ nữ có thai, do vậy khỏng sử
dung ZYTIGA cho phụ nữ có khả nảng đang mang thai. Việc dùng thuốc ức chế CYPI7 cùa
người mẹ có thế lảm thay đồi nồng dộ cảc nội tiết tố gây ảnh hưởng đến phảt triển thai nhi. (xem
phần Cơ chế tảc động vả Độc tính trên sỉnh sân).
Người ta chưa biết rõ abiraterone hay chắt chuyến hóa cùa thuốc có hiện diện trong tinh dịch hay
không. Bệnh nhân được khuyến cảo nên mang bao cao su khi quan hệ tình dục với phụ nữ mang
thai Nếu bệnh nhân quan hệ tình dục với phụ nữ có khả năng mang thai, thì bên cạnh sử dụng
bao cao su yêu cằu nên ảp dụng thêm biện phảp trảnh thai hiệu quả khảo.
Để tránh tảo hại do tiếp xúc với ZYTIGA, phụ nữ mang thai hoặc có khả năng có thai nên mang
phương tiện bảo họ khi tiếp xúc thuốc, thí dụ như găng tay
Dùng lhuốc Irong thời kỳ cho con bú
ZYTIGA không được dùng cho phụ nữ.
Không xác định được abirateronc acetate hay chất chuyến hóa của thuốc có được bải tiết qua sữa
người hay không.
Ảnh hưởng trên khả năng iái xe và vặn hảnh máy mỏc
Hiện chưa có cảc nghiên cứu về ảnh hướng cùa ZYTIGA trên khả năng lái xe hay vận hảnh mảy
móc. Nhiếu khả năng ZYTIGA ít ảnh huởng đển cảc khả năng nảy
Tác dụng ngoại ý
Cảo tảc dụng phụ thường gặp nhất thẩy với ZYTIGA là phù ngoại biên, hạ kali máu, tăng huyết
áp, nhiễm trùng đường tiết niệu, tiểu máu, tăng aspartate aminotransferase, tăng alanine
aminotransferase, khótiêu, vả gãy xương
ZYTIGA có thể gây cao huyết áp, hạ kali mảu và giữ nước cơ thể do hậu quả về dược lục hoc
cùa cơ chế tảc động cùa thuốc. Trong cảc nghiên cứu lâm sảng ghi nhận bệnh nhân dùng
ZYTIGA có tảo dụng corticoid chuyến hóa muôi cao hơn nhớm gìả dược: hạ kali mảu 21% so
với 11%, cao huyết áp 16% so với 11% và giữ nước cơ thể (phù ngoại biên) 26% so vởi 20%.
Tác dụng phụ hạ kali máu độ 3 và 4 chiếm tỉ lệ 4% và tác dụng phụ cao huyết ảp độ 3 và 4
chiếm 2% trong nhóm bệnh nhân dùng ZYTIGA. Nhũng ảnh hưởng do corticoid chuyến hóa
muối nhìn chung có thế được giải quyết tốt. Có thể lảm gỉảm xuất độ vả mức độ nặng cùa cảc tảc
dụng phụ nảy bằng cảch dùng đồng thời với một corticosteroid (xem phần Can huyết áp, hạ kali
máu vả giữ nưóc do thừa corticoid khoáng).
PI_ Zytiga_CCDS 25May2012_v1 3f16
Trong các nghiên cứu điếu trị bệnh nhân ung thu tiến liệt tuyến tiến triến di căn đã dùng thuốc
đồng vận luteinizỉng hormone-releasing hormone (LHRH) hay đã đuợc cắt tinh hoản trước đó,
ZYTIGA được dùng với lỉếu lg/ngảy kết hợp prednisone hay prednisolone liếu thấp (10
mglngảy)
Cảo tác dụng ngoại ỷ cùa ZYTIGA xảy ra với tần suất >l% (tất cả cảc độ) được trình bảy trong
Báng 1:
Bảng ị4a: Tảc dụng ngoại ý cũa ZYTIGA với tần suất 21% trong các nghiên cửu lâm ///ẢỔ
sảnga
ZYTIGA 1 g/ngăy vởi prednisone hay prednisolonc
n =i680“
Hệ cơ quan Tât cả cảc độ % Độ 3 Độ 4
, Tải: dụng phụ _ % %
Rôi loạn toản thân và tình trạng tại chõ do dùng thuốc
Phù ngoại bíên 26 1 <]
Rối loạn chuyến hỏa và dinh dưỡng
Hạ kali máu 2] 3 <]
Tăng trigiyceride mảu 2 ] và thời gian đến khi có tiến triển vẽ PSA được dựa trên tiếu chuẩn Nhóm iâm vỉệc
Ung thư Tuyến tỉến iiệt-2 (PCWGZ).
Trong nghiên cứu 302, các phương phảp điếu trị được ngưng tại thời điếm có tiến triến lâm sảng
rõ rảng. Điếu trị cũng có thể được ngưng tại thời điếm cỏ tiển triến trên X quang được xảo nhận
theo quyết định cùa nghiến cúu viên.
Sống không` bệnh tiên triến trên X quang được đánh giá dụa trên việc sử dụng các nghiên cứu
hình ảnh tuần tự theo quy định của tiêu chuẩn PCWGZ (đối với các tốn thuơng xuong) và tiêu
chuẩn đảnh giá đáp ứng trên khối u (RECIST) được sứa đối (đối với tồn thương mô mếm) Việc
phân tích cùa rPFS đã sử dụng đánh giá tìến triền trên X quan g được xem xét toản bộ
Tại thời điếm đánh giá rPFS theo kế hoạch đã có 401 biến cô tiến triến trên X quang, trong đó
150 (28%) bệnh nhân được điếu trị với ZYTIGA và 251 (46%) bệnh nhân được đìếu trị với giả
dược có bằng chứng cùa sự tiến triến trên x quang. Có sự khác biệt đáng kể về rPFS giữa cảc
nhóm điếu trị (xem Bảng 3 và Hinh i).
Bãng 3: Nghiên cứu 302: Sống không bệnh tỉến triến trên X quang của các bệnh nhân được
điếu trị hoặc với ZYTIGA hoặc với giả dược kết hợp với Prednisone hoặc Prednisolonc
cộng với các thuốc đông vận LHRH hay căt tinh hoân trước đó
ZYTIGA Giả dược
(N=546) (N=542)
Sống không bệnh tiến
triễn trên X quang
(rPFS)
Tiến trìển hoặc tử vong 150 (28%) 251 (46%)
Trun g vị rPFS theo Không đạt được 8.3
thảng
(95% CI) (11.66,NE) (8.12, 8.54)
Giá trị p* <0.0001
Tỉ số nguy hại** 0.425 (0.347, 0.522)
(95% CI)
NE= Not Estimatcd: khỏng ước tính được ` ' `
* Giá từ P được iây từ một phân tích Iog-rank được phân tâng theo thang đỉêm ECOG ban đâu (0 hoặc 1)
“ Tỉ sô nguy hại <] ưu thế cho ZYTIGA
Hình 1 — Đường cong Kaplan Mcier Curves biếu diễn Sống không bệnh tiến triển trên X quang
của cảc bệnh nhân được điều trị hoặc với ZYTIGA hoặc với giả được kểt hợp với Prednisone
hoặc Prednisolone cộng với cải: thuốc đỗng vận LHRH hay cắt tinh hoản trước đó
PJ_ Zytiga_CCDS 25May2012_v1 7/1 6
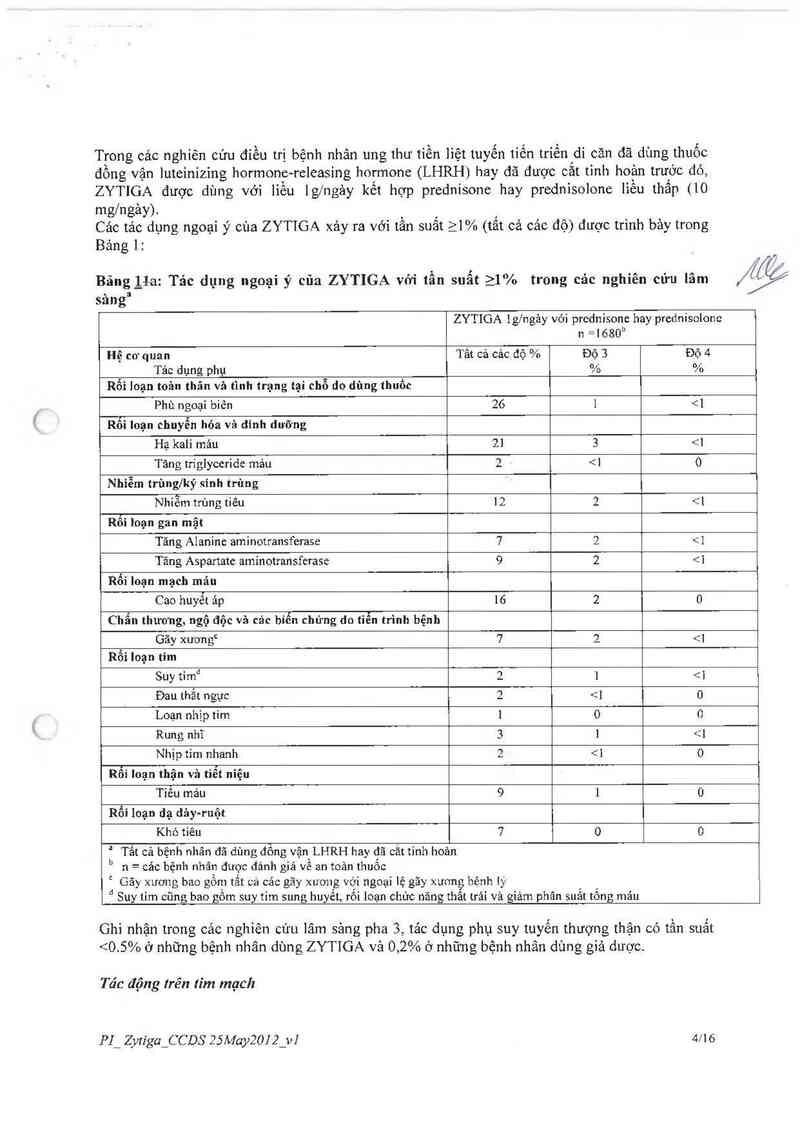
Sau khí 333 trường hợp tử vong đã được quan sảt, một phân tích như theo kế hoạch đã định về
sống còn toản bộ đã được tiến hảnh. Nghiên cứu được phá mù do dựa trên tẩm quan trọng của lợi
ích lâm sảng quan sát được. Hai mươi bảy phần trăm (147 cùa 546) bệnh nhân đuợc điếu trị với
ZYTIGA, so với 34% bệnh nhân được điếu trị với giả dược (186 cùa 542), đã qua đời. Sống còn
toản bộ lâu hơn ở nhóm ZYTIGA so với giả dược với nguy cơ từ vong giảm 25% (Tỉ số nguy hại
= 0,752; 95% CI: 0,606 -0,934). Giá trị p là 0,0097 mà không đảp ứng cảc giá trị định sẵn cho ý
nghĩa thống kê (xem Bảng 4 và Hình 2).
Bảng 4: Nghiên cứu 302: Sổng còn toân bộ của bệnh nhân được điều trị hoặc với ZYTIGA
hoặc với giả dược kết hợp vỏ'i Prednisone hoặc Prednisolone cộng với các chất đồng vận
LHRH hay cắt tinh hoản trước đó
1007
80e
on
c
o
›
E 60 '
co
: \
(Q 3
i _____ _
iẵ 40“ `._
.: - i_
:: ------- _ _ ,
Ễ `l
zo. ............
.o
â\o 20_
0
0 3 6 9 12 1 5 1 8
Thản g
AA 546 489 340 164 46 12 0
Gia dược 542 400 204 go ao 3 o
" * Giả dược—AA
toản bộ theo thảng
ZYTIGA GIA DƯỢC
(N=546) ffl=542)
Sống còn toân bộ
Tử vong 147 (27%) 186 (34%)
Trung vị thời gian Ễống còn Không dạt được 27.2
(95% CI) (không ước tính được, không (25.95, không ước tinh
ước tính được) được)
Giá trị p” 0.0097
Ti sốnguy hại ** 0.752 (0.606, 0.934)
(95% CX)
* Giá trị P được lẩy từ một phân tich iog-rank được phân tẩng theo thang điêm ECOG ban đâu (0 hoặc 1)
** Ti số nguy hại <] ưu thế cho ZYTIGA
Hình 2 —- Đường cong Kapian Meier Cưrves biếu diễn Sống còn trên bệnh nhân được điếu trị
hoặc với ZYTIGA hoặc với giả dược kêt hợp với Prednisone hoặc Prednisolone cộng với cảc
chất đổng vận LHRH hay cắt tinh hoản trước đó
PI_ Zytiga_CCDS 25May2012_v1
100 "zặf\
QD
G'
0
>
—:
23 807
lũ—
0
.E
—Ễ~
; 60—
..0
'E :
: ~1_
'f2 ' ........
%“ 40—
íO
Ế
ã
-E
Ê
.: 20
lc-
.8
G,\°
o 1 v 1
0 3 6 9 1 2 1 5 1 B 21 24 27 30 33
Thảng
AA 546 538 524 503 482 452 412 258 120 27 0 0
Giá dưoc 542 534 509 493 465 437 387 237 106 25 2 0
'" Giá dược _ AA
Bến cạnh sự cải thỉện về sống còn toản bộ vả rPFS quan sảt được, lợi ích của việc điều trị với
ZYTIGA so với giả dược đã được chứng minh trên tất cả các đánh giá về tiêu chỉ phụ như sau:
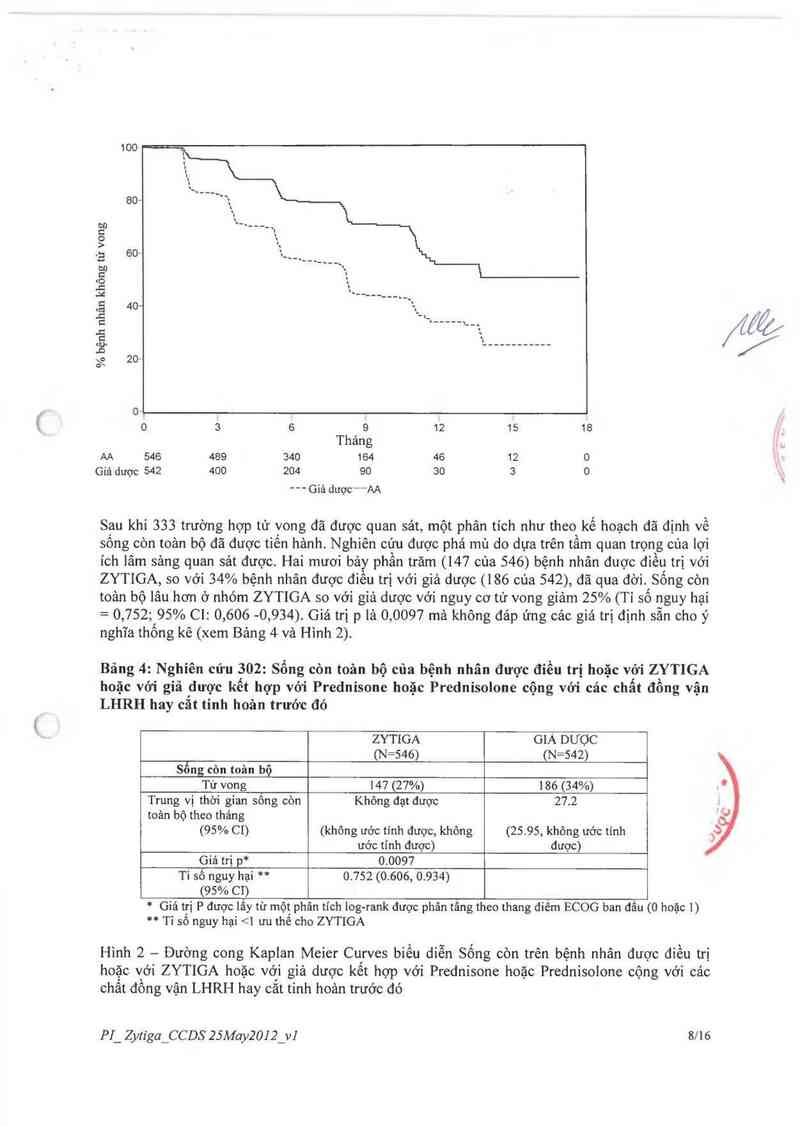
Thời gian cho đến khi có PSA tiến triển dựa trên tiêu chuẩn PCWG2: Trung vị thời gian cho
đến khi có PSA tiến triển lả ii,i thảng đối với bệnh nhân được điều trị với ZYTIGA và 5,6
thảng đối với bệnh nhản dùng giả dược (HR = 0,488, 95% Ci: [0.420, 0.568], p <0,0001). Thời
gian để có PSA tỉến triền lâu hơn gần gắp dôi với bệnh nhân điều trị ZYTIGA (HR = 0.488). Tỷ
lệ các bệnh nhãn được xác định có đảp ứng về PSA là cao hơn ớ nhóm điềti trị ZYTIGA so với
nhóm giả dược (62% so với 24%, p <0,000 [ ).
Thời gian đến khi sử dụng thuốc opioid để giảm đau ung thư: Trung vị thời gian đến khi sử
dụng thuốc opioid đế gỉảm đau ung thư tuyến tiến liệt đã khỏng đạt được cho bệnh nhân điều trị
ZYTIGA vả vởi bệnh nhân dùng giả dược là 23,7 thảng (HR = 0.686; 95% CI: [0,566. 0.833, p
=0,0001).
Thời gian cho đến khi bắt đầu hóa trị iiệu độc tế bỉto: Trung vị thời gian cho đến khi bắt dầu
hóa trị Iiệu dộc tế bảo là 25,2 tháng đối với bệnh nhân điều trị ZYTIGA và 16,8 thảng cho các
bệnh nhân dùng giả dược (HR = 0,580, 95% CI: [0.487, 0.691], p <0,0001).
Thời gian cho đến khi suy giảm hoạt động cơ thể theo thang điếm ECOG với điếm 21:
Trung vị thời gian cho đến khi suy giảm hoạt động cơ thể theo thang điềm ECOG với điếm 21 là
12,3 tháng đối với bệnh nhân điểu trị ZYTIGA và 10,9 thảng đối với bệnh nhân dùng giả dược
{HR = 0,821, KTC 95%: [0,714, 0,943, p = 0.0053).
Cảo tỉêu chí nghiên cứu sau đây đã chứng minh lợi thế có ý nghĩa thống kê ủng hộ cho việc diều
trị với ZYTIGA:
Đáp ứng mục riêu: đáp ứng mục tiếu được định nghĩa là tỷ lệ cảc bệnh nhân với bệnh có thể đo
lường được đạt được đảp ứng hoản toản hoặc một phần theo tiêu chuẩn RECiST (kich thước nốt
bạch huyết ban đầu phải ì 2 cm được xem là tổn thương đich). Tỷ lệ cảc bệnh nhân với bệnh có
thể đo lường được vảo thời điếm ban đầu đã có đảp ứng mục tỉêu lả 36% trong nhóm đỉều trị
ZYTIGA và 16% ở nhóm giả dược (p <0,0001).
PJ_ Zytiga_CCDS 25May2012_v1 9/16
/ỷ
Đan: Điếu trị bằng ZYTIGA 1ảm giảm đáng kể nguy co tiến triến múc dộ đau trung bình 18% so
với giả dược (p= 0 0490). Trung vị thời gian cho đến khi có tìến triển là 26, 7 tháng 0 nhóm đỉếu
trị ZYTIGA và 18 ,4 tháng ở nhóm giả dược
Thời gian dẫn đến chức năng suy giám theo thang điểm đảnh giả chửc nãng của điều trị
ung thu — tuyến tiễn Iiệt FACT- P (Tổng điếm): Điếu tii bằng ZYTIGA giám nguy cơ dẫn đến
chúc năng suy giảm theo thang điếm đảnh gìả chúc nãng cua điếu trị ung thu — tưvến tiến liết
FA-CT P (Tồng điểm) 22% so vởi giả dược (p — 0 0028). Trưng vị thời gian dẫn dến chúc năng
suỵ giảm theo thang điếm đánh giá chúc năng của điếu tii_ ung thu — tuyến tiến liệt FACT P
(Tồng điếm) là 12,7 tháng ở nhóm điếu trị ZYTiGA và 8 ,3 thảng ở nhóm giả dnợc
Nghiên cúu 301 (bệnh nhãn đã nhận được hóa trị liệu trước đó):
11% bệnh nhân tham gia trong nghiên cún 301 có diếm 2 theo thang diếm ECOG; 70“ /o có bằng
chứng X quang cùa bệnh tiến triến với có hoặc khỏng có sự tiến triến PSA, 70% đã nhận được
một hóa trị liệu độc tế bảo truớc đó vả 30% nhận đuợc hai hóa trị liệu độc tế bảo t1uớc đó. 11
bệnh nhân được điếu trị với ZYTIGA có hiện diện của di căn gan.
Bệnh nhân được khuyến cảo duy tri cảc thuốc nghiên cún cùa họ cho đến khi có tiến triến vế
PSA (được xảc định lả tăng 25% trên múc ban đầu cùa bệnh nhân hoặc mức gần triệt tỉêu) kết
hợp với tiến triến vế hinh ảnh X- -quang theo chuẩn đã được xác lập cùa đề cương nghiên cúu vả
tìến triến vế triệu chứng hay lâm sảng Tiêu chi hiệu quả chính cùa nghiên cứu là thời gian sống
còn toản bộ.
Trong một phân tích theo dụ định đã đuợc tiến hảnh sau quan sát thấy 552 trường hợp từ vong,
42% (333 trong 797) bệnh nhân đuợc điếu trị ZYTIGA so với 55% (219 trong 398) bệnh nhân
nhóm chứng đã qua đời. Trong đó, nhóm bệnh nhân điếu trị ZYTIGA có sự cải thiện trung vị
thời gian sông còn toản bộ một cảch có ý nghĩa thống kẽ. (xem Bảng 5 vả hinh 3) Một cập nhật
về phân tích sống còn đuợc tiến hânh khi có 775 truờng hợp tủ vong (chiếm 97% số tử vong
đuợc dụ tỉnh cho việc phân tích cuối cùng) đã đuợc quan sát Kết quả từ phân tich sống còn đuợc
cập nhật nảy phù hợp với phân tich sông còn bạn đầu (xem bảng 5).
Bâng 5: Nghiên cứu 30]: Thời gỉan sống còn toân hộ của các hệnh nhân được đỉều
trị ZYTIGA hay giả dược kết hợp vói Prednisone/Prednísolone cộng với
thuốc đổng vận LHRH hoặc cẳt tinh hoân trước đó
ZYTIGA (N=797) GIA DƯỢC
(N=398)
Phân tích sống eòn ban đẫn
Tử vong 333 (42%) 219 (55%)
Trung vị thời gian sống còn 14.8 (14.1, 15.4) 10.9(102, 12.0)
toản bộ theo tháng
(95% CI)
Giá trị p < 0.0001
Ti sỏ nguy hại* 0.646 (0.543, 0.768)
<95% cn
Cặp nhật phân tích sổng còn
Tử vong 501 (63%) 274 (69%)
Trung vị thời gian sông còn 15.8 (14.8, 17.0) 11.2 (10.4, 13.1)
toản bộ theo thảng
(95% Cl)
Ti sô nguy hại* 0.740 (0.638, 0.859)
(95% CI)
*Ti số nguy hại (Hazard ratio) <1 … mẽ về ZYTIGA
Pỉ_ Zyliga_CCDS 25May2012_v1 10/16
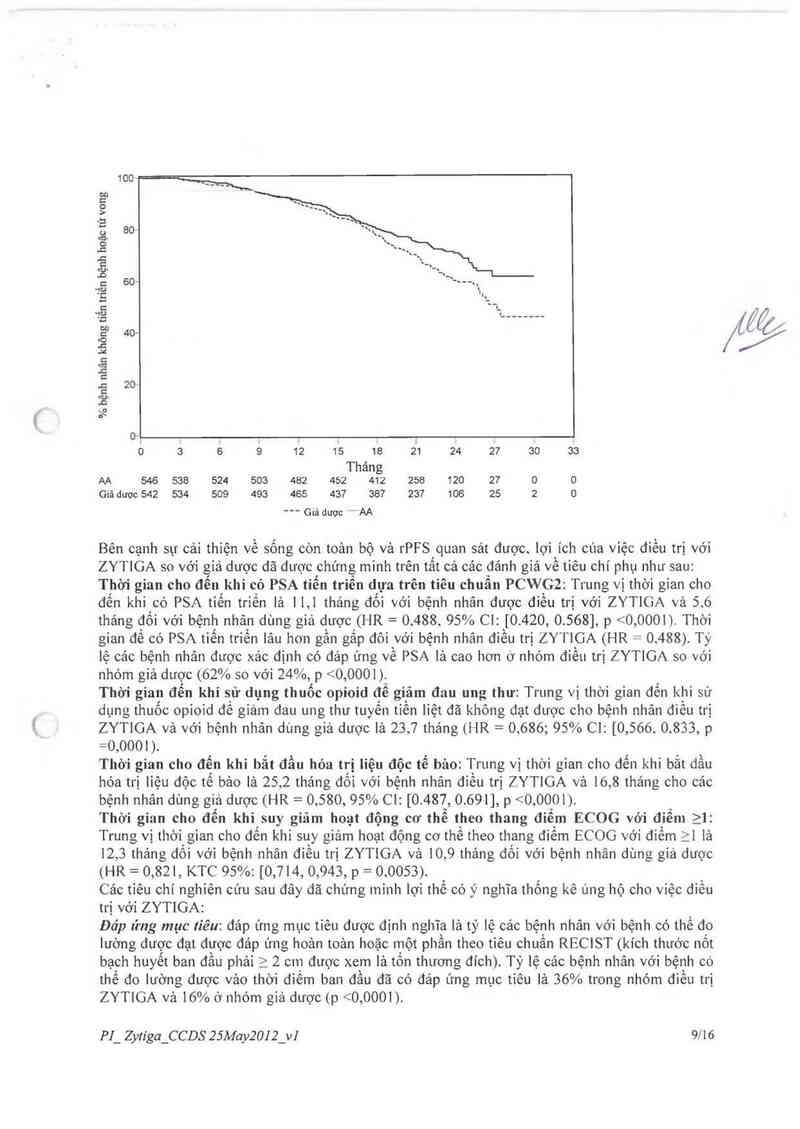
Vâo tất cả cảc thời điếm đánh giá bất kỳ sau khới sự điều trị vải tháng, bệnh nhân điếu trị với
ZYTIGA luôn có tỉ lệ sông còn cao hơn nhóm đôi chứng (xem Hinh 3).
Hình3— Đường biễu diễn sống còn theo Kaplan Meier của các bệnh nhân điếu trị
vói ZYTIGA hay giả được kết hợp vởi Prednisone/Prednisolone cộng với thuôc
đồng vận LHRH hoặc căt tinh hoãn trước đó
100
eoý ""
tị_ỵ ể ,
;: 30- "`~.__ {
0 "—-t
0 n
°° .
c -
«O ' …
m \. ,`_
e\c 40~ h'--c--,__
20
0 1 | 1 | 1
o 3 6 _ _ ~_ , _ ~* ~' 18 21
Thơi gian đen tu vong (thảng)
AA 797 736 657 520 282 68 2 0
Giá dược 398 355 306 210 105 30 3 O
---Giả dươi: AA
AA=ZYTIGA
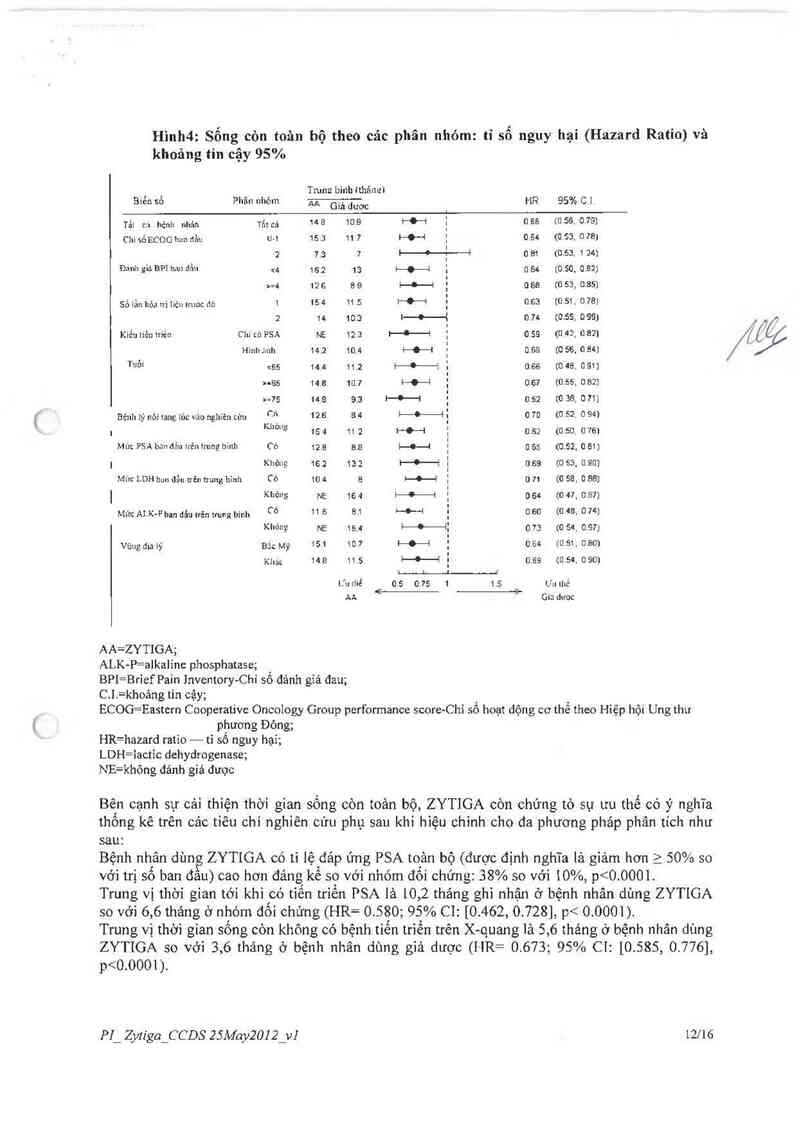
Phân tích sống còn dưới nhóm đã cho thấy nhóm điếu trị với ZYTIGA được hướng ích lợi sống
còn kéo dải (xem Hình 4).
PI_ Zytiga_CCDS 25May2012_v1 1 l/16
Hình4: Sống còn toân bộ theo các phân nhóm: tỉ số nguy hại (Hazard Ratio) và
khoảng tin cậy 95%
I _ Tnum binh (thảnưi
Bien sn Phim nhom AA Giả duơc . HR 95% 01.
. , _ . 1
Tảl i::ì hệnh nhản Thi ca 14 E 10-9 : D ỀE ffl 56- 0 79]
cm sồI-JCOG him dẩn … 15.3 11.1 i—Ọ—i ; 0.84 tu 53, o re;
1
I—Ồ—ơ——-² ,
2 7.3 7 ' n 81 to sa, 1 24;
Đánh gia BP1 han đẩu … 15,2 13 i—ợ—J ', n,64 m_so, n_az;
.
>=4 ưa as 1—ò—1 ; use tn sa, ossi
.
sớ lằn hớa ni iièn lmoc mi 1 15 4 11.5 t—O—~i } n.sa (0,51. 0.78)
2 14 10.3 i—O—t 0.74 m.ss. o ss;
!
Kiều iièii 1Yiển Chi … PSA NE 12_a i—l—i ; o.se tũ.4². 0 82]
!
Hỉnlt Íilllì 14.2 10 4 1-Đ-I : 0.59 (0 55, 0.64)
Tìlồi qớs 144 11.2 i—O——z 1 0.66 to 48. 0.511)
.
›-ss in c m] i—O—i : 0.67 to.ss, cm
›:15 us s.a I—O—l ị o_sz m 38. n m
| I
Bẻilh lý nói ianẹ 1ủc v:io nghiên :t'nl cn 12›6 814 ị—Ồ—ị : 0 70 m 52. G 90
. ffl'ò“ễ 15 4 11 ; l-O-—-l ; n 62 toso_ n 76)
Mức PSA bnn đán iiéii inmg binh Cò 12.8 8.8 ị—c—i E 0 65 (o_sz o 811
| i4 và ít
nhẳt có được một chỉ số đau sau đảnh giả lúc ban đầu (n=—512).
Bệnh nhân điếu trị ZYTIGA có tỉ lệ tiến triến đau thấp hơn nhóm chứng vảo cảc thời điếm 6
thảng (22% so với 28%), 12 thảng (30% so với 38%) và 18 tháng (35% so với 46%). Tiến triến
đau được định nghỉa 1ả tình trạng tăng chỉ số đảnh giá mức độ đau tồi tệ nhất theo BPI— SF > 30%
so với ban đầu trong 24 giờ qua mà không có giảm chỉ số dùng thuốc giám đau được ghi nhận
qua hai lẩn đảnh giá liên tiểp, hay sự gia tăng chỉ số dùng thuốc giảm đau > 30% được ghi nhận
qua hai lần đảnh giá iiên tiếp. Thời gian cho tới khi xuất hiện tiến triến đau tại mốc thứ 25% (25lh
percentiie) là 7 ,4 tháng của nhóm ZYTIGA so với 4, 7 tháng cùa nhóm chứng
Biến cố Iiẻn quan xương
Tỉ lệ biến cố liến quan xương được ghi nhận thắp hơn ở nhóm ZYTIGA so với nhóm chứng tại
cảc thời điếm 6 tháng (18% so với 28%), 12 tháng (30% so với 40%), và 18 thảng (35% so với
4.0%) Thời gian cho tới khi xuất hìện biến cố iiên quan xương tại môc 25% (25th percentile) cùa
nhóm ZYTIGA dải gấp đôi nhóm chủng: 9,9 thảng so vởi 4, 9 tháng. Biến có liên quan xương
được định nghĩa bao gôm: gãy xương bệnh lý, chèn ép tùy sống, xạ trị giảm đau triệu chứng ớ
xương, hoặc phẫu thuật xương.
Đặc tính dược động học
Giói thiệu chung
Dược động học cứa abiraterone vả abiraterone acetate sau khi uống abiraterone acetate được
nghiên cứu trên những người khỏe mạnh, các bệnh nhân ung thư tiền liệt tuyến tiến triển di căn
vả những người không bị ung thư có suy chức năng gan hoặc thận. Abiraterone acetate được
chuyến hớa nhanh chóng trong cơ thể thảnh abiraterone, một chất có tảc dụng ức chế sỉnh tồng
hợp androgen (xem phần Cơ chế tác động).
Hấp thu
Sau khi uống abiraterone acetate lúc bụng đói, abiraterone đạt nồng độ tối đa trong huyết thanh
sau gần 2 giờ.
Uống abiraterone acetate cùng với thức ản lảm gia tăng nồng độ trung bình abiraterone trong cơ
thể đến 17 lần so với lúc bụng đói, tùy thuộc vảo lượng mở có trong thức ân. Do sự thay đối tính
chất vả thảnh phần thúc ăn nên uống ZYTIGA trong bữa ăn có khả năng dẫn đến nhiến nồng độ
thuốc cao khác nhau Vì vậy không được dùng ZYTIGA với thức ăn Nên uống ZYTIGA ít
nhắt hại giờ sau khi ăn và không được an it nhất một giờ sau ưống thuốc. Nến nuốt nguyên viên
thuốc với nước (xem phẩn Liều lượng vả cảch dùng).
Phân bố và gắn kết protein _
Khả năng găn kết với protein trong huyết thanh nguời cùa M—C abiraterone iên tới 99. 8” â. Thê
tich phân bố biếu kỉến gân 5630 L, cho thắy abiraterone phân bố rộng rãi đến cảc tổ chức mô
ngoại biến.
Chuyến hỏa
Sau khi uống' C- abiraterone acetate dạng viên nang, abiraterone acetate được thùy phân thảnh
abiraterone. Chất nảy được tiếp tục chuyến hóa qua cảc phản ứng suifat hóa, hydroxy] hóa và
oxit hóa chủ yếu tại gan. Đa sô hoạt độ phóng xạ lưu hảnh trong máu (gần 92%) được thắy duới
PI_ Zytiga_CCDS 25May2012_v1 13/16
dạng cảc chất chuyến hỏa cùa abiratcrone. Trong 15 chẳt chuyến hóa phát hiện được có 2 chắt
chinh lả abiraterone sulphate vả N-oxide abiraterone sulphate, môi chât chiêm khoảng 43% tông
hoạt độ phóng xạ.
Thải trừ
Ở người binh ]thường, thời gian bản thải trung bình cùa abirateronc trong huyết thanh lả 15 gíờ.
Sau khi uống 14-C abiraterone acetate, gần 88% hoạt độ phóng xạ được thẳy trong phân vả gân
5% trong nước tiếu. Chẳt thải chính hiện diện trong phân lả abiraterone acetate dạng chưa
chuyến hóa (55% cùa liếu uống) và abiraterone (22 % cùa liếu uống).
Trường hợp bệnh nhân đặc biệt
Bệnh nhân suy gan
Dược động học cùa abirateronc được nghiên củu trên nhóm bệnh nhân suy gan nhẹ và trung bình
tổn tại trước dó (xếp loại Child- -Pugh A và B) và trên nhóm nguời chúng khỏe mạnh bình
thường. Sau khi uỏng liếu đơn lg, cảc bệnh nhân suy gan nhẹ vả trung binh đã gia tăng nồng độ
abiraterone trong cơ thể khoảng từ 11% (các bệnh nhân suy gan nhẹ) vả 260% (cảc bệnh nhân
suy gan trung bình) Thời gian bản thải trung binh cùa abiraterone kéo dải gần 18 giờ ở cảc bệnh
nhãn suy gan nhẹ và gần 19 giờ trên cảc bệnh nhân suy gan trung bình Không cân thiết phải
chinh 1iếu cho các bệnh nhân suy gan nhẹ trước đó. Không nên dùng ZYTIGA cho bệnh nhân đã
có suy gan trung binh hoặc nặng trước đó.
Dối với cảc bệnh nhân xưất hiện độc tính tế bảo gan trong khi dùng ZYTIGA có thế phải tạm
ngung vả chinh 1iếu (xem phần Liền lượng vả cảch dùng vả Độc tính gan).
Bệnh nhân suy thận
Dược động học cùa abiratcronc được so sánh giữa nhóm bệnh nhân bệnh thận giai doạn cuối
phải iọc thận định kỳ với nhóm người đối chúng khòe mạnh có chức năng thận binh thường phù
hợp. Nhóm bệnh nhân bệnh thận giai đoạn cuôi phải iọc thận định kỳ không ghi nhận có sự tảng
nông độ abiraterone sau uống liếu đon lg
Dùng ZYTIGA trên các bệnh nhân suy thận kể cả suy thận nặng không cần giảm liếu (xem phần
Điếu chỉnh Iiều cho bệnh nhân suy thận).
Ảnh hưởng trên khoảng QT
Abiratcrone không ảnh huớng đáng kể trên khoảng QT/QTc cùa điện tâm đồ theo kết quả nghiên
cứu về tính an toản trên tim mạch ở bệnh nhân ung thư tỉến liệt tuyến tiến triến di cản
Dữ liệu an toản tiến lâm sâng
Độc tính trên sinh sản
Trong các nghiên cứu khả nảng sinh sản trên chuột cải vả chuột đục, abiraterone acetate iảm
giảm khả năng sinh sản, tuy nhiên khả năng sinh sản phục hồi hoản toản trong vòng 4 đến 16
tuần sau khi ngung abiraterone acetatc
Trong một nghiến cứu độc tỉnh phảt triền trên chưột, abiraterone acetatc ảnh hướng lên quá trình
mạng thai bao gôm cả giám trọng iượng cùa thai nhi và giảm sụ sống còn. Anh hướng trên cơ
quan sinh dục ngoải đă được quan sảt thẩy mặc dù abiratemne acetate khỏng gậy quái thai
Trong các nghiến cứu về khả năng sinh sản và độc tính phải triến trên chuột nảy, tắt cả cảc ảnh
hướng đến liên quan đến hoạt động dược lý cùa abiraterone
Chống chỉ định dùng ZYTIGA cho phụ nữ mang thai (xem phần Chống chỉ định và Dùng
thuốc cho phụ nữ có thai).
Tính sinh ung thư và độc tinh trên gien
Không có nghiên cứu về khả năng sinh ung thư của abiratcrone acetate.
Cảo xét nghiệm căn bản xảc định độc tính trên gien bao gồm đột biến vi khuẩn … vitro (the
Ames test), sai lệch nhiễm sẳc thề tế bảo tuyến vú in vivo (dùng tế bảo iymphô người), định
PI_ Zyti'gti_CCDS 251111ay2012_v1 14716
lượng micronucleus chuột in vivo, ...không xác lập được khả năng gây ảnh hướng cho gien cùa
abiraterone acetate vả abiraterone.
Độc tinh trên động vật
Cảc nghiên cứu độc tính trên động vật ghi nhận lượng testosterone iưu hảnh trong mảu bị suy
giảm nặng dẫn đến sự teo nhỏ vả thay đổi hinh dạng vả mô học của các cơ quan sinh sản, tuyến
thượng thận, tuyến yên và tuyến vú Các thay đổi nảy có thể phục hồi hoản toản hay một phần.
Cảo thay đối ở cơ quan sinh sản vả các cơ quan nhạy androgen 1ả nhắt quán với tảc dụng duợc lý
cúa abiraterone. Các thay đồi nội tỉết lỉên quan đển điếu trị có thể hồi phục sau khoảng thời gian
4 tuân
Tinh trạng tăng sản tế bảo đường mật kèm theo tăng aikaline phosphatase vả/hoặc bilirubin toản
phẩn ở gan chuột và khi đuợc ghi nhận sau hơn 13 tuần điếu trị thuốc. Sau ngưng thuốc 4 tuần,
cảc chi sò huyết thanh hồi phục nhưng tinh trạng tăng sản tế bảo đường mật vẫn còn tồn tại.
Đục thùy tinh thể đuợc ghi nhận trên chuột sau 26 tuần đỉếu trị. Tốn thuơng nảy vẫn duy tri sau
ngưng thuốc 4 tuần. Không ghi nhận đục thùy tinh thế ở khi sau 39 tuần điếu trị
CÁC ĐẶC TÍNH RIÊNG CỦA THUỐC
Danh mục tá dược
Viên nén ZYTIGA có chứa cảc tả dược dưới đây:
iactose monohydrate
colloidal silicon dioxide
croscarmellose sodium
microcrystalline cellulose
magnesium stearatc
povidonc
sodium lauryl sulfate
Tương kỵ
Không ảp dụng
Hạn dùng
24 thảng kế từ ngảy sản xuất.
Không sử dụng thuốc hết hạn SỬ dụng được in trên bao bi.
Những lưu ý đặc biệt khi bão quản
Bảo quản dưới 30°C.
Tính chẩt vả thảnh phần của hao bi
ZYTIGA được cung câp trong lọ đựng mảu trắng tròn bằng poiyethylene tỉ trọng cao với nắp đậy
bằng poiypropylene. Dạng đóng gói lả hộp 1 lọ 120 viên nén.
Hướng dẫn sử dụng vả xử lý loại hớ
Theo cơ chế tảc động, ZYTIGA có thể gây ảnh hưởng xấu trên thai nhi; do vậy phụ nữ mang thai
hay có thế có thai cần được bảo hộ thỉch đảng khi xử 1ỷ thuốc, Thí dụ: mang găng tay (xem phần
Dùng thuốc cho phụ nữ có thai).
Thuốc không được sử dụng hay chắt thải cần được xử lý theo quy định cùa cơ quan quản lý địa
phương.
PI_ Zytiga_CCDS 25May2072_v1 15/16
Th uốc bán theo đ…
Không dùng thuốc đã quá hạn sử dụng ghi lrên bao bì.
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Nếu cần thêm thông tin, xỉn hõiỷ kỉến bác sĩ.
Để xa tầm ta y trẻ em.
Sản xuất và đóng gói sơ cấp tại:
Patheon Inc.,
2100 Syntex Court, Mississauga, Ontario, L5N 7K9, Canada
ĐT: 1-905-821-4001; Fax: 1—905—816-3953
Đóng gói thứ cấp vả xuất xưởng thảnh phẳm bới:
Janssen— Cilag S.p.A
Via C. Janssen, 04010 Borgo San Michele, Latina, Ý
ĐT: + 3907736161; Fax: + 390773²41312
PHÓ cục TRUỞNG
Jiỷmyẫt AVãn %ĨểM'lẩ
PJ_ Zytiga_CCDS 25May2012_v1
16/16
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng