





77 mm x 29 mm
.Aoưi/ii
BỘ Y TẾ
’ CỤC QUẢN LÝ nươc
113M.L39 ĐÃ Ph Ê DL'\ ỆT
E)
Lân đauÁẵ/ỔJaỄW
Waming: Wxỉc lgenl
²mg To be supplied ngeỉnst
, mmg demand from Cancer
l Dossge:Asủededbythe Howũls. Institutbns and
physỉdan. ReIer lo me
tendJsed pedt haeft bơ
daủismdoage.diedim
1 tnruseaMpvemutảons
% Slơehncoddryplaon
temperahne not emeding ưc
Ptoiecưmmligiti.
RecorsMnm Remnstime
aminst ptescription of a
E . ,
1with2mldo.ữbSWm
m M… … mu SĐK
ChlotidelnịeetiontlSP nụmmwm
R Keep out of reach of children. P lũ benh
Carefully ruad the mmving : … ²
. mu & unuh
ZYOCADE-ng ,……w. _ … ZYOCADE-ng a……………
……:J"h…:h…… ……WđhfW
.. In ra n. .. Dmnủđimkh'nhì í1m
Lyophtltzed Contrưindimtions: Lyophtitzed nẵtgụzn 'ỞmmuịỀở
’ III llủq
For I.V lnhsitm mly ỂẸẸự "“ "… '"“" '“ Fơ w mam only um m… … …,
. i . N : Ùillyuh lẻ III Mkytuum
Single Dose Vlal Camiom m, Wed,… Single Dose Via! a_tmmmmm _
. il Gunmdiũmmmm
. | should … be used « dmmdctmhwmbủcdưn
1 containsvisible putumlde mmwmửùmmm
G mdíuaũenecomt'tulim G ửỀusễmmorfflỉ
Hanufadued by: Shu… '
W: W! Phlnnnouuticals Ib……
Ị GETWELL 474. Udyog Vihar, Phasev. GETWELL nc.umw-. tìm
1 - Guụm. Mnnam - 122010. ~ ~fflne-m_ :
1 India. mọnủmk ,
ỉ Barcode
Composltỉon:
Each viat oontains Rx Presu'ution Dmg _ ›
Bortezomb 2 mg To be supplued agalns
Mannitol BP 20 mg demand irom Cancer
DulÌqo: Asẵlraded by the Hospitais. tnsuuho` ' ns 01ẹnd
phys cisn. R et to the endosed EfR; against ptesơiptỉon a
pack lnsen tor details on dosage. Canoer s @fst on _
dlreotion for use and uammiona ZYOCAD "2 mg pe "
Store … a mo! dly plam ' ' Wg. Lit;` No.:
temperatum not emoedng 3ơ’C Lyophulguzed Bam Nu:
i` Pmted fmm iight For LV lntusm only Ề gẫễitlhnum ì
R_eoonstỉluh onzooRe nstique ' p dơmmlyy ;
… ……hhẳf'wthww S'"ế“'°°“°wa' … ……b, *
6 a on an a :
Clutlon: This injedion ca Mls Gemell Phirlluneutials
shoutd not be uoed it a 474. Udyog Whar. Phase V.
oontains visibte D²ỦWW GETWELL Gurgann. Huyma - 122016. India. '
matter after iemnstitutiơh ,
N-
xo w1' ;ịWỄ
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Thuốc nảy chỉ dùng khi có sự kê đơn của thầy thuốc.
Nếu cần thêm thông tin xỉn hỏi ý kiến của thầy thuốc.
Đế xa tầm tay của trẻ em
ZYOCADE - 2mg
THÀNH PHẢN:
Mỗi lọ chứa:
Dươc chất:
Bortezomib ............................. 2 mg
Tá dươc:
Mannitol, tettiary-butyl alcohol, nước pha tiêm.
DƯỢC LỰC HỌC
Cơ chế tác động:
Bortezomib là chất ức chế đảo nghịch hoạt tính giống chymotrypsin trên proteasom 268 của tế bảo
động vật có vú.
Proteasom 268 là phức hợp protein lớn thoái biến protein ubiquitin. Tồn tại trong cơ thể con đường
ubiquitin-proteasom đóng vai trò thiết yếu trong điều hòa nồng độ cảc protein đặc hiệu nội bảo, do
đó duy trì hằng định nội mô bên trong tế bảo. Ửc chế proteasom 268 ngăn chặn sự phân giải protein
đich mã có thể ảnh hướng dòng thảo tín hiện bên trong tế bảo Sự cản trở cơ chế hằng định nội mô
bình thường có thể dẫn đển chết tế bảo. Thử nghiệm đã khẳng định rằng bortezomib\l thúốc độc
tính tế bảo đối với nhiều loại tế bảo ung thư khác nhau trên ín vitro. Bortezomib gâth't hoãn sự
phảt triền khối u trên in vivo theo kiểu khối u không lâm sảng, bao gồm 11 đa tủy
DƯỢC ĐỘNG HỌC
Sau khi tiêm tĩnh mạch liều 1, 3 mglm², nồng độ bortezomib trong huyết tương đạt được tối đa
trung bình là 509 nglml (trong khoảng từ 109 đển 1300 ng/ml) trên những bệnh nhân đa u tùy và có
độ thanh thải trong khoảng từ 31 đến 169 mllphủt. Thời gian bản thải trung bình cùa bortezomib
sau khi dùng liều đẫn tiên từ 1,45 đến 2 ngm² trong khoảng từ 9 đến 15 giờ ở những bệnh nhân có
khối u ảc tính tiến triến.
Phận bố:
Thể tích phân bố trung bình của bortezomib từ 498 đến 1884 L/m2 sau iiều đơn hoặc liều lặp lại 1 ,3
mg/m2 ở bệnh nhân đa u tùy. Điều nảy cho thấy bortezomib phân bố rộng rãi ở cảc mô ngoại biến.
Tỷ lệ gắn kết cùa bortezomib với protein huyêt tương người trung binh khoảng 83% trên khoảng
nồng độ từ 100-1000 nglmL.
Chuyển hóa:
Trong nghiên cứu in vỉtro cho thấy bortezomib được chuyến hóa chủ yếu bằng cách oxy hóa thông
qua men cytochrom P450. Đường chuyển hóa chính là khử gốc boronat tạo thảnh 2 chất chuyển
hóa khử boronat và sau đó chịu sự thùy phân để tạo ra nhiều chất chuyến hóa. Chất chuyến hóa
deboronat-bortezomib là chất không có hoạt tính.
Thải trừ:
Đường thải trừ của bortezomib chưa được xác định ở người.
CHỈ ĐỊNH
ZYOCADE-2mg được chỉ định để điều trị bệnh đa u tủy ở những bệnh nhân đã nhận được it nhất 1
đợt diều trị trước đó
ZYOCADE— —2mg dùng phối hợp với melphalan vả prednison được chỉ định để điều trị ở những
bệnh nhân không được điều trị đau tủy từ trước, không đủ điều kiện để hóa trị liệu liều cao để ghép
tủy xương.
ZYOCADE-2mg được chỉ định dùng đơn trị liệu để điều trị đau tủy tiến triến ở những bệnh nhân
đã điều trị ít nhất một lằn trước đó nhưng không phù hợp để điều trị tủy xương.
.OMSÔJ,
CHỐNG CHỈ ĐỊNẸ
ZYOCADE-ng chông chỉ định cho bệnh nhân mẫn cảm với bortezomib, boron hoặc manitol.
LIÊU DÙNG VÀ CÁCH DÙNG
Liều dùng
Đơn trị lìệu
Liều khuyến cảo cùa bortezomib là 1 ,3 mg/m²fdiện tich bề mặt cơ thể được sử dụng tiêm tĩnh mạch
bolus 3- 5 giây, mỗi tuần 2 lần trong 2 tuần (ngảy l, 4, 8 vả 11) tiếp theo nghỉ 10 ngảy (từ ngảy 12—
21). Vởi liệu trinh đỉều trị kéo dải hơn 8 chu kỳ của ZYOCADE- -2mg, có thể dùng liều cùa
bortezomib theo phảc đồ chuẩn hoặc phảc đồ duy tri mỗi tuần 1 iần trong 4 tuần (Ngảy thứ 1,8, 15,
22) tiếp theo nghỉ 13 ngảy (tù: ngảy thứ 23 đến ngảy thứ 35). Nên ngưng ít nhất 72 giờ giữa 2 iiều
điều trị liên tìếp
Điều chĩnh liều và tái khởi đẩu điều trị
Điều trị bằng bortezomib nên được ngưng ngay khi ghi nhận độc tính không thuộc hệ tạo máu múc
độ 3 hoặc độc tính thuộc hệ tạo mảu mức độ 4 ngoại trừ bệnh lý thần kinh như thảo luận bên dưới
(xem phần Chú ý để phòng và thận trọng lúc dùng) Một khi cảc triệu chứng về độc tinh đã được
giải quyết, điều trị bằng bortezomib có thể bắt đầu lại ở liều giảm 25% (1 ,3mg/m²lliều được gỉảm
xuông 1,0mg/mZ/liếu;1,0mg/mzíliều giảm xuống 0 ,7mg/mzlliều)
Báng 1,“ Điều chỉnh liều được `khuyến cáo cho những bệnh nhân dùng bortezomib có liên quan đến
đau rhán kinh hoặc bệnh lý thán kinh cám gía'c ngoại biên
Mưc độ các dẫu hiệu và triệu chứng đau Điều chỉnh liễu và phảc đồ
thân kính ngoại biên
Mức độ 1 tđị cảm, yếu vả/hoặc mất phản xạ) Không cằn điều chỉnh liều
mã không đau hoặc không mât chức năng
Mức độ 1 vởi đau hoặc mức độ 2 Giảm bortezomib xuống còn 1,0 mg/m2
(cản trở chức năng nhưng không cản trở cảc
1 hoạt động sông hăng ngảy)
' Mức độ 2 vởi đau hoặc mức độ 3 Ngưng bortezomib cho đến khi độc tinh được
(cản trở cảc hoạt động sống hằng ngảy) giải quyết. Khi giải quyết xong độc tinh khởi
đầu lại điều trị bằng iiếu bortezomib được
giậm đến 0 ,? mg/rn2 và thay đối lịch trinh
điếu trị mỗi tuần 1 lần.
Mức độ 4 (bệnh lý thần kinh cảm giác lảm Ngưng bortezomib
mất khả năng hoạt động hoặc bệnh lý thần
kinh vặn động có thể đe dọa tinh mạng hoặc
dẫn đến bị liệt)
Đối tượng đặc biệt
Suy gan
Bortezomib chưa được nghiên cứu ở bệnh nhân suy chức năng gan Suy gan nặng có thế có ảnh
hướng đến việc loại bỏ bortezomib và có thế lảm tăng khả nãng tương tác với các chẵt at tính
khác. Bệnh nhân có chức năng gan bị suy giảm nên được đỉếu trị với sự cẩn trọng và cầhẺếm xét
giảm iiếu dùng.
Suy thận
Dược động học của bortezomib không bị ảnh hưởng ở những bệnh nhân suy thận nhẹ đến trung
binh (Hệ số thanh thải creatinin (CrC1) › 20ml/phút/l,73m²). Do đó, không cằn thiết phải điều
chỉnh liều bortezomib cho những bệnh nhân nảy. Chưa được biết dược động học cùa bortezomib có
bị ảnh hưởng ở những bệnh nhân suy thận nặng hay không (Hệ số thanh thải creatinin (CrCl) <
20ml/phút/ 1,73m2) Lọc mảu có thế lảm giảm nông độ thuốc, do đó nên tiêm bortezomib sau khi
lảm các thủ tục thấm tảch
l«lI--`
Sử dụng trong lão khoa:
Không có bằng chửng cho thấy cần phải điếu chỉnh liềuờ nhũng bệnh nhân trên 65 tuối.
Sử dụng cho trẻ em:
Sự an toản và hiệu quả của bortezomib ở trẻ cm dưới 18 tuổi chưa được thiết lập.
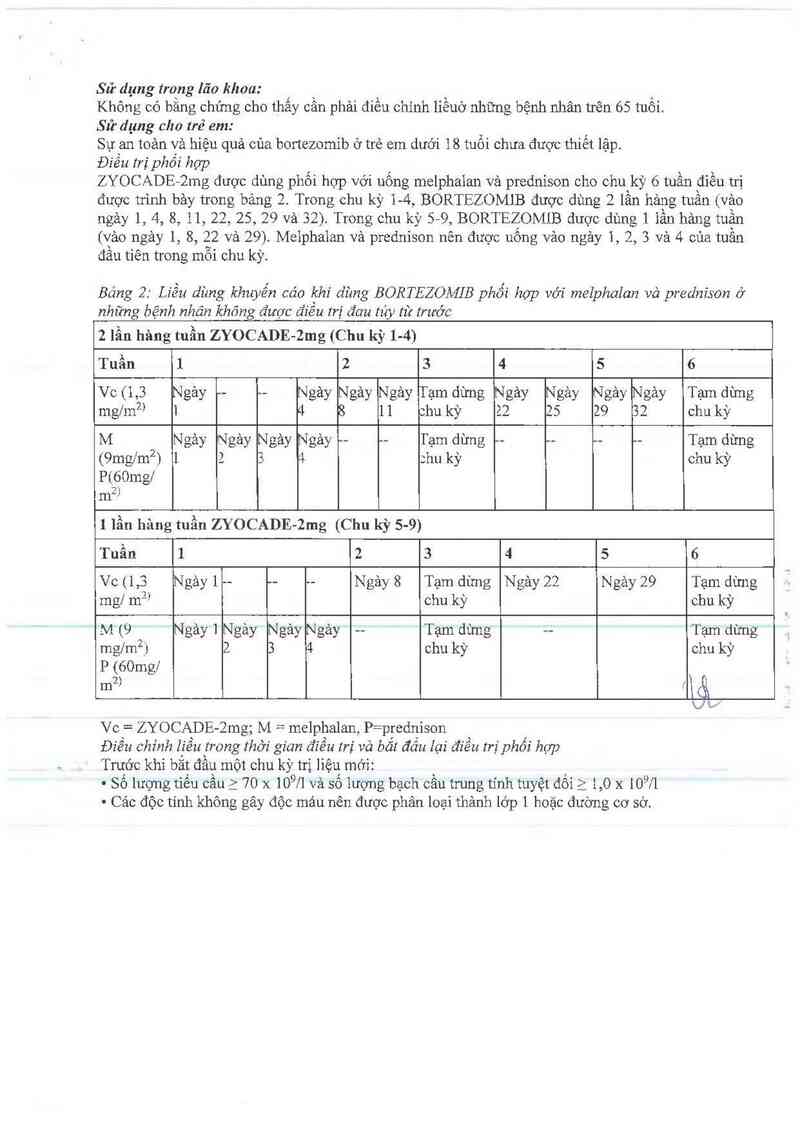
Điều trị phối họp
ZYOCADE-2mg được dùng phối hợp với uống melphaian vả prednison cho chu kỳ 6 tuần điều trị
được trinh bảy trong bảng 2. Trong chu kỳ 14 BORTEZOMiB đuợc dùng 2 lần hảng tuần (vảo
ngảy 1, 4, 8, 11, 22, 25,29 và 32). Trong chu kỳ 59 BORTEZOMLB được dùng 1 iần hảng tuần
(vảo ngảy 1, 8, 22 và 29). Meiphalan vả prednison nên được uống vảo ngảy 1, 2, 3 và 4 của tuần
đầu tiên trong mỗi chu kỳ.
Báng 2: Liều dùng khuyến cáo 211: dùng BORTEZOMIB phối hỌp với melphalan vả prednison ở
những bệnh nhãn không được điêu trị đau tủy từ trước
2 lần hâng tuần ZYOCADE-ng (Chu kỳ 14)
Tuần 1 2 3 5 6
Vc (1,3 Ngảy ~- -— Ngảy Ngảy Ngảy Tạm dừng Ngảy Ngảy Ngảy Ngảy Tạm dừng
mghn²> 1 4 8 1 1 :hu kỳ 22 25 29 32 chu kỳ
M Ngảy Ngảy Ngảy Ngảy —— -— Tạm dừng - —— -— … Tạm dừng
(9mg/mz) l 2 3 4 :hu kỳ chu kỳ
P(GOmg/
m²)
1 lần hảng tuần ZYOCADE-2mg (Chu kỳ 5-9)
Tuần 1 2 3 5 6
Vc (1,3 Ngảy 1 -- -- - Ngảy 8 Tạm dừng Ngảy 22 N gảy 29 Tạm dừng
mg/ m²’ chu kỳ chu kỳ
M (9 Ngảy 1 Ngảy Ngảy Ngảy -- Tạm dừng —— Tạm dừng
mg/m²fJ 2 3 4 chu kỳ chu kỳ
P (60mg/ \
2) : &
Vo = ZYOCADE-2mg; M = melphalan, P=prednison
Điều chỉnh lịều trong rhời gian điều lrị và bắt đầu lại điều trị phối họp
Trưởc khi băt đầu một chu kỳ trị liệu mởi:
' Số lượng tiểu cầu z 70 x 109/] và số lượng bạch cầu trung tinh tuyệt đối 2 1,0 x 109/l
- Các độc tính không gây độc máu nên được phân loại thảnh lớp 1 hoặc đường cơ sớ.
Ự\z
Báng 3: Sửa đổi liều trong các chu kỳ liểp theo
Độc tính Sửa đổi Iiễu hoặc hũy
Độc tỉnh huyết học trong chu kỳ
Nếu giảm bạch cầu trung tính mửc độ 4 kéo Xem xét giảm lỉều melphalan xuống 25% trong
dải hoặc giảm tìễu cầu, hoặc giảm tiễu cầu có chu kỳ tỉếp theo,
chảy máu được quan sát thấy trong chu kỳ
trước
Nếu số lượng tiểu cầu 5 30X10Ễ/1 hoặc ANC S Điếu trị với ZYOCADE-ng nên được giữ lại
0,75X109/1 vảo ngảy dùng thuôo ZYOCADE—
2rng (trừ Ngảy l)
Nếu một số liếu ZYOCADE-ng trong chu kỳ Lỉều dùng ZYOCADE- -2m2g nên được 2giảm với
được giữ lại (2 3 liếu trong thời gian dùng 2 nồng độ liếu (từ 1 ,3 mg/m2 đến ] mg/mẵ hoặc từ
lần mỗi tuần hoặc 2 2 liếu trong thời gỉan lrng/m2 đếnO ,7mg/m2)
dùng thuốc hảng tuần)
Mửc độ 2 3 không độc lính huyết học Điều trị ZYOCADE-2mg nên được giữ lại cho đến
khi cảc triệu chứng độc tính đã được giải quyết đến
mửc độ 1 hoặc đường cơ sở. Sau đó, ZYOCADE-
2mg có thế được bắt đầu lại với một liều giảm (từ
1,3 mg/m² đến ] mg/m², hoặc từ 1 mg/m2 từ 0,7
mg/mẫ). Đối với ZYOCADE-ng - liên quan đến
đau thân kinh vả/hoặc bệnh lý thần kinh ngoại vi,
giữ vảlhoặc điều chỉnh ZYOCADE-ng như được
trinh bảy trong Bảng 1 .
Cảch dùng:
Bortezomib iả một tảc nhân chống ung thư. Nến thận trọng trOng suốt quá trình bảo quản và pha
chế. Nên sử dụng kỹ thuật tiệt trùng thích hợp Cần sử đụng găng tay và đồ bảo hộ để tránh tiếp xúc
trực tiếp với da.
Hoản nguyên/Pha chế dung dịch để tiêm tĩnh mạch:
Mỗi lọ ZYOCADE- -2mg chứa bonezomib 2 mg phải được pha vởi 2 ml dung dịch natri clorid 0,9%
pha tiêm Dung dịch sau khi pha phải trong suốt, không mảu.
Chế phầm đế tiêm nên được kiếm tra bằng mắt thường về cặn vả. sự đồi mảu trước khi sử dụng kể
cả lọ thuốc và dung dịch tiêm. Nếu có đổi mảu vả cặn, không nên sử dụng
Dộ ổn định
ZYOCADE- -2mg không chứa chất bâo quản Sau khi pha theo chỉ dẫn, bortezomib có thế đươc bảo
quản ở 25°C. Bortezomib sau khi pha nên dùng trong vòng 8 tiếng. Dung dịch sau khi pháỏồtthế
được lưu trữ trong lọ gốc vả/hoặc bơm tiêm trưởc khi dùng Tồng thời gian bảo quản dung dịch sau
khi pha không quá 8 gỉờ
CẢNH BÁO VÀ THẬN TRỌNG
Bệnh thẳn kinh ngoại biên:
Điều ưị với bortezomib gây ra bệnh lý thẩn kinh ngoại biên mả nối bật là bệnh lý thần kinh cảm
giác ngoại biên. Tuy nhỉên, một vải trường hợp được bảo cảo bệnh lý thần kinh vận động trầm
trọng có kèm hoặc không kèm theo bệnh lý thần kinh cảm giảc ngoại biên. Bệnh nhân có trước
những triệu chửng (_tê, đau hoặc cảm giảc nóng rảt ởtay hoặc chân) vảlhoặc các dấu hiệu đau thần
kinh ngoại biên trước đó có thế sẽ bị nặng thêm (bao gồm mức độ 2 3) trong khi điều trị.
Vì vậy, tất cả bệnh nhân dùng bortezomib nên được giám sát cảc triệu chúng đau thần kinh, như lá
cảm giảc nóng rát, tăng cảm, dị cảm, khó chịu, đau thần kỉnh hoặc suy kiệt. Bệnh nhân mới bị đau
thần kinh ngoại biên hoặc bị nặng lên có thế cằn thay đồi liều và thời gian điều trị bortezomib (xem
Liều dùng và cảch dùng).
Hạ huyết áp
Nên thận trọng khi điếu ưị cho những bệnh nhân có tiến sử ngất, hạ huyết áp và những bệnh nhân
bị mẩt nước Kiếm soát hạ huyết ảp thế đứng có thể bao gồm điều chỉnh thuốc điếu trị tăng huyết
ảp, bù nước, vả/hoặc dùng mineraicortỉcoid (xem Tác dụng không mong muốn).
Rối loạn tim mạch:
Bệnh nhân có yếu tố nguy cơ, hoặc có bệnh tim nên được theo dõi chặt chẽ, đặc biệt lá ở những
bệnh nhân có QT kéo dải.
Cảo thử nghiệm trong phòng thí nghiệm:
Theo dõi đếm mảu toản phần (CBC) thường xuyên khi điếu trị với bortezomib.
Các xét nghiệm
Nên xét nghiệm thường qui thông số huyết đồ (đếm máu toản phần) trong suốt quá trinh điếu trị vởi
bortezomib.
Tảc dụng phụ đường tiêu hoa.
Điều trị bảng bortezomib có thể gây buồn nôn, tiếu chảy, tảo bón và nôn {xem Tác dụng ngoại ỷ)
có thế cân điếu trị bằng những thuốc chống nôn và chống tiêu chảy. Bù nước và chất điện giải nến
được sử dụng để ngăn ngùa tình trạng mất nước
Giảm tiêu cáu:
Bortczomib có liên quan tới giảm tiếu cầu và giảm thấp nhất ở ngảy thứ 11 ở mỗi chu kỳ và trở về
mức ban đẩu ở trước chu kỳ kế tiếp Số lượng tỉếu câu giảm ở môi chu kỳ và sự phục hồi duy trì
hằng định trong suốt quá trinh điếu trị và không có bằng chứng cho thấy có giảm tiếu câu tich lũy
Nên ngưng điều trị với bortezomib khi lượng tiếu câu < 25. OOO/ịiL vả giảm liếu khỉ đùng lại thuốc
(xem Liều lượng, cách sử dụng và Tác dụng ngoại ỷ).
Hội chửng ly giải khối u.
Bởi vì bortezomib 1ả thuốc độc tế bảo và có thể nhanh chóng tiêu diệt cảc tế bảo ác tính, cảc bìến
chứng hội chứng ly giải khối u có thể xảy rạ. Bệnh nhân có nguy cơ bị hội chứng 1y giải khối u là
những bệnh nhân có tổng khối tế bảo ác tinh lởn trưởc điếu trị. Những bệnh nhân nảy nên được
giảm sát chặt chẽ và cần các biện phảp phòng ngùa thich hợp.
Biển chứng ở gan:
Hiếm gặp cảc trường hợp suy gan cấp ở bệnh nhân dùng cùng lúc nhiến Ioại thuốc và đang có
những bệnh lý nghiêm trọng khác. Những rối loạn khảc tại gan được báo cảo 1ả tăng cảc mcn gan,
tăng bilirubin mảu và viêm gan. Những thay đồi nảy có thể trở lại bình thường khi ngưng sử dụng
bortezomib.
0 bệnh nhân suy gan:
Bortezomib được chuyển hóa bới men gan và độ thanh thải bortezomib có thể giảm ở bệnh nhân
suy gan. Những bệnh nhân nảy nên được giảm sát chặt chẽ về độc tính khi điều trị bortezomib.
Bệnh nhán bị suy thận:
Không có thông tin lâm sảng có sẵn về việc sử dụng cảc bortezmnib ở những bệnh nhân có độ
thanh thải creatinin thắp hơn 13 mllphủt và bệnh nhân chạy thận nhân tạo. Bệnh nhân suy thận nên
được tth dõi chặt chẽ độc tính khi điều trị bằng bortezomib.
TÁC ĐỘNG CỦA THUỐC LÊN KHẢ NAN G LÁI XE HOẶC VẶN HÀNH MÁY MÓC.
Do bortezomib có thể gây ra hạ huyết ảp mệt mỏi, choáng váng, ngất xin, nhìn đôi hoặc nhìịfflmờ
do đó bệnh nhân nên thận trọng khi lái xe hoặc vận hảnh mảy móc ` 'V
SỬ DỤNG CHO PHỤ NỮ MANG THAI VÀ CHO CON BỦ
Độ an toản của thuốc đối với phụ nữ có thai: Loại D
Phụ nữ có thai:
Bệnh nhân nên được khuyên dùng biện phảp trảnh thai hiệu quả trong thời gian điếu trị bằng
bortezomib.
Phụ nữ cho con bử:
Người ta không biết liệu bortezomib có được bải tiết qua sữa mẹ không. Vì nhiều thuốc được bải
tiết quạ sữa mẹ và vì nguy cơ cao các phản ứng phụ nghỉêm trọng cho bé nuôi qua sữa mẹ, bả mẹ
nên được khuyên trảnh cho con bú trong lúc điếu trị bOitczomib.
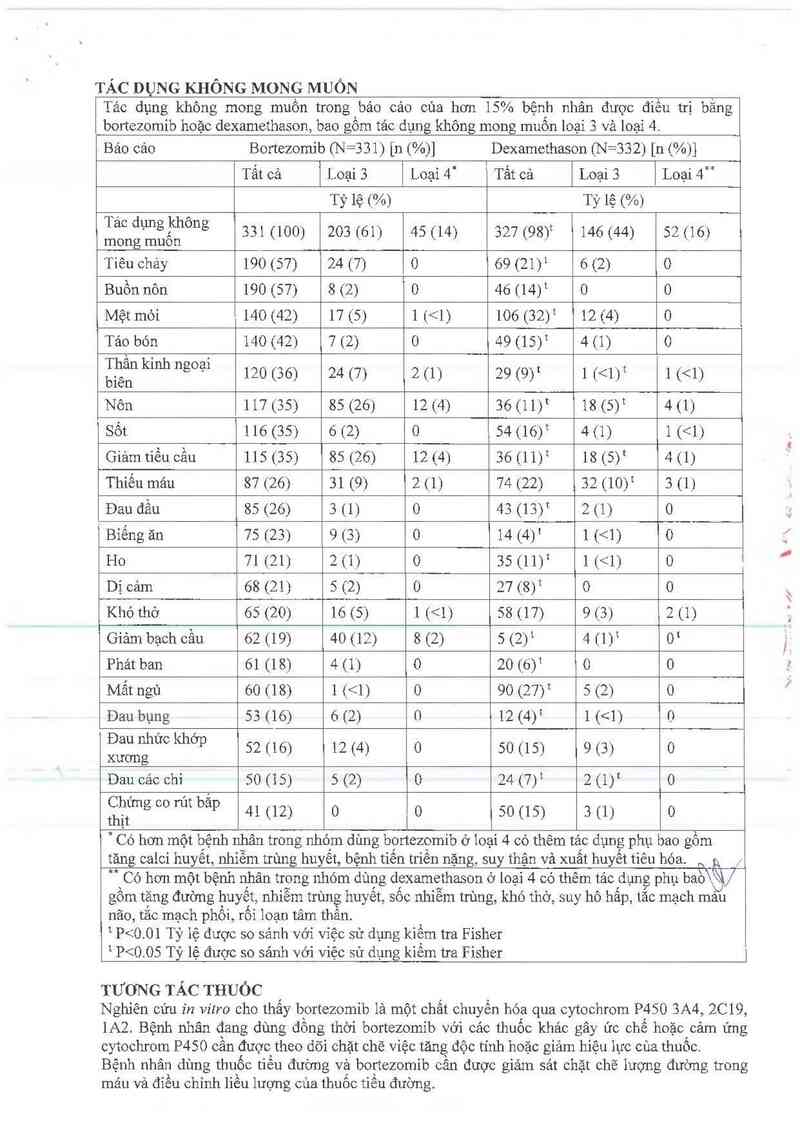
TÁC DỤNG KHÔNG MONG MUỐN
Tảo dụng không mong muốn trong `bảo cảo của hơn 15% bệnh nhân được điếu trị bằng
bortezomib hoặc dexamethason, bao gôm tảc dụng không mong muôn loại 3 và loại 4.
Báo cảo Bortezomib (N =331) [n (%)] Dexamethason (N=332) [n (%)]
Tất cả Loại 3 Loại 4“ Tất cả Loại 3 Loại 4
Tỷ lệ (%) Tỷ lệ (“’/<=)
ẵịcnịụẳỉẵlong 331 (100) 203 (61) 45 (14) 327 (98)t 146 (44) 52 (16)
Tiêu chảy 190 (57) 24 (7) 0 69 (21)1 6 (2) O
Buồn nôn 190 (57) 8 (2) 0 46 (14)t o 0
Mệt mòi 140 (42) 17 (5) 1 (<1) 106 (32)t 12 (4) 0 8
Táo bón 140 (42) 7 (2) 0 49 (15)t 4 (1) 0
TỀân kinh ngoại 120 (36) 24 (7) 2 (1) 29 (9)t 1 (<1)t 1 (<1)
bien
Nôn 117(35) 85 (26) 12(4) 36 (11)t 18(5)t 4(1)
Sốt 116 (35) 6 (2) 0 54 (16)1 4(1) 1(<1)
Giảmtiếu cằn 115 (35) 85 (26) 12(4) 36 (11)t 18(5)t 4(1)
Thiếu rnảu 87 (26) 31 (9) 2 (1) 74 (22) 32 (10)t 3 (1)
Đau đầu 85 (26) 3 (1) 0 43 (13)t 2 (1) 0
Bỉếng ăn 75 (23) 9 (3) 0 14 (4)t 1 (<1) O
Ho 71 (21) 2 (1) 0 35 (11)t 1(<1) 0
Dị cảm 68 (21) 5 (2) 0 27 (8)t 0 0
Khó thờ 65 (20) 16 (5) 1 (<1) 58 (17) 9 (3) 2 (1)
Giảm bạch cầu 62 (19) 40 (12) 8 (2) 5 (2)t 4(1)t 0t
Phát ban 61 (18) 4 (1) o 20 (6)1 0 o
Mất ngủ 60 (18) 1 (<1) 0 90 (27)t 5 (2) 0
Dau bụng 53 (16) 6 (2) 0 12 (4)t 1 (<1) O
ỆỂắểhuc khơp 52 (16) 12 (4) 0 50 (15) 9 (3) 0
Đau các chi 50 (15) 5 (2) 0 24 (7)t 2(1)t 0
ẵỆfmg co rút băp 41 (12) 0 0 50 (15) 3 (1) 0
Có hơn một bệnh nhân trong nhóm dùng bortezomib ơ ioại 4 có thêm tảc dụng phụ bao gồm
tăng calci huyết, nhiễm trùng huyết, bệnh tiến triến nặng, suy thận và xuất huyết tiêu hóa. … g, )
Có hơn một bệnh nhân trong 11hóm dùng dexamethason ơ loại 4 có thêm tảc dụng phụ bao)
gồm tặng đường huyết, nhiễm trùng huyết, sốc nhiễm trùng, khó thở, suy hô hấp, tắc mạch mau
não, tắc mạch phối, rôi loạn tâm thần _
l P
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng