






. H M 4/
. _ -
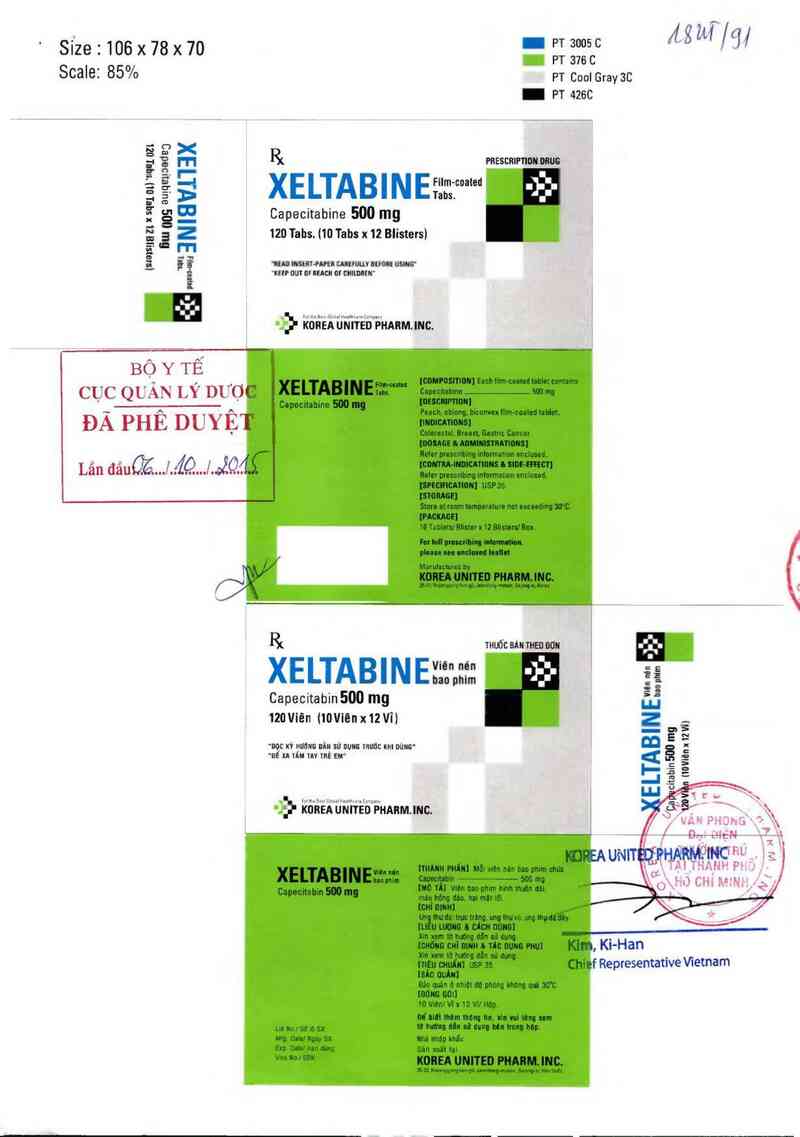
Slze . 106 x 78 x 70 _ ỆỊ ỄỆỂỄC /
808182 85% PT CoolGray SC
_ PT mm
1
Ễẫ fxn R( mtscmmnme
. 2- l- '.
.… » Fll - 111 I 1
88 ;; XELTABINEưJLcoae J:- ;
Ể Ể E Capecitabine 500 mg j
Ẹ ẫ z 120Tabs. 110 Tabsx 12 Biisters) ,
8 …
ỉ ỄỂ …8…W…8…* %
' ị ừ} iỉỏiiỀiiiiiĩlĩễífỉiiAliM.ltư.
BỘ Y TẾ
CỤC QL'ẨN LÝ thợ
ĐÀ PHE DUYẸ
Lân đảuQễ.../ẤQ…LJQ.
Rt mutíc stuntznaơu .:.:-
XELTABINE"W ::
bao phlm ỂỀ
Capecitabin 500 mg Ễj
121Wiẽn (iov1en x 12v11 z -
~wc KÝ 1111111… ní"… sử nvnn mưdc moủus' m 33
~oe`uưnm mẻ ew < Ễ Ề
': 8 ẳ
LH -_
-1-} iii'i'iifiiiiiiiiỉinnnn.mt.
: WM… .` *
11_1 THAHPP1… ;V
ơ… , _ .c_
Oxfn1cniriniv.ryíè
. Ki-Han
f Representative Vietnam
_ PT 3005 c
.11nẩ 51.
19 "NI'II HIAIIJ.
«' ớ… XELTABIN
_jìo JfỒQt_i_ mg Capeuitabine 5111.
.:I' cũ PHIIII. IIIC. IỆ mm IINIỈID lllll
.11~Ề.… XELTABINEr XELTABIM.
.mÌẵitỉ 500 mg] LCapecitabine 500 mẽ] [Capecitabine 500.
~ulưn mman nỆ- mm uum mm.… -Ệ mm umm mnm
'ẺLTABINEZ'Ù“ XELTABINEÉ'“ XELTABINL.
~citabine 500 mgl LCapocitabine 500 mgl | Cspecitabine 500 m._
'WED HIIIII. mc. lặ WIEA WEB NNIIIIC. IỆ ma IIII'IEII PIIAIIIIE.
"²LTABINEỀ'“ XELTABINEỀ'“ XELTA'
~.itabine 500 mg] | Capecitahine 500mg] Ca 0
mu …mm. uỆu…ulưmmullt ở
" TABINEỀ'“ XELT›t`
"abine 500 mg] | Con
ưmnuư. ^
Ữ r. bx
Òv/itểia PHONG
Dơ_v' LHẸN \T
KOREAUN ũụMffl jiẵỂ’
HỔ CHI M' Ni "
ơ\_/O4 /ớ/
QKimĩẵ“
Chief Representative Vietnam
XELTABINE Viên nén bao phim 1 +
Capecitabin 500 mg ị
THÀNH PHẨN
Mỗi viên nén ban phim chứa:
Capecitabin ........................................................... 500 mg
Tả dược: Lactose khan, Povidon, Natri croscarmellose, Cellulose vi tinh thể, Magnesi stearat, Hypromellose
2910, Polyethy1en glycol 6000, Talc, Titan oxyd, Sất oxyd đỏ, Sắt oxyd vảng.
MÔ TẢ
Viên nén bao phim mău quả đảo, hình thuôn dâi, hai mặt lỗi.
DƯỢC LỰC HỌC ngũĨtằV’
Capecitabin lã dẫn xuất fluoropyrimidin carbamat có hoạt tính chống u * \Châ’t nây là một tiền chất vã có
rất ít tác động dược lý cho đến khi nó được chuyển đổi thânh Fluorouracil, một chất chống chuyển hóa. Vì
Capecitahin được biến đổi thănh Fluorouracil hởi các enzym có nồng độ cao hơn trong các khối 11 so với các mô
bình thường vã huyết tương, dẫn tới nổng độ của dạng thuốc có hoạt tĩnh trong khối u đạt được cao hơn vã độc
tinh toản thân thấp hơn. Trong cảc tế bâo binh thường và các tế bâo khối u, Fluorouracil được chuyển hóa thănh
5-fluoro-2`-deoxyuridin monophosphat-S' (FđUMP) vã S—fiuorouridin triphosphat (FUTP). Những chất chuyển
hóa nây sẽ lăm tổn thương tế bâo bằng hai cơ chế. Đẩu tiên, Dcoxyribonucleotid của FđUMP vả đỗng yếu tố
folat (NS-10-methylenetetrahydrofolate) gắn với thymidylat synthase (TS) tạo thảnh một phức hợp gốm ba yếu
tố đổng hóa trị, sự gắn kết nây sẽ ức chế sự hình thảnh thymidyiat tử 2'—deoxyuridylat. Thymidylat lả một tiền
chất cẩn thiết cũa thymidin triphosphat, một chất cẩn thiết cho sự tổng hợp tổng hợp DNA, vì vậy sự thiếu hụt
hợp chất nãy có thể ức chế sự phân chia tế hâo. Thứ hai, các men sao chép nhân có thể kết hợp một cách nhẫm
lẫn FUTP thay vì uridin triphosphat (UTP) trong quá trình tổng hợp RNA. Lỗi chuyển hóa nãy có thể ẳnh hưởng
tới sự tống hợp RNA vả protein.
DƯỢC ĐỘNG HỌC
Capecitabin được hấp thu nhanh chóng qua đường tiêu hóa, nỗng độ tối đa trong huyết tương đạt được sau 1,5
giờ. Thức ăn lâm giảm tỉ lệ vã mức độ hấp thu cũa thuốc. Cạpecitabin 11ên kết với protein huyết tương dưới 60%.
Capecitabin bị thủy phân ớ gan thãnh 5’-deoxy-S-fiuorocytidin (5’—DFCR), sau đó được chuyển hóa thânh 5’-
deoxy-S—fluorouridin và tiếp theo thânh 5—11uorouracil trong tế băo cơ thể. 5—fiuorouracil lại tiểp tục được
chuyển hóa. Khoảng 3% Iiếu dùng của Capecitabin được đảo thải qua nước tiểu dưới dạng chưa chuyển hóa.
CHỈ ĐỊNH
Ung thưđại rrực trâng
Xeltabine được chỉ định điếu trị bước 1 ở bệnh nhân ung thư đại trực trâng di căn.
Xeltabine được chỉ định điều trị hỗ trợ cho những bệnh nhân ung thư đại trâng giai đoạn 111 sau phẫu thuật (Duke
C).
- Xeltabine được chỉ định đơn trị liệu ở bệnh nhân đã cắt bỏ hoãn toăn khối u nguyên phát khi chế độ đớn trị
liệu với Fluoropyrimidin được ưu tiến lựa chọn.
- Xeltabine được chỉ định phối hợp với Oxaliplatin ở bệnh nhân đã cắt bỏ hoản toản khối u nguyên phát.
Ung thư vú
Xeltabine được chỉ định đớn trị liệu trong điếu trị những bệnh nhân ung thư vú tiến triển tại chỗ hoặc di căn sau
khi thất bại với chế độ hóa trị liệu với thuốc nhóm taxan (Paclitaxel hoặc Docetaxe1) vả cả nhóm anthracyclin
và hoặc cho những ung thư khác mã không có chỉ định dùng anthracyclin (ví dụ bệnh nhân điếu trị liều tích lũy
Doxorubicin 400 mglm2 hoặc tương đương).
Xeltabine phối hợp với Docetaxel được chỉ định để diếu trị những hệnh nhân ung 1hư vú tiểu triển tại chỗ hoặc
di cản sau khi thất bại với hóa trị iiệu độc tố bâo.
Trang 1/8
Ung thư dạ dảy
Xeltabine phối hợp với hợp chất platin được chỉ định điều trị bước một cho những bệnh nhân ung thư dạ dăy tíển
Ltiển.
LIÊU LUỢNG VÀ cÁcn DÙNG
Nến uống Xeltabine với nước trong vòng 30 phút 81… khi ăn.
Dơn tri líêu
Ung thu'đại trực trảng vã ung thư vú
Liều đớn trị liệu được khuyến cáo cũa Xeltabine là 1250 mglrn², uống 2 lẩn mỗi ngăy (sáng và tổi, tương đương
với tổng liều 2500 mglrn2 mỗi ngăy) trong 2 tuẩn, sau đó ngưng thưốc l tuẩn trong chu kỳ điếu trị 3 tuần.
Đỉễu trí ghối hơp
Ung thư vú
Trong trường hợp điều trị phối hợp với Docetaxel, liểu khuyến cáo cũa Xeltabine là 1250 mglm², uống 2 lẩn mỗi
ngây trong 2 tuấn sau đó ngưng thuốc 1 tuẩn, phối hợp với Docctaxel 75 mg/m2 truyền tĩnh mạch trOng vòng 1
giờ mỗi 3 tuẩn. Theo hướng dẫn sữ dụng của Docetaxel, nên chuẩn bị trước thưốc nhóm corticosteroid đường
uống như Dexamethason trước khi dùng Docetaxel ở những bệnh nhân điếu trị kết hợp Xeltahine với Docetaxel.
Ung thu'đại trực trảng (ị/ /
Trong trường hợp điểu trị phối hợp với Oxaliplatin, liếu khuyến cáo cũa oine 18) 1000 mglm², ưống 2 lẳn
mỗi ngăy trong 2 tuẫn sau đó ngưng thuốc 1 tuần, phối hợp với Oxaliplatin 130 mg/m2 truyền tĩnh mạch trong
vòng 2 giờ văo ngảy đẩu tiên mỗi 3 mẫn, ttong vòng 24 tuẩn. Theo hướng đẫn sử dụng của Oxaliplatin, nên
chuẩn bị trước thuốc chống nôn trước khi dùng Oxaliplatin ở những bệnh nhân điếu trị kết hợp Xcltabine với
Oxaliplatin.
Ung lhu'dạ dảy
Liễu khuyến cáo cũa Xeltahine là 1000 mg/rn2 uống 2 lẩn mỗi ngãy trong 14 ngăy sau đó ngưng thuốc 7 ngảy,
hoặc 625 tnglm2 uống 2 lẩn mỗi ngăy nếu điếu trị liên tục. Theo hướng dẫn sữ dụ ng cũa Cisplatin, nên chuẩn bị
trước để đãm bảo nước và thuốc chống nôn trước khi dùng Cisplatin ở những bệnh nhân điếu trị kết hợp
Xeltabinc với Cisplatin.
- Phối hợp với Cisplatin: Liễu khuyến cáo cũa Xeltabinc lã 1000 mglm², uống 2 lẩn mỗi ngảy trong 2 tuẩn sau
đó ngưng thuốc 1 tuẫn, phổi hợp với Cisplatin 80111g/m2tmyển tĩnh mạch trong 2 giờ mỗi 3 tuẫn.
— Phối hợp với Cỉsplz1tin hoặc Epirưhicin: Liều khuyến cáo của Xeltabine lả 625 mg/m², uống 2 lẩn mỗi ngây
liên tục trong 3 tuấn, phối hợp với Cisplatin 60 mglm2 truyền tĩnh mạch trong 2 giờ vả Epirubicin 50 mglmatiếm
tĩnh mạch nhanh mỗi 3 tuẩn.
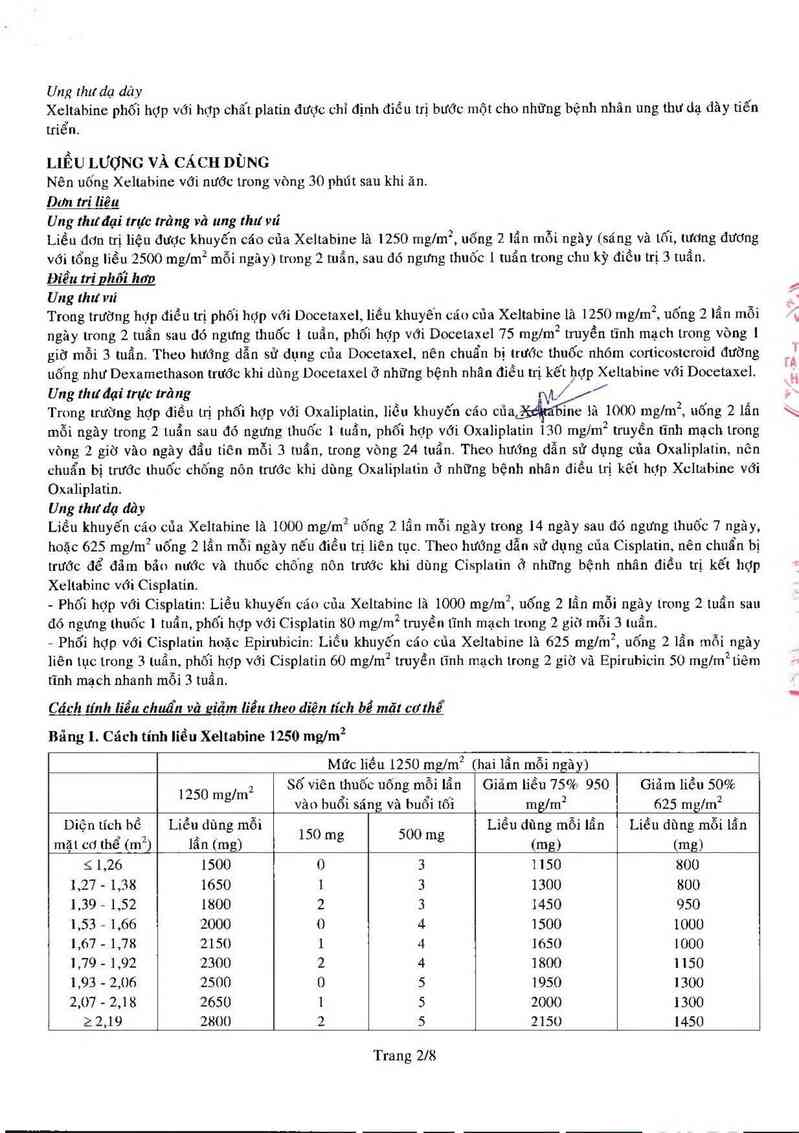
Cách tính liễu chuẩn và ziăm liễu theo diẽn lích bể mã! co'thể
Bẳng 1. Cách tính lỉểu Xeltabine 1250 ngm²
Mức liếu 1250 tnng² hai 18… mỗi ngây)
2 Số viên thuốc uống mỗi lẳn Giảm iiếu 75% 950 Giãm liếtl 50%
1250 mg/m , ,ẹ. , , _4. _... 2 2
vao hum sang va bum tm mg/m 625 mg/m
Diện tích bề Liều dùn mỗi Liều dùn mỗi lẩn Liều dùn mỗi lẩn
mặt cơ thể (m²) lẩn (mgg) 15 0 mg 500 mg (mgg) (mgg)
5 1,26 1500 0 3 1150 800
1,27 - 1,38 1650 1 3 1300 800
1,39 — 1,52 1800 2 3 1450 950
1,53 - 1,66 2000 0 4 1500 1000
1,67 - 1,78 2150 1 4 1650 1000
1,79 - 1,92 2300 2 4 1800 1150
1,93 - 2,06 2500 0 5 1950 1300
2,07 - 2,18 2650 1 5 2000 1300
2 2,19 2800 2 5 2150 1450
Trang 2/8
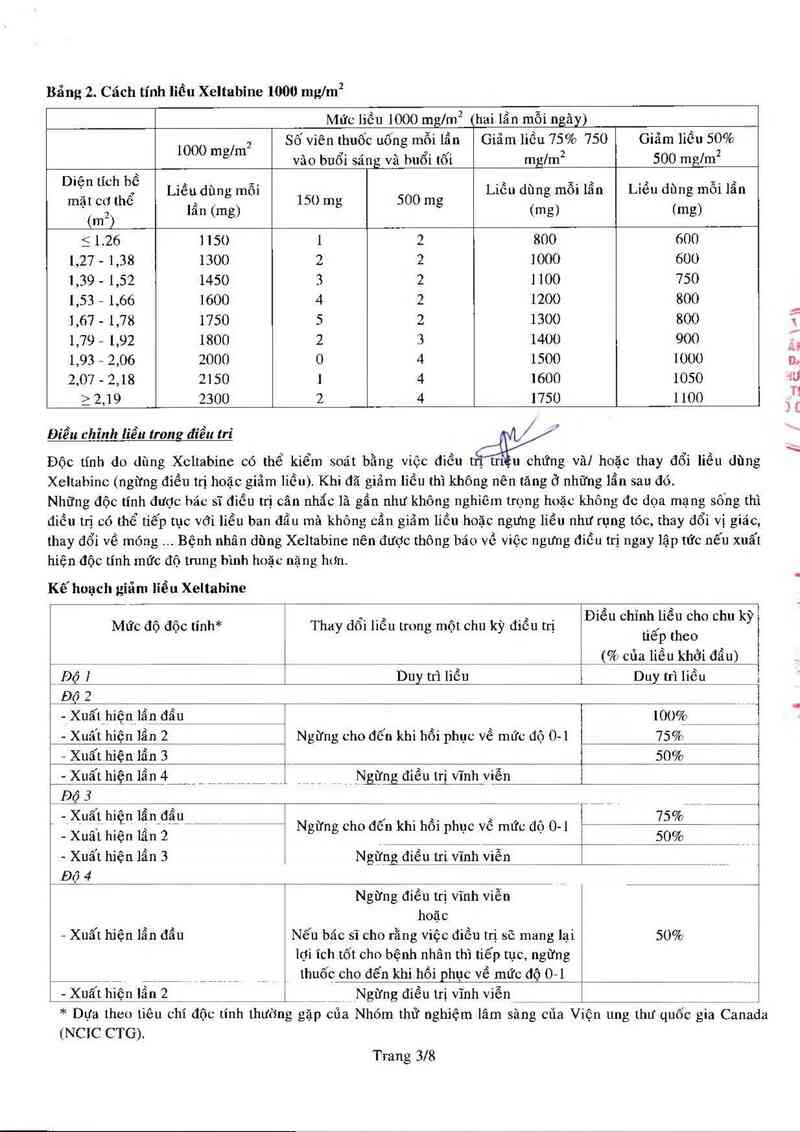
Bắng 2. Cách tính liều Xeltabine 1000 mgfm²
Mức liếu 1000 mglm² (hai lẩn mỗi ngảy)
1000 m /m² Số viến thuốc uống mỗi lẩn Giăm liếu 75% 750 Giãm liếu 50%
g vão buối sáng và buổi tối mg/m² 500 mglm²
D'Ễ" ẦĨCh bỀ Liều dùng mỗi Liếu dùng mỗi lẩn Liều dùng mỗi lẩn
mạt cơ the ,. 151) mg 500 mg
2 lan (mg) (mg) tmg)
(… )
5 1.26 1 150 1 2 800 600
1,27 - 1,38 1300 2 2 1000 600
1,39 - 1,52 1450 3 2 1100 750
1,53 - 1,66 1600 4 2 1200 800
1,67 - 1,78 1750 5 2 1300 800
1,79 … 1,92 1800 2 3 1400 900
1,93 - 2,06 2000 0 4 1500 1000
2,07 - 2,18 2150 1 4 1600 1050
2 2,19 2300 2 4 1750 1100
I
Điều chỉnh liều lrone điều tri rẵỵ/
Độc tính do dùng Xcltabine có thể kiểm soát bằng việc điếu trt_u chứng vâl hoặc thay đổi liều dùng
Xeltabinc (ngừng điếu trị hoặc giãm liếu). Khi đã giảm liếu thì không nến tăng ở những lẩn sau đó.
Những độc tính được bác sĩ điếu trị cân nhấc lã gẩn như không nghiêm trọng hoặc không đe dọa mạ ng sống thì
điều trị có thể tiểp tục với liếu bạn đẩu mã không cẩn giãm liếư hoặc ngưng liểu như rụng tóc, thay đổi vị giác,
thay đổi về móng Bệnh nhân dũng Xeltabine nên được thông báo về việc ngưng điếu trị ngay lập tức nếu xuất
hiện độc tính mức độ trung bình hoặc nặng hơn.
Kế hoạch giẩm liếu Xeltahìne
Điếu chỉnh liếu cho chu kỳ
tiểp theo
('70 của liếu khới đẩu)
Mức độ độc tính* Thay dổi liễu trong một chu kỳ điếu trị
Độ ] Duy trì liếu Duy trì liễu
ĐỆ2 ..
- Xuâ’thiẹniẩn_đtìu 1009n_ `
- Xuất hiện lẩn 2 Ngừng cho đổn khi hồi phục về mức độ 0-1 75%
— Xuất hìện lẩn 3 50%
_fflịệitlỆi_ffl _ __ _ _ _ __ ___Ngững điếu trị vĩnh viễn
-ÊỄÃ _ _ _ _ _ _ __ . ._ __
_ ỄẸỆ.Ì Ệỉễ—ỉ ẺỉỂ—au ___Í Ngừng cho đổn khi hổi phục về mức độ … ễẳịị
- Xuất hiện lẩn 3 Ngừng điếu tri vĩnh _viễn _
Độ 4 _
Ngừng điểu trị vĩnh viễn
hoặc
— Xuất hiện lẩn đẩu Nếu bác sĩ cho rằng việc điếu tti sẽ mang lại 50%
lợi ĩch tốt cho bệnh nhân thì tiếp tục, ngừng
__ _ thuốc cho đến khi hồi phục về mức độ 0—1
- Xuất hiỄn_lặn 2 _ _ _ __ _ _ _Ngừng điếu trị vĩnh viễn _
* Dựa theo tiêu chí độc tĩnh thường gặp cũa Nhóm thử nghiệm lâm sảng cũa Viện ung thư quốc gia Canada
(NCỈC CTG).
Tran g 3/8
Luuý về huyết học: Không nên điếu tnị Xeltabine ở những bệnh nhân có lượng bạch cẩu trung tính ban đẩu < 1,5
x 1011] ] vă/ hoặc tiểu cẩu < 100 x 109/1. Nếu những đánh giá xét nghiệm đột xuất trong suốt chu kỳ điếu trị cho
thẩy lượng bạch cẩu trung tinh < 1,0 x 109/1 hoặc tiểu cẩu < 75 x 10911 thì nên ngưng điểu trị Xeltabinc.
Đíễu chĩnh Iiễu do độc tính khi điều trị kểt hợp Xehubine với thuốc khác: Dựa trên bâng kế hoạch giăm liều
Xeltabine bến trên và theo hướng dẫn sử dụng cũa các thuốc khác một cách thích hợp nhẩt.
~ Khi bắt đẩu một chu kỳ điếu trị, nếu hoãn điểu trị được chỉ định cho Xeltabine hoặc các thuốc khác, thì sau đó
nến hoãn tất cả các thuốc cho đến khi có những yêu cẩu được dùng tất cả các thuốc trở lại.
- Trong suốt chu kỳ điếu trị những độc tính được cân nbấc bởi bác sĩ điếu trị mã không liên quan đến Xeltabinc
thì việc điều trị với Xeltabine nến được tiếp tục vả tiến hảnh điếu chĩnh liếu của những thuốc khác dựa vão
thông tin cũa tờ hướng dẫn sử dụng.
- Nếu các thuốc kbác phãi ngừng điếu trị vĩnh viễn thì điểu trị bầng Xeltabine có thể được bẩt đẩu lại nểu có các
yêu cẩu được dũng Xeltabine trở lại.
THẬN TRỌNG KHI sử DỤNG
Tiêu chây: Xeitabine có thể gây tiêu chảy, đôi khi nặng. Bộnh nhân bị tiêu chảy nặng nên được theo dỏi cẩn
thận vã nếu bị mất nước, nến bù nước vả chất điện giâi. Nến hắt đẫu 1iện pháp chuẩn điếu trị tiêu chây (như
dùng[opmemhijvầúểhhânhgủnihếukffltẩntfflết
Mất nước: Mất nước nên được ngăn chặn hoặc điếu trị kịp thời. Những bệnh nbân chán ãn, suy nhược, buổn nôn,
nôn hoặc tiêu cbây có thể bị mất nước nhanh chóng. Nếu xuất hiện mất nước độ 2 (hoặc cao hơn), nên ngừng
điều trị Xeltahinc ngay lập tức và tiến hănh bù nước. Không nên điển trị lại khi bệnh nhân vẫn còn mẩt nước và
bất kỷ nguyên nhân sớm nâo gây ra phâi được điếu chinh hoặc kiểm soát. Kh'i cẩn thiết nên điều chinh liễu đối
với những tác dụng không mong muốn xuất hiện sớm.
Hội chứng bân tay-bc`m chán (rối loạn cảm giác đó da lòng bân tay—bă `Jn)
- Độ 1 của hội chứng được xãc định bới tê, fối loạn câm giác] dị cảm, cãm giác kiến bò, sưng hoặc ban đỏ không
gây đau ở tay vă/ hoặc chân vã] hoặc cảm giác khó chịu nhưng không ảnh hướng đến sinh hoạt bình thường của
bệnh nhân.
- Độ 2 được xác định là ban đỏ vả sưng tay vả] hoặc chân gây đau vã] hoặc khó chịu ânh hướng đến sinh hoạt
hâng ngảy của bệnh nhân.
- Độ 3 được xãc định là sự tróc vẩy da, loét, rộp gia vả đau nhiến ớ tay vả] hoặc chân vă/ hoặc căm giác rẩt khó
chịu khiến bệnh nhân không thể lâm việc hoặc thực hiện cãc sinh hoạt bình thường hăng ngảy.
Nếu xảy ra hội chứng bản tay-bân chân độ 2 hoặc 3, nên ngưng dùng Xeitabinc cho đến khi câc triệu chứng hổi
phục hoặc giăm xuống độ 1.Sau khi xuất hiện hội chứng bản tay—bản chân độ 3, nến giãm liếu tiếp theo cũa
Xeitabine. Khi sử dụng kết hợp Xeltabine vả Cisplatin, không nên sử dụng vitamin B6 (Pyridoxin) để đỉểu trị
triệu chứng hoặc điếu trị dự phòng thứ phát cũa hội chứng băn tay—bản chân vì theo các báo cáo đã công bố,
điểu năy có thể lầm giảm hiệu quả cũa Cisplatin.
Độc tỉnh tim mạch: Độc tính trên tim mạch được ghi nhận ở Xeltabine cũng tương tự độc tĩnh ghi nhận được ở
Fluoropyrimidin khác. Những độc tĩnh nây bao gồm nhỗi máu cơ tim, đau thắt ngực...Những tác dụng không
mong muốn nầy thường gặp hơn ở những bệnh nhân có tiểu sử bệnh mạch vảnh. Do đó cẩn thận trong khi sử
dụng thuốc ở những bệnh nhân có tiễn sử bị bệnh tim mạch.
Bệnh nhân được điếu trị bằng Xcltabinc nên được theo dõi cẩn thận Về độc tính. Phẩn lớn các tác dưng không
mong muốn có thể hội phục và không yêu cẩu phãi ngừng thuốc vĩnh viễn, mặc dù cẩn phải ngừng thuốc tạm
thời vả giấm liều.
THẬN TRỌNG CHUNG
Nên sữ dụng thuốc thận trọng ở những bệnh nhân sau:
- Bệnh nhân suy thận nặng.
— Bệnh nhân suy gan.
- Bệnh nhân có tiến sử tăng hoặc giãm calci huyết.
- Bệnh nhân có tiến sử bệnh thẩn kinh trung ương hoặc tbẫn kinh ngoại biên, như 11 năo di cãn, bệnh thẩn kinh.
Trang 4/8
- Bệnh nhân có tiền sử đái tháo đường hoặc rối loạn điện giãi.
- Người giă.
- Bệnh nhân có tiến sữ bệnh mạch vănh (nhối máu cơ tim có thể xây ra).
- Bệnh nhân suy tũy (sưy tủy có thể trẩm trọng hơn).
- Bệnh nhân bị loét hoặc xuất huyết đường tiếu hóa.
CHỐNG CHỈ ĐỊNH
Không sử dụng thuốc ở những bệnh nhân sau:
- Quá mẫn với Capecitabin hoặc với bất kỳ thả nh phẩn não của thuốc.
- Có tiến sữ xãy ra cãc phản ứng không mong muốn và nghiêm trỌng khi điểu trị với Fluoropyrimidin.
- Phụ nữ có thai vả cho con hú.
- Bệnh nhân suy thận nặng (Độ thanh thải Creatinin < 30 mllphủt).
- Bệnh nhân đạng điều trị với Sorivudin hoặc các chất tương tự có liến quan về mặt hóa học như Brivudin.
— Bệnh nhân được biết lả có thiếu hụt men dihydropyrimidin dehydrogenase (DPD) (do đã ghi nhận cãc độc tính
nghiêm trọng không dự đoán trước liến quan tới Fluorouracil như như viếm miệng, tiêu chảy, giãm bạch cẩu
trung tính và nhìễm độc thẩn kinh).
Bệnh nhân giãm bạch cẩu, giâm bạch cẩu trung tính, giấm tiểu cẩu nặng.
Bếnh nhãn suy gan nặng.
- Bệnh nhân đang uống dạng phức hợp Tegafur, Gimeracil, Oteracil kali hoặc trợng vòng 7 ngây sau khi ngưng
thuốc. /N '//
Thuốc có chứa tã dược Lactose khan, do đó không nên sử dụng thuốci'nầ hững bệnh nhân có vấn để về di
truyền hiểm gặp như không dưng nạp galactose, thiếu hụt Lapp lactasehoặc kém hấp thu glucose—galactose.
TẤC DỤNG KHÔNG MONG MUỐN
Tướng tự như Fluorouracil, tiêu chăy (có thể xãy ta trẩm ttọng), buổn nôn vả nôn, đau bụng, viêm miệng, hội
chửng bân tay-bãn chân (rối loạn cắm giác đó da lòng bản tay—bân chân) thường xảy ra với Capecitabin vã có
thể giới hạn liều dùng. Các tác dụng không mong muốn khác thường xẳy ra bao gỗm: mệt mỏi, suy nhược, chán
ãn. Phát ban, rụng tóc, ban đớ, khô da, ngứa, rối loạn sấc tố da vả rối loạn móng có thể xắy ra. Một số tác dụng
không mong muốn khác như: sổt, đau, đau cơ, táo bón, khó tiếu, dị cảm, nhức đẩu, chóng mặt, mất ngũ, tãng
hoặc giâm calci huyết vả mất nước. Viêm dạ, ngộ độc tim và suy tủy xương cũng đã được ghi nhận. Tăng
biliribin máu cũng đã xảy ra.
Ảnh hưởng đển lipid máu: Đã ghi nhận trường hợp tăng triglycerid máu trên những bộnh nhân uống Capecitabin
ớ gỉai đoạn đẩu điều trị. Mặc dù đã sử dụng liệu pháp hạ lipid mãu, nhưng nổng độ triglycerid vẫn cao hơn mức
bình thường và nỗng độ năy chi giãm sau vải tuấn ngưng dùng Capecitabin.
Ảnh hưởng trên mẩt: Đã ghi nhận trường hợp kích ứng mẩt nặng với lắng đọng gìác mạc vả suy giảm thị lực ở 2
bệnh nhân sử dụng Capecitabin. Triệu chứng phục hỗi sau vải tuẫn ngưng dùng thuốc.
Ảnh hưởng trên tim: Đau ngực do thiểu máu cục bộ cẩp tính đã được báo cáo, thường xảy ra vâi ngảy sau khi bắt
đẩu sử dụng Capecitabin. Triệu chứng từ các ca báo cáo và tỷ lệ trường hợp mắc phắi trong các nghiên cứu pha
111 tương tự ở những bệnh nhân sử dụng Fluorouracil. Căc triệu chứng được báo cãc có thể phục hổi, tuy nhiên
đã ghi nbận trường hợp chết do nhồi máu cơ tim. Một bệnh nhân đã xảy ra ngộ độc tim khi điếu trị Fluorouracil,
nhưng những trường hợp khác các yếu tố nguy cơ không rõ rảng.
Ánh hưởng trên hệ thần kinh: Bệnh thẩn kinh ngoại biên và bệnh não đã được báo cáo liên quan đến việc sử
dụng Capecitabin.
Ảnh hưởng trên da vò móng: Hội chứng tay-chân thường gặp ở bệnh nhân điểu trị bằng Capecitabin, các tổn
thương da khác hiểm khi gặp. Đã ghi nhận trưởng hợp mâ’t móng vả bong móng. U hạt có mũ cũng đã được ghi
nhận khi sử dụng Capecitabin, có sự tái tạo sẵc tố da trong rối loạn sắc tố da do hóa trị liệu.
Phản ứng quá mẫn: Một bệnh nhân đã thực hiện truyền tĩnh mạch liên tục thănh công với Fluorouracil mặc dù
trước đó đã xảy ra quá mẫn với Capecitabin. Có thể cho rằng phản ứng quá mẫn có thể gây ra đo Capecitabin vả
các chất chuyển hóa trung gian, vã không có sự nhạy căm chéo giữa Capecitabin vả Fluorouracil.
Trang 5/8
Hội“ chứng bân tay-bãn chân (rối loạn căm giác đó da lòng băn tay-bân chân): Hay gặp khi sử dụng Capccitabin
đơn trị liệu hoặc như một phẩn tác dụng không mong muốn của phác đồ hóa trị liệu kết hợp. Hội chứng xãy ra
trong vòng 2 chu kỳ đẩu của chếđộ đơn trị liệu vã trong 3 chu kỳ đẩu của chế độ điếu trị kểt hợp do sự thay đổi
cũa iiếu cũa Capecitabin trong điếu trị kết bợp. Sử dụng phối hợp với Docetaxel vã viếm miệng do hóa trị liệu
trước đó được cho lá các yếu tố nguy cơ đáng kể cho sự xuất hiện hội chứng nảy. Phướng pháp kiểm soát duy
nhẩt có hiệu quả là điếu trị gián đoạn vả điếu chinh liễu. Cẩn sử dựng các biện pháp hỗ trợ để giãm đau, khó
chịu và ngăn ngữa nhiễm trùng thứ phát. Điều trị đổng thời với Celccoxib được cho là giãm tỷ lệ mẩc hội chứng
bãn tay-bân chân gây ra do Capccitabin.
Hội chứng phân giăi' khôi“ u: Một trường hợp tử vong đã được ghi nhận do hội chứng phân giãi khối 11 sau khi sử
dụng Capccitahin.
Thông báo cho bác sĩ các tác dụng không mong muốn gặp phẳi khi sử dụng thuốc.
TƯỚNG TÁC THUỐC
Thuốc chống đông máu Coumarin: Bệnh nhân dùng các thuốc chống đông dẫn xuất cũa coumarin cùng với
Xeltabine nến được theo dõi cẩn thận về những thay đổi các thông số đông máu (PT hoặc INR) và phải điếu
chinh liếu thuốc chống đông cho phù hợp. Đã ghi nhận các thông số đông máu thay đổi vălhoặc chảy máu ở
những bệnh nhân dùng Xeltabine cùng với các thuốc chống động dẫn xuất coumarin như Warfarin vả
Phenprocoumtm. Những tãc dụng không mong muốn nảy xây ra trong vãi ngảy và kéo dăi tới vải tháng sau khi
bắt đẩu đỉếu trị Xeltabinc, vã một số ít trường hợp xảy ra trong một tháng sau khi ngững Xeltabine. Trong một
nghiên cứu tương tác lâm sảng, sau khi dùng Warfarin iiếu đơn 20 mg, việc điếu trị Xcltabine 1ảm tăng AUC cũa
S-Warfarin khoãng 57% và giá trị INR tăng 91%. Vì chẩt chuyển hóa R—Warfarin không thay đổi, điếu nãy
chứng tỏ Capccitabin ức chế isozym 2C9 nhưng không ảnh hướng trên các isozym lAZ vã 3A4.
Thuốc kháng acid: Tác động cũa nhôm hydroxyd vả thuốc kháng acid có chứa magnesi hydroxyd lên dược động
học cũa Capecitabin đã được nghiến cứu. Nổng độ huyết tướng của Capccitabin vả một chất chuyển hóa
(5'DFCR) tăng ít; kbông thấy tác động lên ba chất chuyển hóa chính (5’DFUR, 5-FU vã FBAL.)
Alinpurinnl: Tướng tác với Allopurinol đã được ghi nhận ở 5-FU, thuốc có thể lâm giẳm Hiệu quả cũa 5—FU. Do
đó nên tránh sử dụng đồng thời Allopurinol vả Xeltabine. KN -
Sorivudin vả các thuốc tương tự: Tướng tác thuốc—thuốc có ý nghĩa lâm sâng gi , uorivudin vã 5-FU, lả do
Sorivudin ức chế dihydropyrimidin dehydrogenase, đã được mô tả trong tâi 1iệu nghiên cứu. Tướng tác nầy, dẫn
tới tăng độc tính cũa dihydropyrimidin debydrogenase, có thể nguy hiểm đốn tính mạng. Vì vậy, không nên
dùng Xeltabine với Sorivudin hoặc các thuốc tương tự có liên quan về mặt hóa học như Brivudin (xem
phẩn Chổng chỉ định). Cẩn đợi ít nhất 4 tuẩn sau khi kết thúc điếu trị với Sorivudin hoặc các thuốc tương tự có
liên quan về mặt hóa học như Brivudin truớc khi bắt đẩu trị liệu với Xeltabine.
Phenytoin: Nổng độ huyết tướng cũa Phcnytoin tăng dẫn đến triệu chửng của ngộ độc Phcnytoin trong 1 trường
hợp được ghi nhận trong khi dùng đổng thởi Xeltabine vả Phenytoin. Những bệnh nhân dùng đổng thời
Phcnytoin vã Xcltabine nến được theo dõi cẩn thận vì nổng độ huyết tương cũa Phcnytoin tăng.
Protein huyết tương: Capccitabin có tỉ lệ gắn kết với protein huyết tương thấp (54%). Do đó tướng tác do cạnh
tranh vị trí với các thuốc có tỉ lệ gắn kết với protein huyết tượng cao không đáng kể.
Cytochrom P—450 2C9: Xem phẩn các dẫn chất của thuốc chống đông Coumarin về sự tương tác Với các isozym
lAZ, 2C9, 3A4.
Interj“eron alpha: Liều dung nạp tối đa của Xeltabine lã 2000 mg/m²Ingảy khi kết hợp Interfcron alpha-2a (3
MIUIm²lngãy), trong khi liều dung nạp tối đa cũa Xeltabine khi sử dụng riêng lẻ lả 3000 mg/m²lngây.
Xạ trị: Liều dung nạp tối đa của Xeltabinc khi sử dụng riêng lẻ là 3000 mg/m²íngảy, tuy nhiến khi kết hợp với
xạ trị trong điều trị ung thư ttụ’c trâng liều dung nạp tôi đa cũa Xcltabinc lả 2000 mglm²lngăy (sử dụng chế dộ
điểu trị liên tục hoặc mỗi ngây từ thứ hai đến thứ sáu trong đợt xạ trị 6 tuẳn).
Acidfolinic: Một nghiên cứu kết hợp Xeitabìne Vả acid folinic cho thấy acid folinic không ãnh hưởng nhiều đển
dược động học cũa Xcltabỉne vả các chất chưyển hóa. Tuy nhiến, acid 1'111inic có ănh hướng trên dược lực học
cũa Xeltabine vả lảm gia tăng độc tính của Xcltabine: Liều dung nạp tối đa của Xcltabine khi sử dụng riếng lẻ
Trang 6/8
với chếđộ điếu trị liên tục lả 3000 mglm²lngảy trong khi đó chi iă 2000 mg]m²lngăy khi kết hợp với acid folinic
(30 mg uống 2 lẩn mỗi ngây).
Phức hợp Tegqfur, Gimeracil vả Oteracil kuli: Chống chỉ định khi sử dụng đỗng thời với Xetabine hoặc trong
vòng 7 ngây sau khi ngưng uống Xeitabine. Hâm lượng Fiuorouracil trong máu tăng đáng kể do Gimeracil ức
chế sự chuyển hóa cũa Fluorouracil gây rối loạn đường tiêu hóa như rối loạn máu nặng, tiếu chảy, viêm miệng...
Oxaliplatin: Không có sự khác biệt đáng kể khi tiếp xúc với Capecitabin vã các chất chuyển hóa, platin tự do
hay platin toăn phẩn khi Capecitabin phối hợp với Oxaliplatin hoặc Oxaliplatin vả Bevacizumab.
Bevacizumub: Không có sự ắnh hướng có ý nghĩa lâm săng của Bevacizumab lên các thông số dược động học
của Capecitabin hoặc các chất chuyển hóa của nó khi điểu trị phối hợp với Oxaliplatin.
sữ DỤNG ở PHỤ NỮ MANG THAI VÀ BÀ MẸ CHO CON BÚ
Chưa có các nghiến cứu trên phụ nữ có thai dùng Xeltabine. Trong các nghiên cứu độc tinh sinh sản trên động
vật, dùng Capecitabin có thể gây chết phôi thai vã quái thai. Những bằng chứng nây được dự đoán ở những dẫn
xuất của Fluoropyrimidin. Sử dụng Capacitabin trong khi mang thai có thể gây hại cho thai nhi, Capecitabin
được cho rằng có khả nảng gây quái thai ở người. Vì vậy chống chỉ định Capecitabin trong khi mang thai. Nếu
dùng Xeltabine trong khi mang thai boặc nếu bệnh nhân có thai trong khi đang dùng thuốc nây phãi thông báo
cho bệnh nhân biết nguy cơ tiểm ẩn cho thai nhi. Nên sữ dụng biện pháp tránh thai trong khi sử dụng Xeltabine.
Chưa biết thuốc có dược bải tiết qua sữa mẹ hay không. Trong một nghiên cứu ở chuột đang cho con bú, một
lượng đáng kể Capccitabin và các chất chuyển hóa được tìm thấy trong sữa. Nên ngừng cho con bú trong khi
điểu trị với Xeitabine.
sử DỤNG ở NGƯỜI GIẢ
Không cẩn điếu chinh liếu khởi đẩu khi dùng Xeltabine đơn trị liệu. Tuy nhiên các ' _ng không mong muốn
liên quan đến điểu trị độ 3 hoặc độ 4 xưất hiện thường xuyên hơn ở bệnh nhân trên 60 tuổi so với những bệnh
nhân trẻ tuổi.
Khi điếu trị Xeltabine kết hợp với các thuốc khác ở người giả 2 65 tuổi, thường xãy ra các tác dụng không mong
muốn độ 3 và độ 4 có thể dẫn đến tạm ngừng điểu trị. Nên theo dõi cẩn thận khi dùng thuốc ở bệnh nhân ì 65
tuổi.
- Khi điều trị kểt hợp với Docetaxel: Tỷ lệ tăng các tác dụng không mong muốn nghiêm trọng liên quan đến điếu
trị vã cãc tác dụng không mong muôn liên quan đến điếu trị độ 3 hoặc độ 4 tãng ở bệnh nhân ì 60 tuổi. Với
những bệnh nhân ì 60 tuổi nên giâm liễu khởi dẩn cũa Xcltabine xuống còn 75% (950 mg]…2 hai iẩn mỗi ngăy).
Nếu không xuất hiện độc tính ở liễu đã giâm trên bệnh nhân 2 60 tuổi được điều trị phối hợp Xeltabine vã
Docetaxel, liều Xeltabine có thể tãng dẩn một cách thận trọng đến liểư 1250 mglm2 hai lẫn mỗi ngảy.
SỬ DỤNG ở TRẺ EM
Chưa có kinh nghiệm sử dụng thuốc ở trẻ cm dưới 18 tuổi.
SỬ DỤNG ở BỆNH NHÂN SUY GAN
Chưa có dữ liệu về tĩnh an toãn vả hiệu quả của thuốc ở bệnh nhân suy gan để đưa ra liều khuyến các phù hợp.
Xeltabine nên được sử dụng một cách thận trọng ở bệnh nhân suy gan di căn hoặc không di căn từ nhẹ đến trung
bình. Xeltabinc có thể lảm tăng bilirubin máu. Nên ngưng dùng thuốc nếu bilirubin tăng > 3,0 x ULN (trên giới
hạn bình thường) có liên quan đến điếu trị hoặc men gan ạminotransferase (ALT, AST) tăng > 2,5 x ULN có liên
quan đến điểu trị. Có thể bắt đẩu điểu trị lại khi bilirubin giắm xuống còn 5 3,0 x ULN hoặc men gan
aminotransferase giảm xuống còn 5 2,5 x ULN.
sử DỤNG ở BỆNH NHÂN SUY THẬN
Xcltabinc chống chỉ định ở bệnh nhân suy thận nặng (Độ thanh thải Creatinin dưới 30 mI/phút). Các phân ứng
không mong muốn ở mức độ 3 hoặc 4 xảy ra ở bệnh nhân suy thận trung bình (Độ thanh thãi Creatinin 30-50
mllphủt) nhiều hơn so với người bình thường. Bệnh nhân suy thận trung bình, khuyến cáo giãm liều xuống 75%
Trang 7/8
\\ỤA`f " ~
\u.
với liếu khởi đẩu lã 1250 mg/mz, không cẩn giảm liều với liều khới đẩu lả 1000 mg/m². Bệnh nhân suy thận nhẹ
(Độ thanh thãi Creatinin dưới 51-80 mllphủt) không cẩn điếu chinh liếu khởi đẫu.
Nên theo dõi cẩn thận vã ngững điếu trị ngay lập tức nếu bệnh nhân có cãc tãc dụng ngoại ý độ 2, 3, hoặc 4 và
sau đó điểu chinh liều như băng chỉ dẫn. Nến tạm ngừng điểu trị Xeltabine, nếu độ thanh thãi creatinin giảm
dưới 30 mllphủt.
Điếu chỉnh liểu cho những bệnh nhân bị suy thận áp dụng cho cả việc điếu trị đơn liễu vã điều trị phối hợp.
ẨNH HƯỞNG ĐỂN KHẢ NĂNG LÁ] XE VÀ VẬN HÀNH MÁY MÓC
Xeltabine ãnh hưởng nhẹ hoặc trung bình đến khả năng lái xe vả vận hânh máy móc do Xeltabinc có thể gây
buồn ngủ, mệt mỏi và nôn mửa.
QUÁ LIỄU VÀ XỬ TRÍ
Biểu hiện cũa quá liếu cấp tĩnh bao gổm buổn nôn, nôn, tiêu chãy, viêm niêm mạc, kích thỉch vã chãy mãu
đường tiêu hóa, và suy tủy. N
Vìệc điếu trị quá 1iều nên bao gổm điều trị thông thường và các can thiệp về y trợ nhằm chữa trị những
triệu chứng lâm sâng đang hiện diện vả để phòng những biến chứng có thể xãy ra.
ĐÓNG GÓI
10 Viên nén bao phim] Vi x 12 Vil Hộp.
BÃO QUẢN
Bâo quãn ở nhiệt độ phòng không quá 30°C.
HAN DÙNG
24 tháng kể từ ngây sân xuất.
Không dùng quá hạn sử dụng ghi trên hộp.
TIÊU CHUẨN
USP 35.
Dọc kỹ hướng dẫn sữ dạng trước khi dùng.
Nếu cần lhêm thông tín, xin hỏi ý kiến bác sĩ.
Thuốc chỉ dùng theo sự kê đơn của bác sĩ. TUQ CỤC TRUỞNG
Để'xa tầm tay trẻ em. JVIĨ'TRẸỞNG PHÒ1N_G
yagen Jẳty Jfểìnấ
Sân xuất tại:
KOREA UNITED PHARM. 1NC. , _, .
25-23, Nojanggongdan—gil, Jeondong—Myeon, Sejong- 'ă'mQứốtdụủxỉ’“ `
Kim, Ể-Han
Chìef Reoresentative Wat…"
Trang 8/8
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng