













_ _
' 1
Control Proof Ne of Corrections
Format 128 x 108 x 48 m… . -
Regtster Nr. 96.4.3433 Date: ............................ Date; ............................ Date: ............................ _
NP 7757
- ~ . . - r\
m_05_2012 09112136 Vtsa: ............................ Vtsa. ............................ Visa ............................ t'j _;1
Grundschrift 9 Punkt Ẹ ;… q“
OK for Printing Control File ou< for Printing g ..v [ rA
Ệ' mực r- ĩ
Date: ............................ Date: ............................ Datet ......................... . Ề Ế… i ;; _ Ộ
Ĩ— “ ' i 1 —<
Visa: ............................ Visa ............................ Visar .......................... . Ẹ r“ _
px r., .3… …
i .of 13
10138120 FE 101381²0 FE 101381²0 FE 10138120 FE _; p-«
FưM1VONA FmM2VON4 HUMSVON4 HLM4VONA ẺL. Xiỵ_fầ
Pantone Black PMS 300 PMS 485 PMS 376 p Ế V-
010512 010512 0L0512 Ot0512 —ìỉẫ CỔ
le_ _ À \\
’ ® "
Xeloda )
Capecitabine
1
\ C) 120 film—coated tabiets Roche
/ ` . Medicine: keep out of reach of chnldren 1 fiIm-coated tablet = 500 mg
, Dosage and administratìon: see package capecitabine
1 1nsert 0 x
Do not store above 30 °C 0 m
13 Ô
m _
) - n 0
1 '8 = n.
:› 9² m
ẩ ỂỂ e
? 12 8 0149 04 A 3
. 8 m
1 v1èn nén bao phim = 500 mg capecitabine 8_
Hỏp chứa 12 vì x 10 viên 3
g_
Dùng đường uống. , g.
Chỉ định. chòng chí dinh, llẻu vả cảch dùng xm xem trong tờ hướng dẫn sử dung.
g Khòng bảo quản thuốc ở nh1ệi đỏ trên 30°C
~ D
Ễ ỏ THUOC cm BÁN THEO Đ_ơN g;
;; … oE XA _TÀM TAY cu_A TR_E EM _ _ g_t ;
… °_ ĐỌC KY HƯỚNG DAN sư DỤNG TRƯơC KHI DUNG _c_› E
Ê Ế _faf"'~a_
€ `Ỉ' Ng,ậv gản xqầt. hqn dùng. số lô sản xuảt xem ohằn MFD. EXP số lô trẻ_pgứao bỉ. ' ì\
7757
23 lt3v
gg~tảx\
Capecitabine
©
120 film-coated tablets
8 .g G N ay san xuất va ngay tièt hạn la ngay 01 cua thang.
t 1: O Sẵ dán k' 5
o m n: 0 9 Y _
:: `5 … _g Nhá nhặp khau:
u-' _I3 ẵ ẫ Sản xuất cho F Hoffnm-_La Roche Ltd , Basel. Thụy sỹ
ẻ ẳ -ẳ ẳ bởi Productos ,_ . .V. …
w _, 0 ổ Via lsidro Fa ' 50030 Toluca. Mè-hi-cò ;:
Ẹ%ĩa “ Ể
ã ổẵ .ỗ` 19 cn
'
:
Nguyen '
. OdW
bW ưotea)
ê
/t
(
\
3… /
/
#
" PREPRESS - INFORMATION PREPRESS - ROCHE BASEL CUSTOMER
Control Proof New Proof Corrections
136 mm breit, 1 Nutzen
Bhstergrosse 124 x 48 mm Date: ........................... Date: ............................ o…. ............................
Streudruck
16_06_2008 11:15:13 Visa: ............................ Visa: ............................ Visa: ...........................
Pseudo-PM
Patext halbmanuell OK for Printing Control File OK for Printing
Grundschnft 9 Punkt
Date: ............................ Date: ............................ Date: ..........................
Visa: ............................ Visa: ............................ Visa: ............................
gffldwouNNl Art-Nr, Code und Zeichnung ễaelơglag.
Schwarz Code-Steuermarke 99.4.3720/0 soãỉfịậ "“
16~°6-08 1 x pro Zylinder-Umfang ,
@
Xeloda® Xeloda® Xeloda® ịỳ
Capecitabine Capecitabine Capecitabine
1 500 mg | d ® 500 mg l d ®
Xe o a Xe o a
- Capecitabine . Capecitabine
500 mg 500 mg
Xeloda® Xeloda®
Capecitabine Capecitabine
500mg | d @ 500mg ] d @
Xe 0 a Xe o a
Capecitabine Capecitabine
500 mg 500 mg , ’ ,
Xeloda® Xeloda® . , ,
Capecitabine Capecitabine Capecitabine , —/
500 mg l d ® 500 mg l d 0 500 mg
Xeo a Xeo a” = —- -— _
- Capecitabine . Capecitabine Ủ' * Thi ' "
500 mg 500 mg guyen _ ẨỈlĩlh Thao
Xeloda® Xeloda® Xeloda®
Capecitabine Roohe Capecitabine Capecitabine 1`/
500 mg l d ® 500 mg l d @ 500 mg
Xe 0 a Xe 0 a `
Capecitabine Roche Capecitabine
500 mg 500 mg
Xeloda® _, Xeloda® Xeloda® e
Capecitabine Capecitabine
500 mg 500 mg _
Xeloda® Xeloda® … Xeloda®
Capecitabine <ỀẸẺ> Capecitabine <Ễ°ỆỆ> Capecitabine
500 mg 500 mg 500 mg
… Xeloda® _ Xeloda®
(Roche) Capecitabine Capecitabine <Ề> —
—' 500 mg —' 500 mg
Xeloda® … Xeloda® —, Xeloda®
Capecitabine ấmme,> Capecitabine Capecitabine Capecitabine QRẺẺ)
`— soo mg “ 500 mg r_-
Xeloda® … Xeloda® Xeloda® g
Capecitabine <“ẺỆ> Capecitabine Rỉff Capecitabine g
500 mg 500 mg 500 mg ẫ
__ Xeloda® _ Xeloda® _ e
"“ 500 mg 500 mg
,.J
VẢN PHONG en DLỆN
®
XGlOdũ nt 1HÀNH Phở
Capecitabine
1. MÔ TẢ
1.1 Nhóm dược lý ! Điều trị
Thuốc kìm tế bảo
1.2 Dạng trình bảy
Viên 500mg
1.3 Đường dùng
Uống
1.4 Thảnh phần chính
Hoạt chất chính: capecitabine
Tả dược: Capecitabine, Lactose (anhydrous), Croscarmcllose sodium, Hypromellose ,
Microcrystalline ccllulose, Magnesium stearatc
2. ĐẶC ĐIỂM LÂM SÀNG 77/
2.1 Chỉ định điều trị
Ung thư vú
Xeloda phối hợp vởi docetaxcl được chỉ định để điếu trị những bệnh nhân ung thư vú tiển triền tại
chỗ hoặc di căn sau khi thất bại với hóa trị liệu độc tế bảo. Liệu pháp điếu trị trước đây bao gồm
anthracycline. Xeloda cũng được chỉ định như đơn trị liệu cho điếu trị những bệnh nhân ung thư vú
tiến triến tại chỗ hoặc di căn sau khi thắt bại với chế độ hóa trị bao gồm anthracycline vả taxanc
hoặc cho những ung thư khảc mà không có chỉ định dùng anthracycline.
Ung lhư đại lrực lrảng
Xeloda được chỉ định diếu trị hỗ trợ cho những bệnh nhân ung thư đại trảng sau phẫu thuật.
Xeloda được chỉ định điếu trị cho những bệnh nhân ung thư đại trực trảng di căn.
Ung thư dạ dờy
Xeloda phối hợp với hợp chất platin được chỉ định điều trị bước một cho những bệnh nhân ung thư
dạ dảy tiến triên.
2.2 Liều lượng vả Cách sử dụng
Liều chuẩn
Nên uống Xeloda với nước trong vòng 30 phủt sau khi ản.
Đơn lrị:
Ung thư đại Irực trảng và ung thư vú
Liều đơn trị được khuzyếin cáo của Xeloda lả l250mg/m2 dùng hai lần mỗi ngảy (sảng và tối; tương
đương với 2500mg/m2 tông liều mỗi ngảy) trong 14 ngảy sau đó là 7 ngảy nghi thuốc
1
Điểu lrị kế! họp:
Ung Ihư vú:
Trong trường hợp phối hợp với docetaxel, liều khởi đầu khuyến cáo cùa Xeloda lả 1250mg/m2 hai
lần mỗi ngảy trong hai tuần sau đó là một tuần nghỉ, phối hợp với docetaxcl 7Smg/m2 truyền tĩnh
mạch trong vòng 1 giờ mỗi ba tuần.
Theo hưởng dẫn sử dụng cùa docetaxel, thuốc chuẩn bị nên bắt đầu trước khi dùng docetaxel ở
nhũng bệnh nhân dùng Xeloda phôi hợp với docetaxcl.
Ung Ihư dạ dảy vả ung thư đại trực trảng.
Trong trường hợp điều trị phối hợp, liều khuyến cảo cùa Xeloda lả 2800 tới 1000mg/m2 dùng hai lần
môi ngảy trong hai tuần sau đó 7 ngảy nghi thuốc, hoặc 625mg/m2 2 lần mỗi ngảy khi điều trị liên
tục (xem phần 3 1 2 Hiệu quả/Cảc nghiên cứu lâm sảng). Cảo thuốc sinh phẳm khi diều trị kết hợp
với Xeloda không lảm ảnh hướng tới liều khời đầu của Xeloda
Thuốc chuẩn bị trước để đảm bảo đủ nước và chống nôn phù hợp theo thông tin sản phẩm cisplatin
họặc oxaliplatin nên dùng trước khi dùng cisplatin hoặc oxaliplatin cho những bệnh nhân điêu trị
kêt hợp Xeloda với cisplatin hoặc oxaliplatin.
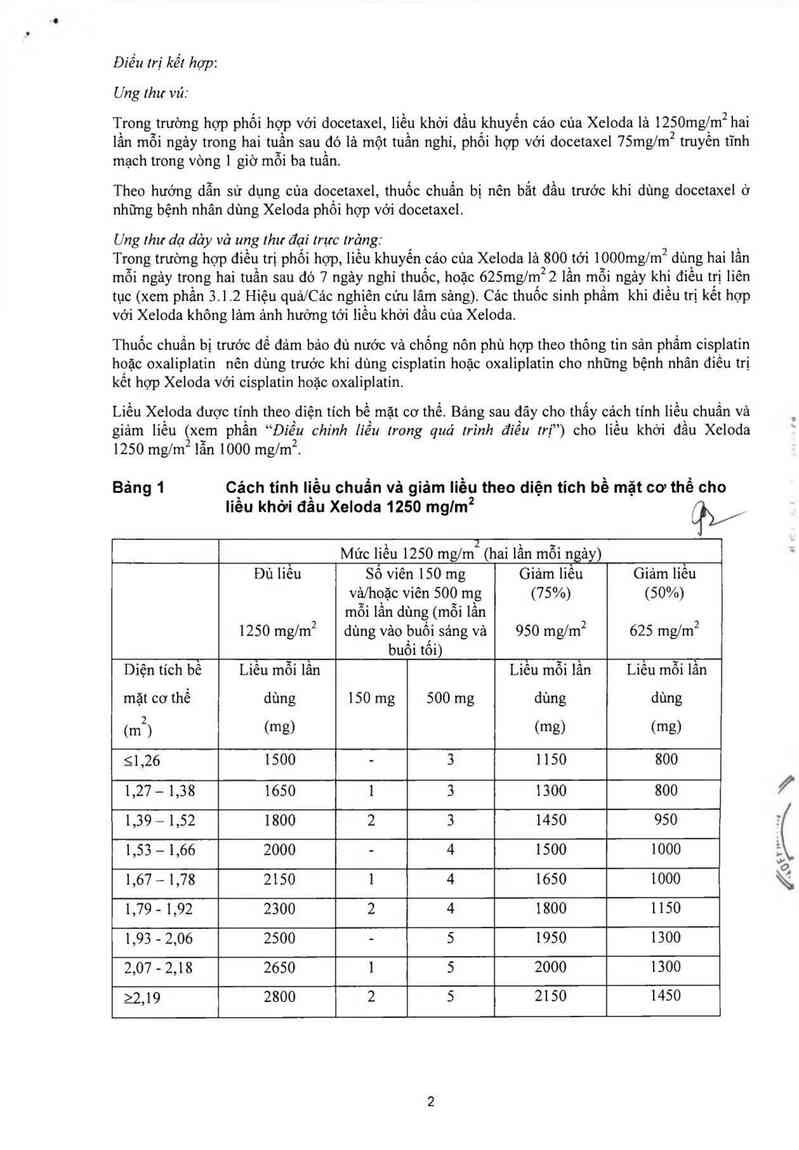
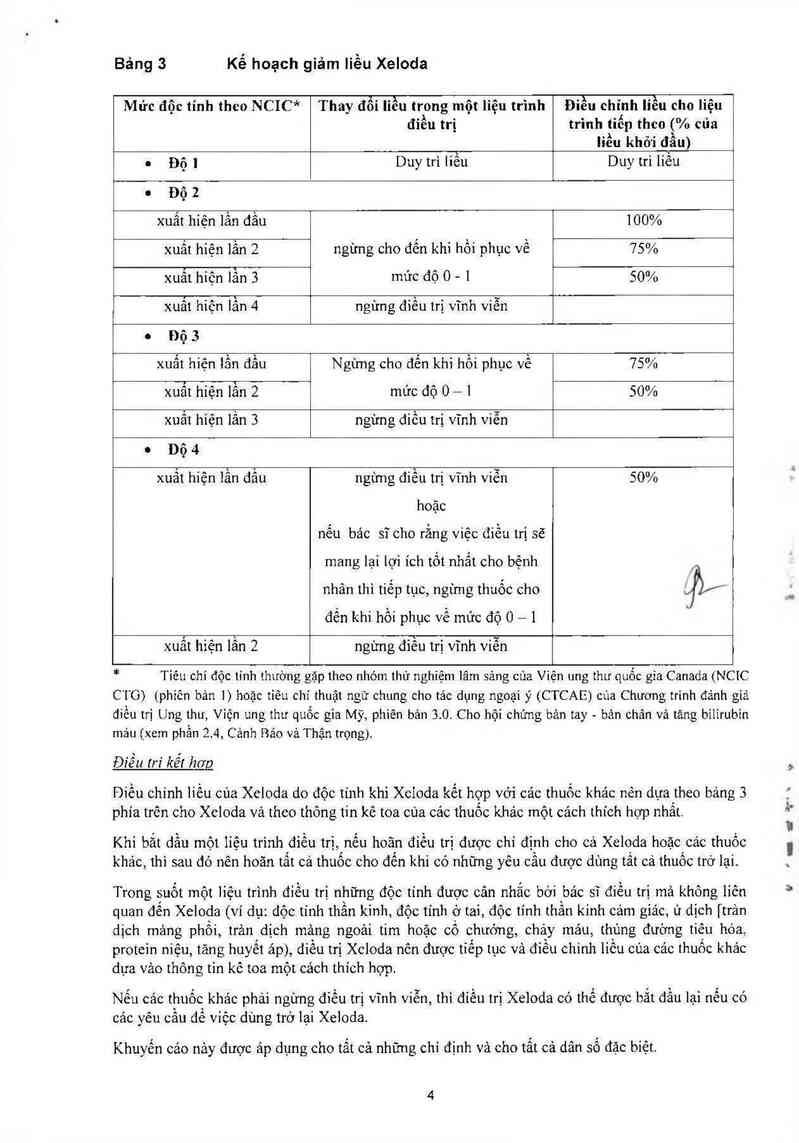
Liều Xeioda được tính theo `diện tích bề mặt cơ thể. Bảng sau đây cho thấy cảch tính liền chuẩn và
giảm liêu (xem phân “Điêu chỉnh Iiêu trong quá trình điêu trị”) cho liêu khởi đâu Xeloda
1250 ngm² lân 1000 ngm².
Bảng 1 c_ách tỉnh Iịều chuẩn và giảm Iiều theo diện tích bề mặt cơ thể cho
lỉêu khởi đâu Xeloda 1250 mg/m2 qV
` Mức liếu 1250 mg/m2 (hai lần mỗi ngảy)
Đủ liêu Số viên 150 mg Giảm liếu Giảm liêu
vả/hoặc viên 500 mg (75%) (50%)
mỗi lân dùng (mỗi lân
1250 mg/m2 dùng vảo buội sáng và 950 mg/m2 625 mg/m2
` ` ` buôi tôi)
Diện tích bê Liêu mỗi lân Liêu mỗi lần Liều mỗi lần
mặt cơ thể dùng 150 mg 500 mg dùng dùng
(m2) (mg)
51,26 1500 - 3 1 150 800
1,27 — 1,38 1650 1 3 1300 800
1,39 — 1,52 1800 2 3 1450 950
1,53 — 1,66 2000 — 4 1500 1000
1,67 — 1,78 2150 1 4 1650 1000
1,79 - 1,92 2300 2 4 1800 1150
1,93 — 2,06 2500 - 5 1950 1300
2,07 - 2,18 2650 1 5 2000 1300
22,19 2800 2 5 2150 1450
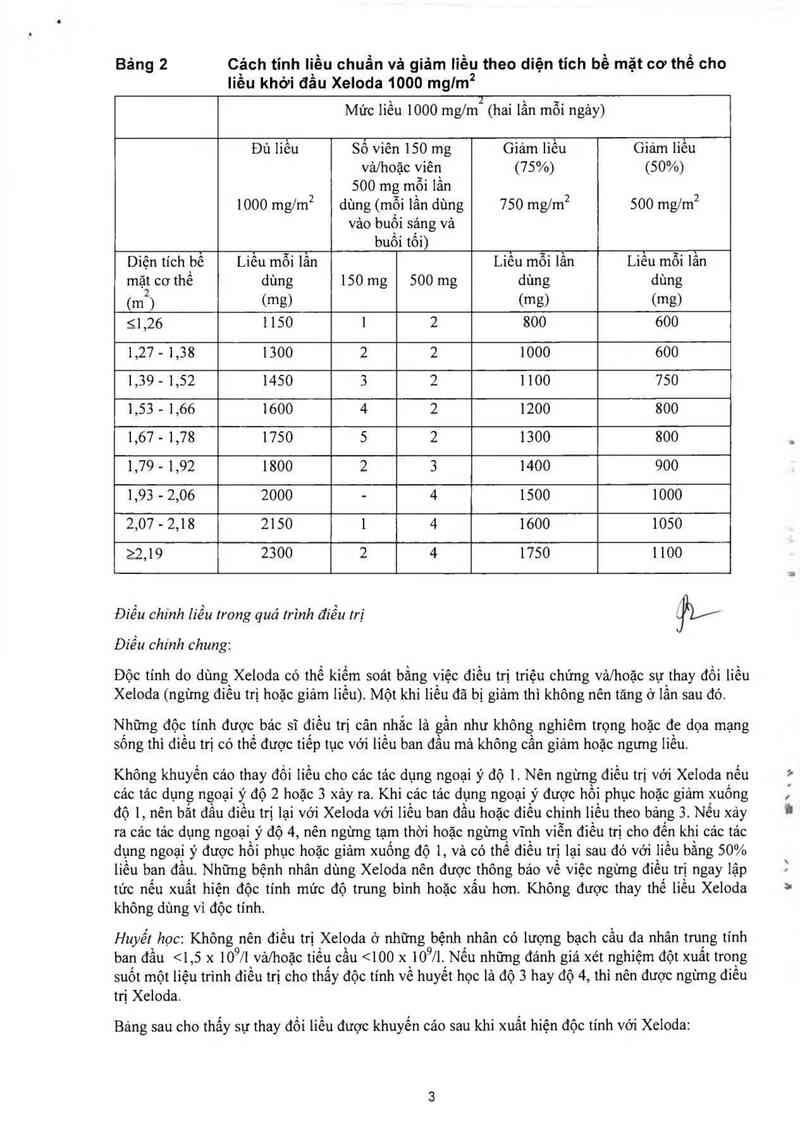
Bảng 2 C`ảch tinh Iịều chuẩn và giảm liều theo diện tích bề mặt cơ thể cho
liêu khởi đâu Xeloda 1000 mglm2
Mức liều 1000 ngm2 (hai lần mỗi ngảy)
Đủ liếu sỏ viên 150 mg Giảm liều Giảm liều
vả/hoặc viên (75%) (50%)
500 mg mội lân
1000 mg/m² dùng (mỗi lân dùng 750 mg/m² 500 ngm²
vảo buội sậng vả
` buôi tôi)
Diện tích hê Liều mỗi lần Liêu mỗi lân Liều mỗi lân
mặt cơ thể dùng 150 mg 500 mg dùng dùng
(mi) 65 tuồi từng trải qua những
tảc dụng thuốc ngoại ý (ADRs) dộ 3 và độ 4 nhiến hơn những bệnh nhận trẻ tuối, ADRs sẽ dẫn đến
ngừng tạm thời điếu trị. Nên theo dõi cẩn thận những bệnh nhân lớn tuổi.
- Khi điều trị Xeloda kết hợp với docetaxel, tỉ lệ cảc tảo dụng ngoại ý có liên quan đến điều trị độ 3
hoặc 4 và các tảc dụng ngoại ỷ nghiêm trọng tảng được ghi nhận ở những bệnh nhân trên 60 tuối
hoặc hơn. Với những bệnh nhân 60 tuổi hoặc hơn được điều trị phối hợp Xeloda với docetaxel, nên
giảm liếu khới đẩu xuống còn 75% (950mg/m2 hai lằn mỗi ngảy). Đế tính toản liều lượng, xem
bảng 2.
- `Với những bệnh nhân 65 tuổi hoặc hợn được điếu trị phối hợp Xeloda với irinotecan, nên giảm
liêu khới đâu xuông còn 800mg/m2 hai lân mỗi ngảy.
2.3 Chống chỉ định
Xeloda được chống chỉ định trên những bệnh nhân được biết là quả mẫn với capecitabine hoặc với
bât kỳ thảnh phân nảo cùa thuỏc.
Xeloda được chống chỉ định trên những bệnh nhân có tiến sử các phản ứng nghiêm trọng và không
dự đoản trước với fluoropyrimidine hoặc được biêt là quả mẫn với tiuorouracil.
Cũng như cảc fiuoropyrimidine, Xeloda dược chống chỉ định trên những bệnh nhân được biết là có
thiên hụt DPD (dihydropyrimidine dehydrogenase).
Không nên dùng Xeloda cùng với sorivudine hoặc cảc chất tương tự có liên quan về mặt hóa học,
như lá brivudine (xem phân 2.4.1 Tương tảo với cảc thuôc khảo).
Xeloda được chống chỉ định trên những bệnh nhân bị suy gan nặng (Child Pugh C)
Xeloda được chống chỉ định trên những bệnh nhân bị suy thận nặng (độ thanh thải creatinine giảm
dưới 30 mllphủt).
Nếu có chống chỉ định cùa bất kỳ thuốc nảo trong diếu trị kết hợp, thì không dùng thuốc đó.
2.4 Cảnh báo vả Thận trọng
Cánh báo
Tiêu chảy: Xeloda có thể gây tiêu chảy, dôi khí nặng. Bệnh nhân bị tiêu chảy nặng nên được theo
dõi cẳn thận vả nếu bị mất nước, nên bù nước vả điện giải. Nên bắt đầu điều trị tiêu chảy chuẩn (ví
dụ Ioperamidc), bằng các thuốc thích hợp cảng sởm cảng tốt. Giảm liều nên được áp dụng khi cẩn
thiết (xem phần 2.2, Liều lượng và Cảch dùng).
Mâl nước: Mất nước nên được ngăn chặn hoặc điêu chỉnh đủng lúc. Những bệnh nhân chán ăn, suy
nhược, buôn nôn, nôn hoặc tiêu chảy có thẻ mât nước một cảch nhanh chóng.
Mất nước có thể gây ra suy thận cấp, dặc biệt ở bệnh nhân có chức năng thận bị tổn thương trước
đó hoặc khi capecitabine được dùng đồng thời với các thuốc dã được biết là có độc tính trên thận.
Tử vong do suy thận đã được báo cảo trong những tình huống nảy, xem mục 2.6.2 Sau khi lưu hănh
Ihị lrường, Tảc dung không mong muốn.
Nếu mắt nước độ 2 (hoặc cao hơn) xuất hiện, nên ngừng điếu trị Xeloda ngay lập tức và mất nước
được hiệu chinh Khỏng nến diều trị lại cho đến khi bệnh nhân vẫn còn mất nước và bất kì nguyên
nhân sớm nảo gây ra phải được hiệu chỉnh hoặc kiếm soát Nên điều chỉnh liều cho những tác dụng
ngoại ý đến sớm khi cần thiết (xem phần 2.2, Liều lượng và Cách dùng).
Thận trọng ýV
Dộc tinh trên tim mạch ghi nhận dược ớ Xeloda cũng tương tự độc tính ghi nhận được ở các
fìuorinated pyrimidine khảo. Những độc tính nảy bao gồm nhồi mảu cơ tim, đau thắt ngực, rối loạn
nhịp tim, ngừng tim, suy tim và thay đối về điện tâm đồ. Những tác dụng ngoại ý nảy thường gặp
hơn ở những bệnh nhân có tiến sữ bệnh mạch vảnh.
Híếm, không mong đợi, cảc tảc dụng ngoại ý nghiêm trọng (ví dụ như viêm miệng, tiêu chảy, giảm
bạch câu trung tính và độc tính vê thằn kinh) kết hợp với sự thiếu hụt hoạt tính cùa
dihydropyrimidine dehydrogenase (DPD) được cho là do 5- FU. Do vậy khỏng thế loại trù có sự
liên kêt giữa việc giảm hảm lượng DPD và tăng tác động độc của 5-FU gây tảc hại một cảch tiếm
n.
Q).
Một vải trường hợp phản ứng da nghiêm trọng trong quá trình sử dụng Xeloda như là hội chứng
Stevens-Johnson (SJS) vả hoại tử nhiễm độc thượng bì (TEN) đã được bảo cảo, trong đó có một vải
trường hợp tử vong. Xeloda nên được ngưng sử dụng vĩnh viễn trên những bệnh nhân bị phản ứng
da nghiêm trọng, mà nguyên nhân của phản ứng da đó nhiều khả năng là do việc sử dụng Xeloda.
Xeloda có thể gây ra hội chứng bản tay — bản chân (rối loạn cảm giác đó da lòng bản tay-bản chân
hoặc gây ban dò đầu chỉ do hóa trị liệu) là độc tính da. Với những bệnh nhân bị di căn đang điều trị
Xeloda đơn thuần, trung vị thời gian để xuất hiện độc tính là 79 ngảy (trong khoảng 11 đến 360
ngảy), mức độ từ độ 1 đến 3. Hội chứng bản tay - bản chân độ 1 được xảc định bởi tê, rối Ioạn cảm
giảc/dị cảm, kiến bò, hoặc ban đỏ ở tay vảlhoặc chân vả/hoặc không cảm thắy thoải mái nhưng
không ảnh hưởng đến cảc hoạt động bình thường. Dộ 2 được xảc định là ban đỏ và sưng tay
vả/hoặc chân gây dau vả/hoặc không thoải mải ảnh hưởng đến các hoạt động cùa cuộc sống hảng
ngảy của bệnh nhân. Độ 3 được xác định là sự tróc vảy da, loét, mụn nước hoặc đau nhiều ở tay
vả/hoặc chân vả/hoặc rất khó chịu khiến bệnh nhân không thể lâm việc hoặc thực hiện các hoạt
động thông thường hảng ngảy. Nếu xảy ra hội chứng bản tay- bản chân độ 2 hoặc 3, nên ngừng
dùng Xeloda cho đến khi các trường hợp hồi phục hoặc giảm xuống độ 1. Sau khi xuất hiện hội
chứng bản tay— bản chân độ 3, nên giảm liều tiếp theo cùa Xeloda (xem phần 2. 2 Liều lượng vả
Cảch sư dụng) Khi sử dụng kết hợp Xeloda vả cisplatin, sử dụng vitamin B6 (pyridoxine) không
được khuyến khích cho triệu chứng hoặc điếu trị dự phòng thử phảt của hội chứng bản tay — bản
chân, bởi vì cảc bảo cáo đã công bò có thế 1ảm giảm hiệu quả cùa cisplatin.
Có một số bằng chứng cho thắy đexpanthenol hiệu quả trong việc dự phòng hội chứng bản tay-bản
chân ở những bệnh nhân được điêu trị băng Xeloda.
Xeloda có thể gây tăng bilirubin máu. Nên ngừng dùng Xeloda nếu bilirubin tăng › 3,0 x ULN
(trên giởi hạn bình thường) có liến quan đến điều trị hoặc men gan aminotransferase (ALT, AST)
tăng > 2,5 x ULN có liến quan đến điều trị. Có thể bắt đầu điếu trị lại khi bilirubin giảm xuống 5
3,0 x ULN hoặc aminotransferase gan giảm xuống 5 2,5 x ULN.
Trong một nghiên cứu tương tảc thuốc với warfarin liều đơn, AUC trung bình cùa S-warfarin tăng
nhiến (+57%). Những kết quả nảy cho thấy sự tuơng tảc thuốc có thế do capecitabine ức chế hệ
thống isoenzyme cytochrome P450 2C9. Những bệnh nhân dùng Xeloda kểt hợp với thuốc chống
đông dạng uống dẫn xuất cùa coumarin phải được theo dõi cấn thận về hiệu quả chống đông cúa
thuốc (INR hoặc thời gian prothrombin) và điều chinh liều thuốc chống đông cho phù hợp (xem
phần Tưong tảc thuốc với cảc thuốc khảo vả cảc hình thức tương tác).
2.4.1 Cảnh báo chung
Bệnh nhân được điếu trị bằng Xeloda nên được theo dõi cẩn thận vế độc tinh Phấn lớn các tảc
dụng ngoại ý có thể hồi phục và không yêu cầu phải ngừng thuốc vĩnh viễn, mặc dù vẫn cần phải
ngưng thuốc hoặc giảm liếu (xem phần 2 2 Liều lượng và Cách sử dụng)
2.4.2 Tương tác vởỉ các thuốc nội khoa khảo và các hinh thức tương tác khá
Thuốc chống đóng máu Coumarin `
Đã ghi nhận cảc thông số đông máu thay đổi vảlhoặc chảy máu ở những bệnh nhân dùng Xeloda
cùng với các thuốc chống động dẫn xuât coumarin như warfarin vả phenprocoumon. Những tảc
dụng phụ nảy xảy ra trong vải ngảy vả kéo dải tới vải tháng sau khi điều trị Xeloda vả, trong một số
ít trường hợp, trong một tháng sau khi ngừng Xeloda. Trong một nghiên cứu tương tảc lâm sảng,
sau khi dùng warfarin Iiếu đơn 20mg, việc điều trị Xeloda lảm tăng AUC cùa S-warfarin khoảng
57% và giá trị INR tăng 91 %. Những bệnh nhân dùng cảc thuốc chống đông dẫn xuất cùa coumarin
cùng với Xeloda nên được theo dõi cấn thận về những thay đối các thông số đông máu cùa họ (PT
hoặc INR) và phải điều chỉnh liếu thuốc chống đông cho phù hợp.
Cơ chất cúa Cytochrome P-450 2C9
Không có cảc nghiên cứu tương tác thuốc với thuốc chính thức được tiến hảnh vởi capecitabine vả
cảc thuôc khảo được biêt lả chuyên hóa bởi isoenzyme cytochrome P450 2C9. Nên theo dõi cân
thận khi Xeloda dùng cùng vởi những thuôo nảy.
Phenyloin
Nồng độ huyết tương cùa phenytoin tăng được ghi nhận trong khi dùng Xeloda cùng với phenytoin.
Chưa có nghiên cứu tương tác thuốc với thuốc chính thức nảo được tiến hảnh với phenytoin, nhưng
cơ chế tương tảc thuốc được cho lả capecitabine ức chế hệ thống isoenzyme CYP2C9 (xem phần
các thuốc chống đông Coumarin). Những bệnh nhân dùng phenytoin cùng với Xeloda nên dược
theo dõi cân thận vì nông độ huyết tương của phenytoin tăng.
Tương tác lhuốc-thức ăn
Trong tất cả cảc thử nghiệm lâm sảng, bệnh nhân được hưởng dẫn uống Xeloda trong vòng 30 phút
sau khi ăn. Vì dữ liệu hiện nay vê tính an toản vả hiệu quả dựa trên việc dùng cùng với thức ăn, nên
sử dụng Xeloda cùng với thức ăn.
Thuốc kháng acid
Tác động cúa hydroxide nhôm và thuốc kháng acid có chứa magnesium hydroxide lên dược động
học cùa capecitabine đã được nghiên cứu trên những bệnh nhân ung thư Nồng độ huyết tương cùa
7
capecitabine và một chất chuyến hóa (5’DFCR) tăng ít; không thấy tảc dộng lên ba chất chuyến hóa
chính (S’DFUR, 5-FU vả FBAL).
Leucovorin (folim'c acid)
Tảo động cùa leucovorin lên dược động học của capecitabine đã được nghiên cửu trên những bệnh
nhân ung thư. Leucovorin không tảo động lên dược động học cùa capecitabine vả cảc chất chuyến
hóa cùa nó. Tuy nhiên, ieucovorin có tác động lên dược lực học cùa Xeloda vả leucovorin có thế
lảm tăng độc tính của Xeloda.
Sorivudỉne và các Ihuôc rương lự
Tương tác thuốc-thuốc có ý nghĩa lâm sảng giữa sorivudine vả 5-FU, do sorivudine ức chế
dihydropyrimidine dehydrogenase, đă được mô tả trong y vãn Tương tác nảy, dẫn tới tăng độc tính
cùa dihydropyrimidine dehydrogenase, có thể nguy hiểm đến tinh mạng. Vì vậy, không nến dùng
Xeloda vởi sorivudine hoặc cảc thuốc tương tự có liên quan về mặt hóa học, như brivudine (xem
phẩn 2 3 Chống chỉ định) Cần đợi ít nhất 4 tuần sau khi kết thúc điếu trị với sorivudine hoặc cảc
thuốc tương tự cao liên quan về mặt hoá học như brivudine truớc khi bắt đầu trị liệu với Xeloda.
Oxaliplatin
Không có khảc biệt có ý nghĩa lâm sảng khi tiếp xúc với capecitabine hoặc cảc chất chuyến hóa,
platinum tự do hoặc platinum toản phần xuất hiện khi capecitabine vả oxaliplatin được dùng trong
điếu trị kết hợp, có hoặc không có bevacizumab.
Bevacízumab
Không có tảc động có ý nghĩa lâm sảng của bevacizumab lên cảc thông sô dược động học của
capecitabine hoặc các chât chuyên hóa cùa nó.
2.5 Sử dụng ở đối tượng đặc biệt ộ/
2.5.1 Phụ nữ có thai
Ành hướng tới phụ nữ có thai mức độ D
Không có nghiên cửu nảo trên phụ nữ có thai dùng Xeloda; tuy nhiến, dựa vảo các đặc tính dược 1
học và độc tính, có thể thấy rằng Xeloda có thể gây hại cho thai nếu được dùng cho phụ nữ có thai.
Trong cảc nghiên cứu độc tính sinh sản trên động vật, dùng capecitabine gây chết phôi và quái thai.
Những bằng chứng nảy có thể xảy ra ở những dẫn xuất của fluoropyrimidine. Capecitabine được
cho rằng có khả năng gây quái thai ở người. Không nến dùng Xeloda trong khi mang thai Nếũ
dùng Xeloda trong khi mang thai hoặc nếu bệnh nhân có thai trong khi dùng thuốc nảy, phải thông
bảo cho bệnh nhân biết nguy cơ tiếm ấn cho thai. Nên khuyến những phụ nữ trong độ tuồi sinh đẻ
trảnh mang thai trong khi điếu trị với Xeloda.
2. 5. 2 Phụ nữ cho con bú
Không biết liệu thuốc được bải tiết qua sữa mẹ hay không. Trong một nghiên cứu cho chuột đang
cho con bú uống Xeloda liều đơn, một lượng đáng kể cảc chất chuyến hóa cùa capecitabine được
bải tiết trong sữa. Nến ngừng cho con bú trong quá trinh điếu trị Xeloda.
2.5.3 Người giả
Trong số những bệnh nhân ung thư đại trực trảng tuổi từ 60 — 79 nhận điếu trị Xeloda đơn thuần
cho di căn xa, xuất độ độc tính đường tiêu hóa tương tự trong dân số chung. Nhũng bệnh nhân 80
tuối hoặc hơn, có tỉ lệ lớn hơn những tảc dụng ngoại ỷ đường tiêu hóa độ 3, độ 4, như tiêu chảy,
buồn nôn vả nôn ói (xem phần 2. 2. 1, Hướng dẫn liếu dùng đặc biệt). Khi điều trị Xeloda kết hợp
với các thuốc khảc, bệnh nhân lớn tuổi > 65 tuổi từng có qua những phản ứng thuốc ngoại ý
(ADRs) dộ 3 và độ 4 nhiều hon những bệnh nhân trẻ tuồi, ADRs sẽ dẫn dến tạm ngừng điếu trị.
Khi điếu trị Xeloda kết hợp với docetaxel, tỉ lệ các tảc dụng ngoại ý có liên quan dến điếu trị độ 3
8
h0ặc 4, cảc tảc dụng ngoại ý nghiêm trọng và rút lui điều trị sóm do cảc tác dụng ngoại ỷ tăng được
ghi nhận ở những bệnh nhân 60 tuổi hoặc hơn, so với bệnh nhân nhỏ hơn 60 tuôi.
2. 5.4 Suy thặn
Cảc bảc sĩ nên kíếm tra cẩn thận khi dùng Xeloda cho nhưng bệnh nhân suy giảm chức năng thận
Như đã thấy với 5- FU xuất độ những tác dụng ngoại ý độ 3, độ 4 liên quan đến diếu trị thì nhiến
hơn ở bệnh nhân suy thận mức độ trung binh (dộ thanh thải creatinine 30- 50 ml/phút) (xem phần
2.2.1, Hưởng dẫn Iiều dùng đặc biệt).
2. 5. 5 Suy gan
Những bệnh nhân suy gan nên theo dõi cẩn thận khi điếu trị với Xeloda. Suy gan không do di căn
gan hoặc suy gạn nặng do tảc động cùa Xeloda thi khỏng được biết (xem phẩn 3. 2 5, Dược động
học trong dân sô đặc biệt và phẳn 2 2.1 ,Hưởng dẫn liếu dùng đặc biệt)
2.6 Tác dụng không mong muốn
Thông bảo cho các bác sỹ những tảc dụng khỏng mong muốn gặp phải khi sử dụng thuốc
2. 6.1 Các thử nghiệm lảm sảng
Cảo phản ưng thuốc ngoại ỷ (ADRs) được xcm xét bời nghiên cứu vìên có khả năng, có thế lá có
liên quan xa với việc điều trị với Xeloda đã được ghi nhặn từ những nghiên cứu lãm sảng tíến hảnh
với Xeloda đơn trị (trong điếu trị hỗ trợ ung thư đại trảng, trong ung thư đại trực trảng di căn vả
ung thư vú di căn), và những nghiên cứu lâm sảng tiến hảnh với Xeloda trong điếu trị phối hợp với
phảc đồ hoá trị khảc nhau cho các chỉ định khảo nhau. Những ADR được nêu ra trong các bảng
dưới đây lả những ADR có tỷ lệ cao nhất được tồng hợp từ 7 thử nghiệm lâm sảng đã hoản thảnh
/Ỉ
Với môi nhỏm tần xuất các ADR dược xếp theo mức độ nguy hại giảm dần Tần xuất được chía kỉ
thânh cảc nhóm, rất hay gặp_ > 10%, hay gặp_ > 5% tới < 10%, ít gặp 0,1% tới 1%. ,
Xeỉoda đơn Jrị — Dữ kiện về tính an toản cùa Xeloda đơn trị được báo cáo từ những bệnh nhân ung
thư đại trảng điếu trị hỗ trợ vả từ những bệnh nhân điếu trị ung thư vú di căn hoặc ung thư đại trục
trảng dí căn. Thông tin về sự an toản từ một thử nghiệm pha III trong diều trị ung thư đại trảng (995
bệnh nhân diều trị với Xeloda vả 974 điếu trị với 5—FU/LV tiêm tĩnh mạch) và từ 4 thử nghiệm pha
II ở bệnh nhân nữ ung thư vú (N=319) và 3 thử nghiệm (1 pha II vả 2 pha 111) ở bệnh nhãn nam vả
nữ ung thư đại trực trảng (N=630). Dữ kiện an toản cùa Xeloda đơn trị thì có thế so sảnh bệnh nhân
ung thư dại trảng điếu trị hỗ trợ với bệnh nhân điếu trị ung thư vú di căn vả ung thư đại trực trảng
dí căn. Mức độ cùa ADRs được xếp loại dựa theo bảng phân loại dộc tính Hệ thống xếp loại NCIC
CTC.
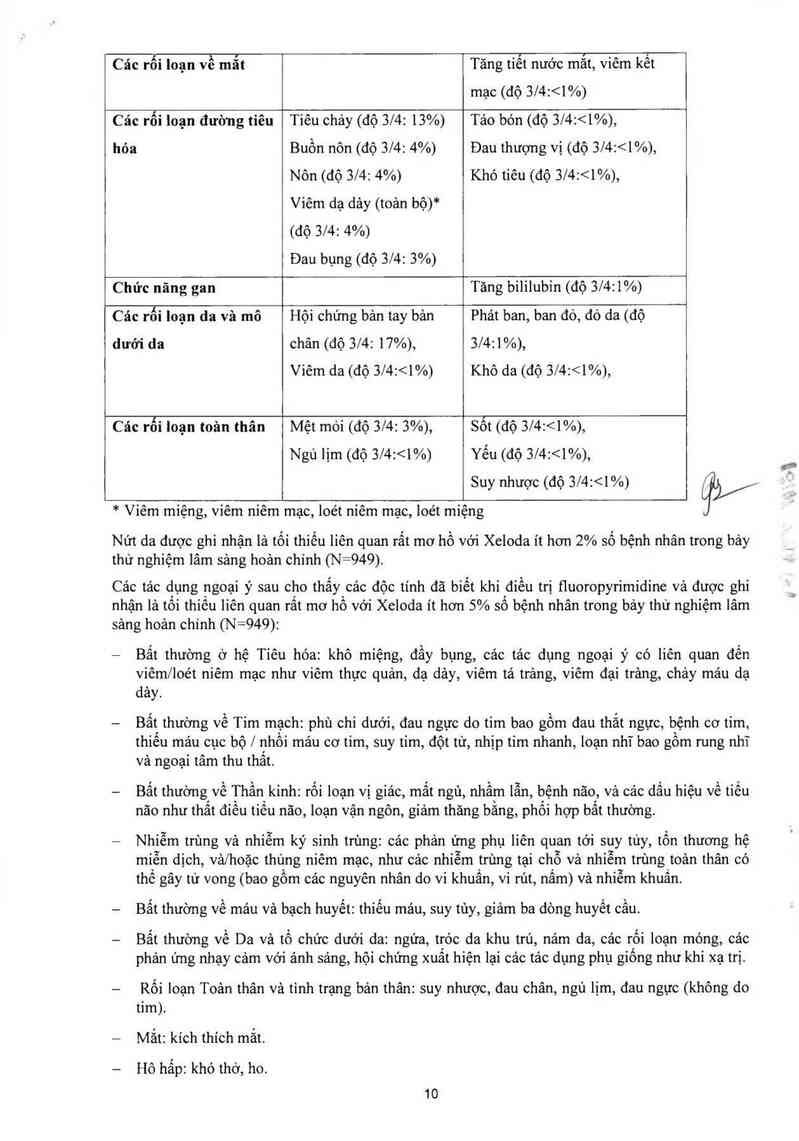
Bảng 4 Tóm tắt các tảo dụng ngoại ỷ ghi nhặn 25% bệnh nhân điều trị với
Xeloda đơn trị
Hệ thống cơ thể Rẩt hay gặp Hay gặp
Tảc dụng ngoại ý (2 10%) (ES'Vo - < 10%)
Các rối loạn chuyển Chán ãn (độ 3/4:1%) Mẫt nước (độ 3/4: 3%)
hóa và dinh dưỡng Gíảm ngon miệng (độ 3/4:<1 %)
Các rổi loạn thần kinh Dị cảm, loạn vị giác (độ
3!41<1%),
Nhức đầu (độ 3!4:<1%),
Hoa mắt (trừ chóng mặt) (độ
3/4:<1%)
Cảc rối Ioạn về mắt
w ~ Ắ ! !. ~ A A
Tang net nươc mat, Viem ket
mạc (độ 3/4:<1%)
p Ẩo \ oA
Cac rou Ioạn đương tieu
hóa
Tiêu chảy (độ 3/4: 13%)
Buồn nôn (độ 3/4: 4%)
Nôn (độ 3/4: 4%)
Viêm dạ dảy (toản bộ)*
(độ 3/4: 4%)
Đau bụng (độ 3/4: 3%)
Tảo bón (độ 3/4:<1%),
Đau thượng vị (độ 3/4:<1%),
Khó tiêu (độ 3/4:<1%),
Chức năng gan
Tăng bililubin (độ 3/4:1%)
Ấ. ` A
Các ro: loạn da va mo
dưới da
Hội chứng bản tay bản
chân (độ 3/4: 17%),
Viêm da (độ 3/4:<1%)
Phát ban, ban đò, đò da (độ
3/411%),
Khô da (độ 3/41<1%),
Các rối loạn toản thân
Mệt mòi (độ 3/4: 3%),
Ngủ lịm (độ 3/4:<1%)
Sổt (độ 3/4:<1%),
Yếu (độ 3/4:<1%),
Suy nhược (độ 3/4:<1%)
* Viêm miệng, viêm niêm mạc, loét niêm mạc, loét miệng
%
Nứt da được ghi nhận là tối thiếu liên quan rất mơ hồ với Xeloda ít hơn 2% số bệnh nhân trong bảy
thứ nghìệm lâm sảng hoản chỉnh (N=949).
Các tảc dụng ngoại ý sau cho thẩy cảc độc tính đã biết khi điếu trị fluoropyrimidine và được ghi
nhận là tối thiều liên quan rất mơ hồ với Xeloda ít hơn 5% số bệnh nhân trong bảy thử nghiệm lâm
sảng hoản chính (N= 949):
Bất thường ở hệ Tiêu hóa: khô miệng, đầy bụng, cảc tác dụng ngoại ý có liên quan đến
viêm/loét niêm mạc như viêm thực quản, dạ dảy, viêm tả trảng, viêm đại trảng, chảy mảu dạ
dảy.
Bất thường về Tim mạch: phù chi dưới, đau ngực do tim bao gồm đau thắt ngực, bệnh cơ tím,
thiêu máu cục bộ / nhôi mảu cơ tim, suy tim, đột tử, nhịp tim nhanh, Ioạn nhĩ bao gôm rung nhĩ
vả ngoại tâm thu thât.
Bất thường về Thần kinh: rối loạn vị giác, mất ngù, nhầm lẫn, bệnh não, và cảc dấu hiệu về tiếu
não như thât điêu tiếu não, loạn vận ngôn, giảm thăng băng, phôi hợp bât thường.
Nhiễm trùng và nhiễm ký sinh trùng: các phản ứng phụ liên quan tới suy tùy, tổn thương hệ
miên dịch, vả/hoặc thùng niêm mạc, như cảc nhiêm trùng tại chỗ và nhiễm trùng toản thân có
thế gây tử vong (bao gồm cảc nguyên nhân do vi khuân, vi rủt, nâm) vả nhiễm khuân.
Bắt thường về máu vả bạch huyết: thiếu máu, suy tủy, giảm ba dòng huyết cầu.
Bât thường vê Da vả tô chức dưới da: ngứa, tróc da khu trú, nám da, các rôi loạn mỏng, các
. J . , . , . … , ả ., - , , .x . .
phan ưng nhạy cam vơi anh sang, hỌl chưng xuat hiẹn lại cac tac dụng phụ giong như khi xạ trị.
Rối loạn Toản thân và tình trạng bản thân: suy nhược, đau chân, ngủ lịm, đau ngực (không do
tim).
Mắt: kích thích mắt.
Hô hấp: khó thờ, ho.
1o
€"
— Cơ xương: đau lưng, đau cơ, đau khớp.
— Các rôi loạn tâm thân: trâm cảm.
— Suy gan vả viêm gan ứ mật được ghi nhận trong các thử nghiệm lâm sảng và sau khi lưu hảnh
trên thị trường. Mối quan hệ nhân quả với việc điếu trị bằng Xeloda chưa được thiết lập.
Xeloda Ir0ng điều tri kết hơp
Những ADR liên quan tởi điếu trị kết hợp Xeloda với các phảc đồ hoá trị khảc nhau trong cảc chỉ
định khác nhau được tông hợp trong bảng 5 là những ADR mới hoặc xuất hiện với tần xuât cao hơn
so với đơn trị liệu. Các dữ liệu an toản giữa cảc chỉ định và cảc phảc đồ kết hợp là tương đương
Cảc phản ứng xuất hiện với tần xuất > 5% ở các bệnh nhân điếu trị Xeloda kết hợp với các phác đồ
hoá trị khảc nhau. Cảc ADR mới được nêu trong cảc bảng dưới đây dựa trên cảc tỷ lệ xuất hiện cao
nhất quan sảt được qua cảc thử nghiệm lâm sảng chính. Một vải ADR cũng thường xuất hiện khi sử
dụng hoá trị (như bệnh thần kinh ngoại vi gặp trong sử dụng docetaxel hoặc oxaliplatin, tảng huyết
áp trong sử dụng bevacizumab), tuy nhiến không loại trừ được sử dụng Xeloda lảm các ADR nảy
nặng thêm.
Bảng 5 Các tác dụng ngoại ý hay gặp và rất hay gặp được ghi nhận thêm ở
bệnh nhân điều trị với Xeloda kết hợp các hoá trị liệu khác nhau so với
Xeloda đơn trị liệu
Hệ thống cơ thể
Tác dụng ngoại ỷ
Rẫt hay gặp
a 10%
Hay gặp
25% tới < 10%
Nhiễm trùng và nhiễm ký
sinh trùng
Nhiễm trùng*
Nhiễm candida miệng
l . A I , `
Rm loạn hẹ thong mau va
bạch huyết
Giảm bạch cầu trung tính+
Giảm bạch cầu *
Sốt do giảm bạch cầu+
Giảm tiếu cầu+
Thiêu máuị
Ku R 1 `
RO! Ioạn chuyen hoa va
Giảm cảm giác ngon miệng
Giảm kali huyết
dinh dưỡng Giảm cân
Rối loạn tâm thần Mẫt ngủ
Rối loạn hệ thần kinh
Bệnh thần kinh ngoại biên,
Loạn cảm thần kinh ngoại biên,
Rối loạn vị giảc,
Dị cảm,
Loạn vị giảc,
Loạn cảm giác,
Đau đâu
Giảm cảm giảc
11
LĨV
\ Rối loạn về mắt Tăng tiết nước mắt
i
Rối loạn về Tim mạch Huyết khối,
Tăng huyết ảp
Phù chi dưới
Hô hẩp Loạn cảm giảc họng, Chảy mảu cam,
Đau họng Khó phảt âm
Chảy mũi
Khó thở
Hệ tiêu hoá Tảo bón Khô miệng
Khó tiêu
Da và tổ chửc dưới da Rụng tóc
Rối loạn móng
Hệ cơ xương và mô liên Đau khớp Đau nhức hảm
kết Đau cơ Dau lưng
Đau ở các chi
Toản thân sả Sốt +
Suy nhược Đau nhức
Mệt mòi vỷỳ
Nhậy cảm với nhiệt độ
Tần xuất tính trên tất cả cảc mức độ ADR, trừ những ADR có dấu + iả chỉ tinh từ mức dộ %
Tăng nhậy cảm (2%) và thiếu máu cục bộ/nhổi mảu tím (3%) cũng được ghi nhận khi điều trị kết
hợp Xeloda với cảc phảc đô hoả trị nhưng tỷ lệ xuất hiện nhỏ hơn 5% trên tông sô bệnh nhân.
Cảo tảc dụng thuốc ngoại ỷ hiếm hoặc không phổ biến được ghi nhận trong điếu trị kết hợp Xeloda
vả cảc hoá trị liệu phù hợp với ghi nhận cảc tảc dụng thuôc ngoại ý trong điêu trị Xeloda đơn trị
hoặc hoả trị đơn trị (xem thông tin kê toa của cảc sản phâm hóa trị).
2. 6. 1.1 Các bất thường về xét nghiệm
Bảng dưới đây thể hiện cảc bất thường về xét nghiệm quan sát ở 995 bệnh nhân (trong điều trị hỗ
trợ ung thư đại trảng ) vả ở 949 bệnh nhân (trong ung thư vú di căn và ung thư đại trực trảng di
căn) không quan tâm đến mối Iiên quan điều trị với Xeloda
Bảng 6 Các bắt thường về xét nghiệm“: Xeloda đơn trị trong hỗ trợ điều trị ung
thư đại trảng và trong ung thư vú di căn và ung thư đại trực trảng
12
Xeloda 1250 ngm² hai lần mỗi
Thông số ngây, dùng khônglliên tục `
Bệnh nhân có những bât thường về
xét nghiệm dộ 3/4 (%)
Tảng ALAT (SGPT) 1,6
Tăng ASAT (SGOT) 1,1
Tăng alkaline phosphatase 3,5
Tăng calcium 1,1
Giảm caicium 2,3
Giảm bạch cầu hạt 0,3
Giảm hemoglobin 3,1
Giảm tế bảo lympho 44_4
Giảm bạch cầu trung tính 3,6
Giảm bạch cẩu trung tính/bạch 2,4
cẩu hạt
Giảm tiếu cẳu 2,0
Giảm kali 0,3
Tăng creatinin huyết thanh 0,5
Giảm natri 0,4 ịĨ'Ẩ/
Tảng dường huyết 4,4
' 3Các bất thường xét nghiệm được xêp Ioại dựa theo bảng phân loại của Hệ thống
xêp loại NCIC CTC.
2.6.2 Sau khi lưu hảnh thị trường
Cảc phản ứng thuốc ngoại ý sau được thấy trong quá trinh lưu hảnh trên thị trường:
—Hiếm: suy thận cấp tính thứ phảt do mất nước bao gồm cả từ vong, xem mục 2.4 Cánh báo và
Thận lrọng.
-Rất hiếm: phản ứng da nghiêm trọng như hội chứng Stevens—Johnson vả hoại tử nhiễm độc thượng
bi (TEN), xem mục 2.4 Cánh báo vờ Thận Irọng.
-Rât hiêm: hẹp ống dẫn lệ không đặc hiệu, rôi loạn giảc mạc bao gồm viêm giảc mạc.
-Rât hiêm: suy gan và viêm gan ứ mật đã được ghi nhận trong quá trình thử nghiệm iâm sảng vả
sau khi lưu hảnh trên thị trường.
2.7 Quá liêu
Biến hiện của quả liêu cấp tinh bao gồm buồn nôn, nôn, tiêu chảy, viêm niêm mạc, kích thich và
chảy máu đường tiêu hóa, và suy tủy.
Việc điếu trị quả liếu nên bao gồm điếu trị thông thường và cảc can thiệp về y khoai hỗ trợ nhằm
chữa trị nhũng triệu chứng lâm sảng đang hiện diện và phòng những biên chứng có thẻ xảy ra.
13
3. ĐẶC TỈNH Dược LÝ VÀ HIỆU QUẢ
3.1 Đặc tỉnh dược lý
3.1.1 Cơ chế hoạt động
Capecitabine lả dẫn xuất fluoropyrimidinc carbamate được đíều chế để dùng đường uống, lá thuốc
độc tế bảo được hoạt hoá bởi khôi u và chọn lọc trên khôi u.
Capecitabine không phải là chất độc tế bảo trên in vilro. Tuy nhiên, trên in vivo, thuốc được biến
đôi liên tiêp thảnh chât gôc độc tế bảo là 5-f1uoroưracil (S-FU), chât nảy sẻ được chuyên hoả tiêp.
Sự hình thảnh 5-FU tại khối u nhờ xúc tảc một cảch tối ưu củạ yếu tố tạo mạch liên quan tới khối u
là thymidine phosphorylase (dTthase), nhờ đó lảm giảm tôi đa mức độ cùa mô lảnh với S-FU
trong cơ thê.
Sự biến đối sính học tuần tự cùa men từ capccitabinc thảnh 5—FU dẫn tới nống độ của 5—FU cao hơn
trong mô khối u. Sau khi cho bệnh nhân bị ung thư đại trực trảng (N=8) uống capccitabine, tỉ số
nồng độ cùa SFU ớ khối u dại trực trảng so với cảc mô gần kế là 3,2 (dao động từ 0,9 đến 8,0). Tỉ
số nồng độ ở khối u so với huyết tương là 21,4 (dao động từ 3,9 đến 59,9) trong khi tỉ số ở cảc mô
khoẻ mạnh so với huyết tương là 8,9 (dao động từ 3,0 đến 25,8). Hoạt tính cùa thymidine
phosphorylase cao hơn gấp 4 lần ở khối u đại trực trảng so với mô binh thường bên cạnh.
Một vải khối u ở người, như ung thư vú, dạ dảy, đại trực trạng, cổ tử cung, và buồng trứng, có nồng
độ thymidine phosphoryiase cao hơn (có khả năng chuyên 5’-DFUR [5’-dcoxy-S-iiuorouridine]
thảnh 5-FU) so với cảc mô binh thường tương ứng.
Cảc tế bảo binh thường vả cảc tế bảo khối u chuyển hoá 5- FU thảnh 5- fluoro- 2— deoxyuridine
monophosphate (FđUMP) vả 5- f1uorouridine triphosphate (FUTP). Những chất chuyến hoả nảy sẽ
lảm tôn thương tế bảo bằng hai cơ chế Đầu tiến, FđUMP vả đống yếu tố folate N5 '0-
methylenetetrahydrofolate gắn với thymidylate synthase (TS) tạo nên một phức hợp gồm ba yếu tố
đồng hoá trị. Sự găn kết nảy sẽ ức chế sự hình thảnh thymidylate tư uracil Thymidylate là một tiền
chắt cần thiết cùa thymidine triphosphate, một chất cân thiết cho sự tổng hợp DNA, vì vậy sự thiếu
hụt hợp chất nảy có thế ức chế sự phân chia tế bảo. Thứ hai, cảc men sao chép nhân có thế kết hợp
một cách nhầm lẫn FUTP thay vì uridine triphosphate (UTP) trong quá trình tống hợp RNA. Lỗi
chuyến hoá nây có thể ảnh hưởng tới sự tồng hợp RNA vả protein.
3.1.2 Hiệu quả lâm sảng ỆỔ/
Đơn Trị - Ung lhư đại !rực trảng
Số liệu từ một thử nghiệm lâm sảng pha III, đa trung tâm, ngẫu nhiến, có đối chứng trên những
bệnh nhân bị ung thư đại trảng giai đoạn III (Dukes C) ùng hộ cho việc sử dụng Xeloda cho sự điếu
trị hỗ trợ trên những bệnh nhân bị ung thư đại trảng (nghiên cứu XACT: M66001). Trong thử
nghiệm nảy, 1987 bệnh nhân được chọn ngẫu nhiên đề điếu trị với Xeloda (1250mg/m2 hai lần mỗi
ngảy trong hai tuần sau đó 1ả một tuần nghi thuốc và được dùng liệu trinh 3 tuần như vậy trong 24
tuần) hoặc 5-FU vả leucovorin (phảc đồ điếu trị Mayo: dùng 20mg/m2 leucovorin tiêm tĩnh mạch
sau đó lả 425mg/m2 5-FU truyền tĩnh mạch nhanh, từ ngảy 1 đến ngảy thứ 5, mỗi 28 ngảy trong 24
tuần). Xeloda ít nhắt tương đương với 5- FU/LV đường tĩnh mạch ờ tỉ lệ sống thêm không bệnh
(p= —0, 0001, khoảng giới hạn không kém hơn 1 ,.2) Trên tất cả số người được chọn ngẫu nhiến, thử
nghiệm cho sự khác biệt giữa Xeloda vả 5- FU/LV ở sống thêm không bệnh, và sống sót chung cho
thấy tỉ số nguy cơ tương ứng lần lượt là 0,88 (khoảng tin cậy 95% 0,77 — 1,;01 p=O, 068) và 0,86
(khoảng tin cậy 95% 0,74 — 1,01; p=0,060), và 0,87 (khoảng tin cậy 95% 0,75—1; p=0,057]. Trung
vị thời gian theo dõi tại thời điềm phân tích là 6,9 năm.
Số liệu từ hai thử nghiệm iâm sảng được thiết kế tương tự, đa trung tâm, ngẫu nhiên, có đối chứng,
pha III ủng họ việc sử dụng Xeloda cho điếu trị bước một ung thư đại trực trảng di căn (8014695;
S014796). Trong các thử nghiệm nảy, 603 bệnh nhân được chọn ngẫu nhiên để điều trị Xeloda
( IZSOmg/m2 hai lần mỗi ngảy trong hai tuần sau đó là một tuần nghi thuốc và được dùng cảc liệu
14
trinh ba tuần như vậy). 604 bệnh2 nhân được chọn ngẫu nhiến đế điếu trị với 5- FU 2vả leucovorin
(phác dỗ điếu trị Mayo: 20mg/m2 leucovorin tiêm tĩnh mạch, tiếp theo lá 425mg/m2 5- FU truyền
tĩnh mạch nhanh, vảo ngảy đầu tiên cho đến ngảy thứ 5, mỗi 28 ngảy).
Tỉ lệ dảp ứng khảch quan chung trên tất cả số người được chọn ngẫu nhiên (đảnh giả cùa nghiến
cứu viên) là 25,7% (Xeloda) so với 16,7% (phác đồ điều trị Mayo); p<0,0002. Trung vị thời gian
đến khi bệnh tiến triển lả 140 ngảy (Xeloda) so với 144 ngảy (phác đồ đíều trị Mayo). Trung vị thời
gian sống là 392 ngảy (Xeloda) so với 391 ngảy (phác đồ điếu trị Mayo).
Điều irị kết hợp — Điều trị bước một ung Ihư đại Jrực rrc`mg
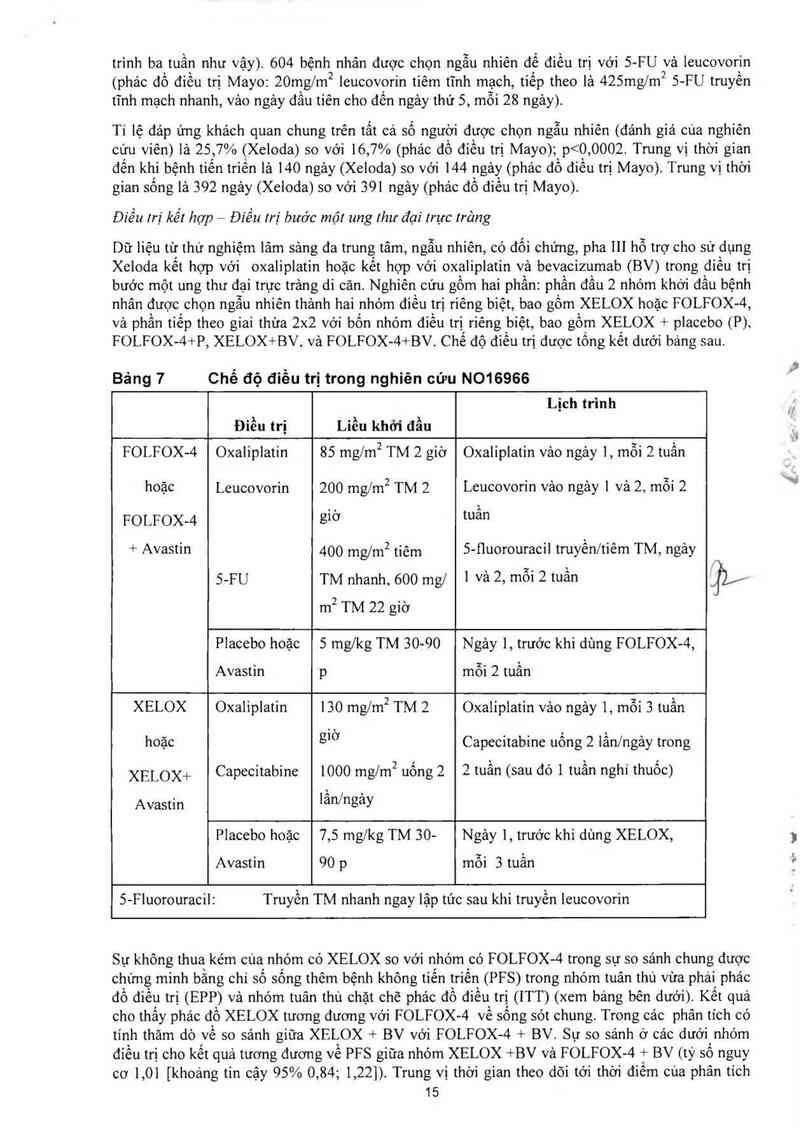
Dữ liệu từ thử nghiệm lãm sảng đa trung tâm, ngẫu nhiên, có đối chứng, pha 111 hỗ trợ cho sư dụng
Xeloda kết hợp với oxaliplatin hoặc kết hợp với oxaliplatin vả bevacizumab (BV) trong điều trị
bưởc một ung thư đại trực trảng di căn. Nghiên cứu gồm hai phần: phần đầu 2 nhỏm khời đầu bệnh
nhân được chọn ngẫu nhiên thảnh hai nhóm điều trị riêng biệt, bao gồm XELOX hoặc FOLFOX-4,
vả phần tiếp theo giai thừa 2x2 với bốn nhóm điếu trị riêng biệt, bao gồm XELOX + placebo (P).
FOLFOX—4+P, XELOX+BV, vả FOLFOX—4+BV. Chế độ điều trị được tồng kết dưới bảng sau.
Bảng 1 Chế độ điều trị trong nghiên cứu N016966
Lịch trình
Điều trị Liều khởi đầu
FOLFOX-4 Oxaliplatin 85 mg/m2 TM 2 giờ Oxaliplatin vảo ngảy 1, mỗi 2 tuần
hoặc Leưcovorin 200 mg/m2 TM 2 Leucovorin vảo ngảy ] và 2, mỗi 2
FOLFOX-4 giờ mần
+ Avastin 400 mg/mz tiêm 5-fluorouracil truyền/tiêm TM, ngảy
5-FU TM nhanh, 600 mg/ 1 Và 2› mỗi 2 tuần
m² TM 22 giờ
Placebo hoặc 5 mg/kg TM 30-90 Ngảy 1, trước khi dùng FOLFOX-4,
Avastin p mỗi 2 tuần
XELOX Oxaliplatin 130 mg/m2 TM 2 Oxaliplatin vảo ngảy 1, mỗi 3 tuần
hoặc giờ Capecitabine uống 2 lằn/ngảy trơng
XELOX+ Capecitabine 1000 mg/m2 uống 2 2 tuẫn (sau đó 1 tuần nghi thuốc)
Avastin lân/ngảy
Placebo hoặc 7,5 mglkg TM 30- Ngảy 1, trước khi dùng XELOX,
Avastin 90 p mỗi 3 tuần
S-Fluorouracil: Truyến TM nhanh ngay lập tức sau khi truyền leucovorin
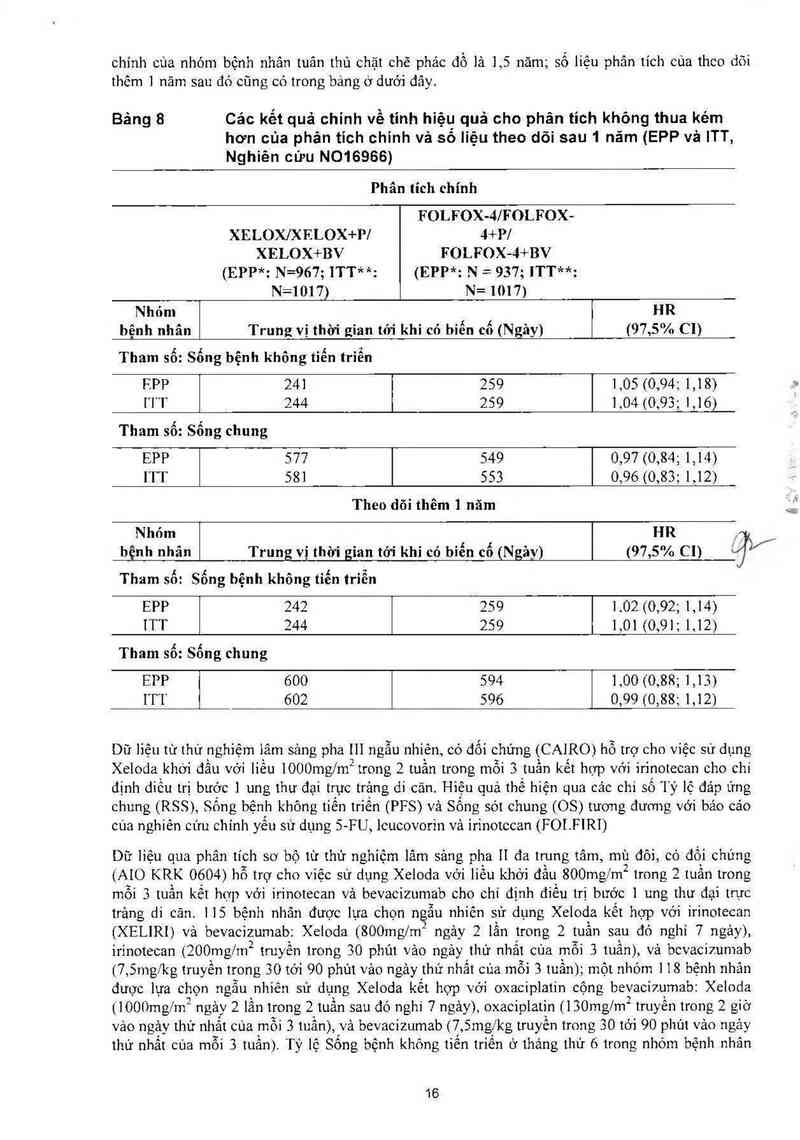
Sự không thua kém cùa nhóm có XELOX so với nhóm có FOLFOX— 4 trong sự so sánh chung được
chứng minh bằng chỉ số sống thêm bệnh không tiến triển (PFS) trong nhóm tuân thủ vừa phải phác
đồ điếu trị (EPP) và nhóm tuân thủ chặt chẽ phác đồ điếu trị (ITT) (xem bảng bên dưới). Kết quả
cho thấy phảc đồ XELOX tương đương với FOLFOX- 4 về sống sót chung Trong cảc phân tích có
tinh thăm dò vế so sảnh giữa XELOX+ BV với FOLFOX- 4 + BV Sự so sảnh ở các dưới. nhóm
điếu trị cho kết quả tương đương về PFS giữa nhóm XELOX +BV vả FOLFOX- 4 + BV (tỷ số nguy
cơ 1,01 [khoáng tin cậy 95% 0 ,84,1,.22]) Trung vị thời gian theo dõi tới thời điếm cùa phân tich
15
chính của nhóm bệnh nhân tuân thủ chặt chẽ phác đồ lả 1,5 năm; số liệu phân tích cùa theo đõi
thêm 1 năm sau đó củng có trong bảng ở dưới đây.
Bảng 8 Cảo kết quả chính về tinh hiện quả cho phân tich khõng thua kém
hơn của phán tích chính và sẽ liệu theo dõi sau 1 nãm (EPP vả ITT,
Nghiên cứu N016966)
Phân tích chính
FOLFOX-4/FOLFOX—
XELOX/XELOX+PI 4+Pl
XELOX+BV FOLFOX-4+BV
(EPP*: N=967; ITT**: (EPP*: N = 937; ITT**:
N=1017) N= 1017)
Nhỏm HR
bệnh nhân Trung vị thời gian tới khi có biến cố (Ngây) (97,5% CI)
Tham sổ: Sống bệnh không tiến triễn
RPP 241 259 1,05 (0,94; 1,18)
111 244 259 1,04 (0,93; 1,16)
Tham số: Sống chung
EPP S77 S49 0,97 (0,84; 1,14)
ITT 581 553 0,96 (0,83; 1,12)
Theo dõi thêm 1 năm
Nhom HR
bệnh nhân Trưng vị thời gian tới khi có bỉến cố (Ngảy) (97,5% CI) Jì/
Tham số: Sống bệnh không tiến triễn
EPP 242 259 1.02 (0,92; 1,14)
ITT 244 259 1,01 (0,91; 1,12)
Tham số: Sống chung
EPP 600 594 1,00 (0,88; 1,13)
ITT 602 596 0,99 (0,88; 1,12)
Dữ liệu từ thử nghiệm iâm sảng pha 111 ngẫu nhiến, có đối chứng (CAIRO) hỗ trợ cho việc sử dụng
Xeloda khới đầu với liếu lOOOmg/m2 trong 2 tuần trong mỏi 3 tuần kết hợp với irinotecan cho chỉ
định điếu trị bước ] ung thư đại trực trảng di cãn. Hiệu quả thể hiện qua các chí số lý lệ đảp ứng
chưng (RSS), Song bệnh không tiến triến (PFS) vả Sống sót chung (OS) tương đưm1g với bảo các
cùa nghiến cứu chính yếu sử dụng 5-F U leucovorin vả irinotecan (FOLF 1R1)
Dữ liệu qua phản tích sơ bộ từ thử nghiệm lâm sảng pha 11 đa trung tãm, mù đôi, có đối chúng
(AIO KRK 0604) hỗ trợ cho việc sử dụng Xeloda vởi liếu khởi đầu 800mgỉm2 trong 2 tuần trong
mỗi 3 tuần kết hợp với irinotecan vả bevacizumab cho chỉ định điếu trị bước ] ung thư đại trực
trảng di cãn 115 bệnh nhân được lựa chọn ngẫu nhiên sử dụng Xelođa kết hợp vởi irinotecan
(XELIRI) vả bevacizumab: Xeloda (800mg/m2 ngảy 2 lần trong 2 tuần sau đó nghỉ 7 ngảy),
irinotecan (200mg/m2 trưy ến trong 30 phút vảo ngảy thư nhắt của mỗi 3 tuần), vá bevacizumab
(7, 5mg/kg truyến trong 30 tới 90 phủt vảo ngảy thứ nhắt cùa mỗi 3 tuần); một nhóm 1 18 bệnh nhản
được lựa chọn ngân nhiên sử dụng Xeloda kết hợp với oxaciplatin cộng bevacizumab: Xeloda
(lOOOmg/m2 ngảy 2 lần trong 2 tuần sau đó nghỉ 7 ngảy), oxaciplatin (l30mglm2 truyền trong 2 giờ
vảo ngảy thứ nhất cùa môi 3 tưần), vả bevacizumab (7, 5mgxkg truyền trong 30 tới 90 phút vảo ngảy
thứ nhất cùa mỗi 3 tuần). Fỷ lệ Sống bệnh không tiến triên ở tháng thứ 6 trong nhóm bệnh nhân
16
tuân thủ chặt chẽ điếu trị là 80% (XELIRI cộng bevacizumab) so với 74% (XELOX cộng
bevacizumab).
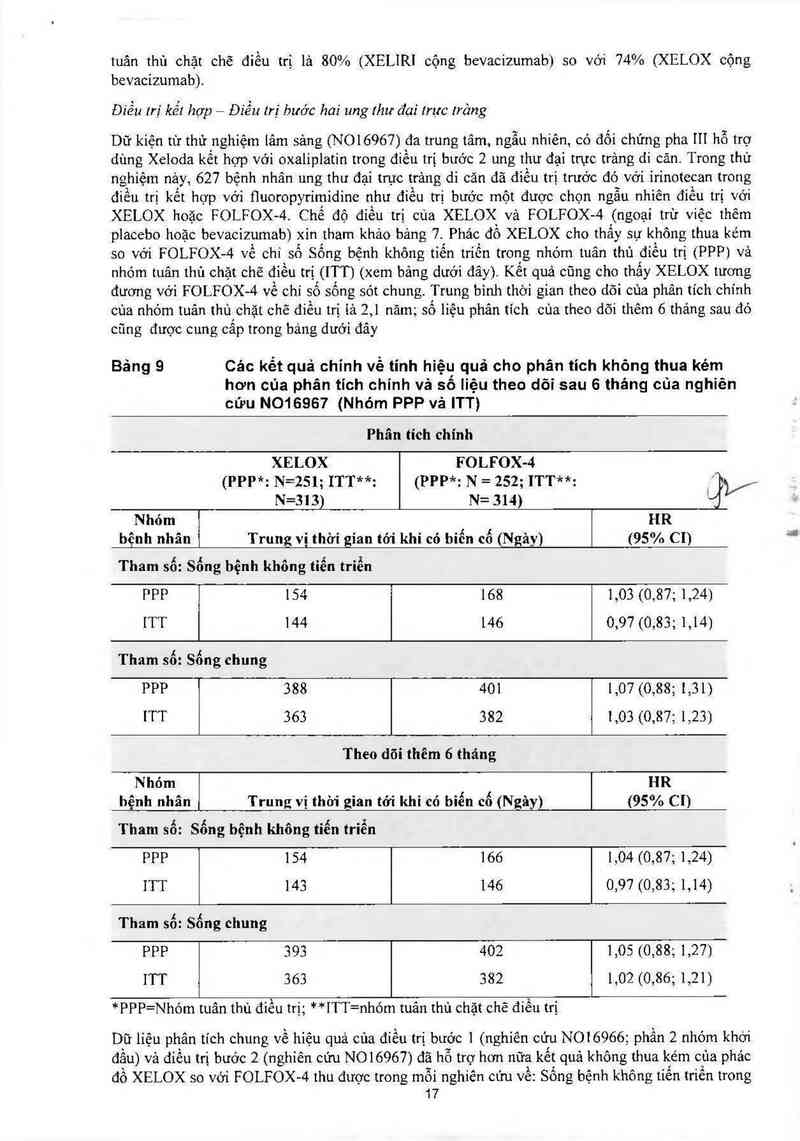
Điều trị kết hợp - Điểu trị bước hai ung thư đại lrực Jrâng
Dữ kiện từ thứ nghìệm lâm sáng (NOIG967) đa trung tâm, ngẫu nhiến, có đối chứng pha III hỗ trợ
dùng Xeloda kết hợp với oxaliplatin trong điếu trị bước 2 ung thư đại trực trảng di căn. Trong thử
nghiệm nảy, 627 bệnh nhân ung thư đại trục trảng di căn đã điếu trị trước đó vởí ỉrinotccan trong
điếu trị kết hợp vởi fluoropyrímidìne như điếu trị bước một được chọn ngẫu nhiên điếu trị với
XELOX hoặc FOLFOX-4. Chế độ đíếu trị của XELOX vả FOLFOX- 4 (ngoại trừ việc thêm
placebo hoặc bevacỉzumab) xin tham khảo bảng 7. Phác đổ XELOX cho thấy sự không thua kém
so với FOLFOX- 4 vé chí số Sống bệnh không tiến triến trong nhóm tuân thủ điếu trị (PPP) vả
nhớm tuân thủ chặt chẽ điếu trị (ITT) (xem bảng dưới đây). Kết quả cũng cho thấy XELOX tương
đương với FOLFOX-4 về chỉ số sống sót chung. Trung binh thời gian theo đõi của phân tích chính
cùa nhóm tuân thủ chặt chẽ điếu trị 1ả 2,1 năm; số liệu phân tích của theo dõi thếm 6 thảng sau đó
cũng được cung cấp trong báng dưới đây
Bảng 9 Các kết quả chinh về tỉnh hiệụ quả cho phân tỉch không thua kém
hớn của phân tích chính và sô liệu theo dõi sau 6 tháng của nghiên
cứu N016967 (Nhỏm PPP vả ITT)
Phân tich chính
XELOX FOLFOX-4
(PPP*: N=2Sl; ITT**: (PPP*: N = 252;1TT**: ' V”
N=313) N= 314) `
Nhóm HR
bệnh nhân Trung vị thời gian tới khi có biến cố (Ngảy) (95% CI)
Tham số: Sống bệnh không tiến triển
PPP 154 168 1,03 (0,87; 1,24)
ITT 144 146 0,97 (0,83; 1,14)
Tham số: Sống chung
PPP 388 401 1,07 (0,88; 1,31)
ITT 363 382 1,03 (0,87; 1,23)
Theo dõi thêm 6 tháng
Nhỏm HR
hệnh nhân Trung vị thời gian tởi khi có biến cố (Ngây) (95% cn
Tham số: Sống bệnh không tiến triến
PPP 154 166 1,04 (0,87; 1,24)
ITT 143 146 0,97 (0,83; 1,14)
Tham số: Sống chung
PPP 393 402 1,05 (0,88; 1,27)
ITT 363 382 1,02 (0,86; 1,21)
*PPP=NhÓm tuân thủ đìếu trị; **ITT=nhóm tuân thủ chặt chẽ điếu trị
Dữ 1iệu phân tích chung về hỉệu quá cùa điếu trị bước 1 (nghiên cửu N016966; phần 2 nhóm khởi
đằu) và điều trị bước 2 (nghiên cứu NOló9ó7) đã hỗ trợ hơn nữa kết quả không thua kém của phảc
đồ XELOX so với FOLFOX- 4 thu được trong mỗi nghiến cứu vế: Sống bệnh không tiến triền trong
17
nhóm bệnh nhân tuân thủ điếu trị (tỷ số nguy cơ 1,00 [khoảng tin cậy 95%: 0,88; 1,44]) với trung vị
thời gian sống bệnh không tiến triến là 193 ngảy (XELOX; 508 bệnh nhân) so vởi 204 ngảy
(FOLFOX- -;4 500 bệnh nhân). Kết quả cho thấy XELOX tương đương với FOLFOX- 4 về chi sỏ
sông sót chung (tỷ số nguy cơ 1 0,1 [khoảng tin cậy 95%:0,87;1,17]) với trung vị thời gian sống
sót chung là 468 ngảy (XELOX) so với 478 ngảy (FOLFOX- 4.)
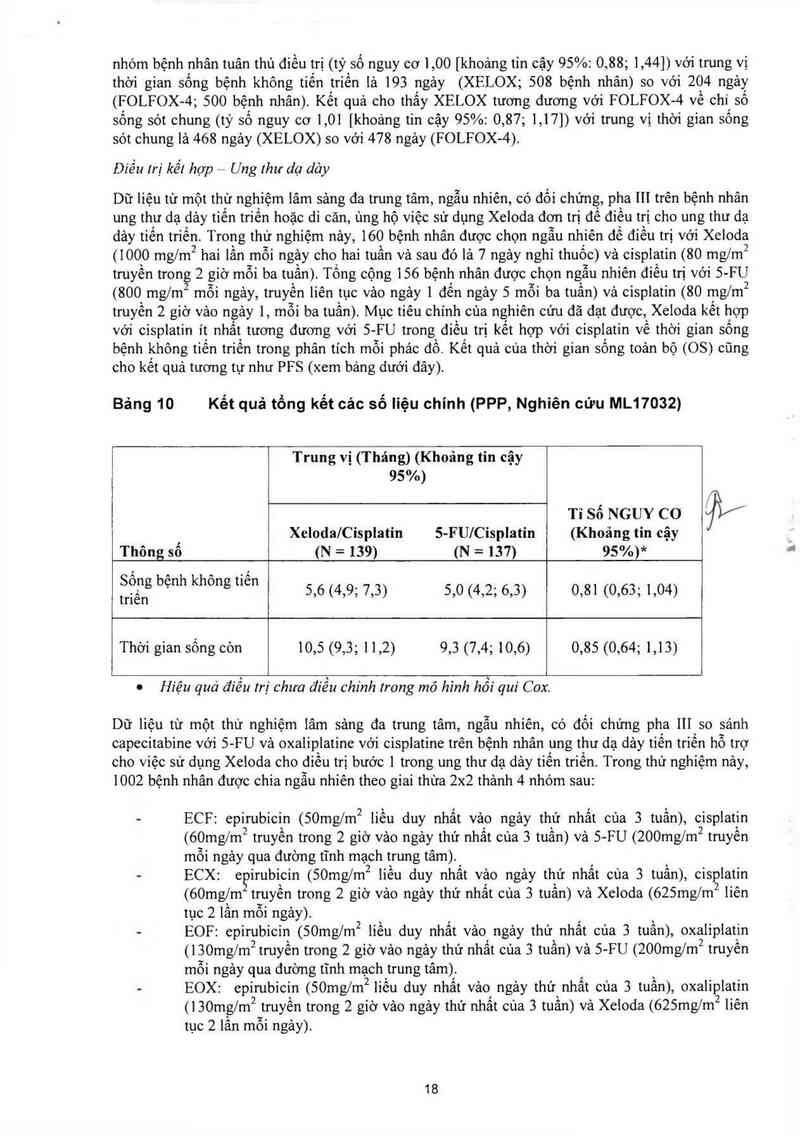
Điều lrị kế! hợp Ung Ihư dạ dảy
Dữ liệu từ một thử nghiệm lâm sảng đa trung tâm, ngẫu nhiến, có đối chứng, pha 111 trên bệnh nhân
ung thư dạ dảy tiến triển hoặc di cãn, ùng họ việc sử dụng Xeloda đơn trị để điếu trị cho ung thư dạ
dảy tiến triến. Trong thử nghiệm nảy, 160 bệnh nhân được chọn ngẫu nhiên đề điếu trị với Xeloda
( 1000 mglm2 hai lần mỗi ngảy cho hai tuần và sau đó lả 7 ngảy nghi thuốc) và cisplạtin (80 mg/m2
truyền trong 2 giờ mỗi ba tuần). Tống cộng 156 bệnh nhân được chọn ngẫu nhiến điều trị với 5- FU
(800 mg/m mỗi ngảy, truyền liên tục vảo ngảy 1 đến ngảy 5 mỗi ba tuần) vả cisplatin (80 mg/m2
truyền 2 giờ vảo ngảy 1, mỗi ba tuần). Mục tiêu chính của nghiên cứu đã đạt được, Xeloda kết hợp
với cisplatin ít nhất tương đương với 5- FU trong điều trị kết hợp với cisplatin về thời gian sông
bệnh không tiến triến trong phân tích mỗi phảc đồ. Kểt quả cùa thời gian sông toản bộ (OS) cũng
cho kết quả tương tự như PFS (xem bảng dưới dây).
Bảng 10 Kết quả tồng kết các số Iiệu chính (PPP, Nghiên cứu ML17032)
Trung vị (Tháng) (Khoảng tin cậy
95%)
Tỉ sá NGUY co Ji/
, Xeloda/Cispiatin 5-FU/Cisplatin (Khoảng tỉn cậy
Thông sô (N = 139) (N = 137) 95%)*
ỉỂẵỆ bẹnh khong t'e“ 5,6 (4,9; 7,3) 5,0 (4,2; 6,3) 0,81 (0,63; 1,04)
Thời gian sống còn 10,5 (9,3; 11,2) 9,3 (7,4; 10,6) 0,85 (0,64; 1,13)
0 Hiệu quả điều trị chưa đíều chinh trong mô hình hồi qui Cox.
Dữ liệu từ một thử nghiệm lâm sảng đa trung tâm, ngẫu nhiến, có đối chứng pha 111 so sánh
capecitabine với 5-FU vả oxaliplatine với cisplatine trên bệnh nhân ung thư dạ dảy tiến triển hỗ trợ
cho việc sử đụng Xeloda cho điếu trị bước 1 trong ung thư dạ dảy tiến triến. Trong thử nghiệm nảy,
1002 bệnh nhân được chia ngẫu nhiên theo giai thừa 2x2 thảnh 4 nhóm 88…
- ECF: epirubicin (50mg/m2 liếu duy nhất vảo ngảy thứ nhất cùa 3 tuần), cisplatin
(60mg/m² truyền trong 2 giờ vảo ngảy thứ nhất cùa 3 tuần) vả S-FU (200mg/m² truyền
môi ngảy qua đường tĩnh mạ2ch trung tâm)
- ECX: epirubicin (50mg/m2 liếu đuy nhất vảo ngảy thứ nhất của 3 tuần), cisplatin
(60mg/m truyền trong 2 giờ vảo ngảy thứ nhất cùa 3 tuần) và Xeloda (625mg/m2 liến
tục 2 1ằn môi ngảy)
— EOF: epirubicin (50mg/m2 iiếu duy nhất vảo ngảy thứ nhất của 3 tuần), oxaliplatin
(l30mg/m2 truyền trong 2 giờ vảo ngảy thứ nhất cùa 3 tuần) và 5- FU (200mg/m2 truyến
mỗi ngảy qua đường tĩnh mạch trung tâm).
- EOX: epizrubicin (50mg/m2 liếu duy nhất vảo ngảy thứ nhất của 3 tuấn), oxaliplatin
(1 3Omg/m2 truyền trong 2 giờ vảo ngảy thứ nhất cùa 3 tuần) và Xe1oda (625mg/m2 liến
tục 2 lần mỗi ngảy)
18
Phân tích hiệu quả chinh trong nhóm tuân thủ đỉếu trị đã chứng tỏ sự không thua kém về chỉ số
Sống sót chung giữa phảc đồ capecitabine vả 5-FU (tỷ số nguy cơ 0,86 khoảng tin cậy 95% từ 0,8
tới 0,99) và oxa1ipiatin so với phảc đổ dựa trên cisplatin (tỷ số nguy cơ 0,92, khoảng tin cậy 95% tư
0,8 tới 1,1 ). Trung vị thời gian Sống sót chung lả 10,9 thảng cùa nhóm phảc đồ dựa trên capecitabin
vả 9,6 tháng cùa nhóm phảc đồ dựa trên 5-FU. Trung vị thời gian sống sót chung là 10,0 thảng cùa
nhóm phác đồ dựa trên cisplatin và 10,4 thảng của nhóm phác đồ dựa trên oxaliplatin.
Xeloda cũng đã được sử dụng trong điếu trị kết hợp với oxaliplatin cho điếu trị ung thư dạ dảy tiến
triến. Nghiên cứu Xeloda đơn trị Iiệu cung cho thắy Xeloda có tảc dụng với ung thư dạ dảy tiến
triến.
Phân Iích tổng quải Ung lhư đai trưc lrảng. ung thư lrưc !rảng vả unfflhư da dảv liến lriến.
Phân tích tồng quát cùa sảu thử nghiệm lâm sảng ( nghiên cứu 8014795, 8014796. M66001, NO
16966, NO 16967, M17032) ủng họ cho sử dụng Xeloda thay thế 5- FU đơn trị - và phối hợp trong
điếu trị ung thư tiếu hoả. Phân tích chung bao gôm 3097 bệnh nhân điếu trị với phác đồ có Xeloda
và 3074 dùng phác đồ có 5- FU. Tỷ sô nguy cơ cùa sống sót chung là 0,96 (khoảng tin cậy 95%
0,90; 1,02) cho thấy phảc đồ có Xeloda tương đương với phác đồ sử dụng 5— FU.
Điều !rị kết hợp ~ Ung thư vú Jj/
Dữ liệu từ một thử nghiệm lâm sảng đa trung tâm, ngẫu nhiên, có đối chứng, pha 111 ùng họ việc sử
dụng Xeloda kết hợp với docetaxel đế điếu trị những bệnh nhân ung thư vú tiên triên tại chỗ hoặc
di cản sau khi thắt bại liệu pháp hoá trị độc tế bảo bao gồm anthracyclinc. Trong thử nghiệm nảy,
255 bệnh nhân được chọn ngẫu nhiên để diều trị với Xeloda ( lZSOmg/m2 hai lần mỗi ngảy trong
hai tuần sau đó lả một tuần nghi thuốc) và docetaxel (7Smg/m2 truyền trong 1 giờ mỗi ba tuần). 256
bệnh nhân được chọn ngẫu nhiên đề điếu trị với docetaxel đơn thuần ( ] OOmg/m2 truyền trong 1 giờ
mỗi ba tuần). Tỉ lệ sống cao hơn ở nhóm kết hợp Xeloda+docetaxei (p=0, 0126). Trung vị thời gian
sống là 442 ngảy (Xeloda+docetaxel) so với 352 ngảy (docetaxel đơn thuần) Tỉ lệ đảp ứng khách
quan chung trên tất cả sô người được chọn ngẫu nhiên (theo đảnh giả cùa nghiên cứu viến) là
41,6% (Xeloda+dơcetaxel) so với 29,7% (docetaxel đơn thuần); p= 0, 0058 Thời gian đến khi bệnh
tiến triến hoặc chết ưu thế hơn ở nhóm kết hợp Xeloda+docetaxel (p
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng