














_ _ _
Control Proof 1 New Proof 1 Corrections
Format 128 x 108 x 48 mm
Regnster Nr. 96.4.3433 om: ............................ Date: Date: ............................
NP 7757
01_05_2012 09:12:36 Visa: Visa: ............................ Visa: ............................
Grundschrlft 9 Punkt
OK for Printing Control File OK for Printing
Date: ............................ Date: ............................ Date: ............................
Visa: ............................ Vỉsa: ............................ Vỉsa: ............................
10138120 FE 101381²0 FE 101381²0 FE 101381²0 FE
FILM1 VON 4 FILM 2 VON 4 FILM 3 VON 4 FILM 4 VON 4
Pantone Black PMS 300 PMS 485 PMS 376
01.05.12 01.05.12 01.05.12 01.05.12
Made for F. Hoffmann-La Rơzhe Ltd
Bas_ei. Switzerland
đuc'tos Roche SA. de cv
'ỂárMỉxico
Ncịịoiic ãtiiitW …i\ ì`\
)«áođđẺ\\x\\\"__fÍz//z////
Capecutabme
CD 120 film-coated tablets
1 film-coated tabiet = 500 mg
Medicine: keep out of reach of children
capecitabine
Dosage and administration: see package
insert
Do not store above 30 °C
7ỊỊIỊIZSWI 014904
1 viên nén bao phim = 500 mg capecitabỉne
Hộp chứa 12 vĩ x 10 vièn
Dùng đườn uống.
Chỉ đinh. ch ng chỉ định. liều và cách dùng: xin xem trong từ hướng dãn sử dụng.
Khỏng bảo quản thuốc ở nhiệt độ irèn 30 °C.
THUỐC cui BÁN THEO ĐơN
oE XA TAM TAY CUA TRẺ EM
oọc KỸ HƯỚNG DẢN ` TRƯỞC KHI DÙNG
.
Ngèy swuấi hạ 9ỵjèÉggfl em phẩn MFD. EXP số lô trèn bao bì
Ngầy sản xửất vả ngây het hạn ả ngáy 01 của tháng.
Nha nhập khâu
i ặnịatưếèdi'ơ F Hotfmann- La Roche Ltd Basel. Thụy sỹ
1Prỏđủđtos Roche S. A de C v.
HIÃISWơJábQỈ; Nte. 1536-B. C P. 50030 Toluca. Mè-hi-cỏ
\®
ẫV/Lỡl'B'V'mFP UẸ'I
flC1 ẸIHd YG
31 A Ọa
,v
DQHGẶ1NYHÒDHJ
’ thịu
J.b
©
Slatqez paưowtu ou
SL100102
@
aumenaadeg
@ )7W
bEP°lax
- - \”TèvửmuJ
.'AtiPHGiiũiìhiiiiịiii ủ\\
r…ggiiiiti } _
'ỉs HÀ NỌI
oda®
Capecitabine
120 film-coated tablets
©
“L
WMW
IP
101381²0
FE 1111
7757
ẵ
ễ
e
PREẸRESS - INFORMATION PREPRESS - ROCHE BASEL CUSTOMER
\
” . Control Proof New Proof Correctỉons
136 mm brent, 1 Nutzen
Bllstergrosse 124 x 48 mm Date: ............................ Date: ............................ Date: ............................
Streudruck
16_06_2008 11:15:13 Visa: ............................ Vìsa: ............................ Visa: ............................
Pseudo-PM
Patext halbmanuell OK for Printing Control File OK for Printing
Grundschrlft 9 Punkt
Date: ............................ Date: ............................ Date: ............................
Visa: ............................ Visa ............................. Visa: ............................
i=iffl4iiiounNi Art-Nr, Code und Zeichnung >c
ùi Xeloda® ,— Xeloda® Xeloda® i`
Capecitabine <ỀE> Capecitabine Capecitabine
500 mg 500 mg 500 mg
,_ Xeloda® Xeloda® _
<ử> Capecitabine <ũoche> Capecitabine E
500 mg _ 500 mg —' ả
Xeloda® … Xeloda® … Xeloda® ổ
Capecitabine Ẹ
—' 500 mg '— 500 mg …
Xeloda® _ Xeloda® … Xeloda®
— Capecitabine ẨRL'hU) Capecitabine <Ễfflỳ Capecitabine _ = —
500 mg 500 mg 500 mg ởz— _A _
_ Xeloda® _ Xeloda® _,Ịá’ , " .s
Capecitabine Capecitabine › g
500 mg _ 500 mg , __ ;;
Xeloda® … Xeloda® f—\ Xeloda® ặ !
Capecitabine <ỀỀ) Capecitabine Capecitabine <ũtmhe) g
—' 500 mg 500 mg —" Ề
Xeloda® Xeloda® f-x Xeloda® O
Capecitabine RẺ² Capecitabine ẦWỘ Capecitabine u,
500 mg 500 mg 500 mg Ể
_ Xeloda® _ Xeloda® _ g
Capecitabine (MM) Capecitabine :
500 mg 500 mg %,ệ
Xeloda® … Xeloda® … Xeloda® 'ỉ'ì
Capecitabine <Ệ°E> Capecitabine <ủ) Capecitabine Ẹg
500 mg 500 mg 500 mg …
_ Xeloda® _ Xeloda® _
_ (mm) Capecitabine (ủeỳ Capecitabine -
—' 500 mg 500 mg
Xeloda® — Xeloda® — Xeloda®
Capecitabine (Êímj) Capecitabine Capecitabine Capecitabine g
500 mg 500 mg 500 mg ễ
_ Xeloda® _ Xeloda® _
Capecitabine Capecitabine
_l 500 mg 500 mg l_
Xeloda®
Capccitabine
1. MÔ TẢ
1.1 Nhóm dược lí IĐiều trị
Thuốc kìm tế bảo
1.2 Dạng trinh bảy
Viên 150mg vả 500mg
1.3 Đường dùng
Uống
1.4 Thảnh phần chinh
Hoạt chẳt chính: capecitabine
Tả dược: Capecitabine, Lactose (anhydrous), Croscarmellose sodium, Hypromellose ,
Microcrystalline cellulose, Magnesium stearate.
z. ĐẶC ĐIẺM LÃM SÀNG
2.1 Chỉ định điều trị
Ung thư vú
Xeloda phối hợp với docetaxel được chỉ định để điều trị những bệnh nhân ung thư vú tiến triển tại
chỗ hoặc di căn sau khi thất bại vởi hóa trị liệu độc tế bảo. Liệu pháp điều trị trước đây bao gồm
anthracycline. Xeloda cũng được chỉ định như đơn trị liệu cho điều trị những bệnh nhân ung thư
vú tiến triển tại chỗ hoặc di cãn sau khi thất bại vởi chế độ hóa trị bao gồm anthracycline vả taxane
hoặc cho những ung thư khác mả không có chỉ định dùng anthracyciine.
Ung thư đại trực trảng
Xeloda được chỉ định điều trị hỗ trợ cho những bệnh nhân ung thư đại trảng sau phẫu thuật.
Xeloda được chỉ định điều trị cho những bệnh nhân ung thư đại trực trảng di căn.
Ung thư dạ dảy
Xeloda phối hợp với hợp chất platin được chỉ định điều trị bước một cho nhũng bệnh nhân ung thư
dạ dảy tiên triên .
2.2 Liều lượng và Cảch sử dụng
Liêu chuẩn
Nên uống Xeloda với nước trong vòng 30 phủt sau khi ăn.
Đơn trị:
Ung thư đại trực Irảng vả ung thư vú
Liều đơn trị được khuzyến cáo của Xeloda lả 1250mg/m2 dùng hai lần mỗi ngảy (sáng và tối; tương
đương với 2500mgim2 tông liều mỗi ngảy) trong 14 ngảy sau đó lả 7 ngảy nghi thuốc.
Điều trị kế! họp:
Ung thư vú:
Trong trường hợp phối hợp vởì docetaxel, liều khởi đằu 1chuyến cáo của Xeloda lả 1250111g/m2 hai
lẳn mỗi ngảy trong hai tuần sau đó lả một tuần nghỉ phối hợp với docetaxel 7Smgi m2 truyền tĩnh
mạch trong vòng 1 giờ mỗi ba tuần
Theo hướng dẫn sử dụng của docetaxel, thuốc chuẩn bị nên bắt đầu trước khi dùng đocetaxel ở
nhũng bệnh nhân dùng Xeloda phỏi hợp với docetaxel. Ẹ
Ung thư dạ dảy vả ung lhư đại lrực trờng.
Trong trường hợp điều trị phối hợp, liều khuyến cảo của Xeloda là 800 tới 1000mg/m2 dùng hai
lần môi ngảy trong hai tuần sau đó 7 ngảy nghỉ thuốc, hoặc 625mg/m2 2 lần môi ngảy khi đíều trị
liên tục (xem phần 3 1. " Hỉệu quải Cảo nghiên cứu lâm sảng]. Các thuốc sinh phầm khi điều trị kết
hợp với Xeloda không lảm ảnh hưởng tới liếu khời đầu của Xeloda
Thuốc chuẩn bị trước để đám bảo đủ nước vả chống nôn phù hợp theo thông tin sản phẩm cisplatin
hoặc oxaliplatin nên dùng trước khi dùng cisplatin hoặc oxaliplatin cho những bệnh nhân điêu trị
kêt hợp Xeloda vởi cisplatin hoặc oxaliplatin.
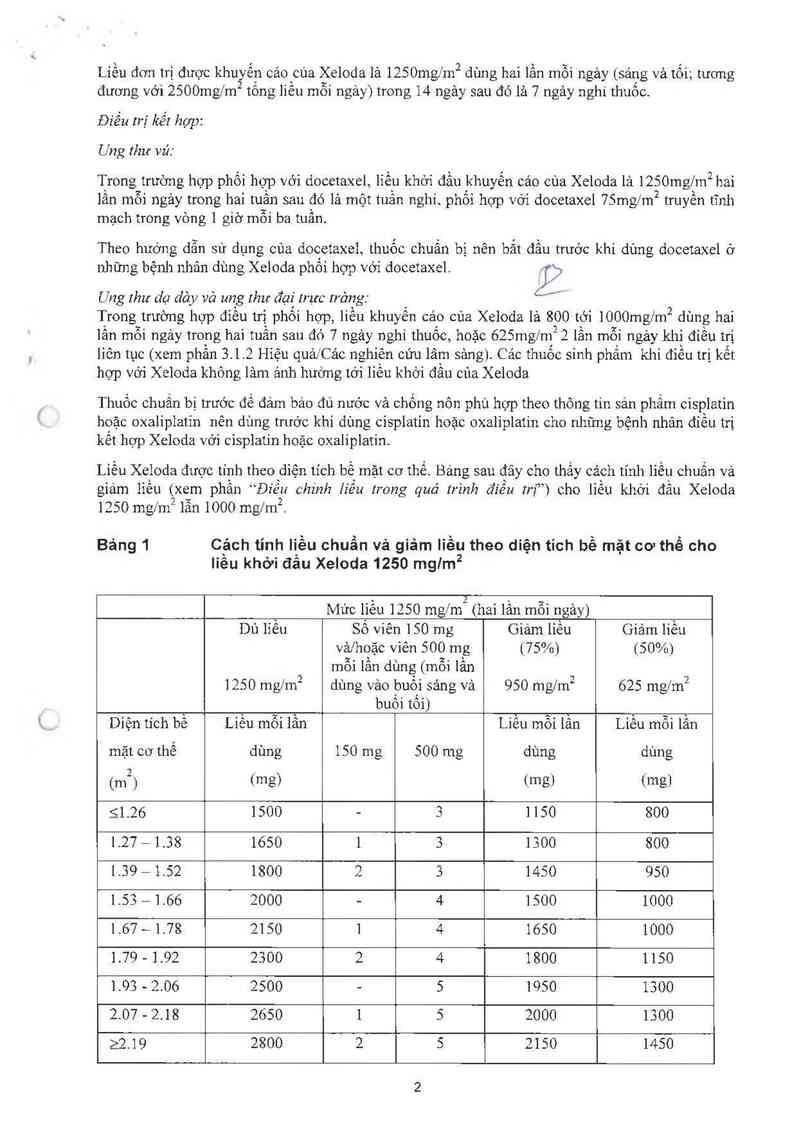
Liều Xcioda được tính theođiện tích bế mặt cơ thề. Bảng sau đây cho thấy cách tính lìềụ chuẩn và
giảm Iỉêu (xem phân `“Điéu chinh liêu trong quá trình điêu trị”ì cho lỉêu khởi đâu Xeloda
1250 mg/m² lẫn 1000 ngm².
Bảng 1 Cảch tỉnh Iiều chuẩn vả giảm liều theo diện tích bề mặt cơ thể cho
liều khởi đầu Xeloda 1250 mglm2
Mức liều 1250 mg/m2 (hai lần mỗi ngảy)
Dù liều Sô viên 150 mg Giảm liều Giảm liều
vả/hợặc viên 500 mg t75%1 (50%)
mỗi lân dùng (mỗi lân
1250 mg/m² dùng vảo buội sáng vả 950 mgfm² 625 ngm²
buôi tôi)
Diện tích bề Liều mỗi lần Liều mỗi lân Liều mỗi lần
mặt cơ thể dùng 150 mg 500 mg dùng dùng
(m2) (mg) tmg) (mg)
51.26 1500 - 3 1150 800
1.27 - 1.38 1650 1 3 1300 800
1.39 -1.52 1800 2 3 1450 950
1.53 - 1.66 2000 - 4 1500 1000
1.67 — 1.78 2150 1 4 1650 1000
1.79 - 1.92 2300 2 4 1800 1150
1.93 - 2.06 2500 - 5 1950 1300
2.07 - 2.18 2650 1 5 2000 1300
22.19 2800 2 5 2150 1450
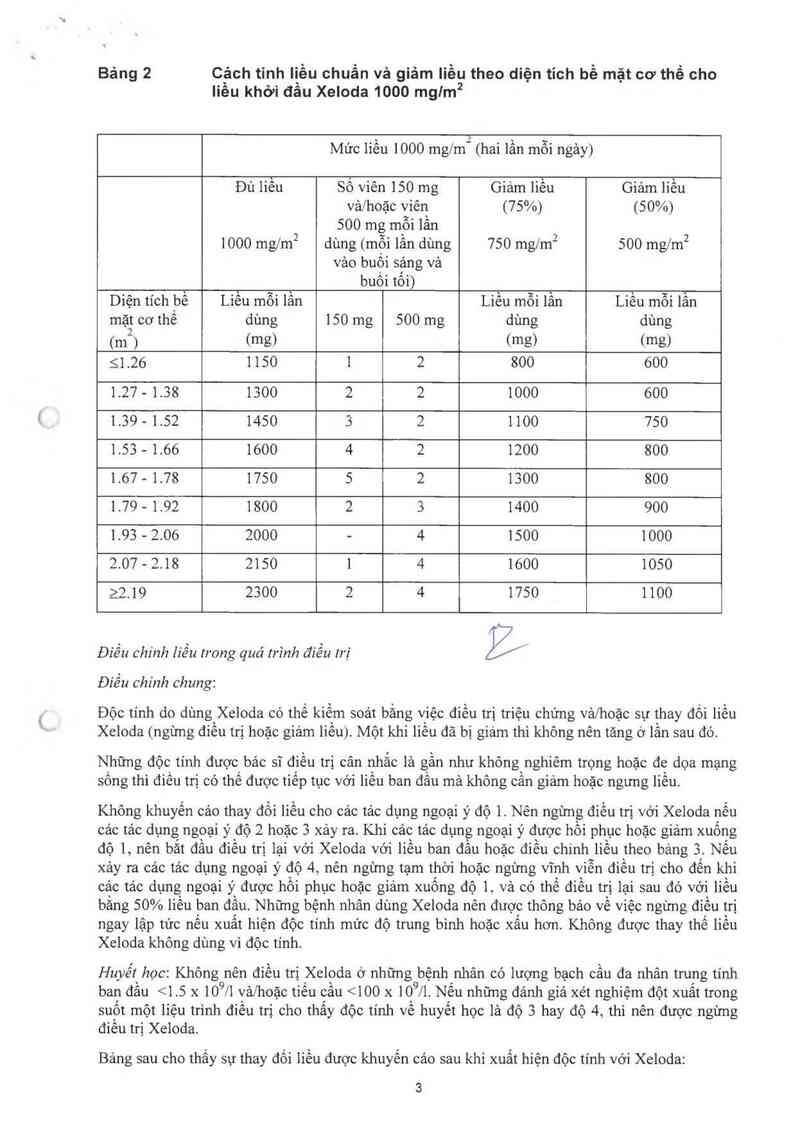
Báng 2 Cảch tỉnh liều chuẩn vả giảm liều theo diện tich bề mặt cơ thể cho
Iiều khởi đầu Xeloda 1000 mglm2
Mức iiều 1000 mg/mI (hai lần mỗi ngảy)
Đủ liều sô viên 150 mg Giảm liều Giảm liều
vả/hoặc viên` (75%) (50%)
500 mg mỗi lân
1000 ngm² dùng (mội lân dùng 750 mg/m² 500 mg/m²
vảo buội sậng vả
buôi tôi)
Diện tích bê Liêu mỗi lân Liều mỗi lần Liều mỗi lần
mặt cơ thê dùng 150 mg 500 mg dùng dùng
(nf) (mg) (mg) (mg)
51.26 1150 1 2 800 600
1.27 - 1.38 1300 2 2 1000 600
1.39 - 152 1450 5 2 1100 750
1.53 - 1.66 1600 4 2 1200 800
1.67 - 1.78 1750 5 2 1300 800
1.79 — 1.92 1800 2 3 1400 900
1.93 - 2.06 2000 … 4 1500 1000
2.07—2.18 2150 1 4 1600 1050
22.19 2300 2 4 1750 1100
Điều chỉnh Iiều trong quá rrình điểu trị ếZ
Đíều chinh chung:
Độc tính do dùng Xeloda có thể kiếm soát bằng việc điều trị triệu chứng vả/hoặc sự thay đối liều
Xeloda (ngừng điếu trị hoặc giảm liều) Một khi liều đã bị giảm thì không nên tăng ở lằn sau đó.
Những độc tính được bảc sĩ điều trị cân nhắc là gần như không nghiêm trọng hoặc đe dọa mạng
sông thì điếu trị có thế được tiếp tục với liều ban đằu mã không cần giảm hoặc ngưng liều.
Không khuyến cáo thay đổi liều cho cảc tảc dụng ngoại ý độ 1. Nên ngừng điều trị với Xeloda nếu
cảc tảc dụng ngoại ỷ độ 2 hoặc 3 xảy ra. Khi cảc tác dụng ngoại ý được hồi phục hoặc giảm xuống
độ 1, nên bắt đầu điếu trị lại với Xeloda với liều ban đằu hoặc điếu chinh liều theo bảng“ J Nếu
xảy ra cảc tảc dụng ngoại ý độ 4, nên ngừng tạm thời hoặc ngừng vĩnh viễn điều trị cho đến khi
các tảc dụng ngoại ý được hồi phục hoặc giảm xuống độ 1, và có thể điều trị lại sau đó với liếu
bằng 50% liều ban đầu. Những bệnh nhân dùng Xeloda nên được thông báo về việc ngừng điều trị
ngay lập tức nểu xuất hiện độc tính mức độ trung bình hoặc xấu hơn. Không được thay thế liếu
Xeloda không dùng vì độc tính.
Huyết học: Không nên điều trị Xeloda ở những bệnh nhân có lượng bạch cầu đa nhân trung tính
ban đầu <1 5 x 109/1 vả/hoặc tỉếu cầu <100 x 109/1 Nếu những đánh giá xét nghiệm đột xuât trong
suốt một liệu trình điều trị cho thấy độc tính về huyết học là độ“ 5 hay độ 4, thì nên được ngừng
điều trị Xeloda.
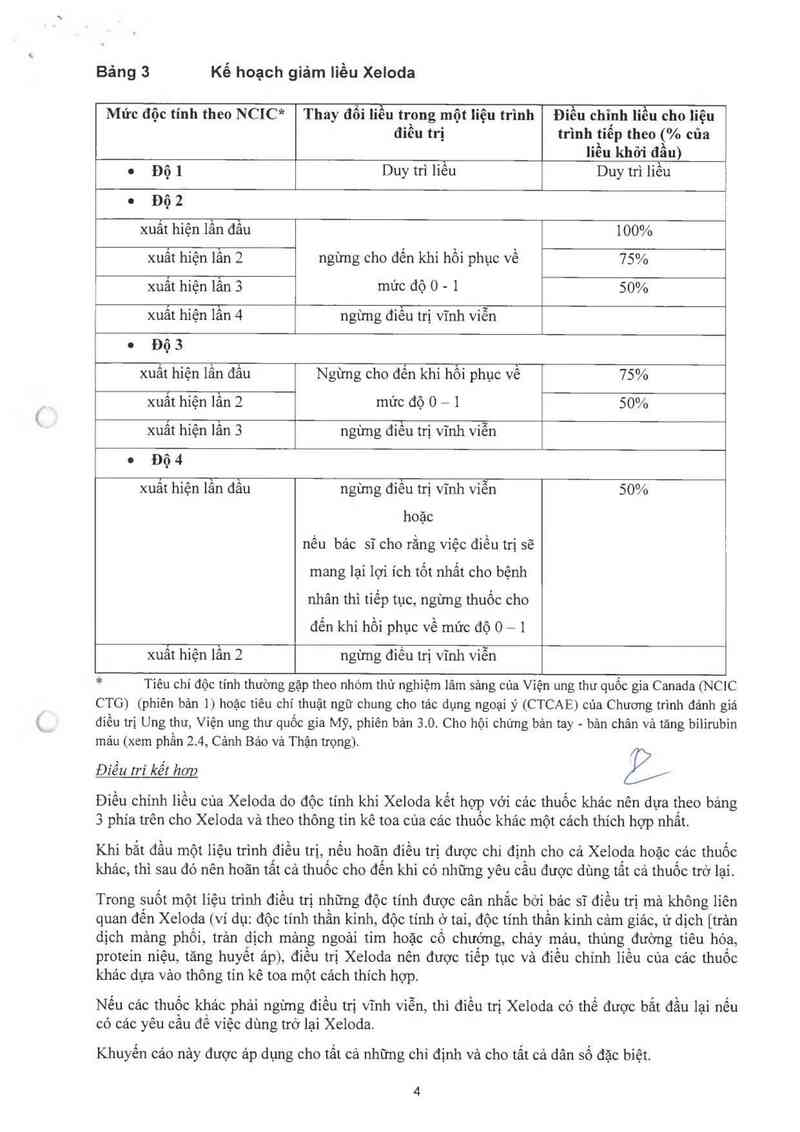
Bảng sau cho thấy sự thay đồi iiều được khuyến cảo sau khi xuất hiện độc tính với Xeloda:
3
Bảng 3 Kế hoạch giảm liều Xeloda
Mức độc tính theo NCIC* Thay đổi liễu trong một Iiệu trình Điều chinh liều cho liệu
điều trị trình tiếp theo (% của
` Iiều khỏi đầu)
o Độ 1 Duy trì liêu Duy trì liêu
o Độ 2
xuất hiện lần đầu 1000/o
xuất hiện lẫn 2 ngừng cho đến khi hồi phục về 75%
xuất hiện lần 3 mức độ 0 - 1 50%
xuất hiện lẩn 4 ngừng điểu trị vĩnh viễn
0 Độ 3
xuất hiện lẩn đầu Ngừng cho đển khi hồi phục về 75%
xuất hiện lần 2 mức độ 0 - 1 50%
xuất hiện lẫn 3 ngừng điếu trị vĩnh viễn
0 Độ 4
xuất hiện lần đầu ngừng điều trị vĩnh viễn 50%
hoặc
nếu bảo sĩ cho rằng víệc điếu trị sẽ
mang lại lợi ích tốt nhất cho bệnh
nhân thì tiếp tục, ngừng thuốc cho
đến khi hồi phục về mức độ 0 - 1
xuất hiện lần 2 ngừng điếu trị vĩnh viễn
* Tiêu chí độc tính thường gập theo nhóm thử nghiệm lâm sảng cùa Viện ung thư quốc gia Canada (NCIC
CTG) (phiên bản 1) hoặc tiêu chí thuật ngữ chung cho tác dụng ngoại ý (CTCAE) của Chương trinh đánh giá
điều trị Ung thư, Viện ung thư quốc gia Mỹ, phiên bản 3.0. Cho hội chứng bản tay - bản chân và tảng bỉlirubin
mảu (xem phần 2.4, Cảnh Bảo vả Thận trọng).
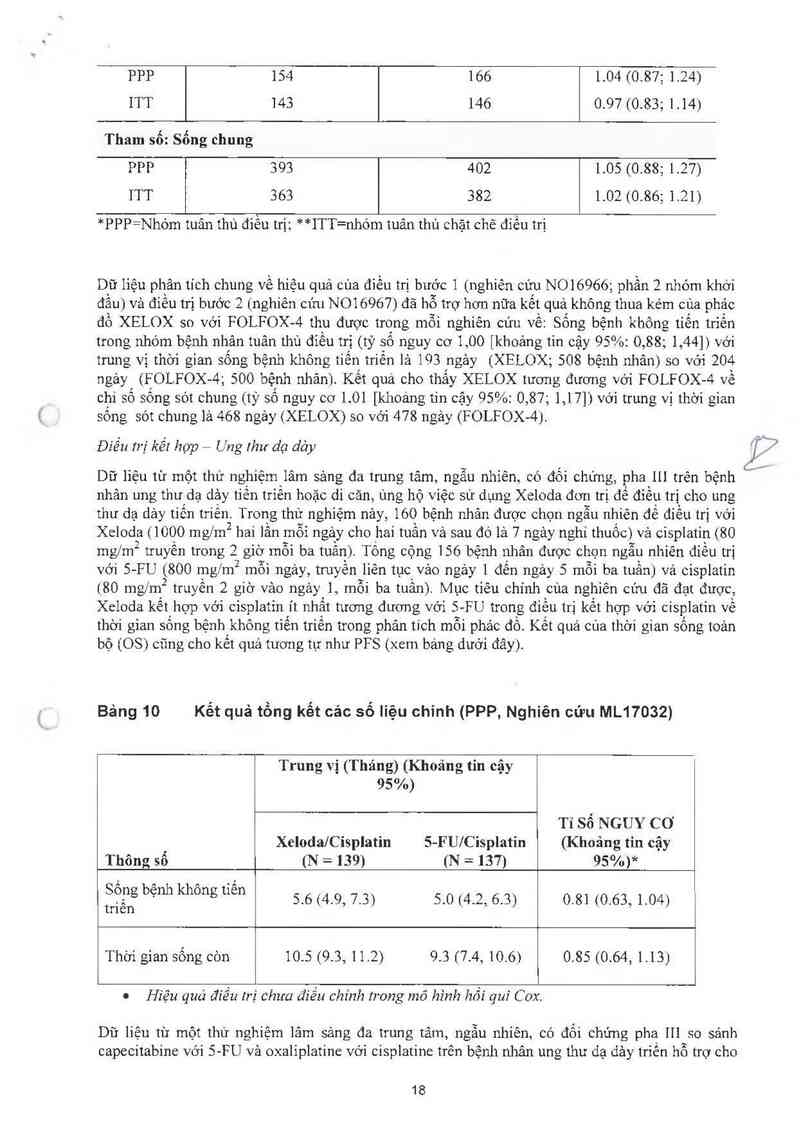
Điều tri kết hgp g
Điếu chinh liều cùa Xeloda do độc tinh khi Xeloda kết hợp với cảc thuốc khác nến dựa theo bảng
3 phía trên cho Xeloda vả theo thông tin kê toa cùa các thuốc khảc một cảch thích hợp nhất.
Khi bắt đầu một iiệu trinh điếu trị, nếu hoãn điều trị được chỉ định cho cả Xeloda hoặc cảc thuốc
khác, thì sau đó nên hoãn tât cả thuôo cho đên khi có những yêu câu được dùng tât cả thuôo trở lại.
Trong suốt một iiệu trình điếu trị những độc tính được cân nhắc bới bảo sĩ điếu trị mà không liên
quan đến Xeloda ( v1 dụ: độc tinh thần kinh, độc tính 0 tai, độc tính thần kinh cảm giảc, ứ dịch [trản
dịch mảng phồi, trản dịch mảng ngoải tim hoặc cố chướng, chảy mảu, thùng đường tiêu hóa,
protein niệu tãng huyết ảp), điếu trị Xeloda nên được tiếp tục vả điều chinh liếu của cảc thuốc
khác dựa vảo thông tin kê toa một cách thích hợp.
Nếu cảc thuốc khảc phải ngừng điều trị vĩnh viễn, thì điều trị Xeloda có thế được bắt đầu lại nếu
có cảc yêu cầu để việc dùng trở lại Xeloda
Khuyển cáo nảy được ảp dụng cho tất cả những chỉ định và cho tất cả dân số đặc biệt.
4
Các hướng dẫn liều dùng đặc biệt
Bệnh nhán bị suy gan do di căn gan
Những bệnh nhân bị suy gan nhẹ tới trung binh do di căn gan, không cần phải điếu chinh liều khời
đầu. Tuy nhiên, nên theo dõi những bệnh nhân nảy tnệt cách cần thận (xem phần 3.2.5 Dược động
học trong dân số đặc biệt và phần 2.4, Cảnh báo và Thận trọng). Những bệnh nhân bị suy gan nặng
chưa được nghiên cứu.
Bệnh nhân bị suy thận
Trên những bệnh nhân bị suy thận trung bình (độ thanh thải creatinine 30-50 ml/phút [theo
Cockroft vả Gault]), tại thời điếm bắt đầu điều trị, người ta khuyến cáo nên giảm còn 75% liều ban
đầu. Trên những bệnh nhân suy thận nhẹ (độ thanh thải creatinine là 51-80 ml/phút) không cần
điếu chinh liếu ban đằu.
Nên theo dõi cấn thận và ngừng điếu trị ngay lập tức nếu bệnh nhân có cảc tác dụng ngoại ỷ độ 2,
3, hoặc 4 và sau đó điều chinh liều như đã chỉ dẫn ở bảng 3 trên (xem 3.2.5, phần dược động học ở
dân số đặc biệt). Nên tạm ngừng điều trị Xeloda, nếu độ thanh thải creatinin giảm dưới 30 ml/phút.
Điều chính liều cho những bệnh nhân bị suy thận mức độ trung binh ảp dụng cho cả việc điều trị
đơn thuần và kết hợp. Đề tính toản liều lượng, xem bảng 1 và 2.
Trẻ em Ểỹ/
Tính an toản và hiệu quả của Xeloda ở trẻ em chưa được thảnh lập.
Người giả
- Không cần điều chỉnh liếu khời đần khiđiều trị Xeloda đơn ltrị. Tuy nhiên cảc tác dụng
ngoại ỷ nghiêm trọng có liên quan đên điêu trị độ 3 hoặc 4 xuât hiện thường xuyên hơn ở
nhũng bệnh nhân trên 80 tuôi so với những bệnh nhân trẻ hơn.
Khi điều trị xcioda kết hợp với cảc thuốc khác, bệnh nhân lớn tuồi a 65 tuổi từng trải qua những
tác dụng thuôc ngoại ý (ADRS) độ 3 và độ 4 nhiêu hơn những bệnh nhân trẻ tuôi, ADRs sẽ dẫn
đên ngừng tạm thời điếu trị. Nên theo dõi cân thận những bệnh nhân lớn tuôi.
- Khi điếu trị Xeloda kết hợp với docetaxel, tỉ lệ cảc tảc dụng ngoại ý có liên quan đến điếu
trị độ 3 hoặc 4 và các tảc dụng ngoại y' nghiêm trọng tăng được ghi nhậnớ những bệnh
nhân trên 60 tuôi hoặc hơn. Với những bệnh nhân 60 tuôi hoặc hơn được điêu trị phôi hợp
Xeloda với docetaxei, nên giảm liêu khời đâu xuông còn 75% (950mg/m2 hai lân môi
ngảy). Đê tính toán liêu lượng, xem bảng 2.
- voi những bệnh nhận 65 tuối hoặc hơn được điều trị phối hợp Xeloda với irinotecan, nên
giảm iêu khới đâu xuông còn 800mg/m2 hai lân môi ngảy.
2.3 Chống chỉ định
Xcloda dược chống chỉ định tlrên những bệnh nhân được biết là quá mẫn vởi capecitabine hoặc với
bât kỳ thảnh phân nảo cùa thuôo.
Xeloda được chống chỉ định trên những bệnh nhân có tiến sử các phản ứng nghiêm trọng và không
dự đoản trước với fluoropyrimidine hoặc được biêt là quả mân với fluorouracíl.
Cũng như các fluoropyrimidine, Xeloda được chống chỉ định trên những bệnh nhân được biết là có
thiêu hụt DPD (đihydropyrimidine dehydrogenase).
Không nên dùng Xeloda cùng vởi sorivudine hoặc cảc chất tương tự có liên quan về mặt hóa học,
như lá brivudine (xem phản 2.4.1 Tương tác với cảc thuôc khảc).
Xeloda được chống chỉ định trên những bệnh nhân bị suy gan nặng (Child Pugh C )
5
Xeloda được chống chỉ định trên những bệnh nhân bị suy thận nặng (độ thanh thải creatinine giám
dưới 30 mllphủt).
Nếu có chống chỉ định của bất kì thuốc nảo trong điều trị kết hợp, thì không dùng thuốc đó.
2.4 Cảnh báo và Thận trọng
Cảnh báo
T zeu chảy: Xeloda có thể gây tiêu chảy, dôi khi nặng. Bệnh nhân bị tiêu chảy nặng nên được theo
dõi cân thận vả nếu bị mất nước, nên bù nước và đỉện giải Nên bắt đầu điều trị tiêu chảy chuẩn (ví
dụ loperamide), bằng các thuốc thích hợp cảng sớm cảng tốt. Giảm liều nên được ảp dụng khi cân
thiết (xem phần 2.2, Liều lượng và Cảch dùng).
Mẩt nước: Mất nước nên được ngăn chặn hoặc điều chinh đúng lúc. Những bệnh nhân chán ăn,
suy nhược, buồn nôn, nôn hoặc tiêu chảy có thể mất nước một cảch nhanh chóng Nếu mất nước
độ 2 (hoặc cao hơn) xuất hiện, nên ngừng điều trị Xeloda ngay lập tức vả mất nước được hiệu
chinh. Không nên điều trị lại cho đến khi bệnh nhân vẫn còn mất nước và bất kì nguyên nhân sớm
nảo gây ra phải được hiệu chỉnh hoặc kiểm soát. Nên điều chinh liều cho những tác dụng ngoại ý
đến sớm khi cằn thiết (xem phần 2.2, Liều lượng vả Cảch dùng). g
Thận trọng
Độc tính trên tim mạch ghi nhận được ở Xeloda cũng tương tự độc tính ghi nhận được ở cảc
fluorinated pyrimidine khác. Những độc tính nảy bao gồm nhồi mảu cơ tim, đau thắt ngực, rối loạn
nhịp tim, ngừng tim, suy tim vả thay đổi về điện tâm đồ. Những tác dụng ngoại ý nảy thường gặp
hơn ở những bệnh nhân có tiền sử bệnh mạch vảnh.
Hiếm, không mong đợi, các tác dụng ngoại ý nghiêm trọng (ví dụ như Viêm miệng, tiêu chảy,
giảm bạch cầu trung tính vả độc tính về thần kinh) kết hợp với sự thiếu hụt hoạt tính cùa
dihydropyrimidine dehydrogenase (DPD) được cho là do 5-FU. Do vậy không thể loại trữ có sự
liên kết giũa việc giảm hảm lượng DPD và tăng tác động độc cùa 5-FU gây tảc hại một cảch tiềm
an.
Xeloda có thể gây ra hội chứng bản tay - bản chân (rối loạn cảm giảc đò da lòng bản tay-bản chân
hoặc gây ban đó đầu chỉ do hóa trị liệu) 01 độc tính da. voi những bệnh nhân bị di căn đang điều
trị Xeloda đơn thuần, trung vị thời gian để xuất hiện độc tính lả 79 ngảy (trong khoảng 11 đến 360
ngảy), mức độ từ độ 1 đến 3. Hội chứng bản tay - bản chân độ 1 được xác định bời tê, rổi loạn cám
giác/dị cám, kiến bò, hoặc ban đỏ ở tay vả/hoặc chân vả/hoặc không cảm thấy thoải mải nhưng
không ảnh hướng đến cảc hoạt động bình thường. Độ 2 được xác định lả ban đỏ vả sưng tay
vả/hoặc chân gây đau vả/hoặc không thoải mải ảnh hướng đến các hoạt động cùa cuộc sống hảng
ngảy cúa bệnh nhân. Độ 3 được xác định lả sự tróc vảy da, loét, mụn nước hoặc đau nhiếu ở tay
vả/hoậc chân vả/hoặc rất khó chịu khiến bệnh nhân không thế lảm việc hoặc thực hiện cảc hoạt
động thông thường hảng ngảy. Nếu xảy ra hội chứng bản tay— bản chân độ 2 hoặc 3, nến ngừng
dùng Xeloda cho đến khi cảc trường hợp hồi phục hoặc giảm xuống độ 1 Sau khi xuất hiện hội
chứng bản tay- bản chân độ 5, nên giảm liếu tiêp theo của Xeloda (xem phần 2. 2 Liều lượng và
Cảch sử dụng) Khi sử dụng kết hợp Xeloda vả cisplatin, sử dụng vitamin Bó (pyridoxine) không
được khuyến khích cho triệu chứng hoặc điều trị dự phòng thứ phát của hội chứng bản tay — bản
chân, bời vì cảc bảo cảo đã công bố có thế lảm giảm hiệu quả cùa cisplatin.
Xeloda có thể gây tăng bilirubin mảu. Nên ngừng đùng Xeloda nếu bilirubin tăng > 3.0 x ULN
(trên giới hạn binh thường) có liên quan đến điều trị hoặc mcn gan aminotransfcrase (ALT, AST)
tăng › 2.5 x ULN có liên quan đến điều trị. co thể bắt đầu điều trị lại khi bilirubin giảm xuống 5
3.0 x ULN hoặc aminotransferase gan giảm xuống 5 2.5 x ULN.
Trong một nghiên cứu tương tảc thuốc với_warfarin liều dơn, ẠUC trung bình cùa S—warfarin tăng
nhiêu (+57%). Những kêt quả nảy cho thây sự tương tảc thuôo có thế do capecitabine ức chếhệ
thông isoenzyme cytochrome P450 2C9. Những bệnh nhân dùng Xeloda kêt hợp với thuôc chông
6
đông dạng uống dẫn xuất của coumarin phải được theo dõi cắn thận về hiệu quả chống đông cùa
thuốc (INR hoặc thời gian prothrombin) vả điếu chỉnh liếu thuốc chống đông cho phù hợp (xem
phần Tương tảo thuốc với các thuốc khác vả cảc hình thức tương tác).
2.4.1 Cảnh báo chung
Bệnh nhân được điều trị bằng Xeloda nên được theo dõi cấn thận vế độc tính. Phần lớn cảc tác
dụng ngoại ý có thể hồi phục và không yêu cầu phải ngừng thuốc vĩnh viễn, mặc dù vẫn cần phải
ngừng thuốc hoặc giảm liếu (xem phần 2. 2 Liều lượng vả Cảch sử dụng).
2.4.2 Tương tảo với các thuốc nội khoa khác và các hỉnh thức tương tác khác
Thuốc chống đông máu C oumarin
Đã ghi nhận các thông số đông máu thay đổi vả/hoặc chảy máu ở những bệnh nhân dùng Xeloda
cùng với cảc thuốc chống đông dẫn xuất coumarin như warfarin vả phenprocoumon. Những tảc
dụng phụ nảy xảy ra trong vải ngảy và kéo dải tới vải thảng sau khi điếu trị Xeloda vả, trong một
số it trường hợp, trong một tháng sau khi ngừng Xeloda. Trong một nghiên cứu tương tác lâm
sảng, sau khi dùng warfarin liều đơn 20mg, việc điếu trị Xeloda lảm tăng AUC cùa S-warfarin
khoảng 57% và giá trị INR tãng 91%. Những bệnh nhân dùng cảc thuốc chống đông dẫn xuất của
coumarin cùng với Xeloda nên được theo dõi cẩn thận về những thay đối cảc thông số đông máu
cùa họ (PT hoặc INR) và phải điều chinh liều thuốc chống đông cho phù hợp.
Cơ chất của Cytochrome P-450 2C 9 Z
Không có cảc nghiên cứu tương tác thuốc với thuốc chính thức được tiến hảnh với capecitabine vả
cảc thuôc khảc được biêt là chuyên hóa bời isoenzyme cytochrome P450 2C9. Nên theo dõi cân
thận khi Xeloda dùng cùng với những thuôc nảy.
Phenytoin
Nồng độ huyết tương cùa phenytoin tăng được ghi nhận trong khi dùng Xeloda cùng với
phenytoin. Chưa có nghiên cứu tương tảc thuốc với thuốc chinh thức nảo dược tiến hảnh với
phenytoin, nhưng cơ chế tương tác thuốc được cho lả capecitabine ức chế hệ thống isoenzyme
C YP2C 9 (xem phần cảc thuốc chống đông Coumarin). Những bệnh nhân dùng phenytoin cùng với
Xeloda nên được theo dõi cấn thận vì nồng độ huyết tương của phenytoin tăng.
Tương tác thuốc-thức ăn
Trong tất cả cảc thử nghiệm lâm sảng, bệnh nhân được hưởng dẫn uống Xeloda trong vòng 30
phút sau khi ăn. Vì dữ liệu hiện nay vê tính an toản và hiệu quả dựa trên việc dùng cùng với thức
ăn, nên sử dụng Xeloda cùng với thức ăn.
Thuốc kháng acid
Tảc động của hydroxide nhôm vả thuốc khảng acid có chứa magnesium hydroxide lên dược động
học cùa capecitabine đã được nghiên cứu trên những bệnh nhân ung thư. Nổng độ huyết tương cùa
capecitabine và một chất chuyền hóa (5’DFCR) tăng ít; không thấy tác động lên ba chất chuyến
hóa chính (S’DFUR, 5—FU vả FBAL).
Leucovorin (folinic acid)
Tảc động của leucovorin lên dược động học của capecitabine đã được nghiên cứu trên những bệnh
nhân ung thư. Leucovorin không tảc động lên dược động học cùa capecitabine và các chất chuyền
hóa cùa nó. Tuy nhiên, leucovorin có tảo động lên dược lực học cùa Xeloda vả leucovorin có thề
lảm tăng độc tính cùa Xeloda.
Sorỉvudine vả các thuôo lương tự
Tương tác thuốc-thuốc có ý nghĩa lâm sảng giữa sorivudine vả 5-FU, do sorivudine ức chế
dihydropyrimidine dehydrogenase, đã được mô tả trong y vản. Tương tảc nảy, dân tới tăng độc
7
tinh của dihydropyrimidine dehydrogenase, có thế nguy hiếm đến tính mạng Vì vậy, không nên
dùng Xeloda với sorivudine hoặc cảc thuốc tương tự có liên quan về mặt hóa học, như brivudine
(xem phần 2 3 Chống chỉ định). Cần đợi ít nhất 4 tuần sau khi kết thúc điều trị với sorivudine hoặc
cảc thuốc tương tự cao liên quan về mặt hoá học như brivudine truớc khi bắt đầu trị liệu với
Xeloda.
Oxaliplatin
Không có khảo biệt có ý nghĩa lâm sảng khi tiếp xúc với capecitabine hoặc cảc chất chuyền hóa,
platinum tự do hoặc platinum toản phần xuất hiện khi capecitabìne vả oxaliplatin được dùng trong
điếu trị kết hợp, có hoặc không có bevacizumab.
Bevacízumab
Không có tảo động có ý nghĩa lâm sảng cua bevacizumab lên cảc thông số dược động học cùa
capecitabine hoặc các chất chuyền hóa của nó.
2.5 Sử dụng ở đối tượng đặc biệt Ê
2.5.1 Phụ nữ có thai
Ánh hưởng tới phụ nữ có thai mửc độ D
Không có nghiên cứu nảo trên phụ nữ có thai dùng Xeloda; tuy nhiên, dựa vảo các đặc tinh dược
học vả độc tính, có thể thấy rằng Xeloda có thể gây hại cho thai nếu được dùng cho phụ nữ có thai.
Trong cảc nghiên cứu độc tính sinh sản trên động vật, dùng capecitabine gây chết phôi và quái
thai. Những bằng chứng nảy có thể xảy ra ở những dẫn xuất cùa fiuoropyrimidine. Capecitabine
được cho rằng có khả năng gây quải thai ở người Không nên dùng Xeloda trong khi mang thai.
Nếu dùng Xeloda trong khi mang thai hoặc nêu bệnh nhân có thai trong khi dùng thuốc nảy, phải
thông bảo cho bệnh nhân biết nguy cơ tiềm ẩm cho thai. Nên khuyên những phụ nữ trong độ tuôi
sinh đẻ tránh mang thai trong khi điều trị với Xeloda.
2. 5. 2 Phụ nữ cho con bú
Không biết liệu thuốc được bải tiết qua sữa mẹ hay không Trong một nghiên cứu cho chuột đang
cho con bú uống Xeloda liếu đơn, một lượng đảng kế cảc chẳt chuyền hóa của capecitabine được
bải tiết trong sữa. Nên ngừng cho con bú trong quá trình điều trị Xeloda.
2.5.3 Người giả
Trong số những bệnh nhân ung thư đại trực trảng tuối từ 60 - 79 nhận điều trị Xeloda đơn thuần
cho di căn xa, xuất độ độc tính đường tiêu hóa tương tự trong dân số chung. Những bệnh nhân 80
tuồi hoặc hơn, có ti lệ lớn hơn những tảc dụng ngoại ý đường tiêu hóa độ 3, độ 4, như tiêu chảy,
buồn nôn vả nôn ói (xem phần 2.2.1, Hướng dẫn líều dùng đặc biệt). Khi điều trị Xeloda kết hợp
vởi cảc thuốc khảc, bệnh nhân lớn tuổi 2 65 tuổi từng có qua những phản ứng thuốc ngoại ý
(ADRs) độ 3 và độ 4 nhiếu hơn những bệnh nhân trẻ tuổi, ADRs sẽ dẫn đến tạm ngừng điều trị.
Khi điều trị Xeloda kết hợp với docetaxel, ti lệ cảc tảc dụng ngoại ý có liên quan đến điều trị độ 3
hoặc 4, cảc tảc dụng ngoại ỷ nghiêm trọng và rút lui điều trị sớm do các tảo dụng ngoại ý tăng
được ghi nhận ở những bệnh nhân 60 tuối hoặc hơn, so với bệnh nhân nhỏ hơn 60 tuổi.
2.5.4 Suy thận
Cảo bảo sĩ nên kiềm tra cẩn thận khi dùng Xeloda cho những bệnh nhân suy giảm chức nảng thận.
Như đã thấy vởi S-FU xuất độ những tác dụng ngoại ý độ 3, độ 4 liên quan đến điều trị thì nhiều
hơn ở bệnh nhân suy thận mức độ trung bình (độ thanh thải creatinine 30-50 ml/phút) (xem phần
2.2.1, Hướng dẫn liếu dùng dặc biệt).
2.5.5 Suy gan
Những bệnh nhân suy gan nến theo dõi cần thận khi đíều trị với Xeloda Suy gan không do di căn
gan hoặc suy gan nặng do tác động cùa Xeloda thì không được biết (xem phần 3 2. 5, Dược động
học trong dân sô đặc biệt vả phần 2.2.1 ,Hưởng dẫn liều đùng đặc biệt).
2.6 Tác động không mong muốn gì
Thông bảo cho cảc bác sỹ những tác dụng không mong muốn gặp phải khi sử dụng thuốc
2.6.1 Các thử nghiệm lâm sảng
Các phản ứng thuốc ngoại ý (ADRs) được xem xét bới nghiên cứu viên có khả năng, có thế là có
liên quan xa với việc điều trị với Xeloda đã được ghi nhận từ những nghiên cứu lâm sảng tiến
hảnh với Xeloda đơn trị (trong điều trị hỗ trợ ung thư đại trảng, trong ung thư đại trực trảng di căn
và ung thư vú di cãn), vả nhũng nghiên cứu lâm sảng tiến hảnh với Xeloda trong điều trị phối hợp
với phác đồ hoả trị khảo nhau cho cảc chỉ định khác nhau. Những ADR được nêu ra trong cảc
bảng dưới đây lả những ADR có tỷ lệ cao nhất được tồng hợp từ 7 thử nghiệm iâm sảng đã hoản
thảnh. Với môi nhóm tần xuất cảc ADR được xếp theo mức độ nguy hại giảm dần .Tần xuất được
chia thảnh cảc nhóm, rất hay gặp ì 10%, hay gặp_ > 5% tới < 10%,1t gặp 0,1% tới 1%.
Xeloda đơn n_i — Dữ kiện về tính an toản của Xeloda đơn trị được báo cảo từ những bệnh nhân
ung thư đại trảng điếu trị hỗ trợ và từ những bệnh nhân điếu trị ung thư vú di căn hoặc ung thư đại
trực trảng di căn. Thông tin về sự an toản từ một thử nghiệm pha 111 trong điều trị ung thư đại
trảng 1995 bệnh nhân điều trị với Xeloda và 974 điếu trị với 5-FU/LV tiếm tĩnh mạch) vả từ 4 thử
nghiệm pha II ở bệnh nhân nữ ung thư vú (N=319) và 3 thử nghiệm (1 pha II và 2 pha 111) ở bệnh
nhân nam và nữ ung thư đại trục trảng (N=630). Dữ kiện an toản cùa Xeloda đơn trị thì có thế so
sảnh bệnh nhân ung thư đại trảng điều trị hỗ trợ với bệnh nhân điểu trị ung thư vú di căn và ung
thư đại trực trảng di căn. Mức độ của ADRs được xếp loại dựa theo bảng phân loại độc tính Hệ
thống xếp loại NCIC CTC.
Bảng 4 Tóm tắt của các tác dụng ngoại ỷ ghi nhận 25% bệnh nhân điều trị
với Xeloda đơn trị
' Hệ thổng cơ thể Rất hay gặp ' Hay gặp
Tảc dụng ngoại ý (2 10%) (25% — < 100Í0)
Câc rối loạn chuyển Chản ăn (độ 3/4:1%) Mất nước (độ 3/4: 3%)
hóa và dinh dưỡng Giảm ngon miệng (độ 3/4:<1%)
Các rổi loạn thần kinh ị Dị cảm, loạn vị giảc (độ
3/4:<1 %),
Nhức đầu (độ 374:<1%),
Hoa mắt (trừ chóng mặt) (độ
374:<1%)
Các rối loạn về mắt Tăng tiết nước mắt, viêm kết
mạc (độ 3/4:<1%)
.f`
Các rôi loạn đường tiêu
hớa
Tiêu chảy (độ 3/4: 13%)
Buồn nôn (độ 374: 4%)
Nôn (độ 3/4: 4%)
Viêm dạ dảy (toản bộ)*
(độ 3/4: 4%)
Đau bụng (độ 3/4: 3%)
Táo bón (dộ 3/4:<1%),
374:<1%1,
Khó tiêu (độ 374:<1%1,
Đau thượng vị (độ
Chửc năng gan Tăng bililubin (độ 3/411%)
Các rối Ioạn da và mô Hội chứng bản tay bản Phảt ban, ban đỏ, đỏ da (độ
dưới da chân (độ 3/4: 17%), 3/4:1%),
Viêm da (độ 3/41<1%) Khô da (độ 3/41<1%),
Các rôỉ Ioạn toản thân
Mệt mòi (độ 374: 3%),
Ngủ lịm (độ 374:<1%>
Sốt (độ 374:<1%),
Yếu (độ 3/4:<1%1,
Ê
Suy nhược (độ 3/4:<1%)
* Viêm miệng, viêm niêm mạc, loét niêm mạc, loét miệng
Nứt da được ghi nhận là tối thiểu liên quan rất mơ hồ với Xeloda ít hơn 2% số bệnh nhân trong
bảy thử nghiệm lâm sảng hoản chinh. (N=949).
Các tảc đụng ngoại ý sau cho thấy_cảc độc tính đã biết khi điều trị fluoropyrimidine và được ghi
nhận là tôi thiêu liên quan rât mơ hô với Xeloda ít hơn 5% sô bệnh nhân trong bảy thử nghiệm lâm
sảng hoản chinh (N=949):
— Bất thường ở hệ Tiếu hóa: khô miệng, đầy bụng, tiêu chảy, cảc tảc dụng ngoại ý có liên quan
đến vìêm/Ioét niêm mạc như viêm thực quản, dạ dảy, viêm tá trảng, viêm đại trảng, chảy mảu
dạ dảy
— Bất thường về Tim mạch: phủ chỉ đười, đau ngực do tim bao gồm đau thắt ngực, bệnh cơ tim,
thiêu mảu cục bộ / nhôi mảu cơ tim, suy tim, đột tử, nhịp tim nhanh, loạn nhĩ bao gôm rung nhĩ
vả ngoại tâm thu thât.
- Bất thường về Thần kinh: rối loạn vị giảc, mắt ngù, nhầm lẫn, bệnh não, và các dấu hiệu về
tiêu não như thât điêu tiêu nảo, loạn vận ngôn, giảm thảng bảng, phôi hợp bât thường.
— Nhiễm trùng vả nhiễm ký sinh trùng: các phản ứng phụ liên quan tới suy tủy, tổn thương hệ
miễn địch, vả/hoặc thùng niêm mạc, như cảc nhiễm trùng tại chỗ và nhiễm trùng toản thân có
thể gây tử vong (bao gôm các nguyên nhân do vi khuẩn, vi rút, nấm) và nhiễm khuẩn.
— Bất thường về mảu và bạch huyết: thiếu mảu, suy tùy (được ghi nhận là một tảo dụng ngoại ý),
giảm ba dòng huyêt câu.
— Bất thường về Da và tổ chức dưới da: ngứa, tróc da khu trú, cảc rối loạn móng, các phản ứng
nhạy cảm với ánh sáng, hội chứng xuât hiện lại cảc tảc dụng phụ giông như khi xạ trị, bong
móng, móng dê gãy, loạn dưỡng móng.
— Rối loạn Toản thân vả tình trạng bản thân: suy nhược, đau chân, ngủ lịm, đau ngực (không do
tim).
— Mắt: viếm kết mạc, kích thích mắt.
10
- Hô hấp: khó thở, ho.
— Cơ xương: đau lưng, đau cơ, đau khớp.
— Các rối loạn tâm thân: trâm cảm.
— Suy gan và viêm gan ứ mật được ghi nhận trong cảc thử nghiệm lâm sảng và sau khi lưu hảnh
trên thị trường. Mối quan hệ nhân quả với việc điều trị bằng Xeloda chưa được thiết lập.
Xeloda trong điều tri kết hơp
Những ADR liên quan tới điều trị kết hợp Xeloda với cảc phác đồ hoá trị khảo nhau trong cảc chỉ
định khác nhau được tổng hợp trong bảng 5 là những ADR mới hoặc xuất hiện với tân xuất cao
hơn so với đơn trị liệu. Cảc dữ liệu an toản giữa cảc chỉ định và cảc phác đồ kết hợp là tương
đương. Cảc phản ứng xuất hiện với tần xuất > 5% ở các bệnh nhân điều trị Xeloda kết hợp với cảc
phảc đồ hoá trị khác nhau. Cảo ADR mới được nêu trong cảc bảng dưới đây dụa trên cảc tỷ lệ xuất
hiện cao nhất quan sảt được qua các thử nghiệm lâm sảng chính. Một vải ADR cũng thường xuất
hiện khi sử dụng hoả trị (như bệnh thần kinh ngoại vi gặp trong sử dụng docctaxel hoặc
oxaliplatin, tăng huyết áp trong sử dụng bevacizumab), tuy nhiên không loại trừ được sử dụng
Xeloda lảm các ADR nảy nặng thêm.
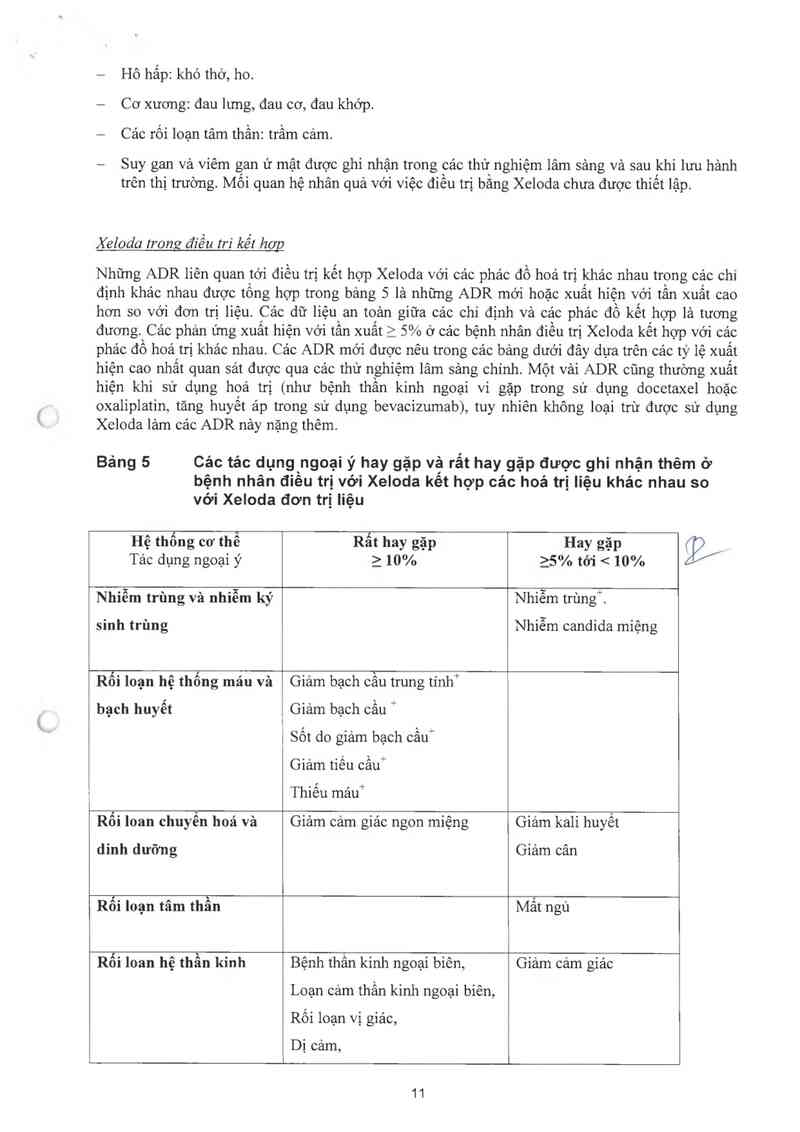
Bảng 5 Các tác dụng ngoại ý hay gặp về rắt hay gặp được ghi nhận thêm ở
bệnh nhân điều trị với Xeloda kết hợp các hoá trị Iiện khác nhau so
vơi Xeloda đơn trị liệu
Hệ thống cơ thể
Tảc dụng ngoại ý
Rất hay gặp
ì 10%
Hay gặp
25% tới < 10%
. X ` ` o 'ẵ !
Nh1em trung va nhiem ky
sinh trùng
Nhiễm trùngĨ
Nhiễm candida miệng
Rối loạn hệ thống máu và
bạch huyết
Giảm bạch câu trung tính+
Giảm bạch câu `ị
i Sốt do giảm bạch cầu'
Giảm tiêu câu“
Thiêu máui
Rôi loan chuyển hoá và Giảm cảm giác ngon miệng Giảm kali huyết
dinh dưỡng Giảm cân
Rối loạn tâm thần Mât ngủ
Rối loan hệ thần kinh
Bệnh thần kinh ngoại biên,
Loạn cảm thân kinh ngoại biên,
Rôi loạn vị giác,
Dị cảm,
Giảm cảm giảc
11
ạ.
Loạn vị giác,
Loạn cảm giảc,
Đau đâu
Tăng tiết nước mắt
Rối loạn về Tim mạch Huyết khối,
Tăng huyết áp
Phù chi dưới
Hô hẫp Loạn cảm giác họng, Chảy mảu cam,
Đau họng Khó phải âm
Chảy mũi
Hệ tiêu hoá Tảo bón Khô miệng
Khó tiêu
Da và tổ chức dưới da Rụng tóc
Rôi loạn móng
Hệ cơ xương và mô liên Đau khởp Đau nhức hảm
kểt Đau cơ Đau lưng
Đau ở các chi
Toản thân Sốt Sốt *'
Suy nhược Đau nhức,
Nhậy cảm với nhiệt độ
1 Mệt mói
Tẫn xuất tính trên tất cảc cảc mức độ ADR, trừ những ADR có dẩn + lả chỉ tính từ mức độ %
32
Tăng nhậy cảm (2%) và thiếu mảu cục bộ/nhồi mảu tim (3%) cũng được ghi nhận khi điều trị kêt
hợp Xeloda với cảc phảc đồ hoả trị nhưng tỷ 1ệ xuất hiện nhỏ hơn 5% trên tổng số bệnh nhân.
Cảo tảc dụng thuốc ngoại ý hiếm hoặc không phổ biến được ghi nhận trong điều trị kết hợp Xeloda
vả cảc hoả trị liệu phù hợp với ghi nhận cảc tảc dụng thuôo ngoại ý trong điêu trị Xeloda đơn trị
hoặc hoá trị đơn trị (xem thông tin kê toa của cảc sản phâm hóa trị).
2. 6.1.1 Các bất thường về Xét nghiệm
Bảng dưới đây thế hiện cảc bất thường về xét nghiệm quan sảt ở 995 bệnh nhân (trong điều trị hỗ
trợ ung thư đại trảng ) và ở 949 bệnh nhân (trong ung thư vú di căn vả ung thư đại trực trảng di
cản). không quan tâm đên môi liên quan điêu trị với Xeloda
12
Bảng 6 Các bắt thường về xét nghiệma: Xeloda đơn trị trong hỗ trợ điều trị
ung thư đại trảng và trong ung thư vú di cãn và ung thư đại trực
trảng
Xeloda 1250 mglm² hai lần mỗi
Thông số ngây dùng khôngiiên tục `
Bệnh nhân có những bât thường vê
xét nghiệm dộ 3/4 (%)
Tăng ALAT (SGPT) 1.6
Tăng ASAT (SGOT) 1.1
. Tăng alkaiine phosphatase 3.5
5 Tăng calcium 1.1
Giảm calcium 2.3
Giảm bạch cầu hạt 0.3
Giảm hemoglobin 3.1
Giảm tế bảo lympho 44.4
Giảm bạch cầu trung tính 3.6
Giảm bạch cầu trung tính/bạch 2.4
cầu hạt
Giảm tiếu cầu 20
Giảm kali 0.3 g
Tăng creatinin huyết thanh 0.5
Giảm natri 0.4
Tăng đường huyết 4.4
. aCảc bất thường xét nghiệm được xếp loại dựa theo bảng phân loại cùa Hệ thống
xêp loại NCIC CTC.
2.6.2 Sau khi lưu hảnh thị trường
Các phản ứng thuốc ngoại ý sau được thẩy trong quá trình lưu hảnh trên thị trường:
— Rất hiếm: hẹp ống dẫn lệ không đặc hiệu.
— Rất hiếm: suy gan và viêm gan ứ mật đã được ghi nhận trong quá trình thử nghiệm lâm sảng vả
sau khi lưu hảnh trên thị trường.
2.7 Quá liêu
Biến hiện cùa quá liêu câp tính bao gôm buôn nôn, nôn, tiếu chảy, viêm niêm mạc, kich thích và
chảy máu đường tiếu hóa, vả suy tùy.
Việc điếu trị quá liều nên bao gồm điếu trị thông thường và các can thiệp về y khoa hỗ trợ nhằm
chữa trị những triệu chứng lâm sảng đang hiện diện và phòng những biên chứng có thế xảy ra.
13
3. ĐẶC TỈNH oược Li VÀ HIỆU QUẢ
3.1 Đặc Tinh Dược Lí
3.1.1 cớ Chế HoạtĐộng
Capecitabine lả dẫn xuất fiuoropyrimidine carbamate được điêu chê đẽ dùng đường uông, lả thuôo
độc tế bảo được hoạt hoả bời khôi u và chọn lọc trên khôi u.
Capecitabine không phải lả chất độc tế bảo trên in vitro. Tuy nhiên, trên in vivo, thuốc được biến
đôi iiên tiêp thảnh chât gôc độc tế bảo là 5—fiuorouracil ( 5—FU), chât nảy sẽ được chuyên hoả tiêp.
Sự hình thảnh 5-FU tại khối 11 nhờ xúc tác một cảch tối ưu cùa yếu tố tạo mạch liên quan tới khối u
lả thymidine phosphorylase ththase), nhờ đó lảm giảm tôi đa mức độ của mô lảnh với 5-FU
trong cơ thê.
Sự biến đối sinh học tuần tự cùa men từ capecitabine thảnh 5- FU dẫn tới nồng độ cùa 5- FU cao
hợn trong mô khối 11. Sau khi cho bệnh nhân bị ung thư đại trực trảng (N— 8) uông capecỉtabine, tỉ
số nộng độ của SFU ờ khối u đại trực trâng so t ới các mô gần kề 1ả3, 2 (dao động từ 0,9 đến 8 ,.0)
Tỉ sô nông độ ở khối 11 so với huyết tương là 21,4 (dao động từ 3,9 đến 59,9) trong khi tỉ số ờ cảc
mô khoẻ mạnh so với huyết tương iả 8, 9 (dao động từ 3, 0 đến 25 ,.8) Hoạt tính cùa thymidinc
phosphorylase cao hơn gắp 4 lẩn ở khối 11 đại trục trảng so với mô binh thường bên cạnh.
Một vải khối u ớ người, như ung thư vú, dạ dảy, đại trực trảng, cổ từ cung, vả buồng trứng, có
nông độ thymidine phosphorylase cao hơn (có khả nãng chuyên 5’—DFUR [S²deoxy—S-
fluorouridine] thảnh 5-FU) so với cảc mô bình thường tương ứng.
Các tế bảo binh thường và các tế bảo khối u chuyến hoá 5- FU thảnh 5- t1uoro- 2 deoxyuridine
monophosphate (F dUMP) vả 5- fiuorouridine triphosphate (FUTP) Những Chẳt chuyến hoá nảy sẽ
lảm tồn thương tế bản bằng hai cơ chế. Đầu tiên, FđUMP và đồng yếu tố folate NS“ 10
methylenetetrahydrofolatc gãn với thymidylate synthase ( TS) tạo nến một phức hợp gồm ba yếu tố
đồng hoá trị Sự găn kết nảy sẽ ức chế sự hinh thânh thymidylate từ uracil. Thyrnidylate là một tiến
chắt cần thiết cùa thym1dme triphosphate, một chất cân thiết cho sự tông hợp DNA, vì vậy sự thiếu
hụt hợp chắt nảy có thế ức chế sự phân chia tế bảo. Thứ hai, cảc men sao chép nhân có thế kết hợp
một cảch nhầm lẫn FUTP thay vì uridine triphosphate (UTP) trong qua' trinh tống hợp RNA. Lỗi
chuyến hoá nảy có thể ảnh hướng tới sự tống hợp RNA vả protein.
3.1.2 Hỉệu Quả Lãm Sảng
Đơn T r_i - Ung thư đại !rực trảng
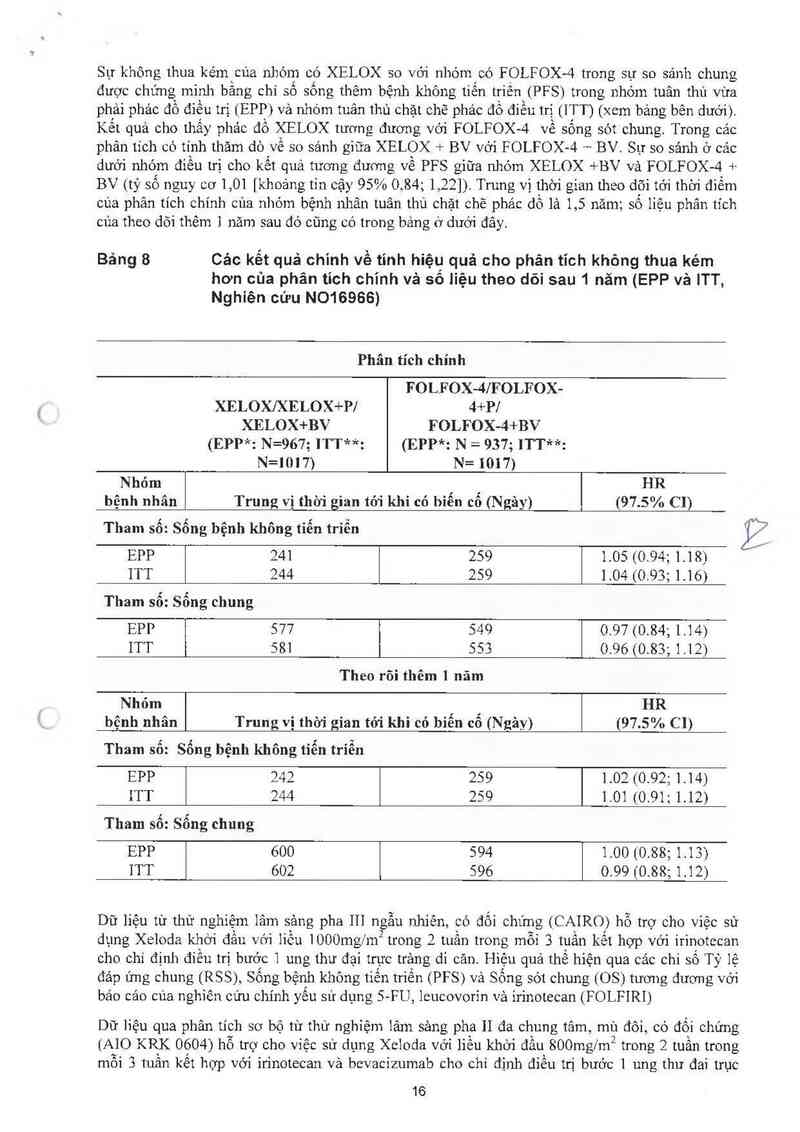
Số liệu từ một thư nghiệm lâm sảng pha III, đa trung tâm, ngẫu nhiên. có đối chưng trên những
bệnh nhân bị ung thư đại trảng giai đoạn 111 (Dukes C) ùng hộ cho việc sử dụng Xeloda cho sự
điếu trị hỗ trợ trên những bệnh nhân bị ung thư đại trảng (nghiên cứu XACT: MóóOOl ). Trong thử
nghiệm nảy, 1987 bệnh nhân được chọn ngẫu nhiên để điều trị với Xeloda ( 1250mg1m2 hai lần
mỗi ngảy trong hai tuần sau đó lả một tuần nghi thuốc và được dùng liệu trinh 5 tuần như vậy
trong 24 tuần) hoặc 5- FU vá leucovorin (phảc đồ điếu trị Mayo: dùng 20mg/m2 ieucovorin ~tiêm
tĩnh mạch 86… độ 121 42510g11112 5- FU truyẽn tĩnh mạch nhanh từ ngảy 1 đến ngảy thứ 5, mỗi 28
ngảy trong 24 tuần) Xeloda1t nhất tương đương vởỉ 5- FU/LV đường tĩnh mạch ờ tỉ lệ sống thêm
không bệnh (p=0, 0001 ,khoảng giới hạn không kém hơn 1 ,.2) Trến tắt cả số người được chọn ngẫu
nhìên, thử nghiệm cho sự khác biệt giữa Xeloda vả 5-FU/LV ờ sống thêm không bệnh, và sống sót
chung cho thấy tỉ số nguy cơ tương t'mg lần iượt là 0,88 (khoảng tin cậy 95% 0,77 — 1,01;
p=0,068) và 0,86 (khoảng tin cậy 95% 0,74 — 1,01; p=0,060), và 0,87 (khoáng tin cậy 95% 0,75-1;
p=0,057]. Trung vị thời gian theo dõi tại thời điếm phân tỉch là 6,9 năm.
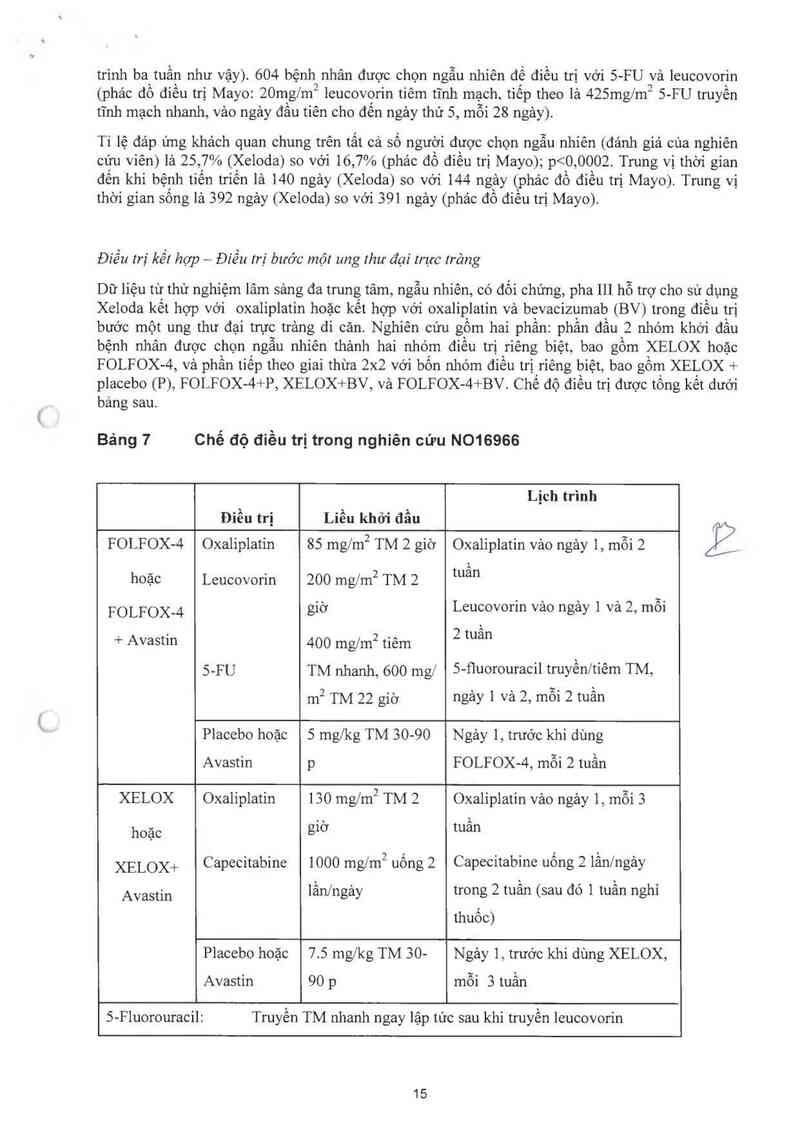
Số liệu từ hai thử nghiệm 1âm sảng được thiết kế tương tự, đa trung tâm, ngẫu nhiên, có đối chứng,
pha 111 ửng hộ việc sử dụng Xeloda cho điếu trị bước một ung thư đại trực trảng di cản (8014695;
8014796). Trong các thử nghiệm nảy, 603 bệnh nhân được chọn ngẫu nhiên để điều trị Xeloda
(1250mg/m2 hai lần mỗi ngảy trong hai tuần sau đó 1ả một tuần nghi thuốc vả được dùng cảc liệu
14
trình bajuần như vậy). 604 bệnh nhân được chọn ngẫu nhiên để diều trị với 5-FU vả leucovorin
(phảc đô điêu trị Mayo: 20mg/m2 leucovọrin tiêm tĩnh mạch, tiêp theo lả 425mg/m2 5-FU truyên
tĩnh mạch nhanh, vảo ngảy đâu tiên cho đên ngảy thứ 5, mỗi 28 ngảy).
Tỉ lệ đáp ứng khảch quan chung trên tất cả số người được chọn ngẫu nhiên (đảnh giá của nghiên
cứu viên) là 25, 7% (Xeloda) so với 16, 7% (phảc đồ điều trị Mayo); p
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng