




















' S’Ữf/ttầâô ộét/ỔĐ~ỔLD
Maừel Trade Nan: No. ot Colouri: 4
Vctrient
— llloSnlithKlilu
lMonnnion Fancl
10000000113676 ẸẫLCut'tnlẵtiu:
tbhụuuibn
Manuhctu ring Site: 21 …- r`ỉụn-omt
GSK-ESP-AIIndO-ESARA
March or Fadt 0wner:
Victnlm-VNM
chhnlut Reference Notsl.z
02-01-(0-272-17
mm…ummMuđ-lm-dút
A…ú umth búnm d th II:…MIInJ Imựd …
›: uulmn ut…g I …1 tu GSI tui plth tmumm 01 m đminnn ma uuumhu nm mu I Iiuna lơ nil lem mun ma … mmmiut with GSK l… … etth and
… d Ionu i Mun mu u item cmlilum … mutlunud ụuomy int: wu. sa: Wii mu mun my Iinliy Im me h… 01 min nmy ìnutlxmi mnglm by om… tcntpment
m… The Gi mu… Jth gm-uwlm uưunoo duhmtut m Iu nm III uit… lơ… … unumu mutu … ntpịu umuuiùnn at uit Um um
h Eun … !! vimng ní !
… mu um… … Moh- m… & hntmeml … Mau mui… m: Sundud ơ Pmtmiơtl mìgim in 51
mưu… h… … b: nm… Iu mu… ut ư…n ma;
nM…. wmmcmh…mmiSơmợm uuWhulnru n Wunq Inmừmuđinũtlurưlmnphtuimnqltnlưehudma
I 1… mm Musuving Bu |
! tn …… Hnmlũuw »… ocn um nục… … mu…m. mm mu m…… iu nm nen pm… h… … mm ›… luuụn…u un… 1
Page 1 of 2
BỘ Y tẾ
CUC QUÁN LY DLĨỢC
ĐÃ PHÊ oưộr
Lùn đau'co'Ozi/fĨ
-c—
GEI'I N ìũO'ì VWIIVNA
NiMEUIDNNOJWWYGƠWWỂẢ
W…UỤWAG
t /,i 000 mm \ ÔweịolịoA 4
Ợ gmnimm m gùuoan i
~~ ct…mm :— … i
Rx Thuốc bin u… un " “""wm Rx n…tk … \
® ' ® ' ® ' ®
Votrient Votrnent Votruent Votrnent i
400 mg 400 mg 400 mg 400 mg
Pmpcnlb 400 mg Puoplnlb 400 mg Pazopanlb 400 mg Puopanlb … mg \
(dụng hydrcdllortdc) (dạng hydrodtlorldt] (dạng hydrochloridcì 1 (dạng hydfodtlofldơ)
acc › tc ao… sa… … …
W…Mnbncphimchhpamplnlb sm GỦWÙW
fflứm°mww ễ's'Ĩẫ’cỀ'fẵẵề'ìmm “" ihuõc dùng đường uónq
No uuản M qul 30°C Dóng goi M:
CMGnDtdtõquìldinhakhdủngvl GImHIEIIQJA
… uanúnđochonqtủ vlèn Avda.deEmemcd ].
mg ……on @ nẻn bao phim i m_ ……aầìm WE … @ vttn … tao phim
WCWWW° fỪW'Ẻ VUT'RENNìnhMMNMMJMJ
'I'lƯử IN DM . ,
ưannnvmtm đãnqư6hmủIMmngpcl
: m 1 Gb»…neuuudmoanm
mrựm …
_ _ 7, _ _ _ _ __
.\ se la st usx. i /
i
( un \ /
i / IMPORTANT
] ' cstt Mukct lí mspcnsihlz
( Im Um modurl lu dutgn
nnd < onlen L
Enstut= thu anơvi ts
lhmnughty zhetkzd, Jll ltư
lut pmnt—téad and nppvovud
TWWĐẨM ""Ắ'EỔN NGU'ỂNVEN nsr csx mespcusiblc Im nlc
tuhmmt veqtmementt .1nd
pre press swuhiily.
G$K Market
i; respomíhle to advỉse 5%
in tm 1,5
đến 3 lần ULN bắt kế cảc giá trị ALT) (xem mục Dược động học).
Không khuyến cáo dùng VOTRIENT cho bệnh nhân suy gan nặng (được định nghĩa lả
bilirubin toản phần › 3 lần giới hạn trèn mức bình thường [x ULN] theo bắt kể các giá trị
ALT nảo).
Trẻ em
Không dùng VOTRIENT cho trẻ em dưới 2 tuổi do các quan ngại về an toán đối với sự phát
triễn cơ quan và sự trưởng thảnh của trẻ.
Tinh an toản vả hiệu quả của VOTRIENT ở trẻ em từ 2 đến 18 tuỗi chưa được thiết lập
(xem mục Dược động học). Hiện chưa có cảc dữ liệu nảy.
Người cao tuối
Dữ Iiệu về việc sử dụng VOTRIENT ở bệnh nhản từ 65 tuồi trở lèn còn hạn chế. Trong các
nghiện cứu với VOTRIENT trèn bệnh nhản RCC, nhìn chung khỏng quan sát thắy có sư
2
\\
`x'l
t~|'
li
khảo biệt đáng kể trện lâm sảng về an toản khi dùng VOTRIENT giữa những bệnh nhân từ
65 tuổi trở lẻn và bệnh nhân trẻ tuối hơn. Các kinh nghiệm trên lâm sảng không chỉ ra được
sự khác biệt về đáp ứng với thuốc giữa bệnh nhân cao tuối và bệnh nhân trẻ tuổi hơn
nhưng khộng thế Ioại trừ được việc tăng nhạy cảm với thuốc ở một số bệnh nhán cao tuồi.
CHỐNG CHỈ ĐINH
VOTRIENT bị chống chỉ định trện những bệnh nhân mẫn cảm với bắt kỳ thảnh phần nảo
của thuốc.
cÀm-t BÁO vÀ THẶN TRỌNG
Cảo tác dụng trẻn gan: Đã có báo cảo về các trường hợp suy gan (bao gồm cả tử vong)
nhẹ hoặc vừa và cằn kiểm soát chặt chẽ. Liều 800mg VOTRIENT một lần mỗi ngảy
khuyến oáo cho bệnh nhản có bảt thường nhẹ trong các xét nghiệm huyết thanh đánh gi
chức nảng gan (hoặc bilirubin blnh thường vả tăng ALT ở bắt kỳ mức độ nảo hoặc tăng
bilirubin tới 1,5 lần ULN bất kể các giá trị ALT). Liều VOTRIENT giảm xuống 200mg một lần
mỗi ngảy được khuyến cảo cho những bệnh nhân suy gan vừa (tảng bilirubin >1,5 đén 3 lần
ULN bất kể ca'c giá trị ALT) (xem mục Liêu dùng và cách dùng và Dược động hoc). Khỏng
khuyến cáo dùng VOTRIENT cho bệnh nhản suy gan nặng (bilirubin toản phản > 3 lần ULN
bất kể các giá trị ALT) (xem mục Liều dùng vả cách dùng và Dược động học). Phơi nhiễm
với thuốc ở Iièu 200mg giảm đáng kể trên những bệnh nhân nảy mặc dù có nhiều thay đối
nhưng cảc giá trị nảy khỏng đủ để xem là có tác động trèn Iảm sảng.
khi sử dụng VOTRIENT. Thận trọng khi dùng VOTRIENT cho những bệnh nhân suy gẫ ,
Trong các thử nghiệm lâm sảng với VOTRIENT, đã quan sát thắy tăng oác men
transaminase (ALT, aspartat aminotransferase [ASTD vả bilirubin trong huyềt thanh (xem
mục Tác dụng không mong muốn). Trong phần lớn các trường hợp, đã ghi nhận có tăng
riêng lẻ ALT vả AST mả không tảng đồng thời phosphatase kiềm hoặc bilirubin. Bệnh nhân
trên 60 tuồi có thể gặp nguy oơ cao có ALT cao hơn gắp 3 lần X ULN.
Bệnh nhân có allel HLA-B*S7zO1 cũng có thể tăng nguy cơ có ALT tăng Iiện quan đến
VOTRIENT. Nẻn theo dõi chức nảng gan chặt chẽ ở tất cả bệnh nhản đang sử dụng
VOTRIENT, bắt kế kiểu gen và độ tuổi (xem mục Dược lý học lâm sảng). Sự tăng men
transaminase ở cảo mức độ phần lớn (> 90%) xảy ra trong 18 tuần đầu. Mức độ tăng mem
transaminase dựa trện tiẻu chuẩn thuật ngữ chung về biến oó bảt lợi của Viện Ung thư
Quốc gia, phiên bản 3 (NCI CTCAE).
Nèn theo dõi chặt chẽ các xét nghiệm huyết thanh đánh giá chức năng gan trước khi điều trị
vởi VOTRIENT, vả vảo các tuần 3, 5, 7 vả 9. Sau đó, theo dõi ở Tháng thứ 3 và Tháng thứ
4, vả dựa trèn biều hiện lâm sảng. Cần tiép tục theo dõi dịnh kỳ sau Tháng thứ 4.Hướng
dẫn sau đây được cung cẩp cho oác bệnh nhân có giá trị ban đầu của bilirubin toản phần s
1.5 X giới hạn trẻn cùa mức bình thường (ULN) vả AST vả ALT s 2 X ULN.
~ Những bệnh nhán tăng ALT riêng lẽ từ 3 đén 8 lằn giới hạn trện của mức binh
thường (ULN) có thề tiép tục dùng VOTRIENT cùng với việc theo dõi hảng tuần
chức năng gan cho đến khi các transaminase trở về Mức 1 (NCI CTCAE) hoặc mức
trước điều trị.
1: \.t —-4
- Những bệnh nhán có ALT tăng > 8 lần ULN cần tạm ngừng VOTRIENT cho tới khi
cảc transaminase trở về Mức 1 (NCI CTCAE) hoặc mức trước điều trị. Nếu xét tháy
những lợi ích tiềm năng cùa việc sử dụng lại VOTRIENT nồi trội hơn nguy cơ độc
tinh trện gan, có thế sử dụng lại VOTRIENT ở mữc lièu đã được giảm và tiến hảnh
xét nghiệm huyết thanh đánh giá chức nảng gan mỗi tuần trong 8 tuần (xem Liều
dùng và Cách dùng). Sau khi sử dụng lại VOTRIENT, nếu ALT tảng trở iại › 3 lằn
ULN thì phải ngừng hẳn VOTRIENT.
- Néu ALT tăng > 3 lần ULN đồng thời với bilirubin tăng > 2 lản ULN, nện ngững sử
dụng VOTRiENT lâu dải. Nẻn theo dõi các bệnh nhân cho đến khi các transaminase
trở về Mức 1 (NCI CTCAE) hoặc mức trước điều trị. Pazopanib lả một chảt ức ế ,
UGT1A1.Tăng bilirubin huyết nhẹ. khòng trưc tiép có thể xảy ra ở những bệnh niỀn/
mắc hội chứng Gilbert. Những bệnh nhân chỉ bị tăng bilirubin huyêt nhẹ, đã biết họ c ÍÍ
nghi ngờ bị mắc hội chứng Gilbert, vả tảng ALT > 3 ULN nện được giám sát theo ~”.
khuyến cáo đối với sự tăng ALT riêng lẻ. \\
Dùng đồng thời VOTRIENT vả simvastatin lảm tăng nguy cơ tảng ALT (xem mục Tuong tác)
và nẻn sử dụng thận trọng vệ theo dõi chặt chẽ.
Ngoại trừ khuyến cáo cảc bệnh nhân bị suy gan nhẹ được điều trị bằng VOTRIENT 800 mg
một lần/ ngảy và giảm Iiều khởi đảu xuống 200 mg mỗi ngảy cho các bệnh nhân bị suy gan
trung binh, khộng oỏ hướng dẫn điều chĩnh liều nảo khác dưa trên các két quả thử máu
đánh giá chức năng gan trong quá trinh fflèu trị đối với các bệnh nhân đã bị suy gan trước
đó.
Tăng huyết áp: Trong cảc nghiện cứu lâm sảng với VOTRIENT, đã xảy ra các biến có tãng _
huyết áp bao gồm các đợt tăng huyết áp mới được chẩn đoán (cơn tăng huyết ảp). Cần
kiểm soát tốt huyết áp trước khi bắt đầu sử dụng VOTRIENT. Bệnh nhản nèn được theo dõi E
sớm và chặt chẽ tình trạng tảng huyết áp ngay sau khi bắt đầu điều trị (không quá 1 tuần "\
sau khi bắt đảu dùng VOTRIENT) vả thường xuyên sau đó để đảm bảo kiếm soát được
huyêt áp. Các mức tăng huyết áp (huyết áp tám thu 2 150 hoặc huyết áp tám trương 2 100
mm Hg) xuất hiện sớm trong đợt điều trị (xáo xỉ 40% các trường hợp xuất hiện trước Ngảy
thứ 9 vả xấp xỉ 90% các trường hợp xuất hiện trong vòng 18 tuần đầu). Huyêt áp cản được
theo dõi chặt ohê vả kiềm soát ngay lặp tức bằng cách sử dụng Iiệu pháp phối hợp hạ huyết
áp và điều chỉnh liều VOTRIENT (tam ngừng hoặc dùng lại Với mức liều giảm thảp dựa vảo
đánh giá trẻn lâm sảng) (xem mục Liều dùng và cách dùng và Tác dụng không mong muốn).
Phải ngững sử dụng VOTRIENT néu có bằng ohứng của tảng huyết áp dai dảng (140/90
mmHg) hoặc néu tảng huyết ảp động mạoh nghiêm trọng vả dai dẳng mặc dù đã sử dụng
liệu phảp chống tăng huyết áp vả giảm iièu VOTRIENT.
\nn
`.
I\IỈ
Hội chứng tốn thương não phía sau có khả nãng hồi phục (Posterior reverslble
encephalopathy syndrome - PRES)I Hội chứng bệnh lý chất trắng não sau có thề hổi
phục (Reversible posterior Ieukoencephalopathy syndrome - RPLS): PRES/RPLS đá
được báo oáo có Iiẻn quan đén VOTRIENT. PRES/RPLS có thể có biểu hiện đau đầu, tảng
huyết áp, co giật, ngủ lịm, lủ lẫn. mù vả các rổi Ioạn thần kinh và thị giác khảo và có thế tử
vong. Ngừng hẳn VOTRIENT ở những bệnh nhân có PRES/RPLS.
Bệnh phồi kẽ (iLD)i Viêm phối: Bệnh phổi kẽ, là bệnh có thể gây tử vong, đã được bảo
cáo là cỏ Iiện quan đến VOTRIENT (xem Tác dụng khỏng mong muốn). Cần theo dõi những
bệnh nhân oỏ triệu chứng phổi gợi ý đến bệnh phối kẽ] viêm phổi. Ngừng sữ dụng
VOTRIENT ở những bệnh nhân bị viêm phổi kẽ hoặc viêm phối tiến triển.
Rối Ioạn chức nảng tim: Trong các thử nghiệm lâm sảng với VOTRIENT, đã xảy ra các
biến oố rối ioạn chức năng tim như Suy tim sung huyết vả giảm phân suất tống mảu thắt trái
(LVEF).Trong một thử nghiệm ngẫu nhiên về bệnh ung thư biếu mô tế bảo thận (RCC), đối
ohững VOTRIENT với sunitinib, ở những người được đo chỉ số LVEF ban đầu và theo dõi,
rối loạn chức năng cơ tim đã được quan sảt thắy ở 13% (47/362) nhóm đối tượng dùng
VOTRIENT so với 11% (421369) ở nhóm đối tượng dùng sunitinib. Suy tim sung huyết đă
được quan sát thắy trong 0,5% cảc đối tượng trong mỗi nhóm điều trị. Trong thử nghiệm
lâm sảng pha III về ung thư phần mềm (STS), suy tim sung huyết đã được báo cảo ở 3
trong số 240 đối tượng (1%). Trong thử nghiệm nảy, nhặn thắy tỷ lệ giảm phân suất tống
máu thất trái ở các đối tượng có tiến hảnh đo chỉ số nảy sau khi điều trị lả 11% (161142)
trong nhóm VOTRIENT so với 5% (2/40) trong nhóm giả dược. Có 14116 đối tượng trong
nhỏm VOTRIENT có tăng huyết áp đồng thời có thẻ lảm táng thêm rối Ioạn chữc năng tim ở
bệnh nhân có nguy cơ (ví dụ, bệnh nhân có điều trị anthracyciin trước đó) bầng cách lảm
tăng hậu gánh tim.
Nèn theo dõi huyết ảp và kiểm soát ngay bằng cảch phối hợp phác đồ điều trị tăng huyết áp
và điều chỉnh liều VOTRIENT (ngừng dùng hoặc bắt đầu iại ở liều thấp hơn dựa the nh
giá lâm sảng). Bệnh nhản nện được theo dõi cẩn thặn các dắu hiệu hoặc triệu chứn | m
sảng của suy tim sung huyết. Khuyên cảo nèn đảnh giá LVEF trước khi điều tri và định
bệnh nhân có nguy cơ rối loạn chức năng tim.
Kéo dâi khoảng QT vả xoắn đỉnh: Trong các nghiên cứu Iảm sảng với VOTRIENT, đã xuất
hiện biến cố kéo dải khoảng QT hoặc xoắn đinh (xem phần Tác dụng không mong muốn).
Cần sử dung VOTRIENT một cách thận trọng trên những bệnh nhân có tiền sử kéo dải
khoảng QT, những bệnh nhản dùng các thuốc chống Ioan nhip hoặc các thuốc khảo có thể
kéo dải khoảng QT, hoặc những bệnh nhản có bệnh tim trước đó. Khi sử dụng VOTRIENT,
cần phải giám sảt điện tám đồ trước điều trị và định kỳ vả duy trì nồng độ các chắt điện giải
(calci, magic, kali) trong khoảng binh thướng.
Biến cố huyết khối động mạch: Trong các nghiên cứu lâm sảng với VOTRIENT, đã quan
sát thắy các biền cố nhồi mảu cơ tim, đau thắt ngực, đột quỵ nhồi máu nảo vả cơn thiếu
mảu năo thoảng qua (TIA) (xem phần Tác dụng khõng mong muốn). Cũng quan sa't thảy
các biến cổ tử vong. Nẻn sử dụng thận trọng VOTRIENT ở những bệnh nhân có nguy cơ
cao dễ xảy ra cảc biến cố huyết khối hoặc những người đã từng xảy ra biến cố trong vòng 6
tháng trước đó. Cần đưa ra các quyết định điều trị dựa vảo đánh giá lợi ichlnguy cơ trện
từng bệnh nhản.
Biến cố thuyên tắc huyết khối tĩnh mạch: Trong cảo nghiện cữu lâm sảng với
VOTRIENT, đã xảy ra oảc biền cố thuyên tắc huyết khối tĩnh mạch bao gồm huyêt khối tĩnh
mạch và thuyên tắc đòng mạoh phối gây tử vong. Tỉ lệ mắc cao hơn ở các đối tượng STS
(5%) so với nhóm đối tượng RCC (2%).
Huyết khối mao mạch: Huyết khối mao mạch (TMA) đã được bảo cảo trong các thử
nghiệm lâm sảng cũa VOTRIENT dùng đơn trị iiệu, phối hợp với bevacizumab, và phối hợp
với topotecan (xem phần Tác dụng khộng mong muốn). Ngừng hắn VOTRIENT ở bệnh
nhân có xuất hiện huyết khối mao mạch. Quan sát thấy 00 sự đảo ngược tảo động của
huyết khối mao mạch sau khi ngững điều trị. VOTRIENT khộng được chỉ định dùng phối
hợp với các chắt khác.
Biển cố xuất huyết: Trong ca'c nghiên oứu lâm sảng với VOTRIENT, đã ghi nhận cảo biến
có xuất huyết (xem phần Tác dụng khõng mong muốn). Đã oộ xảy ra cảc biến có xuất huyết
gảy tử vong. VOTRIENT chưa được nghiện cứu trẻn những bệnh nhãn có tiền sử ho ra
máu, xuất huyềt não, hoặc có xuất huyết đường tiêu hóa nghiêm trọng về mặt lâm sảng
trong 6 tháng trước đó. Phải sữ dụng thận trọng VOTRIENT ở những bệnh nhân có nguy cơ
cao xảy ra xuất huyết.
Thùng vả rò đường tiêu hóa: Trong cảc nghiện cứu lâm sảng với VOTRIENT, đã xuất
hiện cảc biến cố thủng hoặc rò đường tiêu hóa (xem phần Tác dụng không mong muốn).
Biến cố thủng gây tử vong đã xảy ra. Nên sử dụng thận trọng VOTRIENT ở những bệnh
nhản có nguy cơ về thủng hoặc rò đường tiêu hóa.
Lảnh vết th ương: Không có nghiên cứu chinh thức về ảnh hưởng của VOTRIENT trện quả
trinh Iảnh vết thương. Vì các tác nhán ức chế yếu tố tăng trưởng nội mạc mạch máu
(VEGF) có thể lảm chậm quá trình Iảnh vết thương, nên phải ngừng điều trị với VOTRIENT
ít nhắt 7 ngảy trước lịch phẫu thuật. Quyết định dùng lại VOTRIENT sau phẫu thuật phải
dưa trện đánh giá lâm sảng cho thắy quá trình Iảnh vết thương đã ốn định. Phải ngừng
VOTRIENT ở những bệnh nhân có vết thương hở.
Giảm chức năng tuyến giáp: Trong các nghiên cữu lâm sảng với VOTRIENT, đã xuất hiện
biến có giảm chức năng tuyến giáp (xem phần Tác dụng khỏng mong muốn). Nên chủ động
giảm sảt cảc xét nghiệm chữc năng tuyền giáp.
Protein niệu: Trong các nghiên cứu lâm sảng với VOTRIENT, đã ghi nhận các trường hợp
protein niệu (xem phần Tác dụng không mong muốn). Nèn tiến hảnh phản tich nước tiếu
trước điều trị vả định kỳ trong quả trinh điều trị vả oần giảm sảt cảc bệnh nhân về diễn biến
protein niệu trớ nện xấu hơn. Phải ngừng VOTRIENT nếu bệnh nhản tiến triển thềè hội
chứng thận hư.
Trản khí mảng phổi
Trong các nghiên cứu lâm sảng với VOTRIENT trong ung thư phần mềm tiến triển, đã xảy
ra các biến cố trản khí mảng phổi (xem mục Tác dụng khóng mong muốn). Bệnh nhản đang
điều trị với VOTRIENT nện được theo dõi chặt chẽ các dấu hiệu vả triệu chứng của trản khi
mảng phổi.
Nhiễm trùng: Cảo ca nhiễm trùng nặng (có hoặc không có giảm bạch cầu trung tinh) tr0ng
một số trường hợp gây tử vong đã được bảo cáo.
Phối hợp vởi các liệu pháp chổng ung thư dùng đường toản thân khác: Các thử
nghiệm lâm sảng sữ dụng VOTRIENT phối hợp với pemetrexed (ung thư phồi không phải té
bảo nhỏ (NSCLC)) vả lapatinib (ung thư cổ tử cung) đã phải kết thúc sớm do mối quan ngại
về sự tăng độc tinh vảlhoặc tử vong, vả vẫn chưa thiết lập được liều phối hợp an toản vả
6
hiệu quả với những phâc đồ nảy. VOTRIENT khộng được chỉ định dùng phối hợp với các
chất khảo.
Độc tính trẽn động vặt chưa trưởng thảnh: Do cơ chế tảo dụng của VOTRIENT có thể
ảnh hưởng nghiêm trọng đến sự tăng trướng vả trướng thảnh của cơ quan ttong quá trình
phát triển sớm sau sinh (xem phần Dữ tiệu an toán tiến iâm sáng). Không nện sử dung
VOTRIENT cho bệnh nhi dưới 2 tuỗi.
Mang thai: Cảo nghiên cứu tiền lâm sảng ở động vật đã cho thẳy có độc tính sinh sản (xem
phần Dữ iiệu an toản tiển iâm sảng).
Nếu VOTRIENT được sử dụng khi đang mang thai, hoặc nếu bệnh nhân có thai khi dùng
VOTRIENT, phải giải thích cho bệnh nhân về cảc nguy hiểm tiềm tảng đối với thai nhi. Cần
khuyên các phụ nữ trong độ tuối sinh đẻ thực hiện tránh thai khi được điều trị với
VOTRIENT (xem phần Thởt' kỳ mang thai vá Gho con bú).
Tương tác: Nèn tránh điều trị đồng thời với cảc thuốc ức chế mạnh CYP3A4, P-
glycoprotein (P-gp) hoặc protein kháng ung thư vú (BCRP) do nguy cơ tăng phơi nhiễm với
pazopanib (xem phần Tuợng tác). Nện cản nhắc lựa chọn cảc thuốc thay thể dùng đồng
thời khộng có hoặc có khả năng ức chế it nhắt CYP3A4. P-gp hoặc BCRP.
Nèn trảnh dùng đổng thời với các thuốc gảy cảm ứng CYP3A4 do nguy cơ giảm phơi nhiễm
với pazopanib (xem mục Tương tác).
Đã quan sát thắy cảc trường hợp tăng đường huyết khi dùng đồng thời với ketoconazole.
Thận trọng khi dùng đồng thời VOTRIENT với các cơ chẳt uridine diphosphate glucuronosyl
transferase 1A1 (UGT1A1) (ví dụ irinotecan) vi pazopanib lả ohắt ức ohê UGT1A1 (xem mục
Tương tác).
Nên tránh dùng nước ép bưới trong khi điều trị với VOTRIENT (xem mục Tương tác).
TƯỚNG TÁC
Ảnh hưởng của các thuốc khảo đổi với pazopanib
Các nghiên cứu in vitro gợi ý rằng quá trinh chuyển hóa oxy hóa của pazopanib tại
microsome trong gan người chủ yếu là qua trung gian CYP3A4, với sự tham gia một phần
nhỏ từ CYP1A2 vả CYPZCB. Vì thế, các tảo nhân ức chế vả cảm ứng của CYP3A4 có thế
Iảm thay đồi chuyển hóa của pazopanib
Các thuốc ức chế CYP3A4, P-gp, BCRP:
Pazopanib lả cơ chát cho CYP3A4, P-gp vả BCRP.
Sử dụng đổng thời VOTRIENT (400 mg một lần mỗi ngảy) với chắt ức chế mạnh CYP 4
vả P-gp, ketoconazcle (400 mg một lần mỗi ngảy) trong 5 ngảy Iiện tiếp, lảm tãng tbtẵg
ứng 66% và 45% giá trị trung binh của AUCịịm) vả C,… của pazopanib so với khi dùn
VOTRIENT đơn độc (400 mg một lần mỗi ngảy tr0ng 7 ngảy). So sánh các thông số dược
động học oủa paz0panib Cmaxtkhoảng giá trị trung binh từ 27.5 đến 58,1 ug/ml) vả AUCịD.M
(khoảng giá trị trung binh từ 48,7 đến 1040 ịJg*giờlml) sau khi dùng đơn độc pazopanib
800mg và sau khi dùng pazopanib 400mg kết hợp ketoconazole 400mg (C,…trung binh
59,2 pglml, Aucịo.zịị trung bình 1300 ug*giờlml) cho thắy với sự hiện diện oủa chắt ức chế
7
mạnh CYP3A4 vả P-gp, giảm liều VOTRIENT 400mg một lần mỗi ngảy ở phần lớn cảc bệnh
nhân sẽ dẫn đến phơi nhiễm toản thản tương tự như quan sảt thắy sau khi dùng đơn độc
800mg VOTRIENT một lần mỗi ngảy. Tuy nhiện một vải bệnh nhân có thẻ có phơi nhiẻm
pazopanib toản thân nhiều hơn so với những bệnh nhân dùng 800mg VOTRIENT đơn độc.
Sử dụng đồng thời VOTRIENT với các thuốc ức chế mạnh nhóm CYP3A4 khác (ví dụ
itraconazole, clarithromycin, atazanavir. indinavir, nefazodone, nelfinavir, ritonavir,
saquinavir, telithromycin, voriconazole) có thể Iảm tăng nồng độ pazopanib. Nước ép bưởi
có ohứa tác nhân ức chế CYP3A4 cũng có thề lảm tăng nồng độ pazopanib trong huyết
tương.
Sử dụng 1500 mg iapatinib (một cơ chất vả lả chắt ức chế nhẹ CYP3A4, P-gp vả một chất
ức chế mạnh BCRP) cùng với 800 mg VOTRIENT Iảm tăng khoảng 50 % đến 60 % giá trị
trung bình AUCMn và C.… của pazopanib khi so sảnh với việc sử dụng đơn độc 800 mg
VOTRIENT. Sự ức chế P-gp vảihoặc BCRP bới Iapatinib có iẽ đã góp phần váo việc tăng
phơi nhiễm với pazopanib.
Sử dụng đồng thời VOTRIENT với thuốc ức chế CYP3A4, P—gp, vả BCRP, như lapatinib, sẽ
lảm tăng nổng độ pazopanib trong huyết tương. Sử dụng đồng thời với các thuốc ức ohê
mạnh P-gp hoặc BCRP củng có thể Iảm thay đối sự phơi nhiễm vả phán bố của pazopanib,
bao gổm cả sự phân bố tới hệ thần kinh trung ương (CNS).
Nên tránh sử dụng đồng thời VOTRIENT với thuộc ữc chế mạnh CYP3A4 (xem mục Cảnh
báo vả thận trọng). Nều không có lựa chọn khác có thế chảp nhận được về mặt y khoa để
thay thế thuốc ức chế mạnh CYP3A4 thi nện giảm Iiều VOTRIENT xuống còn 400 mg mỗi
ngảy trong khi dùng kết hợp. Trong cảc trường hợp nảy nện theo dõi chặt ohê các tác dụng
không mong muốn. vả có thể cân nhắc giảm liều thêm nếu quan sát thấy cảc tác dụng
không mong muốn có khả năng Iiện quan đến thuốc.
Nèn tránh kết hợp với cảc thuốc ức chế mạnh P-gp hoặc BCRP, hoặc khuyến cảo iựa chọn
một thuộc thay thể dùng động thời không có hoặc có khả năng ức chế ỉt nhắt P-gp hoác
BCRP.
Cảo thuốc cảm ứng CYP3A4, P-gp, BCRP:
Cảo thuốc cảm ứng CYP3A4 như rifampin 00 thế lảm giảm nồng độ pazopanib trong huyết
tương. Dùng đồng thời pazopanib với cảc thuốc oảm ứng mạnh P-gp hoặc BCRP có thể
Iảm thay đỗi sự phơi nhiễm và phân bố của pazopanib, bao gồm cả sự phân bộ tới hệ thần
kinh trung ương (CNS). Khuyển các lựa chọn một thuốc thay thể dùng đồng thời khộng có
hoặc có khả năng cảm ứng ít nhất với enzyme hoặc chắt vận chuyến.
Ảnh hưởng của pazopanib lên các thuốc khác
Các nghiên cứu in vitro trện các microsome gan người đã cho thấy pazopanib có tảo dụng
ức ohê các CYP enzyme 1A2, 3A4, 2E36, 208, 269, 2019, vả 2E1. Tác dụng gây cảm ứng
tiềm tảng trện CYP3A4 ở người đã được chứng minh trong một thử nghiệm PXR in vitro ở
người. Các nghiên cứu dược lý học lâm sảng, sử dụng VOTRIENT 800 mg một lần ỗi
ngảy, đả oho thảy rằng pazopanib khỏng có ảnh hưởng liên quan trện lâm Sảng về ợ
động học của caffeine (cơ chất thăm dò của CYP1A2), warfarin (cơ chất thăm dò của
CYP2CS), hoặc omeprazoie (cơ chắt thăm dò của CYP2C19) & các bệnh nhân ung thư.
8
/
Pazopanib lảm tảng khoảng 30 % giá trị trung binh của AUC vả C,… của midazoiam (cơ
chất thăm dò của CYP3A4) vả iảm tảng 33% đền 64% tỉ lệ nồng độ dextrometrophan trên
dextrorphan trong nước tiểu sau khi uống dextromethorphan (cơ chẩt thám dò của
cvpzoộ). Sử dụng động thời VOTRIENT 800 mg một lần mỗi ngảy vả pactitaxei 80 mglm²
(cơ chẩt của CYP3A4 vả CYP2C8) một lần mỗi tuần dẫn đến tảng trung binh tương ứng
25% và 31% giá trị AUC vả Cmax của paclitaxel.
Dựa trên các giá trị le0 in vitro vả C,nax trong huyết tương in vt'vo, các chắt chuyến hóa của
pazopanib GSK1268992 vả GSK1268997 có thể góp phần vảo tảo dụng ữc chế thực của
pazopanib đối với BCRP. Hớn nữa, không thể loại trừ việc pazopanib ức chế BCRP vả P-gp
trèn đường tiêu hóa. Cần thận trọng khi dùng đồng thời pazopanib với cảc cơ chắt BCRP vả
P-gp đường uống khác.
in w'tro, pazopanib ức chế polypeptide vặn chuyến anion hữu oơ ở người (OATP1B1).
Khóng thể Ioại trừ pazopanib sẽ ảnh hưởng đến dược động học của các cơ chắt của
OATP1B1 (ví dụ cảc statin, xem mục “Ảnh huớng khi sử ơụng đồng thớt" VOTRIENT vá
Simvastatt'n" dưới đây).
Pazopanib iả chắt ức chế enzyme uridine diphosphoqucuronosyl-transferase 1A1
(UGT1A1) in vitro. Chắt chuyến hóa có hoạt tinh của irinotecan, SN-38, lả một cơ chất của
OATPtB1 vả UGT1A1. Dùng đồng thời pazopanib 400mg một lần mỗi ngảy với cetuximab
250 mg/m2 vả irinotecan 150 mglm²dẫn tới tăng khoảng 20% phơi nhiễm toản thân với SN-
38. Pazopanib có thể có ảnh hưởng nhiều hơn tới sự sắp xép SN-38 ở cảc đối tượng có
UGT1A1*28 đa hinh so với cảc đối tượng có kiều allen thể tự nhiên. Tuy nhiên kiễu gen
UGT1A1 khỏng phải lúc nảo cũng dự đoản được ảnh hưởng của pazopanib lện sự sắp xếp
SN-38. Thận trọng khi dùng pazopanib cùng với các cơ chắt của UGT1A1.
Ảnh hưởng khi sử dụng đổng thời VOTRIENT vả simvastatin
Dùng đồng thời VOTRIENT vả simvastatin iâm gia tăng tỷ lệ tăng ALT. Két quả từ một phân
tích gộp sử dụng dữ Iiệu từ cảm thử nghiệm lâm Sảng với VOTRIENT oho thảy ALT>3 lần
ULN đã được báo cáo ở 126/895 (14%) bệnh nhân không dùng oác statin, so với 11141
(27%) bệnh nhân dùng đồng thời với simvastatin (p=0,038). Nếu bệnh nhân dùng đồng thời
simvastatin có xuất hiện tăng ALT, cần tuân theo cảc hướng dẫn về cách dùng VOTRIENT
vả ngưng dùng simvastatin (xem mục Cânh báo và thận trọng). Thêm vảo đó, cần thận
trong khi dùng động thời VOTRIENT với các statin khác do không đủ đữ liệu để đánh giá
ảnh hưởng của các thuốc nảy đối với mức ALT. Không thể loại trừ rằng VOTRIENT sẽ ảnh
hưởng đén dược động học của các statin khảo (ví dụ, atorvastatin, fiuvastatin, pravastatin,
rosuvastatin).
Ảnh hưởng của thức ăn đối với VOTRIENT
Sử dụng VOTRIENT cùng với các bữa ăn nhiều hoặc ít chảt béo dẫn đén lảm tâng khoảng
2 lần giá trị AUC vả c…. Vì thế, VOTRIENT phải được sử dụng ít nhắt 1 giờ trước bữa ăn
hoặc 2 giờ sau bữa ăn.
Các thuốc lảm tảng pH dạ dảy
Sử dụng đồng thới VOTRIENT với esomeprazole lảm giảm sinh khả dụng của pazềgẫh
khoảng 40% (AUC vả C…), và nẻn tránh dùng đồng thời VOTRIENT với cảc thuốc tăng pH
9
dạ dảy. Nếu việc dùng kết hợp với thuốc ức chế bơm proton (PPI) lả cần thiết về mặt y
khoa, khuyến cáo dùng liều VOTRIENT một lần mỗi ngảy không cùng thức ản vả vảo buổi
tội động thời với thuộc PPI. Nếu việc dùng đồng thời với thuộc kháng thụ thể t-i2 lả cần thiết
về mặt y khoa, nên dùng VOTRIENT không cùng thức ăn ít nhất 2 giờ trước hoặc ít nhắt 10
giờ sau khi dùng liều thuộc kháng thụ thể Hz. Nên dùng VOTRIENT it nhắt 1 giờ trước khi
vả 2 giờ sau khi dùng thuộc kháng acid tác dụng ngắn hạn. Khuyến cáo dùng động thới với
các thuốc PPI vả thuốc kháng thụ thể H2 như thế nảo sẽ dựa trèn cảc xem xét về sinh lý
hoc.
THỜI KỸ MANG THAI vÀ cno con BỦ
Khả năng sinh sản
VOTRIENT có thế Iảm suy giảm khá nặng sinh sản trên cả nam và nữ. Trong các nghiên
oứu về độc tinh sinh sản trẻn giống cải ở Ioải chuột, đã cho thấy khả năng sinh sản bị suy
giảm (xem phản Dữtt'ệu An toản tiền iâm sảng).
Thời kỳ mang thai
Không có đủ dữ liệu từ việc sử dụng VOTRIENT ở phụ nữ mang thai. Các nghiên oứu trên
động vật cho thắy thuốc oó độc tinh trên sinh sản (xem phần Dữh'ệu an toản tiền iâm sảng).
Nguy cơ tiềm tảng trèn người chưa được xác định. Không được sử dụng VOTRIENT trong
thời kỳ mang thai trừ khi tinh trạng lâm sảng của người bệnh đòi hỏi phải sử dụng
VOTRIENT để điều trị. Nếu VOTRIENT được sử dụng trong thời kỳ mang thai, hoặc nếu
bệnh nhản có thai khi đang sử dụng VOTRIENT, cản phải giải thich cho bệnh nhản về mối
nguy hại tiềm tảng đối với thai.
Phụ nữ có khả năng mang thai cần được khuyên sữ dụng biện pháp ngừa thai thich hợp
trong quá trinh điều trị vả 2 tuần sau khi ngừng điều trị bằng VOTRIENT và phải tránh có
thai trong khi được điều trị với VOTRIENT (xem mục Cảnh báo vả Thận trọng).
Cho con bú
Tính an toản khi sử dụng VOTRIENT trong thời kỳ cho con bú chưa được xác định. Hiện
không biết pazopanib có bải tiết qua sữa mẹ khộng. Nên ngừng cho con bú bằng sữa mẹ
trong khi điều trị với VOTRIENT.
KHẢ NĂNG THỰC HIỆN cÁc NHIỆM vụ CẦN có sự PHÁN ĐOÁN, cÁc KỸ NĂNG
NHẬN THỨC HOẶC VẬN ĐỘNG
Không có nghiên cứu nảo xảo định tác dụng oùa VOTRIENT trên việc lái xe hoặc khả năng
vận hảnh máy móc. Tác động có hại trện những hoạt động như thế khỏng thể lường trước
được dựa vảo tính chất dược lý của paz0panib. Phải lưu ý đến tinh trạng lâm sảng của
bệnh nhân và hồ sơ biến có bắt lợi của VOTRIENT khi xem xét khả năng cùa bệnh nhân
trong việc thực hiện các nhiệm vụ đòi hòi sự phán đoán, cảc kỹ nảng vận động hoặc nhận
thức.
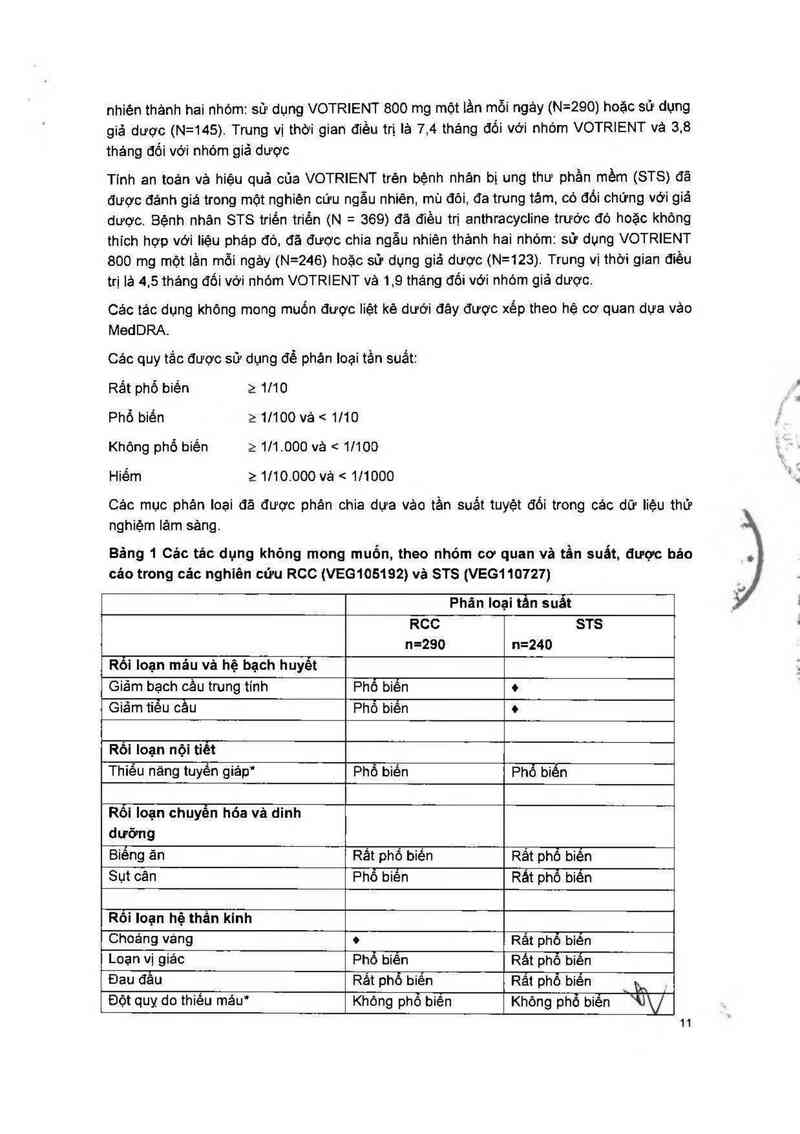
TÁC DỤNG KHÔNG MONG MUỐN
Tính an toản vả hiệu quả của VOTRIENT trẻn bệnh nhân bị ung thư biền mộ tếan
(RCC) đã được đánh giá trong một nghiên cứu ngẫu nhiên, mù đỏi, đa trung tâm, đối
chứng với giả dược. Các bệnh nhân RCC tiên triển tại chỗ vảlhoặc di cản được chia ngẫu
10
nhiên thảnh hai nhộm: sữ dụng VOTRIENT 800 mg một tần mỗi ngảy (N=290) hoặc sử dụng
giá dược (N=145). Trung vị thời gian điều trị là 7,4 thảng đối với nhóm VOTRIENT vả 3,8
tháng đối với nhỏm giả dược
Tinh an toản vả hiệu quả của VOTRIENT trẻn bệnh nhân bị ung thư phần mềm (STS) đã
được đánh giá trong một nghiên cứu ngẫu nhiên, mù đôi, đa trung tảm, có đối chứng với giả
dược. Bệnh nhãn STS triến triến (N = 369) đã điều trị anthracycline trước đó hoặc không
thích hợp với Iiệu pháp đó. đã được chia ngẫu nhiên thảnh hai nhóm: sử dụng VOTRIENT
000 mg một lần mỗi ngảy (N=246) hoặc sử dụng giá được (N=123). Trung vị thới gian điều
trị iả 4,5 thảng đối với nhóm VOTRIENT và 1,9 thảng đối với nhóm giả dược.
Các tác dụng khộng mong muốn được liệt kê dưới đây được xếp theo hệ cơ quan dựa vảo
MedDRA.
Các quy tắc được sử dụng để phản loại tần suất:
Rất phộ biến 2 1110
Phổ biến 211100 vả < 1110
Không phổ biến 2 111.000 vả < 11100
Hiếm 21110.000 vả < 111000
Các mục phản Ioại đă được phân chia dưa vảo tần suất tuyệt đối trong các dữ liệu thử
nghiệm lâm sảng.
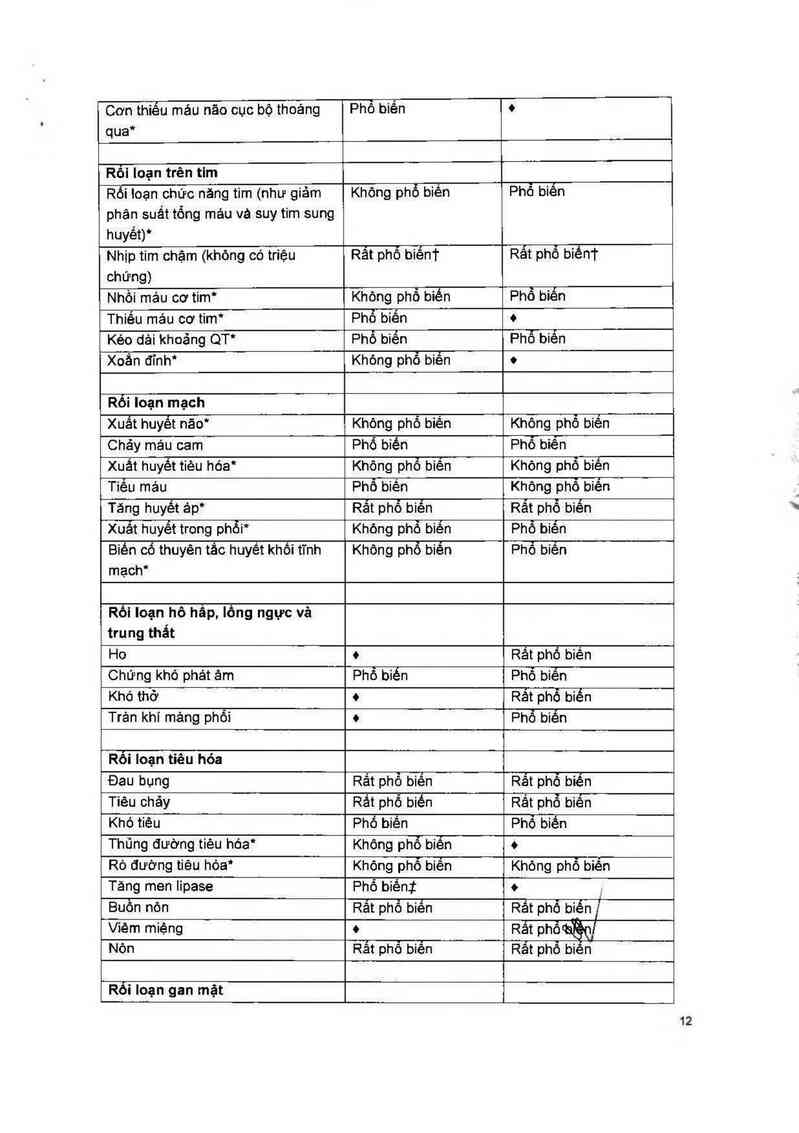
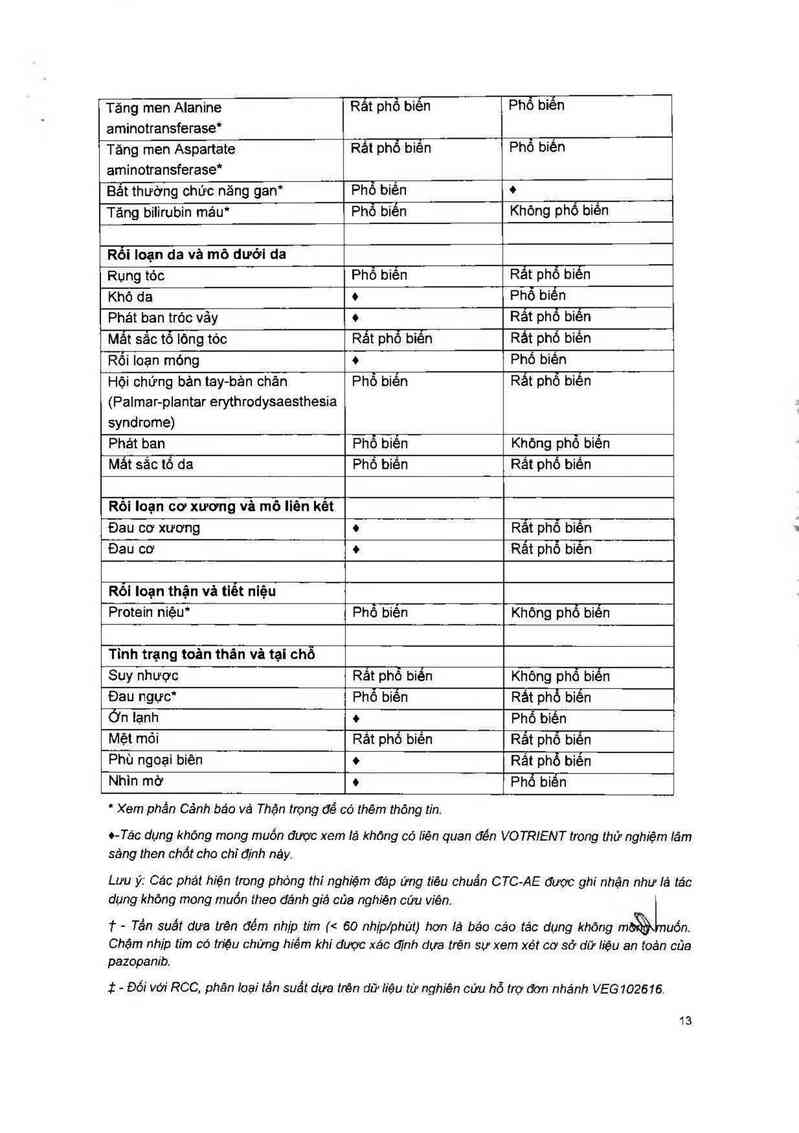
Bảng 1 Các tác dụng không mong muốn, theo nhóm cơ quan và tần suất, được báo
cáo trong các nghiên cứu RCC (VEG105192) vả STS (VEG110727)
Phân loại tán suất
Rcc srs
n=290 n=240
Rối Ioạn máu vả hệ bạch huyết
Giảm bạch oầu trung tính Phổ biền
Giảm tiệu câu Phổ biến
Rối loạn nội tiết
Thiều năng tuyên giản“ Phổ biên Phổ biến
Rôi loạn chuyền hóa và dinh
dưỡng
Biếng ăn Rắt phố biền Rất phổ biến
Sụt cân Phổ biến Rải phổ biến
Rôi Ioạn hệ thẩn kinh
Choáng váng o Rắt phổ biến
Loạn vị giác Phổ biến Rât phổ biến
Đau đâu Rắt phổ biến Rắt phộ biến , t… ,
Đột quy do thiêu mảu" Không phộ biên Khỏng phổ biến `UV
11
Cơn thiếu máu nảo cục bộ thoảng Phổ biến 0
qua*
Rối Ioạn trên tim
Rỏi ioạn chức năng tim (như giảm Khỏng phố biên Phò biên
phân suất tống mảu vá suy tim sung
huyết)*
Nhịp tim chậm (không có triệu Rất phố biến'l' Rẩt phổ biênT
chứng)
Nhồi máu cơ tim* Không phổ biến Phổ biến
Thiếu mảu cơ tim* Phổ biến ›
Kéo dải khoảng QT* Phổ biến Phộbiẻn
Xoắn đỉnh* Không phổ biên 0
Rối loạn mạch
Xuât huyết nảo"
Không phố biên
Khỏng phổ biến
Chảy máu cam Phổ biền Phộbiăi
Xuất huyềt tiệu hđa* Không phổ biến Không phố biên
Tiều máu Phổ biến Không phổ biến
Tăng huyêt ảp~ Rắt phổ biến Rẩt phổ biến
xỉắt huyết trong phổi* Không phổ biến Phổ biển
Biên cố thuyên tắc huyềt khối tĩnh Không phổ biến PỔ biên
mạch“
Rối loạn hô hẩp, lống ngực vả
trung thắt
Ho ơ Rắt phố biên
Chứng khó phảt ảm Phổ biến Phổ biềỉ
Khó thờ 4 Rắt phổ biến
Trản khi mảng phối 0 Phó biên
Rối loạn tiêu hóa
Đau bụng Rắt phổ biến Rảt pho biên
Tiêu chảy Rảt phố biên Rất phổ biếĨt
Khó tiêu Phố biên Phổ biến
Thủng đường tiêu hóa“ Không piTộ biễỉ ›
Ro đường tiêu hỏa* Không pffl biến Không phổ biến
Tăng men lipase Phố biẻnị o
Buôn nòn Rât phô biên Rắt phổ biénf
Viêm miệng › Rắt phộđaỀglj
Nỏn Rất phổ biến Rẩt phổ biến
Rối loạn gan mật
12
Tăng men Alanine Rất phổ biến Phổ biến
aminotransferase"
Tăng men Aspartate Rất phổ biến Phổ biến
aminotransferase"
Bảt thường chức năng gan* Phổ biến o
Tảng bilirubin máu* Phổ biến Không phố biên
Rối loạn da và mô dưới da
Rung tỏc Phổ biến Rẳt phộ biễn
Khô da Phổ biến
Phát ban tróc vảy Rắt phổ biến
Mảt săc tô iông tóc Rảt phổ biến Rảt phổ biến
Rối loạn móng 0 Phố biên
Hội chứng bản tay-bản ohân Phổ biến Rắt phộ biễn
(Palmar-plantar erythrodysaesthesia
syndrome)
Phát ban Phố bien Khộng phổ biẻn
Mảt sắc tố da Phố biên Rắt phố biền
Rõi Ioạn cơ xương và mô Iièn kết—
Đau cơ xương Rãt phỗbĨễh
Đau cơ 0 Rât phộ biễn
Rói loạn thận vả tiểt niệu
Protein niệu* Phổ biến Không phổ biến
Tỉnh trạng toản thân vả tại chỗ
Suy nhược Rắt phổ biến Không phổ biến
Đau ngực* Phổ biên Rẩt phổ biến
Ớn lạnh 0 Phổ biến
Mệt mỏi Rât phố biền Rắt phổ biền
Phù ngoại biên o Rất phổ biến
Nhìn mờ 0 Phổ biến
* Xem phần Cảnh báo vá Thận trọng để có thêm thông tin.
o- Tác đụng khóng mong muốn được xem tả khỏng có iiẻn quan đến VO TRIENT trong thử nghiệm tâm
sảng then chốt cho chỉ định náy,
Lưu ý: Các phát hiện trong phòng thíngh1'ệm đáp ửng tiêu chuẩn CTC-AE được ghi nhận như iá tác
dụng không mong muốn theo đánh giá cùa nghiên cứu v1'én. Im
uốn.
† - Tần suất ơưa trẻn đếm nhịp tim (< 60 nhịplphút) hơn hả báo các tác dụng khõng mổ
Chậm nhip tim có tn'ệu chứng hiếm khi đuợc xác đĩnh dựa trén sự xem xét cơ sở dữ iiệu an toán của
pazopanib.
I — Đỏt' với RCC, phân toại tần suất dựa trên ơữ iiệu từ nghiên cứu hỗ trợ đơn nhánh VE6102616.
13
Giảm bạch cầu. giảm tiểu cằu vả hội ohứng bản tay - bản ohân đã được quan sảt thường
xuyên hơn ở những bệnh nhãn có nguồn gốc Đông Á.
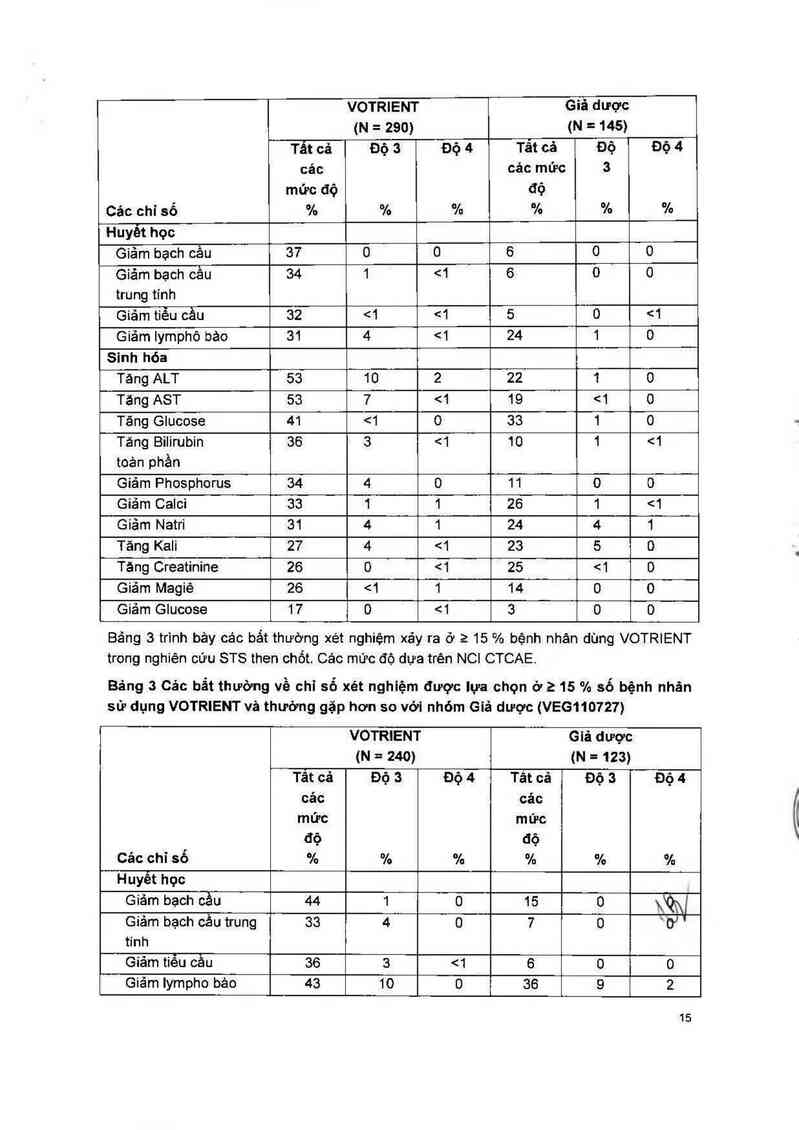
Bảng 2 trinh bảy cáo bắt thường về xét nghiệm xảy ra ở 215% bệnh nhân dùng
VOTRIENT trong các nghiện cứu RCC then chốt. Các mức độ dựa trên NCI CTCAE.
. , , . /
Bảng 2 Các bảt thường vẻ chỉ sỏ xét nghiệm được lựa chọn ở 2 1ã`C sỏ/bệnh nhán
sử dụng VOTRIENT và thường gặp hơn so với nhóm Giả dược (VEG1 2).
14
VOTRIENT Giả dược
(N = 290) (N = 145)
Tất cả Độ 3 Độ 4 Tẩt cả Độ Độ 4
cảc các mức 3
mữc độ độ
Các chỉ số % % % % % %
Huyết học
Giảm bạch cầu 37 0 0 6 0 0
Giảm bạch cầu 34 1 <1 6 0 0
trung tính
Giảm tiều cầu 32 <1 <1 5 0 <1
Giảm lymphô bảo 31 4 <1 24 1 0
Sinh hóa
Tảng ALT 53 10 2 22 1 0
Tảng AST 53 7 <1 19 <1 0
Tăng Glucose 41 <1 0 33 1 0
Tăng Bilirubin 36 3 <1 10 1 <1
toản phần
Giảm Phosphorus 34 4 0 11 0 0
Giảm Calci 33 1 1 26 1 <1
Giảm Natri 31 4 1 24 4 1
Tăng Kali 27 4 <1 23 5 0
Tảng Creatinỉne 26 0 <1 25 <1 0
Giảm Magiệ 26 <1 1 14 0 0
Giâm Glucose 17 0 <1 3 0 0
Bảng 3 trinh bảy cảc bắt thường xét nghiệm xảy ra ở 2 15 % bệnh nhân dùng VOTRIENT
trong nghiên cứu STS then chốt. Các mữc độ dựa trên NCI CTCAE.
Bảng 3 Cảo bẳt thường về chỉ số xét nghiệm được lựa chọn ở a 15 % số bệnh nhân
sử dụng VOTRIENT và thường gặp hơn so với nhóm Giả dược (VE6110727)
VOTRIENT Giả dược
(N = 240) (N = 123)
Tât cả Độ 3 Độ 4 Tât cả Độ 3 Độ 4
các cảc
mức mức
độ độ
Các chỉ số % % % % % %
Huyêt học
Giảm bạch cầu 44 1 0 15 0 `Ổhi
Giảm bạch cảu trung 33 4 0 7 0 ` 0" '
tính
Giảm tiểu cầu 36 3 <1 6 0 0
Giảm lympho bảo 43 10 0 36 9 2
Thiếu máu 27 5 2 23 <1 <1
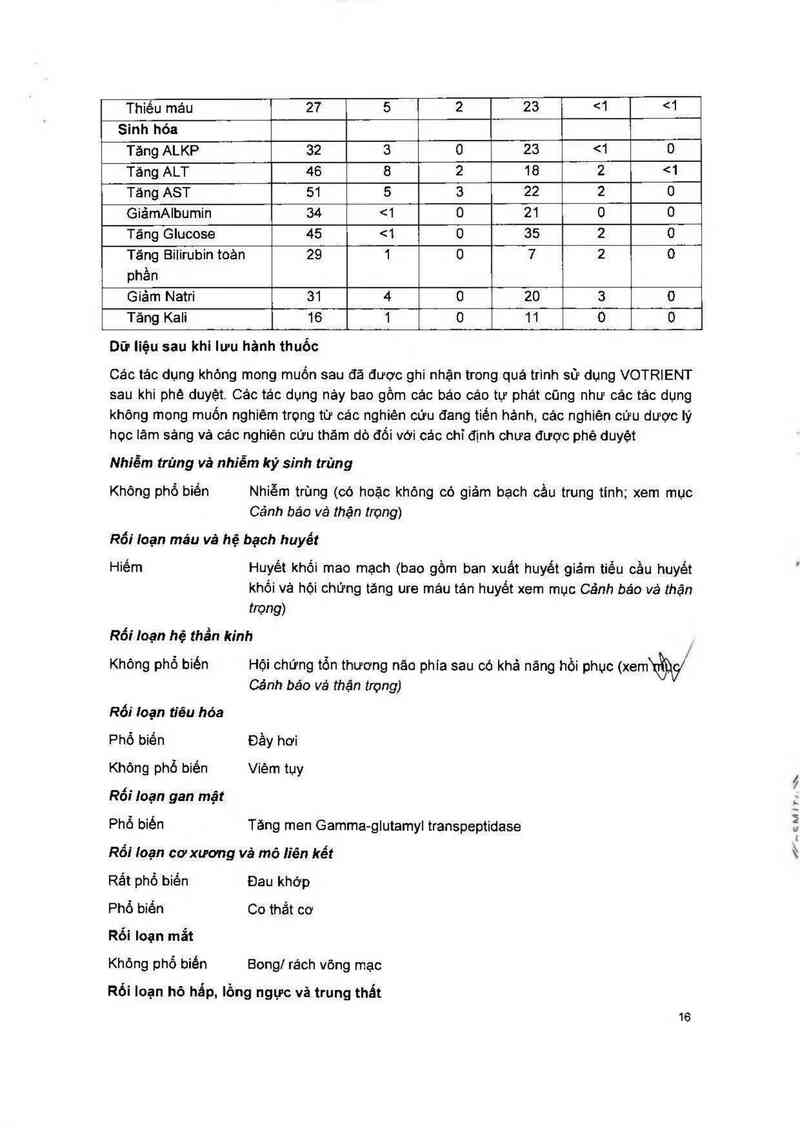
Sinh hóa
Tăng ALKP 32 3 0 23 <1 0
Tảng ALT 46 8 2 18 2 <1
Tăng AST 51 5 3 22 2 0
GiảmAlbumin 34 <1 0 21 0 0
Tảng Glucose 45 <1 0 35 2 0
Tăng Bilirubin toản 29 1 0 7 2 0
phần
Giám Natri 81 4 0 20 3 0
Tăng Kali 16 1 0 11 0 O
Dữ liệu sau khi lưu hânh thuốc
Cảo tảo dụng không mong muốn sau đã được ghi nhận trong quá trình sử dụng VOTRIENT
sau khi phê duyệt. Cảo tác dụng nây bao gồm các báo oảc tự phát cũng như cảc tác dụng
không mong muốn nghiêm trọng từ các nghiên cứu đang tiên hảnh, các nghiên cữu dược lý
học lâm sảng vả các nghiên cứu thăm dò đối với cảc chỉ định chưa được phê duyệt
Nhiễm trùng vả nhiễm ký sinh trùn g
Không phố biền Nhiễm trùng (có hoặc không có giảm bạch cầu trung tính; xem mục
Cảnh báo vè thận trọng)
Rối Ioạn mảu vả hệ bạch huyết
Hiếm Huyết khối mao mạch (bao gồm ban xuất huyết giảm tiểu oầu huyết
khối vả hội chững tăng ure máu tản huyết xem mục Cảnh báo va` thận
ttong)
Rối ioạn hệ thẩn kinh
. - . /
Khộng phô biến Hội chứng tỏn thương nâo phia sau có khả năng hôi phục (xemử
Cánh báo vá thận trỌng)
Rối loạn tiêu hóa
Phổ biến Đầy hơi
Không phổ biến Viêm tụy
Rối !oạn gan mật
Phổ biến Tăng men Gamma-glutamyl transpeptidase
Rối Ioạn cơ xương vá mô liên kết
Rắt phộ biền Đau khớp
Phổ biến Co thắt cơ
Rối loạn mắt
Không phố biền Bong] rách võng mạc
Rối loạn hô hẩp, lồng ngực vả trung thất
16
//…Qerv \\
Hiếm gặp Bệnh phổi kèl Việm phội (xem mục Cánh báo vả thận trọng)
Thông báo cho bảo sỹ những tảo dụng không mong muốn gặp phải khi dùng thuốc.
QUÁ LIỂU
VOTRIENT với liều tên tới 2000 mg đă được nghiện cứu trong oảc thử nghiệm lâm sảng.
Mệt mỏi độ 3 (độc tinh gây giới hạn iìều) vả tăng huyết ảp độ 3, mỗi biẻu hiện đã được ghi
nhận ở 1 trong 3 bệnh nhản sữ dụng lièu 2000 mg vả 1000 mg hảng ngảy theo thứ tự tương
ứng.
Cảo triệu ohứng vả dẩu hiệu
Hiện nay mới chỉ có kinh nghiệm hạn chế về quá Iiều của VOTRIENT.
Điều trị
Xử lý tiếp theo phải theo chỉ định lảm sảng hoặc theo các khuyến cảo cùa Trung tảm chống
độc quốc gia, nếu có. Thấm tách máu không được cho rằng sẽ Iảm tăng sự thải trữ của
pazopanib vi pazopanib bải tiết qua thận không đáng kể vả do thuốc gắn kết cao với protein
huyết tương.
oược LÝ HỌC LÀM SÀNG
Dược lực học
Mã ATC
Nhóm dược trị Iiệu: Cáctác nhân chống ung thư - Tảo nhân ức chế men Protein kinase, mã
ATC: LO1XE11.
Cơ chế tác dụng
VOTRIENT được sử dụng theo đường uống, lả tác nhân ức chế hiệu quả men tyrosine
kinase (TK!) tai nhiều điếm đích của các thụ thế yếu tố tăng trướng nội mạc mạch máu
(VEGFRM, -2, và -3, yếu tố tãng trưởng có nguồn gốc tiếu oầu (PDGFR)-ct vả -[3, vả thụ
thế yếu tố tế bảo gốc (c-KIT), với ca'c giá trị ICso iần lượt tương ứng lả 10, 30, 47. 71, 84 vá
74 nM. Trong cảo thử nghiệm tiền lâm sảng, pazopanib ức chế một cảch phụ thuộc vảo liều
dùng trện quá trình phosphoryl hóa tự động cảm ứng bởi các gốc kết hợp trện các thụ thể
VEGFR-2, c-Kit vả PDGFR-B trong các tế bảo. … vivo, pazopanib ữc chê quá trình
phosphoryl hóa VEGFR—2 cảm ứng bởi VEGF ớ phổi chuột nhắt, sự hình thảnh mạch ở
nhiều mô hinh thừ trện các lcải động vật khác nhau, vả sự tăng trưởng của khối u từ người
được ghép dị chủng trện chuột nhắt.
Dược động họcTrong một phản tích di truyền - dược học tổng hợp từ 31 nghiên cứu lâm
sảng về VOTRIENT sữ dụng đơn độc hay phối hợp với cảc thuộc khảo, ALT › 5 lần LN
(NCI CTC mức 3) xảy ra ở 19% các bệnh nhân mang allel HLA-B’57zo1 vả 10% vợt '
bệnh nhân không mang allel nảy. Trong dữ liệu nảy, 133/2235 (6%) các bệnh nhân mang
allel HLA-B'ST:O1 (Xem Cảnh báo và thận t1ong).
Hấp thu
Sau khi dùng đường uống liều đơn VOTRIENT 800mg cho những bệnh nhân có các khối u
đặc, trung vị thời gian đạt nồng độ đĩnh trong huyết tượng (cm) khoảng 19 $ 13 ug/ml iả
17
//Ịfcở/`\HTI\\
3,5 giờ (khoảng 1,0-11,9 giờ) vả đạt được AUC… khoảng 650 1 500 pg.giờlml. Liều dùng
hảng ngảy Ièm tăng AUC… từ 1,23 đền 4 lần.
AUC vả Cmax khỏng tảng nhắt quản khi táng liều dùng VOTRIENT trên 800 mg.
Phơi nhiễm toản thăn đội với pazopanib tăng Iện khi uống thuộc cùng với thức ăn. Sử dụng
VOTRIENT cùng với bữa ản nhiều hoặc ít chắt béo dẫn đến Iảm tăng giá trị AUC vả Cmaxlên
khoảng 2 !ần. tn thế, VOTRIENT phải được sử dụng it nhất 2 giờ sau bữa ăn hoặc 1 giờ
trước bữa ản (xem phần Liều dùng vá Cách dùng).
Uống một liều viện nén VOTRIENT 400 mg đã được nghiền nảt Iảm tăng Aucmz, thêm
46% và tãng Cmax khoáng gắp 2 lần vả lảm giảm t,… khoảng 2 giờ so với uống nguyên cả
viện nén. Kết quả nảy cho thắy sinh khả dụng và tỉ lệ hắp thu pazopanib theo đường uống
tăng lện khi uống viên nén đã được nghiền so với uống nguyên cả viên nẻn (xem phần Liều
dùng và Cách dùng).
Phản bố
In vivo, pazopanib gắn với protein huyết tương của người trèn 99 % khộng phụ thuộc nồng
độ trong khoảng 10—100 ụglmi. Các nghiên cứu in vitro gợi ý rằng pazopanib lả cơ chắt của
P-gp vả BCRP.
Chuyển hóa
Cảo kết quả từ cảc nghiên cứu in v1'tro cho thắy rằng quá trinh chuyến hóa cũa pazopanib
chủ yếu qua trung gian CYP3A4, và một phần nhỏ qua CYP1A2 vả CYPZCB. Bốn chắt
chuyến hóa gốc của pazopanib chỉ chiếm 6% phơi nhiễm trong huyết tương. Một trong số
các chắt chuyền hóa nèy ức chế sự phảt triến của các tế bảo nội mô tĩnh mạch rốn người
được VEGF kỉch hoạt với cùng hiệu lực như pazopanib, các chẳt chuyền hóa khác có hoạt
tính kèm hơn 10-20 lần. Vì thế, tác dụng cũa pazopanib phụ thuộc chủ yếu vảo phới nhiễm
với pazopanib gốc.
Thảỉ trừ
Pazopanib được thải trữ chậm với thời gian bán thải trung binh là 30.9 giờ sau khi sử dụng
liều khuyến cảo 800 mg. Thuốc thải trừ chủ yếu qua phân với thải trừ qua thặn ohiếm < 4 %
của liều đã sử dụng.
Cảo đối tượng đặc biệt
Suv thản
Các kết quả cho thấy dưới 4% tiều uống pazopanib được thải trữ trong nước tiều dưới dạn
pazopanib vả chắt chuyển hộa Các kết quả từ mô hinh được động học quần thể (dữ iiệuư `
các đối tượng có các giá trị CLCR ban đầu khoảng từ 30,8 mllphút đến 150 mllptịụV 1140
thấy rằng suy thận dường như khộng 00 ảnh hưởng Iiện quan trẻn lâm sảng về dược động
học cũa pazopanib. Không cần chỉnh liều cho bệnh nhân có độ thanh thải creatinine trện
30mllphút. Nện thận trọng với những bệnh nhân có độ thanh thải creatinine dưới 30 mllphủt
do khộng có kinh nghiệm sử dụng pazopanib ở nhóm bệnh nhân nảy (xem phần Liều dùng
vải oa'ch dùng).
Suv oan
18
l \'1 \\
Il \:l—I
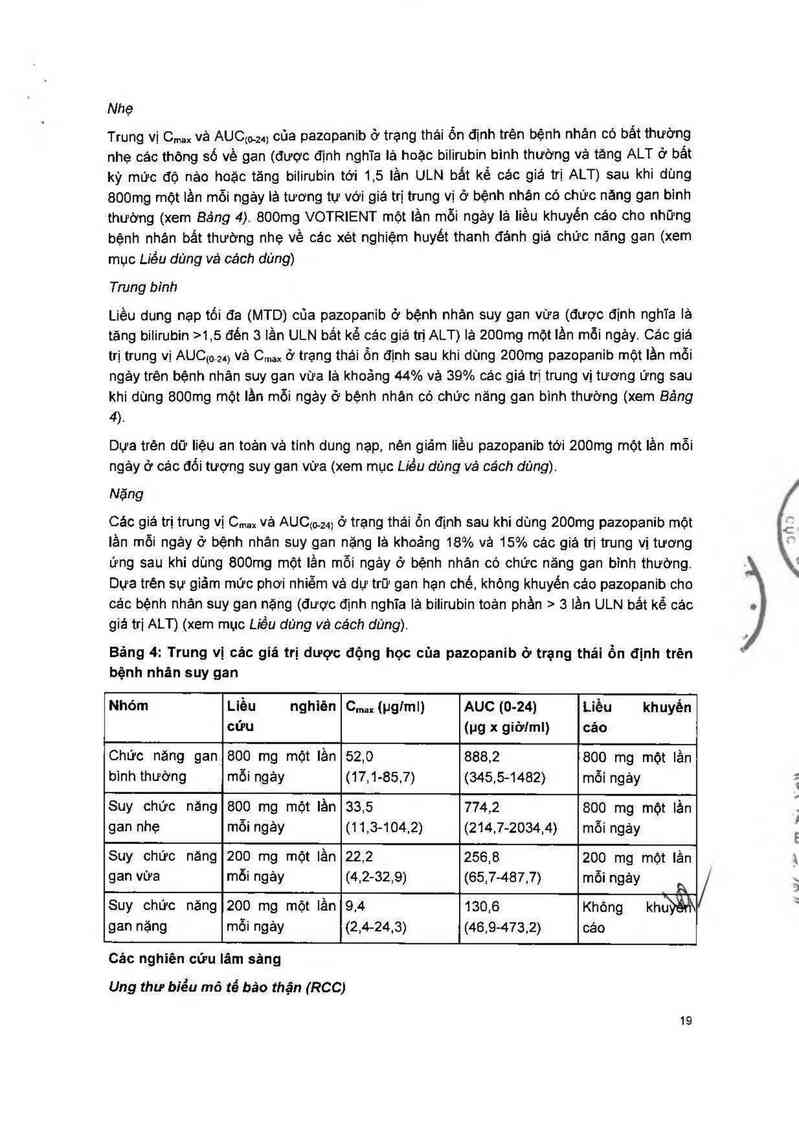
Nhẹ
Trung vị C,… và AUCto.zq của pazopanib ở trạng thái ốn định trên bệnh nhân oỏ bắt thường
nhẹ oác thông số về gan (được định nghĩa lá hoặc bilirubin bình thường vả tăng ALT ở bắt
kỳ mữc độ nảo hoặc tăng bilirubin tới 1,5 lần ULN bắt kế các giá trị ALT) sau khi dùng
800mg một lần mỗi ngảy iả tương tự với giá trị trung vị ở bệnh nhảm 00 chức năng gan binh
thướng (xem Bảng 4). 800mg VOTRIENT một lần mỗi ngảy là liều khuyến cáo oho những
bệnh nhán bắt thường nhẹ về cảc xét nghiệm huyết thanh đánh giá chữc năng gan (xem
mục Liều dùng và cách dùng)
Trung bình
Liều dung nạp tối đa (MTD) của pazopanib ở bệnh nhân suy gan vừa (được định nghĩa là
tăng bilirubin ›1,5 đến 3 lần ULN bắt kể cảo giá trị ALT) lả 200mg một lần mỗi ngảy. Các giá
trị trung vị AUCmM vả Cmax ở trạng thái ồn định sau khi dùng 200mg pazopanib một lần mỗi
ngảy trên bệnh nhân suy gan vừa lả khoảng 44% và 39% cảc giá trị trung vị tương ứng sau
khi dùng 800mg một lần mỗi ngảy ở bệnh nhán có chữc năng gan bình thường (xem Báng
4).
Dưa trện dữ liệu an toản và tính dung nạp, nẻn giảm Iiều pazopanib tới 200mg một lằn mỗi
ngây ở cảc đối tượng suy gan vừa (xem mục Liều dùng vả cách dùng).
Nặng
Các giá trị trung vị C…… vả AUCM4) ở trạng thải ổn định sau khi dùng 200mg pazopanib một
lần mỗi ngảy ở bệnh nhân suy gan nặng là khoảng 18% và 15% cảc giá trị trung vị tương
ứng sau khi dùng 800mg một lần mỗi ngảy ở bệnh nhân có chức năng gan bình thường.
Dựa trẻn sự giảm mức phơi nhiễm vả dự trữ gan hạn chế, không khuyến cáo pazopanib cho
các bệnh nhân suy gan nặng (được định nghĩa lả bilirubin toản phần > 3 lần ULN bắt kể cảo
giá trị ALT) (xem mục Liều dùng và cách dùng).
Bảng 4: Trung vị các giá trị dược động học cùa pazopanib ở trạng thái ồn định trên
bệnh nhản suy gan
Nhóm Liều nghiên C.…(pglml) AUC(O-24) Liều khuyến
cứu (pg x giờt'ml) cáo
Chức náng gan 800 mg một lần 52,0 888,2 800 mg một iần
binh thướng mỗi ngảy (17,1—85,7) (345,5-1482) mỗi ngảy
Suy chức năng 800 mg một lần 33,5 774,2 800 mg một lần
gan nhẹ mỗi ngảy (11,3-104,2) (214,7-2034,4) mỗi ngảy
Suy chức năng 200 mg một lần 22,2 256,8 200 mg một lần
gan vừa mỗi ngảy (4,2-32,9) (65,7-487,7) mỗi ngảy A
Suy chức nâng 200 mg một lần 9,4 130,6 Không khthẵẩ\
gan nặng mỗi ngảy (2,4-24,3) (46,9-473,2) cáo
Các nghiên cứu lâm sảng
Ung thư biểu mô tế bảo thận (RCC)
19
:
,
I
'
… ` .
U]
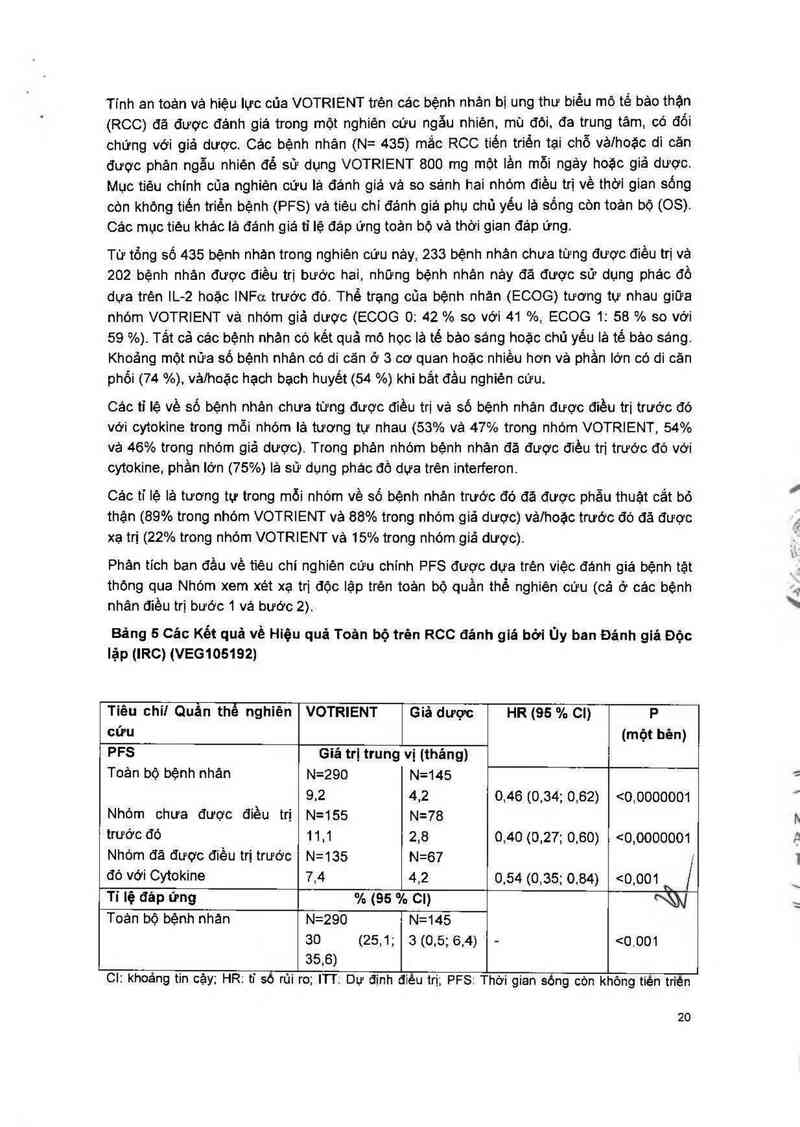
Tính an toản vả hiệu lưc của VOTRIENT trện các bệnh nhản bị ung thư biẻu mô tế bảo thận
(RCC) đă được đảnh giả trong một nghiên cứu ngẫu nhiện, mù đội, đa trung tâm, có đối
chứng với giả dược. Các bệnh nhân (N= 435) mắc RCC tiến triền tại chỗ vảlhoặc di căn
được phản ngẫu nhiên để sử dụng VOTRIENT 800 mg một lần mỗi ngảy hoặc giả dược.
Mục tiêu chính của nghiên cứu lá đánh giá vả so sánh hai nhóm điều trị về thời gian sống
còn khộng tiến triển bệnh (PFS) vả tiệu chi đánh giá phụ chủ yếu lả sống còn toản bộ (OS).
Các mục tiéu khảo lả đánh giá tỉ lệ đáp ứng toản bộ về thời gian đáp ứng.
Từ tổng số 435 bệnh nhản trong nghiền cứu nảy, 233 bệnh nhản chưa tững được điều trị vả
202 bệnh nhân được điều trị bước hai, những bệnh nhản nây đă được sử dụng phác đồ
dựa trện lL-2 hoặc lNFợ trước đỏ. Thể trạng của bệnh nhản (ECOG) tương tự nhau giữa
nhóm VOTRIENT vả nhóm giả dược (ECOG 0: 42 % so với 41 %, ECOG 1: 58 % so với
59 %). Tắt cả các bệnh nhản có kết quả mộ học là tế bảo sáng hoặc chủ yếu là tế bảo sáng.
Khoảng một nửa số bệnh nhân có di căn ở 3 cơ quan hoặc nhiều hơn vả phần lớn có di căn
phối (74 %), vả/hoặc hạch bạoh huyết (54 %) khi bắt đằu nghiên cứu.
Cảo tỉ iệ về số bệnh nhân chưa tững được điều trị vả số bệnh nhân được điều trị trước đó
với cytokine trong mỗi nhóm lả tương tự nhau (53% vả 47% trong nhóm VOTRIENT, 54%
vệ 46% trong nhóm giả dược). Trong phán nhóm bệnh nhân đã được điều trị trước đó với
cytokine, phần lớn (75%) là sử dụng phác đồ dưa trên interferon.
Cảo tỉ lệ lả tương tự trong mỗi nhóm về số bệnh nhân trước đó đã được phẫu thuật cắt bỏ
thặn (89% trong nhóm VOTRIENT vả 88% trong nhóm giả dược) vảlhoặc trước đó đã được
xạ trị (22% trong nhóm VOTRIENT về 15% trong nhỏm giả dược).
Phân tich ban đề… về tiêu chí nghiện cữu chính PFS được dựa trện việc đánh giá bệnh tặt
thộng qua Nhóm xem xét xạ trị độc lập trèn toản bộ quần thể nghiên cứu (cả ở cảo bệnh
nhân điều trị bước 1 vả bước 2).
Bảng 5 Các Kết quả về Hiệu quả Toản bộ trèn RCC đánh giá bời Ủy ban Đánh giá Độc
lặp (IRC) (VEG105192)
Tiêu chi! Quần thể nghiên VOTRIENT Giả dược HR (95 % Cl) P
cứu (một bèn)
PFS Giá trị trung vị (tháng)
Toản bộ bệnh nhân N=290 N=145
9,2 4,2 0,46 (0,34; 0,62) <0,0000001
Nhóm chưa được điều trị N=155 N=78
trước đó 11,1 2,8 0,40 (0,27; 0,60) <0,0000001
Nhóm đã được điều trị trước N=135 N=67 t
đó với Cytokine 7,4 4,2 0,54 (0,35; 0,84) <0,001 " /
Tỉ lệ đáp ứng % (95 % CI) W
Toản bộ bệnh nhản N=290 N=145
30 (25,1; 3 (0.5; 6,4) - <0.001
35,6)
CI: khoảng tin cặy; HR: ti sò rủi ro; ITT; Dự định điêu trị; PFS: Thời gian sòng còn không tiên triền
20
l-z`
\\
—n~127
(
bệnh.
Đối với cảc bệnh nhân đã đảp ứng với điều trị, trung vị oủa thời gian đáp ứng lả 58,7 tuần
theo đánh giá độc lập. Dữ liệu trung vị sổng còn toản bộ (08) ở đề cương có xác định phản
tích sổng còn cuối cùng là 22,9 thảng và 20,5 tháng [HR = 0,91 (95% CI: 0,71; 1,16; p =
0,224)] tương ứng đối với bệnh nhân được phân ngẫu nhién trong nhóm VOTRIENT và
nhóm giả dược. Các kết quả 08 có xu hướng thiện lệch vì 54% bệnh nhán trong nhóm giả
dược cũng dùng VOTRIENT trong phần nghiền cữu mở rộng sau khi bệnh tiến triền. Có
66% bệnh nhản nhỏm giả dược nhận trị Iiệu sau nghiên cứu so với 30% bệnh nhân nhóm
VOTRIENT.
Trong một nghiện cứu then chốt, các đánh giá về Chất lượng cuộc sống (QoL) được dựa
trên thang điềm tự báo cảo Iảm mù từ hai bảng cảu hỏi được thiết kế phù hợp theo đề
cương nghiền cữu, EORTC QLQ-C3O vả EuroQoL EQ-5D. Phản tích được dưa trện những
bệnh nhân tiếp tục được điều trị trong cả 2 nhóm, trước khi có tiến triền bệnh. Cảo đánh giá
đã cho thấy không có sự khác biệt giữa nhom được điều trị với VOTRIENT hoặc nhóm giả
dược (p > 0,05). điều nảy chỉ ra rằng khỏng có ảnh hướng tiêu cực cùa VOTRIENT trèn
Chảt lượng cuộc sống.
Trong một nghiên cứu Pha 2 trên 225 bệnh nhân ung thư biều mỏ tế bảo thận tế bảo sáng
tái phảt tại chỗ hoặc di căn, tỉ lệ đáp ứng là 35 % và trung vị thới gian đáp ững là 68 tuần
theo đánh giá độc lập.
Tính an toản, hiệu quả vả chất lượng cuộc sống cùa VOTRIENT so với sunitinib đă được
đánh giá trong một nghiền cứu không thua kém pha III ngẫu nhiện, nhăn mớ, nhóm song
song (VEG108844).
Trong nghiên cứu VEG108844, các bệnh nhãn (N=1110) ung thư biểu mô tế bảo thận
(RCC) tiền triền tại chỗ vảlhoăc di căn đã khộng dùng liệu pháp toản thân trước đó, được
cho dùng ngẫu nhiên VOTRIENT 800 mg một lần mỗi ngảy Iiện tục h0ặc sunitinib 50 mg một
lần mỗi ngảy theo chu kỳ 6 tuần trong đó 4 tuần điều trị theo sau 2 tuần không điều trị.
Mục tiêu chính của nghiền cứu nảy lá để đánh giá và so sánh PFS ở bệnh nhán được điều
trị với VOTRIENT với bệnh nhân được điều trị với sunitinib. Đặc điềm nhân khảu học lả
tương tự giữa hai nhóm điều trị. Đặc điềm bệnh tại thời điềm chẩn đoản ban đầu vả khi
sảng ioo lả cản bằng giữa hai nhóm điẻu trị với phần iớn bệnh nhân có mộ học lả tế bảo
sáng vả bệnh ở giai đoạn IV.
Nghiện cứu VEG108844 đã đạt tiệu ohi ohinh cùa nó về PFS vả cho thắy VOTRIENT khỏng
thua kém so với sunitinib, độ giới hạn trện của 95% 01 đối với tỉ sộ rùi ro lả thắp hơn giới
hạn khỏng thua kém xác định theo đề cương lả 1,25. Các kết quả về hỉệu quả toản bộ được
tổng kết trong Bảng 6.
Bảng 6: Các kết quả về Hiệu quả toản bộ (VEG108844)
Tiêu chí VOTRIENT Sunitinib HR
N=557 N=553 (95 % Cl) h \/
PFS \
Toản bộ
21
Trung vị (thảng) 8,4 9,5
(95 % 01) (8,3; 10.9) (8.3; 11.0)
1,047
(0,898;1,220)
Sông còn toản bộ
Trung vị (tháng) 28,3 29,1
(95 % 01) 26,0; 35,5) (25,4; 33,1)
0,915a
(0.786; 1.065)
HR = Tỉ số rùi ro; ITT`: Dự định điều trị; PFS: Thời gian sống còn không tiền triển bệnh dựa trẻn đánh
giá cùa Ủy ban đánh giá độc lặp (IRC).
²Giá trị P = 0,245 (2 bên)
Ung thư phần mềm 1s rsi
Hiệu quả vả an toản của VOTRIENT trện STS đă được đánh giá trong một thử nghiệm then
chốt pha ill ngẫu nhiền, mù đôi, đa trung tâm, có đồi chứng với giả dược (VEG110727).
Tống số 369 bệnh nhân ung thư phần mềm tiến triền đã được cho dùng ngẫu nhiên
VOTRIENT 800 mg một lần mỗi ngảy hoặc giả dược. Điều quan trọng lả, chỉ những bệnh
nhân mắc một số phán nhóm mô học chọn lọc cũa ung thư phần mềm được phép tham gia
vảo nghiên cứu, do đó hiệu quả vả tính an toản của VOTRIENT chỉ coi như được thiết lặp
cho các bệnh nhân mắc cảc phân nhóm ung thư phần mềm nảy vả điều trị với VOTRIENT
nên hạn chế cho cảc phân nhóm STS nảy mà thôi.
Cảo Ioại khối 0 dưới đảy được chọn vảo nghiền cứu:
Nguyên bảo sợi (sacỏm sợi ở người lớn, sacỏm sợi nhầy, sacỏm sợi dạng biếu mô xơ cứng
(sclerosing epithelioid tibrosarcoma), các khối u sợi đơn độc ác tinh (malignant solitary
fibrous tumours)), cảc khối 0 được gọi chung lả u mô bảo sợi (u mô bảo sợi ảo tinh đa hinh
thải [MFH], MFH tế bảo khổng tồ, MFH dạng viêm), sacỏm cơ trơn, cảc khối u cuộn mạch ảo
tinh, oơ xương (sacỏm cơ vân dạng phế nang vả đa hinh thái), mạch (0 nội mô mạch mảu
dạng biều mô, sacỏm mạch máu), cảc Ioại chưa xác định rõ sự biệt hóa (hoạt dịch, dạng
biểu mô, phần mềm dạng phế nang, tế bảo sáng, tế bảo trộn nhỏ xơ hỏa, u dạng cơ vân
ngoải thặn, u trung mô ác tinh, PEGoma, sacỏm nội mạc mạch mảu) ngoại trừ sacỏm sụn,
cảc khối u Ewingl các khối u ngoại bi thần kinh nguyên thủy (PNET), các khối u vỏ bao thần
kinh ngoại biền ảc tĩnh, các sacỏm mô mềm không biệt hóa chưa được phản Ioại (N08) và
các loại sacỏm khảo (khộng có trong danh sáoh các khối u không được lựa ohon vảo nghiên
cứu).
Các ioại khối u dưới đây khộng được chọn vèo nghiện cứu:
Seoôm mô mỡ (tắt cả các phản nhóm), tắt cả các sacỏm cơ vân không phải dạng phế nang
hoặc đa hinh thái, sacỏm sụn, sacỏm xương, cảo khối u Ewing/PNET, GIST, sacỏm sợi
dạng củ. sacỏm sợi cơ dạng viêm, u trung mô ác tính vả cảc khối 0 trung bì hỗn hợp của ư
cung.
22
|~11I
+
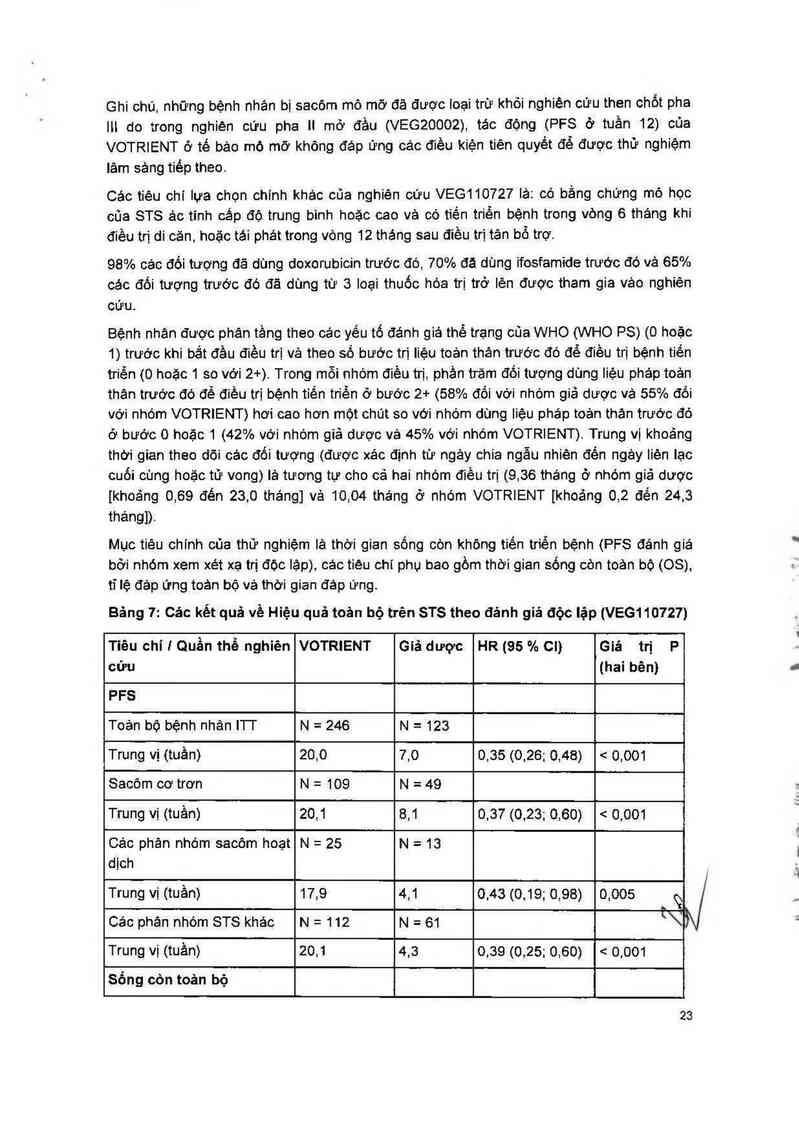
Ghi chú, những bệnh nhân bị sacỏm mô mỡ đã được Ioại trừ khỏi nghiên cứu then chốt pha
lit do trong nghiện oứu pha II mở đầu (VEG20002), tảo động (PFS ớ tuần 12) của
VOTRIENT ở tế bảo mô mở không đáp ứng cảc điều kiện tiên quyềt đế được thử nghiệm
lâm sảng tiếp theo.
Các tiêu chí lựa chọn chinh khác của nghiền cứu VEG110727 lả: có bằng ohứng mô học
cũa STS ảo tính cảp độ trung bình hoặc cao và có tiến triến bệnh trong vòng 6 tháng khi
điều trị đi căn, hoặc tái phát trong vòng 12 tháng sau điều trị tân bổ trợ.
98% các đối tượng đã dùng doxorubicin trước đó, 70% đã dùng ifosfamide trước đó về 65%
các đối tượng trước đó đã dùng từ 3 loại thuốc hóa trị trờ lẻn được tham gia vảo nghiên
cứu.
Bệnh nhân được phân tầng theo cảc yếu tố đánh giá thể trạng của WHO (WHO PS) (0 hoặc
1) trước khi bắt đầu điều trị và theo số bước trị liệu toản thán trước đó để điều trị bệnh tiến
triền (0 hoặc 1 so với 2+). Trong mỗi nhóm điều trị, phản trám đối tượng dùng Iiệu phảp toản
thân trước đó để điều trị bệnh tiến triền ở bước 2+ (58% đối với nhóm giả được vả 55% đối
với nhóm VOTRIENT) hơi cao hơn một ohút so với nhóm dùng iiệu pháp toản thân trước đó
ở bước 0 hoặc 1 (42% với nhóm giả dược vả 45% với nhóm VOTRIENT). Trung vị khoảng
thời gian theo dõi các đối tượng (được xác định từ ngảy chia ngẫu nhiên đến ngảy Iièn lạc
ouối cũng hoặc tử vong) lả tương tự cho oả hai nhòm điều trị (9,36 thảng ở nhóm giả dược
[khoảng 0,69 đên 23,0 tháng] vả 10,04 tháng ở nhóm VOTRIENT [khoảng 0,2 đến 24,3
thángl).
Mục tiêu chính của thử nghiệm lả thời gian sống còn không tiến triến bệnh (PFS đánh giá
bởi nhộm xem xét xạ trị độc lặp), các tieu chỉ phụ bao gồm thời gian sống còn toản bộ (08),
tỉ lệ đảp ứng toản bộ vả thời gian đáp ứng.
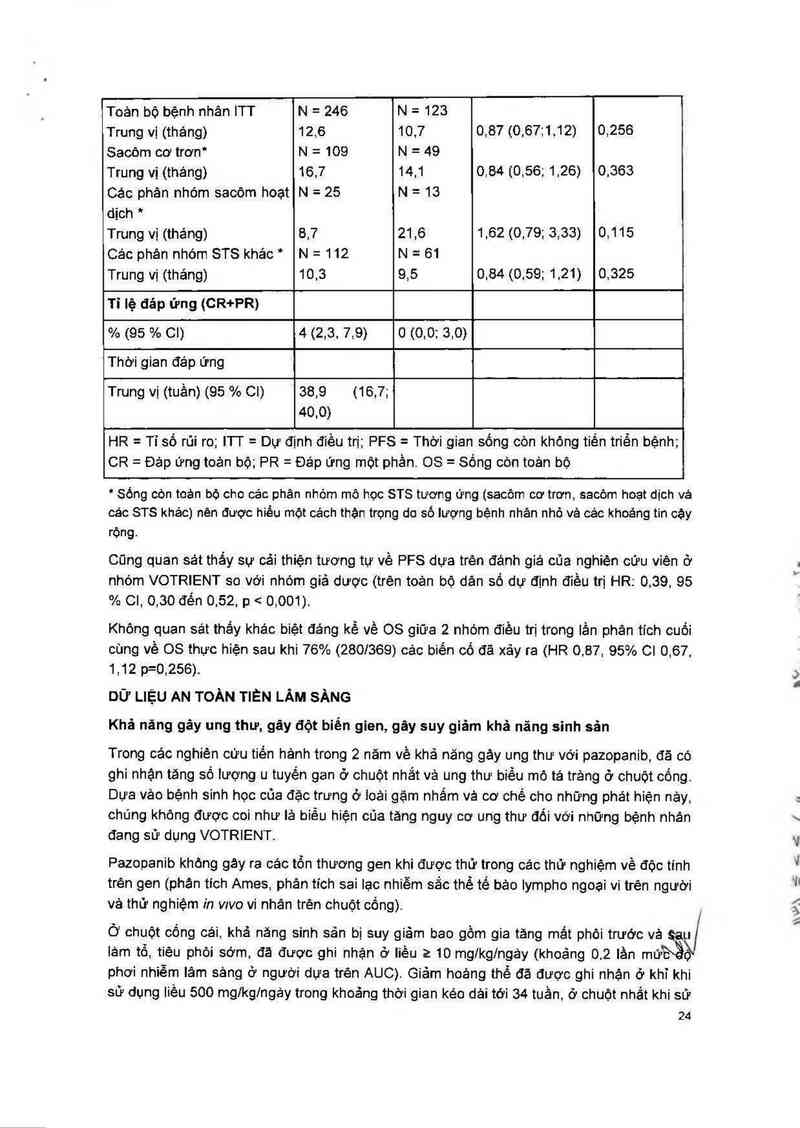
Bảng 7: Các kết quả về Hiệu quả toản bộ trên STS theo đánh giá độc lập (VEG110727)
Tiêu chí 1 Quần thể nghiên VOTRIENT Giã dược HR (95 % CI) Giá trị P
cứu (hai bên)
PFS
Toản bộ bệnh nhân ITI' N = 246 N = 123
Trung vị (tuần) 20,0 7,0 0,35 (0,26; 0,48) < 0,001
Sacôm cơ trơn N = 109 N = 49
Trung vị (tuần) 20,1 8,1 0,37 (0,23; 0,60) < 0,001
Cảo phản nhóm sacỏm hoạt N = 25 N = 13
dịch
Trung vị (tuần) 17,9 4,1 0,43 (0,19; 0,98) 0,005 ị Ỹ
Cảo phân nhóm STS khảo N = 112 N = 61 \
Trung vị (tuần) 20,1 4,3 0,39 (0,25; 0,60) = 0,001
Sống còn toản bộ
23
Toản bộ bệnh nhản ITT N = 246 N = 123
Trung vị (tháng) 12,6 10,7 0,87 (0,6711.12) 0,256
Sacỏm cơ trơn“ N = 109 N = 49
Trung vị (tháng) 16,7 14,1 0,84 (0,56; 1,26) 0,363
Các phản nhóm sacỏm hoạt N = 25 N = 13
dịch *
Trung vị (tháng) 8,7 21,6 1,62 (0,79; 3,33) 0,115
Các phân nhóm STS khảo " N = 112 N = 61
Trung vị (tháng) 10,3 9,5 0,84 (0.59; 1,21) 0,325
Tỉ lệ đáp ứng (CR+PR)
% (95 % Cl) 4 (2,3. 7,9) 0 (0,0: 3,0)
Thời gian đáp ứng
Trung vị (tuần) (95 % Cl) 38,9 (16,7;
40,0)
HR = Tỉ số rủi ro; l1'l' = Dự định điều trị; PFS = Thời gian sống còn khộng tiền triển bệnh;
cn = Đảp ứng toản bộ; PR = Đáp ững một phần. 08 = Sống con toản bộ
' Sống còn toản bộ cho cảc phân nhóm mô học STS tương ứng (sacỏm cơ trơn, sacỏm hoạt dịch vả
các STS khác) nện được hiêu một oảch thận trọng do số lượng bệnh nhân nhỏ vả cảc khoảng tin cậy
rộng.
Cũng quan sát thắy sự cải thiện tượng tự về PFS dựa trên đảnh giá của nghiên cữu viền ở
nhóm VOTRIENT so với nhóm giả dược (trện toản bộ dân số dự định điếu trị HR: 0,39, 95
% 01, 0,30 đến 0,52, p < 0,001).
Không quan sát thấy khác biệt đáng kể về 08 giữa 2 nhóm điều trị trong iằn phăn tích cuối
cùng Về OS thực hiện sau khi 76% (2801369) cảc biến Cổ đã xảy ra (HR 0,87, 95% Cl 0,67,
1,12 p=0,256).
DỮ LIỆU AN TOÀN TIỀN LÃM SÀNG
Khả năng gây ung thư, gây đột biến gien, gây suy giảm khả nãng sỉnh sản
Trong các nghiên cữu tiến hảnh trong 2 năm về khả năng gảy ung thư với pazopanib, đă có
ghi nhận tăng số iượng u tuyến gan ở chuột nhắt vả ung thư biều mô tả trảng ở chuột oống.
Dựa vảo bệnh sinh học của đặc trưng ở ioải gặm nhấm vả cơ ohê cho những phát hiện nảy,
chúng khộng được coi như là biểu hiện của tăng nguy cơ ung thư đối với những bệnh nhán
đang sử dụng VOTRIENT.
Pazopanib khộng găy ra oáo tổn thương gen khi được thứ trong các thử nghiệm về độc tỉnh
trên gen (phân tích Ames, phân tích sai lạc nhiễm sắc thể tế bảo lympho ngoại vi trên người
và thử nghiệm in v1vo vi nhân trện chuột cống).
Ở chuột cống cái, khả nãng sỉnh sản bị suy giảm bao gồm gia tăng mắt phội trước vả sau
iâm tổ, tiệu phội sớm, đã được ghi nhặn ở Iiều a 10 mg]kglngảy (khoảng 0,2 lần mứ'ồẵờ
phơi nhiễm lâm sảng ở người dựa trên AUC). Giảm hoảng thế đã được ghi nhặn ở khi khi
sử dụng Iiều 500 mg/kglngảy trong khoăng thới gian kéo dải tới 34 tuần, ở chuột nhắt khi sử
24
ỵv
dụng liều 2 100 mg/kg/ngảy trong 13 tuần vả teo buồng trứng được ghi nhận ở chuột cống
khi sử dụng liều 300 mglkglngảy trong 26 tuần (iằn lượt tương đương khoảng 0,6; 1,4 vả
0,9 iần mức độ phơi nhiễm lảm sảng trên người dựa trèn AUC).
Pazopanib không tảo động tới khả năng giao phối hay sinh sản trên chuột cống đực. Tuy
nhiên quan sát thắy có sự giảm tỉ lệ sinh tinh trùng, khả năng di chuyến của tinh trùng, và
mặt độ tinh trùng trong mảo tinh hoán vả tinh hoản sau khi sử dụng iiều 2 100 mglkglngầy
(khoảng 0,5 lần phơi nhiễm Iảm sảng ở người dựa trèn AUC) trong 15 tuần. Sau 26 tuần sử
dụng thuốc có sự giảm trọng lượng tinh hoản vả mảo tinh, teo vả thoải hóa tinh hoản với
tình trạng không có tinh trùng, giảm số lượng tinh trùng vả thay đối dạng sảng ở máo tinh
hoân của chuột cống đực khi sử dụng Iiều a 30 mglkg/ngảy (khoảng 0,4 lần mức độ phơi
nhỉễm lâm sảng ở người dựa trên AUC).
Pazopanib có tác động gáy quải thai (bao gổm cảc dị tặt trên tim mạch vả chậm cốt hóa),
lảm giảm trọng lượng thai, và chết phội ở chuột cống ở các mức liều 2 3 mglkg/ngảy
(khoảng 0,1 lần mức độ phơi nhiễm lảm sảng ở người dựa trên AUC). Ở thỏ, độc tinh trên
mẹ (giảm cân nặng, giảm tiêu thụ thức ăn, và sảy thai) đă được ghi nhận ở lièu
2 30 mglkg/ngảy (khoảng 0,007 lằn mức độ phơi nhiễm lảm sảng ở người dựa trén AUC),
trong khi đó trọng lượng thai bị giảm ở các Iièu a 3 mg/kglngảy (xem phần Thời kỳ Mang
thai vả Cho con bú, phần Cảnh báo vả thận trọng).
Độc tinh trên động vật vảlhoặc Tính chất dược lý
Trong các nghiên cứu về độc tính trèn chuột cống, thuốc có tác dụng trén một số mô
(xương, răng, tủy xương, đế móng, cơ quan sinh sản, các mô thuộc về máu, thận, tuyến
thượng thận, hạch bạch huyết, tuyến yên và tụy) phù hợp với sư ức chế VEGFR vảlhoặc sự
gián đoạn đường dẫn truyền tín hiệu VEGF ở mức liếu 3 mglkglngảy (khoảng 0,1 lần mức
độ phơi nhiễm Iảm sảng ở người dựa trên AUC).
Các tảc dụng trên gan bao gồm tảng nhẹ các men transaminase gan ở loải gặm nhấm vả
tãng bilirubin ở ioải khi mà không kèm theo thay đổi mô bệnh học ở mức liều tạo ra mức
phơi nhiễm toản thân tương ứng với khoảng 0,1 vả 0,6 lần mức độ phơi nhiễm lâm sảng &
người.
Trong các nghiên cứu về độc tính trèn động vật chưa trưởng thảnh, khi cho chuột cống
trước khi cai sữa dùng thuốc từ ngảy 9 đến ngảy 14 sau sinh, pazopanib gây tử vong và có
sự tảng trưởngltrưởng thảnh bất thường trên thận, phỗi, gan vả tim ở mức Iiẻu khoảng 0,1
lần của Iiều phơi nhiễm Iảm sâng dựa trên AUC ở người trưởng thảnh. Khi cho chuột cỏng
sau khi cai sữa dùng thuốc từ ngảy 21 đến ngảy 62 sau sinh, các phát hiện về độc tinh là
tương tự với chuột cống trường thảnh có mức phơi nhiễm tương đương với những thay đỗi
trên xương, khí quản, răng, thượng thận, tụy, dạ dảy, tá trảng, hạch bạch huyết, tuyến vú ở
con đực vả cơ quan sinh sản. Ở chuột cống, cai sữa xảy ra ở ngảy 21 sau sinh tương
đương với khoảng 2 tuổi ở người. Bệnh nhi có tăng nguy cơ bị tảo động của thuốc trên `
xương và răng hơn so với người lớn, vì những thay đổi nảy, bao gồm cả ngắn chi đã ' nj
diện ở chuột cống chưa trưởng thảnh ở Iiều 2 10 mglkglngèy (tương đương với khoảnầồ
0,2 lần Iiều phơi nhiễm lâm sảng dựa trẻn AUC ở người trưởng thảnh) (xem phần Cảnh báo
vá Thận trợng).
HẠN DÙNG
25
/x`
\\ \) \
24 thảng kê từ ngảy sản xuất.
BẢO QUẢN
Bảo quản khỏng quá 30°C.
ĐỂ XA TÀM TAY TRẺ EM
ĐỌC KỸ HƯỞNG DĂN sử DỤNG TRƯỚC KHI DÙNG
NỂU CẦN THÉM THÔNG TIN XIN HỎI Ý KIÉN BẢC sỸ
SẢN XUẤT BỜ!
Glaxo Operations UK Limited,
o
Priory Street, Ware, Hertfordshire, SG12 ODJ, GlaxoSmithKline
United Kingdom
ĐÓNG GÓI eơ1
Glaxo Wellcome S.A.,
Avda. de Extremadura, 3,
09400 — Aranda de Duero, Burgos, Spain
VOTRIENT là nhãn hiệu thương mại đã đáng kỷ của GSK group of compa '
Dựa trèn IPI 14 ngảy 28 tháng 07 năm 2015 VOTTAB 0616-14l280715
TUQ. C…Ục TRƯỚNG
P.TRUỜNG PHÒNG
Ảịauỵễn Jfểlỷ Jfíìng
'ỡNis
26
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng