
















, .…um
Votrient®
400mg
Pmpanlh 400 mg
(dụm hydrochlorldcl
we; ' lo m víin
leùi Mn mo phln mm mnù
hydmchiuMe wma dm … mu
ọmpmm
un quln anq quả m
011 Gnh. ’ ` ' Gwootqwldum
\’ , _ ` s……
i \ _ e,JJmai-nOA
j [ ~…m.
` __ _______
Z
[ .zuueỳum j 'Qluúmưllmơ
| R: ma: uu m m .cu'mwm' ' Rx mm … … c…
- G ' ® - @
Votrnent Votrnent Votruent
400 mg 400 mg 400 mg
Pnnpunlb 400 mg Punpnnlb um mg Fuculnlb … mg Ế
l (dọn; hydrochlmldo] (dạng hydmchlotldol (dọng hydmchlcfideì
` SAm:uh bùt '
' sau.—vu- i GmDợunlnm u: u…im
Ề'zvosglỄiữdnìimdmm Thuốc dùng đường udng
Den; w…
GanIIunn. SJ.
@ vien nón hao phim ẫãafiỉả'"ẫểđả u…ms… , ạ … nin blo phim
VO'I'RISM'I' IA nhin thu mung mụ! GI
dừng Iỷ<ủl Glun$mlhKlìnc gmup al
' cnmulvủex
i
emn Gunhuiuanmuzumm ,
Ni :|ngan Y
/
muoemnmmnmuveuven
mmA CDIII N' l172
—›
\
/f›l"~
This PDF has been verified using PitStop 08 - PDF is PDF/X-1a compliant
(lllustrator files workflow)
,.J
/ . ` \
, . i \
I P~ í \ i Ì
| t f— … … i
_ t \ 1 l _1 g; _
: @ ` ' ~ " g- _]
ã cum…mnu _ . i
- . \ _ z /
ỉ ` Ể ot ' nt® ' `8'
' J ' rle 400 mg Bìa quln kh0ng quá 30t. ~ , /0
lữ xnha mvnt … " U
Puopinlb 400 mg Đọc KỸ uưm DAN sử oụuc nươc x… bùnG <
(dạng hydrochloưìde) … n…… _ ẵ
Giam Oọemions ux Limited. ux Ễ-
Thuốc dùng duờng udng oeng goi un; :
Glzm Wellcome. SA. Splm
VOTRIENTIỔ nhin hie th mạ“ dt dtn ' t'a
† e VI.“ M“ ba phim GluoSmlthKIủ-ne grouỀ oflgnrẵpanẵes g ky "
_ _ _ _ - __) __
|
This PDF has been verified using PitStop 08 - PDF is PDFIX-1a compliant
(Illustrator files workflow)
.ịib";
~offl
"%
Sticker of lmporter M/
40mm
numccmụchmmạmninẵ 7mml
1!thThịlijihPlũiffl.ũtĩPfflfflllli _ Ả. ~
CONFIDENTIAL
Rx
Thuốc bán theo đơn
TRÌNH BÀY
Viên nén 200 mg: Viên nén 200 mg chứa 217 mg pazopanib hydrochloride, tương
đương 200 mg pazopanib dạng base tự do. Viên nén mảu hồng hình capsule; với chữ
GS JT dập chim ở một mặt.
Viên nén 400 mg: Viên nén 400 mg chứa 433 mg pazopanib hydrochloride, tương
đương 400 mg pazopanib dạng base tự do. Viên nén mảu trắng hình capsule; với chữ
GS UHL dập chìm ở một mặt. L/
Tá dược: “
Viên nén trần - 200 mg và 400 mg: Magnesium stearate, Microcrystalline cellulose,
Povidone (K30), Sodium starch giycollate.
Lớp bao phim — viên 200 mg (Opadry Pink): Hypromellose, Iron Oxide Red (E172),
Macrogol | PEG 400, Polysorbate 80, Titanium dioxide (E171)
Lớp bao phim — viên 400 mg (Opadry White): Hypromellose, Macrogoi | PEG 400,
Polysorbate 80, Titanium dioxide (E171)
Dạng bảo chế: Viên nén bao mm.
Quy cảch đóng gói: Hộp 1 lọ 30 viên.
CHỈ ĐlNH
VOTRIENT được chỉ định điều trị ung thư biếu mô tế bảo thận (RCC) tiên triến vảlhoặc
di căn.
LIÊU DÙNG vÀ cÁcn DÙNG
Liều được khuyên dùng của VOTRIENT lả 800 mg uống một lằn mỗi ngảy.
VOTRIENT không nên uống cùng vởi thức ăn (cách ỉt nhất 1 giờ trước hoặc 2 giờ sau
bữa ăn (xem phần Dược động học).
VOTRIENT được nuốt nguyên viên vởi nước và không được lảm vỡ hoặc nghiền viên
thuốc (xem phần Duợc động học).
Trong trường hợp quên uống thuốc, khỏng được uống bù nếu còn dưới 12 giờ tỉnh đên
thời điềm uống liều kế tiếp.
Page1 of 16
CONFlDENTIAL
Điều chỉnh liều
Chỉ nẻn giảm Iiều ban đầu từ 800 mg xuống 400 mg mỗi ngảy. Việc điêu chĩnh liều tiếp
theo, hoặc tăng hoặc giảm Iiều, phải tuân theo mỗi bậc 200 mg theo mô hình bậc thang
dựa trên mức độ dung nạp của từng bệnh nhân để hạn chế các tảo dụng không mong
muốn cùa thuốc.
Liều dùng của VOTRIENT không được vượt quá 800 mg.
Tác nhân ỨC chế CYP3A4: Nên tránh việc sử dụng đồng thời vởi các tác nhản ức chế
mạnh CYP3A4 (ví dụ: ketoconazole, itraconazote, clarithromycin, atazanavir, indinavỉr,
nefazodone, nelfinavir, ritonavir, saquinavir, telithromycin, voriconazole) vì có thế lảm
tăng nồng độ pazopanib. Dựa trên cảc nghiên cứu dược động học, nếu sử dụng đồng
thời một tảo nhản ức chế manh CYP3A4, nên giảm liều VOTRIENT xuống 400 mg. Mức
Iìều nảy được dự đoán sẽ điều chỉnh AUC của pazopanib tởi mức đã được ghi nhận khi
không sử dụng kèm cảc tác nhản ức chế (xem phần Tuơng tác thuốc). Tuy nhiên. không
Có dữ liệu lâm sảng về sự điều chỉnh liều dùng nảy ở những bệnh nhản sử dụng các tảo
nhãn ức chế mạnh CYP3A4.
Các nhóm đối tượng đặc biệt ÍM/
» Bệnh nhân suy thận
Không có kinh nghiệm sử dụng VOTRIENT ở bệnh nhân suy thận nặng hoặc ở bệnh
nhản đang thấm phân phúc mạc hoặc thấm phản mảu; vì thế, không nẻn sử dụng
VOTRIENT trẻn những bệnh nhân nảy. Tinh trạng suy thận được cho iả không có ảnh
hưởng về mặt lâm sảng trên dược động học pazopanib do pazopanib và các chảt
chuyền hóa ít được thải trừ qua thận, và việc điều chỉnh liều lá không cần thiết ở bệnh
nhân có độ thanh thải creatinine 2 30 mllphủt (xem phần Thải trừ).
o Bệnh nhân suy gan
Tỉnh an toản vả dược động học của pazopanib trẻn những bệnh nhân bị suy gan trước
khi điều trị chưa được nghiên cứu đầy đủ (xem phần Cảnh báo và Thận trọng).
Khòng cần chỉnh Iiều ở bệnh nhân suy gan nhẹ được xác định dựa trên alanine
aminotransferase (ALT) vả bilirubin (xem phần Dược lý Iảm sảng). Cần giảm liều
VOTRIENT xuống 200 mg mỗi ngảy trên bệnh nhân bị suy gan mức độ trung bình.
Không có đủ dữ Iiệu trên bệnh nhản bị suy gan nặng (bilirubin toản phản > 3 iần ULN
bảt kề ALT ở mức nèo); vì vậy, không khuyên dùng VOTRIENT trẻn những bệnh nhân
nay.
o Trẻ em
Tính an toản vả hiệu quả của VOTRIENT trên trẻ em chưa được nghiên cứu (xem phần
Thông tin tiẻn lâm sáng).
o Người cao tuối
Page 2 of 16
CONFIDENTIAL
Khỏng cần phải điều chỉnh liều dùng, tần suất sử dụng hoặc đường dùng ở bệnh nhán
trên 65 tuồi.
CHỐNG CHỈ ĐỊNH
VOTRIENT bị chống chỉ đinh trẻn những bệnh nhản mẫn cảm với bảt kỳ thảnh phần nảo
của thuốc.
CẢNH BÁO VÀ THẶN TRỌNG
Các tác dụng trên gan: Đã có bảo cảo về cảc trường hợp suy gan (bao gồm cả tử
vong) khi sử dụng VOTRIENT. Trong các thử nghiệm lảm sảng với VOTRIENT, đã quan
sát thảy có sự tảng nòng độ các men transaminase (ALT, AST) vả bilirubin trong huyết
thanh (xem phần Tác dụng không mong muốn). Trong phần iởn oác trường hợp. sự
tăng riêng biệt nòng độ ALT vả AST mà không tăng đồng thời phosphatase kiềm hoặc
bilirubin đă được ghi nhặn. Đại đa số (92.5 %) cảc trường hợp tảng men transaminase
ở bất kỳ mức độ nảo đã xảy ra trong 18 tuần đầu tiên. Các mức độ dựa trên Tiêu chuẩn
Thuật ngữ Chung cùa Viện Ung thư Quốc gia đối với Cảo biên có bât lợi, Phiên bản 3
(NCI CTCAE).
Cần theo dõi các xét nghiệm huyết thanh đảnh giá chức năng gan trưởc khi điều trị với
VOTRIENT vả ỉt nhất 4 tuần một lần trong ít nhảt 4 thảng đầu cùa điều trị, và theo chỉ
định lâm sảng. Cần theo dõi định kỳ tiếp sau giai đoạn nảy.
Những hưởng dẫn sau đảy được áp dụng cho những bệnh nhân có các giá trị bilirubin
toản phần s 1,5 lằn giới hạn trên cùa mức binh thường (ULN) vả AST vả ALT s 2 lần
giới hạn trên của mức bình thường trưởc khi điều trị.
o Những bệnh nhân tăng ALT riêng biệt trong khoảng từ 3 đến 8 iần giới hạn trên của
mức binh thường có thề tỉếp tục sử dụng VOTRIENT kèm vởi giám sát hảng tuần
chức năng gan cho tởi khi ALT trở về mức độ 1 (NCI CTCAE) hoặc mức trước điều
tri.
o Những bệnh nhân có ALT tăng > 8 lần giới hạn trèn của mức bình thường cần
ngừng VOTRIENT cho tới khi ALT trở về Mức độ 1 (NCI CTCAE) hoặc mức trước
điều trị. Nếu xét thây những lợi ĩch tiềm tảng của việc sử dụng lại VOTRIENT lớn
hơn nguy cơ độc tinh trên gan, thi sau đó sử dụng iại VOTRIENT ở mức liều đă
được giảm là 400 mg một lần mỗi ngảy vả tiến hảnh xét nghiệm huyết thanh đảnh
giá chức năng gan một lần mỗi tuần trong 8 tuần (xem Liều dùng và Cảch dùng).
Nêu khi sử dụng lại VOTRIENT mà sự gia tăng ALT > 3 lần giởi hạn trèn oủa mức
bình thường lại xuát hiện thi phải ngừng hẳn VOTRIENT.
› Nếu ALT tăng > 3 lần giởi hạn trèn của mức binh thường xuất hiện đồng thời vởi
bilirubin tăng ›2 lần giới hạn trẻn cùa mức bình thường, cần phải ngừng hắn
VOTRIENT. Phải giám sát bệnh nhân cho tới khi men gan giảm về Mức độ 1 (NCI
CTCAE) hoảc mức trưởc điều trị. Pazopanib là một tác nhân ức chế UGT1A1. co
thể xuất hiện tăng bilirubin máu gián tiếp (không Iiên hợp) mức độ nhẹ ở những
bệnh nhân có hội chứng Gilbert. Những bệnh nhân chỉ tăng bilirubin máu giản tiếp
Page 3 of 16
CONFIDENTIAL
mức độ nhẹ. được xác định hoặc nghi ngờ mắc hội chứng Gilbert, có ALT tăng > 3
lần giởi hạn trên của mức bình thường thì cần được xử lý theo các khuyến cảo đối
với những trường hợp tăng ALT riêng biệt
Sử dụng đồng thời VOTRIENT vả simvastatin lảm tảng nguy cơ ALT tăng (xem Tương
tác) vả nên thận trọng khi uống vả kiểm soát chặt chẽ
Ở bệnh nhản suy gen trưởc khi điều trị, ngoải khuyên cảo lả bệnh nhân suy gan nhẹ
dùng Iièu 800 mg VOTRIENT một iần mỗi ngảy vả giảm lièu khởi đầu xuống 200 mg mỗi
ngảy cho bệnh nhãn suy gan mức độ trung bình, chưa có thèm hướng dẫn chỉnh Iièu
nản dựa trên các xét nghiệm huyết thanh đảnh giả chức năng gan trong khi điều trị.
Tăng huyết ảp: Trong các nghiên cứu lâm sảng với pazopanib, cảc biến có tăng huyêt
áp bao gồm cơn tăng huyết ảp đã xảy ra. Huyêt áp phải được kiếm soát tốt trưởc khi bắt
đầu sử dụng VOTRIENT. Các bệnh nhản phải được giám sát đối với tăng huyết áp vệ
được điều trị nếu cần vởi phảc đồ ohuắn ohống tảng huyết áp (xem phần Tảo dụng
không mong muốn). Tăng huyết áp (huyết ảp tâm thu 2 150 hoặc huyết ảp tâm trương 2
100 mmHg) xuất hiện sớm trong đợt điều trị (39% xuất hiện vảo Ngảy thứ 9 vả 88% xuất
hiện trong vòng 18 tuần đầu). Trong trường hợp tăng huyết áp dai dẳng, mặc dù đã sử
dụng điều trị chống tăng huyêt áp, có thể tiến hảnh giảm Iiều dùng VOTRIENT (xem
phần Liều dùng vả Cách dùng). Phải ngừng sử dụng VOTRIENT nếu có bằng chứng
của cơn tăng huyết áp, hoặc nếu tăng huyết ảp nghiêm trọng vả dai dắng mặc dù đã sử
dụng điều trị chống tăng huyết áp vả giảm Iiẻu VOTRIENT.
Kẻo dải khoảng QT vả xoắn đinh: Trong cảc nghiên cứu tảm sảng với VOTRIENT, đá
xuất hiện biên có kéo dải khoảng QT hoặc xoắn đinh (xem phân Tác dụng không mong
muốn). Cần sữ dụng VOTRIENT một cách thặn trọng trên những bệnh nhân có tiền sử
kéo dái khoảng QT, những bệnh nhân dùng cảc thuốc chống loạn nhịp hoặc các thuốc
khảo có thể kéo dải khoảng QT, hoặc những bệnh nhản có bệnh tim trưởc đó. Khi sử
dụng VOTRIENT, cằn phải giám sát điện tảm đề trước điều trị vả định kỳ và duy trì nồng
độ cảc chất điện giải (calci, magie, kali) trong khoảng bình thường.
Biến cố huyết khối động mạch: Trong các nghiên cứu Iảm sảng với VOTRIENT, cảc
biên có nhồi máu cơ tim, đau thắt ngưc, đột quỵ nhồi mảu năo vả cơn thiếu máu não
thoáng qua (TIA) đă được nhận thấy (xem phắn Tác dụng không mong muốn). Củng
quan sát thấy các biến cổ tử vcng. Nên sữ dụng thặn trọng VOTRIENT ớ những bệnh
nhân có nguy cơ cao xảy ra các biên cố huyết khối hoặc những người đã từng có một
biến cố trong vòng 6 tháng trưởc đó. Cần đưa ra các quyêt định điều trị dựa vảo đánh
giá lợi ich/nguy cơ trên tưng bệnh nhán.
Biến cố xuất huyết: Trong các nghiên cứu lâm sảng với VOTRIENT, đã ghi nhận cảc
biến cô xuất huyết (xem phần Tác ơụng không mong muốn). Cảo biến cô xuất huyết gây
tử vong đă xuât hiện. VOTRIENT chưa được nghiên cứu trẻn những bệnh nhân có tiền
sử ho ra máu. xuất huyết não, hoặc về mặt lảm sảng có xuất huyết đường tiệu hóa
nghiêm trọng trong 6 tháng trước đó. Phải sử dụng thận trọng VOTRIENT ở những
bệnh nhân có nguy cơ cao xảy ra xuất huyết.
Page 4 ot16
i'ial/
CONFIDENTIAL
Thùng vả rò dạ dảy-ruột: Trong các nghiên cứu iâm sảng với VOTRIENT, đả xuât hiện
các biên cố thủng hoặc rò dạ dảy- ruột (xem phần Tác dụng không mong muốn). Biên
cố thủng gây tử vong đã xảy ra. Nèn sử dụng thận trọng VOTRIENT ở những bệnh
nhản có nguy cơ về thùng hoặc rò dạ dảy- ruột.
Lảnh vết thương: Không có nghiện cứu chinh thức về ảnh hưởng cùa VOTRIENT trện
iảnh vết thương. Vì các tảo nhân ức chế yêu tố tăng trưởng nội mạc mạch (VEGF) có
thế lảm chặm quả trinh Iảnh vẻt thương, nên phải ngừng điều trị với VOTRIENT it nhất 7
ngảy trước lịch phẫu thuật. Quyết định dùng lại VOTRIENT sau phẫu thuật phải dựa
trên đánh giá lâm sảng cho thắy quá trình lảnh vết thương đã ồn định. Phải ngừng
VOTRIENT ở những bệnh nhân có vết thương hờ.
Giảm chức năng tuyến giảp: Trong các nghiên cứu lâm sảng với VOTRIENT, đã xuất
hiện biến có giảm chức năng tuyến giáp (xem phân Tác dụng không mong muốn). Nện
chủ động giảm sảt các xét nghiệm chừc nảng tuyến giáp.
Protein niệu: Trong cảc nghiên cứu lảm sảng với VOTRIENT, đã ghi nhận các trường
hợp protein niệu (xem phần Tác dụng không mong muốn). Nên tiến hảnh phân tich
nước tiêu trước điều trị và định kỳ trong quả trinh điều trị và cần giám sát các bệnh nhân
về diễn biên protein niệu trở nên xắu hơn. Phải ngừng VOTRIENT nêu bệnh nhân tiên
triền thảnh hội chứng thận hư. Ỉn
Mang thai: Các nghiên cứu tiền lâm sảng ở động vật đã cho thấy độc tinh sinh sản (Dữ
liệu An toán tiên lâm sâng).
Nếu VOTRIENT được sử dụng khi đang mang thai, hoặc néu bệnh nhản có thai khi
dùng VOTRIENT, phải giải thích cho bệnh nhân về các nguy hiếm tièm tảng đối với thai
nhi. Cản khuyên các phụ nữ trong độ tuối sinh đẻ thực hiện tránh thai khi được điều trị
với VOTRIENT (xem phần Thời kỳ mang thai và Cho con bú).
TƯỚNG TÁC
Các thuốc ức chế hoặc cảm ứng các enzyme Cytochrome P450 3A4
Các nghiên cứu in vìtro gợi ý rằng quá trinh chuyển hóa oxy hóa của pazopanib ở
microsome gan người chủ yếu qua trung gian CYP3A4, với sự tham gia một phần nhỏ
từ CYP1A2 vả cvpzcs. Vi thê, các tác nhân ức chế và cảm ứng CYP3A4 có thế lảm
thay đối quá trình chuyền hóa cùa pazopanib.
Các tác nhân ức chế CYP3A4: Sử dụng đồng thời một liều đơn pazopanib dưới dạng
nhỏ mắt cùng với một tác nhân ức chế CYP3A4 mạnh là ketoconazoie, ở những người
tình nguyện khỏe mạnh, Iảm tăng giá trị trung bình AUC…) iên 220 % và tăng Cnnax iên
150 %.
Sử dụng đòng thời VOTRIENT với các tác nhản ức chế mạnh CYP3A4 (v.đ,
ketoconazoie, itraconazole, ciarithromycin, atazanavir, indinavir, nefazodone, nelfinavir,
ritonavir, saquinavir, teiithromycin. voriconazole) có thẻ lảm tăng nồng độ pazopanib.
Nước ép bưới cũng có thế lảm tăng nòng độ pazopanib trong huyết tương.
Page 5 of 16
CONFIDENTIAL
Sử dụng 1500 mg lapatinib - một cơ chải vả iả chầt ức chế nhẹ CYP3A4, ng vả BCRP
vởi 800 mg VOTRIENT Iám tăng khoảng 50 % đẻn 60 % giá trị trung bình AUC…w vả
C…ax của pazopanib khi so sảnh vởi việc sử dụng đơn độc 800 mg VOTRIENT. Sử dụng
đồng thời VOTRIENT với tảo nhân ức chế CYP3A4, ng, vả BCRP, như lapatinib, sẽ
lảm tăng nồng độ pazopanib trong huyết tương.
Vì thế cần phải tránh kết hợp với các tác nhân ức chế mạnh CYP3A4, hoặc nèn lựa
chọn một thuộc thay thế không có hoặc chỉ có tác dụng ức chế CYP3A4 tối thiêu. Cần
cân nhắc giảm Iièu VOTRIENT khi bắt buộc dùng đồng thời thuốc nảy với các chắt ừc
chế mạnh CYP3A4 (xem phần Liều dùng vả cách dùng).
Các tác nhản cảm ứng CYP3A4: Các tác nhân cảm ứng CYP3A4 như rifampin có thề
lảm giảm nồng độ pazopanib trong huyết tương. Nên lựa chọn thuốc khảo thay thế
không có hoặc chỉ có tảo dụng gây cảm ứng enzyme tói thiếu.
Cảo tác dụng cùa VOTRIENT trên các cơ chẩt CYP ẨtẨ/
Cảo nghiên cứu in vitro với các microsome gan người đã cho thẩy pazopanib có tác
dụng ức chế oác CYP enzyme 1A2, 3A4, 286, 208, 209, 2019, vả 2E1. Tác dụng gây
cảm ứng tiềm tang trèn CYP3A4 ở người đã được chứng minh trong một thử nghiệm in
vitro PXR ở người. Các nghiên cứu dược lý học lâm sảng, sử dụng VOTRIENT 800 mg
một lần mỗi ngảy, đã cho thấy rằng VOTRIENT khỏng có tác dụng đáng kể về mặt lâm
sảng trẻn dược động học của caffeine (cơ chảt thăm dò cùa CYP1A2), warfarin (cơ chất
thăm dò của CYP209), hoặc omeprazoie (cơ chắt thăm dò cùa CYPZC19) ở cảc bệnh
nhân ung thư. VOTRIENT Iảm tăng khoảng 30 % giá trị trung bình của AUC vả Cmax của
midazolam (cơ chát thăm dò của CYP3A4) vả Iảm tảng 33% tới 64% tỉ lệ nồng độ
dextrometrophan trẻn dextrorphan trong nước tiếu sau khi uống dextromethorphan (cơ
chắt thảm dò cùa CYP2D6). Sử dụng đồng thời VOTRIENT 800 mg một lằn mỗi ngảy vả
paclitaxel 80 mglm2 (cơ chắt của CYP3A4 vả CYP2C8) một lần mỗi tuần dẫn đến tăng
tương ứng 26% vả 31% giá trị trung bình của AUC and Crnax của paclitaxel.
Các tác dụng cùa VOTRIENT trên các enzyme khác và cảc chất vận chuyển
Cảo nghiên cứu in vitro cũng cho thấy rằng pazopanib lả một tác nhân ức chế mạnh
UGT1A1 vả OATP1B1 với giá trị tương ứng của le0 là 1,2 vả 0,79 ụM. Pazopanib có
thế lảm tăng nồng độ cùa cảc thuốc thải trừ chủ yêu qua UGT1A1 vả OATP1B1.
Ảnh hưởng của việc sử dụng đồng thời VOTRIENT vả Simvastatin
Page 6 of 16
CONFIDENTIAL
Sử dụng đổng thời VOTRIENT vả simvastatin Iảm tảng tỉ lệ tăng ALT. Qua các nghiên
cứu đơn trị liệu với VOTRIENT, ALT > 3 lần giới hạn trện của mức binh thường (ULN)
đă được báo cáo ở 126/895 (14%) bệnh nhản không sử dụng cảc statin so với 11l41
<27%) bệnh nhân sử dụng đồng thời simvastatin (p = o.oss›. Nêu tăng ALT tiên triền ở
bệnh nhân sử dụng đồng thời simvastatin, hăy tuân theo cảc hướng dẫn về liều dùng
của VOTRIENT vả ngừng sử dụng simvastatin (xem Cánh báo vá Thận trọng). Chưa có
đủ dữ liệu để đánh giá nguy cơ của việc sử dụng đồng thời các statin khảc vả
VOTRIENT.
Ảnh hưởng cùa thức ản trên VOTRIENT
Sử dụng VOTRIENT với các bữa ản nhiều hoặc it chầt béo dẫn đến lảm tăng khoảng 2
lần giá trị AUC và C…. Vì thế, VOTRIENT phải được sử dụng it nhảt 1 tiếng trưởc hoặc
2 tiếng sau bữa ăn (xem Liêu dùng về Cách dùng).
THỜI KỸ MANG THAI vÀ CHO CON BÚ ẤMẤ/
Khả năng sinh sản
VOTRIENT có thẻ Iảm suy giảm khả năng sinh sản trên cả nam và nữ. Trong cảc
nghiên cứu về độc tinh sinh sản trẻn giống cái ở loải chuột, đã cho thấy khả năng sinh
sản bị suy giảm (xem phân Dữliệu An toán tiền lâm sảng).
Thời kỳ mang thai
Không có đủ dữ Iiệu từ việc sử dụng VOTRIENT ở phụ nữ mang thai. Cảc nghiên cứu
trện động vặt cho thấy thuộc có độc tinh trẽn sinh sản (xem phần Dữliệu tiền lâm sảng).
Nguy cơ tiềm tảng trèn người chưa được xác định. Không được sử dụng VOTRIENT
trong thời kỳ mang thai trừ khi tinh trạng lâm sảng của người bệnh đòi hỏi phải sử dụng
VOTRIENT để điều trị. Nếu VOTRIENT được sư dụng trong thời kỳ mang thai, hoặc nếu
bệnh nhản có thai khi đang sử dụng VOTRIENT, cần phải giải thich cho bệnh nhân về
mổi nguy hại tiềm tảng đỏi với thai.
Phụ nữ có khả năng mang thai cần được khuyên sữ dụng biện phảp ngừa thai thich
hợp vả phải trảnh có thai trong khi được điều trị với VOTRIENT.
Cho con bú
Tinh an toản khi sử dụng VOTRIENT trong thời kỳ cho con bú chưa được xác đinh. Hiện
khòng biêt pazopanib có bải tiết qua sữa mẹ không. Nên ngừng cho con bú bằng sữa
mẹ trong khi điều trị với VOTRIENT.
KHẢ NĂNG THỰC HIỆN cÁc NHIỆM vụ CẢN có sự PHÁN ĐOÁN, cÁc KỸ NĂNG
NHẬN THỨC HOẶC VẶN ĐỘNG
Không có nghiên cứu nảo xảo định tác dụng của VOTRIENT trên việc lải xe hoặc khả
năng vặn hảnh máy móc. Tác dụng có hại trên những hoạt động như thế khỏng thế
iường trước được từ tỉnh chắt dược lý của pazopanib. Phải lưu ý đén tinh trạng iâm
sảng của bệnh nhân và hồ sơ biên oố bảt lợi của VOTRIENT khi xem xét khả năng cùa
Page 7 of 16
CONFIDENTIAL
bệnh nhân trong việc thực hiện các nhiệm vụ đòi hỏi sự phán đoán, các kỹ năng vện
động hoặc nhặn thức.
TÁC DỤNG KHÔNG MONG MUỐN
Tính an toản vả hiệu quả của VOTRIENT trện bệnh nhân bị ung thư biểu mô tế bảo thặn
(RCC) đã được đánh giá trong một nghiện cứu ngẫu nhiện, mù đôi, đa trung tâm, có đối
chứng với giả dược. Các bệnh nhản RCC tiên triến tại chỗ vả/hoặc di cản được chia
ngẫu nhiên thảnh hai nhóm: sữ dụng VOTRIENT 800 mg một lần mỗi ngảy (N=290)
hoặc sử dụng giá dược (N=145). Giá trị trung vị cùa thời gian điều trị là 7,4 tháng đối vởi
nhóm VOTRIENT và 3,8 tháng đối với nhóm giả dược.
Các tác dụng không mong muốn được liệt kê dưới đảy được xêp theo hệ cơ quan dựa
vảo MedDRA.
Các quy tắc được sử dụng để phân Ioạỉ tần suất: AL
Rắt thường gặp 2 mo
Thường gặp 2 11100 vả < 1/10
Ít gặp 2 1l1.000 vả < 111 00
Các mục phản loại đã được phản chia dựa vảo tần suát tuyệt đối trong các dữ liệu thử
nghiệm lâm sảng.
Các rối loạn trên hệ huyết học và hệ bạch huyết
Thường gặp Giảm tiều cầu
Giảm bạch cằu trung tinh
Các rối loạn về nội tiết
Thưởng gặp Giảm chức năng tuyên giáp '
Cảo rối Ioạn trên chuyển hóa vả dinh dưỡng
Rất thưởng gặp Biêng ăn
Thướng gặp Sụt cân
Cảc rối loạn trên hệ thần kinh
Rất thuờng gặp Đau đầu
Thuớng gặp Cơn thiếu mảu não cục bộ thoáng qua*
Loạn vị giác
Ỉt gặp Đột quỵ do nhồi máu năo'
Các rối Ioạn trên tim
Thướng gặp Thiêu mảu cơ tim“
Page 8 of 16
CONFIDENTIAL
Kéo dải khoảng QT*
Ít gặp Xoắn đỉnh“
Rối loạn chức năng tim (như giảm phản suất tống máu vả suy tim
sung huyết)
Nhồi máu cơ tim“
Các rối loạn trên mạch
Rất thuớng gặp Tảng huyết áp“
Xuất huyết*
Thướng gễP Chảy máu cam
Tiếu máu ẢJ/
Ỉl gặp Xuất huyết trong phồi
Xuất huyết tiêu hóa
Xuất huyêt não
Các rối loạn đường tiêu hóa
Rất thướng gặp Tiêu chảy
Buồn nôn
Nôn
Đau bụng
Thướng gặp Khó tiêu
Tăng men Iipase
Ít gặp Thủng dạ dảy-ruột*
Rò dạ dảy— ruột“
Các rối Ioạn trên gan mật*
Rất thường gặp Tăng men Aianine aminotransferase
Tăng men Aspartate aminotransferase
Thướng gặp Bắt thường chức năng gan
Tăng bilirubin máu
Các rối Ioạn trên da và mộ dưới da
Rất thuớng gặp Mắt sắc tố iông tóc
Thướng gặp Phát ban
Page 9 of 16
CONFIDENTIAL
Rung tóc
Mảt sắc tố da
Hội chứng bản tay — bản chân (Paimar-piantar
erythrodysaesthesia syndrome)
Các rối Ioạn trẽn thặn và đường tiết niệu
Thướng gặp Protein niệu*
Các rối loạn toản thân và tại chỗ
Rất thường gặp Mệt mỏi
Suy nhược '
Đau ngưc' Á`WÁ/
'Xem phần Cảnh báo vả Thận trọng để có thẻm thông tin.
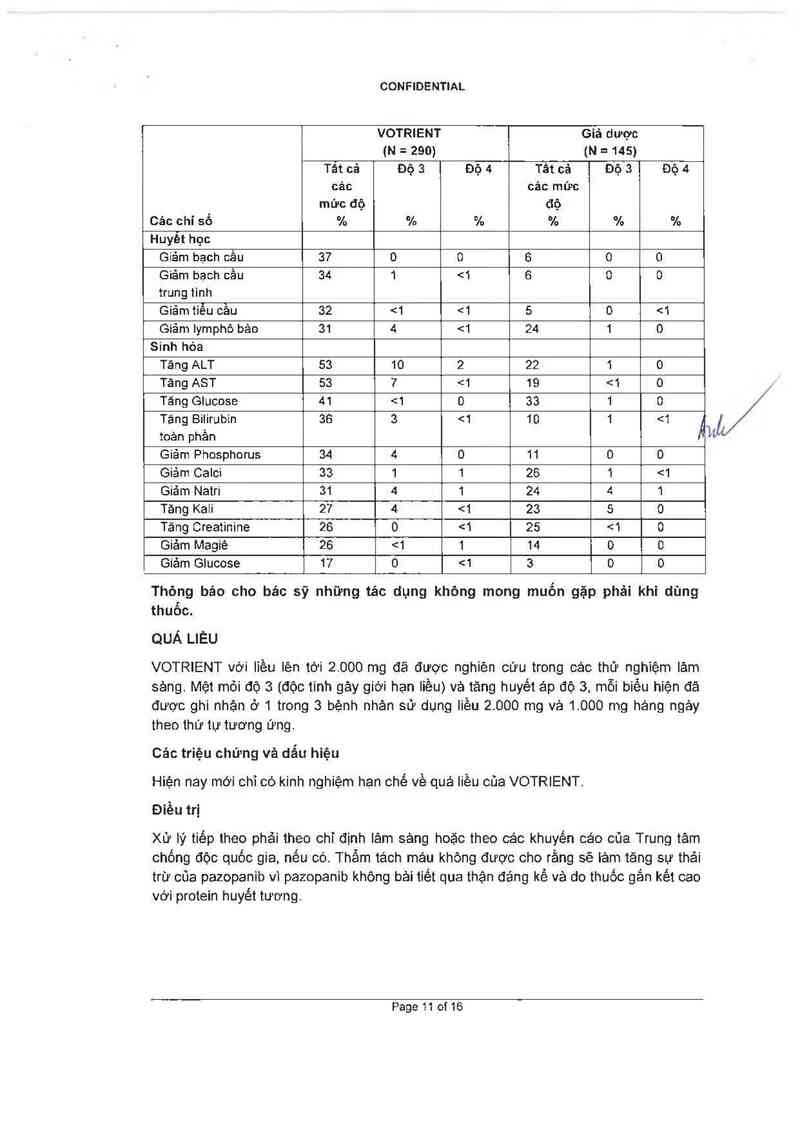
Bảng 1 trình bảy các bất thường về chỉ số xét nghiệm xuất hiện ở a 15 % số bệnh nhân
sử dụng VOTRIENT. Các cấp độ được dựa theo NCI CTCAE.
Bảng 1 Các bắt thường về chí số xét nghiệm được lựa chọn ở 2 15 % số bệnh
nhản sữ dụng VOTRIENT và thường gặp hơn so với nhóm Giả dược.
Page 10 0116
CONFIDENTIAL
VOTRIENT Giả dược
(N = 290) (N = 145)
Tẫt cả Độ 3 Độ 4 Tẳt cả Độ 3 Độ 4
cảt: cảc mứt:
mữc độ độ
Cảc chỉ số % % % % % %
Huyết học
Giảm bạch cầu 37 0 0 6 0 0
Giảm bạch cầu 34 1 <1 6 0 0
trung tinh
Giảm tiếu cầu 32 <1 <1 5 0 <1
Giảm Iymphô bảo 31 4 <1 24 1 0
Sinh hòa
Tăng ALT 53 10 2 22 1 0
Tảng AST 53 7 <1 19 <1 0
Tăng Glucose 41 <1 0 33 1 0
Tảng Bilirubin 36 3 <1 10 1 <1 A J
toản phần l“
Giảm Phosphorus 34 4 0 11 0 0
Giảm Calci 33 1 1 26 1 <1
Giảm Natri 31 4 1 24 4 1
Tăng Kaii 27 4 <1 23 5 0
Tăng Creatinine 26 0 <1 25 <1 0
Giảm Magiê 26 <1 1 14 0 0
Giảm Glucose 17 0 <1 3 0 0
Thông bảo cho bác sỹ những tác dụng không mong muốn gặp phải khi đùng
thuốc.
QUÁ LIỂU
VOTRIENT với lìều Iện tới 2.000 mg đã được nghiện cứu trong các thử nghiệm lâm
sảng. Mệt mỏi độ 3 [độc tinh gây giới hạn liều) vả tăng huyết ảp độ 3, mỗi biều hiện đã
được ghi nhận ở 1 trong 3 bệnh nhản sữ đụng liều 2.000 mg và 1.000 mg hảng ngảy
theo thứ tự tương ứng.
Các triệu chứng vả dấu hiệu
Hiện nay mới chỉ có kinh nghiệm hạn chế về quá liễu của VOTRIENT.
Điều trị
Xử lý tiêp theo phải theo chỉ định lâm sảng hoặc theo các khuyến cáo của Trung tâm
chống độc quóc gia, nếu có. Thẩm tảch máu không được cho rằng sẽ Iảm tăng sự thải
trừ cũa pazopanib vì pazopanib không bảỉ tiết qua thận đảng kế vả do thuốc gắn kêt cao
với protein huyêt tương.
Page11 0116
CONFIDENTIAL
DƯỢC LÝ HỌC LÂM SÀNG
Dược lực học
ATC Code
Nhóm dược trị liệu: Cảo tác nhân chống ung thư — Tác nhân ức chế men Protein kinase,
ATC CodezL01XE11.
Cơ chế tác dụng
VOTRIENT được sử dụng theo đường uống, lả tảo nhân ức ohê hiệu quả men tyrosine
kinase (TK!) tại nhiều điểm đích của các thụ thế yếu tố tăng trưởng nội mạc mạch máu
(VEGFRM, -2, vả -3, yếu tố tăng trưởng có nguồn gốc tiếu cầu (PDGFR)-ơ và -B, vả
thụ thể yêu tố tế bảo gốc (c—KIT), với các giá trị leo lần lượt tương ứng lả 10, 30, 47,
71, 84 vả 74 nM. Trong các thử nghiệm tiền lâm sảng, pazopanib ức chế quá trình
phosphoryl hóa tự động cảm ứng bởi các gốc kết hợp trện các thụ thể VEGFR-2, c-Kit
vả PDGFR-B trong tế bảo phụ thuộc theo liều dùng. In vivo, pazopanib ức chế quá trinh
phosphoryl hóa VEGFR—2 cảm ứng bởi VEGF ở phồi chuột nhắt, sự hình thảnh mạch ở
nhiêu mô hinh thứ trên cảc Ioải động vật khác nhau, và sự tảng trưởng của quá trinh
nhản iên khỏi u của người ghép dị chủng trện chuột nhắt.
Dược động học W
Hấp thu
Pazopanib được hắp thu theo đường uống với giá trị trung vị thời gian đạt nồng độ đỉnh
từ 2,0 đến 4.0 giờ sau khi uống. sư dụng hảng ngảy lảm tăng AUC từ 1,23 tới 4 lần.
AUC vả Cmax khỏng tăng liên tục khi iièu dùng VOTRIENT tăng trên 800 mg.
Phơi nhiễm toản thân đói với pazopanib đã tăng lên khi uống thuộc cùng với thức ăn.
Sử dụng VOTRIENT cùng với cảc bữa ăn nhiều hoặc ít chảt béo dẫn đên tăng khoảng 2
lần AUC và c… Vì thế, cần phải uống VOTRIENT it nhắt 1 giờ trước hoặc 2 giờ sau
bữa ản (xem phân Liều dùng về Cách dùng).
Uống một liều đơn pazopanib 400 mg ở dạng viện nén đă được nghiền iâm tăng AUC…
72, thêm 46% vả tăng Cmax khoảng 2 Iản vả iảm giảm t,… khoảng 1,5 giờ khi so sánh với
uống nguyên viện. Kết quả nảy cho thấy sinh khả dụng và tỉ lệ hấp thu pazopanib theo
đường uống đá tảng lẻn khi uống viện nén đã được nghiền so với uống nguyên viện. \A
thé. do có khả năng tăng phơi nhiễm, nên không được nghiền hoặc nhai nát viên nén
VOTRIENT khi uống (xem phần Liều dùng vá Cảch dùng).
Phân bố
Pazopanib gắn vảo protein huyết tương người in vivo trên 99 % khỏng phụ thuộc nồng
độ trong khoảng 10-100 ụg/ml. Các nghiên cứu in vitro gợi ý rằng pazopanib lả cơ chảt
cùa P-glycoprotein (ng) vả protein khảng ung thư vú (BCRP).
Page 12 of16
CONFIDENTIAL
Chuyển hóa
Các kêt quả từ cảc nghiện cứu in vitro cho thảy rằng quá trình chuyền hóa của
pazopanib chủ yêu qua trung gian CYP3A4, với sự đóng góp một phần nhỏ bởi CYP1A2
vả CYP2C8.
Thải trừ
Pazopanib được thải trừ chặm với thời gìan bản thải trung bình là 30,9 giờ sau khi sử
dụng liều thông thường 800 mg. Thuốc thải trừ chủ yêu qua phán với tỉ lệ thải trừ qua
thận < 4 % cùa liều đã sử dụng.
Các đối tượng đặc biệt
Suy thận
Trong một phản tích dược động học quần thế sử dụng 408 đối tượng mắc nhiều ioại
ung thư khảc nhau, độ thanh thải creatinine (30—150 mllphủt) không ảnh hướng đên độ
thanh thải của pazopanib. Suy thận không được cho là có ảnh hưởng đến phơi nhiễm
cùa pazopanib, vả không cần chỉnh Iiều ở bệnh nhản có độ thanh thải a 30 mllphủt.
Suy gan
Trung vi nồng độ ồn định Cmax vả AUCMU cùa pazopanib ở bệnh nhản suy gan nhẹ
(xác định theo bilirubin binh thường vả mức độ tăng ALT hoặc tăng bilirubin lẻn tới 1,5
lần ULN bất kể ALT ở mức nảo) sau khi dùng liều 800 mg một lần mỗi ngảy (30,9 ụg/ml,
khoảng 12,5-47,3 vả 841,8 ug.giờlml, khoảng 600,4-1078) tương tự như ở bệnh nhân
không bị suy gan (49,4 ug/ml, khoảng 17,1-85,7 vả 888,2 ug.giờlml, khoảng 345,5-1482)
(xem Liều dùng vá cách dùng).
Liều VOTRIENT tối đa có thể dung nạp được ở bệnh nhân suy gan mức độ trung bình
(xác định theo mức độ tăng bilirubin › 1,5 đên 3 lần ULN bắt kẻ ALT ở mức nảo) là 200
mg một lần mỗi ngảy. Trung vị các giá trị ở trạng thải ồn định C,… (22,4 ug/ml, khoảng
6,4-32,9) vả AUCiow (350,0 ụg.giờiml. khoảng 131,8-487,7) sau khi uống 200 mg
VOTRIENT một lần mỗi ngảy ở bệnh nhản suy gan mức độ trung bình tương ứng
khoảng 45% vả 39% các giá trị trung vị C,… vả AUC…ụ, sau khi uống 800 mg một lần
mỗi ngảy ở bệnh nhản có chức nảng gan binh thường (xem Liều dùng vá Cách dùng).
Chưa có đủ dữ liệu ở bệnh nhân suy gan nặng (bilirubin toản phần > 3 lần ULN bảt kể
ALT ở mức nảo); do đó, không nện dùng VOTRIENT ở những bệnh nhản nảy.
Các nghiên cứu lâm sảng
Tinh an toản và hiệu lực của VOTRIENT trên các bệnh nhân bị ung thư biểu mô tế bảo
thận (RCC) đă được đảnh giá trong một nghiên cứu ngẫu nhiên, mù đôi, đa trung tâm,
có đối chứng với giả dược. Các bệnh nhản (N= 435) mắc RCC tiền triền tại chỗ vảlhoặc
di căn được phân ngẫu nhiên để sử dụng VOTRIENT 800 mg một lản mỗi ngảy hoặc
giả dược. Mục tiệu chính cùa nghiên cứu lả đánh giá và so sánh hai nhóm điều trị về
thời gian sống còn không có tiến triền bệnh (PFS) và tiêu chí đánh giá phụ chủ yếu là
Page 13 of16
CONFIDENTIAL
sống còn toản bộ (08). Cảo mục tiệu khác iả đảnh giả ti iệ đáp ứng toản bộ vả thời gian
đáp ứng.
Từ tồng số 435 bệnh nhân trong nghiên cứu nảy, 233 bệnh nhân chưa từng được điều
trị và 202 bệnh nhân được điều trị bước hai, những bệnh nhân nảy đă được sử dụng
phảc đồ dựa trèn lL-2 hoặc iNFnt trước đó. Khả nãng hoạt động của bệnh nhân (ECOG)
tương tự nhau giữa nhóm VOTRIENT vả nhộm giả dược (ECOG D: 42 % so với 41 %,
ECOG 1: 58 % so với 59 %). Tất cả các bệnh nhân có kềt quả mô học lả tế bảo sáng
hoặc chủ yếu lả tế bảo sảng. Khoảng một nữa số bệnh nhản có đi căn ở 3 cơ quan hoặc
nhiều hơn vả phần lớn có di cản phổi (74 %>, vả/hoặc hạch bạch huyết (54 %) khi bắt
đầu nghiên cứu.
Cảo tỉ lệ về số bệnh nhân chưa từng được điều trị vệ số bệnh nhân được điêu trị trước
đó với cytokine trong mỗi nhóm lả tương tự nhau (53% vả 47% trong nhỏm VOTRIENT, _
54% và 46% trong nhộm giả dược). Trong phân nhóm bệnh nhản đã được điều trị trướ /
đó với cytokine. phần lớn (75%) lá sử đụng phác đồ dựa trèn interferon. ẨnL,
Các ti lệ là tương tự trong mỗi nhóm về số bệnh nhân trước độ đã được phẫu thuật cắt
bỏ thận (89% trong nhộm VOTRIENT vả 88% trong nhóm giả được) vảlhoặc trước đó
đã được xạ trị (22% trong nhóm VOTRIENT và 15% trong nhóm giả được).
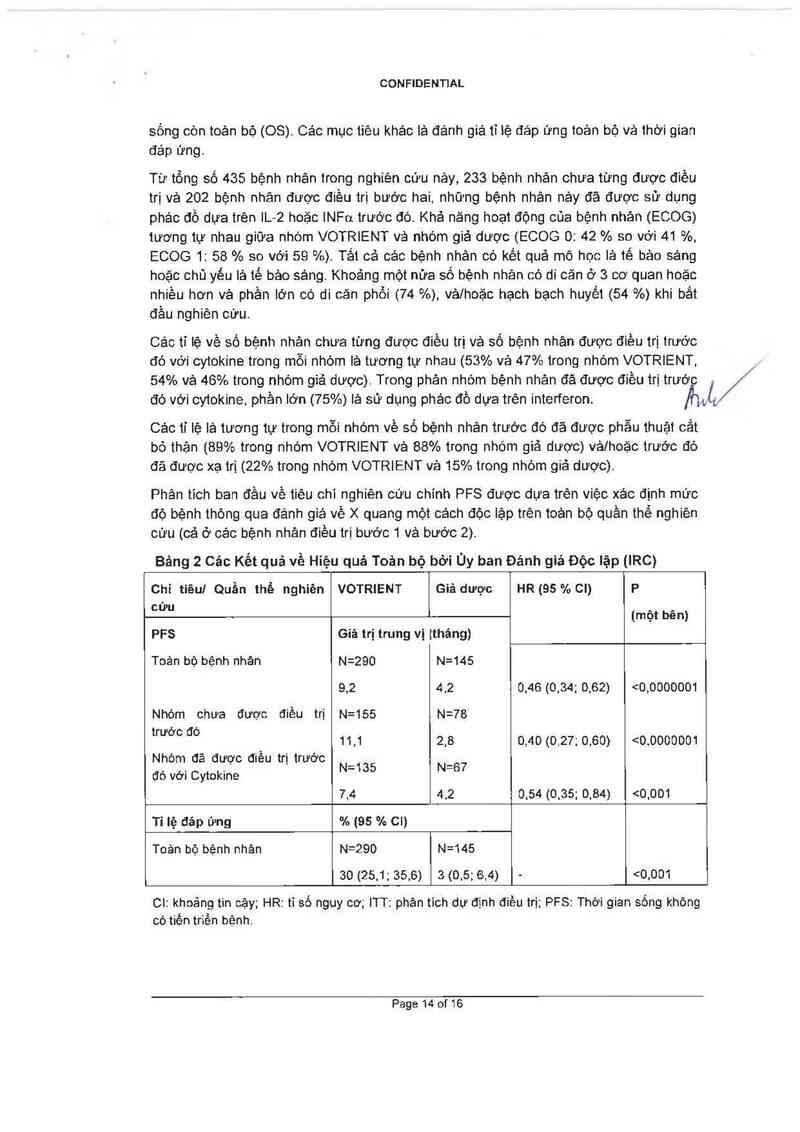
Phản tich ban đầu về tiệu chi nghíên cứu chính PFS được dưa trên việc xảo định mức
đó bệnh thòng qua đảnh giá vè )( quang một cảch độc lập trên toản bộ quần thể nghiên
cừu (cả ở cảc bệnh nhân điều trị bước 1 vệ bước 2).
Bảng 2 Các Kết quả về Hiệu quả Toản bộ bới Úy ban Đảnh giả Độc lập (IRC)
Chi tiêui Quần thể nghiên VOTRIENT Giả được HR (05 % cn P
CỬ" (một bẽn)
PFS Giá trị trung vị ltháng)
Toản bộ bệnh nhân N=290 N=145
0,2 4,2 0,40 (0,34; 0,02) <0,0000001
Nhóm chưa được điều trị u=1ss N=7s
WỚC đò ` 11,1 2,8 0,40 (0.27; 0.60) <0,0000001
7,4 4,2 0,54 (0,35; 0,84) <0,001
Tỉ lệ đáp ứng % [95 % CI)
Toản bộ bệnh nhản N=290 N=145
30 (25,1; 35,0) 3 (0,5; 6,4) - <0,001
Cl: khoảng tin cậy; HR: tỉ số nguy cơ; ITT: phân tìch dự định điêu trị; PFS: Thời gian sống không
có tiên triền bệnh.
Page 14 of 16
CONFIDENTIAL
Đối với các bệnh nhân đã đáp ứng với điều trị, trung vị của thời gian đáp ứng lệ 58,7
tuần theo đánh giá độc lập.
Trong một nghiên cứu chinh, các đánh giá về Chảt lượng cuộc sống (QoL) được dựa
trên thang điếm tự bảo các Iảm mù từ hai bảng câu hòi được thiết kế phù hợp theo đề
cương nghiên cứu, EORTC QLQ-C3O vả EuroQoL EQ-SD. Phân tích được dựa trên
những bệnh nhân tiếp tục được điều trị trong cả 2 nhớm, trước khi có tiến triền bệnh.
Các đảnh giá đã cho thấy khỏng có sự khác biệt giữa nhóm được điều trị với
VOTRIENT hoặc nhóm giả được (p › 0,05), điều nảy chi ra rằng không có ảnh hưởng
tiêu cực cùa VOTRIENT trèn Chảt lượng cuộc sống.
Trong một nghiên cứu Pha 2 trẻn 225 bệnh nhân ung thư biều mô tế bảo thận rõ rệt tái
phát tại chỗ hoặc di cản, tỉ iệ đáp ứng lả 35 % vả giá trị trung vị cùa khoảng thời gian có
đảp ứng lả 68 tuần theo đánh giá độc lập.
HẠN DÙNG
24 tháng kế từ ngảy sản xuất.
BẢO QUẢN
Bảo quản không quá 30°C.
ĐỂ XA TÀM TAY TRẺ EM
ĐỌC KỸ HƯỞNG DÃN sứ DỤNG TRƯỞC KHI DÙNG
NẺU CẢN THÊM THÔNG TIN XIN HỎI Ý KIÉN BÁC SỸ
SẢN XUẤT Bời
Glaxo Operations UK Limited,
Priory Street, Ware, Hertfordshire, SG12 ODJ,
United Kingdom
ĐÓNG GÓI BỞI
Glaxo Wellcome S.A.,
Avda. de Extremadura, 3,
' PHÓ CỤC TRƯỞNG
09400 — Aranda de Duero, Burgos, Spain JV ~i V(ĨM Wímá
VOTRIENT lả nhãn hiệu thương mại đã đăng ký của GiaxoSmithKline group of
companies.
Page 15 of16
CONFIDENTIAL
Dựa trèn tPl 05 ngảy 30 tháng 01 năm 2011
VOTTAB 0311-051300111
Page 16 of 16
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng