




















........... ..g
Wwww=xsumw
M'Ww mmxa
aLsows ION …
qaịqez aseapL-paauoioid oc
ux .aunmum
L ................... -- ..................
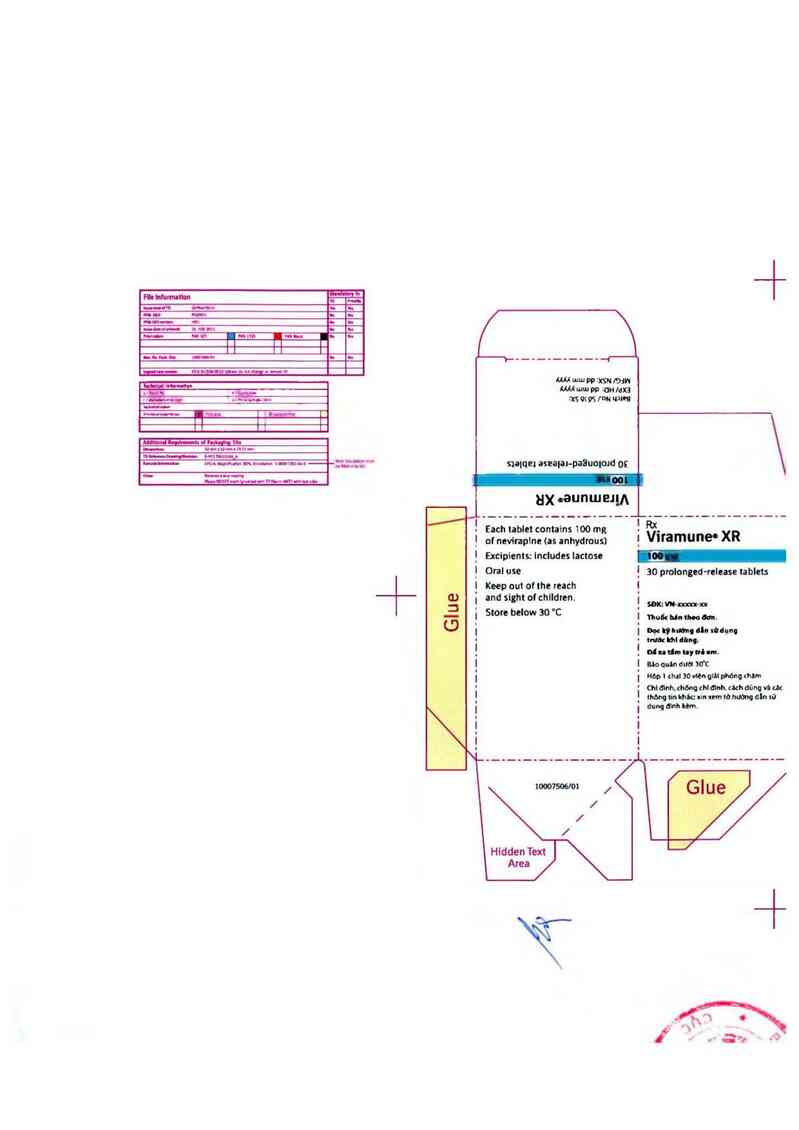
. Each tabletcontains100mg ~ Rx_ R
| ofnevinpine(asanhydmusi i Vlfamune'x
Excipìents: includes Iactose
Onl use 30 prolonged-relnse tablets
Keep out of the reach
and sight ol chllđren.
. SBK:Wm
Store below 30 C mú mm h_
Dụ Ith Ila lửdung
lưk … m..
Nomia dum 30'(
NOpl dut 30 vtén glll phóng zhan
Oil d'lnh. đL6ơiị 5 X giới hạn trên của mức bình thường (ULN=
Upper Limit ofNormality) cho đên khi ASAT/ALAT cơ bản ổn định < 5 X ULN.
Không nên dùng lại VIRAMUNE cho những bệnh nhân đã dược yêu cầu ngừng thuốc vĩnh viễn
do phát ban nặng, phảt ban đi kèm với cảc triệu chúng toản thân, cảc phản ứng quá mẫn, hoặc
viêm gan trên lâm sảng do nevirapine.
Khỏng nến dùng lại VIRAMUNE cho những bệnh nhân đã t_ừng có ASAT hoặc ALAT > 5 X
giởi hạn Lrẽn cùa mức binh thường (ULN) trong thời gian điếu trị với nevirapine vả tải xuất hiện
bất thường chức năng gan khi điếu trị lại với nevirapine (xem Thận trọng và Cảnh bảo đặc biệt).
Chống chỉ định trong trường hợp bệnh di truyền hiếm gặp có thế tương kỵ với một tá dược của
thuốc (xem Thận trọng vả Cảnh báo đậc biệt).
Không đưọo dùng cảc chế phẩm thảo được chứa cò St John (hypericum perforatum) trong khi
dùng VIRAMUNE do nguy cơ giảm nồng độ nevirapine trong huyết tương và giảm tảo dụng lâm
sảng (xem Tương tảo).
Cảnh bảo và _t_hân trong đăc biêt
18 tuần điều trị đầu tiên với VIRAMUNE là giai đoạn quan trọng cần theo dõi bệnh nhãn
chặt chẽ để phảt hiện cảc khả năng xuất hiện phân ứng trên da nghiêm trọng và đe dọa
tính mạng (bao gôm hội chứng Stevens- Johnson và hoại từ biểu bì nhiễm độc) và viêm
ganlsuy gan nặng.
Nguy cơ lớn nhẩt của cảc biến cổ ở _gan và phản ứng trên da xuất hiện trong 6 tuần điều trị
đầu tiên. Tuy nhiên, nguy cơ của bẩt kỳ biến cổ ở gan nảo cũng có thể xuất hỉện sau giai
đoạn nây và nên tiếp tục theo dõi định kỳ. Phụ nữ và những ngườiJ có số lượng tế bảo CD4+
cao hơn tại thời điểm bắt đầu điều trị với VIRAMUNE (> 250/mm ở nữ giới trưởng thânh
vả > 400/mm ở nam giới trưởng thảnh) thường có nguy cơ cao bị tảc dụng bẫt lợi ở gan
nểu bệnh nhân được phát hiện có HlV- ] RNA trong huyết tương- như nông độ > 50
bảnlmL- tại thời điểm bắt đầu dùng VIRAMUNE.
Do độc tính trên gan nặng và đe dọa tính mạng đã được quan sảt thấy trong các nghiên
cứu có đối chửng và không đối chứng chủ yếu ở những bệnh nhân có số lượng virus HlV-l
trong huyết tương 2 50 bản/mL, không nên bắt đầu dùng VIRAMUNE cho bệnh nhân nữ
trưởng thảnh với số lượng tế bảo CD4+ > 250 tế bảolmm3 hoặc bệnh nhân nam trường
thảnh với số lưọng tế bảo CD4+ > 400 tể bảo/mmJ những người được phảt hiện HlV-l RNA
trong huyết tương trừ khi lợi ich vượt trội nguy cơ.
Trong một số trường hợp tổn thương gan tiếp tục tiến triễn mặc dù ngừng điều trị.
Bệnh nhân xuất hiện cảc dẩu hiệu hoặc triệu chứng viêm gan, phân ứng da nặng hoặc phản
ứng quả mẫn thì phải ngừng VIRAMUNE và đánh giá lâm sảng ngay lập tức.
Không nên dùng lại VIRAMUNE sau khi cảc phản ứng nặng trên gan, da hoặc quá mẫn \Mị
nặng.
Cần tuân thủ liều dùng một cảch nghiêm ngặt, đặc biệt giai đoạn dẫn đầu 14 ngảy (xem
Liều lượng và cảch dùng).
Phản ứng trên da
Các phản ứng trên da nặng và đế dọa tính mạng, kể cả tử vong, đã xưất hiện ở những bệnh nhân
điều trị với V1RAMUNE,bao gồm hội chứng Stevens Johnson (SJS), hoại tử biếu bì nhiễm độc
(TEN) và hội chứng quả mẫn thế hiện bời phát ban, cảc triệu chứng toản thân, và tổn thương nội
tạng. Bệnh nhân nên được theo dõi chặt chẽ trong 18 tuân điêu trị đâu tiên. Nên theo dõi chặt chẽ
bệnh nhân nêu có xuât hiện phảt ban đơn độc.
Phải ngừng VIRAMUNE vĩnh viễn ờ bắt kỳ_ bệnh nhân nảo xuất hiện phảt ban nặng hoặc phát
bạn đi kèm cảc triệu chứng toản thân (như sốt, _giộp da, sang thương ở miệng, viêm kết mạc, phù
mặt, nhức cơ hoặc khớp, hoặc mệt mòỉ), bao gôm hội _chứng Stevens—Johnson, hoặc hoại tử biếu
bi nhiễm độc. Phải ngừng VIRAMUNE vĩnh viễn ở bất kỳ bệnh nhân nảo có phản ứng quả mẫn,
biền hiện bằng phảt ban với cảc triệu chứng toản thân, đi kèm với tốn thương nội tạng, như viêm
gan, tảng bạch cầu ải toan, giảm bạch cầu hạt, vả rối loạn chức năng thận hoặc cảc dấu hiệu tốn
thương nội tạng khảo (xem Tảo dụng phụ).
Nên thông bảo cho bệnh nhân biết độc tinh chính cùa VIRAMUNE lả phảt ban. Nên tuân thủ
giai đoạn điêu trị dẫn đầu do đã được chứng minh Iảm giảm tân xuât phảt ban (xem Liêu lượng
và cảch dùng).
Da phần phảt bản do VIRAMUNE xuất hiện trong sảu tuần điều trị đầu tiên, do đó bệnh nhân
nên được theo dõi chặt chẽ để phảt hiện ban trong giai đoạn nảy.
Đối với VIRAMUNE viên giải phóng chậm, nên hướng dẫn cho bệnh nhân là họ không được
dùng VIRAMUNE viên giải phóng chậm cho đến khi không còn bất kỳ ban nảo xuất hiện trong
giai đoạn dẫn đầu 14 ngảy với VIRAMUNE viên giải phóng nhanh. Phảc dồ Iiều 200 mg một lần
mỗi ngảy không nên kéo dải quả 28 ngảy mả khi đó nên thay thế bằng phác dồ điều trị khảng
retrovirus khảo.
Một số hiếm trường hợp gặp tiêu cơ vân ở những bệnh nhân có phản ứng trên da vảlhoặc trên
gan Iiên quan đên sư dụng VIRAMUNE.
Các yếu tố nguy cơ để xuất hiện phản ứng trên da n_ặng bao gồm không tuần thú liều dùng 200
mg mỗi ngảy trong giai đoạn d_ẫn đầu. Việc chậm đến khảm bảo sĩ khi có cảc triệu chứng ban
đầu có thể gây tăng nguy cơ trầm trọng hơn cùa cảc phản ứng trên da. Phụ nữ dường như có
nguy cơ phảt ban cao hơn nam giới, bất kể trong phảc đồ điều trị có VIRAMUNE hay không có
VIRAMUNE.
Bắt kế bệnh nhân nảo cỏ phảt ban nặng hoặc phát ban đi kèm cảc triệu chứng toản thân như sốt,
gỉộp da, tổn thương miệng, viêm kết mạc, phù mặt, nhức cơ hoặc khớp, hoặc mệt mỏi thì nên
ngừng thuốc và đến khảm bác sĩ ngay. Không nến dùng lại VIRAMUNE cho những bệnh nhân
nay.
Nếu bệnh nhân phảt ban nghi ngờ do VIRAMUNE, nên kiếm tra chức năng gan. Nên ngừng
VIRAMUNE vĩnh viễn ờ những bệnh nhân tăng men gan trung binh đến nặng (ASAT hoặc
ALAT > 5 X ULN).
Nếu xuất hiện phản ứng quả mẫn, biều hiện bằng phảt ban với các triệu chứng toản thân như sốt,
đau khớp, đau cơ và bệnh bạch huyết, kèm tốn thương nội tạng như viếm gan, tăng bạch cầu ải
toan, giảm bạch câu hạt, và rôi Ioạn chức năng thận, nên ngửng nevirapine vĩnh viễn vả không
được dùng lại.
Phản ứng trên gan
Nhiễm độc gan nặng hoặc đe dọa tính mạng, kể cả viêm gan tối cắp gây tử vong đã xưất hiện ở
những bệnh nhân điều trị với VIRAMUNE. 18 tuần điếu trị đẳu tiên là giai đoạn cằn thiết yêu
cằu theo dõi chặt chẽ. Nguy cơ cảc biến cổ ở gan lớn nhất trong 6 tuẫn điếu trị đẩu tiên.
Tuy nhiên nguy cơ có thể kéo dải qụa giai đoạn nảy vả nên theo dõi dịnh kỳ liên tục trong thời
gian điếu trị. Nên cho bệnh nhân biết cảc phản ứng trên gan lả dộc tinh chinh của VIRAMUNE.
Bệnh nhân có các dấu hiệu hoặc triệu chứng của viêm gan phải ngừng dùng VIRAMUNE vả
đảnh giả y_ khoa ngay, kể cả xét nghiệm chức năng gan.
Một sô hiếm trường hợp đã gặp teo cơ vân ở những bệnh nhân có cảc phản ứng trên da vảlhoặc
trên gan liên quan đển sư dụng VIRAMUNE.
Dộc tinh gan nặng, kế cả _suy gan cẳn cấy ghép, đã được bảo cảo ở những bệnh nhân không
nhiêm H_1V dùng nhiêu Iiêu VIRAMUNE trong dự phòng sạu phơi nhiễm (PEF), là chỉ định chưa
được châp thuận vả do dó khỏng nến dùng.
Tăng nồng độ ẠSA'1“ hoặc ALAT > 2,5 X ULN vảlhoặc đồng nhiễm viêm gan B vả/hoặc C tại
thời điêm băt đâu_điêu trị khảng retrovirus đi kèm với nguy cơ cao cảc biêu hiện bất lợi ở gan
trong thời gian điêu trị với thuôo kháng retrovirus nói chung, kê cả phảc dỗ có VIRAMUNE.
Nữ giới và số lượng CD4+ cao hơn ngay khi bắt đầu điếu trị với VIRAMUNE ở những bệnh
nhân chưa được điếu trị đi kèm với tăng nguy cơ biến cổ ở gan. Đảnh giả hồi cứu chủ yếu trên
những bệnh nhân có lượng virus HIV-l 50 bản/mL hoặc cao hơn, phụ nữ với số lượng CD4+ >
250 tế bảo/mm3 có nguy cơ Lâng gắp 12 lần bị tác dụng ngoại ý trên gan có triệu chứng so với
phụ nữ với số lượng CD4+ <250 tế bảo/mm3 (| 1% so với 0,9%). Đã thắy nguy cơ tăng cao ở
nam giới có H1V-I RNA trong huyết tương và số lượng CD4+ > 400 tế bảo/mm3 (6,3 % so với
1,2 % ờ nam giới với số lượng tế bảo CD4 < 400 tế bảo/mmj). Nguy cơ độc tinh tăng cao dựa
trên ngưỡng số lượng CD4+ chưa được phát hiện ở những bệnh nhân không dịnh lượng được tải
lượng virus huyết tương (tức là <50 bản/mL).
Theo dõi chức nãng gan
Đã có bảo cảo bất thường xét nghiệm chức năng gan với VIRAMUNE, đôi khi trong những tuần
điếu trị đầu tiên. Tăng men gan không triệu chứng thường được bảo cảo và không chống chỉ định
dù_ng VIRAMUNE. Tăng GGT khỏng triệu chứng không phải là chống chi dịnh cho việc tiếp tục
diều trị.
Cần phải theo dõi xét nghiệm chức nảng gan _định kỳ, tùy theo yêu cầu lâm sảng cùa bệnh nhân,
nhất 1ả_trong 18 tuần điều trị đầu tiên Nên tiếp tục theo dõi lâm sảng vả xét nghiệm_ trong thời \Ồrị_ị
gian điểu trị bằng VIRA_MUNE. Thầy thuốc vả bệnh nhân nên thận trọng với cảc dấu hiệu hoặc
triệu chứng bảo trước về viêm gạn, như chản ăn, buồn nôn, vảng da, bilirubin niệu, phân bạc
mảư, gản to hoặc căng đau. Nên khuyên bệnh nhân đi khám bảo sĩ nếu xuất hiện cảc triệu chứng
trên.
Đối v_ới những bệnh nhân đang dùng VIRAMUNE viên giải phóng nhanh hai lần mỗi ngảy
chuyên sang VIRAMUNE viên giải phóng chậm một lần mỗi ngảy, không cân thay đôi lịch trình
theo dõi bệnh nhân.
Khi giá trị ASAT hoặc ALAT > 2,5 x ULN trước hoặc trong thời gian điều trị, nên theo dõi xét
nghiệm chức năng gan thường xuyên hơn trong những lẳn thăm khám lâm sảng. Không nên dùng
VIRAMUNE cho những bệnh nhân có ASAT hoặc ALAT › 5 x ULN trước điều trị cho đến khi
ASAT/ALAT khi bắt đầu điều trị ốn định tại mức < 5 x ULN.
Nên ngừng VIRAMUNE ngay khi ASAT hoặc ALAT tãng > 5 X ULN trong thòi gian điều
trị. Nếu ASAT vã ALAT trở về giá trị ban đầu và nếu bệnh nhân không có các dẩn hiệu
hoặc triệu chứng lâm sảng viêm gan hoặc các triệu chứng toản thân hoặc cảc dấu hiệu khác
gợi ý rối loạn chửc nãng cơ quan, thì có thể sử dụng lại VIRAMUNE dựa trên nhu cầu và
đánh giá lâm sâng, tùy từng trường hợp.
Nên hết sức thận trọng về lâm sảng vả xẻt nghỉệm khi dùng lại VIRAMUNE với liếu khởi
đầu 1 viên giải phỏng nhanh 200 mg một lần mỗi ngảy trong 14 ngảy, tiếp nối bỏ1'
VIRAMUNE vỉên phóng nhanh 200 mg hai lần mỗi ngây hoặc 1 viên VIRAMUNE giải
phỏng chậm 400 mg một lần mỗi ngây. Nếu tái xuất hiện bẩt thường chức nãng gan, nên
ngừng VIRAMUNE vĩnh viễn.
Nếu xuất hiện viêm gan trên lâm sảng, thể hiện bằng chản ăn, buồn nôn, nôn, vảng da VÀ
biễu hiện xét nghiệm (như bất thường xét nghiệm chức nãng gan trung binh hoặc nặng
(ngoại trừ GGT)), phải ngừng VIRAMUNE vĩnh viễn. Không nên sử dụng lại VIRAMUNE
cho những bệnh nhân đã phải ngừng VIRAMUNE vĩnh viễn do viêm gan trên lâm sâng.
Cảnh bảo khác
Cảc biều hiện sau đây cũng được bảo cảo khi sử dụng VIRAMUNE kết hợp với cảc thuốc khảng
retrovirus khác: viêm tụy, bệnh thần kinh ngoại biên và giảm tiếu cầu. Những biếu hiện nảy
thường Iiên quan đến cảo Lhuốc kháng retrovirus khảc vả có thể xảy ra khi dùng VIRAMUNE kết
hợp với cảc thuốc khảo; tuy nhiên những biều hiện trên khỏng thường xảy ra khi điều trị với %
nevirapine. /
Những bệnh nhân dùng VIRAMUNE hoặc bắt kỳ thuốc kháng retrovirus khảo có thể tiếp tục
mắc nhiễm khuấn cơ hội và cảc biến chứng khảo cùa nhiễm HIV, và do đó nên được theo dõi
lâm sảng chặt chẽ bời bác sĩ có kinh nghiệm đỉều trị bệnh HIV. Diều trị VIRAMUNE không cho
thắy giảm nguy cơ lây nhiễm ngang H1V-l cho người khảo.
VIRAMUNE được chuyền hóa rộng rãi ở gan và cảc chất chuyển hóa cùa nevirapine được bải
tiết phần lớn qua thận.
Cảo kết quả dược động học cho thắy cần thận trọng khi dùng VIRAMUNE cho những bệnh nhân
suy gan trung bình (ChiId-Pugh nhóm B).
Không nên dùng VIRAMUNE cho những bệnh nhân suy gan nặng (Child—Pugh nhóm C).
Chưa đảnh giả VIRAMUNE viên giải phóng chậm trên những bệnh nhân suy gan.
Chưa có nghiên cứu VIRAMUNE viên giải phóng chặm trên bệnh nhân suy thặn.
Không nên sử dụng cảc thuốc hormone không phải DMPA như phương phảp trảnh thai duy nhất
ở những phụ nữ dùng VIRAMUNE. Nevirapine có thế lảm giảm nồng độ cùa những thuốc nảy
trong huyết tương (xem Tương tảo). Do đỏ, nên theo dõi kết quả điếu trị khi điếu trị hormone
trong thời kỳ hậu mãn kinh cùng thời gian dùng VIRAMUNE.
Hội chứng tái kích hoạt miễn dịch
Những bệnh nhân nhiễm HIV có suy giảm miễn dịch nặng tại thời điếm điếu trị kết hợp thuốc
kháng retrovirus có thế xu_ất hiện phản ứng viếm không triệu chứng hoặc nhiễm khuần cơ hội và
gây tình trạng l_âm sảng trầm trọng, hoặc cảc triệu chứng tiến triển xấu. Đặc biệt, các phản ứng
trên thường xuất hiện trong những tuần hoặc thảng đầu tiên khi điều trị kết hợp với khảng
retrovirus. Ví dụ như viêm giảc mạc do cytomegalovirus, nhiễm nấm toản thân vảlhoậc tại chỗ,
viêm phồi do Pneumocystis carỉnỉi. Khi cẩn nên đánh giả và điếu trị thich hợp nếu có bất kỳ triệu
chứng viêm nảo.
Thận trọng khi dùng kết hợp với cảc thuốc khác (xem Tương tảo đế có thông tin chi tiết)
VIRAMUNE có thế lảm thay đỏi nông độ trong huyêt tương cùa cảc th uốc khác, và cảc thuốc
khảo có thẻ ảnh hưởng đên nông độ trong huyêt tương cùa VIRAMUNE.
Không nên dùng VIRAMUNE kết hợp với những thuốc sau:
Efavirenz, rifampicin, ketoconazole; nêu không dùng kêt hợp vởi ritonavir liêu thâp:
fosamprenavir, saquinavir, atazanavir.
VIRAMUNE viên giải phóng chậm chứa 400 mg lactose cho liếu đề nghị tối đa mỗi ngảy. Bệnh
nhân với bệnh di truyền hiếm gặp không dung nạp galactose như galactose máu không được
dùng thuốc nảy.
Tương tảc _
Dữ liệu sau đây thu được khi sử dụng VIRAMUNE viên giải phóng nhanh nhưng có thế được ảp
dụng cho Lất cả cảc dạng bảo chế.
Đã chứng minh nevirapine là chất gây oảm ứng các men chuyến hóa cytochrome P450 ở gan
(CYP3A, CYP2B) và có thể gây giảm nồng độ trong huyết tương cùa cảc thuốc dùng đồng thời
và được chuyến hóa nhiếu tại gan_ bời CYP3A hoặc CYP2B (xem Dược động học). Do đó, có thế
cần chinh liếu nếu bệnh nhân đã on định với liếu dùng cùa một thuốc chuyến hóa bời CYP3A `\ẾW
hoặc CYP2B vả bắt đầu điều trị với nevirapine.
Sự hắp thu cùa nevirapine không bị ảnh hưởng bời thức ăn, thuốc khảng axit hoặc các thuốc có
công thức với chất đệm đặc tính kiếm.
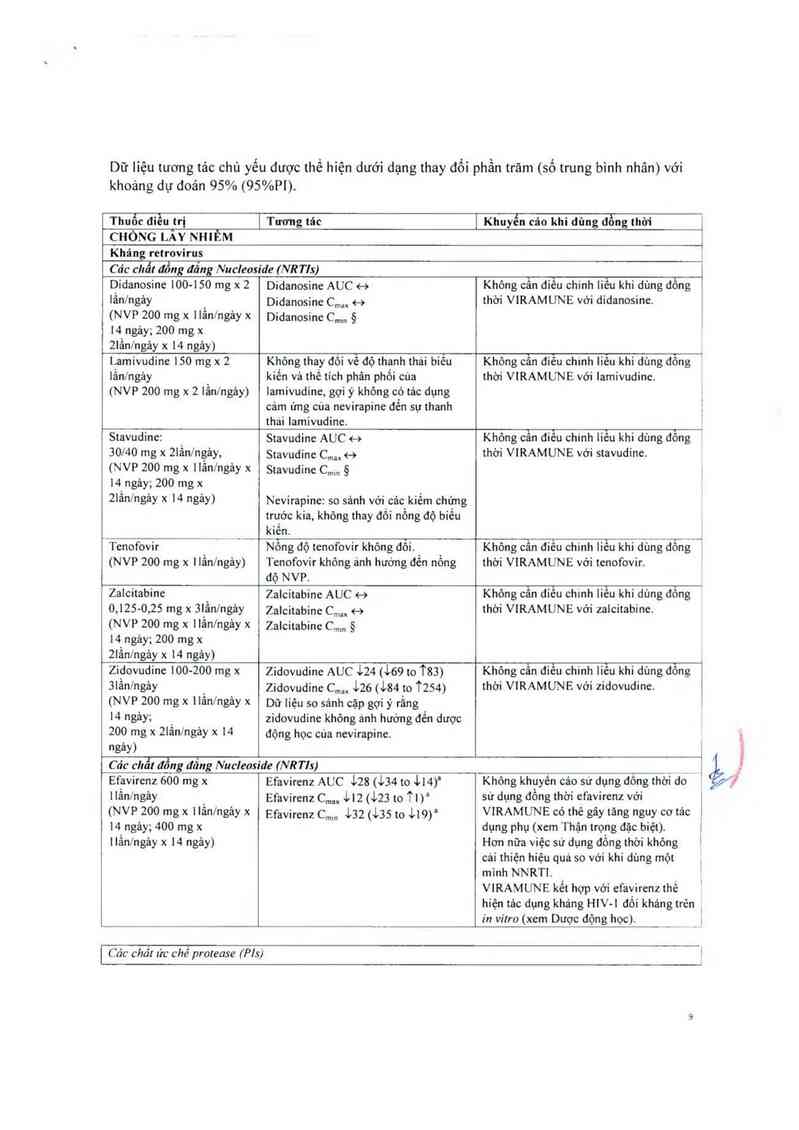
Dữ liệu tương tác chủ yếu được thế hiện dưới dạng thay đổi phần trăm (số trung bình nhân) với
khoảng dự đoản 95% (95%P1).
Thuốc điếu tri [
Tương tảc
] Khuyến cáo khi dùng đồng thời
CHỐNG LÂY NHIỄM
Khảng retrovirus
-Lụs _
Các chất đồng đãng Nucleoside (NR Tls)
1
Didanosine 100-150 mg x 2
lần/ngảy
(NVP 200 mg x Hẳnlngảy x
14 ngảy; 200 mg x
2lần/ngảy x 14 ngảy)
Didanosine AUC <——›
Didanosine C,… <—›
Didanosine Cmm 5
Không cẫn ớẵ chinh Iiếu khi dùng đông
thời VIRAMUNE với didanosine.
Lamivudỉne 150 mg x 2
lân/ngảy _
(NVP 200 mg x 2 lân/ngảy)
Không thay đôi vê độ thanh thải biêu
kiến vả thế tich phân phổi cứa
lamivudine, gợi ý không có tảo dụng
cảm ứng cùa nevirapine đến sự thanh
thải Iamivudine.
Không cân đỉẽu chinh liêu khi dùng đông
thời VIRAMUNE với lamivudine.
Stavudine:
30… mg x 21ần/ngảy,
(NVP 200 mg x llần/ngảy x
14 ngảy; 200 mg x
2Iẩnlngảy x 14 ngảy)
Stavudine AUC <-›
Stavudine C,… <—›
Stavudine C…… 5
Nevirapine: so sánh với_các kiềm chứng
trước kia, không thay đôi nông độ biên
kiến.
Không cẫn điếu chinh liếu khi dùng đông
thời VIRAMUNE với stavudine.
ịTenofovir ý _
(NVP 200 mg x llãn/ngảy)
Nông độ tenofovir không đôi. _ _
Tenofovir không ảnh hướng đên nông
độ NVP.
Không Ẹ… điều chinh liêu khi dùng dẩng
thời VIRAMUNE với tenofovir.
Zalcitabine
0.125-o,25 mg x 3lầnlngảy
(NVP 200 mg x llầningảy x
14 ngảy; 200 mg x
2Iầnlngảy x 14 ngảy)
Zalcitabine AUC 4—›
Zalcitabine C,… <—›
Zalcítabine Cmm ã
Khỏng cân điêu chmh liếu khi dùng đông
thời VIRAMUNE với zalcitabine.
Zidovudine 100-200 mg x
3lẳnlngảy
(NVP 200 mg x llần/ngảy x
14 ngảy;
200 mg x 21ầnlngảy x 14
ngảy)
Zidovudine AUC 124 (169 to 1`83)
Zidovudine cm,, 126 (184 to T254)
Dữ Iiệu so sảnh oặp gợi y' rằng
zidovudine không anh hướng đến dược
động học cứa nevirapine.
Không cân điêu chinh liêu khi dùng đông
thời VIRAMUNE với zidovudine.
Các cliẩl đẩng đẳng Nucleoside (NRTIs)
Efavirenz 600 mg x
llẳnlngảy
(NVP 200 mg x llầnlngảy x
14 ngảy; 400 mg x
llầnlngảy x 14 ngảy)
Efavirenz AUC 128 (134 to 1L4)'
Efavirenz C,… 112 (123 to 1`1)l
Efavirenz c…… 132 (135 to 1L9)a
Không khuyến cảo sư dụng đông thời đom
sử dụng đồng thời efavirenz vởi
V1RAMUNE có thẻ gây tảng nguy cơ tác
dụng phụ (xem Thận trọng đặc biệt).
Hơn nữa việc sử dụng đồng thời không
cải thiện hiệu quả so với khi dùng một
mình NNRTI.
VIRAMUNE kết hợp với efavirenz thế
hiện tác dụng kháng HlV-l đối kháng trén
in vilro (xem Dược động học).
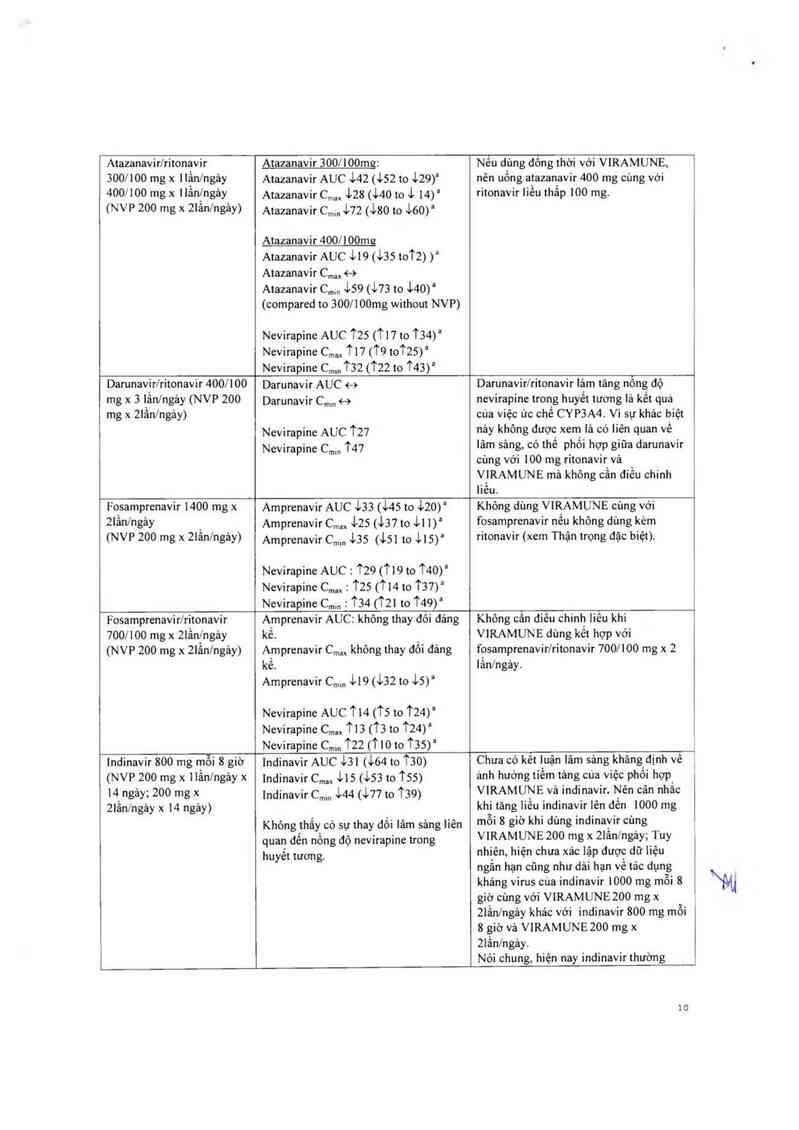
Các chầl ức chế protease (Pls)
Atazanavir/ritonavir
300/100 mg x llẳn/ngảy
400/100 mg x llần/ngảy
(NVP 200 mg x 2lẳnlngảy)
Atazạnavir 300/100mg:
Atazanavir AUC 142 (152 to 129)a
Atazanavir c,… 128 (140 to 1 14)"
Atazanavir C,,… 172 (180 to 160)“
Atazanavir 400/100mg
Atazanavir AUC 119(135t0'12) ):
Atazanavir CIm <-›
Atazanavir cmm 159 (173 to 140)’
(compared to 300/100mg without NVP)
Nevirapine AUC tzs (T17 to T34)a
Nevirapine C,… T17 (T9 to'125)a
Nevirapine c,… T32 (T22 to t43)a
Nêu d_ùng đông thời với VIRAMUNE,
nên uỏng atazanavir 400 mg oùng với
ritonavir liêu thãp 100 mg.
Darunav_ir/ritonavir 400! 100
mg x 3 1ân/ngảy (NVP 200
mg x 21ẩn/ngảy)
Darunavir AUC <-›
Darunavir C…m <-›
Nevirapine AUC 127
Nevirapine C…… T47
Darunavirlritonavir lảm tăng nông độ
nevirapine trong huyết tương lả kết qua
cứa việc ức chế CYP3A4. Vì sự khác biệt
nảy khõng được xem là có Iiên quan về
lám sảng, có thể phối hợp giữa darunavir
cùng với 100 mg ritonavir vả
V_IRAMUNE mã không oần diếu chinh
liêu.
Fo_samprenavir 1400 mg x
2Iân/ngảy
(NVP 200 mg x 21ánlngảy)
Amprenavir AUC 133 (145 to 120)a
Amprenavir C… 125 (137 to 111)“
Amprenavir C…… 135 (151 to 115)a
Nevirapine AUC : T29 (T19 Lo T40)“
Nevirapine C.… : TZS (114 to T37)“
Nevirapine C…… : T34 (TZI to T49)’
Không dùng VIR_AMUNE cùng với
fosamprenavir nêu không dùng kẻm
ritonavir (xem Thận trọng đặc biệt).
Fosamprenavir/ritonavir
700/100 mg x 21ân_lngảy
(NVP 200 mg x 21ân/ngảy)
Amprenavir AUC : không thay đỏi đảng
kề.
A_mprenavir C,… không thay đối đáng
kê.
Amprenavir cmm 1L9 (132 to 15)"
Nevirapine AUC TL4 (“15 to T24)’
Nevirapine c,… T L 3 (T3 to t24) '
Nevirapine C…In '122 ('110 to T35)’
Không oân điếu ohinh liếu khi
VIRAMUNE dùng kết hợp với
fosamprenavir/ritonavir 700/100 mg x 2
lần/ngảy.
Indinavir 800 mg mỗi 8 giờ
(NVP 200 mg x 11ầnlngảy x
14 ngảy; 200 mg x
2Iẩn/ngảy x 14 ngảy)
Indinavir AUC 131 (164 to t30)
lndinavir c…, 1Ls (153 to tss>
lndinavir c…… 144 (177 to T39)
Không thẳy oó sự thay dối lâm sảng liên
quan đên nỏng độ nevirapine trong
huyết tương.
Chưa Có kêt luặn Iâm săng khăng định vê
ảnh hướng tiểm tảng cùa việc phối hợp
VIRAMUNE vả indinavir. Nến cân nhắc
khi tăng liều indinavir lên đến 1000 mg
mỗi 8 giờ khi dùng indinavir cùng
VIRAMUNE 200 mg x 21ần/ngảy; Tuy
nhiên, hiện chưa xảo lập được dữ liệu
ngắn hạn cũng như dải hạn về tác dụng
kháng virus oùa indinavir 1000 mg mỗi 8
giờ cùng với VIRAMUNEZOO mg x
21ầnlngảy khảo với indinavir 800 mg mỗi
8 giờ vả V1RAMUNEZOO mg x
21ần/ngảy.
Nói chung, hiện nay indinavir thường
10
được phôi hợp với ẸTV. _
Dữ liệu lâm sảng vê tương tảo thuôo giữa
VIRAMUNE vả dinavirứitonavir oòn hạn
ohế.
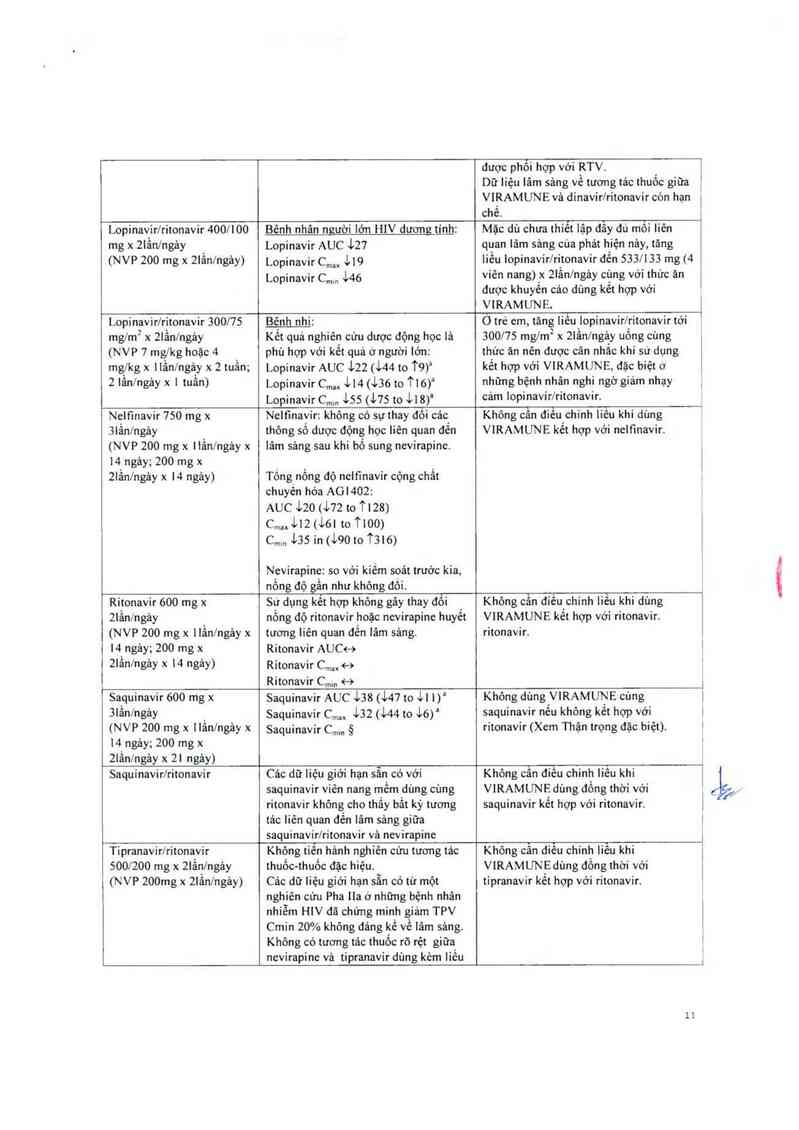
Lopinavir/rỉtonavir 400/100
mg x 21ân/ngảy _
(NVP 200 mg x 21ân/ngảy)
Bênh nhân người lởn HIV dương tính:
Lopinavir AUC 127
Lopinavir C,… 119
Lopinavir C…… 146
Mặc dù chưa thiêt lặp đây đú môi Iiên
quan lãm sảng oùa phát hiện nảy, tăng
Iiều lopinavir/ritonavir đến 533l133 mg (4
viên nang) _x 21ẩn/ngảy cứng với thức ăn
dược khuyên cáo dùng kêt hợp với
VIRAMUNE.
Lopinavir/ritonavir 300/75
mng x 2lẩnlngảy
(NVP 7 mg/kg hoặc 4
mglkg x Hằn/ngảy x 2 tuần;
2 lần/ngảy x 1 tuần)
Bênh nhi:
Kết quả nghiên cứu dược động học lả
phù hợp với kểt quả ớ người lớn:
Lopinavir AUC 122 (144 to T9)a
Lopinavir c,… 114 (136 to 116)“
Lopinavir c,nm 135 (175 to 118)“
0 trẻ em, Lãng liếu lopinavir/ritonavir tới
300/75 mglm2 x 2lằn/ngảy uống củng
thức ăn nên được oân nhắc khi sử dụng
kết hợp với VIRAMUNE. đặc biệt ớ
những bệnh nhân nghi ngờ gỉảm nhạy
oảm lopinavir/ritonavir.
Neltìnavir 750 mg x
3Iằnlngảy
(NVP 200 mg x llằn/ngảy x
14 ngảy; 200 mg x
ZIẩn/ngảy x 14 ngảy)
Nelfinayir: không có sự thay đôi cảc_
thỏng sò dược động học Iìên quan đén
lâm sảng sau khi bỏ sung nevirapine.
Tống nổng độ nelfinavir cộng chẩt
ohuyến hóa AGI4OZ;
AUC 120 (172 to TL28)
C…,,112(161t0 1100)
c…… 135 in (190 to T3 16)
Nevirapine: so với kiếm soát trước kia,
nông độ gán như không đôi.
Không cân điêu_chỉnh liêu khi dùng
VIRAMUNE kêt hợp với nelfinavir.
Ritonavir 600 mg x
21ẩnfngảy
(NVP 200 mg x llầnlngảy x
14 ngảy; 200 mg x
21ần/ngảy x 14 ngảy)
Sứ dụng kêt hợp không gây thay đổi
nổng độ ritonavir hoặc nevirapine huyết
tương liên quan đến lâm sảng.
Ritonavir AUC<—›
Ritonavir C,… <—›
Ritonavir Cmm <—›
Không cần điếu_chinh Iiều khi dùng
V1RAMUNE kẻt hợp với ritonavir.
ritonavir.
Saquinavir 600 mg x
31ẩn/ngảy
(NVP 200 mg x llẳnlngảy x
14 ngảy; 200 mg x
2Iẩnlngảy x 21 ngảy)
Saquinavir AUC 138 (147 to 111)1
Saquinavir C… 132 (144 to 16)“
Saquinavir C,… ộ
Khỏng dùng VIRAMUNE oùng
saquinavir nêu không kêt hợp với
ritonavir (Xem Thận trọng đặc biệt).
Saquinavirlritonavir
Các dữ liệu giới hạn sẵn có với
saquinavir viên nang mềm dùng cùng
ritonavir không cho thẩy bất kỳ tương
tác Iiên quan đến lâm sảng giữa
saquinavirlritonavir vả nevirapine
Không cân điều chinh liếư khỉ
VIRAMUNE dùng đông thời với
saquinavir kêt hợp vởi ritonavir.
Tipranavir/ritonavir
500/200 mg x 2lânlngảy
(NVP 200mg x 21ân/ngảy)
Không tiên hảnh nghiên cứu tương tảo
thuốo-thuốo đặc hiệu.
Cảo dữ Iiệu giới hạn sẵn có từ một
nghiến cứu Pha 11a ớ nhũng bệnh nhăn
nhiễm HIV đã ohứng minh giảm TPV
Cmin 20% không đáng kể về lâm sảng.
Không có tương tác thuốc rõ rệt giữa
nevirapine vả tipranavir dùng kèm liếu
Không oân diếu chinh Iiễu khi
VIRAMUN_E dùng đông thời với
tỉpranavir kêt hợp với ritonavir.
11
[ thâp ritonavir.
Ức chế xâm nhậ
P
Enfuvirtide
Không có Lương tảo dược động học rõ
rảng trẽn lãm sảng giữa enfuvinide vả
những thuốc dùng đổng thời chuyến hóa
bới men CYP4SO.
Do con đường chuyên hóa cùa
enfuvinide, không có khả nãng tương tảo.
Vì thế không oần điều chinh Iiếu khi dùng
VIRAMUNE phối hợp với enfuvirtide.
Maraviroc 300 mg liêu duy
nhất
(Nevirapine 200 mg x
21ằn/ngáy)
Maraviroc AUC <—›
Maraviroc C,… 1
so với nhóm chứng trước đó
Không định lượng nổng độ nevirapine,
không có Lương tác.
So sảnh với nông độ thuôo ớ nhỏm chứng
tmớc đó gợi ý rằng có thể dùng maraviroc
300 mg x 2 Iằn/ngảy kết hợp vởi
V_IRAMUNE mả không cần điều chỉnh
liêu.
Ữc chế hỏa nhập
Raltegravir Chưa có dữ liệu lâm sảng. Do con đường chuyên hóa của raltegravir,
không có khả năng tương tảo nên không
cần điếu chinh liểu khi dùng
VIRAMUNE kết hợp với raltegravir.
Kháng sinh
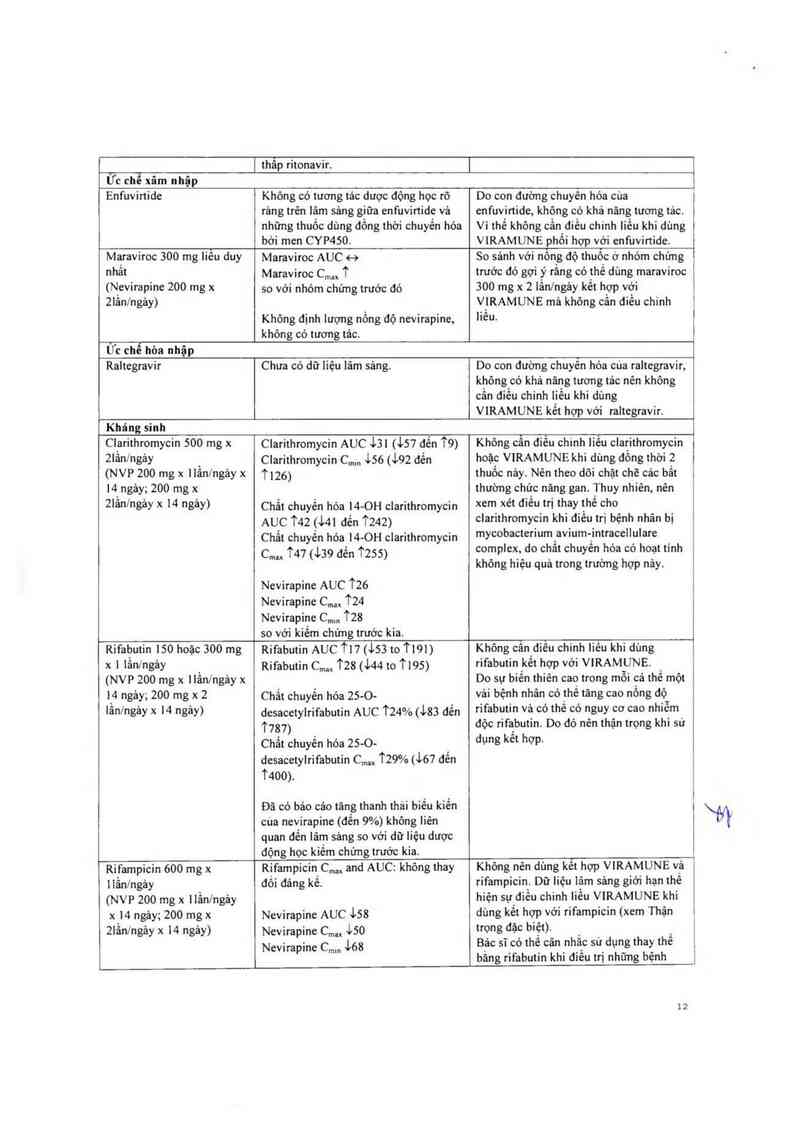
Cl_arithromycin 500 mg x Clarithromycin AUC `L31 (157 đến T9) Không cân điêu ohinh liêu olarithromycin
2|ânlngảy Clarithromycỉn C…… 156 (192 đển hoặc VIRAMUNE khi dùng đổng thời 2
(NVP 200 mg x llấn/ngảy x
14_ ngảy; 200 mg x
2lân/ngảy x 14 ngảy)
1126)
Chẩt chuyển hóa 14-0H clarithromycin
AUC T42 (141 đến t242›
Chắt chuyền hỏa 14-0H olarithromycin
cm,, t47 (139 đển “1255)
Nevirapine AUC 126
Nevirapine CIm 124
Nevirapine C…… 128
so với kiếm chứng trước kia.
thuốc nảy. Nến theo dõi chặt chẽ các bắt
thường ohức nảng gan. Thuy nhiên, nến
xem xét điếu trị thay thế cho
clarithromycin khi điều trị bệnh nhân bị
mycobacterium avium-intracellulare
complex, do chẳt chuyển hóa có hoạt tính
khỏng hiệu quả trong trường hợp nảy.
Rifabutin 150 hoặc 300 mg
x 1 1ần/ngảy
(NVP 200 mg x llẩnlngảy x
14 ngảy; 200 mg x 2
Iần/ngảy x 14 ngảy)
Rifabutin AUC TL7 (153 to Tl9l)
Rifabutin c,… T28 (144 to TL95)
Chẩt ohuyến hóa 25-o-
desacetylrif'abutin AUC T2498 (183 đến
T787) _
Chât chuyên hóa 25-0-
desacetylrifabutin cm,, 129%(167 đến
T4ooỵ
Đã có bảo cáo tãng thanh Lhấi biểu kiến
của nevirapine (đến 9%) không liên
quan đến lâm sảng so với dữ liệu dược
động học kiềm chứng trước kia.
Không oân điêu chinh Iiẻu khi dùng
rifabutin kết hợp với VIRAMUNE.
Do sự biến thiên oao trong mỗi cá thể một
vải bệnh nhân có thể tăng cao nồng độ
rifabutin vả có thề oó nguy cơ cao nhiễm
độc rifabutin. Do đó nến thận trọng khi sử
dụng kết hợp.
Rifampicin 600 mg x
llẳn/ngảy
(NVP 200 mg x llần/ngảy
x 14 ngảy; 200 mg x
2lầnlngảy x 14 ngảy)
Rifampicin_ C,… and AUC: không thay
đối đảng kê.
Nevirapine AUC 158
Nevirapine C,… 150
Nevirapine Cmm 168
Không nên dùng kết hợp VIRAMUNE vả
rifampicin. Dữ Iiệu lâm sảng giởi hạn thế
hiện sự diều chinh liếu VIRAMUNE khi
dùng kết hợp với rifampicin (xem Thận
trọng đặc biệt).
Bác sĩ có thế cân nhắc sủ dụng thay thế
bằng rifabutin khi điểu tLi những bệnh
12
so với dữ liệu kiêm ohứng trước kia.
nhân đông nhiễm Iao vả sư dụng phảc đô
oó VIRAMUNE.
Chống nấm
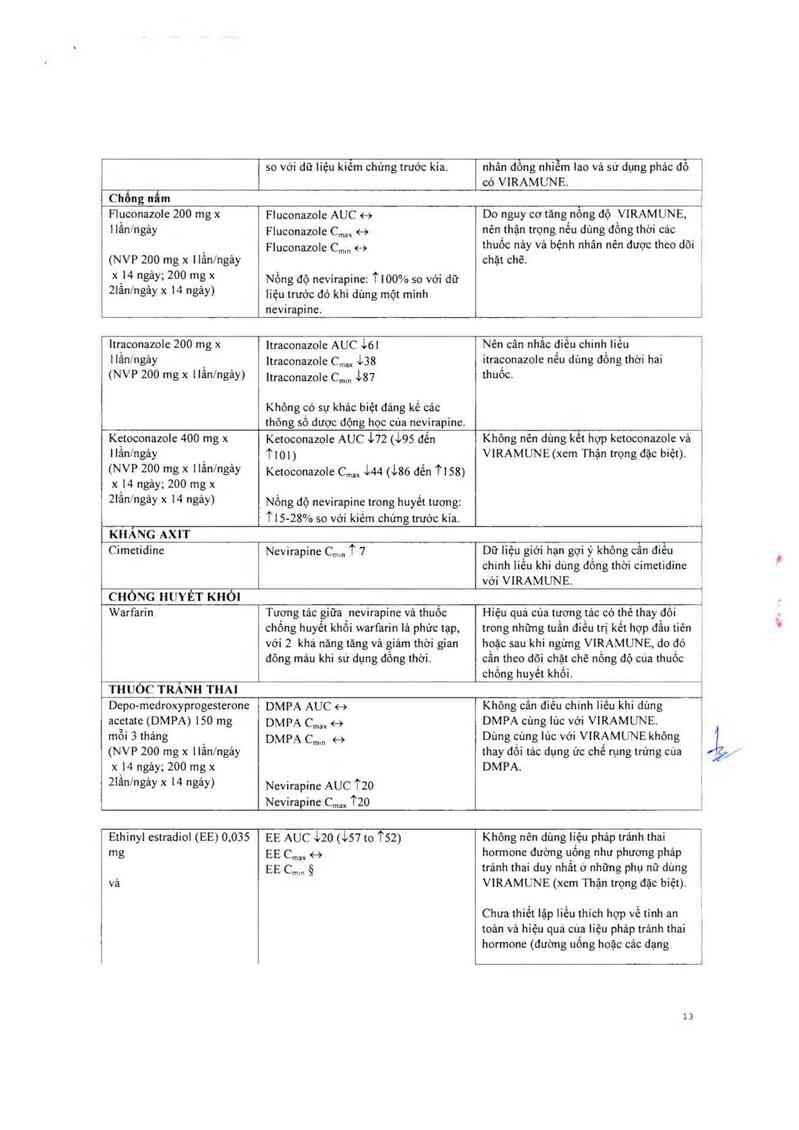
Fluconazole 200 mg x
1 1ân/ngảy
(NVP 200 mg x Ilần/ngảy
x 14 ngảy; 200 mg x
21ân/ngảy x 14 ngảy)
Fluconazole AUC <—›
Fluconazole C,… <—›
F luconazole Cmm <-›
Nống độ nevirapine: 1100% so với dữ
liệu trước đó khi dùng một minh
nevirapine.
Do nguy cơ tăng nỏng độ VIRAMUNE,
nên thận trọng nếu dùng đổng thời cảc
thuốc nảy vả bệnh nhân nẻn được theo dõi f
chặt chẽ. `
ltraconazole 200 mg x
llản/ngảy _
(NVP 200 mg x IIân/ngảy)
ltraconazole AUC 161
ltraoonazole C,… 138
ltraconazolc C…… 187
Không có sự khác biệt đáng kế các
thỏng sô dược động học cùa nevirapine.
Nên oân nhão diêu ohinh liẻu
itraconazole nêu dùng đỏng thời hai
thuôc.
Ketoconazole 400 mg x
IIằn/ngảy
(NVP 200 mg x llầnlngảy
x 14 ngảy; 200 mg x
2Iằn/ngảy x 14 ngảy)
Ketoconazole AUC 172 (195 đến
t… 1)
Ketoconazole cm,. 144 (186 đến T L 58)
Nồng độ nevirapine trong huyết tương:
115—28% so với kiếm chứng trước kỉa.
Không nến dùng kểt hợp ketoconazole vả Ả
VIRAMUNE(xom Thận trọng đặc biệt).
KHÁNG AXIT
Cimetidine
Nevirapine C…… T 7
Dữ liệu giới hạn gợi ỷ_ không cẫn điếu
chinh liều khi dùng đông thời cimetidine
với VIRAMUNE.
CHỐNG HUYẾT KHỎI
Warfarin
Tương tác giữa nevirapine vả thuôo
chống huyết khối warfarin 1ả phức tạp,
với 2 khá nảng tảng và giảm thời gian
đông máu khi sử dụng đống thời.
Hiệu quả của tương tác oò thê thay đôi
trong những tuần điếu trị kết hợp đầu tiên
hoặc sau khi ngừng VIRAMUNE, do đó
cẳn theo dõi ohặt ohế nổng độ oứa thuốc
ohống huyết khối.
THUỐC TRẨNH THAI
Depo-medroxyprogesterone
aoetate (DMPA) 150 mg
mỗi 3 thảng
(NVP 200 mg x llẳn/ngảy
x 14 ngảy; 200 mg x
21ằn/ngảy x 14 ngảy)
DMPA AUC <—›
DMPA C,… H
DMPA C…… <—-›
Nevirapine AUC Tzo
Nevirapine C,… 120
Không cấn điếu chinh lỉếu khi dùng
DMPA cùng Iức Vởỉ VlRAMUNE.
Dùng củng lủc với VIRAMUNE không
Lhay đối tác dụng ức chế rụng trứng cứa
DMPA.
Ethinyl estradiol (EE) 0,035
mg
vả
EE AUC 120 (157 to t52)
EE C…, H
EE c… 8
Khỏng nên dùng lỉệu phảp trảnh thai
hormone đường uống như phương phảp
tránh thai duy nhất ớ những phụ nữ dùng
VIRAMUNE (xem Thận trọng đặc biệt).
Chưa thiết lập 1iềuthich hợp về tinh an
toản vả hiệu quả cù_a Iiệu pháp Lránh thai
hormone (đường uỏng hoặc các dạng
13
' Norethindrone (NET) 10
mg (liêu duy nhât)
(NVP 200 mg x llần/ngảy
x _14 ngảy; 200 mg x
Zlãntháy x 14 ngáy)
NET AUC 119 (150 đến t30)
NET C… 116 (149 đến '137)
NET c…,g
khảo) khỏng phai DMPA khi kẽt hợp với
VIRAMUNE.
THUỐC cẮv NGHIẸN
Methadone liêu riêng biệt
oho Lừng bệnh nhân
(NVP 200 mg x llẩn/ngảy
x 14 ngảy; 200 mg x
21ấnlngảy 2 7 ngảy)
Methadone AUC 165 (182 đến 132)
Methadone C,… 150 (167 dến 125)
Hội chứng cai thuôo dã được báo cảo 0__1
những bệnh nhân được điều trị bầng
VIRAMUNE đổng thời với methadone.
Những bệnh nhân đạng đùng methadone
bắt đằu điếu trị VIRAMUNE nên được
theo dõi bằng chứng cai thuốc vả nên điếu
chinh liểu methadone tương ứng. 1
cui: PHẢM THAO DƯỢC
1
C 0 SL John's
Nông độ nevirapine trong huyêt thanh
có thẻ giám khi dùng đổng thời với các
chế phấm thảo dược chứa có St John
(Hypericum perforalum). Điều nảy lả do
sự cám ứng cảc men chuyến hóa thuốc
vải'hoặc protein vặn chuyến cớ St John.
Không nên dùng chế phâm thảo dược
chứa cớ St John kết hợp với
VIRAML'NE. Nếu bệnh nhân đang dùng
chế phâm chừa cờ St John thi kiêm tra
nống độ nevirapine vả nổng độ virus, nếu
được, vả ngứng dùng thảo dược nảy.
Nổng độ nevirapine _có thể tăng khi ngùng
co St John. Có thế oần điếu chinh líều
VIRAMUNE. Tác dụng nảy oó thê kéo
đải 2 tuần sau khi ngừng điểu lrị với oo St
John`s (xem Chống chỉ định).
ẽ = C…… dưới mức phảt hiện được trong xét nghiệm
T = tăng, 1_= giảm, <——› = không hiệu quả
3dữ liệu thế hiện giá trị trung binh nhân với khoảng dự doản 90% (90% P1).
Thông lin khác
Trong những nghiến cứu in vilro sữ dụng oảo ty lạp thế gan ở người cho thắy sự hình thảnh cảc
chất chuyến hóa hydroxyl của nevirapine khỏng bị ảnh hưởng bời sự có mặt cùa dapsone,
rifabutin, rifampin, vả trimethoprim/sulfamethoxazole. Ketoconazole vả erythromycin ức chế
dảng kể sự tạo thảnh cảo chất chuyến hóa hydroxyl cùa nevirapine. Vẫn chưa thực hiện cảc
nghiên cứu lâm sảng.
Khả năng sinh sản,_tl_tai kỳ và cho con bú
Dữ liệu khá lớn (584 bệnh nhân trong tam cá nguyệt đẩu vả 1044 bệnh nhân trong tam cả nguyệt
thứ hai/ba theo Dăng ký Thai sản Dùng thuốc khảng retrovirus ngảy 31 thảng 7 nảm 2007) ở phụ
nữ có thai không cho thấy dị tật vả/hoặc dộc tính trên thai/trẻ sơ sinh.
Có thế cân nhắc sử dụng VIRAMUNE trong thời kỳ có thai nếu thật sự cần thiết.
Chưa oó dữ liệu về việc sử dụng VIRAMUNE viên giải phóng chậm để phòng ngừa lấy nhiễm từ
mẹ sang con.
Ẩnh hưởng đến khả năng lái xe và vấn hânh mảỵ mỏc
14
Chưa có nghiên cứu cụ thể ảnh hướng đến khả năng lái xe và vận hảnh máy móc.
Tuy nhiên, nên bảo cho bệnh nhân biết họ có thế có những tảo dụng ngoại ý như mệt mòi trong
thời gian điếu trị với VIRAMUNE. Do đó, nên khuyên bệnh nhân thận trọng khi Iải xe hoặc vận
hảnh mảy móc. Bệnh nhân nên trảnh những việc có nguy oơ rùi ro như lái xe hay vận hảnh mảy
móc nêu mệt mòi.
Tác dung ghu
Người lớn
Ngoài phát ban và cảc bất thường xét nghiệm chức năng gan, cảc biến cố ngoại ý Iiên quan đến
điếu trị VIRAMUNE được ghi nhặn nhiều nhất qua tất cả oảo thử nghiệm lâm sảng là buồn nôn,
mệt mòi, sôt, đau đâu, nôn, tiếu chảy, đau bụng và đau cơ. Rât hiêm có trường hợp thiêu máu vả
giảm bạch cầu do đùng VIRAMUNE. Dau khớp được ghi nhận như là một biến cố đơn thuần
trong một số hiếm trường hợp bệnh nhân dùng cảc phảc đồ có VIRAMUNE.
Kinh nghiệm sau khi thuốc được lưu hảnh cho thẳy oảo phản ứng ngoại ý trầm trọng nhất lả hội
chứng Stevens—Johnson, hoại tử bỉếu bì nhiễm độc, viêm gan nặng/suy gan vả hội chứng quả
mẫn, thế hiện bằng phảt ban với oảo triệu chứng toản thân như sốt, đau khớp, đau cơ vả bệnh
bạch huyết, tốn thương oảo tạng liên quan như viếm gan, tãng bạch cấu ái toan, giảm bạch cầu
hạt vả rối loạn chức năng thận. 18 tuần diếu trị đằu tiên là giai đoạn quan trọng cần theo dõi
bệnh nhân chặt chẽ (xem Cảnh bảo và thận trọng dặc bỉệt).
Da và mô dưới da
Dộc tính lâm sảng thông thường nhất của VIRAMUNE lả phảt ban. Cảo phản ứng trên da trầm
trọng hoặc đe dọa tính mạng xuất hiện với tằn suất khoảng 2 % (xem bảng 1). Các phản ứng nảy
bao gôm hội chứng Stevens-Johnson (SJC), hiếm hơn là hoại tử biếu bi nhiễm độc (TEN) xảy ra
hầu hết trong 6 tuấn điếu trị dấu tiên. Trong số 2861 bệnh nhân tham gia thứ nghiệm lâm sảng
được điêu trị với VIRAMUNE viên giải phóng nhanh, tân suất chung cùa hội chứng Stevens—
Johnson là 0,3% (9/2861).
Phảt ban xuất hiện đơn lẻ hoặc lả một phần cùa hội chứng quả mẫn thế hiện bằng phảt ban với
cảc triệu chứng toản thân như sôt, đau khớp, đau cơ vả bệnh bạoh huyêt kèm tôn thương phủ
tạng như viếm gan, tăng bạch oâu ải toan, giảm bạch oâu hạt và rôi Ioạn chức năng thặn.
Dã có bảo cảo tử vong do SJS, TEN và các phản ứng quả mẫn.
Bảng !. Nguy cơ phảt ban (%) trên các thử nghiệm lâm sảng"2 có đối chứng giả dược ở
người lởn qua 52 tuần đỉều trịJ — Bẫt kế liên quan nhân quả
VIRAMUNE Giả dược
(n=1374) (n11331)
% %
Biến cố phát ban ở tất cả mức ớộ“ 24,0 14,9
Ban độ 3 hoặc 4“ 1,7 0,2
15
2/
Thử nghiệm 1090: Điếu trị cơ bản bao gồm 3TC cho tẩt cả bệnh nhân vả phối hợp NRTIs
vởi Pls
Thử nghiệm 1037, 1038 vả 1046: Điếu trị cơ bấn bao gồm ZDV vả ZDV+ddl;
VIRAMUNE đơn trị liệu được dùng cho một sô bệnh nhân.
% dựa trên ước lượng xảo suất cùa Kaplan-Meier.
“ Hệ thống chia độ NCI.
fJ
Phảt ban thường từ nhẹ đến trung binh, cảc hồng ban dạng dảt sẩn, có kèm ngứa hoặc không, khu
trú ở thân, mặt vả cảc chi. Cảo phản ứng dị ứng (kể cả phản vệ, _phù mạch vả mảy đay) đã được
bảo cáo. Phẩn lởn phảt ban nặng xuất hiện trong vòng 6 tuần điếu trị dầu tiên.
Trong thử nghiệm 1 100.1486 (VERxVE) những bệnh nhân chưa được điếu trị đã dùng
VIRAMUNE viên giải phỏng nhanh trong giai đoạn dẫn đấu với 1iếu 200 mg một lẫn mỗi ngảy
trong 14 ngảy (n=1068) vả sau đó ngẫu nhiên dùng hoặc VIRAMUNE viên giải phóng nhanh
200 mg hai lấn mỗi ngảy hoặc VIRAMUNE viên giải phỏng chậm 400 mg một Iẳn mỗi ngảy.
Tắt cả bệnh nhân được dùng tenofovir + emtricitabine như điều trị oơ bản. Dữ liệu an toản bao
gồm tắt cả bệnh nhấn kết thúc tiếu chỉ cơ bản tại tuấn 48 của nghiên cứu (giai đoạn theo dõi
trung bình 61 tuần). Phảt ban nặng hoặc đe dọa tính mạng được cho lả liên quan đến điều trị
bảng VIRAMUNE xuất hiện ở 1,1% bệnh nhân trong giai doạn điếu trị dẫn đẳu bằng
VIRAMUNE viên giải phóng nhanh, vả lần lượt là 0,8% vả 0,6% trong giai đoạn ngẫu nhiên
dùng VIRAMUNE viên giải phỏng nhanh và VIRAMUNE vỉên giải phóng ohậm. Hơn nữa, 5
trường hợp bảo cảo hội chứng Stevens-Johnson trong thử nghiệm, tất cả đều xuất hiện trong 30
ngảy đầu tiên điếu trị với VIRAMUNE.
Trong nghiên cứu 1 100.1526(TRANx1T10N) bệnh nhấn dùng VIRAMUNE viến giải phóng
nhanh 200 mg hai lấn mỗi ngảy trong it nhất 18 tuần sau đó ngẫu nhiến dùng hoặc VIRAMUNE
viên giải phóng chậm 400 mg một lần mỗi ngảy (n=295) hoặc tiếp tục dùng VIRAMUNE viên
giải phóng nhanh (n=148). Trong nghiến cứu nảy, không thấy xuất hiện phảt ban mức độ 3 hoặc
4 trong cả hai nhóm điếu trị.
Gan-Mật
Cảo bất thường xét nghiệm hay gặp nhất là tăng cảc xét nghiệm chức năng gan bao gôm ALAT,
ASAT, GGT, bilirubin toản phẳn vả phosphatase kiêm. Thường gặp nhât lả tãng GGT nhưng
không oó triệu chứng. Đã ghi nhận các trường hợp vảng da.
Cảo trường họp viêm gan, độc tính gan nặng và đe dọa tính mạng, và viếm gan tối oấp gảy tử
vong đã được ghi nhận ở bệnh nhân dùng nevirapine trong cảc thử nghiệm lâm_ sâng. Trong oảo
thử nghiệm lâm sảng với VIRAMUNE viên giậi phóng nhanh, nguy cơ biển cố gan trên lâm sảng
với VIRAMUNE tại thời điềm một nãm cao gâp khoảng 2 lẩn so với giả dược
Trong thử nghiệm 1 100 1486 (VERxVE) những bệnh nhân chưa đ_ược điếu trị đã đùng \Mịl
VIRAMUNE viên giải phóng nhanh trong gỉai đoạn bắt đằu với liếu 200 mg một lần mỗi ngảy
trong 14 ngảy vả sau đó ngẫu nhiến đùng hoặc VIRAMUNE viên giả_i phóng nhanh 200 mg hai
lần mỗi ngảy hoặc VIRAMUNE viên giải phóng chậm 400 mg một lấn mỗi ngảy. Tất cả bệnh
16
nhân được dùng tenofovir + emtricitabine lảm điều trị cơ bản. Bệnh nhân được kiềm tra đảm bảo
số lượng CD4+ < 250 tế hào/mm3 đối với nữ vả < 400 tế LazioJmm3 đối với nam. Dữ liệu về oác
biến oố gan gây triệu chứng được thu thập từ thử nghiệm nảy. Dữ Iiệu an toản bao gồm tất cả
những lần khảm bệnh nhân cho đến thời điếm bệnh nhân cuối cùng được hoản tẩt theo dõi dế ghi
nhận kết cuộc chính lủc 48 tưần cùa nghiên cứu (giai đoạn theo dõi trung bình 61 tuần). Tỷ lệ cảc
biến oố gan oó triệu chứng trong giai đoạn dẫn đấu với VIRAMUNE viên giải phóng nhanh lả
0,5%. Sau giai đoạn dẫn đầu, tỷ lệ cảc triệu chứng ở gan là 2,8% với nhóm dùng VIRAMUNE
viến giải phóng nhanh và 1,6% với nhóm dùng VIRAMUNE viên giải phóng chậm. Nhin chung
tỷ lệ các triệu ohứng ở gan lả tương đương giữa nam vả nữ tham gia thử nghiệm VERxVE.
'1`rong nghiên cứu L 100.1526(TRANx1T10N) không thấy cảc biến cố gan trên lâm sảng Mức độ
3 hoặc 4 trong cả 2 nhóm.
Tăng nồng độ ASAT hoặc ALAT vả/hoặc huyết thanh dương tính với viêm gan B vảlhoặc C liên
quan đến nguy cơ cao cảo biếu hiện gan oho oả nhóm dùng VIRAMUNE viên giải phóng nhanh
và nhóm chứng. Nguy cơ biến cố gan tại thời điềm L năm điều trị với VIRAMUNE viên giải
phóng nhanh lả dưới 2% trong số những bệnh nhân nhân ấm tinh với viêm gan B vả/hoặc C.
18 tuần điều trị_ đầu tiên lả _giai đoạn quan trọng cấn theo dõi chặt chẽ. Nguy cơ biến oố gan lớn
nhất trong 6 tuần điếu trị đấu tiến. _Tuy nhiến nguy cơ oòn tiếp tục trong giai đoạn nảy vả cân
theo dõi định kỳ trong thời gian điếu trị (xem Cảnh báo và thận trọng đặc biệt)
Viêm gan lâm sảng có thể riêng rẽ hoặc đi kèm với phảt ban vả/hoặc cảo triệu chứng thực thể
kèm theo.
Theo dõi cảc xét nghiệm chức nảng gan xem phân Cảnh báo và thận trọng đặc biệt.
Bênh nhi:
Tính an toản đã được đánh giá trên 361 bệnh nhi nhiễm HlV—l từ 3 ngảy tuối đến 19 tuồi. Trong
hai thử nghiệm, chủ yếu cảc bệnh nhi nảy được điều trị VIRAMUNE kết hợp với ZDV hoặc dd1,
hoặc ZDV+ddl. Trong một thử nghiệm nhãn mờ B! 882 (ACTG 180), 37 bệnh nhân được theo
dõi trong thời gian trung binh 33,9 thảng (phạm vi từ 6,8 thảng đến 5,3 năm; bao gồm thứ
nghiệm theo dõi kéo dải BI 892).
Trong nghiên cứu ACTG 245, một nghiên cứu mù đôi đối chứng giả dược, 305 bệnh nhân tưổi >Ịf_7
trung binh là 7 _(phạm vi từ 10 thản_g tuổi đến 19 tuổi) được điếu trị với VIRAMUNE ít nhất 48 /
tuần với một liều 120 mg/m2 một lấn mỗi ngảy trong 2 tuần tiếp nối bời 120 mg/m2 hai lấn mỗi
ngảy. Những biến cố bất lợi Iiên quan đến VIRAMUNE được ghi nhận thường xuyên nhất là
tương tự như ở người lớn, ngoại trừ giảm bạch cầu hạt xuất hiện ở trẻ em thường xuyến hơn. Hại
bệnh nhân điếu trị VIRAMUNE trong cảo nghiên cứu nảy có hội chứng SJS hay Stevens—
Johnsonlhội chứng hoại tử biếu bì nhiễm độc. Cả hai bệnh nhân đã hối phục sau khi ngừng
VIRAMUNE.
Trong cảc giám sát sử dụng thuốc sau khi lưu hảnh, thiếu mảư thường gặp ở trẻ em hơn.
17
Danh muc các tác dung ghu
Nhìn chung cảc tác dụng phụ oó thê gặp khi điều trị với VIRAMUNE bao gốm:
Rối loạn mảư vả hê bach huvết
Giâm bạch cấu hạt, Lhiêu máu.
Rối loan hê miễn dich
Phảt ban do thuôo kèm tăng bạch câu ải toan vả oác triệu chứng toản thân, phản ứng phản vệ, quả
mấn (bao gôm phản ứng phản vệ, phù mạch, mảy đay).
Rối Ioạn hệ thần kinh
Đau đâu.
Rối Ioan da dảv ruôt
Tiêu chảy, đau bụng, buôn nôn, nôn.
Rối loan gan mât
Viêm gan (kế cả nhiếm độc gan nặng vả đe dọa tính mạng), viêm gan tối cắp (oó thể gây từ
vong), vảng da.
Rối loan da vả mô dưới da
Phát ban, hội chứng Stevens-Johnsonlhoại tứ biếu bì nhiễm độc (có thể gây tử vong), phù mạch,
mảy đay.
Rối loan cơ xương khớp
Đau khớp, đau cơ.
Rối Ioan toản thân vả tai chỗ
Sôt, mệt mới.
Xét nghiêm
Bất thường xét nghiệm chức năng gan (được ghi nhận bằng cảc cụm từ: tăng alanine
aminotransferase; tăng transaminase; tăng aspanate aminotransferase; tảng gamma-
glutạmyltransferase; tăng men gan; tãng transaminase trong mảu), giảm phosphorus mảư, tăng
huyêt ảp.
Mọi phản ứng bất lợi của VIRAMUNE viện giải phóng chậm đếu đã được ghi nhận trước đó với
V1RAMUNE viên giải phóng nhanh.
Thông báo cho bác sĩ những tác dụng phụ gặp phải !rong lhời gian dùng thuốc.
Quá Iiếu
Chưa có thuốc giải dộc trong trường hợp quá Iiếu VIRAMUNE Đã oó bảo oáo cảc trường hợp \(L,__
quả Iiếu VIRAMUNE viên giải phóng nhanh trong phạm vi từ 800 đến 6000 _mglngảy cho tới 15
ngảy Bệnh nhân biền hiện phù, hổng ban dạng nốt, mệt mòi, sốt, đau đầu, mất ngù, buồn nôn,
thâm nhiễm phổi, phát ban, chóng mặt, nỏn, tăng transaminase, sụt cân. Toản bộ triệu chứng
thuyên giảm sau khi ngừng VIRAMUNE.
18
Dươc lưc hoc
Nevirapine lả một thuốc ức chế men sao chép ngược không nucleoside (NNRT1) oùa 111V-1.
Nevirapine gắn trực tiếp vảo mon sao chép ngược và ức chế tảo dụng cùa polymerase phụ thuộc
RNA vả polymerase DNA phụ thuộc DNA bằng cảch phá vỡ vị trí xúc tác oùa men. Tác dụng
oùa nevirapine không phải do cạnh tranh với khuôn mẫu (template) hoặc các nucleoside
triphosphatc. Men sao chẻp ngược HIV-2 vả cảc polymerase DNA eukaryotic (như DNA-
polymerase u, B, y hoặc 8 ở người) không bị ức chế bời novirapinc.
Trong cảc nghiến cứu lâm sảng, VIRAMUNE có liên quan đến sự gỉa tảng HDL- choiesterol và
cải thiện nói chung về tỉ lệ HDL-cholesterol toản phần, mà trong dân số ohung có thể xem lả liên
quan đến tỉ lệ thấp nguy cơ tim mạoh. Tuy nhiên, do chưa có những nghiên oứu cụ thể về
VIRAMUNE trong việc thay đổi nguy oơ tim mạoh trên bệnh nhấn nhiễm H1V,ảnh hướng lâm
sảng cùa những phảt hiện nảy chưa rõ. Việc lựa chọn cảc thuốc khảng retrovirus chủ yếu dựa
trên hiệu quả khảng virus oùa thuốc.
Các thử nghiệm lâm sảng
Hiệu quả lâm sảng oùa VIRAMUNE viên giải phóng ohậm dựa trên dữ Iiệu 48 tuần từ một
nghiên oứu Pha 3 hai giá dược, mù đôi, ngẫu nhiên và đang tiếp diễn (VERxVE — Nghiên cứu
] 100.1486) ở những bệnh nhân chưa từng được điếu trị và dữ liệu 24 tuần từ một nghiên cứu
nhăn mờ, ngẫu nhiên và đang tiếp diễn ở những bệnh nhân chuyến tù VIRAMUNE viến giải
phóng nhanh hai lần mỗi ngảy sang VIRAMUNE viên giải phóng chậm một lần mỗi ngảy
(TRANxITION — Nghiên oứu 1 100.1526).
Bénh nhân chưa từng đươc điều tri
VERxVE (Nghiên cứu 1 100 1486)1ả một nghiên cứu Pha 3 ở những bệnh nhân chưa tứng điếu
trị đã đuợc dùng VIRAMUNE viên giải phóng nhanh 200 mg một lần mỗi ngảy trong 14 ngảy và
sau dó duợc chọn ngẫu nhiên dùng VIRAMUNE viến giải phóng nhanh 200 mg hai lần mỗi ngảy
hoặc VIRAMUNE viên giải phóng chặm 400 mg một lấn mỗi ngảy. "1ất cả bệnh nhân được điểu
trị cơ bán với tenofovir + emtricitabine. Sự ngẫu nhiên hóa được phân tầng theo nồng độ H1V-I
RNA khi sảng lọc (5100,000 bảnlmL vả >100,000 bản/mL). Một số đặc điếm dân số nghiến cứu
vả bệnh lúc thu nhận được nếu trong Bảng 2.
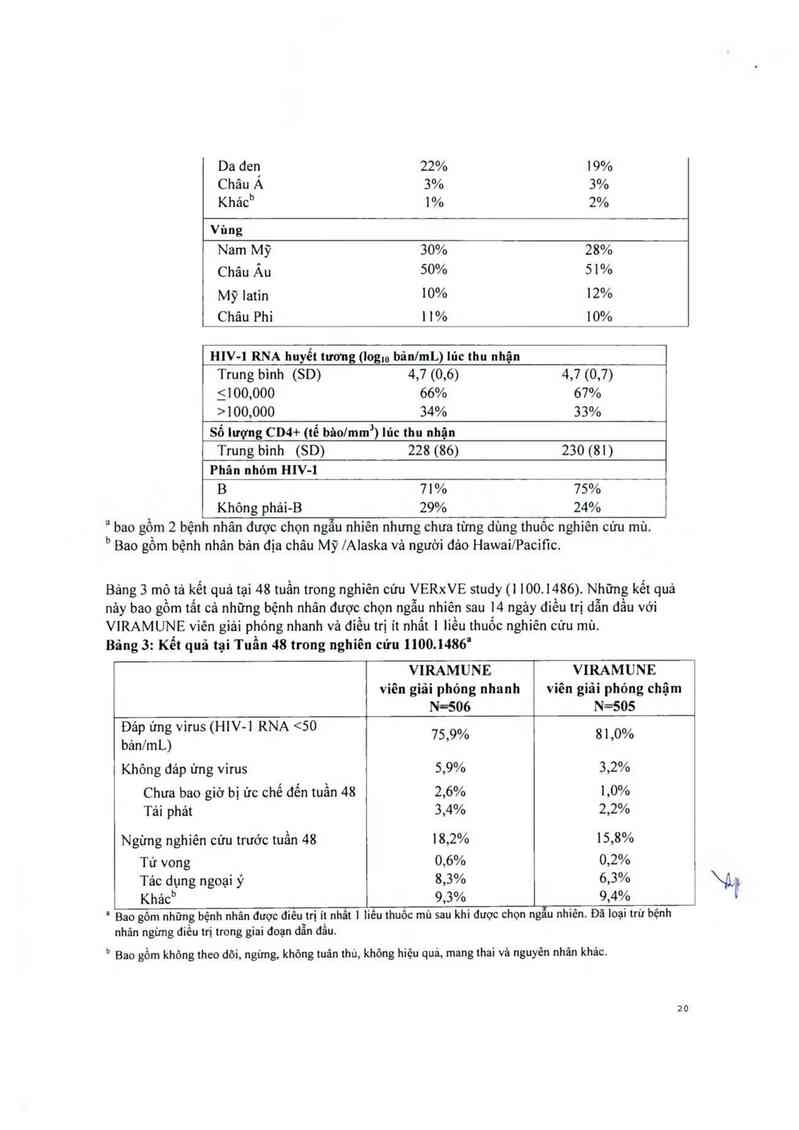
Bảng 2: Cảo đặc tính của dân số nghiên cứu và bệnh lý lúc thu nhận trong Nghiên cứu
1100.1486
VIRAMUNE viên VIRAMUNE
giải phóng nhanh viên giải phỏng chậm
N=508a N=505
Giới tinh _______
Nam 85% 85% `
Nữ 15% 15%
Chủng tộc - J
Da trắng 74% 77%
1
Da đen 22% 19%
Châu A 3% 3%
Khảc" 1% 2%
Vùng
Nam Mỹ 30% 28%
Châu Âu 500/° 510/°
Mỹ latin 10% 12%
Châu Phi 11% 10%
HIV-l RNA huyết tương (Loglo bảnlmL) Iủc thu nhận
Trung binh (SD) 4,7 (0,6) 4,7 (0,7)
5100,000 66% 67%
>100,000 34% 33%
Số lượng CD4+ (tế bữolmm’) lúc thu nhận
Trung bình (SD) 228 (86) 230 (81)
Phân nhóm HIV-l
B 71% 75%
Không phải-B 29% 24%
“ bao gồm 2 bệnh nhân được chọn ngẫu nhiên nhưng chưa từng dùng thuốc nghiên cứu mù.
" Bao gôm bệnh nhân bản địa châu Mỹ lAIaska và người đảo Hawai/Pacific.
Bảng 3 mô tả kết quả tại 48 tuần trong nghiên cứu VERxVE study (1 100.1486). Những kết quả
nảy bao gồm tất cả những bệnh nhân được chọn ngẫu nhiên sau 14 ngảy điếu trị dẫn đầu với
VIRAMUNE viên giải phóng nhanh và điếu trị it nhất L liều thuốc nghiến oứu mù.
Bảng 3: Kết quả tại Tuần 48 trong nghiên cứu 1100.1486'
VIRAMUNE VIRAMUNE
viên giải phóng nhanh viên giãi phóng chậm
N=506 N=505
Đ_ap ưng vưưs (H1V-l RNA <50 75_9% 81,0%
ban/mL)
Không dảp ứng virus 5,9% 3,2%
Chưa bao giờ bị ức chế đến tuần 48 2,6% 1,0%
Tải phảt 3,4% 2,2%
Ngừng nghiên cứu trước tuấn 48 18,2% 15,8%
Tử vong 0,6% 0,2%
Tảo dụng ngoại ý 8,3% 6,3%
Khácb 9,3% 9,4%
' Bao gôm những bệnh nhãn đuợc điêu trị it nhât 1 liếu thuôo mù sau khi được chọn ngẫu nhiên. Đã Ioại trừ bệnh
nhân ngừng điêu trị trong giai đoạn dẫn đầu.
” Bao gổm không theo dỏi, ngừng, khỏng Luân thù, không hiệu quả, mang thai và nguyên nhân khác.
20
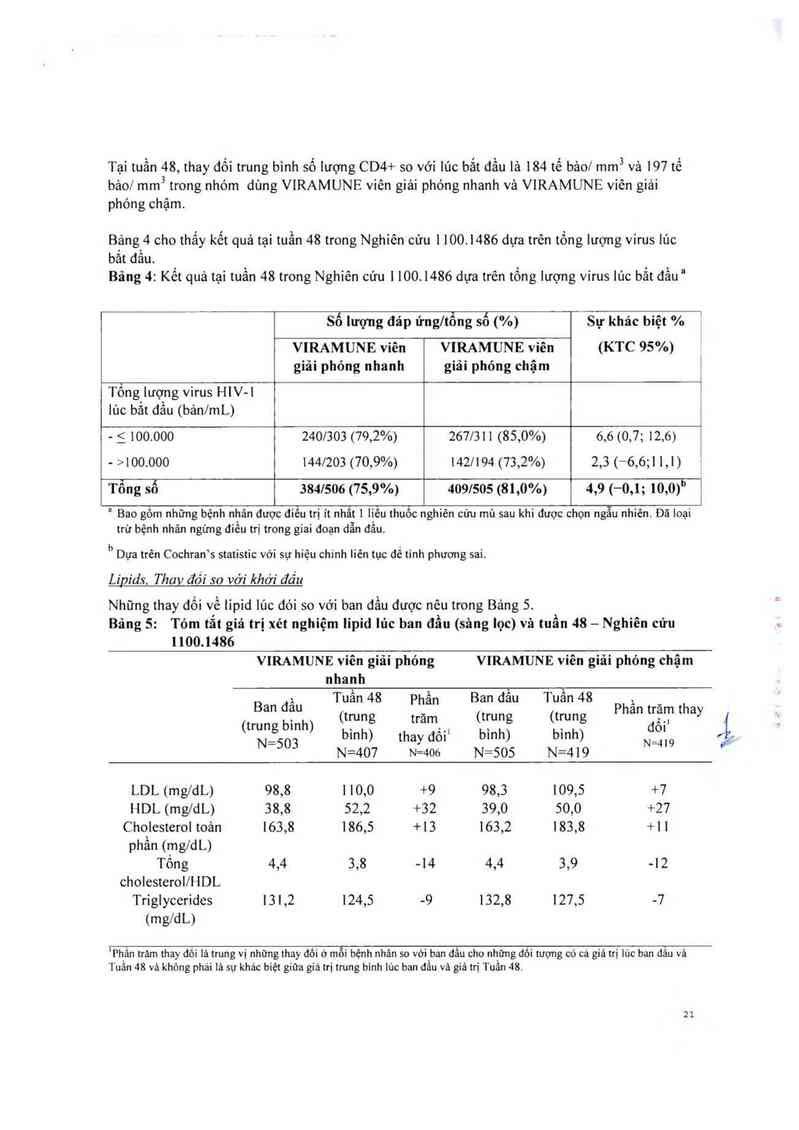
Tại tuần 48, thay đối trung bình số lượng CD4+ so với Iức bắt đầu là 184 tế bảo/ mm3 và L97 tế
băo/ mm3 trong nhóm dùng V1RAMUNE viên gỉải phóng nhanh và VIRAMUNE viện giải
phóng ohậm,
Bảng 4 cho thấy kết quả tại tuấn 48 trong Nghiên oứu 1 100.1486 dựa trên tống lượng virus lúc
bắt đầu. _ _
Bảng 4: Kết quả tại tuân 48 trong Nghiên oứu 1 100.1486 dựa trên tông lượng vỉrus lủc bảt đâuI
Số lượng đảp ửng/tổng số (%) Sự khảo biệt %
VIRAMUNE viên VIRAMUNE viên (KTC 95%)
giải phỏng nhanh giải phỏng chậm
Tống_lượng virus HIV-1
1ủc bảt đầu (bảnlmL)
-5100.000 240/303 (79,2%) 267/311 (85,0%) 6,6 (0,7; 12,6) Ĩ
… >100.000 144l203 (70,9%) 142/194 (73,2%) 2,3 (—6,6;1 1,1)
Tổng số 384/506 (75,9%) 4097505 (81,0%) 4,9 (-0,1; 10,0)b
² Bao gỏm những bệnh nhân được điêu trị ít nhất 1 Iiêu thuôo nghiên cứu mù sau khi đuợc chọn ngân nhiên. Đã Ioại
trừ bệnh nhấn ngừng điếu trị trong giai đoạn dẫn đấu,
h Dựa trẻn Cochran’s statistic với sự hiệu ohinh liến tục đề tinh phương sai.
Lipids, Thay đỏi so với khởi đầu
Những thay đối về Iipid lúc đói so với bản đầu được nêu trong Bảng 5.
Bảng 5: Tỏm tắt gỉả trị xét nghiệm lipid lúc ban đầu (sâng lọc) và tuần 48 — Nghiên cứu
1100.1486
VIRAMUNE viên giải phóng VlRAMUNE viên giải phóng chậm
nhanh
; Tuân 48 Phần Ban đấu Tuần 48 , _
Ban đạn (trung trăm (trung (trung Phan trạm thay
(trung binh) , , ,, , . đOLl
N=503 binh) thay đo) binh) binh) N=4L9 7;
N=407 N=406 N=505 N=419
LDL (mg/dL) 98,8 | 10,0 +9 98,3 109,5 +7
HDL (mg/dL) 38,8 52,2 +32 39,0 50,0 +27
Cholesterol toản 163,8 186,5 +13 163,2 183,8 +1 1
phần (mg/dL)
Tống 4,4 3,8 -14 4,4 3,9 —1 2
cholesteroI/HDL
Triglycerides 131,2 124,5 -9 132,8 127,5 -7
(mg/dL)
'Ph_ấn trâm thay đới 1ảtrung vị những thay đới ớ mỗi bệnh nhân so vớỉ_ban đầu oho những đối tượng có cả giá trị lủo ban đấu và
'1`uân 48 vả không phải là sự khảo biệt giữa giá trị trung binh lùc ban đãu vả giá trị Tuân 48.
21
Bênh nhân chuvển từ VIRAMUNE viên giải phóng nhanh sang VIRAMUNE viên gL'âL' phóng
@
TRANxITION (Nghiên cứu 1 100.1526) lả một nghiên oứu pha 3 đánh giá độ an toản và hoạt
tính khảng virus ở những bệnh nhân ohuyến từ VIRAMUNE viến giải phóng nhanh sang
VIRAMUNE viên giải phóng chậm. Trong nghiến cứu nhãn mờ nảy, 443 bệnh nhân điều trị
kháng virus có VIRAMUNE viện giải phóng nhanh 200 mg 2 lần mỗi ngây với HIV-l RNA <50
bản/mL được chọn ngẫu nhiến theo tỷ lệ 21] dùng VIRAMUNE viến giải phóng chậm 400 mg ]
lần mỗi ngảy hoặc VIRAMUNE viên giải phóng nhanh 200 mg 2 lần mỗi ngảy.
Khoảng một nứa bệnh nhân được điếu trị cơ bản bằng tenofovir + emtricitabine , những bệnh
nhân còn lại dùng abaoavir sulfate + lamivudine hoặc zidovudine + lamivudine. Khoảng một nứa
bệnh nhân có it nhắt 3 nảm trước đó điếu trị bằng VIRAMUNE viến giải phóng nhanh trước khi
tham gia Nghiên cứu 1 100.1526.
Tại tuần 24 sau khi được chọn ngẫu nhiên vảo Nghiên cứu TRANxITION, lằn lượt 92,6% và
93,6% bệnh nhản dùng VIRAMUNE viên giải phóng nhanh 200 mg 2 lần mỗi ngảy hoặc
VIRAMUNE viên giải phóng ohậm 400 mg 1 lân mỗi ngảy, tiêp tục có HIV—l RNA <50
bản/mL.
Nhạy cảm HIV in vilro
Tảo dụng kháng virus in vitro cùa nevirapine đã được xác định trong một loạt cảc dòng tế bảo
bao gồm các tế bảo đơn nhân ở mảư ngoại vi, đại thực bảo nguồn gốc bạch oầu đơn nhân, vả tế
bảo dạng nguyên bảo _l.ympho Trong những nghiên c_ứu gấn đây sử dụng bạch cầu lympho mảư
cuống rôn người và tế bảo thận phôi thai người mã số 293, giá trị EC50 (nồng độ ức chế 50%)
dao động từ 14- 302 nM đối với các chùng H1V- 1 phân lập trên lâm sảng và xét nghiệm.
Nevirapine có tác dụng khảng virus in vitro dối với cảc ohùng nhóm M H1V-l phân lập từ dòng
A, B, C, D, F, G, vả H, và dạng lưu hảnh tải tổ hợp (CRF), CRFOI AE, CRFO2 AG vả CRF12
BF (giá trị trung vị của EC50 là 63 nM). Nevirapine không có tác dụng khảng virus in vitro đối
với cảc phân lập từ nhóm 0 H1V—l vả H1V-2.
Nevirapine kết hợp với efavirenz thế hiện tảo dụng đối khảng mạnh với khảng H1V- 1 in vitro và
bổ sung tảo dụng đối khảng với thuốc ức chế protease lả ritonavir, hoặc chất ức chế chung
enfuvirtide. Nevirapine có tác dụng hiệp đồng khảng H1V- 1 khi phối hợp với thuốc ức chế
protease như ạmprenavir, ạtazanavir, indinavir, lopinavir, nelfinavir, saquinavir vả tipranavir; vả
cảc thuốc NRTI như abacavir, didanosine, emtricitabine, 1amivudine, stavudine, tenofovir vả
zidovudine. ln vitro tác dụng khảng HIV-l của nevirapine bị đối khảng bời thuốc khảng viếm
gan B (HBV) adefovir, vả thưốc kháng viêm gan C (HCV) ribavirin.
Đề kháng
In vitro đã xuất hiện cảc phân lập HIV giảm nhạy cảm với nevirapine (từ 100- 250 lẩn ). Phân
tích kiếu gen oho thấy sự đột biến trong gen H1V- 1 RT Y181C vả/hoặc V106A phụ thuộc vảo W)
chùng virus và dòng tế bảo đã dùng. Thời gian xuất hiện sự dễ khảng nevirapine in vilro không 1
bị thay đối khi chọn nevirapine kết hợp với nhiều NNRTI.
22
Sự thạy đối kiều gen vả kiến hinh trong cảc phân lập HlV-I từ những bệnh nhân được điều trị
hoặc với VIRAMUNE viên giải phóng nhanh (n=24) hoặc VIRAMUNE viên giải phóng nhanh +
ZDV (n=l4) được theo dõi trong cảc thử nghiệm pha VII từ | đến _>_ 12 tuần. Sau một tuần đơn
trị Iiệu với VIRAMUNE, phân lập HlV-l từ 3 bệnh nhân dã thấy giảm nhạy cảm dối với
nevirapin in vilro; một hoặc nhiều đột biến gen RT tại axit amin vị trí IO3, 106, 108, l8l, I88 vả
I90 được phát hiện trên vải bệnh nhân ngay 2 tuần sau khi bắt đầu điều trị.
Tại thời điềm 8 tuần đơn trị liệu với VIRAMUNE, IOO% bệnh nhân thứ nghỉệm (n=24) có phân
lập HIV giảm nhạy cảm ín vilro với nevirapine > IOO lần so với ban đầu, và có một hoặc nhiều
đột biến gen RT khảng nevirapine; l9 trong số 24 bệnh nhân (80%) có phân lập đột biến gen ở vị
trí l8l không liên quan đến liều dùng.
Phân tích kiều gen cứa các phân lập từ những bệnh nhân chưa được điều trị với khảng retrovirus
có tải xuất hiện virus (n=7 !) dùng nevirapine [ lần/ngảy (n=25) hoặc 2 lằn/ngảy (n=46) kết hợp
với lamivudine vả stavudine (nghiên cứu 2NN) trong 48 tuần cho thấy phân lập trên 8/25 bệnh
nhân và 23/46 bệnh nhân, tương ứng, có một hoặc nhiều gen đột biến liên quan đến kháng thuốc
NNRTI bao gồm: YISIC, KIOIE, (ìl9OA/S, KIO3N, VlOôA/M, VIO8I, YI88C/l., A98CL,
F227L vả M23OL.
Đã tiến hảnh phân tích kiếu gen từ phân lập 86 bệnh nhân chưa được điều trị với khảng
retrovirus những người dã dứng trong nghiên cứu VERxVE (] 100. | 786) sau khi xét nghiệm
virus thất bại (tải phảt, đáp ứng l phẳn) hoặc do một tảc dụng ngoại ý hoặc tăng thoáng qua nồng
độ virus trong thời gian nghiên cứu. Phân tich những mẫu của cảc bệnh nhân dùng VIRAMUNE
viên giải phóng nhanh hai lần mỗi ngảy hoặc VIRAMUNE viên gìải phóng chậm một lần mỗi
ngảy kết hợp với tenofovir vả emtricitabine cho thấy phân lập từ so bệnh nhân có đột biến khảng
thuốc như dự kiến ở những bệnh nhân điếu trị bằng nevirapine. Trong số 50 bệnh nhân, 28 bệnh
nhân đề kháng efavirenz vả 39 bệnh nhân để khảng etravirỉne (thường gặp nhất lả dột biến khảng
thuốc tại YI8IC).
Không có sự khác biệt về dạng bảo chế đã sử dụng (viên giái phóng nhanh 2 lẩn mỗi ngảy hoặc 11
viên giải phóng chậm | iân mỗi ngảy). Ệf/ỉ
Dột biến khi thất bại là những loại đã dự kiến ở những bệnh nhân điều trị bằng phảc đồ có
nevirapine.
Đã quan sát thấy hai thay thế mới trên codon trước kia do kháng nevirapine: một bệnh nhân với
Y | 81 I trong nhóm dùng VIRAMUNE vỉên giải phóng chậm và một bệnh nhân với YI88N trong
nhóm dùng VIRAMUNE viên giải phóng nhanh; khảng nevirapine đã được khắng định bằng
kiếu hình.
Đề kháng chéo: Dã thấy sự xuất hiện nhanh chóng của cảc chùng HIV đề khảng chéo với cảc
thuốc ức chế men sao chép ngược không nucleoside (NNRTI) trên in vitro. Dữ Iiệu đề kháng
chéo giữa NNRTI nevirapine vả cảc thuốc ức chế RT nhóm nucleoside còn rất hạn chế. Trên 4
bệnh nhân, cảc phân lập để khảng ZDV ín viiro vẫn thế hiện sự nhạy cảm với nevirapine và trên
6 bệnh nhân, các phân lập dề kháng nevirapine vẫn nhạy cảm với ZDV vả ddi. Đề kháng chéo
giữa nevirapine vả cảc thuốc ức chế protease HIV thường không xảy ra do cảc đích enzyme lả
khảc nhau.
Dế kháng chéo với delavirdine vả efavirenz có thể xảy ra sau khi thất bại về mặt virus học với
nevirapine. Tùy thuộc vảo kết quả xét nghiệm sự đề khảng, một phảc đồ điều trị chứa etravirine
có thế được dùng sau dó.
Không được sử dụng nevirapine đơn độc để đìều trị HIV cũng như không được thêm một mình
thuốc nảy vảo cảc phác đồ điều trị đã thắt bại. Cũng như tắt cả các thuốc ức chế sao chép ngược
khỏng nucleoside khảc, virus kháng thuốc sẽ phát triến rất nhanh nếu nevirapine được sử dụng
như phác đồ đơn trị liệu.
Nên cân nhắc khả năng đề kháng chéo khi chọn cảc thuốc khảng retrovirus mới để sử dụng kết
hợp với nevirapine.
Khi ngứng sử dụng phảc đồ kháng retrovirus có nevirapine, cần lưu ý rằng nevirapine lá thuốc có
thời gian bán thải dải; nếu cảc thuốc khảng retrovirus có thời gian bản thải ngắn hơn được ngừng
cùng lúc thì nổng độ thấp của một minh nevirapine trong huyết tương có thể kéo dải hơn ] tuần
và có thể xuất hiện sự dễ kháng virus sau đó.
Dươc đông hoc
Dược động học ở bệnh nhân người lớn
Dược động học cùa niverapine đã được khảo sảt trong một nghiên cứu VIRAMUNE viên giải
phóng chậm liếu duy nhất (Nghiên cứu HOO.I48S) trên 17 người tình nguyện khóe mạnh. Sinh
khả dụng tương đối cùa nevirapine khi dùng một viên 400 mg VIRAMUNE viên giải phóng
chậm tương ứng khoảng 75% so với khi dùng hai viên 200 mg VIRAMUNE viên giải phóng
nhanh. Nồng độ dinh trung bình cùa nevirapine trong huyết tương là 2060 ng/mL định lượng vảo
lúc trung bình 24,5 giờ sau khi dùng 400 mg VIRAMUNE viên giải phóng chậm.
Dược động học của VIRAMUNE viên giải phóng chặm cũng dã được nghiên cứu trong một
nghiên cứu dược động học đa liều (Nghiên cứu 1100. l489) trên 24 bệnh nhân nhiễm HIV- !
chuyến từ điếu trị dải ngảy bằng VIRAMUNE viên giải phóng nhanh sang VIRAMUNE viên
giải phóng chậm AUCo 24 55 và C….an của nevirapine đánh giả sau l9 ngảy uống lúc đói
VIRAMUNE viên giải phóng chậm 400 mg một lần mỗi ngảy tương ứng khoảng 80% và 90%
cùa AUCo…za.ss vả Cm…_ss đo khi bệnh nhân dùng VIRAMUNE viên giải phóng nhanh 200 mg hai
lần mỗi ngảy. Trung bình nhân Cmian cùa nevirapine là 2770 ng/mL.
Khi VIRAMUNE viên giải phóng chậm được dùng cùng với bữa ăn giảu chắt béo, AUCO.ụ_SS vả
C……s cùa nevirapine tương ứng khoảng 94% và 98% AUCo. 24 55 vả Cmmss khi bệnh nhân dùng
VIRAMUNE viên giải phóng nhanh. Sự khảc biệt trong dược động học cùa niverapine khi
VIRAMUNE viên giải phòng chậm dược uống khi đói hoặc no được cho là không quan trọng về
lâm sảng. VIRAMUNE viên giải phóng chặm có thể uống cùng hoặc không cùng thức ăn. \Ml
Ành hướng của giới tính đến dược động học cùa VIRAMUNE viẽn giải phóng chậm đã được
khảo sát trong Nghiên cứu | 100. l486. Bệnh nhân nữ có xu hướng có nông dộ dáy cao hơn
24
(khoảng 20-30%) ở cả hai nhóm VIRAMUNE giải phóng nhanh và VIRAMUNE giải phóng
chậm.
Dược động học của nevirapine ở những bệnh nhân người lớn nhiễm 111V—1 dường như không
thay đồi theo tuối (phạm vi từ 18-68 Luới), Những bệnh nhân da đen (n=80/nhóm) trong Nghiên
cứu L 100.1486 cho thẩy nổng dộ đáy cao hơn khoảng 300/o so với bệnh nhân da trắng (250-325
bệnh nhân/nhóm) ờ cả hai nhóm VIRAMUNE giải phóng nhanh và VIRAMUNE giải phỏng
chậm trong 48 tuần điều trị với liều 400 mg mỗi ngảy.
VIRAMUNE giải phóng chậm chưa được đảnh giả ở những đối tượng suy gan hoặc suy thặn.
Cảc chắt không hoạt tính cùa VIRAMUNE viên giải phóng chậm đôi khi sẽ được bải tiết trong
phân dưới dạng cảc chât mềm hydrat hóa.
Dược động học ở bệnh nhi
Dược động học cùa VIRAMUNE giải phóng chậm được đảnh giả trong Thử nghiệm | 100.1518.
85 bệnh nhân từ 3 đến dưới 18 tuối được dùng VIRAMUNE gìải phóng nhanh, điều chinh Iiểu
theo thể trọng hoảc dìện tich bề mặt cơ thề, tối thiều trong 18 tuần và sau đó chuyền sang
VIRAMUNE giải phóng chậm 12 x 100 mg, 3 x 100 mg hoặc L x 400 mg một lần mỗi ngảy) kết
hợp với cảc thuốc khảng retrovirus khảc trong 10 ngảy.
Tỷ số cùa trung binh nhân quan sát thấy giữa VIRAMUNE giải phóng chậm so với VIRAMUNE
giải phóng nhanh là khoảng 90% đối với Cmms vả AUCss với khoảng tin cậy 90% trong phạm vi
80%—125%; tỷ số nảy đối với c…ss lả thẳp hơn và phù hợp với dạng liều dùng một lần mỗi
ngảy. Trung binh nhân cùa nồng độ đảy trong huyết tương ở trạng thái ổn định trước khi dùng
VIRAMUNE giải phóng chậm lả 3.880 ng/mL, 3.310 ng/mL và 5.350 ng/mL tương ứng với cảc
nhóm tuổi 3 đển dưới 6 tuốì, 6 đến dưới 12 tuổi và 12 đến dưới 18 tuồi. Nhìn chung, nồng độ ở
trẻ em tương tự như số liệu ghi nhận ở người lớn dùng VIRAMUNE giải phóng chậm trong Thử
nghiệm | 100.1486.
Trong những nghiên cứu về sinh khả dụng nhóm song song, dùng đơn Iiều (Thử nghiệm ằ
1100.1517 vả 1100.1531), VIRAMUNE viên giải phóng chậm 50 vả 100 mg thế hiện đặc tính
giải phóng chậm bằng hấp thu kéo dải vả nống độ tối đa thấp hơn, tương tự như ghi nhận khi so
sảnh viên giải phóng chậm 400 mg với VIRAMUNE viên giải phóng nhanh 200 mg.
Chia một Iiểu 200 mg thảnh 4 Iiều 50 mg hoặc 2 liều 100 mg Iảm tăng hấp thu 7—11%,nhưngtỳ
lệ giải phóng thuốc thì tương tự. Sự khác biệt về dược dộng học quan sát thấy gìữa VIRAMUNE
viên giải phớng chậm 50 mg vả 100 mg lá không quan trọng về lâm sảng, và viên giải phóng
chậm 50 mg có thế được sử dụng thay thế viên 100 mg.
Các chất không hoạt tinh cùa VIRAMUNE viên giải phóng chậm đôi khi sẽ dược bải tiết trong
phân dưới dạng các chât mêm hydrat hóa.
Đỏn ỏi
Chai 30 và 90 viên giải phóng chậm.
Bân guản
Dưới 30°C.
Han dùng
36 thảng kể từ ngảy sản xuất
Sân xuất bỡi
Boehringer Ingelheim Roxane Inc.
1809 Wilson Road, Columbus, Ohio 43228, USA
Thuốc bản theo đơn.
Đọc kỹ hưởng đẫn sử dụng trước khi dùng.
Hãy liến hệ vởi bác sĩ nểu cần thếm thông tỉn. ẳ
Đế nơi an toân ugoâi tầm tay trẻ em.
ÁC
MảéJ _Jơẻ
DÍ'ĂCCẾA gẮWJÍ tfallẮ/
Ltt ỄlCLỦÝ ~
f'_"
@
Boehringer
llĨil Ingelheim
PHÓ cục TRUỞNG
e/VỹMJẨM "Va7n %ẨcmẨ
26
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng