









lnúuunlmli vlumuu W souo5mn
240 m. 1 Icm m
mu… svaĩcììỉ" '
ẽ'ỉỉú: ' … w…wu
m…… nm
um Em :… nsz-a
…:
… ỈTiĨ-ỉtỉưÊỈ
… ĩỉìvnỉơỉ
ù—i luu _ na mc
__ i… =ì-fìịị .
fim {' ` '
m'h' nơ: ỉm. ubmnrm, …
ỉĩỉìnĩ W
Ềũ'ỉ'wĩ' nm… "' ’
Slthl-ự- ;…
ỉ…ỉ ' ’ ` ' ' ” ’ ” “ “
~ u…m; uvc : nrA; ru m… m.; nm… mmru.
uưon mu um um
« Wurum …mu ln mu mom; um mmmnoad In
mụmnnơulhvzuunutou
c……» tu unwmm ~ Ki
…
Al
Y TE
BỘ
OC
NLÝDƯ
CỤCQUA
A
ĐAPHEDUYET
,.
«
Lânớiniiụỉư…AảhJ…ghnLĩ
Iun-ut Mum
Inn:
IHIII
l…
v
”2’
t ửtnạV
Lolj
ttữể
LD
…
ỐỈiủỹ/D ỄmnẮCn ổb/Lỹ
Ồn ẾMJ ơỉti
uoịsuadsns mo |Lu oqz
Im Slim 05
mnumm
.---.- -------…-q
Vĩnmunư Vlramunr
Ể20qu ml Ễtzomgfs ml
… m
oral suspension oral suspensỉon
om uu
mm… Shan mm … …
Mnhhnnn. Mldcènll umduci wbhd
nu lnm dh nqg ln medlnl pnsntpơian
' RX um“ . ' Kan nuolme mth Illd
i … u-u-uuc- . _ : stlntchlhmn
' ' m .
; Vưamu ne° ; .':7121……… . Viram uneơ ; Ị°…°:…:ifặitz…u
I . . mam…gnẹukm ; : lhebơule
Ẹ ; 50 mgl5 m' . : ầ'ẩ'ẫưắễ“ : 50 mgl5 ml . i lánlcmlẵmm micrn'n.
' ' oral suspensmn : ; oral suspensmn ; ă..mzaraz…mm
: numle 1 i nmnlm : Euidenlszmclodu
Í 240 ml oral suspension . ' 240 ml oral suspension l sumn. wmel
i i __Oẫ : ẢnnrtnpỉẫỂnW1
i DNNK: i ã gi, i ỀỆ'Ểon um
. 0 | .
: : -—T ễ su lul tu up
1 ỉl Boehringer l _,Ỉ, * Boehringer
_ _ ' lngelheìm ! ' Ingelhum .
mm… r
INWI
Ỉ .......................
\
hdn…m mm IOMIIU
30— 1 ». Iu
A_JLT… ' hiu…
Cn—nễử ốrđothhinul] “
ISWBDo: nm1
mm… na my.u
MI…
iuu= Í: iìmrnmưm.
ĩu'ỉ ` lĩỉn'cữ
cỉínỉn ' gu: _ _ . gu mc _
… mc c…iu
ỉĩunủ, _ F '
EỂnììuc au: nm…iu.ủẹ
ỉuỉut'T ĩmca ơĩuỉuíc
mỉ ” mm… ”
Sm`lhmm ỉẮỈ. ’
- u…d- uch …Mu m… owmuum uu…m-u;
umnmumulmm.
' ĩdđn|m ll(lilil IrIWIỦ KNIMl Iml erl IIMMII
mụ… ut ui … mui…
caunm Ion Mu unwlmen ~ II
uogsuadsns mo |uJ oa
MWva msn MW
MM…er ion Joe
«s m 95 m …
oral suspension
-ub-………-……
ũ'LT…
…"“…“i…Ề“"“ .
' m. : u…mmu— ỆRX.
ỉVưamune~ ị xm*;;m…… ;Vưamuneo
,50 mg|5 ml _ { ỂỂỀz-ỆỆẸ'Ị-ặề'“ 550 mg/5 m| .
;oral suspens:on : ;oral suspensmn
l nlvlnclnu ’ !
ị20 ml oral suspension Ắ : 20 ml oral suspension
g DNNK: ỉ ị:
: : Ẹiẻ
: : E::
Ị ^ Boehringer ĩ Ẹ,Ỉg ^ Boehringer
i liiỈl Ingelheim _; ỈỈỈI Ingelheim
l !1lMMZn—ìi - _ —l- _ m-v—ỞÙÌ--u __ _Ả___ v-_ _ - _ - _ - . -.
snuma
ViramuneU
50 mng ml
20 ml
orai suspension
Oral uu
Shake gentty m… uu
Medlclnd umdutl smim
to mulul munlmỉm
Km; out M me reach and
mmdehlldm
To be um uitmn
² mmtm alm openỉnl
lhc bom»
! mlnnutml' ml ehửt
10 mg naỉrepỉn
us nzvừapỉnu humiởydml)
Euìdems: iucludu
wcmu. white!
SMInIID'W
Il"
VIRAMUNẸ®
Hỗn dịch uông 50 mg/S mL
Thảnh nhần
1 mL hỗn dịch uống chứa: 10 mg nevirapỉne; tương đương 10,35 mg nevirapine hemỉhydrate
T á dược: Carbomer 934P, Methylparaben, Propylparaben,’Polysorbate 80, Sucrose, Sorbitol Solution,
Sodium Hydroxide Pellets (Reagent Grade), nước tinh khỉêt
Chỉ đinh
VIRAMUNE được chỉ định kết hợp với cảc thuốc kháng retrovirus khảc trong điếu trị nhiễm HIV- 1.
Vírus đề khảng phảt triến nhanh và đồng nhất khi đon trị Iiệu bằng VIRAMUNE. Do đó, nên luôn dùng
VIRAMUNE kết hợp với it nhất hai thuốc kháng retrovirus khảo.
Dế phòng ngùa iây nhiễm HIV- ltù mẹ sang con ở những phụ nữ mang thai không được điếu trị bằng
những thuốc kháng retrovirus hiệu lưc mạnh (highly active antiretroviral therapy- IHAART) tại thời
điếm chuyến dạ: VIRAMUNE được chỉ định và có thể dùng một mình với Iiều uống duy nhất cho
người mẹ lúc chuyền dạ và liếu uống duy nhất cho trẻ sau khi sinh (Xem Liều Iuợng vả cảch dùng).
Don trị liệu với VIRAMUNE liên quan dến sự phát triển để khảng đối với nhóm thuốc ức chế men sao
chép ngược không nucleoside (NNRTI). Hiệu quả của VIRAMUNE trong điều trị kết hợp có thế giảm
ở những phụ nữ vả trẻ nhỏ trước đây đã dùng nevirapìne lỉều duy nhất đề phòng ngừa lây nhỉễm HlV—l
từ mẹ sang con (xem Cảnh báo vả Thận trọng đặc biệt).
Ở những nơi có cảc thuốc khảng retrovirug khác, nên kết hợp VLRA_MUNE Iiềụ đơn với cảc thuốc
kháng retrovirus hiệu quả khảc (như khuyên Cảo trong cảc hướng dân được quôc tế công nhận).
ig
Liều lương và cách dùng
Bên]: nhi: Tổng liếu mỗi ngảy không nên `vượt quả 400 mg cho mọi bệnh nhân. Có thể tính Iiếu
VIRAMUNE cho bệnh nhi theo diện tích bê mặt cơ thê (BSA) hoặc theo thế trọng như sau:
Với BSA, sư dụng công thức Mosteller, liều uốzng khuyến cảo cho bệnh nhi mọi lứa tuổi là 150 mg/m
x 1 lần/ ngảy x 2 tuần, sau đó lả Iiếu ISO mg/m2 x 2 iần/ngảy.
Cảch tính thể tích hỗn dịch uống VIRAMUNE (50 mg/S mL) cần thiết cho chia liếu cho bệnh nhi dụa
trên diện tích bề mặt cơ thế 150 mg/mzz
Khoảng BSA (m2) Thể tích (mL)
0,08 - 0,25 2,5
0,25 … 0,42 5
0,42 — 0,58 7,5
0,58 - 0,75 10
0,75 - 0,92 12,5
0,92 — 1,08 15
l 1
l .
A\ucE R 1.
3 |
Không dùng VIRAMUNE cho nhũng bệnh nhân rối Ioạn chúc nảng gan nặng (Child— Pugh C) hoặc
ASAT hoảc ALAT truớc khi diếu trị > S lằn giới hạn trên cùa múc bỉnh thuờng (ULN= Upper Límit of
Normality) cho dến khi ASAT/ALAT nền truớc khi dỉều trị Ồn định ở mức < 5 lẳn ULN
Không dùng lại VIRAMUNE cho những bệnh nhân đã được yêu cầu ngừng thuốc vĩnh viễn do phảt
ban nặng, phảt ban đi kèm vởi các triệu chứng toản thân, cảc phản ứng quá mân, hoặc viêm gan trên
lâm sảng do nevirapine.
Không dùng lại VIRAMUNE cho những bệnh nhân đã từng có ASAT hoặc ẠLAT > 5 lần giới hạn trên
cùa mức binh thưởng (ULN) trong thời gian điêu trị với nevirapine và tái xuât hiện bât thường chức
năng gan khi diêu trị lại với nevirapine (xem Thận trọng và Cảnh báo đặc biệt).
Chống chỉ định trong tntớng hợp bệnh di truyền hỉốm gặp có thể tương ky với một tá dược cùa thuốc
(xem Thận trỌng vả Cảnh báo đặc bỉệt).
Không được dùng các chế phẩm thảo dược chứa cỏ St John (hypericum perforatum) trong khi dùng
VIRAMUNE do nguy cơ gìảm nông độ nevirapine trong huyêt tương vả giảm tảo dụng lâm sảng txem
Tương tải:).
Cânh bảo vả thân trong đăc biêt
Cảc xét nghỉệm sinh hóa mảư, bao gồm xét nghỉệm chúc nãng gan nên đuợc tiến hảnh truớc khi bắt
đầu điếu trị với VIRAMUNE và định kỳ thích họp trong thời gỉan diều trị
18 tuần diếu trị đầu tiên với VIRAMUNE là giai đoạn quan trọng cần theo dõi bệnh nhân chặt chẽ để
phảt hiện cảc khả năng xuât hiện phản ứng trên da nghỉêm trọng và đe dọa tính mạng (bao gôm hội
chứng Stevens—Johnson vả hoại từ biêu bì nhìêm độc) và vìẽm gan/suy gan nặng.
Ngưy co bỉến cổ ở Igan và phản ứng trên da cao nhất xuất hiện trong 6 tuần điếu trị đầu tiên. Tuy nhiên,
nguy cơ cùa biến có bất kỳ ở gan có thể xuất hiện sau giai đoạn nảy vả nên tiếp tục theo dõi định kỳ
Chua có dữ liệu về số luợng tế bảo CD4+ vả nguy cơ khi bắt đầu sử Idụng VIRAMUNE 0 trẻ em Phụ
nữ và nhũng nguòi có sỏ lượng tế bảo CD4+ cao hon tại thời điếm bắt đằu đỉếu trị với VIRAMUNE (> Ểf
250/mmj ở nữ giới trưởng thảnh vả > —400/mm3 ở nam giới trưởng thảnh) thường có nguy cơ cao bị tảo
dụng bất lợi ở gan nễu bệnh nhân được phảt hìện có HIV-l RNA trong huyết tương - như nồng dộ ì 50
bản/mL- tại thời đỉếm bắt đầu dùng VLRAMLJNE.
Do độc tính trên gan nặng và đe dọa tính mạng đã được quan sảt thắy trong cảc nghiến cứu có dối
chủng và không đối chúng chủ yếu ở những bệnh nhân có số Iuợng virus HIV- ] trong huyết tuong_ >
50 bản sao chép/mL (copy/mL), không nến 3bắt đầu dùng VỈRAMUNE cho bệnh nhân nữ truờng thảnh
vởi số lượng tế bảo CD4+ > 250 tế bảo/mm3 hoặc bệnh nhân nam truớng thảnh với số Iuợng tế bảo
CD4+ > 400 tế bảofmm đuợc phát hiện HIV- 1 RNA trong huyết tuong trù khi lợi ích vuọt trội nguy
cơ.
Trong một số truờng hợp tốn thương gan tiếp tục tiến trìển mặc dù ngừng đíếu trị.
Nhũng bệnh nhân xuât hiện cảc dấu hiệu hoặc triệu chủng viêm gan, phản ứng da nặng hoặc phản ửng
quá mân phải ngùng VIRAMUNE và đánh giá lâm sảng ngay lập túc.
Không nên dùng lại VIRAMUNE sau khi bị cảc phản ứng nặng trên gan, da hoặc quá mẫn nặng.
Cẩn tuân thủ liếu dùng một cách nghỉêm ngặt, nhắt là 14 ngảy đầu dùng thuốc (xem Liều lượng và
Cảch dùng).
5Iiì ĨL“
Phân ứng trên gan
Nhiễm độc gan nặng hoặc đe dọa tinh mạng, kể cả viêm gan tối cấp gây tư vong đã xuất hiện ở nhũng
bệnh nhân điếu trị với VIRAMUNE. 18 tuần đỉếu trị đằu tiên là giai đoạn cân thiết yêu cầu theo dõi
chặt chẽ. Nguy cơ cảc biến cổ ở gan lởn nhất trong 6 tuần điều trị đầu tiên.
Tuy nhiên nguy cơ có thể kéo dải qua giai đoạn nảy và nên theo dõi định kỳ liên tục trong thời gian
điếu trị. Nên cho bệnh nhân bỉết cảc phản ứng trên gan là độc tính chính của VIRAMUNE. Bệnh nhân
có cảc dấu hiệu hoặc triệu chứng của viêm gan phải ngùng dùng VIRAMUNE vả đảnh giả y khoa
ngay, kể cả xét nghiệm chủc năng gan.
Dã ghi nhận một số hỉếm trường hợp hỉếm gặp teo cơ vân ở những bệnh nhân có cảc phản ứng trên da
vả/hoặc trên gan liên quan đến sử dụng VIRAMUNE.
Độc tính gan nặng, kể cả suy gan cần cấy ghép, đã được bảo cáo ở những cá nhân không nhiễm HIV
dùng nhiều liếu VIRAMUNE trong dự phòng sau phơi nhiễm (PEP), là chỉ định chưa được chấp thuận
và do đó không nên dùng.
Tặng nộngđộ ASAT hoặc ALAT > 2,5 lần ULN vả/hoặc đồng nhiễm viêm gan B vả/hoặc C tại thời
điêm băt đâu điếưtrị khảng retrovirus đi kèm với nguy cơ cao ›Luât hiện các biên có ngoại ý trên gan
trong thời gian đỉêu trị với thuôo khảng retrovirus nói chung, kê cả phác đô có VIRAMUNE.
Nữ giới vả số lượng CD4+ cao hơn ngay khi bắt đầu điếu trị với VIRAMUNE ớ những bệnh nhân chưa
được điếu trị liến quan đến tãng nguy cơ biến cổ ở gan. Theo đảnh giả hồi cứu chủ yếu trên những bệnh
nhân có lượng virus HIV- | > 50 bản/mL, phụ nữ với số lượng CD4+ > 250 tế bảo/mm có nguy cơ bị
tác dụng ngoại ý trên gan có trìệu chúng cao gấp 12 lần so vởi phụ nữ vói số lượng CD4+ <250 tế
bảo/mm (] 1% so với 0 ,9%) Đã thấy nguy cơ tăng cao ở nam giới có HIV— I RNA trong huyết tương
vả số lượn CD4+ > 400 tê bảo/mm (6, 3 % so với [ ,2 % ờ nam giới với số lượng tế bâo CD4r < 400
tế bảo/mm ). Nguy cơ độc tính tăng cao dựa trên ngưỡng số lượng CD4+ chưa được phảt hỉện ở những
bệnh nhân không định lượng được tải lượng virus huyết tương (tức lả <50 bản sao chép/mL).
Theo dõi chức nãng gan ?
Đã có bảo cảo bất thường xét nghíệm chức năng gan với VIRAMUNE, đôi khi trong những tuần đìếL
trị đầu tiên. Tăng men gan không triệu chúng thường được bảo cảo vả không phải là chống chỉ định
dùng VIRAMUNE. Tăng GGT không triệu chứng không phải là chống chỉ định cho vỉệc tiếp tục điếu
trl.
Cần theo dõi xét nghiệm chúc năng gan định kỳ, tùy theo yêu cầu lâm sảng cùa bệnh nhân, nhất là
trong 18 tuần điếu trị đầu tiên. Nên tiếp tục theo dõi lâm sảng và xét nghiệm trong thời gian điếu trị
bằng VIRAMUNE Thầy thuốc và bệnh nhân nên cảnh giảc với các dấu hiệu hoặc triệu chúng báo
trước về viêm gan, như chản ăn, buồn nôn, vảng da, bilirubin niệu, phân bạc mảư, gan to hoặc căng
đau. Nên khuyên bệnh nhân đi khảm bác sĩ nếu xuất hiện các triệu chứng trên.
Khi gỉả trị ASAT hoặc ALAT › 2,5 lần ULN trước hoặc trong thời gian đỉếu trị, nên theo dõi xét
nghiệm chức năng gan thường xuyên hơn trong những lần thăm khám lâm sảng định kỳ. Không nên
dùng VIRAMUNE cho những bệnh nhân có ASAT hoặc ALAT › 5 lần ULN trước điếu trị cho dến
khìASAT/ALAT nến trước khi điều trị ổn định tại mức < 5 lần ULN.
Nên ngừng VIRAMUNE ngay khi có ASAT hoặc ALAT tăng > 5 lần ULN trong thời gian điều trị.
Nếu ASAT vả ALAT trở về giá trị ban đầu và nếu bệnh nhân không có cảc dấu hiệu hoặc triệu chứng
7lil
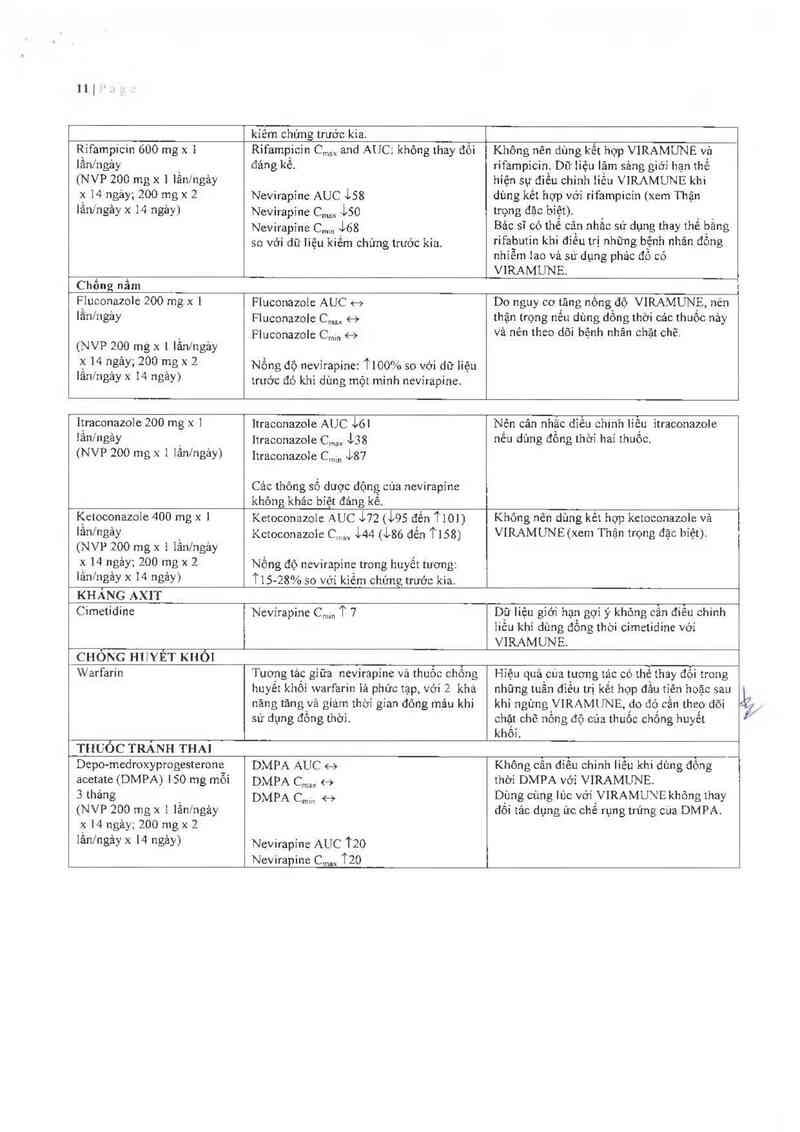
Không nến dùng VIRAMUNE kết hợp với những thuốc sau:
Efavirenz, rifampicin, kctoconazole; nếu không dùng kêt hợp với ritonavir liêu thâp: fosamprenavir,
saquinavir, atazanavir.
Hỗn dịch VIRAMUNE chứa 6 g sucrose cho liếu khuyến cảo tối đa hảng ngảy.
Bệnh nhân có bệnh di truyền hiếm gặp không dung nạp fructose, kém hắp thu glucose- galactose hoặc
thiếu men sucrase- -isomaltase thì không nên sử đụng thuốc nảy
Hỗn dịch VIRAMUNE chứa 6,5 g sorbitol cho iiều khuyến cảo tối đa hảng ngảy.
Bệnh nhãn có bệnh di truyền hiếm gặp không dung nạp fructose thì không nên sủ dụng thuốc nảy
Hỗn dịch VIRAMUNE chúa tả duợc methylparahydroxy benzoate vả propyl pmahyđroxy benzoate lả
nhũng chắt có thể gây phản ửng dị úng (có thể muộn)
Tương tác
Dũ lỉệu sau đây thu được khi sử dụng VIRAMUNE viên phóng thích nhanh nhưng có thế duợc ảp dụng
cho tất cả các dạng bảo chế.
Nevirapìne đuợc biết lả chẳt gây cảm úng các mcn chuyển hóa cytochrome P450 ở gan (CYP3A,
CYPZB) và có thể gây giảm nông độ trong huyết tương cùa cảc thuốc dùng đồng thời và đuợc chuyền
hóa nhiếu tại gan bòi CYP3A hoặc CYP2B (xem Duợc động học) Do đó, có thế cẩn chinh iiều nôu
bệnh nhân đã on định với liều dùng cùa một thuốc chuyền hóa bời CYP3A hoặc CYP2B và bắt đầu
điêu trị với nevirapine.
Sự hấp thu cùa ncvirapine khỏng bị ảnh huờng bời thúc an, thuốc khảng axit hoặc cảc thuốc có công
thúc vởi chất đệm đặc tính kiếm.
Dữ liệu tuong tảo chủ yếu duợc thế hìện duởi dạng thay đổi phần trăm (số trung binh nhân) với khoảng,
dụ đoản 95% (KDĐ 95%).
Thuốc điều trị
[ Tương tảc
| Khuyến cáo khi dùng đồng thời
CHÒNG LẮY NHIÊN!
Kháng retrovirus
Các chât ức chê men sao chép
ngược Nucleoside (NR Tls)
Didanosine 100-150 mg x 2
lầrưngảy
(NVP 200 mg xi lần/ngảy x
14 ngảy; 200 mg x 2 lần/ngảy
x 14 ngảy)
Didanosine AUC <—›
Didanosine C,… <—+
Diclanosine Cmm ê
Không cần điếu chinh liếu khi dùng đồng
VIRAMUNE vởì đidanosine.
Lgmivudìne 150 mg x 2
lân/ngảy _
(NVP 200 mg x 2 lãningảy)
Độ thanh thải biên kiên và thế tích phản bỏ
của iamivudine không thay đối, gợi ý
không có tảo dụng cảm ứng của nevírapỉne
đến sự thanh thải lamỉvudine
Khỏng cằn điểu chĩnh liễu khi dùng đòng
VIRAMUNE vởỉ lamivudỉne.
Stavudine:
30140 mg x 2 lầnlngảy,
(NVP 200 mg x ] lằn/ngảy x
14 ngảy; 200 mg x 2 lằningảy
x 14 ngảyj
Stavuđínc AUC <—›
Stavudine C,… <-›
Stavudỉne C…m ê
Nevirapine: Nồng độ biếu kiến không thay
đôi so với cảc kiêm chứng trước kia.
Không cân điếu chình Iiễu khi dùng đồng
VIRAMUNE với stavudine.
Tenofovir
Nổng dộ tenofovir không đỏi.
Không cần điều chinh iiều khi dùng đồng
9li`:
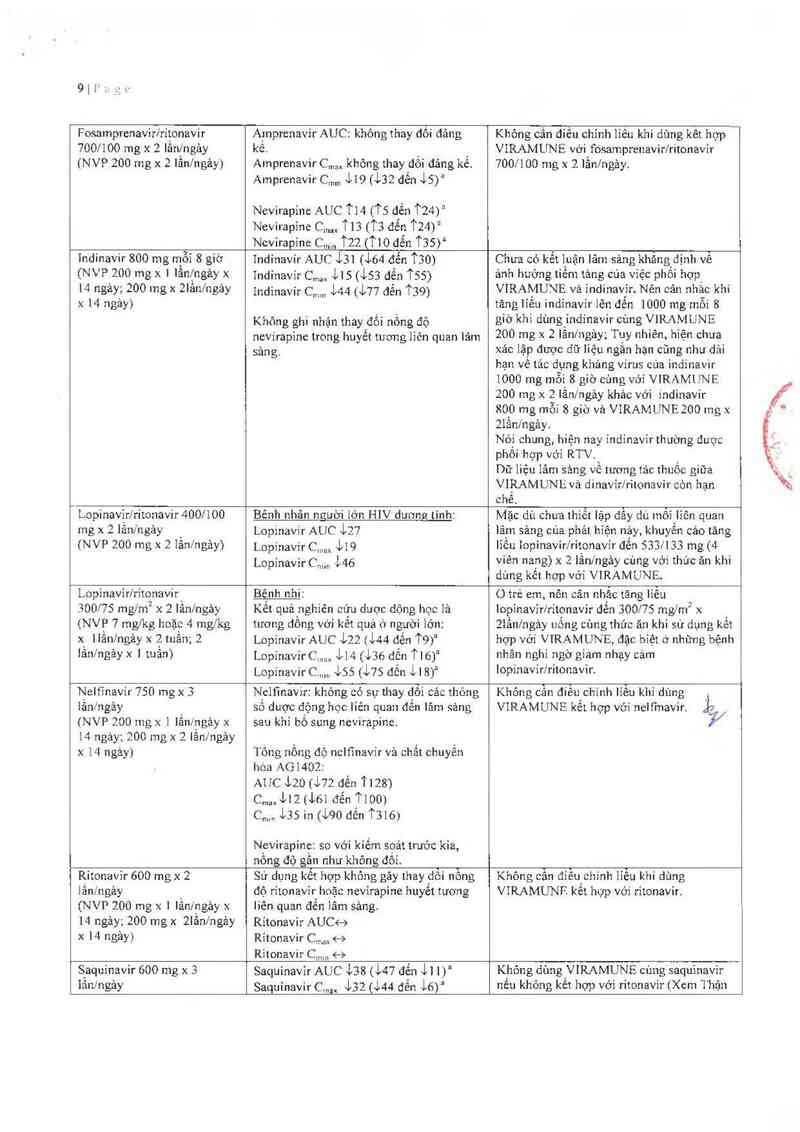
Fosamprenavirlritonavir
700/100 mg x 2 lănỊngảy
(NVP 200 mg x 2 Iân/ngảy)
Aanrenavir AUC: không thay đối đảng
kê.
AinprenaVir C…… không thay dồi đảng kế.
Amprenavir Cmm Ji9 (i32 đến ~lv5)a
Nevìrapine AUC TL4 (Ts dến 1`24)a
Nevirapỉne cm, T13 (T3 đến T24)a
Nevirapine c…… Tzz (TlO đến Tas>a
Khỏng oần điều chỉnh liếu khi dùng kêt hợp _
VIRAMUNE vởi fosamprenavir/ritonavir
700/100 mg x 2 Iần/ngảy.
indinavir 800 mg mỗi 8 giờ
(NVP 200 mg x t lần/ngảy x
14 ngảy; 200 mg x 2lần/ngảy
x l4 ngảy)
Indinavỉr AUC stL (~l64 đển T30)
Indinavir c… iLs (i53 dến ’TSS)
Indinavỉr c… L44 @77 đên T39)
Không ghi nhận thay'đối nồng độ
nevirapine trong huyêt tương liên quan lâm
sảng.
Chưa có kết luận lãm sảng khăng dịnh vê
ảnh huởng tiềm tảng cua việc phối hợp
VIRAMUVE vả indinavir. Nến cân nhắc khi
tăng Iiêu indinavỉr lến đến 1000 mg mỗi 8
gíờ khi dùng indínavir cùng VIRAMUNE
200 mg x 2 lầnlngảy; Tuy nhiên, hỉện chua
xảc lập đưọo dữ liệu ngắn hạn cũng như dải
hạn vê tác dụng khảng virus eùa indínavir
1000 mg mỗi 8 giờ cùng với VIRAMUNE
200 mg x 2 Iẩníngảy khảo với indinavir
800 mg mỗi 8 giờ và VIRAMUNE 200 mg x
Ziầnlngảy.
Nói chung, hiện nay indinavỉr thường được
phối hợp với RTV.
Dữ liệu lâm sảng về tương tảo thuốc giữa
VIRAMUNE vả dinavir/ritonavir còn hạn
chẽ.
Lopinavir/ritonavir 400/100
mg x 21ân/ngảy _
(NVP 200 mg x 2 Iân/ngảy)
Bênh nhân người lớn HIV dương tinh:
Lopinavir AUC ~ir27
Lopinavir C,… ~lr19
LopinavirCm,n ị46
Mặc dù chưa thiễt lặp đẫy đủ mỏi lỉên quan
lâm sảng cùa phải hiện nảy, khuyến cáo tăng
lỉều iopinavir/ritonavír đến 533f133 mg (4
viên nang) x 2 Iẳnlngảy eùng vởi thúc an khi
dùng kết hợp vởí VIRAMUNE
Lopinaviríritonavir
300/15 ngm² x 2 lần/ngảy
(NVP 7 mg/kg hoặc 4 mgfkg
x ]lần/ngảy x 2 tuần; 2
lầnỉngảyx 1 tuần)
B_ênh nhi
Kết quả nghiên cứu duoc dộng học là
tương đồng vởi kết quả ở người lớn.
Lopinavir AUC ~L22 (i44 đến T9)²
LopinavirC,… le4 (\ir3Ố đến 'i`lõ)a
Lopinavir C…, iss (i75 đến il 8)“
0 trẻ em nên cãn nhăc tãng iíêu
lopinavir/ritonavir đến 300/75 mg/m2 x
2lằn/ngảy uỏng cùng thúc an khi sử dụng kết
hợp với VIRAMUNE, đặc biệt ớ những bệnh
nhân nghi ngờ gỉzim nhạy cám
lopinavír/ritonavir.
Neltỉnavir 750 mg x 3
iần/ngảy
(NVP 200 mg x L lầnfngảy x
14 ngảy; 200 mg x 2 Iânx`ngảy
x 14 ngảy)
Nelfmavir: khỏng có sự thay đổi các thông
sô dược động học liên quan đẽn iâm sảng
sau khi bỏ sung nevirapine.
Tồng nổng độ nclfinavir và chất chuyến
hóa AG1402:
A1 IC tzo (J72 đến T L 28)
c…,,Mz (… đến 1100)
C… ị35 in ct90 đến T316J
Nevirapinẹ: so với kiếm soát trưởc kia,
nông độ gân như không đôi.
Khỏng cẫn điếu chinh iiều khi dùng
VĨRAMUNE kêi. hợp Vởí nelfinavir. Jo
Ritonavir 600 mgx 2
lần/LLgảy
(NVP 200 mg X | lầnf'ngảy x
14 ngảy; 200 mg x 2Iần/ngảy
x 14 ngảy)
Sử dụng kêt hợp khỏng gây thay đỗi nồng
độ ritonavir hoặc nevỉrapine huyết tương
liên quan đến iảm sảng,
Ritonavir AUC<—›
Ritonavir Cmax <—›
Ritonavir Crr1ll1 <—-›
Không cẳn điểu chinh Iiễu khi dùng
VIRAMUNF. kêt họp vởi ritonavir.
Siaquínavir 600 mg x 3
iân/ngảy
Saquinavir AUC i38 100 ngme, vả tỷ số máu cuống rổn/mảu mẹ 1ả 0, 84 + 0,19 (n=—;36 giói hạn
tù 0,37-1,221.
Do độc tính gan thường gặp ở phụ nữ có Số lượng tế bảo CD4+ >250 tế bảo/mm3 và định lượng được
HlV-1 RNA trong huyết tương (2 50 bản sao chépỉmL), nên xem xét những yếu tố nảy khi quyết định
điếu trị (xem '1`hận trong đặc biệt). Chưa có đủ bằng chứng để chửng minh rằng tình trạng khỏng tăng
nguy cơ độc tinh ở phụ nữ đã được điếu trị tru'ởc khi dùng VIRAMUNE có lượng virus khỏng định
lượng được (111V—1 trong huyết tương dưới 50 bản sao chép/mL) và số iượng tế hảo CD4+ > 250 tế
bảo/mm3 cũng ảp dụng cho phụ nữ mang thai.
Tắt cả nghiến cứu ngẫu nhìên chú trọng đến vắn đề nảy đến loại trừ phụ nữ mang thai, vả phụ nữ manẩỄz’"
thai có sô lượng không nhiến trong những nghiến cứu thuân tập cũng như phân tich gộp.
T›é sơ sinh: Ở trẻ sơ sinh uống một liếu 2 mg/kg hỗn dịch nevirapine trong vòng 72 giờ sau khi sinh,
mà nguời mẹ nhiễm HIV- 1 đã đùng một liếư duy nhắt 200 mg trong lúc chuyến dạ, thời gian bán thải
trung bình nhân của nevirapine lả 47 giờ (n= 36). Nồng độ trong huyễt tuong đuợc duy trì trên 100
ng/mL trong tuần đầu sau khi sinh (nghiên cứu PATCG2SO [n= 17] vả HIVNET 006 [n= 191)
Nguời mẹ cho con bú: Nên khuyên nhũng nguời mẹ bị nhiễm HIV- 1 không nên cho con bú đế trảnh
nguy cơ lây nhiễm HIV sau sinh. Kết quả của 2 nghiên cứu duợc động học (nghỉên cứu PACTG 250 và
HIVNET 006) cho thắy VIRAMUNE đi qua rau thai đễ dảng vả được tìm thấy trong sũa mẹ. Trong
nghiên cúu ACI`G 250, mẫu sủa mẹ thu đuợc ở 3 trong sô 10 sản phụ nhiễm HIV- 1 sau khi tlông một
liếu nevirapine đuy nhất 100 mg hoãc 200 mg (trung binh 5,8 giờ trước khi sinh), tỉ lệ trung bình nồng
độ nevirapine trong sữa so với trong huyết tương của người mẹ là 76% (54-104W0).
Kết quả tù nghỉên cúu HỈVNET 006 (n= 20) cho thẳy trung vị tỉ lệ nồng độ trong sũa so với nồng độ
trong huyết tuong nguời mẹ sau khi uỏng liếu duy nhắt 200 mg nevirapine là 60,5 %(25 122%). Phù
lS|ặ
Bãng 1. Nguy cơ phát ban (%) trên các thử nghiệm lâm sảng 2có đối chứng giả được ở người lớn
qua 52 tuần đỉễn trị — Bất kể Iiên quan nhân quả
VIRAMUNE Giả dược
(n=1374) (n=1331)
% %
| Biến cố phải ban ở tẫi cả mức dộ“ 24,0 14,9
1 Ban độ 3 hoặc 44 1,7 0,2
Thử nghiệm 1090: Đìếu n—i cơ bản bao gồm 3TC cho tất cả bệnh nhân vả phối hợp NRTIs với
P1s
' Thử nghiệm 1037, 1038 và lO46aĐiếu trị cơ bản bao gồm ZDV vả ZDV+ddI; VIRAMUNE
đơn trị liệu dược dùng cho một sô bệnh nhân.
% dựa trên ước 1LL'ợng xác suất cùa Kaplan-Mcicr.
Hệ thống chia độ NCI.
Phát ban thường tù nhẹ đến trung binh, cảc hồng ban dạng dảt sẳn, có kèm ngửa hoặc không, khu trú ớ
thân, mặt và cảc chi. Cảo phản úng dị ung (kể cả phản vệ, phù mạch và mảy đay) đã đuợc báo cáo.
Phân lớn phát ban nặng xuất hiện trong vòng 6 tuần điều trị đầu tiên.
Gan-Mât
Các bất thường xét nghiệm hay gặp nhẳt lả tãng các xét nghiệm chức năng gan bao gồm ALAT, ASAT,
GOT, bilirubin toản phần vả phosphatase kìếm. ”i`hường gặp nhắt 1ả tăng CLGT nhưng không có triệu
chứng. Đã ghi nhận cảc trường hợp vảng da. Cảo trường hợp viêm gan, dột: tinh gan nặng vả đe dọa
tính mạng, và viếm gan tối cấp gây tử vong đã được ghi nhận ở bệnh nhân dùng nevirapine trong cảc
thử nghiệm lâm sảng. Trong các thử nghiệm lâm sảng với VIRAMUNE viến phóng thích nhanh, nguy
cơ biến cố gan trên lâm sảng với V1RAMUNE tại thởi điếm một nãm cao gấp khoảng 2 lần so với giả
được. ịĩ
Trong thử nghiệm 1100.1486 (VERxVE) những bệnh nhân chưa được điếu trị đã dùng VIRAMUNE Il
viên phóng thích nhanh trong giai doạn bắt đầu với liều 200 mg x 1 lần/ngảy x 14 ngảy và sau đó ngẫu
nhiên dùng hoặc VIRAMUNE viên phóng thích nhanh 200 mg x 21ần/ngảy hoặc VIRAMUNE viên
phớng thích chậm 400 mg x ] lầnfngảy. Tắt cả bệnh nhân được dùng tenofovir + emtrỉcitabine lảm điều
trị cơ bản. Bệnh nhân được kiềm tra đảm bảo số lượng CD4+ < 250 tế hhưmm3 đối với nữ và < 400 tễ
bảofmm² đối với nam. Dữ liệu về các biến cố gan gây triệu chứng được thu thập Lù~ thử nghiệm nảy. Dữ
liệu an toản bao gồm tẳt cả những lần khảm bệnh nhân cho đến thới đỉếm bệnh nhân cuối cùng được
hoản tất theo đõí để ghi nhặn kết cuộc chinh lúc 48 tuần cùa nghiên cứu (giai đoạn theo dõi trung bình
61 tuần). Tỷ lệ cảc biến cố gan có triệu chửng trong giai đoạn bắt đầu với VIRAMUNE viến phóng
thich nhanh là 0,5%. Sau giai đoạn bắt đầu, tỷ lệ cảc triệu chứng ở gan 1ả 2,8% với nhớm dùng
VIRAMUNE viến phóng thỉch nhanh và 1,6% với nhớm dùng VIRAMƯNE viến phớng thỉch chậm.
Nhin chung tỷ lệ cảc triệu chứng ở gan lả tương đương giữa nam vả nữ tham gia thử nghiệm VERXVE.
Trong nghiên cứu 1 100.1526 (TRANXITION) không thẳy cảc hiến cố gan trên lâm sảng Mức độ 3
hoặc 4 trong cả 2 nhóm.
Tảng nống độ ASAT hoặc ALAT vả/hoặc huyết thanh dương tinh với viêm gan B vảfhoặc C liến quan
đên nguy cơ cao các biên hiện gan cho cả nhớm dùng VIRAMUNE viến phóng thich nhanh và nhóm
17|,…
Rôỉ loan da dảv ruôt
Tiêu chảy, đau bụng, buôn nôn, nôn.
Rối loan gan mât
Viêm gan (kê cả nhiêm độc gan nặng gan nặng và đe dọa tinh mạng), viêm gan tôi câp (có thế gây tử
vong), vảng da.
Rối Ioan da vả mô dưới da _ ,
Phảt ban, hội chứng Stevens-Johnson/hoại tử biêu bì nhiễm độc (có thế gây tử vong), phù mạch, mảy
đay.
Rối loan cơ xương kth'
Đau khớp, đau cơ.
1… \ . ` . ?
ROL loan toan than va tai cho
Sôt, mệt mỏi.
Xét nghỉêm
Bất thường xét nghiệm chức năng gan (được ghi nhận bằng các cụm từ: tăng alanine aminotransferase;
tăng transaminase; tăng aspartate aminotransferase; tăng gamma-glutamyltransferase; tăng men gan;
tăng transaminase trong mảư), giảm phosphorus máu, tăng huyết ảp.
Thông báo cho bác sĩ những tác dụng phụ gặp phải trong thời gỉan dùng thuốc.
Quả Iiều
Chưa có thuốc gỉải độc trong trường hợp quá liếu VIRAMUNE. Đã có bảo cảo các trường hợp quá Iiều
VIRAMUNE viến phớng thích nhanh trong phạm vi từ 800 đến 6000 mg/ngảy cho tới 15 ngảy. Bệnh
nhân bỉếu hiện phù, hồng ban dạng nốt, mệt mòi, sốt, đau đầu, mất ngủ, buồn nôn, thâm nhiễm phổi
phải ban, chóng mặt, nôn, tăng transaminase, sụt cân. Toản bộ triệu chúng thuyên gỉảm sau khi ngưng
VIRAMUNE. cệ
Dươc lưc hoc .
Co chế tác dụng
Nevirapine là một thuốc úc chế men sao chép nguợc không nucleoside (NNRTI) của HIV- 1.
Nevirapine gắn trục tiếp vảo men sao chép ngược và ức chế tảc dụng cua polymerase phụ thuộc RNA
vả polymerase DNA phụ thuộc DNA bằng cách phá vỡ vị trí xúc tác của men. Tác dụng cùa nevirapine
không phải do cạnh tranh với khuôn mẫu (template) hoặc cảc nucleosìde triphosphate. Men sao chép
ngược HIV—2 vậ cảc polymerase DNA eukaryotic (như DNA— polymerase OL, 13, y hoặc 8 ở người)
không bị ức chế bởi nevỉrapine.
Thủ nghiệm lâm sảng
Trong cảc nghiến cứu lâm sảng, VIRAMUNE có liên quan đến sự gia tăng HDL— cholesterol và cải
thiện nói chung về tỉ lệ giũa HDL- cholesterol vả cholesterol toản phần, mà trong dân số chung có thể
xem là liên quan đến tỉ lệ thấp nguy cơ tim mạch. Tuy nhiên, do chưa có những nghiên cứu cụ thế về
VIRAMUNE trong vỉệc thay đổi nguy cơ tim mạch trên bệnh nhân nhiễm HIV, ảnh hướng lâm sảng
cùa những phảt hiện nảy chưa rõ Việc lụa chọn các thuốc kháng retrovirus chủ yếu dựa trên hỉệu quả
khảng virus cùa thuốc.
19|1ffl1__;
phát, đảp ứng 1 phần) hoặc do một tảo dụng ngoại ý hoặc tãng thoảng qua nồng độ virus trong thời gian
nghiên cứu. Phân tich những mẫu cùa các bệnh nhân dùng VIRAMUNE viên phóng thich nhanh 2
1ần/ngảy hoặc VIRAMUNE viên phóng thích chậm x 1 lần/ngảy kết hợp với tenofovir vả emtricitabine
cho thấy phân lập từ 50 bệnh nhân có đột biến kháng thuốc như dự kìền ở những bệnh nhân điếu trị
bằng nevirapine. Trong số 50 bệnh nhân, 28 bệnh nhân để khảng efavirenz và 39 bệnh nhân để khảng
etravirine (thường gặp nhẩt là đột bỉến khảng thuốc tại Y181C).
Không có sự khác biệt về dạng bảo chế đã sử dụng (viên phóng thich nhanh 2 lần/ngảy hoặc viên
phóng thích chậm L Iần/ngảy).
Đột biến khi thắt bại là những loại đã dự kiến ở những bệnh nhân điều trị bằng phác đồ có nevirapine.
Đã quan sảt thấy hai thay thế mới trên codon trước kia do kháng nevirapine: một bệnh nhân với Y1811
trong nhóm dùng VIRAMUNE viên phóng thich chậm và một bệnh nhân với Yi 88N_trong nhóm dùng
VIRAMUNE viên phóng thích nhanh; kháng nevirapine đã được khăng định băng kiêu hình.
Dế kháng trong 1rường họp dựphòng lây từ mẹ sang con:
Đột biến kháng nevirapine được phảt hiện trong vòng 6-8 tuần sau khi điếu trị liều duy nhắt ở 21 trên
1 I 1 (19%) phụ nữ tham gia nghiên cứu HIVNET 012. K103N là đột biến thường gặp nhất vởi
nevirapỉne (57%) trên những bệnh nhân nảy, kế tiếp là một hỗn hợp đột biến KIO3N vả Y181C (190/o).
Đột biến kháng nevirapine không được phảt hiện trên bất cứ phụ nữ nảo (n=l 1) có đột biến tại thời
điếm 6-8 tuần, và tải xét nghiệm tại 12-24 tháng sau khi sình. 1 1 trong số 24 (46%) trẻ em nhiễm HIV
tham gia thử nghiệm HIVNET 012 cho thấy kháng nevirapine, trong đó đột biến thuòng gặp nhắt lả
Y181C. Đột biến khảng nevirapine không được phảt hiện thấy trên bắt cứ đúa trẻ nảo (n= 7) mã đã
được phảt hiện đột biến ở 6- 8 tuần tuổi vả đuợc tái xét nghiệm lúc 12 thảng tuồi.
Trong một nghiên cứu trên những phụ nữ đã uống một liếu duy nhắt VIRAMUNE viên phóng thích
nhanh để phòng lây nhiễm từ mẹ sang con, và được đỉều trị bằng VIRAMUNE viến phóng thích nhanh
kết hợp với cảc thuốc khảng retrovirus khác cho bệnh của chính họ, 29/123, hoặc 24 % bị thất bại về
mặt virus học, vả 5/13 phụ nữ (38%) nhiễm H1V-l được xác định đề kháng với VIRAMUNE iủc bắt
đầu nghiên cứu bị thất bại về mặt virus học.
Trong một nghiên cứu ở những đứa trẻ có mẹ nhiễm HIV đã được dùng hoặc giả dược hoặc nevirapine
liếu duy nhất, 30 trẻ nhiễm HIV, 15 trẻ dùng giả dược và 15 trẻ dùng nevirapine, sau đó được điếu trị
nevirapine kết hợp với nhũ ng thuốc kháng retrovirus khảo. Sự thất bại về mặt virus học sau 6 tháng
điều trị nevirapine kết họp với cảc thuốc khảng retrovirus khảo xuất hiện nhiếu hơn đảng kể ở những
đứa trẻ đã dùng liều duy nhất nevirapine trước đó (10 trong số 15) so với những đứa trẻ dùng giả dược
trước đó (1 trong số 15).
Sự kết hợp cảc thuốc kháng retrovirus với một liều duy nhất nevirapine Iảm giảm bói sự xuất hiện đề
khảng nevirapine.
Đề kháng chéo: Đã thấy sự xuất hiện nhanh chóng của cảc chủng HIV đề kháng chéo vởi các thuốc ức
chế men sao chép ngược không nucleoside (NNRTI) trên in vitro. Dữ 1iệu đế khảng chéo giữa NNRTI
nevỉrapine vả cảc thuốc ức chế RT nhóm nucleoside còn rất hạn chế. Trên 4 bệnh nhân, cảc phân lập đề
kháng ZDV ín vitro vẫn thế hiện sự nhạy cảm với nevirapine và trên 6 bệnh nhân, cảc phân lập để
21|
nevirapinc 200 mg x 2 lẩn/ngảy tiếp nối bới một liếu duy nhất 50 mg 14C- -nevirapine, khoảng 91,4 i
10, 5% liếu đảnh dấu phóng xạ đuợc tim thắy trong nuớc tiều thế hiện con đuờng thải trù chính là qua
nuớc tiếu (81,3 i 11,1%)so vói qua phân (10,1 i 1,5%) Trên 80% chắt đảnh dấu phóng xạ trong nuớc
tiếu duới đạng 1iến hợp giucuronic của cảc chất chuyển hóa hydroxyl hóa. Như vậy chuyển hớa qua
cytochrome P450,1iên hợp glucuronic vả thải trù các chất chuyến hóa glucuronic qua nuớc tiếu lả con
đuờng chuyến dạng sinh học vả thải trù chính của ncvirapine trong cơ thể người. Chỉ một phần nhỏ
(<5%) của chất đảnh dấu phóng xạ trong nuớc tiếu (tương ưng vởi < 3% tổng liếu) ớ duởi dạng hợp
chất ban đầu; do đó, thải trù qua thận it có vai trò trong quá trinh thải trừ họp chất ban đầu.
Nevirapine có khả năng gây cảm úng hệ mcn chuyến hỏa qua cytochrome P450 ở gan. Duợc động học
cùa quá trinh tụ cảm úng được đặc trưng bới sự tăng khoảng 1 _,5 đến 2 lần hệ số thanh thải biếu kỉến
cùa nevirapine dùng đường uống khi diếu trị 1iến tục tù liếti duy nhất chuyến sang liếu 200- 400
mgxngảy trong 2 đến 4 tuần Sự tự cảm ủng cung gây gìảm tương úng thời gian bản thải pha cuối của
nevirapine trong huyết tuơng tù khoảng 45 giờ (liếu duy nhất) xuông khoảng 25— 30 giờ sau khi dùng đa
liều 200- -400mg/ngảy
Giới tỉnh: Trong nghiến cứu đa quốc gia 2NN, một nghiến cứu phụ về dược động học tìến hảnh trên
1077 người trong đó có 391 phụ nữ. Bệnh nhãn nữ có độ thanh thái nevirapine thắp hơn 13,8% so với
bệnh nhân nam Sự khảo biệt nảy không có ý nghĩa trên lâm sảng.
Do thể trọng và chỉ số khối cúa cơ thế( (BMI) khõng ảng hưởng tới độ thanh thải của nevirapinc, sự
khảc biệt về giói tinh nảy không thế giải thích bằng kích thuớc cơ thế.
Duợc động học của nevirapine trên nguời lớn nhiễm 111V-1 duờng như không thay đối theo lứa Luối
(khoảng tù 18- 68 tuồỉ) h0ặc theo chùng tộc (Da đen, gốc Tây Ban Nha hoặc Da trắng) "Ihỏng tin nảy
thu duọc từ một đảnh giả dù Iiệu tồng thể qua nhiếu nghiến cúu lâm sảng
Suy lhận. Dược động học của VIRAMUNE víến phớng thích nhanh liều duy nhẩt đuợc so sánh giữa 23
cả thể suy thận nhẹ (50 S C1 cr S 80 mprhút), suy thận trung bình (30 < CLcr < 50 mL/phủt), suy thận
nặng (CLcr < 30 mL/phút), suy thận giai đoạn cuôi cần lọc thận, vả 8 cả thế có chức năng thận bình
thuòng (CLcr > 80 mL/phút) Suy thận (nhẹ, trung binh vả nặng) không Iảm thay đồi đảng kế duợc ếẽg
động học cúa niverapine.
Tuy nhiên, nhũng bệnh nhân suy thận gìai đoạn cuối cần lọc thận thế hiện sự suy giảm 43, 5% AUC cùa
VIRAMUNE sau một tuần điều trị. Đồng thời cũng có sụ tích lũy chắt chuyến hoả dạng hydoxyl hóa
cua nevirapine trong huyết tuong Cảc kết quả trên gợi ý rầng nếu dùng thếm 200 mg VIRAMUNEviên
phóng thích nhanh sau môi lần lọc thận có thể giúp bù lại ảnh hướng cua lọc thận lên sự thanh thải
nevirapine. Mặt khác, cảc bệnh nhân có CLcr 2 20 mL/phủt khỏng cần diếu chinh iiều VLRALvLUNE.
Suy gan: Một nghiên cứu trong tình trạng ồn định để so sảnh 46 bệnh nhân với
Nhẹ (n=17; điếm lshak 1-2),
Trung bình (n=20; điếm Ishak 3-4),
Iioặc nặng (n=9; điêm lshak 5-6, Chi1d-Pugh A ở 8 bệnh nhân, 1 bệnh nhân không xảo định được
Child-Pugh)
Đảnh giá tình trạng xơ hớa gan để đo lường mức độ suy gan được tiến hảnh.
LÌ/tln
I
23|1`1gư
6 tháng sau khi mở chai thuốc
›:
Đóng gOL
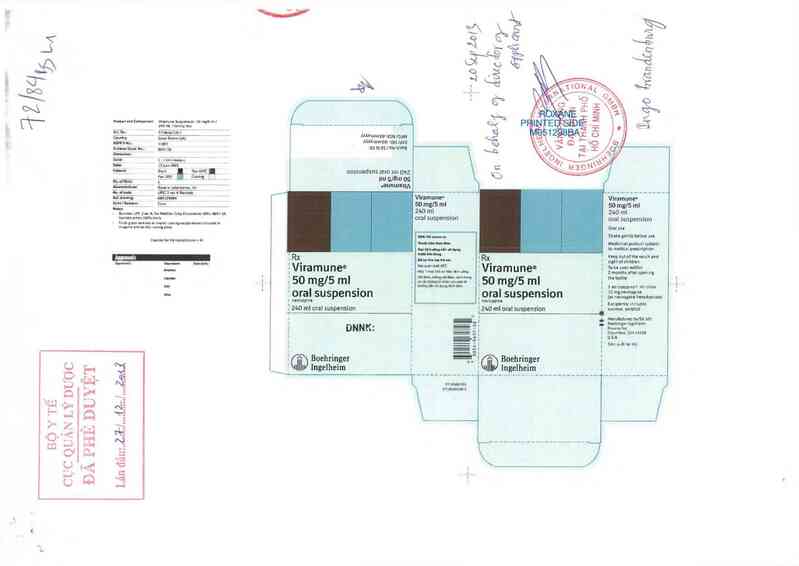
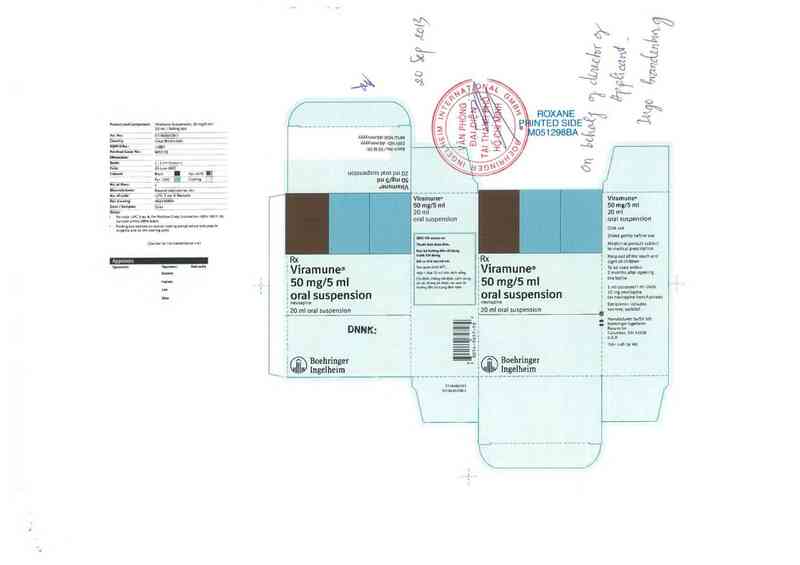
Hộp 1 chai 20 mL.
Hộp 1 chai 240 mL.
Sãn xuất bởi
Boehringer ingelheỉm Roxan Inc
Co1umbus, Ohio 43228 - USA
Thuốc bán theo đơn.
Đọc kỹ hướng dẫn sử dụng trước khi dùng
Liên hệ với bác sĩ hoặc dược sĩ nếu cần thêm thông tin.
Đê thuốc xa tầm tay trẻ em.
Director ofapplicant ( TẨư…o MÁí Ổf/Wjẽn— CCLa’ỹfaín ẮĨC/éắhjtltj ÝfẮỷ b/j
OẦ ỚỮE LLClỄ_ ếầ
PHÓ cuc TRUỞNG )
JVffln 7% M
\ẹQ
' 'v \ `… _
Ủĩzỷ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng