











/
HMĐIJ’f/m/JL
IIIIIIIIL
ilii ]
m..….ăamownn
…o.:ấnụ Eng
… ẵẵ ẦmẵEb.>
…
m _ _
4 _
m
a M WA _ _
...... 1 30 _
m.Ễỉỉiắllnỡăẵẵầ 8x… .— i i i i
……ủHỦhWM—nmưẵ3il .:Ềw !: u.! Ê: E If: .! 1 !.. `
. Bon ỗễẽẵ am: u.v n..ỗ !.ỉa x: Ễ:É _
oai . , . o …oo 13
ao
s @ Ếủửễntgảảẵ <.ẵm:m` I
…… ? .Ềẵẵzì ẵỄaaaẵẳnủỏ ỄỄỄỄB
ma. ĩaễưH... .t. Ở 91 Bẵu:Êễớl. z.ẵọỄẫẳ 85 :nì nnỉm:ỉm
_ n…ẫu…ẵẵ ỉ Ễ… ẳ. .ỄỄ _ . + .
ẵẵiẳ .ẹ _... ỂỂsgẵt _ơẵẵẻ
9838…. #ưẵẵsnpuvoẵỉatụoprẻ Ê›mx.Ễ. ẫ…xằẵ :a._ …Đ.Ễỉẵ
Buẫầ! w.Ỉ ..ắn 303. 828! _
5..ẵỉẽễỈhsễẳỉũẻolniỉ
RẮEẾIĐĨIẺI:IÉ …
.!i C T V… i i :BỂỂỄẺSEỄỄỄỉS i . …Ẩ i i
Ơ. ( u .. H . :
U Ê %… ẵ o.…z
D w... J… .. , ,ả.
Ế . L … Ế.: z> _ .
T Y . _ ,
Y L D … ,
…… Ê _tư
A0. i Ồ…
E L H _ _/
C ~A d ,_
U. .… ,
. C Đ i.… _/
_ ii A f
0lĨ
ẵzì ĩ m! .:: E.…
Zễổùỉi. …mẫlzẵ nỉẫ
un ỰìJDỊLƯÌỚJ
SLTSLO.LAO
[iti'il QZI1 >< 89AÙ
ãunuựd tuiodieetg
l WV 03²01 ELISL/S
_\fiẵỸđfflĩỤ 774/82_ li
i”²i ĐAiiJiặii i \iìiịl\
Q\\Ịúứ Ầ`I/ĩ_llịlli
\ĨJ TAI HÀ NỘI /
acusmo l i—
ệ MSD \ỉfỪj Ễ/
. D |
Victrells® 200 mg Ả
hard capsules
boceprevir
Manufactured by:
Schering-Plough (Singapore) Pte Ltd.,
Singapore
Packed by: Schering-Plough Labo N.V., Belgium
đ \
\ !
Ô MSD
D 0 GĐ \ | J
Victrelis … mg » .
hard capsules ' ' `
boceprevir
Manufactured by:
Schering-Plough (Singapore) Pte Ltd.,
Singapore
Packed by: Schering-Pl0ugh Labo N.V., Belgium
ệmso
I I ®
Vlctrells ửì
hard capsules
boceprevư
Manufactured by:
Schering-Plough (Singapore) Pte Ltd.,
Singapore
Packed by: Schering-Plough Labo N.V., Belgium
DVT075173
l/4/2013
Mỗi viên nang cứng chứa 200 mg boceprevir
Tả dược
Thảnh phần vỉên nang: Sodium lauryl sulfate, Microcrystalline cellulose, Lactose monohydrate,
Croscanneliose sodium, Pre—gelatinìzed starch, Magnesium stearatc
DẠNG BÀO CHẾ
Viên nang cứng
Mỗi viên nang có nắp mảu nâu vảng, mờ đục có in logo “MSD” đỏ vả trắng nhạt, thân viên nang
mờ đục có in số mã “314” mảu đỏ.
ĐẶC TỈNH LÂM SÀNG
CHỈ ĐỊNH ĐIỀU TRỊ ;A’LL/
Victrelis được chỉ định điều trị vìêm gan siêu vi C mản tính kiều gen !, phối hợp với peginterferon
alfa vả ribavirin ở bệnh nhân người iớn (18 tuối trở iên) bị bệnh gan còn bù chưa được điếu trị hoặc
đã thẳt bại với trị liệu trước dỏ.
LIÉU LƯỢNG VÀ CÁCH DÙNG
Victrelis phải đuợc điểu trị kết hợp với peginterferon aifa vả ribavirin. Tham khảo thông tin chuyên
khoa về peginterferon alfa vả ribavirin trước khi bắt đầu điều trị vởi Victrelis.
Liều iươna
Liễu khuyến cáo cho Victrelis lả 800 mg, uống ba lần mỗi ngảy cùng với thức ăn (bữa ãn chính
hoặc ăn nhẹ).
Bênh nhân không bi xơ ilan chưa đươc điều Iri
- Khởi đẩu điều trị bằng peginterferon alfa vả rỉbavirin trong 4 tuần (Tuần điều trị thứ ] dến
thứ 4).Bồ sung Victrelis 800 mg đường uống ba lần một ngảy cùng với peginterferon alfa vả
ribavirin ở tuần điều trị thứ 5. Dựa trên kết quả axit rỉbonuclcìc vi rủt viêm gan c (HCV—RNA)
cùa từng bệnh nhân ở tuần điều trị thứ 8 và thứ 24, sử dụng Hướng Dẫn Đảp Ứng Đìều Trị dế
xảc định khoảng thời gian điều trị (xem Bảng 1).
MKJOS4—VNM—Iũl3-OOWG 11412013
Rej. LRN:5OJOJLBCV—CP—CCDS IU Feb 2013
2. Dùng peginterfan alfa vè
ribavirin dển tuần diều ưi thứ 48.
Kễi quá bẩt kỳ Có ihể phát hiện Ngừng phác đò điêu tri bộ 3.
’ Đáp ứng ] phẫn trước dây — Nhũng bệnh nhân có sự suy giâm HCV-RNA ; 2~IOgio ở tuấn
diều trị thứ 12 nhưng khớng đạt được đáp ửng siêu vi lâu dùi (SVR); Tái phát - Những bệnh
nhân không mẻ phớt mẹ… được HCV-RNA ở cuối giai đoạn diều tri trước đó vởi HCV-RNA có
thế phát hiện dược trong mẻu sau dó.
"”Trong cảc thử nghiệm lâm sùng. HCV-RNA trong huyết tương đuợc do bằng phương pháp
đinh lượng Rochc COBAS Taqman 2.0 vởi nguững phát hiện 9.3 IUlml.
bê ' “n … i @ i
Những bệnh nhân đưọc điều trí với pcgỉntcrfcron nlfa vù ribavirin trưởc dó có mức gìám HCV-
RNA n hơn 2-l0gio ờ iuần dièu trị um 12 (đối tượng khỏng dảp ứng) … đưọo diều trị 4 tuần vởi
peginterferon alfa vả rỉbavỉrin, sau dó 44 tuấn điều trị kết hợp VICTRELIS 800 mg uỏng 3
iấn/ngảy cùng với pcgintcrferon alfa vả ribavirin. Khuyến cáo ngưng sử dụng liệu pháp kết hợp
VICTRELIS— pcgỉnlcrfcmn alfa vả ribavirin ở những bệnh nhân phát hiện dược HCV-RNA ở tuấn
điều trị thứ 12. ẨM.
Bệnh nhản xơ gan
Những bệnh nhân xơ gan còn bù nén diều tri 4 mần với peginterferon alfa vè ribavirin. sau đó 44
tuần diều trị bằng v1cnusus wo mg uổng 3 lấnlngây phói hợp với pcgimcrfcron alfa va
ribavirin. Khuyển cáo ngừng diều trị ở những bệnh nhân chưa duợc diều tri ưuớc đây có HCV-
RNA phát hiện dược ở iuồn diều trị thứ 24 vả nhửng bẹnh nhân điều ưi ihái bại với HCV—RNA
phả! hiện đưọo ở tuần diẻu uị thử l2.
cm dùng
Uống thuốc vảo bữa an.
Trường họp uống lhiếu Ii'ểu
Néu bệnh nhân uỏng thiếu iièu nhưng cảch iièu ké iiẻp dưới 2 giờ un nên bỏ qua liều thỉếu.
Nếu bệnh nhãn uống thiếu liễu nhưng cách liều kế tiếp trên 2 giờ. bệnh nhãn phải uống bổ sung
liều thiểu cùng với thức an. sau dó trở vè lidl uống thuốc bình thường.
Điếu chinh Iiểu
Không khuyến cáo giám Iiều Victrelis.
Nén bệnh nhân gặp phản ửng bải lợi nghiêm trọng có iiẻn quan déu peginterferon alfa vivhoạc
ribavirin. cần phái giám lỉều pcgintcrfcron alfa vâ/hoặc ribavirin. Xin tham khảo tâi iiệu hưởng dẫn
MK3034—VNM-2013-006076 l/4/2013
Ref. LRN:503034-8CV—CP-CCDS 10 Feb 2013
CHỐNG CHỈ ĐỊNH
Chống chỉ định dùng Victrclis phối hợp với peginterferon alfa vả ribavirin trong cảc trường hợp:
0 Bệnh nhân trước đây đã phải. hiện quá mẫn dáng kể về mặt lâm sảng với hoạt chẳt hoặc bất
cứ thảnh phần nảo của thuốc.
0 Bệnh nhân bị viêm gan tự miễn
« Bệnh nhân gan mất bù cỏ điềm Chigh-Pugh > 6 ( phân loại B vả C ) (Xem Liều lượng vả
cách sử dụng, Đặc tính duợc động học).
› Dùng phối hợp với những loại thuốc phụ thuộc chặt chẽ vảo hệ CYP3A4IS trong việc thanh
thải, vả lảm gia tăng nồng dộ trong huyễt tương có liên quan tới việc lảm trầm trọng vảlhoặc
nguy hiềm tói tính mạng bệnh nhân, như cảc thuốc sử dụng đưòng uống midazolam,
amiodarone, astemizole, bepridil, propafenone, quinidine, sìmvastatin, lovastatin và những
dẫn xuất nấm cựa gả (dihydroergotamine, ergonovine, ergotamine, methylergonovine) (xem
Tuong tảc với cảc thuốc khảo vả các dạng tuơng tác khác). Ịlxụl/
ơ Phụ nữ mang thai (xem Thai kỳ)
Tham khảo Thông tin sản phẩm của peginterferon alfa vả ribavirin để có thêm thông tin
CẢNH BÁO ĐẶC BIẸT VÀ THẬN TRỌNG KHI DÙNG
Thiểu máu
Đã có báo cảo về triệu chứng thiếu mảu khi điều trị với pcgintcrfcron alfa vả ribavirin. Việc dùng
phối hợp VlCTRELIS vởi pcginterferon alfa vả ribavirin thường đi kèm với sự giảm thêm nổng dộ
haemoglobin huyết thanh. Phải kiếm tra công thức máu toản phần vảo các thời điếm: trước khi điều
trị, vảo tuần điều trị thứ 4 vả tuần điều trị thứ 8, vả sau đó tìểp tục với bệnh cảnh lâm sảng. Nếu
haemoglobin huyết thanh < 10 g/dl, có thế cần gìảm liễu hoặc gián đoạn đìễu trị rìbavirin vả/hoặc
dùng erythropoietin (epoetin alfa) (Xem Tảc dụng không mong muốn và Đặc tính dược lực học).
Trong một thử nghiệm tiền cứu ngẫu nhiên có kỉềm soát, tỉ lệ dạt SVR vả dung nạp chung có thế so
sảnh với sự giảm liều ribavirin hoặc khi dùng erythropoietin (xem các nghiên cứu lâm sảng)
Tham khảo thông tin sản phẳm ribavirin đế có thêm thông tin về việc giảm liễu vảÍhoặc ngung
hoặc gián đoạn điều trị ribavirin.
Giảm bach cầu trung tính
Trong cảc thử nghiệm lâm sảng Giai doạn 2 và 3, bảy phần trăm bệnh nhân được dùng
VICTRELIS phối hợp vởi peginterferon alfa-2b vả ribavirin có số lượng bạch cầu trung tính giảm
dưới 0,5 x 109ÍL so Vởi 4% bệnh nhân dược dùng peginterferon alfa—Zb vả rỉbavỉrin. Ba bệnh nhân
có biếu hiện nhiễm khuẩn nặng hoặc đe dọa tinh mạng do giảm bạch cằn trung tỉnh, vả hai bệnh
nhân có giảm bạch cầu trung tính đe dọa tinh mạng khi điều trị VICTRELIS phối họp vởi
peginterferon aifa-2b vả ribavirin. Cần phải kiềm tra công thức máu toân phần ở tất cả cảc bệnh
5
MK3034-VNM—2013-006076
Ref LRN:5OJDJ4-BCV—CP—CCDS 10 Feb 2013
ll4/2013
trong huyết tương có liên quan tới việc lảm trầm trọng válhoặc nguy hiểm tới tinh mạng bệnh nhân.
như các thuốc sủ dụng dường uống: midazolam. amiodaronc, asicmizole. bepridil, pimozide,
pmpat'enone. quinidinc. simvastatin, Iovastatin. vai những dẫn xuất nấm cựa gả (dihydroorgoiamine.
crgonovinc. crgotaminc, mcthylcrgonovine) (xem Chống chi đinh).
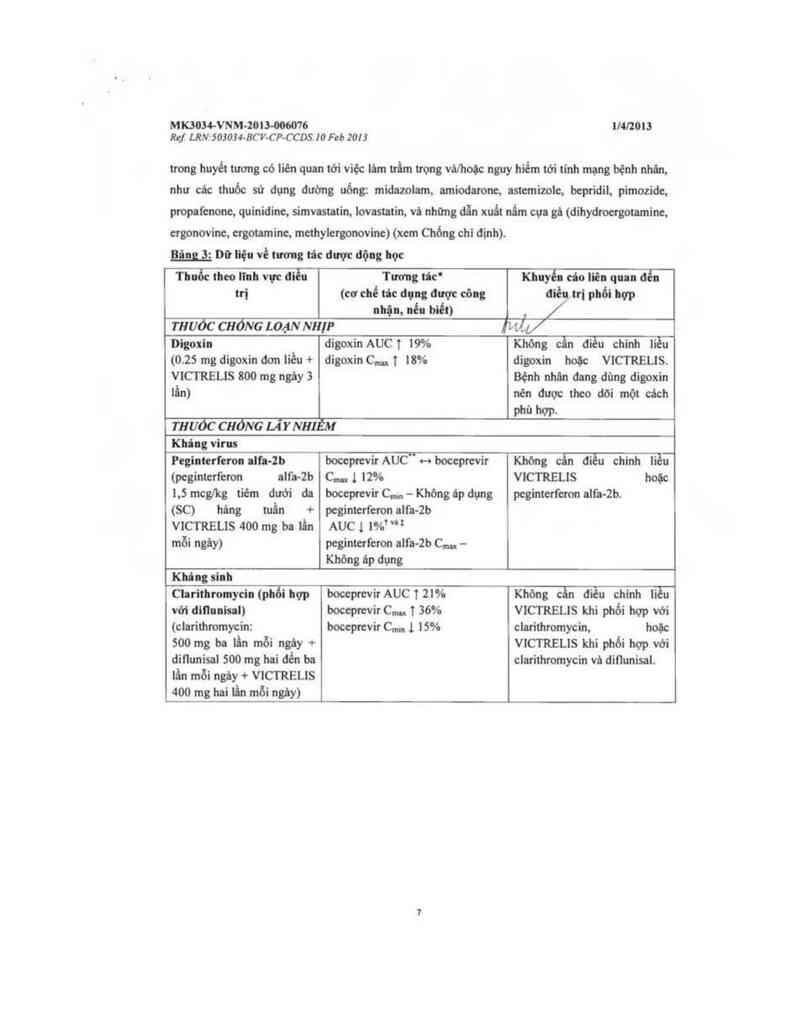
… Dữ Itệu về tương tác dược dộng học
Thuốc i… lĩnh vực aièn Tương tảc° Klilyễl cớo liên q… «&
trị (cơ chế tíc dụng dược eỏng diều trị phối bợp
nhận, uếu bìết) ,
muóc CHỐNG LOẠNNHIP iiLỵ/
Digoxin digoxin AUC T 19% Khỏng cẫn điều chinh liều
(0.25 mg digoxin đơn liều + digoxin C… t 18% digoxin hoặc VICTRELIS.
VICTRELIS 800 mg ngây 3 Bệnh nhân đang đùng digoxin
lấn) nèn dược theo dõi một cách
phù hợp.
muỏc cuỏzvc u” y NHI M
Khing virus
Peginterl'eron alh-Zb boceprevir AUC" Hboceprevir Không cấn diều chinh liều
(pcginterferon alfa-2b CIm 1 12% VICTRELIS hoặc
i.5 mcg/kg tiêm dưới da boceprevir C… - Khỏng áp dụng peginterferon alfa-2b.
(SC) hân; mẩn + pcgintcrferon alt'a-2b
VICTRELIS 400 mg ba lẩn
mỗi ngây)
AUC 1 m’ "*
peginterferon alfa-2b C… —
Không áp dụng
Khủng sinh
Chrithromycin ipũi Ilợp boceprevir AUC t 2… Khỏng cần diều chinh ii u
với dillunisal) boceprevir C… 136% VICTRELIS khi phối hqp với
(clarithmmycin: boceprevir Cmm 1 15% clarithromycin. hoặc
500 mg ba lẩn mỗi ngảy + wcmsus khi phối hợp với
ditìunisal 500 mg hai dén ba clarỉthromycin vả diílunisal.
lần mỗi ngây + VICTRELIS
400 mg hai iin mỗi ngây)
MKJOJ4-VNM-ZIIIJ-GWS l/ỒIZOIJ
ch LRNI5OJOJl-BCV~CP-CCDS m Fcb 2013
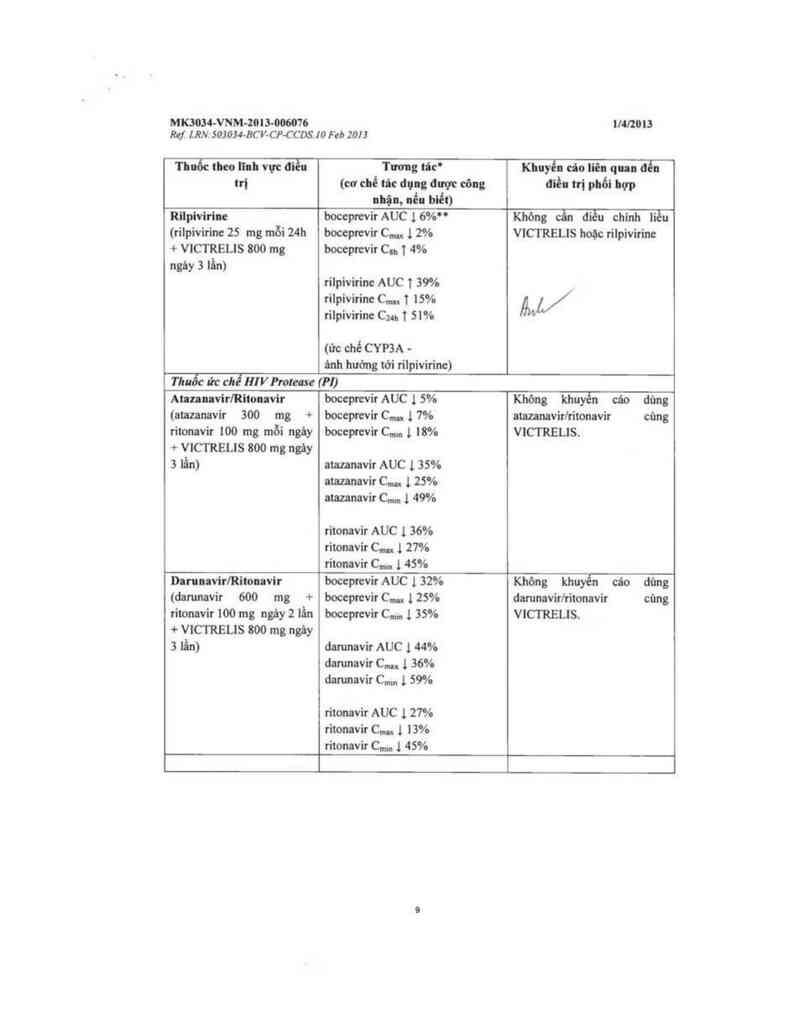
Thuốc theo Illh vực dlền Twug tớc’ Khuyển củo Iiên qua đễn
m (cơ chẻ … dụng am eòug điều trị phổi hợp
lllậl, nếu biết)
Rilpivirine bocepưevir AUC ], 6%" Khòng cẩn điều chinh liều
(rílpivirinc 25 mg mỗi 24h boceprevir C… 1 2% VICTRELIS hoặc rilpivirine
+ VICTRELIS 800 mg boceprevir Cu. 1 4%
ngùy 3 lấn)
rilpivirine AUC T 39%
rilpivirine C.… 1 15%
rilpivirine C… T 51% W
(ức chế CYP3A -
ùnh huởng tới rilpivirine)
17mỗc ủc chế mv pm…e m;
AhunvirlRitonvit bocepưvỉr AUC 1 5% Không khuyến cáo dùng
(atazanavir 300 mg + boceprevir C… 1 7% atazanavirlritonavir cùng
ritonavir 100 mg mỗi ngảy boceptcvir C,… 1 l8% VICTRELIS.
+ VICTRELIS 800 mg ngây
3 lằn) atazanavir AUC 1 35%
amunavir C..., 1 25%
atazanavir C… 1 49%
ritonavir AUC ], 36%
ritonavir C… 1 27%
ritonavir C… 1 45%
DanuavirlRitouvir boceprevir AUC 1 32% Không khuyến cáo dùng
(danmavir 600 mg + boceprevir C… 1 25% darunavirlritonavir cùng
ritonavir 100 mg ngảy 2 lẩn boceprevir C… 1 35% VICTRELIS.
+ VICTRELIS 800 mg ngảy
3 lẩn) darunavir AUC 1 «%
darunavir C,… 1 36%
danmavir Cmm 1 59%
ritonavir AUC 1 27%
titonavir C… 1 13%
ritonavir C… 1 45%
MKJOJI-VNM-ZOIJMỞ ll4IZOIJ
Rtf LRN:SOJOJJ-BCV~CP-CCDS lo Fcb 2013
Thuốc theo lỉnh vục diều Tương tic' Khuyễn cảo lih qua dễn
trị (cơ ciié … dụng um cõng aièu m phối iiợp
lliậil. nếu biết)
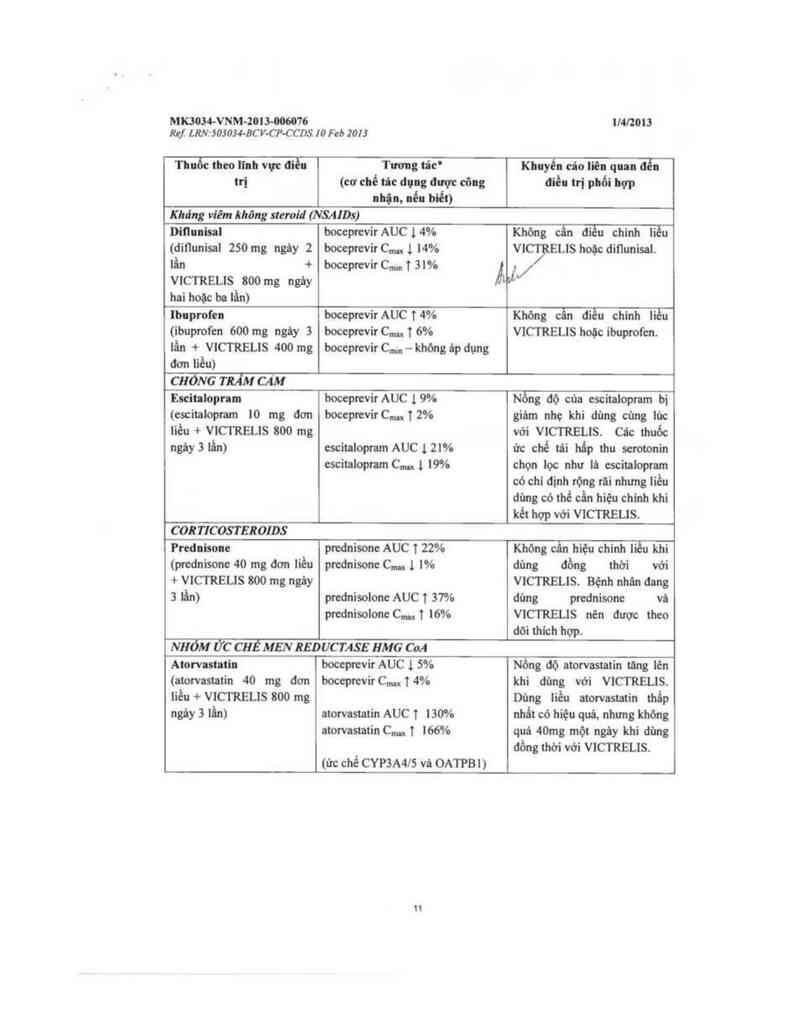
Kliảng víêm khõng sltroid (NSAIDs)
Di!luisal bocepưvir AUC l 4% Khỏng cẩn dièu chinh liều
(dit1unỉsni 250 mg ngây 2 boceprevir CIm 1 14% VICỹELIS hoặc ditiunisal.
lần + boceprevirC…ĩ3l% ẢiuỈ/
VICTRELIS 800 mg ngảy
hai hoặc ba lần)
Ibnproíen boceprevir AUC 1 4% Khòng cần điều chinh liều
(ibuprofen 600 mg ngảy 3 boceprevir CIm T 6% VICTRELIS hoặc ibuprofen.
lẩn + wcnuaus 400 mg
đơn liều)
boceprevir Cmlll — khỏng áp dụng
CHONG TRẮM CẢM
Eưitalopnm boceprevirAUC 19% Nồng dộ cùa escitalopnm bị
(escitaiopram 10 mg đơn boceprevir C… T 2% giảm nhẹ khi dùng cùng lúc
iièu + wcnuaus 800 mg với wcnuaus. ca thuốc
ngảy3 lẩn) cscitnlopram AUC 1 21% ức chế tái hấp thu serotonin
cscitalopram CIm 1 I9%
chọn lọc như lá escitalopram
có chi dinh rộng rãi nhưng iièu
dùng có thể cần hiệu chinh khi
kéi hợp với VICTRELIS.
COR TICOSTEROIDS
Prednisone prodnisone AUC T 22% Không cẩn hiệu chinh liều khi
(prednisone 40 mg … liều prednison: c,… 1 1% dùng đồng thời với
+ VICTRELIS 800 mg ngáy VICTRELIS. Bệnh nhân đang
3 lấn) prednisolone AUC 1 37% dùng prednisone vả
prednisolone CIm 1 16%
v1cmaus nen dược theo
dớithich hợp.
NHÓM ức cut MEN REDUCTASE HMG cu
Atorvastatin
(atorvastatin 40 mg don
liều + VICTREUS 800 mg
ngây 3 lấn)
boccpmir AUC l 5%
boceprevir C… T 4%
atorvastatin AUC T 130%
atorvastatin C… 1 166%
(ửc chế cvmmrs vả OATPB n
Nồng dộ atorvastatin tãng iên
khi dùng Vởi VlCTRELIS.
Dùng liều atorvastatin thấp
nhất có hiệu quả, nhưng không
quá 40mg một ngảy khi dùng
dồng thới với wcmeus.
MKJOJ4-VNM—ZMJ—Nõũư I/412013
Re/ LRN. sotou-scwcr-ccos 10 Feb 2013
Thuốc theo Iloh vực điều Tương tủe’ Khuyến của liên qua dển
trị (cơ ehễ … dong «… eõog aièu trị puti hợp
nhận, nếu hiết)
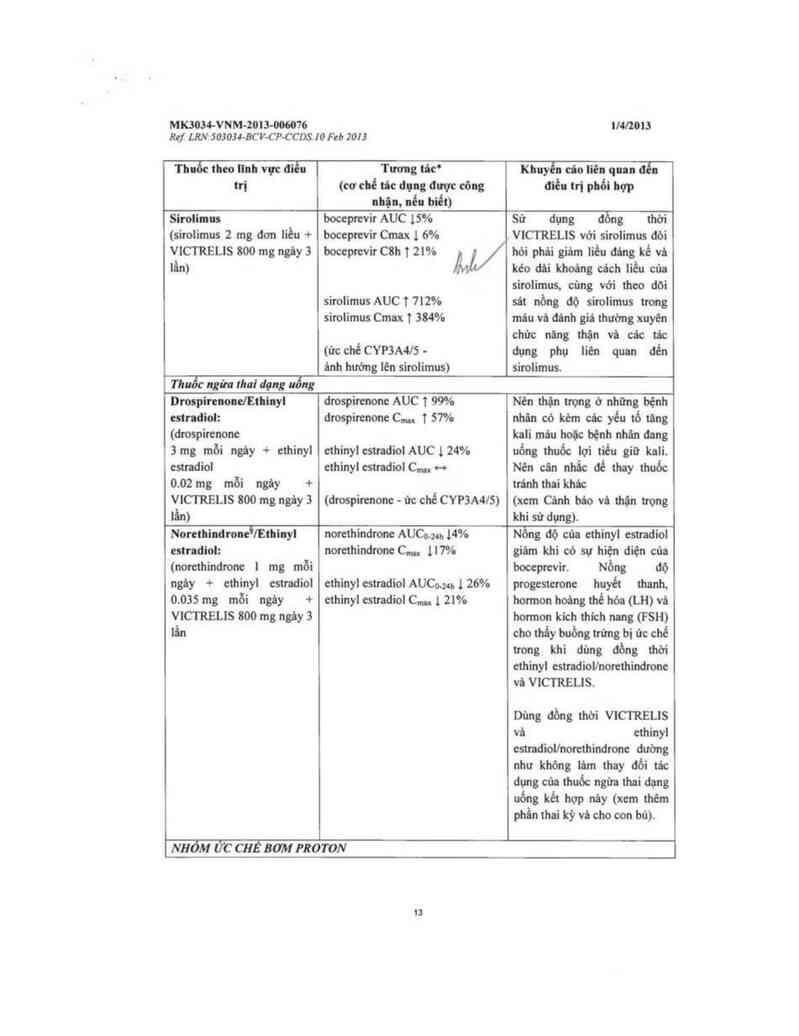
Sirolinu boceprevir AUC 15% Sử dụng dồng thời
(sirolimus 2 mg dơn liều + boceprevir Cmax 1 6% VICTRELIS với sirolimus dòi
v1cmzus 800 mg ngây 3 boceprevir cau t 2… hòi phâi gỉảm iièu đáng kể vá
iân) kéo dâi khoảng cách Iiều của
sirolimus. cùng với theo dõi
sirolimus AUC t mv. sát nồng dộ sirolimus trong
sirolimus Cmax T 384% miu vã dùnh giả thướng xuyên
chừc năng thặn vả các tác
(ừc chế CYP3A4I5 . dụng phụ liên quan dến
ảnh hướng lén sirolimus) simlimus.
Thuốc ngầm tha! dạng uống
DrospirenonelEthinyl dmspirenone AUC T 99% Nên thặn trọng ớ những bệnh
estndiol: drospircnone C… T 57% nhãn có kèm các yếu tố tủng
(drospirenone keli máu hoặc bệnh nhân dang
3 mg mõi ngảy + ethinyl
estmdiol
0.02 mg mỗi ngảy +
ethinyl estmdiol AUC }, 24%
ethinyl estradiol C… -o
uống thuốc lợi tiều siũ kaii.
Nén cân nhất: để thay thuốc
tránh thai khất
VICTRELIS 800 mg ngây 3 (drospitenone - ủc chế CYP3A4IS) (xem Cảnh háo vả thận uong
lẫn) khi sử dụng).
Norethindrooe'lEthioyl norethindrone AUCo.m 14% Nồng dộ cún ethinyl estradiol
estndtol: norethindrone C..., 1l7% giám khi có sự hiện diện của
(norethindrone ] mg mỗi
ngảy + ethinyl estrodiol
0.035 mg mỗi ngây +
VICTRELIS 800 mg ngây 3
lân
ethinyl estradiol AUCo.m 1 26%
ethinyl estradỉol C… 1 21%
boceptevir. Nồng dộ
progesterone huyết thanh,
honnon hoảng thể hóa (LH) vả
hormon kich thich nang (FSH)
cho thấy buồng trứng bị ức chế
trong khi dùng dồn; thời
ethinyl estradiollnorethindrone
vâ VICTRELỈS.
Dùng đồng thời v1crmzus
vả ethinyl
estradiollnorethindrone dường
như không iim thay đồi tác
dụng của thuốc ngừa thai dạng
uống kểt hợp nây (xem thẻm
phẫn thei kỳ vù cho con bú).
NHÓM ức CHẾ BOM mo TON
13
MKJoJ4-VN M-201 3—006076 l1412013
Rej LRN'5OJOSl-BCV-CP—CCDS ID Fưb 2013
M
Chưa có cảc nghiên cứu dẳy dủ vả kiểm soát tốt ở nhũng phụ nữ mang thai dùng VICTRELIS. Phụ
nữ có khá ning mang thei chi nén được diều trị khi sử dụng biện pháp tránh thai hiệu quả.
Chưa quen sát thẫy ảnh hướng đến khả nũng phát trỉến của thai ớ ch vi mo (xem phẩn An toản
tiền lâm sâng). M
Chống chi đinh dùng VICTRELIS phối hợp với ribavirin vả peginterferon alfa ớ nhũng phụ nữ
dang mang thai (xem Chống chỉ định).
Tham khác Thỏng tin sân phim của peginterferon alfa vá rỉbavirỉn ớẻ có me… thông tin.
Cho eoo g;
Do liệu hiện có vẻ dược lực họdđộc tinh ớ chuột cho iháy sự bai tiết cửa boceptevirldẫn xuất
boceprevir trong sửa (xem phẫn An toân tiền iảm sâng).
Chưa Ioại trừ nguy co dối với ưe mới sinhltré nhò.
Cần cân nhắc dến lợi ich của việc cho trẻ bú mẹ hoặc lợi ich của điều trị đối với ngưới mẹ khi
quyềt đinh ngửng cho con bú hoặc ngừngltránh điều trị với VICTRELIS .
ÀNHHƯỜNG ĐÉNKHẢNÃNGLÁIXEVÀVẶNHÀNHMẤY
Chưa tiến hùnh nghiên cứu về ânh hướng của VICTRELIS phối hợp với peginterferon alfa vả
ribevirin đểu khi nâng lái xe vã vận hânh máy móc. Tuy nhiên. một vải iác dụng phụ đã dược báo
cáo có thể ânh hướng đén khả nang lái xe vả vận hânh máy móc của bệnh nhân. Đáp ứng với
VICTRELIS phối hợp peginterferon eifa vá ribevirin có thể khảo nhau ớ mõi bệnh nhân. Bệnh
nhản nén dược thông báo rằng mệt mói vù ehóng mịt đã được ghi uhặn (xem Tủe dụng ngoại ỷ).
Tham khảo Thông tin sản phấm của peginterferon alfa vá ribavirin để eỏ thèm thòng tin.
TẢC DỤNG KHÓNG MONG MUÔN
Trong 3 nghiên cửu lâm sâng chinh (2 thử nghiệm iâm sảng trên nhũng bệnh nhân chua tímg điều
ới trưởc dây vả 1 thử nghiệm iiim sảng ớen những bệnh nhác « bị ihái bại với điều tri trước đớ).
nghiên củu trên 2095 bệnh nhân trong đó 1508 bệnh nhân được diều trị với boceprevir. Thông tin
về tính an toản tren 1508 bệnh nhãn diều trị phối hợp Victrelis với peginterferon aIfa-Zb vả
ribavirin dược trinh bây ớ Bảng 3. Bệnh nhán bị viêm gan C mạn. dược diều trị với
VICTRELIS 800 mg ngảy 3 lần kết hợp với peginterferon alfa-2b vù ribavirin. SPRINT—l
(903523) đánh giá viẹc sủ dụng VICTRELIS trong phác dồ phổi hợp với PeglntrotưREBE'ĩ'OL có
và không có giai doạn ớièu tri dẫn nhập 4 tuẩn với PeslntroanEBETOL so với phát: dồ chi có
peginterferon elfa-2b vã ribavirin ở những bệnh nhân chưa từng điều tri truớc dãy. SPRINT—Z
(P05216 - dối tượng chưa tửng diễu tri) vá RESPOND—Z (P05101 - dối tượng iiiải bại với điều trị
trước dây) dánh giá việc sử dụng VICTRELIS 800 mg ngảy 3 iần kết hợp với peginterferon alfa—2b
vả ribavirin có giai đoạn diều tri dẫn nhập 4 tuần với peginterferon alfa—Zb vả ribavirin so với phác
15
MKSOJO—VNM—2MJ-OM'ĨG lllã013
Rej LRN. 5 03034—3C V-CP-CC DS ! 0 F eb 20] 3
Hệ eo qua ] Cie phân ửng ngogi ỷ
Rõi Ian mto vì hệ bạch hoyễt
Rất thường gặp: | 'Hiiếu máu’. giâm bạch cầu truịngịtinhỳ“
Rỗi loạn ethễn hỏi: vì um iiuớug
Rất thường gặp: [ Giảm ngon miệng’
Rỗi loạn tâm thủ
Rất thường gặp: [ Lo iing’, trầm cám'. mất ngủ. dễ bị kích thích
Rõi im iiẹ iiih iiinii
Rất thường gặp: ] Chóng mặt’. đau đẫu*
Rối Ioạn hô hấp, lgựe vi trong thẤt
Rỉi thường gặp: ] Ho“, khó thở”
R6i ioạu dạ diy-ntột
Rẵt thướng gặp: Tieu chảy’. khô miệng. loạn vị giác. buồn nôn*.
nônỢ
Rõi ioạn do vi mô đuới de
RÌỮướng ap: [ Rụng tóc. khô da. ngứa. phát ban
Rối loạn cơ. xương. khỡp vi mô liên kết
Rất ihướng gặp: | Đeu khởp. deu co
Rối looo toùn thi: vì tại ehỗ dùng thuốc
Rẩt thường sặp: Suy nhược’. ớn iạnh, mệt mòi’. bệnh giống củm.
sổt°
Nghiên cứu
im thường gặp: Giảm cãn
’ Beo gồm các phán ủng ngoại ý có thẻ nghiêm trọng do các nghiên eứu viên đánh giá utn
các bệnh nhân tham gia thử nghiệm iảm sâng.
“ Do VICTRELIS dược kẽ toa củng với peginterferon aifa vá ribavirin. xin tham khảo
thớng tìn sản phấm của peginterferon elfa vù ribavirin.
… Khỏng bao gồm cớc phản ứng tại chỗ tiớm do boeeprevir dùng dường uống.
MK3034-VNM-2013—006076 ll4l2013
Ref. LRJVJSO3O3đ-BCV-CP-CCDS. ] 0 Feb 2013
ĐẶC TÍNH DƯỢC LÝ .
ĐẶC TÍNH DƯỢC LỰC HỌC M/
Cơ chế tảc đônz
Boceprevir iả chất ức chế protease N83 cùa HCV. Boceprevir gắn vảo serine gây phản ứng cùa
protease NSZ3 (Serl39) nhờ nhóm chức (alfa)-ketoamide theo iiẽn kết cộng hóa trị có thế thuận
nghịch nhằm ức chế quá trinh sao chép vỉrus trong tế bảo chủ bị nhiễm HCV.
Hoat tinh khảng virus trong môi trường cẩv tế bảo
Hoạt tính kháng virus của boceprevir được dảnh giả trong một xét nghiệm sinh hóa về sự gắn kết
chậm chất ức chế NSB protease vả trong hệ thống đơn vị sao chép HCV (replicon). Giá trị ICso vả
ng0 của boceprevir tuong ứng khoảng 200 nM và 400 nM trong môi trường nuôi cấy tế bảo 72 gìờ.
Mất đơn Vi sao chép RNA lả trinh rự đẳu tiên xuất hiện trong thời gian điều trị. Việc đỉều trị với
nồng độ 1ch trong 72 giờ lảm giảm i-logio số đơn vị sao chép RNA. Điều trị kéo dải lảm giảm 2-
Iog lượng RNA cho đến ngảy 15.
Việc đánh giá sự phối hợp khác nhau boceprevir với interferon alfa-2b gây ức chế 90% sao chép
RNA cho thấy tác dụng cộng lực; không phải hiện bằng chứng về tác dụng hiệp lực bội tăng hoặc
đối kháng.
Đề khánz
Đề kháng boceprevir đuợc xác định qua cảc xét nghiệm về sinh hóa vả đơn vị sao chép virus. Hiệu
lực của Victrelis bị giảm (giảm 2— 10 lần) bời cảc biển thể amino acid liên quan dề kháng
(resistant—associated amino acid variants: RAVS) chủ yếu sau đây: V36M, T54A, R155K vả
V170A. Thuốc mất hiệu lực (giảm > 50 lần) khi có biến thể amino acid Iiên quan đề kháng lả
AlSóT vả A156V. Đảng lưu ý là dơn vị sao chép virus chứa biến thế A156T iại kém vững bền so
với các đơn vị sao chép chứa các RAV khác. Số lần tăng đề kháng khi có các RAV kép thì gần
bằng với số iần tăng đề kháng khi có RAV riêng lẻ.
Một phân tich tổng hợp từ 2 thử nghiệm lâm sảng giai đoạn 111 với cảc đối tượng chưa điều trị
trước vả đối tuợng thất bại với trị iiệu trước đây đã phát hiện cảc RAV xuất hiện sau khi vảo
nghiên cứu ở 15% tổng số các đối tượng được dùng peginterferon aifa-2b cùng ribavirin trong 4
tuần, sau đó dùng Victrelis 800 mg ngảy 3 lần phối hợp với pcginterfcron alfa-2b vả ribavirin.
T rong số các mẫu xét nghiệm được phân tích từ những đối tượng không có đáp ứng virus kéo dải
khi điều trị với Victreiis, có 53% trường hợp phải hiện RAV xuất hiện sau khi tham gia nghiên cứu.
Các RAV được phảt hiện nhiều nhất sau khi tham gia nghiên cứu (› 25% đối tượng) ở các đối
tượng nảy là những phẩn amino acid thay thế V36M (61%) và R155K (68%) ở người nhiễm virus
kiểu gen la và TS4A (42%), TS4S (37%), A1565 (26%) và VI7OA (32%) ở người nhiễm virus
kiều gen lb.
19
MK3034-VNM-2013-006076 1l412013
Ref LRNJSO3034-BCV-CP—CCDS. lo Feb 2013
phân không đối quang hoán chuyển nhanh chóng trong huyết tương. Diastercomer chủ yểu là hoạt
chẳt có tảc dụng dược lý vả dỉastereomcr khảo lá không hoạt tinh.
Cảo nghiên cứu in vitro cho thẩy boceprevir chủ yếu được chuyền hóa thảnh cảc chất chuyền hóa
đã khử ketone không có hoạt tinh chống HCV qua phản ứng xúc tác với men aldo-kctoreductase
(AKR). Sau khi uống một liều đơn MC-boceprcvir 800mg, phần lớn cảc chẩt chuyển hóa lưu hảnh
iả hỗn hợp chẩt đồng phân không đối quang của chẩt chuyến hóa đã khử ketone với nổng độ thuốc
trung bình nhiều hơn gấp 4 iần so với boceprevir. Boceprevir cũng được chuyến hóa ở mức độ it
hơn qua phản ứng oxy hóa bời CYP3A4/S.
Thâ_itrừ
Boceprevir được thải trừ với thời gian bản thải trong huyết tuong trung bình khoáng 3,4 giờ.
Boceprevir có độ thanh thải toản thân (CLÍF) trung bình khoảng 16] líi/giờ. Sau khi uống một liều
đơn 800 mg MC-boccprevỉr, khoảng 79% vả 9% liều dùng được đảo thải tương ửng qua phân vả
nước tiểu, với xấp xỉ 8% và 3% liều thuốc có chứa cacbon phóng xạ giống như boceprevir được
thải trù trong phân và nước tiều. Dữ iiệu nảy chứng tỏ boceprevir được thải trù chủ yểu bời gan.
_I-_)_ố_i_Ịươnz đăc biêt
Bệnh nhi
Chưa thiết iặp tính an toản, hiệu quả và đặc tính dược động học cùa VICTRELIS ở bệnh nhi dưới
18 tuối.
Suy gan
Trong một nghiên cứu trên các bệnh nhân có suy gan mãn tính ồn định ở các mức dộ khác nhau
(nhẹ, trung bình và nậng), không phảt hiện bắt kỳ khác biệt có ý nghĩa lâm sảng về các thông số
dược động học và không có khuyến cáo chinh liều. Chống chỉ định dùng Victrciis phối hợp với
peginterferon alfa vả ribavirin ở bệnh nhân xơ gan có điềm số Child-Pugh > 6 (lớp B và C) (xem
Chống chi dịnh).
Suy thận
Không ghi nhận khảc biệt có ý nghĩa lâm sảng về cảc thông số dược động học giữa bệnh nhân có
bệnh thận giai đoạn cuối (ESRD) vả dối tượng khóe mạnh. Không cần điều chỉnh Iiều ở cảc bệnh
nhân nảy vả ớ các bệnnh nhân bị suy thặn ớ bắt kỳ mức độ nảo.
Giới tinh
Dược động học theo giới tính dược ghi nhận không khảc biệt ở cảc bệnh nhân người lớn tham gia
các nghiên cứu giai đoạn II].
21
MK3034-VNM-2013-006076 ll4l2013
RejÍ LRNỊ503034—BCV—CP-CCDS. 10 Feb 2013
QUÁ LIẺU ớiẨ/
Liều hảng ngảy 3.600 mg dùng trong 5 ngảy ở người tình nguyện khỏe mạnh không gây cảc tác
động bìều hiện triệu chứng bất lợi. Không có thuốc giải độc đặc hiệu cho việc sử dụng quá Iiều
Victrelis. Điều trị sử dụng quá liều Victrclis nên bao gồm cảc biện pháp hỗ trợ, kể cả theo dõi cảc
dẩn hiệu sinh tồn vả quan sát tình trạng lâm sảng cùa bệnh nhân.
HẠN DÙNG
24 thảng kể từ ngảy sản xuất
THẬN TRỌNG ĐẶC BIỆT KHI BẨO QUÀN
Bảo quản trong tủ lạnh (2°C - 8°C) cho tới khi phân phải tới bệnh nhân.
Đối với việc sử dụng ở bệnh nhân, chế phẩm có thế được bảo quản trong tủ iạnh cho tới khi hết hạn
dùng ghi trên nhãn. Chế phẳm cũng có thể được bảo quản ở nhiệt dộ phòng (dưới 30°C) trong vòng
3 tháng.
Bảo quản thuốc trong bao bì gốc.
QUI CÁCH ĐÓNG GÓI
Hộp gồm 4 hộp nhỏ (mỗi hộp nhỏ chứa 7 vì x 12 viên nang cứng).
Bãn chắt vả thảnh phần trong bao bì
Vi ép polychiorotritiuorocthylcnc trong IPVC/nhôm có 3 ô, mỗi ô chứa 4 viên nang cứng. Cảo ô
trong vi được hản kin trảnh nhiệt với nắp cho có thế bóc ra được.
Thận trọng đặc biệt khi hủy thuốc
Nên hủy bẩt kỳ sản phẩm chưa dùng hoặc phế phầm phù hợp với yêu cầu cùa từng nước.
Sim xuất bỡi: Schering—Plough (Singapore) Pte Ltd., 70 Tuas West Drive, 638414 Singapore
Đỏng gỏi bởi: Schering-Piough Labo N.V., lndustriepark 30, 2220 Heist-op-den-Bcrg,
Belgium/Bi
THUỐC KÊ ĐƠN
TRÁNH XA TÀM TAY TRẺ EM
ĐỌC KỸ HƯỚNG DẤN SỬ DỤNG TRƯỚC KHI DÙNG
nÃv HỎI BÁC sì ĐỂ BIÉT THÊM THÔNG TIN.
THÔNG BÁO CHO BÁC ' _ .CA TÁC DỤNG NGOẠI Ý XẢY RA KHI DÙNG
THUỐC.
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng