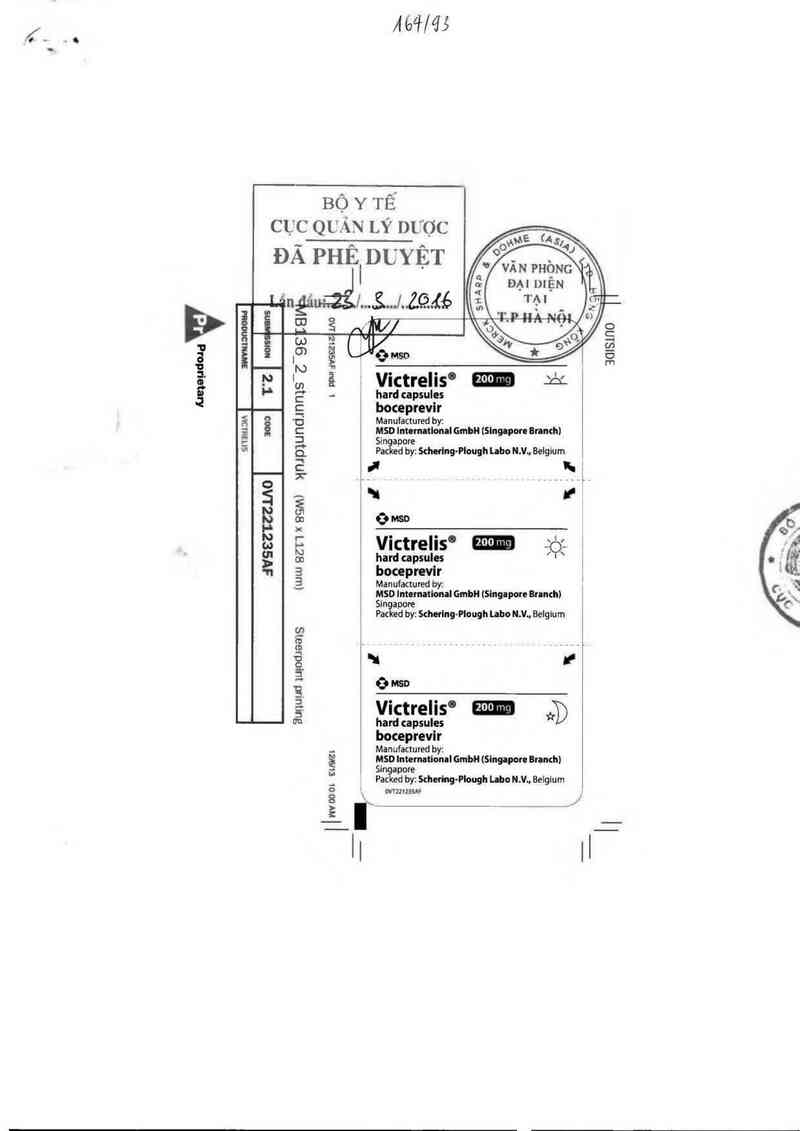





















Ệ\
Mege_udozd v
Áhilẩỉ
lán
SIWHIDM
-5
ẫ
:IVSSZTZZMO
BỘYTỀ
CỤC QUÁN LÝ nUợc
ĐÃ PHÊ DL'YỆT
gá»ũẳi ___…g ..Zộ. .4£›
IWVNOI EIIUZK
—98 8
1 w…3vscz1 mo
|
`. ;
Ix _ _ _ Ị/
to emso
'… , Vưtrelts° za
g hard capsules
; boceprevlr
~c' Manufactured by:
C MSD Internltloml GmbH (Slngapon Branch)
3 Sianỉepore
e_ d by: Schefing- Plough LaboN .V., Belgium 4
c d \ 1
x _ _ _ ...... ị
ẳ \ !
00 0 m
,, ,
Ẹ Victrelis' gợ- 1
on hard capsules ` l
3 boceprevir i
ị Manufactured by:
MSD lnternatlonal GmbH (SIngapofe Bmưh)
Sina
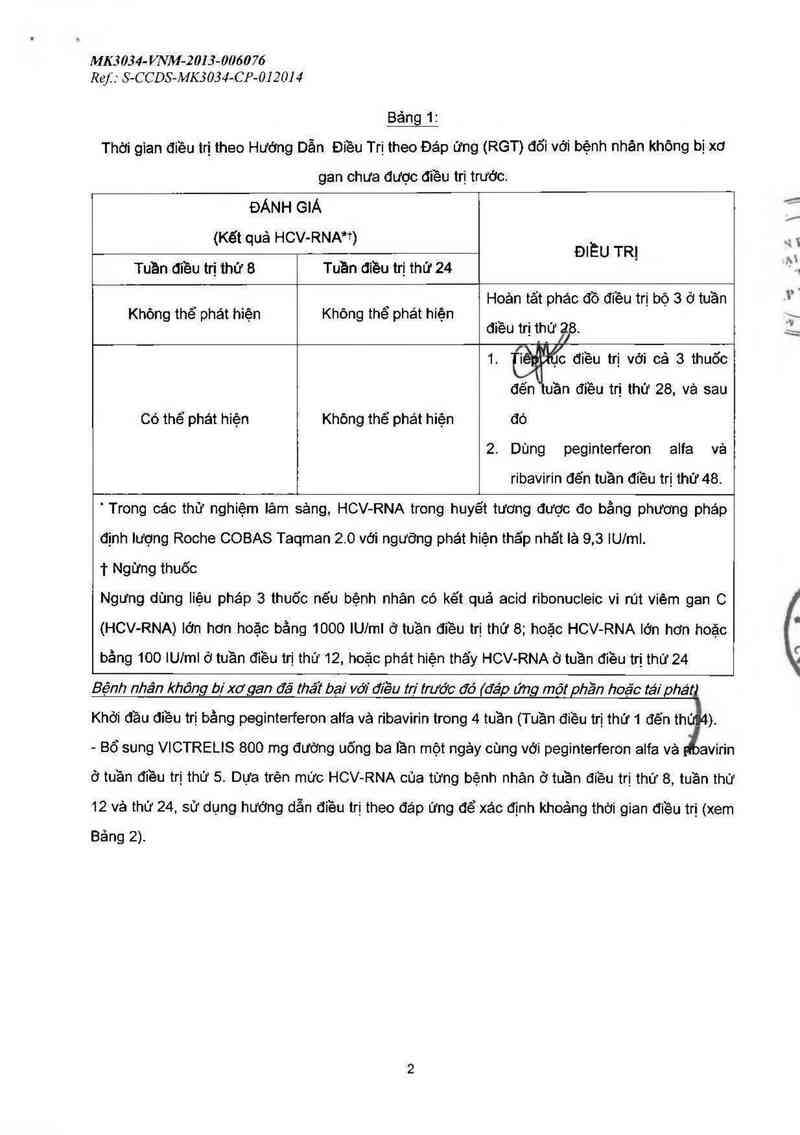
Pacỉedre by: S6 (phân ioại B và C) (xem Chống chỉ định vả Đặc
tính dược động học).
Để biết thêm thòng tin về sử dụng VICTRELIS ở những bệnh nhản xơ gan còn bù, xem Cảnh báo
đặc biệt và thận trọng khi dùng, mục suy gan
`/Í
'.`1/"—_
\ ty
ử-~ .
MK3034—VNM-2013-006076
Ref : S—CCDS-MK3 034-CP-012014
Trẻ em
Dữ Iiệu về tính an toản, hiệu quả vả dược động học của VICTRELIS đối với trẻ em dưới 18 tuổi
chưa được thu thập đầy đủ
Người cao tuôĩ
Các thử nghiệm lâm sảng về sử dụng thuốc VICTRELIS đối vởỉ nhóm người cao tuổi không thực
hiện đủ số đối tượng cần thiết từ 65 tuổi trở lên để xác định xem họ có đáp ứng thuốc khác so với
nhóm đối tượng trẻ hơn. Kinh nghiệm lâm sảng khác không phát hiện sự khác biệt trong đáp ứng
thuốc giữa nhóm bệnh nhân iớn tuổi và nhóm bệnh nhân trẻ (xem phầ Bá tính dược động học).
Bệnh nhân đồng thởi bị nhiễm HIV /
Chưa xác định được tính an toản vả hiệu lực cùa VICTRELIS khi sử dụng đơn lẻ hoặc phối hợp VỚi
peginterferon alfa vả ribavirin để điều trị cho bệnh nhân nhiễm viêm gan siêu vi C mản tính kiểu
gen 1 đồng thời nhiễm HIV. Dữ liệu về tương tác thuốc với các nhóm thuốc kháng virus, xin xem
phần tương tác với các thuốc khác và các dạng tương tác khác, bảng 3
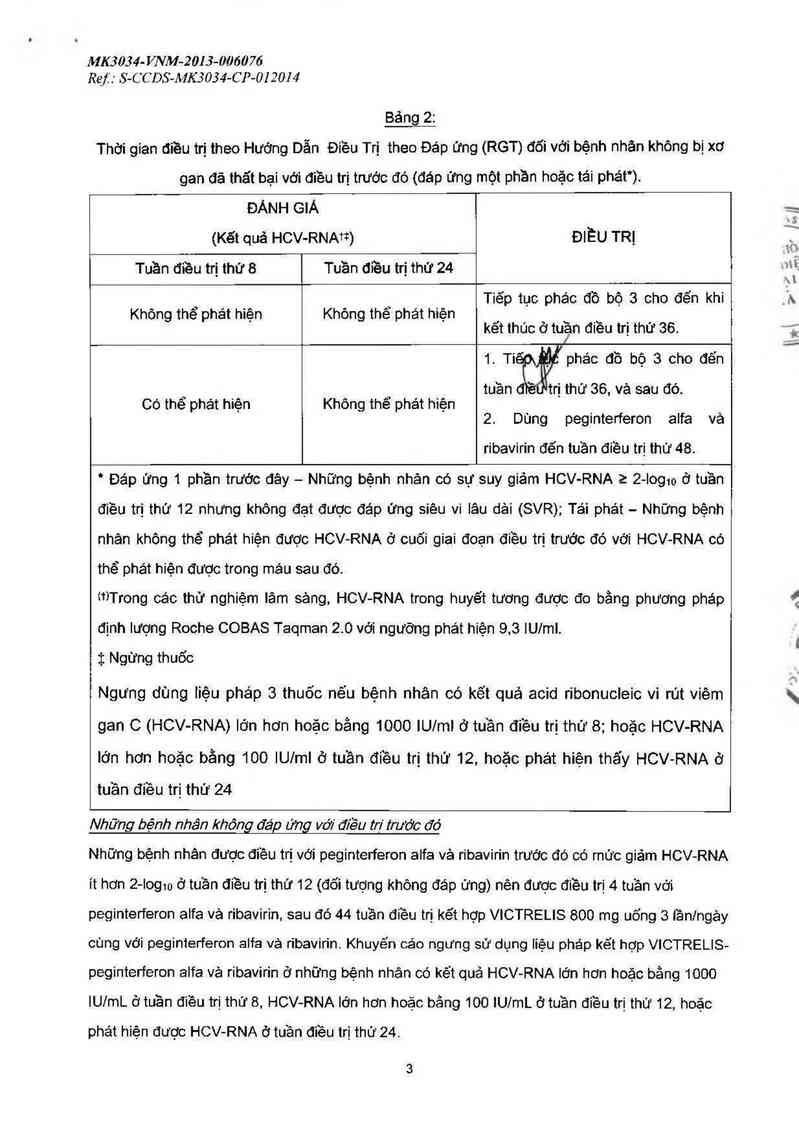
Bệnh nhân đồng thở! bị nhiễm viêm gan siêu vi 8
Chưa có nghiên cứu về tính an toản và hiệu lực của VICTRELIS khi sử dụng đơn lẻ hoặc phối hợp
với peginterferon aifa vè ribavirin để điều trị cho bệnh nhân nhiễm viêm gan siêu vi C mãn tính
(HCV) kiểu gen 1 đồng thời nhiễm virus viêm gan siêu vi B (H BV) .
Bệnh nhân ghép tạng
Chưa có nghiện cửu về tính an toản vả hiệu iực cũa VICTRELIS khi sử dụng đơn lẻ hoặc phối hợp
với peginterferon aifa vả ribavirin để điều trị cho bệnh nhân nhiễm viêm gan siêu vi C mãn tính
kiểu gen 1 ở những bệnh nhân ghép gan hoặc những người nhận ghép tạng khác. Xem dữ liệu về
tương tác thuốc với các thuốc ức chế miễn dịch trong bảng 3: tương tác với các thuốc khác và các
dạng tương tác khác
Quy tăc ngùng thuốc
Khuyến cáo ngưng điều trị ở những bệnh nhân (1) có kết quả HCV-RNA lớn hơn hoặc bằng 1000
lU/mL ở tuần điều trị thứ 8; (2) HCV-RNA lớn hơn hoặc bầng 100 iUlmL ở tuần điều trị thứ 12;
hoặc (3) phát hiện được HCV-RNA ở tuần điều trị thứ 24
CHỐNG CHỈ ĐỊNH
Chống chỉ định dùng VICTRELIS phối hợp với peginterferon aifa vả ribavirin trong các trường hợp:
o Bệnh nhân trước đảy đã phát hiện quá mẫn đáng kể về mặt iảm sảng với hoạt chất hoặc bẩt
cứ thảnh phần nảo của thuốc.
n Bệnh nhân bị viêm gan tự miễn
MK3034- PWM-2ffl3-006076
ReJĨ: S-CC'DS-MK3034-CP-01201r 4
o Bệnh nhân gan mẩt bù có điềm Child-Pugh > 6 (phản loại B vả C) (Xem Liều lượng và cách
dùng, Đặc tính dược động học).
o Dùng phối hợp với những loại thuốc phụ thuộc chặt chẽ vảo hệ CYP3A4I5 trong việc thanh
thải. và lảm gia tăng nồng độ trong huyết tương có liên quan tới việc iảm trầm trọng vảlhoặc
nguy hiểm tới tính mạng bệnh nhân, như các thuốc sử dụng đường uống midazolam,
amiodarone, astemizole. bepridil, propafenone, quinidine, simvastatin, Iovastatin, alfuzosin,
đoxazosin, silodosin, tamsulosin vả những dẫn xuất nấm cựa gả (dihydroergotamine,
A
tương tác khác). |
ergonovine. ergotamine, methylergonovine) (xem Tương tảo với Ệ/thuõc khác vả các dạng
ư
c Phụ nữ mang thai (xem Thai kỳ)
Tham khảo Thỏng tin sản phẩm của peginterferon aifa vả ribavirin để có thêm thông tin
CẤNH BÁO ĐẶC BIỆT VÀ THẬN TRỌNG KHI DÙNG
Thiếu máu
Đã có bảo cáo về triệu chứng thiếu máu khi điều trị với peginterferon alfa vả ribavirin. Việc dùng
phối hợp VICTRELIS với peginterferon alfa vả ribavirin thường đi kèm với sự giảm thêm nồng độ
haemoglobin huyết thanh. Trong các thử nghiệm lâm sảng, thời gian trung bình để hemoglobin bắt
đầu dưới 10 gldl. từ lúc bắt đầu điều trị là tương tự nhau giữa cảc đối tượng được điều trị kểt hợp
VICTRELIS vả peginterferon alfa-2blribavirin (71 ngảy với khoảng thời gian giao động 15-337
ngảy) so vởi những người dùng peginterferon aifa-2b/ribavirin (71 ngảy với khoảng thời gian giao
động 8-337 ngảy). Cần kiểm tra công thức máu toản phần (kèm số lượng các loại tế bảo bạch
cầu) vảo các thời điểm: trước khi điều trị, vảo tuần điều trị thứ 2, 4, 8. 12 vả theo dõi chặt chẽ ở
các thời điểm khác, theo bệnh cảnh lảm sảng. Nếu haemoglobin huyêt thanh < 10 gldl. có thể cần
giảm liều ribavirin vả/hoặc dùng erythropoietin (epoetin alfa) (Xem Tác dụng không mong muốn vả
Đặc tính dược lực học). Trường hợp phải ngưng ribavirin vĩnh viễn thi cũng phải ngưng cả
peginterferon alfa vả VICTRELIS.
Khuyến cáo giảm liều ribavirin trong việc điều trị ban đầu bệnh thiếu máu cẩp.
Trong một thử nghiệm tiền cứu ngẫu nhiên có kiểm soát, tỉ lệ đạt SVR có thể so sánh với sự giảm
liều ribavirin hoặc khi dùng erythropoietin. Trong thử nghiệm nảy, việc sử dụng erythropoietin cớ
Iiên quan với việc tăng nguy cơ huyết khối tắc mạch 50 với việc chỉ giảm liều ribavirin.
Tham khảo thông tin sản phẩm ribavirin để có thệm thông tin về việc giảm liều vả/hoặc ngưng
đỉều trị ribavirin.
Giảm bạch cầu trung tính
MK3034-WVM-2013-006076
Ref.: S-CCDS-MKJO34-CP-OI 2014
Trong oác thử nghiệm lảm sảng Giai đoạn 2 và 3, 7% bệnh nhân được dùng VICTRELIS phổi hợp
với peginterferon alfa-2b vả ribavirin có số lượng bạch cầu trung tính dưới 0,5 x 10% so với 4%
bệnh nhãn chỉ dùng peginterferon alfa-2b vả ribavirin. Ba bệnh nhân có biểu hiện nhiễm khuẩn
nặng hoặc đe dọa tính mạng do giảm bạch cầu trung tinh, và hai bệnh nhân có giảm bạch cầu
trung tính đe dọa tính mạng khi điều trị VICTRELIS phối hợp với peginterferon aifa-2b vả ribavirin..
Nên kiểm tra công thửc máu toản phần (kèm số lượng các loại tế bảo bạch cầu) ở thời điểm trước
khi điều trị, ở tuần điều trị thứ 2, 4, 8 vả 12. và theo dõi chặt chẽ tại các thời điểm khác theo bệnh
cảnh lâm sảng. Giảm bạch cầu trung tinh có thể cần giảm Iiều pegint rferon alfa hoặc ngưng điều
trị. Trường hợp phải ngưng ribavirin vĩnh viễn thi củng pl'ìếì ưng cả peginterferon alfa vả
VICTRELIS. V
Tham khảo nội dung liên quan đê'n giảm Iiều vảlhoặc ngưng điều trị trong thông tin sản phẩm của
peginterferon alfa.
Các phản ứng huyết học khác
Đã có báo cáo sau khi đưa sản phẩm ra thị trường về các trường hợp giảm toản thể huyết cầu ở
những bệnh nhân dùng kểt hợp VICTRELIS với peginterferon alfa vả ribavirin. Nên kiểm tra công
thức máu toản phần (kèm số lượng các loại tế bảo bạch cầu) tại thời điểm trước khi điều trị, vả ở
tuần điều trị 2, 4, 8 vả 12, và theo dõi chặt chẽ tại các thời điểm khác, theo bệnh cảnh lâm sảng.
Quá mẫn
Đã quan sát thấy các phản ứng quá mẫn cấp tính nặng (ví dụ: mề đay. phù mạch) trong quá trinh
điều trị phối hợp VICTRELIS với peginterferon alfa vả ribavirin. Nếu các phản ửng nảy xảy ra, nên
ngưng điều trị phối hợp và lặp tức tiến hảnh các Iiệu pháp điều trị thích hợp. (xem Chống chỉ định
và Tác dụng không mong muốn).
Suy gan
Tính an toản và hiệu quả của VICTRELIS khi kẽt hợp với peginterferon alfa vả ribavirin chưa được
nghiên cứu ở những bệnh nhân xơ gan mất bù (xem Chống chỉ định).
Trong các nghiên cứu quan sát đã công bố trện bệnh nhân xơ gan còn bù được điều trị bằng
VICTRELIS hoặc telaprevir kết hợp VỚi peginterferon alfa vả ribavirin, số lượng tiểu cầu
<100.000/mm3 vả albumin huyết thanh <35 g/L lá các dấu hiệu cơ bản dự báo trước tử vong hoặc
biến chứng nghiêm trọng (nhiễm trùng nặng hoặc gan mất bù) trong quá trinh điều trị.
Những nguy cơ vả lợi ich tiềm tảng của liệu pháp kẽt hợp VICTRELIS, peginterferon alfa vá
ribavirin cần được xem xét kỹ trước khi bắt đầu điều trị cho những bệnh nhân xơ gan còn bù có số
MK3034- VNM-ZOIJ-OỦÓỦ7Ổ
Ref. : S-CCDS—MK3034-CP-Ol2 014
lượng tiểu cầu <100.0001mm3 vả albumin huyết thanh <35 g/L. Nêu quyết định điều trị, giảm sảt
chặt chẽ các dẩu hiệu của nhiễm trùng và đảm bảo chức nảng gan không xãu đi.
Những thuốc có chứa Drospirenone
Cần thặn trọng đối với bệnh nhân dùng thuốc có chứa drospirenone kèm theo những nguy cơ lảm
tăng kali huyết hoặc những bệnh nhân dùng thuốc lợi tiếu giữ Kali. Cần phải xem xét thay thế
bằng những loại thuốc ngừa thai khảo (xem Tương tác Với các thuốc khác vả các dạng tướng tảo
kháoi
Các thuốc cảm ứng mạnh CYP3A4
Không khuyến cáo dùng VICTRELIS phối hợp với các thuốc cảm/ ' ạnh CYP3A4 (rifampicin,
carbamazepine, phenobarbital, phenytoin).
Đơn tri liêu HCV grotease
Theo các kểt quả nghiên cứu lâm sảng, VICTRELIS không được sử dụng một mình do khả năng
tăng kháng thuốc cao khi không kẽt hợp với các Iiệu pháp kháng-HCV (xem Đặc tính dược iực
học).
Vẫn chưa biểt ảnh hướng của liệu phảp với VICTRELIS lên hoạt động của các chất ức chế HCV
protease được sử dụng sau đó. bao gồm việc tái điều trị với VICTRELIS .
Xét nghiệm
Tham khảo các thông tin sản phẩm của peginterferon alfa vả ribavirin, khuyến các xét nghiệm
trong và sau điều trị bao gồm xét nghiệm huyết học, sinh hóa (bao gồm cả xét nghiệm chửc năng
gan). vả xét nghiệm thai nghén
Nồng độ HCV - RNA nẻn được theo dõi tại tuần điều trị 8, 12, vả 24, và các thời điểm khác như
chi ra trèn lảm sảng .
Nên kiểm tra công thức máu toản phần (kèm số lượng các loại tế bảo bạch cầu) tại thời điểm trước
khi điều trị, vả ở tuần điều trị 2, 4, 8 vả 12, vả theo dõi chặt chẽ tại các thời điểm Khảo, theo bệnh
cảnh lâm sảng
Để biết thẻrn thỏng tin về sử dụng VICTRELIS ở những bệnh nhân xơ gan còn bù, xem Cảnh báo
đặc biệt vả thặn trọng khi dùng, mục suy gan
Dùng cho bệnh nhân bị rối Ioan di truyền hiếm
Những bệnh nhân bị các vẩn đề di truyền hiếm về không dung nạp galactose, thiếu lactase Lapp
hoặc kém hấp thu glucose-galactose không nên dùng thuốc nảy.
MK3 034- VNM-ZOlẵ-OOỐO 76
Ref. : S-CC DS-MK3034-C P-01 201 4
TƯỚNG TÁC VỚI CÁC THUỐC KHÁC VÀ CÁC DẠNG TƯỚNG TÁC KHÁC
VICTRELIS lả chãt Ức chế CYP3A4|5 mạnh. Cảo loại thuốc chuyển hóa chủ yếu bởi CYP3A4/S có
thể gia tảng nồng độ khi được sử dụng kèm VICTRELIS. điều nảy có thể Iảm tăng hoặc kéo dải
những phản ứng điều trị vả những phản ứng bất lợi (xem bảng 3). In vìtro, VICTRELIS không ức
chế CYP1A2, CYP2A6, CYP2B6, CYPZC8, CYP2CS, CYPZC19, CYP2D6 hoặc CYP2E1. Hơn
nữa, in vitro, VICTRELIS không gây cảm ứng CYP1A2, CYP2B6, CYPZCồ, CYP209, CYP2C19
hoặc CYP3A4IS.
Trong một thử nghiệm tương tác thuốc với digoxin, VICTRELIS I` chế khả năng ức chế p-
glycoprotein (P-gp) ở nồng độ thích hợp (xem bảng 3) d
VICTRELIS được chuyển hóa một phần bởi CYP3A4/õ. Việc sử dụng đồng thời VICTRELIS vởi
những thuốc gây cảm ứng hoặc ức chế CYP3A4/ỏ có thể Iảm tăng hoặc giảm nồng độ
VICTRELIS.
Boceprevir biểu hiện là một cơ chất P-gp in vỉtro
Chống chỉ định dùng VICTRELIS phối hợp peginterferon alfa, ribavirin vả đồng thời phối hợp với
những loại thuốc phụ thuộc cao vảo CYP3A4/5 trong vìệc thanh thâi. vả lảm gia tăng nồng độ
trong huyết tương có liẽn quan tới việc Iảrn trầm trọng vá/hoặc nguy hiểm tới tính mạng bệnh
nhân, như các thuốc sử dụng đường uống: midazolam, amiodarone, astemizole, bepridii,
pimozide, propafenone. quinidine. simvastatin, lovastatin. alfusozin, doxasozin, silodosin,
tamsulosin và những dẫn xuất nẩm cựa gả (dihydroergotamine, ergonovine, ergotamine,
methyiergonovine) (xem Chống chỉ định).
MK3034- VWM-2013-006076
Ref: S-CCDS-MK3034-CP—OIZOM
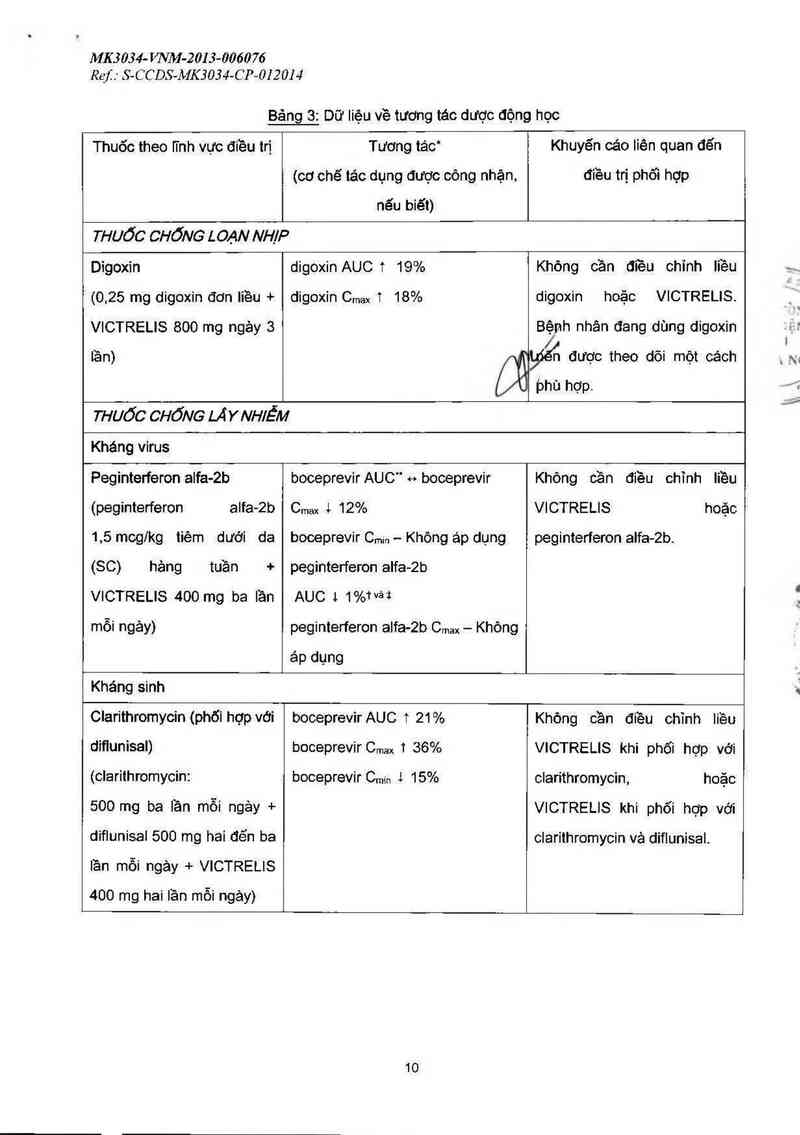
Bảng 3: Dữ liệu về tương tác dược động học
Thuốc theo iinh vực điều trị
Tương tác“
(cơ chế tác dụng được công nhặn,
nếu biết)
Khuyên cảo liên quan đến
điều trị phôi hợp
THUỐC CHỐNG LOẠN NHIP
Digoxin
(0.25 mg digoxin đơn liều +
VICTRELIS 800 mg ngảy 3
digoxin AUC 1 19%
digoxin Cmax 1 18%
Không cần điều chỉnh liều
digoxin hoặc VICTRELIS.
Bệnh nhân đang dùng digoxin
tần) n được theo dõi một cách
bhù hợp.
THUỐC CHỐNG LÁ Y NH/ỄM
Kháng virus
Peginterferon alfa-2b boceprevirAUC" «» boceprevir Không cần điều chỉnh Iiều
(peginterferon alfa-2b Cmax & 12% VICTRELIS hoặc
1,5 mcglkg tiêm đưới da
(SC) hảng tuần +
VICTRELIS 400 mg ba lần
mỗi ngảy)
boceprevir Cmin - Không áp dụng
peginterferon alfa-2b
AUC t 1%ì`vài
peginterferon alfa-2b Cmax — Không
áp dụng
peginterferon alfa-2b.
Kháng sinh
Clarithromycin (phối hợp với
dỉflunisal)
(clarithromycin:
500 mg ba lần mỗi ngảy +
diflunisal 500 mg hai đẻn ba
lần mỗi ngảy + VICTRELIS
400 mg hai lần mỗi ngảy)
boceprevir AUC 1 21%
boceprevir Cmax 1 36%
boceprevir Cmin 1 15%
Không cần điều chỉnh liều
VICTRELIS khi phối hợp vởi
clarithromycin, hoặc
VICTRELIS khi phối hợp với
clarithromycin vả diflunisal.
10
MK3 03 4- VNM-2013—006076
Ref : S-CCDS-MK3 034-CP-01 20] 4
Thuốc theo linh vực điều trị Tương tác* Khuyên cáo Iièn quan đẽn
(cơ chế tác dụng được cỏng nhận, điều trị phối hợp
nẽu biểt)
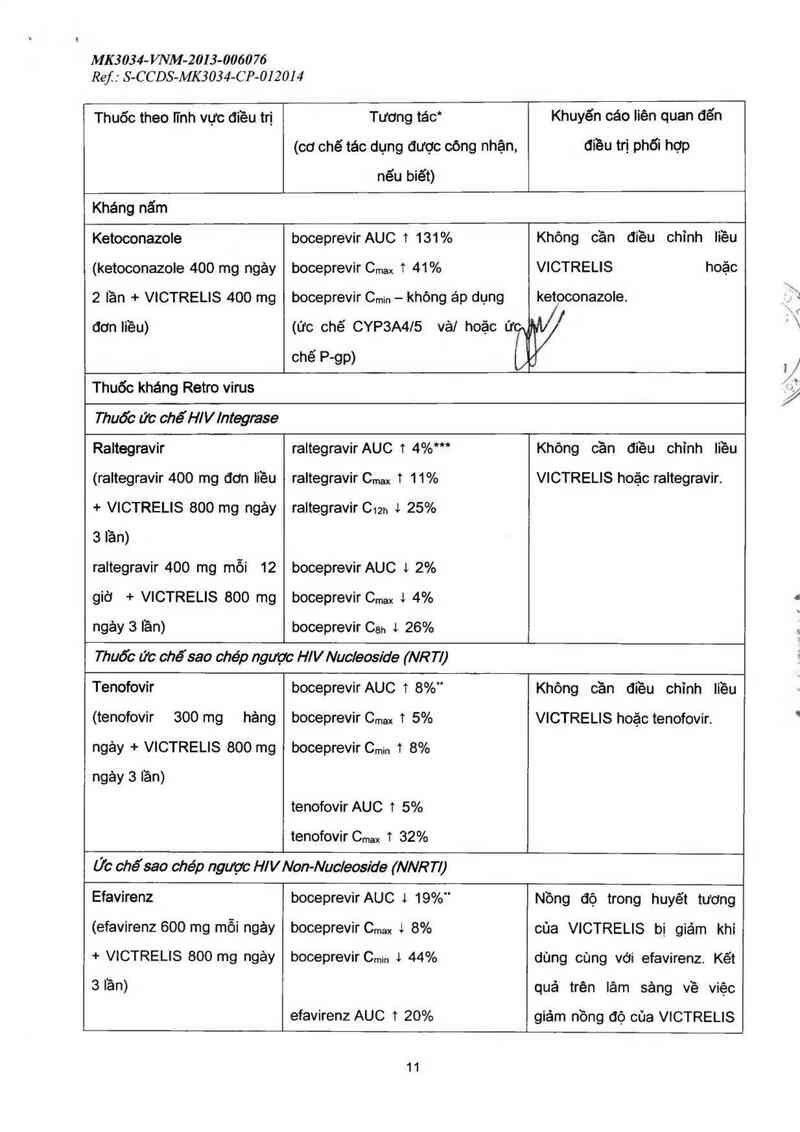
Kháng nấm
Ketoconazole boceprevir AUC 1 131 % Không cần điều chinh Iiều
(ketoconazole 400 mg ngảy
2 lần + VICTRELIS 400 mg
đơn Iiều)
boceprevir Cmax 1 41%
boceprevir Cmin - khòng áp dụng
VICTRELIS hoặc
ketoconazole.
(1110 chế CYP3A4/5 vải hoặc Ứl //
chẽ P—gp)
Thuốc kháng Retro virus
Thuốc ức chếH/V/ntegzase
Raltegravir
(raltegravir 400 mg đơn liều
+ VICTRELIS 800 mg ngảy
3 lần)
raltegravir 400 mg mỗi 12
giờ + VICTRELIS 800 mg
ngảy 3 lần)
raitegravirAUC t 4%***
raltegravir Cmax 1 11%
raltegravir C12h 4 25%
boceprevir AUC t 2%
boceprevir Cmax t 4%
boceprevir Can 4 26%
Khỏng cần đtều chỉnh Iiều
VICTRELIS hoặc raltegravir.
Thuốc ức chếsao chép nguptc H! V Nuc/eoside (NR TI)
Tenofovir
(tenofovir 300 mg hảng
ngảy + VICTRELIS 800 mg
ngảy 3 lần)
boceprevirAUC t 8%"
boceprevir Cmax t 5%
boceprevir Cmin t 8%
tenofovir AUC t 5%
tenofovir Cmax 1 32%
Không cần điều chỉnh Iiều
VICTRELIS hoặc tenofovir.
Ức chế sao chẻp nguptc H/VNon-Nuc/eoside (NNR TI)
Efavirenz
(efavirenz 600 mg mỗi ngảy
+ VICTRELIS 800 mg ngảy
3 lần)
boceprevir AUC 1 19%"
boceprevir C… 4 8%
boceprevir Cmin 1 44%
efavirenz AUC 1 20%
Nồng độ trong huyết tương
của VICTRELIS bị giảm khi
dùng cùng với efavirenz. Kẽt
quả trèn Iảm sảng về việc
giảm nồng độ của VICTRELIS
11
MK3034- VNM-2OI3-006076
Ref. : S-CC DS-MK3 03 4-C P-01 201 4
Thuốc theo lĩnh vực điều trị
Tương tác’
(cơ chế tác đụng được công nhặn,
nểu biết)
Khuyến cáo Iiên quan đẽn
điều trị phối hợp
efavirenz Cmax 1 11%
(cảm ứng CYP3A4 -
ảnh hưởng tới boceprevir)
chưa được đánh giá trực tiểp.
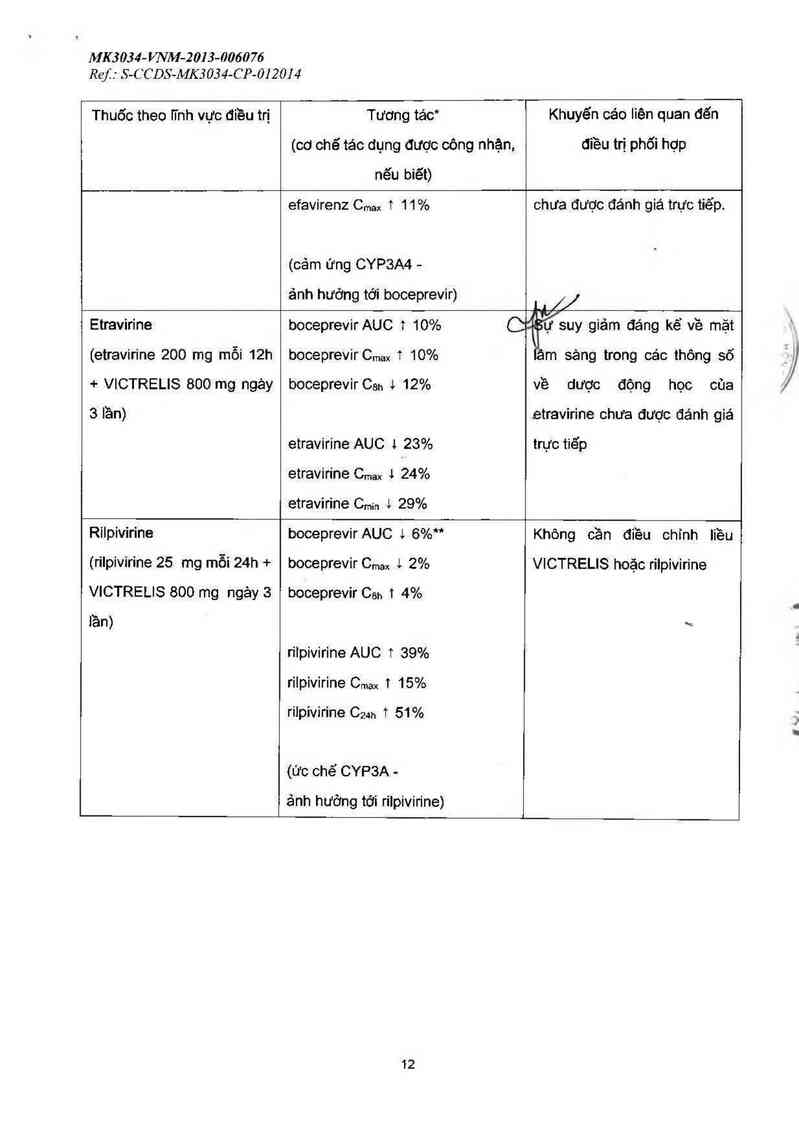
Etravirine
(etravirine 200 mg mỗi 12h
+ VICTRELIS 800 mg ngảy
3 lần)
boceprevirAUC t 10%
boceprevirCmax 1 10%
boceprevir Can 4 12%
etravirine AUC 1 23%
etravirine Cmax 1 24%
etravirine C…… 1 29%
Lb//
ự suy giảm đáng kể về mặt
âm sảng trong các thông số
về dược động học cùa
etravirine chưa được đánh giá
trực tiếp
Rilpivirine
(rilpivirine 25 mg mỗi 24h +
VICTRELIS 800 mg ngảy 3
iần)
boceprevir AUC % 6%"
boceprevir Cmax i 2%
boceprevir Csh 1 4%
rilpivirine AUC T 39%
rilpivirine Cmax T 15%
rilpivirine C24h 1 51%
(ức chế CYP3A -
ảnh hướng tới rilpivirine)
Không cần điều chinh liều
VICTRELIS hoặc rilpivirine
12
MK3034-VNM-2013-006076
Ref : S-CCDS-MK3034—CP-OI 201 4
Thuốc theo rinh vực điều trị Tương tảc* Khuyến cáo liên quan đển
(cơ chế tác đụng được công nhận, điều trị phối hợp
nếu biểt)
Thuốc ức chếH/VProtease (Pl)
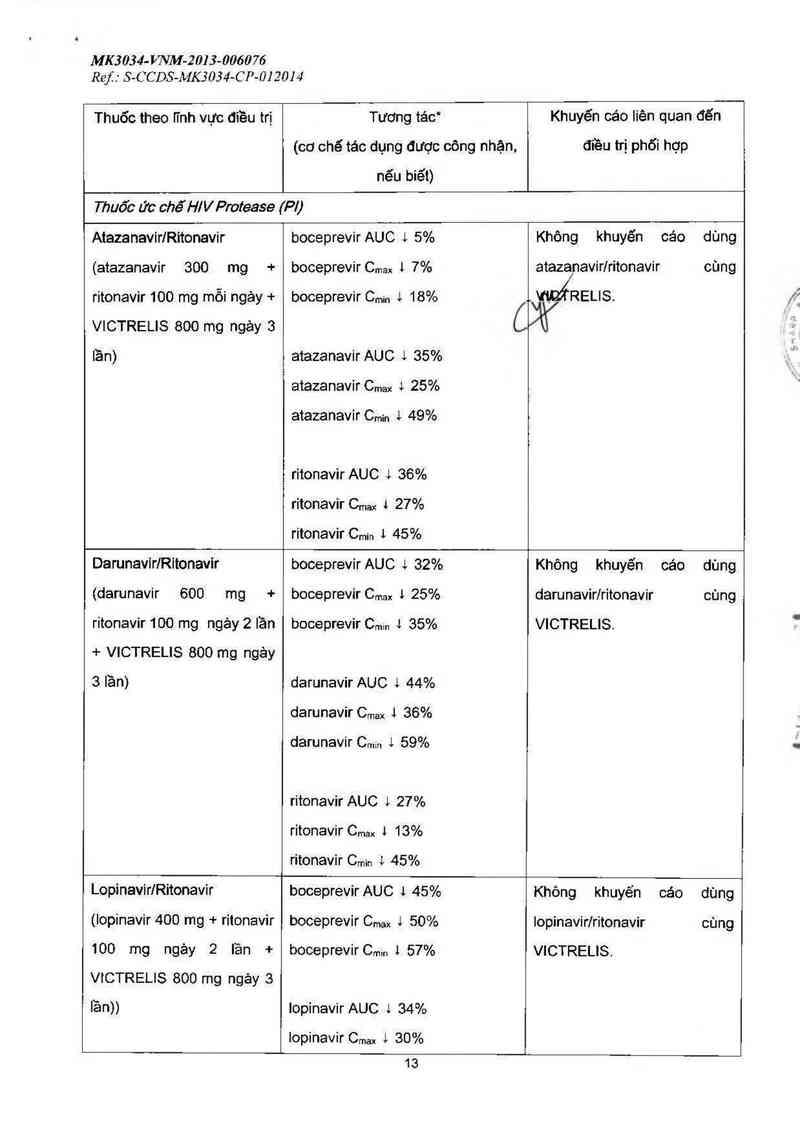
Atazanavir/Ritonavir boceprevir AUC l 5% Không khuyến cáo dùng
(atazanavir 300 mg + boceprevir Cmax t 7% ataza/navirlritonavir cùng
ritonavir1OO mg mỗi ngảy + boceprevir Cmin 1 18% .. WỊẤRELIS.
VICTRELIS 800 mg ngảy 3 Cjò/
lần) atazanavirAUC 1 35%
atazanavir Cmax 4 25%
.31tazanavirCmin & 49%
ritonavir AUC 4 36%
ritonavir Cmax 1 27%
ritonavir Cmin 1 45%
DarunavirlRitonavir boceprevir AUC 4 32% Không khuyến cáo dùng
(darunavir 600 mg + boceprevir Cmax 1 25% darunavir/ritonavir cùng
ritonavir 100 mg ngảy 2 lần boceprevir Cmin 1 35% VICTRELIS.
+ VICTRELIS 800 mg ngảy
3 lần) darunavir AUC 1 44%
darunavir Cmax 1 36%
darunavir C…… 4 59%
ritonavir AUC 1 27%
ritonavir cm, 1 13%
ritonavir Cmin 1 45%
Lopinavir/Ritonavir boceprevir AUC 1 45% Không khuyến cáo đùng
(lopinavir 400 mg + ritonavir boceprevir Cmax 1 50% Iopinavirlritonavir cùng
100 mg ngảy 2 lần + boceprevirCmin 1 57% VICTRELIS.
VICTRELIS 800 mg ngảy 3
lần)) lopinavir AUC 1 34%
Iopinavir Cmax 4 30%
13
MK3034- VNM-2013-0060 76
Ref: S-CCDS-MK30ỉ4-CP-OI2OM
Thuốc theo lĩnh vực điều trị
Tương tác*
(cơ chẽ tác dụng được công nhận,
nếu biết)
Khuyến cáo liên quan đẽn
điều trị phối hợp
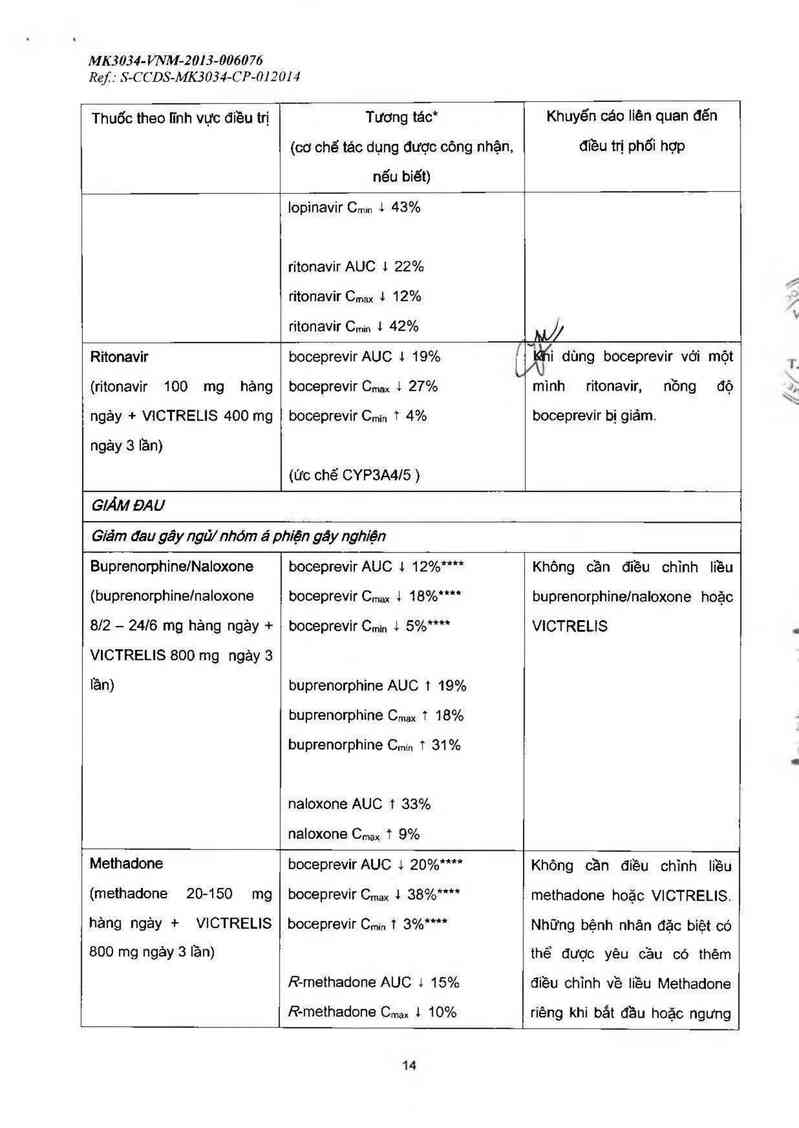
lopinavir C…… 4 43%
ritonavirAUC 1 22%
ritonavir C,… J… 12%
ritonavir Cmin 1 42%
@
Ritonavir
(ritonavir
ngảy + VICTRELIS 400 mg
100 mg hảng
ngảy 3 lần)
boceprevirAUC 4 19%
boceprevir Cmax 1 27%
boceprevir Cmin t 4%
(ức chế CYP3A4/5 )
c_\
ẾlẤi dùng boceprevir với một
mình ritonavir, nồng độ
boceprevir bị giảm.
GJẢM ĐAU
Giãm dau gã y ngti/ nhóm á phiện gả y nghiện
Buprenorphine/Naloxone
(buprenorphine/naloxone
812 — 2416 mg hảng ngảy +
VICTRELIS 800 mg ngáy 3
lần)
boceprevir AUC 1 12%*”*
boceprevir Cmax 4 18%““
boceprevir Cmin 1 5%****
buprenorphine AUC 1 19%
buprenorphine Cmax T 18%
buprenorphine Cmin T 31%
naioxone AUC 1 33%
naloxone Cmax t 9%
Không cần điều chĩnh Iiều
buprenorphinelnaloxone hoặc
VICTRELIS
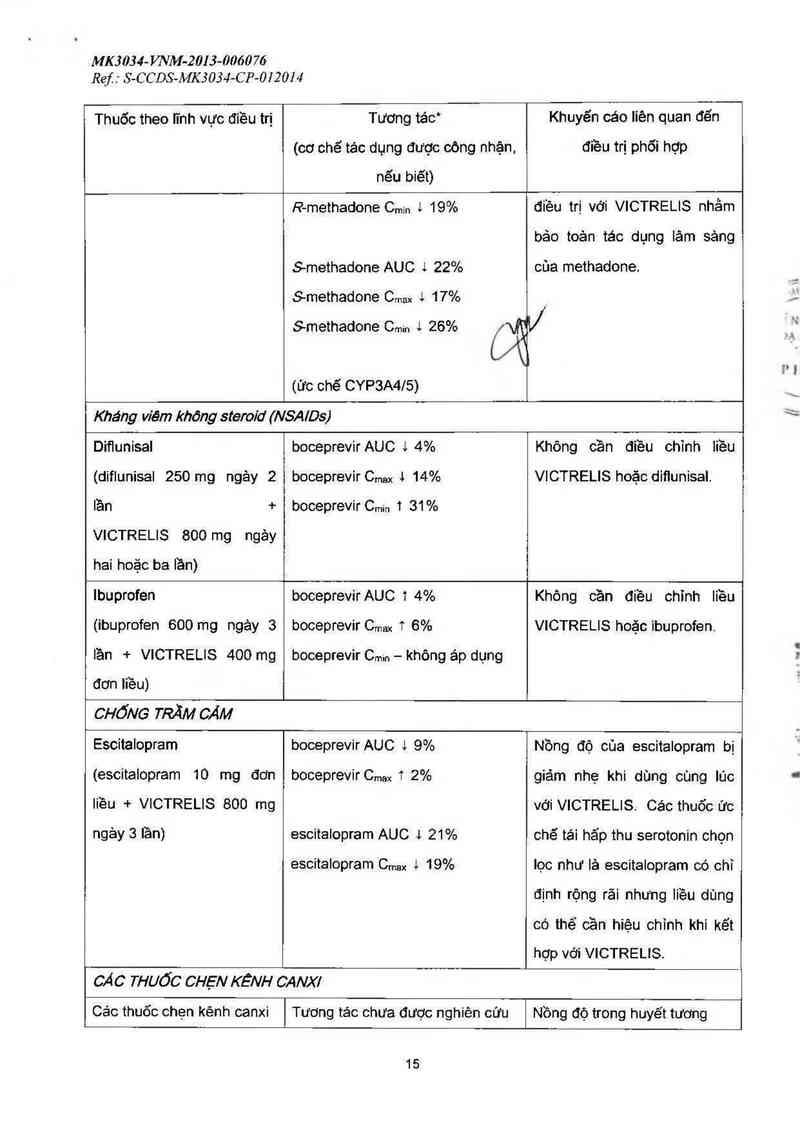
Methadone
(methadone 20-150 mg
hảng ngảy + VICTRELIS
800 mg ngảy 3 lần)
boceprevir AUC 1 20%****
boceprevir Cmax l 38°o*“*
boceprevir Cmin T 3%"**
R-methadone AUC 1 15%
R—methadone Cmax 1 10%
Khỏng cần điều chinh Ii`êu
methadone hoặc VICTRELIS.
Những bệnh nhãn đặc biệt có
thể được yêu cầu có thêm
điều chinh về liều Methadone
riêng khi bắt đầu hoặc ngưng
14
,.… \_l_
MK3034- VNM-20I3-006076
Ref: S-CCDS-MK3034-CP-OI2OM
Thuốc theo lĩnh vực điều trị
Tương tác*
(cơ chế tác dụng được oòng nhặn,
nếu biết)
Khuyến cáo liên quan đẽn
điều trị phối hợp
R-methadone C…… 1 19%
S-methadone AUC 1 22%
S-methadone Cmax L 17%
Smethadone Cmin 1 26% _/
(ức chế CYP3A4/5)
điều trị với VICTRELIS nhằm
bảo toản tác dụng lâm sảng
của methadone.
Kháng viêm khỏng sieroiơ (NSA/Ds)
Difiunisal
(diflunisal 250 mg ngảy 2
lần +
VICTRELIS 800 mg ngảy
hai hoặc ba lần)
boceprevir AUC l 4%
boceprevir Cmax J 14%
boceprevirCmin 1 31%
Không cần điều chinh liều
VICTRELIS hoặc diflunisal.
lbuprofen
(ibuprofen 600 mg ngảy 3
lần + VICTRELIS 400 mg
đơn liều)
boceprevirAUC 1 4%
boceprevir Cmax T 6%
boceprevir Cmin — không áp đụng
Không cần điều chỉnh Iiều
VICTRELIS hoặc ibuprofen.
CHỐNG TRĂM CẢM
Escitalopram
(escitalopram 10 mg đơn
Iiều + VICTRELIS 800 mg
ngảy 3 lần)
boceprevirAUC i 9%
boceprevir Cmax 1 2%
escitalopram AUC J 21%
escitalopram Cmax & 19%
Nồng độ của escitaiopram bị
giảm nhẹ khi dùng cùng lúc
với VICTRELIS. Các thuốc Ức
chẽ tái hấp thu serotonin chọn
lọc như lả escitalopram có chỉ
định rộng rãi nhưng liều dùng
có thể cần hiệu chỉnh khi kẽt
hợp với VICTRELIS.
CẢC THUỐC CHẸN KỀNH CANX/
Các thuốc chẹn kênh canxi
Tương tác chưa được nghiên cứu
Nồng độ trong huyết tương
15
MK3034— VNM-2013-006076
Ref : S-C CDS-MK3034—CP~OI 201 4
Thuốc theo linh vực điều trị Tương tảc* Khuyến cảo Iiên quan đẽn
(cơ chế tác dụng dược còng nhận. đíều trị phối hợp
nếu biểt)
như của các thuốc chẹn kênh canxi
amlodipine, diltiazem,
felodipine, nitrardipine,
nifedipine, nisoldipine,
verapamil
có thể tăng khi
dùng cùng với VICTRELIS.
yến cáo thận trọng vả theo
Jdõi lâm sảng bệnh nhân
16
MK3034- VNM-ZOI3-Ủ0óO7ớ
Ref. : S-C C DS—MK3 034-C P-O] 20] 4
Thuốc theo iinh vực điều trị
Tương tác*
(cơ chế tác dụng được công nhận,
nếu biểt)
Khuyến cáo iiên quan đến
điều trị phối hợp
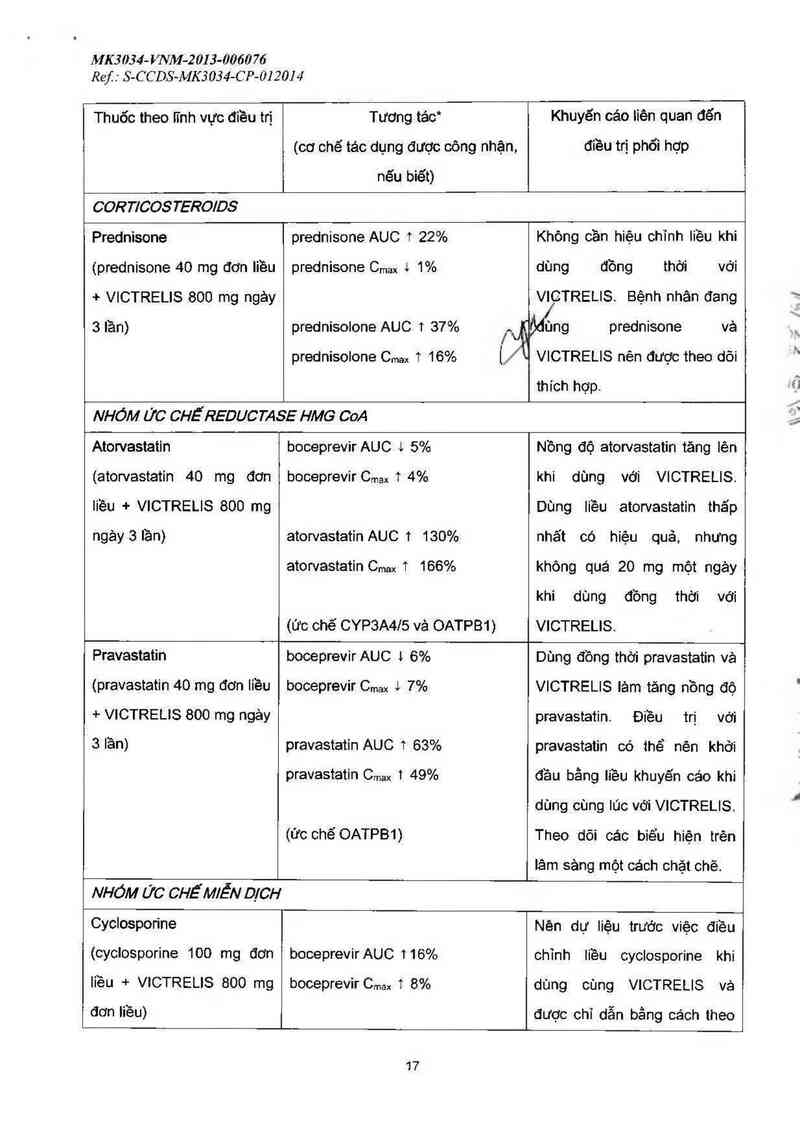
COR T1008 TERO/DS
Prednisone
(prednisone 40 mg đơn Iiều
+ VICTRELIS 800 mg ngảy
3 lần)
prednisone AUC 1 22%
prednisone Cmax l 1%
prednisolone AUC 1 37%
Ở
prednisolone Cmax 1 16%
Không cần hiệu chinh liều khi
đùng đồng thời với
VICTRELIS. Bệnh nhân đang
f ùng prednisone vả
VICTRELIS nên được theo dõi
thich hợp.
NHÓM ỬC CHẾREDUCTASE HMG CoA
Atorvastatin
(atorvastatin 40 mg đơn
liều + VICTRELIS 800 mg
boceprevir AUC l 5%
boceprevir Cmax 1 4%
Nồng độ atorvastatin tãng lên
khi dùng với VICTRELIS.
Dùng liều atorvastatin thấp
ngảy3 lần) atorvastatin AUC 1 130% nhất có hiệu quả, nhưng
atorvastatin Cmax 1 166% không quá 20 mg một ngảy
khi dùng đồng thời với
(Ức chế CYP3A4IS vả OATPB1) VICTRELIS.
Pravastatin boceprevir AUC 1 6% Dùng đồng thời pravestatin vả
(pravastatin 40 mg đớn liều
+ VICTRELIS 800 mg ngảy
3 lần)
boceprevir Cmax t 7%
pravastatin AUC 1 63%
pravastatin Cmax 1 49%
(ức chế OATPB1)
VICTRELIS Iảm tăng nồng độ
pravastatin. Điều trị với
pravastatin có thể nên khởi
đầu bằng liều khuyến cáo khi
dùng cùng lúc với VICTRELIS.
Theo dõi các biểu hiện trẻn
lâm sảng một cách chặt chẽ.
NHỎM ức CHẾMIỄN DJCH
Cyclosporine
(cyclosporine 100 mg đơn
Iiều + VICTRELIS 800 mg
đơn liều)
boceprevir AUC 1 16%
boceprevir Cmax 1 8%
Nên dự liệu trước việc điều
chinh liều cyclosporine khi
dùng cùng VICTRELIS vả
được chỉ dẫn bằng cách theo
17
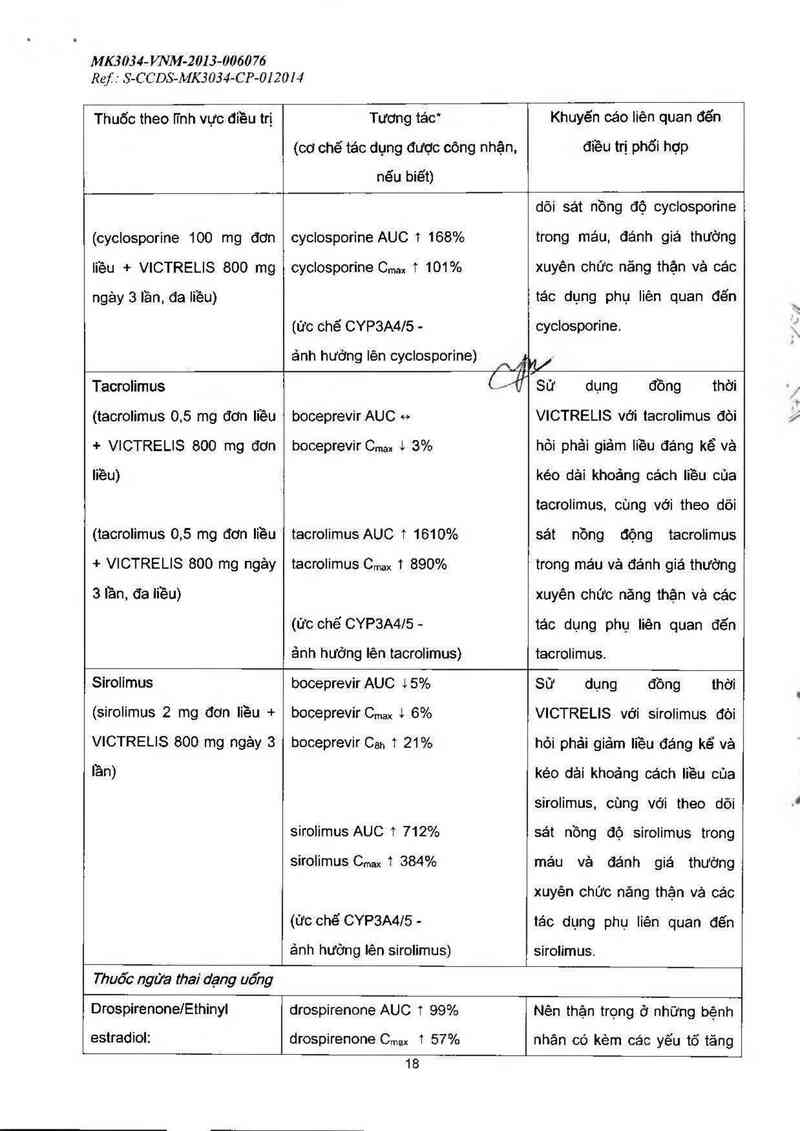
MK303 4-WVM-2013—006076
Ref : S-C C DS-MK3 034-CP-01 201 4
Thuốc theo iỉnh vực điều trị
Tương tác*
(cơ chế tác dụng được công nhận,
nếu biết)
Khuyến cáo liên quan đến
điều trị phối hợp
(cyclosporine 100 mg đơn
liều + VICTRELIS 800 mg
ngảy 3 lần. đa Iiều)
cyclosporine AUC 1 168%
cyclosporine Cmax 1 101%
(Ức chẽ CYP3A4IS -
anh hương Ien cyclosponne) A.Ắ
dõi sát nồng độ cyclosporine
trong máu, đánh giả thường
xuyên chức năng thận và cảc
tác dụng phụ liên quan đến
cyclosporine.
KV
Tacrolimus
(tacrolimus 0.5 mg đơn liều
+ VICTRELIS 800 mg đơn
liều)
(tacrolimus 0,5 mg đơn liều
+ VICTRELIS 800 mg ngảy
3 lần, đa iiều)
CÁf
boceprevir AUC e
boceprevir Cmax t 3%
tacrolimus AUC 1 1610%
tacrolimus Cmax 1 890%
Sử dụng thời
VICTRELIS với tacrolimus đòi
đồng
hòi phải giảm liều đáng kể và
kéo dải khoảng cách Iiều của
tacrolimus, cùng với theo dõi
sát nồng động tecrolimus
trong máu và đánh giả thường
xuyên chức năng thặn vả các
(ức chế CYP3A4IS- tác dụng phụ Iiên quan đẽn
ảnh hưởng lên tacrolimus) tacrolimus.
Sirolimus boceprevir AUC 4 5% Sử dụng đồng thời
(sirolimus 2 mg đon liều +
VICTRELIS 800 mg ngảy 3
lần)
boceprevir Cmax & 6%
boceprevir 01311 1 21%
sirolimus AUC 1 712%
SirOlimus Cmax 1 384%
(ức chế CYP3A4/5 -
ảnh hướng lên sirolimus)
VICTRELIS với sirolimus đòi
hỏi phải giảm liều đáng kể vả
kéo dải khoảng ca'ch liều của
sirolimus, cùng với theo dõi
sát nồng độ sirolimus trong
mảu và đánh giả thường
xuyên chức năng thận vả các
tảo dụng phụ liên quan đẽn
sirolimus.
Thuốc ngửa thai dạng uống
Drospirenone/Ethinyl
estradiol:
drospirenone AUC 1 99%
drospirenone Cmax 1 57%
Nên thận trọng ở những bệnh
nhân có kèm các yếu tố tăng
18
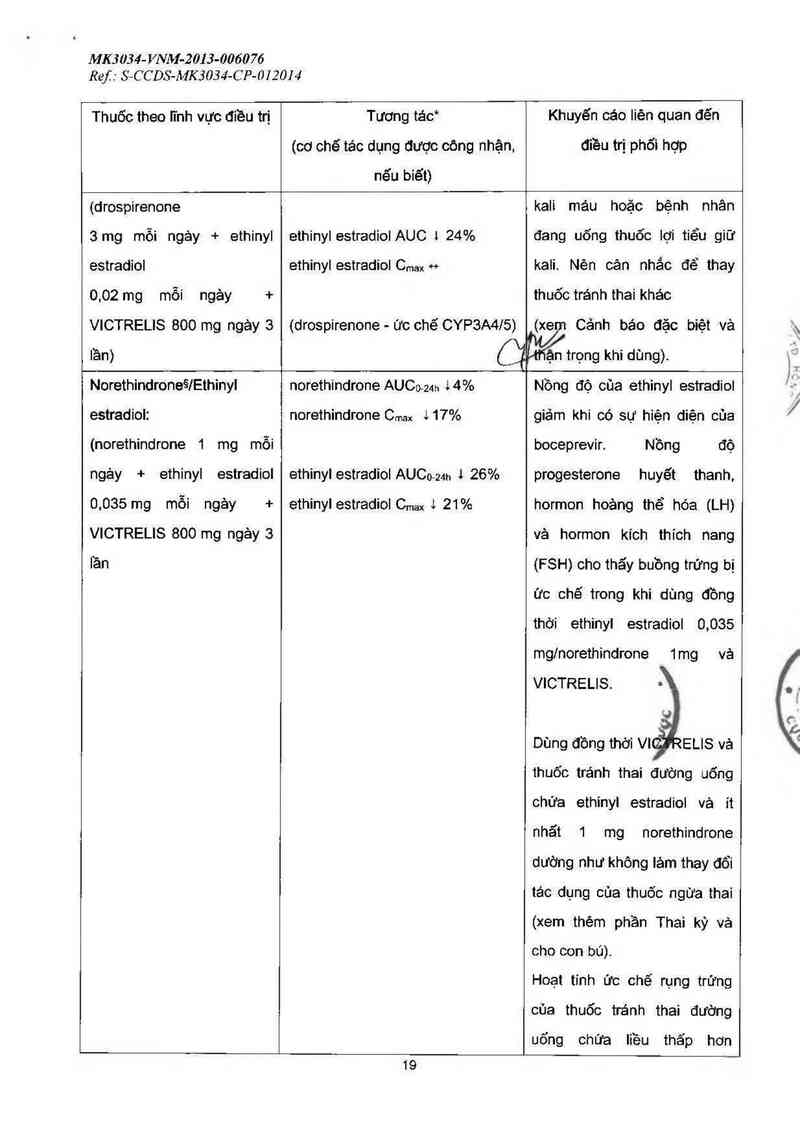
MK 3 034- VNM-2 013-0060 76
Ref : S—CCDS-MK303—í-CP-(JÌ2OJ4
Thuốc theo lĩnh vực điều trị
Tương tác*
(cơ chế tảo dụng được công nhận.
nếu biết)
Khuyến cáo liên quan đẽn
điều trị phối hợp
(drospirenone
3mg mỗi ngảy + ethinyl
ethinyl estradiol AUC I 24%
kali máu hoặc bệnh nhân
đang uống thuốc lợi tiểu giữ
estradiol ethinylestradiolCmaxw kali. Nên cân nhắc để thay
0,02 mg mỗi ngảy + thuốc tránh thai khác
VICTRELIS 800 mg ngảy 3 (drospirenone - ức chế CYP3A4/S) (xe Cảnh báo đặc biệt vả
lần) Cậổẳểrọng khi dùng).
Norethindroneẳ/Ethinyl norethindrone AUCO-24h l4% Nồng độ cùa ethinyl estradiol
estradiol: norethindrone Cmax i17% giảm khi có sự hiện diện của
(norethindrone 1 mg mỗi
ngảy + ethinyl estradiol
0,035 mg mỗi ngảy +
VICTRELIS 800 mg ngảy 3
lần
ethinyl estradiol AUCo-ụh 1 26%
ethinyl estradiol Cmax 1 21 %
boceprevir. Nồng độ
progesterone huyết thanh,
hormon hoảng thể hóa (LH)
vả hormon kích thích nang
(FSH) cho thấy buồng trứng bị
ức chế trong khi dùng đồng
thời 0,035
ethinyl estradiol
mg/norethindrone vả
VICTRELIS.
1mg
Dùng đồng thởi VI 'J ELIS vả
thuốc tránh thai đường uống
chửa ethinyl estradiol và ít
nhãt 1 mg norethindrone
dường như không lảm thay đổi
tác dụng của thuốc ngừa thai
(xem thêm phần Thai kỳ và
cho con bú).
Hoạt tính ức chế rụng trứng
của thuốc tránh thai đường
uống chứa liều thẩp hơn
19
MK3034- VNM-ZOIJ-OOÓO7Ó
Ref. : S-C CDS-MK3034-C P-OI 2014
Thuốc theo iỉnh vực điều trị
Tương tác*
(cơ chế tảo dụng được công nhận.
nếu biết)
Khuyến cáo Iiên quan đê’n
diều trị phối hợp
norethindrone vả cảc dạng
tránh thai bằng hormon khác
trong giai đoạn kết hợp dùng
Vic elis chưa được biết đến.
_nh nhân sử dụng các
estrogen như Iiệu pháp thay
thế hormon phải được theo dõi
lâm sảng với các dấu hiệu
thiếu hụt estrogen.
NHỎM ức CHẾBOM PRO TON
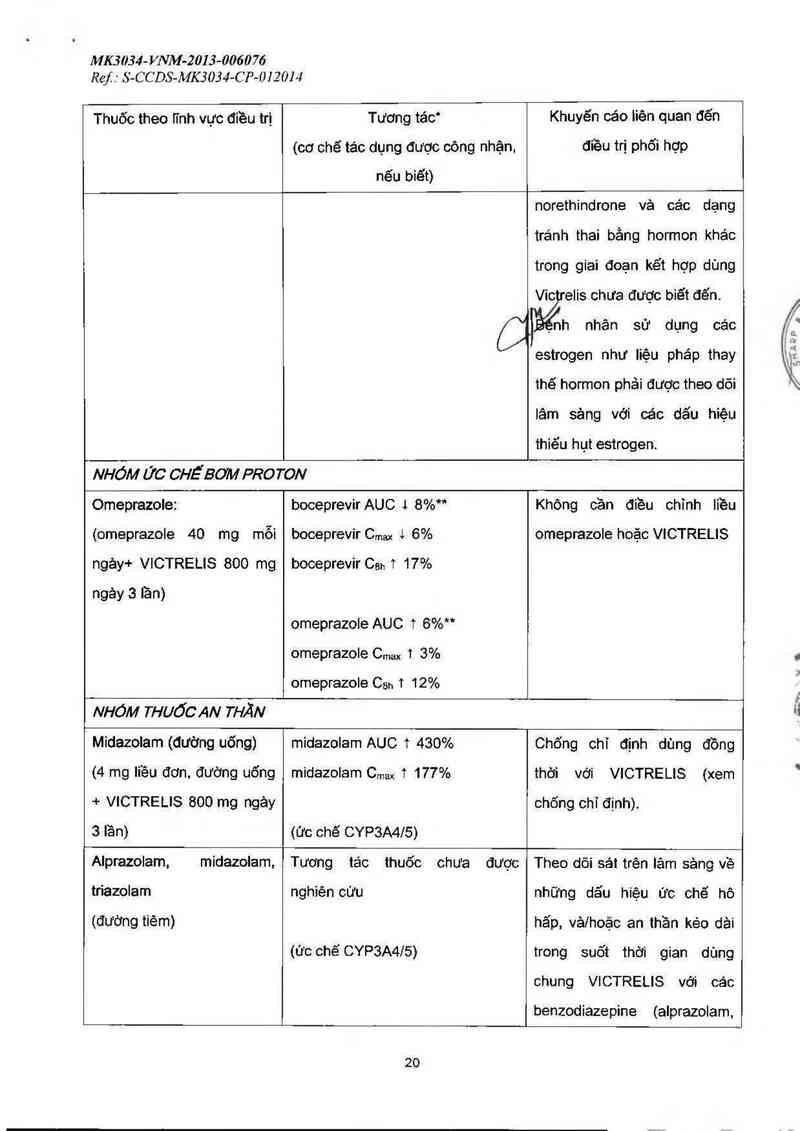
Omeprazoie: boceprevir AUC 1 8%” Không cần điều chỉnh liều
(omeprazole 40 mg mỗi
ngảy+ VICTRELIS 800 mg
boceprevir Cmax i 6%
boceprevir Ceh T 17%
omeprazole hoặc VICTRELIS
ngảy 3 lần)
omeprazole AUC t 6%"
omeprazole Cmax 1 3%
omeprazole Cgh 1 12%
NHÓM THUỐCAN THĂN
Midazolam (dường uống)
(4 mg liều đơn, đường uống
+ VICTRELIS 800 mg ngảy
3 lần)
midazolam AUC T 430%
midazolam Cmax T 177%
(ức chế CYP3A4I5)
Chống chỉ dịnh dùng đồng
VICTRELIS (xem
chõng chỉ định).
thời với
Alprazolam, midazolam,
triazolam
(đường tiêm)
Tương tác thuốc chưa dược
nghiên cứu
(ức chế CYP3A4/õ)
Theo dõi sát trên lâm sảng về
những dẩu hiệu ức chế hô
hăp, vảlhoặc an thần kéo dải
trong suốt thời gian dùng
chung VICTRELIS với các
benzodiazepine (alprazolam,
20
MK3034- WVM-2013-006076
Ref. : S-CCDS-MK3034-CP-012014
Thuốc theo rỉnh vực điều trị
Tương tác*
(cơ chế tác dụng dược công nhận,
nếu biết)
Khuyến cảo liên quan đến
diều tri phối hợp
midazolam, triazolam) tiêm
tĩnh mạch. Nên xem xét việc
ớ
'” chỉnh Iiều
énzodiazepine.
* Tương tác giữa VICTRELIS với các thuốc khác (thay đổi ước tính tỷ lệ trung binh của VICTRELIS
phối hợp với các thuốc kháchCTRELIS dùng một mình): l chỉ sự giảm ước tính tỷ lệ trung bình;
1 chỉ sự gia tăng ước tinh tỷ lệ trung bình; « chỉ sự khòng thay đổi
** o-a giờ
0-12 giờ
**“ Được so sánh với các chứng cũ
1 0-168 giờ
=Auc ghi nhận là 200 mg và 400 mg nhóm kết hợp
ẽNorethisterone lả tên thay thế cho norethindrone.
THAI KÝ VÀ CHO CON BÚ
Khả nảng sinh sản
Chưa có dữ liệu về ảnh hưởng cùa VICTRELIS đến khả năng sinh sản. Dữ liệu có sẵn về dược lực
học/độc tính ở chuột cho thấy ảnh hưởng của VICTRELIS đến khả năng sinh sản, ảnh hưởng đến
con cái là có hồi phục (xem phần Dữ Iiệu an toản tiền lâm sảng)
Thai kỳ
Chưa có cảc nghiên cứu đầy đủ vả kiểm soát tốt ở những phụ nữ mang thai dùng VICTRELIS.
Phụ nữ có khả năng mang thai chỉ nẻn được điều trị khi sử dụng biện pháp tránh thai hiệu quả.
Chưa quan sát thấy ảnh hưởng đẽn khả nảng phát triển của thai ở chuột và thỏ (xem phần Dữ liệu
an toản tiền lâm sảng).
Chống chỉ định dùng VICTRELIS phối hợp với ribavirin vả peginterferon alfa ở những phụ nữ đang
mang thai (xem Chổng chỉ định).
Tham khảo Thông tin sản phẩm cùa peginterferon aifa vả ribavirin để có thêm thỏng tin.
21
MK3034-WM-2013-006076
Ref : S—CCDS-MK3034-CP-OI2OM
Cho con bú
Dữ Iiệu hiện có về dược lực học/độc tính ở chuột cho thấy sự Dải tiết của boceprevirldẫn xuất
boceprevir trong sữa (xem phần Dữ liệu an toản tiền lảm sảng).
Chưa loại trừ nguy cơ đối với trẻ mới sinhltrè nhỏ.
Cần cân nhắc đẽn iợi ích của việc cho trẻ bú mẹ hoặc lợi ich của điều trị đối với người mẹ khi
quyết định ngừng cho con bú hoặc ngừngltránh điều trị với VICTRELIS .
ẢNH HUỞNG ĐỂN KHẢ NĂNG LÁ! xe vA VẬN HÀNH MÁY
Chưa tiến hánh nghiên cửu về ảnh hưởng của VICTRELIẺV i hợp với peginterferon alfa vả
ribavirin đến khả nảng lái xe và vận hảnh máy móc. Tuy nhiên, một vải tảo dụng phụ đă được báo
cáo có thể ảnh hưởng đẽn khả năng lái xe và vận hảnh mảy móc của bệnh nhán. Đáp ửng vởi
VICTRELIS phối hợp peginterferon alfa vả ribavirin có thể khác nhau ở mỗi bệnh nhân. Bệnh nhân
nên được thông bảo rằng mệt mỏi vả chóng mặt đã được ghi nhận (xem Tác dụng không mong
muốn).
Tham khảo Thông tin sản phẩm của peginterferon alfa vả ribavirin để có thêm thông tin.
TÁC DỤNG KHÔNG MONG MUỐN
Trong 3 nghiên cứu lâm sảng chính (2 thử nghiệm lâm sảng trên những bệnh nhân chưa từng
điều trị trước đây và 1 thử nghiệm lâm sảng trên những bệnh nhân đã bị thất bại với điều trị trước
đó), nghiên cửu trên 2095 bệnh nhản trong đó 1508 bệnh nhân được điều trị với boceprevir.
Thòng tin về tính an toản trên 1508 bệnh nhân điều trị phối hợp VlCTRELIS với peginterferon
alfa-2b vả ribavirin được trình bảy ở Bảng 3. Bệnh nhân bị viêm gan C mạn. được điều trị với
VICTRELIS 800 mg ngảy 3 iần kết hợp với peginterferon alfa-2b vả ribavirin. SPRINT-1 (P03523)
đảnh giá việc sử dụng VICTRELIS trong phác đồ phối hợp với Peglntron/REBETOL có và không
có giai đoạn điều trị dẫn nhập 4 tuần với Peglntron/REBETOL so với phác đồ chỉ có peginterferon
alfa-2b vả ribavirin ở những bệnh nhân chưa từng điều trị trước đây. SPRINT-2 (P05216- đối
tượng chưa từng điều trị) và RESPOND-2 (P05101 — đối tượng thẩt bại với điều trị trước đây)
đánh giá việc sử dụng VICTRELIS 800 mg ngảy 3 lần kẽt hợp với peginterferon alfa-2b vả ribavirin
có giai đoạn điều trị dẫn nhập 4 tuần với peginterferon alfa-2b vả ribavirin so với phác đồ chỉ có
peginterferon alia-2b vả ribavirin. Tuổi trung binh của quần thể nghiên cứu lả 49 tuổi (2% đối
tượng lớn hơn 65 tuổi ). 39% nữ. 82% là người da trẳng và 15% lá người da đen. Trong mỗi nghiên
cứu, các đối tượng nhận VICTRELIS 800 mg ngảy 3 lần. Bệnh nhản bị viêm gan C mạn tính được
phản nhóm ngẫu nhiên nhận VICTRELIS trong cả 3 nghiên cứu với thời gian dùng thuốc trung
bình là 201 ngảy .
22
MK3 03 4- WVM-ZIH3-0OóO7õ
Ref: S-CCDS-MK3OJ—í-CP-OIZOM
Các tác dụng không mong muốn được báo cáo thường xuyên nhất tương tự nhau giữa các nhóm
bệnh nhân trong các thử nghiệm. Các phản ứng bất lợi được báo cáo thường xuyên nhăt được các
nghiên cứu viên cho lá có quan hệ nhân quả VỚi việc điều trị phối hợp VICTRELIS với
peginterferon alfa-2b vả ribavirin, bao gồm: mệt mỏi, thiếu máu. buồn nỏn, đau đầu, vả loạn vị
giác.
Trong giai đoạn điều trị dẫn nhập với peginterferon alfa-2b vả ribavirin, 28|1263 bệnh nhân trong
nhớm nhận VICTRELIS xuất hiện tác dụng bất lợi dẫn đến ngưng điều trị. Trong suốt thời gian trị
Iiệu, tỷ lệ bệnh nhân phải ngưng điều trị do phản ửng băt lợi lẤiiu/ốẽlả 13% ở nhớm bệnh nhân
được điều trị với VICTRELIS phối hợp với peginterferon alfa=2b vả ribavirin so Với 12% ở nhóm
bệnh nhân được điều trị chỉ với peginterferon alfa-2b vả ribavirin. Những biển cố dẫn đến phải
ngưng điều trị tương tự như đã được ghi nhận trong ca'c nghiên cứu trước đãy với peginterferon
alfa-2b vả ribavirin. Chỉ ghi nhện thấy thiếu máu và mệt mỏi là biến cố gây ngưng điều trị ở hơn
1% bệnh nhân ở băt kỳ nhóm điều trị nảo.
Những tác dụng bãt lợi dẫn đẽn phải điều chỉnh liều dùng của thuốc đang dùng xảy ra ở 39%
bệnh nhân trong nhóm điều trị phối hợp VICTRELIS với peginterferon alfa-2b vả ribavirin so với
24% bệnh nhân ở nhóm điều trị chỉ với peginterferon alfa-2b vả ribavirin. Lý do thường gặp nhất
cho việc giảm Iiều lả thiêu máu. biến cố xảy ra thường xuyên ở bệnh nhân điều trị phối hợp
VICTRELIS với peginterferon alfa-2b vả ribavirin hơn là ở nhóm được điều trị chỉ với peginterferon
alfa-2b vả ribavirin .
Các tác dụng bẩt lợi liên quan tới mối tương quan nhân quả được bảo cáo với tần suất ỉ 10% số
bệnh nhân được điều trị phối hợp VICTRELIS với peginterferon alfa-2b vả ribavirin; những tác
dụng băt lợi nảy được Iiệt kê theo từng nhóm hệ cơ quan (xem bảng 4). Trong mỗi nhóm hệ cơ
quan, tác dụng bãt lợi được kiệt kê dưới tiêu đề về tần suất với mức phân loại là rất thướng xảy ra
(z1110).
Các phản ứng ngoại ý được báo cáo ở những bệnh nhản dùng phối hợp VICTRELIS" Với
peginterferon alfa-2b vả ribavirin được báo cáo trong các nghiên cữu lâm sảng
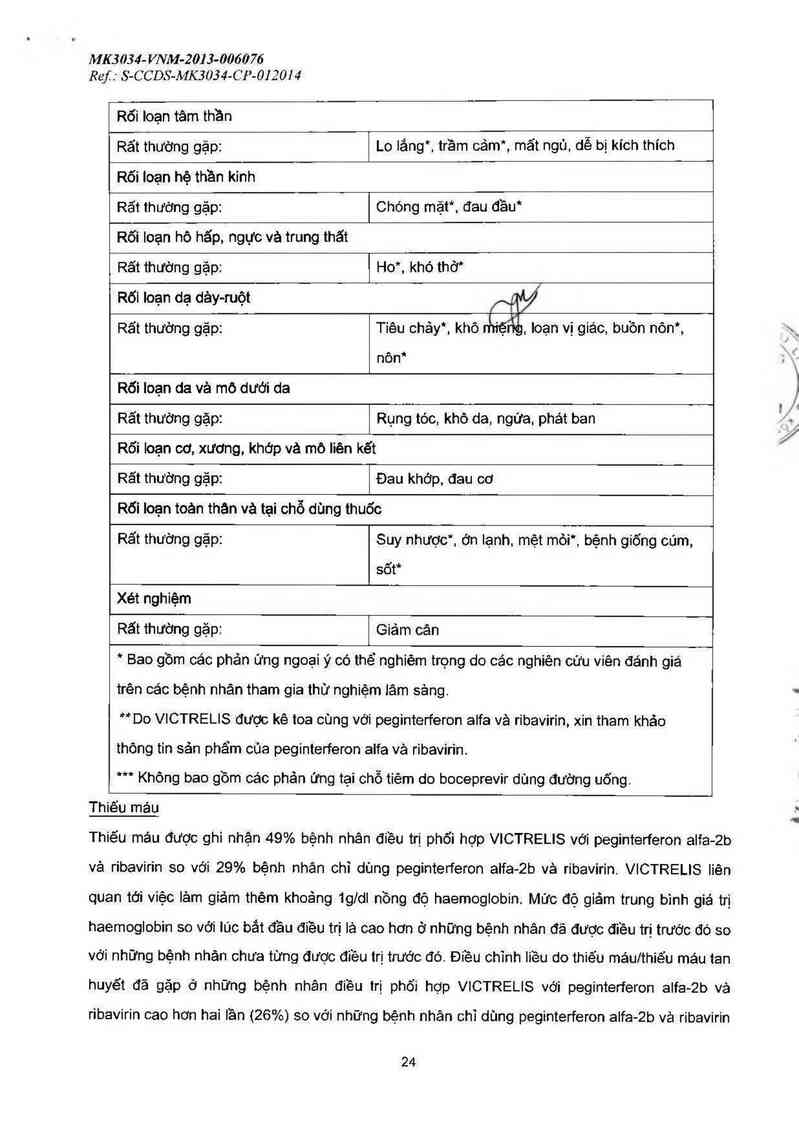
Hệ cơ quan Các phản ửng ngoại ỷ
Rõi Ioạn máu và hệ bạch huyết
Rãt thường gặp: Thiếu mảu', giảm bạch cầu trung tính“
Rối loạn chuyển hóa và dinh dưỡng
Răt thường gặp: Giảm ngon miệng“
23
MK 3 034- VNM-ZOI 3-00607 6
Ref : S—CCDS-MK3034-CP—OIZO14
Rối loạn tâm thần
Rất thường gặp: Lo lăng*. trầm cảm’", mẩt ngủ, dễ bị kích thích
Rối loạn hệ thần kinh
Rãt thường gặp: Chóng mặt”“, đau đầu*
Rối loạn hô hấp, ngực vả trung thất
Rất thường gặp: Ho*, khó thở*
Rối loạn dạ dảy-ruột
Rất thường gặp: Tiêu chảy“. khô ấriệổề, loạn vị giác, buồn nón*,
nôn*
Rõi Ioạn da và mỏ dưới da
Rất thướng gặp: Rụng tóc, khô da, ngứa, phát ban
Rõi loạn cơ. xương. khớp vả mô liên kết
Rất thường gặp: Đau khớp, đau cơ
Rối Ioạn toèn thân và tại chỗ dùng thuốc
Rất thường gặp: Suy nhược”. ớn lạnh. mệt mỏi“, bệnh giống cúm,
sổt*
Xét nghiệm
Rất thường gặp: Giảm cân
* Bao gồm các phản ửng ngoại ý có thể nghiêm trọng do các nghiên cửu viên đánh giá
trên các bệnh nhân tham gia thử nghiệm lâm sảng.
** Do VICTRELIS được kê toa cùng với peginterferon alfa vả ribavirin, xin tham khảo
thông tin sản phẩm của peginterferon alfa vả ribavirin.
*** Không bao gồm các phản ửng tại chỗ tiêm do boceprevir dùng đường uống.
Thiếu máu
Thiếu máu được ghi nhận 49% bệnh nhân điều trị phổi hợp VICTRELIS với peginterferon alfa—2b
vả ribavirin so với 29% bệnh nhân chỉ dùng peginterferon aifa-2b vả ribavirin. VICTRELIS lièn
quan tới việc iảm giảm thẻm khoảng 1g/dl nồng độ haemoglobin. Mức độ giảm trung bình giá trị
haemoglobin so với lúc bắt đầu điều trị là cao hơn ở những bệnh nhân đã được điều trị trước đó so
với những bệnh nhân chưa từng được điều trị trước đó. Điều chĩnh liều do thiếu mảu/thiê'u máu tan
huyết đã gặp ở những bệnh nhân điều trị phối hợp VICTRELIS với peginterferon alfa-2b vả
ribavirin cao hơn hai lần (26%) so với những bệnh nhân chỉ dùng peginterferon alfa-2b vả ribavirin
24
MK3034- VNM-2013-006076
Ref: S—CCDS-MK3034—CP-OIZOM
(13%). Trong những nghiên cứu lâm sảng chinh yếu nảy. kiểm soát thiếu máu thích hợp đi kèm
với việc tiếp tục điều trị và mức đáp ứng virus kéo dải cao hơn. với những người thiếu máu chủ yếu
được dùng erythropoietin. Tỷ lệ bệnh nhân được truyền máu để kiểm soát thiểu mảu là 3% trong
nhóm dùng phối hợp VICTRELIS so với dưới 1% trong nhóm chỉ dùng peginterferon alfa-2b vả
ribavirin.
Bạch cầu trung tỉnh vè tiểu cầu
Tỷ lệ bệnh nhãn giảm số lượng bạch cầu trung tinh và tiểu c . zo hơn trong nhóm dùng phối hợp
VICTRELIS so với nhóm chỉ dùng peginterferon alfa-2b vả rin. 7% bệnh nhân dùng phối hợp
VICTRELIS với peginterferon alfa-2b vả ribavirin có số lượng bạch cầu trung tính <0,5 x1oglL so
với 4% bệnh nhân chi dùng peginterferon alfa-2b vả ribavirin. 3% bệnh nhãn dùng phối hợp
VICTRELIS với peginterferon alfa-2b vả ribavirin có số lượng tiểu cầu <50 x 10°]L so với 1% bệnh
nhân chi dùng peginterferon alfa-2b vả ribavirin
Kinh nghiêm hâu măi
Những phản ứng bất lợi sau đây dược báo cáo sau khi thuốc lưu hảnh mả khỏng cần chú ý đến
nguyên nhân.
Nhiễm trùng vả ký sinh trùng: viêm phổi. nhiễm trùng huyết
Rõi Ioạn máu vả hệ bạch huyết: mãt bạch cầu hạt, giảm toản thể huyết cầu (xem Cảnh báo đặc
biệt và thận trọng khi dùng), giảm tiểu cầu
Các rõi loạn về đướng tiêu hóa: loét miệng. viêm dạ dảy
Những rối loạn ở da vả mò dưới da: phù mạch. nổ: mề đay (xem cảnh báo đặc biệt và những thặn
trọng đặc biệt khi dùng); phát ban do thuốc với tăng bạch cầu ải toan vả triệu chứng toản thân (hội
chứng DRESS), phát ban bong vẩy. viêm da dạng bong vẩy, hội chứng Stevens-Johnson. nhiễm
độc da dạng phát ban, nhiễm độc da.
ĐẶC TÍNH DƯỢC LÝ
ĐẶC TÍNH DƯỢC LỰC HỌC
Cơ chế tác động
Boceprevir là chất ức chế protease N83 cùa HCV. Boceprevir gắn vảo serine gây phản ứng của
protease N823 (Ser139) nhờ nhóm chức (alfa)—ketoamide theo liên kết cộng hóa trị có thể thuận
nghịch nhầm ức chế quá trình sao chép virus trong tế bảo chủ bị nhiễm HCV.
Hoạt tính kháng virus trong môi trtỀg cấy tế bảo
Hoạt tính kháng virus của boceprevir được đánh giá trong một xét nghiệm sinh hóa về sự gắn kẽt
chậm chất ức chế N83 protease và trong hệ thống dơn vị sao chép HCV (replicon). Giá trị leo và
25
MK3034-WM-2013-006076
Ref: S-C C DS—MK3 034-CP-01 20] 4
ngo của boceprevir tương ứng khoảng 200 nM vả 400 nM trong mỏi trường nuôi cãy tế bảo 72 giờ.
Mất đơn vị sao chép RNA lả trinh tự đầu tiên xuất hiện trong thời gian điều trị. Việc điều trị với
nồng độ ng0 trong 72 giờ lảm giảm 1-logm số dơn vị sao chép RNA. Điều trị kéo dải Iảm giảm 2-
iogio lượng RNA cho đẽn ngèy 15.
Việc đánh giá sự phối hợp khác nhau boceprevir với interferon alfa-2b gây ức chế 90% sao chép
RNA cho thấy tác dụng cộng lực; không phát hiện bầng chứng về tác dụng hiệp lực bội tảng hoặc
đối kháng.
Đề kháng
Đề kháng boceprevir dược xác định qua các xét nghiệm về sinh hóa và đơn vị sao chép virus.
Hiệu iực của VICTRELIS bị gìảm (giảm 2 - 10 lần) bởi các biến ẾỄ ' o/acid Iiên quan đề kháng
(resistant—associated amino acid variants: RAVs) chủ yếu sau đây: V36M, T54A, R155K vả
V170A. Thuốc mãt hiệu lực (giảm > 50 lần) khi có biến thể amino acid liên quan đề kháng lả
A156T vả A156V. Đáng lưu ý lá đơn vị sao chép virus chứa biến thể A156T lại kém vững bền so
với các đơn vị sao chép chứa các RAV khác. Số lần tăng đề kháng khi có các RAV kép thì gần
bằng với số lần tảng đề kháng khi có RAV riêng lẻ.
Một phân tích tổng hợp từ 2 thử nghiệm lâm sảng giai đoạn III với các đối tượng chưa điều trị trước
vả đối tượng thất bại với trị Iiệu trước đây đã phảt hiện các RAV xuất hiện sau khi vảo nghiên cứu
ở 15% tổng số các đối tượng được dùng peginterferon alfa-2b cùng ribavirin trong 4 tuần, sau đó
dùng VICTRELIS 800 mg ngảy 3 iần phối hợp với peginterferon aifa-2b vả ribavirin. Trong số các
mẫu xét nghiệm được phân tích từ những đối tượng không có đáp ửng virus kéo dải khi điều trị với
VICTRELIS. có 53% trường hợp phát hiện RAV xuất hiện sau khi tham gia nghiên cứu. Các RAV
được phát hiện nhiều nhẩt sau khi tham gia nghiên cứu (> 25% đối tượng) ở cảc đối tượng nảy là
những phần amino acid thay thế V36M (61%) và R155K (68%) ở người nhiễm virus kiểu gen 1a vả
T54A (42%), T54S (37%), A1568 (26%) và V170A (32%) ở người nhiễm virus kiểu gen 1b.
Ở đối tượng dùng VICTRELIS, đáp ứng với interferon (được xác định bằng lượng virus giảm 2 1-
log… vảo tuần điều trị thứ 4) thường gắn liền với sự phát hiện RAV ít hơn. với 6% các đối tượng
nảy có RAV so với 41% đối tượng có RAV với lượng virus giảm < 1-logio vảo tuần điều trị thứ 4
(đáp ứng virus kém).
Ở đối tượng dùng VICTRELIS không đạt đảp ửng virus kéo dải và có mẫu xét nghiệm sau khi
tham gia nghiên cừu được phản tich tìm RAVs, đáp ứng với interferon thường gắn liền với sự phát
hiện RAV ít hơn, với 31% các đối tượng nảy có RAV xuất hiện sau khi tham gia nghiên cứu so với
68% đối tượng có lượng virus giảm < 1'l0910 vảo tuần điều trị thứ 4. Trong một phản tích gộp. sự
26
Ặ\
b“ —~
`-%/f—\
/,
/_
MK3034- VNM-2013-006076
Ref: S—CCDS-MK30ẵ4-CP-OIZOM
có mặt của RAVs lúc tham gia nghiên cứu (trong số 7% bệnh nhân được điều trị bầng
VICTRELIS) dường như không Iièn kẽt đáng kể với đảp ứng điều trị ở đối tượng dùng VICTRELIS
phối hợp với peginterferon alfa-2b vả ribavirin.
Dữ Iiệu từ một nghiên cứu đang tiển hảnh, theo dõi trong thời gian dải ở những bệnh nhân không
đạt được SVR với thời gian theo dõi trung bình đến 2 năm gợi ý RAV sau nghiên cứu dùng
VICTRELIS có thể quay trở lại Ioại hoang dại theo thời gian.
ĐẶC TINH ouợc ĐỌNG HỌC
Hấp thu và sinh khả dụng.
Boceprevir được hẩp thu sau khi uõng với Trnax trung binh là 2 giờ. AUC/ớ trạng thái bền vững,
Cmax vả Cmin đã tảng tương ứng theo tỷ lệ ít hơn liều dùng vả nồnấđ ` uõc trong các cá thể về
cản bản lại trùng khớp khi dùng liều 800 mg vả 1200 mg, gợi ý giảm hẫ'p thu thuốc khi dùng cảc
liều cao hơn. Thuốc it được tich Iủy vả đạt trạng thái bền vững về dược động học sau 1 ngảy với
chế độ liều dùng 3 lần trong ngảy.
Nồng độ thuốc boceprevir ở đối tượng khỏe mạnh chỉ dùng liều 800 mg 3 lần mỗi ngảy được biểu
hiện qua AUC(T) là 6147 ng.hrlml. Cmax lả 1913 nglml, vả Cmin là 90 nglml. Các kẽt quả dược động
học đều giống nhau giữa đối tượng khóe mạnh vả đối tượng nhiễm HCV.
Chưa nghiên cửu sinh khả dụng tuyệt đối của VICTRELIS.
Ành hưởng của thức ăn lên sự hấp thu thuốc qua đường uống
Nên dùng VICTRELIS cùng với thức ăn. Thưc ăn Iảm tăng nồng độ boceprevir được hãp thu đẽn
60% khi dùng thuốc Iiều 800 mg ngảy 3 lần cùng với bữa ản so với khi đùng thuốc lúc đói. Sinh
khả dụng của boceprevir không bị ảnh hưởng bởi bẩt kỳ món ăn (như lá nhiều chất béo so với ít
chất béo) hoặc phải uống thuốc trưởc bữa ăn 5 phút. hoặc trong bữa ăn hoặc ngay sau khi ản
xong.
Phân bố
Boceprevir có thể tich phân bố biểu kỉẻ'n (leF) trung binh khoảng 772 lít ở trạng thái bền vững.
Tỷ iệ gắn kết với protein huyết thanh xấp xỉ 75% sau khi dùng 1 liều đơn VICTRELIS 800 mg.
Boceprevir được phản bố như một hỗn hợp gồm hai thánh phần gần bằng nhau, đó lả hai chẩt
đồng phân khỏng đối quang hoán chuyển nhanh chóng trong huyết tương. Diastereomer chủ yếu
là hoạt chất có tác dụng dược lý vả diastereomer khác lá không hoạt tính.
Chuyển hóa
Các nghiên cửu in vitro cho thấy boceprevir chủ yếu được chuyển hóa thảnh cảc chẩt chuyển hóa
đã khử ketone không có hoạt tính chống HCV qua phản ứng xúc tác với men aldo-ketoreductase
2?
MK3034- WVM-2013—006076
Ref: S-CCDS-MK3034-CP-OI2OM
(AKR). Sau khi uống một liều đơn 14C-boceprevir 800mg. phần lớn ca'c chẩt chuyển hóa lưu hảnh
là hỗn hợp chẩt đồng phân khỏng đối quang của chẩt chuyến hóa đã khử ketone với nồng độ
thuốc trung bình nhiều hơn gấp 4 lần so với boceprevir. Boceprevir cũng được chuyển hóa ở mức
độ ít hơn qua phản ứng oxy hóa bởi CYP3A4IS.
Boceprevir được thải trừ với thới gian bán thải trong huyết tướng trung bình khoảng 3.4 giờ.
Boceprevir có độ thanh thải toản thản (CLIP) trung binh khoảng 161 lítlgiớ. Sau khi uống một liều
đơn 800 mg 14C-boceprevir. khoảng 79% và 9% Iiều dùng được/d á tương ứng qua phân và
nước tiếu, với xấp xỉ 8% vả 3% liều thuốc có chửa cacbon phóng xạ giống như boceprevir được
thải trừ trong phân và nước tiểu. Dữ liệu nảy chứng tỏ boceprevir được thải trừ chủ yếu bới gan.
Đối tượng đặc biệt
Bệnh nhi
Chưa thiết lập tính an toản, hiệu quả vả đặc tính dược động học cùa VICTRELIS ở bệnh nhi dưới
18 tuổi.
Suy gan
Trong một nghiên cứu trên cảc bệnh nhân có suy gan măn tính ổn định ở các mức độ khác nhau
(nhẹ, trung bình vả nặng), không phát hiện bẩt kỳ khác biệt có ý nghĩa lâm sảng về các thõng sổ
dược động học vả không có khuyến cáo chinh liều. Chống chỉ định dùng VICTRELIS phối hợp với
peginterferon alfa vả ribavirin ở bệnh nhân xơ gan có điểm số Child—Pugh > 6 (phân loại B và C)
(xem Chống chỉ định).
Để biết thêm thông tin về sử dụng VICTRELIS ở những bệnh nhân xơ gan cờn bù, xem Cảnh báo
đặc biệt vả thặn trọng khi dùng, mục suy gan
Suy thận
Không ghi nhận khác biệt có ý nghĩa lâm sảng về các thông số dược động học giữa bệnh nhân có
bệnh thận giai đoạn cuối (ESRD) và đối tượng khỏe mạnh. Không cần điều chinh liều ở các bệnh
nhân nảy vả ở các bệnnh nhân bị suy thận ở bất kỳ mức độ nảo.
Giơi'“ tỉnh
Dược động học theo giới tinh được ghi nhận không khác biệt ở các bệnh nhân người lớn tham gia
các nghiên cứu giai đoạn III.
Chủng tộc
Phân tich dược động học cùa VICTRELIS trong quần thể cho thẩy chủng tộc không có ảnh hưởng
rõ rệt lên nồng độ thuốc.
28
MK3034- WVM-2OI 3-01)60 76
Ref: S-CCDS-MK3O3II-CP-OI2OM
Tuổi
Phân tích dược động học của VICTRELIS trong quần thể cho thấy tuổi tác không có ảnh hướng rõ
rệt lên nồng độ thuốc.
DỮ LIỆU AN TOÀN TIỀN LÃM SÀNG
Trong một nghiên cứu in vitro trên bộ sợi Purkinje của chó. boceprevir đả lảm kéo dải thới gian
điện thể hoạt động với sự phụ thuộc tần số nghịch đảo; vẫn chưa biết rõ tầm quan trọng lâm sảng
cùa phát hiện nảy.
Trong các nghiên cứu độc tính với Iiều lặp lại. chuột cống đã có tình tiạng thoái hóa tinh hoản khi
dùng boceprevir với mửc độ phơi nhiễm toản thân thấp hơn sỏ\/ỆVỔ người khi dùng liều điều trị
khuyến cáo. Không nhận thấy tinh trạng nảy khi dùng thuốc ở chư nhắt hoặc ở khỉ.
Một loạt các thử nghiệm in vitro hoặc ín vỉvo, bao gồm thử nghiệm đột biến gen của vi khuẩn, tế
bảo lympho ngoại biền ở người và nhân sinh sản ở chuột nhắt đã cho thấy boceprevir khộng có
độc tính trẻn gen.
Các nghiên cửu kéo dải 2 năm không thấy tác dụng về khả nãng gây ung thư nhưng ghi nhặn có
tăng tỷ lệ mới mẳc u tuyến tế bảo gan ở chuột nhắt ở mức độ phơi nhiễm toản thân cao gấp 5,7
lần so với ở người khi dùng liều điều trị khuyến cáo. Không có ung thư biểu mô hoặc ung thư tuyến
xảy ra ở chuột cống. Các khối u tế bảo gan được cho là do tinh trạng cảm ứng enzyme và do đó
không liên quan đến con người.
Boceprevirlcác chất dẫn xuất từ thuốc nảy được ghi nhận truyền qua sữa của chuột cống mẹ. Mức
độ phơi nhiễm boceprevir ở trẻ nhỏ bú mẹ, theo ước tính chưa đến 1% liều dùng.
Ở chuột cống, boceprevir gây ảnh hưởng có thể phục hồi lẽn khả nảng sinh sản vả sự phát triển
ban đầu của phôi thai khi chuột cõng mẹ dùng thuốc ở mức phơi nhiễm gấp 1,2 lần so với ở người
khi đùng thuốc theo liều điều trị khuyến cáo. Chuột cống đực cũng giảm khả nảng sinh sản, có
nhiều khả năng nhãt là do hậu quả thoái hóa tinh hoản (không nhận thăy thoái hóa tinh hoản ở
chuột nhắt hoặc khi). Không tim thấy khả năng gây hại tiềm tảng cho phỏi thai hoặc gảy quái thai
khi dùng thuốc ở các Iiều gây độc cho chuột cõng mẹ và cả thò mẹ.
Dữ liệu thu thập từ chuột cõng con gợi ý đặc tinh dược động học của boceprevir ở quần thể nảy có
lẽ khéo so với quần thể chuột cống trưởng thảnh, có thể do một vải con đường chuyển hóa chưa
phát triển hoản chĩnh. Chưa có dữ liệu nghiên cứu về nồng độ thuốc ở trẻ em.
QUÁ LIỀU
Liều hảng ngảy 3600 mg dùng trong 5 ngảy ở người tinh nguyện khỏe mạnh không gây các tác
động biểu hiện triệu chứng bãt lợi. Không có thuốc giải độc đặc hiệu cho việc sử dụng quá liều
29
MK3034- VNM—2013-006076
Ref: S-CC DS-MK3 034-CP-01 20] 4
VICTRELIS. Điều trị sử dụng quá liều VICTRELIS nèn bao gồm các biện pháp hỗ trợ. kể cả theo
dõi các dấu hiệu sinh tồn và quan sát tình trạng lâm sảng của bệnh nhân.
HẠN DÙNG
24 tháng kể từ ngảy sản xuất
THẬN TRỌNG ĐẶC BIỆT KHI BẢO QUẢN
Bảo quản trong tủ lạnh (2°C — 8°C) cho tới khi phân phát tới bệnh nhân.
Đối với việc sử dụng ở bệnh nhân, chế phẩm có thể được bảoỊq trong tủ lạnh cho tới khi hết
hạn dùng ghi trên nhản. Chế phẩm cũng có thể được bảo quăn/ hiệt độ phòng (dưới 30°C) trong
vòng 3 tháng. \
Bảo quản thuốc trong bao bì gốc. Ồ \
N ’ i
QUI cAcn ĐÓNG GÓI )
_il
Hộp gồm 4 hộp nhỏ (mỗi hộp nhỏ chửa 7 vì x 12 viên nang cửng).
Bản chất vả thảnh phần trong bao bì
Vi ép polychlorotrifluoroethylene trong lPVC/nhôrn có 3 6. mỗi ô chứa 4 viên nang cứng. Các 6
trong vi được hản kín tránh nhiệt với nảp che có thể bóc ra được.
Thận trọng đặc biệt khi hủy thuốc
Nên hủy bẩt kỳ sản phẩm chưa dùng hoặc phế phẩm phù hợp với yêu cầu của từng nước.
Sản xuất bới: MSD lnternational GmbH (Singapore Branch), 70 Tuas West Drive. 638414
Singapore
Đóng gói bởi: Schering-Plough Labo N.V., lndustriepark 30. 2220 Heist—op-den-Berg. Belgium/Bi
THUỐC KÊ ĐơN
TRÁNH XA TẦM TAY TRẺ EM
ĐỌC KỸ HƯỚNG DẢN sử DỤNG TRƯỚC KHI DÙNG
HÃY HỎI BÁC sĩ ĐỂ BIẺT THÊM THÔNG TIN.
THÔNG BÁO CHO BÁC si TẤT CẢ TÁC DỤNG NGOẠI Ý xAv RA KHI DÙNG THUỐC.
TUQ. cuc TRUỜNG
P.TRUỚNG PHÒNG
Íiỷtgển ›ffllÙợ —Ĩfểìng
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng