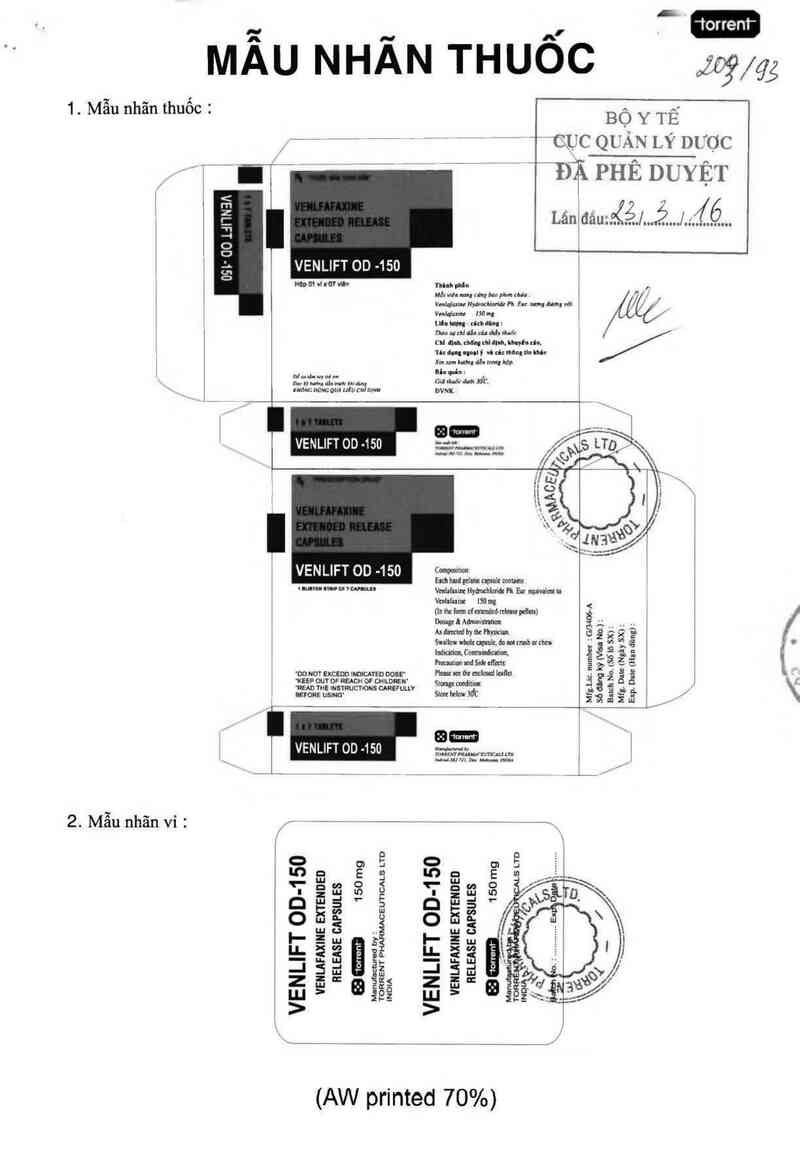








MẦU NHÂN THUỐC
1. Mẫu nhãn thuốc :
2. Mâu nhãn vỉ :
<
…
Z
C
’T1
_.
0
O
.'.ụ
í.h
O
VENLIFT 00 -150
H0p 01 vinđ'lvlln
N…:Anmnơu.
mẹumudnmlmmg
x… uùivc ouA utu cu] um:
JCỷ/ậẻ
BỘ Y TẾ
**TSỤC QL'ẢN LÝ DƯỢC
“1›Ặ PHÊ DUYỆT
Lânđau°ểễlỷlấố
Tlhh phia ,
Mối wh …; mu; bao ph…: d…m` `
v…q… Hydrocth n fu …; mg …
v…ldznn lSOnỵ
Lllu Hn. d:l ùlnl:
n… wmah da M, m…sc
CII au». chđq thi Im, man cu.
n: đunl lpnlỷ vù «: mu; tln iMc
›… nu lutug dJn m…; hop
u. ụẳn :
cu muh … sn'c.
DVNK
’ _ VENLIFT OD-150
e- 7-f=
r.:::……… … 'ÝỄÂẠ'S LTD_
… … … .... . … ,
ẹ,m — _
i'.j LỂJ \
n ° i
²" 4 I
lx ừ
` ốỸ—J gòỒx /
"\ 1 N 1 /
VENLIFT on -1so c……
EJdI hlld geinlm cựnuie cmmm
' …… '… … '…' Velhfuim iiydmchloride u Eur uụivdul …
Wuhiuint i50mg <
(in ihc ímn nfnldidtởttlm pclius) ắ
DoagchAửmmnmn M_-_~_ … __ __
Asd'lixtcdhyúcPlystml. Ở 3 SẺ Q Ex
Swalluv wủlz WIIk.ỔOIIICNSÌIGTCMW " 2 “1 g
induuhm.Calhnđintim Ể ẵ— @ ã
Pm…dSlleelĩccts ễỉ`ẵẻ 15
m NOT Exceno imiqu nose- Pieu: … ihe mckmi ienl'lei u. Ế ẳ 3 i
'KEEP out of REACM OF c…mnew Simgz MM… "J ẩ g Ổ
mo 1nz msmucnous cansruuv ga 8 ủ d. i
aerons usuơ s…hdmồc Ể % ổ Ề ,E \ _
VENLIFT 00 -150
`i
\
150 mg
RELEASE CAPSULES
aw
VENLAFAXINE EXTENDED
Manuínctured by ;
TORRENT PHARMACEUTICALS LTD
INDIA
' VENLIFT oo-1so
WAV
n…znrnuamrtmuu uu
:ủ-uu … n… …… mnu
ũ- \
L
_ ALS LTD
RELEASE CAPSULES
VENLAFAXINE EXTENDED
VENLIFT OD-150
(AW printed 70%)
/””`—`\
VENLIFT 0D 150
Viên nang giẩi phóng kéo dải Venlafaxine......150 mg
CẢNH BÁO ĐẶC BIỆ T:
Thuốc bán theo đơn
Đọc kỹ hướng dẫn sữ dụng trước khi dùng.
Nếu cẩn thêm thông tin, xin hỏi ý kiến bác sĩ.
Xin thông báo cho bão sĩ biết các tãc dụng ngoại ý xây ra trong quá trình sử dụng.
Để thuốc xa tẩm tay trẻ em.
Không dùng thuốc đã quá hạn sử dụng.
THÀNH PHẦN
Mỗi viên nang giãi phóng kéo dâi có chứa: é,
Hoạt chất: ế / /
Venlafaxine hydrochloride Ph.Eur tương đương Venlafaxine ............. 150 mg (dưới dạng hạtạeTlẩ
Tả dược: Sugar Globules (20/30#), HPMC 2910 E15 LV (Hypromellose), Colloidal Silicon
Dioxide (Aerosil 200), Methyl Alcohol , Methylene Chloride, Tale , Ethyl cellulose (45 cps),
Hydroxypropyl methyl cellulose ( HPMC 6 cps), Nang cỡ số “0”, mâu cam, trong suốt.
DƯỢC LỰC HỌC:
Cơ chế tác dụng chống trẳm cãm cũa venlafaxine trên người được cho là liên quan tới khả năng
tác dụng trên hoạt dộng dẫn truyền thẩn kinh ở hệ thẫm kinh trung ương. Các nghiên cứu tiền
lâm săng đã chỉ ra rằng venlafaxine và chất chuyển hóa có hoạt tính cũa nó 0-
desmethylvenlafaxine (ODV) là các chẩt ức chế mạnh sự tái hấp thu serotonin vả
norepinephrine thẩn kinh, ức chế yếu sự tái hấp thu dopamine. Venlafaxine và 0-
desmethylvenlafaxine (ODV) không có ái lực đãng kể đối với cãc thụ thể muscarinic
cholinergic, Hl-histaminergic hoặc l-adrenergic trên in vitro. Tác dụng dược lý tại cãc thụ thể
năy được cho lả có liên quan dến tác dụng phụ khác đã thấy ở các thuốc chống trầm căm khác
như cãc thuốc kháng cholinergic, các thuốc an thẩn, các tác dụng trên tim mạch. Venlafaxine vả
O—desmethylvenlafaxine (ODV) không có tác dụng ức chế monoamine oxidase ( IMAO).
DƯỢC ĐÔNG HỌC:
Trạng thái ổn định nồng độ của venlafaxine vả O-desmethylvenlafaxine (ODV) trong huyết
tương đạt được trong vòng 3 ngăy khi điểu trị đa liều. Venlafaxine vả O-desmethylvenlafaxine
(ODV) cho thấy động học tuyển tính trong khoãng liễu 75 — 450 mglngây. Thời gian bãn thâi
biểu kiến lẩn iượt lả 5i2 vã 1112 giờ, thể tích phân bố biểu kiến (ở trạng thái ổn định) lẩn lượt
lả 7,5 1 3,7 và 5,7 i 1,8 leg. Venlafaxine vã O-desmethylvenlafaxine (ODV) liên kết tối thiểu
(lẩn lượt iă 27% và 30%) với protein huyết tương ở nồng độ điều trị
Hấp thu
Venlafaxine được hấp thu tốt vả chịu chuyển hóa bước đẩu qua gan mạnh. 0-
desmethylvenlafaxine (ODV) là chất chuyển hóa chính duy nhất có hoạt tính. Dựa trên cơ sở
của cãc nghiên cứu cân bằng khối lượng, ít nhất 92% liều đơn venlafaxine dùng đường uống
được hấp thu. Sinh khả dụng tuyệt đối của venlafaxine khoãng 45%.
Uống viên nang giâi phóng kéo dải Veniafaxine (150 mg mỗi 24 giờ) thường cho kết quả Cmax
thấp htýn ( 150 ng/ml đối với venlafaxine và 260 ng/ml đối với O-desmethylveniafaxìne ( ODV))
vã Tmax dăi hơn (5,5 giờ đối với venlafaxine vã 9 giờ đối với O—dcsmethylvenlafaxine (ODV))
so với viên nén giải phóng tức thì venlafaxine (sau khi uổng 75 mg mỗi 12 giờ vìên nén giãi
phóng tức thì venlafaxine, Cmax lã 225 ng/ml đổi với veniafaxine vả 29f ngiml đối với 0-
dcsmethylvenlafaxine (ODV); Tmax là 2 giờ đối với venlafaxine vả 3 giờ đối với 0-
desmethylvenlafaxine (ODV)). Thức ăn không ănh hướng đến sinh khả dụng cũa venlafaxine
cũng như chất chuyển hóa có hoạt tính O-desmethylvenlafaxine (ODV). Thời gian uống (sáng
hay chiều) viên nang giải phóng kéo dâi Venlafaxine 75mg không ảnh hưởng đến dược động
học của venlafaxine vả O-desmethylvcnlafaxine (ODV).
Chuyển hóa và thải trừ
Sau khi hấp thu, venlafaxine trăi qua quá trình chuyển hóa trước hệ tuẩn hoản rộng rãi tại gan,
chủ yếu thảnh O—desmcthylvenlafaxìne và một phẩn thãnh N-desmethylvenlafaxine, N,O-
didesmcthylvenlafaxine vả các chất chuyển hóa khăc. Các nghiên cứu in vitro cho thấy sự hình
thânh của O-desmethyiveniafaxine ( ODV) được xúc tác bới CYP2D6 điều nây đã được xác nhận
trong một nghiên cứu iâm sảng cho thấy rẵng ở cãc bệnh nhân với mức CYP2D6 thấp (chuyển
hóa yếu) thì nống độ venlafaxine tãng vả nỗng độ O—dcsmethylvenlafaxine (ODV) giăm so với
bệnh nhân có CYP2D6 bình thường (chuyển hóa mạnh). Tuy nhiên sự khác biệt giữa CYP2D6
chuyển hóa hạn hẹp vả rộng rãi không dự kiển tĩnh quan trọng về mặt lâm săng bởi vì tổng
vcnlafaxine vả O-desmethylvenlafaxine (ODV) tương tự như nhau ở cả hai nhóm, venlafaxine
vả O-desmethylvenlafaxine (ODV) cùng có sự tương đương hoạt tính vả hiệu lực xét trên tính
dược lý.
Khoảng 87% liều venlafaxine được tìm thấy trong nước tiểu trong vòng 48 giờ dưới dạng
velafaxine không đổi (5%), O—dcsmethylvenlafaxìne (ODV) dưới dạng không liên hợp (29%),
O-desmethylvenlafaxine (ODV) dạng liên hợp (26%) hoặc một số chất chuyển hóa không có
hoạt tính khác (27%). Do vặy thận lả con đường thăi trừ chủ yểu cũa vcnlafaxine vã các chất
chuyển hóa của nó.
Đối tượng đặc bỉệt
Tuổi tãc và giới tính : Một phân tích dược động học trên 404 bệnh nhân điểu trị với vcnlafaxine
2 lẩnlngây và 3 lẩn/ngảy cho thấy nống độ huyết tương đỉnh ở liều thông thường của
venlafaxine hoặc O-desmethyivenlafaxine (ODV) không bị thay đổi bới tuổi hoặc giới. Do vậy
không cẩn phải chĩnh liễu ở đổi tượng năy.
Chuyển hóa mạnh/yếu của CYP2D6 : Nổng độ huyết tương của venlafaxine ở những người
chuyển hóa yếu của CYP2D6 cao hơn so với người chuyển hóa mạnh cùa CYP2D6. Do AUC
toản phẫn của venlafaxine vả O—desmethylvenlafaxine (ODV) tương tự ở cả hai đối tượng nảy
nên không cẩn phãi chỉnh liều ở cả hai nhóm.
Bệnh gan: Trên 9 bệnh nhân xơ gan, đặc tính dược động học phân bố cũa cã venlafaxine và 0-
desmethylvenlafaxine (ODV) thay đổi đáng kể sau khi uống venlafaxine. Thời gian bán thải của
venlafaxine kéo dăi khoãng 30% và độ thanh thãi giãm khoãng 50% ở bệnh nhân xơ gan so với
người có chức năng gan bình thường. Thời gian bán thãi cũa O—desmethylvenlafaxine (ODV)
kéo dăi khoảng 60% vả độ thanh thãi giảm khoảng 30% ở bệnh nhân xơ gan so với người có
chức năng gan bình thường. Ở bệnh nhân xơ gan nặng độ thanh thãỉ venlafaxine suy giẩm đáng
kể hơn (khoảng 90%) so với người bình thường. Không cẩn chỉnh liền ở bệnh nhân nảy.
Bệnh thận: Trong một nghiên cứu suy thận, thời gian bãn thâi của venlafaxine sau khi uống kéo
dăi khoảng 50% vã độ thanh thăi giãm khoảng 24% ở bệnh nhân suy thận (mức lọc cẩu thận =
10 — 70 mllphút) so với người bình thường. Ở bệnh nhân thấm tách, thời gian bán thải của
venlafaxine kéo dải khoảng 180% và độ thanh thãi giãm khoảng 57% so với người bình thường.
Thời gian bãn thâi cũa O—desmethyivenlafaxine (ODV) kéo dải khoảng 40% mặc dù độ thanh
thâi không đổi ở bệnh nhân suy thận (mức lọc cẩu thận = 10 — 70 mllphút) so với người bình
thường. Ở bệnh nhân thẩm tách, thời gian bán thải của O-desmethylvenlafaxine (ODV) kéo dâi
khoãng 142% và thanh thâi giảm khoảng 56% so với người bình thường. Không cẩn chĩnh liều ởp _
đối tượng bệnh nhân năy.
CHỈ ĐỊNH ĐIỄU TRỊ
Trẫm cãm: Viên nang giãi phóng kéo dăi Venlift 0D (Venlafaxine HCl) được chỉ định điêu trị
bệnh trẩm cãm.
Rối loạn lo âu lan tỏa (GAD): Venlift 0D được chỉ định điều trị rối loạn lo âu lan tỏa được định
nghĩa trong sổ tay hướng dẫn chuẩn đoán vả thống kê các rối loạn tâm thẫn (DSM-IV)
LIÊU LƯỢNG VÀ CÁCH DÙNG
Venlift 0D được uống theo Iiều đơn vảo bữa ăn sáng hoặc tối ở cùng một thời điểm trong ngảy.
Nên nuốt cả viên cùng với nước, không chia liều, bẻ, nhai nãt hay để trong m. ớc.
Liễu khởi đầu
Trầm câm: Đối với hẩu hết các bệnh nhân liếu khởi đẩu là 75 mglngăy, dùng liều đơn. Trong
các đánh giá thử nghiệm iâm săng, hiệu quả của Venlift ở bệnh nhân trầm câm vừa liều khởi
đẩu cũa venlafaxine lả 75mg/ngăy. Ở một số bệnh nhân, liều khởi đẩu là 37,5 mg/ngây trong 1
— 7 ngăy, theo dõi các bệnh nhân mới dùng thuốc trước khi tảng liều lên 75mg/ngăy. Bệnh nhân
không đáp ứng với liều 75mg/ngăy thì hiệu quả có thể đạt được khi tăng liểu tối đa xấp xỉ 225
mg/ngảy. Nếu cẩn tăng liều lên 75mg/ngảy vả thực hiện ngẩt quãng không dưới 4 ngăy vì nổng
độ huyết tương hằng định của venlafaxine vả các chất chuyển hóa của nó đạt được ở hẩu hết
bệnh nhân trong 4 ngảy. Đánh giá hiệu quả trong các thử nghiệm lâm săng, thì việc tăng liều
chuẩn cho phép thực hiện cứ 2 tuẩn một lẩn hoặc hơn với liễu trung bình khoảng 140 — 180
mg/ngảy.
Rối loan lo âu lan tỏa (GADỊ: Hầu hết ở căc bệnh nhân liều khởi đẫu là 75 mg/ngăy, dùng liều
đơn. Đãnh giá hiệu quả lâm sâng trên các bệnh nhân GAD ngoại trú liều khởi đẩu lả 75
mg/ngãy. Ở các bệnh nhân dùng liều 37,5 mg/ngảy trong 4 — 7 ngăy cẩn theo dõi để điều chỉnh
tăng liều 75 mg/ngăy. Mặc dù mối quan hệ liều đãp ứng hiệu quả ở bệnh nhân GAD chưa được
thiết iập rõ rảng trên các nghiên cứu cố định liều nhưng các bệnh nhân chắc chẩn không đáp
ứng với liều khới đẩu 75 mglngảy thì liều hiệu quả tăng tối đa xấp xỉ 225 mg/ngãy. Có thể tăng
liều lên 75 mglngãy nếu cẩn vả thực hiện không dưới 4 ngảy.
Chuyển các bệnh nhân đang dùng viên nén Venlift
Bệnh nhân trẩm cãm đang điều trị với viên nén Venlift có thể chuyển sang Venlift 0D với liễu
tương ứng như từ 37,5 mg x 2 lẩn/ngãy đến 75 mgllẩnlngãy. Tuy nhiên việc điều chỉnh liều ở
từn g bệnh nhân là cấn thiết.
Bệnh nhân suy gan
Giãm thải vả tăng nửa đời thâi trữ ở cả viên nén và viên nang giãi phóng kéo dăi Venlift được
quan sát ở bệnh nhân xơ gan so với người binh thường. Liễu khởi đẩu nên giảm xuống 50% ở
ii
bệnh nhân suy gan trung bình. Do có sự biến đổi thanh thâi nhiễu ở từng bệnh nhân xơ gan, chỉ
định liều rõ rảng cũng cẩn được thực hiện ở một số bệnh nhân.
Bệnh nhân suy thận
Giâm thải vả tăng nữa đời thải trữ ở cả viên nén và viên nang giẳi phóng kéo dăi Venlift được
quan sãt ở bệnh nhân suy thận (GFR = 10 — 70 mL/phút) so với người bình thường. Tổng liều
khỡi đẩu hâng ngăy nên giâm xuống 25 — 50%. Ở bệnh nhân đang điều trị thẩm tãch, thì tổng
liều khới đẩu gìảm xuống 50% và cũng có thể không dùng được thuốc cho tới khi việc thẩm tãch
hoân tất (ít nhẩt trong 4 giờ). Do có sự biến đổi thanh thấi nhiều ở từng bệnh nhân suy thận, ch” …
định liều rõ râng cũng cẩn được thực hìện ở một số bệnh nhân. /ảểó
Người giâ: /
Không điều chinh lìễu gợi ý ở người giả nếu chỉ dựa vảo độ tuổi. Cũng như các thuốc điều trị
trẩm căm hoặc rối loạn 10 lắng chung cẩn thận trọng khi điểu trị ở người giả.
Điều trị duy trì | kéo dải: Cẩn tái đãnh giá theo giai đoạn ở bệnh nhân tiếp tục điều trị với
Venlift 0D có hiệu quã.
Ngưng dùng Venlift 0D: Khi ngưng dùng Venlift 0D sau hơn 1 tuần điều trị thì giảm liều để
giảm thiểu các nguy cơ cũa các triệu chứng ngưng dùng thuốc.
Bệnh nhân đang dùng IMAOs hoặc mới ngừng sử dụng IMAOs: Ít nhất sau 14 ngãy điều trị với
IMAO thì mới được dùng Venlift 0D. Ít nhất sau khi ngưng Venlift 0D 7 ngăy thì mới được điều
trị Với IMAO.
Đường dùng: Đường uống
CHỐNG CHỈ ĐỊNH
Viên nang Venlift 0D được chống chỉ định ở bệnh nhân có tiền sử quá mẫn với Venlafaxine
hydrochloride.
Chống chỉ định sử dụng đồng thời với các thuốc ức chế monoamine oxidase (IMAO) do nguy cơ
tương tác với các thuốc năy. Các tác dụng không mong muốn, đôi khi rất nghiêm trỌng đã được
báo cáo ở bệnh nhân vừa mới ngưng điếu trị bằng IMAO vả bất đẩu dùng Venlafaxine hoặc
ngược lại, do venlafaxine lả chất ức chế tái hấp thu cả norepinephrine vã serotonin nên không
dùng kết hợp venlafaxine với thuốc IMAO, hoặc trong vòng ít nhất 14 ngãy sau khi ngưng dùng
IMAO. Dựa trên thời gian bán thải của Venlafaxine, sau khi ngưng dùng V( nlafaxine ít nhất 7
ngây mới bất đẩu dùng IMAO.
CẨNH BÁO VÀ THẬN TRỌNG
Cảnh báo
Nguy cơ tương tác với IMAO
Các phản ứng nghiêm trọng không mong muốn đã được báo cáo ở bệnh nhân đang điểu trị với
IMAO và chuyển sang Venlafaxine hoặc đang điếu trị với Venlafaxine chuyển sang IMAO do
venlafaxine ức chế tái hấp thu norepinephrine vả serotonin. Không dùng kết hợp Venlift 0D với
IMAO, hoặc ít nhất sau 14 ngăy ngưng dùng Venlafaxine mới chuyển sang dùng IMAO. Dựa
trên nửa đời cũa Venlafaxine, ít nhất 7 ngảy sau khi ngưng dùng Venlafaxine mới chuyển sang
dùng IMAO.
Tăng huyết áp liên tục
Venlafaxine có liên quan đển việc liên tục tăng huyết áp ở một số bệnh nhân. Trong số bệnh
nhân điều trị Với viên nang giẳi phóng kéo dâi Venlafaxine với iiều 75 — 375 mg/ngảy trong các
nghiên cứu trầm căm tiền bán hảng, 3% (19/705) bệnh nhân bị tăng huyết áp liên tục (được xác
)S“ .’.
định là tăng huyết áp tâm trương tư thế nẫm ngửa (SDBP) > 90 mm Hg vả > 10 mm Hgb ở 3
trường hợp điều trị liên tiếp). Trong số các bệnh nhân điều trị với viên nang giãi phóng kéo dăi
Venlafaxine với liều 75 - 375 mg/ngảy trong các nghiên cứu tiền bán hăng thì 0,4% (21476)
bệnh nhân bị tăng huyết áp liên tục.
Trong các nghiên cứu trẩm cãm tiền bán hăng có kiểm soát placebo với viên nang giãi phóng
kéo dải Venlafaxine 75 — 225 mg/ngăy, ở liều cuối cùng thì tăng huyết áp tâm trương quan sát
được trung bình lả 1.2 mm Hg ở nhóm điều trị với venlafaxine so với giãm trung bình 0.2 mm Hg
` . , . 4 ’
ở nhóm điểu trị với placebo. Trong cãc nghiên cứu GAD tiên bán hăng có kiểm soat placebo W
viên nang giãi phóng kéo dăi venlafaxine 75 — 225 mg/ngăy, ở lìều cuối cùng thì tăng huyết ’
tâm trương quan sát được trung bình iă 1.1 mm Hg ở nhóm điều trị với venlafaxine so với giam
trung bình 0.9 mm Hg ở nhóm điều trị với placebo. Việc tăng liên tục SDBP có thể dẫn đến hậu
quả cũa một số phản ứng phụ. VÌ vậy cấn phãi kiểm tra đều đặn huyết áp ở bệnh nhân dùng
Veniift 0D. Đối với bệnh nhân bị tãng huyết iiên tục trong khi đìểu trị với venlafaxỉne hoặc
giãm liều hoặc ngưng dùng thuốc.
Thân trong
Thận trọng chung
Mất ngủ và lo lắng
Điều trị triệu chứng mất ngủ vả lo lắng được bão cão thông thường hơn ở bệnh nhân điểu trị với
viên nang giải phóng kéo dâi venlafaxine so với placebo trong các phân tĩch sâu cũa nghiên cứu
GAD vả trẩm cảm ngắn hạn.
Những thay đổi cảm gỉác thèm ăn và cân nặng
Điểu trị chứng biểng ãn được báo cáo thông thường hơn ở bệnh nhân điểu trị với viên nang giâi
phóng kéo dâi venlafaxine (8%) so với placebo (4%) trong cãc phân tích sâu cũa nghiên cứu
GAD và trầm cãm ngấn hạn. Giãm cân đáng kể, đặc biệt ở những bệnh nhân trầm câm nhẹ cân,
có thể là phãn ứng không mong muốn của việc điều trị với viên nang giăi phóng kéo dăi
veniafaxine.
Kích thích chứng điên cuồng/hưng cẵm nhẹ
Trong suốt các nghiên cứu trẩm cãm tiền bán hăng, chứng điên cuồng hay hưng câm nhẹ xãy ra
ở 0,3% bệnh nhân điều trị với viên nang giãi phóng kéo dâi venlafaxine vả 0,0% với placebo;
trong các nghiên cứu GAD tiền bán hăng, thì 0,0% với venlafaxine vã 0, 5% với placebo. Ở tất
cả các thử nghiệm trầm cảm tiền bán hăng với venlafaxine chứng điên cuồỂ`hay hưng câm
nhẹ xây ra ở 0, 5% bệnh nhân với venlafaxine so với 0% ở nhóm với placebo. iE'rtg điên cuồng
hay hưng câm nhẹ cũng được bão cáo ở một lượng nhỏ bệnh nhân điều trị v thuốc chống
trẩm cảm khác trên thị trường với biểu hiện rối loạn tâm tính. Cũng nhtựồc chông trẫm
câm khác, VENLIFT 0D nên được theo dõi chặt chẽ ở bệnh nhân có sử cũa chứng điên
cuồng.
Động kinh
Cũng như các thuốc chống trẩm câm khác, Venlift 0D cẩn được sử dụng thận trọng ở các bệnh
nhân có tiền sử động kinh và nên ngưng dùng ở bệnh nhân có biểu hiện động kinh tiến triển
Tự tử: Khả năng tự tử tổn tại cố hữu vả liên tục ở người bị trẩm câm cho tới khi bệnh trẫm cãm
thuyên giảm. Cẩn theo dõi chặt chẽ cũng như đi kèm với iiều điều trị khởi đằu ở bệnh nhân có
nguy cơ tự từ cao.
Sử dụng ở bệnh nhân đi kèm với ổm:
Nên sử dụng thận trọng Venlift 0D ở người có bệnh hoặc ở người có thể bị ãnh hưởng đến các
đáp ứng huyết động học và chuyển hóa. Venlafaxine chưa được đánh giá hoặc sử dụng ở các
bệnh nhân có tiền sử bị suy tim xung huyết hoặc bệnh tim không ổn định. Các bệnh nhân có các
chẩn đoán nảy không nằm trong các nghiên cứu iâm sảng mang tính hệ thống trong suốt thử
nghiệm tiền bán hâng cũa venlafaxine.
ẨNH HƯỞNG TRÊN KHẢ NĂNG LÁI XE VÀ VẬN HÀNH MÁY MÓC:
Cũng như các thuốc tác động lẽn thẩn kinh khác, Venlafaxin lảm giảm khả năng tỉnh táo, khả
năng suy nghĩ, vận động, do đó cẩn thận trọng nếu dùng thuốc khi đang iái xe hoặc vận hânh
mãy móc. ' `
TƯỚNG TÁC THUỐC /
Cimetidine: Trong một nghiên cứu ổn định khi uống kết hợp cimetidine vả valafaxine ở người
khỏe mạnh 18 tuổi đều cho kết quả ức chế giai đoạn đẫn chuyển hóa của cả hai thuốc. Thanh
thãi đường uống cũa venlafaxine giãm xuống 43%, AUC vã Cmax tăng khoảng 60%. Tuy nhiên,
kết hợp với cimetidine không gây ãnh hưởng rõ rệt lên dược động học của ODV, một thảnh
phẩn có nhiều trong hệ tuẩn hoăn hơn veniafaxine.
Diazepam: Ở điều kiện ổn định khi uống venlafaxine lSOmg/ngăy, liều đơn diazepam lOmg
không gây ảnh hưởng đển dược động học của venlafaxine cũng như ODV ở 18 bệnh nhân nam
khỏe mạnh. Venlafaxine không gây ãnh hưởng đến dược động học của diazepam hay các chất
chuyển hóa của nó như desmethyldiazepam hoặc không ănh hưởng dến hệ thấu kinh bỡi
diazepam.
Haloperidol: Uống Venlafaxine ở trạng thái ổn định với liễu lSmg/ngảy ở 24 đối tượng khỏe
mạnh lảm giảm tổng thanh thải đường uống (Cl/F) cũa haloperidol liều đơn 2mg xuống 42% dẫn
đến tăng 70% AUC của haloperidol. Thêm vảo đó, Cmax của haloperidoi tăng 88% khi uống kết
hợp với venlafaxine, tuy nhiên nửa đời thăi trừ cũa haloperidol lại không đổi. Cơ chế hoạt động
vẫn chưa được nghiên cứu rõ rảng.
Lithium: Dược động học của venlafaxine khi uống iiều lSOmg/ngăy không bị ãnh hưởng khi kết
hợp với liếu uống Lithium 600mg ở 12 đối tượng nam khỏe mạnh. ODV cũng không bị ãnh
hưởng. Venlafaxine không gây ãnh hưởng đến dược động học của Lithium.
Các thuốc gắn kết cao với protein huyết tương: Veniafaxine không gắn kết cao với protein
huyết tướng, vì vậy uống Venlafaxine 0D ở bệnh nhân đang dùng các thuốc có gắn kết cao với
protein không gây tăng nống độ tự đo cũa cãc thuốc khác.
Các thuốc ức chế CYP2D6: Không cẩn điểu chĩnh liếu khi uống kết hợp venlafaxine với các
thuốc ức chế CYP2D6. Dùng kết hợp veniafaxine với các thuốc điều trị có khả năng gây ức chế
lên cả CYP2D6 vả CYP3A4, các enzyme chuyển hóa ban đẩu đối với venlafaxine vẫn chưa
được nghiên cứu. Vì vậy nên thận trọng khi điều trị kết hợp venlafaxine với các tác nhân gây ức
chế đồng thời lên cả hai hệ enzym nảy. Kết quả nảy đã được khẵng định trong một nghiên cứu
tương tác lâm săng so sánh hiệu quả của venlafaxine với fluoxetine lên CYP2D6 - chất chuyển
hóa trung gian của dextromethorphan vã dextrorphan.
lmipramine: Venlafaxine không ảnh hưởng đến dược động học cũa Imipramine vả 2-OH—
imipramine. Tuy nhiên AUC. Cmax vã Cmin của desipramine tăng khoãng 35% với sự có mặt
của venlafaxine. AUC của 2-OH-desipramine tăng gấp ít nhất 2,5 lẩn (với venlafaxine 37,5 mg,
mỗi 12 giờ) vã 4,5 lẩn (với venlafaxine 75 mg, mỗi 12 giờ). Imipramine không ãnh hưởng đến
p-
xÀC
ỈÍtÍ
\'i
dược động học cũa venlafaxine vả ODV. Việc tăng nồng độ cũa 2-OH-desipramine vẫn chưa
được biểt đến trên lâm sãng.
Rỉsperidone: Dùng Venlafaxine ở trạng thái ổn định với liều lSOmg/ngăy gây ức chế nhẹ lên
CYP2D6 - chất chuyển hóa trung gian của risperidone (khi uống liễu đơn 1 mg) tới các chất
chuyển hóa hoạt tính như 9-hydroxyrisperidone, kết quả là lăm tăng khoảng 32% AUC của
risperidone Tuy nhiên, kêt hợp với venlafaxine không lăm thay đổi đáng kể dược động học cũax IÍ
nữa hoạt tính toân phẫn (risperiđone cộng 9-hydroxyrisperidone).
CYP3A4: Venlafaxine không gây ửc chê lên CYP3A4 trên in vitro. Điểu năy được khẳng định/
trọng các nghiên cứu tương tác lâm sảng in vivo, trong đó venlafaxine không gây ức chế lên
chuyển hóa của một vải chất nến CYP3A4 bao gỗm alprazolam, diazepam vả terfenadine.
Các thuốc hoạt tính CNS: Nguy hại khi sử dụng kết hợp venlafaxine với các thuốc hoạt tính CNS
vẫn chưa được đánh giá (trừ trường hợp các thuốc hoạt tính CNS được để cập ở trên). Do đó, nên
thận trọng khi kết hợp venlafaxine với các thuốc năy.
Điểu trị điện rung: Không có đữ liệu lâm sãng được thiết lập về hiệu quả của điều trị điện rung
kết hợp với viên nang giãi phóng kéo dải Venlift 0D.
SỬ DỤNG CHO PHỤ NỮ CÓ THAI, CHO CON BÚ VÀ TRẺ EM
Phụ nữ mang thai và cho con bú: Không có các nghiên cứu có kiểm soát và đẩy đủ ở phụ nữ
mang thai do các nghiên cứu tái sinh sân trên động vật không phản ánh được đáp ứng trên
người. Chi sử dụng venlafaxine cho phụ nữ mang thai khi thật cẩn thiết. Venlafaxine vả ODV
được bão cáo iă có tiết vảo sữa mẹ. Do nguy cơ cũa một số phãn ứng không mong muốn lên trẻ
đang bú mẹ từ Venlift 0D, nên cân nhẩc giữa nguy cơ và lợi ích giữa việc ngưng hoặc tiếp tục
dùng thuốc khi đang cho con bú. Hiệu quả cũa venlafaxine trong phòng thí nghiệm và việc đáp
ứng trên người vẫn chưa được biết.
Sử dụng ở trẻ nhỏ: Tính an toản và hiệu quả ở bệnh nhân nhi vẫn chưa được thiết lập.
TÁC DỤNG KHÔNG MONG MUỐN.
Các phắn ứng thông thường có Iiên quan đến việc sử dụng venlafaxine (chiếm khoảng 5% hoặc
lớn hớn) vả các phăn ứng chưa được biết ở các bệnh nhân điểu trị với placebo lã hen suyễn, đổ
mồ hôi, buồn nôn, táo bón, bốn chồn, nôn, ngủ lơ mơ, khô miệng, chóng mặt, lo lắng, mờ thị lực,
xuất tinh/đạt cực khoái bất thường vả bệnh liệt dượng ở đản ông. Một so sánh về tỷ lệ phãn ứng
phụ ở liều cố định venlafaxine liều 75,225 và 375 mg/ngăy so với placebo cho thấy sự phụ thuộc
liều cũa hẩu hết một sốphăn ứng phụ thông thường có liên quan đến việc sử dụng venlafaxine.
Tỷ lệ các phân ứng không mong muốn ở thử nghiệm so sánh liều
Phản ứng phu Placebo Venlafaxine Venlafaxine Venlafaxine
' 75 mg/ngăy 225 mg/ngăy 375 mg/ngăy
Tăng huyết áp 1,1% 1,1% 2,2% 4,6%
Buổn nôn 14,1% 32,6% 38,2% 58,0%
Nôn 1,1% 7,9% 3,4% 6,8%
Bồn chồn 0,0% 1,1% 2,2% 4,5%
Giảm libiđo 1,1% 2,2% 1,1% 5,7%
Mất ngủ 9,8% 22,5% 20,2% 13,6%
Đổ mồ hôi 5,4% 6,7% 12,4% 19,3%
QUẢ LIÊU
Trong trường hợp quá liều, nên ãp dụng các trường hợp điếu tti chung với việc quá liều với các
thuốc chống trầm cãm.
Bắn quản: Dưới 3OOC.
DẠNG BÀO CHẾ VÀ QUI cÁcn ĐÓNG GÓI: ' —
Viên nang Venlift 0D được đóng gói trong vi 7 viên, hộp 1 vĩ. /Ảểạ
Tiêu chuẩn chất lượng: Nhã sân xuất. /
Hạn dùng: 36 tháng kể từ ngăy sân xuất.
Số lô sân xuất (Batch No. ) ngăy săn xuât (Mfg. date), haan .date): Xin xem trên nhãn
vỉ vã hộp.
ẵn xuât bởi: í//ỆỪ otípi.`
f.. .
_ % .ẽ' "
. % /
Torrent Pharmaceuttcals Ltd.
\
( ` //
Nhã máy: Indrad—382 721, Dist. Mehsana, India \`_../
Trụ sớ: Torrent House Off Ashram Road, Ahmedabad-SSOOO9, Gujarat, India
Ngãy xem xét lại tờ hưởng dẫn sữ dụng:
03l07/2012
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng