











)… `Aĩ633'
flrmyfflT
i
i
1
l
LABELING
.’ ./'í;a 4 ` \
`.7 -' cc— "_ ' ỄỂ. \\
° oịk 'ợf Se’ìĩoỹđ ry packaging
6ng g 01ư10zaung
DW S'E ElCWD1EI/ề
…n
VELCADE 3,5 MG
Borlezomib 3.5mg
Bot pna liêm lỉnt- mđch
unuquụ" nmnlưnlM …
l ' '… __ Janssen
i ẫ'nẳ' iu'm. W²
°.hum-Chnzms …… MỌp1lo
D E `ùị UIIIVMMIỦUIUIIIỦIMUỈIIỤI)
== \ ổ) ỉ
` 1.0x—1 .5x ULN > 1.5x—3x ULN > 3x ULN
SGOT/AST › ULN Bắt củ Bất cứ Bất cứ
Chữ viết tắt: AST = ASpanate aminotransferase; SGOT = serum glutamic oxaloacctic transaminase; ULN
= trên mửc giởi hạn bỉnh thường
Cách dùng `
VELCADẾE được dùng tiêm tĩnh mạch l iân từ 3-5 _giây qua cathétcr tĩnh mạch ngoại biên hoặc trung
ưong và được trảng bãng dung địch NaCl 0,9% cho môi lân tiêm.
Liệu pháp kết hợp
Liều khuỵến cáo
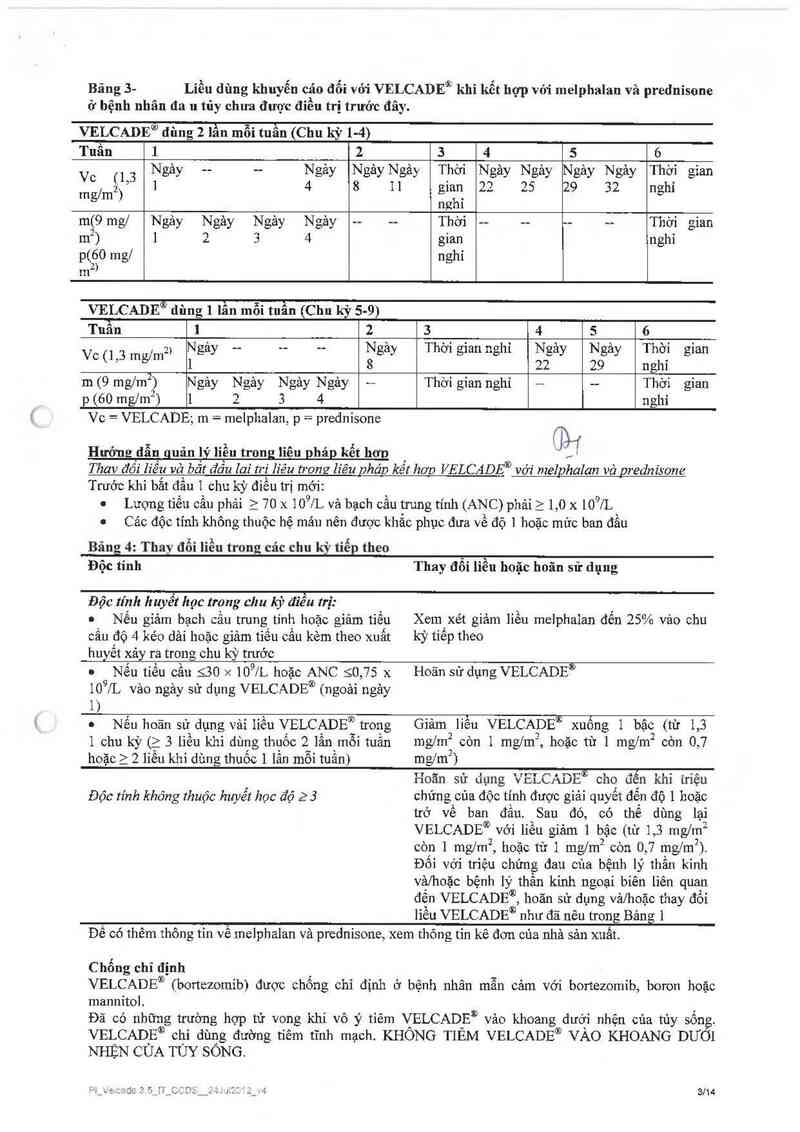
Bảng 3 trình bảy iiệu phảp kết hợp VELCADE® (bortezomib) tiêm tĩnh mạch nhanh liều duy nhất trong
3-5 gỉây, với uống mclphalan vả prednisonc trong 9 chu kỳ điều trị, mỗi chu kỳ kéo dải 6 tuần. Trong chu
kỳ 1-4, dùng VẸLCA_DEỀ 2 lần mỗi tuần (vảo ngảy 1, 4, 8, 11, 22, 25, 29 và 32). Trong chu kỳ 5-9, dùng
VELCADE 1 lân môi tuân (vảo ngảy 1, 8, 22 và 29).
1=1_4c… ? 5_1T_CCDS__ẸMuQOì ;_-…4 2114
Bảng 3- Liều dùng khuyến cáo đổi vói VELCADE® khi kết hợp vởi melphalan vả prednisone
ớ bệnh nhân đa n tủy chưa được điều trị trước đây.
VELCADE® đùng 2 lần mỗi tuần (Chu kỳ 1-4)
Tuần 1 2 3 4 5 6
Vc (] 3 Ngảy -— -- Ngảy Ngảy Ngảy Thời Ngảy Ngảy Ngảy Ngảy Thời gian
2 ’ 1 4 8 11 gian 22 25 29 32 nghi
mglm ) .
nghi
m(9 mg/ Ngảy Ngảy Ngảy Ngảy -- -- Thời -— -- -- -- Thời gian
ml) ] 2 3 4 gian nghỉ
p(60 mg/ nghỉ
m2›
VELCADEỏ dùng 1 lần mỗi tuẫn (Chu kỳ 5-9)
Tuần 1 2 3 4 5 6
2) Ngảy -- -- -- Ngảy Thời gian nghỉ Ngảy Ngảy Thời gian
V“ (1’3 mg/m 1 8 22 29 nghi
m (9 mglm²) Ngảy Ngảy N gảy N gảy —— Thời gian nghỉ — — Thời gian
p (60 ngm²) 1 2 3 4 nghi
Vc = VELCADE; m = melphalan, p = prednisonc
Hưởng đẫn guản lý liền trong liêu pháp kểt hơn %
Thav đồi liều và bắt đầu ch tri Iz'éu nong liêu pháp kết hơn VELCADE® với melphalan vả prednisone
Trưởc khi bắt đầu 1 chu kỳ điều trị mới:
0 Lượng tiếu cầu phải 2 70 x 109/L vả bạch cầu trung tính (ANC) phải ì 1,0 x 109/L
. Các độc tính không thuộc hệ mảu nên được khắc phục đưa về độ 1 hoặc mức ban đầu
Bảng 4: Thay đổi Iiều trong các chu kỳ tiếp theo
Độc tính
Thay đổi liễu hoặc hoãn sử dụng
Độc tính huyết học trong chu kỳ điều trị:
0 Nếu giảm bạch cằu trung tính hoặc giảm tiếu
cầu độ 4 kéo dải hoặc giảm tiều cầu kèm theo xuất
huyết xảy ra trong chu kỳ trưởc
0 Nếu tiểu cầu S30 >< 109/L hoặc ANC 50,75 x
109/L vảo ngảy sử dụng VELCADE® (ngoải ngảy
1)
* Nếu hoãn sử dụng vải Iiểu VELCADEtĩJ trong
1 chu kỳ (2 3 Iiều khi dùng thuốc 2 lần mỗi tuần
hoặc 2 211ều khi dùng thuốc 1 lần mỗi tuần)
Độc tính khỏng thuộc huyết học đó 23
Xemlxét giảm liều meiphaian đến 25% vảo chu
kỳ tiêp theo
Hoãn sử dụng VELCADE®
Giảm liều VELCADỄ® xuống 1 bậc (từ 1,3
mglm2 còn 1 mg/tnẫ hoặc từ 1 mg/m2 còn 0,7
mg/rnz)
Hoãn sứ đụng VELCADEỔỆO đên khi triệu
chứng cùa độc tính được giải quyết đến độ 1 hoặc
trở về ban đầu. Sau đó, có thể dùng lại
VELCADE® với liều gíảm 1 bậc (từ 1,3 mg/m²
còn ] mg/mz, hoặc từ 1 mg/m2 còn 0,7 mg/mz).
Đối với triệu chửng đau của bệnh lý thần kỉnh
vả/hoặc bệnh lý thần kinh ngoại biên liên quan
đến VELCADE®, hoãn sử dụng vả/hnặc thay đồi
liễu VELCADE® như đã nêu trong Bảng 1
Đê có thêm thông tỉn về mclphalan vả prednisone, xem thông tin kê đơn của nhà sản xnầt.
Chống chỉ định
VELCADE® (bortezomib) được chống chỉ định ở bệnh nhân mẫn cảm vởi bortezomib, boron hoặc
mannítol.
Đã có những trường hợp tử vong khi vô ý tiêm \ỉELCAD_Eủ vảo khoang dưóji nhện của tùy sống.
VELCADE® chỉ đùng đường tiêm tĩnh mạch. KHONG TIEM VELCADE® VAO KHOANG DƯOI
NHỆN CÙA TỦY SÔNG.
3114
Lưu ý và thận trọng đặc biệt khi sử dụng
VELCADE4Ị nên được chỉ định dưới sự giảm sảt của bác sĩ có kinh nghiệm trong đỉều trị khảng ung thư.
Nói chung, hồ sơ an toản của bệnh nhân dùng VELCADE® đơn trị liệu tương tự như ở bệnh nhân dùng
VELCADE® kết hợp với melphaian vả prednisone.
Bênh thần kinh ngoai biên
Điều ưị VELCADE® gây ra bệnh lý thần kinh ngoại biên (PN) mả nổi bật lả bệnh lý thần kỉnh cảm gỉảc
ngoại biên. Tuy nhiên, một vải trường hợp được bảo cảo bệnh lý thần kinh vận động trầm trọng có kèm
hoặc không kèm theo bệnh 1ý thần kỉnh cảm giác ngoại biên.
Bệnh nhân có trước những triệu chứng (tê, đau hoặc cảm giảc nóng bòng tay hoặc chân) vâlhoặc các dấu
hiệu đau thần kinh ngoại biên trước đó có thể sẽ bị nặng thêm (bao gồm 2 mức độ 3) trong khi điều trị
bằng VELCADEẾ Bệnh nhân nên được giám sảt cảc triệu chứng đau thần kinh, như là cảm giảc nóng
bỏng, tăng cảm, dị cảm, khó chịu, đau thần kinh hoặc suy kìệt. Bệnh nhân mới bị đau thần kinh ngoại
biên hoặc bị nặng lên có thế cần thay đổi liều và lịch điều trị VELCADE® (xem Liều dùng và cách
dùng). Trong nghiên cứu pha 3 bệnh đa u tủy điều trị đơn trị với VELCADE® so với đexamethasone, sau
khi điều chinh liều, bệnh lý thần kinh ngoại biên đã được cải thiện hoặc giải quyết ở 51% cảc bệnh nhân
với bệnh lý thần kinh ngoại biên 2 độ 2. Trong cảc nghỉên cứu bệnh đa u tủy pha 2, bệnh lý thần kinh
ngoại biên đã được cải thiện hoặc giải quyết ở 73% bệnh nhân đã ngưng điều trị do bệnh iỷ thần kinh độ
2 hoặc những người có bệnh lý thần kinh ngoại biên 2 độ 3. Ở
Hậu quả lâu dải của bệnh lý thần kinh ngoại vi đã không được nghiên cứu trong ư lympho tế bảo mantle.
Ha huvết áp
Trong cảc nghíên cứu đơn trị iiệu giai đoạn 2 vả 3 về đa u tủy, tỳ iệ đối tượng bị hạ huyết ảp (theo mọi tư
thế, theo tư thế đứng và những trường hợp hạ huyết’ ap khảo không được nêu rõ) là 11%-12%
Biến cố nảy xảy ra trong suốt đợt điều trị Nên thận trọng khi đìều trị những bệnh nhân có tiền sử ngất,
bệnh nhân nhận cảc dược phẩm được biết có liên quan với hạ ảp, và những bệnh nhân bị mất nước. Kiểm
soát hạ áp thế đứng có thế bao gôm điều chỉnh thuốc điều trị cao huyết ảp, bù nước, vả/hoặc dùng
mineraiconicoids vả/hoặc cảc chất kich thích thần kinh giao cảm (xem Tảc dụng ngoại ý)
Rối loan trên tim
Sự xuất hiện cấp tính hoặc đợt kịch phát suy tim xung huyết, vả/hoặc đợt mới gìảm phân suất tống mảu
thất trái đã được ghi nhận, kể cả bảo cảo ở những bệnh nhân có vải hoặc không có cảc yếu tố nguy cơ lảm
giảm phân suất tống mảu thất trái. Nên theo dõi chặt chẽ bệnh nhân có yếu tố nguy cơ xuất hiện hoặc
đang có bệnh tim. Trong nghiên cửu đơn trị liệu giai đoạn 3 về đa u tủy sử dụng VELCADE® hay
đexamethasone, tỷ lệ rôi loạn tim mạch do bất kỳ trị liệu sử dụng tương ứng của 2 nhóm lả 15% và 13%.
Tỷ lệ cảc biến có suy tim (phù phối cấp, suy tim, suy tim xung huyết, sôo tim, phù phổi) đều tương tự ở cả
hai nhóm dùng VELCADE® vả dexamethasonc, theo thứ tự iả 5% và 4%. Trong cảc nghiên cứu lâm sảng,
có những trường hợp cá biệt chỉ kéo dải đoạn QT chưa xảc định được nguyên nhân.
Bỉến cổ ở gan
Hiếm gặp cảc trường hợp suy gan cấp ở bệnh nhân dùng cùng lúc nhiều loại thuốc và đang có những bệnh
lý nghiêm trọng khảo. Những rối loạn khảc tại gan được bảo cảo lả tãng cảc men gan, tăng bilirubin mảu
và viêm gan. Những thay đổi nảy có thể trở lại bình thường khi ngưng sử dụng VELCADEẾ Thông tin
về việc sử dụng lại thuốc nảy cho các bệnh nhân trên vân còn hạn chế
Rối loan ở ghôi
Hiếm gặp cảc bảo cảo về viêm phổi thâm nhiễm lan tòa cấp tinh do cảc tác nhân gây bệnh không xảo
định, như iả viêm phối khu trú, viêm phối mô kẻ, thâm nhiễm phối và Hội chứng Suy hô hấp câp (Acute
Respiratory Distress Syndrome: ARDS) ở bệnh nhân dùng VELCADE®. Vải biến có nảy gây chêt người.
Tỷ lệ cảc biến cố nảy xảy ra cao hơn ở Nhật. Nên chấn đoản xác định nhanh chóng và tiên hảnh điêu trị
phù hợp nếu bệnh nhân có các tn'ệu chứng' 0 phổi mới xuất hiện hoặc trở nên xâu hơn.
Pi_xletcađe 3 5_11_CCDS_ỆẢJuiEÙỆ_M 4114
Trong 1 thử nghiệm lâm sảng, có hai bệnh nhân đã tử vong sởm vi hội chứng suy hô hấp cẩp sởm 2trong
quá trinh điều trị bệnh bạch cầu nguyên tủy bảo cấp tính tải phảt bằng cytarabine liều cao (2g/m2 môi
ngảy) truyền tĩnh mạch liên tục cùng vởi daưnorubicin vả VELCADÊíộ
Các xét nghiêm
Nên xét nghiệm thường quỉ thông số huyết đồ (đếm mảu toản phần) trong suốt quá trình điều trị
VELCADE?
Giảm tiếu cầu
Giảm tiểu cầu xảy ra trên 43% bệnh nhân trong suốt quá trình điều trị vả gìảm thấp nhất ở ngảy thủ 1 1 ở
mỗi chu kỳ và trở về mửc ban đầu ở trước chu kỳ kế tiếp. Số lượng tiếu câu giảm ở mỗi chu kỳ và sự
phục hồi dny tri hằng định trong suốt 8 chu kỳ vả không có bằng, chúng cho thấy có giảm tiếu câu tỉch
lũy. Số lượng tiếu câu trung bình khoảng xấp xỉ 40% so với lúc bất đầu điều trị. Mức độ trầm trọng cùa
giảm tiểu cầu iiên quan đến số lượng tiêu câu trước điếu trị trình bảy’ ơ Bảng 5. Trong nghíên cứu đơn ưị
Iiệu giai đoạn 3 vê đa u tùy giữa VELCADẾ"ì so với dexamethasone, Elễf lệ cảc biến có chảy mảu quan
trọng (> độ 3) đều tương đương nhau ở cả hai nhóm dùng VELCADE (4%) và đexamcthasone (5%).
Nên theo dõi lượng tiểu câu trưởc khi dùng mỗi liều VELCADEỂ Nên ngưng trị liệu VELCADE® khi
lượng tiểu cầu < 25. OOO/ịtL và giảm iiều khi dùng lại thuốc (xem Liều lượng, cách sử dụng và Tảc
đụng ngoại ỷ) Có những báo cáo về xuất huyết đường tiêu hóa và xuất huyết não xảy ra khi dùng
VELC.ADE Có thể xem xẻt việc truyền mảu khi có những biến cố nảy.
Bảng 5: Độ nặng của giảm tiểu cầu liên quan đến lượng tỉếu cầu trước khi điều trị, theo nghiên
cứu đưa trị liệu giai đoạn III về đa u tủy giữa VELCADE® so với Dexamethasone
Số lượng bệnh nhân Số (%) bệnh nhân có Số (%) bệnh nhân có
Lượng tiều cần trước (N=331)** iượng tiếu cầu lượng tiền cầu 10 000-
khi điều trị* <10.000ÍụL 25. OOOÍuL
275.000/ụL 309 8 (3%) 36 (12%)
250.000/ị1L- 14 2 (14%) li (79%)
<75.000/ụL CD“J
210.000/ụL- 7 1 (14%) , 5 (71%)
<50 OOO/ụL
*Đê tham gia nghíẽn cửu, lưọng tiêu cầu ban đầu được yêu cầu là 50. 000/,u£
**Mất dữ liệu ban đầu của 1 bệnh nhân
Tác dung phu đuờnE® tiêu hóa
Điều trị VELCADE® có thể gây buồn nôn, tiêu chảy, tảo bón và nôn (xem Tác dụng ngoại ý) thinh
thoảng cần điều trị những thuốc khảng nôn và chống tiêu chảy. Điều trị mắt nước nên dùng dịch thay thế
và dung dịch điện giải. Bởi vì bệnh nhân đíều trị VELCADE® có thế bị nôn hoặc tiêu chảy nên được
khuyên cảc biện phảp thích hợp trảnh mất nước. Bệnh nhân nên được hưởng dẫn cảc thuốc nếu họ bị
choáng váng, đau đầu nhẹ hoặc cảm giảc ngắt
Hôi chửng lv giải khối u
Bởi vì VELCADE® là thuốc độc tế bảo vả có thể tiêu díệt nhanh tế bảo ác tính, biến chứng hội chứng ly
giải khối u có thể xảy ra. Bệnh nhân có nguy cơ bị hội chúng ly giải khối u iả những bệnh nhân có tổng
khối tế bảo ac tính lớn trưởc điều trị. Những bệnh nhân nảy nên được giảm sảt chặt chẽ vả cần thận trọng
thích hợp.
Ở bênh nhân suỵ ga n
Bortczomib được chuyển hóa bởi men gan, nổng độ bortezomib tăng ở bệnh nhân suy gan vừa hoặc nặng.
Những bệnh nhân nảy nên được giảm líều VELCADE® ở liều khởi đầu và theo đôi sát độc tinh. Xem
phần Liều đùng vả cảch sử dụng và Tính chẫt dược động hợc
Hôi chímg bênh não chất trắng có thể phuc hồi ( Reversible Posterior Leukoencephalopathv Svndrome -
RP_LSì.
Có những bảo cảo về RPLS ở bệnh nhân sử dụng VELCADEẾ RPLS là rối loạn thần kinh hiếm gặp, có
thể hồi phục, có thể biểu hiện bằng động kinh, tãng huyết ảp, đau đầu, hôn mê, lú lẫn, mù và những rối
loạn thẩn kinh và thị giảc khảo. Hình ảnh nảo, tôt nhẩt lả MRI (chụp cộng hưởng từ) được dùng để chấn
&
,,
\
ti`
(J
…
1.
f`›
(«
U
En
Ei`J
___4JUi2L1kad 5114
đoản xác định ở bệnh nhân tiến triến RPLS, nên ngừng VELCADEỂ Độ an toản khi điều trị trở lại bằng
VELCADE“D ở bệnh nhân đã từng bị RPLS chưa được biết
Tương tác với cảc dược phẩm khác và cảc dạng tương tác khảc
Nghiên cứu in vitro và nghiên cứu ex vivo trên động vật cho thấy bortezomib là một chất ức chế
cytochrome P450 (CYP) yểu trên cảc isozyme 1A2, 2C9, 2C19, 2D6 vả 3A4. Dựa trên tỉ lệ thấp (7%)
CYP2D6 tham gia trong quả trinh chuyền hóa bortezomib, chẳt chuyền hóa yếu dạng CYP2D6 được coi
như không ảnh hưởng đến sự chuyển hóa chung cùa bortezomib.
Một nghiên cứu về tương tác thuốc-thuốc đảnh giả ảnh hưởng của ketoconazole, chất ức chế CYP3A4
mạnh, trên dược động học của bortezomib, đã cho thấy diện tich dưới đường cong (AUC) cùa bortezomib
tăng trung bình 35%, theo dữ liệu từ 12 bệnh nhân. Do đó, bệnh nhân cần được theo dõi chặt chế khi được
chỉ định bortezomíb phối hợp với cảc chât ức chế CYP3A4 mạnh (như ketoconazole, ritonavir)
Trong một nghiên cứu tương tảc thuốc-thuốc đảnh giả ảnh hưởng cùa omeprazole, một chất ức chế
CYP2CI9 mạnh trên dược động học của VELCADEỀ kểt quả cho thấy không có ảnh hưởng đảng kể trên
dược động học của bortezomib, theo đữ liệu từ 17 bệnh nhân.
Trong một nghíên cứu tương tác thuốc-thuốc đánh giá ảnh hưởng của rifampicin, là một chất kích thích
CYP3A4 mạnh, trên được động học cùa VELCADE®, kết quả cho thấy diện tích dưới đưòng cong (AUC)
trung bình của bortezomib giảm 45%, theo dữ liệu từ 6 bệnh nhân. Do đó, không khuyến cảo việc dùng
VELCADE® cùng với các chất kích thích CYP3A4 mạnh bởi vì có thể lảm giảm hiệu quả VELCADE. Ví
dụ cảc chất kích thích CYP3A4 mạnh như rifampicin, carbamazepine, phenytoin, phenobarbital và St.
John’ s Wort. Trong một nghiên cứu tương tảc thuốc-thuốc giông như vậy, hiệu quả của dexamethasone,
một chất kích thích CYP3A4 yêu hơn đã được đánh giá. Kết quả cho thấy không có ảnh hưởng đáng kể
trên dược động học của bortezomib, theo dữ iiệu từ 7 bệnh nhân.
Một nghiên cứu về tương tác thuốc đảnh giả tác động của melphalan-prednisone lên VELCADE® đã cho
thấy AUC trung bình của bortezomib tăng 17%, dựa theo dữ liệu từ 2] bệnh nhân. Sự gia tăng nảy được
xem không liên quan đến lâm sảng
Trong cảc nghiên cứu lâm sảng, hạ đường huyết được báo cảo ở những bệnh nhân tiều đường điều trị
bằng thuốc hạ đường hu uẵết dạng uỏng Bệnh nhân đang dùng thuốc điều trị tiếu đường dạng uống khi
điều trị bằng VELCADE can phải giảm sảt chặt chẽ nông độ glucose trong mảu vả điều chinh liều thuốc
điều trị tiếu đường
Bệnh nhân nên lưu ý thận trọng sử dụng cảc thuốc phối hợp có liên quan đển bệnh đau thần kinh ngoại
biên (như lá amiodarone, khảng virus, isoniazid, nitrofurantoin hoặc statin) hoặc với thuốc lảm hạ huyết
ảp.
Tương tảc cảc xét nghỉêm thuốc Oầhi
Chưa được biết
Phụ nữ có thai và cho con bú
Phụ nữ có khả năng mang thai nên tránh có thai trong lức điếu trị bằng VELCADEỔ
Chưa có nghiên cửu bortezomib có qua nhau thai hay không Không có nghiên cứu đầy đủ vả kiềm chứng
ở phụ nữ có thai. Nếu VELCADE® được dùng trong suốt thai kỳ, hoặc nêu bệnh nhân bắt đầu có thai
trong lúc dùng thuốc nảy, bệnh nhân nên được bảo trước những rủi ro có thế có trên bảo thai.
Bệnh nhân nên được khuyên sử dụng biện phảp trảnh thai hiệu quả để ngừa thai và trảnh cho con bú trong
lủc điều ni VELCADE®.
Phu nữ đang cho con bú
Chưa được biểt bortezomib có bải tiết qua sữa mẹ hay không. Vì nhiều thuốc được bải tiết qua sữa mẹ và
vì nguy cơ cao cảc phản ứng phụ nghiêm trọng cho bé nuôi qua sữa mẹ từ VELCADEẾ bà mẹ nên được
khuyên trảnh cho con bú trong lủc điều trị VELCADẸ®.
Tảc động trên khả năng lải xe và vận hảnh máy móc
Do VELCADE® có thể gây ra hạ huyết ảp, mệt mỏi, choáng vảng, lả, nhin đôi, cho nên bệnh nhân nên
thận trọng khi điều hảnh mảy móc, lái xe.
Tảc dụng ngoại ỷ
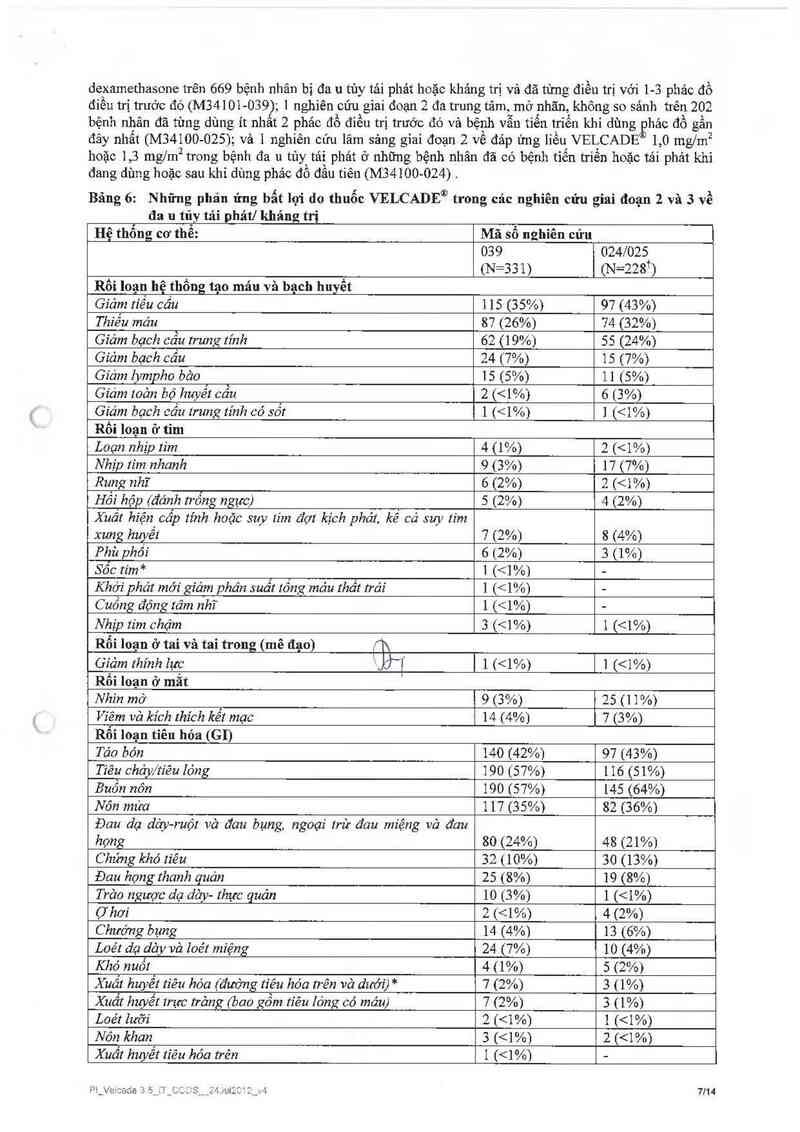
T óm tắt các thử nghiệm lâm sảng ở bệnh nhân đa u tủy tái phảt/ kháng trị:
Tính an toản và hiệu quả của VELCADE® được đảnh giá trong 3 nghiên cứu với liều đề nghị/khuyến cảo
là 1,3 ngm². Ba nghiên cứu nảy bao gồm 1 nghiên cứu giai đoạn 3, phân nhóm ngẫu nhiến, so sảnh với
Pl_Vc cađc 3 ớ_iT_CC Ds_24…12c ' 2 J 6114
dexamethasone trên 669 bệnh nhân bị đa u tủy tải phát hoặc khảng trị và đã từng điều trị với 1— 3 phảc đồ
điều trị trưởc đó (M34101—039); 1 nghiên cún giai đoạn 2 đa trung tâm, mở nhãn, không so sảnh trên 202
bệnh nhân đã tùng dùng ít nhất 2 phác đồ điều trị trước đó và bệnh vẫn tiễn tríến khi dùng
`Ẹhác đồ gần
đây nhất (M34100- 025); và ] nghiên eứu lâm sảng giai đoạn 2 về đảp ứng 1iều VELCADE l, 0 mg/m2
hoặc 1 ,3 rng/m2 trong bệnh đa 11 tủy tái phát ở những bệnh nhân đã có bệnh tiễn triển hoặc tải phảt khi
đang đùng hoặc sau khi dùng phảc đổ đầu tiên (M34100- 024).
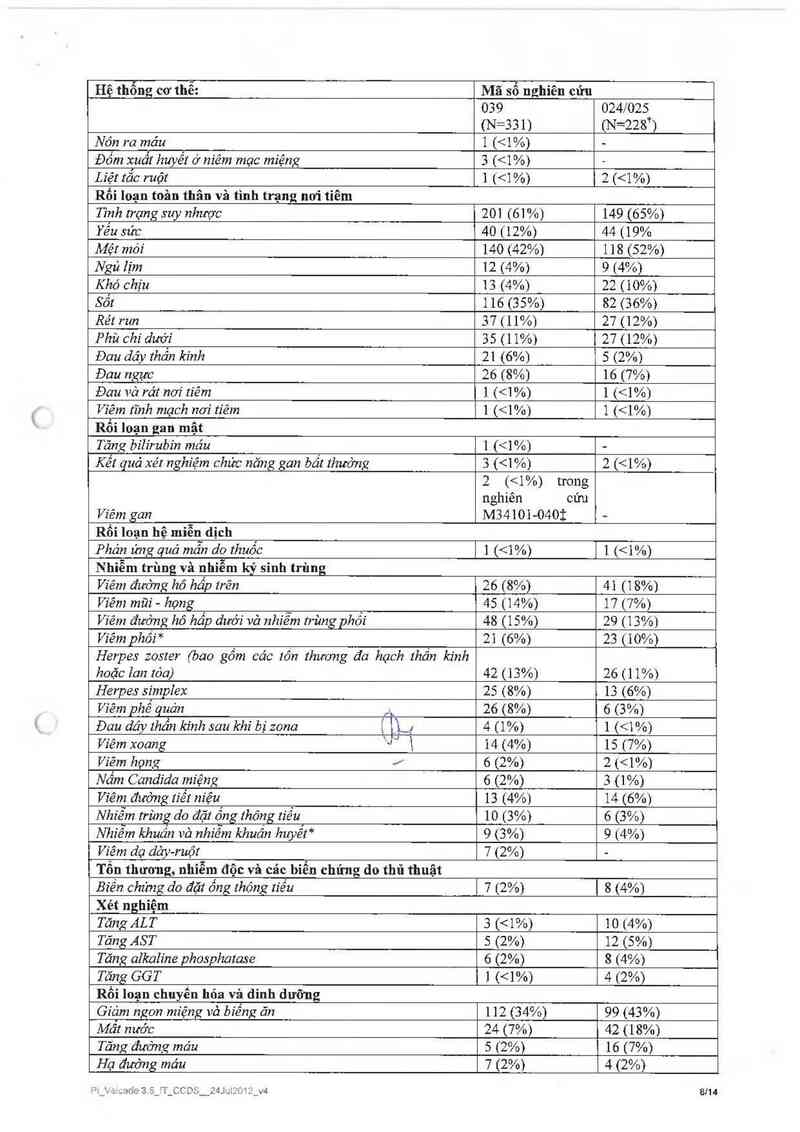
Bảng 6: Những phản ứng bất lợi do thuốc VELCADE“ỄJ trong các nghiên cửu giai đoạn 2 và 3 về
đa u tủy tải phátl khảng trị
Hệ thổng cơ thể: Mã số nghiên cứu —1
039 024/025
(N=331) (N=228ij
Rồi loạn hệ thống tạo máu và bạch huyết
Giảm tiểu cầu 1 15 (35%) 97 (43%)
Thiếu máu 87 (26%) 74 (32%)
Giảm bạch cầu trung tính 62 (19%) 55 (24%)
Giám bạch cẳu 24 (7%) 15 (7%)
Gz'ảm lympho băo 15 (5%) 11 (5%)
Giảm me… bộ huyết cầu 2 (<1%) 6 (3%)
Giám bạch cầu lrung tính có sổt 1 (<1%) 1 (<1%)
Rối loạn ở tim
Loạn nhịp tim 4 (1%) 2 (<1%)
Nhịp tim nhanh 9 (3%) 17 (7%)
Rung nhỉ 6 (2%) 2 (<1 %)
Hồi hộp (đánh trống ngực) 5 (2%) 4 (2%)
Xuất hiện cấp tính hoặc suy lim đợt kịch phát, kể có suy tìm
xung hưyếl 7 (2%) 8 (4%)
Phù phối 6 (2%) 3 (1%)
Sốc tim* 1 (<1%) -
Khởi phát mới giảm phân suất tống máu thất trái ] (<1%) -
Cuồng động tâm nhĩ 1 (<1%) -
Nhịp tim chậm 3 (<1%) 1 [<1%)
Rỗi loạn ở tai và tai trong (mê đạo) ,f1\
Giảm thính lực "=Jđ'ị 1 <<…» | 1 (<1%)
Rồi loạn ở mắt '
Nhìn mở 9 (3%) 25 (11%)
Viêm và kích thích kết mạc 14 (4%) 7 (3%)
Rối loạn tiêu hỏa (gi)
Táo bón 140 (42%) 97 (43%)
Tiêu chởy/tz'ẽu lóng 190 (57%) 116 (51%)
Buỗn nôn 190 (57%) 145 (64%)
Nỏn mửa 117 (35%) 82 (36%)
Đau dạ dảy-ruộr vả đau bụng, ngoại lrừ đau miệng vò đau
họng 80 (24%) 48 (21%)
Chứng khó tiêu 32 (10%) 30 (13%)
Đau họng thanh quản 25 (8%) 19 (8%)
T rảo ngược dạ dảy- thực quản 10 (3%) 1 (<1%)
Ợhơi 2 (<1%) 4 (2%)
Chưởng bụng 14 (4%) 13 (6%)
Loét dạ dảy vả loétmiệng 24 (7%) 10 (4%)
Khó nuốt 4 (1%) 5 (2%)
Xuất huyết tìẻu hóa (đường tiêu hóa trên vờ dưới) * 7 (2%) 3 (1%)
Xuất huyết lrực trảng (bao gồm tiêu lỏng có máu) 7 (2%) 3 (1%)
Loét lưỡi 2 (<1%) 1 (<1%)
Nỏn khan 3 (<1%) 2 (<1%)
Xuất hzmểt tiêu hóa trên 1 (<1%) -
Pá_Ve1ưcce 3 5_Ỉ_CJL TJS…_ ,; ủưl'Lỉ ’ Z…. -ì
7/14
Hệ thống cơ thễ:
"' IA )
Mã so nghien cưu
039 024/025
(N=331) (N=228*)
Nón ra máu 1 [<1%) -
Đốm xuất huyết ở niêm mạc miệng 3 (<1%) —
Liệt tắc ruột 1 (<1 %) 2 (<1%)
Rối loạn toân thân và tình trạng nơi tiêm
Tình trạng suy nhược 20] (61 %) 149 (65%)
Yếu sức 40 (12%) 44 (19%
Mệt mói 140 (42%) 1 18 (52%)
Ngủ lịm 12 (4%) 9 (4%)
Khó chịu 13 (4%) 22 (10%)
Sốt 116 (35%) 82 (36%)
Rél run 37 (11%) 27 (12%)
Phù chi dưới 35 (11%) 27 (12%)
Đau dáy thần kinh 21 (6%) 5 12%)
Đau ngực 26 (8%) 16 (7%)
Đau vả rát nơi tiêm ]. (<1%) 1 (<1%)
Víẻm tĩnh mạch nơi tíẻm l (<1%) 1 {
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng