









íủ/ẢƯffl'F
»ẢỨSỸ»UT
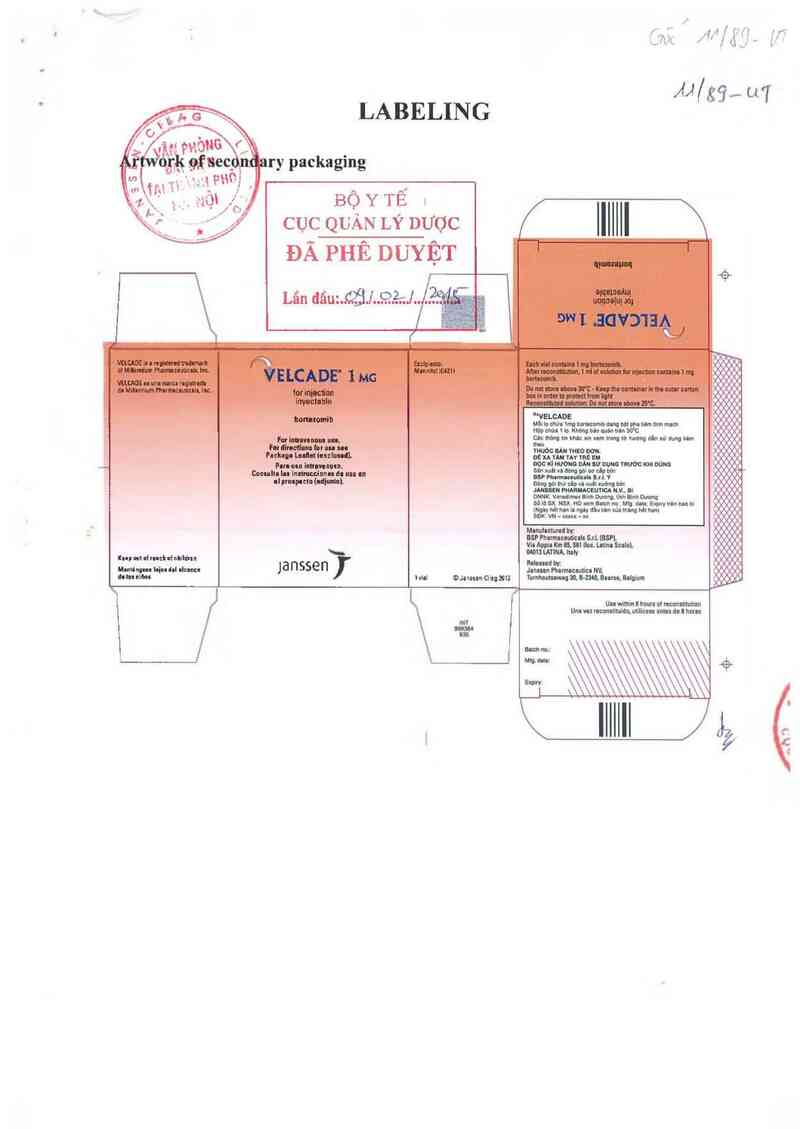
LABELING
BỘ Y TẾ .
CỤC QUẢN LÝ DƯỢC
ĐÃPHÊDUYỆT
Lân đãuz.ầặfĩJ..ẽãằd
luVELGAĐE
IAhlochlmo…đlưbũffllfflưủnưđz
H»…mxmmqulnmưt:
ỀMmmlhleinmlmủhươwdhnùđumkim
USP hn…ulhlh l.r.l.
… @ mũ do vi mit mbng DM
um PMARWW N.V.. Il
DNNK Vlmđmcl Hnn Dwno. um HM Dwno
Gblon. …. NDumemm,Wg du; Emmanobì
mm…mmmchmụumuhmm
SDK,VN-lunt-n
ul
luN
Iu; Mulưuhdclỉlùln
Mllúí uu: Iliu III Illlm
ÚI In IIÌMI
llduud w:
Jmuu Phanmmlu NV.
Tumhwtumoư. l-m lum. Idgbum
Janssen7
lvìll ®Junsm-Cllng am
Un w'mìn ! hom M m……
Um vu n…huido, ưu'llcm mu dl I hnm
…
nm
…
('.
LABELING
Artwork u
VE LCADE°Đ l MG
forinjơction-imcublo g —_,
bnnemmih g _
MFD, hy: BSP Pharmaceuticals S:.l.iBSPL Izaìy ẽ --
Released by:Janssnn Pharmecculica NV. Balgium
®anssen-Cihg 2012
“%
\
\.
mmùnè
THỤÓC
' ẨN SỐ LUỢNG VÀ CHẤT LUỌNG,
VELCADE® (bortezomib) dùng đường tiêm lá thuốc kháng ung thư chỉ sử dụng dạng tiêm tĩnh mạch
Mỗi lọ thuốc liều đơn chưa:
o 1 mg bortezomib ở dạng bột đông khô tỉnh khiết. Tả dược: 10 mg Mannitol, hoặc
0 3,5mg bortezomib ở dạng bột đông khô tinh khiết. Tả dược: 35 mg Mannitol
DẠNG BÀO CHẾ
VELCADEga (bortezomib) dùng dường tiêm được dóng gói ở dạng lọ rỉêng bìệt từng hộp carton 5 mL
chửa l mg bortezomib hoặc lOml. chửa 3,5mg bortezomib dưới dạng bột trắng nhạt.
. Lọ thuốc chứa lỉều đơn lmg.
o Lọ thuốc chứa lìều đơn 3,5mg.
ĐẶC ĐIỂM LÂM SÀNG
Chỉ định
VELCADECvJ (bortezomib) dùng đường tiêm được chỉ định điều trị cho bệnh nhân đa u tùy.
VELCADEnạ (bortezomib) dùng đường tỉêm được chỉ định điều trị cho bệnh nhân u lympho tế bảo mantle
đã nhận được ít nhẫt ] đm đỉều trị trước đó.
Liều dùng và cách sử dụng
VELCADE® CHỈ DÙNG ĐƯỜNG TIÊM TĨNH MẠCH. Tiêm vảo khoang dưới nhện cùa tùy sống sẽ
gây tử vong.
Đơn trị liệu (Đìều trị bệnh đa u tủy tải phát và u lympho tế bảo mantle)
Liều khuvến cáo
Liều khuyến cảo cùa VELCADEíIĐ lả 1,3mg/m2 /mỗi liều được chỉ định tiêm tĩnh mạch I lần .›— —5 giây, mỗi
tuần 2 lần trong 2 tuần (ngây !, 4, 8 vả ] 1) tiếp theo nghỉ 10 ngảy (từ ngảy 12-21). Với] ỉệu trình điều trị
kéo dải hơn 8 chu kỳ, có thể dùng lìều cùa VELCADEog như Iiều chuẩn hoặc duy trì liều mỗi tuần 1 lần
trong 4 tuần (Ngảy l ,,8 15, 22) tiếp theo nghỉ 13 ngảy (tử ngảy 23 đển ngảy 35) Nên ngưng it nhắt 72 giờ
giữa 2 lỉềư điều trị lìên tìếp
Điều chỉnh liều vả tái khởi đẳu điều trĩ
Điểu trị VELCADEfE nên được ngưng ngay khi ghi nhận độc tính không thuộc hệ tạo mảu mức độ 3 hoặc
độc tính thuộc hệ tạo máu mức độ 4 {dựa theo Tỉêu chuẩn độc tỉnh thường gặp của Vìện ung thư quốc gia
Hoa Kỳ {National Cancer lnstỉtute— NCIỊ), ngoại trừ bệnh lý thần kình như thảo luận bên dưới (xem phần
Lưu ý và thận trọng đặc bìệt khi sử dụng) Một khi các triệu chứng về độc tỉnh đã được giải quyết, điều trị
VELCADE® có thể bắt đầu lại ở lỉều giảm 25% (1 ,3ngm²llỉều được giam xuống l,Omglm²/liềug
l,0mglm²flièu gỉảm xuống O,7mglm²/Iiều). Bảng sau đây đề cặp sự diễu chỉnh ]ỉều được khuyến cảo cho
những bệnh nhân dùng VELCADE® cỏ lỉẽn quan đến đau thần kinh hoặc bệnh lý thẳn kinh cảm gìảc
ngoại bìên (Bảng 1). Những bệnh nhân đã có bệnh lý thần kinh nặng trước đó chỉ nên được đỉều trị bằng
VELCADE® sau khi được cân nhắc cẩn thận về nguy cơ vả lợi ích.
P[_Vclcadc _lmg_lT_CCDS_Z4JuIZOI2_VB l/l4
Bảng 1: Điều chỉnh Iiều được đề nghị cho bệnh nhân đau thần kinh vă/hoặc bệnh lý thần
kinh cảm giản ngoại biên hoặc bệnh lý thẩn kinh vận động liên quan VELCADEỦ
Mức độ các dẫu hiệu và triệu chứng đau thẫn Đỉều chỉnh liều vả phác đồ
kinh ngoại biên'
Mức độ 1 (dị cảm, yếu vả/hoặc mất phản xạ) mả Không cắn điều chình liều
không đau hoặc không mất chức năng
Mức độ 1 với đau hoặc mức độ 2 (cản trở chức Giảm VELCADE® xuống còn 1,0mgxm²
năng nhưng không cản trở cảc hoạt động sống
hằng ngảy)
Mức độ 2 v_ớỉ đay hoặc mức độ 3 (cản trở cảc Ngưng VELCADE® cho đến khi độc tính được gỉải
hoạt động sông hăng ngảy) quyêt. Khỉ gĩảỉ quyêt xong độc tính khời đâu lại
điều trị bằng liều yVELCADE® `được gỉảm `đén
O,’7mg/mz vả thay đôi lịch trình đỉêu trị mỗi tuân l
lân.
Mức độ 4 (bệnh lý thẫn kinh cảm giặc lảm mẳ Ngưng VELCADE®
khả năng họạt động hoặc bệnh lý thânJcinh vận
động có thẻ đe dọa tỉnh mạng hoặc dân đên bị
lỉệt)
' Tiêu chuẩn độc tính thường gặp, theo NCI.
Bênh nhân suỵ thân
Dược động học cùa VELCADE® không bị ảnh hưởng bởi mức độ suy thận. Do đó, không cần thiết phải
điều chĩnh liều VELCADE” cho nhũng bệnh nhân suy gìảm chức năng thận. Lọc thặn có thế lảm giảm
nồng độ thuốc, do đó nên tỉêm VELCADEw sau khi lọc thận. (Xem Tính chẩt dược động học).
Bênh nhân suy zan
Bệnh nhân suy gan nhẹ không cần phải điểu chinh ]ìều và nên được đỉều trị theo liều khuyến cảo. Bệnh
nhân suy gan ưung bình hoặc nặng nên được khởi đầu với liều thẩp 0,9 mg/m². Đối với bệnh nhân suy
gan vừa hoặc nặng đòi hòỉ gỉảm liều dằn đề kìếm soát độc tính, sự giảm lỉều nên từ 0,9 mglm² đến 0,7
mgim², và từ 0,7 mglm² đến 0,5 mgfm², xem Bâng 2 - Phân Ioạỉ mức dộ suy gan.
Bảng 2 - Phân loại mức độ suy gan
Xét nghỉệm chức Nhẹ Trung bình Nặng
nảng gan
Bỉlirubin S ULN > 1.0x—1 .Sx ULN > l.Sx—3x ULN , > 3x ULN
SGOTJAST > ULN Bẫt cứ Bất cứ ] Bắt cứ
Chủ viểt tắt: AST = aspanare aminotransferase; SGOT = serum glutamỉc oxaloacetic transaminase; ULN
= trên mức giới hạn bình thường
Cách dùng
VELCADE® được dưng tiêm tĩnh mạch 1 lần từ 3-5 ~gỉâỵ qua cathéter tĩnh mạch ngoại bỉên hoặc trung
ương và được tráng bãng dung dịch NaCl 0,9% cho môi lân tiêm.
Liệu phág kết hợp (Điều trị bệnh đa u tủy chưa được điều trị trước đó)
Liêu khuỵẽn cảo
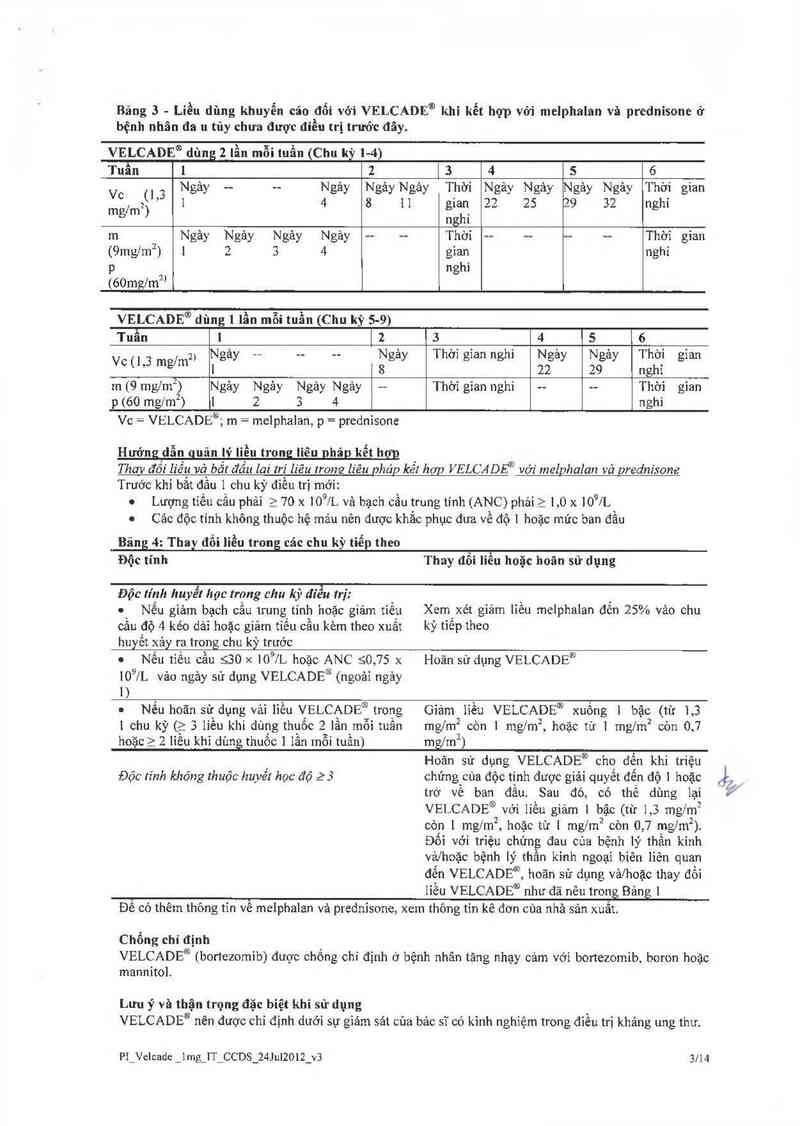
Bảng 3 trình bảy liệu phảp kết hợp VELCADE® (bortezomibj tiêm tĩnh mạch nhanh 1ỉều duy nhất trong
3-5 gỉây, với uống melphalan vả prednisone trong 9 chu kỳ điều trị, mỗi chu kỳ kéo dải 6 tuần. Trong chu
kỳ 1-4, dùng VELCADE® 2 lần mỗi tuần (vảo ngảy 1,4, 8, 11, 22, 25, 29 và 32). Trong chu kỳ s-9, dùng
VELCADE® 1 lần mỗi tuần (vảo ngảy 1, 8, 22 và 29).
PI_Velcade _1mg_lT_ccos_z4Julzon_vs M 4
\ể“
Bảng 3 - Liều dùng khuyến cảo đối với VELCADE® khi kết hợp với melphalnn vã prednisone ở
bệnh nhân đa u tủy chưa được điều trị trước đây.
VELCADE® dùng 2 lần mỗi tuần (Chu kỳ 1-4)
Tuần 1 2 [3 4 5 6
Vc (1 3 Ngảy —- -— Ngảy Ngảy Ngảy Thời Ngảy Ngảy Ngảy Ngảy Thời gian
mgfmz) ’ l 4 8 11 gian 22 25 29 32 nghỉ
nghi
… Ngảy Ngảy Ngảy Ngảy -- —- Thời -- -— -— —— Thời gian
(9mgfm²) 1 2 3 4 gìan nghi
p nghỉ
(60mg/m”
VELCADE® dùng 1 lần mỗi tuẫn (Chu kỳ s—9)
Tuần 1 1 2 3 4 5 6
,, z) Ngảy -— -- -- Ngảy Thời gỉan nghỉ Ngảy Ngảy Thời gian
V° (I,: mg’m 1 8 22 29 nghi
m (9 mglm²) Ngảy Ngảy Ngảy Ngảy —— Thời gỉan nghỉ -— -- Thời gỉan
p «ao mgl_m²) 1 2 3 4 nẵhì
Vo = VELCADE°Ễ m = melphalan, p = prednisone
Hướng dẫn guản lỵ’ Iiều trong lỉêu phảg kết hgm
Thav đồi liều vò bắt đầu Iat' lri liêu trong liên pháp kểl hop VELCADỂ' với melphalan vả prednisone
Trước khi bắt đầu 1 chu kỳ đỉều trị mới:
0 Lượng tỉểu cầu phải 2 70 x 100/L và bạch cầu trung tính (ANC) phải 2 1,0 x lOĐIL
. Các độc tính không thuộc hệ mảu nên được khắc phục đưa về độ 1 hoặc mức ban đầu
Bảng_43 Thay đổi liều trong các chu kỳ tiểp theo
Độc tính
Thay đổi liều hoặc hoãn sử dụng
Độc lính huyết học trong chu kỳ đíễu lrị:
' Nếu gìảm bạch cầu trung tính hoặc giảm tiểu
cấu độ 4 kéo dải hoặc giảm tiểu cầu kèm theo xuất
huyết xảy ra trong chu kỳ trước
. Nếu tìền cầu sao >< 10% hoặc ANC 50,75 x
10% vảo ngảy sử dụng VELCADE' (ngoảĩ ngảy
1)
0 Nếu hoãn sử dụng vải lỉều VELCADE trong
[ chu kỳ (a 3 liều khi dùng thuốc 2 lần mỗi tuần
hoặc ? 2 liều khi dùng thuốc 1 lần mỗi tuần)
Độc tính khỏng thuộc huyết học đó 23
Xem'xét giảm liều mclphalan đến 25% vảo chu
kỳ tìêp theo
Hoãn sử dụng VELCADE®
Gỉảm lỉều VELCADE® xuồng 1 bậc (từ 1,3
mg/m2 còn ! mglm², hoặc từ ] mg/m2 còn 0,7
mglml)
Hoãn sử dụng VELCADE® cho đến khi triệu
chứng cùa độc tính được giải quyểt đến độ 1 hoặc
trở về ban đầu. Sau đó, có thể dùng lại
VELCADE® với liều giảm 1 bậc (từ 1,3 mg/m²
còn 1 mglm², h0ặc từ 1 mg/m2 còn 0,7 mg/mz).
Đối vởỉ triệu chứng đau của bệnh lý thần kinh
vảz’hoặc bệnh lý thần kỉnh ngoại biên liên quan
đến VELCADE®, hoãn sử dụng vả/hoặc thay đối
liều VELCADE® như đã nêu trong Bảng 1
Đê có thêm thông tĩn về melphalan vả prednisone, xem thông tìn kê đơn cùa nhà sản xuât.
Chống chỉ định
VELCADEm (bortezomib) được chống chỉ định ở bệnh nhân tảng nhạy cảm với bortezomib, boron hoặc
mannitol.
Lưu y' và thặn trọng đặc biệt khi sử dụng
VELCADE.® nên được chỉ định dưới sự gỉảm sát cùa bảc sĩ có kỉnh nghìệm trong đìều trị khảng ung thư.
PI_Velcade _l mg_lT_CCDS_Z4JUIZOIZ_vB
3114
\Ỉxồ_
Đã có những trường hợp tử vong khi vô ý tiêm VELCADEỦ vảo khoang dưới nhện cúa tùy sống.
VELCADE® chỉ dùng đường tiêm tĩnh mạch KHÔNG TIÊM VELCADE® VÀO KHOANG DUỚI
NHỆN CỦA TỦY SÓNG.
Nói chung, hồ sơ an toản của bệnh nhân dùng VELCADEỦ đơn trị liệu tương tự như ở bệnh nhân dùng
VELCADE® kết hợp vởi melphalan vả prednisone.
Bênh thằn kinh nzoai biên ` _ `
Điêu trị VELCADE® gây ra bệnh lý thân kỉnh ngoại bỉẽn (PN) mả nôi bật lả bệnh lý thân kinh cảm gìảc
ngoại biên. Tuy nhiên, một vải trường hợp được bảo cảo bệnh ỉỷ thần kinh vận động trằm trọng có kẻm
hoặc không kèm theo bệnh lý thần kỉnh cảm giảc ngoại biên.
Bệnh nhân có trước những triệu chứng (tê, đau hoặc cảm giảc nóng bỏng tay hoặc chân) vả/hoặc các dấu
hiệu đau thần kỉnh ngoại biên trước đó có thề sẽ bị nặng thêm (bao gồm 2 mức độ 3) trong khi điều trị
bằng VELCADE®. Bệnh nhân nên được giảm sát cảc trìệu chứng đau thần kinh, như lá cảm giảc nóng
bỏng, tăng cảm, dị cảm, khó chịu, đau thần kinh hoặc suy kiệt. Bệnh nhân mới bị đau thần kỉnh ngoại
biên hoặc bị nặng lên có thề cẩn thay đồi lỉều vả lịch đỉều trị VELCADE® (xem Liều dùng và cách
dùng). Trong nghìên cửu pha 3 bệnh đa u tùy đỉều trị đơn trị vởi VELCADE® so với dexamethasonc, sau
khi điểu chỉnh liều, bệnh iý thần kinh ngoại biên đã được cải thiện hoặc giải quyết ở 51% cảc bệnh nhân
với bệnh lý thần kinh ngoại biên 2 độ 2. Trong cảc nghiên cứu bệnh đa u tùy pha 2, bệnh lý thần kình
ngoại biên đã được cải thiện hoặc giải quyết ở 73% bệnh nhân đã ngưng điều trị do bệnh lý thần kinh độ
2 hoặc những người có bệnh lý thần kỉnh ngoại bỉên ; độ 3.
Hậu quả lâu dải cùa bệnh lý thằn kinh ngoại vi đã không được nghiên cứu trong u lympho tế bảo mantle.
Ha huvết' ag
Trong cảc nghiên cứu đon trị liệu giaì đoạn 2 và 3 về đa u tùy, tỷ lệ đối tượng bị hạ huyết ảp (theo mọi tư
thế, theo tư thế đứng và nhtmg trường hợp hạ huyết ảp khảo không được nêu rõ) lả l 1%-12%
Biển cố nảy xảy ra trong suốt đợt điều trị. Nên thận trọng khi điểu trị nhũng bệnh nhân có tiền Sử ngất,
bệnh nhân nhận các dược phầm được biết có liên quan với hạ ảp, và những bệnh nhân bị mất nước. Kiểm
soát hạ ảp thế đứng có thể bao gôm đỉểu chinh thuốc điều trị cao huyết ảp, bù nước, vảlh0ặc dùng
mỉneralcorticoids vả/hoặc các chẩt kích thích thằn kinh giao cảm (xem Tác dụng ngoại ý)
Rối loan trên tìm
Sự xuất hiện cẳp tính hoặc đợt kịch phảt suy tim xung huyết, vả/hoặc đợt mới giảm phân suất tống mảu
thắt trải đã được ghi nhặn kể cả bảo cảo ở những bệnh nhân có vải hoặc không cô các yêu tố nguy cơ lảm
giảm phân suất tông máu thất trái Nên theo dõi chặt chẽ bệnh nhân có yêu tố nguy cơ xuất hiện hoặc
đang có bệnh tim Trong nghìên cứu đơn trị lìệu giai đoạn 3 về đa 0 tủy sử dụng VELCADE® hay
dexamethasone, tỷ lệ rôi loạn tim mạch do bất kỳ trị lìệu sử dụng tương ứng cùa 2 nhóm lả l5% vả 13%.
Tỷ lệ các bỉển có suy tim (phù phổi cấp, suy tỉm, suy tim xung huyêt, sôc tìm, phù phổi) đều tương tự ở cả
hai nhóm dùng VELCADE® vả dexamethasone, theo thứ tụ lả 5% vả 4%. Trong các nghiên cứu lâm sảng,
có những trường hợp cá biệt chỉ kéo dải đoạn QT chưa xảo định được nguyên nhân.
Bỉến cổ ở gan
Hiếm gặp các trường hợp suy gan cấp ở bệnh nhân dùng cùng lúc nhỉều loại thuốc vả đang có những bệnh
lý nghiêm trọng khác. Những rối loạn khảo tại gan được báo cảo lả tâng các men gan, tảng bilirubin mảu
vặ viêm gan. Những thay đối nảy có thể trở lại bỉnh thường khi ngưng sử dụng VELCADEỂ Thông tin
về việc sử dụng lại thuốc nảy cho các bệnh nhân trên vẫn còn hạn chế
Rối toan ở phổi ~
Hiểm gặp các báo cáo về viêm phôi thâm nhìễm lan tỏa cấp tính do cảc tảo nhân gây bệnh không xảc
định, như lá vìêm phổi khu trú, vỉẻm phồì mô kẽ, thâm nhiễm phổi vả Hội chứng Suy hô hấp câp (Acute
Respìratory Dìstress Syndrome: ARDS) ở bệnh nhân dùng VELCADEẨ Vải bìến cô nảy gây chết người.
Tỳ lẹ cảc biến cố nảy xảy ra cao hơn ở Nhật. Nên chẩn đoán xác định nhanh chóng và tiến hảnh đỉều trị
phù hợp nếu bệnh nhân có cảc triệu chứng ở phối mới xuất hiện hoặc trở nên xấu hơn.
PI_Velcade _img_lT_CCDS_Z4JuUOU_v3 4f14
Trong 1 thứ nghỉệm iâm sảng, có hai bệnh nhân đã tử vong sớm vì hội chứng suy hô hấp cấp sớm trong
quá trình điều trị bệnh bạch cầu nguyên tùy bảo cắp tỉnh tái phát bằng cytarabine liều cao (2gJ'm2 môi
ngảy) truyền tĩnh mạch lìẽn tục cùng vởi daunorưbicin vả VELCADE®
Các xét nghiêm _ _ ` _ _ `
Nên xét nghiệm thường qui thông sô huyêt đô (đêm máu toân phân) trong suôt quá trình diêu trị
VELCADE®.
Giảm tiểu cầu
Giảm tiểu cằu xảy ra trên 43% bệnh nhân trong suốt quá trình điếu trị và gỉảm thấp nhất ở ngảy thứ 11 ở
mỗi chu kỳ vả trở về mức ban đầu ở trước chu kỳ kế tỉếp. Số lượng tỉếu câu giảm ở mỗi chu kỳ vả sự
phục hồi duy trì hằng định trong suốt 8 chu kỳ và không có bằng chứng cho thẳy có giảm tiều câu tich
lũy Số iượng tiếu câu trung bình khoảng xấp xỉ 40% so vởỉ lúc bắt đầu điều trị. Mức độ trầm trọng cùa
giảm tỉều câu liên quan đến số lượng tiểu câu trước đỉểu trị trình bảy ở Bảng 5 Trong nghiên cứu đơn trị
liệu gìai đoạn 3 về đa u tùy gỉữa VELCADE® so với dexamethasone, tỷ lệ các biến cố chảy mảu quan
trọng (> độ 3) đều tương đương nhau ở cả hai nhỏm dùng VELCADE“lg (4%) và dexamethasone (5%).
Nến theo dõi iượng tiểu cẳu trước khi dùng mỗi iiều VELCADFỂ’. Nên ngưng trị lỉệu VELCADE® khi
lượng tiểu cầu < 25. OOO/ụL và giảm liều khi dùng lại thuốc (xem Liễu l_ượng, câch sử dụng và Tảc
dụng ngoại ý). Có những báo cảo về xuất huyết đường tỉêu hóa và xuất huyết năo xảy ra khi dùng
VELCADEỂ Có thể xem xét việc truyền mảu khi có nhưng bìển cố nảy
Bảng 5: Độ nặng của giảm tỉễu cầu iìên quan đễn lưọng tiễu cầu trưởc khi điều trị, theo nghiên
cửu đơn trị liệu giai đoạn 111 về đa 11 tủy giữa VELCADE1D so với Dexamethasone
Sô lượng bệnh nhân Số (%) bệnh nhân có Số (%) bệnh nhân có
Luợng tìếu cầu trước (N=331)** iượng tiếu cầu iượng tiều cẩu 10 000-
khi điều trị* 1110000 vả <111000)
Rất hỉểm gặp (<1110000, kể cả cảc bảo cảo đơn độc).
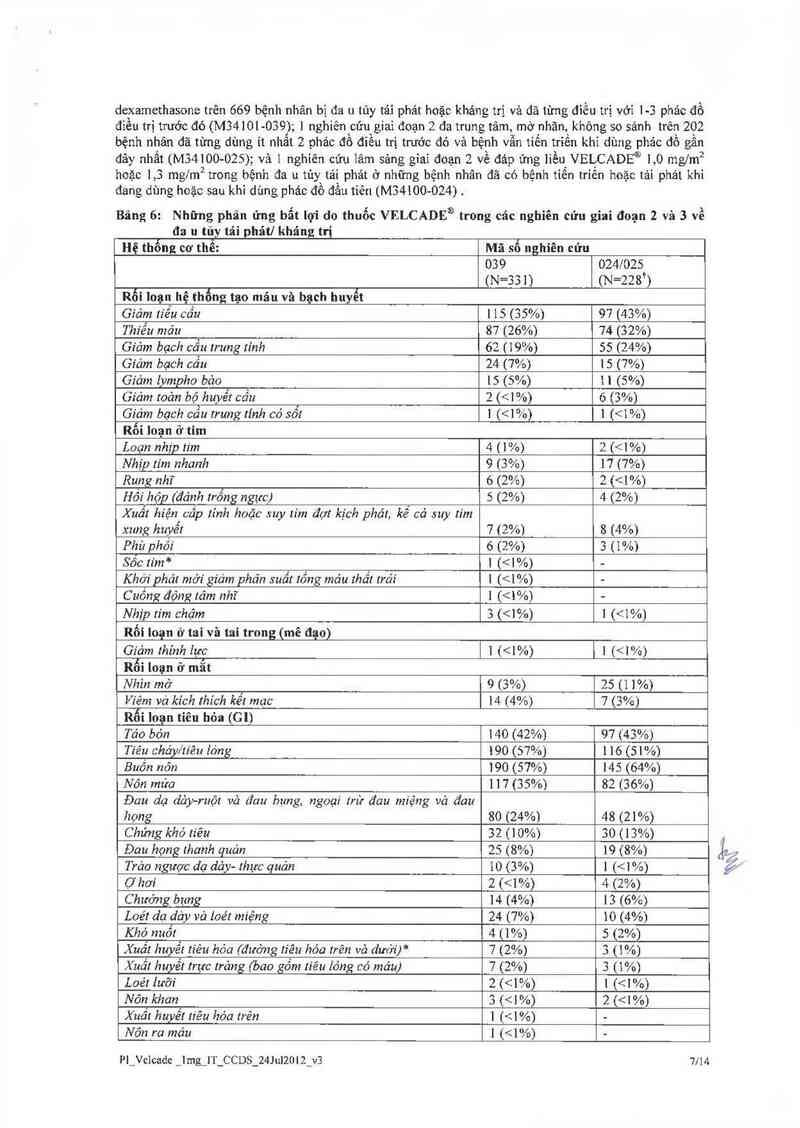
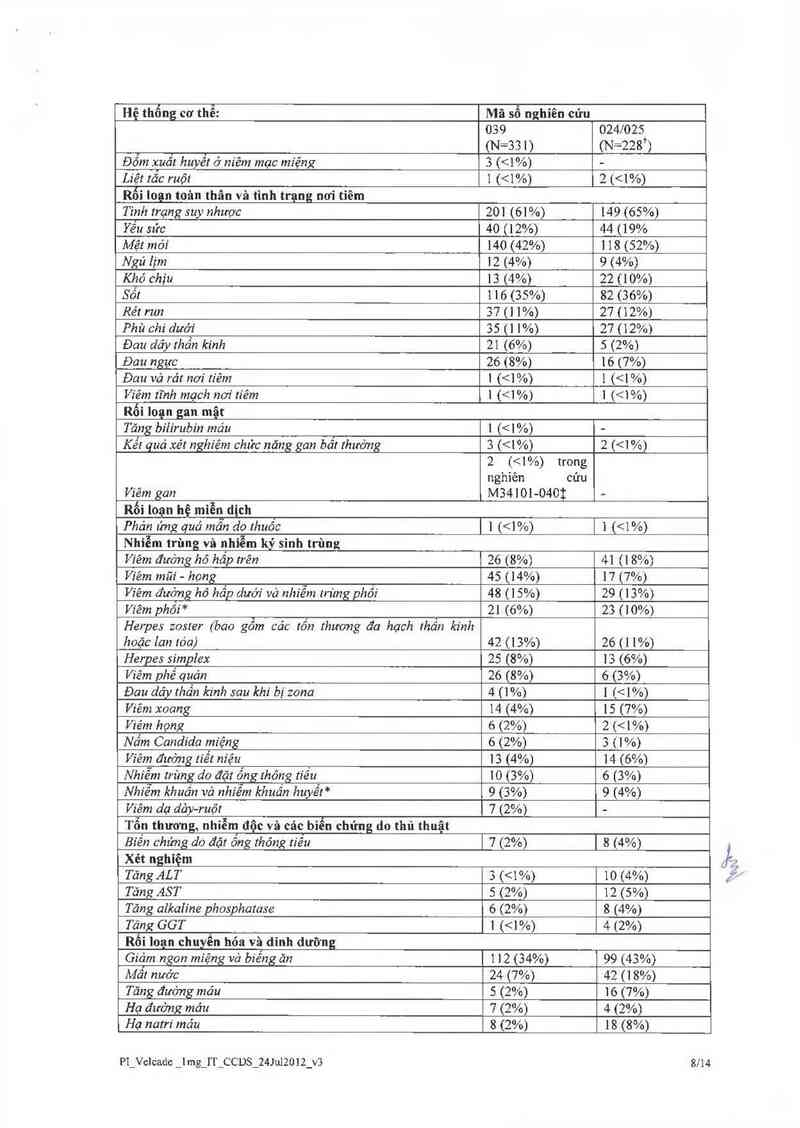
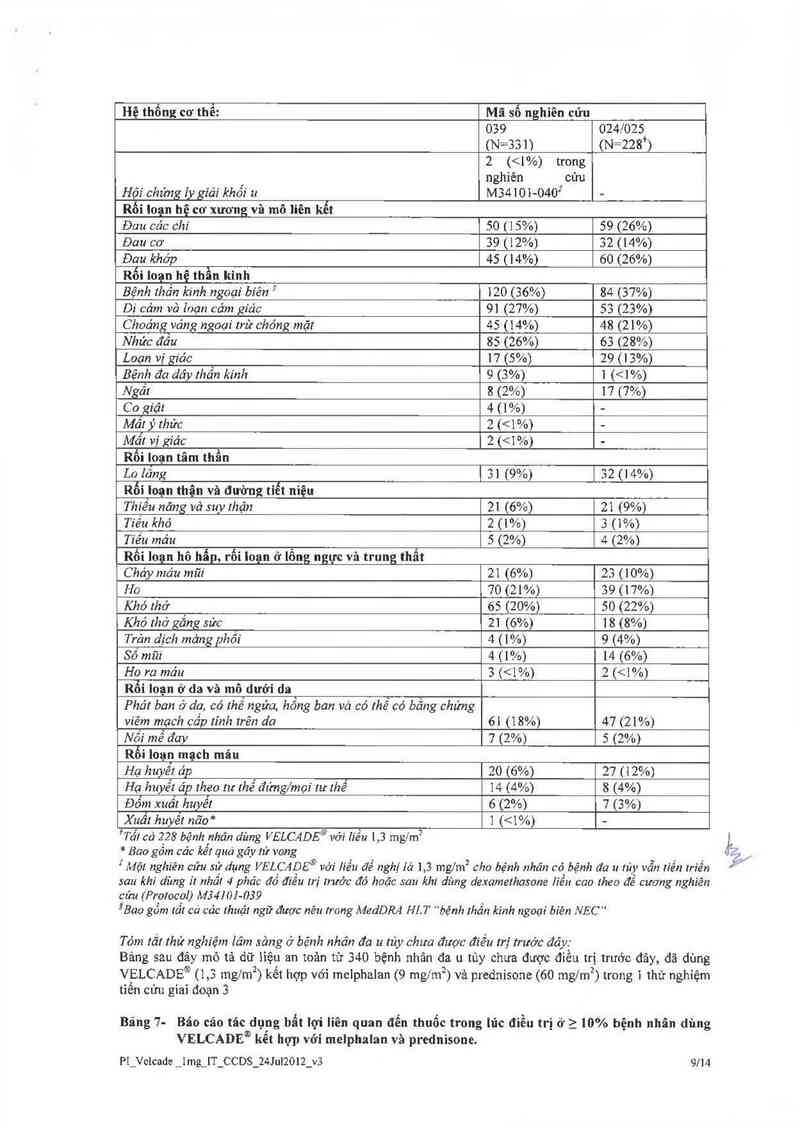
Bảng 8: Cảc báo cảo về tác dụng phụ của thuốc sau khi đưa ra thị trường
Rối loạn hệ tạo máu vã bạch huyễt
Hiếm gặp Đỏng mău nội mạch rái rác
Rỗi Ioạn ở tỉm
Hiềm gặp Nghẽn nhĩ-zhẩt hoản roản, chèn ép tim
Rối loạn ở tai và mê đạo
Hìểm gặp Giám thính lực (Điếc) hai tai
Rối loạn ở mắt
Hỉểm gặp Herpes ở măt, bệnh lý lhân kinh thị gíác, mù
Rỗi Ioạn tiêu hóa
Hìếm gặp Víẽm đại lrảng do lhiẽu mảu cục bộ. viêm Iụy câp
Nhiễm trùng và nhiễm ký sình trùng
Hỉễm gặp Viêm não-mảng não do herpes, sốc nhiễm trùng
Rất hiếm Bệnh lý chất trắng não đa 6 tiển lriên
Rối loạn hệ miễn dịch
Hiếm gặp Phù mạch
Rối loạn hệ thần kinh
Hiêm gặp Bệnh não, Thần kinh thực vật, Hội chứng bệnh não chấl
lrắng có rhểphục hồi
Rỗi loạn ở đường hô hẩp, lồng ngực và
trung thẩt
Hỉểm gặp Bệnh phỏi thâm nhiêm lan tỏa cáp tính, lăng ảp lực động
mạch phối
Rối loạn ở da và mô dưới da
Rất hỉếm Hội chủng Steven-Johnson và độc tính hoại tử ngoảz' da
Hiểm Hội chứng Sweet (Bệnh da thâm nhiễm bạch câu trung
lính số! cấp)
Thông băo cho băc sĩ những tác dụng không mong muốn gặp phăí khi sử dụng thuốc.
Quá liều
Nghiên cứu dược lý an toản trên tỉm mạch ở khỉ vả chó cho thấy liều tiêm tĩnh mạch cao khoảng 2-3 lần
Iỉều được khuyến cáo trên lâm sảng trên cơ sở tính bằng mg/m2 thấy có lìên quan đến tăng nhịp tím, gỉảm
co thắt, hạ huyết ảp và chết. Giảm co thẳt tỉm và hạ huyết ảp đảp ửng bằng sự can thiệp cấp bằng thuốc
lảm tăng huyết ảp hoặc thuốc inotropic tích cực. Nghiên cứu ở chó, thấy có sự tăng nhẹ đoạn QT.
ở bệnh nhân, quá liều hơn gấp đôi liều được khuyến cảo, thấy có liên quan đến khờĩ phát cẫp tính hạ ảp
triệu chứng vả giảm tiếu cầu gây hậu quả từ vong.
PI_Vclcade _lmg_IT_CCDS_Z4.IUIZO12_v3 ] II] 4
Chưa có thuốc giải độc đặc hiệu cho quá liều VELCADE®. Trong trường hợp quá liều, dắu hỉệu sống còn
cùa bệnh nhân nẻn được giám sải vả đìều trị hỗ trợ thích hợp để duy trì huyết ảp (như truyền dịch, thuốc
lảm tăng huyết ảp vảlhoặc thuốc nhóm inotropic) vả nhiệt độ cơ thể (xem Lưu ý vè thận trọng đặc biệt
khi sử dụng và Liều lượng và Cách dùng).
TÍNH CHÁT nu'ợc LÝ
Tính chẩt dược lực học
Cơ chế tác đô_ng
Bortezomib lả chắt ức chế đảo nghịch hoạt tính giống chymotrypsỉn trên proteasome 265 của tế bảo động
vặt có vú. Proteasome 268 lả phức hợp protein iớn thoái biến protein ubiquitin. Tồn tại trong cơ thể con
đường ubiquitin-protcasome đóng vai trò thiết yếu trong điểu hòa nồng độ cảc protein đặc hỉệu nội bâo,
do đó duy trì hằng định nội mô bên trong tế bảo. Ức chế protcasome 268 ngăn chặn sự phân giải protein
đích mã có thể ảnh hưởng dòng thảo tín hiệu bẻn trong tế bảo. Sự cản trở cơ chế hằng định nội mô bình
thường có thể dẫn đến chết tế bảo. Thử nghiệm đã khẳng định rằng Bonezomib lá thuốc độc tính tể bâo
đối vởì nhiều loại tế bảo ung thư khác nhau trên in vítro. Bortezomib gây trì hoãn sự phát trìển khối 1.1 trên
… vivo theo kiểu khối u không lâm sảng, bao gồm u đa tủy.
Dữ liệu từ phòng thí nghiệm, thử nghiệm xảy ra bên ngoải cơ thể sinh vật (ex-vỉvo), và các mô hình trẽn
động vật với bortezomib cho thắy rằng nó iảm tăng sự biệt hóa và hoạt động tạo cốt bảo và ức chế chức
năng hủy cốt bâo. Những tác động nảy đã được quan sát thấy ở những bệnh nhân đa u tủy bị ânh hưởng
bởi một bệnh hủy xương tìến trỉến vả được điều trị bằng bonezomỉb.
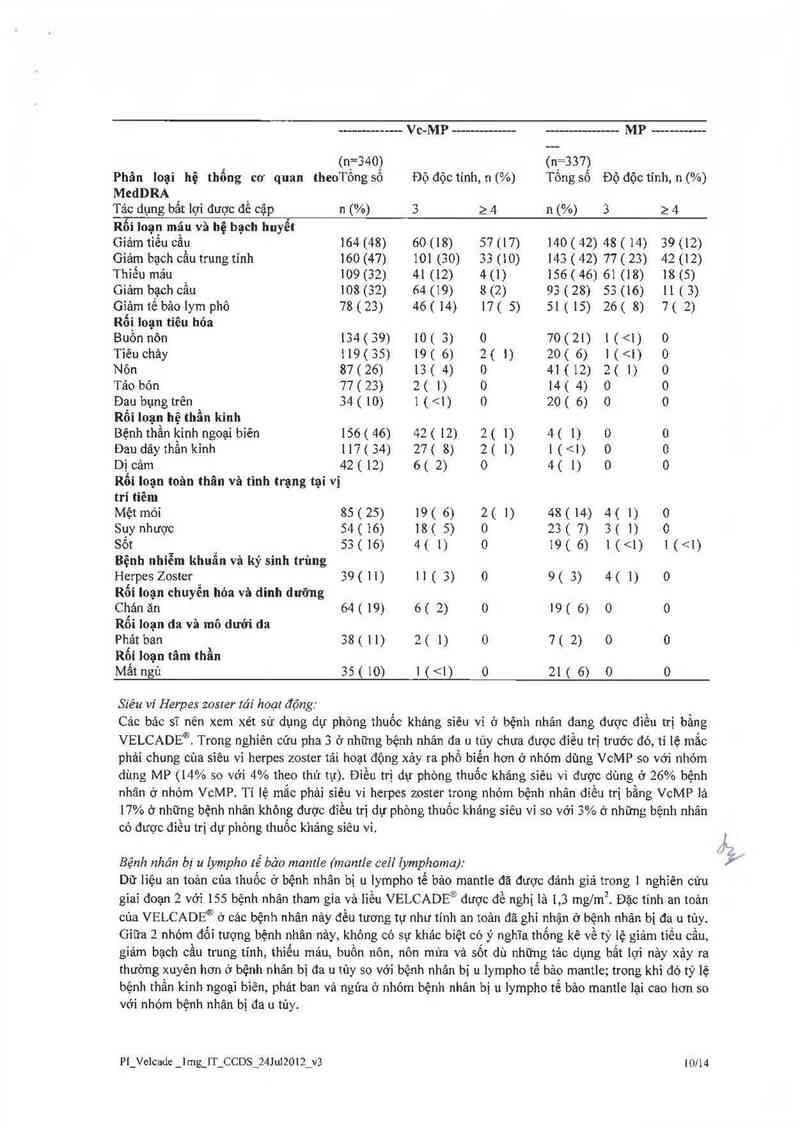
Cập nhật dữ liệu sổng còn được thực hiện với thời gỉan theo dõi trung bình 36 thảng, tỉ lệ sống còn vượt
trội ở nhóm điều trị bằng VcMP được quan sảt (HR= —0 65; p— —0 00084) Trong khí tỉ lệ sông còn trung
bình ở nhỏm đỉều trị bằng MP được ước đoán là 43.1 thảng, ti 1ệ sống còn trung bình ở nhóm VcMP chưa
tỉnh đươc.
Bệnh nhân Amyioidosis chuỗi nhẹ đã được điều trị trước đó:
Một nghiên cửu pha 1/2 đã được tiến hảnh để xác định tính an toản vả hiệu quả cùa VELCADE® ở những
bệnh nhân Amyloiđosis chuỗi nhẹ đã được điều trị trước đó. Không có vấn đề an toân mới được quan sát
trong quá trình nghiên cứu và đặc biệt VELCADE® đã không iảm trầm trọng thêm tốn thuơng cơ quan
đich (tim, thận và gan). Trong 49 bệnh nhân đảnh giả được điều trị liễu ] ,6 mgỉm2 hảng tuần hoặc 1,3
mg/m2 hai lằn một tuần, tỷ lệ đáp ửng là 67 3% (trong dó tỷ lệ CR lả 28 ,6%) được đảnh gíá bằng đáp’ ung
huyết học (protein M) đã được bảo cáo Đối với những nghiên cứu đoản hệ về liều nảy, tỷ lệ sông còn [
năm kết hợp iả 88, 1%.
Sử dumz cho nhi
Độ an toản và hiệu quả của VELCADE® ở trẻ em chưa được thỉết lập.
Tính chẩt dược động học
Dươc đônu hoc
Sau khi tiêm nhanh tĩnh mạch ở liều 1,0mng2 vả ! ,²3mg/m ở ] ] bệnh nhân đa u tùy, nồng độ bortezomib
trong huyết tương đạt được tối đa ở ]ìều đầu tỉên trung bình tương ứng là 57 và H²nglml, ở những liều
tĩểp theo, nổng độ trong huyết tương đạt được tối đa trung bình từ 67-106ng/m1 ờ lỉểu 1,0mg/m2 và 89-
12011g1m1 ở liều 1,3ngm², thời gian bản hùy thải trừ trung bình của bortezomib trên nhiều iiều từ 40…
giờ.
Bortezomib được thải trừ sau liều đằu tiên nhanh hơn so vởi những liều tiếp theo. Thải trừ ra khỏi cơ thể
toản bộ trung binh là 102 vả 112 L/h (tương ứng với 1,0mg/m2 vả l,3mglm²) sau liều đầu tiên và từ
15321/h (tương ửng vởi I,Omgfm2 vả 1,3mg/mz) sau những liều tiếp theo.
Phân bố
Thể tích phân bố trung bình của bortezomib từ 1659L đến 3294L (489 đến 1884L/m² ) sau liều đơn hoặc
liễu lặp lại của 1,0mg/m2 hoặc l,3ngm2 ở bệnh nhân đa u tùy. Điều nảy cho thấy bortezomib phân bố
rộng rãi ở cảc mô ngoại biên.
Tỉ lệ gắn kết của bortezomib với protein huyết tương người trung bình khoáng 83% trên khoảng nổng độ
từ 100-lOOOng/mL.
Chuvền hóa
Nghiên cứu trên in vitro với tiều thề gan ngưởi vả mcn cytochrome P450 có biếu hiện chuỗi DNA cùa
người cho thấy bortezomib được chuyến hóa chính bẳng cảch oxy hóa thông qua men cytochrome P450
Pl_Velcade _l mg_IT_CCDS_24JuI2O 12_v3 12114
\“ỀỉaJ'
3A4, 2C19, IA2. Bortczomib được chuyền hóa không đáng kể qua cảc enzyme CYP 206 và 2C9. Đường
chuyến hóa chĩnh iả khử gốc boronate tạo thảnh 2 chắt chuyến hóa khử boronate và sau đó chịu sự thùy
phân để tạo ra nhíều chẳt chuyển hóa.
Chất chuyền hỏa deboronate-bortezomib là chất không có hoạt tinh như chẩt ửc chế proteasome 265.
Những dữ liệu huyết tương trộn vảo của 8 bệnh nhân ở thời điểm 10 phủt và 30 phút sau khi tiêm cho
thẳy nồng độ cùa chẳt chuyển hóa trong huyết tương thấp hơn so với phân từ mẹ.
Thải trừ
Đường thải trừ của bortezomib chưa được xảo định ở người.
Dân số đãc biêt
Tuổi, gỉới tính và chùng tộc.
Ành hưởng cùa tuổi, giới tính, chủng tộc lrẽn dược động học cùa bortezomib chưa được đảnh gỉả.
Suv can
Ành hưởng của suy gan trên dược động học của bortezomib được đảnh giả trên 60 bệnh nhân ung thư ở
cảc liều tỉêm tĩnh mạch bortezomib khác nhau, từ 0,5 đến 1,3 mglm². Khi so sảnh với bệnh nhân có chức
nảng gan bình thường, Suy gan nhẹ không lảm thay đối điện tỉch đưới đường cong cùa bortezomib ở liều
bỉnh thường. Tuy nhiên, cảc giá trị AUC trung bình ở liều bình thường bị gia tăng khoảng 60% ở những
bệnh nhân suy gan trung binh hoặc nặng. Do đó, liều khởi đầu thấp hơn được khuyến cáo ở những bệnh
nhân suy gan trung bình hoặc nặng, và những bệnh nhãn nảy cần được theo dõi chặt chẽ.
S_UY_ĩhãn
Nghiên cửu dược động h0c được tiến hảnh trên những bệnh nhân có mức suy thặn khảc nhau, được phân
nhỏm tùy theo giá. trị độ thanh thải creatinine (CrCL) như sau: Bình thường (CrCL 2. 60 mL/phút/ ] .73 m²,
n=l2), Giảm nhẹ (CrCL=40-59 mL/phủtll ,73 m², n=10), Giảm vừa (CrCLẺZO-S9 lephútf1,73 ml, n=9),
vả Giảm nặng (CrCL < 20 mL/phútll ,73 ml, n=3). Một nhóm bệnh nhân lọc thận được tiêm thuốc sau khi
chạy thặn cũng được đưa vảo nghiên cứu (n=8). Cảo bệnh nhân được tiêm tĩnh mạch liều 0.7 đểu l,3
ngm² bcnczomih 2 lần/tuần. Mức độ nép xúc với thuốc (diện tich dưới đường cong vả nồng độ đinh cùa
bortezomib ở liều chuẩn hóa) thì gần như nhau giữa tất cả các nhỏm. (xem Liều lượng vả cách dùng).
Dữ liệu an toân tiền lâm sảng
Chất gâv ung thư. chẩt sinh đôt biển. lảm suv ciảm khả nãng sinh sán
Nhũng nghiên cửu về khả năng gây ung thư chưa được tiểu hảnh với boưezomib.
Bortezomỉb cho thấy hoạt tính clastogenic (bất thường nhỉễm sẳc thế về cẩu trúc) trong thứ nghìệm bất
thưởng về nhiễm sẳc thể in vilro sử dụng tế bảo tri'mg cùa chuột đồng Trung Quốc. Bortezomib không
gây độc tính irên gen khi được thử nghìệm về chẩt sỉnh đột biến in vilro (Ames test) vả thử nghiệm nhân
nhỏ ở chuột in vitro.
Nghiên cứu về sự sinh sản với bortezomib không được thực hiện nhưng đảnh giả trên mô sinh sản được
thực hiện trong những nghiên cứu độc tỉnh chung. Trong nghiên cứu về độc tinh trẻn chuột cống 6 tháng,
ảnh hưởng sự thoải hóa trên trứng được quan sảt ở liều z 0.3mgfm² (1/4 liều lâm sảng đề nghị) vả những
thay đối về sự thoái hóa trong những thử nghiệm xảy ra ở l,2mg/m².
VELCADE® có thể có khả năng ảnh hưởng trên sự sinh sản ở cả nam vả nữ.
ĐẶC ĐIỂM CỦA DƯỢC PHẨM
Tính tương kỵ
Sản phẳm nảy không được trộn với cảc thuốc khảo ngoại trừ nhCmg thuốc được kể ra trong phần Hướng
đẫn sứ đụng.
Hạn đùng
36 thảng kế từ ngảy sản xuất.
Khi được bảo quản trong bao bì nguyên vẹn vả trảnh ánh sảng, thi lọ thuốc VELCADE® chưa mờ vẫn gĩữ
nguyên tinh ổn định cho đến ngảy hết hạn sử đụng ghi trên bao bì.
Không sử dụng thuốc hết hạn sử dụng in trên bao bì.
Thận trọng đặc bỉệt khi băo quản
PI_Vclcadc _l lng_IT_CCIJS_2-'iJUIZU 12_v3 13l14
VELCADE® không chứa chất bảo quản khảng khuấn. Khi hoản nguyên như hướng dẫn, VELCADE'Ủ có
thế iưu giữ ở 25°C. Chế phẩm sau khi hoản nguyên VELCADE® nên được dùng trong vòng 8 giờ sau khi
pha. Dung dịch được hoản nguyên có thể được bảo quản cho đến 8 giờ trong lọ gốc hoặc trong ống tiêm.
Tống thời gian bảo quản dung dịch được hoản nguyên không quá 8 giờ khi để ngoảì ảnh sảng thường.
Không bảo quản lọ chưa mở nắp trên 30°C. Gỉữ thuốc trong hộp dế trảnh ảnh sảng.
Bản chẩt vả số lượng của bao bì
Lọ 5 hoặc 10 mL, thủy tinh loại 1 với nắp bromobutyl mảu xám vả khóa nhỏm. Nắp lọ 5 mL mảu xanh
lục, nấp lợ 10 mL mầu xanh hoảng gỉa. Mỗi lọ dược chứa trong vi trong suốt có khay lõm. Mỗi lọ 5 mL
chứa 11 mg bột pha tiêm vả lọ 10 mL chứa 38,5 mg bột pha tiêm
VELCADE® dược đựng trong hộp carton chứa 1 lọ sử dụng ] lần.
Hướng dẫn sử đụng và quả trinh hủy thuốc:
Thân trong sử dunz:
VELCADE® là chắt chống ung thư. Thận trọng trong suốt quá trinh bảo quản và pha chế. Nên sử dụng kỹ
thuật tiệt trùng thich hợp. Nên sử dụng găng tay và đồ bảo hộ để ngăn chặn tìếp xủc trực tiếp với da. Trên
lâm sảng, kích ứng da tại chỗ được báo cáo khoảng 5% bộnh nhân, nhưng sự thoảt mạch của VELCADE®
không liên quan đến tổn thương mao quản.
Đã có những trường hợp tử vong khi vô ý tiêm VELCADỂộ vảo khoang dưới nhện cùa tủy sống.
VELCADE® chỉ dùng đường tiêm tĩnh mạch. KHÔNG TIÊM VELCADE® VÀO KHOANG DƯỚI
NHỆN CỦA TÙY SÓNG.
Hoản ncuvêanha chế để tiêm tĩnh mach:
Trước khi sử dụng, mỗi lọ 5… phải được hoản nguyên với 1 ml dung dịch muối NaCl dẳng trương 0,9%,
mỗi lọ IO ml phải được hoản nguyên với 3,5 ml dung dịch muối NaCl đẳng trương 0,9%. Chế phẩm hoản
nguyên phải trong suốt, không mảu.
Chế phẩm để tĩêm nên được kiểm tra bằng mẳt thường về chất hạt và sự đổi mảu trưởc khi sử đụng kể cả
lọ thuốc và dung dịch tiêm. Nếu có đối mảu vả chắt hạt, không nên sử dụng.
Quá trình hủỵ thuốc thích hgg:
Bất cứ chế phẩm không sử dụng hoặc vứt bỏ nên dược hùy theo qui định của nước chủ quản.
Thuốc nảy chỉ dùng theo sự kê đơn của ihầy ihuốc.
Không dùng lhuốc qua' h'ều chỉ đinh.
Giữ ngoảỉ tãm iay tre” em.
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cẳn mê… rhõng n'n, xin hỏi ý kiến bác sĩ. gể
Sản xuất vả đóng gói sơ cấp bởi:
BSP Pharmaceuticals S.r.l, ,
Via Appia Km 65,561, 04013 Latina. Y
Đóng gói thứ cấp vả xuất xưởng bởi:
Janssen Pharmaceutica N.V.
Turnhoutscweg 30, B-2340, Bcerse, Bỉ
TUQ CỤC TRƯỘNG
P.TRUỜNG PHONG
JiỆzufgễn inlg; Jfẫìng
Pi_Velcade _img_IT_CCDS_MJuI2OI 2_v3 14114
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng