






























LABELIN G
Artwork of secondary packaging
Reconstllutlon Information
Thỏng tln hoản nguyên thuóc
SUBCUTANEOUS ……
m…
… U V ' 4`N Vì HU
CHITIEM ouou DA culntuffmmcu
3 5 mg nonezcnnn dang
bói nha dung dich hérn
CNdlM.ddiơưqơúnqcfi
ư cum mm momaoznz—m mam
Mwùwhùt … P…lu N.E.
Tum… 30. va Bưu. Il
WỦW ủ ù W CTĐK~ Jlnsscn—CIIIỊ LM… TMi Lm
, wa lu &; DN…. xxmxx
SP Velcadẹ 3.5_FR_V5
ch thculane0ul »sE
). ._ . ,
.. -_ i
For lnưmnon Lư
_._ì _ . _ _ ..
RIW
w:a’ ng.;ìêf ~.- … .n ang
D.m J 3 liều khi dùng thuốc 2 lần mglm2 còzn l mg/mẫ hoặc từ ] rrigltbỔLòn
môi tuần hoặc > 2 liếu khi dùng thuốc ] lần 0 ,7mg/m2 ) '
mỗi tuần)
\ Il \\
\`I
II
Hoãn sử dụng VELCADE cho đến khi triệu
Độc tính không ihuộc huyêt học đó 23 chứng cùa độc tính được giải quyết về độ 1
hoặc trở về ban đầu. Sau đó, có thể dùng lại
Pl_Vclcadc_3.S_FR_CCDS lApr20l S_vl 3.88
VELCADE với liếu giảm 1 bậc (từ 1,3
mg/m2 còzn ] mgfrn², hoặc từ 1 mg/m2 còn
0 7 mg/m2 ). Đối vởi triệu chứng đau do bệnh
lý thần kinh vả/hoặc bệnh lý thần kinh ngoại
biên liến quan đến VELCADE, hoãn sử dụng
va/hoặc điếu chỉnh liếu VELCADE như đã
nêu trong Bảng ]
Đê có thêm thông tin về melphalan vả prednison, xem thông tin kê đơn của nhà sản xuât.
Liều dùng đối vởi b ẽnh nhân đa g_i_iv đú điều_ị_dẽn ghép tế băn gốc tao máu và chưa đươc
@ tri trffló (điêu trí dẫn nhậpJ
Liêu nhản kết hơn với dexamethason
VELCADE 3 ,5 mg dạng bột pha dung dịch tiêm được dùng qua đường tĩnh mạch hoặc tiêm dưới
da với liếu khuyến cảo 1,3 mglm2 diện tích bề mặt cơ thể 2 lẩn mõi tuần trong hai tuần vảo các
ngảy 1, 4, 8 và 11 của chu .kỳ điếu trị 21 ngảy. Khoảng thời gian 3 tuần nảy được xem là một chu
kỳ điếu trị Khoảng cảch giữa 2 liều VELCADE liên tiếp nên cách nhau it nhất 72 giờ.
Uống dexamethason vởi liều 40 mg vảo cảc ngảy 1,2, 3,4, 8, 9, 10 và 11 cùa chu kỳ điều trị
VELCADE.
Sử dụng 4 chu kỳ điếu trị liệu pháp kết hợp nảy.
Liêu oháo kết h_ợ_g vởi dcxamethason vả thalidomid
VELCADE 3 ,5 mg dạng bột pha dung dịch tiêm được dùng qua đường tĩnh mạch hoặc tiêm dưới
da vởi liếu khuyến cảo 1,3 mg/m2 diện tích bề mặt cơ thể 2 lần môi tuần trong hai tuần vảo các
ngảy 1, 4, 8 và 11 của chu kỳ điếu trị 28 ngảy. Khoảng thời gian 4 tuần nảy được xem lả một chu
kỳ điều trị Khoảng cách giữa 2 liếu VELCADE liên tiếp nên cách nhau ít nhất 72 giờ
Uống 40 mg dexamethason vảo cảc ngảy 1, 2, 3, 4, 8, 9, 10 và 1 1 của chu kỳ điếu trị VELCADE.
Uống thalidomidvới liều 50 mg môi ngảy vảo các ngảy từ 1— 14 vả nếu dung nạp được có thể
tăng liếu đến 100 mg vảo cảc ngảy 15- 28, và sau đó có thể tăng thêm đến 200mg h` g ngảy từ
chu kỳ 2 (xem Bảng 4). aỉm
Bệnh nhân được điếu trị với bốn chu kỳ điếu trị kết hợp nảy Bệnh nhân có ít nhất đápỆgmột
phần nên được điều trị thêm 2 chu kỳ bổ sung
Pl_Velcadc_lS_FR_CCDS iAprzols_vi 4ng
IIV`In
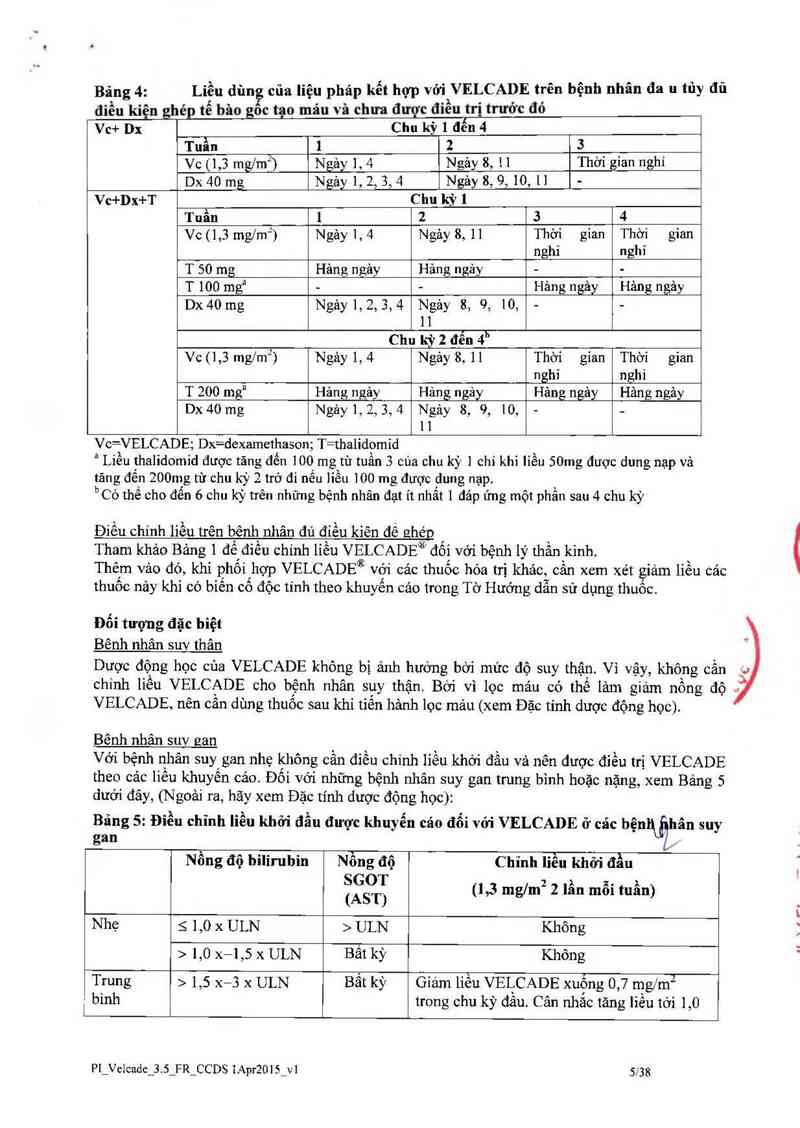
Bãng 4:
Liều dùng của liệu pháp kết hợp vởi VELCADE trên bệnh nhân đa u tủy đủ
điều kiện ghép tế bâo th›c tạo máu và chưa được điếu trị trước đó
Vc+ Dx Chu kỳ 1 đến 4
Tuần 1 2 3
Vc (1,3 mg/m" ) Ngảy 1, 4 Ngảy 8, 11 Thời gian nghỉ
Dx 40 mg Ngảy 1, 2, 3, 4 Ngảy 8, 9,10,11 -
Vc+Dx+T Chu kỳ 1
Tuần 1 2 3 4
Vc (1,3 mglm“) Ngây 1, 4 Ngảy 8, 11 Thời gian Thời gian
nghỉ nghi
T 50 mg Hâng ngây Hảng ngảy - -
T 100 mga ~ - Hâng ngảy Hảng ngảy
Dx 40 mg Ngảy 1, 2, 3, 4 Ngảy 8, 9, 10, - -
11
Chu kỳ 2 đến 4“
Vc (1,3 mg/mz) Ngảy 1, 4 Ngảy 8, 11 Thời gían Thời gian
nghỉ nghỉ
T 200 mga Hảng ngảy Hảng ngảy Hảng ngảy Hảng ngảy
Dx 40 mg Ngảy 1, 2, 3, 4 Ngảy 8, 9, 10, - -
1 l
Vc=VELCADE; Dx=dexamethason; T=thalidomid
² Liều thalidomid được tãng đến 100 mg từ tuần 3 của chu kỳ ] chỉ khi Iiếu 50mg được dung nạp và
tăng đến 200mg từ chu kỳ 2 trở đi nếu liếu 100 mg được dung nạp.
bCó thế cho đến 6 chu kỳ trên những bệnh nhân đạt ít nhất 1 đảp’ ưng một phẩn sau 4 chu kỳ
Điều chỉnh liếu trên bênh nhân đủ điếu kiên đế ghép
Tham khảo Bảng 1 để điều chỉnh liếu VELCADE'Ẻ đối với bệnh lý thằn kinh.
Thêm vảo đó, khi phối hợp VELCADEẾ vởi cảc thuốc hóa trị khảo, cần xem xét giảm liều các
thuốc nây khi có biến có độc tinh theo khuyến cảo trong Tờ Hưởng dẫn sử dụng thuốc.
Đối tượng đặc biệt
Bênh nhân suy thân
Dược động học cùa VELCADE không bị ảnh hưởng bới mức độ suy thận Vì vậy, không cẩn —
chỉnh liều VELCADE cho bệnh nhân suy thặn. Bởi vì lọc mảu có thế Iả.m giảm nông độ …-
VELCADE, nến cần dùng thuốc sau khi tiến hảnh lọc mảu (xem Đặc tính dược động học)
Bênh nhân suv ean
Vởi bệnh nhân suy gan nhẹ không cần điếu chỉnh liếu khởi đầu và nên được điếu trị VELCADE
theo các liều khuyến cảo Đối vói những bệnh nhân suy gan trung bình hoặc nặng, xem Bảng 5
dưới đây, (N gom ra, hãy xem Đặc tính dược động học):
Bãng 5: Điều chỉnh liều khởi đầu được khuyến cáo đổi với VELCADE ở các bệnbứịhân suy
gan
Nồng độ bilirubin Nồng độ Chỉnh liếu khởi đầu
ỄỆẫỊỂ (1,3 ngm² 2 lần mỗi tuần)
Nhẹ s 1,0 x ULN > ULN Không
> 1,0 x—l ,5 x ULN Bất kỳ Không
Trung > 1,5 x—3 x ULN Bất kỳ Giám liều VELCADE xuống 0 ,? mg/ m2
binh trong chu kỳ đầu. Cân nhắc tăng liều tới 1,0
Pl_Vclcade_3.S_FR_CCDS IApr2015_vl 5x38
Nặng > 3 x ULN Bất kỳ mg/ẵz hoặc giảm liều thêm nữa xuống còn
0,5 mg/m2 trong các chu kỳ tiêp theo dựa
theo khả nãng dung nạp cúa bệnh nhân.
Viết tắt: SGOT = glutamic oxaloacetic transaminasc huyết thanh (serum glutamic oxaloacetic
transaminase);
AST = aspartate aminotransferase; ULN = upper limit of the normal range (gíởi hạn trên của mức bình
thường)
Cách dùng
VELCADE được dùng tiếm tĩnh mạch hoặc tiêm dưới da Khi tiêm tĩnh mạch, VELCADE được
tiêm nhanh trong 3- 5 giây qua ống thông tĩnh mạch ngoại biên hoặc trung ương và sau đó lọ
thuốc được trảng bằng dung dịch NaCl 0, 9% để tiêm hết. Khi tiêm dưới da, dung dịch hoản
nguyên được tiêm vảo đùi (bến phải hoặc trải) hoặc bụng (bên phải hoặc trải) Nến thay đối vị trí
tiêm để việc tiếm thuốc đạt hiệu quả.
Nếu có phản ứng tại chỗ sau khi tiêm VELCADE dưới da, có thể dùng dung dịch VELCADE
nồng độ thắp (l mg/mL thay cho 2, 5 mg/mL) đế tiêm dưới da, hoặc đối sang dùng đường tiêm
tĩnh mach.
CHỐNG CHỈ ĐỊNẸ
VELCADE được chông chỉ định ở bệnh nhân:
— Mẫn cảm với bortezomib, boron hoặc mannitol.
— Đã có những trường hợp từ vong khi vô ý tiêm VELCADE vảo khoang dưới nhện của
tùy sống. VELCADE chi dùng đường tiêm tĩnh mạch và tiêm dưới da. CHỐNG CHỈ
ĐỊNH TIẾM VELCADE VÀO KHOANG DƯỚI NHẸN CỦA TỦY SỐNG.
CÁNH BÁO VÀ THẬN TRỌNG
VELCADE nến được sử dụng dưới sự giám sảt của bác sĩ có kinh nghiệm trong điều trị thuốc
kháng ung thư.
Nói chung, hồ sơ an toản của bệnh nhân dùng VELCADE đơn trị líệu tương tự như ở bệnh nhân
dùng VELCADE kết hợp với melphalan vả prednison.
Bênh thần kinh ngoai biên
Đíếu trị VELCADE gây ra bệnh lý thần kinh ngoại biên (PN) mà chủ yếu lả bệnh lý thần kinh
cảm giảc. Tuy nhỉên, một vải trường hợp bệnh lý thần kinh vận động trầm trọng có hoặc không
kèm theo bệnh lý thần kính cảm giác ngoại biên đã được bảo cảo.
Bệnh nhân đã có trưởc những triệu chứng (tê, đau hoặc cảm giảc nóng bỏng tay hoặc chân)
vả/hoặc cảc dẳu hiện bệnh lý thần kinh ngoại biên trưởc đó có thể bệnh lý nảy sẽ bị nặng thếm
(bao gồm cả 2 mức độ 3) trong khi điếu trị bằng VELCADE. Bệnh nhân nên được giám sảt cảc
triệu chímg bệnh lý thần kinh, như là cảm gỉác nóng bỏng, tăng cảm, giảm cảm giảc, dị ảm, khó
chịu, đau thấn kinh hoặc suy nhược Trong nghiên cứu pha 3 so sảnh VELCADE tiêm\ uh mạch
vởi tiêm dưới da, tỉ lệ mắc bệnh lý thần kinh ngoại biên độ › 2 là 24% ở nhóm tiêm dưới da và
41% ở nhóm tiêm tĩnh mạch (p=ODIZ4). Tỉ lệ bệnh lý thần kinh ngoại biên độ 2 3 xảy ra khoảng
6% ở nhóm tỉêm dưới da vả 16% ở nhóm tiếm tĩnh mạch (p=0,0264) (Bảng 9). Do đó, những
bệnh nhân đã có bệnh lý thần kinh trưởc đó hoặc có nguy cơ cao bị bệnh lý thần kinh ngoại biên
sẽ có lợi khi bắt đầu bằng việc dùng VELCADE tiêm đưới da.
Pl_Vclcadc_3.S_FR_CCDS lApr20] S_vl 61'38
.\` '
Bệnh nhân với bệnh lý thằn kinh ngoại biên mới xuất hiện hoặc nặng lến có thế cần thay đổi liều
dùng, liệu trình dùng thuốc hay đưòng tiêm thuốc sang tiêm dưới da (xem Liều dùng và cách
dùng). Trong nghiên cứu pha 3 về bệnh đa 11 tủy đơn trị liệu với VELCADE so vởi
dexamethason, sau khi đìều chinh liếu, bệnh lý thần kinh ngoại biên đã được cải thiện hoặc giải
quyết ở 51% cảc bệnh nhân vởi bệnh lý thần kinh ngoại biên 2 độ 2. Trong các nghiên cứu pha
2 về bệnh đa 11 tủy, bệnh lý thần kinh ngoại biến đã được cải thiện hoặc giải quyết ở 73% bệnh
nhân đã ngưng điếu trị do bệnh lý thẩn kinh độ 2 hoặc những người có bệnh lý thẩn kinh ngoại
biên 2 độ 3.
Kết cục lâu dải của bệnh lý thẳm kinh ngoại biên đã không được nghiên cứu trong ụ lympho tế
bảo mantlc.
Ha huyết ảp ' ' '
Trong cảc nghiên cửu đơn trị liệu pha 2 và 3 về đa u tủy, tỷ lệ hạ huyêt ảp (tư thê, thế đứng và
những trường hợp hạ huyết ap khác không được nêu rõ) lả i 1%-12%
Cảc biến có nảy được quan sảt thấy trong suốt đợt điếu trị. Nên thận trọng khi điều trị những
bệnh nhân có tiến sử ngắt, bệnh nhân dùng cảc thuốc được biết có liên quan vói hạ huyết ảp, và
những bệnh nhân bị mất nước Kiếm soát hạ huyết áp thế đứng/tư thế có thế bao gồm điếu chinh
thuốc điếu trị cao huyết áp, bù nước, vảfhoặc dùng mỉneralcorticoids vả/hoặc cảc chất kích thích
thẩn kinh giao cảm (xem Tảc dụng không mong muốn)
Rối loan trên tim
Sự xuất hiện cấp tinh hoặc đợt kịch phảt suy tim xung huyết, vảfhoặc đợt mới giảm phân suất
tống máu thất trải đã được bảo cáọ, kể cả cảc bảo cảo ở những bệnh nhân có it hoặc không có cảc
yêu tố nguy cơ lảm giảm phân suất tống mảu thất trải Nến theo dõi chặt chẽ bệnh nhân có yếu tố
nguy cơ cao hoặc đang có bệnh tim Trong nghiến cứu đơn trị liệu pha 3 về đa ư tủy sử dụng
VELCADE so vởi dexamethason tỷ lệ rôi loạn tim đòi hỏi điếu trị tương ứng của 2 nhóm là
15% và 13%. Tỷ lệ mắc mới cảc biến cố suy tim (phù phổi cắp, suy tim, suy tim sung huyết, sốc
tim, phù phối) đếu tương tự ở cả nhóm dùng VELCADE vả dexzưncthason, tương ứng là 5% vả
4%. Trong các nghiên cứu lâm sảng, có những trường hợp cá biệt kéo dải đoạn QT; chưa xảo
định được nguyên nhân.
Biến cổ ở gan
Hiếm có báo cảo về cảc trường hợp suy gan cẳp ớ bệnh nhân dùng cùng lúc nhiều loại thuốc vả
đang có những bệnh lý nghiêm trọng khác. Nhũng biến cố khảc tại gan được bảo cảo là tăng các
men gan, tảng bỉlirubin máu và viêm gan Nhưng thay đổi nây có thế hổi phục khi ngừng sử
dụng VELCADE. Thông tin về việc sử dụng lại thuốc cho các bệnh nhân trên vẫn còn hạn chế.
Rối loan ớ ohối
Hiếm có bảo cảo vế vỉêm phổi thâm nhiễm lan tỏa cấp tinh do cảc tác nhân gây bệnh không xảc
định như lả viếm nhu mô phổi viêm phối mô kẽ thâm nhiễm phối và Hội chứng Su uy…hô hấp câp
(Acute Respiratory Distress Syndrome: ARDS) ở bệnh nhân dùng VELCADE. Một gỏ biến cố
nảy gây tử vong. Chụp X- -quang phổi ban đầu được khưyến cảo. Tỷ lệ cao hơn cảc biến cố nảy
được bảo cáo ở Nhật. Nến chẳn đoản xảo định nhanh chóng vả tiến hảnh điếu trị phù hợp nếu
bệnh nhân có cảc triệu chứng ớ phối mới xuất hiện hoặc trở nên xấu hơn. Nên cân nhắc tỷ số lợi
ích/nguy cơ trước khi tiểp tục điếu ni với VELCADE.
Pl_Vclcadc_3.S_FR_CCDS 1Apr2015_v1 ma
Trong 1 thử nghiệm lâm sảng, có hai bệnh nhân đã tử vong vì hội chừng suy hô hẳp cẳp trong
giai đoạn sớm của quả trinh điếu trị bệnh ung thư máu dòng tuý cấp tái phảt bằng cytarabin liều
cao (2 g/m2 mỗi ngảy) truyền tĩnh mạch liên tục cùng với daunorubicin vả VELCADE.
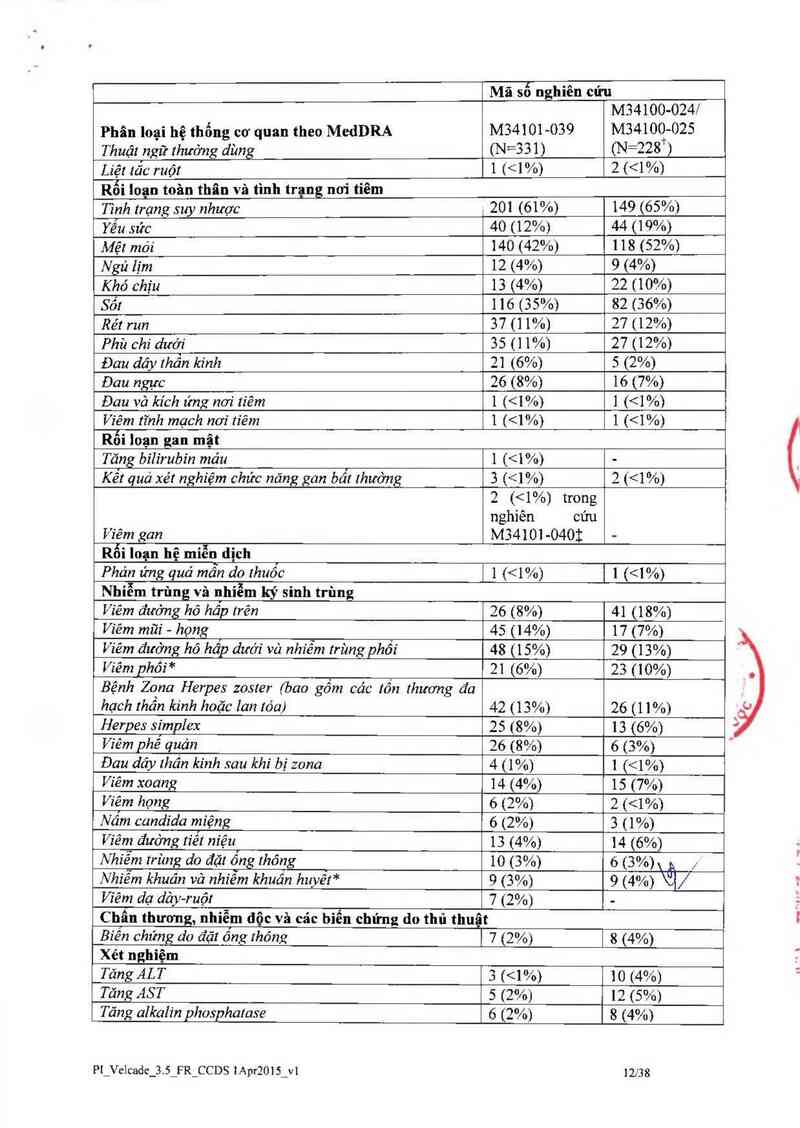
Cảc xét nghiẽm , , _ ’ ` ' `
Nên xét nghiệm thường qui thông sô huyêt đô (đêm máu toản phân) trong suôt quá trình điêu trị
VELCADE.
Giảm tỉếu cầu/Giảm bach cầu tan tính
VELCADE có liên quan đến giảm tiếu cầu/giảm bạch cầu trung tính (xem Tảo dụng không mong
muốn). Số lượng tiểu câu giảm thấp nhất 0 ngảy thử 1 1 ở môi chu kỳ dùng VELCADE vả sẽ trở
vế mức ban đằu một cảch điến hỉnh ở chu kỳ kế tiếp. Mô hình cùa giảm sô lượng tiếu cầu vả hồi
phục có tính chu kỳ và nhất quán trong cảc nghiên cứu về đa u tủy vả u lympho tế bảo mantlc,
không có bằng chứng cho thẳy có giảm tiếu câu hay giảm bạch cãu trung tính tích lũy trong bất
kỳ phảc đồ liều nảo được nghiến cứu. Nên theo dõi sô iượng tiếu câu trước khi dùng môi liếu
VELCADE. Nên tạm ngừng điếu trị VELCADE khi số lượng tiều cầu < 25 OOO/ịiL (xem Liều
dùng và cách dùng và Tảc dụng không mong muốn). Đã có những báo cảo về xuất huyết đường
tiêu hớa vả xuất huyết não liến quan đến VELCADE. Có thể xem xét đến cảc biện phảp truyền
mảu và chăm sóc hỗ trợ.
Trong nghiên cứu về đa u tùy dùng VELCADE đơn trị liệu so với dexamethason số lượng tiểu
câu thấp nhất (nadir) trung bình đếm được khoảng xấp xỉ 40% so với lúc bắt đầu điếu trị. Mức
độ nặng cúa giảm tiêu câu liên quan đến số lượng tiêu cầu trước điếu trị được trình bảy ở Bảng
6. Tỷ lệ mắc biến cố chảy mảu nặng (2 độ 3) là tương đương nhau ở cả nhóm dùng VELCADE
(4%) và dcxamethason (5%).
Bảng 6: Mức độ nặng của giâm tiểu cầu liên quan đến số lượng tiễu cầu trước khi điều
trị, theo nghiên cứu đơn trị liệu pha 3 về đa u tủy giữa VELCADE so với
dexamethason
Số lượng bệnh nhân Số (%) bệnh nhân có Số (%) bệnh nhân có sô
Số lượng tiếu cằn (N= 331)** số lượng tỉếu cầu lượng tiến cầu 10. 000-
trước khi điếu trị* <ì O OOO/ụL 25 OOO/ụL
z7s.ooomt 309 8 (3%) 36 (12%)
zso.oooifụL- <75.000ỂỤL 14 2 (14%) 11 (79%)
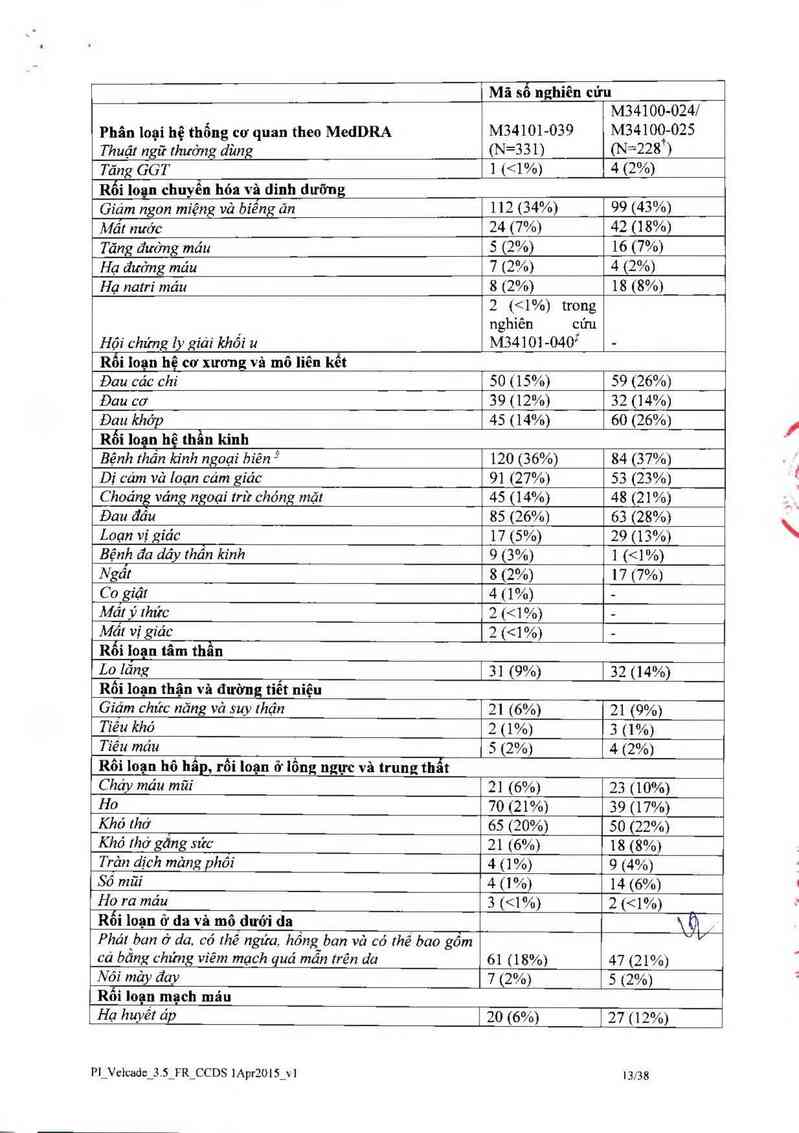
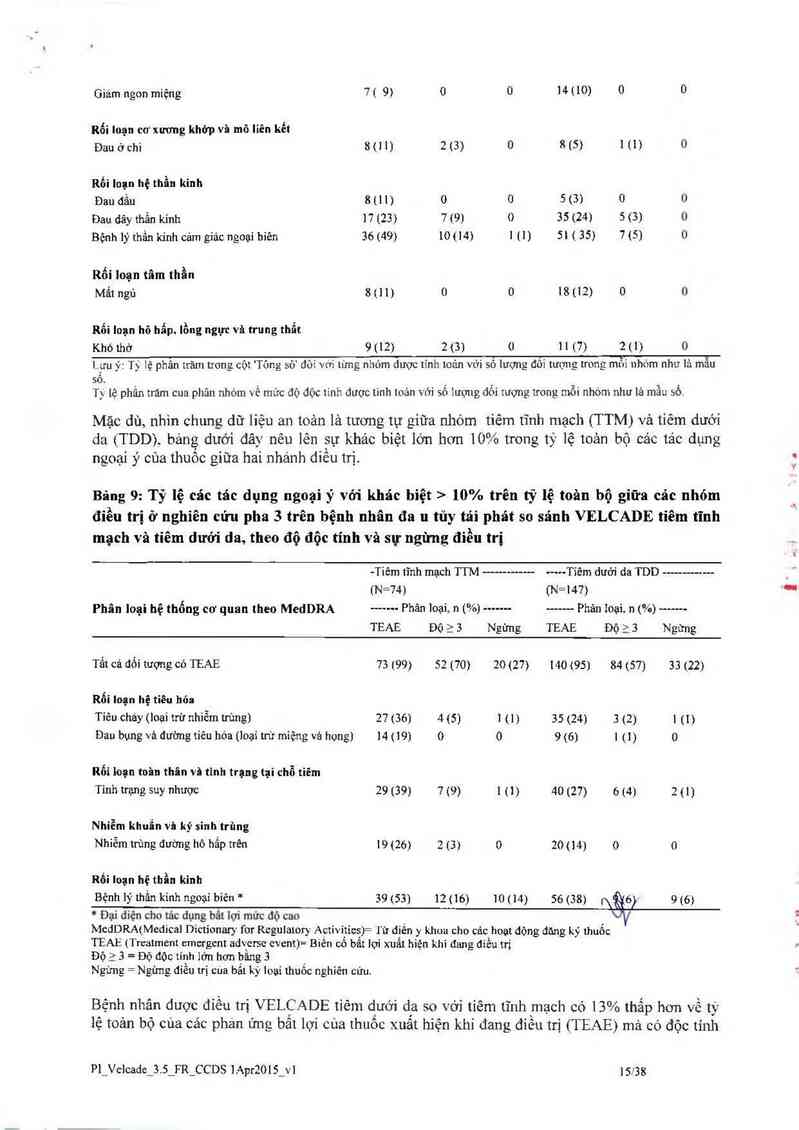
21Ủ.OỮOÍpL- 10% trên tỷ lệ toân bộ giữa các nhóm
điều trị ở nghiên cửu pha 3 trên bệnh nhân đa 11 tủy tái phát so sánh VELCADE tiêm tĩnh
mạch vả tiêm dưới da, theo độ độc tính và sự ngừng điếu tri
-Tiếm tĩnh mạch TTM -—-———-— --…Tiêm dưới đa TDD ——-———— _
(N=74) (N=147) '—
Phân loại hệ thống cơ quan theo Med DRA ------ Phân lũạỉ.` n (%) -------------- Phân 101114 n (%) “"…
TEAE Độ a 3 Ngừng TEAE Độ a 3 Ngừng
Tất cả đối tượng có TEAE 73 (99) 52 (70) 20 (27) 140 (95) 84 (57) 33 (22)
Rối Ioạn nạ tỉêu hóa
Tiêu chảy (loai trừ nhiễm trùng) 27 (36) 4 (5) 1 (1) 35 (24) 3 (2) 1 (1)
Đau bụng vả đường tiếu hóa (loại trừ miệng vả hong) 14 (19) 0 0 9 (6) 1 (1) 0
Rối loạn toim thân và tlnh trạng tại chỗ tiêm
Tinh trạng suy nhược 29 (39) 7 (9) l (1) 40 (27) 6 (4} 2(1)
Nhiễm khuẩn vả ký sinh trùng
Nhiễm trùng đường hô hấp trên 19 (26) 2 (3) 0 20 (14) 0 0
Rối loạn hệ thần kinh
Bệnh lý thần kỉnh ngoại biên * 39 (53) 12 (16) 10 (14) 56 (38) (\gó) 9 (6)
’ Dại diện cho tảc dụng bảt lợi mức độ cao
MedDRA(Medical Dictionary for chulatory Activities)= lữ diến y khuc cho các hoạt dộng đăng ký thuốc
TEAE (Treatment emergent advctsc cvent)= Biến cô bắt lợi xuất hiện khi đang điếu trị '
Độ > 3= Độ độc tính lớn hơn bằng 3
Ngừng= Ngừng điếu trị cua bất kỳ loại thuốc nghiến cứu.
Bệnh nhân dược đíếu trị VELCADE tiêm dưới da so với tiếm tĩnh mạch có 13% thắp hơn về tỷ
lệ toản bộ cúa cảc phán ứng bất lợi cùa thuốc xuất hiện khi đang điều trị (TEAE) mà có độc tính
Pl_Velcade_3.S_FR_CCDS lAprZOl 5_v1 151'38
mủc độ 3 hoặc lớn hơn (57% so VỚỈ 70% tương ửng), vả thắp hơn 5% về tỷ lệ ngừng VELCADE
(2 2% so vởi 27%). Tỷ lệ toản bộ về liêu cháy (24% đối xới nhóm TDD và 36% đối với nhòm
TTM) đau bụng vả đuờng tiêu hóa (6% ở nhóm TDD so vởi 19% ở nhóm TI M) tình trạng suy
nhược (27% 0 nhóm TDD so vởi 39° ’o 6 nhóm TTM) cảc nhiễm trùng đường hô hấp trên ( 14%
ở nhóm TDD so với 26% ở nhóm TTM ) vả bệnh lý thằn kinh ngoại vi NEC (38% ở nhóm TDD
so vởì 53% 0 nhóm TTM) lả thắp hơn từ 12% -15% ở nhóm tiêm dưới da so với nhóm tiêm tĩnh
mạch. Ngoải ra, tỷ ỉệ bệnh lý thần kỉnh ngoại biên có độc tính mức độ J hoặc cao hơn có tỉ iệ
thẳp hon 10°… (6% ơ nhóm TDD so vởi 16% nhóm TTM). vả ty lệ ngùng điểu trị do bệnh lý thần
kỉnh ngoại bíêii lả 8% thắp hơn cho nhóm tiêm dưới da (5 %) so vởi nhóm tiêm tĩnh mạch
(12%).
6% bệnh nhân nhóm tiêm dưới da được bảo cảo có phản ứng bất lợi tại chỗ tiêm. chu yếu 111 đô
da Chỉ có 2 (1%) bệnh nhãn đă được bảo cảo ỉả có phản ứng nghiêm trọr1g Những phản ứng bất
lợi tại chỗ nghiêm trọng nảy ỉả 1 trường hợp ngứa vả ] trường hợp đó da Những phản ứng nảy
hiếm khi dẫn đến thay đổi lìêu ]ưọng và tất cả đều được phục hồi trong vòng trung vị 6 ngảy.
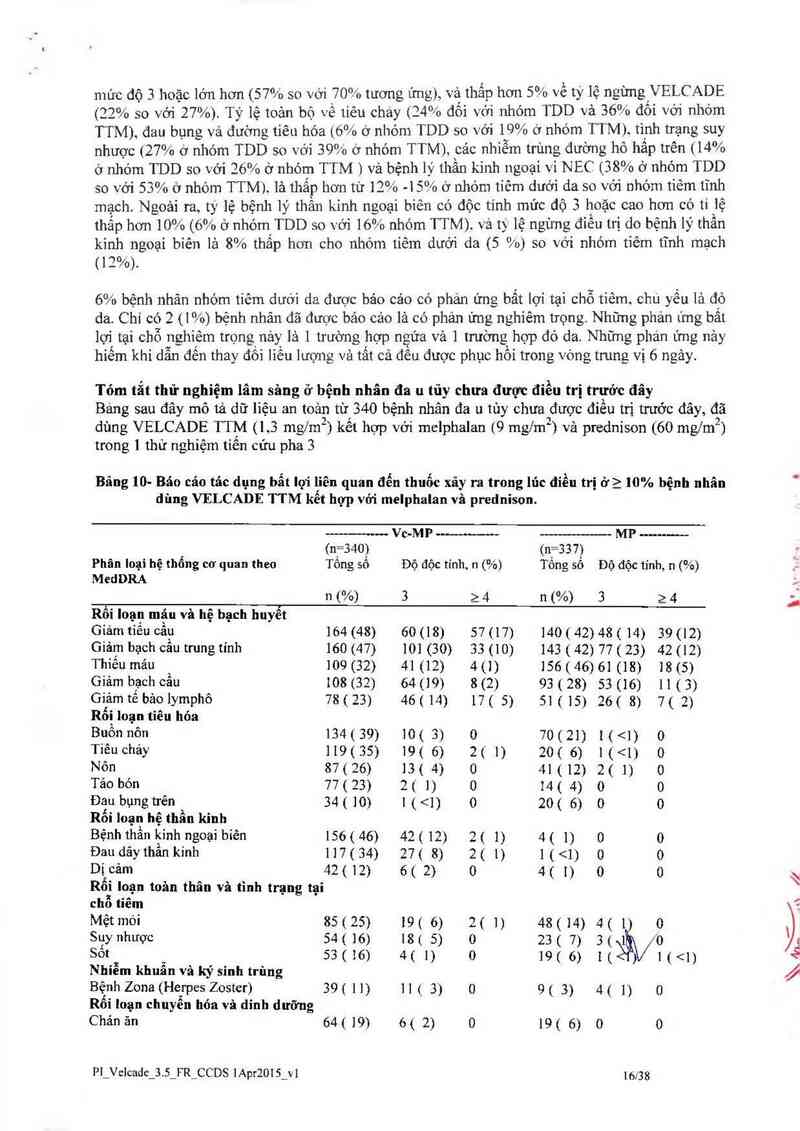
Tóm tắt thử nghỉệm lâm sâng ở bệnh nhân đa 11 tủy chưa được điều trị trước đây
Báng sau đây mô tả dữ liệu an toản từ 340 bệnh nhân đa 11 tùy chưa 2được điều trị trước đây, đ²ã
dùng VELCADE TTM (l 3 mg/m2 ) kết hợp với melphalan (9 mg/m2 ) vả prednison (60 mglm2 )
trong 1 thử nghiệm tiến cửu pha 3
Bâng 10- Báo cáo tác dụng bẳt lợi liên quan đến thuốc xãy ra trong lúc điều trị ở> 10% bệnh nhân
dùng VELCADE TTM kễt hợp với melphalan vả prednison.
Vc-MP ——-————— MP ----- ——-~
' (n_=340) (n_=337)
Phân loại hệ thông cơ quan theo Tông sô Độ độc tính. 11 (%) Tông sô Độ độc tính, 11 (%)
MedDRA
n (%) 3 2 4 n (%) 3 2 4
Rối loạụ mặn và hệ bạch huyễt
Giảm tiêu Câẫl 164 (48) 60 (18) 57 (17) 140 ( 42) 48 ( 14) 39 (12)
Giảm bạch cau trung tính 160 (47) 101 (30) 33 (10) 143 (42) 77 ( 23) 42 (12)
Thiêu mảu 109 (32) 41 (12) 4(1) 156(46)61(18) 18(5)
Giảm bạch cầu 108 (32) 64 (19) 8 (2) 93 ( 28) 53 (16) 11 ( 3)
Giảm tế bảo lymphô 78 ( 23) 46 ( 14) 17 ( S) 51 ( 15) 26( 8) 7( 2)
Rốị loạn tiêu hỏa
Buồn nỏn 134(39) 10( 3) 0 70(21) l( độ 4 lá <1% số bệnh nhân. Tảm phần trăm (8%) bệnh nhân phải ngưng
dùng VELCADE do bệnh lý thần kinh ngoại biên. Tỷ lệ bệnh lý thằn kinh ngoại biên gặp ở bệnh
nhân bị 11 lympho tế bảo mantle (54%) cao hơn bệnh nhân đa 11 tủy (3 6%)
Ở nghiên cửu pha 3 về đa u tùy tái phát sử dụng VELCADE so vởi dexamethason, trong số 62
bệnh nhân dùng VELCADE có bệnh lý thần kinh ngoại biên > độ 2 vả phải chinh liều, 48% bệnh
nhân đã có cải thiện hoặc được giải quyết sau trung vị 3, 8 thảng kể từ lủc khởi phảt triệu chứng
đằu tiên.
Trong các nghiên cứu pha 2 về đa 11 tùy tái phát, trong số 30 bệnh nhân có bệnh lý thần kinh
ngoại biên độ 2 dẫn đến việc ngừng điều trị hoặc có bệnh lý thần kính ngoại bỉên z đcÌtxi 73%
được báo cáo có cải thỉện hoặc gíảí quyết được với trung vị thời gỉan là 47 ngảy để cả1 11 một
mức độ hoặc hơn kể từ liễu cuối của VELCADE.
Ha huvểt' an
Tỷ lệ hạ huyết áp (tư thế, thế đứng vả hạ huyết ảp N08) trên cảc bệnh nhân điều trị VELCADE
là 8% Đa sô bệnh nhân có hạ huyết ảp độ 1 và độ 2 độ 3 lá 2% vả > độ 4 là < 1%. Hai phần
Pl_Velcadc_3.S_FR_CCDS 1Apr201 5_v1 17138
`.\u
trăm (2%) bệnh nhân bị hạ huyết ảp được bảo cản, như là phản ủng bất lợi nghiêm trọng, và 1%
phái ngừng điều trị do hạ huyêt áp. Tỷ lệ hạ huyêt ảp ở bệnh nhân đa 11 tủy (8%) tương tự von
bệnh nhân bị 11 lympho tế bảo mantle (9%). Thêm vảo đó, < 1% bệnh nhân bị hạ huyêt ảp có kem
ngất.
Giảm bạch cầu trung tính .
Giảm số lượng bạch cầu trung tính trong thời gian dùng VELCADE (ngảy 1-11) và trở lại mức
ban đầu trong thời gian nghỉ 10 ngảy của mỗi chu kỳ đỉếu trị. Nhìn chung, có 15% bệnh nhân
giảm bạch cẩu trung tính, giảm bạch cằu trung tính độ 3 lá 8%, ì độ 4 13 2%. Giảm bạch cầu
trung tính được báo cảo như là một phản ứng bất lợi nghiêm trọng gặp 61 < 1% bệnh nhân, và <
1% số bệnh nhân phải ngừng điều trị do gíảm bạch cầu trưng tính. Tỷ lệ giảm bạch cầu trung tính
ở những bệnh nhân đa u tùy (16%) cao hơn so với những bệnh nhân bị u lympho tế bảo mantle
(5%). Tỷ lệ giảm bạch cầu trung tính >; độ 3 cũng cao hớn ở bệnh nhân đa 11 tủy (12%) so với
những bệnh nhân bị u lympho tế bảo mantle (3%).
Tình trang suy nhược (mêt mói. khó ớ. Vếu ớt, suy nhươc)
54% số bệnh nhân được báo cảo có tinh trạng suy nhược. Mệt mỏi độ 3 là 7% và 2 độ 4 lá < 1%
số bệnh nhân. Suy nhược độ 3 là 2% và 2 độ 4 lá < 1% số bệnh nhân. Hai phần trăm (2%) số
bệnh nhân phải ngừng điều trị do mệt mỏi và < 1% số bệnh nhân ngừng diều trị do yếu và suy
nhược. Tình trạng suy nhược được bảo cảo ở 53% số bệnh nhân đa 11 tùy và 59% bệnh nhân bị u
lympho tế bảo mantle.
Sốt
Sốt (>38°C) được bảo cảo như 13 một phán ứng bất lợi ở 21% số bệnh nhân. Sốt độ 3 13 1% và 2
độ 4 lá < 1%. Sốt được bảo cảo như là một phản ứng bất lợi nghiêm trọng gặp ở 3% số bệnh
nhân, và dẫn đến < 1% số bệnh nhân phải ngừng đỉều trị VELCADE®. Tỷ lệ sốt ở những bệnh
nhân đa u tùy (23%) cao hơn so với những bệnh nhân bị 11 lympho tế bảo mantle (10%). Tỷ lệ sốt
. o
2 độ 3 lá 1% ở bệnh nhân đa 11 tủy và ở những bệnh nhân bị 11 lympho tê bảo mantle lả <1%. _x_
Nhiễm vi rủt Hemes
Xem xét sư dụng dự phòng thuốc khảng vi rút ở bệnh nhân đang được điều trị bằng VELCADE.
Trong các nghiên cứu ngẫu nhiên ở những bệnh nhân đa 11 tùy chưa được điều trị trước đó vả tải
phảt, tỉ lệ vi rút herpes zoster tái hoạt động xảy ra phổ biến ở nhóm bệnh nhân dùng VELCADE
(trong khoảng từ 6-11%) so với nhóm chứng (3-4%). Herpcs simplex được ghi nhận ở 1-3%
bệnh nhân dùng VELCADE và ở nhóm chứng cũng là 1-3%. Trong nghiên cứu ở những bệnh
nhân đa 11 tủy chưa được đìều trị trước đó, ở nhóm VELCADE, melphalan vả prednison tỷ lệ vi
rủt herpes zoster tải hoạt động trên những bệnh nhân được điều trị dự phòng thuốc kháng vi rút
(3%) ít phổ biến hơn so với những bệnh nhân không được điều trị dự phòng thuốc khảng vỉ rủt
(17%).
Tóm tắt thử nghiệm lâm sảng trên bệnh nhân 11 lympho tế bảo mantle tái phát
Dữ liệu an toán cùa thuốc ở bệnh nhân bị u lympho tế bảo mantlc tái phảt đã được đánh giá trong
[ nghíên cứu pha 2 [M34103-053 (PINNACLE)] vởi 155 bệnh nhân tham gia được điều trị với
VELCADE ở liều khuyến cáo 13 1,3 mg/m². Hồ sơ an toản của VELCADE ở các bệnh nhân nảy
đều tương tự vởi hồ sơ an toản đã ghi nhận ở bệnh nhân bị đa u tùy. Khảc biệt đáng kể giữa 2
nhóm đối tượng bệnh nhản nảy 13 tỷ lệ giảm tiểu cấu, giảm bạch cầu trung tính, thiếu má`ừl buồn
nỏn, nôn và sốt được bảo cản thường xuyên hơn ở bệnh nhân bị đa u tủy so với bệnh nhân bị 11
PI_Velcade_ìSJ—`R_CCDS 1Ap12015_v1 18/38
.Ịg
1ympho tế bảo mantle; trong khi đó tỷ lệ bệnh thần kinh ngoại biên, phảt ban và ngứa ở nhóm
bệnh nhân bị u lympho tế bảo mantle lại cao hơn so vởi nhóm bệnh nhân bị đa 11 tủy.
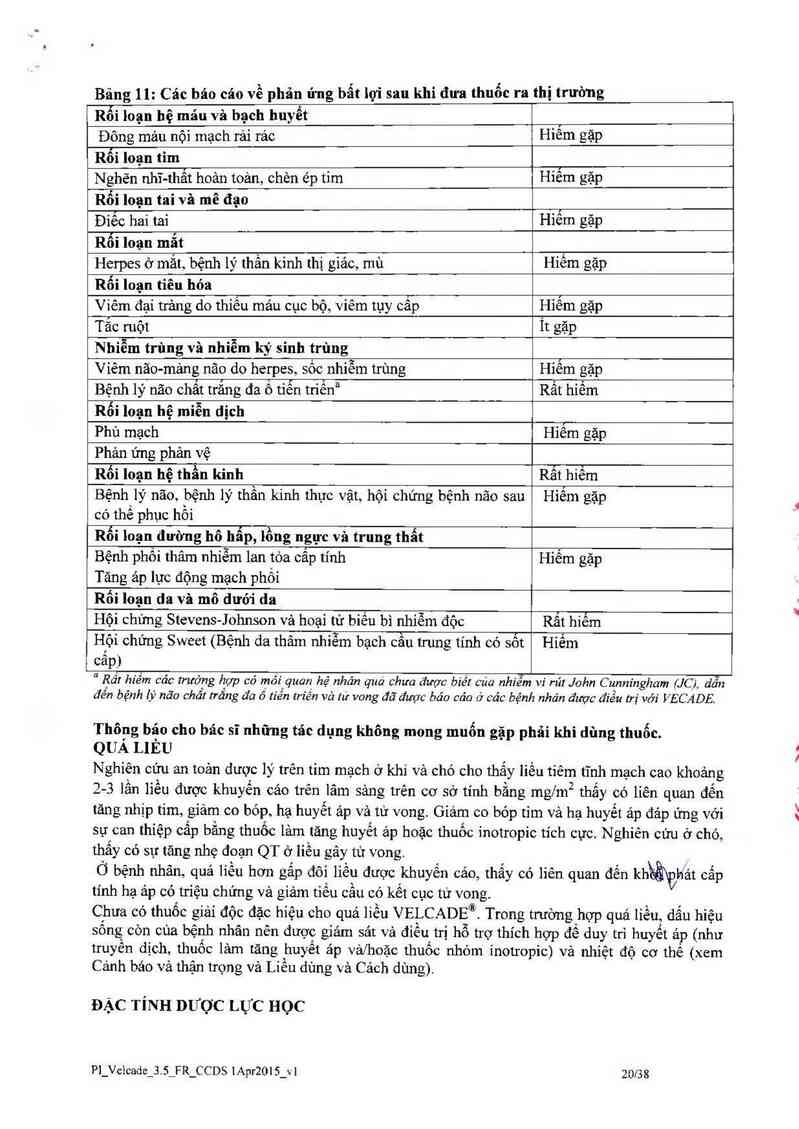
Kinh nghiệm hậu măi
Các phản ửng bất lợi đảng kể trên lâm sảng cùa thuốc được liệt kê dưới đây nểu chưa được trình
bảy ở phần trên.
Tần suất đưa ra dưới đây phản ảnh tỉ lệ bảo cảo phản ứng bắt lợi cùa thuốc từ kình nghiệm sử
dụng VELCADE® hậu mãi trên toản thế giới. Tuy nhiên, tần suất đưa ra dưới đây chỉ phản ảnh tỉ
lệ_báo Cảo vả lfhông thệ dự đoản chính xảo xảo suất xảy ra. Cảo phản ứng bất lợi của ìỆpột' được
xêp loại theo tân sô xuât hiện băng quy ước như sau:
Rất phố biển (2 1110),
Phổ biến (2 M… và <1/10)
Ít gặp (2 1/1000 và <1/100)
Hiểm gặp (z1/10000 vả <1/1000)
Rất hiếm gặp (<1/10000, kể cả các bảo cảo riêng lẻ).
PI_Vclcade_3.S_FR_CCDS 1Apr2O ] 5_vl ]9/38
c.—
Bâng 11: Cảc báo cáo về phản ứng bẩt lọi sau khi đưa thuốc ra thị trường
Rối loạn hệ mảu vả bạch huyết ,
Đông máu nội mạch rải rác Hiêm gặp
Rối loạn tim ,
Nghẽn nhĩ-thất hoản toản, chèn ép tim Hiêm gặp
Rối loạn tai và mê đạo ,
Điếc hai tai Hìêm gặp
Rối loạn mắt .
Herpes ở mắt, bệnh lý thần kinh thị giác, mù Hiêm gặp
Rối loạn tiêu hóa ,
Viêm đại trảng do thiếu máu cục bộ, viêm tụy cấp 1-Iiêm gặp
Tắc ruột It gặp
Nhiễm trùng và nhiễm ký sinh trùng
Viêm năo-mản g não do herpes, sổc- nhiễm trùng Hiếm gặp
Bệnh lý não chất trắng đa ô tiễn triêna Rất híếm
Rối loạn hệ miễn dịch ,
Phù mạch Hiêm gặp
Phản ứng phản vệ
Rối loạn hệ thẫn kinh Rẫi hiểm
Bệnh lý não, bệnh lý thần kinh thực vật, hội chứng bệnh não sau Hiếm gặp
có thể phục hổi
Rối loạn đường hô hẩp, lồng ngực và trung thất
Bệnh phối thâm nhiễm lan tóa cấp tính Hiếm gặp
Tăng ảp lực động mạch phổi
Rối loạn da vả mô dưới da
Hội chứng Stevens-Johnson vả hoại từ biến bì nhiễm độc Rất hiểm
Hội chứng Sweet (Bệnh da thâm nhiễm bạch cầu trung tính có sốt Hiếm
câp)
“ Rẩz hiếm các trường họp có mỏi Iquan hệ nhân qua` chưa được biét cua nhiễm vi rú! John C unnmgham (JC) dẫn
đến bệnh lý não chầt trăng đa 6 tiến m'én vả … vong đã được băo cáo ở các bénh nhan được điểu trị với VECADE.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phâi khi dùng thuốc.
QUẢ LIÊU
Nghiên cứu an toản dược lý trên tim mạch ở khi và chó cho thấy iiều tiêm tĩnh mạch cao khoảng
2-3 lần liều được khuyến cảo trên lâm sảng trên cơ sở tính bằng mg/m2 thấy có lỉên quan đến
tâng nhịp tim, giảrn co bóp, hạ huyểt áp và tử vong. Gíảm co bóp tim và hạ huyết ảp đáp ứng vởi
sự can thỉệp cấp bằng thuốc lảm tăng huyết ảp hoặc thuốc inotropic tích cực. Nghiên cứu ở chó
thấy có sự tăng nhẹ đoạn QT ở liều gây tử vong.
Ở bệnh nhân, quá liều hơn gấp đôi liền được khuyến cảo, thấy có liên quan đến kh hảt cẳp
tính hạ ảp có triệu chứng và giảm tiểu cằu có kết cục tử vong.
Chưa có thuốc giải độc đặc híệu cho quá liều VELCADEẤ Trong trương hợp quá Iiều, dấu hìệu
sống` còn của bệnh nhân nên được giám sát và điều trị hỗ trợ thích hợp để duy trì huyết' ap (như
truyền địch, thuốc lảm tăng huyết áp vảfhoặc thuốc nhóm ỉnotropic) và nhiệt độ cơ thể (xem
Cánh bảo và thận trọng và Liều dùng và Cách dùng)
ĐẶC TÍNH DƯỢC LỰC HỌC
Pi_Vcicade_3.S_FR_CCDS lApr2OI 5_vl 20138
\—
ll
Cơ chế tảc dõne
Bortezomib là chất ức chế có hồi phục proteasom 26S có hoạt tính gỉống chymotrypsỉn cùa tế
bảo động vật có vú Proteasom 268 là phức hợp protein lớn lảm thoải biến protein bị ubiquitin
hóa. Con đường ubiquitin-proteasom đóng vai trò thiết yếu trong điều hòa nồng độ nội bảo của
cảc protein đặc hỉệu nhờ đó duy tri hằng định nội mô bên trong tế bảo. Ừc chế proteasom 268
ngăn chặn sự phân giải protein đich mã có thể ảnh hướng đến việc tmyền đa tín hiện bên trong tế
bảo. Sự cản trở cơ chế hằng định nội mô bình thường nảy có thể dẫn đến chết tế bảo. Thử
nghiệm đã chứng minh rằng Bortezomib lá thuốc độc tính tế bảo đối vởi nhiều loại tế bảo ung
thư khảc nhau trong phòng thí nghiệm. Bortezomib lảm chậm phát triến khối u trên động vật thí
nghiệm theo mô hình khối u dạng khỏng lâm sảng, bao gồm cả đa u tủy.
Dữ liệu in vilr0, ex- vivo, vả cảc mô hỉnh trên động vật với bortezomib cho thấy thuốc lảm tăng
sự biệt hóa vả hoạt động của tạo cốt bảo và ức chế chức năng hủy cốt bảo. Nh1mg tảc động nảy
đã được quan sảt thấy ở nhĩmg bệnh nhân đa u tủy bị ảnh hướng bới một bệnh hủy xương tiến
triển vả được điểu trị bằng bortezomib.
Nghiên cứu lâm sâng
Hiên quả lâm sảng trèn bênh nhản đa u tùy chưa điều tri trưởc đó
Một nghiên cứu lâm sảng tiến cứu pha 3, quốc tế, ngẫu nhiên (1:1), mở nhãn (MMY-3002
VISTA) được thực hiện trên 682 bệnh nhân đa u tủy chưa được điều trị trước đó để xác định
VELCADE (1,3 mg/m2 tiêm tĩnh mạch) phối hợp với melphalan (9 mg/m2) vả prednison(ôO
mg/mz) cải thiện thời gian sống không tiến triến bệnh khi so sảnh với melphalan (9 mg/mz) vả
prednison (eo mg/m²). Điều trị tối đa 13 9 chu kỳ (khoảng 54 tuần) và bị dừng sớm vì bệnh tiến
triến hoặc có độc tính không chấp nhận được. Trung vị tuối của bệnh nhân trong nghiên cứu lả
71 tuổi, 50% là nam giởi. người da trắng chiếm 88% vả trung vị điềm đảnh giá thể trạng
Kamofsky đối với bệnh nhân lả 80. Tỉ lệ bệnh nhân vởi cảc thế đa 11 tủy IgGIIgA/chuỗi nhẹ lả
63%/25% | 8%, trung vị hemoglobin lả 105g/L, trung vị số lượng tiểu cầu lả 221,5x1091L. Tỉ lệ
tương tự bệnh nhân có độ thanh thải creatinin S 30 mL/phút (3% ở mỗi nhóm).
Tại thời điếm phân tích giữa kỳ được xác định trước, đã đạt tiêu chí chính về thời gian cho đến
khi bệnh tiến triển và bệnh nhân ở nhóm M+P được cho sử dụng phác đồ Vc+M+P. Trung vị
thời gian theo dõi là 16,3 thảng. Cập nhật sau cùng về sống còn đã được thực hiện với trung vị
thời gian, theo dõi 60.1 tháng. Nhóm điều trị Vc+M+P đã đạt được lợi ích sống còn đáng kể có ý
nghĩa thông kê (HR = 0,695, p = 0,00043) bất kể các phương phảp điều mị tiểp theo bao gồm
phảc đô dựa trên VELCADE. Trung vị sông còn cùa nhóm điếu trị Vc+M+P được ước tính lả
56,4 thảng so vởi 43,1 thảng cùa nhóm điều mị vởi M+P. Kết quả hiệu quả được trình bảy trong
Bảng 12
Bảng 12: Kết quả về hiệu quả sau phẩn cập nhật cuối cùng về sống còn cũa nghỉẽn cứu WỦA
Tỉêu chí hỉệu quả Vc+M+P M+P
n=344 n=338
Thời gian đến khi bệnh tiến triển
Biển cô (%) 101 (29) 152 (45)
Trung vị (95% C1) 20,7t11ả11g 15,0 thảng
(17,6, 24,7) (14,1, 17,9)
Pl_Velcadc_3.S_FR_CCDS IAprZOIS_vl 21f38
II nụ…
Tỉ số rủi rob
(0,42, 0,70)
(95% CIc)
Giá trị p 0,000002
Sỗng không tiến triên bệnh
Biến cô 11 (%) 135 (39) 190 (56)
Trung vị3 (95% CI) 18,3 tháng 14,0 thảng
(16,6,21,7) (11,1, 15,0)
Tỉ số rủi rob 0,61
(95% cư (0,49, 0,76)
Giá trị pc 0,00001
Sống còn toăn bộ°
Bỉến cổ (chết) 11 (%) 176 (51.2) 211 (62.4)
Trung vịa (95% CI) 56,4 tháng 43,1 thảng
(52,8, 60,9) (35,3, 48,3)
Tỉ số rủi ro“ 0,695
(95% CI) (0,567, 0,852)
Giá trị pc 0,00043
Tỉ lệ đảp ửng n=337 n=331
Dân sô n- — 668
cư 11 (%) 102 (30) 12 (4)
PRl n (%) 136 (40) 103 (31)
nCR n (%) 5 (1) 0
CR+PR' n(%) 238(71) 115 (35)
Giá trị p <10-10
Giảm M-protein huyết thanh n=336 n=331
Dân số° n=667
>=90% n (%) 151 (45) 34 (10)
Thời gian đểu đáp ứng đầu tiên của CR +
PR
Trung vị 1,4 tháng 1 4,2 thảng
Trung vị 3 khoáng thời gian đảp ửng
CRf 24.0 tháng 12,8 thảng
CR + PRf 19,9 thảng 13,1 tháng
Thời gian đễnj Ian điều trị tiếp theo
Bỉến cô 11 (%)
224 (65,1) 260 (76,9)
Trung vịa (95% CI) 27,0 thảng 19,2 tháng
(24,7,31J) (17.0,21,0)
Tỷ 1ệ rủi ro° 0,557
(95% CI) (0,462, 0,671)
Giá trị p"` (< 0,000001)
Ịưởc tính Kaplan-Meier
Đảnh gỉả ti sô rùi ro dựa trên mô hình tỷ lệ rùi ro Cox được đíều chỉnh cho các yểu tố phân tẩng: beta2-
microglobulin, albumin, và khu vực. Tỷ số rủi ro ít hơn 1 chi ra một lợi thế cho VcMP.
Giá rn' p không đảng kế dựa trên cảc phép thử log rank được phân tầng được diều chinh đối với cảc yểu tố phân
tầng: beta2- -microglobulin, albumin, và khu vực
Giá trị p cho tỉ lệ đảp úng (CR + PR) từ phép kiếm tra chi bình phương Cochran- Mantel- Haenszel đuủỀtỀíều chinh
cho cảc yêu tố phân tẩng
Dân số đảp ứng bao gồm những bệnh nhân có bệnh được đánh giá lúc ban đằu
CR= Complete response (Đảp ứng hoản toản); PR= Partial response (Đáp ứng một phần). Tiêu chuẩn EBMT
° Tắt cả cảc bệnh nhân được chọn ngẫu nhiên bị bệnh tiết
* Cập nhật sống còn dựa trên trung vị thời gỉan theo dõi là 60,1 tháng
CI: Confidence Interval (Khoảng tin cậy)
PI_VeIcade_3.ã_FR_CCDS lApr2015_vl
221²38
II vhd'
Bệnh nhân đủ điều kiện để ghép tế bảo gốc tạo máu
Hai nghiên cứu pha 3 ngẫu nhiên nhãn mờ, đa trung tâm (IF M 2005— 01, MMY- 3010) được thực
hiện để chứng minh hiệu quả vả sự an toản cùa VELCADE trong phác đồ phối hợp 2 thuốc vả 3
thuốc hóa trị khác, như lá phác đồ dẫn nhập trước khi ghép tế bảo gôc trên bệnh nhân đa 11 tùy
chưa được diễu trị trước đó.
Trong nghiên cứu IFM- 2005- 01 VELCADE kết hợp với dDexamethason [VcDx, n=240] được
so sánh với vincristin- doxorubicin-dexamethason [VDDx, n=242]. Bệnh nhân trong nhóm
VcDx nhận 4 chu kỳ 21 ngảy, mỗi chu kỳ gổm VELCADE (1, 3 mglm2 tiêm tĩnh mạch mỗi tuần
2 lần vảo các ngảy 1, 4, 8, vả 11), và uỏng dexamethason (40 mg/ngảy vảo cảc ngảy 1 đến 4 và
ngảy 9 đến 12, trong chu kỳ 1 vả 2, vả vảo cảc ngảy 1 đến 4 cùa chu kỳ 3 và 4)
198 bệnh nhân (82%) và 208 (87%) bệnh nhân cùa nhóm VDDx vả VcDx tương ứng được ghép
tế bảo gốc tự thân; Đa số bệnh nhân được ghép một lần duy nhắt. Các đặc điếm nhân khẩu học
và bệnh ban đầu của bệnh nhân lả tương tự như nhau ở cả hai nhóm Trung vị tuổi của bệnh nhân
trong nghiên cứu là 57 tuối, 55% lả nam và 48% số bệnh nhân có nguy cơ cao về mặt gen tế bảo
Trung vị thời gian điều trị là 13 tuần đối vởi nhóm VDDx và 11 tuần đối với nhóm VcDx. Trung
vị sô chu kỳ được điều trị ở cả hai nhóm là 4 chu kỳ
Tiêu chí híệu quả chính của nghiên cứu là tỉ lệ đáp ứng sau điếu trị dẫn nhập (CR+nCR) Một sự
khảo biệt có ý nghĩa thống kê vê CR+nCR được quan sát thẳy ưu thể thuộc nhóm VELCADE
kết hợp với dexamethason. Tiêu chí hỉệu quả phụ bao gồm ti lệ đảp ửng sau ghép (CR+nCR,
CR+nCR+VGPR+PR), sống còn không tiên triên bệnh vả sống còn toản bộ. Kết quả hiệu quả
chính được trình bây trong bảng 13.
Bảng 13: Cảc kết quả về hiệu quả từ nghiên cứu IFM-ZOÙS-Ol
Tiêu chí VcDx VDDx OR; 95% Cl; Giá tri n'
lFM-2005-01 N=240 (dân số ITT) N=242 (ITT dân sô)
RR (sau dẩn nhặp)
l°CR+IICR 14,6 (10,4, 19,7) 6,2 (3,5, 10,0) 2,58 (1,37, 4,85); 0,003
CR+nCR+VGPR+PR 77,1 (71,2, 82,2) 60,7 (54,3, 66,9) 2,18 (1,46, 3,24); < 0,001
% (95°/o CD
RR (sau ghép)"
CR+nCR 37,5 (31,4, 44,0) 23,1 (18,0, 29,0) 1,98 (1,33, 2,95); 0,001
CR+nCR+VGPR+PR 79,6 (73,9, 84.5) 74,4 (68,4, 79,8) 1,34 (0,87, 2,05); 0,179
°/íJ (95% CI)
CI= —khoảng tin cậy; CR=đáp ửng toản bộ, nCR=dáp ứng gần toản bớ, ITT=intcnt to treat; RR=ti lệ đáp ứng;
Vc=VELCADE. VcDx= VELCADE, dexmncthason: VDDx=vincrỉstin, doxorubicin dexamcthason; VGPR= —đáp ứng
một phẩn rất tốt; PR= đáp ứng một phẳn; OR= tì suất chênh.
* Tiẽu chi chinh
OR đối với 11 16 đảp ứng dựatrẽn ước tính Mantel-Haenszel cùa 11 suất chênh chung dối với bảng phăn tẩng; giả ưị
p-valucs theo phép thử Cochran Mantcl-Haenszel.
Liên hệ với tỉ số đảp ửng sau lần ghẻp thứ hai cho cảc đối tượng được ghép lần hai (421240 [18%] ở nhóm VcDx vả
52/242 [21%] ở nhóm VDDx].
Chú ý: Mõt OR > 1 cho thây ưu thế cùa phảc đổ dẫn nhặp cỏ Vc.
Trong nghiên cứu MMY- 3010 so sánh điếu trị dẫn nhập với VELCADE kết hợp với thalidomid
vả dexamethason [VcTDx, n=130] với thaịidomid-dcxamethason [TDx, n=127]. Cảc bệnh nhân
ở nhóm VcTDx được điếu trị 6 chu kỳ 4 tuần, mỗi chu kỳ gồm VELCADE (1,3 fng/m2 dùng mỗi
tuần 2 lần vảo ngảy l, 4, 8, vả 11, tỉếp theo lả thời gian nghỉ 17 ngảy từ ngảy 12- -28),
dexamethason (40 mg uống vảo cảc ngảy 1- 4 vả ngảy 8- 11), vả thalidomid (uống 5 g mỗi
ngảy vảo cảc ngảy 1-14, tăng lên 100 mg vảo các ngảy 15- 28 vả sau đó lên đến Iiều 200 hảng
ngảy)-
105 bệnh nhãn (81%) và 78 bệnh nhân (61%) tương ứng ở nhóm VcTDx vả TDx đã nhận một
lần ghép tế bảo gôc tự thân duy nhất. Các đặc điêm nhân khấu học và bệnh ban đầu của bệnh
nhân tương tự như nhau ở cả hai nhóm Trung vị tuội của bệnh nhân trong nghiên cứu ờ nhỏm
VcTDx vả TDx tương ứng là 57 tuồi vả 56 tuôi, bệnh nhân da trắng tương ứng lả 99% và 98%;
PI_VeIcade_3.S_l-`R_CCDS lAprZOl S_vl 23738
II «'A
nam giới chiếm tương ứng là 58% và 54%. Ô nhóm VcTDx 12% số bệnh nhân được xếp loại
nguy cơ cao về mặt gen tế bảo so với 16% ở nhóm TDx. Trung vị thơi giạn điểu trị là 24 tuân và
trung vị số chu kỳ được điều trị lả 6 chu kỳ vả nhẩt quán qua cảc nhóm đỉều trị
Tiêu chí hiệu quả chính của nghiên cứu lả tỉ lệ dáp ứng sau điều trị dẫn nhập và đảp ứng sau
ghép (CR+nCR) Một sự khác biệt có ý nghĩa thống kê về CR+nCR được quan sảt thẳy ưu thể
thuộc nhóm VELCADE kểt hợp với dexamethason vả thalidomid. Tiêu chí hiệu quả phụ bao
gồm sống còn không tiến triển bệnh và sống còn toản bộ. Kết quả hiệu quả chính được trinh bảy
trong Bảng 14.
Bảng 14: Các kết quả về hiệu quả từ nghìên cứu MMY-SOIO
Các tiêu chí VcTDx TDx OR; 95% CI; Giá trị pI
MMY-3010 N=130 (dân số ITT) N=127 (dân số ITT)
*RR (sau điểu trị dấn nhập)
CR+nCR 49,2 (40,4, 58,1) 17,3 (11,2, 25,0) 4,63 (2,61, 8,22); < 0,001'
CR+nCR+PR % (95% CI) 84.6 (77,2, 90,3) 61,4 (52,4, 69,9) 3,46 (1,90, 6,27); < 0.001a
*RR (sau ghép)
CR+nCR 55,4 (46,4, 64,1) 34,6 (26,4, 43,6) 2,34 (_1,42, 3,87); 0.001“
CR+nCR+PR % (95% CI)
77,7 (69,6, 84,5)
56,7 (47,6, 65,5)
2,66 (1,55, 4,57); < 0,001“
Cĩ=khoảng tin cậy; CR=đảp ửng hoản toản; nCR=đảp ứng gắn hoản toản; ITT=intent to treat; RR=ti lệ đáp ứng; Vc=VELCADE;
VcIDx=VELCADE, thalidomid. dexamethasơn; TDx=thalidomid. dcxamethason; PR=đáp ứng mòt phân: OR=ti suất chênh
* tiêu chỉ chính
a
OR đối vởi tỉ lệ đáp ứng dựa trên ước tinh Mantcl-Hacnszc] của ti suất chênh chung đổi vởi báng phân tầng; giá trị p theo
phép thử Cochran Mantcl-Hacnszcl.
Chú ý: Một OR › 1 cho thấy ưu thế cùa phảc đồ dẫn nhập có Vc
Cảc nehiên cứu lãm sảng nha 2 trên bênh nhân đa u tủv tái nhát
Một nghiên cứu đa trung tâm, một nhảnh, nhãn mở để xảc định tính an toản vả hiệu quả của
VELCADETTM đã dược tiến hảnh trên 202 bệnh nhân đã nhận ít nhất 2 trị liệu trưởc đó và có
biểu hìện bệnh tiến triền ở lần điều trị gần nhất. Trung vị số trị liệu trước đó là sáu. Đặc điểm
bệnh lý và bệnh nhân tại thời điểm ban đầu được tóm tắt 6 Báng 15
Tìêm tĩnh mạch nhanh 1 liều VELCADE ] ,3mg/m2 hai lần mỗi tuần trong 2 tuần, sau đó nghỉ 10
ngảy còn lại của chu kỳ (chu kỳ 21 ngảy) cho tối đa 8 chu kỳ điều trị. Nghiên cứu sử dụng thay
đối liều lượng do độc tính (xem Liều dùng và Cách dùng) Bệnh nhân có đảp ửng với đỉều tn_
VELCADE được phép tỉếp tục điểu trị VELCADE trong một nghiên cứu mở rộng.
Bâng 15: Tóm tắt cảc đặc điểm bệnh lý và bệnh nhân*
N = 202
Đặc điểm bệnh nhân
Trung vị độ tuối (tinh theo năm) (khoảng) 59 (34, 84)
Giới tính: Namlnữ 60% | 40%
Chủng tộc: da trắng/da đen/khảc 81% ! 10% f8%
Điểm dảnh giá thể trạng Karnofsky 570 20%
Hemoglobin <100 g/L 44%
Số lượng Tiểu cầu <7s x 10°JL zwo
\h
LLu4
Đặc điểm bệnh lý
Thể loại đa u tủy (%): IgG/Ichhuỗi nhẹ 60% / 24%! 14%
Trung vị [32-microglobulỉn (mg/L) 3,5
Trung vị độ thanh thải creatinin (mL/phút) 73,9
Bất thường gen tế bảo 35%
PI_VcIcade_lS_FR_CCDS lAprZOIS_vl 247'38
Il
Mất nhiễm sẳc thể 13 15%
Trung vị thời gian bệnh đa 11 tủy từ khi được chẩn đoán (theo năm) 4.0
Điều trị trước đó
Steroid bất kỳ, ví dụ, dexamethason, VAD 99%
Tác nhân alkyl bắt kỳ, ví dụ, MP, VBMCP 9274
Nhóm anthracyclin bất kỳ, ví dụ, VAD, mitoxantron 81%
Bắt kỳ điều trị thalídomid trước đó 83%
Đã được điều trị ít nhắt 2 trong các nhóm thuốc kế trên 98%
Đã được diều trị it nhất 3 trong các nhóm thuốc kế trên 92%
Đã được điều trị 4 trong cảc nhóm thuốc kể trẽn 66%
Bắt kỳ ghép tế bảo gốclhóa trị liều cao khảc trước đó 64%
Điều trị thứ nghỉệm hoặc cảc điều trị khác trước đó 44%
* Dựa trên số bệnh nhán với cảc dữ liệu ban dầu có sẵn
Đảp ửng với VELCADE dơn trị được trình bảy trong Bảng 16. Tỉ lệ đảp ứng với VELCADE
đơn trị đã được xảo định bởi một ủy ban đảnh gíá độc lập (IRC) dựa trên cảc tiêu chí được xuất
bản bởi Blade vả các tác giả khác. Đáp ứng hoản toả.n (CR) yêu cầu có <5% tương bảo trong tùy
xương, giảm 100% M protein, và một xc't nghiệm cố định miễn dịch âm tỉnh (IF-). Sử dụng cảc
tiêu chí SWOG để đánh giá tỷ lệ đáp ứng cũng được trình bảy. Đảp ứng theo SWOG yêu cầu
giảm 2 75% protein u tủy huyết thanh và / hoặc 2 90% protein nước tiếu. Tổng cộng có 188 bệnh
nhân được đánh giá đảp ứng, 9 bệnh nhân bị bệnh không đảnh giá được cũng không được đảnh
gỉả đáp ứng bởi IRC. Năm bệnh nhân bị loại khỏi phân tích hiệu quả bới vì họ đã có điếu trị tối
thỉếu trước đó.
98% các bệnh nhân nghỉẽn cứu nhận được một liếư2 khởi đầu là 1,3 mgỉm2 tiêm tĩnh mạch 28%
số bệnh nhân nảy đã nhận được một liều 1 ,3 mg/m2 trong suốt nghiên cứu, trong khi 33% bệnh
nhân bắt đằu với lìều 1 ,3 mg/m2 phải gỉảm liều trong thòi gian nghiên cứu. 63% bệnh nhân phải
ngưng it nhất một liếu trong thời gian nghiện cứu. Nói chung, bệnh nhân có xác nhận là đáp ửng
hoản toản (CR) đã nhận thêm 2 chu kỳ điều trị VELCADE nữa sau khi xảo nhận. Khuyến cáo
bệnh nhân có đảp ứng điếu trị nên được điếu trị lên đến 8 chu kỳ VELCADE Trung vị sô chu kỳ
dùng thuốc là 6. '
Trung vị thời gian đên khi đảp ứng là 38 ngảy (từ 30-127. gảy).
Trung vị sông còn của tất cả cảc bệnh nhân tham gia là 16 thảng (khoảng <1— 18 + thảng.
Bản 16: Tóm tắt các I_cểt m_1ả của bênl_1
Phân tích đáp ứng (VELCADE“ đơn trị) N = 188 N (%) (95% CI)
Tỷ lệ đảp ứng toản bộ (Bladé) (CR + PR) 52 (27,7%) (21, 35)
Đáp ứng hoả.n toản (CR)' 5 (2,7%) (1, 6)
Đáp ứng bản phẫn (PR)² 47 (25%) (19, 32)
Lui bệnh lâm sảng (SWOG)3 33 (17,6%) (12, 24)
T . . . . , r , ' _ ' 0
Ciíi)mg VỊ thơi g1an đap ưng ươc tinh theo Kaplan Meter (95 Am 365 ngảy (224, NE)
' Đảp ứng hoòn toản (CR) yêu câu có <5% rương bờo lrong tủy xương, M prolein giám 100%, vả một xét nghiệm có
định miên dịch âm rính (lF-l
Pl_Veicadc_3.S_FR_CCDS 1Apr2015_v1 25138
491
/
'v
II 3111
"Đảp ửng một phần yêu cấu giảm 250% M protein huyết thanh vả 2 90% M protein nước tiêu ít nhất 2 lấn thư cách
nhau tối thiếu 6 mần, bệnh xương vã nồng độ canxi ốn định.
3Lui bệnh 16… sờng (SWOG) yêu cầu giảm 275% M protein huyết thanh vafhoạc a 90% M protein nuớc tiêu í! nhốt
2 lần thử cách nhau tối rhiểu 6 tuần, bệnh xương vả nồng độ caraci ón định.
Trong nghiên cứu nảy, tỷ lệ đáp ứng với VELCADỂÊ 1ả độc lập vởi số lượng và loại trị liệu
trước đó. Có khả nảng giảm đảp ứng trến những bệnh nhân có > 50% tương bảo hoặc gen tế bảo
bất thường trong tủy xuong. Có đáp ứng trên những bệnh nhân có bât thường nhiêm sãc thế 13.
Một nghiên cửu nhỏ về đảp ưng theo liếu đă được thực hiện trên 54 bệnh nhân đa 11 tùy đã nhận
được liều 1,0mg/mz/liều hoặc 1,3 mg/ m 2l1iếu hai lần một tuần cho hai trong số ba tưần. Đã có
một đảp ửng hoản2 toản duy nhất ở mỗi liều, và tỷ lệ đảp ứng toản bộ (CR + PR) là 30% (8/27)
với liều 1,0 mg] m2 vả 38% (10/26) với lieu 1,3 mg/ m².
Những bệnh nhân điều trị với VELCADE đơn trị không đạt được đảp ứng tối ưu (bệnh tiến triến
hoặc ôn định sau 2 hoặc 4 chu kỳ, tương ứng) có thế được dùng thêm dcxamcthason liếu cao kết
hợp với VELCADE (tức lả 40 mg dexamethason với mỗi liếu VELCADE được uống 20 mg vảo
ngảy tiêm VELCADE và 20 mg một ngảy sau khi tiêm VELCADE, (tức là ngảy l, 2, 4, 5, 8, 9,
11, và 12), do đó tống liều là 160 mg trong 3 tuần). Tổng cộng có 74 bệnh nhân được dùng
dexamethason kết hợp vởi VELCADE và được đảnh giả đáp ứng. Mười tảm phần trăm (13Í74)
bệnh nhân đạt được hoặc có đáp ứng cải thiện (CR 1194 hoặc PR 7%) với điều trị kết hợp.
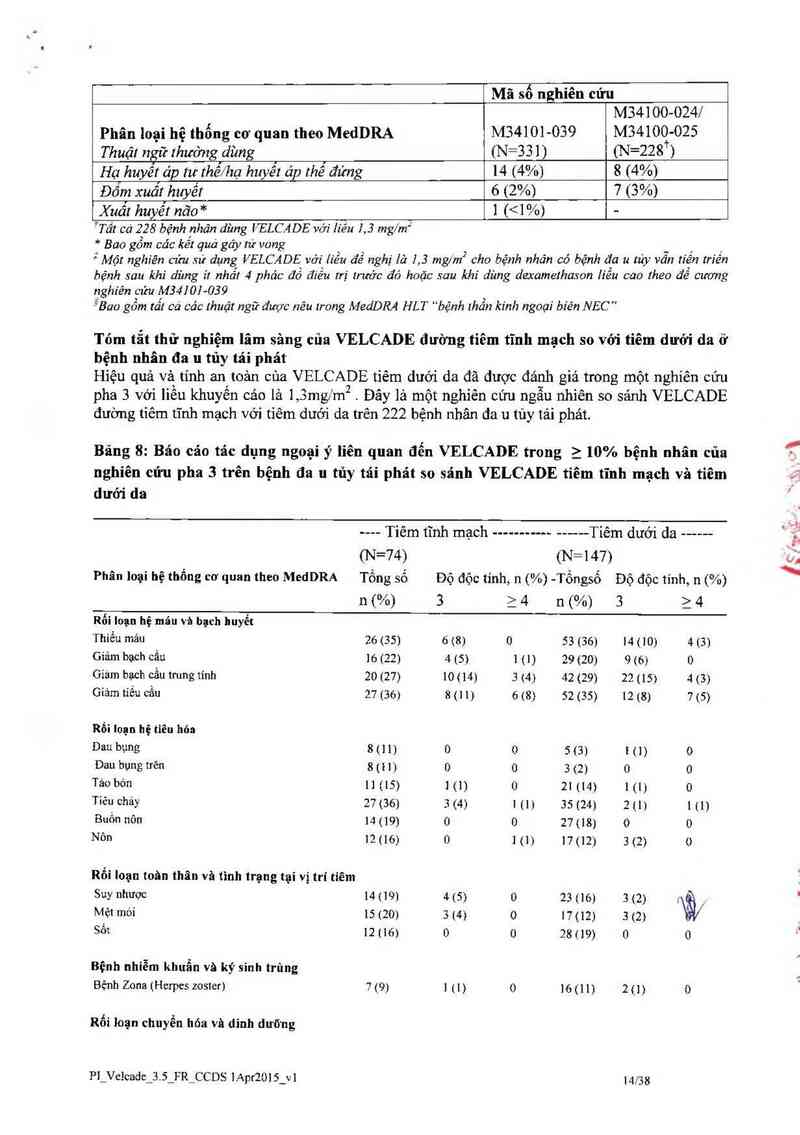
Nchiên cứu lâm sảne. nhãn mở. nqẫu nhiến về đa 11 tủv tải nhảt so sánh VELCADE với
dexamethason:
Một nghiên cứu lâm sảng tiến cứu nhãn mở, phân tầng, ngẫu nhíên (1: 1), quốc tể, pha 3, tuyến
chọn 669 bệnh nhân được thiết kế để xảo định xem liệu VELCADE có đem lại kết quả cải thiện
về thời gian đến khi bệnh tiến triển (TTP) so với dexamcthason lỉếu cao trên bệnh nhân có bệnh
da 11 tủy tiến triến sau 1-3 trị liệu trước đó Bệnh nhân được xem lả khảng trị với dexamethason
liều cao trước đó đã được loại trừ cũng như lá nhũng người có bệnh lý thần kinh ngoại biên ban
đằu > độ 2 hoặc số lượng tiếu cẩu <50.000111L Tống cộng có 627 bệnh nhân được đánh giá đáp
ứng.
Cảc yếu tố phân tầng dựa trên số lượng các lần điều trị trước đó (1 lần trưởc đó so với hơn 1 lần 0
điếu trị), thời gian tiến tríển liên quan đến điếu trị trước đó (tiến triến trong quá trình điều trị
hoặc trong vòng 6 thảng sau khi ngưng điếu trị gần đây nhắt so vởi tải phảt> 6 thánga aư khi '
nhận được điếu trị gân đây nhất), và nông độ (h—microglobulin sảng lọc (< 2 ,5 mg/L so 2,5
mglL)
Các đặc điềm bệnh lý và bệnh nhân được tóm tắt ở Bảng 17
Bãng 17: Tóm tắt đặc điểm ban đầu về bệnh lý và bệnh nhân trong nghiên cứu pha 3
VELCADE Dexamethason
Đặc mẻ… bệnh nhân N=333 N=336
Pl_Velcadc_3.5_FR_CCDS lApr2Dl 5_vl 261²38
Trung vị độ tuổi tính theo năm (khoảng)
62,0 (33, 84)
61,0 (27, 86)
Giới tính: Nam/nữ 56% / 44% 60% | 40%
Chùng tộc: da trắng/da đenlkhảc 90% / 6% / 4% 88% 7’ 7% l 5%
Điếm đảnh giá thể trạng Karnofsky 570 13% 17%
Hemoglobin <100 g/L 32% 28%
Số lượng tiếu cầu <75 x 109/L 6% 4%
Đặc điểm bệnh lý
Thể loại đa 11 tùy (%): IgG/lgA/chuỗi nhẹ
Trung vị [32-mỉcroglobulin (mgz'L)
60% / 23% ! 12%
3,7
59% / 24%Í 13%
3,6
Trung vị albumin (g/L) 39,0 39,0
Trưng vị độ thanh thải creatinin S30 mL/phút 17 (5%) 11 (3%)
in (%11
Trung vị thời gian bệnh đa 11 tủy từ khi
được chẩn đoán (nãm) 3,5 3,1
Số lần điều trị trước đó
Trung vị 2 2
1 lần 40% 35%
> 1 lần 60% 65%
Tắt cả bệnh nhân (N=333) (N=336)
Bất kỳ steroid nảo trước đó, ví dụ, 98% 99%
deịxamethason, VAD
Bât kỳ anthracyclin nảo trưởc đó, ví dụ, 77% 76%
VẠD, mitoxantron
Bât kỳ tảc nhân alkyl trước đó, ví dụ, MP, 91% 92%
V13MCP`
Bât kỳ điêu trị thalidomid trưởc đó 48% 50%
Vinca alkaloiđ ' . 74% 72%
Lỉếu phaịp ghép tế bảo gôcfhóa trị liêu cao 67% 68%
khạc trươc đo `
Đ1eu trị thư nghiẹm hoạc cac đ1cư trị khac 3% 2%
trưởc đó
Bệnh nhân trong nhỏm điều trị VELCADE đã nhận được 8 chu kỳ điếu trị 3 tuần tiếp theo bằng
3 chu 2kỳ điếu trị 5 tuần cùa VELCADE. Trong mỗi chu kỳ điều trị trong 3 tuần, VELCADE 1 ,3
mgfm2 /lỉếu đơn trị được tiêm tĩnh mạch nhanh 2 lần một tuần trong 2 tuần vảo ngảy 1, 4, 8, 11 và
tiêp theo lá thời gían nghỉ 10 ngảy (ngảy 12- 21). Trong mỗi chu kỳ điểu trị 5 tuần, VELCADE
1, 3 mg/m2 |liếu đon trị được tiêm tĩnh mạch nhanh một lần mỗi tuần trong 4 tuần vảo ngảy 1,8,
15, 22 và sau đó là thời gian nghỉ 13 ngảy (ngảy 23- 35) (xem Liều dùngvả Cảch dùng).
Bệnh nhân trong nhóm điếu trị dcxamethason đã nhận được 4 chu kỳ điếu trị 5 tuần tểẳv/theo
bằng 5 chu kỳ điếu trị 4 tuần. Trong mỗi chu kỳ điều trị 5 tuần, dexamethason 40 ngay
đường uống được dùng mỗi ngảy một lần các ngảy 1- 4, 9- 12 và 17-20 sau đó là thời gian nghỉ 15
ngảy (ngảy 21 -35). Trong mỗi chu kỳ điều trị 4 tưần, dexamethason 40 mglngảy đường uỏng
được dùng mỗi ngảy một lần các ngảy 1-4 sau đó là thời gian nghỉ 24 ngảy (ngảy 5- 28). Bệnh
nhân có bệnh tiến triền được ghi nhặn khi dùng dexamethason được cho sư dụng VELCADE với
liều vả liệu trinh chuẩn trên một nghiên cứu song hảnh.
Theo một phân tích tạm thời được lập kế hoạch trước để đánh giả thời gian cho đến khi bệnh tiến
triến, nhảnh dùng dexamethason đã được ngưng vả tẩt cả các bệnh nhân được chọn ngẫu nhiên
dùng dcxamethason đếu được cho dùng VELCADE, bất kế tình trạng bệnh. Tại thời điếm chấm
Pl_Vclcadc_3.S_FR_CCDS 1Apr2015_v1 27,/38
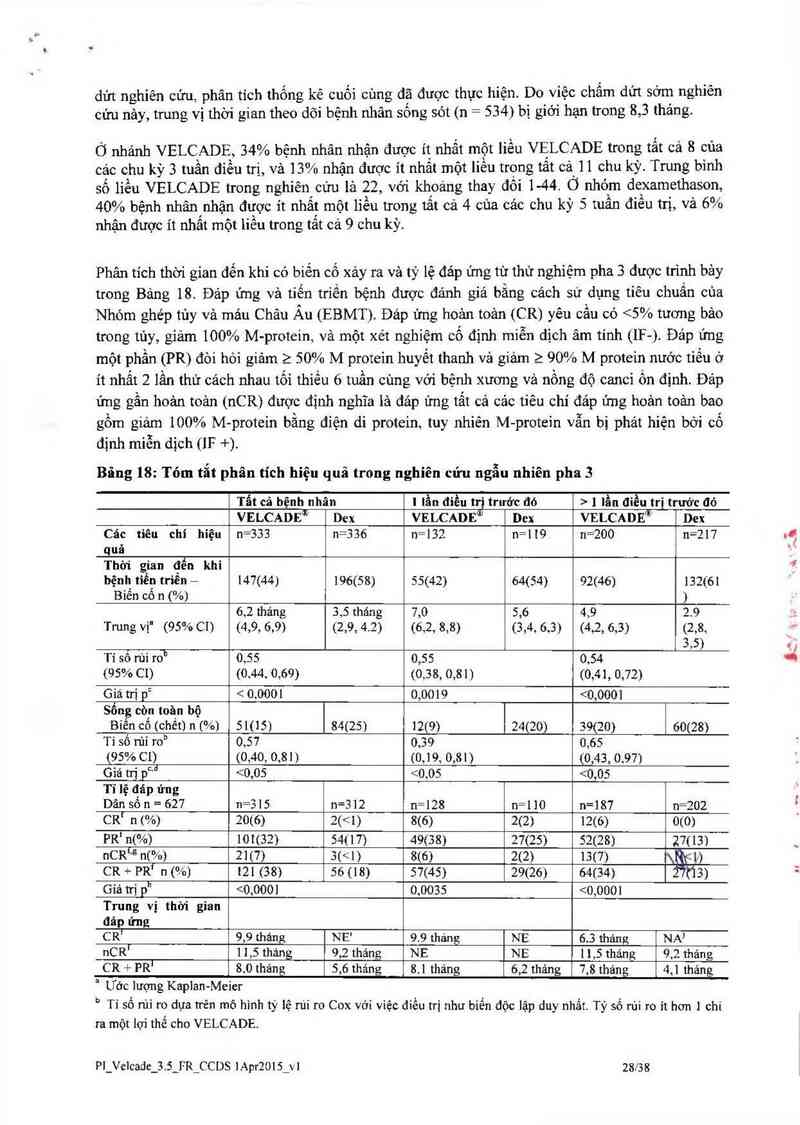
dứt nghiên cứu phân tích thống kê cuối cùng đặ được thực hiện. Do việc chấm dứt sởm nghiên
cứu nảy, trung vị thời gian theo dõi bệnh nhân sống sót (n= 534) bị giới hạn trong 8,3 thảng.
Ở nhảnh VELCADE, 34% bệnh nhân nhận được ít nhất một liếu VELCADE trong tất cả 8 của
các chu kỳ 3 tuần điểu trị, và 13% nhận được ít nhất một liều trọng tất cả 11 chu kỳ. Trung bình
số liều VELCADE trong nghiên cứu lả 22, vởí khoảng thay đồi 1-44. Ở nhóm dexamethason,
40% bệnh nhân nhận được ít nhất một liều trong tắt cả 4 cùa cảc chu kỳ 5 tuần điều trị, và 6%
nhận được ít nhất một liều trong tắt cả 9 chu kỳ.
Phân tích thòi gian đến khi có biến cố xảy ra và tỷ lệ đảp ứng từ thử nghiệm pha 3 được trình bảy
trong Bảng 18. Đảp ứng và tiến triến bệnh được đánh giá bằng cách sử dụng tiêu chuẩn cùa
Nhóm ghép tùy và máu Châu Ảu (EBMT). Đáp ứng hoản toản (CR) yêu cầu có <5% tương bảo
trong tủy, giảm 100% M-protein, và một xét nghiệm cố định miễn dịch âm tính (11²-). Đảp ứng
một phần (PR) đòi hỏi giảm 2 50% M protein huyết thanh và giảm ?. 90% M protein nước tiếu ở
ít nhất 2 lần thử cảch nhau tối thiếu 6 tuần cùng với bệnh xương vả nồng độ canci ốn định. Đáp
ứng gần hoản toản (nCR) được định nghĩa là đảp ửng tất cả cảc tiêu chí đảp ửng hoản toản bao
gổm giảm 100% M-protein bằng điện di protein, tuy nhiên M-proteỉn vẫn bị phảt hiện bởi cố
định miễn dịch (IF +).
Bâng 18: Tóm tắt phân tích hiệu quả trong nghỉên cửu ngẫu nhiên pha 3
Tất cả bệnh nhãn 1 lần điều trị trưởc ao › 1 lần điều trị trưởc đỏ
VELCADEỦ Dex VELCADEw Dex VELCADE® Dex
Các tiêu chỉ hiện n=333 n=336 n=132 n=l 1.9 n=200 n=217
quả
Thời gian đến khi
bệnh tiến triển - 147(44) 196(58) 55(42) 64(54) 92(46) 132(61
Biến cố n (%) )
6,2 tháng 3,5 tháng 7,0 5,6 4,9 2.9
Trung vị" (95% CI) (4,9, 6,9) (2,9, 4.2) (6,2, 8,8) (3,4, 6,3) (4,2, 6,3) (2,8,
3,5
Tỉ số rùi ro13 0,55 0,55 0,54 )
(95% CI) (0,44, 0,69) (0,38, 0,81) (0,41, 0,72)
Giá trị pc < 0,000! 0,0019 <0,0001
Sống còn toăn bộ
Biến cổ (chết) 11 [%) 51(15) 84( 25) 12(9) 24(20) 39(20) 60(28)
Tỉ số rủi roh 0,57 0,39 0,65
(95% 01) (0,40, 0,81) (0,19, 0,81) (0,43, 0,97)
Giả mị pc`đ 2 tại thời điếm
ban đầu hoặc số lượng tiền cầu <50. 000 /ụL đã bị loại trừ. Tổng cộng có 218 bệnh nhân được
đánh giá đảp ứng.
Yếu tố phân tẩng dựa trên số phảc đồ mà bệnh nhân đã được điều trị trước đó ( 1 phảc đồ trưởc
đó so với hơn 1 phác đồ trong một liệu phảp điều trị), và hệ thống phân loại giai đoạn quốc tế
(ISS) (kết hợp beta2- microglobulin vả nông độ albumin; giai đoạn I, II, hoặc III)
Cảc đặc điềm ban đầu về bệnh lý và bệnh nhân được tóm tắt ở bảng 19
Bảng 19: Tỏm tắt đặc điểm bệnh lý và bệnh nhân tại thời điểm ban đầu trong nghiên cứu pha 3 so
sánh VÉLCADE® TTM vả TDD
Đặc điểm bệnh nhân IV sc
N=74 N=148
Trung vị đó tuối tỉnh bằng nãm (khoảng) 64,5 (38,86) 64,5 (42,88)
Giới tính: Nam/nữ 64% .J 36% 50% | 50%
Chùng tộc: da trắng/da vảng 96% | 4% 97% / 3%
Đỉểm đánh giá thể trạng Kamofsky 570 16% 22%
Đặc điểm bệnh lý
Thể loại đa u tủy (%): IgG/IgA/chuỗi nhẹ 72%] 10% M 8% 65% 126°/ %
Phân loại 158² mmn (%) 27741/32 27141/32
Trung vị beta2-microglobulỉn (mg/L) 4,25 4,20
Trung vị albumin (g/L) 3,60 3,55
Trung vị độ thanh thải creatinin S30 mL/phút [n 2 (3%) 5 (3%)
(%)]
Trung vị thời gian bệnh đa u tủy từ khi được
chẩn đoán theo năm 2,93 2,68
sỏ phảc đồ trong điều trị trước đó
Pl_Velcadc_3.5_FR_CCDS lApr2O l 5_vl 29138
1 phác đồ trưởc đó 65% 62%
> ] phác đồ trưởc đó 35% 38%
° Phân loại ISS có nguồn gốc từ dữ lỉệu cơ sở cùa phòng thí nghiệm trung tâm
Nghiên cứu nảy đạt mục tiêu chính cho tỷ lệ đảp ứng không kém hơn (CR + PR) lả 42% ở cả hai
nhóm sau 4 chu kỳ VELCADE đơn trị cho cả hai đường đùng tiêm dưới da (TDD) và tiêm tĩnh
mạch (TTM) Ngoài ra, đảnh giá tiêu chí hỉệu quả liên quan vởi đáp ứng thứ phát vả thời gian
đến khi có biến có cho thấy kết quả nhất quán đối với cả tiêm dưới da (TDD) và tiêm tĩnh mạch
(TTM) (Bảng 20).
Bâng 20: Tóm tắt phân tích hiệu quả so sảnh VELCADE® tiêm dưới đa (TDD) vả tiêm tĩnh mạch
(TTM)
VELCADE TTM VELCADE TDD
Dân số đánh giá đáp ứng (8) n=73 n=145
Tỉ lệ đảp ửng sau 4 chu kỳ
ORR (CR+PR) 31 (42) 61 (42)
Gỉả trị p (a) 0.00201
CR n (%) 6(8) 9(6)
PR n (%) 25(34) 52(36)
nCR n (%) 4(5) 9(6)
Tỉ lệ đáp ửng sau 8 chu kỳ
ORR (CR+PR) 38(52) 76(52)
Giá trị p (a) 0,000]
CR n (%) 9 (12) 15 (10)
PR n (%) 29(40) 61 (42)
nCR n (%) 7(10) 14(10)
Dãn số ITT (Intent to Treat) (c) n=74 n=148
Trung vị thời gian đến khi bệnh tiến triễn, 9,4 104
tháng
(95% CI) (7,6, 10,6) (8,5, 11,7)
Tỉ lệ rùi ro (95% CI) (d) 0,839 (0,564, 1,249)
Giá trị p (d) 0,38657
Sống còn không tiểu triễn bệnh, tháng 8,0 10,2
(95% CI) (6,7, 9,8) (8,1, 10,8)
Tỉ lệ rủi ro (95% CI) (d)
0,824 (0,574, 1,183)
Giá trị p (d) 0,295
Sống còn toần bộ 1 nãm (%)(f) 76,7 72,6
(95wa1) (641, 85 4) (63,1 80,0)
(8) Tất cả. cảc bệnh nhân được chọn ngẫu nhiên nhận được ít nhắt 1 liều thuốc nghiên cứu và đã có bệnh đánh giá
được tại thời điềm bất đầu nghiên cứu
(b) Giá trị p cho giả thuyết không kém hơn rẳng nhảnh dùng TDD vẫn đạt ít nhất 60% của tỷ lệ đáp ímg_Ềìb nhánh
TTM
(c) 222 đối tượng được tuyển chọn vảo nghiên cửu, 22] bệnh nhân được đíểu trị bằng VELCADE
(d) Đánh giá tỉ số rùi ro dựa trên mô hỉnh tỷ lệ rủi ro Cox được điều chính cho các yếu tố phân tầng: phân loại ISS
và số loại thuốc trong liệu pháp điếu trị trước đó.
(e) Phép thù Iog-rank đuợc điều chinh cho các yếu tố phân tẩng: phân loại ISS vả số loại thuốc trong liệu pháp
đìễu trị trưởc đó
(1) Trung vị thời gỉan theo dõi lả ] 1,8 thảng
Pl_Ve1cadc_lS_FR_CCDS 1Ap12015_v1 30738
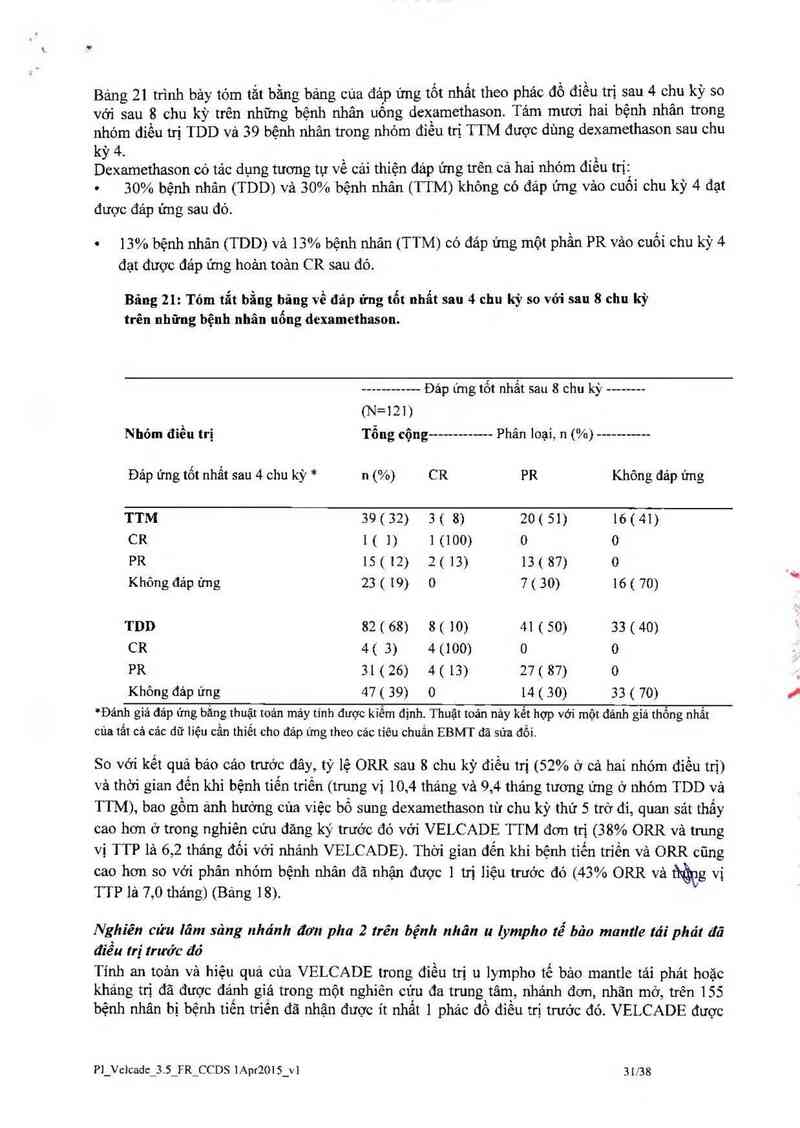
Bảng 2] trình bảy tóm tắt bằng bảng của đáp ứng tốt nhất theo phảc đô điêu trị sau 4 chu kỳ 80
vởi sau 8 chu kỳ trên những bệnh nhân uống dexamethason. Tám mươi hai bệnh nhân trong
nhóm điều trị TDD vả 39 bệnh nhân trong nhóm điều trị TTM được dùng dexamethason sau chu
k` 4. `
Dởếxamethason có tác dụng tương tự về cải thiện đáp ứng trên cả hai nhóm điêu trị:_
0 30% bệnh nhân (TDD) và 30% bệnh nhân (TTM) không có đáp ứng vảo cuôi chu kỳ 4 đạt
được đáp ứng sau đó.
' 13% bệnh nhân (TDD) vả 13% bệnh nhân (TTM) có đáp ửng một phần PR vảo cuối chu kỳ 4
đạt được đáp ứng hoản toản CR sau đó.
Bâng 21: Tỏm tắt bằng bãug về đảp ứng tổt nhẩt sau 4 chu kỳ so với sau 8 chu kỳ
trẽn những bệnh nhãn uống dexamethason.
Đảp ứng tốt nhắt sau 8 chu kỳ --------
(N=121)
Nhóm điều trị Tổng cộng ------------- Phân loại, n (%)
Đảp ứng tốt nhất sau 4 chu kỳ * n (%) CR PR Không đảp ứng
TTM 39(32) 3( 8) 20(51) 16(41)
CR l ( l) 1 (100) 0 0
PR 15(12) 2(13) 13(87) 0
Không đảp ứng 23 ( 19) 0 7 ( 30) 16 ( 70)
TDD 82 ( 68) 8 ( 10) 41 ( 50) 33 (40)
CR 4( 3) 4 (100) 0 0
PR 31(26) 4(13) 27(87) 0
Không đảp ứng 47 ( 39) 0 14 ( 30) 33 ( 70)
*Đảnh giá đảp ứng bắng thuật tơán mảy tính được kiếm định. Thuật toản nảy kểt hợp với một đánh giá thống nhất
của tắt cả cảc dữ liệu cẩn thiết cho đảp ứng theo các tiêu chuẩn EBMT đã sửa đổi.
So với kết quả báo cảo trước đây, tỷ lệ ORR sau 8 chu kỳ điều trị (52% ở cả hai nhóm điều trị)
vả thời gian đến khi bệnh tiến triển (trung vị 10,4 tháng và 9,4 thảng tương ứng ở nhóm TDD vả
TTM), bao gồm ảnh hưởng cùa việc bổ sung dexamethason tù chu kỳ thứ 5 trở đi, quan sát thấy
cao hơn ở trong nghiên cứu đăng ky’ trước đó với VELCADE TTM đơn trị (38% ORR và trung
vị TTP là 6,2 thảng đối với nhánh VELCADE). Thời gian đến khi bệnh tiến triển và ORR cũng
cao hơn so với phân nhóm bệnh nhân đã nhận được I trị lỉệu trước đó (43% ORR vả t1ửg vị
TTP lả 7,0 thảng) (Bảng 18).
Nghiên cửu lâm sảng nhánh đơn pha 2 trên bệnh nhân 11 lympho lể bâo mantle tái phát đã
điều trị trước đó
Tính an toản vả hiệu quả của VELCADE trong điều trị u lympho tế bảo mantle tái phảt hoặc
kháng trị đã được đảhh giả trong một nghiên cưu đa trung\târn, nhảnh đơn, nhãn mở, trên 155
bệnh nhân hị bệnh tiên triên đã nhặn được ít nhât 1 phác đô điêu trị trước đó. VELCADE được
Pl_Vclcadc_5.5jR_CCDS 1Apr20l 5_v 1 31f38
dùng với liều khuyến Cảo 1 ,3 mg/m2. Trung vị số chu kỳ điểu trị trên tất cả cảc bệnh nhân lả 4
(trong khoảng 1- 17) và 8 chu kỳ trên bệnh nhân có đảp ứng. Tỉ lệ đảp ứng với VELCADE được
mô tả trong Bảng 22.
Bảng 22: Tóm tắt kết quả đỉều trị của nghiên cứu pha 2 về 11 lympho tể bâo mantle
“Phân tích đáp ứng (N = 141) N (%) 95% C]
Tỉ lệ đáp ứng toản bộ (IWRC) (CR + CRu + PR)
47 (33) (26, 42)
Đảp ửng hoân toản (CR + CRu) l1 (8) (4› 14)
CR 9 (6) (3, 12)
CRu 2 (1) «L 5)
Đáp ửng bán phần (PR) 36 (26) (19, 34)
Phân tỉch thòi gian đến khi xay ra biến cổ Trung vị 95% CI
Uớc tính thời gỉan có đáp ứng theo Kaplan-Meier
CR + CRn + PR (N = 47) 9,2 tháng (4,9, 13,5)
CR+CRu(N= 11) 13,5 tháng (13,5,NE)
Uớc tính thời gian dến khi bệnh tiến triền theo Kaplan-Meier (N = 155) 6,2 tháng (4,0, 6,9)
** Uớc tính khoảng thời gian không bệnh theo Kaplan-Meier, CR + CRu 13,8 tháng (13,4, NE)
(N ² l lì
Trung vị thời gian để diển trị tiềp theo
CR + CRu + PR (N = 47) 12,7 thảng (9,33, NE)
CR+CRu (N=1 1) 19,4 thảng (17,8. NE)
*Dựa trên Tiêu chuẩn IRWC (International Response Workshop Criteria).
CRu = Đảp ứng chưa được xảc định
NE= không ước tính được ”“Phân tích thêm
Với trung vị thời gian theo dõi hơn 13 thảng trên những bệnh nhân còn sống, trung vị sống còn
chưa đạt được vả ước tính sống còn 1 năm theo Kaplan Meier lả 69%. Ước tính sông còn 1 năm
theo Kaplan- Meier lả 94% trên số bệnh nhân có đảp ứng vả 100% trên số bệnh nhân đạt được
CR hoặc CRu.
Có ít thông tin về sử dụng lại VELCADE trên bệnh nhân đa u tủy tải phảt.
Nghiên cứu pha 1] MMY-203ô (RETRIEVE), nhánh đơn, nhãn mở được tiến hảnh đế xảo định
hìệu quả và tính an toản của việc sử dụng lại VELCADE. 130 bệnh nhân (>18 tuổi) bị đa 11 tùy
trưởc đó có đảp ứng một phần với phảc đồ điều trị có VELCADE được điều trị lại khi bệnh tiến
trịến. Ít nhất 6 tháng2 sau trị liệu trước đó, bệnh nhân được bắt đầu điều trị với 1iểu được dung nạp
gẩn nhất là 1 ,3mg/m2 (n=93) hoặc <1,20mgfm (n=37) và được cho vâo cảc ngảy l, 4 8 vả 11 môi
3 tuần trong tối đa 8 chu kỳ dưới hình thức đơn trị hoặc phối hợp với dexamcthason phù hợp với
điều trị chuẩn. Dexamethason được dùng phối hợp với VELCADE cho 83 bệnh nhân trong chu
kỳ 1 với thêm 11 bệnh nhân dùng dexamethason suốt trong các chu kỳ điều trị lại vởi
VELCADE.
Tiêu chí chinh lả đảp ưng tốt nhất được xảc định đối với việc điều trị lại được đảnh giá thủjiêu
chuẩn EBMT Tỉ lệ đảp ứng tốt nhất toản bộ (CR+PR) đối vởi việc điều trị lại trên 130 bệnh
nhân là 38 5% (95%C1: 30, 1; 47 ,4)
Bênh nhân Amvloidosis chuỗi nhe đã đươc điều tri trưởc đó:
Một nghiên cửu pha 1/2 đã được tỉến hảnh để xác định tính an toản và hiệu quả của VELCADE
ở những bệnh nhân Amyloiđosis chuỗi nhẹ đă được điều trị trưởc đó. Không quan sảt thấy vắn
Pl_Vclcade_3ỏ_FR_CCDS ]Apr20l 5_v1 32l38
`Ớ
\v.
đề quan ngại về an toản mới trong quá trình nghiên cửu, vả đặc biệt VELCADE đã không lảm
trầm trọng thêm tốn thương cơ quan đích (tím, thận và gan) Trong 49 bệnh nhân đánh giá được
điều trị liều 1 ,6 mg/m2 hảng tuần hoặc 1 ,3 mg/m2 hai lần một tuân, tỷ lệ đảp ứng lả 67, 3% (trong
đó tỷ lệ CR lả 28,6%) được đánh giá bằng đảp ửng huyết học (protein M) đã được bảo cáo Đối
với những nghiên cứu đoản hệ về liều nảy, tỷ lệ sông còn 1 năm kết hợp là 88,1%.
Sứ dung cho bênh nhân nhi
Tinh an toản và hiệu quả của VELCADE ở bệnh nhân nhi bị đa 11 tủy và u lympho tế bảo mantle
chưa được xác lập. Tính an toản vả hiệu quả của VELCADẸ đặ được nghiên cứu ở bệnh nhân
nhi bị bệnh bạch cầu cấp dòng nguyên bảo lympho (ALL) tiền tế bảo B. Một thử nghiệm pha 2,
đơn nhánh về hiệu quả, an toản và dược động học tiến hỉmh bời Nhóm ung thư trẻ em trên bệnh
nhân nhi bị ALL để đánh giá hoạt tính của việc bổ sung bortezomid vảo liệu phảp hóa trịtái dẫn
nhập đa tác nhân. Đối tượng bao gồm những bệnh nhân ALL tiền tế bảo B tái phảt lần đẳu trong
độ tuổi từ 1 đến 21 đã tải phát trong vòng 36 thảng kế từ chẩn đoản ban đẩu. Phân tầng 1 bao
gồm cảc bệnh nhân tải phát trong vòng 18 tháng từ lúc chấn đoản vả phân tầng 2 bao gôm cảc
bệnh nhân tải phảt từ 18-36 thảng sau khi chẩn đoản.
104 bệnh nhân bị ALL được đảnh_giả về tính an toảjn: 7 trẻ nhũ nhi dưới 2 tuổi, 61 trẻ em từ 2-12
tuôi, 19 trẻ vị thánh niên từ 12 đên nhỏ hơn 17 tuôi, và 17 người trướng thảnh từ 17 — 21 tuôi.
Chưa có dữ liệu ở bệnh nhân nhi bị ALL dưới 1 tuối.
Không quan sát thấy có quan ngại về an toản mới nảo khi bổ sung VELCADE vảo phác đồ hóa
trị chính cho bệnh nhân nhi bị ALL tiền tế bảo B điền hình khi so vởi một nghiên cửu có đối
chứng đã thực hiện trước đây dùng phảc đồ chính đơn trị.
VELCADE (1,3 mg/mzlliều) được dùng 2 lần mỗi tuần (Ngảy I, 4, 8 và 11) cùng với hóa trị tái
dẫn nhập trong 35 ngảy điều trị đầu tiên (Khối 1). VELCADẸ sau đó được dùng vảo ngảy l, 4
và 8 trong 35 ngảy điều trị thứ 2 (Khối 2) với hóa trị tổng cộng 7 lẳn tiêm VELCADE.
VELCADE không dùng như một phẩn của phảc đồ Khối 3
Tải dẫn nhập Khối 1 Cytarabin IT (liều phụ thuộc tuồi)a vảo ngảy 1b
Vincristin 1,5 mg/m²fhèu IV vảo ngảy 1,8,15, 22
Doxorubicin 60 mg/m²Aiều 1v vảo ngảy 1
Prcdnison uống 20 mgfm²fhều 2 lẩiu’ngảy vảo ngảy 1 28 '
Pegaspargase IM hoặc IV 2500 10 Jm²fhèu vảo ngảy 2 8 và 22
Methotrexat (líều phụ thuộc tuổi)
CNS am tính: IT vảo ngảy 15 và 29
CNS dương tính: theo MTXfHC/AraCd IT vâo ngảy 8, 15, 22 và
29
VELCADE 1,3 mg/m²Jhèu IV vảo ngảy 1, 4, 8, 11
Tải dẫn nhập Khối 2 Cyclophosphamid 440 mglm²/liều IV vảo ngảy 1-5
Etoposid 100 mg/mz/liều IV vảo ngây 1-5
Methotrexat (liều phụ thuộc tuồi)c
CNS âm tính: IT vảo ngảy 1 vả 22
CNS dương tính: theo MTX/HCJAraCd IT vảo ngảy 1 @@1
VELCADE 1,3 ngm²/hèu IV vảo ngảy 1, 4, 8
Filgrastim (G-CSF) s ưg/kglliều sc hảng ngảy bắt đẩu từ ngảy 6
PI_Velcade_35_FR_CCDS 1Apr20] 5_v1 331’38
Methotrexat liều cao 5000 mg/m²l1iều 1v vảo ngảy 22
Tải dẫn nhập Khối 3 Cytarabin 3000 mg/m²flièu trong mỗi 12 giờ 1v vảo ngảy 1, 2 và 8, 9
L-asparaginase 6000 IUfm²/liểu IM vảo ngảy 2, 9
Filgrastím 5 ).1g/kg/liềư SC hảng ngây bắt đầu từ ngảy 10
Ghi chú: IT = tiêm vảo khoang dưới nhện của tùy sống; 1v= tiêm tĩnh mạch; IM = tiêm bắp; CNS = hệ
thần kinh trung ương; MTX = methotrexat; HC = hydrocortison; AraC = cytarabin; G-CSF = yếu tô kích
thich tăng sinh dòng bạch cẩu hạt; SC = tiêm dưới da.
8. liều phụ thuộc tuối cùa cytarabin IT như sau: 1-1,99 tuỗi, 30 mg; 2—2,99 tuốỉ, 50 mg; 2 3 tuổi, 70 mg
b vảo ngảy 1 hoặc tại thời đỉểm chọc dò tùy sống chẳn đoán lên tới 72 giờ trước ngảy 1
c liều phụ thuộc tuối của MTX như sau: 1-1,99 tuổi, 8 mg; 2-2,99 mỏi, 10 mg; 3-8,99 tuối, 12 mg; a 9 tuốỉ, 15 mg
d líều ba trị liệu (theo mg) dựa theo tuổi như sau: MTX HC AraC
1-1,99 tuối 8 8 16
2-2,99 tuổi 10 10 20
3—8,99 tuồi 12 12 24
2 9 tuổi 15 15 30
Đáp ứng hoản toản khi kết thúc của Khối 1 được đánh giả ở 60 bệnh nhân đầu tiên có thế đánh
giả để tham gia vảo phân tầng 1 (n-27) vả phân tầng 2 (n-33). Trong phân tầng 1, tỷ lệ đảp ứng
hoản toản lả 67% (khoảng tin cậy 95%: 46, 84); tỷ lệ sống 4 thảng không biến cố lả 44%
(khoảng tin cậy 95%: 26, 62). Trong phân tầng 2 tỷ lệ đảp ứng hoản toản lả 79% (khoảng tin cậy
95%: 61, 91) vả tỷ lệ sống 4 thảng không biến cố là 73% (khoảng tin cậy 95%: 54, 85).
ĐẶC TÍNH DƯỢC ĐỌNG HỌC
Dươc đônư hoc
Sau khi tiêm tĩnh mạch nhanh ớ liếu 1,0ngm² vả 1,3ngm² cho 11 bệnh nhân đa 11 tùy, nồng độ
bortezomib trong huyết tương đạt được tối đa ở lìếu đầu tiên trung bình tương ứng là 57 và
112ng/mL, ở những liều tiếp theo, nồng độ tối đa trung bình trong huyết tương quan sảt được
trong phạm vi từ 67-106ng/mL ở liều 1,0…g/m² vả 89-120ng/mL ở liều 1,3mg/m². Thời gian bản
thải trung bình của bortezomib trên nhiều liều trong khoảng từ 40-193 gỉờ.
Bortezomib được thải trừ sau liều đẫu tiên nhanh hon so với những liều tiếp theo. Độ thanh thải
trong toả.n bộ cơ thể trung binh là 102 và 112L/h (tương ứng với liều 1 ,Omg/zm2 và 1 ,3mg/m2 ) sau
liều đầu tiên vả từ 15 đến 32 L/h (tương úng với liền 1 ,Omg/m2 và 1 ,3mgfm2 ) sau những liếu tiếp
theo.
Trong một nghiên cứu dưới nhóm về dược lực học/ dược động học cùa một nghiên cửu pha 3,
sau khi tiêm tĩnh mạch nhanh (TTM) hoặc tiêm dưới da (TDD) cùa một liều 1 ,'²3ngm trên bệnh
nhãn đa 11 tủy (n— = 14 dùng TTM, n— = 17 ở nhóm dùng TDD), tổng nồng độ toản thân sau khi
dùng liều lặp lại (diện tích dưới đường cong cuối cùng AUCcuốlcùng) là tương đương nhau ở nhóm
tiêm dưới da và tiêm tĩnh mạch. Nồng độ tối đa Cmax sau khi tiêm dưới da (20,4 ng/ml) ấp hơn
so với tíêm tĩnh mạch (223 ng/mL). Tỷ số trung bình nhân cùa AUC…) cùng là 0,9 ả với
khoảng tin cậy 90% thi lả 80,18% - 122, 80 Ai,
Phân bố
Pl_Velcade_3.S_FR_CCDS 1Apr201 5_v1 34738
Thể tích phân bố trung binh cùa bortezomib từ 1659 lỉt đến 3294 lit (489 đển 1884L/m2 ) sau liều
đơn hoặc liễu lặp lại của 1 -ZOmg/m hoặc 1 ,²3mg/m ở bệnh nhân đa 11 tùy Điều nảy gợi ý cho
thấy bortezomib phân bố rộng rãi ở cảc mô ngoại biên.
Tỉ lệ gắn kểt của bortezomib với protein huyết tương ở người trung bình khoảng 83% trên
khoảng nổng độ từ 100—1000ng1'mL.
Chuvển hóa
Nghỉên cún trên in vitro với tiểu thể gan người và men cytochrom P450 có biểu hiện chuỗi DNA
cùa người cho thấy bortezomib được chuyến hóa chính bằng cách oxy hóa thông qua men
cytochxome P450 3A4, 2C19, 1A2. Bortczomib được chuyến hóa không đáng kể qua cảc enzym
CYP 2D6 vả 2C9. Đường chuyển hóa chính là khứ gốc boronat tạo thảnh 2 chất chuyến hóa khử
boronat vả sau đó chịu sự thùy phân để tạo ra nhiều chất chuyến hóa.
Chất chuyến hóa deboronat-bortezomib là chất không có hoạt tính như chắt ức chế proteasom
268. Những dữ liệu huyết tương trộn vảo cùa 8 bệnh nhân ở thời điểm 10 phút và 30 phút sau khi
tiêm cho thẳy nổng độ của chất chuyển hớa trong huyết tương thấp hơn so vói thuốc ban đầu.
T_hải trừ
Thời gian bản thải trung bình (tltz) của bortezomib trên nhiều lỉễu dao động từ 40- 193 giờ.
Bortezomib được thải trù nhanh chóng hơn sau liều đầu tiên 50 vói các liều tiếp theo. Độ thanh
thải toản bộ cơ thể là 102 và 112 lit / giờ sau liều đầu tiên tương ứng cho liều 1 ,0 mg/m2 và 1 ,3
mg/m2, và dao động trong khoảng 15- 32 L/h và 18 đến 32 L/h sau cảc liều tiếp theo tương ứng
cho liều 1,0 mg/m2 và 1,3 mg/m2
Dân số đăc biêt
Tuổi. eiói tính và chủng tôc
Tuổi: Phân tích dữ liệu sau liều đầu tiên của chu kỳ 1 (ngảy 1) trên 39 bệnh nhân đa 11 tủy đã
được tiêm tĩnh mạch liều 1 mg/m2 vả 1,3 mg/m2 cho thấy AUC vả Cmax bình thường hóa theo
cả hai liền có xu hướng thấp hơn trên cảc bệnh nhân trẻ tuối hơn. Bệnh nhân <65 tuối (n = 26)
AUC vả Cmax bỉnh thường hóa theo 1iếu trung bình thấp hơn khoảng 25% so với những người_ >
65 tuối (n= — 13)
Giới tính: Cảo giá trị trung bình AUC vả Cmax bình thường hóa theo 1iều tương tự nhau giữ2a
bệnh nhân nam (n— = 22) và nữ (n— = 17) sau liều đầu tiên cùa chu kỳ 1 cho liền 1 vả 1, 3 mgfm².
Chủng tộc: Ành hưởng của chùng tộc trên nồng độ bortezomib không thế đảnh giả được vi hằn
hết các bệnh nhân là người da trắng
Suy gan
Ảnh huởng của suy gan trên dược động học cùa bortezomib được đánh giá trên 60 bệnh nhân
ung thư ở các liều tiêm tĩnh mạch bortezomib khác nhau, từ 0,5 đến 1,3 mg/m2. Khi so sánh với
bệnh nhân có chức nãng gan binh thường, suy gan nhẹ không lảm thay đổi diện tích dưới đưòng
cong của bortezomib ở liều bình thường. Tuy nhiên, cảc giá trị AUC trung bình ở liều bình
thường tăng khoảng 60% ở những bệnh nhân suy gan trung bình hoặc nặng. Do đó, liều iđẩu
thẳp hơn được khuyến cảo ở nhưng bệnh nhân suy gan trung binh hoặc nặng, và nhữn ệnh
nhân nảy cần được theo dõi chặt chẽ.
Suy thân
Nghiên cứu dược động học được tiến hảnh trên những bệnh nhân có mức suy thận khảo nhau,
được phân nhỏm tùy theo giá trị độ thanh thải creatinin (CrCL) như sau: Bình thường (CrCL 2
60 mL/phút/ 1,73 m², n=12), nhẹ (CrCL=40-S9 mL/phút/ 1,73 m², n=10), trung bình (CrCL=ZO-
39 mL/phút/l,73 m², n=9), và nặng (CrCL < 20 mL/phủt/lJB m², n=3). Một nhóm bệnh nhân
Pl_Velcade_3.S_FR_CCDS 1.4pr2015_v1 35138
lọc thận được tiêm thuốc sau khi chạy thận cũng được đưa vảo nghiên cứu (n=8). Các bệnh nhân
được tiếm tĩnh mạch liều 0, 7 đến 1 ,3 mg/m2 bortezomib 2 Iần/tuần. Nồng độ của bortezomid
(diện tích dưới đường cong được chuẩn hóa theo liếu vả nồng độ đinh) là gần như nhau giữa tất
cả cảc nhớm. (xem Liều dùng vả cách dùng).
THÔNG TIN TIỀN LÂM SÀNG
Tinh sinh ung thư, gãy đôt biến. sư suv eiảm khả năng sinh sản
Những nghiên cứu về khả năng gây ung thư chưa được tiến hảnh với bortezomib.
Bortezomib cho thẳy hoạt tính clastogcnìc (bất thường nhiễm sắc thể về cẩu trùc) trong thử
nghiệm bất thường về nhiễm sắc thể in vítro sử dụng tế bảo buồng trứng cùa chuột lang
(hamster) Trung Quốc. Bortezomib không gây độc tính trên gen khi được thử nghiệm về tính
sinh đột biến in vítro (Ames test) vả thử nghiệm ví nhân ở chuột in vitro.
Nghiên cứu về sự sinh sản với bortezomib không được thực hiện nhưng đảnh giả trên mô sinh
sản được thực hiện trong những nghiên cứu độc tính chung. Trong nghiên cứu về độc tính trên
chuột cống 6 thảng, tảc động gây thoải hóa trên buồng trứng được quan sảt ở liều 2 0,3mg/m2
(17’4 liều lâm sảng được khuyến cảo) và những thay đổi thoải hóa trong những thử nghiệm xảy ra
ở 1,2 mglm².
VELCADE có thể có khả năng ảnh hưởng trên sự sinh sản ở cả nam vả nữ.
TÍNH `TƯO'NG KY
Sản phâm nảy không được trộn với cảc thuốc khác ngoại trừ những thuốc được kế ra trong phần
Hướng dẫn sử dụng.
HẠN DÙNG
36 tháng kể từ ngảy sản xuất
Khi được bảo quản trong bao bì nguyên vẹn vả trảnh ánh sảng, lọ thuốc VELCADE® chưa mờ
vẫn giữ nguyên tính ốn định cho đến ngảy hết hạn sử dụng ghi trên bao bi.
Không sử dụng thuốc hết hạn sử dụng … trên bao bì.
VELCADE không chứa chất bảo quản kháng khuẩn. Khi được hoản nguyên như hướng dẫn,
VELCADE có thể lưu giữ ở 25°C (77°F). VELCADE sau khi hoản nguyên nên được ng trong
vòng 8 giờ Dung dịch được hoản nguyên có thế được bảo quản cho đến 8 giờ trong lểoc hoặc
trong ống tiêm. Tổng thời gian bảo quản dung dịch được hoản nguyên không quá 8 gỉờ khi đế
ngoải ánh sáng trong nhà bình thường
BẢO QUẢN
Khỏng bảo quản thuốc ở nhiệt độ trên 30°C
Giữ thuốc trong hộp để trảnh ảnh sáng.
Để xa tẩm tay trẻ em.
QUY CÁCH ĐÓNG GÓI
Hộp 1 lọ.
HƯỚNG DÃN SỬ DỤNG VÀ XỬ LÝ VÀ LOẠI BỔ
PI_Velcade_3.5_FR_CCDS 1 Aptzol 5_v1 3673 8
_
'41’fflỵ.
\\ .\ằ
Thân trong sử dung:
VELCADE lá thuốc chống ung thư. Thận trọng trong suốt quá trình bảo quản và pha chế. Nên sử
dụng kỹ thuật tiệt trùng thích hợp. Nến sử dụng găng tay và đồ bảo hộ để ngăn chặn tiếp xúc trực
tiếp với da. Trên lâm sảng, kich ứng da tại chỗ được báo cảo khoảng 5% bệnh nhân, nhưng sự
thoát mạch của VELCADE không liến quan đến tổn thưong mao quản.
Khi tiêm dưới da, thay đối vị trí tiếm cho mỗi lần tiêm (bắp đùi hoặc bụng). vi tri tiêm mới nên
cảch it nhất một inch (2,54 cm) từ vị trí cũ và không bao giờ tiêm vảo cảc khu vực đau, thâm tỉm,
đớ, hoặc cứng.
Đã có những trường hợp tử vong khi vô ý tiêm VELCADE vảo khoang dưới nhện cùa tùy sống.
VELCADE chi dùng đường tiêm tĩnh mạch và tiêm dưới đa. KHÔNG TIÊM VELCADE VAO
KHOANG DƯỚI NHỆN CÙA TUY SÔNG.
Hoản nguvên/Pha chế để tiêm tĩnh mach vả tiêm dưới da:
Nên sử dụng kỹ thuật vô trùng thích hợp. Chỉ hoăn nguyên thuốc vỏi vói đung dịch natri
clorid 0, 9% C he phấm hoản nguyên phải trong suốt và không mảu.
Hoản nguyên thuốc với cảc thề tich dung dịch natri clorid 0,9% khác nhau tùy theo đường tiêm
thuốc. Nồng độ cuối cùng sau khi hoản nguyên bortezomib cho tiêm dưới da (2, 5 mg/mL) lớn
hơn nồng độ cuối cùng sau khi hoản nguyên của bortezomib đế tiếm tĩnh mạch (] mg/mL) Bởi
vì mõi đường dùng thuốc có nồng độ hoãn nguyên khác nhau, cần thận trọng khi tính toản
thể tích thuốc được dùng.
Vởi mỗi lọ bortezomib 3,5 mg sử dụng một lần hoản nguyên với thể tích dung dịch natri clorid
0,9% dựa trên đường dùng (Bảng 23):
Bâng 23: Thể tích hoân nguyên vả nồng độ cuối cùng sau khi hoân nguyên cho đường dùng
tiêm tĩnh mạch và tiêm dưới da
Đường dùng thuốc Bortezomib (mgllọ) Thể tích dung dịch Nồng độ cuối cùng
pha loãng (0,9% sau khi hoản
Natri clorid) nguyên (mglmL)
Tiẽm tĩnh mạch 3,5 mg 3,5 mL 1 mg/mL
Tiêm dưới da 3,5 mg 1,4 mL 2,5 mg/mL
Để ngăn chặn việc sử dụng quá lỉều, liều lượng phái được tinh cho từng cá nhân. Sau 1Ỉ\'xảc
định dìện tích bề mặt cơ thể bệnh nhân (BSA) theo mét vuông, sư dụng cảc phương trình sa ây
đề tính toản tống thể tích (mL) của VELCADE hoân nguyên được dùng:
Đường dũng tiêm tĩnh mạch (nồng độ lmglmL)
Liều VELCADE (mg/m²)x BSA bệnh nhân (m²)
lmg/mL =Tong the tich VELCADE can dùng (mL)
Đường dùng tiêm dưới da (nồng ao 2,5ng…L)
Liều VELCADE (ngm²) x BSA bệnh nhân (m²)
235 mgme ² Tong the tich VELCADE cân dùng (mL)
Pi_Veioade_35_FR_ccos 1Apt2015_01 371'38
\Ô, ,v` 1
\\ỊVh`TĨn
Miếng dán chỉ dẫn đường dùng và nồng độ được dản trên lọ VELCADE. Những miếng dán nảy
nên được đặt trực tiêp trên bơm tiêm vả lọ VELCADE mỗi khi chuẩn bị lọ VELCADE để sử
dụng nhằm đảm bảo đường dùng chính xảc.
Chế phẩm hoản nguyên phải trong suốt, không mảu.
Nên kiếm tra bằng mắt xem chế phấm để tiêm có cảc phần từ bất thường và sự đổi mảu trước khi
sử dụng lọ thuốc và dung dịch tiêm. Nếu có bất kỳ sự đổi mảu và phần từ bất thường. chế phẩm
đã hoản nguyên không nên được sử dụng.
Ouả trình hủv thuốc thích hơn
Bất cứ chê phấm không sử dụng hoặc vứt bỏ nên được hủy theo qui định của nước sở tại.
Sản xuất tại: Pierre Fabre Medicament Production (PFMP),
Aquitaine Pharm International, Avenue du Beam, F-64320 Idron, Pháp
Xuất xưởng tại: Janssen Pharmaceutica N.V.
Tumhoutseweg 30, B—2340, Beerse, Bỉ
Đóng gỏi thứ cấp tại:
Zuellig Pharma Specialty Solutions Group Pte. Ltd.
15 Changi North way #0] -02,#02-02,#02-10 Singapore 498770
Mọi câu hỏilBáo cáo tác dụng ngoại ý/ Than phiền chất lượng sản phẫm x
VPĐD Janssen—Cilag Ltd., TP Hồ Chí Minh.
ĐT: +84 8 38214828
E-mail: iacvndrugsafetvĩãìits.ini.com
Công ty đăng ký: JANSSEN-CILAG Ltd., Thái Lan
Mảeyấệ:
Phiên bản: CCDS ]Apr2015; số 25
Pl_ Velcade_3. 5_FR_CCDS IApr20] 5_v1
Ngòy sửa đôi: 20/04/2015
TUQ. cục TRUỞNG
PTRUỞNG PHÒNG
›Ấỷũấêĩl elỔlấ 'ffln’lấ
PI_VeIcade_3.S_FR_CCDS lAprZOI 5_v1 38/38
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng