













x.ontrou rroot wew rrom LOƯECIIOHS
/Format 82 x 50 x 47 mm
Reg1ster Nl'. 97 4.3541 Date: ............................ Date: ............................ Date: ............................
NP 91 4, ỹ/Ệãi
13_11_2008 15:03:50 Visa: ............................ Visa: ............................ Visa .................... ' ........
Grundschrift 8 Punkt
OK for Printing Control File OK for Printing
Date: ............................ Date: ............................ Date: ............................
V'Lsa- ............................ Visa: ............................ Visa: ............................
10098605 FE 10098605 FE 10098605 FE 10098605 FE 10098605 FE
FILM1 VON 5 FILM 2 VON 5 FILM 3 VON 5 FILM 4 VON 5 FILM 5 VON 5
Schwarz PMS 300 PMS 485 PMS 151 PMS 376
13.11.08 13.11.08 13.11.08 13.11.08 13.11.08
Bộ Y TẾ Ỉ
CỤC QL'ẨN LÝ DUỢC
ĐÃ PHÊ DL’YỆT
Lân đauXJ/ẮZLẮCYY1L
1_—
_~.
2
(
@
sLaneL pĐLEOJ-WIB 09
.IỊAOpỊDUEỎ|EA
,aỊẮJLeA
Medicine: keep out of reach of
child ren
Dosage and administration: see
package insert
Do not break or crush the tablets
Caution- strict adherence tc
dosage recommendations is
essential to avoid overdose
Avoiđ contact of broken or
crushed tablets with skin or
mucous membranes
Do not store above 30 °C
LnnuvLLn\slv
fiiN 1imm:aawummn
. \ ửLLOLIu uWLL lu lnmuđ ủLn'o
nnmu M…
Ê
Made for
F. Hoffmann-La Roche Ltd
Basel. Switzerland
by Patheon 1nc., Mississauga.
Canada
\\Ề\HẢ Nl_
Valcyềểẫ
ValgancicỪrr“
60 fiIm—coated tablets
©
Jilalcyte®
Valganciclovir
60 fiIm-coated tablets
©
1 tabl. = 450 mg
valganciclovir as 496. 3 m
valgancicịovir hyđggchlorỉ e
` 1 vièn nén= 460mg valgancỉclovir
> Dùng dường uõng.
ị Lọ chứa 60 viên nén bao phim
dụng
ao°c.
muoc cnl BÁN THEO Đơn
ĐỂ XA TAM TAY CÙA TRẺ EM
TRƯỞC KHI DÙNG
Sô ĐK VN-
NSX. HD, sô lô SXL xem phân MFD
EXP sô 16 in trẻn bao bi Ngảy sản
xuất vả ngáy hét hạn lá ngảy 01 của
Ếtháng
Sản xuất cho F Hoffmann—La Rcche
ịLtd Basel Thụy Sỹ
Wa
lNhả nháp ko. _
-.….Juụ. L.fl`.
Chỉ 6th chóng chi dinh iièu vá cáchỄ
idùng: xin xem trong tờ hưởng dẫn sừỄ
Knòng bảo quản thuôo ở nhiệt độ trèn
ĐỌC KỸ HƯỚNG DẤN sư DỤNG“
\… n NOI
10098605 `
FE1111 < creatinine huyết thanh [ụmol/iD
Với nữ = 0,85 x giá trị của nam
Bệnh nhân đang thấm phân máu
Với nhũng bệnh nhân đang thẩm phân máu (CLC! < lOml/phủt) liếu khuyến cảo không được ảp dụng. Vì vậy,
Valcyte không được dùng ở những bệnh nhân nảy (xem phần 4.2.5 Dược động học cho những đối tượng đặc
biệt và phần 3.4 Khuyến cảo đặc biệt và Thận trọng đặc biệt).
Những bệnh nhán giảm bạch cấu, giám bạch cầu trung tính nặng, thiếu máu, giảm tiếu cầu và giám toản thế
huyết cẩu
Giảm bạch cẩu nặng, giảm bạch cầu trung tính, thiếu mảu, giảm tiểu cầu, giảm toản thế huyết cầu, ức chế tủy
xương và thiếu máu bất sản đã được ghi nhận ở những bệnh nhân được điếu trị với Valcyte (vả ganciclovir). Vì
vậy không nên bắt đầu điều trị nếu số lượng bạch cẩu trung tính dưới 500 tế bảo/ụl hoặc số lượng tiểu cầu dưới
25000/ụ1 hoặc hemoglobin dưới 8ng (xem phần 3.2.5 Dược động học ở những đối tượng đặc bỉệt và 2.6. Tảo
dụng không mong muốn).
Nguời giã
Tỉnh an toản và hiệu quả chưa được xảo định ở những đối tượng bệnh nhân nảy.
Trẻ em
Tfnh an toăn và hiệu quả của ganciclovir ở bệnh nhi chưa được xác lập. Sử dụng Valcyte ở trẻ em chưa
được khuyến cáo bởi vì các đặc điểm được động học cũa Valcyte chưa được thiểt lập ở những đối tượng
bệnh nhân nãy.
Tính an toản và hiệu quả của Valcyte ở bệnh nhi chưa được xác lập trong cảc thử nghiệm lâm sảng thich hợp vả
cỏ kiêm soát tỏt.
2.3 Chổng chỉ định
Valcyte được chống chỉ định ở những bệnh nhân có tinh quả mẫn đă được biết vởi valganciclovỉr, ganciclovir
hoặc vởi bất kỳ thảnh phần nảo cùa thuốc.
Do tính tương tự về cấu trúc hóa học của Valcyte và của aciclovir vả valaciclovir, phản ứng quả mẫn chéo giữa
những thuốc nảy có thể xảy ra.
2.4 Cảc cânh báo và thận trọng
2 4.1 Cănh báo và thận trọng chung
Trong cảc nghiên cứu ở động vật ganciclovir được phảt hiện lả chất gây đột biến gen, quái thai, giảm sinh tinh
trùng vả gây ung thư. Vì vậy Valcyte nẻn được cân nhắc lá có tính gây quải thai và ung thư tiềm tảng ở người
với khả năng gây khuyết tật ở trẻ sơ sinh và gây ung thư (xem phần 4 2. Hướng dẫn đặc biệt trong sử dụng. thao
tảo vả huỷ bỏ) Cũng cân cân nhắc rằng Valcyte úc chế tạm thời hoặc thường xuyên sự sinh tinh trùng (xem
phần 3. J. 4. Tính gây quải thai vả 2. 6. Tảc dụng khỏng mong muốn) Những bệnh nhân nam LLẽLL được khuyên
dùng cảc dụng cụ tránh thai trong khi và sau khi đỉếu trị Valcyte Lt nhất 90 ngảy (xem phần 3. 3. 4. Tính sinh
quải thai).
Giảm bạch cầu nặng, giảm bạch cầu trung tinh, thiếu mảu, giảm tiếu cẳu, giảm toản thế huyết cầu, ức chế tủy
xương và thỉếu mảư bất sản đã được ghi nhận ở nhũng bệnh nhân được điếu trị với Valcyte (vả ganciclovir).
Không nên bắt đầu điều trị nếu số bạch cẳu trung tính dưới 500/ụ] hoặc số lượng tiếu cầu dưới zsooonn hoặc
hemoglobin dưới 8 g/dl (xem phẳn 2.2. Liều lượng và cảoh sử dụng, 2.4. Các cânh báo vả thận trọng và 2.6. Tảo
dụng không mong muốn).
Cần theo dõi số lượng tế bảo mảư toản phần và số lượng tiếu cầu trong quá trình đíếu trị. Ở những bệnh nhân bị
giâm bạch cẩu nặng, giảm bạch cầu trung tính, thiếu máu vả/hoặc gỉảm tiêu cầu, nên điếu trị với cảc yếu tố lảm
tãng sự tạo huyết vả] hoặc ngừng sử dụng thuốc (xem phần 2. 2 Liều lượng vả cảch sứ đụng vả 2. 6. Cảo tảc
dụng không mong muốn).
Co giật đã được báo cảo ở những bệnh nhân đang dùng imipenem-cilastatin vả ganciclovir. Valcyte không nên
sử dụng đông thởi với imipenem-cilastatin trừ khi lợi ích sử dụng cao hơn hãn các nguy cơ tiêm tảng (xem phân
2.4.5. Tương tảc vởỉ cảc thuõc khảc vả các hinh thức tương tảc khảo).
Zidovudine vả Vaicyte đều có nguy cơ gậy giảm bạch cầu trung tính và thiếu mảu. Một vải bệnh nhân không
thể dung nạp đồng thời chế độ đỉếu trị kết hợp vởi đủ liếu (xem phẩn 2.4.5. Tương tải: vởi cảc thuốc khảc vả
cảc hình thức tương tác khảc).
Nồng độ huyết tương của didanosine có thề tãng khi dùng đồng thời vởi Valcyte; vì vậy, những bệnh nhân nảy
nên được theo dõi chặt chẽ những độc tính của didanosine (xem phẳn 2.4.5. Tương tác với các thuốc khác và
cảc hình thức tương tảc khảo).
Dùng đồng thời với cảc thuốc khác mả được biết là gây ức chế tủy hoặc suy thận vởi Valcyte có thể lảm tăng
độc tính (xem phần 2.4.5. Tương tảc vởỉ cảc thuốc khảc vả các hình thức tương tác khảo).
Độ khả dụng sinh học cùa ganciclovir tù Valcyte lên tới gắp 10 lằn từ viên nang ganciclovir. Viên nén Valcyte
khỏng được dùng thay thế cho viên nang ganciclovir trên cờ sở 1:1. Bệnh nhân chuyển điều trị từ viên nang
ganciclovir nên cân thận tránh nguy cơ quá liều nêu họ đùng nhiều hơn số viên Valcyte được kê toa (xem phần
2 2. Liều lượng vả cách sử dụng vả 2 7 Quá lỉếu)
2.4.2. Sự lệ thuộc v`â lạm dụng thuốc ,
Không có thông tỉn vê iệ thuộc và lạm dụng thuốc đỏi vởi Valcyte.
2.4.3. Tương tác vởi các thuốc khác và cảc hình thửc tương tác khảc
Tương lác Ihaổc với Valcyte
Trong một thử nghiệm in—silu về tính thắm tại ruột ở chuột, không thẳy có tương tảo thuốc của valaciclovir,
didanosine, nelfinavit, cyclosporin, omeprazole vả mycophenolate mofetil với valganciclovir.
/aiĩc
//
fl
Vaicyte được chuyển hóa thảnh ganciclovir, đo vậy cảc tương tảc thuốc cùa ganciclovỉr cũng được xét đến ở
Valcyte.
T ương tác th uốc với ganciclovir
Ganciclovir gắn kết vởí protein huyết tưong chỉ 1-2% và tương tảo thuốc liên quan đến sự cạnh tranh vị trí gắn
kết được loại trừ.
Imipenem-cflastatin
Co giật đã được bảo cảo ở những bệnh nhân dùng đổng thời ganciclovir vả imipencm-cilastatin. Các thuốc nảy
không nên dùng đồng thòi trừ khi các lợi ích cùa thuốc cao hơn hẳn các nguy cơ (xem 2.4. Cảc cảnh báo vả
thặn trọng)
Probenecid
Probenccỉd được dùng cùng với ganciclovỉr dạng uống lảm giảm đảng kế độ thanh thải thận cùa ganciclovir
(20%) dẫn tởi lảm tãng một cách đảng kề nồng độ ganciclovír (40%). Nhưng thay đối nảy phù hợp vởi cơ chế
tương tảc thuốc có líên quan đển sự cạnh tranh bải tiết ở ống thận. Vì vậy nhưng bệnh nhân dùnơ Ôprobenecid vả
Valcyte nên được theo dõi chặt chẽ về độc tính của ganc1clov ư.
Zidovudine
Khi zidovudine được dùng cùng vởi ganciclovir dạng uống, AUC của zidovudine tăng với tỉ lệ nhỏ (17%),
nhưng có ý nghĩa thống kê. Nồng độ ganciclovir cũng có khuynh hướng thẳp hơn khi dùng với zidovudine, mặc
dù không có ý nghĩa thống kê. Tuy nhiên, bởi vì cả zidovudine vả ganciclovir có thể gảy giảm bạch cầu trung
tính vả thiểu mảư một vải bệnh nhân có thể không dung nạp liệu phảp điều trị đồng thời với liều lượng đủ (xe
phẳn 2. 4 Cảc cảnh bảo vả thận trọng). /Ĩ/Ịạ
Didanmỉne
Nồng độ huyết tưong cùa didanosíne đuợc ghi nhận là tãng liên tục khi dùng ganciclovir (cả đường tiêm tĩnh
mạch và đưòng uống). Vởì lỉều ganciclovir đường uống là 3 và 6g/ngảy, AUC của didanosinc tãng từ 84-124%,
và cũng giống như vậy, với liều tiêm tĩnh mạch 5 vả lOmg/kg/ngảy, mức tăng AUC cùa didanosine từ 38- 67%
củng đuợc ghi nhận. Sự tãng nảy khỏng thế gíải thích bằng sự cạnh tranh bảỉ tiết ở ống thận, bởi vì có hiện
tượng tãng tỷ lệ của didanosine được bải tỉết. Sự tãng nảy có thế do tăng cá độ khả dụng sinh học vả giảm
chuyến hóa. Không có tác động đảng kể về mặt lâm sảng vởỉ nồng độ của ganciclovỉr. Tuy nhỉẽn vởi hiện tuợng
tăng nồng độ huyết tưong cùa didanosine do sư có mặt cùa ganciclovir, bệnh nhãn nên được theo dõi chặt chẽ
độc tỉnh cùa didanosine (xem phần 2.4. Các cảnh bảo và thận trọng)
.Mycophenoỉate mofetil
Dựa vảo kết quả từ nghiên cứu dùng liều đơn dưòng uống cùa mycophenolate mofetỉl [MMF) với liều được
khuyến cảo vả ganciclovir tiêm tĩnh mạch và cảc tảc động đã biểt cùa suy thận trẽn dược động học cùa MMF vả
ganciclovir, cẩn chú ý rằng dùng đồng thời hai thuốc nảy (có khả năng cạnh tranh sự bải tiết ở ống thận) sẽ lảm
tăng phenolico Dlucuronỉdc của acid mycophenolic (MPAG) vả nồng độ ganciclovir. Không có sự thay đối nhiều
về dược động học cua mycophenolic acid (MPA) được dự tinh trưởc và không cân điều chinh liều cúa MMF
Nhũ ng bệnh nhân bị suy thận mả dùng cả MMF vả ganciclovir, cần chú ý theo dõi liều khuyến cảo của
ganciclovir và bệnh nhân cần được theo dõi một cảch cẩn thận.
Zalcitabine
Zalcitabỉne lảm tãng AUCO g cùa ganciclovir dạng uống khoảng 13%. Không thấy sự thay đổi có ý nghỉa thống
kê ở cảc thông sỏ dược động học khảo được đánh giả. Ngoài ra, không có những thay đối liên quan về mặt lâm
sảng về dược động học cùa zalcitabine khi có sự hiện diện cúa ganciclovir dạng uông mặc dầu đã quan sát thẳy
có tãng nhẹ tỉ lệ đảo thải.
Stavudine
Không thấy tương tảc dược động học có ý nghĩa thống kê khi stavudine vả ganciclovỉr dạng uống được dùng
kêt họp.
Trimethoprim
Trimcthoprim lảrn giảm có ý nghĩa thống kê độ thanh thải thận cùa ganciclovỉr dạng uống khoảng 16,3% và
điêu nảy kêt hợp với sự gỉảm tỉ lệ bải tiêt giai đoạn cuôi có ý nghĩa thông kê vả ]ỂLLLL tăng tương ứng thời gian
bản hùy khoảng 15%. Tuy nhiên, những thay đôi nảy dường như không đáng kê vẻ mặt lặm sảng, vì AUCH và
C,… không bị ảnh hưởng. Sự thay đôi duy nhất có ý nghĩa thỏng kê ở cậc thông sô dược động học cùa
trimethoprim khi dùng chung với ganciciovir lả tãng 12% Can- Tuy nhiên, điêu nảy không có ý nghĩa đảng kê
trõn lâm sảng và không cân điêu chỉnh liêu.
C yclosporin
Không có bằng chứng cho thấy ganciclovir tác động tới dược động học cùa cyclosporin dựa vảo sự so sảnh
nông độ thấp nhất cùa cyclosporin Tuy nhiên có một số bằng chứng về sự tăng giá trị tối đa của creatinine
huyết thanh được quan sát sau khi bắt đầu điều trị với gancilcwir.
C ác tương tác thuốc tìềm tảng khảc
Vi ganciclovir được bải tiết qua thận thông qua lọc cẳu thận và bải tiết ở ồng hoạt động (xem phần 3. 2 4 Các
đặc tính dươc động học. Bài tiết), điều trị đồng thòi valgancic10vir vởi các thuốc khảng vỉrus mà cùng chia sẻ
đường bải tiết ở õng thận, chẳng hạn như cảc chất ức chế men sao chép nguợc nucleos(t)ide, có thế lảm thay
đồi nồng độ của valganciclcwir vả/hoặc các thuốc dùng chung trong huyết tương.
Độc tính có thể tăng lẽn khi ganciclovỉr được dùng cùng vởi cảc thuốc khảo được biểt lả ức chế tủy xương hoặc
kết hợp với Suy thận (như lá dapsone, pentamidine, flucytosỉne, vincristỉne, vinblastine, adriamycin,
amphotericin B, chắt tương tự nucleoside, hydroxyưrea vả pegylated interferons/ribavirin). Vì vậy, những thuốc
nảy nên được cân nhắc khi dùng cùng với ganciclovir nếu lợi ích cao hơn hẳn cảc nguy cơ tiềm ân (xem phẩn
2.4 Khuyến cáo và thận trọng đặc biệt).
2.5. Sử dụng ở nhóm dân số đặc biệt /ggể
/
2.5.1. Phụ nữ có thai
Cảo nghiên cưu về độc tính sính sản chưa được đề cập với valganciclovir do sự chuyền hóa thảnh ganciclovir
nhanh vả nhiều. Gancỉclovỉr lảm giảm khả nãng sinh sản vả có tính gây quải thai ở động vật (xem phần 3.3.3 Sự
suy giảm khả năng sinh sản and 3.3.4. Tính sinh quái thai)
Nhũng phụ nữ trong giai đoạn sinh đẻ nên được khuyên dùng cảc biện phảp tránh thai hữu hiệu trong khi điều
tn.
Độ an toản cùa Valcyte khi sử dụng ở phụ nữ có thai chưa được chứng minh. Nên trảnh sử dụng Vaĩcyte ở phụ
nữ có thai trừ khi các lợi ích cho mẹ hơn hắn cảc nguy cơ tíềm tảng cho thai.
2.5.2. Quá trình chuyển dạ và sinh nở
Không có thông tín nảo về việc sử dụng Valcyte trong khi chuyền dạ vả sinh nớ.
2.5.3. Phụ nữ đang cho con bú
Sự phảt triền trong thời kỳ chu sỉnh vả sau khi sinh chưa được nghiên cứu vởi valganciclovir hoặc với
ganciclovir nhưng khả năng ganciclovir được tiết qua sữa mẹ và gây cảc phản ứng phụ nghiêm trọng ở trẻ mới
sinh không thể loại trù. Vì vậy, quyết định ngừng điều trị hoặc ngùng cho con bú phải được cãn nhắc vì lợi ích
tiềm tảng cùa Valcyte cho bả mẹ đang cho bú.
2.5.4. Sử dụng trong lão khoa
Tính an toản vả hiệu quả cùa Valcyte còn chưa được xảc lập ở đối tượng nảy (xem phần 2.2. Liều lượng và
cảoh sử dụng).
2.5.5. Suy thận
ơ bệnh nhân suy thận, việc điều chỉnh liều phải dựa vảo độ thanh thải creatinine (xem phần 2.2.1, Hướng dẫn
sử dụng liều đặc biệt và 3.2.5 Dược động học ở những đối tượng đặc biệt).
2.5.6. Suy gan
Không có thông tin về sử dụng Valcyte ở bệnh nhãn suy gan.
2.5.7. Tác động Iẽn khả năng lái xe và vận hânh mảy mỏc
Co giật, buồn ngù, chóng mặt, mắt điều hòa vận động, vả/hoặc lẫn lộn có thể xảy ra ở nhũng bệnh nhân đang
điều trị vởỉ Valcyte vả/hoặc ganciclovỉr. Nếu chúng xảy ra, các tảc dụng phụ nảy có thể ảnh hưởng đến các
công việc đòi hói sự tinh táo bao gổm cả khả năng lái xe vả vận hảnh mảy móc cùa bệnh nhân.
2.6. Tác dụng không mong muốn
Thông bảo cho bảc sĩ của bạn bắt cứ tác dụng có hại nảo có liên quan đến việc dùng thưốc.
2.6.1. Kinh nghiệm từ cảc thử nghiệm lâm sảng
Kinh nghiệm với VaIcyte
Valganciclovir là tiền chất cùa ganciclovir, được chuyến hóa nhanh chóng thảnh ganciclovit sau khi uống. Vì
thế mã các tảo dụng không mong muốn được biểt khi dùng ganciclovir có thể được trỏng đợi xảy đến với
5
v
Valcyte. Tất cả các tác dụng không mong muốn quan sát được trên cảc nghiên cứu lâm sảng với Valcyte đã
được ghi nhận trước đây với ganciclovir.
Bênh nhân trưởng thảnh
Điều trị viêm võng mạch do virus cự bảo ở bệnh nhân AIDS
Độ an toản cùa valgancỉclovir vả ganciclovir tiêm tĩnh mạch trong 28 ngảy của một nghiên cứu ngẫu nhiên (21
ngảy điểu trị khời đầu và 7 ngảy điều trị duy trì) ở 79 bệnh nhân mỗi nhóm cho kết quả tương đương Các tảo
dụng phụ được đề cập thường xuyên nhất là tiêu chảy, giảm bạch cầu trung tính và sốt. Nhiều bệnh nhân được
bảo cáo bị tiêu chảy, nâm miệng, đau đầu vả mệt mòi trong nhóm uống valganciclovir, vả buổn nôn vả nhưng
tảc dụng khảc có liên quan đểu vị trí tiêm trong nhóm điều trị bằng ganciclovir tiêm tĩnh mạch (xem bảng 2)
Bâng 2. Phần trăm số bệnh uhân có tảc dụng ngoại ý chọn lọc xảy ra trong pha nghiên cửu ngẫu nhỉên.
Cảc tác dụng ngoại ý Nhóm dùng N hóm dùng ganciclovir
Valganciclovir tiêm tĩnh mạch
n = 79 n = 79
Tiêu chảy 16% 10% , —
Nắm rniệng 11% 6% /ẶỞ
Đau đâu 9% 5%
Mệt mòi 8% 4% /
Buổn nôn 8% 14%
Viêm tĩnh mạch và viêm tĩnh mạch huyết khối — 6%
Bảng 3 dưới đây đưa ra các tác dụng ngoại ý không tính tới mức độ nặng vả mối quan hệ vởi thuốc dùng với tỉ
lệ 2 5% thu được từ thử nghiệm lâm sảng điểu trị bằng valganciclovir trên bệnh nhân bị viêm võng mạc hoặc sử
dụng valganciclovỉr trên cảc bệnh nhân ghép tạng cứng.
Thông tin trong bảng 3 liên quan tới các bệnh nhân viêm võng mạc do virus cụ bảo dựa trên 2 thử nghiệm lâm
sảng (N = 370), bệnh nhân viêm võng mạc do CMV được điều trị bằng Valcyte với Iiều 900mg hai lần mỗi
ngảy hoặc một lần mỗi ngảy, ứng vởi chế độ điểu trị khởi đầu và duy trì theo thứ tự. Khoảng 65% nhưng bệnh
nhân nảy được điều trị bằng valgancíclovir hơn 9 thảng (thời gian tối đa là 30 thảng).
Cảo phản ứng phụ thường gặp nhất, bất kể mức độ nặng được cảc nhà nghiên cứu coi là có liên quan (ít, có kh“
năng hoặc có thế) tới Valcyte là giảm bạch cẳu trung tính, thiếu máu, tiêu chảy và buồn nôn.
Phòng bệnh do CMVở bệnh nhân ghép tạng ầ _.
Bảng 4 cũng đưa ra cảc tảc dụng ngoại ý (theo dõi đển 28 ngảy sau điều trị trong nghiên cứu) bất kể mức đỡ
nặng và mối liên quan vởi thuốc dùng với tỷ lệ 2 5% từ cảc thử nghiệm lâm sảng trong đó bệnh nhân ghép n”9
tạng có sử valganciclovir hoặc uống ganciclovirbắt đầu trong vòng 10 ngảy của ca ghép cho đến ngảy thứ [
sau khi ghép tạng. . f
Phần lởn tần số cảc tác dụng ngoại ý, bất kể mức độ nặng được xem là có liên quan (rất ít, có thề, hoặc chắc
chắn) với Valcyte, được các nhà nghiên cứu ghi nhận trên cảc bệnh nhân ghép tạng lả giảm bạch cầu, tiêu chảy,
buồn nôn, gỉảm bạch câu trung tính và gỉảm bạch cầu, giảm bạch cầu trung tmh, thiếu mảư và tiêu chảy ở bệnh
nhân ghép thận được điếu trị cho đến khi ngảy thứ 200 sau ghép
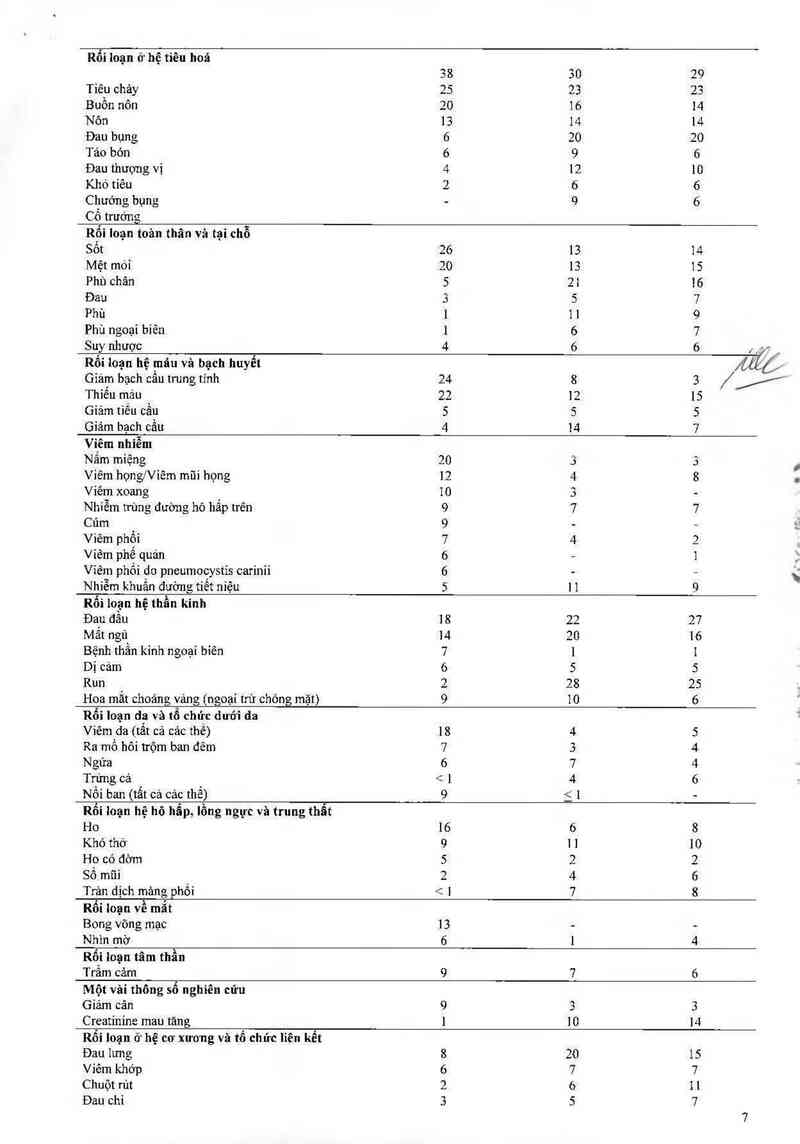
Bảng 3: Phần trăm số bệnh nhân vởi các tác dụng ngoại ý xảy ra 2 5% số bệnh nhân ở bệnh nhân viêm
võng mạc do CMV hoặc ghép tạng được nghiên cứu với valganciclovir hoặc ganciclovir
Bệnh nhân viêm Bệnh nhân ghép tạng cứng
võng mạc do CMV dùng tớỉngây thứ 100 sau ghép tạng
Valganciclovir Valganciclovir Ganciclovir uống
Hệ cơ quan (n=370) (n=244) (n= 126)
% % %
Rối loạn ở hệ tiêu hoá
38 30 29
Tiêu chảy 25 23 23
Buồn nôn 20 16 14
Nôn 13 14 14
Đau bụng 6 20 20
Táo bón 6 9 6
Đau thượng vị 4 12 10
Khó tiêu 2 6 6
Chưởng bụng - 9 6
Cổ trướng
Rối loạn toản thân và tại chỗ
Sốt 26 12 14
Mệt mòỉ 20 13 15
Phù chân 5 21 16
Đau 3 5 7
Phù l 1 1 9
Phù ngoại hiên ] 6 7
Suy nhược 4 6 6 ;,ỵ' _
Rối loạn hệ máu và bạch huyết /Ặélớ
Giảni bạch cầu trung tính 24 8 3 //'
Thiêu máu 22 12 15
Gìảm tiểu cầu 5 5 5
Giảm bạch cầu 4 14 7
Viêm nhiễm
Nắm miệng 20 3 3
Viêm họnglViêm mũi họng 12 4 8
Viêm xoang 10 3 -
Nhiễm trùng đường hô hấp trên 9 7 7
Cúm 9 - —
Viêm phổi 7 4 2
Viêm phế quản 6 — 1
Viêm phối do pneumocystis carinii 6 - —
Nhiễm khuẩn đường tiết niệu 5 L 1 9
Rối loạn hệ thần kinh
Đau đầu 18 22 27
Mắt ngủ 14 20 16
Bệnh thần kinh ngoại biên 7 l 1
Dị cảm 6 5 5
Run 2 28 25
Hoa mắt choáng vảng (ngoại trừ chóng mặt) 9 10 6
Rối Ioạn da và tổ chút dưới da
Viêm da (tẳt cả các thế) 18 4 5
Ra mồ hôi trộm ban đêm 7 3 4
Ngứa 6 7 4
Trứng cá < 1 4 6
Nổi ban (tẩt cả các thế) 9 ỉ ] -
Rối loạn hệ hô hẫp, lồng ngực và trung thẩt
Ho 16 6 8
Khó thờ 9 1 1 10
Ho có đờm 5 2 2
Số mũi 2 4 6
Trân dịch mảng phổi < 1 7 8
Rối loạn về mắt
Bong võng mạc 13 - -
Nhìn mở 6 l 4
Rối loạn tâm thần
Trầm cảm 9 7 6
Một vâi thông số nghiên cứu
Giảm cân 9 3 3
Creatinine mau tảng ] 10 14
Rối loạn ở hệ cơ xương và tổ chức liên kết
Đau lưng 8 20 15
Viêm khớp 6 7 7
Chuột rút 2 6 11
Đau chi 3 5 7
Rối loạn ở thận và tiết niệu
Suy thận l 7 12
Bí đải 2 7 6
Rối loạn hệ miễn dịch
Ghép vả thải ghép - 24 30
Rối loạn về chuyển hoá và dinh đường
Chản ăn 5 3 -
Suy nhược 5 - -
Tăng kali hưyết < L 14 1
Giảm kali huyết 2 8 8
Giảm ma—giê huyết < 1 8 8
Tăng g1uco huyết 1 6 7
Giảm cảm giác thèm ăn 8 4 5
Mắt nước 5 6
Giảm phospho huyết < 1 9 6
Giám ca1ci huyết < 1 4 c
Rối loạn hệ thống gan - mật
Rối ioạn chức năng gan 3 9 1 1
Phẫu thuật và thủ thuật /ẶỄU
Các biến chứng sau mổ L L2 8 _//
Đau sau phẫu thuật 2 13 7
Nhiễm trùng vết mổ l 1 1 6
Chẩn thmmg, nhiễm độc và biển chứng sau thủ
thuật
Tăng tiết dịch vết thương - 5 9
NL'Lt vết thuong < L 5 6
Rối loạn về mạch
Hạ huyết ảp L 3 8
Tăng huyết áp 3 18 15
Các phản ứng ngoại ý được coi lả có liên quan đến việc dùng Valcyte đuợc bảo cáo từ ba thử nghiệm lâm sảng
(n=934) với tằn suất dưới 5% vả không được đề cập đến trong hai bảng trên, đuợc liệt kê dưói đây:
Hệ máu vả hạch bạch huyết: giảm toản bộ huyết cầu, úc chế tủy xương ,thiếu mảư bất sản, sốt giảm bạch cẳu
trung tính.
Hệ tiết m'ệu: giảm độ thanh thải creatinine
Biến chúng cháy máu: nguy cơ chảy mảư đe dợa đến tinh mạng kết hợp với giảm tiểu cẳu
Hệ thần kinh trung ương và ngoại vi: co giật, rối loạn tâm thần, ảo giác, lẫn lộn, kich động
T oản thăm quá mẫn với valganciclovir
Giảm bạch cầu trung tinh nặng (< 500 ANC/ 121) gặp thường xuyên hon ở bệnh nhân võng mạc do CMV (16%)
điều trị với valganciclovir so với cảc bệnh nhân ghép tạng dùng valgancic10vir (9%) hoặc bệnh nhân dùng
ganciclovir uống (3%) cho tới ngảy thứ 100 sau khi ghép tạng hoặc valganciclovir (10%) cho đến ngảy 200 sau
ghép. Hiện tượng tãng creatinine huyết gặp nhiếu hơn ở cảc bệnh nhân ghép tạng được điếu trị cho đến ngảy
thứ 100 hoặc ngảy thứ 200 sau khi ghép tạng bằng cả valganciclovir vả ganciclovir uống so với cảc bệnh nhân
viêm võng mạc do CMV. Sưy thận là biểu hiện thường gặp hơn ở cảc bệnh nhãn ghép tạng.
Dữ iiệu an toản cùa Vaicyte không thay đồi khi kéo dải liều phòng ngừa cho tởi ngảy thứ 200 sau khi ghép tạng
ở bệnh nhân ghép thận có nguy cơ cao. Giảm bạch cẳu đã được bảo cảo với một tỷ lệ cao hơn một chút trong
nhảnh dùng 200 ngảy trong khi tỷ lệ giảm bạch cầu trưng tỉnh, thiếu mảư và giảm tiếu cầu tương tự ở cả hai
nhánh.
K L'nh nghiệm vởi ganciclovir
Va1cytc đuợc chuyến hóa nhanh thảnh ganciclovir. Các tảc dụng phụ được bảo cảo vởi ganciclovir, vả khõng
được đề cập ở trên, được liệt kê dưới đây
- Rồi loạn hệ tiêu hóa: viêm đưòng mật, khó nuốt, ợ hơi, viêm thực quản, đại tíện không tự chù, đầy hơi,
viêm dạ dảy, rối loạn tiêu hớa, chảy mảư đường tiêu hoả, loét miệng, viêm tụy, rối loạn tại lưỡi.
- Toản lhán: cảc rối loạn chung: suy nhược, nhiễm vi khuẩn, nâm vả virus, chảy mảu, mệt mỏi, rối loạn niêm
mạc, phản' ưng nhạy cảm vởi ánh sảng, rẻt run, nhíễm khuẩn.
— Rối Ioạn hệ gan: vỉêm gan, vảng da.
- Rối loạn da vảphần phụ: rụng tóc, da khô, ra nhiếu mồ hôi, Lnế đay.
- Rối 10an hệ lhấn kinh trung 1ng vả ngoại vi. mộng mị, quên, lo lắng, mất điều hòa, hôn mẽ, khô miệng,
rối loạn cảm xức, hội chứng tăng vận động, tãng trung lực cơ, gỉảm tình dục, múa giật, căng thẳng, buổn
ngủ, suy nghĩ bẩt thường.
- Rối Ioạn hệ cơ xương khóp: đau cơ xương, hội chứng nhược cơ.
— Rối Ioạn hệ tiết m'ệu: đải máu, bắt lực, suy thận, tiếu nhiều lần.
- Rối loạn chuyến hóa và dinh dưỡng: alkalỉne phosphatase máu tăng, creatỉne phosphokinase mảư Lãng,
glucose mảư giảm, lactic dehydrogenase máu tăng, đải thảo đường, hạ protein máu.
— Các giác quan: giảm thị lực, mù, đau tai, chảy máu mắt, đau mắt, điếc, thiên đẩu thống, rối Ioạn vị giác,
viêm xoang, bất thường về thị giảc, rối loạn thủy tinh thề.
— Hệ máu vả hạch bạch huyết. chứng tãng bạch cầu ưa axit, chứng tăng bạch cẩu, bệnh hạch bạch huyết, phì
đại Iảch
— Rối loạn hệ zim mạch. loạn nhịp tim (bao gồm loạn nhịp thất), đau nứa đầu, viêm tĩnh mạch, nhịp tim
nhanh, viêm tĩnh mạch huyết khối, giãn mạch.
- Rối Ioạn hệ hô hấp. sung huyết xoang.
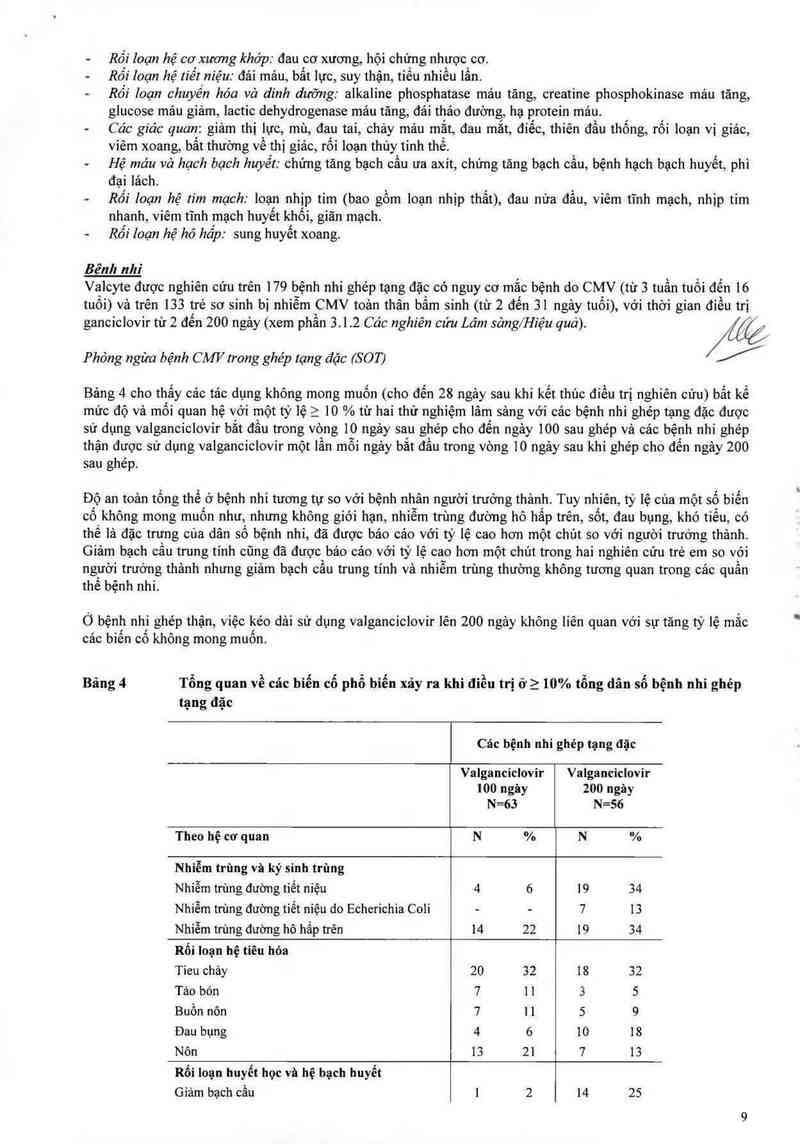
Bênh nhi
Valcyte được nghiên cứu trên 179 bệnh nhi ghép tạng đặc có nguy cơ mắc bệnh do CMV (từ 3 tuần tuổi đến 16
tuổi) và trên 133 trẻ sơ sinh bị nhiễm CMV toản thân bẩm sinh (từ 2 đến 31 ngây tuổi), với thời gian điều trị
ganciclovir từ 2 đến 200 ngảy (xem phần 3.1.2 Cảc nghiên cứu Lám sảng/Hiệu quả). /ử
/
Phỏng ngừa bệnh CMV trong ghép tạng đặc (SOT)
Bảng 4 cho thấy cảc tảc dụng không mong muốn (cho đến 28 ngảy sau khi kết thúc điều trị nghiên cứu) bất kể
mức độ và mối quan hệ với một tỷ lệ > 10 % từ hai thử nghiệm lâm sảng với cảc bệnh nhi ghép tạng đặc được
sử dụng valganciclovir bắt đầu trong vòng 10 ngảy sau ghép cho đến ngảy 100 sau ghẻp vả cảc bệnh nhi ghép
thận được sử dụng valganciclovir một lần mỗi ngảy bắt đầu trong vòng 10 ngảy sau khi ghép cho đến ngảy 200
sau ghép
Độ an toân tống thể ở bệnh nhi tương tự so với bệnh nhân người trưởng thảnh. Tuy nhiên, tỷ lệ của một số biến
cố không mong muốn như, .nhưng không giói hạn, nhiễm trùng đường hô hấp trên, sốt, đau bụng, khó tiếu, có
thế là đặc trưng cùa dân số bệnh nhi, đã được bảo cáo với tỷ lệ cao hon một chủt so với ngưòi trưởng thảnh.
Giảm bạch câu trung tính cũng đã được báo cảo với tỷ lệ cao hon một chủt trong hai nghiên cứu trẻ em so vói
người trưởng thảnh nhưng giảm bạch cầu trung tính vả nhiễm trùng thường không tương quan trong các quần
thể bệnh nhi.
Ó bệnh nhi ghép thận, việc kéo dải sử dụng valganciclovir lên 200 ngảy không liên quan với sự tăng tỷ lệ mắc
cảc biến cố không mong muốn.
Bảng 4 Tổng quan về các biển cổ phổ biến xảy ra khi điếu trị ở2 10% tổng dân số bệnh nhi ghép
tạng đặc
Cảc bệnh nhi ghép tạng đặc
Valganciclovir Valganciclovir
100 ngây 200 ngảy
N=63 N=56
Theo hệ cơ quan N % N %
Nhiễm trùng và ký sinh trùng
Nhiễm trùng đường tiết niệu 4 6 19 34
Nhiễm trùng đường tiểt niệu do Echerichia Coii — - 7 13
Nhiễm trùng đường hô hấp trên 14 22 19 34
Rối loạn hệ tiêu hóa
Tieu chảy 20 32 18 32
Tảo bón 7 1 1 3
Buồn nôn 7 11 5
Đau bụng 4 6 10 18
Nôn 13 21 7 13
Rối loạn huyết học và hệ bạch huyết
Giảm bạch cầu 1 2 14 25
Thiếu mảư 9 14 9 16
Giảm bạch cẩu trung tính 8 13 13 23
Rối loạn chung và tại đuờng dùng
Sốt 15 24 9 16
Xét nghiệm
Tăng creatinine mảư l 2 9 16
Rối Ioạn thận niệu
Tiều máu 4 6 6 L L
Khó tiểu L 2 10 18
Rối Ioạn hệ thần kinh
Run 2 3 10 18
Nhức dầu 4 6 12 2L
Ảo :
ROL Ioan mach mau
Tăng huyết áp 14 22 9 16
Rối loạn hệ miễn dịch /
Thải ghép 6 10 3 5
C MV bầm sinh
Độ an toản cùa valganciclovir vả ganciclovir cho đến 6 thảng điều trị được đảnh giả ở 133 trẻ sơ sinh hoặc nhũ
nhi bị nhiễm CMV bẩm sinh có triệu chứng ở độ tuổi từ 2 ngảy đến 31 ngảy trong hai nghiên cứu. Mặc dù dữ
liệu nảy có hạn nhưng không có vấn đề về an toản thuốc được xảc định, vả tính an toân cùa thuốc là phù hợp
vởỉ dữ iiệu an toản đã được biết của valganciciovir / ganciclovir.
Trong nghiên cứu thứ nhất, độc tính chính liên quan vởi ganciclovir là giảm bạch cầu trung tinh vởi 9 trong số
24 cả thể (38%) ở mức độ 3 hoặc 4 trong khi điều trị. Chi có một đối tượng đã phải chắm dứt điều trị khảng
virus vĩnh viễn do giảm bạch cầu trung tỉnh. Hầu hết các biến cố đều kiểm soát được và tiếp tục điều trị khảng
virus trong nghiên cứu nảy. Sự tăng trường (chu vi vòng đầu, trọng lượng và chỉều cao) cùa tất cả cảc trẻ sơ
sinh có ghi nhận số đo tãng trưởng đều tãng theo thời gian trong nghiên cứu khỏng so sánh nây.
Trong nghiên cứu thứ hai, các biến cố không mong muốn do điều trị thường gặp nhắt liên quan đến
valganciclovir đường uống lả gíảm bạch cầu, thiếu mảu, chức năng gan bất thường và tiêu chảy, tất cả đếu có
tần suất cao hơn ở nhóm dùng giả dược. Các biến cố không mong muôn nghiêm trọng do điểu trị chi có giảm
bạch cầu trung tính và thiếu mảu, cả hai thường gặp hơn ở nhóm giả dược. Có sự khảc biệt có ý nghĩa thống kế
hoặc lâm sảng đã được quan sảt trong tốc độ tãng trưởng (trung bình chu vi vòng đầu, trọng lượng và chiều dải
cơ thể) theo thời gian tại môi thời điếm giữa hai nhóm điều trị.
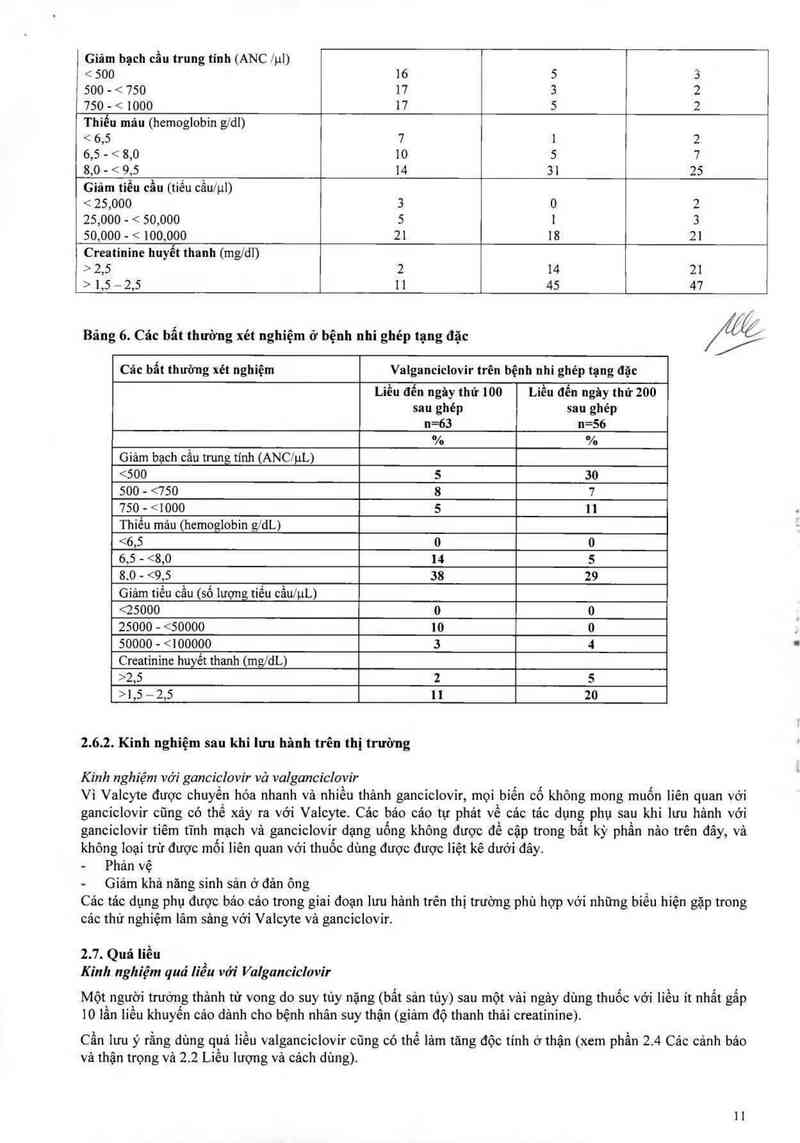
2. 6.2. Các bất thường về xét nghỉệm
Cảc bất thường về xét nghiệm ở bệnh nhân ghép tạng đặc người trưởng thảnh điều trị valganciclợvir
cho đến ngặy thứ 100 sau ghép được liệt kê trong Bảng 5. Tỷ lệ cảc bất thường xét nghiệm có thể so
sánh với phần điều trị dự phòng mở rộng lên đến 200 ngảy ở các bệnh nhân ghép thận có nguy cơ cao.
Các bất thường xét nghiệm ở bệnh nhi ghép tạng đặc được liệt kê trong Bảng 6. Tỷ lệ giảm bạch cầu
trung tính nặng (ANC <500/ụL) ở những bệnh nhi ghép thận được điều trị cho đển ngảy thứ 200 cao
hơn so với bệnh nhi được điều trị cho đến khi ngảy 100 và so với bệnh nhân ghép thận người trưởng
thảnh được điều trị cho đến ngảy 100 hoặc ngây 200.
Bâng 5 Các bẩt thường về xét nghiệm trên bệnh nhân người trưởng thânh
Bệnh nhãn viêm vỏng Bệnh nhân ghép tạng đặc (vởi liều đến ngây
mạc CMV 100 sau ghép)
Các bẩt thường về xét nghiệm Valganciclovir fflganciclovir Ganciclovir uổng
(n=370) (n=244) (n=126)
% % %
I
Giãm bạch cầu trung tính (ANC lụl)
< 500 16 5 3
500 - < 750 17 3 2
750 - < 1000 17 5 2
Thiểu mảu (hemoglobin g/dl)
< 6,5 7 1 2
6,5 - < 8,0 10 5 7
8,0 - < 9,5 14 31 25
Giâm tiễu cầu (tiều cầulụl)
< 25,000 3 0 2
25,000 - < 50,000 5 1 3
50,000 - < 100,000 21 18 21
Creatinine huyết thanh (mg/dl)
> 2,5 2 14 21
> 1,5 — 2,5 11 45 47
Bảng 6. Các bẩt thường xét nghiệm ở bệnh nhi ghép tạng đặc
\ề
Các bẩt thường xét nghiệm Valganciclovir trên bệnh nhi ghẻp tạng đặc
uủaủngymứmo uửaửnạymứmo
sau ghép sau ghẻp
n=63 n=56
% %
Giảm bạch cầu trung tính (ANCJ’ựL)
<500 5 30
500 - <750 8 7
750 - < 1000 5 1]
Tỏmủfflmgủmfflm
<6,5 0 0
6,5 - <8,0 14 5
8.0 - <9,5 38 29
Giảm tiểu cầu (số lượng tiều cầw'ụL)
<25000 0 0
25000 - <50000 10 0
50000 - < 100000 3 4
Creatinine huyết thanh (mg/dL)
>2,5 2 5
>1,5 — 2,5 1] 20
2.6.2. Kinh nghỉệm sau khi lưu hânh trên thị trường
Kinh nghiệm với ganciclwir vả valganciclovir
Vi Valcyte được chuyền hóa nhanh và nhiếu thảnh ganciclovir, mọi biến cố không mong muốn liên quan với
ganciclovir cũng có thể xảy ra với Valcyte. Cảc bảo cảo tự phảt vế cảc tảc dụng phụ sau khi lưu hảnh với
ganciclovir tìêm tĩnh mạch và ganciclovir dạng uống không được đề cập trong bẩt kỳ phần nâo trên đây, và
không loại trừ được mối liên quan vởi thuốc dùng được được liệt kê dưới đây,
- Phản vệ
- Giảm khả năng sinh sản ở đản ông
Các tác dụng phụ được bảo cảo trong gỉai đoạn lưu hảnh trên thị trường phù hợp vởi những biềư hiện gặp trong
các thử nghiệm lâm sảng với Valcyte vả ganciclovir.
2.7. Quá liều
Kỉnh nghiệm qua' Iiêu với Valganciclovir
Một người trường thảnh tử vong do suy tủy nặng (bất sản tùy) sau một vải ngảy dùng thuốc với liều ít nhẩt gấp
10 lân liêu khuyến cảo dảnh cho bệnh nhân suy thận (giảm độ thanh thải creatinine).
Cần lưu ý rằng dùng qụá 1iều valganciclovir cũng có thể lảm tăng độc tính ở thận (xem phần 2.4 Các cảnh bảo
vả thận trọng và 2.2 Liêu lượng vả cảch dùng).
11
Thẩm phân mảư vả cân bằng nước cũng có thế có ích trong việc giảm nồng độ thuốc trong huyết tương cùa
bệnh nhân dùng quá liều valganciclovir (xem phần 3.2.5 Dược động học ở những đôi tượng đặc biệt).
Kinh nghiệm qua' !iều với ganciclovir tiêm tĩnh mạch
Cảo bảo cảo về quá liều vởi ganciclovir tiêm tĩnh mạch đã được thu thập từ cảc thử nghiệm lâm sảng vả trong
quá trinh thuôc lưu hảnh trên thị trường. Trong một số trường hợp, không có cảc tảc dụng ngoại ý được báo
cảo. Phân lớn cảc bệnh nhân có một số cảc tảc dụng ngoại ý sau:
— Độc tính về máu: giảm toản thể huyết cầu, ức chế tủy xưong, bất sản tùy, giảm bạch cầu, giảm bạch cầu
trung tính, giảm bạch câu hạt.
— Độc tính vê gan: viêm gan, rôi loạn chức năng gan.
— Độc tỉnh thận: Iảm nặng thêm tình trạng đải mảư ở bệnh nhân có suy thận từ trước, suy thận cấp, creatinine
tăng cao.
- Độc tính về tìêu hóa: đau bụng, tiêu chảy, nôn. '
— Độc tính thần kính: run khắp người, co giật ở
3. CÁC ĐẶC TÍNH VÀ TÁC DỤNG DƯỢC LÝ
3.1. Các đặc tính được lực học
3.1.1. Cơ chế hoạt động
Valganciclovir lả chắt este L-valyl (tiến chất) của ganciclovir, sau khi uống nhanh chóng chuyền thảnh
ganciclovir nhớ men esterase ở gan và ruột. Ganciclovir lả chẩt đồng đẳng tống hợp của 2’deoxyguanosine, ức
chế sự sao chép virus herpes ở in vitro và in vivo. Cảo virus nhạy cảm ở người bao gổm virus cự bảo (HCMV),
virus herpes-simplex 1 và 2 (HSV—l vả HSV-2), vỉrus herpes người -6, -7 và -8 (HHV—ó, HHV-7, HHV-8),
vims Epstein-Barr (EBV), vỉrus varicella-zoster (VZV) và virus viêm gan B.
Ở các tế bảo nhiễm virus cự bảo, ganciclovir bước đẩu được phosphoryl hỏa thảnh ganciclovir monophosphate
bòi men protein kinase UL 97 cùa virus Sự phosphoryl hóa tiếp theo xảy ra nhờ một vải men kinase của tế bảo
để tạo nên ganciclovir triphosphate, sau nảy được chuyến hóa một cách từ từ bên trong tế bảo. Người ta đã quan
sảt thẳy sự chuyến hóa nảy xảy ra ở các tế bảo nhiễm virus Herpes-simplex và virus cụ bảo với thời gían bán
hủy cho từng loại tương ứng là 18 giờ và trong khoảng 6 đến 24 giờ sau khi ganciclovir đi ra ngoải tế bảo Do
sự phosphoryl hóa phần lớn phụ thuộc vâo men kinase của virus, do vậy sự phosphoryl hóa cùa ganciclovir xảy
ra chủ yếu trong cảc tế bảo bị nhiễm virus.
Hoạt tính kim virus của ganciclovir là do ức chế sự tổng hợp DNA cùa virus bởi (a) sự ức chế cạnh tranh của sự
hợp nhât deoxyguanosine triphosphate vảo trong DNA bởi men virus polymerase DNA, và (b) sự hợp nhât
ganciclovir triphosphate vảo trong DNA cùa virus lảm cho sự kéo dải chuôi DNA của virus bị ngừng hoặc bị
hạn chế rât nhiêu. Nồng độ ức chế ICso chông vỉrus điến hình đối với CMV in vitro nằm trong khoảng 0,08ụM
(0,02ụg/ml) đến 14ụM (3,5ụglml).
Tảc động chống virus trên lâm sảng của Valcyte được chửng minh trong điều trị bệnh nhân AIDS với chấn đoản
mới cùa viêm võng mạc ỌMV (thử nghiệm lâm sảng WV 15376). Lượng virus CMV giậm từ 46% (32/69) bệnh
nhân vảo thòi điêm băt đâu nghíên cím xuông còn 7% (4/55) bệnh nhân sau bốn tuân điêu trị băng Valcyte.
3.1.2. Hiệu quả] Các nghiên cứu lâm sâng
Bệnh nhân trưởng thảnh
Điều trị viêm võng mạc C MV
Các nghiên cứu trên lâm sảng cùa Valcyte được tiến hảnh ở những bệnh nhân bị AIDS và bị viêm võng mạc do
CMV. Valcyte cũng cho thấy tính hỉệu quả tương đương trong việc điều trị viêm võng mạc do CMV so với
ganciclovir dạng tiêm.
Bệnh nhân mới được chấn đoán viêm võng mạc do CMV được lựa chọn ngẫu nhiên trong nghiên cứu điều trị
tạo dáp ứng với Valcyte hoặc ganciclovir dạng tiêm. ĩ1`i lệ bệnh nhân bị viêm võng mạc do CMV có diên biên
tốt tại tuần điều trị thứ 4 lá như nhau ở cả hai nhóm điêu trị.
Sau khi điều trị tạo đảp ứng, số bệnh nhân trong nghiên cứu nảy được điều trị duy trì với Valcyte với liều
900mg hảng ngảy. Thời gian trung bình từ lủc bắt đầu điếu trị tới Iủc bệnh tiến triển trong nhóm được điều trị
tạo đảp ứng và điều trị duy trì vởi Valcyte 1ả 226 (160) ngảy và trong nhóm nhận điếu trị cảm ứng vởi
ganciclovir tiêm tĩnh mạch và điều trị duy trì với Vaicyte là 219 ngây (125 ngảy).
l')
Dùng Valcyte cho phép nổng độ của ganciclovir trong cơ thể tương đương với nồng độ ganicỉclovir đạt được
với liều khuyến cảo cùa ganciclovir tiêm tĩnh mạch, nồng độ nảy có hiệu quả trong việc điều trị viêm võng mạc
do CMV. Miền diện tích dưới đường cong AUC của ganciclovir cho thấy có liên quan đến thời gian diễn tiến
của bệnh viêm võng mạc do CMV.
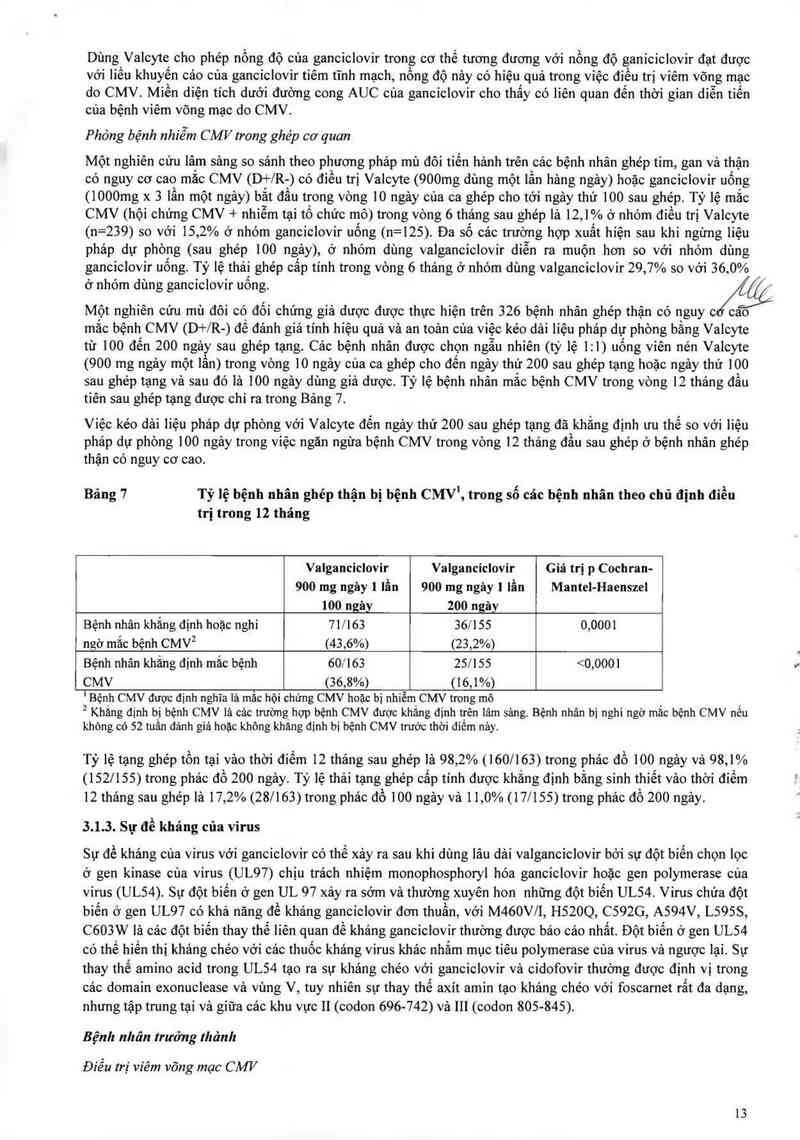
Phỏng bệnh nhiễm CMV trong ghép cơ quan
Một nghiên cứu lâm sảng so sánh theo phương phảp mù đôi tiến hảnh trên các bệnh nhân ghép tim, gan và thận
có nguy cơ cao mắc CMV (D+/R-) có điểu trị Valcyte (900mg dùng một lẩn hảng ngảy) hoặc gancic1ovir uống
(]000mg x 3 lần một ngảy) bắt đẩu trong vòng 10 ngảy của ca ghép cho tới ngảy thứ 100 sau ghép Tỷ lệ măc
CMV (hội chứng CMV + nhiễm tại tổ chức mô) trong vòng 6 thảng sau ghép là 12,1% ở nhóm điều trị Valcyte
(n=239) so với 15,2% ở nhóm ganciclovir uống (n=125). Đa sô các trường hợp xuất hiện sau khi ngừng iiệu
phảp dự phòng (sau ghép 100 ngảy), Ở nhóm dùng valganciclovir diễn ra muộn hơn so với nhóm dùng
ganciclovir uông Tỷ lệ thải ghép câp tính trong vòng 6 thảng ở nhóm dùng valganciclovir 29,7% so với 36 0%
ở nhỏm dùng ganciclovir uống.
Một nghiên cứu mù đôi có đối chứng giả dược được thực hiện trên 326 bệnh nhân ghẻp thận có nguy c cao
mắc bệnh CMV (D+lR-) đề đảnh giá tính hiệu quả và an toản cua việc kéo dải liệu pháp dự phòng bằng Valcyte
từ 100 đến 200 ngảy sau ghép tạng. Cảo bệnh nhân được chọn ngâu nhiên (tỷ lệ 1: l) uống víên nén Vaicyte
(900 mg ngảy một lần) trong vòng 10 ngảy của ca ghép cho đến ngảy thứ 200 sau ghép tạng hoặc ngảy thứ 100
sau ghép tạng vả sau đó là 100 ngảy dùng giả dược. Tỷ lệ bệnh nhân mắc bệnh CMV trong vòng 12 thảng đầu
tiên sau ghép tạng được chỉ ra trong Bảng 7.
Việc kéo dải Iiệu pháp dự phòng với Valcyte đến ngảy thứ 200 sau ghép tạng đã khẳng định ưu thế so với lìệu
phảp dự phòng 100 ngảy trong việc ngăn ngừa bệnh CMV trong vòng 12 thảng đầu sau ghép ở bệnh nhân ghép
thận có nguy cơ cao.
Tỷ lệ bệnh nhân ghép thận bị bệnh CMV', trong số các bệnh nhân theo chủ định điều
trị trong 12 tháng
Bảng 7
Valganciclovir
900 mg ngây 1 lần
Valganciclovir
900 mg ngây 1 lần
Giá trị p Cochran-
Mantel-Haenszel
100 ngãy 200 ngâv
Bệnh nhân khắng định hoặc nghỉ 71/163 36/155 o,oom
ngờ mắc bệnh CMV² (43,6%) (23,2%)
Bệnh nhân khắng định mắc bệnh 60/163 257155 <0,0001
CMV (36,8%) (16,1%)
' Bệnh CMV dược dịnh nghĩa lả mắc hội chứng CMV hoặc bị nhiễm CMV trong mô
² Khảng dinh bị bệnh CMV lả cảc trường hợp bệnh CMV được khắng định trên lâm sảng. Bệnh nhân bị nghi ngờ mắc bệnh CMV nếu
không có 52 tuần dảnh giá hoặc không khảng dịnh bị bệnh CMV trước thời điềm nảy.
Tỷ lệ tạng ghép tổn tại vâo thời điếm 12 thảng sau ghép là 98,2% (160/163) trong phác đồ ]00 ngảy vả 98,1%
(152/155) trong phảc đồ 200 ngảy. Tỷ lệ thải tạng ghép cấp tính được khắng định bằng sinh thiết vảo thời điểm
12 thảng sau ghép là 17,2% (28/163) trong phảc đổ 100 ngảy và 11,0% (17/155) trong phác đồ 200 ngây.
3.1.3. Sự đề kháng của virus
Sự đề khảng của virus vởi ganciclovir có thể xảy ra sau khi dùng lâu dải valganciclovir bòi sự đột biến chọn lọc
ở gen kỉnase cùa virus (UL97) chịu trảch nhiệm monophosphoryl hóa ganciclovir hoặc gen polymerase của
virus (ULS4). Sự đột biến ở gen UL 97 xảy ra sớm và thường xuyên hon những đột biến UL54. Virus chứa đột
biến ở gen UL97 có khả năng dễ khảng ganciclovir đơn thuần, với M460V/1, HSZOQ, csọzc, A594V, L595S,
ceo3w lá các đột biến thay thế liên quan để khảng ganciclovir thường được báo cáo nhất. Đột biển ở gen ULS4
có thề híển thị kháng chéo với cảc thuốc khảng virus khảc nhắm mục tiếu polymerase cùa virus và ngược lại. Sự
thay thế amino acid trong ULS4 tạo ra sự kháng chéo với ganciclovir vả cidofovir thường được định vị trong
các domain exonuclease và vùng V, tuy nhiên sự thay thế axít amin tạo khảng chéo vởí foscarnet rất đa dạng,
nhưng tập trung tại và giữa các khu vực II (codon 696—742)vả111(c0d0n 805-845).
Bệnh nhân trướng thảnh
Điểu trị viêm võng mạc CMV
Phân tich kiểu gen cùa CMV trong cảc phân lập bạch cầu hạt đa nhân từ 148 bệnh nhân viêm võng mạc CMV
tham gia trong một nghiên cứu lâm sảng đã cho thấy 2,2%, 6,5%, 12,8% vả 15, 3% có sự đột biến gen UL 97
sau 3, 6, 12 vả 18 tháng điều trị vởi valganciclovir.
Phòng bệnh CMV trong ghép cơ quan
Tình trạng khảng thuốc nghiên cứu qua phân tích kỉếu gen cùa CMV trong các mẫmãn bạch cẩu hạt đa nhân
được thu thập 1) tại ngảy thứ 100 sau ghép (kết thúc điều trị dự phòng dùng thuốc nghiên cứu) và 11) trong cảc
trường họp nghi ngờ CMV trong vòng 6 tháng sau ghép. Vởi 245 bệnh nhân được chọn ngẫu nhỉên điều trị
valgancíclovir, 198 mẫu được thu thập vảo ngảy thứ 100 sau ghép để kiếm tra vả không thắy cảc đột biến khảng
ganciclovir được ghi nhận. Trong khi đó có 2 trường hợp đột biến khảng ganciclovir được phảt hiện từ 103 mâu
thử nghiệm (1,9%) ở cảc bệnh nhân nhóm ganciclovir uỏng.
Trong số 245 bệnh nhân chọn ngẫu nhiên dùng valganciclovir, cảc mẫu thứ từ 50 bệnh nhân nghi ngờ CMV
được xét nghiệm và không có trường hợp đột biến kháng thuốc được ghi nhận. Trong số 125 bệnh nhân ở nhóm
ganciclovir, cảc mẫu thử được lấy từ 29 bệnh nhân nghi ngờ CMV được xét nghiệm, hai trong số nảy cho thấy
có đột biến kháng thuốc, cho tỷ lệ khảng là 6, 9%.
/
Sự đề khảng được đảnh giá trong một nghiên cứu mở rộng điếu trị valganciclovir dự phòng CMV từ 100 ngảy
đến 200 ngảy sau ghép ở bệnh nhân ghép thận người trưởng thảnh có nguy cơ cao đối với bệnh CMV (D+lR- )
(xem phần 3.1.2 Các nghiên cứu lâm sảng/Hiệu quả). Năm đối tượng trong nhóm 100 ngảy và bốn đối tượng
trong nhóm 200 ngảy đạt tiêu chuẩn phân tích để khảng đã được biết lả phảt hiện có sự thay thế amino axit có
liệnen quan đến đề khảng ganciclovir. Trong sáu đối tượng, sự đề kháng liên quan đến sự thay thế amino axit
sau đây đã được phảt hiện trong pUL97: nhóm 100 ngảy: A440V, M460V, C592G, nhóm 200 ngảy: M460V,
C603W. Trong ba đối tượng, sự đề khảng liên quan đến sự thay thế các amino axit sau đây đã được phát hiện
trong pULS4: nhóm 100 ngảy: E3ISD, nhóm 200 ngảy: E3ISD, P5225. Nhìn chung, sự khảng ganciclovir liẻn
quan đến thay thế amino axit được quan sảt thường xuyên ở những bệnh nhân trong khi điều trị dự phòng hơn
là sau khi hoản tất điều trị dự phòng (trong khi điều trị: 5/12 [42%] so với sau khi điếu trị: 4/58 [7%]). Cẩn xem
xẻt khả nãng kháng virus ở những bệnh nhân có đáp' ưng lâm sảng kém hoặc các bệnh nhân bải tiết virus tồn tại
dai dắng trong khi điều trị.
3.2. Cảc đặc tính dược động học
Các đặc tính dược động học của valganciciovir được đánh giá ở những bệnh nhân có huyết thanh dương tính
với HIV vả CMV và ở những bệnh nhân bị AIDS và viếm võng mạc do CMV và trên bệnh nhân ghép tạng.
Cảc thông số kiềm soát sự hiện diện của ganciclovir từ valganciclovir bao gồm khả dụng sính học và chức năng
thận. Độ khả dụng sinh học của ganciclovir từ valganciclovir tương đương nhau ở tất cả cảc nhóm bệnh nhân
nghỉên cứu (bệnh nhân người trướng thảnh và trẻ em). Sự hiện diện của ganciclovir trong toản bộ cơ thể ở
những người ghép tim, thận và gan tương đương nhau sau khi uống valganciclovir với cảc công thức điều tri
phủ hợp với tinh trạng chức năng thận cùa người trưởng thảnh và công thức tính liều cho trẻ em (xem mục 2.2
Liều Iưọng vả Cách dùng).
3.2.1 Hấp thu
Valganciclovir lả tiền chất cùa ganciclovir, được hấp thu tốt ở đường dạ dảy ruột và nhanh chóng chuyền hóa ở
thảnh ruột và gan thảnh ganciclovir. Độ khả dụng sinh học hoản toản của ganciclovir từ valganciclovir xâp xỉ
60%. Sự hiện diện của valganciclovir trên toản cơ thê thâp vả thoảng qua. Cảc giá trị AUCỵ vả Cmax xâp xỉ 1%
vả 3% của ganciclovir, tương ứng.
Sự tương quan giữa liều vả AUC cùa ganciclovir sau khi dùng valganciclovir ở khoảng liếu 450 tới 2625mg
được thế hiện chỉ với đỉều kiện sau ăn. Khi valganciclovir được đùngcùng vởi thức ãn ở liêu khuyên cảo
900mg, cả hai giá trị AUCu của ganciclovir vả Cmax của ganciclovir đêu tăng tương ứng là khoậng 30% vả
14%. Do vậy người ta khuyến cáo rảng Valcyte nên được dùng cùng với thức ăn (xem phân 2.2 Liên lượng vả
cảch dùng).
3.2.2 Phân bố
Do valganciclovir chuyển hóa nhanh thảnh ganciclovir, khả năng gắn kết với protein huyết tương cùa Valcyte
không được xảc định. Gancíclovir gắn kêt với protein huyêt tương khoảng 1-2% vởi nông độ 0,5 và 51 LLg/ml.
Thể tích phân bố của ganciclovir 6 trạng thải ổn định sau khi tiêm tĩnh mạch là 0,680 3 0,161 1/kg
3.2.3 Chuyến hóa
14
Valganciclovir được thủy phân nhanh chóng thảnh ganciclovir, không tìm thấy chẳt chuyển hóa nảo khảo
Không tim thẳy chất chuyến hóa sau khi uống ganciclovir được đánh dấu phóng xạ (liếu đơn 1000mg) giả thích
cho khoảng hơn 1 -2% hoạt tính phóng xạ xuất hiện trong phân hoặc nước tỉêu.
3.2.4 Đâo thải
Sau khi dùng Valcyte, ganciciovir đươc bả'Ptiết qua thận là chủ yếu bời sự alọc & tiều cầu thận và sự tỉết ở ống
thận. Độ thanh thải ở thận chiêm khoảng 81,5% i 22% thanh thải toân cơ thê cùa ganciclovir.
3.2.5 Dược động học ở những đổi tượng đặc biệt
Bệnh nhân bị suy thận
Chức nãng thận giảm lãi… giảm độ thanh thải của ganciclovir từ valgancỉclovir vả lảm tăng tương ủng thời gian
bản hủy pha cuối. Vì vậy, cân điều chinh liều ở những bệnh nhân suy thận (xem phẩn 2. 2. Liều lượng và cảch sử
dụng vả 2. 4 Cảc cảnh báo và thận trọng) / ,.
_ /(2 2
Bệnh nhân đang thâm phân máu
Vói những bệnh nhãn đang thẩm phân máu (độ thanh thải creatinine CrCl < 10 ml/phủt), liếu khuyến cáo không
được đưa ra. Lý do là liều dùng cho cả nhân của Valcyte dảnh cho những bệnh nhân nảy thấp hon hảm lượng
viên thuốc 450mg. Vì vậy, Valcyte không được dùng cho những bệnh nhân nảy (xem 3. 2 2 Cảo hướng dẫn iiều
dùng đặc biệt và 3. 4 Khuyến cảo đặc bỉệt vả thặn trọng đặc biệt).
Bệnh nhân bị suy gan
Dược động học của valganciclovir dạng ganciclovir ở những bệnh nhân ghép gan ốn định được xác định trong
một nghiên cứu mở, đảnh giá chéo 4 phần (N = 28). Độ khả dụng sinh học tuyệt đối của ganciclovir từ
valganciclovir, sau khi dùng liều đơn 900mg valganciclovir sau khi ăn, đạt khoảng 60%, phủ hợp với cảc chỉ số
đảnh giả ở những nhóm bệnh nhân khác. Giá trị AUCML tương đương với nông độ đạt được sau khi tiêm tĩnh
mạch ganciclovir 5mg/kg ở những bệnh nhân ghép gan.
3.3. Số liệu an toản tiền lâm sâng
3.3.1. Tính sinh ung thư
Kết quả ganciclovir dưong tính trong một nghiên cứu về tính gây ung thư ở chuột Valganciclovir, cũng giống
như ganciclovir là chất gây ung thư tiềm ân.
3.3.2. Tính gây đột biến gen
Valganciclovir vả ganciclovir là chất gây đột biến gen ở các tế bảo lympho ở chuột và chất 1ảm gãy gen ở các tế
bảo cùa động vật có vú.
3.3.3. Suy giảm khả nãng sính sản
Ganciclovir ảnh hưởng đến khả nâng sinh sản và tính gây quải thai ở động vật.
Cảc nghíên cứu về độc tính sinh sản không nhắc lại với valganciclovir do khả năng chuyến thảnh ganciclovír
nhanh và nhiêu. Cảnh bảo vê độc tinh lên khá nâng sinh sản như nhau được ảp dụng cho cả hai thuốc (xem phân
2. 4 Cảc cảnh bảo vả thận trỌng).
Dựa vảo các nghiên cứu trên động vật, tình trạng không sản sinh tinh trùng diễn ra khi nồng độ cùa ganciclovir
trong cơ thể thấp hơn mức điếu trị, cần lưu ý ganciclovir (vả valganciclovir) có thể gây ức chế việc sản xuất
tinh trùng ở người.
3.3.4. Tính gây quải thai
Gancíclovir gây quái thai ở động vật.
Cảc nghiên cứu về độc tinh sinh sản không nhắc lại với valganciclovir do khả năng chuyến thảnh ganciclovir
nhanh và nhiều. Cảnh bảo về độc tính lên khả năng sinh sản như nhau được áp dụng cho cả hai thuốc (xem phần
2.4 Các cảnh bảo và thận tLỌng).
Số liệu thu được khi sử dụng ở ex vivo mẫu nhau thai người cho thấy rằng ganciclovir qua được nhau thai và sự
khuếch tản đon giản là cơ chế chủ yếu của sự vận chuyển. Sự vận chuyến không bão hòa ở khoảng nồng độ từ 1
đến lOmg/ml vả xảy ra bởi sự khuếch tản thụ động.
4. CÁC ĐẶC TÍNH DƯỢC HỌC
4.1. Bảo quãn:
Viên nén:
Không bảo quản ở nhiệt độ trên 30°C.
4.2. Hướng dẫn đặc biệt trong sử dụng, thao tảc vả huỷ bỏ
Tính không tương thích: Không ảp dụng
Hạn dùng: 36 tháng.
Độ ổn định:
Không nên bè hoặc nghiến nát viên thuốc. Do Valcyte được coi lả tác nhân gây quải thai và ung thư tiềm tảng ở
người, nên thận trọng khi sử dụng viên thuốc bị vỡ hoặc bột để pha hỗn dịch uông (xem phần 2 4. Cảc cánh bảo
và thận trỌng). Trảnh tiếp xúc trực tiếp viên thuốc vỡ hoặc bị nghiền nảt, bột thuốc hoặc dung dịch thuốc đã pha
với da và niêm mạc. Nếu có sự tiếp xúc, rửa kỳ với xã phòng và nước, rửa mắt thật kỳ với nước vô trùng hoặc
nước sạch nếu không có nước vô trùng.
Không nên sử dụng thuốc sau ngây hết hạn ghi trên bao bì. /Ă/ử
Huỷ bỏ thuốc không sử dụng/quá hạn dùng
Cần hạn chế thải bỏ các dược phầm vảo môi trường. Không được vứt bỏ các dược phấm qua nước thải và trảnh
vút bỏ qua rảc thải sinh hoạt. Hãy sử dụng “hệ thống thu gom’ ’chuyên dụng nếu có thể.
5. ĐÓNG GÓI
Viên nén 450 mg valganciclovir. Lọ đóng 60 viên.
Thuốc: Tránh xa tầm tay của trẻ
Đợc kỹ hướng dân sử đụng trước khi dùng. Nếu cần biêt thẽm thông tin xin hỏi ý kiến bác sĩ của bạn.
Chi sử dụng theo sự kế đơn cùa bác sỹ.
Lưuhảnh thảng 10 năm 2013
Sản ftuất theo yêu cẩu của: F.Hoffmann-La Roche Ltd. Basel, Thụy Sỹ
bởi: Patheon Inc.
2100 Syntex Court, Mississauga, Ontario, Canada LSN 7K9
Điện thoại: + 1 905 821 4001 Fax: + 1 905 812 6709
PHÓ cục muònc
16
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng