








%ijủ
uu… nnln- ou uủuu nuA ulu cnl mm.
um : mi Gnng dlch cuu ưu vlu nv ni m
!ùopomo on me lcc KỸ nuom: như sử nuns nưuc m Dùue.
n we: van Hủ : Im
cllelu cllng aẨlqnn. Llluenu
.. ae ...,g n,. ...… x… MW un … mm on. m u :… nương: Ilupuhonn S.A
BỘ YIL
cục QUÁN LÝ D1
| ĐĂPHỂDUY [
l
ị
Lãn dảu:ffl.…ilỔzề.……l…ỉ
\ nth unủ. ud«
nllOt « … u“c. lmm n… tlnp lun… Ainu. ARGENTINA
ưneq mamhm
MM:
lcrln IIIA s.….c
Fnlpl uu 0mnd Aulomu u m…»: Allu AHG!NY\NA
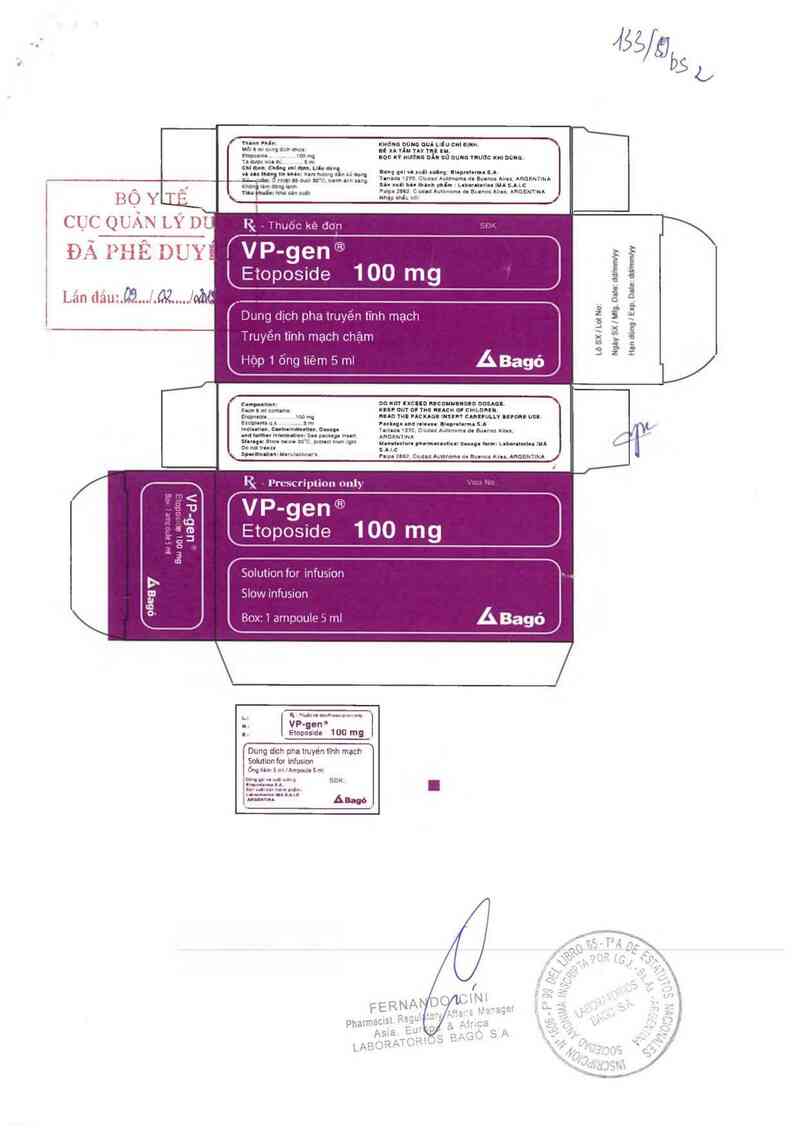
lỉ ihuòc ke don
lEtoposide 100 mg
Dung dlCh pha truyèn tính mạch
Truyền tình mạch chảm
Nqu 521 | Wu. Dlle: ddlmnưyy
mu dùng I Exp. Dllu: ddlmmlw
Lô SX /Lot NO“
Hòp1õngtièmỏmi
cnnpmlnn:
Eun 5 ml cnmdnt
Empomc… von nụ
Ele q : . . . ; ml
umluuu. cụ….mauuu. Dnnnc
mu tnmm ln…mnuum s— puug. Inun
mmụn m- …… au"c nm… 1… m
De … lrun
spulmmm Mlmllnuru':
no um :xcuu nncuuunuuu amcl.
xu: mn or 'I'NI uuen u cuanuu.
nem YNE uc na mun cuuuuv luon: us:.
fnunp nm mun IlcpMuml s.a
mua. vno. c……n m……- uu uunnu uu.
AROENYINA
uu…m-u Jluuluuulkll uuụ huu: Lunmnun l\IA
S.A.LC
Pl›pl Êlũầ. Ciudld Aumnonu uc Huunel NIlI. AIUENTINA J
:
lỉ l’rcscriplionnnly
V P-gen ®
Etoposide 100 mg
Solution for ìnfusuon
Slow ìnfusion
BOXịl drnpoulp `› ml
_..—
rg › vu: … Wlmơnnưq
Il VP-gen '
I: Elcpossdo 100 mg
Dung dich pha truyén ìĩnh mach
Sulution for infussơn
Ống m… 5 ưl lAmpm-n 5 m
mmgn u Mi…r.
SDK .
……i`
Phaman Ruy-
As a ỄU'
LAan RÂTO 7”
bsb
Rx- Thuốc kê đơn Hướng dẫn sử dụng thuốc
VP GEN
Etoposide 100mg/5m1
Dung dịch pha truyền tĩnh mạch
CẢNH BÁO:
Nên dùng VP-GEN cẩn thận dưới sự theo dõi cũa bác sỹ có kinh nghiệm dùng hoá trị liệu
ung thư. Suy tuỳ nặng kéo theo nhiễm trùng hay xuất huyết có thể xãy ra.
THÀNH PHẦN:
Mỗi ống 5 ml chứa:
Etoposide ............ 100mg
Tá dược: Acid citric, benzyl alcohol, polysorbate 80, polyethyleneglycol 300, cồn tuyệt
đối.
DẠNG TRÌNH BÀY:
Thuốc t.iêm VP-GEN được đóng trong ống thuốc tiêm 5ml chứa 100 mg. Dung dịch trong
suốt gần như không mãn đến mău vâng, có pH từ 3-4
TÍNH CHẤT: ẶỔỹ
Mã ATC: LOICBOI
Etoposide, có tên gọi thông thường lã VP - lô, lã một dẫn xuất bán tổng hợp của
podophyllotoxin, được dùng chủ yểu trong điều trị các bệnh về khối u. Tên khoa học lã 4—
demethylepipodophyllotoxin 9-[4,6-0-(R)-ethylidene—(beta)-D—gluco pyranoside].
Etoposide tan tốt trong methanol vả chloroform, ỉt tan trong ethanol, khó tan trong nước vã
ether. Dung môi hữu cơ lăm tăng độ hoà tan cũa etoposide trong nước. Trọng lượng phân
tử 558.58 Vả công thức phân tử ngHazO];
VP-GEN được dùng đường tiêm tĩnh mạch.
DƯỢC LÝ LÂM SÀNG:
Dược lực học
Etoposide có tác dụng ngăn chặn giai đoạn phân bâo ở nguyên băo sợi của gă. Tuy nhiên,
tác dụng chính cũa thuốc trên động vật có vũ là ngăn chặn chu kỳ tế băo ở giai đoạn G2.
Hai đáp ứng khác nhau phụ thuộc vảo liều đã được quan sát thấy. Ở nồng độ cao (10 pg/ml
hoặc lớn hơn), quan sát thấy có sự phân giâi tể băo ở giai đoạn gián phân, trong khi ở nồng
độ thấp (0,3 - 10 Ụg /ml), thuốc có tác dụng ngăn cãn các tếbảo đi văo giai đoạn tiền gián
phân. Thuốc không tác động tới tập hợp sợi thoi. Tác dụng chĩnh cũa etoposỉde lã lăm gãy
chuỗi AND sau khi tương tác với DNA topoisomerase hoặc hình thânh các gốc tự do.
Dược động học " *
FERNANDO CINI
Ph rmacìst Re~uiaicry Affairs_ Manager
3 Asia. Ểurope & Afnca .; ~.
LABORATORtOS BAGO S.A.
Khi tiêm tĩnh mạch, sự phân bố của etoposide được mô tả rõ nhất theo một tiến trình gồm
hai pha với nửa đời phân bố khoâng 1, 5 giờ vã nữa đời thâi trừ trong khoảng 4-1 lh. Tổng
giá trị thanh thãi của cơ thể trong khoảng từ 33-48 ml/ phút hoặc 16 -36 mllphút/mẫ tương
tự như nữa đời thãi trừ, các giá trị nảy không phụ thuộc vão liều lượng và trong khoãng 100
- 600 mglm². Quá liều năy, diện tỉch dưới đường cong vã nồng độ thuốc cực đại trong máu
gia tăng một cách tuyến tính với liều dùng. Etoposide không tích lũy trong huyết tương khi
dùng hâng ngăy với liều 100 mg /m2 trong 4 - 5 ngăy.
Thể tích phân bố ở trạng thái ổn định giãm trong khoâng 18 - 29 lít hoặc 7 - 17 lít /m².
Etoposide đi văo dịch não tuỹ rất ít. Mặc dù, thuốc được tìm thấy trong dịch não tuỳ vã
trong các khối u trong não, nhưng nồng độ cũa thuốc thấp hơn ở trong các khối u ngoâi não
vả máu. Nồng độ etoposide trong phổi bình thường cao hơn so với phổi di căn và trường
hợp nãy cũng tương tự như trong các khối u tiên phát và mô bình thường của tử cung. Trên
invitro, etoposìdc gắn kết mạnh với protein huyết tương (97%). Đã quan sát thấy có mối
liên hệ ngược giữa nồng độ albumin trong huyết tương vả thanh thải etoposide qua thận ở
trẻ em. Trong nghiên cứu xác định ânh hưởng cũa các thuốc điều trị khác trên invitro có
gẩn carbon 14 đánh dấu etoposide trong protein hnyết thanh người, chỉ thấy
phenyibutazone, sodium salicylate vả aspirin lả đẩy et0poside ra khỏi liên kết với prote/in.
ở nồng độ đạt được trên invivo. /Íỳ
Tỷ lệ gấn kết của Etoposide tương quan trực tiếp với nồng độ albumin trong huyết thanh ở
bệnh nhân ung thư và ở người tình nguyện liên quan chặt chẽ với nồng độ bilirubin ở các
bệnh nhân ung thư. Nhiều dữ liệu đã chỉ ra rằng có mối tương quan ngược giữa nồng độ
albumin trong huyết thanh vã tỷ lệ thuốc ở dạng tự do.
Sau khi tiêm tĩnh mạch 3 giờ etoposide với liều 70 - 290 mg/ m², mức độ tìm thấy chất
phóng xạ trung bình trong nước tiểu khoãng 42 - 67% và trong phân khoãng 0-16% liều
dùng. Dưới 50% liều tiêm tĩnh mạch được đâo thãi qua nước tiểu dưới dạng etoposide với
mức độ khoảng 8 - 35% trong 24 giờ.
Ở trẻ cm khoâng 55% liều dùng được đâo thãi qua nước tiểu dưới dạng et0poside trong
24h. Thanh thải thận trung bình của etoposide khoãng 7 - 10 ml] phútlm2 hoặc khoảng
35% thanh thăi toăn phần theo một liều trong khoãng 80- 600 mglm².
Etoposide bâi xuất qua nước tiểu và phân dưới dạng nguyên vẹn và các chất chuyển hóa.
Khoảng 45% lượng thuốc được băi xuất qua nước tiểu trong 72 giờ, trong đó 2/3 ở dạng
không biến đổi; 16% được bâi tiết theo phân vã khoăng 6% hoặc ít hơn được băi tiết qua
mật. Chất chuyển hoá chĩnh trong nước tiểu của người lớn vã trẻ em là hydroxy acid [4oxy
- demethylepipodophyllic acid-9-( 4, 6—0- ( R )- e t h y ] i d e n e - ( b 6 t a ) - D -
glucopyranoside)] , được hình thănh bằng cách mở vòng lacton. Nó cũng hiện diện trong
huyết tương, có thể ở dạng đồng phân trans. Dạng liên hợp glucuronide hoặc sulfate cũa
etoposide cũng được đâo thâi qua nước tiểu và chiếm khoảng 5-22% liều dùng. Ngoài ra,
FERNANDO CìNi
Pharmacist. Regutaảo’y AHaưsẬ Manager
Asua_ Europe & Atnca
LABORATORIOS BAGO S.A.
còn có sự demetyl hoá vòng dimethoxyphenol thông qua isoenzyme CYP450 3A4 để tạo
thânh dạng catechol tương ứng.
Sau khi truyền tĩnh mạch hoặc uống thuốc các giá trị Cmax và diện tích dưới đường cong
(AUC) có sự khác biệt đáng kể trong từng bệnh nhân vã giữa các bệnh nhân. Điều năy cho
thấy có sự khác nhau trong việc đánh giá sinh khả dụng tuyệt đối cũa etoposide viên nang
dùng theo đường uống.
Ở người lớn, thanh thải toăn phần của etoposide có tương quan với thanh thải creatinin
nồng độ albumin huyết thanh và thanh thải ngoâi thận. Thanh thãi toản phần của
etoposide giâm ở bệnh nhân suy thận, do đó diện tích dưới đường cong (AUC) tăng và thể
tích phân bố ở trạng thãi ổn định giãm. Sự sữ dụng cisplatin có thể dẫn đển giâm thanh thâi
toăn phần cũa etoposid. Ở trẻ em, nồng độ SGPT trong huyết thanh cao đi kèm với sự
giãm thanh thải toãn phần cũa thuốc. Sự sữ dụng cisplatin trước đó có thể cũng đưa đến sự
giảm thanh thải toãn phần của etoposide ở trẻ em.
Mặc dù có một số sự khác biệt nhỏ về cãc thông số dược động học giữa các độ tuổi và giới
tính đã được quan sát thấy, nhưng không gây ra sự khác biệt đáng kể nâo trên lãm sâng. ẮẸ
CHỈ ĐỊNH:
VP-GEN được chỉ định trong kiểm soát các bệnh sau:
Khối 11 tinh hoãn khó trị:
VP—GEN được dùng phối hợp với các tác nhân hoá trị liệu được công nhận khác trên bệnh
nhân bị khối u tinh hoãn khó chữa, đã được điều trị bẵng các liệu pháp phẫu thuật, hoá trị
liệu và xạ trị thích hợp.
Khối u phổi không tăng sản tế băo nhỏ:
VP-GEN dùng trong liệu pháp phối hợp với các tác nhân hoá trị liệu được công nhận khác
trên bệnh nhân bị khối u phổi không tăng sản tế băo nhỏ.
LIỀU LƯỢNG VÀ CÁCH DÙNG:
VP - GEN được dùng đường truyền tĩnh mạch chậm.
Không được tiêm tĩnh mạch nhanh!
Liều lượng:
- Điều trị ung thư tinh hoãn: Liều thông thường cũa VP—GEN dùng phối hợp với các thuốc
hóa trị liệu đã được công nhận khác lả khoãng 50 - 100mg/mzlngây dùng từ ngăy 1 đển
ngây thứ 5 hoặc 100 mglm²l ngăy văo các ngăy thứ 1, 3 vã 5.
- Điều trị ung thư phổi không tăng sân tế bảo nhỏ: VP-GEN được dùng phối hợp với các
hóa trị liệu đã được công nhận khác. liều dùng từ 35 mglm²lngăy trong 4 ngăy liền cho đến
50 mglm²lngăy, trong 5 ngãy liền.
Đợt điều trị sau khoãng 3 - 4 tuần sau khi cơ thể đã hồi phục đầy đủ do độc tỉnh của thuốc.
FERNANDO ClNi
Pharmacẽst. Regụia:ory Aftaưs Manager
Asia. Europe & Ain'ca
LABORATORIOS BAGÓ S.A.
- Trường hợp suy thận: Liều khới đầu cần được hiệu chinh theo độ thanh thãi creatinin
Độ thanh thãi creatinin > SOmll phút lS-50ml/ phút
Etoposide 100% liều 75% liều
Cách dùng:
Thuốc tiêm VP-GEN cần được pha loãng trước khi sử dụng với dung dịch Glucose 5%
hoặc dung dịch Natri clorid tiêm 0,9% để được dung dịch có nồng độ cuối cùng lả 0,2 -
0,4mg/ml. Nếu dung dịch có nồng độ lớn hơn 0,4 mg/ml có thể xuất hiện kết tủa.
Hạ huyết áp do truyền nhanh đã được báo cáo. Vì vậy khuyến cáo truyền tĩnh mạch với
tốc độ 30 - 60 phút một lần truyền. Có thể truyền trong thời gian lâu hơn, nếu có lo lấng về
lượng dịch được truyền. Không được tĩnh mạch nhanh VP-GEN.
Cần kiểm tra bằng cãm quan về độ trong vả mău sắc dung dịch trước khi sử dụng.
Các dụng cụ bầng chất dẻo được chế tạo từ acrylic họăc ABS (một polymer cũa
acrylonitrile, butadien vã styrene) đã được báo cáo rạn nứt hoặc rò gì khi dùng với thuốc
tiêm Etoposide không pha loãng.
Hướng dẫn đề phòng:
Cũng như các chất có khả năng gây độc khác, phải thận trọng khi tiếp xúc vả thao tác với (
dung dịch VP-GEN. Phân ứng dị ứng da do tiếp xúc với VP-GEN có thể xảy ra. Khuyến
cáo dùng găng tay khi tiếp xúc với VP-GEN. Nếu dung dịch VP-GEN tiểp xúc với da hoặc
niêm mạc, cần rửa da ngay lập tức bằng xã phòng và xả nước, rửa niêm mạc bầng nước.
CHỐNG CHỈ ĐỊNH:
Chống chỉ định cho những người có tiền sử mẫn cảm với VP—GEN hoặc bất cứ thảnh phần
nâo của thuốc.
Không được dùng etoposide trong trường hợp suy tủy xương nhẩt là sau khi điều trị bầng
tia xạ hay hóa trị liệu, trong trường hợp suy thận.
Không được tiêm etoposide vâo các khoang hốc vì thường gây tử vong.
THẬN TRỌNG:
Chú ý chung
Tất cả các trường hợp sử dụng etoposide đều được coi lã hóa trị liệu. Các thầy thuốc phãi
đánh giá sự cần thiểt và lợi ích cũa việc dùng thuốc so với nguy cơ xãy ra các tác dụng
không mong muốn cũa thuốc.
Hầu hết các tác dụng phụ đều có thể phục hồi nếu được phát hiện sớm. Nếu xảy ra phân
ứng trầm trọng, nên giãm liều hoặc ngưng thuốc và thực hiện các biện pháp điều trị tuỳ
theo đánh giá cũa bác sỹ. Khi dùng etoposide trở lại nên cẩn thận và xem xét cân nhắc
giữa nhu cầu dùng thuốc và nguy cơ có thể tái xuất hiện độc tính.
Độc tính cũa etoposide có thể tăng ở những những bệnh nhân có nồng độ albumin trong
huyết thanh thấp.
Suy tủy
FERNANDO CIN!
Pharmacist. Reguìa'srỵ Affairs Manager
Asia. Europe & Africa
LABORATORIOS BAGO S.A.
Ji²
PHỤ NỮ có THAI VÀ ĐANG CHO CON BÚ
Phụ nữ có thai
Etoposide có thể gây hại tới thai nhi khi dùng cho phụ nữ mang thai. Etoposid đã cho thấy
có gây quái thai trên chuột cống vã chuột nhẩt. Trên chuột cổng, tiêm tĩnh mạch với liều
0,4 mglkglngây (bầng khoảng 1120 liều dùng trên người tĩnh theo mg |m²) trong thời kỳ tạo
cơ quan, đã gây ra các độc tính trên chuột mẹ, độc tính trên phôI vả sinh quãi thai (bất
thường khung xương, quái thai lòi não, thoát vị não và tật không có nhãn cầu). Với liều cao
hơn 1, 2 và 3,6 mglkglngảy (băng khoãng 1/7 và 1/2 liều dùng trên người tính theo mg
lm2) dẫn đến 90 - 100% sự tiêu phôi. Ở chuột nhắt, được cho tiêm phũc mạc một liều đơn
1,0 mg/kg (bằng khoãng 1/ 16 liều dùng trên người tính theo mg lm²), cho thấy rõ răng độc
tính trên phôi, các bất thường về hộp sọ vả dị dạng khung xương nặng. Tiêm phúc mạc với
liều 1,5 mglkg (bằng khoảng 1/ 10 liều dùng trên người tĩnh theo mg /m2 ) văo ngây thứ 7
của thai kỳ lăm gia tăng tỷ lệ chết trong tử cung, dị dạng thai và lâm giãm đáng kể trọng
lượng thai nhi trung bình.
Phụ nữ trong độ tuổi sinh đẻ nên tránh mang thai trong thời gian điều trị. Nếu dùng thuốc
trong khi mang thai hoặc nểu bệnh nhân mang thai trong khi đang dùng thuốc. Bệnh nhâm.
nên được cãnh bão về những nguy cơ có thể xãy ra đối với thai nhi. '/JỒ
Etoposide cũng được xem như tác nhân có thể gây ung thư ở người. Bệnh bạch cầu cấp có
hay không có tiền bệnh bạch cầu đã được báo cáo ở một số hiếm bệnh nhân đựơc điều trị
bằng etoposide đơn độc hoặc phối hợp với các tác nhân kháng ung thư khác. Nguy cơ tiến
triển của hội chứng bạch cầu hoặc tiền bạch cầu lả không rõ râng. Các xét nghiệm về tính
gây ung thư với etoposide vẫn chưa được tiến hănh trên các động vật thí nghiệm.
Phụ nữ cho con bú
Chưa biết được ở người, thuốc có được bâi tiểt vảo sữa mẹ hay không. Do rất nhiều thuốc
được bâi tiết vâo sữa mẹ vả do nguy cơ xăy ra các tác dụng phụ trầm trọng từ etoposide
cho trẻ còn bú, nên cân nhắc quyết định nên ngưng cho con bú hay ngưng thuốc có xem
xét tầm quan trọng của thuốc đối với người mẹ.
NGƯỜI LÁI XE VÀ VẬN HÀNH MÁY MÓC
Etoposide có thể gây buồn nôn vã nôn. Thận trọng khi dùng thuốc cho người lái xe vã vận
hânh máy móc
TƯỢNG TÁC THUỐC:
Dùng cyclosporine liều cao dẫn đến nồng độ thuốc trong máu cao hơn 2000 ụg Im]. cùng
với etoposide đường uống dẫn đến tăng nồng độ etoposide 80% và giăm thanh thăi toăn
phần cũa etoposide 38% so với khi dùng etoposide đơn độc.
FERNANDO Cl l
Bệnh nhân được điều trị với VP-GEN cần được theo dõi chặt chẽ và thường xuyên về dấu
hiệu suy tuý cả trong vã sau quá trình điều trị.
Suy tuý dẫn đển tử vong đã được báo cáo. Suy tuỳ có lỉên quan đển liều dùng là độc tính
đáng kể nhất khi điều trị bằng etoposide. Do đó, phải thực hiện một số xét nghiệm trước
khi trị liệu và trước mỗi liều VP-GEN kể tiếp: đếm tiểu cầu, hemoglobin, bạch cầu vã các
thânh phần khác. Khi số tiểu cầu dưới 50.000/mm3 hay số bạch c`âu ttung tính tuyệt đối
dưới 500] mm3 phãi ngưng sử dụng thuốc cho tới khi các tếbăo máu được phục hồi đầy đủ.
Bác sỹ nên biết rõ tai biến có thể xảy ra của phản ứng phản vệ biểu hiện qua các triệu
chứng như: lạnh run, sốt, tim đập nhanh, khó thở, tụt huyết ãp. Tần số gặp sốc phân vệ xãy
ra thường xuyên hơn ở những trẻ em được truyền thuốc ở nồng độ cao hơn nồng độ khuyến
cáo . Nồng độ thuốc (hoặc tốc độ truyền thuốc) đóng vai trò lăm tăng nguy cơ sốc phãn vệ
vẫn chưa được xác định chắc chẩn
Xử lý bằng cách điều trị triệu chứng. Nên ngưng truyền thuốc ngay lập tức, vả sau đó dùng
cãc tác nhân lăm tăng huyết áp, corticosteroid, kháng histamin, hoặc tãng thể tích lưu
thông, tuỳ theo ý kiến cũa bác sỹ.
Đối với dung dịch gốc etoposide cần được truyền tĩnh mạch chậm (thời gian 1 lần truyền &
thường là 30- 60 phút), vì tụt huyết áp đã dược báo cáo như là một tác dụng phụ có thểf/
xảy ra khi truyền tĩnh mạch nhanh.
Các xét nghiệm
Nên thực hiện kiểm tra định kỳ huyết đồ trong quá trình sử dụng VP-GEN. Nên lăm xét
nghiệm năy trước khi điều trị vả trong những thời điểm thích hợp trong khi điều trị. Nên
thực hiện ĩt nhất một lần trước mỗi liều VP-GEN.
Bệnh nhân suy thận: Phâi điều chỉnh liều.
Khả nãng gây ung thư, gây đột biến, suy giảm khả năng sinh sản
Etoposide đã cho thẩy khả năng có thể gây đột biển trong phép định lượng Ames.
Tiêm phúc mạc etoposide với liều 1,5 mglkg cho chuột nhắt Swiss - Albino văo ngăy thứ 7
cũa thai kỳ lâm gia tăng tỷ lệ chết trong tử cung, dị dạng thai và lăm giảm đáng kể trọng
lượng trung bình cũa thai nhi. Sự tăng cân ở chuột mẹ không bị ânh hưởng.
Teo tinh hoãn không phục hồi đã xãy ra ở chuột cống đực khi điều trị bằng etoposide
đường tiêm tĩnh mạch trong 30 ngăy với liều 0,5 mglkg/ngây (khoãng 1l16 liều dùng trên
người tính theo mg lm²).
Sử dụng thuốc trong nhi khoa
Độ an toản vã hiệu quả cũa thuốc đối với trẻ em vẫn chưa được đưa ra.
Etoposide có chứa polysorbat 80, ở trẻ sơ sinh, các hội chứng đe doạ đển tính mạng như
suy giảm chức năng gan, thận, bệnh phổi, chứng giăm tiểu cầu, cổ chướng đã được bão cáo
có liên quan đến việc sử dụng vitamin E tiêm chứa polysorbate 80.
Phân ứng phân vệ cũng đã được báo cáo ở trẻ em.
FERNANDO
Pharma: ist Regula: ory aưs Manager
Asia Europe Á A ca
LABORATOPIOS’ 8 o 5 A
Các tác dụng gây giâm bạch cầu vâl hoặc giãm tiểu cầu cũa Etoposide có thể tăng lên khi
dùng kết hợp hoặc vừa mới điều trị những thuốc có cùng tác dụng như thuốc gây suy tủy
tia xạ trị liệu.
Khi dùng etoposide kết hợp với vaccin virus chết, đáp ứng tạo kháng thể cũa người bệnh
đối với vaccin có thể bị giảm. Vì vậy nên tính toán dùng luân phiên các thuốc năy từ 3
tháng đến 1 năm.
Khi dùng kết hợp với vaccin virus sống, có thể gây tăng sự sao chép của virus vaccin,lăm
tăng tác dụng phụ cũa vaccin vâ/ hoặc lâm giảm đáp ứng kháng thể cũa người bệnh với
vaccin. Vì vậy phãi dũng các thuốc nây cách xa nhau từ 3 tháng đến 1 năm.
TÁC DỤNG KHÔNG MONG MUỐN:
Các dữ liệu về phân ứng có hại sau được báo cáo với etoposide khi dùng đường uống và
đường tiêm, dùng một liều hoặc nhiều liều khác nhau trong điều trị khối u ác tính.
Huyết học
Suy tuỷ thường phụ thuộc với liều lượng nhiều nhất, với giãm bạch cầu hạt, xuất hiện văo
ngảy thứ 7 đến 14 và giăm tiểu cầu văo ngây thứ 9 dển 16 sau khi dùng thuốc. Sự phục hồi
tuý xương thường hoân tất sau ngăy thứ 20 vã không có sự tích tụ độc tính được báo cáo.
Sốt vã nhiễm trùng cũng được báo cáo ở những bệnh nhân giãm bạch cầu trung tính. Tt’ẩAỷ/
vong liên quan đến suy tuý đã được báo cáo.
Bệnh bạch cầu cấp có hay không có tiền bệnh bạch cầu đã được báo cáo ở một số hiếm
bệnh nhân đựơc điều trị bắng etoposide đơn độc hoặc phối hợp với các tác nhân kháng ung
thư khác.
Tiêu hoá
Buồn nôn vã nôn lả những độc tính nhiều nhất trên đường tiêu hoá. Thường xãy ra ở mức
độ nhẹ đến vừa, chỉ khoãng 1% bệnh nhân cần phải ngưng điều trị. Nôn vã buồn nôn có
thể kiểm soát được bằng những liệu pháp chống nôn. Viêm niêm mạc | viêm thực quản
mức độ vừa đến nặng cũng có thể xãy ra. Các độc tĩnh trên đường tiêu hoá sau khi dùng
thuốc bằng đường uống xãy ra thường xuyên hơn khi truyền tĩnh mạch.
Hạ huyết áp
Hạ huyết áp thoáng qua sau khi truyền Lĩnh mạch nhanh đã được báo cáo với 1-2% bệnh
nhân. Thuốc không gây độc với tim vã không lâm thay đổi điện tim. Để tránh sự cố hiếm
gặp năy, etoposide nên được tiêm tĩnh mạch chậm trong vòng 30 — 60 phút. Nếu bệnh nhân
bị hạ huyết áp, phãi ngừng truyền dịch vả bù dịch hoặc dùng các biện pháp điều tnị hỗ trợ
thỉch hợp khác. Khi truyền trở lại, phải truyền với tốc độ chậm.
Phân ứng dị ứng
Các phân ứng dạng phân về biểu hiện qua chứng ớn lạnh, sốt, tim đập nhanh, co thất phế
quãn, khó thở vả hạ huyết áp đã được ghi nhận xuất hiện trên 0,7 - 2% bệnh nhân truyền
tĩnh mạch bằng etoposide và dưới 1% bệnh nhân điều trị bằng viên nang et0poside đường
FERNANDO CINI
Pharmecist. Reg…atory Affairs Manager
Asia. Europe & Africa
LABORATORỉOS BAGO S.A.
uống. Những phân ứng nãy thường đáp ứng ngay sau khi ngưng truyền và sau khi dùng các
tác nhân tãng huyết áp, corticoid, kháng histamin hay tảng thể tích lưu thông nếu cần
thiết. Tuy nhiên các phản ứng có thể rất trầm trọng.
Tăng huyết áp vâ/hoặc đỏ bừng mặt cũng đã được báo cáo. Huyết áp thường được ổn định
trong một văi giờ sau khi ngừng truyền. Các phãn ứng dị ứng thường xãy ra trong giai đoạn
đầu của quá trình truyền thuốc. Sưng mặt |lưõi, ho, toát mồ hôi, tĩm tãi, viêm họng, co thất
thanh quản, đau lưng, ngất đôi khi xãy ra liên quan đến những phẩm ứng trên. Ngoài ra,
cũng hiếm gặp trường hợp mẫn cắm gây ngừng thở.
Chứng phát ban, mề đay hoặc ngứa không thường xuyên xãy ra ở liều sữ dụng. ở liều thăm
dò, ban đỏ, ngứa toăn thân, rát sần, viêm quanh mạch đã được báo cáo.
Chứng rụng tóc, rụng lông măy
Chứng rụng lông tóc có hồi phục, đôi khi tiến triển đến hói hoân toãn đã được quan sát
thấy trên khoãng 66% bệnh nhân.
Tác dụng phụ khác
Những tác dụng phụ sau được báo cáo không thường xuyên: Đau bụng, ợ chua, táo bón,
khó nuột, suy nhược, mệt mỏi, phiền muộn, ngủ gầ, rối loạn mău sấc, đau giây thần kinh
thị giác, trăn dịch măng phổi, xơ hóa phối, sốt, động kinh (đôi khi liên quan đến những
phân ứng dị ứng khác), hội chứng Steven — Johnson, xơ cứng biểu bì, nhiễm sấc tố, viêm
da bức xa,
Độc với gan, thường xảy ra ở những bệnh nhân dùng liều cao hơn liều khuyến cáo. Nhiễm
toan chuyển hóa cũng được báo cáo ở những bệnh nhân dùng liều cao hơn.
Những báo cáo về thóat mạch có sưng phù đã được đề cập trong bão cáo lưu hănh. Hiếm
khi sự thoát mạch có liên quan đến hoại tử và chai cứng tĩnh mạch.
Phải thông báo với bác sỹ các tác dụng không mong muốn gặp phăi khi sử dụng thuốc.
QUÁ LIỀU:
Không có thuốc giãi độc đặc hiệu trong trường hợp quá liều, chủ yếu là điều trị hỗ trợ vả
điều trị triệu chứng.
ĐỘ ỔN ĐỊNH:
Dạng ống tiêm chưa mở ổn định trong thời gian 24 tháng ở nhiệt độ phòng (300C). Dạng
ống tiêm đã pha loãng tới 0,2 - 0,4 mglml ổn định tương ứng trong 96 và 24 giờ ở nhiệt độ
phòng (300C), dưới ánh sáng đèn huỳnh quang, khi đựng trọng lọ thủy tinh hay lọ plastic.
BẨO QUÂN:
Bảo quãn ở nhiệt độ dưới 300C, tránh ánh sáng. Không để đông lạnh
HẠN DÙNG: 24 tháng kể từ ngăy sản xuất.
p FÌERNANDO ClNi
harmacxẹt. Regutazory Affairs Manager
LA Asza. Eurcpe & Africa
BORATOR:OS BAGÓ s A
TIÊU CHUẨN: Nhã sắn xuất.
KHÔNG SỬ DỤNG THUỐC SAU KHI ĐÃ HẾT HAN.
KHÔNG DÙNG QUÁ LIỀU CHỈ ĐỊNH.
ĐỂ XA TẦM TAY TRẺ EM.
ĐỌC KỸ HƯỚNG DẨN SỬ DỤNG TRƯỚC KHI DÙNG.
NẾU CẦN BIẾT THÊM THÔNG TIN VỀ THUỐC HÃY HỎI Ý KIỄN BÁC SỸ HOẶC
DƯỢC SỸ.
Sân xuất bới:
Đóng gói và xuất xưởng:
BIOPROFARMA S.A
Terrada 1270, Ciudad Autónoma de Buenos Aires. República Argentina
Sán xuất bán Ihãnh phầm:
LABORATORIOS IMA S.A.I.C.
Palpa 2862, Ciudad Autónoma de Buenos Aires. Repủblica Argentina.
TUQ. cth TRUỞNG
P.TRUỜNG PHÒNG
Jlỷayễn Jắfy Jẳìw
Pharmacist. Reguìatcry Aftairs_Man gẽt “
Asia. Europe & Afnca `*Ễẵ“
LABQRATORIOS BAGO S.Ạ.f —
FERNANDO c… /ếẽ ; … __
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng