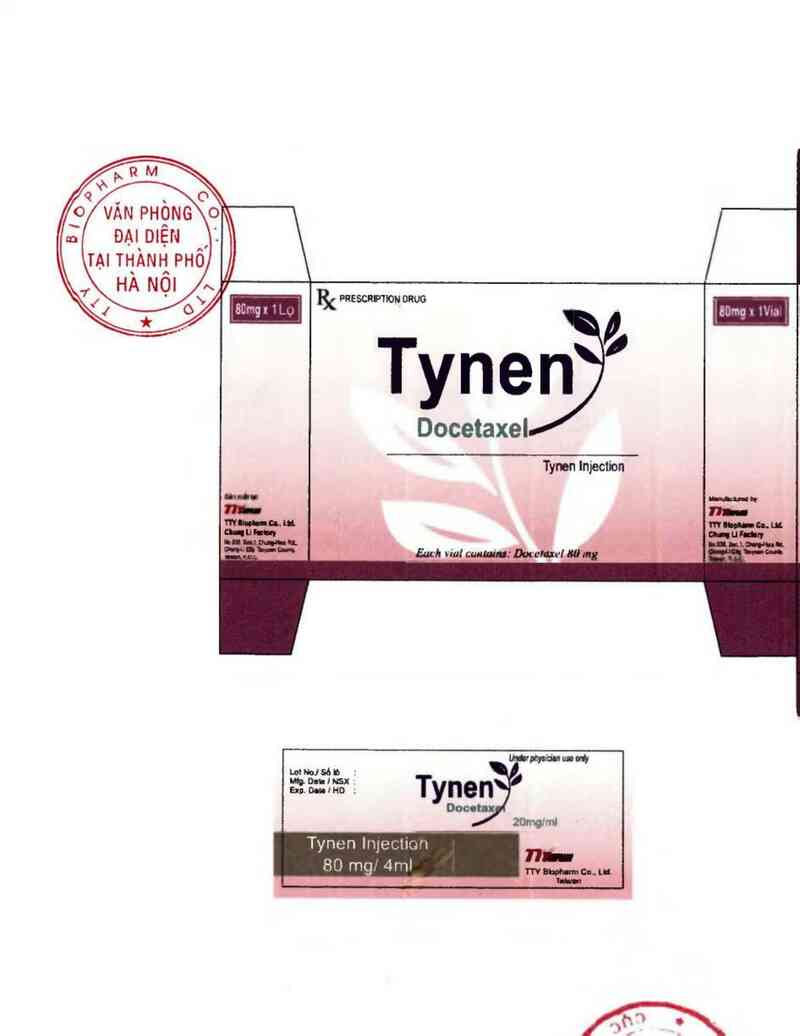


















PRESCRPTION
Docetaxel
Tynen lnjection
Tynen l1uecticm
80 mg 4r117
Tyne_pằ
Docetaxe
Gllme. … M m…:
Donhnl tnhydmu… ..….………In mg
u…mun I DOWI | A…
nchm IAWIRIE sưem:
anu nhơ In Im ouckụ lu…
61…
h… : ì - rc, … … lum
KH! an muon cnnun
GAan WD VIE man: mĩ
mu III!
mw
wmv lùúN
NA… mu ma !) :…
…
m.....…… …N %
eul 01… | um nuu I cAcu ưmu
We l fAc nuuu mụ:
lh … & mm. … nm …
IM 1uuulnl -rc. umhùnnu
anIẦHIAVI'IIIƯIU
man…
%… .… °…
............................
z171"1……33puẹ1
n
:
HđYG
lỆ
«
ELÀÒH
ĂHGẸ
anuA1Nynòona
v
lv
ZỞhhw'
1A1Trffl)ckỹỮư ,
… f ' * ' ff=²-ÚT/qaz
KÊ ĐO'N
g dẫn sử dụng trước khi dùng
\ HNễlfflhẩú ! êm thông tin xin hoi ý kiến thẩy thuốc.
TYNEN Thuốc tỉêm
20 mgll ml & 80 mgl4 ml
[THÀNH PHẦN]
4- Mỗi lọ (1 ml) chứa:
Docetaxel khan ......................... 20 mg
& Mỗi lọ (4 ml) chứa:
Docetaxel khan ......................... 80 mg
Tá dược: polysorbat 80, ethanol 96%, acid cilric monohydrat.
[DƯỢC LÝ]
Dươc lưc hoc
Nhỏm dược lý: Thuốc khảng ung thư
Số liêu tiến lâm sảng .
Docetaxel lả một thuốc kháng ung thư, tác động bằng cách thủc đây sự ghép cảc tubulin thảnh
vì cấu trúc hình ống ổn định và ức chế sự tảoh rời, do đó lảm giảm đảng kế lượng tubulin tự
do. Sự lỉên kết của docetaxel với vi cấu trúc hình ống không lảm thay đổi số sợi nguyên sinh.
In vitro docetaxel phá vỡ mạng lưới cấu trúc hình ống trong các tế bảo cần thiết cho chức
năng giản phân và gian kỳ.
In vitro docetaxel có độc tính tế bảo đối với nhiều loại tế bảo chuột, tế bảo khối 11 người và
khảng với tế bảo khối u người bằng kỹ thuật đơn dòng. Docetaxel đạt nông 40 cao trong tế
bảo trong thời gian dải. Thêm vảo đó, docetaxel có hoạt tinh với vâi dòng tế bảo, nhưng
không phải tất cả cảc dòng tế bảo với p- glycoprotein dược mã hóa bời các gien khảng đa
thuốc. In vivo, docetaxel có phổ khảng ung thư rộng đối với các khối u của chuột và người.
ê2hgịam_saạg
Ung thư vú
Docetaxel kết họp vởi doxorubicin vả cyclophosphamid: điều trị hỗ trợ
Số liệu từ thử nghiệm ngẫu nhiên đa trung tâm ủng hộ việc sử dụng docetaxel để hỗ trợ điều
trị bệnh nhân bị ung thư vú có hạch có thể phẫu thuật được vả KPS 2 80%, ở độ tuổi từ 18
đến 70. Sau khi phân loại theo số hạch 2dương tính (1- 3, 4+), 1491 bệnh nhân được chia nhóm
ngẫu nhiên dùng docetaxel 75 mglm2 dùng 1 giờ sau khi dùng doxorubicin2 50 mg7m2 vả
cyclophosphamid 500 mglm2 (nhóm TAC) hoặc dùn doxorubicin 50 mg7m2 sau khi dùng
fluouraci] 500 mg/m2 vả cyclophosphamid 500 mglm (nhóm FAC). Cả 2 cảoh điều trị đếu
dược dùng 1 lần môi 3 tuần x 6 đợt. Docetaxel được truyền tĩnh mạch trong 1 giờ, tất cả cảc
thuốc khác được tiêm tĩnh mạch vảo ngảy đầu. Yếu tố kích thích sinh bạch câu (0- -CSF) được
dùng để dự hòng bệnh nhân bị biến chứng thiếu bạch cầu trung tính (sốt do thiếu bạch câu,
thiểu bạch cau kéo dải, hoặc nhiễm khuẩn). Bệnh nhân nhóm TAC dùng khảng sinh dự phòng
ciprofloxacin 500 mg uống 2 lần/ngảy x 10 ngảy bắt đầu vảo ngảy thứ 5 của mỗi dợt hóa trị,
bệnh nhân dương tính với thụ thể cstrogen vả/hoặc progesteron dùng docetaer 20 mg/ngảy
trong 5 năm. Hỗ trợ xạ trị theo hướng dẫn ở mỗi bệnh viện được chỉ định cho 69% bệnh nhân
cùa nhóm TAC và 72% bệnh nhân nhóm FAC.
Thực hiện phân tích sau thời gian theo dõi trung bình là 55 tháng. Nhóm TAC có thời gỉan
sống không có bệnh dải hơn đảng kể so vởi nhóm FAC. Tỷ lệ tái phát sau 5 nảm giảm bớt ở
nhóm TAC so với nhóm FAC (25% so vởi 32% tương ứng) có nghĩa là giảm 7% nguy cơ
(p=O, 001). Tỷ lệ sống sau 5 năm cũng tãng đảng kế ở nhóm TAC so với nhóm FAC (87% so
3/1› Ế ... ')…
J—ị af/ \ \ C` "
'Ò/ v'ẢN PHONG\P
’ 07ò( D1E11
TA1
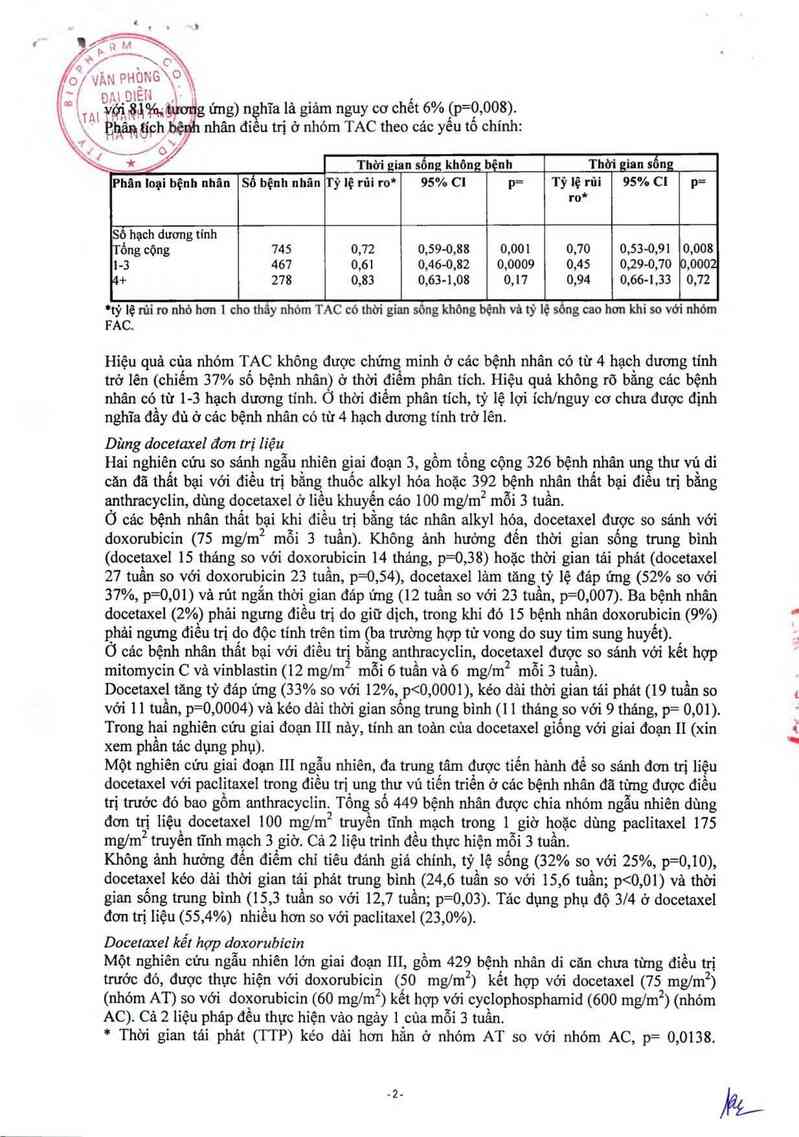
%,jgimig ửng) nghĩa là giảm nguy cơ chết 6% (p=O, 008).
Ẹhaạt h cẠbệỷh nhân đỉeu trị ở nhóm TAC theo các yếu tố chính:
Thời gian sống không bệnh Thời gian sốn
Phân *loại bệnh nhân Sổ bệnh nhân Tỷ lệ rũi ro* 95% CI p= Tỷ lệ rũi 95% C! p=
ro*
Sỉoỉhạch dương tính
Tổng cộng 745 0,72 0,59—0,88 0,001 0,70 0,53-0,91 0,008
1-3 467 0,61 0,46-0,82 0,0009 0,45 0,29-0,70 0,0002
4+ 278 0,83 0,63—1,08 0,17 0,94 0,66-1,33 0,72
°tỷ lệ nii ro nhỏ hơn 1 cho thây nhóm TAC có thời gian sông không bệnh vả tỷ lệ sỗng cao hơn khi so với nhóm
FAC.
Hiệu quả của nhóm TAC không được chứng minh ở cảc bệnh nhân có từ 4 hạch dương tính
trở lên (chiếm 37% số bệnh nhân) ở thời đìểm phân tích. Hiệu quả không rõ bằng cảc bệnh
nhân có từ 1-3 hạch dương tinh. Ở thời điếm phân tích, tỷ lệ lợi íchlnguy cơ chưa được định
nghĩa đầy đủ ở các bệnh nhân có từ 4 hạch dương tính trở lên.
Dùng docetaxel đơn lrị liệu
Hai nghiên cứu so sảnh ngẫu nhiên giai đoạn 3, gồm tổng cộng 326 bệnh nhân ung thư vú di
căn đã thất bại với điếu tn“ bằng` thuốc alkyl hóa hoặc 392 bệnh nhân thất bại điều trị bằng
anthracyclin, dùng docetaxel ở liều khuyến cảo 100 mglm2 mỗi 3 tuần.
Ở cảc bệnh nhân thất bại khi đỉếu trị bằng tác nhân alkyl hóa, docetaxel được so sảnh với
doxorubicin (75 mg/m2 mỗi 3 tuần). Không ảnh hưởng đến thời gian sông trung bình
(docetaxel 15 tháng so với doxorubicin 14 thảng, p=0, 38) hoặc thời gian tải phảt (docetaxel
27 tuần so với doxorubicin 23 tuần, p=0, 54), docetaxel lảm tăng tỷ lệ đáp ứng (52% so với
37%, p=0, 01) và rủt ngắn thời gian đảp ứng (12 tuần so với 23 tuần, p=0, 007). Ba bệnh nhân
docetaxel (2%) phải ngưng điều trị do giữ dịch, trong khi đó 15 bệnh nhân doxorubicin (9%)
phải ngưng điều trị do độc tính trên tim (ba trường hợp tử vong do suy tỉm sung huyết).
Ở cảc bệnh nhân thất bại với điều trị bằng anthracyclin, docetaxel dược so sánh với kết hợp
mitomycin C vả vinblastin (12 mg/m2 mỗi 6 tuần và 6 mglm2 mỗi 3 tuấn).
Docetaxel tăng tỷ đảp ứng (33% so với 12%, p<0, 0001), kéo dải thời gian tái phảt (19 tuần so
với 11 tuấn, p= —0 ,0004) và kéo dải thời gian sông trung bình (11 tháng so với 9 tháng, p= 0 ,01).
Trong hai nghiên cứu giai đoạn III nảy, tính an toân của docetaxel giống với giai đoạn II (xin
xem phần tảc dụng phụ).
Một nghiên cứu giai đoạn 111 ngẫu nhỉên, đa trung tâm được tỉến hảnh để so sảnh đơn trị liệu
docetaxel với paclitaxel trong điếu trị ung thư vú tiến triển ở cảc bệnh nhân đã timg được điều
trị trước đó bao gôm anthracyclin. Tổng số 449 bệnh nhân được chỉa nhóm ngẫu nhiên dùng
đơn trị lỉệu docetaxel 100 mg7m2 truyền tĩnh mạch trong 1 giờ hoặc dùng paclitaxel 175
mglm2 truyền tĩnh mạch 3 giờ. Cả 2 liệu trình đều thực hiện mỗi 3 tuần.
Không ảnh hưởng đến điểm chỉ tiêu đánh giá chinh, tỷ lệ sổng (32% so với 25%, p=O, 10),
docetaxel kéo dải thời gian tái phảt trung bình (24,6 tuần so với 15 ,6 tuần; p 20% (13,1% so với 6,1%) giảm LVEF > 30% (6,2% so với 1 1,°/.o) Chết do
độc tính của thuốc xảy ra ở 1 bệnh nhân nhóm AT (suy tim sung huyết) và 4 bệnh nhân nhóm
AC (1 do sốc nhiễm khuẩn và 3 do suy tim Sung huyết).
Ở cả 2 nhớm, chắt lượng cuộc sông được đánh giá bằng bảng câu hòi EORTC, là tương
đương nhau và ốn định trong thời gian điếu trị và theo dõi.
Docetaxel kết họp trastuzumab
Docetaxel kết hợp trastuzumab được nghiên cửu trong điều trị bệnh nhân bị ung thư vú di căn
cảc khối u đã tạo HER quá mức, và chưa từng dùng hóa trị cho bệnh di căn. Một trăm tám
mươi sản bệnh nhân được chia nhóm ngẫu nhiên dùng docetaxel (100 mg/rn2 ) có7không dùng
trastuzumab; 60% bệnh nhân đã có hóa trị hỗ trợ trước đó với anthracyclin. Docetaxel vả
trastuzumab có hiệu quả ở cảc bệnh nhân cólkhông dùng anthracyclin trước đó Phương phảp
chủ yếu để xảo định dương tính HER2 trong thử nghiệm nảy là hóa miễn dịch tế bảo (IHC).
Một sô ít bệnh nhân được xét nghiệm theo phương phảp FISH. Trong nghiến cứu nảy, 87%
bệnh nhân có bệnh với IHC 3+, và 95% bệnh nhân có bệnh với IHC 3+ vả/hoặc FISH dương
tính. Kết quả được tóm tắt 6 bảng sau:
Thông số Docetaxel + trastuzumab' Docetaxell
n=92 n=94
Tỷ lệ đáp ứng 61% 34%
(95% CI) (50-71) (25-45)
Thời gian đáp ứng trung binh 1 1,4 5,1
(thảng) (95% CI) ( 9,2-15,0) (4,4-6,2)
I`hời gian tải phảt trung bình (thảng) 10,6 5,7
95% CI) (7,6-12,9) (5,0—6,5)
Thời gian sống trung binh (tháng) 30,52 22,12
(95% CI) (26,8-ne) (17,6-28,9)
”có nghĩa lả chưa được đánh gỉá, hoặc chưa đạt đến mức.
' Đẵnh giá đầy đủ
2 Uớc 1ượng thời gian sống trung bình
Docetaxel kết hợp capecitabin
Số liệu từ một thử nghiệm lâm sảng giai đoạn 111 có kỉếm soát ngẫu nhiên đa trung tâm ủng
hộ việc sử dụng docetaxel kết hợp với capecitabin trong địếu trị bệnh nhân ung thư vú di cãn
hay tiến triến sau khi thất bại với hóa trị dộc tế bảo, bao gổm anthracyclỉn. Trong thử 2nghiệm
nảy, 255 bệnh nhân được chia nhóm ngẫu nhiên để điều trị bằng docetaxel (75 mg7m2 truyền
tĩnh mạch một giờ mỗi 3 tuần) và capecitabin (1250 mg/m2 2 lầnfngảy, dùng trong 2 tuần,
nghĩ 1 tuần). 256 bệnh nhân được chia nhóm ngẫu nhiên đơn trị liệu với docetaxel (100
mgm2 truyền tĩnh mạch 1 gíờ mỗi 3 tuấn). Tỷ lệ sông cao hơn ở nhóm kểt hợp docetaxel +
capecitabin (p=0, 0126). Thời gian sống trung bình Iặ 442 ngảy (docetaxel + capecitabin) so
với 352 ngảy (đơn trị liệu docetaxel). Tỷ lệ sông ở tất cả các nhóm bệnh nhân ngâu nhiên là
41,6% (docetaxel + capecitabin) so với 29,7% (đon trị liệu docetaxel); p= 0 ,0058. Thời gian
tải phảt dải hơn ở nhóm kết hợp docetaxel + capecitabin (p<0, 0001). Thời gian tải phảt tnmg
binh là 186 ngảy (docetaxel + capecitabin) so vởi 128 ngảy (chi dùng docetaxel).
vỉxm PHÒNG \ \x
, …í Đf~ìưẸỂthgmuồi không có tế bảo nhỏ (NSCLC)
\ \fmĩHữồầ Pi _ ,)
` HIỀÊ'ỂỞ ”ha
, đã được hóa trị trước đó có/khõng xạ trị
_!fflngc,Ệ
nghiên cứu giai đoạn III ở bệnh nhân đã được điều trị tmớc, thời gian tải phảt
_ _ so vởi 7 tuần) và tỷ lệ sống dải hơn đáng kể với docetaxel 75 mglm2 so với chế độ
sẳn sóc hỗ trợ tốt nhất. Tỷ lệ sống 1 năm cũng cao hơn nhiều ơ nhóm docetaxel (40%) so với
nhóm theo chế độ săn sóc hỗ trợ tốt nhất (16%)
Ít phải dùng thuốc giảm đau có morphin (p60 được chỉa nhóm ngẫu
nhỉên:
- Docetaxel 75 mg/m2 mỗi 3 tuần, dùng 10 đọ1.
/ " '
/ 0 , vỉ… PHÒNG ©`
QĨÍ LA'ẺẺổẺ ẵ1 10 mg/m2 dzùng mỗi tuần trong 5 tuần đầu cho một đợt 6 tuần, dùng 5 đợt.
`, `TA'ĨỈỂMỈẮỂ 011112mg/m²mỗi3tuần,dùngfflđợt
` _iỂảủ'tr đều kết hợp với prednison hoặc prednisợlon 5 mg 2 lần mỗi ngảy, dùng liên tục.
' nhân dùng docetaxel mỗi 3 tuần có thời gian sống dải hơn nhiều so với cảc bệnh
điếu trị bằng mitoxantron. Thời gian sống ở nhóm dùng docetaxel mỗi tuần không khác
so với nhóm dùng mitoxantron. Đảnh giá hiệu quả của nhóm docetaxel so với nhóm kiếm soát
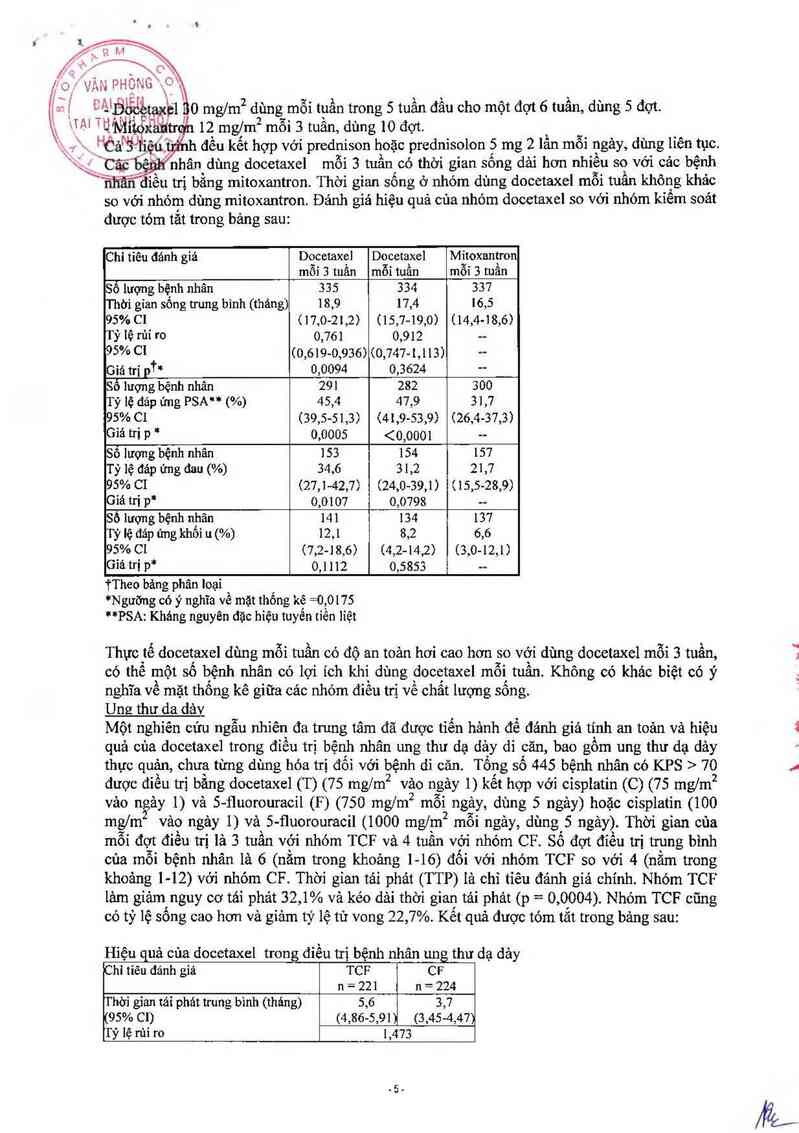
được tỏm tắt trong bảng sau:
Chi tiêu dánh giả Docetaxel Docetaxel Mỉtoxantron
mỗi 3 tuẳn mỗi tuần mỗi 3 mần
Số lượng bệnh nhân 335 334 337
Thời gỉan sống trung binh (tháng) 18,9 17,4 l6,5
95%c1 (17,0-21,2) (15,7…19,0) (14,4~18,6)
Tỷ lệ rùi ro 0,761 0,912 --
95% Cl (0,619-0,936) (0,747-1,113) -—
Giá trị pi* 0,0094 0,3624 -—
sỏ lượng bệnh nhân 291 282 300
Tỷ lệ đảp ứng PSA… (%) 45,4 47,9 31,7
95% CI (39,5-51,3) (41,9-53,9) (26,4-37,3)
Giá trị p * 0,0005 <0,0001 --
Số lượng hệnh nhân 153 154 157
Tỷ lệ đáp ứng đau (%) 34,6 31,2 21,7
95% c1 (27,1-42,7) (24,0-39,1) (15,5-28,9)
Giá tri 1J* 0,0107 0,0798 …
Số lượng bệnh nhân 141 134 137
Tỷ lệ đảp ứng khối u (%) 12,1 8,2 6,6
95% ct (7,2-18,6) (4,2-142) (3,0-12,1)
Giá trị P" 0,1112 0,5853 ……
TTheo bảng phân loại
*Ngưỡng có’ y nghĩa về mặt thống kê =0, 0175
*'*PSAz Kháng nguyên đặc hiệu tuyển tỉền liệt
Thực tế docetaxel dùng mỗi tuần có độ an toản hơi cao hơn so với dùng docetaxel mỗi 3 tuần,
có thể một số bệnh nhân có lợi ích khi dùng docetaxel mỗi tuần. Không có khác bỉệt có ý
nghĩa về mặt thống kê giữa các nhóm điếu trị về chẳt lượng sống.
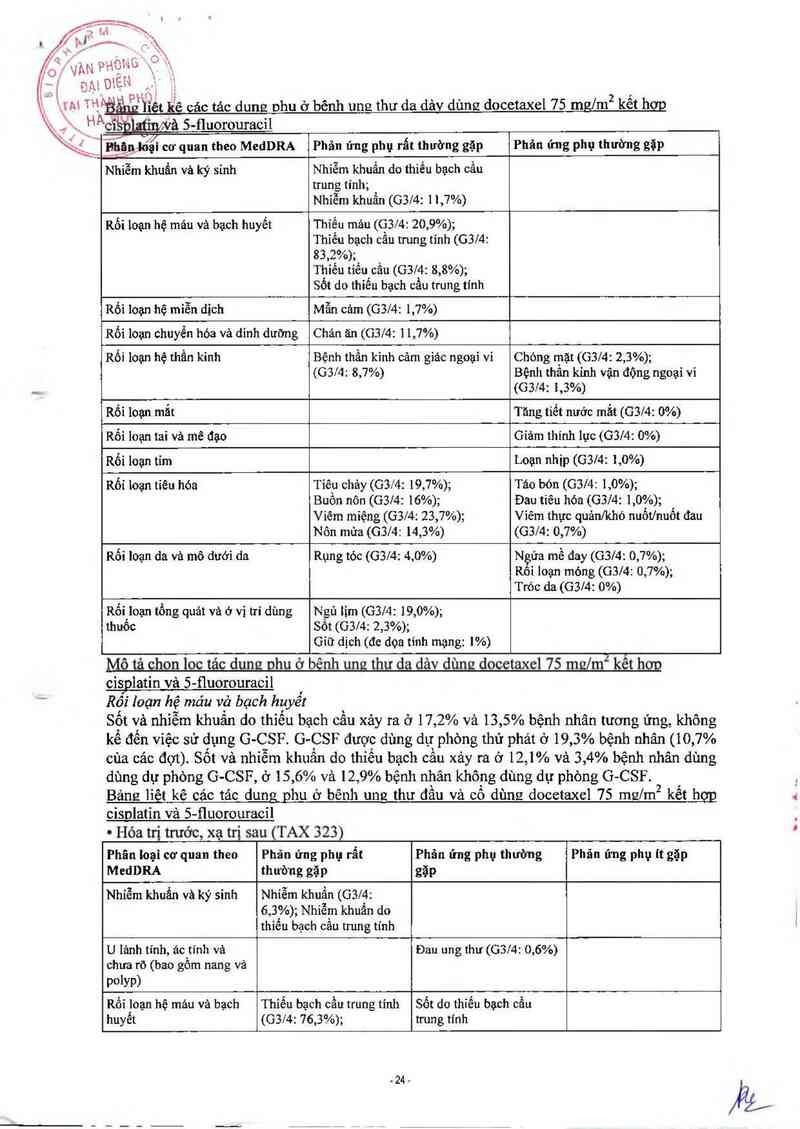
Ung thư da dảv
Một nghiên cứu ngẫu nhiên đa trưng tâm đã được tiển hảnh để đảnh giá tinh an toản và hiệu
quả cùa docetaxel trong điếu trị bệnh nhân ung thư dạ dảy di căn, bao gồm ung thư dạ dảy
thực quản, chưa từng dùng hóa trị đối với bệnh di căn. Tổng số 445 bệnh nhân có KPS > 70
được điếu trị bằng docetaxel (T) (75 mg/m2 vảo ngảy 1) kểt hợp với cisplatin (C) (75 mg/m2
vảo ngảy 1) và 5- fluorouracil (F) (750 mg/m2 mỗi2 ngảy, dùng 5 ngảy) hoặc cisplatin (100
mg/mz vảo ngảy I) và 5- fluorouracil (1000 mg/m2 môi ngảy, dùng 5 ngảy) Thời gian của
môi đợt đỉều trị là 3 tuần với nhóm TCF và 4 tuần vởi nhóm CF Số đợt điểu trị trung bình
của mỗi bệnh nhân là 6 (nằm trong khoảng 1-16) đối vởi nhóm TCF so với 4 (nằm trong
khoảng 1- -12) với nhóm CF. Thời gỉan tải phảt (TTP) là chỉ tiêu đảnh giả chính Nhóm TCF
lảm giảm, nguy cơ tải phát 32, 1% và kéo dải thời gian tái phát (p= 0 ,0004). Nhóm TCF cũng
có tỷ lệ sông cao hơn và giảm tỷ lệ tử vong 22,7%. Kết quả đuợc tóm tắt trong bảng sau:
Hiệu quả của docetaxel trong điểu trị bệnh nhân ung thư dạ dảy
Chi tỉẽu dánh giả TCF CF
n = 22] 11 = 224
Thời gian tái phát trung bình (thảng) 5,6 3,7
(95% Cl) (4,86-5,91) (3,45-4,47
Tỷ lệ rùi ro 1,473
"",_,,ỵg, ,.1.1—1110 j \
0,1101ẸN ;, Wu
1 111 TH EWUỤ,J JJ (1,189-1,825)
H p°qatrị,pJ y 0,0004
: : … r_hơLị ' ng trung bình (tháng) 9,2 8,6
96% (8,38-10,58) (7,16-9,46)
" “i'íấiượng sống 2 năm (%) 18,4 8,8
Tỷ lệ rủi ro 1,293
(95% cm (1,041—1,606)
* Giá trị p 0,0201
Tỷ iẹ đáp ứng (CR+PR) (%) 36,7 [ 25,4
Giá trị p 0,0106
Bệnh diễn tỉển với đảp ứng tốt nhẩt (%) 16,7 ] 25,9
’Không theo bảng phân loại
Cảc phân tích phụ về tuối, giới tính và chùng tộc cho thấy nhóm TCF tốt hơn nhỏm CF.
Chất lượng sống và các kết quả lợi ích trên lâm sảng cho thẳy nhóm TCF có cải thiện tốt hơn
nhóm CF.
Ung thư đẳu và cổ
Hiệu quả vả tính an toản cùa docetaxel trong điếu trị bệnh nhân ung thư tế bảo vảy ở đầu và
cổ (SCCHN) được đánh giá trong một thử nghiệm ngẫu nhiên đa trung tãm gian đoạn III
(TAX323). Trong nghiên cứu nảy, 358 bệnh nhân có bệnh SCCHN tiến triến chưa phẫu thuật,
trạng thải hoạt động WHO mức 0 hoặc 1, được chia ngẫu nhiến thảnh 2 nhóm điều trị. Bệnh
nhân nhóm docetaxel dùng docetaxel (T) 75 mglm2 sau đó là cisplatin (P) 75 mg/m2 rổi 5-
fiuorouracil (F) 750 mg/m mỗi ngảy truyền tĩnh mạch iiên tục trong 5 ngảy Liệu pháp nảy
dùng mỗi 3 tuần x 4 đợt cho trường hợp có đảp ứng tối thiểu (kích thước khối u gỉảm 2 chiều
>25%) sau 2 đợt điếu trị Kết thủc hóa trị, cảoh ít nhất là 4 tuần vả nhiều nhất là 7 tuần, các
bệnh nhân không dùng xạ trị (RT) Bệnh nhân nhóm so sánh dùng cisplatin (P) 100 mg/m2
sau đó là 5- fluorouracil (F) 1000 mg/m2 mỗi ngảy dùng 5 ngảy Liệu phảp nảy dùng môi 3
tuần x 4 đợt cho trường hợp có đáp ứng tối thiếu (kích thước khối u giảm 2 chiều ì25%) sau
2 đợt điều trị. Kết thủc hóa trị, cách ít nhất là 4 tuần và nhiều nhất lả 7 tuần, cảc bệnh nhân
không dùng xạ trị (RT) Xạ trị phân đoạn kinh điếu (l, 8Gy- -2 ,OGy 1 lần/ngảy, 5 ngảyftuần,
tổng 1iếu lả 66 đến 7OGy), hoặc xạ trị tăng cườnglphận đoạn cao (2 lần môi ngảy, tối thiếu
cách 6 giờ, 5 ngảy mỗi tuần) Khuyến cáo dùng tổng iiếu 7OGy với xạ trị tăng cường và 74 Gy
với xạ trị phân đoạn cao. Phẫu thuật sau khi hóa trị, trước hoặc sau khi xạ trị. Bệnh nhân
nhóm TPE uống kháng sinh dự phòng ciprofloxacin 500 mg x 2 lần/ngảy x 10 ngảy, bắt đầu
vảo ngảy thứ 5 cùa mỗi đợt. Chỉ tiêu đảnh giá chủ yếu cùa nghiên cứu nảy lả thời gian sổng
khi bệnh chưa tải phảt (PFS), dải hơn ở nhóm TPF so với nhớm PF, p=O, 0042 (PFS trung bình:
11,4 thảng so với 8, 3 tháng tương ứng) vởi thời gian theo dõi trưng bình là 33,7 thảng Thời
gỉan sông trung binh (OS) cũng dải hơn đáng kể ơ nhóm TPF so với nhóm PF (OS trung binh:
18 ,6 so với 14,5 tháng tương ứng), tỷ lệ tử vong giảm 28%, p= 0, 0128. Kết quả biếu thị ở
bảng sau:
Hiệu quả của docetaxel trong điếu trị bệnh nhân SCCHN tiến triển chưa phẫu thuật
Chỉ tiêu đảnh gỉá Docetaxel+Cis+S-FU Cis+S-FU
n=177 n=l8l
Thời gian sông trung blnh khi bệnh chưa tải phát 11,4 8,3
(tháng) (95% CI) (10,1-14,0) (7,4-9,1)
Tỷ lệ rủi ro (95% CI) 0,70
"Giả trị p (0,55-0,89)
0,0042
Thời gian sống trung binh (tháng) 18,6 14,5
(95% CI) (15,7-24,0) (11,6-18,7)
Tỷ lệ rủi ro 0,72
(95% CI) (0,56-0,93)
“Giá trị p 0,0128
,Q ỐÍNP 011°
0A101ỂN
m
//,—-"
1u Dhn
với hóa ưi (%) 67,8 53,6
(60,4—74,6) (46,0—61,0)
0,006
g tốt nhất với nghiên cứu [hóa trị +/- xạ tri] (%) 72,3 58,6
(95% Cl) (65,1—78,8) (51,0-65,8)
***Giá trị p 0,006
Thời gian đáp ứng trung bình với hóa trị t xạ trị (tháng) n=128 n=106
(95% Cl) 15,7 (13,4-24,6) 11,7 (10,2-17,4)
Tỷ lệ rủi ro 0,72
(95% Cl) (0,52-0,99)
**Giá trị p 0,0457
Cảo thông số chấtiượng sống ' ' '
Cảo bệnh nhân điêu trị với TPF it bị giảm chât lượng sông so với nhóm PF theo thang điêm
sức khỏe (p=0,01, dùng thang điêm EORTC QLQ-C30).
Cảc thôn số lợi ich lâm sảng ,
Thang điem vê trạng thái hoạt động với đầu và cổ (PSS-HN) được dùng đê đảnh giá khả năng
hỉều lời nói, khả năng ăn nơi công cộng, thực đơn ãn bình thường cho thây nhóm TPF tốt hơn
nhỏm PF.
Thời gian trung bình đến khi có suy giảm đầu tiên về trạng thải hoạt động WHO cho thấy
nhóm TPF tốt hơn nhóm PF. Chỉ số đau được cải thỉện ở cả hai nhóm cho thấy được kiểm
soát đau đầy đủ ở cả 2 nhóm.
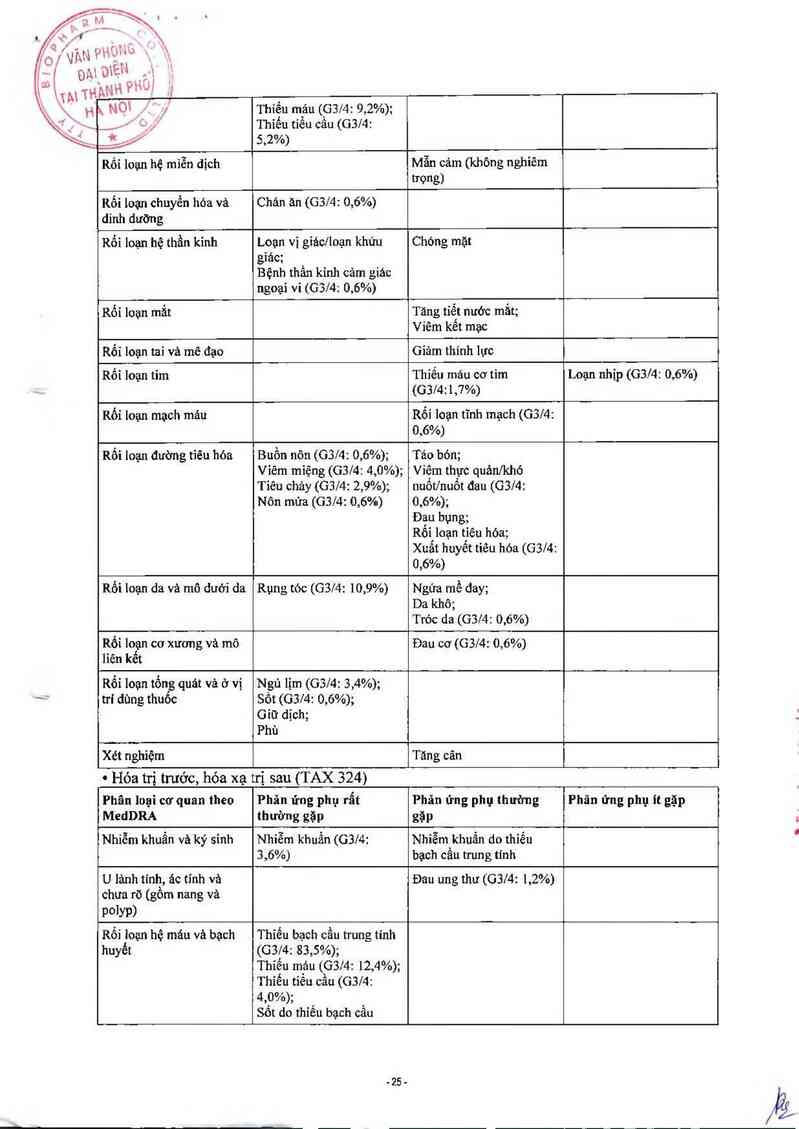
Hóa ni trước rồi hóa xạ trị sau, tinh an toân và hiệu quả của docetaxel trong điếu trị SCCHN
được đảnh giả trong một nghiên cứu gỉai đoạn 111 đa trung tâm ngẫu nhiên. Trong nghiên cứu
nảy, 501 bệnh nhân có bệnh SCCHN tỉến triến, và trạng thái hoạt dộng WHO là 0 hay 1,
được chia nhóm ngẫu nhiên. Nghiên cứu nảy bao gồm những bệnh nhân không thể giải phẫu
do vân đề kỹ thuật, bệnh nhân ít có khả năng cứu được bằng giải phẫu, bệnh nhân muôn giữ
lại cơ quan trên thân thế. Đánh giá hiệu quả và tính an toản vảo cảc chỉ tỉêu sống, sự thảnh
công của việc giữ lại cơ quan không được đề cập chính thức. Cảo bệnh nhân nhóm docetaxel
dùng docetaer (T) 75 mglm2 truyền tĩnh mạch vảo ngảy 1 sau đó lả cisplatin (P) 100 mg/m2
truyên tĩnh mạch 30 phủt đến 3 giờ, rổi đến truyên tĩnh mạch 5- fiuorouracil (F) 1000
mglm²lngảy từ ngảy ] đển ngảy 4. Mỗi đợt là 3 tuần, dùng 3 đợt Tất cả bệnh nhân chưa tái
phảt được dùng hỏa xạ trị (CRT) theo liệu trình (TPF/CRT). Các bệnh nhân ở nhóm đối
chứng dùng cisplatin (P) 100 mg/m2 truyền tĩnh mạch 30 phủt đến 3 giờ vảo ngảy 1, sau đó
truyền tĩnh mạch 5- fiuorouracil (F) 1000 mglm²lngảy từ ngảy 1 đến ngảy 5. Mỗi đợt là 3 tuần,
dùng 3 đợt. Tất cả bệnh nhân chưa tải phảt dùng CRT theo liệu trình (PF/CRT).
Bệnh nhân ở cả hai nhóm điếu trị dùng 7 tuần CRT sau hóa trị, cảch ít nhất 3 t `
chậm hơn 8 tuần kế từ khi bắt đầu đợt hóa trị cuối (ngảy 22 đến ngảy 56 của đợt h
Trợng thời gian xạ trị, dùng carboplatỉn (AUC 1,5) môi tuần, truyền tĩnh mạch `
nhất là 7 lỉều. Xạ trị dùng thiết bị megavolt (2 Gy mỗi ngảy, 5 ngảy mỗi tu
tổng liếu dùng là 70- 72 Gy). Có thế cân nhắc giải phẫu 0 vị trí phảt bệnh đầu tiên vả/hoặc cổ
bất cứ lúc nảo sau khi đã hoản tất liệu trình CRT. Tất cả bệnh nhân nhóm docetaxel của
nghỉên cứu nảy có dùng khảng sinh dự phòng. Chi tiêu đảnh giả chính của nghiên cứu nảy là
thời gian sống (OS) của nhóm docetaxel (log- rank test, p= 0 ,0058) dải hơn so với nhóm PF
(OS trung binh: 70,6 thảng so với 30,1 thảng), gỉảm 30% nguy cơ tử vong so với nhóm PF (tỷ
lệ rùi ro (HR)= 0, 70, 95% CI — 0, 54- 0 ,90) với thời gian theo dõi trung bình lả 41, 9 tháng. Chi
tiêu đánh giá phụ, PFS, cho thấy giảm 29% tái phảt hoặc tử vong và tăng thời gian PFS trung
bình thêm 22 tháng (35,5 tháng với nhỏm TPF và 13,1 thảng với nhóm PF). Điêu nảy cũng có
ý nghĩa về mặt thống kẽ với HR= 0, 71, 95% CI= 0,56-0,90;10g-rank test p= 0,004. Kết quả
dược trình bảy ở bảng sau:
vả không
trị cuôi).
DJ, ì \ `… ' .~ “
MHỄHĨệỦ_ q'ừă cũa docetaxel trong điều trị bệnh nhân SCCHN tiến triến
Hi
"<1
HU1 J., Ịfyi Chỉ tiêu đánh giá Docetaxel+Cis+ă- FU Cis+S-FU
J / n=177 n=181
Ềời 'g’ỉan sống không bệnh trung bình 11,4 8,3
(thảng) (95% Cl) (10,1- 14,0) (7,4-9,1)
Tỳ tệ rùi ro 0,70
(95% co (0,55-0,89)
I"Giả trị p 0,0042
Thời gian sỗng trung bình (thảng) 18,6 14,5
(95% 01) (15,7-24,0) (11,6-18,7)
Tỷ lệ rủi ro 0,72
(95% Cl) (0,56-0,93)
**Giả trị p 0,0128
Đáp ứng tốt nhẩt với hóa trị (%) 67,8 53,6
(95% CI) (60,4-74,6) (46,0-61,0)
**'Giá trị p 0,006
Đáp ứng tốt nhẩt với nghiên cứu [hóa trị +/- 72,3 58,6
xạ trị] (%) (95% CI) (65,1-78,8) (51 ,0-65,8)
***Giá trị p 0,006
Thời gian đâp ứng lrung binh với hỏa trị 2 n=128 n=106
xạ trị (thảng) (95% cn 15,7 11,7
(13,4-24,6) (10,2-17,4)
Tỷ lệ rủi ro 0,72
(95% cn (0,52-0,99)
MGiả trị p 0,045?
Tỷ lệ rủi ro thẩp hơn l`cho nhóm docetaxel + cisplatin + fiuorouracil
" log-rank test Chưa đỉêu chinh
[ịưo’g động I_ịgg
Dược 2động học của docetaxel đã dược đánh giá ở các bệnh nhân ung thư sau khi dùng 20-115
mg/m2 ở các nghiên cứu giai đoạn I. Dược động học cùa docetaxel không phụ thuộc liều dùng
và gồm có ba giai đoạn với thời gian bán hủy ở pha oc ,B và y lả 4 phút, 36 phủt và 11,1 gíờ.
Giai đoạn chặm, một phần2 là do docetaxel được phóng thích tương đối chậm từ ngoại vi. Sau
khi dùng 1 liếu 100 mg/m2 truyền tĩnh mạch trong 1 giờ, nồng độ đinh trung binh trong huyết
tương lả 3, 7 12ng tương ứng với AUC là 4, 6 giờ glml Giá trị trung bình cùa tổng thanh thải
toản thân vả thể tích phân bố ở trạng thải ỏn định là 21 1/giờ/m2 và 113 1 tương ứng. Khác biệt
về tổng thanh thải toản thân giữa cảc cả nhân lả khoảng 50% Docetaxel liên kểt với protein
huyết tương khoảng 95%.
Một nghiên cứu với M-C docetaxel đã được tiến hảnh với 3 bệnh nhân ung thư. Docetaxel
được thải trù ở cả nước tiếu và phân sau khi được oxy hóa ở nhóm ester tert-buty. qua trung
gian cytocrom P450, trong vòng 7 ngây, lượng bải tiết ra nước tiều và phân là 6% và 75%
lượng chất đánh dấu phóng xạ đã dùng. Khoảng 80% hoạt tính phóng xạ được tìm thấy trong
phân trong 48 giờ đầu tiên với 1 chất chuyến hóa chính không có hoạt tính và 3 chất chuyến
hóa phụ ít hoạt tính, lượng chất chưa biến đối rất ít
Một phân tích dược động học được tiến hảnh với docetaxel trên 577 bệnh nhân. Các thông
sô dược động học được ước lượng theo cảoh gần với cảch đã dùng trong các nghiên cứu giai
đoạn I. Dược động học của docetaxel không thay đổi bởi tuổi tác và giới t1nh của bệnh nhân
Một số it bệnh nhân (n=23) có các xét nghiệm lâm sảng cho thấy bị suy chức năng gan mức
độ nhẹ đến trung bình (ALT, AS'I>I ,5 lần giới hạn binh thường trên và phosphatase kiềm
>2 ,5 lần giới hạn bình thường trên), tổng thanh thải thấp hơn bình thường 27% (xin xem phần
Liều dùng và cách dùng). Thanh thải docetaxel không thay đổi ở bệnh nhân ứ dịch mức độ
nhẹ và trung bình, không có số liệu với bệnh nhân bị ứ dịch nặng.
Khinùng kết hợp, docetaxel không ảnh hướng đến thanh thải cùa doxorubicin và nồng độ
huyêt tương cùa doxorubicinol. Dược động học của docetaxel, doxorubicin vả
D
1
lỵ,tliầ \
`y.
1 I . . w,' ' Íi ` . n R 5 ~
: \T. M 11*`_c`yẫềịpihợsphamid không bị ảnh hướng kh1 dùng đong thơi.
.,m -
1,11'4'd `
_»xẸH
\Ỹ MỄậcn/ngỉaếi/t cứu giai đoạn I đảnh giá hiệu quả của capecitabin đối với dược động học của
\,._,glgtgetajíel và ngược lại cho thấy capecitabin không ảnh hưởng đến dược động học của
docetaxel (Cmax vả AUC) vả docetaxel không ảnh hưởng đến dược động học của chất
chuyên hóa của capecitabin là 5 ——DFUR.
Thanh thải của đocetaxcl khi kết họp điều trị với cisplatin hoặc `carboplatỉn tương tự như khi
đơn trị lỉệu. Dược động học cùa cisplatìn dùng ngay sau khi truyền tĩnh mạch docetaxel tương
tự như khi dùng cisplatin đơn trị liệu.
Tảo dụng của prednison trên dược động học cùa docetaxel được dùng với liệu trình
dexamethason chuẩn đã được nghỉên cứu ở 42 bệnh nhân. Prednison không ảnh hướng đên
dược động học cùa docetaxel.
Sổ Iiêu an toân tỉền lâm sâne
Khả năng gây ung thư của docetaxel chưa được nghiên cứu.
Docetaxel gây đột biến gien ở thử nghiệm in vitro nhiễm sắc thể với tế bảọ CHO-Kl và thử
nghiệm nhân nhỏ in vivo với chuột. Tuy nhiên, docetaxel không gây đột biên với thử nghiệm
Ames hoặc CHOIHGPRT. Cảo kêt quả nảy tương đông với tảc động dược lý cùa docetaxel.
Tảc dụng không mong muốn trên tỉnh hoản đã được quan sát ở các nghiên cứu trên loải gặm
nhâm, đê xuât docetaxel có thẻ ảnh hưởng đên sự sinh sản cùa con đực.
[CHỈ ĐỊNH]
Ung thư vú, ung thư phồi không có tế bảo nhò, ung thư tuyến tỉền liệt, ung thư dạ dảy, ung
thư đầu và cổ.
Ung thư vú
- Docetaxel kết họp doxorubicin vả cyclophosphamid được chỉ định điếu trị hỗ trợ cho bệnh
nhân ung thư vú có hạch có thể giải phẫu.
- Docetaxel kết hợp doxorubicin được chỉ định điều trị bệnh nhân ung thư vú di căn hoặc tiến
triển chưa từng dùng hóa trị độc tế bảo cho bệnh nảy.
- Docetaxei đơn trị liệu được chỉ định điều trị bệnh nhân ung thư vú di căn hoặc tiến triến sau
khi đã thât bại với hóa trị độc tế bảo.
- Docetaxel kết hợp trastuzumab được chỉ định điều trị các bệnh nhân ung thư vú di căn, khối
u đã tạo HER2 quá mức và bệnh nhân chưa từng hóa trị cho bệnh di cãn.
- Docetaxel kết hợp với capecitabin được chỉ định điếu trị cảc bệnh nhân ung thư vú di
cãn hoặc tiên triên sau khi đã thất bại với hóa trị độc tế bảo. Trị liệu trước đây bao gổrn
anthracyclin.
Ung thư nhổi không có tế bảo nhỏ
- Docetaer kết hợp với cisplatỉn được chỉ định đỉều trị bệnh nhân ung thư phối không có tế
bảo nhỏ, di căn hoặc tiến triến, không giải phẫu được, bệnh nhân chưa từng được hóa trị
cho tình trạng bệnh nảy. Docetaxel kết hợp carboplatỉn lả một chọn lựa khảo của chiến lược
điều trị platin.
- Docetaxel kểt hợp cisplatin được chỉ định điếu trị bệnh nhân ưng thư phối không có tế bâo
nhỏ, di căn hoặc tiến triến sau khi đã thất bại với hóa trị platin.
Ung thư tuvến tiến liêt
- Docetaxel kết hợp với prednison hoặc prednisolon được chỉ định điếu trị bệnh nhân ung thư
tuyên tỉên liệt di căn khó chữa.
Ung thư da dảv
- Docetaxel kết hợp cispiatin vả 5-fiuorouracil được chỉ định điều trị bệnh nhân ung thư dạ
dảy di căn, bao gồm ung thư dạ dảy thực quản, bệnh nhân chưa từng được hóa trị cho bệnh
[LIÊU DÙNG VÀ CÁCH DÙNG] ,
(Chỉ dùng thuốc nảy dưới sự giám sảt của một thầy thuôo chuyên khoa)
Sử dụng docetaxel chỉ nên giởi hạn ở các khoa chuyên vê hóa trị độc tế bảo và chỉ được dùng
dưới sự giảm sảt cùa một thầy thuốc chuyên khoa về sử dụng hóa trị ung thư. ` Â
Đối với ung thư vú, ung thư phổi không có tế bảo nhỏ, ung thư dạ dảy, ung thư đâu và cô, có
thể uống corticosteroid như lá dexamethason 16 mg mỗi ngảy (8 m x 2 lần/ngây) trong 3
ngảy, băt đầu ] ngảy trước khi dùng docetaxel, trừ trường hợp có chong chỉ định (xem phần
Cảnh giác và thận trọng). Với ung thư tuyến tiền liệt, khuyến cảo dùng đổng thời prednison
hoặc prednisolon kèm với dexamethason uông 8 mg vảo thời điếm trước 12, trước 3 giờ và
trước 1 giờ truyền tĩnh mạch docetaxel.
Docetaxel được truyền tĩnh mạch trong 1 giờ mỗi 3 tuần (xin xem Cảnh giảc vả Thận trọng).
Có thể dùng G-CSF dự phòng để giảm nguy cơ độc tính huyết học.
Ung thư vú
Đối với đỉều trị hỗ trợ ung thư vú có hạch có thể giải phẫu dược, liều khuyến cảo 2của
docetaxel là 75 mg/m2 truyền tĩnh mạch ] giờ sau khi dùng doxorubicin 50 mglm2 vả
cyclophosphamid 500 mglm2 mỗi 3 tuần x 6 đợt. (xin xem Điều chỉnh liếu dùng trong điều trị)
Đối với bệnh nhân bị ung thư vú di căn hoặc tiến triển, liều khuyến cáo của docetaxel là 100
mg/m2 đơn trị liệu. Liệu pháp hảng đầu, docetaxel 75 mg/m2 dùng kết hợp với doxorubicin
(SO mg/m2 ).
Khi kêt hợp với trastuzumab liều khuyến cảo của docetaxel lả 100 mg/m2 mỗi 3 tuần, dùng
trastuzumab mỗi tuần. Trong một thử nghiệm, truyền tĩnh mạch docetaxel lần đầu một ngảy
sau khi dùng liều đầu tiên cùa trastuzumab. Cảc liều docetaxel tiếp theo được dùng ngay sau
khi truyền tĩnh mạch trastuzumab, nếu liều trastuzumab được dung nạp tốt.
Khi dùng kết hợp với capecitabin, Iiều khuyến cảo cùa docetaxel là 75 mg/m2 mỗi 3 tuần, kết
hợp với capecitabin 1250 mg/m2 2 lần/ngảy (dùng 30 phủt sau khi ăn) trong 2 tuần, sau đó
nghỉ 1 tuần.
Ung thư phổi không có tế bảo nhỏ
Ở các bệnh nhân u2ng thư phối không có tế bảo nhỏ chưa từng hóa trị, liều khuyến cáo là
docetaxel 75 mg/m2 dùng ngay sau khi dùng cisplatin 75 mg/m2 trong 30- 60 phút Đối với
trường hợp đã thất bại với hóa trị platin, liếu khuyến cáo là 7Smglm2 đơn trị liệu.
Ung thư tuvến tiền lỉêt
Liều khuyến cáo của docetaxel là 75 mg/mz. Uống prednison hoặc prednisolon 5 mg x 2
lần/ngây, dùng liên tục. (xỉn xem Dược lực học)
Ung thư da dảỵ
Liều khuyến cáo của docetaxel là 75 mg/m2 truyền tĩnh mạch 1 giờ, sau đó lả cisplatin 75
mglm², truyền tĩnh mạch 1 đến 3 giờ (cả 2 dùng trong ngảy 1), sau đó dùng 5- fiuorouracil
750 mg/m2 mỗi ngảy truyền tĩnh mạch liện tục trong 24 giờ trong 5 ngảy, bắt đầu khi kết thủc
truyền cisplatin. Lập lại điều trị mỗi 3 tuần. Bệnh nhân phải được dùng thuốc chống ói trước
và cung câp đủ dịch dễ dùng cisplatin. Nên dùng G— CSF dự phòng để giảm nguy cơ độc tính
huyết học (xin xem Điều chỉnh liều dùng trong quá trình điếu trị).
Ung thư đầu và cổ
Để điều trị khởi đầu ung thư tế bảo vảy ở đẫn và cổ chưa phẫu thuật (SCCHN), liều khuyến
cảo cùa docetaxel là 75 mg/m2 truyền tĩnh mạch ] `giờ, sau đó dùng cisplatin 75 m mỉ trên 1
giờ, vảo ngảy l, tiểp theo dùng 5- fiuorouracỉl truyền tĩnh mạch liên tục 750 mg/m mỗi ngảy
.1o.
n.\h .
1. \]i'iii ;,rịíJĨ
Đ, =dLiì
\ tiếng 5 iẩgảỵ, Liệu trình nảy dùng mỗi 3 tuần x 4 đợt Sau hóa trị, bệnh nhân nên được xạ trị.
,Ẹẹnịí nhân phải được dùng trước thuốc chống ói và bổ sung nước đầy đủ (trước và sau khi
dùngcĩsplãtin). Có thể dùng G- CSF dự phòng để giảm nguy cơ độc tính huyết học.
: nh liều dùng trong uuá trình diếu tri
Tổng gua uảt
Nên dùng docetaxel khi lượng bạch cầu trung tính > 1,500 tế bảo/mm
Ở các bệnh nhân bị một trong cảc tình trạng sau sốt do thiếu bạch cầu trung tinh, bạch cầu
trung tính < 500 tế báolmm3 trong hơn 1 tuần, phản ứng da hoặc bệnh bạch cầu ngoại vi
nghiêm trọng trong quá trình điếu trị docetaxel, nên giảm 1iểu dùng docetaxel từ 100 mglm2
xuông 75 mg/m2 vả/hoặc2 từ 75 xuống 60 mglm². Nếu bệnh nhân tiếp tục có những phản ứng
nảy ớ liếu dùng 60 mglm², nên ngưng điếu trị.
Đỉều tri hỗ trơ ung thư vú
Ở cảc bệnh nhân theo chế độ điều trị hỗ trợ cho bệnh ung thư vú và các bệnh nhân bị bệnh
thiếu bạch cầu có biến chứng (gồm thỉếu bạch cầu trung tính kéo dải, sốt do thiếu bạch cầu
trung tính, hoặc nhiễm khuẩn), khuyến cảo dùng GSF để dự phòng (ví dụ từ ngảy 4 đến 11)
trong tất cả cảc đợt điếu trị tiếp theo. Cảc bệnh nhân bị những phản ứng nảy nên duy trì dùng
G- CSF và giảm liều dùng docetaxel xuống 60 mglm².
Tuy nhiên, thiếu bạch cầu trung tính có thẻ xảy ra sớm hơn trên lâm sảng. Vì thế nến cân nhắc
dùng G—CSF nếu bệnh nhân có nguy cơ thiếu bạch cẩu. Bệnh nhân viêm mỉệng độ 3 hoặc 4
nên giảm liếu dùng còn 60 mg/m.
Kết hợp cisplatin
Đối với cảc bệnh nhân dùng3 liều khởi đầu docetaxel 75 mg/m2 kết hợp cisplatin và có lượng
tiếu cầu < 25. 000 tế bảolmm3 trong đợt điếu trị trước (kết hợp với cisplatin), và lượng tiếu câu
< 75.000 tế bảo/mm3 (kết hợp với carboplation) hoặc ở cảc bệnh nhân bị sốt do thiếu bạch cầu
trung tinh, hoặc các bệnh nhân bị độc tính nặng (khộng phải độc tỉnh huyết học), liếu dùng
docetaxel trong các đợt điều trị tiếp theo nên gỉảm xuông 65 mg/m.
Kết hgg capecitabin
o Đối với bệnh nhân có dấu hiệu đầu tiên của độc tính đó 2 kéo dải đến thời điểm của đợt
điếu trị docetaxel/capecitabin tiếp theo, hoãn diều trị cho đến khi giảm về độ 0-1, và dùng
lại 100% liều dùng ban đầu.
. Đối vởi bệnh nhân có dấu hỉệu thứ 2 cùa độc tính dộ 2, hoặc dấu hiệu đầu tiên của độc tính
độ 3, ở bất cứ thời diểm nảy trong chu kỳ điều m“, hoãn điếu trị cho đến khi về độ o-1, rồi
dùng lại docetaxel 55 mgfm².
0 Nếu xuất hiện cảc độc tính tỉếp theo, hoặc cảc độc tính dộ 4, ngưng dùng docetaxel.
Kết hc_rg cisplatin vả 5-fiuorouracil
Nếu có dùng G-CSF mà vẫn xảy ra sốt do thiếu bạch cấu trung tính, thiếu bạch cầu trung tính
kéo dải hoặc nhziễm khuân do thiếu bạch cầu trung tinh, nên giảm liếu dùng docetaxel từ 75
xuống 60 mg/mỀ. Nếu tiếp tục bị thiếu bạch câu có biến chứng, nên giảm liều docetaxel từ 60
xuống 45 mglmị. Trường hợp thiếu tiều cầu độ 4 nên giảm liều dùng docetaxel dose từ 75
xuông 60 mgmz. Không nên tiếp tục điều trị các đợt sau với ocetaxel cho đến khi bạch cầu
trung tính trở vê mức > 1.500 tế bảo/mm vả tiếu cầu hồi phục về mức > 100.000 tế bảo/mm.
Ngưng điều trịnếu cảc đọc tính nảy kéo dải (xin xem Cảnh giảc và thận trọng). _
Khuyên cáo điêu chỉnh liêu dùng do độc tính ở cảc bệnh nhân điêu trị băng docetaxel kêt hợp
cisplatin vả 5-fluorouracil (5-FU):
Độc tính Điều chỉnh Iiều dùng
Tiêu chảy độ 3 Giai đoạn đẩu: giảm 20% liểu dùng 5-FU
Giai đoạn 2: giảm 20% liều dùng docetaxel
Tiêu chảy độ 4 Giai doạn dâu: giảm 20% liêu dùng docetaxel vả 5-FU
Giai đoạn 2: ngưng điều trị
Viêm miệng/niêm mạc Giai đoạn đẫu: giảm 20% liều dùng 5- FU ,
Độ 3 Giai đoạn 2: ngưng dùng 5- FU ớ tât cả các đợt tiêp theo
-11.
198,
l’1 11
" oQẤIAN PHQNG` \
DA]
DiỆN '…\'11 11
TA\TH
1N11 "nGÍ ]] Giai đoạn 3: giảm am20% liều dùng docetaxel
HA
\Ấffl nỉêm mạc Giai đoạn dâu: ngưng dùng 5- FU ở tất cả các đợt tiếp theo
6 ’ Giai đoạn 2: giảm 20% liều dùng docetaxel
ệnh nhân SCCHN bị thiếu bạch cầu có biển chứng (bao gồm thiểu bạch cầu trung tính
kéo dâi, sốt do thiếu bạch cầu trung tính, hoặc nhiễm khuấn), khuyến cảo dùng G- CSF để dự
phòng (ví dụ từ ngảy 6-15) trong tất cả cảc đợt điếu trị tiếp theo.
Cảc nhóm b nh nhân đăc biêt:
Dựa trên cảc số liệu dược động học của docetaxel đơn trị liệu 100 mg/m2, các bệnh nhân tăng
transaminase (ALT vả/hoặc AST) vượt 1, 5 lần giởi hạn bình thường trên và phosphatase kiềm
vượt 2, 5 lần giới hạn bình thường trên, liếu khuyến cáo của docetaxel là 75 mglm² (xin xem
Cảnh giác và Thận trọng, Dược động học). Vởi những bệnh nhân có bilirubin huyết_ thanh
vượt mức binh thường vả/hoặc ALT vả AST vượt 3,5 lần giới hạn bình thường trên kết hợp
với phosphatase kiếm vượt 6 lần giới hạn bình thường trên, không khuyến cáo giảm liều và
không nên dùng docetaxel trừ khi chỉ định bắt buộc.
Kết hợp cisplatin và 5 -fiuorouracil điều trị bệnh nhân ung thư dạ dảy, nghiên cứu lâm sảng đã
loại các bệnh nhân có ALT vảfhoặc AST vượt 1,5 lần giới hạn bình thường trên, phosphatase
kiềm vượt 2, 5 lần, bilirubin vượt giới hạn binh thường trên; vì vậy không có khuyến cảo giảm
liều dùng cho các bệnh nhân nảy, và chi dùng khi có chỉ định bắt buộc. Không có số liệu ở
cảc bệnh nhân suy gan diều trị bằng docetaxel kết hợp
Trẻ em và thiểu niên:
Ít có kinh nghiệm sử dụng ở trẻ em.
Người cao tuổi:
Dựa trên phân tích dược động học ở cảc nhóm bệnh nhân, không có hướng dẫn đặc biệt cho
người cao tuổi. Khi kết hợp với capecitabin ở bệnh nhân từ 60 tuổi trở lên, khuyến cáo dùng
75%1iều dùng cùa capecitabin.
KTƯO'NG Kv1
Không nên pha chế phấm nảy với các thuốc khác, trừ các thuốc được nêu trong phầanha chế
dịch truyền].
[Pha chế dịch truyền]
Dung dịch Tynen nồng độ 20 mg/l ml KHÔNG cần pha loãng với dung môi trước khi thêm
vâo dịch truyền. Mỗi lọ dùng 1 lần và nên dùng ngay.
Nếu cảc lọ thuốc được bảo quản trong tủ lạnh, nên để ở nhiệt độ dưới 25°C trong 5 phút trước
khi sử dụng.
Có thể cần dùng hơn 1 lọ Tynen để đạt được liếu dùng cần thiết cho bệnh nhân. Dùng bơm
tiêm có khắc vạch đễ rủt lượng dung dịch Tynen cần thiết.
Nồng độ của dung dịch Tynen là 20 mng (Tynen 20 mg | 1 ml vả Tynen 80 mg/4 ml).
Bơm lượng dung dịch Tynen cần dùng vảo chai hoặc túi dịch truyền 250 m], có thể là dung
dịch g1ucose 5%, natri clorid 0,9%.
Nếu cần dùng docetaxel liều dùng trên 200 mg, cần dIùng thể tích dịch truyền lớn hơn vì nồng
độ của docetaxel không được cao hơn 0,74 mglml Lắc chai hoặc tủi dịch truyền để trộn dung
dịch thuốc.
Dung dịch đã pha nên được dùng trong 4 giờ ở nhiệt độ phòng (dưới 25 °C) bao gồm cả thời
gian 1 giờ truyền tĩnh mạch.
Cũng như tât cả cảc chế phấm tiêm truyền khảc, phải kíếm tra dịch truyền docetaxel bằng mắt
trước khi sử dụng, loại bỏ dung dịch có cặn.
KCHÓNG CHỈ ĐỊNH]
o Mẫn cảm với hoạt chất hoặc bẫt cứ tả dược nảo.
0 Không nên dùng docetaxel ở cảc bệnh nhân có lượng bạch cầu trung tinh < 1.500 tế
-12.
an toản, hiệu quả
0 Tuân thủ chông chỉ định cùa cảc thuôo dùng kết hợp với docetaxel.
1CÁNH GIÁC VÀ THẬN TRỌNG]
Với ung thư vú và ung thư phổi không có tế bảo nhỏ, dùng thuốc trưởc điếu trị gồm
corticosteroid uống như dexamethason 16 mg/ngảy (8mg x 2 lần/ngảy) trong 3 ngảy, bắt đầu
1 ngảy trước khi dùng docetaxel trừ khi có chống chi dịnh, có thế lảm giảm tỷ lệ vả giảm sự
giữ dịch cũng như giảm phản ứng mẫn cảm.
Dùng thuốc trưởc điều trị với ung thư tuyến tiến 1iệt lả uống dexamethason 8 mg vảo 12 giờ, 3
giờ và 1 giờ trước khi truyền tĩnh mạch docetaxel (xin xem Liều dùng và cách dùng).
Huvết hoc
'Ihiếu bạch cầu trung tính là phản ứng phụ thường gặp nhất của docetaxel. Thời điếm bạch
cầu trung tính xuống thấp nhất trung bình là 7 ngảy, nhưng có thể ngắn hơn ở cảc bệnh nhân
đã điểu trị nhiều đợt. Nên tiến hảnh xét nghiệm kiếm soát toản thế công thức mảu thường
xuyên ở tất cả bệnh nhân dùng docetaxel Chỉ dùng lại docetaxel khi lượng bạch cẩu trung
tính > 1.500 tế bảo/mms. (xin xem Liều dùng và cảch dùng)
Trường hợp thiếu nghiêm trọng bạch cầu trung tính (<500 tế bảo/mmẫ trong 7 ngảy hoặc hơn)
trong liệu trình docetaxel, khuyến cảo giảm liều dùng ở đợt điều trị tiếp theo hoặc sử dụng cảc
biện phảp thích hợp (xỉn xem Liều dùng vả cách dùng).
Ở cảc bệnh nhân điều trị bằng docetaxel kết hợp cisplatin và 5— fiuorouracil (TCF), sốt và
nhiễm khuẩn do thiếu bạch câu trung tính có thể xảy ra ít hơn nếu dùng dự phòng G— CSF.
Bệnh nhân điều trị bằng TCF nên dùng dự phòng G- CSF để giảm nguy cơ thỉếu bạch cầu
trung tính có biến chưng (sốt do thiếu bạch câu, thiêu bạch cấu trung tính kéo dải hoặc nhiễm
khuân do thiêu bạch câu trung tính). Nên theo dõi cấn thận bệnh nhân dùng TCF (xin xem
Liều dùng cách dùng và Tảo dụng phụ).
Phản ứng mẫn cảm
Nên theo dõi bệnh nhân sát sao về phản ứng mẫn cảm, đặc biệt trong 2 lần truyền tĩnh mạch
đầu. Phản ứng mẫn cảm có thể xảy ra chi vải phủt sau khi truyền tĩnh mạch docetaxel, vì vậy
cần có sẵn cảc phương tiện điều trị hạ huyết' ap và co thắt phế quản. Nếu xảy ra phản ứng mẫn
cảm, cảc triệu chứng nhẹ như đỏ bừng mặt hoặc phản ứn da tại chỗ có thế không cân ngưng
điều trị ngay. Tuy nhiên, các phản ứng nặng như hạ huyet' ap, co thắt phế quản hoặc nổi ban
đỏ toản thân cần ngưng dùng docetaxel ngay và có bỉện phảp điều trị thích hợp. Bệnh nhân có
phản ứng mẫn cảm nặng không nên thử dùng lại docetaxel.
Phản ứng trên da
Nổi ban đỏ trên cảc chi (lòng bản tay bản chân) phủ và lột da. Có bảo cảo về cảc triệu chứng
nặng như phát ban lột da cân ngưng ngay điều trị (xỉn xem Liều dùng và cảoh dùng).
G_i___ữ dich
Cảo bệnh nhân bị giữ dịch nặng như trản dịch mảng phổi, trản dịch mảng tim và bảng nên
được theo dõi cẩn thận.
Bênh nhân suv gan
Ó cảc bệnh nhân đơn điều trị bằng docetaxel 100 mg/m2 có mức transaminase huyết thanh
(ALT vảfhoặc AST) vượt 1,5 lân gỉới hạn bình thường trên, phosphatase kiêm vượt 2,5 lần
giới hạn bình thường trên có nguy cơ cao bị cảc phản ứng phụ nặng như chết do độc tính bao
gồm nhiễm khuân huyết, xuất huyết đường tiếu hóa có thế tử vong, sốt do thiếu bạch cẩu
trung tính, nhiễm khuẩn, thiếu tiếu cầu, viêm miệng và mệt mỏi. Vì vậy, liều khuyến cáo của
docetaxel ở các bệnh nhân có xét nghiệm chức năng gan cao là 75 mg/m2 và nên xét nghiệm
.13.
..I ìI
`.
' ' (ĨĨTI>.
46 VẢN PHONG` f
°ếi o…vntEN
lủc đầu và trước mỗi dợt điều trị (xin xem Liều dùng và cảoh dùng). Đối với
ire iiặnâ ]
\ĨẨ M“ 0_ấổỀ ệrihẩnltần có mức bilirubin huyết thanh cao vả/hoặc ALT vả AST > 3,5 giới hạn binh
ờrigìtếấ cùng với phosphatase kiềm > 6 lần giới hạn bình thường trên, không khuyến
\Ĩc _go' ỉều và không nên dùng docetaxel trừ khi có chỉ định bắt buộc
\Kễ`t ợp với cisplatin vả 5-fiuorouracil điếu trị bệnh nhân ung thư dạ dảy, nghỉên cứu lâm
sảng đã loại cảc bệnh nhân có ALT vả/hoặc AST vượt 1, 5 lẫn giởi hạn bình thường trên,
phosphatase kiếm vượt 2, 5 lẫn, bilirubin vưọt giởi hạn binh thường trên; vì vậy không có
khuyến cảo giảm Iiếu dùng cho cảc bệnh nhân Onảy, và chỉ dùng khi có chỉ định bắt buộc.
Không có số liệu 0 các bệnh nhân suy gan điểu trị băng dooetaxel kết hợp.
B_enhn_hủvtlm
Không 06 số liệu về bệnh nhân suy thận nặng điếu trị bằng docetaxel.
T__hần kinh
Khi xảy ra độc tính nặng với thần kinh ngoại vi, phải điếu chinh liếu dùng (xin xem Liều
dùng và cách dùng).
Đôc tính tim
Suy tim đã được quan sảt thấy ở bệnh nhân dùng docetaxel kết hợp với trastuzumab, đặc biệt
sau khi dùng hóa trị có anthracyclin (doxorubicin hoặc epirubicin), có thế ở mức trung binh
hoặc nặng dẫn đến tử vong (xin xem Tác dụng phụ)
Cảo bệnh nhân được chọn để điều trị với docetaxel kết hợp trastuzumab, cần phải đảnh giả về
tỉm trước khi điều trị. Chức nãng tim có thế cần phải kiếm soát thêm trong quá trình điều trị
(ví dụ mỗi 3 thảng) đế phảt hiện bệnh nhân bị rối loạn chức năng tim.
Thân trong khác
Phải có biện pháp ngừa thai trong khi điều trị và ít nhất 6 thảng sau khi chắm dửt điều trị.
Thân trong bổ sung khi dùng đỉều tri hỗ trơ ung thư vú
Thiếu bạch cồu trung tinh có biến chửng
Đối với các bệnh nhân bị thiếu bạch câu trung tính có biến chửng (thiếu bạch cầu trung tính
kéo dải, sốt do thiểu bạch cầu trung tính, hoặc nhiễm khuẩn), nên cân nhắc giảm lỉều và dùng
G-CSF (xìn xem Liều dùng và Cách dùng).
Phản ứng trên đường tiêu hóa
Cảo triệu chứng sớm như đau bụng, căng cứng, sốt, tiêu chảy, có/không thiếu bạch cầu trung
tinh có thế là cảc biếu hiện sớm cùa độc tính đường tiêu hòa nghiêm trọng, nên đánh giá vả
điếu trị thích hợp.
Suy tim sung huyết
Nên kỉếm soát các triệu chứng suy tỉm sung huyết trong khi điều trị và trong thời gian theo
dõi.
Thiếu bạch cầu huyết
Ở cảc bệnh nhãn điều trị bằng docetaxel, doxorubicin vả cyclophosphamid (TAC), cần theo
dõi nguy cơ rối loạn sản tùy chậm hoặc thiếu bạch cầu do tủy.
Bệnh nhán có 4 hạch dương tính
Tỷ lệ của ích lợi/nguy cơ ở cảc bệnh nhân có 4 hạch dương tính điếu trị bằng TAC chưa được
định nghĩa đằy đủ trong phân tích (xin xem Dược động học)
Người cao tụốz'
Không có sô lỉệu ở cảc bệnh nhân trên 70 tuối sử dụng docetaxel kết hợp với doxorubicin vả
cyclophosphamid.
Trong một nghiên cửu ung thư tuyến tiến liệt 333 bệnh nhân được điếu trị bằng docetaxel mỗi
3 tuần, 209 bệnh nhân từ 65 tuối trở lên và 68 bệnh nhân trên 75 tuổi. Ở cảc bệnh nhân điếu
trị bằng docetaxel mỗi 3 tuần, tỷ lệ có các thay đổi ở móng ở bệnh nhân từ 65 tuối cao hơn
10% so với bệnh nhân trẻ tuổi. Tỷ lệ sốt, tiêu chảy, chán ăn, phù ngoại vi ở cảc bệnh nhân từ
75 tuối trở lên cao hơn 10% so với bệnh nhân đưới 65 tuồi.
Trong một nghiên cứu ung thư dạ dảy, 300 bệnh nhân điều trị bằng docetaxel kết hợp với
'Ia
\ <
vhn PHONG “ :
Ị[ ĐèisìbỞfin =Ĩ" ẵ-fiưorouracil, 74 bệnh nhân từ 65 tuối trở lên và 4 bệnh nhân từ 75 tuổi trở lên.
" i,… iBỳ 1ỆỄiẵế ụ
ng phụ ở bệnh nhân lớn tuối cao hơn bệnh nhân trẻ tuối. Tỷ lệ các tảo dụng phụ
(Ểễttfẩ ức độ): ngủ 1ịm, vìêm miệng, nhiễm khuẩn do thiếu bạch cầu trung tính ở cảc
'z__ bệrểrĩth“ từ 65 tuồi trở lên cao hơn 10% so với các bệnh nhân trẻ.
eo dõi sát sao các bệnh nhân cao tuồi điếu trị bằng TCF.
[TÁC DỤNG PHỤ]
Cảo tảo dụng phụ được xem là có thế liên 2quan đến việc sử dụng docetaer được lấy từ:
' 1312 và 121 bệnh nhân dùng 100 mglm2 và 75 mg/m2 docetaxel đơn trị liệu
* 258 bệnh nhân dùng dooetaxel kết họp với doxorubicin.
' 406 bệnh nhân dùng docetaxel kết hợp với cisplatin.
* 92 bệnh nhân dùng docetaxel kểt hợp với trastuzumab
' 255 bệnh nhân dùng docetaxel kết hợp với capecitabin.
' 332 bệnh nhân dùng docetaxel kết họp với prednison hoặc prednisolon
' 1276 bệnh nhân (744 và 532 nhóm TAX 316 và GEICAM 9805 tương ứng) dùng docetaxel
kểt hợp với doxorubicin vả cyclophosphamid
' 300 bệnh nhân ung thư dạ dảy (221 bệnh nhân trong nghiên cứu giai đoạn III và 79 bệnh
nhân trong nghiên cứu giai đoạn 11) dùng docetaxel kết hợp với cisplatin vả 5-i1uorouracil
' 174 và 251 bệnh nhân ung thư đầu và cổ dùng docetaxel kểt hợp cisplatin vả 5-fluorouracil
Các phản ứng nảy được mô tả theo bảng tiêu chuẩn độc tính thông thường NCI (độ 3 = 63; độ
3-4= 0374; độ 4= G4), dùng cảc thuật ngữ của COSTART vả MedDRA. Tẩn suất được định
nghĩa lả: rất thường gặp (> 1l10), thường gặp (> 1/100 đến < 1/10); ít gặp (> 1l1.000 đến <
11100);11ỉểm (> 1/10. 000 đến < 1/1. 000); rất hiếm (< ll10. 000); không rõ (không thế đánh giá
từ cảc số Iiệu săn có).
Ở mỗi nhóm tần suất, cảc tảc dụng phụ được sắp xếp theo mức độ nghiêm trọng giảm dần.
Các tảo dụng phụ thường gặp nhất khi dùng đơn trị liệu docetaer lả: thiếu bạch câu trung tính
(có thể hồi phục và không tích lũy; thời gian trung bình đến mức xấu nhất là 7 ngảy và thời
gian thiếu bạch cằn trung tính nghiếm trọng (< 500 tế bảo/mm3 ) là 7 ngảyl thiếu mảu, rụng
tóc, bưồn nôn, nôn mừa, viêm miệng, tiêu chảy và mệt mòi. Mức độ nghiêm trọng cùa các tảo
dụng phụ của đocetaxel có thể tăng lên khi docetaxel được dùng kết hợp với cảc thuốc hóa trị
khảc
Khi dùng kết hợp trastuzumab, cảc tảo dụng phụ (tất cả mức độ)_ > 10% đã được bảo cáo.
Tăng tỷ lệ tảo dụng phụ nghỉêm trọng (40% so với 31%) và tác dụng phụ độ 4 (34% so với
23%) ở nhóm dùng kết hợp với trastuzumab so với docetaxel đon trị lỉệu.
Khi dùng kết hợp với capecitabin, các tảc dụng phụ thường gặp nhất trong điếu trị (> 5%)
được bảo cáo trong một nghiên cứu gian đoạn 111 với bệnh nhân ung thư vú đã thất bại với
điếu trị bằng anthracyclin.
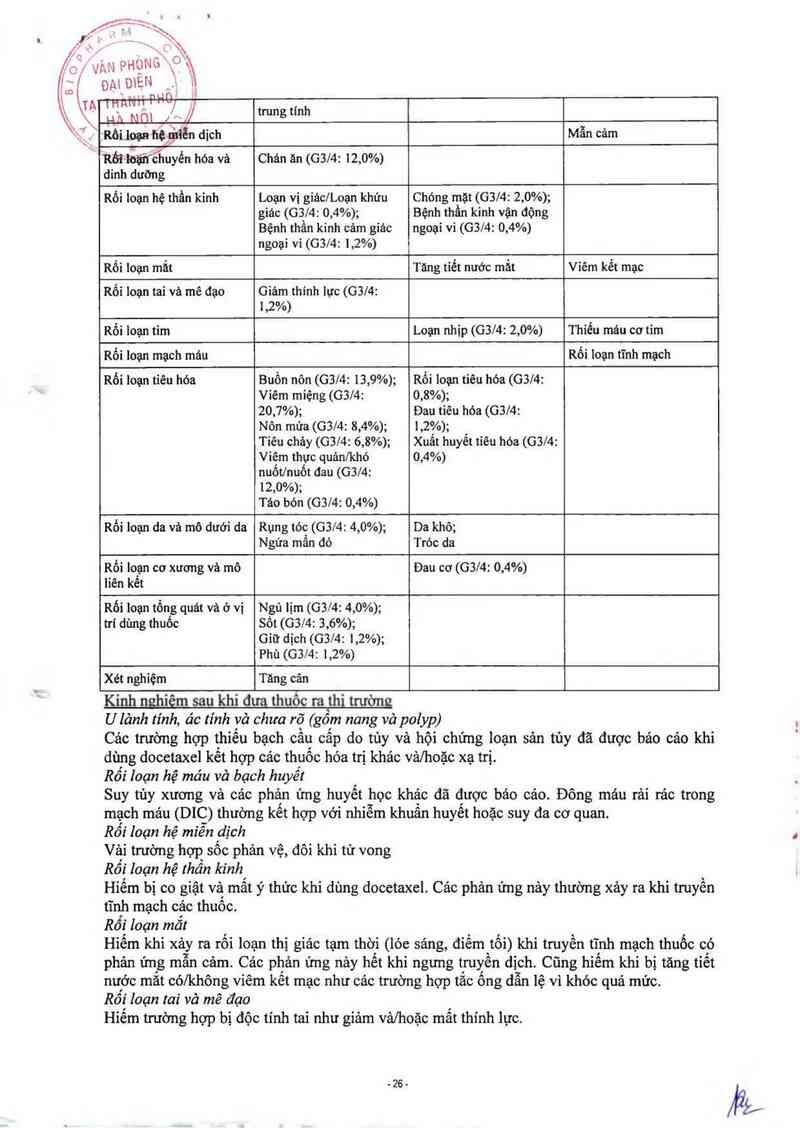
Cảo tảc dụng phụ sau thường thấy với docetaxel:
Rối loan hê thống miễn dich
Phản ửng mẫn cảm thường xảy ra vải phút sau khi bắt đầu truyền tĩnh mạch docetaxel, thương
ở mức độ nhẹ đến trung bình. Các triệu chứng thường được báo cáo nhất lá đỏ bừng mặt, nôi
mẩn đò có/không ngứa, nặng ngực, đau lưng, khó thờ, sốt hoặc lạnh run. Các phản ứng phụ
nặng là hạ huyết áp vảfhoặo co thắt phế quản hoặc nối ban đỏ toản thân.
Rối loan hê thẩn kinh
Khi có độc tính thần kinh ngoại vi nặng cần giảm liều dùng. Cảo dấu hiệu thần kinh cảm giảc
từ nhẹ đến trung bình gồm dị cảm, loạn cảm, đau hoặc nóng rải. Các rối loạn thần kinh vận
động chủ yêu là sự mệt mỏi
Rối loan da và mô dưới da
Cảo phản ứng dưới da thuận nghịch thường từ nhẹ đến trung binh. Các phản ứng đặc trưng lả
nổi mềm đó cục bộ chủ yếu trên bản tay và bản chân (bao gồm hội chứng tay chân nặng),
.15.
,_ì
€
phù tĩnh mạch, thoảt mạch và viếm tĩnh mạch.
Giữ dịch gồm có phù ngoại vi, và ít gặ P
’thế ở trên cánh tay, mặt hoặc ngực, và thường lả ngứa. Phảt ban thường xảy ra
vò g tuần sau khi truyền tĩnh mạch docetaxel. Cũng có báo cảo về cảc triệu chứng
ưug ít gặp như nổi ban đó rồi tróc da, hiếm khi cân phải ngưng dùng docetaxel. Cảo
^n móng nghiêm trọng gồm tãng hay giảm sắc tố, đôi khi đau và bong móng.
roi loan tổng guảt và vi trí dùng thuốc ` '
Cảo phản ứng tại vị trí truyền tĩnh mạch thường nhẹ, gôm tăng săc tố, viêm, đỏ hay khô da,
hơn là trản dịch mảng phối, trản dịch mảng tim, bảng
và tăng cân. Phù ngoại vì thường bắt đau' 0 chân rồi toản thân, tăng cân thêm 3 kg hoặc hơn.
Giữ dịch có tích lũy và nghiêm trọng.
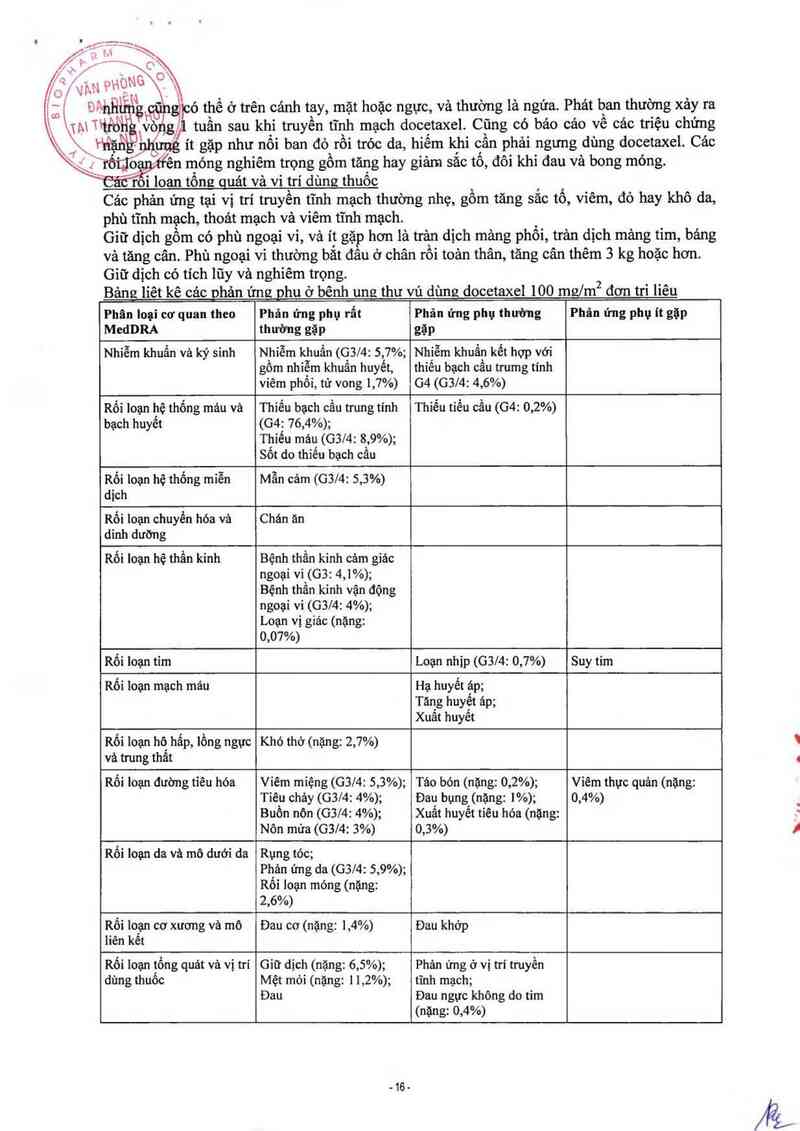
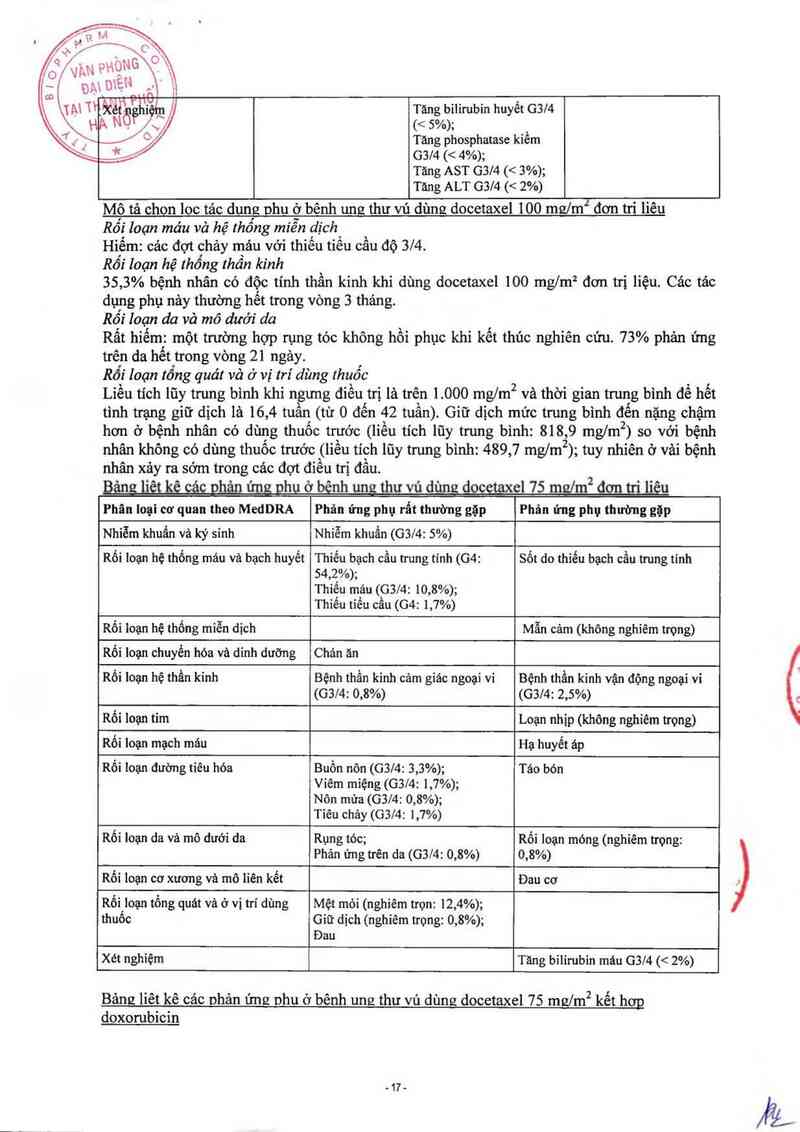
Bảng lỉêt kê cảc ohản ứng ghu ơ bênh ung thư vú dùng docetaxel 100 mưlm2 đơn tri liêu
liên kểt
Phân loại cơ quan theo Phán ứng phụ rẩt Phản ứng phụ thuimg Phản ửng phụ ít gặp
MedDRA thuừng gặp gặp
Nhiễm khuẩn và ký sinh Nhiễm khuẩn (0314: s,m; Nhịễm khuẩn kết hợp với
gồm nhiễm khuẩn huyết, thíêu bạch cẩu trumg tinh
vỉêm phồi, tử vong 1,7%) G4(63/414,6%)
Rối loạn hệ thống máu và Thỉếu bạch cầu trung tính Thiếu tiếu cầu (G4: 0,2%)
bạch huyêt (G4: 76,4%);
Thiếu máu (G3/4: 8,9%);
Sốt do thiếu bạch cầu
Rối loạn hệ thống miễn Mẫn cám (G3J4: 5,3%)
dịch
Rối loạn chuyến hóa và Chán ăn
dinh dưỡng
Rối loạn hệ thẩn kinh Bệnh thần kinh cảm giảc
ngoại vi(GBz 4,1%);
Bệnh thân kỉnh vận động
ngoại vi (03/4: 4%);
Loạn vị giác (nặng:
0,07%)
Rối loạn tim Loạn nhip (G3l4: 0,7%) Suy tim
Rối loạn mạch mảu Hạ huyết áp;
Tăng huyết áp;
Xuất huyết
Rối loạn hớ hấp, lồng ngực Khó thở (nặng: 2,7%)
và trung thât
Rối Ioạn đường tỉêu hóa Viêm míệng (GSM: 5,3%); Táo bón (nặng: 0,2%); Vỉêm thực quản (nặng:
Tiêu chảy (G3l4: 4%); Đaụ bụngjnặng: 1%); 0,4%)
Buồn nôn (63/4: 4%); Xuât huyết tiêu hóa (nặng:
Nôn mứa (G3l4: 3%) 0,3%)
Rối loạn da và mô dưới da Rụng tóc;
Phản ửng da (G3/4: 5,9%);
Rối loạn móng (nặng:
2,6%)
Rối loạn cơ xương và mô Đau cơ (nặng: 1,4%) Đau khớp
Rối loạn tổng quảt và vị trí
dùng thuốc
Giữ dịch (nặng: 6,5%);
Mệt mỏi (nặng: 1 1,2%);
Đau
Phản ửng ở vị trí truyền
tĩnh mạch;
Đau ngực không do tim
(nặng: 0,4%)
.16.
Tăng bilirubin huyết G3/4
(< 5%);
Tăng phosphatase kỉềm
G3/4 (< 4%);
Tăng AST G3J4 (< 3%);
Tăng ALT G3l4 (< 2%)
Mô tả chon loc tảc dung phu ở bênh ung thư vú dùng docetaxel 100 mgỊmTđơn tri liêu
Rối loạn máu vả hệ thống miễn dịch
Hiểm: các đợt chảy mảu với thiếu tỉếu cầu độ 3/4.
Rối loạn hệ thổng thần kinh
35,3% bệnh nhân có độc tính thần kinh khi dùng docetaxel 100 mglm² đơn trị liệu. Cảo tảo
dụng phụ nảy thường hết trong vòng 3 thảng.
Rối Ioạn da và mô dưới da
Rất hỉểm: một trường hợp rụng tóc không hồi phục khi kết thúc nghiên cứu. 73% phản ứng
trên da hết trong vòng 21 ngảy.
Rối loạn tống quát và ở vị trí dùng thuốc
Liều tich lũy trung bình khi ngưng điều trị là trên 1 000 ngm² và thời gian trung bình đề hết
tình trạng giữ dịch là 16,4 tuần (từ 0 đến 42 tuần). Giữ dịch mức trung bình đzến nặng chậm
hơn ở bệnh nhân có dùng thuốc trước (liều tich lũy trung binh: 818, 9 mg/m2 ) so với bệnh
nhân không có dùng thuốc trước (lỉều tích lũy trung bình: 489, 7 mg/rn2 ); tuy nhiên ơ vải bệnh
nhân xảy ra sớm trong cảc đợt đíếu trị đầu.
ẸfflpửgựJ_—JẺụmgeửbnhun thuvud =—Ẻm,ủmhgws ² '"u
Phân loại cơ quan theo MedDRA Phản ứng phụ rất thường gặp Phân ửng phụ thường gặp
Nhiễm khuẩn và ký sinh Nhiễm khuẩn (G3/4: 5%)
Rối loạn hệ thống máu vả bạch huyết ỊỊIÌỆẸ/l ẵ›ạch cẩu trung tính (G4: Sốt do thiếu bạch cầu trung tính
, 0 2
Thiếu máu (0374: 10,8%);
Thiêu tiều cầu (G4: 1,1%)
Rối loạn hệ thống miễn dịch
Mẫn cảm (không nghiêm trọng)
Rối loạn chuyến hóa vả dinh dưỡng
Chản ăn
Viêm miệng (G3l4: 1,7%);
Nôn mửa (G3/4: 0,8%);
Tỉêu chảy (6374: 1,7%)
Rối loạn hệ thần kinh Bệnh thần kinh cảm giác ngoại vi Bệnh thần kinh vận động ngoại vi
(G3l4: 0,8%) (G3l4: 2,5%)
Rối loạn tim Loạn nhịp (không nghiêm trọng)
Rối loạn mạch máu Hạ huyểt áp
Rối loạn đường tỉêu hóa Buồn nôn (03/4: 3,3%); Táo bón
Rối loạn da vả mô dưới da
Rụng tóc;
Phản ứng trên da (G3/4: 0,8%)
Rối loạn móng (nghiêm trọng:
0,8%)
Rối Ioạn cơ xương vả mô liên kểt
Đau cơ
Rối loạn tổng quảt vả ở vị trí dùng
thuốc
Mệt mỏi (nghiêm trọn: 12,4%);
Giữ dịch (nghiêm trọng: 0,8%);
Đau
Xét nghiệm
Tăng bilirubin máu G3/4 (< 2%)
Bảng liêt kê cảc nhản ứng Dhu ở bênh ung thư vú dùng docetaxel 75 mitlm2 kết hgp
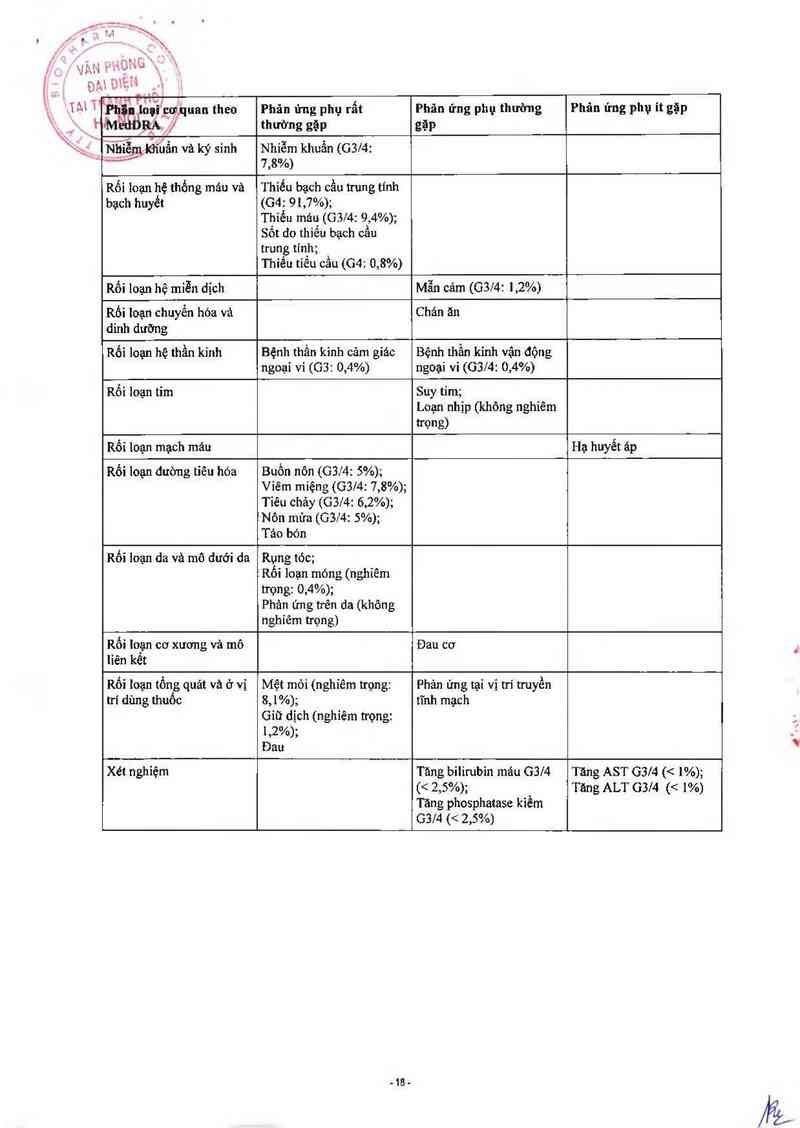
doxorubicin
.17.
/'0
v“… ở-O'ẮÙ "
)_ f: ~>
" _ Ni
_`
\
\
ỦN '()\Ệ_Ĩi , Y)
' ý…
1
Ỉ.
A~JL
n 4 ? HVJ .
P ị Ioạyu_gqa uau theo
Phản ửng phụ rẩt
Phản ứng phụ thường
Phân ứng phụ ít gặp
, , thường gặp gặp
` ÌĨIĨiẾ iẻi'ủản và sinh Nhiễm khuẩn (G3J4z
zợm ký ,ffl
Rối loạn hệ thống máu và
bạch huyết
Thiểu bạch cầu trung tính
(G4: 91,7%);
Thiếu máu (G3/4: 9,4%);
Sốt do thiếu bạch cầu
trung tính;
Thiếu tiếu cầu (G4: 0,8%)
ngoại vi (63: 0,4%)
Rối loạn hệ mỉễn dịch Mẫn cảm (G3/4: 1,2%)
Rối Ioạn chuyển hóa và Chán ăn
dinh dưỡng
Rối loạn hệ thần kinh Bệnh thần kinh cảm giác Bệnh thằn kỉnh vận động
ngoại vi (G314: 0,4%)
Rối loạn tim
Suy tim;
Loạn nhịp (không nghiêm
trọng)
Rối loạn mạch mảu
Hạ huyết áp
Rối loạn đường tiêu hóa
Buồn nôn (GS/4: 5%);
Viêm miệng (GSI4: 7,8%);
Tiêu chảy (G374: 6,2%);
Nôn mửa (G3/4: 5%);
Táo bón
Rối loạn da và mô dưới da
Rụng tóc;
Rối loạn mớng (nghiêm
trọng: 0,4%);
Phản ứng trên da (không
nghíêm trọng)
Rối loạn cơ xương và mô
liên kêt
Đau cơ
Rối loạn tổng quát vả ở vị
Mệt mỏi (nghiêm trọng:
Phản ửng tại vị trí truyền
tri dùng thuốc 8,1%); tĩnh mạch
Giữ dịch (nghiêm trọng:
1,2%);
Đau
Xét nghiệm Tăng bilirubin máu G3/4 Tăng AST G314 (< 1%);
(< 2,5%); Tăng ALT G3/4 (< 1%)
Tăng phosphatase kỉềm
G3/4 (< 2,5%)
Ả ' Bliân loại cơ quan theo Phân ứng phụ rất Phản ứng phụ thường Phân ứng phụ ít gặp
MedDRA thường gặp gặp
Nhiễm khuẩn và ký sính Nhiễm khuẩn (63/4:
5,7%)
Rối loạn hệ thống máu và Thíếu bạch cầu trung tinh Sốt do thiếu bạch cầu
bạch huyểt (G4: 51,5%); trung tính
Thỉếu máu (6374: 6,9%);
Thiếu tíếu cầu (G4: 0,5%)
Rối loạn hệ thống miễn Mẫn cảm (6374: 2,5%)
dich
Rối loạn chuyển hóa và Chán ăn
dinh dưỡng
Rối loạn hệ thần kinh Bệnh thần kinh cảm gỉác
ngoại vi(G3z 3,7%);
Bệnh thân kinh vận động
ngoại vi (G3/4: 2%)
Rối loạn tim Loạn nhịp (63/4: o,7%) Suy tim
Rối ioạn mạch máu Hạ huyết áp (03/4: 0,7%)
Rối loạn đường tiêu hóa Buồn nôn (63/4: 9,6%); Táo bón
Nõn mừa (G374: 7,6%);
Tiêu chảy (G3/4: 6,4%);
Viêm miệng (G3/4: 2%)
Rối loạn da vả mô dưới da Rụng tóc;
Rối ioạn móng (nghiêm
trọng: 0,7%);
Phản ứng trên da (G3/4:
0,2%)
Rối Ioạn cơ xương vả mô Đau cơ (nghiêm trọng:
liên kết 0,5%)
Rối Ioạn tổng quảt vả ở vị Mệt mòi (nghiêm trọng: Phản ứng tại vị trí truyền
trí dùng thuốc 9,9%); tĩnh mạch;
Giữ dịch (nghíêm ưọng: Đau
o,y%);
Sôt (G3/4: 1,2%)
Xét nghỉệm Tăng bilirubin máu G3/4 Tăng AST 6374 (0,5%);
(2,1%); Tăng phosphatase kiềm
Tăng ALT G3l4 (1,3%) G3/4 (0,3%)
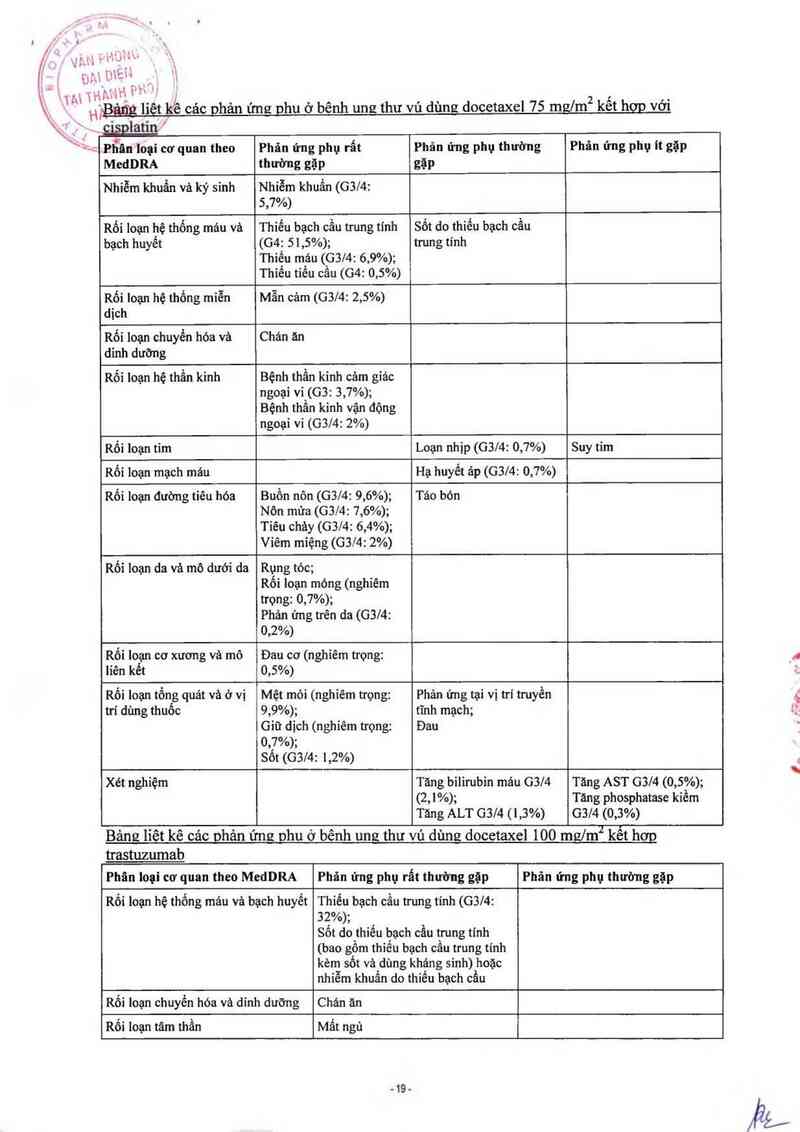
Bảng liêt kê cảc nhản ứng như ở bênh unghư vú dùng docetaxel 100 msz/m2 kết hơp
trastuzumab
Phân Ioại cơ quan theo MedDRA
Phản ứng phụ rất thường gặp
Phản ứng phụ thường gặp
Rối loạn hệ thống máu vả bạch huyết
32%);
Thiếu bạch cầu trung tinh ((53/4:
Sốt do thiếu bạch cầu trung tính
(bao gồm thỉếu bạch cầu trung tính
kèm sổt và dùng kháng sinh) hoặc
nhiễm khuấn do thỉểu bạch cầu
Rối loạn chuyển hóa vả dinh dưỡng
Chán ăn
Rối loạn tâm thần
Mất ngủ
.19.
/ỔJ .f' .
Q 7’ Ở Ảii
thuốc
niêm mạc, bệnh giống cúm; đau
ngực, lạnh run
MH iJỂ) i.ì
DLA Oựcì\ . ul 1
,,,…41°1x…
ìz`.ỏi lgẩịnthệthần kinh Dị cảm; Nhức đầu, loạn vị giác
ỊRếHoựrĩmẵt Tăng tíết nước mắt, viêm kết mạc
Ợ
ÌỈỗĩ'Ìỗẵh tỉm Suy tim
Rối ioạn mạch máu Phù mạch bạch huyết
Rối loạn hô hẳp, ngực, trung thất Chảy máu mũi, dau họng thanh
qụản, vỉêm mũi họng, khó thở, ho,
sô mũi
Rối loạn tiêu hóa Buồn nôn, tiêu chảy, nôn mửa, táo
bón, viêm mỉệng, rối loạn tiêu hóa,
đau bụng
Rối loạn da và mô dưới da Rụng tóc, nổi ban đó, mảy đay,
mỏng
Rối loạn cơ xương vả mô liên kết Đau cơ, đau khớp, đau chỉ, đau
xương, đau lưng
Rối loạn tổng quảt và tại vị trí dùng Mệt mỏi, phù ngoại vi, sốt, viêm Ngủ lịm
Xét nghiệm
Tăng cân
Mô tả chon loc cảc phản ứng phu ở bênh ung thư vú dùng docetaxel 100 mg/m² kết hơp với
trastuzumab
Rối loạn hệ thống máu vả bạch huyết
Rất thường gặp: Độc tinh huyết học tăng ở các bệnh nhân dùng trastuzumab vả docetaxel, so
với đơn trị liệu docetaxel (32% thiếu bạch cầu trung tinh độ 374 so với 22%, dùng tỉêu chuẩn
NCI-CTC). Lưu ỷ, đảnh giả nảy có thế thẩp hơn thục tế, vì đơn trị liệu docetaxel 100 111ng
gây thiếu bạch cầu trung tính ở 97% bệnh nhân, 76% độ 4, dựa trên công thức mảu lúc thắp
nhất. Tỷ lệ nhiễm khuẩn hoặc sốt do thỉếu bạch cầu trung tính tăng ở các bệnh nhân điều trị
bằng herceptìn + docetaxel (23% so vởi 17% đơn trị iiệu docetaxel).
Rối Ioạn tím
Suy tim có triệu chứng được bảo cảo ở 2,2% bệnh nhân dùng docetaxel + trastuzumab so với
0% bệnh nhân đơn trị liệu docetaxel. Ớ nhóm dùng docetaxel + trastuzumab, 64% đã dùng
anthracyclìn trước đó so với 55% ở nhóm chỉ dùng docetaxel.
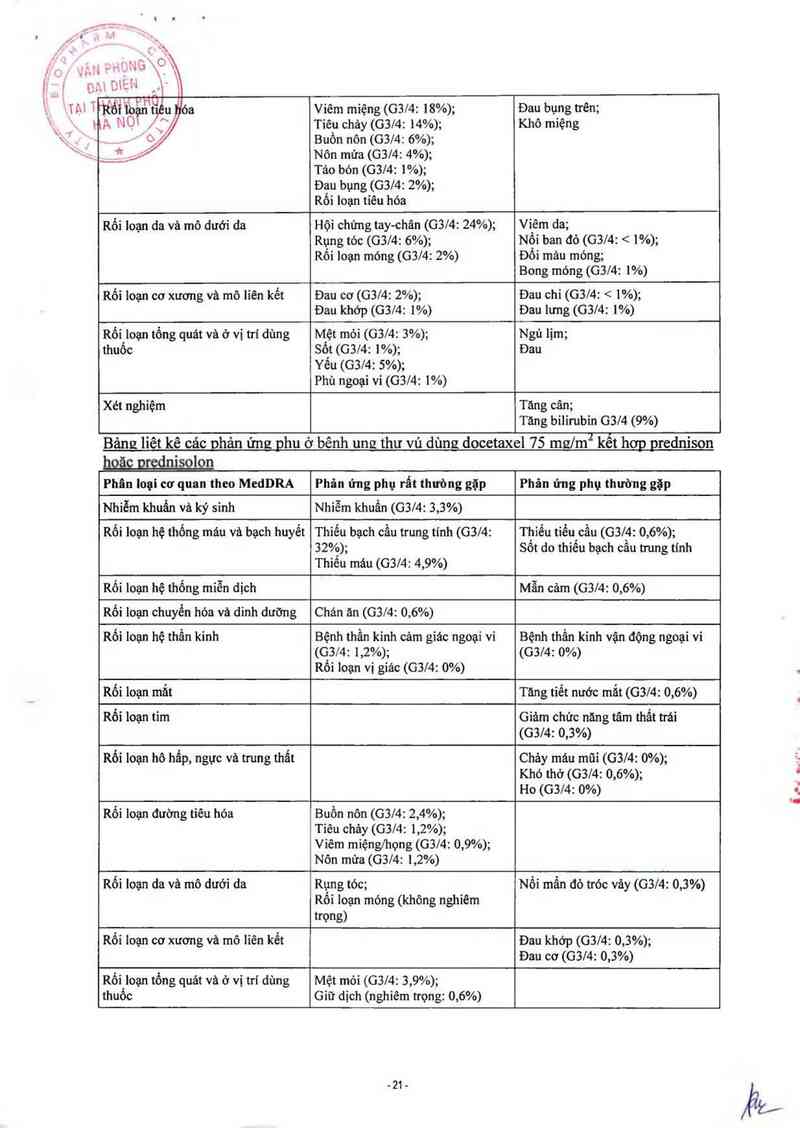
Bảng liêt kê cảc phân ứng phu ở bênh ung thư vú dùng docetaxel 75 mg/m2 kết hơp với
canecitabỉn
Phân loại cơ quan theo MedDRA Phản ứng phụ rẩt thường gặp Phản ửng phụ thường gặp
Nhiễm khuẩn và ký sinh Nhiễm candida miệng (G3/4: < 1%)
Rối loạn hệ thống máu vả bạch huyết
Thiếu bạch cầu trung tính (GSM:
63040;
Thiêu máu (G3/4: 10%)
Thiểu tiểu cẩu (6314: 3%)
Rối loạn chuyến hóa và dinh dưỡng Qhá.n ăn (G3/4: 1%); Mất nước (G3/4: 2%)
An kém ngon
Rối loạn hệ thằn kinh Loạn vị giác (0314: < 1%); Chóng tpặt;
Dị cảm (GB/4: < 1%) Nhức đâu (G3/4: < 1%);
Bệnh thần kinh ngoại vi
Rối loạn mắt Tăng tiết nước mắt
Rối loạn hô hấp, ngục vả trung thẳt
Đau họng thanh quân (GSM: 2%)
Khó thớ (G3/4: 1%);
Ho (G374: < 1%);
Chảy máu mũi (0374: < 1%)
.20.
If I.. …“
\
I
r…—
, :,i
.… …“…fo CĨ\
Ẹ'il rJii'Ắ N hẫịl\i
"mĩ
't
"
:`X
ttfổiủặẫĨ a Viêm miệng (6314: 18%); Đau bụng trẽn;
1A NOỂ Tiêu chảy (G3l4: 14%); Khô miệng
Buồn nôn (6314: 6%);
ỊỊ'I Nôn mửa (6314: 4%);
Táo bón (6314: 1%);
Đau bụng (G3/4: 2%);
Rối loạn tiêu hóa
Rối loạn da và mô dưới da Hội chứng tay-chân (G3/4: 24%); Viêm da;
Rụng tóc (6314: 6%); Nổi ban đó (6314: < 1%);
Rối loạn móng (G3/4: 2%) Đổi mảu móng;
Bong móng (G3/4: 1%)
Rối loạn cơ xương và mô liên kểt
Đau cơ (GSM: 2%);
Đau khớp (6314: 1%)
Đau chi (G3/4: < 1%);
Đau lưng (G3/4: 1%)
Rối loạn tống quảt và ở vi … dùng Mệt mòi (6314: 3%); Ngủ lịm;
thuốc Sốt (6314: 1%); Đau
Yêu (G3/4: 5%);
Phù ngoại vi (G3/4: 1%)
Xét nghỉệm Tăng cân;
Tăng bỉlirubin 6314 (9%)
Bảng liết kê cảc ghản ứng phu ở bếnh ung thư vú dùng docetaxel 75 mglm2 kểt hơp nrednison
…
Phân Ioại cơ quan theo MedDRA Phân ứng phụ rẩt thường gặp Phân ứng phụ thường gặp
Nhiễm khuẩn và ký sinh Nhiễm khuẩn (6314: 3,3%)
Rối loạn hệ thổng máu và bạch huyết
Thiếu bạch cầu trung tính (G3/4:
az%›:
Thiêu máu (G3/4: 4,9%)
Thiếu tiếchẳu (6314: 0,6%);
Sôt do thiêu bạch câu trung tính
Rối loạn hệ thống miễn dịch
Mẫn cảm (6314: 0,6%)
Rối loạn chuyển hóa và dinh dưỡng
Chán :… (6314: 0,6%)
Rối loạn hệ thẩn kinh
Bệnh thẩn kỉnh cảm gỉác ngoại vi
(G3l4: 1,2%);
Rối loạn vì gỉảc (G3/4: 0%)
Bệnh thần kinh vận động ngoại vi
(G3/4: 0%)
Rối loạn mắt
Tăng tiết nước mắt (6314: 0,6%)
Rối loạn tỉm
Giảm chức năng tâm thất trái
(G3l4: 0,3%)
Rối loạn hô hấp, ngực và trung thẩt
Chảy máu mũi (G3/4: 0%);
Khó thờ (6314: 0,6%);
Ho (G3/4: 0%)
Rối loạn đường tiêu hóa
Buồn nôn (6314: 2,4%);
Tiêu cháy (G3/4: 1,2%);
Viêm miệng/họng (6374: 0,9%);
Nôn mừa (G3/4: l,2%)
Rối loạn da và mô dưới da
Rụng tóc;
Rôi loạn móng (không nghiêm
trọng)
Nổi mẩn dò tróc vảy (G3/4: o,3%)
Rối Ioạn cơ xương và mô liên kểt
Đau khớp (G3/4: 0,3%);
Đau cơ (6314: 0,3%)
Rối loạn tổng quảt và ở vị trí dùng
thuốc
Mệt mói (GB/4: 3,9%);
Giữ dịch (nghỉêm trọng: 0,6%)
.21.
\
// á m
/…»
ổỉ/ẨJ À M P H 0 N GẺf"² `\
` E… DìÉN _ :
t…thfflH Ph’O 1“: , , _ , , , _
' liat kê các nhản ứng nhu 6 benh ung thư vu dung đocetaxel 75 rụglm ket hơp VOI
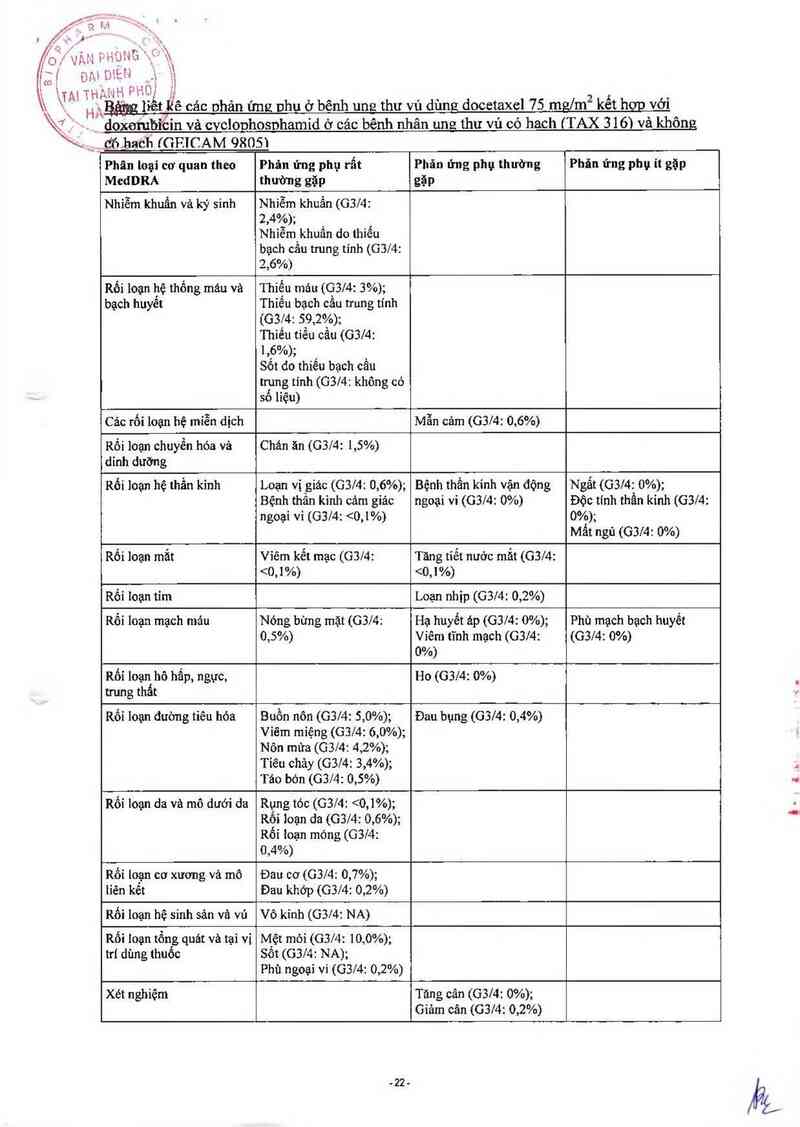
_ doxorubiếin vả cvclonhosnhamid ở các bênh nhân ung thư vú có hach (TAX 316) và không
' Ợfì.haéh rGFJCAM 9805)
\, _
H ›hx
_) `)
Phân Ioại cơ quan theo
Phản ứng phụ rẩt
Phân ứng phụ thường
Phân ứng phụ it gặp
bạch cầu trung tỉnh (G3/4:
2,6%)
MedDRA thường gặp gặp
Nhiễm khuẩn và ký sinh Nhíễm khuẩn (G3/4:
²,4%): _
Nhiêm khuân do thiếu
Rối loạn hệ thống máu và
bạch huyêt
Thiếu máu (G3/4: 3%);
Thỉếu bạch cằu trung tính
(Gẵz’4: 59,2%);
Thiếu tiều cẩu (G3/4:
1,6%);
Sốt do thiếu bạch cầu
trung tinh (G314: không có
số liệu)
Các rối loan hệ mỉễn dịch
Mẫn cảm (G314: 0,6%)
Rối loạn chuyển hóa và
dinh dưỡng
Chán ãn (0314: 1,5%)
Rối loạn hệ thần kỉnh
Loạn vị `giác (G314: 0,6%);
Bệnh thân kinh cảm giảc
ngoại vi (G314: 95%). Mặc dầu tương tảo in vìvo chưa được kiếm tra
.27.
,o/ /VẢN PHQNG "
ĐA)DiỄN ,4'; , . . … .. ả … :, … . .
,cảc tương tac … vưro vơi nhưng thuoc 11en ket chặt vơi protein như erythromycm,
nhdramin, propranolol, propafenol, phenytoin, salicylat, sulfamethoxazol vả natri
4 vai nh=không ảnh hưởng đến sự liên kết của docetaxel với protein. Docetaxel không ảnh
Ắ4hướ_Ịtg đến sự liên kết của digitoxin.
Dược động học của docetaxel, doxorubicin vả cyclophosphamid không ảnh hưởng khi dùng
đồng thời. Có ít số liệu từ một nghiên cứu không có kiếm soát đề nghị về sự tương tác giữa
docetaxel vả carboplatỉn. Khi kết hợp với docetaxel, thanh thải của carboplatỉn cao hơn 50%
so với đơn trị liệu carboplatỉn.
Dược động học docetaxel với sự hiện diện cùa prednison đã được nghiên cứu trên các bệnh
nhân ung thư tuyến tiền liệt. Docetaxel dược chuyến hóa bởi CYP3A4 vả prednisone được
biết là gây cảm ứng CYP3A4. Không thấy prednisolon ảnh hưởng đến dược động học của
docetaxel.
Nên dùng docetaxel thận trọng ở cảc bệnh nhân dùng đồng thời cảc chất ức chế CYP3A4
mạnh (như là chất ức chế protease như ritonavír, thuốc khảng nấm azol như ketoconazol hoặc
itraconazol). Một nghiên cứu về tương tảc thuốc đã được thực hiện ở bệnh nhân dùng
ketoconazol vả docetaxel cho thây thanh thải của docetaxel giảm % do ketoconazol, có lẽ là
do sự chuyến hỏa chủ yếu của docetaxel qua CYP3A4. Giảm dung nạp docetaxel có thể xảy
ra, ngay cả với liếu thấp.
[QUÁ LIÊU VÀ ĐIỀU TRỊ)
Chi có vải bảo cảo về quá liều. Không có thuốc giải độc do quá_ liều docetaxel. Một trường
hợp quá liều, bệnh nhân được giữ ở phòng săn sóc đặc biệt và kiểm soát các chức năng sông.
Khi quả liếu, cảc tác dụng phụ có thể trầm trọng. Dự đoản biến chứng quả liếu có thế là suy
tùy xương, độc tinh thần kinh ngoại vi và viêm niêm mạc. Bệnh nhân nên được điếu trị với 0-
CSF ngay khi phảt hìện dùng quá liếu. Có thể cần các biện pháp điều trị triệu chứng khác.
[BẢO QUÁN)
Bao bì gôc: Bảo quản 2 ~ 8°C, trảnh ảnh sảng.
Dịch truyền docetaxel: Nên dùng trong vòng 4 giờ ở nhiệt độ phòng (dưới 25°C)
[HẠN DỤNG] '
24 thảng kê từ ngảy ’sản xuât.
Không dùng khi thuôo đã quá hạn.
iĐÓNG Gót] Hộp 1 1ọ.
[NHÀ SẢN XUẤT) UÙ
TTY Bio harm Com an Limited- Chun Li Facto TUQ CỤC TR NG
p p y g ry P.TRUớNG PHÒNG
[ĐỊA CHỈ NHÀ MÁY] /V yuỵen Jẳ1y Ĩf`nỵ
No. 838, See 1, Chung—Hwa Rd, Chung- Li City, Taoyuan County, Taiwan, R. 0. C.
[ĐỊA CHỈ VĂN PHÒNG]
3F., No.3-l, Yuanqu St., Nangang Dist.,Taipei City 11503, Taiwan, R.O.C.
Tel: +886—2-2652-5999
Fax: +886-2-2652-5981
.28-
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng