













Jfaz [M…
Ể VĂN PI-NR
ẳ( ĐAI DIỆN
© TẬIT.PHÀ Nộ
ủn nén nao phim Hộp 1 lọ 70 vu0n Mỗi viên chứa
405 mg lapahnib ditosylate monohydrate tương mung
vùi 250 mg lapatinit: đang base tu do
sá lo sx, usx. HD: xem LOT_ MANF EXP tren hno
bì Băn quln khỏng quả 30°C
Sin xuất bởi: Glaxo Operatz'cns UK Ltmiteđ Pncry
Smct Ware. Henfordshre 5612 00.1 UK
Đủng gút bòt: GiamSmithKlino Auaralta Pty Ltd, 1m1
Mountain Hig1wny, Bomnin, Victoria 3155, Awtratia
DNNK:
Chi qm». chóng chl đlm clch dủng vù dc thông
tln khtc: xem to hưởng đẫn sủ o.mg
grc kỷ nướng dln sử dụm trước khi đũng
u tìm u riom
4/se (oznaầỵ)
VĂN PHÒNG
ĐAI DIỆN
/ ~ tlpetinib dang bau tụ đo
~ ~. J NSX. HD: xem LOT. MANF. EXP trén bao
| No quin: khỏng quá 30°C
Sin xuđt bời: Glaxo Operations UK Limited. Pliory
Strent_ Ware, Herifomnhira. SG12 ODJ. UK
an gól bởi: GI…cSmltnKllne Australia Fty Ltd,
1061 Mauman Highwny. Bomnla. Victoria 3155.
Australia
DNNK:
Cùi đhh, chan chi qmu, cách dùng vì dc mong
tin khiczxemtơ hương đân sữmng.
grekỷiwớuwđlnnừđụngfflkhldừnơ\ủ
númtgtdom TYKIvaxxx
U
Ả/Ổj (oẵn ỄĨMJ
VĂN PHÒNG
RX ĐAI DIỆN
TYKERBTM
Lapatinib Ditosylat Monohydrat
Thuốc bán theo đơn
THÀNH PHẦN
Mỗi viên nén bao phim chứa Iapatinib ditosylat monohydrat, tương đương với 250 mg lapatinib.
Tá dược: Celulose vi tinh thề. povidon, natri starch glycolat, magnesi stearat, Opadry Yellow YS-1-
12524-A (chứa hypromelose, titan dioxid. macrogollPEG 400, polysorbat BO, oxit sắt vảng, oxit sắt
đỏ).
DẠNG BÀO CHẾ
Viên nén bao phim.
Viên bao phim mảu vảng hinh oval, hai mặt lồi, một mặt trơn vả mặt đối diện được khắc chữ GS
XJG.
QUY CÁCH ĐỎNG GÓI
Hộp 1 lọ 70 hoặc 84 viên nén bao phim.
CHỈ ĐỊNH
TYKERB, kêt hợp với capecitabine, được chỉ định trong cũèu trị bệnh nhân bị ung thư vú tiến triến
hoặc di căn, với khối u có bộc lộ quá mức HER2/neu (ErbB2) và đã được nhận phác đồ điều trị
gồm cả trastuzumab trước đó (xem Các nghiên cứu Lâm sâng).
TYKERB, kết hợp với trastuzumab, được chỉ định trong điều trị bệnh nhân bị ung thư vú di ' với
khối u có bộc lộ quá mức HER2lneu (ErbB²) và bệnh tiên triển khi đã đượềỳđiềt/c `_ bằng
trastuzumab và hóa trị liệu (xem Các nghiên cứu lâm sảng). V
TYKERB, kết hợp với chảt ức chế aromatase, được chỉ định trong điều trị ung thư vú di cản có thụ
thể nội tiết dương tính ở phụ nữ sau mãn kinh vả không có dự định được điều trị bằng hóa trị liệu.
(xem Các nghiên cứu lâm sảng). Chưa có dữ Iiệu về hiệu quả của phối hợp nảy so với
trastuzumab phối hợp với chất ức chế aromatase
uEu LƯỢNG vÀ CÁCH DÙNG
Chỉ nẻn bắt đầu điều trị với TYKERB bởi một bác sỹ đã có kinh nghiệm sử dụng các thuốc] hóa
chắt chống ung thư.
Cảc khối u có bộc lộ HER2 (ErbB²) quá mức được xác định bởi sự khuếch đai gen riêng lẻ hoặc
kèm theo IHC3* hoặc IHC2Ĩ Tinh trạng HER2 nên được xác định bằng cách sử dụng cảc
phương pháp chính xác và đã được thắm định.
L^L~Ầ
/; .
r-
S
/1
A
Trước khi bắt đầu điều trị, cần phải đánh giá phân suất tống mảu thết trải (LVEF) để đảm bảo
LVEF ban đầu nằm trong giởi han cơ bản] quy ước binh thường (xem Cảnh báo vả Thận trọng).
Cần tiếp tục theo dõi giá trị LVEF trong suốt quá trình điều trị với TYKERB để đảm bảo rằng LVEF
khỏng giảm dưới mức thầp của giới hạn cơ bản] quy ước binh thường (xem phân trì hoãn liều vá
giảm Iiều — các biến cố trên tim).
Nên uống TYKERB ít nhắt 1 giờ trước khi ăn hoặc ít nhắt 1 giờ sau khi ăn (xem Tương tác và
Dược động học — Hẩp thu).
Không nên uống bù các liều đă quẻn và nên tiếp tục lại vởi liều hảng ngáy tiếp theo như Iiệu trinh
đã định (xem Quá iiều).
Tham khảo thỏng tin kê toa đầy đủ của thuốc dùng đồng thời để biết thèm chi tiết có Iiên quan về
Iiều dùng, chống chỉ định vả thông tin an toản của thuốc đó.
TYKERB kết họp với capecitabine
Liều khuyến cảo của TYKERB lả 1.250 mg (tương đương 5 viên) một lầnlngảy, dùng liên tục khi
kết hợp Với capecitabine.
Liều khuyến cảo của capecitabine lả 2.000 mglm²lngảy, chia lảm 2 lằn dùng cách nhau 12 giờ từ
ngảy 1 đến ngảy 14 trong một liệu trình điều trị 21 ngảy (xem Các nghíén cứu iâm sảng). Nên
uống capecitabine trong khi ản hoặc trong vòng 30 phút sau khi ăn.
TYKERB kết họp với trastuzumab
Liều khuyến cảo của TYKERB là 1.000 mg (tương đương 4 viên) một lầnlngáy, dùng Iièn tục khi
kết hợp với trastuzumab.
Liều khuyến cáo của trastuzumab lả 4 mglkg truyền tĩnh mạch (IV) liều tấn công khởi đầu, sau đó
dùng liều 2 mglkg truyền tĩnh mach háng tuần (xem Các nghiên cứu lâm sáng).
TYKERB kết hợp vói chẩt ửc chế aromatase
Liều khuyên các của TYKERB lả 1,500 mg (tương đương 6 viên) một iầnlngảy, dùng iiẻn tục khi
kết hợp với chất ức chế aromatase.
lẻ 25 mg một lầnlngảy. Nêu dùng đồng thời TYKERB với cảc chẩt ức chế aromatas ' ,Jhăy
tham khảo thỏng tin kê toa đầy đủ của thuốc đó để biết chi tiết về liều dùng.
Khi dùng đồng thời TYKERB với chắt ức chế aromatase lả Ietrozole, Iiều khuyến cáo cúỀletrozote
Trì hoãn iiêu về giảm liều (tất cả các chi đ_mh)
Các biến cố trên tim (xem Cảnh báo vả Thận trọng)
Nèn ngừng sử dụng TYKERB ở những bệnh nhản có cảc triệu chứng đi kèm với giảm LVEF độ 3
hoặc cao hơn theo Tiêu chuẩn Thuật ngữ phổ biến của Viện Ung thư Quốc gia về cảc tác dụng
không mong muốn (NCI CTCAE- National Cancer Institute Common Terminology Criteria for
Adverse Events) hoặc nếu giá trị LVEF của họ tụt xuống dưới mức thấp của giới hạn cơ bản/ quy
ườc binh thường. Có thể bắt đầu dùng lại TYKERB tại một liều thắp hơn (giảm từ 1.000 mglngảy
xuống 750 mgingảy, từ 1.250 mg/ngảy xuống 1.000 mglngảy hoặc từ 1.500 mglngảy xuống 1.250
mg/ngảy) sau một khoảng thời gian tối thiểu 2 tuần và nếu giá trị LVEF trở lại binh thường và bệnh
nhản không có triệu chừng. Dựa trên các số liệu hiện tại, phần lớn tinh trạng giảm LVEF xảy ra
trong vòng 12 tuần đầu điều trị, tuy nhiên cảc số liệu về sự phơi nhiễm trong thới gian dải còn hạn
chế.
Bệnh phổi mỏ kẽ/ viêm phổi (xem Cảnh báo vá Thận trọng về Các tác dụng không mong muốn)
Nên ngừng điều trị TYKERB ở những bệnh nhân có các triệu chứng phối gợi ý/ chỉ điếm cho bệnh
phổi mô kẽ] viêm phổi độ 3 hoặc cao hơn theo NCI CTCAE.
Tiêu chảy (xem Cánh báo vá Thận trọng vả Tác dụng khóng mong muốn)
Nên ngừng sử dụng TYKERB ở bệnh nhảm tiêu chảy độ 3 theo NCI CTCAE hoặc đỏ 1 hoặc 2 với
cảc biểu hiện phức tạp (đau quặn bụng mức độ vừa đền nặng. buồn nôn hoặc nôn nhiều hơn
hoặc tương đương độ 2 theo NCI CTCAE, giảm khả năng hoạt động, sốt, nhiễm trùng huyết, giảm
bạch cầu trung tính, máu tươi trong phân hoặc mất nước). Có thể dùng lại TYKERB ở liều thắp
hơn (giảm từ 1.000 mglngảy xuống 750 mglngảy, từ 1.250 mglngảy xuống 1.000 mglngảy hoặc từ
1.500 mglngảy xuống 1.250 mg/ngảy) khi tiêu chảy giảm xuống độ 1 hoặc thắp hơn. Nên ngừng
dùng TYKERB vĩnh viễn ở bệnh nhân tiêu chảy độ 4 theo NCI CTCAE.
Những độc tính khác
Có thể cản nhắc ngừng hoặc dùng gián đoạn liều điều trị của TYKERB khi bệnh nhân có biểu hiện
độc tính cao hơn hoặc bằng độ 2 theo NCI CTCAE. Có thể bắt đầu sử dụng lại ở mức Iièu chuẩn
1.000 mglngảy, 1.250 mglngảy, hoặc 1.500 mglngảy khi biểu hiện độc tính được cải thiện về độ 1
hoặc thấp hơn. Nếu độc tinh tải xuắt hiện, thì nên bắt đầu điều trị lại bằng TYKERB ở một liều
thắp hơn (giảm từ 1.000 mg/ngảy xuống 750 mg/ngảy, từ 1.250 mglngảy xuống 1,000 mglngảy
hoặc từ 1.500 mglngảy xuống 1.250 mg/ngảy).
Nhóm bệnh nhân
Suy thận
Chưa có kinh nghiệm về điều trị TYKERB cho bệnh nhân suy thận nặng, tuy nhiên bệnh nhản suy
thận chưa hẳn cản điều chinh Iiều TYKERB do dưới 2% Iiêu sử dụng (Iapatinib và các chất chuyến
hóa) được thải trừ qua thận (xem Dược Động học - Nhóm Bệnh nhân đặc biệt).
Suy gan
Lapatinib được chuyến hóa tại gan Suy gan trung binh vả nặng đi kèm vởi tảng phơi nhiễm toản
thân với thuốc lẻ 85% và 56% tương ứng. Nên thận trọng sử dụng TYKERB ở những Vnhân
suy gan do tăng phơi nhiễm với thuốc (xem Cảnh báo và Thận trọng và Dược Động học— Nhỏm
bệnh nhân đặc biệt).
Nẻn giảm liều TYKERB cho bệnh nhân suy gan nặng (Child-Pugh Nhóm C). Có thể dự đoán rằng
giảm Iiều từ 1.250 mglngảy xuống 750 mglngảy hoặc từ 1.500 mg/ngảy xuống 1.000 mglngảy cho
bệnh nhân suy gan nặng sẽ điều chinh diện tich dưới đường cong (AUC) về khoảng bỉnh thường.
Tuy nhiên, không có dữ liệu lâm sảng về sự chỉnh Iièu nảy ở bệnh nhảm suy gan nặng (xem Cảnh
báo và Thận trọng vả Dược động học — Nhóm bệnh nhân đặc biệt).
Trẻ em
LA )
Chưa thiết lập được tính an toản vả hiệu quả của TYKERB ở bệnh nhi.
Người cao tuổi
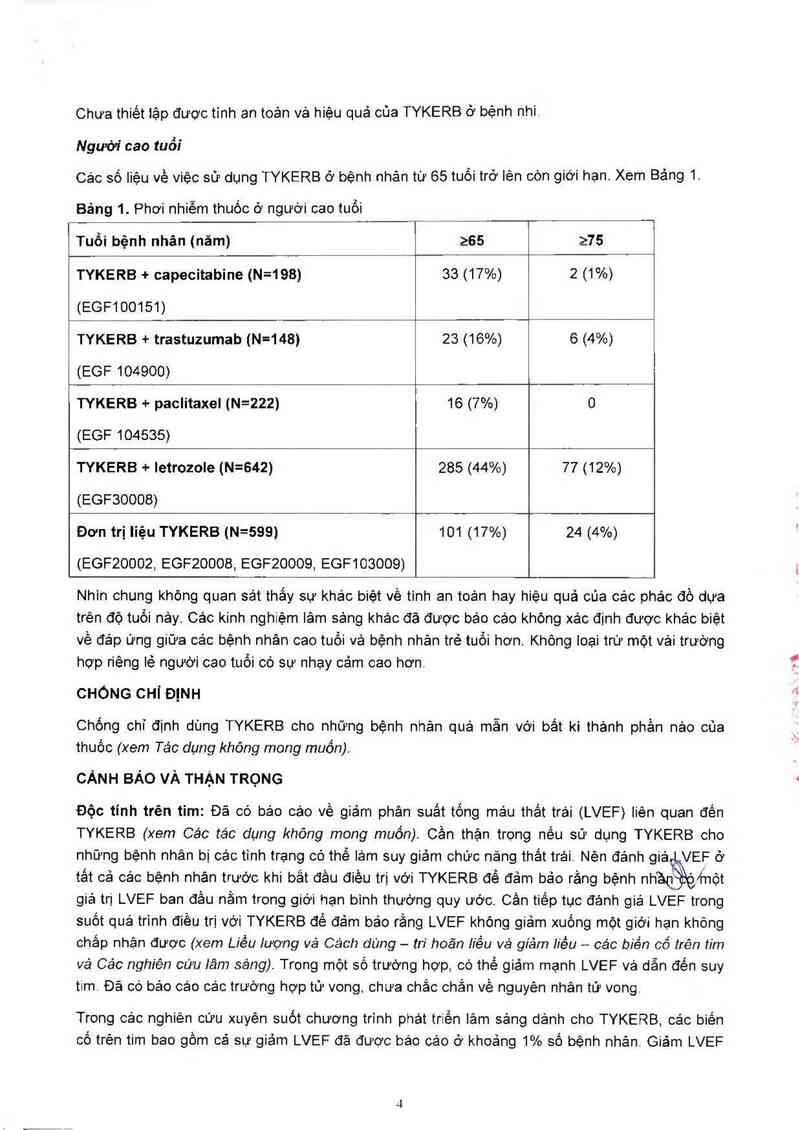
Các số liệu về việc sử dụng TYKERB ở bệnh nhản từ 65 tuối trở lên còn giới hạn. Xem Bảng 1.
Bảng 1. Phơi nhiễm thuốc ở người cao tuồi
Tuổi bệnh nhân (năm) 265 275
TYKERB + capecitabine (N=198) 33 (17%) 2 (1%)
(EGF100151)
TYKERB + trastuzumab (N=1481 23 (16%) 6 (4%)
(EGF 104900)
TYKERB + paclitaxel (N=222) 16 (7%) 0
(EGF 104535)
TYKERB + letrozole (N=642) 285 (44%) 77 (12%)
(EGFSOOOB)
Đơn trị liệu TYKERB (N=5991 101 (17%) 24 (4%)
(EGFZOOOZ, EGFZDOOS, EGFZOOOS, EGF1OSOOS)
Nhìn chung không quan sát thắy sự khảo biệt về tinh an toản hay hiệu quả của các phác đồ dựa
trên độ tuốt nảy. Các kinh nghiệm lâm sảng khác đã được béo cáo khõng xác định được khảo biệt
về đáp ứng giữa cảc bệnh nhân cao tuổi và bệnh nhân trẻ tuổi hơn. Không Ioại trừ một vải trường
hợp riêng lẽ người cao tuồi có sự nhạy cảm cao hơn
CHỐNG cnỉ ĐỊNH
Chống chỉ định dùng TYKERB cho những bệnh nhân quả mẫn vởi bầt ki thảnh phẩn nảo của
thuốc (xem Tác dụng khỏng mong muốn).
CÀNH BÁO VÀ THẬN TRỌNG
Độc tính trên tim: Đã có báo cáo về giảm phân suất tống mảu thắt trái (LVEF) liên quan đến
TYKERB (xem Các tác dụng khỏng mong muốn). Cần thặn trọng nếu sử dụng TYKERB cho
những bệnh nhân bị cảc tinh trạng có thế lảm suy giảm chức năng thất trái. Nên đánh giá VEF ở
tắt cả các bệnh nhân trưởc khi bắt đầu điêu trị vởi TYKERB để đảm bảo rằng bệnh nhầnẾềgfmột
giá trị LVEF ban đầu nằm trong giởi hạn bình thường quy ước. Cần tiếp tục đảnh giá LVEF trong
suốt quá trinh điều trị vởi TYKERB để đảm báo rằng LVEF không giảm xuống một giới hạn không
chấp nhận được (xem Liều tượng và Cách dùng - trì hoãn it'ẻu vả giảm liều … các biển cố trên tim
vả Các nghiên cứu lâm sảng). Trong một số trường hợp, có thể giảm mạnh LVEF và dẫn đến suy
tim. Đã có bảo cáo các trường hợp tử vong, chưa chắc chắn về nguyên nhân tử vong
Trong các nghiên cứu xuyên suốt chương trinh phát triền lảm sảng dảnh cho TYKERB, cảc biến
cố trên tim bao gồm cả sự giảm LVEF đă được báo cáo ở khoảng 1% số bệnh nhán Giảm LVEF
có triệu chứng được quan sải thẩy ở khoảng 0,3% bệnh nhân dùng TYKERB. Tuy nhiên, trong thử
nghiệm then chốt, khi dùng TYKERB kết hợp với trastuzumab trong điều trị di căn, tỉ lệ mắc biến
cố trên tim kể cả giảm LVEF lả cao hơn (7%) so vởi nhóm dùng TYKERB đơn trị liệu (2%). Các
biến cố trên tim quan sát thẩy trong nghiên cứu nảy, về bản chất vả mức độ nặng, lả tương tư với
cảc báo cáo trưởc đó với TYKERB.
Chưa có nghiên cứu chuyên biệt nảo để đảnh giá khả năng gây kéo dải khoảng QT của lapatinib.
Một tỉ lệ nhỏ có tăng khoảng QTc phụ thuộc nồng độ đã quan sảt thắy trong nghiên cứu tăng liều
lapatinib theo bậc thang, mở nhãn, không đối chứng trẻo bệnh nhân ung thư tiến triển, như Vậy
ảnh hưởng đên khoảng QT iả không thể loại trừ. Thận trong khi dùng TYKERB trên bệnh nhân
trong tinh huống có thể gây kéo dải khoảng QT (bao gồm hạ kali máu, hạ magnesi mảu, hội chứng
QT dải bầm sinh, hoặc phối hợp với các thuốc khảo được biết lá có gây kéo dải khoảng QT). Hạ
kali mảu hoặc hạ magnesi máu cần được điều chỉnh trưởc khi điều trị. Nên cân nhắc đo khoảng
QT trên điện tâm đồ trưởc khi bắt đầu và trong quá trình điều trị bằng TYKERB.
Bệnh phỗi mô kẽ vả viêm phổi: TYKERB có liên quan đến cảc báo cáo về bệnh phối mò kê và
viêm phổi (xem Tác dụng khóng mong muốn). Bệnh nhân nên được theo dõi cảc triệu chứng tại
phổi bộc lộ bệnh phổi mỏ kẻ/viẽm phổi {xem Liều lượng và Cách dùng). Bệnh nhân nên được theo
dõi sải các triệu chứng của nhiễm độc phồi (khó thở, ho, sốt) vả ngừng điêu trị nếu bệnh nhân có
cảc triệu chứng N01 CTCAE độ 3 hoặc nặng hơn. Nhiễm độc phối có thể nặng vả dẫn đến suy hô
hấp. Đã có trường hợp tử vong được báo cáo, nguyên nhân tử vong chưa xảc định
Độc tinh trên gan: Đã quan sát thắy độc tính trẻn gan (ALT hoặc AST lớn hơn 3 lần giởi hạn trẻn
của mức binh thường vả bitirubin toản phần lởn hơn 1.5 lần giới hạn trẻn của mức bình thường)
trong cảc thử nghiệm lâm sảng (<1% số bệnh nhân) vả kinh nghiệm sau khi lưu hảnh thuốc. Độc
tính trên gan có thể nặng vả đã có báo cáo tử vong, mặc dù chưa chắc chắn có liên quan đến
TYKERB. Độc tính trèn gan có thể xuất hiện vải ngảy đến vải tháng sau khi bắt đầu điều trị. Nên
theo dỏi các xét nghiệm kiếm tra chức năng gan (transaminase, bilirubin vả alkaline phosphatase)
trước khi bắt đầu điều trị, mỗi 4 đền 6 tuân trong suốt quá trình điều trị, vả theo biếu hiện lâm
sảng. Nếu có thay đồi chức năng gan nghiêm trọng, nên ngừng sử dụng TYKERB vả khỏng nên
điêu trị lại cho bệnh nhân bằng TYKERB Bệnh nhân mang các a-len HLA DQA1*O2ỊO1 vả
DRB1'07101 có nguy cơ tăng độc tinh trèn gan Iiên quan đến lapatinib. Trong một thử nghiệm lâm
sảng qui mô lởn, ngẫu nhiên dùng TYKERB đơn trị liệu (n=1194), nguy cơ toán bộ tốn thương gan
nặng (ALT > 5 lần giởi hạn bình thường trẻn, độ 3 theo NCI CTCAE) lá 2% (1:50), nguy cơ trong
nhóm mang các a-len DOA1'02101 vả DRB1*0701 lả 8% (1:12) vả nguy cơ trong nhóm khỏng
mang các a-len náy là 0,5% (1:200). Người mang cảc a-Ien HLA nguy cơ náy lá phổ biền đến
25%) ở người da trắng, châu Ả, châu Phi vả người Tây Ban Nha vả Bồ Đảo Nha nhưng\ẵ
(1%) ở người Nhật Bản.
'n
Khuyến cảo giảm liều nếu dùng TYKERB cho bệnh nhân đã bị suy gan nặng trưởc đó, Ở bệnh
nhân có phát triển độc tính trên gan nghiêm trọng trong khi điều trị, nẻn ngừng dùng TYKERB vả
không nên điều trị lại cho bệnh nhân bằng TYKERB (xem Líều iượng vá cách dưng vả Duoc động
học — Nhóm bệnh nhân đặc biệt).
Tiêu chảy: Đã có báo cảo về tiêu chảy, bao gòm cả tiêu chảy nặng khi điều trị với TYKERB (xem
Tác dụng không mong muốn). Tiêu chảy có thể đe dọa tinh mạng nếu có kèm theo mắt nước. suy
thận, giảm bạch cầu vảlhoặc mầt cân bầng điện giải, vả đă có các ca tử vong được báo cáo. Tièu
chảy thường xảy ra sớm khi điều trị Với TYKERB, hầu như phân nửa số bệnh nhân nảy bị tiêu
chảy lần đầu trong vòng 6 ngảy. Tiêu chảy thường kéo dải 4-5 ngảy. Tiêu chảy do TYKERB
thường là cắp độ nhẹ, dười 10% số bệnh nhân bị tiêu chảy nặng độ 3 vé dưới 1% số bệnh nhân bị
tiêu chảy nặng độ 4 theo NC! CTCAE. Phảt hiện và can thiệp sớm lả điều then chốt cho việc kiểm
soát tối ưu tình trạng tiêu chảy. Nên hướng dẫn bệnh nhản báo cáo ngay bắt kì sự thay đối nảo ở
đường ruột. Khuyến cảo nên nhanh chóng điều trị tiêu chảy với các thuốc chống tiêu chảy như
Ioperamide sau lần đầu tiên đi tiêu phản không thảnh khuôn. Các trường hợp tiêu chảy nặng có
thể yêu cầu phải sử dụng các dung dịch vả chải điện giải uống hoặc truyền tĩnh mạch, sử dụng
thuốc kháng sinh như fluoroquinolone (đặc biệt nêu tiêu chảy dai dắng trên 24 giờ. có sốt, hoặc
giảm bạch cầu trung tính đó 3 hoặc 4) vả gián đoạn hoặc ngừng điều trị với TYKERB (xem Liều
iượng vá Cách dùng — trì hoãn ii'ềư và giám tiều — tiêu chảy).
Điều trị đồng thời vởi các chẳt ức chế hoặc cảm ứng CYP3A4:
Trảnh điều trị đồng thời với cảc chảt cảm ứng CYP3A4 do nguy cơ lám giảm phơi nhiễm với
Iapatinib (xem Tương tác).
Tránh điều trị đồng thời với các chât ức chế mạnh CYP3A4 do nguy cơ lảm tăng phơi nhiễm với
lapatinib (xem Tương tác).
Tránh dùng nước ép bưởi trong quá trinh điều trị với TYKERB (xem Tương tác).
Tránh phối hợp TYKERB với các thuốc dùng đường uống có khoảng điều trị hẹp lả cơ chầt của
CYP3A4 vả/hoặc CYPZCS (xem Tương tác).
Tránh điều trị đổng thời với các chất Iảm tảng pH dạ dáy. do Iám giảm độ hòa tan vả hảo thu cùa
Iapatinib (xem Tương tác)
TƯỜNG TÁC
Lapatinib được chuyền hóa chủ yếu bới CYP3A (xem Duợc Động học). Do vậy, các chắt ức chế
hoặc cảm ưng các enzyme nảy có thể ảnh hưởng đẻn dược động học của lapatìnib
Nên thận trong khi sử dụng TYKERB đồng thời với cảc chất được biết ức chế CYP3A4 (ví dụ
ketoconazole, itraconazole hoặc nước bưởi) vả nên theo dõi chặt chẽ đáp ứng lảm sảng vá các
tác dụng không mong muốn (xem Cảnh báo và Thận trọng). Nếu bệnh nhân buộc phái sử dụng
cùng với một chải ức chế mạnh CYP3A4, dưa vảo cảc nghiên cứu dược động học, có thể dự
đoán rằng giảm Iiều TYKERB xuống 500 mglngảy sẽ điều chinh AUC của lapatinib đến khoảng
AUC tương tư quan sát được khi không bị ảnh hưởng bởi chắt ức chế về nên xem xét vi"c giảm
Iièu TYKERB xuống 500 mg/ngảy. Tuy nhiên, không có dữ liệu iâm sảng về việc điều I lịèu
nảy ở những bệnh nhản dùng cảm chắt ức chế mạnh CYP3A4. Nêu ngừng sử dụng chất ức chế
mạnh, nên dảnh một giai đoạn lảm sạch thuốc khoảng 1 tuần trước khi điều chỉnh tiều TYKERB
1ẻn mức Iiều được chỉ định.
Nên thận trọng khi sử dụng TYKERB đồng thời với các chât được biết cảm ưng CYP3A4 (ví dụ
rifampin, carbamazepine, hoặc phenytoin) vả nên theo dõi chặt chẽ đáp ưng lảm sảng vả cảc tác
dụng không mong muốn (xem Cảnh báo vá Thận trọng). Nếu bệnh nhân buộc phái sử dụng cùng
với một chât cảm ứng manh CYP3A4, dưa vảo các nghiên cứu dược động học, nẻn dò liều
TYKERB dần dần từ 1250 mglngảy lên đến 4500 mglngảy hoặc từ 1500 mglngảy đến 5500
mglngảy dựa trên khả năng dung nạp. Liều TYKERB nảy được dự đoán sẽ điều chỉnh AUC của
lapatinib đến khoảng AUC quan sát được khi không bị ảnh hưởng bởi các chất cảm ứng vả điều
nảy cần được cân nhắc. Tuy nhiên, không có dữ Iiệu lâm sáng về việc điêu chỉnh Iiều nảy ở những
bệnh nhản dùng các chắt cảm ứng mạnh CYP3A4. Nền ngừng sử dụng chất cảm ứng mạnh, nên
giảm liêu dùng cùa TYKERB trong khoảng 2 tuần trước khi trở về liêu chi đinh.
Điều trị trước đó với chất ức chế bơm proton (esomeprazole) lảm giảm phơi nhiễm lapatinib trung
bình 27% (khoảng: 6% đến 49%). Tác dụng nảy giảm khi độ tuổi tảng, từ xắp xỉ 40 đến 60 tuối. Do
đó, thận trọng khi sử dụng TYKERB ở bệnh nhân đã được điều trị trước đó với chắt ức chế bơm
proton.
Lapatinib ức chế CYP3A4 trên in vitro tại các nồng độ liên quan trẻn lâm sảng. Dùng đồng thời
TYKERB vời midazolam dùng đường uống lảm tăng khoảng 45% AUC cùa midazolam. Khỏng có
tăng AUC có ý nghĩa trên lâm sảng khi midazoiam được dùng theo đường tĩnh mạch Cần thận
trọng khi dùng TYKERB đồng thời với cảc thuốc dùng đường uống có cửa số điều trị hẹp và là cơ
chắt cùa CYP3A4 (xem Dược động học).
Lapatinib ức chế CYP2Cỡ trên in vitro tại các nồng độ tương quan trên iâm sảng Cần thặn trọng
khi dùng TYKERB đồng thời với các thuốc có cửa số điều trị hẹp vả lả cơ chắt của CYP2CS (xem
Duoc động học).
Uống TYKERB đồng thời với paclitaxel dùng đường tĩnh mạch Iảm tăng phơi nhiễm của paclitaxel
khoảng 23% do sự ức chế Iapatinib của CYP2C8 vả/hoặc P-glycoprotein (ng). Đã quan sát thẳy
sự tăng tỉ lệ mắc mới vả mức độ nặng của tiêu chảy vả giảm bạch cầu trung tinh khi dùng kết hợp
TYKERB với paclitaxel trong các thử nghiệm lâm sảng. Nèn thận trọng khi dùng TYKERB đồng
thời với paclitaxel.
Uống đồng thời TYKERB với docetaxel dùng đường tĩnh mạch không ảnh hướng đáng kể đến
AUC hay Cmax của cả hai hoạt chắt. Tuy nhiên, khả năng xảy ra giám bạch cầu trung tính do
docetaxel lại tăng lên.
Uống đồng thời TYKERB với irinotecan (khi được sử dụng như là một phần của phác đồ FOLFIRI)
lảm tảng khoảng 40% AUC của SN-38, chầt chuyển hóa có hoạt tính của irinotecan. Vẫn chưa biêt
cơ chế chính xác của tương tác náy. Nên thận trọng khi dùng TYKERB đồng thời với irinotecan.
Lapatinib lả cơ chắt cho protein vận chuyền ng vả Protein khảng ung thư vú (BCRP). Cảc chất
ức chế vả cảm ứng các protein nảy có thể lảm thay đồi phơi nhiễm vả/hoặc phân bố của Iapatinib
(xem Dược động học).
Lapatinib ức chế protein vận chuyển ng trẻn in vttro ở những nồng độ tương quan trên lảm 'nặ.
Dùng đồng thời TYKERB với digoxin uống lảm táng khoảng 98% AUC của digoxin. Nèn thậh~trọng
khi dùng TYKERB đồng thới với các thuốc lá cơ chắt của ng có cứa số điều trị hẹp.
Lapatinib ức chế protein vặn chuyền BCRP vả OATP1B1 trẻn in vitro. Chưa đánh giá được sư Iiên
quan lãm sảng của tảo dụng náy. Không thể loại trừ được rằng lapatinib sẽ ảnh hưởng đên dược
động học của các cơ chắt của BCRP (ví dụ topotecan) vả OATP1B1 (vi dụ rosuvastatin) (xem
Dược Động học).
`1
Sử dụng đồng thời TYKERB với capecitabine, Ietrozole hoặc trastuzumab không tảm thay đối có ý
nghĩa dược động học của các chất nảy (hoặc các chất chuyến hóa của capecitabine) hoặc
iapatinib.
Sinh khả dụng của Iapatinìb bị ảnh hướng bới thức ăn (xem Liều tượng vè Cách dùng vá Duợc
động học}.
THAI KÝ VÀ CHO CON BÚ
Khả năng sinh sản
Không có các thòng tin Iiên quan.
Thaikỳ
Không có các nghiên cứu đối chứng tốt vả đầy đủ khi dùng TYKERB cho phụ nữ mang thai. Chưa
biết ảnh hướng của TYKERB iên thai kỳ ở người. Chỉ nên sử dụng TYKERB trong khi mang thai
nêu lợi ích mong đợi vượt trội nguy cơ có thể gặp phải đối với phôi thai. Nên khuyên các phụ nữ
có khả năng mang thai sử dụng cảc biện pháp tránh thai thich hợp vả tránh mang thai trong khi
đang điếu trị với TYKERB.
TYKERB không gây quải thai khi nghiên cứu trên chuột cống và thỏ mang thai nhưng gây bất
thường nhẹ ở liếu gảy độc cho mẹ (xem Dữh'ệu tiên tâm sảng).
Cho con bú
Chưa biết Iiệu lapatinib có được bải tiết vèo sữa mẹ hay không. Do có rất nhiều thuốc được bải
tiết vảo sữa mẹ vả do tiếm năng xảy ra các tác dụng không mong muốn của lapatinib cho trẻ bú
mẹ, khuyến cảo nên dừng cho con bú ở những phụ nữ đang điếu trị với TYKERB.
ẢNH HƯỚNG ĐÉN KHẢ NĂNG LÁI XE VÀ VẬN HÀNH MÁY MÓC
Không có nghiên cứu đánh giá ánh hưởng của TYKERB lên khả năng lái xe hoặc vận hảnh mảy
móc. Khóng thể dự đoán được ảnh hưởng bắt lợi lẻn các hoạt động nảy từ dược lý học của
TYKERB. Nên luôn ghi nhớ tình trạng lâm sảng của bệnh nhản và hồ sơ tác dụng không mong
muốn của TYKERB khi cân nhắc khả năng thực hiện cảc công việc đòi hỏi kĩ năng phán đoán, vận
động hay nhặn thưc của bệnh nhân.
TÁC DỤNG KHÔNG MONG MUỐN
Dữ Iiệu thử nghiệm lâm sảng
Đã đảnh giá tinh an toản của TYKERB khi dùng đơn trị Iiệu vá kết hợp với các hóa chắt khảo trong
điếu trị nhiều loại ung thư khác nhau cho hơn 20000 bệnh nhân trong đó có 198 bệnh nhânửị2g
TYKERB kết hợp với capecitabine, 149 bệnh nhân dùng TYKERB kết hợp vởi trastuzunib,tẵi 2
bệnh nhản dùng TYKERB kêt hợp vời paclitaxel, 293 bệnh nhân ơùng TYKERB kết hợp với
paclitaxel (175 mglm² mỗi 3 tuần), và 654 bệnh nhân dùng TYKERB kết hợp với letrozole (xem
Các nghiên cứu lâm sảng).
Quy ước dưới đảy được sử dụng để phân loai tần suất: Rắt phổ biến (lớn hơn hoặc bằng 1l10),
phổ biến (lớn hơn hoặc bằng 11100 vả nhỏ hơn 11101. khỏng phổ biến (lớn hơn hoặc bằng 1/1.000
và nhỏ hơn 11100), hiếm (lớn hơn hoặc bầng 1/10.000 vả nhỏ hơn 111.000) vả rầt hiếm (nhỏ hơn
1/10.000).
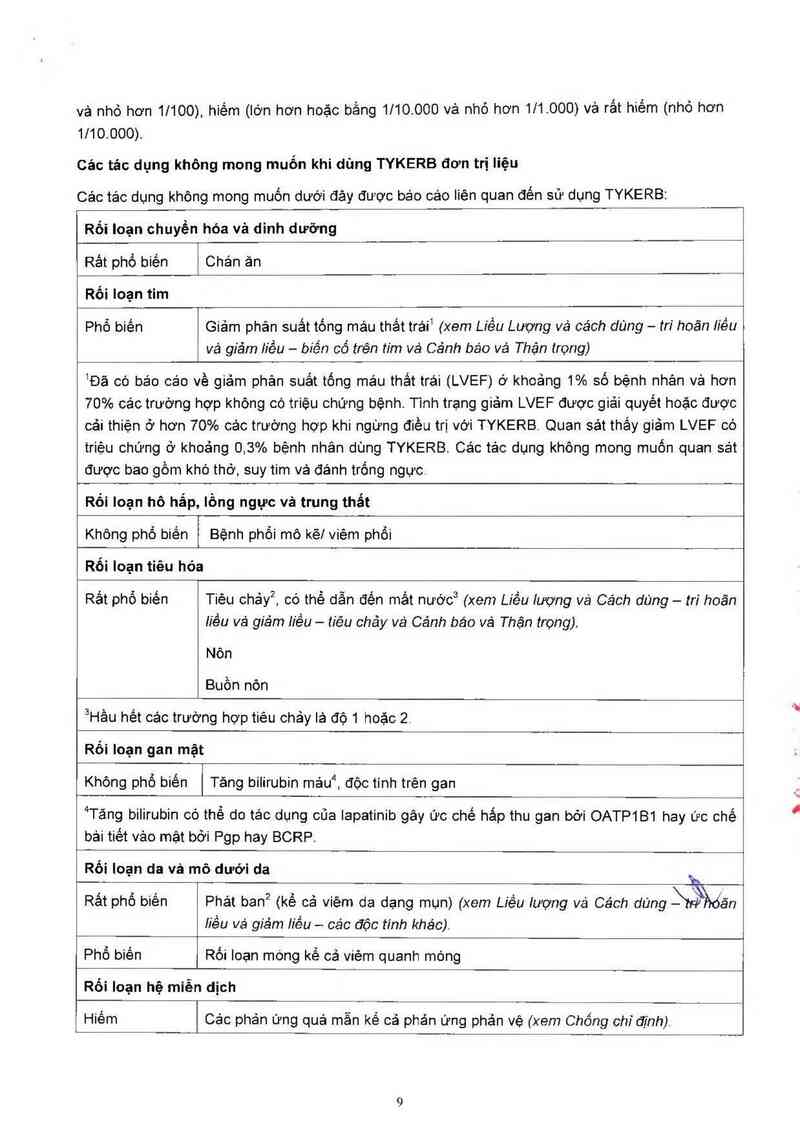
Cảc tác dụng không mong muốn khi dùng TYKERB đơn trị liệu
Các tác dụng không mong muốn dưới đảy được báo cáo liên quan đến sử dụng TYKERB:
Rối loạn chuyến hỏa và dinh dưỡng
Rât phổ biến Chản ăn
Rối loạn tim
Phổ biến Giảm phân suất tống mảu thắt trái1 (xem Liều Lượng vả cách dùng — tri hoãn Ii'êu
và giám liều — biển cố trên tim vá Cảnh báo vả Thận trọng)
1Đã có báo cáo về giảm phản suất tống máu thắt trái (LVEF) ở khoảng 1% số bệnh nhân vả hơn
70% ca'c trường hợp khỏng có triệu chứng bệnh. Tinh trạng giảm LVEF được giải quyết hoặc được
cải thiện ở hơn 70% các trường hợp khi ngừng điêu trị với TYKERB Quan sát thắy giâm LVEF có
triệu chứng ở khoảng 0,3% bệnh nhân dùng TYKERB. Các tảo dụng không mong muốn quan sát
được bao gốm khó thớ, suy tim vả đánh trống ngực
Rối loạn hô hắp, lồng ngực và trung thẩt
Không phổ biến Bệnh phối mô kẽ! viêm phổi
Rối loạn tiêu hóa
Rẩt phổ biến Tiêu chảy², có thể dẫn đến mắt nước3 (xem Líều lượng vá Cách dùng — tri hoãn
iiều vả giảm iiều — tiêu chảy vả Cảnh báo vá Thận trọng).
Nôn
Buồn nỏn
3Hằu hết các trường hợp tiêu chảy lả độ 1 hoặc 2,
Rối Ioạn gan mặt
Khỏng phổ biên Tảng bilirubin máu“, độc tinh trên gan
4Tảng bilirubin có thế do tác dụng của Iapatinìb gây ức chế hảp thư gan bởi OATP1B1 hay ức chế
bải tiêt vảo mặt bởi ng hay BCRP.
Rối loạn da và mô dưới da
».
Rất phố biên Phát ban2 (kể cả viêm da dạng mụn) (xem Liều lượng vá Cách dùng SFỄhổãn
tiều vá giảm iiẻu - các độc tinh khác).
Phổ biến Rối loạn móng kể cả viếm quanh mớng
Rối loạn hệ miễn dịch
Hiếm Cảo phản ứng quá mẫn kể cả phản ứng phản vệ (xem Chống chĩđịnh).
Rối loạn toản thân và tại chỗ
Rất phổ biến Mệt mỏi
2Titẽu chảy vả phát ban nhìn chung đều ở mức độ thấp vả khỏng đưa đến hệ quả lả phải ngừng sử
dụng TYKERB. Tiêu chảy đáp ứng tốt với các biện pháp kiếm soát chủ động (xem Cánh báo vả
Thận trọng). Phát ban thường thoáng qua trong hầu hết các trường hợp.
Cảc tảo dụng không mong muốn khi dùng TYKERB kết hợp với Capecitabine
Ngoái cảc tác dụng khỏng mong muốn quan sát thắy với TYKERB đơn trị liệu2, đă có thẻm các
báo cáo về tảo dụng không mong muốn sau đây liên quan đến phảc đồ điếu trị TYKERB kết hợp
với capecitabine với sự khác biệt về tần suất lớn hơn 5% so với capecitabine đơn trị liệu. Các dữ
liệu nảy dựa trèn sự phối hợp thuốc ở 198 bệnh nhản.
Rối loạn tiêu hỏa
Rắt phổ biên Khó tiêu
Rối Ioạn da và mô dưới da
Rắt phổ biến Khô da
Các tác dụng không mong muốn sau đã được báo cáo liên quan đến TYKERB trong phác đồ kết
hợp với capecitabine nhưng với tần suất ương tự với nhóm dùng capecitabine đơn trị liệu.
Rối loạn tiêu hỏa
Rắt phổ biến Viêm miệng, táo bón vá đau bụng.
Rối Ioạn da vả mô dưới da
Rắt phổ biến Hội chứng tay-chản (Palmar-plantar erythrodysaesthesia.)
Rối Ioạn toản thân vả tại chỗ
Rất phổ biến Viêm niêm meo
Rôi loạn cơ xương vả mô Iiẽn kết
Rết phổ biến Đau ở chân tay, đau lưng
Rối loạn thần kinh
Phổ biến Đau đầu
Rối loạn tâm thần \\ỵV
Rết phổ biến Mảt ngủ.
Các tác dụng không mong muốn khi dùng TYKERB kết hợp vởi Trastuzumab
Không có thêm tảo dụng không mong muốn nảo khác được báo cảo khi dùng TYKERB kêt hợp
với trastuzumab. Có sự gia tãng tỉ lệ độc tính trẻn tim, nhưng những biến cố nảy cũng tương tư về
bản chắt và mức độ nặng so với những biến cố được báo cáo trong chương trinh iâm sảng của
10
TYKERB (xem Cảnh báo và Thận trọng— Độc tinh trên tim). Các dữ Iiệu nảy dựa trên phơi nhiễm
với phác đồ phối hợp thuốc nảy ở 149 bệnh nhân trong thử nghiệm then chốt.
Cảc tác dụng không mong muốn khi dùng TYKERB kết hợp với Letrozole
Ngoài cảc tảo dụng không mong muốn quan sải thầy với TYKERB đờh trị Iiệu, các tác dụng không
mong muốn thêm sau đây được bảo cáo có Iiên quan đến phác đồ TYKERB kết hợp với letrozole
với sự khảc biệt về tần suất lớn hơn 5% so với Ietrozole đơn trị liệu. Cảo dữ Iiệu nảy dựa trên phơi
nhiễm với phảc đồ phối hợp thuốc nảy ở 654 bẻnh nhân.
Rối Ioạn hô hẩp, lồng ngực và trung thắt
Rắt phổ biến Chảy mảu cam.
Rối loạn da vả mô dưới da
Rảt phổ biến Rung tóc.
Khô da.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi dùng thuốc.
QUÁ uEu
Khỏng có chât giải độc đặc hiệu để ức chế quá trinh phosphoryl hóa tyrosine của ErbB1 (EGFR)
vả! hoặc ErbB2. Liều uống tối đa của TYKERB sử dụng trong cảc nghiên cứu lâm sảng lả 1.800
mg một iần hảng ngảy.
Dùng TYKERB thướng xuyên hơn có thể dẫn đến nồng độ huyết thanh vượt quá nồng độ quan
sát thẩy trong các thử nghiệm lâm sảng, do vặy không nên thay thế các liều đã quên. và nên tiếp
tục lại với liều hảng ngảy tiếp theo như tiệu trình đã định (xem Liều Iượng vả Cách dùng).
Triệu chứng vả dẩu hiệu
Đã có bảo các về các trường hợp quá liều không có triệu chứng vả có triệu chứng ở bệnh nhân
đang được điều trị bằng TYKERB. Các triệu chứng quan sát thắy bao gồm các biền cố Iiên quan
đến TYKERB đã biết (xem Tác dụng khóng mong muốn) vả trong một số trướng hợp đau da đèu,
nhịp nhanh xoang (với điện tâm đồ khác binh thường) vảlhoặc viêm niêm mạc.
Điều trị
TYKERB bải tiết không đảng kề qua thận vả gắn kết mạnh với protein huyết tương, do vậy thắm
tách máu không được mong đợi là biện phảp hữu hiệu để lảm tăng thải trừ TYKERB.
Nên có biện pháp điều trị thếm theo dấu hiệu lâm sảng hoặc theo khuyến cáo của trung tânikctỄng
đôc ² ' ² ’ \; \/
_ quoc gia, neu co.
ĐẶC TÍNH oược LÝ
Dược lực học
Mã ATC
LO1XEO7
il
Cơ chế tác dụng
Lapatinib là một chải ức chế 4-anilinoquinazoiine kinase mới với cơ chế tác dụng độc đáo, vì
lapatinib lả chắt ức chế mạnh, có hồi phục vả chọn lọc vùng tyrosine kinase nội bảo của cả hai thụ
thể ErbB1 vả ErbB² (các giá trị Kiapp được ước tính tả 3 nM vả 13 nM tương ứng) với tốc độ tách
ra khỏi thụ thể châm (thời gian bản thải lớn hơn hoặc bằng 300 phút). Tốc độ phân tảoh nảy được
thắy lả chậm hơn các chắt ức chế 4-anilinoquinazoie kinase khác đã nghiến cứu. Lapatinib ức chế
tăng trướng tế bảo khối u do ErbB điếu khiến trên in vitro vả ở cảc Ioại mô hình động vật khác.
Ngoài tác động của dạng đơn trị liệu, Iapatinib cũng chứng minh được hiệu quả trong một nghiên
cứu trèn in vitro phối hợp với 5-FU (chắt chuyến hóa có hoạt tính của capecitabine) trong thử
nghiệm điếu trị bốn dòng tế bảo ung thư. Ý nghia trên lảm sảng của các dữ iiệu in vitro nảy chưa
được rõ.
Dùng kết hợp lapatinib vả trastuzumab có thể bổ sung cơ chế tảc dung cho nhau cũng như các cơ
chế để khảng có thể không trùng iắp. Tảo dụng ức chế tăng trướng của Iapatinib trên cảc dòng tế
bảo được điều trị với trastuzumab đă được đảnh giá. Lapatinib duy trì được hoạt tinh quan trọng
chống lại cảc dòng tế bảo ung thư vú bộc lộ quá mức HER2 được lựa chọn để phảt triễn trong thời
gian dải ở môi trường thử nghiệm in vitro có chứa trastuzumab vả lapatinib có tác dụng hiệp lực
khi phối hợp với trastuzumab trên cảc dòng tế bảo nảy. Các phát hiện nảy gợi ý rằng không có sự
đề khảng chéo giữa hai thuốc tảo động trực tiếp lên ErbB2 nêu trên.
Cảo dòng tế bảo ung thư vú nhay cảm với hormone (thụ thể oestrogen [ER] dương tinh vảlhoặc
thụ thể progesterone [PgR] dường tính) đồng thời có bộc lộ ErbB2 có xu hướng trở nên kháng với
cảc liệu pháp nội tiết. Những tế bảo ung thư vú nhạy cảm với hormone nảo mả ban đâu khiếm
khuyết ErbB1 hoặc ErbB² sẽ gia tăng điều hòa các thụ thể nảy khi khối u trở nên đề kháng liệu
pháp nội tiết. Cảo thử nghiệm lâm sảng ngẫu nhiên ở bệnh nhân ung thư vú di cán nhạy cảm với
hormone cho thếy chầt ức chế tyrosine kinase ErbB1 hoặc ErbB2 có thế có khả năng cải thiện
hiệu quả lảm sảng khi được bổ sung vảo Iiệu pháp nội tiết.
Dược động học
Hấp thu
Hầp thu của iapatinib sau khi uống lá không hoản toản và dao động (xấp xỉ khoảng 50 đến 100%
hệ số thay đối trong AUC). Cảo nồng độ trong huyết thanh xuất hiện sau một trung vị thới gian trễ
lả 0.25 giờ (khoảng 0 đến 1.5 giờ). Các nồng độ đỉnh trong huyết tương (Cmax) của iapatinib đạt
được xắp xỉ khoảng 4 giờ sau khi dùng thuốc. Liều dùng hảng ngáy 1.250 mg tạo ra giá trị trung
binh nhân ở trạng thái ổn định (khoảng tin cậy 95%) của Cmax là 2.43 (1,57 đến 3,77) |.tglỪ/
AUC lả 35,2 (23,4 đên 56) ug.giờlmL
Phơi nhiễm toản thân với Iapatinib tăng lèn khi dùng cùng thức ăn (xem Liều Lượng vả Cách dùng
vả Tương tác thuôo). Cảo giá trị AUC của lapatinib tương ứng cao hơn xâp xỉ khoảng 3 vả 4 lần
(Cmax xấp xỉ cao gắp 2,5 và 3 lần) khi dùng với một bữa ản ít chầt béo (5% chất béo [500 calol)
hoặc với một bữa ăn nhiều chắt béo (50% chắt bến [1.000 caloị),
Phán bố
Lapatinib gắn kết mạnh (trên 99%) với albumin vả alpha-1 acid glycoprotein. Cảc nghiên cứu trên
ín vitro chỉ ra rầng Iapatinib lá cơ chắt cho các chắt vận chuyển BCRP (ABCGZ) vả p-glycoprotein
(ABCB1). Trên in vitro ở cảc nồng độ tương quan trèn lảm sảng cho thảy lapatinib ức chế ng
(ic50 2.3 ug/mL), BCRP (ic:50 0,014 ugimL) vả chắt vặn chuyến hấp thu tại gan OATP 151 ucso 2.3
ụg/mL). Chưa rõ ý nghĩa lâm sảng của các tảo động nảy trên dược động học của cảc thuốc khác
hoặc tảo dụng dược lý của chắt chống ung thư khảc. Lapatinib không ức chế đảng kế cảc chất vận
chuyển ở thận OAT hoặc OCT (các giá trị 1ng trên in vitro lớn hơn hoặc bằng 6,9 ụglmL).
Chuyển hóa
Lapatinib được chuyển hớa mạnh mẽ, chủ yếu bởi CYP3A4 vả CYP3A5, vả một it từ CYP2C19 vả
CYPZCS thảnh cảc chất chuyến hóa bị oxy hóa khác nhau, không một chắt nảo trong đó được tìm
thấy trong phân nhiếu hơn 14% liều hoặc 10% nồng độ iapatinib trong huyết tương.
Lapatinib ức chế CYP3A (Ki 0,6 đến 2,3 ug/mL) vả CYP2CS (0,3 ụg/mL) trên in vitro tại cảc nồng
độ tương quan trên lâm sảng Lapatinib không ức chế đáng kể cảc enzyme sau ở microsome gan
ngưới: CYP1A2, CYP2CS, CYPZC19 vá CYP2D6 hoặc enzyme UGT (các giá trị 105… trên in vitro
lớn hờn hoặc bằng 6,9 ụg/mL).
Ở nhửng người tinh nguyện khỏe mạnh dùng ketoconazole, một chất ức chế CYP3A4, ở liều 200
mg hai lầnlngảy trong ? ngảy, phơi nhiễm toản thân với Iapatinib tảng lến xấp xỉ khoảng 3,6 lần vả
thời gian bán thải tăng gấp 1.7 lần.
Ở những người tinh nguyện khỏe mạnh dùng carbamazepine, một chắt cảm ứng CYP3A4, tại Iiều
100 mg hai lầnlngảy trong 3 ngảy và 200 mg hai lầnlngảy trong 17 ngảy, phơi nhiễm toản thân với
lapatinib giảm xấp xỉ 72%.
Thải' trừ
Thời gian bản thải của Iapatinib sau khi dùng Iiều đơn sẽ tảng lên khi tăng liếu. Tuy nhiên, liệu
dùng hảng ngăy của Iapatinib đạt được trạng thái ốn định trong 6-7 ngảy cho thắy thời gian bán
thải hiệu quả lẻ 24 giờ. Lapatinib được thải thừ chủ yếu qua chuyến hóa bởi CYP3A4I5. Đường
thải trừ chính của Iapatinib và các chất chuyền hóa của nó lả qua phân, dưới 2% liếu dùng (dưới
dạng lapatinib vả cảc chắt chuyển hóa) được bải tiết qua nước tiếu. Lapatinib được tim thắy trong
phân chiếm khoảng trung vị 27% (khoảng 3 đến 67%) của một Iiếu uống.
Cảo nhóm bệnh nhân đặc biệt
Suy thận
Dược động học của lapatinib chưa được nghiên cứu một cảoh cụ thể ở những bệnh nhân suy
thận hoặc trên những bệnh nhân đang thẩm tách máu Tuy nhiên suy thận có thế khỏhgủ
hưởng đến dược động học của Iapatinib vi dưới 2% liều dùng (dưới dạng lapatinib khỏng đổi vả
các chảt chuyến hóa) được thải trừ qua thận
Suy gan
Dược động học của rapatinib đã được khảo sải ở bệnh nhân suy gan trung bình (n=8) hoặc nặng
(n=4) vá trên 8 đối tượng khỏe mạnh có kiếm soát. Phơi nhiễm toản thân (AUC) của Iapatinib sau
khi uống một Iiếu đơn 100 mg tăng lên tương ửng xắp xỉ 56% vé 85% ở bệnh nhân suy gan trung
bình và nặng. Cần thận trọng khi dùng TYKERB cho những bệnh nhân suy gan do tảng phơi
nhiễm với thuốc. Khuyến cáo giảm liếu cho bệnh nhản từng bị suy gan nặng. Ở bệnh nhân phát
triến độc tinh trên gan nặng trong khi điếu trị, nên ngừng dùng TYKERB và không nên điếu trị lại
với TYKERB (xem Liều lượng vả Cách dùng và Cảnh báo vả Thận trọng).
Cảc nghiên cứu lăm sảng
Điều trị kết hợp với TYKERB vả capecitabine
Tinh an toản và hiệu quả của TYKERB dùng kết hợp với capecitabine trên bệnh nhản ung thư vú
đă được đánh giá trong một thử nghiệm ngẫu nhiên. Bệnh nhân đủ điều kiện tham gia vảo nghiến
cứu lá có bộc lộ quá mức ErbB2 (IHC 3+ hoặc IHC 2+ vả FISH dương tinh), ung thư vú tiến triển
tại chỗ hoặc di căn, bệnh tiến triến sau khi đã được điếu trị với nhiếu thuốc trước đó kể cả
taxanes, anthracyclines vả trastuzumab. LVEF được đánh giá ở tắt cả các bệnh nhân (bằng điện
tâm đồ [ECG] hoặc MUGA (multigated acquisition scan)) trước khi bắt đầu điều trị với TYKERB để
đảm bảo LVEF ban đầu nằm trong giới hạn binh thường quy ước. Trong các thử nghiệm lâm
sảng, LVEF được theo dõi khoảng mỗi 8 tuần trong suốt quá trinh điều trị với lapatinib để đảm bảo
rằng nó khỏng giảm xuống dưới giới han dưới của mức binh thường quy ước. Đa số trường hợp
giảm LVEF (trèn 60% các biến cố) được quan sát thếy trong 9 tuần đầu điếu trị, tuy nhiên các dữ
Iiệu vế phơi nhìễm dải hạn còn hạn chế.
Các bệnh nhân được chọn ngẫu nhiên dùng hoặc TYKERB 1.250 mg một Iần/ngáy (dùng Iiên tục)
phối hợp với capecitabine (2.000 mglm²lngảy từ ngảy 1 đến 14 trong mỗi chu kỳ điếu trị 21 ngảy),
hoặc dung đơn trị liệu capecitabine (2.500 mglm²lngảy từ ngảy 1 đến 14 trong mỗi chu kỳ điếu trị
21 ngảy). Việc điều trị trong nghiên cứu tiếp tục cho đến khi bệnh tiến triến, hoặc phải rút khỏi
nghiên cữu vì lý do nảo khác. Tiêu chí chinh lả thời gian đến khi tiến triến (TTP) và các kết quả
được trình bảy dưới đây dựa trẽn đánh giá của một úy ban đánh giá độc lập.
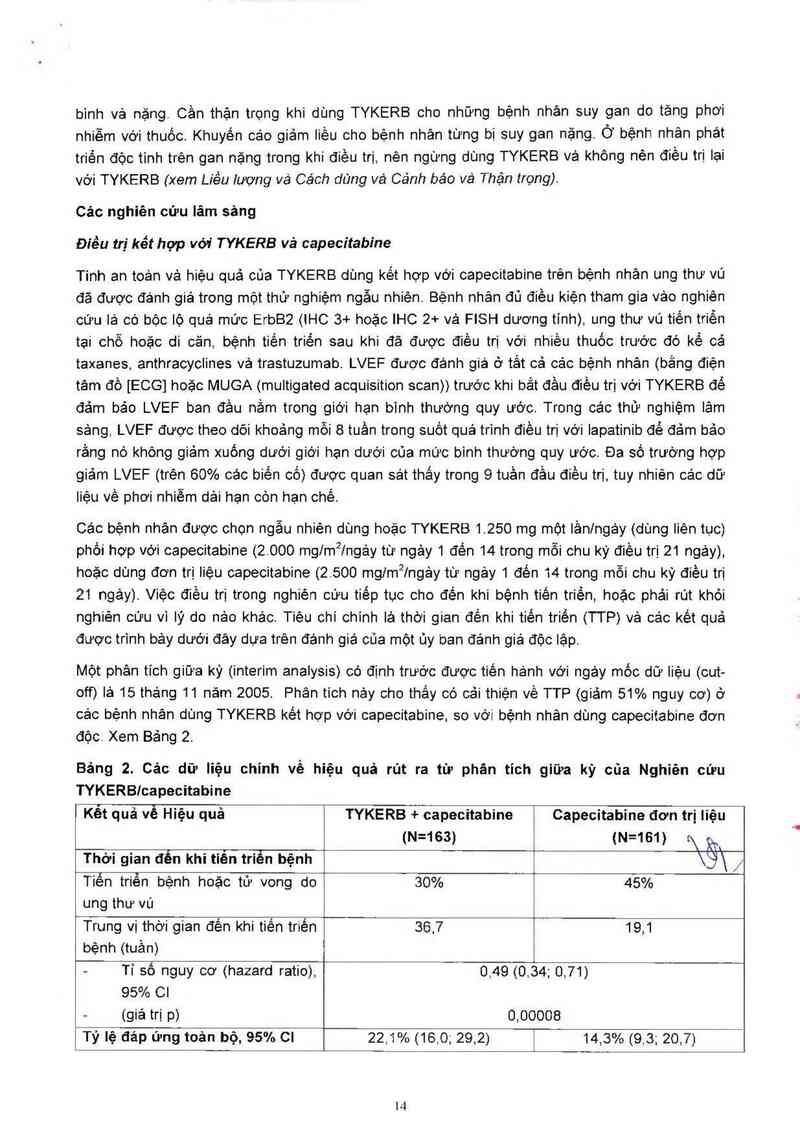
Một phân tich giữa kỳ (interim analysis) có định trước được tiến hảnh với ngáy mốc dữ Iiệu (cut-
off) lả 15 tháng 11 nảrn 2005. Phân tích nảy cho thảy có cải thiện về TTP (giảm 51% nguy cơ) ở
các bệnh nhân dùng TYKERB kết hợp với capecitabine, so với bệnh nhân dùng capecitabine đơn
độc. Xem Bảng 2.
Bảng 2. Cảo dữ liệu chính về hiệu quả rủt ra từ phân tich giữa kỳ của Nghiên cứu
TYKERBIcapecitabine
Kết quả về Hiệu quả TYKERB + capecitabine Capecitabine đơn trị Iiệu
(N=163) (N=161) t\ử
Thời gian đến khi tiên triễn bệnh \3\ /
Tiến triến bệnh hoặc tử vong do 30% 45%
ung thư vú
Trung vị thời gian đến khi tiến triến 36,7 19,1
bệnh (tuần)
— Tỉ số nguy cơ (hazard ratio), 0,49 (0,34; 0,71)
95% 01
(giá trị p) 0,00008
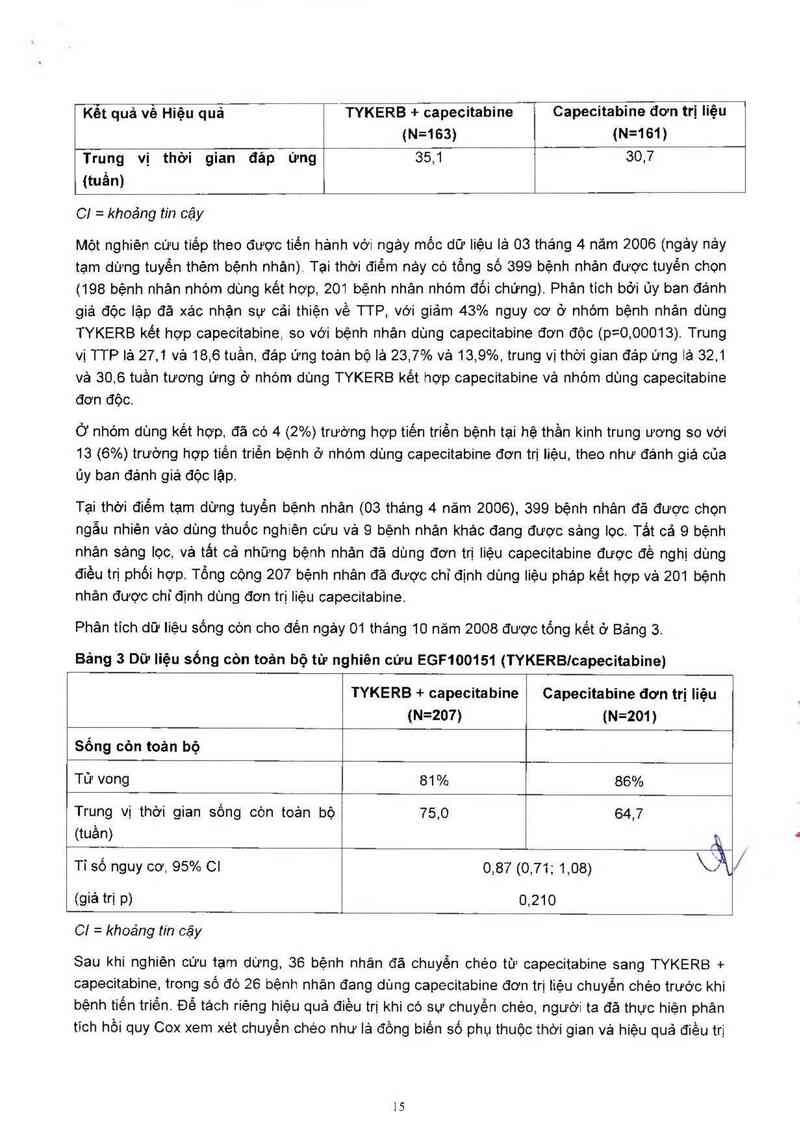
Tỷ lệ đáp ứng toản bộ, 95% Cl 22,1% (16,0; 29,2) i 14,3% (9,3; 20,7)
Kễt quả về Hiệu quả TYKERB + capecitabine Capecitabine đơn trị liệu
(N=163) (N=161)
Trung vị thời gian đáp ứng 35,1 30,7
(tuần)
C! = khoáng tin cậy
Một nghiên cữu tiếp theo được tiến hảnh với ngảy mốc dữ liệu lẻ 03 tháng 4 năm 2006 (ngảy nảy
tạm dừng tuyển thèm bệnh nhân) Tại thời điếm nảy có tồng số 399 bệnh nhân được tuyến chọn
(198 bệnh nhân nhóm dùng kết hợp, 201 bệnh nhân nhớm đối chứng). Phân tích bởi ủy ban đảnh
giá độc lập đã xác nhận sự cải thiện về TTP, với gìảm 43% nguy cơ ở nhóm bệnh nhân dùng
TYKERB kết hợp capecitabine, so với bệnh nhân dùng capecitabine đơn độc (p=0,00013). Trung
vị TTP lả 27,1 vả 18,6 tuần, đáp ứng toản bộ lả 23,7% vả 13,9%, trung vị thời gian đảp ứng lả 32,1
và 30,6 tuần tương ứng ở nhóm dùng TYKERB kết hợp capecitabine vả nhóm dùng capecitabine
đơn đôc.
Ở nhóm dùng kết hợp, đã có 4 (2%) trường hợp tiến triến bệnh tại hệ thần kinh trung ương so với
13 (6%) trường hợp tiến triến bệnh ở nhóm dùng capecitabine đơn trị iiệu, theo như đánh giá của
ủy ban đánh giá độc lập.
Tại thời điếm tạm dừng tuyến bệnh nhân (03 thảng 4 năm 2006), 399 bệnh nhân đã được chọn
ngẫu nhiến vảo dùng thuốc nghiên cứu vả 9 bệnh nhản khác đang được sảng loc. Tắt cả 9 bệnh
nhản sảng lọc, vả tất cả những bệnh nhản đã dùng đơn trị Iiệu capecitabine được đề nghị dùng
điếu trị phối hợp. Tồng cộng 207 bệnh nhân đã được chỉ định dùng liệu pháp kết hợp vả 201 bệnh
nhân được cht’định dùng đớn trị liệu capecitabine.
Phân tich dữ Iiệu sống còn cho đến ngảy 01 tháng 10 năm 2008 được tống kết ở Bảng 3.
Bảng 3 Dữ liệu sống còn toản bộ từ nghiên cứu EGF100151 (TYKERBIcapecitabine)
TYKERB + capecitabine Capecitabine đơn trị Iiệu
(N=207) (N=201)
Sống còn toản bộ
Tử vong 81 % 86%
Trung vị thời gian sống còn toản bộ 75,0 64,7
(tuần) Â
Tỉ số nguy cơ, 95% 01 0,87 (0,71; 1,08) \Ă
(giá trị p) 0,210
C! = khoảng tin cậy
Sau khi nghiến cứu tạm dững, 36 bệnh nhân đã chuyến chéo từ capecitabine sang TYKERB +
capecitabine, trong số đó 26 bệnh nhân đang dùng capecitabine đơn trị liệu chuyến chéo trước khi
bệnh tiến triến. Đế tách riẻng hiệu quả điếu trị khi có sự chuyến chéo, người ta đã thực hiện phân
tich hồi quy Cox xem xét chuyến chéo như lá đồng biến số phụ thuộc thời gian vả hiệu quả điếu trị
vẫn được đánh giá, Kết quả từ phân tích náy gợi ý nguy cơ tử vong tương ứng trên lâm sảng giảm
20%, vởi tỉ số nguy cơ hiệu quả điều trị lả 0,80 (khoảng tin cậy [01] 95%: 0,64; 0,99; p=0,043)
Diều trị kết hợp với TYKERB vả trastuzumab
Hiệu quả vả tính an toản của TYKERB kết hợp với trastuzumab trong ung thư vú di căn đă được
đánh giá trong một thử nghiệm ngẫu nhiên. Những bệnh nhân đú điếu kiện tham gia vảo nghiên
cứu là những phụ nữ ung thư vú di cản giai đoạn IV khuếch đại qua' mức gen ErbB² (hoặc bộc lộ
quá mức protein), những bệnh nhân nảy đă được điếu trị với anthracycline vả taxane. Ngoải ra,
theo như đề cương nghiên cứu, bệnh nhân cũng được nghiên cứu viên báo cảo lả đang tiến triến
bệnh trong lúc dùng phảc đồ gần đây nhắt có chứa trastuzumab để điều trị di căn. Trung vị số
phác đồ có chữa trastuzumab trước đó khi điếu trị di căn là 3. Bệnh nhân được chon ngẫu nhiẻn
dùng hoặc TYKERB 1000 mg uống một lằnlngảy + trastuzumab 4 mglkg dùng đường tĩnh mạch
liều tắn công, sau đó là 2 mglkg dùng đướng tĩnh mạch hảng tuần (N=148). hoặc TYKERB 1.500
mg uống một lần/ngảy (N=148). Bệnh nhân có tiến triến bệnh khách quan sau khi dùng ít nhắt 4
tuần điếu trị với TYKERB đơn trị liệu được xem lả đủ điếu kiện để chuyến chéo sang dùng Iiệu
phảp phối hợp, Trong số 148 bệnh nhân dùng đơn trị iiệu, 77 (52%) bệnh nhản quyết định dùng
liệu pháp phối hợp tại thời điếm tiến triến bệnh
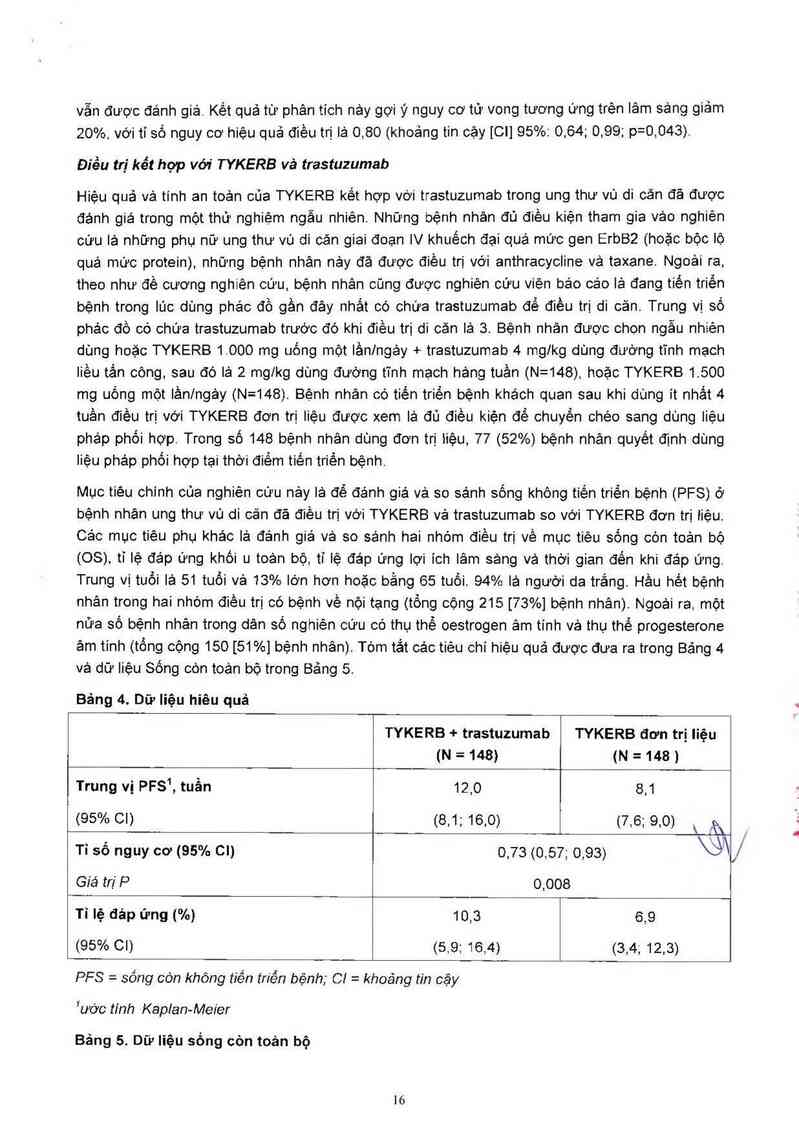
Mục tiêu chính của nghiên cữu nảy lá để đánh giả và so sánh sống không tiến triến bệnh (PFS) ở
bệnh nhân ung thư vú di căn đả điếu trị với TYKERB vả trastuzumab so với TYKERB đơn trị 1iệu.
Các mục tiêu phụ khác lả đánh giá vả so sánh hai nhóm điều trị về mục tiêu sống còn toản bộ
(OS), tỉ lệ đảp ứng khôi u toản bộ, tỉ lệ đáp ứng lợi ích lâm sáng vả thời gian đến khi đáp ứng.
Trung vị tuổi là 51 tuổi vả 13% lớn hơn hoặc bằng 65 tuối. 94% là người da trắng. Hầu hết bệnh
nhân trong hai nhóm điếu trị có bệnh về nội tạng (tống cộng 215 [73%] bệnh nhân). Ngoải ra. một
nữa số bệnh nhản trong dân số nghiên cữu có thụ thể oestrogen âm tính vả thụ thể progesterone
âm tinh (tổng cộng 150 [51%] bệnh nhân). Tớm tắt ca'c tiếu chí hiệu quả được đưa ra trong Bảng 4
và dữ liệu Sống còn toản bộ trong Bảng 5.
Bảng 4. Dữ liệu hiêu quả
TYKERB + trastuzumab TYKERB đơn trị Iiệu
(N=148) (N=148)
Trung vị PFS`, tuần 12,0 8,1
(95% 01) (8,1; 16,0) (7,6; 9,0) \ zỀx
, ; Ư\
Ti so nguy cơ (95% 01) 0,73 (0,57; 0,93)
Giá trịP 0,008
Tỉ lệ đáp ứng (%) 10,3 6,9
(95% 01) <5.9; 16,4) (34 12.3)
PFS = sõng còn không tiẻn triển bệnh; 67 = khoáng tin cậy
Iước tính Kaplan-Meier
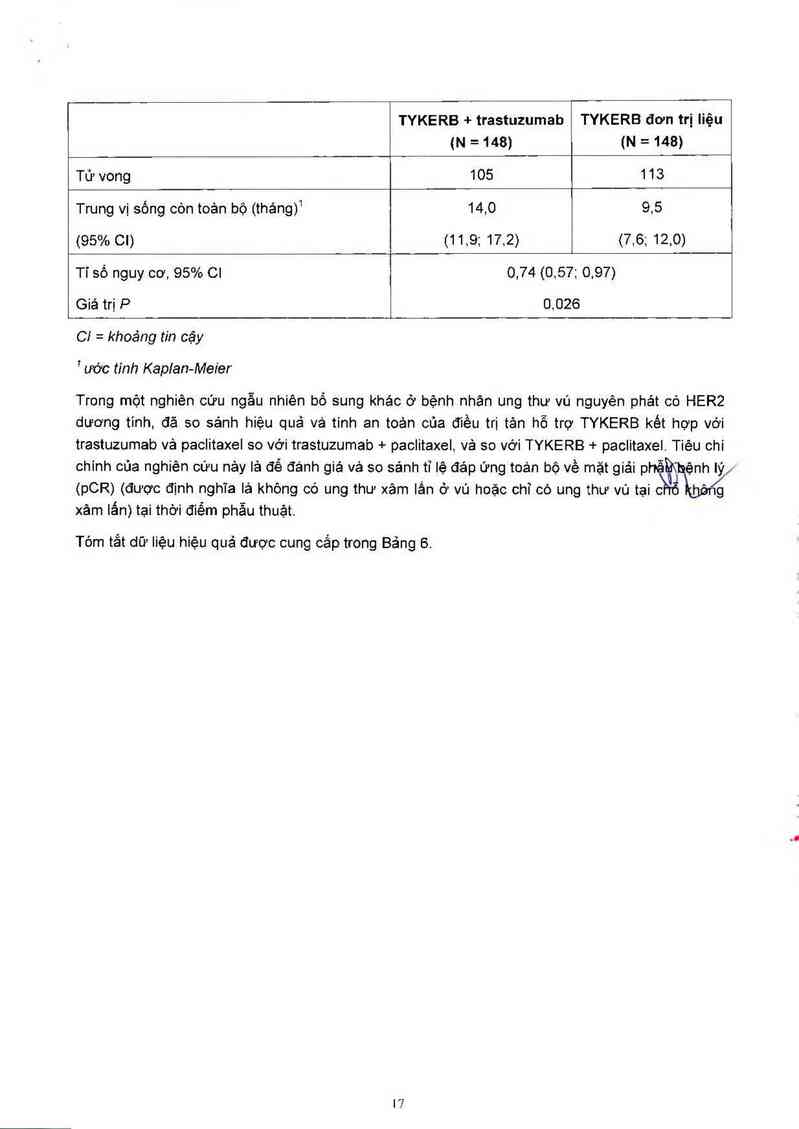
Bảng 5. Dữ liệu sống còn toản bộ
TYKERB + trastuzumab TYKERB đơn trị liệu
(N=148) (N=148)
Tử vong 105 113
Trung vị sống còn toản bộ (tháng)1 14,0 9,5
(95% co (11,9; 17,2) (7,6; 12,0)
Tỉ số nguy cơ, 95% CI 0,74 (0,57; 0,97)
Giá trị P
0,026
C! = khoảng tín cậy
1ước tính Kaplan-Mer'er
Trong một nghiên cứu ngẫu nhiên bổ sung khác ở bệnh nhân ung thư vú nguyên phét có HER2
dương tinh, đã so sánh hiệu quả và tinh an toản của điều trị tân hỗ trợ TYKERB kêt hợp vởi
trastuzumab vả paclitaxel so vởi trastuzumab + paclitaxel, và so vởi TYKERB + paclitaxel. Tiêu chí
chính của nghìên cứu nảy lá để đánh giá và so sánh tỉ lệ đảp ứng toản bộ về mặt giải phế ệnh Iý_,
(pCR) (được định nghĩa lá không có ung thư xâm lẩn ở vú hoặc chỉ có ung thư vú tại c\hổ hộn/g
xâm lấn) tại thời điếm phẫu thuật.
Tóm tắt dữ liệu hiệu quả được cung cắp trong Bảng 6.
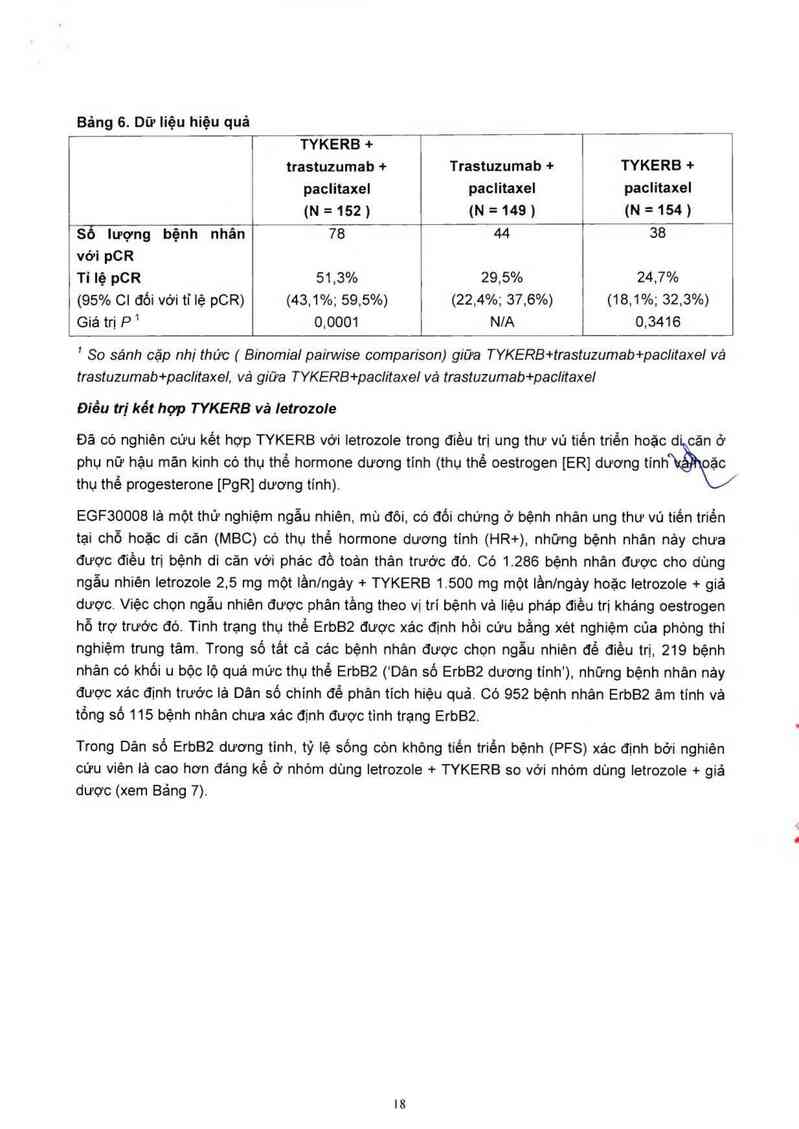
Bảng 6. Dữ Iiệu hiệu quả
TYKERB +
trastuzumab + Trastuzumab + TYKERB +
paclitaxel paclitaxel paclitaxei
(N=152) (N=149) (N=154)
sỏ lượng bệnh nhân 78 421— 38 ”
vởi pCR
Tỉ lệ pCR 51,3% 29,5% 24,7%
(95% Cl đối với tỉ lệ pCR) (43,1%; 59,5%) (22,4%; 37,6%) (18,1%; 32,3%)
Giá trị P1 0,0001 N/A 0,3416
' So sánh cặp nhị thức ( Binomia/ paiwvise comparison) giữa TYKERB+trastuzumab+paclitaxel vá
trastuzumab+paclitaxel, và giữa TYKERB+pac/itaxel vả trastuzumab+paclitaxel
Điểu tri kết hợp TYKERB vả letrozole
phụ nữ hậu mân kinh có thụ thể hormone dương tính (thụ thể oestrogen [ER] dương tính 0"
Đã có nghiên cứu kết hợp TYKERB vởi letrozole trong điều trị ung thư vú tiến triền hoặc d“ căn ở
\ẶỸIC/
thụ thể progesterone [PgR] dương tính).
EGF30008 lả một thử nghiệm ngẫu nhiên, mù đôi, có đối chứng ở bệnh nhân ung thư vú tiến triền
tại chỗ hoặc di căn (MBC) có thụ thể hormone dương tính (HR+), những bệnh nhân nảy chưa
được điều trị bệnh di cản vởi phác đồ toản thân trưởc đó. Có 1.286 bệnh nhân được cho dùng
ngẫu nhiên Ietrozole 2,5 mg một lầnlngảy + TYKERB 1500 mg một lần/ngảy hoặc letrozole + giả
dược. Việc chọn ngẫu nhiên được phân tầng theo vị trí bệnh và liệu phảp điều trị kháng oestrogen
hỗ trợ trước đó. Tinh trạng thụ thể ErbB² được xác định hồi cứu bằng xét nghiệm của phòng thí
nghiệm trung tâm. Trong số tắt cả các bệnh nhân được chọn ngẫu nhiên để điều trị, 219 bệnh
nhản có khối u bộc lộ quá mức thụ thể ErbB2 ('Dân số ErbBZ dương tính'), những bệnh nhân nảy
được xảc đinh trưởc lả Dân số chính để phân tích hiệu quả. Có 952 bệnh nhân ErbB² ảm tính vả
tồng số 115 bệnh nhân chưa xác dịnh được tinh trạng ErbB2.
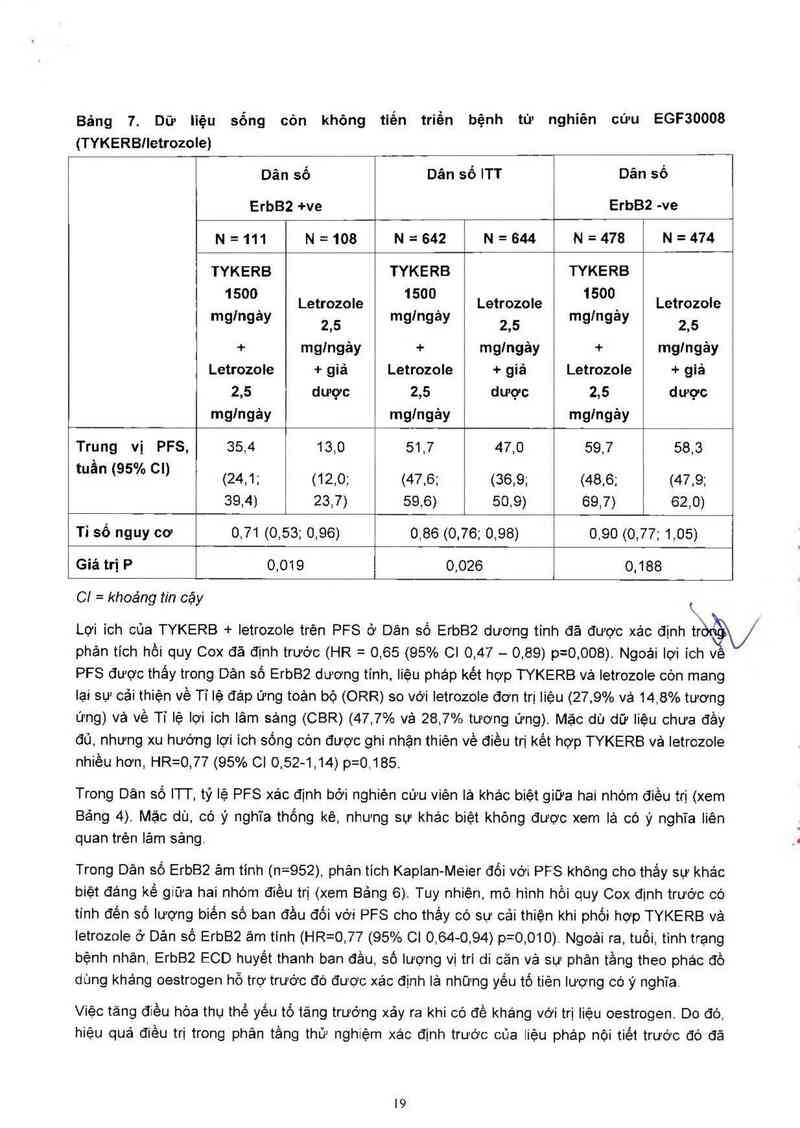
Trong Dân số ErbB² dương tinh, tỷ lệ sống còn không tiến triển bệnh (PFS) xảo định bởi nghiên
cứu viên lả cao hơn đáng kể ở nhóm dùng letrozole + TYKERB so với nhóm dùng letrozole + giả
dược (xem Bảng 7).
Bảng 7. Dữ Iiệu sống còn không tiến triển bệnh từ nghiên cứu EGF30008
(TYKERBIIEÌFOZOIO)
Dân số Dân số ITT Dân số
ErbB2 +ve ErbB2 -ve
N=111 N=108 N=642 N=644 N=478 N=474
TYKERB TYKERB TYKERB
1 500_ Letrozole 1500, Letrozole 1/500` Letrozole
mglngay 2’5 mglngay 25 mg ngay 15
+ mglngảy + mglngảy + mg/ngảy
Letrozole + giả Letrozole + giả Letrozole + giá
2,5 dược 2,5 dược 2,5 dược
mglngây mglngảy mglngảy
Trung vị PFS, 35,4 13,0 51,7 47,0 59,7 58,3
` o
tuân (95 Á’ cn (24,1; (12,0; (47,6; (36,9; (48,6; (47,9;
39,4) 23,7) 59,6) 50,9) 69,7) 62,0)
Tỉ số nguy cơ 0,71 (0,53; 0,96) 0,86 (0,76; 0,98) 0,90 (0,77; 1,05)
Giá trị P 0,019 0,026 0,188
C! = khoảng rin cậy &
Lợi ích của TYKERB + Ietrozole trên PFS ở Dân số ErbB2 dương tinh đã được xác định tr\
phân tích hồi quy Cox đã định trước (HR = 0,65 (95% Cl 0,47 — 0,89) p=0,008) Ngoải lợi ích ve
PFS được thấy trong Dân số ErbB2 dương tính, liệu pháp kêt hợp TYKERB vả letrozole còn mang
lại sự cải thiện về Tỉ lệ đáp ứng toản bộ (ORR) so với letrozole đơn trị Iiệu (27,9% vả 14,8% tương
ứng) vả về Tỉ lệ lợi ích lâm sảng (CBR) (47,7% vả 28,7% tương ứng). Mặc dù dữ liệu chưa đầy
đủ, nhưng xu hướng lợi ích sống còn được ghi nhận thiên về điều trị kết hợp TYKERB vả Ietrozole
nhiều hơn, HR=O,77 (95% Cl 0,52-1,14) p=0,185.
Trong Dân số ITI', tỷ lệ PFS xảc định bởi nghiên cưu viên lả khác biệt giữa hai nhóm điều trị (xem
Bảng 4). Mặc dù, có ý nghĩa thống kê, nhưng sự khác biệt không được xem lá có ý nghĩa Iiên
quan trên lâm sảng
Trong Dân số ErbB2 âm tính (n=952), phân tich Kapian-Meier đối với PFS không cho thấy sự khảo
biệt đảng kể giữa hai nhóm điều trị (xem Bảng 6). Tuy nhiên, mô hình hồi quy Cox định trước có
tính đến số lượng biến số ban đầu đối với PFS cho thắy có sự cải thiện khi phồi hợp TYKERB vả
letrozole ở Dản số ErbB2 âm tinh (HR=O,77 (95% Cl 0,64—0,94) p=0,010) Ngoải ra, tuổi, tình trang
bệnh nhân, ErbB2 ECD huyết thanh ban đầu, số lượng vị trí di căn và sự phân tầng theo phác đồ
dùng kháng oestrogen hỗ trợ trước đó được xác định lả những yếu tổ tiên lượng có ý nghĩa.
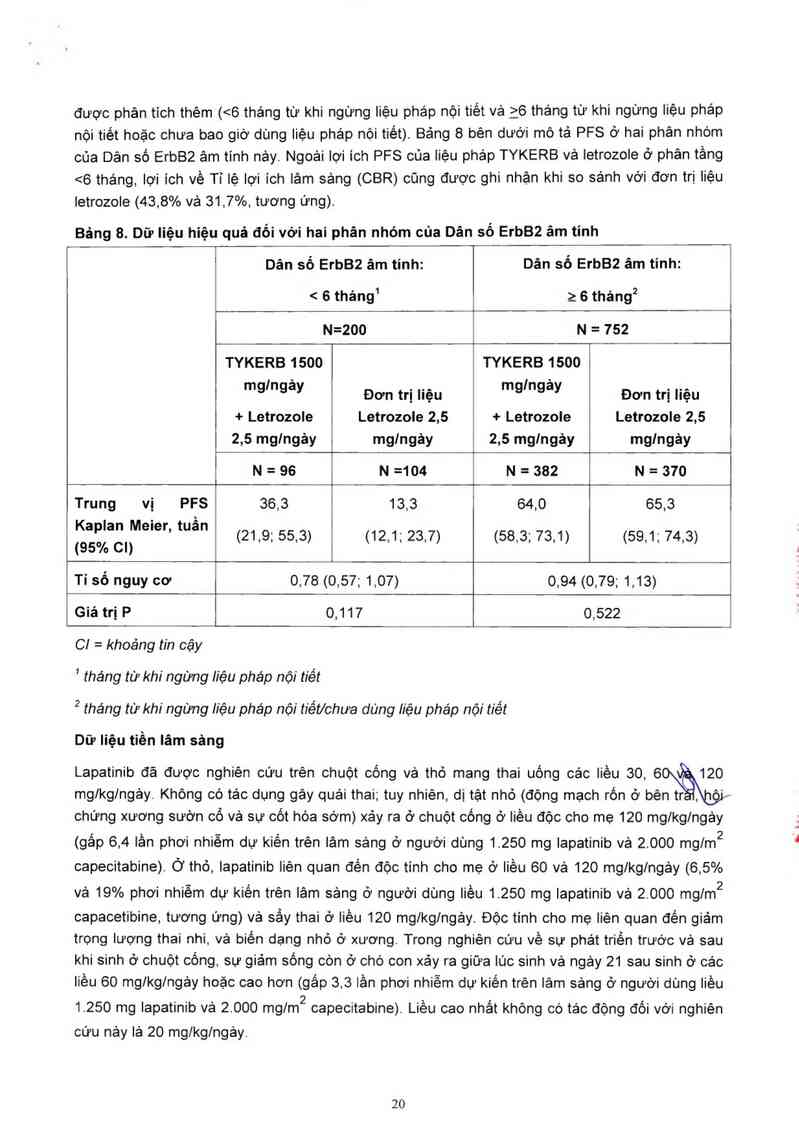
Việc tảng điều hòa thụ thế yếu tố tăng trướng xảy ra khi có đề kháng với trị Iiệu oestrogen. Do đó,
hiệu quả điều trị trong phân tầng thử nghiệm xác định trước cúa liệu phảp nội tiết trước đó đã
được phân tích thêm (<6 tháng từ khi ngừng Iiệu pháp nội tiết vả ỉ6 thảng từ khi ngừng liệu pháp
nội tiết hoặc chưa bao giờ dùng liệu pháp nội tiêt). Bảng 8 bẻn dưới mô tả PFS ở hai phân nhóm
của Dân số ErbB2 âm tỉnh nảy. Ngoài lợi ích PFS của liệu pháp TYKERB vả Ietrozole ở phân tầng
<6 tháng, lợi ich về Tỉ lệ lợi ích lâm sảng (CBR) cũng được ghi nhận khi so sảnh vởi đơn trị liệu
Ietrozole (43,8% vả 31,7%, tương ứng).
Báng 8. Dữ liệu hiệu quả đổi với hai phân nhóm của Dân số ErbB² âm tỉnh
ẵnỊố ErbB² âm tinh: Dân số ErbB² âm tinh:
< 6 tháng1 2 6 tháng2
N=200 N = 752
TYKERB 1500 TYKERB 1500
mg’“gày Đơn trị Iiệu mg’ngày Đơn trị liệu
+ Letrozole Letrozole 2,5 + Letrozole Letrozole 2,5
2,5 mglngảy mglngảy 2,5 mglngây mglngảy
N=96 N=104 I N=382 N=370
Trung vị PFS 36,3 13,3 64,0 65,3
ễịẵaglịv'eie" tUâ" (21,9; 55,3) (12,1; 23,7) (58,3; 73,1) (59,1; 74,3)
Tỉ số nguy cơ 0,78 (0,57; 1,07) 0,94 (0,79; 1,13)
Giá trị P 0,117 0,522
C! = khoảng tin cậy
' thảng từ khi ngừng Iiệu pháp nội tiết
² tháng từ khi ngừng Iiệu pháp nội tiểt/chưa dùng liệu pháp nội tiết
Dữ Iiệu tiền lám sảng
Lapatinib đă được nghiên cứu trẻn chuột cống vả thỏ mang thai uống các liều 30, 6 120
mglkg/ngảy. Không có tảo dụng gây quái thai; tuy nhiên, dị tật nhỏ (động mach rốn ở bèn tr , “`
chứng xương sườn cố vả sự cốt hóa sởm) xảy ra ở chuột công ở Iiều độc cho mẹ 120 mglkg/ngảy
(gắp 6,4 lần phơi nhiễm dự kiên trên lâm sảng ở người dùng 1.250 mg lapatinib vả 2.000 mglm2
capecitabine). Ở thỏ, lapatinib liên quan đến độc tính cho mẹ ở liều 60 vả 120 mglkglngảy (6,5%
và 19% phơi nhiễm dự kiên trên lâm sảng ở người dùng liều 1.250 mg lapatinib vả 2.000 mg/m2
capacetibine, tương ứng) vả sầy thai ở liều 120 mglkglngảy. Độc tỉnh cho mẹ Iiên quan đến giảm
trọng lượng thai nhi, và biến dạng nhỏ ở xương. Trong nghiên cứu về sự phảt triển trước vả sau
khi sinh ở chuột cống, sự giảm sống còn ở chó con xảy ra giữa lúc sình vả ngảy 21 sau sinh ở các
liều 60 mglkg/ngảy hoặc cao hơn (gắp 3,3 lần phơi nhiễm dự kiến trên lâm sảng ở người dùng Iiều
1.250 mg lapatinib vả 2.000 mg/m2 capecitabine). Liều cao nhắt không có tác động đối với nghiên
cứu nảy lả 20 mglkglngảy.
20
Trong cảc nghiên cứu về tinh sinh ung thư khi uống lapatinib, đã thầy tổn thương da nặng ở các
Iièu thử cao nhắt, liều nảy tạo ra các phơi nhiễm dựa trèn AUC lên tới 1,7 lằn ở chuột nhắt vả
chuột cống đực, vả lẻn tới 12 lần ở chuột cống cái, so với người dùng 1.250 mg lapatinib vả 2.000
mglm2 capecitabine. Khỏng có bằng chứng về khả năng sinh ung thư ở chuột nhắt. Ở chuột cống,
tỉ lệ mắc mới u mạch máu Iảnh tinh ở hạch mạc treo cao hơn ở một số nhóm so với trong nhóm
đối chứng đồng thới, nhưng vẫn nằm trong giới hạn cơ bản. Củng có gia tăng nhồi máu thận và
hoại tử nhú ở chuột cống cái khi phơi nhiễm 6 vả 8 lằn so với ở ngưới dùng liều 1.250 mg lapatinib
vả 2.000 mglm2 capecitabine. Chưa rõ môi Iiên quan của cảc phát hiện nảy trên người.
Lapatinib không gây đột biến nhiễm sắc thể hay đột biến gen trong bộ phân tích bao gồm phân
tích sự khảo thường của nhiễm sắc thể chuột đồng Trung Quốc, phân tích Ames, phân tích sự
khác thường của nhiễm sắc thể tế bảo lympho ở người vả một phân tích sự khảc thường nhiễm
sắc thể tủy xương ở chuột cống trèn in vivo. Không có ảnh hưởng đén chức nảng tuyến sinh dục
ở chuột cống cái hoặc chuột cống đực, sự giao phối, hoặc sự sinh sản ở liều iê \tới 120
mglkglngảy (chuột cải) vả lên tới 180 mglkglngảy (chuột đưc) (tương ứng gắp 8 vấẫẵằn phối
nhiễm lâm sảng dự kiến ở người). Chưa biết ảnh hưởng lên khả năng sinh sản ở người. V
HẠN DÙNG
24 tháng kể từ ngảy sản xuât.
THẬN TRỌNG ĐẶC BIỆT KHI BẢO QUẢN
Bảo quản không quá 30°C.
ĐỂ XA TAM TAY TRẺ EM
ĐỌC KỸ HƯỞNG DẦN sứ DỤNG TRƯỞC KHI DÙNG
NÉU CÀN THÊM THÔNG TIN x… HỎI Ý KIEN BÁC SỸ
SÀN qur BỜ! TUQ, cục TRUỚNG
Glaxo Operations UK Limited P'TR } G PHÒfNCỄ
. ° JV n Jẳty Jfẫmy
Pnory Street, Ware, Giaxosmiẵilễẫfễ
Hertfordshire, SG12 ODJ, United Kingdom
ĐÓNG GÓI BỞI
GlaxoSmithKline Australia Pty Ltd
1061 Mountain Highway, Boronia,
Victoria 3155, Australia
TYKERB là nhãn hiệu thương mại của GlaxoSmithKline group of companies.
Dựa trên IPI 16 ngảy 04 thảng 7 nảm 2012 (và theo yêu câu của DAV)
TYKTAB 0814—16/040712
2]
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng