

















CỤCQUẨNLÝDƯỢC
ĐÃ PHÊ DL'YỆT
BỘYTẾ
/' L
. , / ;
Lạn đau..~… .?².
1
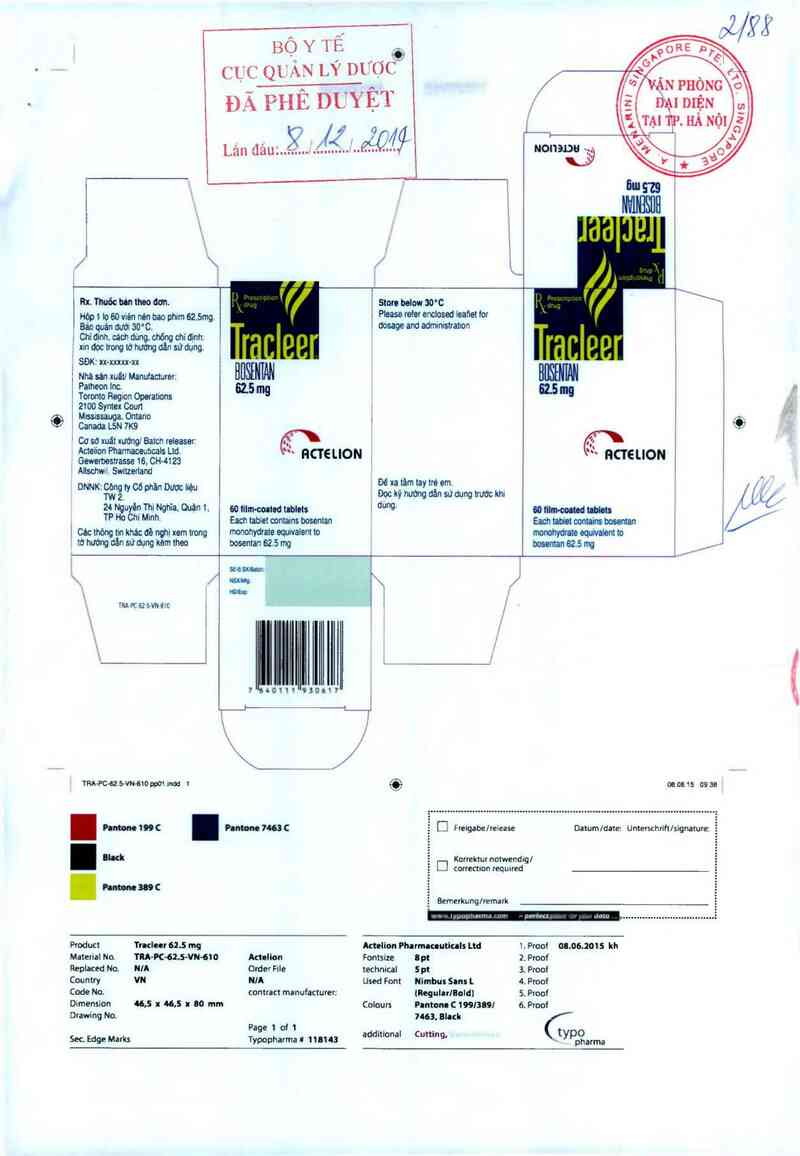
Rx.Thuõcbinthoo dơn. St… bdow 30°C
Hòp L Lọ so vien nén bao phim 62.5mg. -² Phase …… WPsed Mei f°f
Bán quán dưởi 30’C. J dosage and admmerauon
, Chi dịnh. cách ding, chõnq chí ũ_nhz
_ mdoctrong tờhưtmgdăn sửdụng.
' SĐK: LLLL—LLLLLLxx—xx 1
' Nhã sát xuéti Manưacturer: HBẾW
Patheon Inc.
Toronto Region Opuations 62'5 mg
2100 Syntex Com
Mssassauga. Ontano '
Canada L5N 7K9
' Cơ sd xuất xưfflol BaLcn releaser: ổ` (.fỉ`
Actelion Pharmaoeutials Ltd. … , u,
GmmeHm ncteuon , ncreuou
1 Alsoth Switzefiand ~ L
. - Đê xa tăm tay trẻ em.
DNNK“ Tcẵlgờ Có phần Dược hệu Đọc hỹ hưởng dãn sứdung Lrước km
²4 Nuuyẽạ Thi Nghĩa. OUận 1. eo tilm-ooated tủletl …… ., mm …
_ TP "° cm M'nh~ Each tabiat mntains bosentan EM … oontnhs …
L cac th0ng t'n khác 6! nợLi xem Lmng monohydrate equivalent to mmhydrate mm… to
’ từ hướng dân sử dụng kèm Lheo bosentan 62.5 mg bosentan 62.5 mg /
unm. .
m /
›oa- )
Lm x 52 svmrc ,i'
( i `|
) ~ `L
', , L
\ ' mi Il Il H 1 ]
i_._VN i _..7 il
1 :. 6 L L \ o : u 6 1 y
i L
/
J/
TRA~PCU.S~MLO ppin.imu L @ on 66 La os ae
I ……
PlM mc . Pan… 7463 c
Ilock
Ủ Freìgabe /rezease
[]
Konektur notwencbgl
coLrection required
Dalum/date: Unlevschrift/signature:
Bemerkung/remark
Pfoduct Trxleer 62.5 mg Actelion Phummutỉnls le t. Proof 0!.06.2015 kh
Material Na TIA-PC-us-VN-mo Actelion Fontsize Dpt 2. Proof
Replaced No. NIA Order File technical 5 pt 3. Proot
Country VN NIA Used Font Nimbus Sans L 4. Proof
Code No. contract manufacturer: (Regulnr/lolđ) 5. Proof
Dimension 46.5 x 46.5 : ao mm Colcurs PcntoncC199/JBĐ/ 6. Prooi
Drawing No. 7463, Black (/
Page 1 of 1 , _ t 0
Sec. Edge Mark; Typopharma I 115143 addmonal Cutting. ` yppharma
[""
n…— Mlnuhcluur ’;i\
Eldl MW c…… Iounnn Pnhcun Inc. “P
mohvùuo uuivulcmtu 1umntoùlnmn 0pcrntions ẫ
“““” ẫ1°"""'°ãJ Ẹ
ffl… W… LLL:LL.LL.Lf~ «z
… hn…“ AcLetiun Phunẵununcnh LLLL Ễ .
ỏ} ancrbmnmư. (ịi
z’ c…m ALLm…L L ,
Swnurhud
BUSiNIAN 62.5 mg
……p: 60tablets Ổ~`~'~ nơeuon
_ \ _/
TRA-PL-GZBVN—Gt2 ppOL.indơ 1 08.06.15 09:33
. Pantone 199 C I Pantone 7463 C Ủ Freigabe/release Datum/date: Unterschrift/signature:
. Pantone 389 C I Black Korrektur notwendig/
; Ủ correction required
Bemerkung/remark
www.typopharnta.con1 L'L perfectpu… « tv w `,L'"H dam ...."...“"...nuuuuu.....Ễ
Product Tracleer 62.5 mg Actelion Pharmaceuticals Ltd 1.Proof 08.06.2015 kh
Material No. TRA-PL—62.S-VN-õl 2 Actelion 2. Proof
Replaced No. NIA Order File Fontsize 4,5 pt 3. Proof
Country VN N/A technical 4.5 pt 4. Proof
Code No. contract manufacturer: Used Font Univers Cond. (57/67) 5. Proof
Dimension 76,2 x 31,75 mm Myriad Pro Cond. 6. Proof
Drawing No. Colours Pantone C 199/389/7463,
Page 1 of 1 Black
Sec. Edge Marks Typopharma # 1 18154 additional Cutting/
\ L"\
A` '
t`\ -
Tracleer®
Thuốc bán theo đơn Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Nếu cân thêm thông tin, xin hỏi ý kiến bác sĩ Để thuốc xa tâm tay trẻ em.
Thảnh phần:
Hoạt chất: Bosentan (dạng monohydrate) 625 mg hoặc 125 mg).
Tả dược: Tinh bột ngô, tinh bột ngô tiền gelatin hóa tinh bột natri glycollat, povidon,
glyceryl behenate rnagiê stearat, hypromellose glycerol triacetate talc, titan dioxid,
oxid sắt vảng, oxid sắt đô ethylcellulose
Dạng bảo chế vả khối lượng hoạt chẩt trên một đơn vị liều
Viên nén bao phim:
62,5 mg (viên nén tròn, lồi 2 mặt, mảu trắng cam, có chữ 62,5 trên một mặt)
125 mg (viên nén hỉnh ovan, lồi 2 mặt. có chữ 125 trên một mặt).
Chỉ định:
Điều trị trên bệnh nhân tăng áp lực động mạch phổi (PHA) theo phân nhóm II- IV của
WHO
Giảm số lượng vết loét chi mởi trên bệnh nhân xơ cưng động mạch hệ thống có loét /( (t
chi.
Liều dùng vả cách dùng
Cách dùng
Bệnh nhân cần được bảo sỹ có kinh nghiệm về bệnh tảng áp lực động mạch phối vả xơ
cứng mạch hệ thống chỉ định điều trị và theo dõi. Tracleer nên được uống sáng và tối.
cùng hoặc không cùng thức ăn. Nên nuốt cả viên nén bao phim với nước.
A
Liều dùng
Tãnq áp lưc đónq mach phồi _
Chế độ liều cho người lớn
Điều trị bằng Tracleer nên được bắt đầu với liều 62, 5 mg 2 lần mỗi ngảy trong thời gian
bốn tuần sau đó tăng đến liều duy tri là 125 mg 2 lần môi ngảy.
Chế độ liều cho trẻ em vệ trẻ vị thânh mên
Không có nghiên cứu đảy đủ về tác dụng vả độ an toản trên bệnh nhân tuối dưới 12.
Chế đó dùng liều sau được sử dụng tại thử nghiệm AC—052-356 (BREATHE-B): *
Cân nặng Liều khởi đằu Liều duy trì
(kg) (4 tuần)
10 S * S20 1xngảy 31,25 mg 2xngảy 31.25 mg
20 < * S40 2xngảy 31,25 mg 2xngảy 62.5 mg
>40 kg 2 x ngảy 62,5 mg 2 x ngảy 125 mg
o Liều 31,25 mg được chia từ viên nén bao phim 62,5 mg bằng dụng cụ chia viên.
Tuy nhiên, không có số liệu về lượng hoạt chắt cùa viên đã chỉa đôi. Thử nghiệm
được thiết kế để xác định dược động học trên trẻ em. Tuy nhiên, số lượng bệnh
nhân ở mỗi nhóm quả thấp để xác định được chế độ liều tối ưu cho các bệnh
nhân dưới 12 tuối Kết quả dược động học cho thắy sinh khả dụng thấp hơn trên
ngưới lớn tăng áp iực động mạch phối điều nảy có thể dẫn đến việc chưa đạt
được tác dụng tối ưu trên hệ thống mạch phỗi. Không có số liệu đầy đủ về thay
đồi huyềt động học ở trẻ em. Không có số iiệu trên trẻ em dưới ba tuổi.
Xơ cưng đóng mach hê thổnơ có ioét chi
Chế độ !L'ều cho người lớn
Điêu trị với Tracleer nên bắt đầu với liều 62. 5 mg hai lần một ngảy trong vòng bốn
tuần tăng tới liều duy tri 125 mg, hai lần một ngảy Kinh nghiệm từ cảc thử nghiệm lâm
sảng có kiểm soát cho thấy, chỉ định nảy giới hạn trong thời gian 6 thảng Cần thường
xuyên đảnh giá sự đáp ứng trong điều trị vả sự cần thiết tiêp tục điều trị
Chế độ ii'ều cho trẻ em vả trẻ vị thảnh niên
Không có số liệu về an toân vả hiệu quảtrên bệnh nhân dưới 18 tuồi.
Chỉ có số liệu hạn chế trèn bệnh nhân dưới 40kg Để chọn liều cho các bệnh nhân nảy
xem bảng liều phần“ sử dụng cho trẻ em vả trẻ vị thảnh niên". Liều 31 25 mg được chiạ
từ viện nén 62, 5 mg không chia rãnh bằng dụng cụ chia liều. Tuy nhiên khỏng có số
liệu về hảm lượng hoạt chẳt trong viên nén đã được chia đôi.
DừLLgL đều trị
Chưa có kinh nghiệm đầy đủ về việc đột ngột dừng điều trị bầng Tracleer Không có
bằng _chứng về tảo dụng dội ngược ác tính của thuốc. Đế trảnh tinh trang lâm sảng có
thế xâu đi do tác dụng dội ngược có thể cớ, cần xem xét việc giảm dần liều giảm một
nửa trong vòng 3- 7 ngảy. Khuyến cáo nên theo dõi bệnh nhân chặt chẽ trong giai đoạn
ngừng thuốc.
Chế độ liều cho bệnh nhân có bệnh gan
Không cần điếu chỉnh liều cho bệnh nhân suy giảm chức náng gan nhẹ (ví dụ như bệnh
nhân Child- -Pugh nhóm A) (xem phần "Đặc tĩnh dược động học”.) Tracleer chống chỉ
định trên bệnh nhân rối Ioạn chức năng gan vừa đến nặng hoặc khi aminotransferase
lớn hơn ba lần giá trị binh thường tại thời điểm trước khi điều trị (xem phần "Chống chỉ
định", "chủ ý vả thận trọng đặc biệt khi sử dụng" vả ““các đặc tính dược động học")
Xem phần "Chú ý và thận trọng đặc biệt khi sử dụng” để xử trí trong trường hợp
aminotransferase tăng trong quá trình điều trị.
Chế độ iiều cho bệnh nhân suy thận
Không cần điều chỉnh liều trên bệnh nhân suy giảm chức năng thận hoặc trèn bệnh
nhân lọc máu (xem phần 'đặc tỉnh dược động học)
Chế độ iL'ều trên bệnh nhân iớn tuổi
Không có nghiên cứu đầy đủ về tác động của độ tuồi đến việc điều trị bằng thuốc.
Chống chỉ địinh _
Mãn cảm với bosentan hoặc bât cứ thảnh phần nảo của thuốc.
o
' :
/.;Mt.ffl "" sn,x\
\
Bệnh gan vừa đến nặng (Child Pugh nhóm B hoặc C xem phần Đặc tính dược động
học).
Aminotransferase gan tăng trưởc khi điều trị, vi dụ như aspartate aminotransferase
(AST) vảlhoặc alanine aminotransferase (ALT) cao trên ba lần giá trị tối đa (xem phần
Chú ývả thận trọng đặc biệt khi sử dụng")
Phụ nữ có thai
Phụ nữ trong độ tuối sinh đẻ không sử dụng các biện phảp tránh thai thích hợp.
Sử dụng đồng thời với cyclosporin A vả glibenclamid.
Chú ý vả thận trọng đặc biệt khi sử dụng
Đánh giá nguy cơ-Iợi ich cùa bosentan chưa được thưc hiện trên bệnh nhân tảng áp
lực động mạch phổi ở bệnh nhân mức độ nghiêm trọng tương ứng với độ | thang độ
của WHO (xem phần “đặc tỉnh dược Lực học")
Điều trị bầng Tracleer chỉ nên bắt đầu khi ảp lưc tâm trương động mạch trèn 85 mmHg.
Điều trị bằng Tracleer không có tác dụng trên vét Ioét chi sẵn có.
Chúc năng gan
Tảng aminotransferase gan (aspartate vảlhoặc alanine aminotransferase; AST vả/hoặc
ALT) do bosentan phụ thuộc Iiếu Thay đối của cảc enzym gan thông thường xuất hiện
trong 26 tuần đầu điều trị (“xem phần tảo dụng không mong muốn ") mặc dù sau đó
không xuất hiện. Tăng giá trị cảc enzym gan thường từ từ và không có triệu chứng
Aminotransferase có thế giảm dần khi tiếp tục điều trị bằng Iièu duy trì Tracleer hoặc
sau khi giảm liều. Tuy nhiên, có thể cần dừng thuốc. Trong số ít trường hợp có xơ gan
hoặc suy gan được bảo cảo sau khi đưa thuốc ra lưu hảnh trẻn thị trường. Cơ chế của ’
tảc dụng không mong muốn nảy chưa được biết rõ.
Sự tăng aminotransferase có thể líên quan một phần đến việc ức chế cạnh tranh thải
trừ muối mật từ tế bảo gan. Tuy nhiên, một cơ chế khảo cũng chưa được chứng minh
rõ rảng có thế liên quan đến việc suy giảm chức nảng gan tiên triến. Không Ioại trừ khả
nảng tế bảo gan bị phân hủy do tích tụ bosentan-có thể dẫn đên suy gan nghiêm trọng-
hoặc do một cơ chế miễn dịch. Nguy cơ suy giảm chức năng gan có thể tăng nếu
bosentan được điều trị đồng thời vời thuốc ức chế bơm muối mật (BSEP), như
rifampicin glibenclamid vả cyclosporin A (xem phần “chống chỉ định” vả "tương tác").
Tuy nhiên, cảc dữ liệu về vấn đề nảy còn hạn chế.
Giá trị aminotransferase phải được đo trước điều trị vả hảng tháng trong suốt
quá trinh điều trị bằng Tracleer. Thêm nữa, cần phải đo giá trị aminotransferase
gan 2 tuần một lần mỗi khi tăng liều. Các khuyến cáo khi có tăng giá trị ALTIAST
Khuyển cáo đĩểu tn“ và kiểm soát
ALT/AST >3 và 55 lần giá trị giá trị binh thường tối đa (UNV): kiềm tra đo lại kết quả
Nếu vẫn khẳng định kêt quá cũ, cần giảm liều hảng ngảy hoặc dừng dùng thuốc và
kiếm tra giá trị aminotransferase tối thiệu 2 lằnltuần. Khi giá trị aminotransferase trở lại
mức trước khi điều trị, có thể bắt đầu tiêp tục điều trị bằng Traci_eer theo hướng dẫn
dưới.
ALT/AST >5 vả 58 giá trị bình thường tối đa: kiềm tra đo lại kêt quả. Nếu vẫn khẵng
định kết quá cũ, cần giảm liều hảng ngảy hoặc dừng dùng thuốc vá kiềm tra giá trị
xc'g
_l/ ›"f-ã
n\
aminotransferase tối thiều 2 lầnltuần. Khi giá trị aminotransferase trở lại mức trước khi
điều trị, có thể bắt đầu tiếp tục điều trị bằng Tracleer theo hưởng dẫn dưới.
ALTIAST > 8 lần giá trị bình thường tối đa: phải dừng thuốc. Không điều trị lại.
Nếu biều hiện cảc triệu chứng liên quan đến suy giảm chức năng gan, ví dụ như
nôn buồn nôn, sốt, đau dạ dảy, vảng da mệt bắt thường, triệu chứng giông cúm (đau
khớp xương, đau cơ, sốt), cân dừng điều trị. Không xem xét việc tiêp tục điều trị lại
bằng Tracleer.
TL'ểp Lục cũều trị
Tíềp tục điều trị chỉ được xem xét khi xác định lợi ích điều trị vượt trội so với nguy cơ có
thể có vả giá trị aminotransferase gan trở lại mức trước khi điều trị. Khuyến cáo cần
tham vẳn bảo sỹ chuyện khoa về gan. Nếu bắt đầu điều trị lại, cần tuân thủ chế độ liều
trong phần' Chế độ liều vả cách dùng'.’ Sau khi bắt đầu điều trị lại, cẩn kiểm soát
mức aminotransferase trong vòng 3 ngảy đầu, sau 2 tuần và sau đó theo khuyến
cảo ở phần trên.
Nổng độ Hemogiobin
Nồng độ hemoglobin giảm có phụ thuộc vảo liều điêu trị bosentan (xem phận Tác dụng
không mong muôn '). Việc giảm nồng độ hemoglobin khỏng tiến triền mả ôn định trong
vòng 4- 12 tuần đầu sau khi bắt đầu điêu trị trong nghiên cứu có kiếm soát dùng
placebo. Các trường hợp thiếu mảu cần truyền erythrocyte được báo cảo trong giai
đoạn hậu marketing (xem phần “Tác dụng không mong muốn”) Khuyến cáo nên kiểm
tra nồng độ hemoglobin trưởc khi bắt đầu điều trị hảng thảng trong 4 thảng đầu và sau
đó 3 thảng một lần. Nếu nồng độ hemoglobin giảm trèn lâm sảng, cằn đánh giá vả xảc’
định nguyên nhân và có biện pháp điều trị thích hợp Các bệnh nhân điều trị bằng thuốc
chống đông máu đường uống khuyến cảo cần giám sát chặt chẽ giá trị INR đặc biệt khi
bắt đầu điêu trị và khi táng Iièu (xem phần “tương tảc thuốc warfarin")
Thiểu máu hồng cầu iL'ểm
Có bảo các hậu marketing có liên quan đên việc tảng thiếu máu hông cầu liêm ở bệnh
n , A 1 A .). I . .). .
nhan co bẹnh hong cau lLem trươc khL đLeu trL.
Sử dụng trên bệnh nhân tắc nghẽn mạch phối (Pulmonary veno—occfusive disease —
PVOD)
Có cảc nghiên cứu về trường hợp phù phối khi điều trị bằng các thuốc giản mạch (chủ
yếu là cảc prostacyciins) trèn bệnh nhân tắc nghẽn mạch phối. T,rong nguyên nhân nảy,
nếu triệu chứng phù phối tiến triển trên bệnh nhân tãng áp lực động mạch phồi (PAH)
sau điều trị bằng Tracleer, cần xem xét việc liên quan đến bệnh tắc nghẽn mạch. Có
các nghiên cứu hậu marketing về phù phổi trên bệnh nhân nghi ngờ có bệnh tắc nghẽn
mạch phồi khi điều trị vởi Tracleer.
Sử dụng trên bệnh nhân tăng áp Lực động mạch phổi theo sau suy tim trái
Trong nghiên cứu có kiếm soát dùng placebo trên bệnh nhân tảng áp lực động mạch
phồi, phù mạch và giảm hemoglobin được bảo các nhưng không Iảm tăng tỉ lệ nhập
viện do tình trạng lâm sảng xâu đỉ. Trong một nghiên cứu trên bệnh nhản suy tim mạn
tỉnh nặng. có tăng số lần nhập viện do ứ dịch sau khi bắt đầu điêu trị. Do các bệnh
\'a\\
nhân tăng ảp lực động mạch phối thường đồng thời có suy tim trải vả ứ dịch được quan
sát thấy trên cảc bệnh nhân tăng ảp lực động mạch phổi trong căc nghiên cứu có kiểm
soát với giả dược khi điều trị bằng Tracleer khuyến cáo cân giảm sảt cảc triệu chưng ư
nước (ví dụ như tăng cân). Trong trựờng hợp nảy, khuyến cáo nên bắt đầu điều trị
bằng thuốc lợi tiểu hoặc tăng Iièu thuốc lợi tiều. Các bệnh nhân có triệu chưng ừ nước
cần được điều trị vời thuốc lợi tiểu trưởc khi bắt đầu điều trị bằng bosentan.
Tăng áp iực động mạch phổi trẽn bệnh nhản nhiễm HIV
Kinh nghìệm sữ dụng Tracieer trên bệnh nhân tăng ảp lực động mạch phồi vả nhiễm
HIV đang điều trị bằng thuốc kháng virus còn hạn chê. Một nghiên cứu về tương tác
thuốc giữa bosentan vả lopinavir + ritonavir trên người khỏe cho thấy có tăng nống độ
bosentan, xem phân "Tương tác".
Khi bắt đầu điều trị bằng Tracleer trên bệnh nhân phải dùng thuốc ức chế prostease
kiểu ritonavir, cần theo dõi cần thận sự dung nạp với Tracleer trên bệnh nhân. Do có
thế cảc tương tác ảnh hưởng đến tác dụng của thuốc khảng virus, bệnh nhân nhiễm
HIV cần được theo dõi cẩn thận.
Epoprostenoi
Sự phối hợp Tracieer vả epoprostenol được nghiên cứu trên 2 thử nghiệm: BREATHE-
2 vả BREATHE— 3
BREATH- 2 iả nghiên cứu mù đôi, ngẫu nhiên đa trung tâm vời Tracleer (n=22) vả giả
dược (n=11) trên 33 bệnh nhân tăng áp lưc động mạch phồi nặng, đồng thời được
dùng epoprostenoi.
BREATHE-3 là một nghiên cứu có kiếm soát, nhăn mở. 10 trên 19 bệnh nhân nhi được "
dùng đồng thời Tracleer vả epoprostenol trong vòng 12 tuần.
Cảo dữ liệu an toản ở nhóm nảy không khác cảc dữ liệu an toản khi dùng riêng rẽ từng
hoạt chắt và liệu phảp phối hợp được dung nạp tốt ở cả nhóm trẻ em vả người lớn.
Trong nghiên cứu trên người lởn, hai bệnh nhân dùng Tracleerlepoprostenol tử vong
do bệnh tiến triến. Hiệu quả [âm sảng của việc kết hợp thuốc chưa được chứng minh.
Sử dụng trên phụ nữ ở độ tuổi sinh đẻ
Xem phần "Phụ nữ có thai vả cho con bú"
Sử dụng đổng thời với các_thuổc khác ,
Xem phản "Tương tảc thuôc”
Tương tác thuốc
Bosentan lả chât cảm ứng cytochrome P450 isoenzym CYP2CS vả CYP3A4. Các dữ
liệu in vitro cho thầy CYP2C19 bị cảm ứng. Kêt quả là nồng độ cảc thuốc bị chuyền hóa
bởi các isoenzym nảy trong máu cũng bị giảm khi điều trị đồng thơi vời Bosentan. Cần
xem xét khả nảng tác dụng của các thuốc bị chuyển hóa bởi cảc isoenzym nảy có thể
thay đổi. Liều dùng cảc thuốc nảy có thế phải được điều chỉnh khi bắt đầu hoặc kết thúc
điều trị vởi Tracleer hoặc khi thay đồi liều.
Bosentan chuyến hóa bởi CYP209 vả CYP3A4. Nếu cảc isoenzyme nảy bị ức chế,
nồng độ bosentan trong huyết tương có thể tăng (xem ketoconazol). Sự ảnh hưởng cùa
các chầt ức chế CYP2CS đến nồng độ bosentan chưa được nghiên cứu. Cần thận
trọng khi phối hợp các thuốc dạng nảy. Fluconazol phần Lờn ức chế CYP209 vả
CYP3A4 một phần nảo đó nên có thế lảm tãng đáng kể nồng độ bosentan trong huyệt
tương. Không khuyến cảo kết hợp nảy. Khõng khuyến cáo sử dụng đồng thời các chât
có khả nảng ức chế CYP3A4 (như ketoconazol, itraconazol vả ritonavir) vả chắt ừc chế
CYP2C9 (như voriconazol) vời Tracleer.
Cảo nghiên cứu đặc thù về tương tảo vởi cảc thuốc nảy đưa ra kết quả như sau:
Các thuốc tránh thai dạng hormon: Điếu trị đồng thời Tracleer 125 mg x 2 lần một ngảy
trong ? ngảy cùng vởi một thuốc tránh thai dạng uống (chứa norethisteron 1 mg vá
ethinyloestradiol 35 mcg) lảm giảm AUC cùa norethisteron 14 % vả AUC của
ethinyloestradiol 31%. Tuy nhiên, AUC của norethistron vả ethynyloestradiol giảm lần
lượt tời 56% và 66% trên người tinh nguyện nữ riêng lé. Do vặy, dùng một minh thuốc
tránh thai dạng hormon, không phụ thuộc vời đường dùng thuốc (vi dụ như đường
uống, tiêm bắp. tiêm dưới da, đặt âm đạo và cảc dạng cắy dưới 'da) không được xem là
biện pháp tránh thai tin cậy.
CycLos,oorin A: Chống chỉ định điếu trị đồng thời Tracleer vả cyclosporin A (xem phần
"tương tảo thuốc”). Sau khi điều trị đồng thời, nồng độ bosentan thắp nhắt Iờn gắp 30
lần so với khi điều trị bosentan một mình. Tại trạng thái cân bằng, nồng độ bosentan
trong huyết tương lớn gầp 3-4 lần so với nồng độ bosentan khi điếu trị một minh. Cơ
chế của tương tảo nảy chưa được biết Nồng độ cyclọsporin A (một chắt nến CYP3A4)
giảm tời 50%. Cả cyclosporin vả bosentan đều ức chế bơm xuất muối mật, điếu nảy có , ( [LL
thể lảm tăng nồng độ aminotransferase.
Tacro/imus, siroiimus: Điều trị đồng thời tacrolimus hoặc sirolimus vả Tracleer trên
người chưa được nghiến cứu. Tương tự như điếu trị đông thời với cyclosporin A, điếu
trị đồng thời vời tacrolimus hoặc sirolimus có thế Iảm dẫn đến việc tảng nồng độ
bosentan trong huyêt tương. Điếu trị đồng thời vời Tracleer có thể Iảm giám nồng độ
tacrolimus hoặc sirolimus trong huyết tương. Vì lý do nảy, khộng khuyến cảo điều trị
đồng thời Tracleer vời tacrolimus hoặc sirolimus Bệnh nhân bắt buộc phải kết hợp điều
trị như vậy phải được theo dõi chặt chẽ tác dụng không mong quốn của Tracleer vả
nồng độ tacrolimus hoặc sirolimus trong huyết tương.
GiibencLamiơ: Điều trị đồng thời Tracleer 125 mg 2 lần một ngảy trong 5 ngảy Iám giảm
nồng độ glibenclamid trong huyết tương (một chắt nèn CYP3A4) tới 40%, có thể Iảm
giảm tảc dụng hạ đường huyết đáng kế. Nống độ bosentan trong huyết tương giảm tới
29%. Hơn nữa, tỉ lệ bệnh nhân tảng aminotransferase củng tảng trèn những bệnh nhân
nảy. Cả glibenclamid vả bosentan ức chế bơm xuất muối mật, điều nảy có thể giải thích
việc tảng nồng độ cảc aminotransferase. Do vậy, không nên sử dụng phối hợp nảy
(xem phần "Chống chỉ định”). Không có số liệu tương tác vời các sulfonylurea khác.
WaLfarin: sử dụng đồng thời Tracleer (500 mg, hai lằn một ngảy) dẫn đến giảm nồng độ
S-warfarin vả R-warfarin (chắt nến cùa CYPZCS) tởi 30%. Trên bệnh nhân tăng áp lực
động mạch phổi mạn tĩnh điều trị bằng warfarin, dùng Tracleer 125 mg hai lần một ngảy
không cho thầy có tác dụng trên lâm sảng liên quan đến Ithời gian prothrombinllRN.
Khộng cần thiết phải điều chỉnh liêu warfarin hoặc thuôc chông đông mảu tương tự khi
:32² \%\ì
ll`l
bắt đầu điều trị bặng bosentan Tuy nhiên, khuyến cảo cần theo dỏi chặt chế giá trị INR,
đặc biệt khi bắt đầu điều trị vả khi tăng liều
Simvastatin: Điều trị đồng thời Tracleer 125 mg 2 iần một ngảy trong 5 ngảy lảm giảm
nồng độ simvastatin (một chất nèn CYP3A4) trong huyết tương vả chất chuyền hòa
beta_-hydroxyacid có hoạt tính tương ứng là 34% và 46%. Nồng độ của bosentan trong
huyêt tương không bị ảnh hưởng khi điều trị đồng thời với simvastatin. Cần xem xét
việc theo đõi nồng độ cholesterol để điều chỉnh liếu simvastatin.
Ketoconazoi. Điều trị đồng thời Tracleer 62, 5 mg hai lần một ngảy trong 6 ngảy vả
ketoconazol, một chắt ức chế CYP3A4 mạnh, có thế lảm tăng khoảng 2 lần nông độ
bosentan trong huyết tương. Không cần thiết phải điều chinh liếu Tracleer. Mặc dù
chưa được chứng minh bằng các nghiên cừu in vivo, cảc chầt ức chế CYP3A4 khảo
(như itraconazol vả ritonavir) có thể gây tác dụng tương tự Iảm tăng nồng độ bosentan
trong huyết tương. Tuy nhiên, nguy cơ nảy tồn tại trên bệnh nhân có chắt chuyến hóa
CYP209 kém vả cảc bệnh nhân điều trị động thời với chảt ức chế CYP3A4 và có thế
Iảm tăng hơn nữa nồng độ bosentan, điều nảy có thể dẫn đến các tảo dụng phụ nguy
hiếm.
Digoxm: điêu trị đồng thời bosentan 500 mg 2 lần một ngảy trong 7 ngảy có thế lảm
giảm diện tich dưới đường cong - AUC cúa digoxin 12% , nồng độ cưc đại Cmax 9% vả
nồng độ cực tiểu Cmin 23%. Tác dụng nảy có thể liên quan đến việc giảm P-
glycoprotein. Tương tảo nảy hầu như không có giá trị trèn lám sảng. //
L—Ẹ;\
,—`
/
Rifampicin: rifampicin lả chât ức chế CYP209 vả CYP3A4. Điều trị đồng thời rifampicin
vả Tracleer 125 mg (2'lần một ngảy x 7 ngảy) lảm giảm nồng độ bosentan tới khoảng
58%. Cần phải cân nhăc sự giảm hiệu quả điều trị của bosentan.
Siidenaffl: Điều trị đồng thời Tracleer 125 mg 2 lần một ngáy vả sildenafil 80 mg 3 lần
một ngảy lảm giảm diện tĩch dưới đường cong AUC của sildenafil 63% và iảm tăng
AUC của bosentan tới 50%. Phối hợp được dung nạp tốt. Không cân thiết phải điều
chỉnh iièu Tracleer.
Lopinavir + Ritonavin Điều trị đồng thời Tracleer 125 mg hai lần một ngảy vả
lopinavir+ritonavir 400 + 100 mg hai lần một ngảy trong 9,5 ngáy trên người tinh
nguyện khỏe mạnh cho thấy tại ngảy điều trị thứ 4 nồng độ bosentan trong huyêt
tương tảng cao gắp khoảng 48 lần so với nồng độ bosentan huyết tương trên người
điều trị bằng Tracleer một mình. Ở ngảy thứ 10, nồng độ bosentan trong huyết tương
gấp khoảng 5 lần nồng độ bosentan trong huyết tương khi điều trị Tracleer một mình
Nồng độ của lopinavir vả ritonavir ở trạng thải cân bằng giảm Itượng ứ'ng khoảng 14%
vả 17%. Khi điều trị đồng thời với lopinavir+ritonavir hoặc chât ức chế protease dạng
ritonavir khảc độ dung nạp Tracleer vệ các thuốc HIV khảc cần được theo dõi (xem
phần “Chú ý vả thận trọng đặc biệt khi sử dụng' ’.)
Phụ nữ có thai và cho con bú
Độc tỉnh trên sinh sản được phảt hiện trên cảc thử nghiệm trên động vật (về tác động
gây quái thai và độc trên phôi; xem phần ““Các số liệu an toản tiền Iảm sảng”). Chỉ có
một vải báo cáo hậu marketing về việc sử dụng Tracleer trên phụ nữ có thai. Tracleer
chống chỉ định trên phụ nữa có thai (xem phần “Chống chỉ định").
Tracleer có thể được sử dụng trèn bệnh nhân trong độ tuổi sinh đẻ nếu test thử thai âm
tính trước khi bắt đằu điều trị vả bệnh nhân được phổ biến về c_ảc biện phảp tránh thai
tin cậy vả phải sử dụng các biện phảp tránh thai tin cậy. Bệnh nhân vả bảc sỹ kê đơn
cần được thông báo lả Tracleer có thể lảm giảm tác dụng của thuốc trảnh thai dạng
hormon do có tương tác dược động học (xem phần "Tương tác thuốc”). Vì lý do nảy,
phụ nữ ở độ tuối sinh đế không nên sử dụng cảc biện pháp tránh thai dùng hormon
(đường uống, tiêm bắp, tiêm dưới da, viên đặt âm đạo và cảc dạng cấy dưới da khác)
như một biện phảp trảnh thai duy nhắt mả phải dùng thêm hoặc thay thế bằng một biện
pháp trảnh thai tin cậy khác (như dùng bao cao su cho nữ, mảng chắn, vòng trảnh thai,
bao cao su cho nam). Cần tham vấn bảo sỹ phụ khoa khi có bầt cứ nghi ngờ nảo về
các biện pháp trảnh thai ảp dụng cho từng bệnh nhân. Cảc biện pháp trảnh thai cần
tiếp tục trong vòng 3 tháng sau khi ngừng điều trị với Tracleer.
Do khả nảng thất bại khi tránh thai bằng hormon khi điếu trị với Tracleer và có nguy cơ
tình trạng tăng áp lưc mạch phổi nghiêm trọng trong thai kỳ, khuyến cáo cần kiêm tra có
thai hay không để đảm bảo phảt hiện cảng sớm cảng tốt nếu có thai. Phụ nữ mang thai
trong giai đoạn điều trị với Tracleer cần được thông bảo nguy cơ có thể có cho thai nhi
Việc Tracleer có thể qua được sữa mẹ hay không chưa được biết. Người mẹ đang nuôi
1
con bằng sữa mẹ điếu trị bằng Tracleer cần được cai sữa cho em bé //
/
Độ an toản trên chức nãng tinh hoản
Giảm sổ iuợng tinh trùng
Nghiên cứu AC- 052-402 đảnh giá tác động trện chừc năng trên tinh hoản của Tracleer
62. 5 mg hai lần một ngảy trong vòng 4 tuần, sau đó là 125 mg hai lần một ngảy trong 5
tuần. Hai mươi lăm bệnh nhân tăng ảp lực động mạch phối độ III và IV theo phản Ioại
của WHO và có số lượng tình trùng ở giới hạn bỉnh thường tham gia vảo nghiên cứu;
23 bệnh nhân hoản tắt nghiên cứu và 2 bệnh nhân dừng nghiên cứu do có các phản
ứng phụ không liên quan đến chừc năng của tinh hoản. Số lượng tinh trùng duy tri ở
mức binh thường trên tắt cả 22 bệnh nhân trên sộ liệu sau 6 tháng và không có thay
đối về hinh thái học tinh trùng, sự di chuyến và nồng độ hormon được quan sát thầy.
Một bệnh nhân có tinh trùng di chuyển chặm đáng kế tại thời điếm 3 tháng vả số lượng
tinh trùng duy trì mức thầp trong 2 lần đo sau trong 6 tuần tiếp theo Sau khi dừng điều
trị bằng Tracleer trong vòng 2 tháng, số lượng tinh trùng iại trở về giới hạn binh thường
Mối liến quan của quan sát nảy lá không chắc chắn do có nhiều yếu tố tự nhiên trẻn
giữa các cá thể ảnh hướng đến số lượng tinh trùng. Mặc dù vặy, theo các số liệu như
trên, không thế Ioại trừ khả năng chắt đối kháng thụ thể endothelin lả Tracleer có thể
ảnh hưởng đến khả năng sinh tinh, không có tảo dụng trên hệ thống trên chức nảng
tinh hoản khi điều trị bằng bosentan lâu dải được quan sát tại nghiên cứu náy tương
ứng với dữ iìệu về độc tính cũa bosentan.
Tác dụng lên khả năng lái xe vả vận hảnh máy móc
'~b
Khõng có nghiến cứu nảo được thực hiện về tảo động của Tracleer trên khả năng lái xe
vả vận hảnh mảy móc. Tracleer có thể gây chóng mặt, lảm ảnh hướng đèn khả năng lải
xe hoặc vận hảnh mảy móc.
Tác dụng không mong muốn
Tóm tắt các kết quả từ các thử nghiệm giá dược có kiểm soát
Trên hại mươi thử nghiệm giả dược có kiếm soát được tiến hảnh trên các chỉ định điếu
trị, tổng số 2486 bệnh nhản được điếu trị bằng bosentan, ở liếu từ 100-200 mg một
ngảy và 1838 bệnh nhân điều trị bằng giá dược. Khoảng thời gian điều trị trung binh là
45 tuần. Tảo dụng không mong muốn ,thường gặp nhắt (xảy ra trên it nhất 1% bệnh
nhản dùng bosentan vả với tần xuất ít nhầt trên 0,5% đối với nhóm dùng giả dược bao
gồm: đau đầu (11,5% so với 9,8%), phù mạchlgiữ nước (13,2% so với 10,9%), chức
năng gan bất thường (99,9% so với 4,6%) vá thiếu máu/giảm hemoglobin (9,9% so với
4,9%).
Tác dụng không mong muốn được phân hạng theo tần xuất sau: rất thường gặp (21/10);
thường gặp (21/100 đến < 1110); không thường gặp (21l1,000 đến < 1/100); hiếm gặp
(21110,000 đến < 111,000); rầt hiếm gặp (<1/10,000).
Báo cáo từ cảc nghiên cứu sau khi lưu hảnh trên thị trường được thế hiện bằng chữ in
nghiếng. Nhóm tần xuất không tĩnh đến các yếu tố khảo như thời gian điếu trị khác
nhau, tình trạng trước khi điều trị vả cảc đặc tính nền của bệnh nhân.
'›
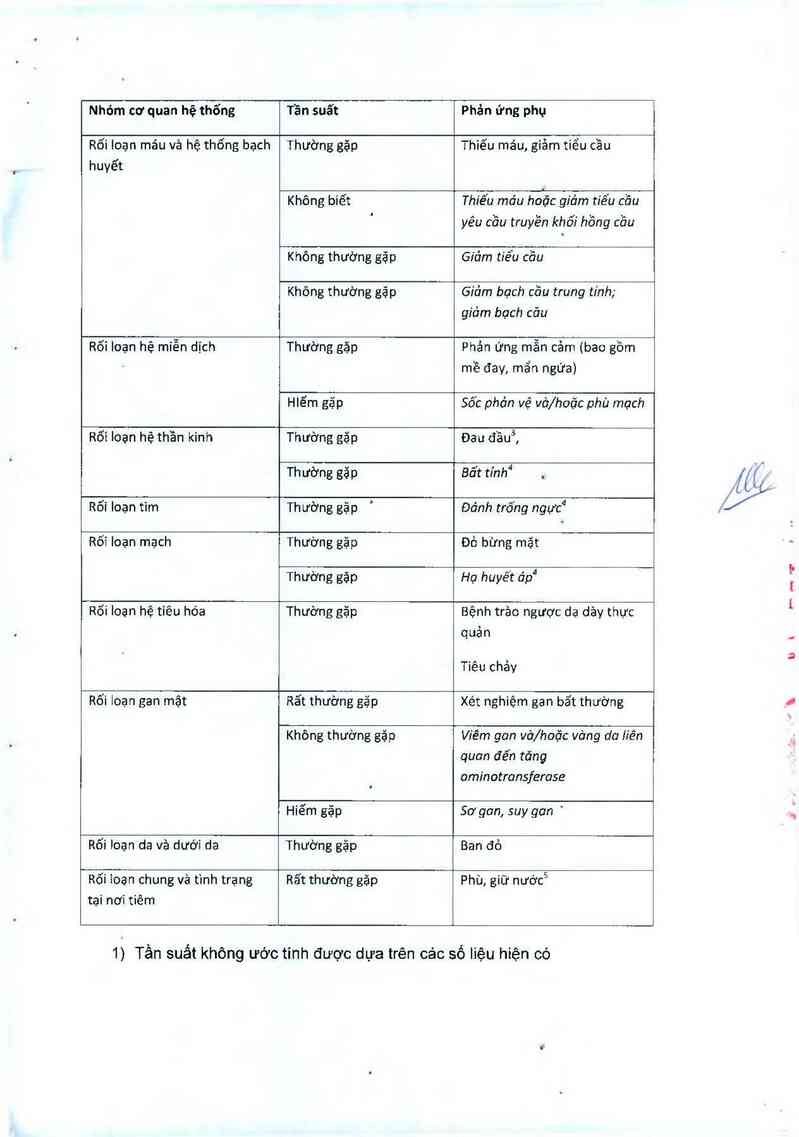
Nhóm cơ quan hệ thống Tần suất Phản ứng phụ
Rối loạn máu vả hệ thống bạch Thường gặp Thiểu máu, giảm tiểu cầu
huyết
Không biết Thiếu mđu hoặc giỏm tiếu cồn
' yêu cồu truyền khối hồng cồu
Không thường gặp GLđm tiểu cõu
Không thường gặp Giỏm bạch cồu trung tinh;
giảm bạch cỡu
Rối Ioạn hệ miễn dịch Thường gặp Phản ứng mẫn cảm (bao gồm
mề đay, mẩn ngứa)
Hlếm gặp Sốc phc’m vệ vở/hoặc phù mạch
Rối loạn hệ thần kinh Thường găD Đau đầuẵ
Th ường găp Bổt tỉnh"l .
Rõi Ioạn tim Th ường gặp ' Đơ'nh trống ngực“
Rõi loạn mạch Thường gặp Đỏ bừng măt
Thường Eăp Họ huyết đp“
Rối Ioan hệ tiêu hóa Thường 8ăp Bệnh trảo ngược da dảy thực
quản
Tiêu chảy
Rối loạn gan mật Rất thường gặp Xét nghiệm gan bất thường
Không thường gặ p Viêm gan vở/hoặc vờng do Liên
quan đến tăng
ominotransferose
Hiếm gặp Sơ gan, suy gan '
Rối loạn da và dưới da Thường sặp Ban đỏ
Rõi ioan chung vả tình trạng Rất thường Bẫp Phù, giữ nước5
tại nơi tiêm
1) Tần suất không ườc tinh được dựa trên cảc số liệu hiện có
2) Phản ứng mẫn cảm được bảo cảo trên 9, 9% bệnh nhân dùng bosentan vả 9,1%
bệnh nhân dùng giả dược.
3) Đau đầu được báo cáo trện 11,5% bệnh nhân dùng bosentan vả 9,8% bệnh
nhân dùng giả dược.
4) Phản ứng loại nảy có thế liên quan đến cảc bệnh mắc kèm.
5) Phù hoặc giữ nước được báo cáo trện 13, 2% bệnh nhản dùng bosentan vả
10,9% bệnh nhân dùng giả dược.
Bệnh nhi (BREA THE-3)
Cảc dữ liệu an toản trên nhóm bệnh nhân nảy (BREATHE 3: n=19) khi điếu trị bằng
Tracleer tương tự dữ liệu lâm sảng quan sảt thầy trong thử nghiệm trung tâm trên bệnh
nhân là người lớn bị tăng ảp lực động mạch phổi. Trong nghiên cứu BREATHE-3, phản
ứng phụ thường gặp nhất lá đỏ bừng mặt (21%). đau đầu vả chức năng gan bắt
thường (mỗi tảo dụng phụ 16%).
Thay đổi các tnị số trén gan ':
Trong chương trình lâm sảng nảy, tặng aminotransferase ở gan phụ thuộc Iièu
thường xuất hiện trong vòng 26 tuần điều trị, thường phát triến từ từ và chủ yếu
là không có triệu chứng.
Cơ chế của phản ứng phụ nảy không được rõ. Sự tảng aminotransferase có thể
đảo ngược khi tiếp tục điều trị với liều Tracleer duy trì nhưng có thế cần tạm
dừng.
Trong giai đoạn hậu marketing, xơ gan và suy gan hiếm gặp đă được báo cáo.
Trên hai mươi thử nghiệm tích hợp có kiếm soát placebo, Aminotransferase gan
tăng~gắp 3 lần giá trị bình thường tối đa được thây trên 11,2% bệnh nhản trong
nhóm điều trị với bosentan so với 2,4% trong nhóm bệnh nhân điêu trị bằng
placebo. Tăng trên 8 lần giá trị tối đa được thấy trên 3,6% bệnh nhân điều trị
bằng bosentan và 0,4% bệnh nhân dùng giả dược. Tăng aminotransferase liên
quan đến tăng bilirubin (trên 2 lần giá trị tối đa) mã không có bằng chứng về việc
tắc mật trên 0,2% (5 bệnh nhân) dùng bosentan và 0,3% (6 bệnh nhân) dùng
placebo.
Thay đối nổng độ hemoglobin
Giảm nồng đọ hemoglobin tới dưới 10g/dL từ mức binh thường được báo cảo 8,0%
bệnh nhân điếu trị bằng bosentan và 3,9% bệnh nhân điều trị bằng giá dược (xem phần
"Chú ý đặc biệt vả thận trọng khi sử dụng").
Cảo trường hợp thiếu mảu cần truyền khối hồng cầu được báo cáo trong giai đoạn hậu
marketing.
Thông báo cho bảc sĩ biết các tác dụng không mong muốn xảy ra khi dùng thuốc.
Quá liều ` '
Bosentan được điều trị trện người tỉnh nguyện khỏe mạnh với liêu đơn lện đèn 2400
mg vả với bệnh nhân có bệnh khảo ngoải tăng ảp lực mạch phổi với liếu 200 mglngảy
trong hai tháng. Tác dụng khỏng mong muốn thường gặp nhất là đau đầu, từ nhẹ đến
\’
I°U
LL
ẸL
“L L
\ủL\
\
trung bỉnh Liêu quá lớn có thể dẫn đến giảm áp lực đáng kề, có thể đòi hỏi phải cần
các biện pháp hỗ trợ tim mạch. Trong giai đoạn hậu marketing, quá liều đến 10 000 mg
được báo cáo ở bệnh nhân nam tuối vị thảnh niên. Bệnh nhân có biếu hiện triệu chứng
buồn nôn, nôn, hạ huyết ảp. hoa mắt, toát mồ hội và nhin mờ Bệnh nhân hồi phục
hoản toản trong vòng 24 giờ sau khi được hỗ trợ huyết áp. Không thể sử dụng các biện
pháp lọc máu với bệnh nhân quả liêu bosentan.
Các đặc tính dược lực học
Mã ATC: COZKXO1
Cơ chế tác dụng
Bosentan là chắt đối khảng trện thụ thể endothelin (ERA), có ái lực với cả thụ thể ETA
vả ETa. Bosentan Iảm giảm khảng trở trên mạch phổi vả hệ thống, do vậy Iảm tăng
cung lượng tim, không Iảm tăng nhịp tim.
Hóc môn thần kinh Endothelin- 1 (ETL) lá một trong cảc chất co mạch mạnh nhất. Nó có
thề Iảm tăng xơ hóa, phân chia tế bảo, tố chừc lại và phi đại tìm vảiả chất tiên gảy
viêm. Các tảo dụng nảy được kỉch hoạt khi endothelin gắn với các receptor ETA vả ETB
lá các receptor có ở mảng trong vả trong tế bảo cảc cơ trơn thảnh mạch. Nồng độ ETL
tại mỏ vả trong huyết tương tăng ở một số bệnh tim mạch và các bệnh cúa mô liên kết
bao gồm tảng áp lực động mạch phối, bệnh xơ cứng da, suy tim cắp và mạn tinh, thiếu
máu cơ tim vả xơ vữa động mạch, điều nảy cho thấy ETL động vai trò lả tảo nhân gây [( (J
bệnh trong các trường hợp nảy. Không có chất đối kháng thụ thể endothelin, nồng độ ,
ETL tăng cao liên quan chặt chẽ tới mức độ trầm trọng vả tiên lượng của cảc bệnh nhân
tảng ảp lực động mạch phối và các bệnh nhân suy tim.
Bosentan là chắt cạnh tranh gắn kêt ETL và các ET peptid trên 2 receptor ETA vả ETB
với ái lực tương đối lớn hơn trên receptor ETA (K.=4, 1 -43 nM) so với thụ thể ETB (Ki=
38- 730 nM). Bosentan iả chất đối kháng đặc hiệu với thụ thể ET vả không gắn với cảc
thụ thể khác.
Các đặc tính dược lực học
Trên mộ hinh động vặt tăng ảp lực mạch phổi, sử dụng bosentan đường uống Iảu dải
dẫn đến giảm khảng trở trên mạch phổi vả gìảm phì đại tâm thất ph'ải vả mạch phối.
Trên mõ hỉnh động vật có xơ cứng phổi, bosentan gây giảm lắng đọng collagen trong
phổi.
Tác dụng iâm sáng
Tăng áp iực động mạch phổLF
Hai thử nghiệm có kiếm soát placebo đa trung tảm, mù đôi, ngẫu nhiên được thực hiện
với 32 bệnh nhân (thử nghiệm AC- 052- 351) và 213 bệnh nhân (BREATHE 1) tảng áp
lực động mạch phổi có mức độ bệnh tương ứng với độ Ill- IV theo phân loại của WHO
(tăng áp lực mạch phổi tiên phát hoặc thứ câp, chủ yếu là liên quan đến xơ cứng da)
Sau 4 tuần điêu trị với 62, 5 mg Tracleer hại lần một ngảy, liều duy trì trong các thử
nghiệm nèy là 125 mg Tracleer hai lằn một ngảy trong thử nghiệm AC—052-351 vả 125
và 250mg hai lần một ngảy trong thử nghiệm BREATH-1.
Tracleer được bổ sung vảo liệu pháp điêu trị hiện thời cho cảc bệnh nhân nảy, có thế
bao gồm kết hợp với thuốc chống kết tập tiếu cầu, thuộc giãn mạch (ví dụ như các chầt
đối khảng kênh calci), thuốc lợi tiếu, oxy vả digoxin nhưng khỏng bao gồm
epoprostenol. Nhóm chứng được sử dụng placebo bổ sung vảo điều trị hiện thời.
Thời điếm cuối mỗi thử nghiệm là thời điếm thay đối về khoảng cách đi bộ trong 6 phút—
sau 12 tuần ở thử nghiệm đầu vả sau 16 tuần ở thử nghiệm thứ hai. Điều trị bằng
Tracieer cải thiện đảng kê tình trạng thế chắt ở cả hai thử nghiệm. Sự tăng khoảng
cách đi bộ ở nhóm hiệu chỉnh placebo, so sảnh với giá trị ban đầu tại thời điếm bắt đầu
điều trị là 76m (p=O, 02; t-Test) vả 44m (P= 0, 0002, Mann-Whitney U-test) được đo tại
thới điếm kết thúc đầu tiên cho mỗi thử nghiệm Sự khảo biệt giữa hai nhóm- 125 mg
vả 250 mg hai lần mỗi ngảy-không có ý nghĩa thống kê, mặc dù có xu hướng thế chẳt
cải thiện tốt hơn ở nhóm dùng liều cao hơn 2
Sự cải thiện khoảng cách đi bộ là rõ rệt, sau 4 tuần điều trị, đáng kể sau 8 tuần điều trị
vả duy trì tới 28 tuần trong cảc thử nghiệm mù đôi trện một vải bệnh nhân.
Phân tích hồi cứu được thực hiện trong các thử nghiệm có kiếm soát placebo trên 95
bệnh nhản tham gia điếu trị với liếu tracleer 125 mg hai lần một ngảy trên cảc chỉ tiêu
như thay đổi khoảng cảch đi bộ, phân loại bệnh theo WHO vả khó thờ. Thử nghiệm cho
kết quả như sau: ở tuần thứ 8, 66 bệnh nhân thế hiện sự cải thiện, 22 bệnh nhân Ổn
định và 7 bệnh nhân tình trạng xấu đi. Trong số 22 bệnh nhân ổn định ở tuần thứ 8, 6
bệnh nhân cải thiện ở tuần thứ 12/16 tương đối so với giá trị ban đầu trong độ 4 bệnh
nhân tình trạng xắu đi. Trong số 7 bệnh nhân tinh trạng xắu đi ở tuần thứ 8, 3 bệnh
nhân cải thiện ở tuần thứ 12116 so với giá trị ban đầu vả 4 bệnh nhân tình trạng xắu đi.
Cảo thông số huyết động học chỉ được đảnh giả ở thử nghiệm đầu. Điếu trị bằng
Tracleer dẫn đến tăng cung lượng tim, liên quan có ý nghĩa với sự giảm ảp lực động
mạch phổi, trở kháng mạch phối vả áp lực nhĩ phải.
Điều trị bằng Tracleer Iảm giảm triệu chứng của PAH vả cải thiện thể chắt Khó thờ
(được đo trong thử nghiệm đi bộ) được cải thiện trên bệnh nhân điều trị bằng Tracleer.
Tại thời điểm đầu của thử nghiệm BREATH- 1, 92% bệnh nhân trong tồng sô 213 bệnh
nhân được phân Ioại độ III theo phân Ioại WHO về độ nặng của bệnh và 8% bệnh nhân
được phân Loại độ IV. Điều trị bằng Tracleer lạm cải thiện mức độ bệnh trẻn 42,4%
bệnh nhân, so với 30,4% trong nhóm bệnh nhân dùng placebo Trong cả hai thử
nghiệm, Tổng số bệnh nhân có thay đỗi về độ phân Ioại của WHO tốt hơn có ý nghĩa
thống kê ở nhóm bệnh nhân dùng Tracleer so với nhóm bệnh nhân dùng placebo. Điêu
trị bằng Tracleer lảm giảm có ý nghĩa thống kê tỉnh trạng xầu đi trện lâm sáng sau 28
tuần điều trị, so với placebo (10,7% so với 37,1%; p=0,0015).
Trên~một thử nghiệm có kiếm soát placebo, đa trung tâm, mù đôi ngẫu nhiên (EARLY),
185 bệnh nhân có triệu chứng tăng ảp lực động mạch phối nhẹ độ Il theo WHO
(khoặng cách đi bộ trung binh trong 6 phút lả 443m) được sử dụng 62, 5 mg bosentan
hai lần một ngảy trong 4 tuần, sau đó lả 125 mg hai lần mỗi ngáy (n= 93) về placebo
(n= 92) trong sảu thảng. Bệnh nhân không được điều trị đặc hiệu (n= 156) hoặc bệnh
nhân được điều trị bằng liều ốn định sildenafil (n= 29) Thời điềm kết thúc xơ cắp là thời
điềm thay đổi trở khảng mạch phối (PVR) và khoảng cách đi bộ trong 6 phút trong thử
nghiệm placebo Icó kiếm soát trong khoảng thời gian 6 thảng. Thời gian dẫn đến tinh
trạng lảm sảng xắu đi (tử vong, phải nhặp viện do các biến chứng của tảng áp lưc động
mạch phổi hoặc tình trạng tăng ảp iực động mạch phổi xắu đi), chỉ số khó thở Borg,
thay đồi độ phân ioại bệnh theo WHO vá huyết động hoc được đảnh giá tại thời điểm
kết thủc thứ cắp. Sau 6 thảng, sự giảm trở kháng mạch phồi PVR trong thử nghiệm
]
,(tỂ
)
w… 9 o ma
placebo có kiềm soát là 22,6% (p<0,0001). Sư cải thiện khoảng cách đi bộ trung bình
trong 6 phút ở nhóm bosentan so với nhóm placebo lả 13,8 m (p=0,0758) Về các thay
đổi trở kháng mạch phồi PVR, không có sự khảo biệt có ý nghĩa thống kê giữa các
nhóm bệnh nhập tăng ảp lưc động mạch phồi thứ cầp nhiễm HIV, tim bầm sinh, bệnh
mô liên kết hoặc bệnh nhân dùng liệu pháp kết hợp với sildenafil trến một Số nhỏ bệnh
nhãn.
Hiện tượng Iảm sảng xắu đi chậm lại ’có ý nghĩa thống kê ở nhóm bệnh nhân dùng
bosentan so với nhóm bệnh nhân dùng placebo (gìảm nguy cơ đến 77,3%, p=0,0114).
Bosentan lảm giảm tỉ lệ bệnh nhân có tỉnh trạng lảm sảng xấu đi ít nhất một độ (3,4%
bosentan so với 13,2% placebo, p=0,0285) vả cải thiện huyết động học (mPAP, TPR,
chỉ số tim và SVOZ; p<0,05).
Trong một nghiên cứu có kiềm soát placebo, mù đôi, ngẫu nhiến, đa trung tâm, hồi cố
(BREATHE-õ) trên bệnh nhân tăng áp iực động mạch phồi PAH độ III theo phân loại
của WHO có suy tim bẩm sỉnh vả Eisenmenger physioiogy, Tracleer (n=37) hoặc
placebo(N=17) được sử dụng trong 16 tuần với chế độ liều như trong thử nghiệm trung
tâm. Thời điếm kết thúc đầu tiên cho thắy điều trị bằng Tracleer không lảm trầm trọng
tinh trạng thiếu oxy huyết. Sau 16 tuần, tracleer cải thiện độ hòa tan oxy 1% (95%Cl-
0,7: 2,8%) so với placebo. Kêt quả nảy cho thắy bosentan không Iảm trầm trọng tinh
trạng thiếu oxy huyết. Điều trị bằng tracleer dẫn đến viêc giảm đáng kể kháng trở mạch
phổi vả cải thiện tinh trạng thế chắt. Sau 16 tuần, tăng khoảng cách đi bộ trong 6 phút
lả 53m (p=0,0079) trong thử nghiệm có kiểm soát placebo.
Bệnh nhân tăng ảp iực mạch phối PAH có nhiễm HIV không được tham gia vảo thử
nghiệm trung tâm (thử nghiệm AC-052-351 vả BREATHE-1). Trong thử nghiệm không
so sánh, mở, đa trung tâm (BREATHE-4), 16 bệnh nhân tăng ảp lực động mạch phổi
(độ III và IV theo phân loại của WHO) nhiễm HIV được điếu trị cùng chế độ liếu với các
thử nghiệm trung tâm. Sau 16 tuần, có sự cải thiện về thế chầt vả các thông số huyết
động học tim phổi so với các giá trị ban đằu. Độ bệnh theo phân loại của WHO cải thiện
trên 14 bệnh nhản. Hầu hêt bệnh nhãn (15116) được điêu trị bằng thuộc kháng
retroviruẹ ức chế thụ thể phiến mã ngược nucleoside hoặc không nucleoside, chât
được điệu trị phổ biên nhât trong cảc điều trị phối hợp. Tracleer không thể hiện tảo
động rõ rảng trên cảc chỉ số nhiêm khuẩn HIV trong các thử nghiệm — như số lượng tế
bảo CD4 hoặc HlV-1 RNA.
Số liệu dải hạn về phân loại PAH độ H theo WHO được tống hợp từ tắt cả 173 bệnh
nhân điều trị bằng bosentan trong nghiện cứu có kiếm soát AC-052-364 (EARLY)
vả/hoặc thời gìan kéo dải OL. Thời gian điều trị trung bỉnh bằng bosentan lả 3.6 i 1.8
năm (tới 6,1 năm), với 73% bệnh nhân điếu trị ĩt nhât 3 năm và 62% bệnh nhân điều trị
ít nhắt 4 năm. Bệnh nhân có thể điều trị PAH theo yêu cầu trong giai đoạn kéo dải OL.
Phần lớn bệnh nhân được chần đoán lá tảng áp lực động mạch'phổi vô căn hoặc di
truyền (61%). Khả năng vận động (khoảng cảch 6 phút đi bộ) được duy tri trong thời
gian điếu trị bằng bosentan (thay đối trung binh so với mức nền tại thời điềm cuối điều
trị lả 3,7m. Nói chung, 78% bệnh nhân duy tri múc độ bệnh Il theo phản Ioại của WHO
hoặc tốt hơn. Ước tinh tỉ Lệ sống sót Kaplan-Meier là 90% và 85% tại thời điểm 3 và 4
năm sau khi bắt đầu điều trị. Tại thời điếm tương tư, 83% vả 75% bệnh nhân PAH
("it,-
không nặng thệm (được xác định bằng tử vong do mọi nguyên nhân, ghép phồi, phẫu
thuật động mạch hoặc bắt đầu điều trị bằng prostanoid tiệm tĩnh mạch hoặc dưới da).
Trong nghiên cứu thời gian kẻo dải OL (AC- 052-4- 9) của thử nghiệm AC- 052-4- 5
(BREATHE-S) trên bệnh nhân PAH độ III theo phân loại cùa WHO Eisenmenger liên
quan đến suy tim sung huyết, 26 bệnh nhản tiếp tục điếu trị bằng bosentan trong thời
gian 24 tuần (trung bình 24, 4-2, 0 tuần). Hiệu quả của Bosentan cho thắy trẻn thời gian
điêu trị mù đôi nói chung là duy trì trong thời gian điều trị dải (tồng thời gian điếu trị lẻ
40 tuân)
Hlệu quả lâm sâng trẻn bệnh nhán trẻ em vá trẻ vị thảnh nién tảng áp iực động mạch
phỏL'.
Một thử nghiệm được thưc hiện trên bệnh nhi tăng áp lực động mạch phối. Tracleer
được nghiên cứu trên thử nghiệm mở không kiềm soát trên 19 bệnh nhi tăng áp lực
động mạch phồi (AC-052-356, BREATHE—S: 10 bệnh nhản tăng áp lực động mạch phồi
tiên phảt, 9 bệnh nhản tăng áp lực động mạch phồi do khiếm khuyết tim bẩm sinh). Thử
nghiệm được thiết kế để hghiện cứu cảc thộng số được động học (xem phần “các đặc
tính dược động học’.) Bệnh nhân được chia Iảm 3 nhộm tương đương với các thể
trọng khảo nhau (xem phần 'sử dụng oho trẻ em vả trẻ vị thảnh niên ”) vả được điều trị
trong 12 tuần. Tại thời điếm bắt đầu thử nghiệm một nửa số bệnh nhảm trong mỗi nhóm
được điều trị bằng epoprostenol tĩnh mạch. Liều epoprostenol được duy trì trong suốt
thử nghiệm. Độ tuổi từ 3-15 tuổi. Tại thời điếm bắt đầu thử nghiệm, tắt cả các bệnh .
nhân ở độ II (N=15 bệnh nhân, 79%) hoặc đỏ III (N=4 bệnh nhân, 21%) theo phân loại
WHO
Các thông số huyết động học được đo t2rên 17 bệnh nhân. So với các giá trị ban đầu,
chỉ sô tim tăng trung binh 0, 5I/ phútlm², ảp lực động mạch piễối trung binh giảm 8
mmHg và kháng trở mạch phồi trung binh giảm 389 dyn-sec—cmỂ Sự cải thiện cảo chỉ
số huyết động học so với cảc giá trị ban đầu xuất hiện trong cả nhóm dùng hoặc không
dùng eposporstẹnol. Sự thay đối các chỉ số thử nghiệm găng sức ở tuần thứ 12 so với
giá trị ban đầu rẩt khảo biệt vả khỏng có ý nghĩa thống kê.
77 lệ kéo dái thời gian sổng sót trên bệnh nhân tăng áp lực động mạch phổi
Tỉ lệ sống sót dải hạn được nghiên cứu trên toản bộ 235 bệnh nhân trên hai thử nghiệm
có kiếm soát placebo chĩnh (AC-052-353 vả AC-052-354). Thời gian điều trị trung binh
bằng bosentan lả 1,910,7 năm (tối thiếu 0,1; tối đa: 3,3 nảm) vả bệnh nhân được theo
dõi trung bình 2,010,6 nảm. Hầu hêt các bệnh nhân được chần-đoán tãng áp lưc động
mạch phối tiên phát (PPH; 72%) và độ Iịl theo phân loại của WHO (84%). Tỉ lệ sống sót
sau một năm oủa nhóm điếu trị bằng bosentan là 93% và sau hai nảm là 84% (Kaplan-
meyer). Tỉ lệ sống sót trên phân nhóm tăng ảp iực động mạch phổi tiên phảt sau 1 năm
vả sau 2 năm đều cao hơn— 96% vả 89% tương ứng. So sánh với các sô liệu của bệnh
nhân dùng epoprostenol trên 6 trung tâm điều trị chuyên sâu (N=682) cho thấy Tracleer
cải thiện tỉ lệ sống sót của bệnh nhân tăng áp iực động mạch phổi ít nhất là tương
đương với epoprostenol.
Xơ cứng động mạch hệ thổng vả loét chi tiển triển.
Hai thử nghiệm có kiếm soát placebo đa trung tảm, mù đôi, ngẫu nhiên được thực hiện
trèn `122 (RAPIDS-1) vả 190 (RAPIDS-2) bệnh nhân có xơ cứng mạch hệ thống và Ioét
chỉ tiến triến-bao gốm cả các bệnh nhân đang hiện có Ioét chỉ hoặc có tiền sứ loét chi
trong vòng 1 năm trước. Trong thử nghiệm RAPIDS-2, bệnh nhân có ít nhât một vêt
\›'b\. /'\lđ
Ioét chi mới và trong cả hai thử nghiệm 85% bệnh nhân có ít nhât một vêt Ioét chỉ khi
kết thúc nghiên cứu. Sau 4 tuần điều trị bằng Tracleer 62,5mg hai lần một ngảy, liều
duy tri lả 125 mg hai lần một ngảy. Điều trị mù đội kéo dải trong 16 tuần (RAPIDS-1)
hoặc 24 tuần (RAPIDS—Z). Cho phép điều trị Cơ bản về xơ cứng mạch hệ thống vả Ioét
chỉ nếu điều trị nảy ổn định trong ĩt nhắt 1 tháng trước và trong suốt pha thử nghiệm mù
đôi.
Trong cả hai thử nghiệm, thời điếm có vết loét chi mới giữa thời điếm bắt đầu dùng
thuốc vả thời điềm cuối thử nghiệm lả thời điếm kết thúc xơ cắp.
Điềutrị bằng Tracleer cho kêt quả it vết loét chi mới trong quá trình điều trị hơn so với
nhóm placebo. Trong thử nghiệm RAPIDS—1, bệnh nhân điều trị bằng bosentan xuất
hiện trung binh 1,4 vết Ioét chi mới trong suốt 16 tuần thử nghiệm mù đội so với 2,7 vết
loét chi mới trên nhóm placebo (p=0,0042). Giá trị tương ứng trện thử nghiệm RAPIDS-
2 lả 1,9 và 2,7 vết loét chi mới (p=0,0351) trong suốt 24 tuần điều trị mù đôi. Trên cả hai
thử nghiệm, bệnh nhân điều trị bằng bosentan xuất hiện it vết loét chi mởi trong suốt
nghiên cứu so vởi nhóm bệnh nhân dùng placebo và thời gian xuất hiện vét loét mới
cũng kéo dải hơn.
Mặc dù tảo dụng của bosentan trong việc Iảm giảm số lượng vết Io_ét chi mới không độc
lập với số lượng vết loét ban dầu nhưng tảo dụng lởn hơn trên bệnh nhân Ioét chi nhiêu
vi tri
Tác dụng Iảm lảnh vết loét chi của bosentan được nghiên cứu tại thời điếm kết thúc thứ
câp trong thử nghiệm RAPIDS-1 vả thời điểm kết thúc xơ câp trong thử nghiệm
RAPIDS-2. Không có tác dụng của bosentan được phát hiện trong thử nghiệm.
Các đặc tính dược động học
Đã có các số liệu dược động học sau khi uống vả truyền tĩnh mạch trên bệnh nhân
người lớn. Số liệu cho thắy sinh khả dụng hệ thống của bosentan trên bệnh nhân
trưởng thảnh tăng áp lực động mạch phối cao hơn 2 lần so với người tinh nguyện khỏe
manh.
Dược động học của bosentan độc lập về thời gian vả liều trên người khỏe mạnh. Thải
trừ vả thế tich phân bố giảm khi tăng liều tĩnh mạch nhưng sau đó lại tăng. Sau khi
uống, sinh khả dụng hệ thống tương ứng liều 500mg. Ở liều uổng cao hơn, tãng Cmax
vả AUC it hơn không tỉ lệ với liếu. '
Hấp thu
Sau khi dùng liều 125 mg trên người tình nguyện khỏe mạnh, sinh khả dụng tuyệt đối
bosentan khoảng 50%. Sinh khả dụng không bị ãnh hưởng bởi thức ăn. Ở liếu nảy,
nồng độ huyết tương tối đa đạt được sau 3-5 giờ.
Phân bố
Bosentan gắn mạnh (>98%) với protein huyết tương, phần lớn với albumin. Bosentan
không qua được hảng rảo nhau thai. Thế tỉch phân bố (VssL khoảng 18L được xác định
sau khi dùng đường tĩnh mạch 250 mg.
Chuyển hóa vả thải trừ
Sau khi điều trị liều đơn 250mg đường tĩnh mạch, độ thanh thải khoảng 9I/h Thời gian
bán thải (tm) lả 5, 4h
s›uu… l\'lol
Sau khi điều trị liều lặp lại, nồng độ trong huyết tương giảm dần tới 50- 60% nồng độ
sau khi dùng liều đơn. Sự giảm nảy lả do kích hoạt các enzym chuyến hóa ở gan. Thời
điếm cân bằng đạt được sau 3- 5 ngảy
Bosentan chuyển hóa ở gan bời cytochrome P450 isoenzym CYP3A4 vả CYP209 sau
đó thải trừ qua mặt Dưới 3% cũa lỉếu uống xuất hiện trong nước tiếu.
Bosentan tạo ra ba chất chuyến hóa. Chỉ một trong ba chảt chuyển hóa nảy có tác dụng
dược lý vả chiếm 20% tảo dụng của bosentan
Bosentan kich thích CYP2C9 vả CYP3A4, có thế cả CYPZC19 vả P-glycoprotein. In
vitro, bosentan ức chế bơm xuất muối mặt ở tế bảo gan Các dữ liệu in vitro cho thắy,
bosentan không có tảo dụng ức chế các isoenzym cytochrome sau: CYP1A2, 2A6, 286,
2C8, 2C9 2D6, 2E1, 3A4 Do vậy, bosentan khỏng lảm tăng nồng độ cùa các thuốc
chuyến hóa bời cảc isoenzym nảy.
Động học trên các nhóm bệnh nhân đặc biệt
Giời tính, cân nặng, chùng tộc, tuối
Các số liệu săn có cho thắy giới tinh, cân nặng cơ thế, chủng tộc hay tuổi không được
xem lá có tảo động đến dược động học cùa bosentan trên người lớn.
Trẻ em vả trẻ vị thánh niên
Dược động học sau khi dùng đường uống đơn liệu hoặc đa liêu được nghiên cứu trện
bệnh nhi tăng áp lực động mạch phổi trẻ em hoặc trẻ vị thảnh niên, liều được tính theo
cân nặng cơ thể (BREATHE-3 xem phần "Cảo đặc tinh dược động học”). Sinh khả
dụng hệ thống của bosentan giảm theo thời gian, do tương ứng với việc kich ứng các
enzym đã biết của bosentan.
AUC trung binh (CV%) của bosentan trên trẻ em được điếu trị với 31, 25 62 5 hoặc 125
mg hai lần một ngảy được tính tương ứng là 3496 (49), 5428 (79) và 6124 (27) ng. hlml.
Giá trị nảy thấp hơn 8149 (47) ng. h/ml oủa bệnh nhân trưởng thảnh tăng ảp lực động
mạch phối dùng 125 mg hai lần một ngảy. Khi đạt đến trạng thải cân bằng, sinh khả
dụng hệ thống ở Các nhóm cân nặng khảo nhau so với sinh khả dụng trên người trưởng
thảnh như sau: 10-20 kg: 43%; 20-40 kg: 67%; >40kg: 75%. Nguyên nhân của sự khác
biệt nảy không rõ rảng vả có thế Iiên quan đến việc tăng chuyến hóa vả thải trữ trên
gan. Tuy nhiên, khoảng 50% bệnh nhi có cảc khiếm khuyết trên tim, do vậy huyết động
học thay đối có thể ảnh hưởng đến dược động học. Chưa rõ lả điếu nảy có ảnh hưởng
đến độc tĩnh trên gan hay không. Giới tính bệnh nhân vá eprostenol đường tĩnh mạch
dùng kèm không có ảnh hướng có ý nghĩa thống kê trên các đặc tinh dược động học
của bosentan. Không có dữ liệu dược động học trên bệnh nhân dưới 3 tuổi.
Bệnh nhân suy gan
Không có thay đổi dược động học đáng kể trên bệnh nhân suy gan nhẹ (Child-Pugh đó
A). Trện những bệnh nhản nảy, diện tích dưới đường cong ở trạng thái cân bằng bầng
9% so với bosentan và 33% so với chất chuyến hỏa chính Ro-48-5033, so với người
tinh nguyện khỏe mạnh. Dược động học của bosentan không được nghiện cứu trện
bệnh nhân suy gan phân loại Child-Pugh B hoặc C.
Các bệnh nhán suy thận
z'I
"
Đóng gói
Tracleer 62.5 mg; Hộp 1 chai 60 viến ban phim
Tracleer 125 mg; Hộp 1 chai 60 viên bao phim
Nhà sản xuất:
Patheon, Inc.
Toronto Region Operations
2100 Syntex court, Mississauga, Ontario, Canada L5N 7K9.
Cơ _sờ xuất xưởng
Actelion Pharmaceuticais Ltd
Gewerbestrasse 16
CH-4123 Allschwil
Switzerland
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng