















10. Proof: 31.07.2013 85
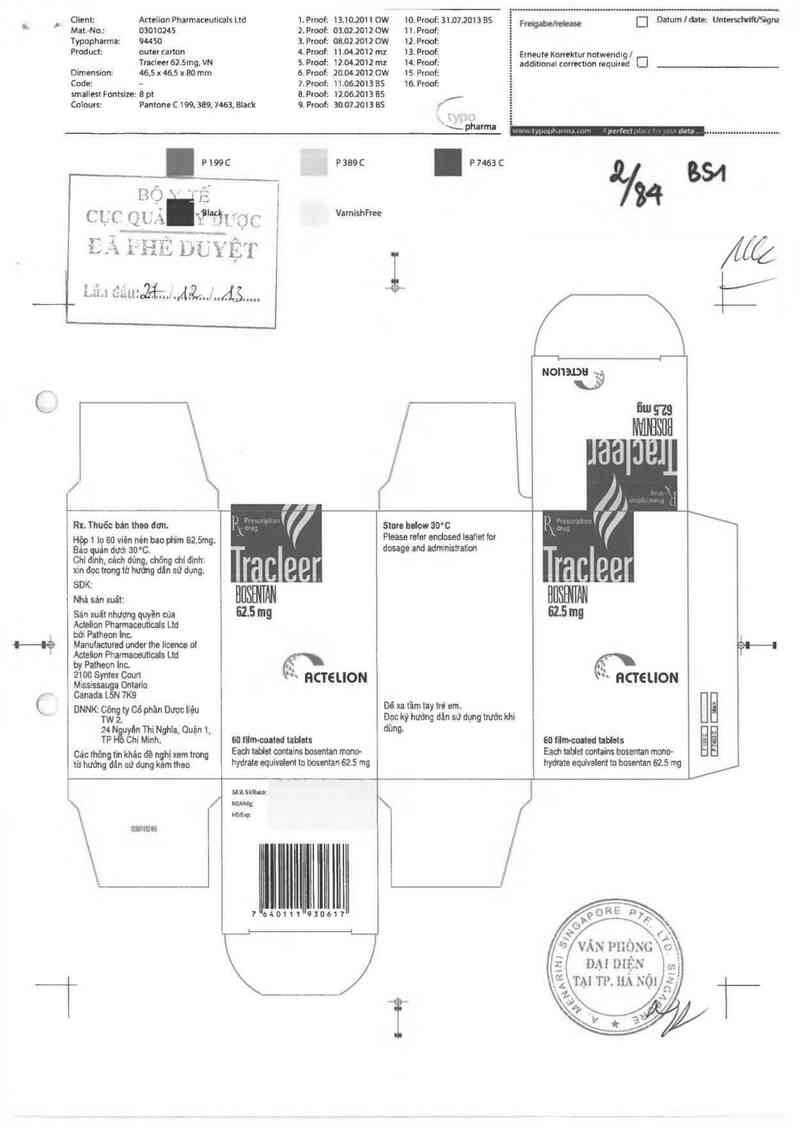
Client: Attelion Phatmaceutìcals Ltd 1. Proof: 13.10.2011 OW
Mat.-No.z 03010245 2. Proof: 03.02.20120W 11.Pmofz ễ
Typophanna: guso 3.Proofz oa.oz.zoư ow 12. Proof:
Product: outer cartcn 4. Proof: 11.04.2012 mz 13. Proof:
Tracieer 62.5mg, VN 5. Proơf: 12.04.2012 mz 14. Proof: '
Dimension: 46.5 x 46.5 x 80 mm 6. Prooí: 20.04.2012 OW 15. Proof:
Code: - 7` Proof: 11.06.2013 85 16. Proof:
smallesl Fontsize: 8 pt &. Pmof: 12.06.2013 BS |,
Colours: Pantone C 199, 389. 7463,81uk 9. Proof: 30.07.2013 BS J
\ pharma
Ả P 389 C . P 7463 C
——
BỘ a Lĩ
cự Q1JẮL ~ẹ?'²fthfic
|
I
1
i…fL 1~i*ỉẫL ULLYET 1
LLỆ,L íỂ'ảU! «i=ÁuZzJ/íẫ
/
VamishFree
ỉ ldditional correctton required
I
FLetgabe/ưieae El Datumldate: Unlecsdtihngna
Emeute Konektur notwendig |
@
uuunnuuuuunnn.
Rx. Thuõc bản thu dơn.
Hộp 1 lọ 60 viên nén bao ph“… 62.5mg.
Bảo 511 dưới 30°C.
Chi đth, cảch dùng. chõng dLi Lflnh:
xin dọc trong từ hướng dán sử dụng.
SDK:
NLả sán xuất:
Sán xuất nhượng quan của
Actelion Pharmcuuticals Ltd
bởi Patheon hc.
Manuiaotured under the lícm oi
Acteion Pharmaoeutiais Ltd
by Patheon Inc. _
2101) Syntex Coun '
Mississauga Ontario
Canada L5N 7K9
DNNK: Ẹòng ty 06 phần Dược Ilệu
W 2.
24 N uyên Thi Nghĩa, Ouặn 1,
TP Chí Minh.
Cảo thòngt'n khác Liồ nghị xem Irong
từ hướng dản sử dung kem theo
HCT€ LION
60 ílm-coltnd taHnts
Each Lablat contains bosentan mono-
hydrale equivded to bosentan 625 mg
StoLc below 30°C
Piease reier andused loatlet for
dosage and admmistratim
Dê xa Lãm tay Iré am.
Dọc kỷ hưởng dản sử dt,ng trước khi
dùng.
1
ểíỉìqỀTGIJON
611 íilm-omtod hbleis
Each tablet oontahs bosentan mono—
hydrate equivalent tn bosentan 625 mg
fflỉlĩiĩi
sua s…
NSIAIn~
7 640111uI930611
/
MMlư
\
\
\
Wffllh
. /`\
VĂN PHÒNG \;”r.\`
D.—_\1 UIỆN )
TAI TP. LLJL XỘI
Ui
c, )
Client: Actelion Pharmaceuticals Ltd 1. Proof: 13.10.2011 OW Freigabe/release Ủ Datum/ date: Unterschrift/Signature:
Mat.-No.: 06010040 2. Proof. 10.04.2012 mz E
Typopharma: 94452 3. Prooft 12.04.2012 mz
Tracleer 62.5mg, VN 5. Proof: 12.06.2013 BS ; additionai cmrection required LĨI
Dimension: 76,2 x 31.75 mm 6. Proof: 30.07.2013 BS
smallest Fontsize: 4,5 pt
Colours: Pantone 199 C, 389 C, 7463 C, Black /
"; pharma www.typopharma.com f~1 perfect pfncc foryour data ...…u...…. ............... .……
. P 199 C . P 7463 c VarnishFree
60 filn-culnd uhlah Msnula ctutau under the 8
Ench tableL contains hosentln license ni Actelion o
monnhydrate equivalent to Phumuceuticals LLd by 2
bosentan 61.5 mg PuLheon Inc. 8
Usull Dnạgn: ặee machnd ẫđfflẵẵỦẵacỗrilllẫrio °
full prescnbmg Lniurmation. Clnada L5N TKB
Stum bcinw 311'0
Ị
HÙSENĨẨN 62.5 mg
so tablets (²²- ncreuou
So Iu SX/Balch:
NSX/Mfg:
HDIELLp:
TRACLEER®
(bosentan)
Viên nén, bao phim 62,5mg vả 125mg
Rx. Thuốc nảy chỉ dùng theo đơn của bác sĩ.
MÔ TẢ
Bosentan lá thuốc đâu tiên oùa một nhóm thuốc mới, một thuốc đối khảng với thụ thể của
endothelin.
TRACLEER® (bosentan) thuộc về một nhóm dẫn xuất pyrimidin thay thể ở mức độ oao. Nó
có tên hóa học là 4-tert-butyl-N-[6-(2-hydroxy—ethoxy)-S-(2ĩmethoxy-phenoxyy[2,2']-
bỉpyrimidin-4-yil-benzensulfonamid monohydrat và có công thúc câu tạo sau đây:
, , Mị
:zz __, ,xẳ ỦHƠ—fio …/
Bosentan oó trọng lượng phân tử 569,64 và công thức phân từ C27HZọNSOÓSOHZO. Bosentan
lả một bột từ trắng đến vảng nhạt. Nó ít tan trong nước (1,0mg/ IOOmI) và trong dung dịch
nước ở pH thấp (0,1mg/IOOmI ở pH 1, | vả 4,0;0,2mg1100m1ở pH 5 ,.O) Dộ hòa tan tăng lên ở
các độ pH cao hơn (43mg/100m1 ở pH 7,5). Ở trạng thải rắn, bosentan rất ồn định, không hút
ấm và không nhạy cảm với ánh sáng.
TRACLEER® có dưới dạng viên nén bao phim 62,5mg vả 125mg dùng uống và chứa cảc tả
dược sau đây: tinh bột ngô, tinh bột tiền gelatin-hóa, natri tinh bột glycolat, povidon, glyceryi
bchenat, magnesi stearat, hydroxypropyimethyloellulose, triacetin, talc, titani dìoxyd, vảng
oxyd sắt, đô oxyd sắt, và ethylcellulose. Mỗi viên nén TRACLEER® 62,5th chứa 64,541mg
bosentan, tương đương với 62,5mg bosentan khan. Mỗi viên nén TRACLEER" 125mg ohứa
129,082mg bosentan, tương đương với 125mg bosentan khan.
CHỈ ĐỊNH
TRACLEER® được chỉ định để điều trị tăng huyết ap động mạch phổi (Nhóm 1 Tổ chức y tế
thế giới) ở bệnh nhân có cảc triệu chưng nhóm 111 hoặc IV Tổ chức y tế thế giới, để cải thiện
khả năng luyện tập và 1ảm giảm tỷ lệ trường hợp xấu đi về 1âm sảng (xem Nghiên cứu lâm
sâng).
CHỐNG CHỈ ĐỊNH
Thuốc dưọc CÁNH BÁO CHỐNG CHỈ ĐỊNH đối với thai kỳ.
Loại X về thai nghén. TRACLEER® Có thể gây độc hại cho thai nếu dùng oho phụ nữ mang
thai. Bosentan có tảo dụng gây quái thai ở chuột cống trắng được cho uông liếu ì
60mg/kg/ngảy (gấp 2 [ần liếu uống tối đa khuyến cảo cho người 125mg, 2 lằn/ngảy, trên cơ
sở mg/m ). Trong một nghiên cứu về độc tính phôi—thai trên chuột cống trắng, bosentan thế
hiện tác đụng gây quải thai phụ thuộc vảo liều, bao gổm dị dạng Ở đầu, mặt, miệng vả mạch
máu lớn. Bosentan iảm tăng từ sản và tỷ lệ tử vong của chuột oon ở các Iiếu uống 60 vả
300mg/kglngảy (gấp 2 và 10 lần, tương ứng, 1iều tối đa khuyến oảo cho người trên cơ sở
i)\i iìli N
` \".111'1'1 .LLL …) , .,
mg/m ). Mặc dù cảc khuyết tật khi sinh không thẳy có ờ thò dược cho LLống liếm tói
1500mg/kg/ngảy, nồng độ huyết tưong cua bosentan ờ thờ thấp hon nồng độ dạt được o~ chuột
công trắng Sự giỏng nhau cưa cảc dị dạng gây bới bosentan vả dị dạng nhận xét thắy ở động
vật điếu trị với cảc thuốc dối khảng với thụ thể cùa endotheiin khảo cho thắy tinh chắt gây
quải thai lả một tác dụng của nhóm thuốc nảy. Không có dữ liệu về sử dụng TRACLEER`~`
phụ nữ có thai
Phải loại trù thai nghén trước khi bắt đầu điều trị với TRACLEER’“ và sau đó dự phòng bằng
biện phảp tránh thụ thai chẳc chắn. Đã chúng minh cảo thuốc trảnh thụ thai hormon, bao gôm
các thuốc tránh thụ thai uống, tiêm, qua chân bỉ, cẳy dưới da không chắc chắn khi dùng
TRACLEER® vả khỏng thể dùng 1ảm phương pháp ngừa thai duy nhắt 6 bệnh nhân dùng
TRACLEER® (xem Tương tảc thuốc: Thuốc tránh thit thai hormon, hao gồm thuốc
trảnh thai uống, tiêm, qua chân bì vè cấy dưới da). Khi cần thiết, tìm kiếm sự huớng dẫn
từ một bảo sĩ phụ khoa hoặc chuyên gia tượng tự về biện phảp tránh thai thích hợp.
Chí bắt đầu dùng TRACLEER® ở bệnh nhân được bìết lá không có thai. Đối với bệnh nhân
nữ có khả năng man g thai, người kế đơn không nến kê TRACLEER“ trừ phi bệnh nhân cam
đoan với người kế đơn lả không có hoạt động sinh dục hoặc cung cấp kết quả âm Lính từ một
xét nghiệm thai nghén nước tiếu hoặc huyết thanh trong 5 ngảy đầu cúa một chu kỳ kinh
nguyệt binh thường và ỉt nhât 1 1 ngảy sau lần giao hợp không được bảo vệ cuối cùng.
Các xét nghiệm thai nghén nước tiếu hoặc huyết thanh tiểp theo phải được thực hìện hảng
tháng ở phụ nữ có khả năng mang thai dùng TRACLEERỂ Phải khuyên bệnh nhân nếu thẳy
chậm có kinh nguyệt hoặc bắt kỳ lý do nảo khảo để nghi ngờ có thai thì phải báo ngay cho bác
sĩ để lảm xết nghiệm về thai nghén Nếu xét nghiệm thai nghén dương tinh, bác sĩ vả bệnh
nhân phải thảo luận vê ngụy co đối vói thai nghén và đối với thai.
Cyclosporin A: Việc dùng đồng thời cyclosporin A`vả bosentan dẫn đến sự tăng rõ rệt nồng
độ huyêt tương cùa bosentan. Do đớ, việc sử dụng đông thời TRACLEER" vả cyclosporin A
bị chông chỉ định.
Gbeuriđ: Đã nhận xét thẳy nguy cơ cao hờn của sụ tăng các enzym gan ở bệnh nhân dùng
glyburid đồng thời với bosentan. Do đó, việc dùng đồng thời glyburid vả TRACLEER bị
chống chỉ định
Mẫn cảm: TRACLEERẵì cũng bị chống chỉ định ở bệnh nhân mẫn cảm với bosentan hoặc
bất cứ thảnh phần nảo cùa thuốc
LIÊU LƯỢNG VÀ CẢCH DÙNG
Chung rì
Phải bắt đằu điếu trị với TRACLEER'Ể với liếu 62 ,5mg, 2 lần/ngảy trong 4 tuần vả sau đó
tăng lên tới ]iếu duy tri 125mg, 2 lần/ngảy Các liền trên 125mg, 2 Iần/ngảy có vẻ như không
đem iại thếm lợi ích đủ để bù lại sự Lãng nguy cơ tổn thưong gan.
Phải uống viên nén vảo buồi sảng vả buối chiếu cùng vởi hoặc không cùng với thức ăn.
Điếu chỉnh 1iếu 1ượng và theo đôi ở bệnh nhân phảt triến sự không bình thường về
aminotransferasc
Mức AL'I"IAST Cáo khuyến cảo vế điếu trị vả theo dõi.
> 3 và S 5 x ULN Xảc nhận bằng một xét nghiệm aminotransiếrase khác;
nếu được xác nhận, giảm Iiếu hảng ngảy hoặc ngưng
điếu trị, vả theo dõi mức aminotransfcrase ít nhắt cứ 2
/6
tuân một lân. Nếu mức ạminotransferase trở về trị số
trước điếu trị, hăy tiếp tục hoặc ảp dụng trị liệu thích
hợp (xan ở dưới).
> 5 vả S 8 x ULN Xác nhận bằng một xẻt nghiệm ạminotransferasc khảo;
nếu được xác nhận, ngừng điều trị vả theo dỏi các mức
aminotransferasc it nhất cứ 2 tuần 1 iần Một khi các
mức ạminotransferase trở về trị số trưởc điếu trị, xem
xét việc điếu trị trở lại (xem ở dưới).
> 8 x ULN Phải ngùng điều trị vả không xem xét việc điếu trị trớ
Lại với TRACLEER®. Không có kinh nghỉệm về việc
điêu trị trớ 1ại với TRACLEER1Ụ trong các trường hợp
nảy.
Nếu dùng TRACLEER® trở lại thi phải dùng ở liếu bắt đầu; kiếm tra cảc mức
ạminotransterase trong vòng 3 n gay vả sau đó theo cảc khuyến cảo ở trên.
Nếu sự Lăng aminotransferasc gan có kèm theo cảc triệu chứng lâm sảng cùa tốn thưong gan
(như buồn nôn, nôn, sốt, đau bung, vảng dạ, hoặc ngủ lịm không thông thường hoặc mệt mời,
hoảc sự tăng bilirubin _>_ 2 x ULN) phải ngùng điều trị Không có kinh nghiệm về việc sử
dụng trở lại TRACLEER'“lí trong các trường hợp nảy
Sử dụng ở phụ nữ có khả năng mang thai
Chi bắt đầu việc điều trị với TRACLEERO ò phụ nữ có khả năng mang thai sau một xét
nghiệm thạị nghén âm tinh vả chỉ ở phụ nữ ảp dụng sự tránh thụ thai đầy đủ không chỉ dựa
duy nhất trên cảc thuốc trảnh thụ thại hormon, bao gồm các thuốc tránh thụ thại uông, tiếm,
qua chân bi hoặc cẳy dưới da (xem TƯONG TÁC THUỐC: Thuốc tránh thụ thai hormon,
bao gồm thuốc trảnh thụ thai uông, tỉêm, qua chân bì và cấy dưới da). Tim kiếm tải 1iệu
từ một bảo sĩ phụ khoa hoặc một chuyên gia tương tự về sự tránh thụ thai đầy đủ khi cần. Phải
nhận được các xết nghiệm thai nghến nuớc tiếu hoặc huyết thanh hảng thảng 0 phụ nũ có khả
năng mang thai dùng TRACLEER®
Điều chỉnh liều lượng ở bệnh nhân suy thận
Suy thận ỉt ảnh hướng trên dược động học oủa bosentan vả không cần phải điếu chinh liều
lượng.
Điếu chỉnh ]iếu lượng ở bệnh nhân cao tuổi
Cảo nghiên cúu lâm sảng vế TRACLEER'Ạ không gồm số lượng đủ đối tượng tư 65 tLLồi trớ
lến để xác định xem họ có đáp ứng khác với đối tuợng trẻ hơn hay không Kinh nghiệm lâm
sảng đã không xác định sự khác nhau trong đảp ứng gỉua bệnh nhân cao tuốì và trẻ tuổi. Nói
chung phải thận trọng việc 1ụạ chọn liều đối với bệnh nhân cao tuồi, xét đến tần số cạo của
giảm năng gan, thận hoặc tim, vả cùa bệnh mắc đồng thời hoặc việc điếu trị với cảc thưốc
khảo trong nhóm tuồi nảy.
Điều chỉnh liều lượng ở bệnh nhân suy gan
Vì có bầng chứng in vitch vả in vith lả đường thải trừ chính cùa bosentan lả đường mật, suy
gan oó thế lảm tăng sự phơi nhiễm (Nồng độ tối đa, Cmax; vả Diện tích dưới đường cong,
AUC) cùa bosentan.
Đã chứng minh suy gan nhẹ khỏng ảnh hướng nhiếu đến dược động học cua bosentan. Đã
khớng đánh giá ảnh hường cùa suy gan vừa h0ặc nặng đến duợc động học cùa
TRACLEERỂ Không có dữ liệu riêng biệt để hưóng dẫn việc xác định liều lượng cho bệnh
L»)
4
/%
nhân suy gan (xem CÁNH BÁO); phải thận trọng đối với bệnh nhân suy gan nhẹ Phải trảnh
dùng TRACLEER® nói chung cho bệnh nhân oó suy gan vừa h0ặc nặng
Điều chỉnh liều lượng ở trẻ em
Đã không xảo định độ an toản vả hiệu lực ở bệnh nhân trẻ em.
Điếu chỉnh liếu lượng ở bệnh nhân có thế trụng thắp
Ở bệnh nhân có thể trọng dưới 40kg nhưng trên 12 tuồi, liếu bắt đầu vả 1iếu duy trì được
khuyến cáo là 62 ,5mg, 2 lần mỗi ngảy.
Ngừng điều trị
Có it kinh nghiệm về ngừng đột ngột TRACLEER®. Không thấy có bằng chứng về sự hồi
ứng cấp tỉnh. Tuy vậy, để tránh khả năng xấu đi về lâm sảng, phải xem xét việc giảm dẩn liếu
(62, 5mg, 2 lần/ngảy trong 3 đến 7 ngảy).
CẦNH BÁO
Khả nãng trin terơng gan
Đã nhận xét thấy sự tăng ALT hoặc AST gắp hơn 3 x ULN ở 11% bệnh nhân điếu trị với
bosentan (N= 658) so với 2% bệnh nhân điếu trị với placebo (N= 280). Đã thẳy sự tăng gấp
3 lần ở 12% cùa 95 bệnh nhân có tăng huyết áp động mạch phối (PAH) dùng liếu 125mg,2
iằn/ngảy, và 14% của 70 bệnh nhân PAH dùng liếu 250mg, 2 lần/ngảy. Đã nhận xét thấy sự
tãng gâp 8 lần ở 2% bệnh nhân PAH dùng liếu 125mg, 2 lần/ngảy, vả ở 7% bệnh nhân PAH
dùng liếti 250mg, 2 1ằn/ngảy. Sự tăng bilirubin tới ỉ 3 x ULN (giới hạn trên cúa binh thường)
kết hợp với tăng aminotransferase ở 2 tr0ng 658 (0,3%) bệnh nhân điếu trị với bosentan.
Sự phối hợp củạ tồn thưong tế bảo gan (tăng aminotransferạse tới > 3 x ULN) vả tăng
bilirubin toản phân (ì 3 x ULN) lả một đâu hiệu oủa khả nãng tôn thưong gan nghiêm trọng1
Sự tăng AST vả/hoặc ALT kết hợp với bosentan phụ thuộc vảo liều, xảy ra cả ở thời kỳ đầu
và thời kỳ cuối điếu trị thường tiến triến chậm, không triệu chứng điến hình, vả thuờng phục
hồi sau sự gián doạn hoặc ngùng điếu trị. Sự tăng aminotransferase cung có thể phục hồi một
cảch tự nhiến trong khi tiếp tục điếu trị với TRACLEER. ị
Phải đo cảc mức aminotransferase gan truớc khi bắt đầu điếu trị vả sau đó hảng tháng. Nếu
thấy tăng aminotransferase, thi phải bắt đầu thay đổi sự theo dỏi vả điếu trị (xem LIÊU
LƯỢNG VÀ CÁCH DÙNG) Nếu sự tăng aminotransferase gan kèm theo cảc triẹu chúng
lâm sảng vế tồn thương gan (như buồn nôn, nôn, sốt, dau bụng, vảng dạ, hoặc ngủ lịm bất
thường hoặc mệt nhọc) hoặc tảng bilirubin a 2 x ULN thi phải ngừng điều trị. Không có kinh
nghiệm về sử dụng lại TRACLEERỄỤ trong các trường hợp nảy.
Suy gan có Lz`r lrước
Phải đo cảc mức aminotransferase gan trước khi bắt đầu điếu trị và sau đó hảng tháng. Nói
chung, phải trảnh dùng TRACLEER® ờ bệnh nhân có suy gan vù~a hoặc nặng (xem Dược lý
lâm sảng vả_ LIÊU LƯỢNG VÀ CÁCH DÙNG). Ngoải Lạ, nói chung tránh dùng
TRACLEER® ở bệnh nhân có aminotransfcrase cao (> 3 x ULN) vì sự theo dõi tồn thuong
gan ở các bệnh nhân nảy có thế khó hon.
THẬN TRỌNG
Thay đôi huyết học _
Vìệc điều trị với TRACLÉER'B` gây sự giảm liên quan với liếu vế hcmoglobin vả hematocrit
(tỷ lệ thể tích huyết cằu). Theo dõi nồng độ hemoglobin sau 1 vả 3 tháng điều trị vả sau đó cứ
3 tháng 1 lằn. Sự giảm toản bộ trung binh về nồng độ hemoglobin đối với bệnh nhân điếu trị
với bosentan La 0,9ng1 (thay đồi tới khi kết thủc điếu trị). Phần lớn sự giảm nồng độ
hemoglobin nảy được phải hiện trong một số ít tưần đầu tiến điếu trị với bosentan vả nồng độ
hemoglobin ôn định ở cảc tuần diếu trị 4 - 12 với bosentan Trong các nghiến cứu có đối
ohứng với p]acebo với tắt cả cảc cách dùng bosentan, đã nhận xét thấy sự giảm hemoglobin rõ
rệt (giảm › 15% so vởi mức ban đầu dẫn đến cảc trị số < 11g/dl) ở 6% bệnh nhân điếu trị với
bosentan vả 3% bệnh nhân điếu trị với placcbo. Ở bệnh nhân có tăng hưyết ảp động mạch
phồi điếu trị với các liếu 125 và 250mg, 2 lầnfngảy, đã nhận xét thấy sự giảm hemogiobin rõ
rệt ở 3% bệnh nhân so với 1% ở bệnh nhân điều trị với placebo.
Dã nhận xẻt thấy sự giảm nồng dộ hemoglobin it nhẳt ig/d] ở 57% bệnh nhân điếu trị với
bosentan so với ở 29% bệnh nhân điếu trị với placebo. 0 80% cảc bệnh nhân mà hemoglobin
giảm ít nhât 1g/dl, sự giảm xảy ra trong 6 tuân đảu điếu trị với bosentan.
Trong tiến trinh điếu trị, nồng độ hemogiobin vẫn ở trong phạm vi các giới hạn binh teròng ở
68% bệnh nhân điếu trị với bosentan so với ở 76% bệnh nhân điếu trị với p]acebo. Không có
sự giải thích về thạy đôi nông độ hemoglobin, nhưng đó khỏng có vẻ là do xuât hưyêt hoặc
Lạn hưyêt.
Nến kiếm tra nồng độ hemoglobin sau ] thảng và 3 tháng vả sau đó cứ 3 tháng ] lằn. Nếu sự
giảm rõ rệt nông độ hemoglobin xảy rạ, cân đảnh giá thêm đế xảo định nguyên nhân vả như
câu vế trị liệu đặc hiệu.
Giữ dịch
T rong một thử nghiệm có đối chứng với placebo trên bệnh nhân có suy tim mạn tính nặng, có
sự tăng tỷ lệ trường hợp điếu trị Lại Iộbệnh viện vê suy tim mạn tính kết hợp với tăng thể trọng
vả tăng phù chân trong 4— 8 tuần đầu tiến điếu trị với TRACLEER® Ngoài rạ, có nhiều bảo
cáo sau bán thuốc về giữ dịch ở bệnh nhân có tăng huyết áp phồi, xáy ra trong vờng mấy tuần
sau khi bắt đầu dùng TRACLEERỂ Bệnh nhân cân được điếu trị với một thuốc iợi tiếu, sự
quản lý địch, hoặc điếu trị tại bệnh viện về suy tim mắt bù (xem NGHIÊN CỬU LÂM
SÀNG; Suy lim sung huyết).
Bếnh lắc li'nh mạch phối (P VỌD) _ `
Nêu cảc dâu hiệưcùạ phù phôi xảy ra khi dùng TRACLEERỂ’, cản xem xét khả năng có bệnh
tăc tĩnh mạch phôi kêt hợp vả phải ngưng dùng TRACLEERẾ
Thông tin đối với bệnh nhân
Khuyên bệnh nhân nên tham khảo Bản chỉ dẫn sử đụng thuốc TRACLEER`gJ về cách sử dụng
ạn toản TRACLEER®
Bảo sĩ phải thảo luận với bệnh nhãn về tầm quan trọng của việc theo dõi hảng tháng
ạminotransferase hưyết thanh vả xét nghiệm thại nghén nước tiếu hoặc huyết thanh vả cùa
việc tránh thụ thai Bác sĩ phải thảo luận vói bệnh nhân nữ về 1ựa chọn sự tránh thụ thai có
hiệu quả vả các biện phảp dế phòng ngùa thai nghén Khi cần thiết, tìm kiếm sự chỉ dẫn từ
một bác st phụ khoa hoặc chuyên gia tương tự vẽ biện phảp tránh thại thich hợp
TƯỢNG TÁC THUỐC
Bosentan dược chuyến hóa bởi các enzym CYP2C9 vả CYP3A4 Sự ức chế cảc enzym nảy có
thế lảm tăng nông độ huyết tương của bosentan (xem ketoconazol) Việc đùng đồng thời cả
chắt ức chế CYPZC9 (như iÌuconazol hoặc amiodmon) vả chất ức chế CYP3A4 (nhu
ketoconazol, itraconazol, hoặc ritonavir) với bosentan có thể dẫn đến sự Lãng cạo nồng độ
huyết tương của bosentan. Không dùng đồng thời sự phối hợp ch1a một thuốc ức chế mạnh
CYP2C9 và một thuốc ức chế CYP3A4 như vậy với TRACLEER".
Ui
Bosentan là một chất gây cảm ứng CYP3A4 vả CYP2C9. Vì vậy, nồng dộ huyết tương cùa
các thuốc dược ohuyên hóa bới hai enzym nảy sẽ giảm khi dùng cùng với TRACLEER®.
Bosentan không có tác dụng ức ohế có liên quan trên bất cứ isozym CYP nảo in vitro
(CYPIA2, CYP2C9, CYP2CI9, CYP2D6, CYP3A4). Vì vậy TRACLEER® không lảm tăng
nồng độ huyết tương của cảc thuốc được ohuyên hóa bới oảo enzym nảy.
Các thuốc tránh thụ thai hormon, bao gồm thuốc trảnh thụ thai uống, tiêm, qua chân bì,
và cấy dưới da: Một nghiên oứu về tương tảo đã chứng minh răng việc dùng dồng thời
bosentan và thuốc tránh thụ thai hormon uông Ortho-Novumĩc gãy sự giảm trung bình nồng
dộ norethindron vả ethinyl estradiol 14% vả 31%, tương ứng. Tuy vậy, mức giảm phơi nhiễm
là 56% vả 66%, tương ứng, ở oác đối tượng cá nhân. Vì vậy, các thuốc tránh thụ thai hormon,
bao gồm oác dạng thuốc uông, tiêm, qua chân bì vả cấy dưới da, có thế không chắc chắn khi
dùng cùng với TRACLEER”. Phụ nữ cân ảp dụng cảo phương pháp tránh thụ(ị thai phụ thêm
và không chỉ dựa vảo sự tránh thụ thai hormon đơn độc khi dùng TRACLEERỂ
Các nghiên oứu tương tác đặc hiệu đã chứng minh như sau:
Cyclosporin A: Trong ngảy đầu dùng đồng thời, nổng độ đảy cùa bosentan tăng gắp khoảng
30 lần. Nổng độ huyết tương cùa bosentan ở trạng thải ổn định cao hơn gấp 3- 4 lân so với
khi không có cyclosporin A. Chống ohỉ định dùng đồng thòi bosentan vả cyclosporin A (xem
CHỐNG CHỈ ĐỊNH). Việc dùng đổng thời bosentan lảm giảm nồng độ huyết tương cùa
cyclosporin A (một oơ chẳt cùa CYP3A4), khoảng 50%.
Tacrolimus: Việc dùng đồng thời tacrolimus vả bosentan đã không được nghiên cứu trên
người. Việc dùng đồng thòi taorolimus vả bosentan trên động vật dẫn đến tăng rõ rệt nồng độ
huyết tương cùa bosentan. Cần phải thận trọng nếu dùng đồng thời tạcrolimus vả bosentan
Glyburid: Đã nhận xét thẩy sự tăng nguy cớ cùa tăng aminotransferase gan ở bệnh nhân dùng
đồng thời với glyburid. Do đó, việc dùng đông thời TRACLEERị vả glyburid bị chông chỉ
định, vả phải xem xét dùng cảc thuôc hạ đường huyêt khác (xem CHỐNG CHI ĐỊNH).
Việc dùng đồng thời bosentan lảm giảm nồng độ huyết tương cùa glyburid khoảng 40%.
Nồng độ huyết tương của bosentan cũng giảm khoảng 30% Bosentan cũng lảm giảm nồng độ
huyết tương cùa cảc thuốc hạ đường huyết uống khác đưọo chuyến hóa chủ yếu bới CYP2C9
hoặc CYP3A4 Cần phải xem xét khả năng xâu đi cùa sự kiếm soát đuờng huyết ở bệnh nhân
dùng cảo thuốc nảy.
Ketoconazol: Việc dùng đổng thời bosentan 125mg, 2 Iần/ngảy, vả ketoconazol, một thuốc
ức chế mạnh CYP3A4, lảm tăng nồng độ huyết tương cùa bosentan gấp khoảng 2 1ần.Không
oần phải điếu chinh liếu bosentan, nhưng phải xem xét sự tãng tảo dụng cùa bosentan
Simvastatin và các statỉn khác: Việc dùng đồng thời bosentan lảm giảm nồng độ huyết
tương cùa simvastatin (một cơ chất cùa CYP3A4), vả chất chuyền hóa có hoạt tính [3— hydroxy
acid, khoảng 50% Nỗng độ huyết tương oủa bosentan không bị ảnh hướng. Bosentan cũng
Iảm giảm nông độ huyết tương cùa các statin khảo được ohuyền hóa một cách có y' nghĩa bòi
CYP3A4, như lovastatin vả atorvastatin. Cần phải xem xét khả năng giảm hiệu lực cùạ statin.
Đối với bệnh nhân dùng statin chuyến hóa bới CYP3A4, cân phải theo dõi nổng độ
cholesterol huyết sau khi bắt đầu dùng TRACLEER® để xem oó cần phải điếu chỉnh liều
statin hay không.
Warfarin: Việc dùng đồng thời bosentan SOOmg, 2 lần/ngảy trong 6 ngảy Iảm giảm nồng độ
huyết tương cùa cả S. warfarin (một cơ chất của CYP2C9) và R warfarin (một cơ chất cùa
CYP3A4) với tỷ lệ 29% vả 38%, tương ứng Kinh nghiệm 1âm sảng với việc dung đồng thời
.…zZéị,
//
bosentan vả warfạrin ở bệnh nhân có tảng huyết ảp động mạch phồi không cho thấy thạy đổi
có liên quan về lâm sảng ở INR hoặc liếu warfarin (mức bạn đầu so với khi kết thúc nghiến
cứ,u) và sự cằn thiết thay đối liếu w ạrfạrin trong các thử nghiệm, do sự thay đối về INR hoặc
do các tác dụng khỏng mong muốn, giống nhau giũa bệnh nhân điếu trị với bosentan vả bệnh
nhân điếu trị với placebo
I)ỉgoxin, Nimodỉpin vả Losartan: Bosentan không có tương tác dược động học có ý nghĩa
với digoxin vả nimodipỉn, vả losartan không có tảc dụng có ý nghĩa trến nỏng độ huyết tương
của bosentan.
Sildenafil: ớ đối tượng khỏe mạnh, việc dùng đồng thời nhiếu liếư bosentan 125mg, 2
lầnlngảy vả 80mg sildenaíi], 3 lần/ngảy dẫn đến sự giảm nồng độ huyết tướng cùa sildenafi]
63% vả sự tăng nông độ huyết tương cứa bosentan 50%. Không cần phải điếu chinh iiều cùa
thuốc nảo. Khuyến cảo nảy vân đủng khi dùng si1denafil đế điếu trị Lãng huyết ảp động mạch
phổi hoặc loạn chức năng cư~.ong
Iloprost: Trong một nghiến cứu nhò, ngẫu nhiến hóa, mù kép, có đối chứng với placcbo (thứ
nghiệm STEP), 34 bệnh nhân điều trị với bosentan 125mg, 2 lần/ngảy trong it nhất 16 tuần đã
dưng nạp việc dùng thêm iioprost hít (tới 5 microg, 6 - 9 lẳn/ngảy trong những giờ đi bộ).
Liều hit trung binh mỗi ngảy là 27 microg vả số 1ần hít trung binh mỗi ngảy lả 5,6 lần.
Rifampicin: Việc dùng đồng thời bosentan vả rifampicin ở người tinh nguyện binh thường
dẫn đến sự tảng trung binh gắp 6 iần nồng độ đậy của bosentan sau liều dùng đồng thời đầu
tiến, nhưng dẫn đến sự giảm khoảng @ nồng độ bosentan ở trạng thải ồn định. Chưa đánh
giá tác dụng của bosentan trên nồng độ cùa rít`ampicin. Khi sự oân nhắc khả năng cùa lợi ích
vả nguy cơ đã biết vả chưa biết dẫn đến việc sử dụng đồng thời, phải đo LFTs hảng tuần trong
4 tuần đầu tiên trước khi trở lại sự theo dõi binh thường.
Sự gây ung thư, sự gây đột biến, suy giảm khả năng sinh sản
Cho chuột nhắt trắng LLông bosentan trộn với thức ăn trong hai năm gây tăng tỷ iệ trường hợp
có 11 tưyến tế bảo gan vả ung thư biếu mô (careinoma) ở chuột đưc với lỉếu thẩp
450mgfkg/ngảy (gắp khoáng 8 lẩn liếu tối đa khuyến cảo dùng cho người [MRHD) lả 125mg,
2 lầnlngảy trên cơ sở mg/m ). Trong cùng nghiên cúu nảy, cảc liếu 1ớn hớn 2000111g/kg/ngảy
(gấp khoảng 32 lần MRHD) đã kết hợp với sự tăng tỷ lệ trường hợp có u tuyến ruột kết ở cả
chuột đực và cải. Ở chuột công trắng, việc cho uỏng bosentan trộn vảo thức ăn trong hai năm
đã kết hợp với sự tăng tỷ lệ trường hợp có LL tế bảo hinh sạo ờ nảo ohuột đực với liếu thấp
500n1g/kg/ngảy (gầp khoảng 16 lằn MRHD) Trong một tập hợp cảc thử nghiệm in virro hỗn
hợp (thử nghiệm gảy đột biến vi sinh vật, thứ nghiệm tồng hợp ADN không theo chương
trình, thử nghiệm gây đột bìến tế bảo động vật có vú V- 79, và thứ nghìệm tế bảo iympho
người) và một thứ nghiệm nhân sinh sản chưột nhẳt trắng in vivo, đã không có bằng chứng về
bẩt cứ hoạt tính gây đột biến nâo cùa bosentan
Suy giảm khả nãng sinh sảnlChức năng tinh hoản
Nhiếu chất đối kháng với thụ thể cùa endothelin có tác dụng lớn trên mô học vả chức năng
tinh hoản của động vật Đã chứng minh cảc thuốc nảy gây teo các ống sinh tinh cứạ tinh hoản
vả lảm giảm sô đếm tinh trùng và khả năng sinh sản cùa chuột cống trắng đục được cho đùng
trong hon 10 tuần Sự teo ông tinh hoản vả sự giảm khả năng sinh sán cùa giống đục quạn sải
thẳy với cảc thuốc đối kháng với thụ thể của endothelin có vẻ không hồi phục
Trong các nghiến cứu về khả nảng sinh sản trong đó ohuột cống trắng đưc vả cải được điếu trị
với bosentan với cảc liếu uống tới lSOOmg/kg/ngảy (gấp 50 lần MRHD trên cơ sở mg»m 2)
hoặc các liếu tiêm tĩnh mạch tới 40mg/kg/ngảy, không thấy có tác dụng trên số đếm tinh
trùng, sự chuyến động của tinh trùng, sự thục hiện giao phối hoặc khả nảng sinh sản Đã nhận
/7222
/7
xét thấy sự tãng tỷ lệ trường hợp có teo ống tinh hoản ớ chưột oóng trắng được cho LLống
bosentan với liều thắp l25mg/kg/ngảy (gấp khoáng 4 lần MRHD vả liếu thẳp nhắt được thử
nghiệm) trong 2 năm nhưng không thấy vói liếu cạo 1500n1g/kg/ngảy (gấp khoảng 50 lần
MRHD) trong 6 thảng Chi đảnh giả tác dựng trên số đếm và sự chuyến động cùa tinh trùng
trong cảc nghiên cứu về khả năng sinh sản với thời gian ngắn hon nhìếu, trong đó động vật
đục được phơi nhiễm với thuốc trong 4- 6 tuần Đã không nhận xét thẳy sự tăng tỷ lệ trường
hợp teo ông tinh hoản ở chuột nhắt trắng được điếu trị trong 2 năm với liếu tới
4500mglkg/ngảy (gắp khoảng 75 lẩn MRHD) hoặc ờ chó được điếu trị tới 12 tháng với liếu
tới 500mg/kg/ngảy (gắp khoảng 50 lẳn MRHD).
Không có dữ liệu về tảo dụng cùa bosentan hoặc các thuốc đối kháng với thụ thể cùa
endothelin khảo trên chức năng tinh hoản ở người nam giới.
Thời kỳ mang thai, Tác dụng gây quái thai: Loại x [xem CHỐNG cui DỊNH).
Người mẹ cho con bú
Người ta không biết thuốc nảy có bải tiết trong sữa người hay không Vì nhiếu thuốc được bải
tiết trong sữa ngưòi, khỏng nến cho con bú trong thời gian dùng TRACLEERỂ
Sử dụng cho trẻ em ` `
Đặ khôngxác định độ ạn toản vả hiệu 1ụ~c ở bệnh nhân trẻ em (xem LIEU LƯỢNG VA
CACH DUNG).
Sử dụng ở bệnh nhân cao tuổi
Kinh nghỉệm lâm sảng về sử dụng TRACLEER`m ở bệnh nhân từ 65 tưới trở lên đã không
bao gôm dù số lượng bệnh nhân như vậy để xảo định sự khác nhạụ vế đáp ứng giũa các bệnh
nhân cao tuối vả trẻ tuổi (xem LIẺU LƯỢNG VÀ CÁCH DÙNG).
TÁC DỤNG KHÔNG MONG MUÔN
Các tảc dụng không mong muốn
Xem CÁNH BÁO, phần bản luận về tồn thư~ong gạn vả xem THẬN TRỌNG, phần bản luận
về cảc dị thường về hemoglobin vả hemetocrit
Cảo dữ liệu về độ an toản trên bosentan đã thu nhặn được từ 12 nghiên cứu lâm sâng (8
nghiến củu có đối chúng với placebo và 4 nghiến cứu nhãn mớ) (› 777 bệnh nhân có tăng
huyết áp động mạch phối và các bệnh khảo Cảo Iiếu tới gẫp 8 lần liếu lâm sảng |Liệh đang
được khuyến cáo (125mg, 2 lẩn/ngảy) đă được dùng trong cảc khoảng thời gian khác nhau.
Sự phơi nhiễm với bosentan trong cảc thử nghiệm nảy xê dịch từ 1 ngảy đến 4,1 năm (N = 89
đối với 1 năm; N = 61 đối với 1,5 năm; vả N = 39 dối với trên 2 năm). Sự phơi nhiễm của
bệnh nhân có tăng huyết ảp động mạch phổi (N = 235) với bosentan xế địch tù ] ngảy đến 1,7
năm (N = ]26 đối với trên 6 tháng vả N = 28 đối với trên 12 tháng).
Sự gián đoạn điếu trị do cảc tảo dụng không mong mướn khác ngoải các tác dụng có liên quan
với tăng huyết áp phối trong các thử nghiệm lâm sảng ở bệnh nhân có tăng huyết ảp động
mạch phối xảy ra thường xuyên hon đối với bosentan (5%; 8/165 bệnh nhân) so với placebo
(3%; 2780 bệnh nhân). Trong cơ sở đữ liệu nảy, nguyên nhân dưy nhắt gây gián đoạn điếu trị
> [% vả xảy ra thường xuyên hơn đối với bosentan lả chức năng gạn không binh thường.
Cảo tác dụng khỏng mong muốn xảy ra ở > 3% bệnh nhân điếu trị với bosentan và thường gặp
hon với bosentan trong cảc thù nghiệm có đối chứng với placebo trong tăng huyết ảp động
mạch phồi với các liếu bosentan 125 hoặc 250mg, 2 1ầnfngảy được trinh bảy ớ Bảng 4
Bảng 4. Tác dụng không múonẵ-rnunốn"le itảy ra ở > 3% bệnh nhân điều trị với bosentan 12—5-—'
250mg, 2 lầnlngảy vả thường gặp hơn với bosentan trong cảc thử nghiệm có đối chứng với
placebo trong tăng huyêt áp động mạch phôi
Tác dụng không mong _ Bosentan (N = 165) Placebo (N = 80)
muôn Số lượng __… __ _Ọ% ,_._ _ ___ SỐ lượng… _ %
Nhức đầu 36 22% 16 20%
Viêm mũi-họng 18 11% 6 8%
Đỏ bừng 15 9% 4 5%
Chức năng gan không 14 8% 2 3%
binh thường
Phù, chi dưới 13 8% 4 5%
Hạ huyểt áp 11 7% 3 4%
Đảnh trống ngực 8 5% 1 1%
Khó tiêu 7 4% [) 0%
Phù 7 4% 2 3%
Mệt mòi 6 4% 1 1%
Ngứa 6 4% 0 0%
* Ghi chủ: Chi có cảc tải: dụng không mong muốn xáy ra từ khi bẳt đầu điều trị tới ] ngảy theo lịch
sau sự kết thúc điều trị được tỉnh đến Tắt cả các tảo dụng có báo Cảo (it nhất 3%) được tính đến trừ
nhũng tảc dụng quả chung, ĩt thông tin vả những tảc dụng không kết hợp một cảch hợp lý với việc sủ
dụng thuốc vi các tảc dụng đã kết hợp với bệnh được điều trị hoặc rắt phổ biến trong quân thể điều trị.
Trong cảc nghiên cứu có dối chứng với placebO về bosentan trong tăng huyết ảp động mạch
phồi vả đối với các bệnh khảc (chủ yếu suy tim mạn tính), một tống số 677 bệnh nhân được
điều trị với bosentan với liều hảng ngảy xê dịch từ lOOmg đến 200mg, và 288 bệnh nhân được
điều trị với placcbo Thời gian điều trị xê dịch từ 4 tuần đến 6 thảng Đối với cảc tác dụng
không mong muôn cua thuốc xảy ra ở > 3% bệnh nhân điểu trị với bosentan cảc tác dung duy
nhất xảy ra thuờng xuyên hơn với bosentan so với placebo (khảo nhau > 2%) lá nhức đẩu
(16% so với 13%), đó bùng (7% so vói 2%), chức năng gan không bình thuờng (6% so với
2%), phi) chân (5% so với 1%), và thiếu máu (3% so với 1%).
Kinh nghiệm sau bán hảng: Mẫn cảm, ban giảm lượng tiếu cầu
Đã có nhiều báo cáo sau bản hảng về phu thần kinh mạch kết họp với việc sủ dụng bosentan.
Cảo trường hợp đưọc bảo cáo xảy ra trong phạm vi 8 giờ đến 21 ngảy sau khi bắt đầu điều trị.
Một sỏ bệnh nhân đã được điều trị vởi một thuốc khảng histamin vả các dẳu hiệu cùa phù
mạch đã khỏi mã không phải ngưng TRACLEER®
Trong thời kỳ sau bán hảng, trong hoản cảnh theo dõi chặt chẽ, có báo cáo hìếm về xơ gan
không giải thỉch được sau trị liệu kéo dải (> 12 thảng) vởi TRACLEERÙ ở bệnh nhân măc
nhiều bệnh và điều trị với nhiều thuốc. Cũng hiếm có các bảo cảo về suy gan. Sự gỏp phần
cùa TRẨCLEERịj trong các trường hợp nảy không thế được loại trù (xem CẢNH BÁO).
Những sự dị thường về xét nghiệm
Tăng aminotransferase gan (xem CẢNH BÁO)
Giảm hemoglobin vả hcmatocrit (tỷ lệ thể tích huyết cằu) (xem THẬN TRỌNG)
Thông báo cho Mc sĩ những tăc dụng không mong muốn gặp phăi khi sử dụng thuốc.
QUÁ LIÊU `
Đã cho ngưòi tinh nguyện khỏe mạnh dùng bosentan với liêu duy nhât tới 2400mg, hoặc đã
cho bệnh nhân dùng liêu bosentan tởi 20001ng/ngảy trong 2 thảng mả khõng có hậu quả lâm
,… ấQ
, /
sảng iớn nảo. Tác dụng không mong muốn thường gặp nhất iả nhưc đầu cường độ nhẹ đến
vừa Trong nghiến cứu vê tương tác với cyciosporin A, trong đó đã dùng cảc liếu bosentan
500 vả 1000mg, 2 lầnlngảy đồng thời với cyclosporin A, nỏng độ đáy trong huyết tương của
bosentan tăng gâp 30 lần dẫn đến nhức đầu nặng, buổn nỏn vả nôn nhưng không có sự kiện
không mong muôn nghiếm trọng Đã nhận xét thắy sự giảm nhẹ huyết ảp vả tăng tần số đập
của tim.
Không có kinh nghiệm riêng biệt về quá liếu với bosentan ngoải các iiêu mô tả ở trên. Quả
liêu lớn có thế dân đến hạ huyết ảp rõ rệt cân sự hô trợ tim mạch tích cực,
DƯỢC LÝ LÂM SÀNG
Cơ chế tác dụng
Endothelin- ] (ET- 1) là một hormon thằn kinh mà tảc dụng đưọo trung gian bòi sự gắn với
các thụ thế ETA vả ETg ở nội mô và cơ trơn mạch Các nông độ ET— ] tăng lến trong huyết
tưong vả mô phồi cùa bệnh nhân có Lãng huyết ảp dộng mạch phối, gọi ý về vai trò gây bệnh
cùa ET-l trong bệnh nảy. Bosentan lả một thuốc đối kháng đặc hiệu và cạnh tranh ở cảc thụ
thể cùa endothelin týp ETA vả ETg. Bosentan có ải lục hơi cao hon đối với thụ thể ETA so với
thụ thể ETB
DƯỢC ĐỌNG HỌC
Chung
Dược động học cùa bosentan chủ yểu được ghi chép lại ở người khòe mạnh. Sau khi uổng,
nồng độ trong huyết tướng tối đa của bosentan đạt được trong vòng 3 -5 giờ vả nửa dời thải
trư tận cùng (tưz) là khoảng 5 giờ ở đối tượng người 1ớn khóe mạnh Ít dữ liệu trên bệnh nhân
cho thẳy sự lưu lại của bosentan trong cơ thể ở bệnh nhân tảng huyết ảp động mạch phối lớn
hơn khoảng 2 lằn so với đối tượng người lớn khóe mạnh
Hẩp thu và phân hố
Sinh khả dụng tuyệt đối cùa bosentan ở người tình nguyện bình thướng là khoảng 50% và
không bị ảnh hướng bới thức ản Thể tích phân bố lả khoảng 18 lít. Bosentan gãn kết ở mức
cao (> 98%) với protein huyết tương, chủ yếu với albumin Bosentan không thâm nhập vảo
hồng câu
Chuyển hóa và thải trừ
Bosentan có ba chẳt chuyến hóa, một chẳt đó có hoạt tính được lý vả có thể đóng góp 10 -
20% vảo tảc dụng của bosentan. Bosentan là chất gây cảm úng các enzym CYP2C9 vả
CYP3A4 vả có thế cả CYP2C19 Sự thanh thải toản bộ sau một liều tiếm tĩnh mạch don lả
khoảng` 4 lít/giờ ở bệnh nhân có tăng huyết ảp động mạch phồi. Khi dùng thuốc uống nhiếu
liều, nông độ huyết tuơng ở người lớn khỏe mạnh giảm dần đến 50— 65% nồng dộ nhận xét
thấy sau khi dùng liếu đơn có thế do tác dụng tự cảm ùng cùa các enzym chuyến hóa ở gan
Trạng thải ốn định đạt được trong vòng 3- 5 ngảy. Bosentan được thải trừ do sự bải tiết trong
mật sau khi được chuyến hóa ở gan. Dưới 3% cùa một liếu uông được thu hồi trong nước tỉếu.
Các đối tượng bệnh nhân đặc biệt
Người ta không biết dược động học cua bosentan có bị ảnh hướng bởi giới tính, cân nặng,
chùng tộc, hoặc tuối hay không.
Suy giám chưa năng gan
Bằng chứng in viíro và in vivo cho thẳy sự chuyến hóa mức độ iớn ở gan cùa bosentan gợi ý
răng suy gan có thể lảm tăng có y' nghĩa sự phơi nhiễm với bosentan Trong một nghiến cứu
so sảnh 8 bệnh nhân có suy gan nhẹ (được cho biết bằng phướng phảp Child- -PLLgh) với 8 đối
chứng, dược động học cùa liếu đơn và nhiều liều bosentan không bị thay đổi ở bệnh nhân có
10
suy gan nhẹ. Đã không đánh giá ảnh hưởng cùa suy gan vừa hoặc nặng đển dược động học
cùa bosentan Nói chung, phải trảnh dùng bosentan cho bệnh nhân có những sự không bình
thường vừa hoặc nặng vê gan, vảlhoặc aminotransferase tăng > 3 x ULN (xem LIÊU
LƯỢNG VÀ CÁCH DÙNG vả CẢNH BÁO).
Suy thận
Ở bệnh nhân có suy thận nặng (sự thanh thải creatinin ]5— 30mI/phủt), nồng độ huyết tương
cùa bosentan chủ yếu không thay đổi và nồng độ huyết tương cùa ba chẩt chuyến hóa Lãng lên
khoảng 2 lẩn so với người có chức năng thận bình thường. Các sự khác nhau nảy có vẻ như
không quan trọng về mặt lâm sâng (xem LIÊU LƯỢNG VÀ CÁCH DÙNG).
CUNG cÁp THUỐC
Viên nén bao phim, tròn, hai mặt lồi, mảu da cam—trắng, chứa 62 ,5mg, rập nồi dắu "62,5",
đóng gói trong lọ polyethylen trắng tỷ trọng cao vả một nắp polypropylen trắng kháng lại trẻ
em.
NDC 66215-101-06: Hộp 1 lọ chứa 60 viên nén.
Viên nén bao phim, hình bầu dục, hai mặt iồi, mảu da cam- trắng, chúa 125mg, rập nối dấu
"125", đóng gói trong lọ polyethylen trắng tỷ trọng cao vả một năp polypr0pylen trắng kháng
lại trẻ em.
NDC 66215-102-06: Hộp 1 lọ chứa 60 viên nén.
Chỉ bản theo đơn.
BẢO QUẢN
Bảo quản ở nhiệt độ dưới 300 C.
Hạn dùng: 60 thảng kế từ ngảy sản xuất.
Tiêu chuẩn chất lượng thuốc thânh phẩm: Nhà sản xuất.
Đọc kỹ ILướLLg dẫn sử dụng trước khi dùng. Nếu cần IILêm thông lin, xin hỏi ý kiến bác sĩ.
Để thuốc xa tẩm tay trẻ em.
Sản xuất bởi:
Patheon, Inc.
2100 Syntex court, Mississauga, Ontario, Canada LSN 7K9. %
Phân phổi bởi: /
tcs
Louisville, KY40229, USA.
Tiếp thị bởi:
Actelion Pharmaceuticals US, Inc.
Miên Nam San Francisco, CA 94080, USA.
Tải liệu tham khảo:
1. Zimmerman H.J ., Hepatotoxicity. The adverse effec ' — and other chemicals on the
liver. Second ed., Philadelphia, Lippinoott, 1999.
Ngảy 15 tháng 2 năm 2007.
PHÓ cục TRUỞNG
JVW AỈ/ỔnW
Khi dùng TRACLEERỄN cần chủ ý tới hai đìều quan trọng: 1) khả năng gây tổn
thương gan nặng và 2) khả nãng gây tôn hại cho thai.
CẢNH BÁO: Khả năng gây tổn thương gan
TRACLEER® gây tăng ít nhẩt gấp 3 lần giới hạn trên của mức bình thường (ULN)
cảc aminotransferase gan (ALT vả AST) ở khoảng 11% bệnh nhân, kèm theo tăng
bilirubin ở một số it trường hợp. Vì cảc thay đổi nảy lả dẩn hiệu cua tổn thương gan
nghiêm trọng có thể xảy ra, cân phải đo nồng độ aminotransferase huyết thanh trước
khi bắt đầu điếu trị và sau đó hảLtg tháng (xem CẢNH BÁO: Khả nãng gây tổn
thương gan và LIÊU LƯỢNG VÀ CÁCH DÙNG). Trong thòi kỳ sau khi bản thuốc ở
thị trường, trong hoản cânh theo dỏi chặt chẽ, đã có báo cáo về các trường hợp xơ
gan hiếm gặp không giãi thích được sau trị liệu kéo dải (> 12 tháng) vói
TRACLEER®ở bệnh nhân mắc nhiếu bệnh đổng thời và được điểu trị vởi nhiếu
thuốc. Cũng hiếm có cảc bảo cảo về suy gan. Sự đóng góp của TRACLEER trong
các trướng hợp nảy không thế được loại trừ.
Trong ít nhẩt một trường hợp, sự xuất hiện đầu tiên (sau > 20 tháng điều trị) gồm sự
Lãng rõ rệt nồng độ aminotransferase vả bilirnbin, kèm theo các triệu chứng không
đặc hiệu, tẫt cả khỏi chậm cho đển sau khi ngừng TRACLEERỂ Điếu nảy lảm tãng
tầm quan trọng của việc thực hiện nghiêm chỉnh biểu thời gian theo dõL hảng thảng
về thời gian điều trị và algorithm (thuật toán) điều trị, bao gồm việc ngùng
TRACLEER® khi có sự tăng aminotransferase kèm theo các dẩn hiệu hoặc triệu
chứng cũa loạn chửc nãng gan (xem LIÊU LƯỢNG VÀ CÁCH DÙNG).
Tãng aminotransfcrase đòi hỏi sự chăm sóc cẩn thận (xem LIÊU LƯỌNG VÀ CÁCH
DÙNG). Nói ch ung, tránh dùng TRACLEERỦ ở bệnh nhân có aminotransferase tăng
cao ở mức ban đầu (3 x ULN) vì sự theo dõi tổn thương gan có thế khó hơn. Nếu sự
tăng aminotransfcrase gan có kèm theo các triệu chửng lâm sảng cũa tổn thương gan
(như buồn nôn, nôn, sốt, đau bụng, vảng da, hoặc ngủ lịm không thông thường hoặc
mệt mỏi) hoặc tăng bilirubin ỉ 2 x ULN, phải ngừng điếu trị. Không có kinh nghiệm
về việc sử dụng lại TRACLEERLÊ trong các trường hợp nây.
CHỐNG CHÍ ĐỊNH: Thời kỳ mang thai
TRACLEER® (bosentan) rẩt có thể gây các khuyết tật lởn về sinh đẻ nếu dùng cho
phụ nữ mang thai,_vì thường nhận xét thẩy tảo dụng nảy khi dùng thuốc nảy cho
động vật (xem CHÒNG CHỈ ĐỊNH). Do đó phải loại trừ sư mang thai trước khi hắt
đầu điếu trị với TRACLEERJìJ vả sau đó dự phòng bằng cách sử dụng một phương
pháp tránh thai chắc chắn. Không dùng cảc thuốc tránh thụ thai hormon, bao gôm
các thuốc trảnh thụ thai uống, tiêm, qua chân bì, và cấy dưới da lảm biện pháp duy
nhẫt tránh thụ thai vì các thuốc nảy có thế không hiệu quả ở bệnh nhân dùng
TRACLEER® (xem THẬN TRỌNG: Tương tảc thuốc). Do đỏ, nên dùng phương
phảp trảnh thai có hiệu quả với các dạng thuốc tránh thụ thai kết hợp. Cần thực hiện
các xét nghiệm về thai nghén hảng tháng.
Vì thuốc có khả Ltãng gây tổn thương gan và để cố gắng Iảm cho khả nãng phơi nhiễm
của thai với TRACLEER® (bosentan), ít nhẩt có thể được, chỉ có thế kê đơn
TRACLEER® qua Chương trình Tiếp cận TRACLEERQLJ bằng cảch gọi số máy 1 866
228 3546. Cũng có thể báo cản trực tiếp cảc tác dụng không mong muôn qua số máy
nay.
Bản chỉ dẫn sử dụng thuốc
Viến nẻn Tracleer (tra-KLEER)
(bosentan)
Hãy đọc kỹ bản thông tin nảy trước khi bạn bắt đầu dùng viên nén Tracleer. Hãy đọc bản
thông tin mả bạn có được cùng với thuôc Tracieer mỗi 1ân bạn được kê đớn lại. Có thế có
thông tin mới. Thông tin không thay thế vỉệc trao đôi với bác sĩ cùa bạn.
Điều gì lả thông tin quan trọng nhẩt tôi phải biết về Tracleer?
o Hư hại gan
Tracleer có thể gây hư hại gan nểu không phảt hiện sớm những vấn để về gan. Do đó
bạn phải được Iảm xẻt nghiệm máu để kiếm tra chưc năng gan truớc khi bắt đầu dùng
Tracleer và sau dó môi thảng một lần. (Xem "Những tảc dung phụ có thể xảy ra cua
Tracleer lả gì?") dễ có thông tin về cảc dấu hìệu cùa cảc vấn để vẽ gan.
c Các khuyết tật sinh đẻ lớn
Tracleer có thể gây cảc khuvết tặt sinh đẻ lớn nển dùng trong thời kỳ mang thai. Do đó,
phụ nữ không được mang thai khi bắt đầu dùng Tracleer hoặc trong khi điều trị với
Tracleer. Phụ nữ có hoạt động sinh dục phải có xét nghiệm thai nghén âm tính trước khi hắt
đầu điếu trị. Một xét nghiệm âm tính có nghia là bạn không có thai. Phải lảm xét nghiệm
trong 5 ngảy đầu của một chu kỳ kinh nguyệt bình thường vả ít nhắt ! 1 ngảy sau lễ… giao hợp
không được bảo vệ cuối cùng. Phải lảm xét nghiệm thai nghén hảng tháng sau khi điều trị
với Tracleer, nếu bạn có hoạt động sinh dục.
Phụ nữ có khả năng có thai phâi áp dụng sự kiểm soát sinh để có hiệu quả trong khi
dùng Tracleer. Sự kiểm soát sinh đẻ dựa trên các viên thuốc, viên đạn, miếng bãng
dính, viên cẩy hoặc thuốc hormon khác để kiểm soát sinh đẻ có thể không đủ khi dùng
Tracleer. Trao đồi với bác sĩ cùa bạn vả, nếu cần, với một bác sĩ phụ khoa (một bảc sĩ chuyên
khoa về sự sinh sản ở phụ nữ) hoặc một bác sĩ khác am hiếu về sự kiếm soát sinh đè, đê tim ra
cảch trảnh thụ thai. Nói ngay tửc thì với bác sĩ nếu bạn không thẩy có một kỳ hảnh kinh
hoặc nghĩ rằng bạn có thể có thai.
Tracleer lả gì?
'T`racleer là một thuốc để điếu trị tăng huyết ap động mạch phối, lả ảp suất mảu cao trong cảc
động mạch phồì. Bạn dùng thuốc đó bằng cảch uông
Tracleer có thể cải thiện khả năng luyện tập cùa bạn và iảm chậm lại sự xấu đi cùa tinh trạng
cơ thể vả cảc triệu chúng Tracleer 1ảm giảm huyết áp cao trong phồi bạn và lảm cho tim bạn
bom máu có hiện quá nhiếu hon.
Ai không được dùng Tracleer?
Không được dùng Tracleer nễu:
ơ bạn có thai, dự định có thai, hoặc bắt đầu có thai trong khi điểu trị với Tracleer.
Tracleer có thể gây các khuyết tật sinh đẻ lớn Tẩt cả phụ nữ phải đọc phần về khuyết
tật sinh đẻ trong "Điều gì là thông tin quan trọng nhẩt tôi phâi biết về Tracleer?". Các
khuyết tật sinh đè nặng do Trạcleer xảy đến sớm trong thời kỳ mang thai, Do đó, bạn
không được có thai trong khi dùng Tracleer.
c xét nghiệm máu của bạn cho thẩy có thế có tổn thương gan.
0 bạn đang dùng cyclosporin-A (được dùng ttị bệnh vảy nến vả viêm khớp dạng thẳp, vả
để dự phòng sự loại bỏ ghép tim hoặc thận) hoặc glyburid (dùng trị đái tháo đường).
» bạn bị dị ứng với bẫt cứ thảnh phần nảo trOng Traclccr. Thảnh phần có hoạt tính lả
bosentan. Hòi bác sĩ hoặc dược sĩ cùa bạn nêu bạn cân biết các thảnh phân không có hoạt
tính.
Nỏi cho bác sĩ của bạn biễt nếu bạn có các vẩn đề về gan vù~a hoặc nặng Tracieer có thế
không thích hợp đối với bạn
Nói với bác sĩ cùa bạn về tẩt cả cảc thuốc mà bạn dùng. Cảo thuốc đó có thể ảnh hưởng đến
tác dụng của Tracleer, hoặc Traclcer có thể ảnh hướng đến tác dụng cùa cảc thuốc khảo. Hãy
nói với bảc sĩ của bạn nếu bạn đùng:
o ketoconazo], fluconazol, itraconazol hoặc voriconazol (dùng trị nhiễm nấm).
o sự kiếm soát sinh đẻ đụ~a trên hormon, như viến, viên đạn, miếng băng đính, vả viến cắy_
o cyclosporin A (dùng trị bệnh vảy nến vả viêm khớp dạng thấp, vả để dự phòng sự loại bỏ
ghẻp tim hoặc thận).
tacrolimus (dùng để dự phòng sự loại bỏ ghép gan hoặc thận)
rifampicin (dùng trị bệnh lao)
giyburid (dùng trị dải tháo đường)
thuốc giảm cholesterol
warfarin (dùng để đụ~ phòng cục đông máu)
ritonavir (dùng để điều trị HIV)
Tôi phải dùng Traclccr như mé nảo?
Tracleer sẽ được gửi qua bưu điện cho bạn bới một hiệu thuộc trung tâm. Bác sĩ của bạn sẽ
cung cắp cho bạn các chi tiết đầy đủ:
» Trong phần lớn trường hợp, bạn sẽ dùng 1 viên nén vảo buồi sảng vả 1 viẽn vảo buồi
chiếu.
- Bạn có thể dùng thuốc cth g với hoặc không cùng với thưc ăn.
0 Bảo sĩ của bạn sẽ nới với bạn cách dùng thuốc như thế nảo.
0 Sẽ dễ nhớ dùng Tracleer hon nếu bạn dùng thuốc vâo cùng thớỉ gian mỗi buối sảng vả
buồi chìếu. Nếu bạn có trí nhớ kém, hãy yêu cầu một người trong gìa đinh nhắc bạn, hoặc
dề lời ghi viết ở chỗ mà bạn sẽ chẳc chắn trông thẳy.
0 Nếu bạn dùng nhiếu hơn liếu kê đớn cùa Traclcer, hãy bảo cho bảo sĩ của bạn ngay lập
tú~.c
~ Nếu bạn bỏ quên một liều hăy dùng viên nén ngay khi bạn nhớ ra Tuy vặy, không dùng
2 liếu gộp lại để bù cho một liếu bò quên. Dùng viên tiếp sau vảo thòi gian như thuờng
lệ
0 Không ngừng dùng Traclecr trừ phi bác sĩ cùa bạn nói với bạn lảm như vậy Sụ ngùng
điếu trị đột ngột có thề 1ảm cho cảc triệu chứng trở nên xắn hon Nếu bạn cân phải ngừng
dùng Tracleer, bảc sĩ cúa bạn có thế nói cho bạn biết phái giảm liếu trong mây ngảv
trước khi ngừ ng hoản toản.
Trong thời gian điếu trị, bác sĩ sẽ lảm xét nghiệm máu cùa bạn vế cảc dân hiện cùa tác dụng
không mong muôn đôi với gan vả hông câu.
Tôi phải tránh điều gì trong khi dùng Traclcer?
ơ Đừng có thai trong khi dùng Tracleer (xem phần khuyết tật sinh đế ở "Điếu gi iả thỏng tin
quan trọng nhất tôi phải biết về 'Fracleer' '). Nếu bạn khõng thẳy có một kỳ hảnh kinh, hây
bảo cho bác sĩ cùa bạn.
» Không được cho con hú trong khi dùng Tracleer. Người ta khỏng biết Tracleer có đi vảo
sữa` cùa bạn vả gây tôn hại cho trẻ nhỏ hay không.
o Không dùng sự kiếm soát sinh đẻ dựa trên hormon (viên, viên đạn, mảnh băng dính,
viên cây) là phương pháp duy nhất kiểm soát sinh đẻ. Các thuốc nảy có thể không có
tảc dụng khi dùng vởi Tracleer. Hãy hòi bảo sĩ của bạn về các sự lựa chỌn kiếm soát sinh
đẻ có hiệu quả.
0 Không dùng cyclosporin-A. Thuốc nảy có thế Iảm cho có quả nhiếu Tracleer trong mảu
bạn và lảm tăng nguy cơtổn hại gan.
o Không dùng giyburid. Thuốc nảy có thế lảm Lăng nguy cơ tổn hại gan.
Z
Các tác dụng không mong muốn của Tracleer có thể xãy đểu là gì? ,Ị/
Tracleer có thể có những tác dụng không mong muốn nghiêm trọng:
0 Tổn hại gan: Tracleer có thể gây tốn hại gan nếu không được phát hiện sởm. Vì tảc dụng
không mong muốn nảy có thể không gây cảc triệu chứng lúc đầu, chỉ một xét nghiệm mảu
có thể cho thấy bạn có tồn hại gan sớm Các xét nghiệm máu đếu đặn cho phép bác sĩ cùa
bạn thay đổi hoặc ngừng việc điếu trị cùa bạn trước khi có sự tồn hại lâu dải. Do đó điều
rất quan trọng 1ả bạn có một xét nghiệm mảu về chức năng gan trước khi bắt đầu điếu trị
và sau dó môi tháng một lần.
Bảo ngay lập tức cho bác sĩ cùa bạn nếu bạn có triệu chứng nảo trong cảc triệu chứng của
các vân để vẽ gan nảy: buồn nôn, nôn, sốt, mệt mòì bất thường, đau bụng (vùng dạ dảy),
hoặc vảng da hoặc vảng tròng trắng mắt (chứng vâng da).
0 Các khuyết tật sinh đẻ lởn. Tẩt cả phụ nữ phải đọc phần khuyết tật sinh đẻ trong "Điểu
gì là thông tin quan trọng nhất tôi phải biết vê Tracleer ?".
0 Số đếm tinh trùng thẩp. Cảo thuốc như Tracleer Iảm giảm số đếm tinh trùng ở động vật.
Nếu điều nảy xảy đến ở người nam giới dùng Tracleer, họ có thể mất khả năng sinh con.
Cảc tác dụng không mong muốn khác có thể xảy ra
Các tác dụng khỏng mong muốn thường gặp nhất của Tracleer lả:
0 số lượng hồng cầu thấp (thiếu mảu)
o nhức đầu
viêm họng và kich thich đường qua mũi
đỏ bừng (cơn bốc nóng)
sưng mắt cá chân vả chân
huyết ảp thấp
tiếng đập Lim không đều
rối ioạn dạ dảy
mệt mỏi
ban
ngứa
Lời khu ên chung về cảc thuốc kê đơn
Các thuôc đôi khi được kê đơn cho cảc mục đích khảo ngoải các mục đich được ghi trong Bản
chỉ dẫn sử dụng thuốc. Nếu bạn có sự quan tâm hoặc câu hòi nảo về Tracleer, hãy hỏi bảo sĩ
cùa bạn hoặc người cung cấp dịch vụ chăm sóc sức khỏe nảo khảo. Bản chỉ dẫn sử dụng thuốc
nảy là một tóm tắt cùa một số thông tin quan trọng về Tracleer. Bảc sĩ cùa bạn có thể cho bạn \
thông tin về Tracleer được viết cho các cản bộ chuyên môn y tế. Không dùng Tracleer cho
một bệnh mà thuốc nảy không được kê đơn. Không được chia Tracleer cho người khác dùng.
Bản chỉ dẫn sử dụng thuốc nảy đã được phê chuẩn bởi Cơ quan Quản lý Thuốc và Thực phẩm /
Hoa kỳ.
Ngảy 15 tháng 2 năm 2007.
© 2007 Actelion Pharmaceuticals US, Inc.
15
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng