










\ ……
Anelion Phamxeuticals le I.Pmot lBJO.MII OW
' ' ' MaL-Nm 03020245 2. ant 0302.2012 OW
› Typopharma: 94451 3. Proof: 08.022012 OW
’. Product: outer canon 4. Proof. l l.04.2012 mz
? Tracleer I2Smg. vu s. Proof: 12.04.2012 …:
Dimension: 46.5 x 46.5 x 00 mm 6. Pmof: zomzmz OW
Code: ~ 7.Proofz 11.06201385
smallest Fonlsize: a pt &. Pmof: 12.062013 BS
Colours: Pantone C 199. 389, 7463. Biack 9. Proof: 30.07.2013 BS
ỂIIIMI D….
ỤIEW nmwmd'9" ũ
.. .. ..
….
nu uun .
—comnion ii—quưLđ
P199C . P389C
BỌ Y TE
(ÌLjf` QIỈA. ìùèfflC . v…..…
7 ” rr*` “`?"1 *"n
-. .ẵ 1 =.—:zu L'L ẾỈUT
’ ĨzJẵ~ <Ể.’;1:.Ẻhổ.Ảẳa…alJiẵ….…
NOIÌĐỦ
Rx. Thuở: bản thun dm.
Hộp 1 lọ 60 viên nén ban phim 125 mg.
Báo quán dưới 30°C.
Chí đinh. cảch dùng. chõng dií d_nhz
xin dọc imng tờ hưởng dẩn sử dựig.
SĐK:
Niă sán xuất:
Sản xuất nhưưng quyền oùa
Actelion Pharmaoeuũcals Ltd
bới Pztheon Inc…
Mamlactured under lhs Iioenoe or
Adeiion Pharmacwuưels Lm
by Patheon Inc
2100 Symex Coun
iusnum’
125 mg
Store below ao'c
Please feier endosed Iealiet im
dosaga and admmislraiion
mui…
Mississauga Onlario
C Canada L5N 7K9
DNNK: Ẹ34ng ly có phăn Dược Fiệu
2.
24 Nguyẽn Thị Nghỉa, Quận 1.
TP Ho Chi Minh.
Các thòng I`m khác ơồ n hị xem lrmg
tờ hưởng dần sử dụng k … theo
0 ncreuou
eo 1IIn-cotled tlblots
Each iahlet contains bosentan mono-
hydme equivalent to bosemzn 125 mg
/
OIX'IDTỦ
7 640111 930624
06 xa lầm lay trẻ em.
Đọc kỹ hưởng din sử dụng trưức khi
dùng.
ểĨỀTELION
60 lilrn-couted lablels
Each tablel contains bosentan mono-
hydrale oquivdem iu bosmtm 125 mg
vÀx PiiỌxc
mi mm: _
… TP. H.i xọi
Client:
Mat.—No.z
Typopharma:
Product:
Dimension:
smallest Fontsize:
Colours:
IZ
Lo
aè
:.ịm im
cf-J\ fJ.«_iiid xy
Actelion Pharmaceutìcals Ltd
06020040
94454
Iabel
Tracleer 125mg, VN
76,2 x 31,75 mm
4,5 pt
Pantone 199 C, 389 C, 7463 C, Black
I
. P389C
1. Proof:
2. Proof:
3. Proof:
4. Proof:
5. Proof:
6. Proof:
13.10.2011 OW
11.04.2012 ml
12.04.2012 mz
1 1,06.2013 85
12.06.2013 BS
30.07.2013 BS
./
" )
\… pharma
I ……
I Black
uuuuuuuuuuuuuuuuuuuu luunlnllliclluinlllltnolnulnlclcnlnnnnnlnnnnlnlulnlnnlnlnlnllllcanullnlnollnltllnllolloln
ff."
El
Freigabe/release
Erneute Korrektur notwendig | ._
additional correction required
www.typopharma.com
I I VarnishFree
. \
v 60 liln—wnml hbch Manulanumd under ihe ẹ
^3\ Each table! nomzins bnsentan Iicance oi Actelion 0
O mnnnhydram nquivaleni … Pharmacmmcah Lid by
i ẵẵ "°"m" "5 '“ ẵfốổ'ề'3'iễễẵ'cnun
' Uma! Dnlue: San anarhad . . .
~G I MI prescnbảng |niotmation. ÉỄị'ẵẵ'ổỉẵ'ầ’wo
'ồY Sluro hean JI'C
’\
Sô lô SXIBalch HUSENĨAN 1 25
NWMig: mg (ỉ\
…… .… eo tablets '~² ncreuou
_ \ / _
Datum | date: Unterschrift/Signature:
A perfect piơce for your data
TRACLEER®
(bosentan)
Viên nén bao phim 62 ,Smg vả 125mg
Rx. Thuốc nảy chỉ dùng theo đơn của bác sĩ.
MÔ TẢ
Bosentan lả thuôc đầu tiên cùa một nhóm thuốc mới, một thuốc đối khảng với thụ thể cùa
endothelin.
TRACLEER® (bosentan) thuộc về một nhỏm dẫn xuất pyrimidin thay thế ở mức độ cao. Nó
có tên hóa học là 4-tert-buty1-N-[6—(2—hydroxy-ethoxy)-S-(2Ĩmethoxy-phenoxy)—[2,2']—
bipyrimidin-4-yil-benzensulfonamid monohydrat vả có công thức câu tạo sau đây:
°w°
\N
…. ,.hỦ
Bosentan có trọng lượng phân từ 569, 64 và công thức phân từ CzszọNsOósOHzo. Bosentan
là một bột tù trắng đến vảng nhạt. Nó ít tan trong nước (1,0mg/IOOmI) và trong dung dịch
nước ở pH thấp (0,1mg/IOOmI ớ pH 1,1 vả 4,0; 0,2mg/IOOmI ở pH 5 ,0.) Độ hòa tan tăng lên ở ,
các độ pH cao hơn (43mg/IOOmI ở pH 7 ,.5) Ở trạng thải rãn, bosentan rất ồn định, không hút LKQ
ẩm vả không nhạy cảm vởi ánh sảng //—
TRACLEER® có dưới dạng viên nén bao phim 62,5mg vả 125mg dùng uống vả chứa các tả
dược sau đây: tinh bột ngô, tinh bột tiền gelatin-hóa, natri tinh bột glycolat, povidon, glyceryl
behenat, magnesi stearat, hydroxypropyimethylcellulose, triacetin, talc, titani dioxyd, vảng
oxyd sắt, đô oxyd sắt, và ethylcelluiose. Mỗi viên nén TRACLEER" 62,5mg chứa 64,541mg
bosentan, tương đương vởi 62,5mg bosentan khan. Mỗi viên nén TRACLEERu 125mg chứa
129,082mg bosentan, tương dương với 125mg bosentan khan.
CHỈ ĐỊNH
TRACLEER® được chỉ định để điều trị tăng huyết ảp động mạch phối (Nhóm [ Tô chức y tế
thế giới) ở bệnh nhân có cảc triệu chứng nhóm … hoặc IV Tổ chức y tế thế giới, để cải thiện
khả nãng luyện tập và lảm giảm tỷ lệ trường hợp xấu đi về lâm sảng (xem Nghiên cứu lâm
sảng).
CHỘNG CHỈ ĐỊNH
Thuốc được CẢNH BÁO CHỐNG CHỈ ĐỊNH đối với thai kỳ.
Loại X về thai nghén. TRACLEER® có thể gây độc hại cho thai nếu dùng cho phụ nữ mang
thai. Bosentan có tảc dụng gậy quải thai ở chuột cống trắng được cho uông liều >
60mg/kg/ngảy (gấp 2 lần liều uông tối đa khuyến cáo cho ngưòi 125mg, 2 Iần/ngây, trên cơ
sò mg/m ). Trong một nghiên cúu về độc tính phôi— —thai trên chuột công trăng, bosentan thế
hiện tác dụng gây quái thai phụ thuộc vảo liều, bao gồm dị dạng ở đầu, mặt, miệng và mạch
máu lón Bosentan lảm tăng từ sản vả tỷ lệ tử vong của chuột con ớ cảc liều uông 60 vả
/f/`i\ Pi…xtjỈ' _-
~` i›.ui:ưi.~ ,
Ễ`1\ỉ '!“i'. … Ntì;ỵjặ
\ .
mg/m2 ). Mặc dù các khuyết tật khi sinh không thấy có ờ thò được cho uống ìiềư tói
ISOOngkg/ngảy, nồng độ huyết tương của bosentan ở thớ thắp hon nồng độ đạt đưọc ở chuột
công trăng Sự giông nhau cùa cảc dị dạng gây bói bosentan và dị dạng nhận xét thấy ở động
vật điểu trị vói các thuốc dối kháng vởi thụ thể cùa endothelin khác cho thắy tính chắt gây
quải thai là một tảo dụng cùa nhóm thuốc nây Không có dữ liệu về sử dụng TRACLEERJộ
phụ nữ có thai.
Phải loại trù thai nghén irưóc khi bắt dầu đìều trị vởi FRACLEFJREL và sau đó dự phòng bằng
biện pháp trảnh thụ thai chẳc chẳn. Đã chủng minh cảc thuốc trảnh thụ thai hormon, bao gôm
các thuốc trảnh thụ thai uống, tiêm, qua chân bì, cấy dưới da không chẳc chắn khi dùng
TRACLEER® vả khỏng thể dùng lảm phuong phảp ngùa thai duy nhất ở bệnh nhân dùng
TRACLEER® (xem Tương tác thuốc: Thuốc tránh thụ thai hormon, bao gồm thuốc
trảnh thai uổng, tiêm, qua chân bì vả cẩy dưới da} Khi cần thiết, tìm kiếm sự huớng dẫn
từ một bảc sĩ phụ khoa hoặc chuyên gia tương tự về biện pháp tránh thai thích hợp.
Chỉ bắt đầu dùng TRACLEER'“ ở bệnh nhân dược biết iả không có thai. Dối với bệnh nhân
nũ có khả năng mang thai người kế đơn không nên kê TRACLEERLỦ trừ phi bệnh nhân cam
đoan với người kê đơn là không có hoạt động sinh dục hoặc cung cắp kết quả âm tính từ một
xét nghiệm thai nghén nước tiêu hoặc huyết thanh trong 5 ngảy đâu của rnột chu kỳ kinh
nguyệt bình thường vả ít nhất 1] ngảy sau lần giao họp không đuợc bảo vệ cuối cùng
Các xét nghiệm thai nghén nuớc tiếu hoặc hưyết thanh tiếp theo phải đuợc thực hiện hảng
tháng ở phụ nữ có khả năng mang thai dùng TRACLEER® Phải khuyên bệnh nhân nếu thầy
chậm có kinh nguyệt hoặc bất kỳ lý do nâo khảo để nghi ngờ có thai thì phải báo ngay cho bác
sĩ để lảm xét nghiệm về thai nghén. Nếu xét nghiệm thai nghén dương tỉnh, bác sĩ vả bệnh
nhân phải thảo luận vê nguy cơ đối vói thai nghén và đối với thai
Cyclosporỉn A: Việc dùng đồng thời cyclosporin A và bosentan dẫn đến sự tăng rõ rệt nồng
dộ huyễt tương của bosentan Do đó, việc sủ dụng đồng thời TRACLFER vả cyclosporin A
bị chống chỉ định.
Glyburid: Đã nhận xét thẳy nguy cơ cao hơn cùa sụ tăng các enzym gan ở bệnh nhân dùng
giybnrid đồng thời vởi bosentan. Do dó, việc dùng dồng thời glyburid vả TRACLEERtị bị
chống chỉ định.
Mẫn câm: TRACLEER® cũng bị chống chỉ định ở bệnh nhân mẫn cảm với bosentan hoặc
bất cứ thảnh phần nảo cùa thuốc.
LIÊU LƯỢNG VÀ CÁCH DÙNG
Chung
Phải bắt đầu diễu trị với TRACLEER® vởì liều 62 ,5mg, 2 lần/ngảv trong 4 tuần vả sau đó
tăng lên tởi liều duy tri l25mg ,2 ]ần/ngảy Các liều trên I2Smg, 2 lầnt'ngảy có vẻ như không
đem lại thêm lợi ích đủ để bù lại sụ tăng nguy co tốn thương gan.
Phải uống viên nén vảo buối sảng vả buồi chìều cùng với hoặc không cùng vởi thức ăn.
Điều chỉnh iiểu iu~ợng và theo dõi ở bệnh nhân phát triền sự không bình thường về
aminotransferase
Mức ALT/AST Các khuyến cáo về điêu trị và theo dõi.
> 3 vả g 5 x ULN Xác nhận băng một xét nghiệm aminotransferase khảo;
nêu được xảc nhận, giám liêu hảng ngảy hoặc ngừng
điêu trị, vả theo dõi múc aminotransferase ít nhât cứ 2
tuân một lần. Nều mức aminotransferaẵeỂrờ về trị số
trước đìêu trị, hãy tiêp tục hoặc áp dụng trị liệu thích
hợp (xem ở dưới).
> 5 vả S 8 x ULN Xảc nhận bằng một xét nghỉệm aminotransferase khảc;
nếu được xác nhận, ngừng điều trị vả theo dõi cảc mức
aminotransferase ít nhất cứ 2 tuần ! lẳn. Một khi các
mửc aminotransferase trở về trị số trưởc điều trị, xem
xét việc đỉều trị trở lại (xem ở dưới).
> 8 x ULN Phải ngừng điều trị và không xem xét việc điều trị trở
lại vói TRACLEERỀ Không có kinh nghiệm về việc
điều trị trở lại vói TRACLEER® trong cảc trường hợp
nảy.
Nếu dùng TRACLEER® trở lại thi phái dùng ở liều bắt đầu; kiềm tra cảc mức
aminotransferase trong vòng 3 ngảy và sau đó theo các khuyên cảo Ở trên.
Nếu sự tăng aminotransferase gan có kèm theo cảc triệu chứng lâm sảng cùa tồn thương gan
(như buồn nôn, nôn, sốt, đau bụng, vảng da, hoặc ngủ lịm không thông thường hoặc mệt mòi,
hoặc sự tăng bilirubin E 2 x ULN) phải ngứng điều trị. Không có kinh nghiệm về vìệc sử
dụng trở lại TRACLEERu trong cảc trường hợp nảy.
Sử dụng ở phụ nữ có khá nãng mang thai
Chi bắt dẳu việc diều trị với TRACLEER® ở phụ nữ có khả năng mang thai sau một xét
nghiệm thai nghén âm tính và chỉ ở phụ nữ ảp dụng `sụ tránh thụ thai dẩy đu khỏng chỉ dụa
duy nhắt trên cảc thuốc trảnh thụ thai hormon bao gồm các thuốc trảnh thụ thai uỏng, tiêm,
qua chân bì hoặc cấy dưới da (_xem TƯỚNG TÁC THUỐC: Thuốc tránh thụ thai hormon,
bao gồm thuốc trảnh thụ thai uống, tiêm, qua chân bi và cẩy dưới da) Tim kiếm tải liệu
từ một bác sĩ phụ khoa hoặc một chuyên gia tương tự về sự trảnh thụ thai đầy đủ khi cẳn. Phải
nhận được các xét nghiệm thai nghén nước tiêu hoặc huyết thanh hảng tháng ở phụ nữ có khả
năng mang thai dùng TRACLEERQ
Điều chỉnh liều lượng ở bệnh nhãn suy thận
Suy thặn ỉt ảnh huởng trên duợc động học cùa bosentan và không cần phải diều chinh liều
]uọng.
Điều chỉnh liều lượng ở bệnh nhân cao tuổi
Cảo nghiên cúu lâm sảng về TRACLEER`ltj không gồm số iượng đủ đối tuợng tù 65 tuôi trở
lên để xảo định xem họ có đáp úng khác vởi đối tượng trẻ hơn hay không Kinh nghiệm lâm
sảng đã không xảc định sự khác nhau trong đảp ứng giữa bệnh nhân cao tuổi vả trẻ tuôỉ Nói
chung phải thận trọng việc lụa chọn liều đối với bệnh nhân cao tuổi, xét đến tần số cao của
giảm năng gan, thặn hoặc tim, và của bệnh mắc đồng thòi hoặc việc diều trị vói cảc thuốc
khảc trong nhóm tuồi nảy.
Điều chinh liều lượng ở bệnh nhân suy gan
Vì có bầng chứng in vitro vả ín vivo lả đường thái trừ chính cùa bosentan [ả đường mật, suy
gan có thế Iảm tăng sự phơi nhiễm (Nồng độ tối đa, Cmax; vả Diện tích dưới đường cong,
AUC) cùa bosentan.
Đã chứng minh suy gan nhẹ không ảnh hưóng nhiếu đến dược động học cùa bosentan. Đã
không đảnh giả ảnh huờng của suy gan vùa hoặc nặng đến dược động học cùa
TRACLEERỂ Không có dữ liệu riêng biệt để hướng dẫn việc xảc định liều lượng cho bệnh
Ửg
nhân suy gan (xem CẢNH BÁO); phải thận trọng đối với bệnh nhân suy gan nhẹ. Phải trảnh
dùng TRACLEER® nói chung cho bệnh nhân có suy gan vừa hoặc nặng.
Đỉều chỉnh liều lượng ở trẻ em
Đã không xác định độ an toản vả hiệu lực ở bệnh nhân trẻ em.
Điều chinh liều lượng ở bệnh nhân có thể trọng thẩp
Ở bệnh nhân có thể trọng dưới 40kg nhưng trên 12 tuổi, liều bắt dầu và liều duy tri đu~ọc
khuyến cảo là 62 ,5mg, 2 lần mỗi ngảy.
Ngừng điều trị
Có it kinh nghiệm về ngừng đột ngột TRACLEERẾ Không thấy có bằng chứng về sụ hồi
i’mg cấp tính. Tuy vậy, để trảnh khả nãng xắu đi về lâm sảng, phải xem xẻt việc giảm dần iiều
(62, Smg, 2 iần/ngảy trong 3 đến 7 ngảy).
CẢNH BÁO
Khả năng tổn thương gan
Dã nhận xét thắy sự tăng ALT hoặc AST gấp hơn 3 x ULN ở 11% bệnh nhân điều trị với
bosentan (N= 658) so với 2% bệnh nhân điều trị với placebo (N= 280). Đã thắy sự tăng gấp
3 lần ở 12° o cùa 95 bệnh nhân có tãng huyết ảp động mạch phối (PAH) đùng liều 125mg,2
iằn/ngảy, vả 14% cùa 70 bệnh nhân PAH dùng liều 250mg, 2 iần/ngảy. Đã nhận xét thấy sự
tăng gâp 8 lần ở 2% bệnh nhân PAH dùng liều l25mg, 2 lần/ngảy, vả ò 7% bệnh nhân PAH
dùng liều 250mg, 2 lầni'ngảy. Sự tăng bìlirubin tởi > 3 x ULN (giởi hạn trên cùa bỉnh thường)
kết hợp với tăng aminotransferase ở 2 trong 658 [0, 3%) bệnh nhân đìều trị với bosentan.
Sụ phối hợp cùa tồn thưong tế bảo gan (tăng aminotransferase tới > 3 x ULN) vả tănlg
bilirubin toản phần (> 3 x ULN) là một dấu hiệu của khả nãng tồn thương gan nghiêm trọng.
Sự tăng AST vả/hoặc ALT kết hợp với bosentan phụ thuộc vảo iiểu, xảy ra cả ở thòi kỳ đầu
vả thời kỳ cuối điều trị, thuờng tiến trỉền chậm, không triệu chứng đìến hỉnh, và thường phục
hồi sau sự gián đoạn hoặc ngừng điều trị. Sự tăng aminotransferase cũng có thể phục hồi một
cảch tự nhiên trong khi tiếp tục điều trị vởi TRACLEERỂ
Phải đo các mức aminotransferase gan trước khi bắt dầu điều trị và sau đó hâng tháng. Nếu
thấy tăng aminotransfcrase, thì phải bắt đầu thay đồi sự theo dõi và đỉều trị (xem LIÊU
LƯỢNG VÀ CÁCH DÙNG) Nếu sự tảng aminotransferase gan kèm theo các triệu chúng
lâm sảng về tổn thương gan (như bưồn nôn, nôn, Sốt, đau bụng, vảng da, hoặc ngủ iịm bất
thường hoặc mệt nhọc) hoặc tăng bỉlirubin > 2 x U LN thì phải ngùng diều trị. Khỏng có kinh
nghiệm về sử dụng lại TRACLEER trong các truờng hợp nảy.
Suy gan có từ Irước
Phải đo cảc mức aminotransferase gan truớc khi bắt đầu điều trị và sau đó hảng tháng Nói
chung, phải trảnh dùng TRACLEER® ở bệnh nhân có suy gan vùa hoặc nặng (xem Duợc lý
lâm sảng vả LIẺU LƯỢNG VÀ CÁCH DÙNG). Ngoài ra. nói chung tránh dùng
TRACLEER® ở bệnh nhân có aminotransferase cao (> 3 x ULN) vì sự theo dõi tồn thưong
gan ở các bệnh nhân nảy có thế khó hơ.n
THẬN TRỌNG
Thay đối huyết học
Việc điều trị với TRACLEER® gây sự giảm liên quan với liều về hemoglobin vả hematocrìt
(tỳ iệ thể tích huyết cầu). Theo dõi nồng độ hemoglobin sau ] và 3 tháng đìều trị vả sau đó cứ
3 tháng 1 lần. Sự giảm toản bộ trung bình về nồng độ hemoglobin đối với bệnh nhân điều trị
vởi bosentan lả 0,9g/dl (thay đổi tởi khi kết thúc điều trị). Phần lớn sự giảm nồng độ
hemoglobin nảy được phảt hiện trong một số ít tuần đầu tiên điếu trị với bosentan vả nồng độ
hemogiobin ồn định ở cảc tuần diếu trị 4 - 12 vói bosentan. TrOng các nghiên cứu có đối
chửng vởi placebo với tất cả cảc cảch dùng bosentan, đã nhận xét thẳy sự giảm hemoglobin rõ
rệt (giảm > 15% so với mức ban đầu dẫn đến cảc trị số < llg/dl) ở 6% bệnh nhân điều trị vói
bosentan vả 3% bệnh hhản đìều trị với placcbo. Ở bệnh nhân có tăng huyết ảp động mạch
phôi điêu trị với cảc liêu 125 vả 250mg, 2 lầnỉngảy, dã nhận xét thắy sự giảm hemoglobin rõ
rệt ở 3% bệnh nhân so với 1% ở bệnh nhân điêu trị với piacebo.
Đã nhặn xét thắy sự giảm nồng độ hemoglobìn ít nhảt_ lg/dl ở 57% bệnh nhân diều trị với
bosentan so với ờ 29% bệnh nhân điêu trị vởi piaccbo. 0 80% cảc bệnh nhân mà hemoglobin
gíảm ỉt nhât ] g/dl, sự giám xảy ra trong 6 tuân đâu điêu trị với bosentan
irong tiến trinh điều trị, nồng dộ hemoglobin vẫn ở trong phạm vi các giói hạn bình thường 0
68% bệnh nhân điếu trị với bosentan so với ở 76% bệnh nhãn điều trị với placebo. Không có
sự giải thich về thay đồi nổng độ hemoglobin, nhung dó không có vẻ là do xuất huyết hoặc
tan huyết.
Nên kiếm tra nồng độ hemoglobin sau 1 tháng và 3 thảng vả sau đó cứ 3 thảng 1 lần. Nếu sự
giảm rõ rệt nông độ hemoglobin xảy ra, cân đánh giá thêm đê xác định nguyên nhân và như
câu vê trị lìệu đặc hiệu.
Giữ dịch
Trong một thủ nghiệm có đối chúng với placebo trên bệnh nhân có suy tim mạn tính nặng, có
sự tảng tỳ iệ trường hợp điếu trị tại bệnh viện vê suy tim mạn tinh kết họp vói tăng thể trọng
vả tảng phù chân trong 4- 8 tuần đầu tiên điếu trị với TRACLEER Ngoài ra, có nhiều báo
cáo sau bản thuốc vê giữ dịch ớ bệnh nhân có tăng huyết ảp phối xảy ra trong vòng mấy tuần
sau khi bắt đầu dùng TRACLEER® Bệnh nhân cân được điều trị vói một thuốc lợi tiếu, su
quản lý dịch, hoặc điều trị tại bệnh viện về suy tim mất bù (xem NGHIÊN CỨU LÂM
SÀNG; Suy tỉm sung huyết).
Bệnh tắc rĩnh mạch phôi“ (P VỌD)
Nếu các dẳu hiệu của phủ phổi xảy ra khi dùng TRACLEER® cần xem xét khả nãng có bệnh
tắc tĩnh mạch phổi kết hợp và phải ngừng dùng TRACLEER'“.
Thông tin đối với bệnh nhân
Khuyên bệnh nhân nên tham khảo Bản chỉ dẫn sử dụng thuốc TRACLEER" về cảch sư dụng
an toản TRACLEER®.
Bác sĩ phải thảo Iuận với bệnh nhân về tằm quan trọng của việc theo đõi hảng tháng
aminotransferase huyết thanh vả xét nghiệm thai nghén nước tiếu hoặc huyết thanh và cúa
việc tránh thụ thai Bác sĩ phải thảo Iuận vởi bệnh nhân nữ về iựa chọn sự trảnh thụ thai có
hiệu quả và cảc biện phảp đề phòng ngừa thai nghén. Khi cần thiết, tim kiếm sự chỉ dẫn tù
một bác sĩ phụ khoa hoặc chuyên gia tưong tự vẽ biện phảp tránh thai thích hợp.
TƯỚNG TÁC THUỐC
Bosentan được chuyến hóa bời cảc enzym CYP2C9 vả CYP3A4. Sự ức chế các enzym nảy có
thế Iảm tăng nồng độ huyết tướng của bosentan (xem ketoconazol). Việc dùng đồng thời cả
chất úc chế CYP2C9 (như fiuconazo] hoặc amiodaron) vả chẳt ức chế CYP3A4 (như
ketoconazol, itraconazoi, hoặc ritonavir) với bosentan có thể dẫn đến sự tảng cao nồng độ
huyết tương cùa bosentan. Không dùng đồng thời sự phối hợp cúa một thuốc ức chế mạnh
CYP2C9 và một thuốc ức chế CYP3A4 như vậy với TRACLEERỂ
Bosentan là một chất gây cảm ứng CYP3A4 vả CYP2C9. Vì vậy, nồng độ huyết tương cùa
các thuốc được chuyển hóa bời hai enzym nảy sẽ giảm khi dùng cùng với TRACLEERỦ
Bosentan không có tác dụng ức chế có liên quan trên bất cứ isozym CYP nảo in vitro
(CYPIA2, CYP2C9, CYP2CI9, CYP2D6, CYP3A4). Vì vậy TRACLEER® không Iảm tảng
nông độ huyết tương cùa cảc thuốc được chuyến hóa bòi cảc enzym nảy.
Các thuốc tránh thụ thai hormon, bao gồm thuốc trảnh thụ thai uống, tiêm, qua chân bì,
và cấy dưới da: Một nghiên cúu về tương tảo đã chứng minh răng việc dùng đồng thời
bosentan và thuốc trảnh thụ thai hormon uông Ortho-Novum gây sự giảm trung bình nồng
độ norethindron vả ethinyl estradiol 14% và 31%, tuong ứng. Tuy vậy, mức giảm phơi nhiễm
lả 56% và 66%, tương úng, ở các đối tuợng cả nhân. Vì vậy, cảc thuốc trảnh thụ thai hormon,
bao gồm cảc dạng thuốc uông, tiêm, qua chân bi và cấy dưới da, có thế không chắc chắn khi
dùng cùng với TRACLEER“. Phụ nữ cân áp dụng các phương pháp tránh thụ thai phụ thêm
vả không chỉ dựa vảo sự tránh thụ thai hormon đon độc khi dùng TRACLEER'.
Các nghiên cứu tương tảo dặc hiệu đã chứng minh như sau:
Cyclosporin A: Trong ngảy đầu dùng đồng thời, nồng độ đáy cùa bosentan tăng gấp khoảng
30 lần. Nồng độ huyết tưong cùa bosentan ở trạng thải ổn định cao hơn gấp 3- 4 lân so với
khi không có cyclosporin A. Chống chỉ định dùng đồng thời bosentan vả cyclosporin A (xem
CHỐNG CHỈ ĐỊNH). Việc dùng đồng thời bosentan lảm giảm nồng độ huyết tưong cùa
cyclosporin A (một cơ chất cùa CYP3A4), khoảng 50%.
Tacrolimus: Việc dùng đồng thời taorolỉmus vả bosentan đã không được nghiên cứu trên
người. Việc dùng đồng thời tacroiimus vả bosentan trên động vật dẫn dến tăng rõ rệt nồng độ
huyết tương cùa bosentan Cần phải thận trọng nếu dùng đồng thời tacrolimus vả bosentan.
Glyburid: Đã nhận xét thấy sụ tăng nguy cơ của tãng aminotransferase gan ò bệnh nhân dùng
đồng thời với glyburid. Do đó, vỉệc dùng đồng thời TRACLEER'Il vả glyburid bị chống chỉ
định, và phải xem xét dùng cảc thuốc hạ đường huyết khảo (xem CHỐNG CHỈ ĐỊNH).
Việc dùng đồng thời bosentan lảm giảm nồng dộ huyết tương cùa glyburid khoảng 40%.
Nồng độ huyết tương cùa bosentan cũng giảm khoảng 30%. Bosentan cũng lâm giảm nông độ
huyết tương của cảc thuốc hạ đường huyết uông khảo được chuyền hóa chủ yếu bòi CYP2C9
hoặc CYP3A4 Cần phải xem xét khả năng xâu đi cùa sự kiếm soát đuờng huyết ở bệnh nhân
dùng các thuốc nảy.
Ketoconazol: Việc dùng đồng thời bosentan I125mg, 2 lần/ngảy, vả ketoconazol, một thuốc
ức chế mạnh CYP3A4, lảm tăng nông độ huyêt tương của bosentan gâp khoảng 2 lân. Không
cân phải điêu chinh liêu bosentan, nhưng phải xem xét sự tăng tảo dụng cùa bosentan.
Simvastatin và các statin khảo: Việc dùng đồng thời bosentan Iảm giảm nồng độ huyết
tương cùa simvastatin (một cơ chất cùa CYP3A4), và chất chuyến hóa có hoạt tính [3- hydroxy
acid, khoảng 50% Nồng độ huyết tương cùa bosentan không bị ảnh hưòng. Bosentan cũng
lảm giảm nông độ huyết tương của cảc statìn khác được chuyến hóa một cách có ý nghĩa bòi
CYP3A4, như lovastatin vả atorvastatin. Cần phải xem xét khả nãng giảm hiệu lực của statìn.
Đối với bệnh nhân dùng statin chuyền hóa bời CYP3A4, cần phải theo dõi nồng dộ
choiesterol huyết sau khi bắt đầu dùng TRACLEERỞ để xem có cần phải điều chỉnh liều
statin hay không.
Wagfarin: Việc dùng đồng thời bosentan 500mg, 2 lần/ngảy trong 6 ngảy lảm giảm nồng độ
huyêt tương cùa cả S.warfarin (một cơ chât cùa CYP2C9) vả R.warfarin (một cơ ohât cùa
CYP3A4) với tỷ lệ 29% vả 38%, tương ứng. Kinh nghiệm lâm sảng với việc dùng đông thòi
bosentan vả warfarin ở bệnh nhân có tâng huyết áp động mạch phồi không cho thắy thay đồi
có lìến quan về lâm sảng ở INR h0ặc liều warfarỉn (mức ban đầu so vói khi kết thức nghiên
cứu), và sự cần thìết thay đối liều warfarin trong cảc thử nghiệm, do sư thay đổi về INR hoặc
do các tảc dụng không mong muốn, gỉống nhau giữa bệnh nhân đỉều trị với bosentan và bệnh
nhân diều trị với placebo.
Digoxin, Nimođipin vả Losartan: Bosentan không có tương tác dược động học có ý nghĩa
với digoxin vả nimodipin, vả losartan không có tảc dụng có ý nghĩa trên nông độ huyết tương
cùa bosentan.
Sildenafil: Ở đối tượng khóe mạnh, việc dùng đồng thòi nhỉếư liều bosentan ]2Smg, 2
lần/ngảy vả 80mg sildenafil, 3 lần/ngảy dẫn đển sự giảm nồng dộ huyết tương cùa siidenafìl
63% và sự tăng nông độ huyết tương của bosentan 50% Không cần phải đìều chỉnh liều của
thuốc nảo. Khuyến cảo nảy vân đúng khi dùng sildenaiìl để điều trị tăng huyết áp động mạch
phồi hoặc loạn chức năng cư.ơng
Iloprost: Trong một nghiên cứu nhò, ngẫu nhỉên hóa, mù kép, có đổi chứng với piacebo (thứ
nghìệm STEP), 34 bệnh nhân điều trị vói bosentan 125mg, 2 iầnỉngảy trong it nhắt 16 tuần đã
dung nạp việc dùng thếm ỉloprost hit (tởi 5 microg, 6- 9 lầningảy trong những giờ đi bộ)
Liều hít trung binh mỗi ngảy là 27 microg vả sô lần hít trung bình môi ngảy lả 5,6 lằn.
Rífampìcin: Việc dùng đồng thời bosentan vả rifampicìn ở người tinh nguyện binh thường
dẫn đến sự tăng trung binh gâp 6 lần nồng độ @ cùa bosentan sau iiều dùng đồng thòi đằu
tiên, nhung dẫn đến sự giảm khoảng 6_0% nồng độ bosentan ở trạng thái ỏn dịnh Chua đảnh
giá tảc dụng của bosentan trên nỏng độ cùa rifampicin Khi sự cân nhắc khả năng cúa lợi ích
vả nguy cơ đã bìết và chưa biết dẫn đến việc sử dụng đồng thời, phải đol FT s hảng tuần trong
4 tuần đầu tiên trước khi trở lại sự theo dõi bình thường.
Sự gây ung thư, sự gây đột biển, suy giảm khả năng sinh sản
Cho chuột nhắt trắng uỏng bosentan trộn với thức ăn trong hai năm gây tăng tỷ lệ truờng hợp
có u tuyến tế bảo gan vả ung thư biểu mô (carcinoma) ở chuột đục với liều thấp
450mg/kglngảy (gấp khoảng2 81ần lỉều tối đa khuyến cáo dùng cho người [MRHDI lả 125mg,
2 Iần/ngảy trên cơ sở mg/m2 ) lrong cùng nghiên cứu nảy, các liếu lớn hơn ZOOOmg/kglngảy
[`gấp khoảng 32 lần MRHD) đã kết hợp với sự tăng tỷ lệ truờng hợp có u tuyên ruột kểt 6 cả
chuột đực vả cải Ở chuột công trắng, việc cho uông bosentan trộn vảo thúc ăn trOng hai năm
đã kết hợp vởỉ sự tăng tỷ lệ trường hợp có u tế bảo hình sao ờ não chuột đục vởi Iiều thấp
SOOmgIkg/ngảy (gấp khoảng 16 lần MRHD) Trong một tập hợp các thủ nghiệm in vzrro hỗn
hợp (thử nghiệm gây đột biển vi sinh vật, thù nghiệm tồng họp ADN không theo chương
trinh thử nghiệm gây đột biến tế bảo động vật có vú V- 79, vả thử nghiệm tế bảo lympho
ngưòi) và một thử nghiệm nhân sinh sản chuột nhắt trắng in w'vo, đã không có bằng chứng về
bất cứ hoạt tỉnh gây đột biến nảo của bosentan.
Suy giảm khả năng sinh sản/Chức năng tinh hoản
Nhìều chẳt đối kháng vởi thụ thể cùa cndothelin có tảc dụng lớn trên mô học và chức năng
tinh hoản cùa động vật. Đã chửng minh cảc thuốc nảy gây teo cảc ống sinh tỉnh cùa tinh hoản
vả ]ảm giảm sô dếm tinh trùng và khả năng sinh sản cùa chuột cống trắng đục duợc cho dùng
trong hơn 10 tuần. Sự teo ông tinh hoản và sự gỉảm khả náng sinh sản cùa giống dục quan sát
thẳy với các thưốc đối khảng vói thụ thể cùa endothelỉn có vẻ không hồi phục
Trong các nghiên cứu về khả nảng sinh sản trong đó chuột cống trắng đực vả cái được điều trị
vởì bosentan vởi các iiều uống tới lSOOmg/kg/ngảy (gấp 50 lần MRHD trên cơ sở mg/m )
hoặc cảc liều tiêm tĩnh mạch tới 40mg/kg/ngảy, không thắy có tác dụng trên số đểm tinh
trùng, sự chuyến động cùa tinh trùng, sự thực hiện giao phối hoặc khả năng sinh sản. Đã nhận
xẻt thấy sự tăng tỷ lệ trường hợp có teo ống tính hoản ở chuột cống trắng được cho uống
bosentan với liếm thấp I2Smg/kgmgảy (gắp khoảng 4 lần MRHD và liều thấp nhẳt được thử
nghiệm) trong 2 năm nhưng không thắy với liều cao lSOOmgr’kg/ngảy (gấp khoảng 50 lằn
MRIID) trong 6 thảng. Chỉ đânh giá tảc dụng trên số đếm vả sự chuyến động của tinh trùng
trong cảc nghỉên cứu về khả năng sinh sản với thời gian ngắn hơn nhiều, trong đó động vật
dực đuợc phơi nhiễm với thuốc trong 4- 6 tuần Đã không nhặn xét thẳy sự tăng tỷ lệ truờng
họp teo ông tinh hoản ở chưột nhắt trắng được điều trị trong 2 năm với iiều tới
4500…g/kg/ngảy (gấp khoảng 75 lần MRHD) hoặc ở chó được đìều trị tởì |2 tháng vói liều
tới SOOmg/kgíngảy (gắp khoảng 50 lần MRHD)
Không có dữ lìệu vế tảo dụng cùa bosentan h0ặc các thuốc đối khảng với thụ thể của
endothelin khảc trên chức năng tinh hoản ở người nam giới.
Thời kỳ mang thai, Tảc dụng gây quái thai: Loại x (xem CHỐNG CHỈ ĐỊNH).
Người mẹ cho con bú
Nguời ta không biết thuốc nảy có bải tiết trong sủa người hay không Vì nhiều thuốc được bải
tiẽt trong sữa người, không nên cho con bú trong thời gian dùng TRA.CLEER
Sử dụng cho trẻ em
Đã không xảc định độ an toản và hiệu lực ở bệnh nhản trẻ em (xem LIẺU LUỢNG VÀ
CÁCH DÙNG).
Sử dụng ở bệnh nhân cao tuổi
Kinh nghiệm IIâm sảng về sử dụng TRACLEER ở bệnh nhân từ 65 tuối trớ lến dã không
bao gôm đủ số luợng bệnh nhân như vậy để xác định sự khảc nhau về dảp ứng giữa cảc bệnh
nhân cao tuồi và trẻ tuối (xem LIÊU LU ỢN'G VÀ CÁCH DÙNG)
TÁC DỤNG KHÔNG MONG MUỐN
Cảc tảc dụng không mong muốn
Xem CÁNH BÁO, phần bản luận về tốn thương gan và xem THẬN TRỌNG, phần bản luận
về cảc dị thường về hcmoglobỉn vả hematocrit.
Cảo dữ liệu về độ an toản trên bosentan đã thu nhận được từ 12 nghỉến cứu lãm sảng (8
nghiên cứu có đối chứng vởi placebo vả 4 nghiên cứu nhãn mở) ở 777 bệnh nhản có tăng
huyết ảp động mạch phồi và các bệnh khác. Cảc liều tới gấp 8 lần liều lâm sảng hỉện đang
dược khuyến cảo (125mg, 2 lần/ngảy) đã du~ọc dùng trong các khoảng thời gian khảo nhau
Sự phơi nhiễm với bosentan trong cảc thử nghiệm nảy xê dịch từ 1 ngảy đến 4,1 năm (N= 89
đối với ] năm; N= 61 đối với 1,5 nãm; vả N = 39 đối với trên 2 năm). Sự phoi nhiễm của
bệnh nhân có tăng huyết’ ap dộng mạch phối (N= 235) với bosentan xê dịch tứ 1 ngảy đển 1,7
năm (N = 126 đối với trên 6 thảng vả N = 28 đối vởi trên 12 thảng).
Sự giản đoạn điều trị do các tảo dụng không mong muốn khảo ngoải cảc tảc dụng có lỉẻn quan
với tăng huyết ảp phối trong các thu nghiệm lâm sảng ở bệnh nhân có tăng huyết áp động
mạch phối xảy ra thường xuyên hơn đối với bosentan (5%; 8/165 bệnh nhân) so với placebo
(3%; 2/80 bệnh nhân). Trong cơ sở dữ iiệu nảy, nguyên nhân duy nhất gây giản doạn đìều trị
> 1% vả xảy ra thường xuyên hơn đối với bosentan là chức năng gan không bình thườ.ng
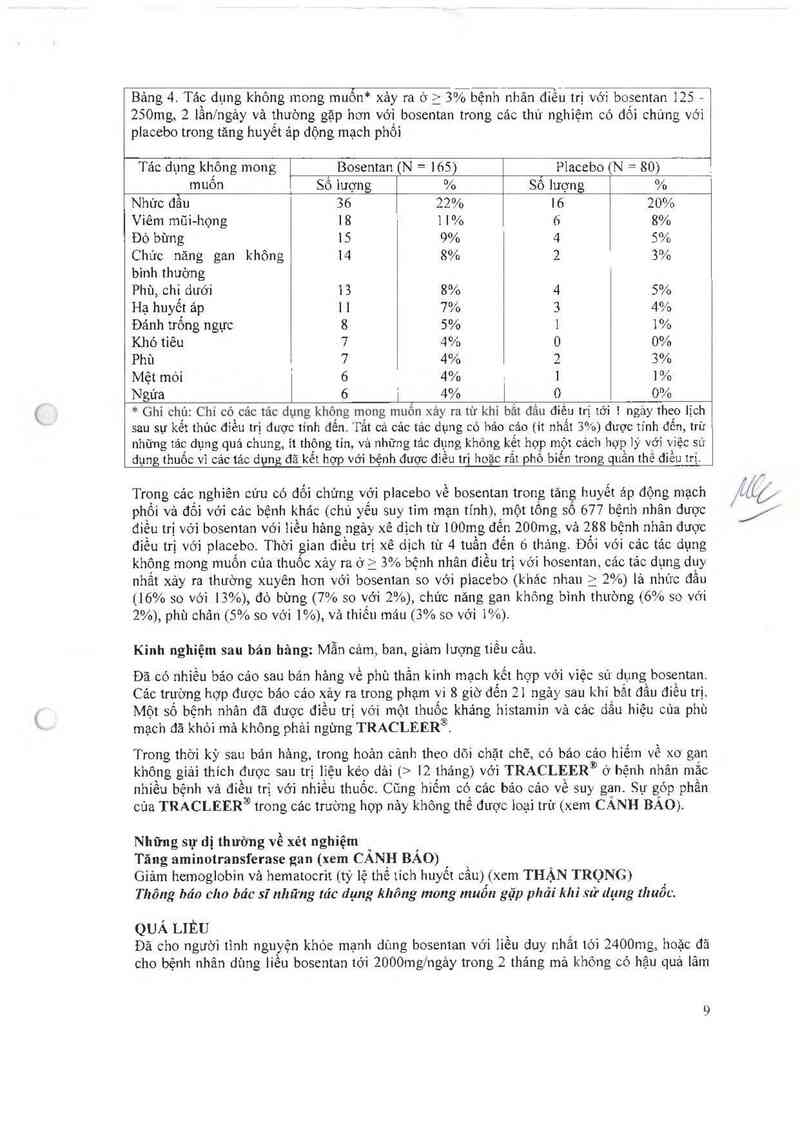
Các tảc dụng không mong muốn xảy ra ở ì 3% bệnh nhân điều trị với bosentan và thường gặp
hờn với bosentan trong cảc thử nghìệm có đôi chứng với placebo trong tăng huyêt áp động
mạch phôi với cảc ]ìêu bosentan 125 hoặc 250mg, 2 lânfngảy được trinh bảy ở Bảng 4.
Bảng 4 Tảo dung không mong muốn* xảy ra ở > 3%bệnh—nhân điếu trị với bosentan 125 —
250mg, 2 lần/ngảy vả thuò~ng gặp hơn với bosentan trong các thứ nghiệm có dối chứng vói
placcbo trong tăng huyết ảp dộng mạch phối
Tảc dụng không mong Bosentan (N = 165) Placebo (N= 80)
muôn . Số 1ượng % Số lượng %
Nhức đẫn 36 22% L6 20%
Viêm mũi-họng 18 ' 11% 6 8%
Đò bừng 15 9% 4 5%
Chức năng gan không 14 8% 2 3%
bình thường
Phù, chi dưới 13 8% 4 5%
Hạ huyết ảp [ 1 7% 3 4%
Đảnh trống ngực 8 5% 1 1%
Khó tiêu 7 4% 0 0%
Phù 7 4% 2 3%
Mệt mòi 6 4% - l 1%
Ngúa 6 L 4% ] o 0%
* Ghi chủ: Chi có các tác dụng không mong muôn xảy ra từ khi bắt đâu điếu trị Lới 1 ngảy theo lịch
sau sự kết thủc điếu trị được tinh đến. Tẩt cả các tảo dụng có háo cảo (it nhất 3%) được tinh đến, trừ
những tảo dụng quả chung, ỉt thông tin, vả những tảc dụng không kết hợp một cách hợp lý với việc sư
dụng thuốc vi cảc tảc dụng đã kết hợp với bệnh được điếu trị hoặc rất phổ biến trong quân thể điều trị
Trong các nghìên cứu có đối chứng với placebo về bosentan trong tăng huyết áp động mạch
phồi vả đối với cảc bệnh khác (chủ yếu suy tim mạn tính), một tông sô 677 bệnh nhân dược
điều trị với bosentan với 1iễu hảng ngảy xê dịch tự lOOmg đến 200mg, và 288 bệnh nhân được
điều trị với placebo Thời gian điếu trị xê dịch từ 4 tuần đến 6 thảng. Đối với cảc tảc đụng
khộng mong muôn của thuốc xảy ra ờ> 3% bệnh nhân điều trị với hosentan, cảc tác dụng duy
nhất xảy ra thường xuyên hon vói bosentan so với piacebo (khác nhan> _2%) lá nhức đầu
(16% so với 13%), đó bùng (7% so với 2%), chức nảng gan không bình thường (6% so với
2%), phù chân (5% so với 1%), và thiếu mảu (3% so vói 1%).
Kinh nghiệm sau bán hảng: Mẫn cảm, ban, giảm lượng tiểu câu.
Đã có nhiều bảo cảo sau bán hảng vế phù thần kinh mạch kểt họp với việc su dung bosentan.
Cảc trường hợp đuọc báo cáo xảy ra trong phạm vi 8 giờ đến 21 ngảy sau khi bắt đầu điều trị
Một sô bệnh nhân đã dược điếu trị vói một thuốc kháng hìstamin vả cảc dắư hiệu của phủ
mạch đã khỏi mã không phải ngùng TRACLEER®
Trong thời kỳ sau bản hảng, trong hoản cảnh theo dõi chặt chẽ, có bảo cảo hiếm về xo gan
không giải thich được sau trị liệu kéo dải (> 12 thảng) với TRACLEERỆ ở bệnh nhân măc
nhiều bệnh và điểu trị với nhiều thuốc Cũng hiếm có cảc bảo cảo về suy gạn. Sự góp phần
của TRACLEERÌIJ trong cảc trường họp nảy không thế được loại trư (xem CÁNH BẢO).
Những sự dị thường về xẻt nghiệm
Tăng aminotransí'erase gan (xem CẢNH BÁO)
Giảm hcmoglobin vả hematocrit (tỷ lệ thể tích hưyết cầu) (xem THẬN TRỌNG)
Thông băo cho bác sĩ những níc dụng không mong muốn gặp phải khi sử dung thuốc.
QUÁ LIÊU
Đã cho người tinh nguyện khỏe mạnh dùng bosentan với liễu duy nhắt lớì 2400mg, hoặc đã
cho bệnh nhân dùng liểu bosentan tới 2000mgIngảy trong 2 thảng mả không có hậu quả lâm
,
,. “f(Ắứ-
sảng lớn nảo. Tảo dụng khỏng mong muốn thuờng gặp nhắt lả nhức đầu cường độ nhẹ đến
vừa. Trong nghiến củu vê tượng tác với cyclosporin A, trong đó đã dùng các liều bosentan
500 và 1000mg, 2 iần/ngảy đổng thời với cyclosporin A, nông độ đảy trong huyết tuơng của
bosentan tăng gâp 30 lần dẫn đến nhức đầu nặng, buồn nôn, vả nôn nhung không có sụ kìện
không mong muôn nghiếm trọng Đã nhận xét thắy sự giảm nhẹ huyết áp vả tăng tần số đập
của tim.
Không có kinh nghiệm riêng biệt về quá liều vởi bosentan ngoải cảc liều mô tả ở trên. Ouá
liêu lớn có thẻ dân đẽn hạ huyêt áp rõ rệt cân sự hô trợ tim mạch tích cực.
nược LÝ LÂM SÀNG
Cơ chế tảc dụng
Endotheiin- 1 (ET- !) lả một hormon thằn kinh, mả tảc dung được trung gian bới sự gắn với
cảc thụ thể ETA vả ETB ở nội mô và cơ trợn mạch Các nông độ ET- 1 tăng lên trong huyết
tương và mô phổi cùa bệnh nhân có tảng huyết áp động mạch phối, gợi y' về vai trò gây bệnh
của ET-l trong bệnh náy. Bosentan ]ả một thuốc đối khảng đặc hiệu và cạnh tranh ở các thụ
thể củạ endothelin týp ETP` vả ETB. Bosentan có ải lực hơi cao hơn đối với thụ thể ETA so với
thụ thê ETB
DƯỢC ĐỌNG HỌC
Chung
Dưọc động học của bosentan chủ yếu được ghi chép lại Ở người khỏe mạnh Sau khi uống,
nồng độ trong huyết tương tối đa cùa bosentan đạt được trong vòng 3 5 giờ vả nù~a đời thải
trừ tận cùng (tlf2) là khoảng 5 giờ ở đối tượng người lớn khỏe mạnh. Ỉt dữ lỉệu trên bệnh nhân
cho thẩy sự lưu lại cùa bosentan trong cơ thể ở bệnh nhân tảng huyết áp động mạch phổi lớn
hơn khoảng 2 lần so với đối tượng người lớn khóe mạnh.
Hẩp thu và phân bố
Sinh khả dụng tuyệt đối cùa bosentan ớ nguời tinh nguyện binh thường là khoảng 50% và
không bị ảnh hưởng bới thức ăn. Thế tich phân bố lả khoảng 18 lit. Bosentan găn kết ò mức
cao (> 98%) với protein huyết tương, chú yêu với albumin. Bosentan không thâm nhặp vảo
hồng cầu.
Chuyển hóa và thải trừ
Bosentan có ba chẳt chuyến hóa, một chắt đó có hoạt tính dược lý và có thể đóng góp 10 —
20% vảo tác dung cùa bosentan Bosentan lả chất gây cảm ứng các enzym CYP2C9 vả
CYP3A4 vả có thế cả CYP2CI9. Sự thanh thải toản bộ sau một liếu tiêm tĩnh mạch đon lả
khoảng 4 lit/giờ ở bệnh nhân có tăng huyết ảp dộng mạch phổi. Khi dùng thuốc uống nhiều
liều, nồng độ huyết tương ở ngưòi lớn khóe mạnh giảm dần đến 50 — 65% nồng độ nhận xét
thẳy sau khi dùng liếụ đo~,n có thế do tảc dụng tự cảm ứng cùa cảc enzym chuyền hóa c) gan
Trạng thải ốn định đạt đuợc trong vòng 3- 5 ngảy. Bosentan được thải tru do sự bả] tiết trong
mật sau khi được chuyền hóa ớ gạn. Dưới 3% cnạ một liều uống đuợc thu hồi trong nước tiều
Các đối tượng bệnh nhân đặc biệt
Người ta không biêt dược động học cùa bosentan có bị ảnh hưởng bời giởi tính, cân nặng,
chùng tộc, h0ặc tuôL' hay không.
Suy gỉảm chức năng gan
Bằng chứng in vỉtro và in vsz cho thẳy sự chuyến hóa múc độ 1ởn ở gan cùa bosentan gợi v
răng suy gan có thế lảm tăng có ý nghĩa sự phơi nhiễm với bosentan. Trong một nghiên cứu
so sánh 8 bệnh nhân có suy gan nhẹ (được cho biết bằng phương phảp Child- -Pugh) vởi 8 đối
chứng, dược động học cùa liếu đơn và nhiếu liếm bosentan không bị thay đối ở bệnh nhãn có
10
(Mc
suy gan nhẹ. Đã không đảnh giá ảnh hưởng cùa suy gan vừa hoặc nặng đến dược động học
của bosentan. Nói chung, phải tránh dùng bosentan cho bệnh nhân có những sự không binh
thường vừa hoặc nặng vê gan, vả/hoặo aminotransferase tảng > 3 x ULN (xem LIÊU
LƯỢNG VÀ CÁCH DÙNG vả CẨNH BÁO).
Suy thận
Ó bệnh nhân có suy thận nặng (sự thanh thải oreatinin 15-30m1/phú1), nổng độ huyết tuơng
của bosentan chủ yêu không thay đổi vả nồng độ huyết tương cùa ba chất ohuyền hóa tăng lên
khoảng 2 lần so với người có ohức năng thận bình thường. Cảo sụ khảo nhau nảy có vẻ như
không quan trọng về mặt lâm sảng (xem LIÊU LƯỢNG VÀ CÁCH DÙNG).
CUNG CÁP THUỐC
Viên nén bao phìm, tròn, hai mặt lồi, mảu da cam-trắng, chứa 62 ,5mg, rập nồi dẩu "62,5",
đóng gói trong lọ polyethylen trắng tỷ trọng cao và một nắp polypropylen trắng khảng lại trẻ
em.
NDC 66215-101-06: Hộp ] lọ chứa 60 viên nén.
Viên nén bao phim, hình bầu dục, hai mặt lồi, mảu da cam- trắng, chứa 125mg, rập nồi dấu
"125", đóng gói trong lọ polyethylen trắng tỷ trọng cao và một năp polypropylen trắng khảng
lại trẻ cm.
NDC 66215-102-06: Hộp 1 lọ chứa 60 viên nén.
Chi bán theo đơn.
BẢO QUÁN
Bảo quản ở nhiệt độ dưới 30°C .
Hạn dùng: 60 tháng kể từ ngảy sản xuất.
Tiêu chuẩn chẩt lượng thuốc thảnh phẫm: Nhà sản xuất.
Đọc kỹ hưởng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin, xin hoi ý kiến bác sĩ.
Để thuốc xa tẩm tay trẻ em
Sân xuất bởi:
Patheon, Inc.
2100 Syntex coun, Mississauga, Ontario, Canada LSN 7K9.
Phân phối bởi: %
ICS
Louisvillc, KY40229, USA.
Tiếp thị bởi:
Actelion Pharmaoeuticals US, Inc.
Miến Nam San Francisco, CA 94080, USA.
Tâi liệu tham khảo:
[. Zimmennan H.J., Hepatotoxicity. The adverse effec ' and other ohemioals on the
liver. Second ed., Philadelphia, Lippinoott, 1999. '
Ngảy 15 tháng 2 năm 2007.
PHÓ cuc TRUỞNG
JVỵuyểềz 7/a'n ẵắaxnlỉ
/aĩè
/
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng