


























x.
²’Gc
BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC
LABELLING ĐÃ PHÊ DL'YỆT
Artwork of secondary packaging:
Lẩl'l đắU :uặỸuuulncọng'uulluZúoẫloẵu
%
_/ ~ `; ~_ ,
.\Ặ
L;/……gcụgx
/,’ ,f . \"J
,ẹ /, _,fvii;tbơiiG _
sz ' E… LLIỆNI `
AIT.PHANỌI
"Topumux'
25
Topiramate 25 mg
25
Topiramate ²5 mg
THUOC BAN THEO DON PRESCRIPTiON ONLY
ỦE XA TÀM TAYTRẸ EM KFEPCiLL'OL' RFACHOL'CHHDFIÍN
ĐOC Kl HƯỚNG DAN SU RFAD PACKAGE INSERT
Hộp 6 Yi X 10 ViỒn nón DUNG TRUOC KHI DUNG Box Of 6 blisurs CAREFUle RFFORF tsmr.
bao phim x 10 tỉlm- coated tablets
SĐK“ VN-xxxxrn
Sủn xudttur CILAG AG
Hochstruse 201.
8200 Schthauaen Thụy Sĩ
CTDK JamenCleq Ltd..
Thét Lan
DNNK vlmeulrnex Blth Dương,
tlnh Bình Dương
Mcnufocturod by“ CILAG A0,
Hochstonn 20],
Bìffl Stthmmn, Mhulund.
o'o'o'o'o'
°o o°o'o
o°o°o
o o o
o o .
o o'
p°ơ°ơ°
0
0
0
0
00
o
0.0
OO
DOO
.oo
8
ẵ
Ế
…
\, , , ` ,
BNISéÚSX \\ ` ,
ummsx `\\\\\\ dd.mmywv
apmo \ \t dd.mm.vyw ’
\tt\\\\"\\\t\\t`
H ........ ........ _
\ lllllll /
SP_Topamax_ZSmg_v5
Artwork of ptimary packaglng:
PP_Topamax_ZSmg_v3
LABELLING
Bu 0 0 A 5 0 0 0
LọpaĩnĩxoỂ
chpiramate 25
ủSEÌ'
Cilag AG. Thụy Sĩ
Tớpa’maĩoa T ấnaìMớ
thpiramate 25 LiLg , T piramate 25 LiLg
\RỄSẾỬJ \ịanssen
Cllag AG Thuy ST
Tọpínỉxòẹs TọợíM
Tộpiramate 25 mg Tcipiramate 25 ẫLg
Ủy \;anssen
Cilag AG Thụy ST
Cilag AG. Thụy Sĩ
-…---..----__-… ...........
T 25 ' To R25
T iramete 25 »mg T immate 25 lng
EXP: 00.00.0000
TOPAMAX®
(topiramat)
Thuốc nây chỉ dùng theo đơn của bác sỹ.
Đọc kỹ hưởng dẫn sữ dụng trước khi dùng.
Nếu cần thêm thông tỉn xin hỏi ý kiến bảc sỹ.
THÀNH PHÀN
Viên nén bao phim. CD1
Viên nén được khắc, chạm hoặc dập nổi. ,
Viên nén 25 mg
Viên nén tròn, mảu trắng, có chữ “TOP” trên một mặt; mặt còn lại có số “25”. Mổi viên nén
có chứa 25 mg Topiramat.
Viên nén 50 mg
Viên nén tròn, mảu vảng nhạt, có chữ “TOP” trên một mặt; mặt còn lại có số “50”. Mỗi viên
nén có chứa 50 mg Topiramat
Tá dươc:
Nhân viên: Lactose monohydrat, magnesi stearat, cellulose vi tinh thể, tinh bột tiền gelatin
hoả, tinh bột natri glycolat.
Vỏ bao phim: Sáp Camauba, OPADRY® trắng, vảng, hổng có chứa các thảnh phần sau:
hypromellose, polyethylen glycol, polysorbat, oxyd sẳt tổng hợp (chỉ với lớp bao mảu vảng
và hồng), titan dioxid.
CHỈ ĐỊNH _ `
Đơn trị liệu cho người lớn vả trẻ em trên 6 tuôi trong điêu trị động kinh cục bộ có k_èm hoặc
không kèm động kinh toản thể thứ phảt, và cơn động kinh co cứng - co giật toản thê nguyên
phát. ` _
Phối hợp trong điêu trị cho người lớn vả trẻ em tư 2 tuôi trở lên bị con động kinh khờỉ phát
cục bộ, có kế… hoặc không kèm động `kinh toản thế thứ phát hoặc cơn động kinh co cứng — co
giật toản thê nguyên phảt và trong điêu trị cơn động kinh liên quan đên hội chứng Lennox-
Gastaut.
TOPAMAX được chỉ định đỉều trị dự phòng đau nửa đầu ở người lớn sau khi đảnh giá kỹ
lưỡng các biện pháp điều trị khác. Topiramat không dùng để điều trị cơn đau nửa đầu câp.
LIÊU DÙNG VÀ CÁCH DÙNG
Không cần thiết phải kiểm soát nổng độ topiramat trong huyết tương để tối ưu hóa điều trị
với TOPAMAX. Trong những trường hợp hiếm, sử dụng thêm TOPAMAX với phenytoin có
thế cần điều chỉnh liều phenytoin để đạt được hiệu quả lâm sảng tối ưu. Có thế cân điều chỉnh
liều TOPAMAX nếu thêm vảo hoặc ngừng phenytoin vả carbamazepin trong điều trị phối
hợp với TOPAMAX.
Liều dùng
Nên khởi đầu Liều thấp và chinh liều sau đó để đạt được mức liều có hiệu quả.
Động kinh - điều trị phối hợp
Người lớn
Nên khởi đầu với liều 25 tới 50 mg vảo mỗi buổi tối trong một tuần. Đã có báo việc sử dụng
liều khời đầu thấp hơn nhưng chưa được nghiên cứu một cách hệ thống. Sau đó cách mỗi một
tuần hoặc mỗi hai tuần, nên tăng liều thêm 25 tới 50 mg/ngảy và chia lảm 2 lần uống mỗi
Di_Topamax_2ũ ỏOntg_CCDS 'JổJìtỉ’tĩ'tìiỂ_L/i * ",
- \LẬỤG\
ngảy. Việc chỉnh iiều phải dựa vảo đảp ứng lâm sảng. Một số bệnh nhân có thể đạt hiệu quả
điều trị khi dùng liều [ lần/ngảy.
Trong cảc thử nghiệm lâm sảng khi điều trị phối hợp, mức liểu 200 mg lả có hiệu quả và là
liều thấp nhất được nghiên cứu. Vì vậy, liều nảy có thế được xem như là liều tối thiểu đạt
hiệu quả. Liều dùng thông thường hảng ngảy là 200 đến 400 mg, chia lảm hai lần. Một số
bệnh nhân đã được dùng ở lỉều cao 1600 mglngảy.
Cảo khuyến cảơ về liểu dùng nảy áp dụng cho tất cả người lớn, kể cả người cao tuối hiện
không có bệnh về thận (Xem Cảnh bảo và T hạn trọng- Suy thận).
Trẻ em từ 2 tuổi trở lên %
Tống liều dùng hảng ngảy của TOPAMAX khi điếu trị phối hợp được khuyến cáo khoảng 5
đển 9 mg/kg/ngây, chia Iảm hai lần. Việc chinh liều nên được khởi đầu bằng 25 mg (hoặc
thấp hơn, dựa trên phạm vi liều từ 1 đến 3 mg/kg/ngảy) văo mỗi tối trong tuân đẩu tiên. Sau
đó đề đạt được đáp ứng lâm sảng tối ưu, sau cảoh mỗi 1 hoặc 2 tuần nên tăng liều trong giởi
hạn khoảng 1 đến 3 mg/kg/ngảy (chia Iảm hai lẳn uống). Việc chỉnh liều nên dựa trên đảp
ứng lâm sảng.
Liều dùng hảng ngảy lên tởi 30 mg/kg/ngảy đã được nghiên cứu và nói chung dược dung nạp
tốt.
Động kinh- Đơn trị liệu
Khi ngứng các thuốc chống động kình phối hợp đề đạt được đơn trị liệu bằng topiramat, nên
xem xét đến những tác động có thế có của việc nảy trên sự kiềm soát cơn động kinh. Liều của
cảc thuốc chống động kinh điều trị phổi hợp được khuyến cảo giảm từ từ với tỷ lệ khoảng Il3
mỗi hai tuần trừ khi cần phải ngừng ngay các thuốc chống động kinh phối hợp vì liên quan
đển tính an toân (Xem Cảnh báo và Thận trọng— Ngừng thuốc TOPAMAX).
Khi ngừng dùng các thuốc gây cảm ứng men, nồng độ của topiramat sẽ tăng. Có thế cần phái
giảm liều TOPAMAX nếu có chỉ định lâm sảng.
Người lón
Sự chinh liều nên khởi đầu ở Iiếu 25 mg dùng mỗi buổi tối trong một tuần. Sau đó, cách mỗi
! tuần hoặc mỗi hai tuần, nên tăng liều thêm 25 hoặc 50 mg/ngảy và chia lảm 2 lẩn uống một
ngảy. Nếu bệnh nhân không thể dung nạp với chế độ chinh liều như vậy, thì nên tăng liếu ít
hơn hoặc kẻo dải khoảng thòi gian giữa các lần tăng liếu. Liều và tốc độ chinh liếu nên dựa
trên đáp ứn lâm sảng.
Liều khởi đau khuyến cảo khi đơn trị liệu bằng topiramat ở người lớn trong khoảng 100 đến
200 mg/ngảy chia lảm 2 lần vả Iíều hảng ngảy tối đa được khuyến cáo lả 500 mg/ngảy chỉa
Iảm 2 lẩn. Một số bệnh nhân động kinh thể kháng trị dung nạp với topiramat ở liêu 1000
mg/ngảy trong đơn trị liệu. Các liêu khuyến cảo nảy ảp dụng cho tất cả người lởn, kế cả
người cao tuổi không có bệnh về thận.
Trẻ em từ 6 tuốí trở lên
Trẻ em từ 6 tuổi trở lên nên bắt đầu với liều tứ 0, 5 mg đến 1 mg/kg vảo buối tối, trong tuần
đầu. Sau đó cách mỗi 1 hoặc 2 tuần, tăng liều khoảng 0, 5 đến ] mglkg/ngảy, chỉa lảm hai lần
uống. Nếu trẻ không thể dung nạp với chế độ chinh liếu trên, thì nên tăng liều ít hơn hoặc kéo
dải thời gian giữa các lần tăng liều. Liều và tốc độ chinh liếu nên dựa trên đáp ứng lâm sảng
Liều khởi đầu khuyến cáo khi đơn trị liệu bằng topiramat ở trẻ em từ 6 tuổi trở lên iả từ 100
đến 400 mg/ngảy. Trẻ em mới được chấn đoán cơn động kinh khỏi phát cục bộ đã dùng liều
lên đến 500 mg/ngảy.
Đau nửa đẩu
Nguời lớn
Tông liều khuyên dùng mỗi ngảy cùa topiramat trong đíếu trị dự phòng đau nửa đầu là 100
mg/ngảy, chia lảm 2 lần. Sự chinh liều nên khởi đầu bằng liều 25 mg dùng mỗi tối trong một
Pt_Tơpamax_jìẵ ỂJOPĨỦÝCỄỊDS L'ì6JLLtLZOVJ i ;- ;.;J.
tuần. Sau đó mỗi tuần nên tăng thêm 25 mg/ngảy. Nếu bệnh nhân không thể dung nạp với chế
độ chỉnh liếu như vậy thì nên kéo dải hơn khoảng thời gian giữa cảc lẩn điếu chinh liều.
Ở một số bệnh nhân đã có hiệu quả với tồng liếu hằng ngảy 501mg/ngảy. Một số bệnh nhân
đã sử dụng tống liều hằng ngảy lên đến 200 mg/ngảy. Liều và tốc độ chinh liểu nên dựa trên
đảp ứng lâm sảng. (Xem Đặc tính dược lực học— Các Lhử nghiệm lăm sảng đau nửa đầu).
Bệnh nhân đậc biệt
Suy thận
Ở những bệnh nhân suy thận (độ thanh thải creatinin < 70 mL/phút), nên thận trọng khi uống
topiramat bởi độ thanh thải cùa topiramat ở thận và huyết tương giảm Bệnh nhân suy thận
cần thời gian dải hơn để đạt tới trạng thải hằng định tại mỗi mức liều. Khuyển cáo gỉảm một
nửa liếu khới đầu và liều duy trì (Xem Đặc tính dược động học). Ở những bệnh nhân suy
thận giai đoạn cuối, vi TOPAMAX bị loại khói huyết tương khi chạy thận nhân tạo, nên bổ
sung thêm nứa liều TOPAMAX thường dùng hẳng ngảy trong những ngây chạy thận. Liều
TOPAMAX bổ sung khi chạy thận nên được chia ra dùng vâo lúc bắt đầu và khi kết thủc quy
trình chạy thận nhân tạo. Liều bổ sung có thể khác nhau dựa trên đặc tính thiêt bị thâm tảch
máu sử dụng (xem Đặc tính dược động học). (Dj
Suy gan ’
Topiramat nên được dùng thận trọng ở bệnh nhân suy gan (Xem Đặc tỉnh dược động học-
Dân sỏ đặc biệt, Suy gan).
Cách dùng
TOPAMAX ở dạng viên nén, dùng đường uống. Khuyến cáo khi dùng không được bẻ viên
TOPAMAX.
Có thể uống TOPAMAX mã không cần quan tâm đến bữa ăn.
CHỐNG CHỈ ĐỊNH
Quá mẫn cám với bất cứ thảnh phần nảo của thuốc.
Dự phòng đau nứa đầu cho phụ nữ có thai và phụ nữ trong độ tuổi sinh sản không sử dụng
các biện pháp tránh thai phù hợp.
CAN H BÁO VÀ THẬN TRỌNG
Ngừng thuốc TOPAMAX
Trên nhũng bệnh nhân có hay không có tiền sử có cơn co giật, hay động kinh, phải ngừng từ
từ các thuôc chống động kinh, bao gồm cả TOPAMAX, nhằm giảm thiếu nguy cơ bị con
động kinh, hoặc nguy cơ tăng tần số cơn động kỉnh Trong các thử nghiệm lâm sâng, cứ mỗi
một tuần lại giảm liếu uống hảng ngảy 50 tới 100 mg đối với người lớn bị động kinh, và 25
tới 50 mg đối với người lớn đang dùng TOPAMAX dến 100 mg/ngảy cho dự phòng đau nứa
đầu. Trong các thử nghiệm lâm sảng trên trẻ em, TOPAMAX được giảm Iiểu từ từ trong
khoảng thòi gian 2 tới 8 tuấn. Trong những trường hợp mà vì lý do y khoa nên buộc phải
ngừng TOPAMAX nhanh chóng, khuyến cáo phải theo dõi một cách thích hợp.
Bênh nhân suv thân
Đường thải trừ chủ yếu của topiramat dạng không đổi vả cảc chất chuyến hóa cùa nó lả qua
thận. Sự thải trừ qua thận phụ thuộc chức năng của thận và không phụ thuộc vảo tuồi tảc.
Những bệnh nhân bị suy thận ở mức độ trung bình hoặc nặng có thế cần 10 đến 15 ngây đế
nông độ thuốc trong huyểt tương đạt được trạng thái ón định trong khi ở ngưòi bệnh có chức
năng thận bình thường chỉ cân từ 4 đến 8 ngảy.
Đối với tất cả cảc bệnh nhân, chế độ chinh liêu phải theo sự hướng dẫn bới đảp ứng lâm sâng
(chắng hạn như kiếm soát con động kinh, tránh các tác dụng ngoại ý) và lưu ý người bệnh dã
PI_TL_LpeLL~›L›_ZỔ ²xOmg_CCÙF UtỏJtLti.vbiố_ij
biết có sny thận có thế cần một thời gian đảỉ hon đề nồng độ thuốc đạt được trạng thái hắng
định tại môi liếu. (Xem Liều dùng và cách dùng— Bẹnh nhân đặc: biệt, Suy thận & Đặc Lính
dược động học— Dân số đặc biệt, Suy Lhận).
Sư bù nước
Giảm tỉết mồ hôi và không tiết mồ hôi đã được báo cảo lá có liên quan đến việc sử dụng
topiramat. Giảm tiết mô hôi vả tăng thân nhiệt có thế xáy ra dặc bìệt ờ Lrè nhỏ trong môi
trường nhiệt độ cao (xem Tác dụng khóng mong muốn).
Việc dùng nước đẩy đủ trong khi đang dùng topiramat lả điều rất quan trọng. Dùng nước có
thể [ảm giảm nguy cơ bị sói thận (xem Cánh bảo và T han Lrọng— Bệnh sỏi thận). Dùng đủ
nước trước và trong cảc hoạt động, như tập iưyện hay ở noi co' nhỉệt độ cao, có thế lảm giảm
nguy cơ bị các tảo dụng ngoại ý liên quan tới nhiệt (xem Tác dụng không mong muốn).
Rối [oan khí sắc/trầm cảm `
Có sự gia Lãng rối loạn khí sắc và trầm cảm được ghi nhận trong thời gian điêu trị với
topiramat. i` _
Tư tứ/ Có v đinh tư tứ 31
Tăng nguy cơ tự tử trong ý nghĩ hoặc hảnh vi ở nhũng bệnh nhân sử dụng cảc thuốĨ: chống
động kỉnh, bao gồm TOPAMAX, cho bất kỳ chỉ định nảo. Một phân tich tổng hợp các thử
nghìệm ngẫu nhiên, có đối chứng gìả dược của cảc thuốc chống động kinh cho thấy tăng
nguy cơ có ý định tự từ hay hảnh vi tự từ (0,43% ở cảc thuốc chống động kinh so với 0,24%
giả dược). Cơ chế của nguy cơ nảy không biết rõ.
Trong cảc thử nghiệm lâm sảng mù đôi, các biến cố liên quan đến tự từ (ý định tự tủ, có cộ
găng tự tứ, và tự tử) xảy ra với tần suất 0, 5% bệnh nhân đìếut trị vởi topiramat (46 trong số
8652 bệnh nhân được điều trị) so vởi 0, 2% điều trị vởi giả. duợc (8 trong sô 4045 bệnh nhân).
Một trường hợp tự tử được báo cáo trong một thứ nghỉệm mù đôi ở bệnh nhân bị rôi ioạn
lương cực dùng topiramat.
Vì vậy bệnh nhãn nên dược theo dõi các dắu hiệu của ý định vả hảnh vì tự tử vả nên cân nhấc
địều trị một cảch thích họp Nên khuyên bệnh nhân (vả người nhà bệnh nhân khi cần thiết)
cần có tư vấn y khoa ngay lập tức khi có các dẳu hiệu của ý định và hảnh vi tự tứ.
Sòi thân
Một số bệnh nhân, đặc bỉệt lả những người có khả nãng bị sói thận, có thế tảng nguy cơ hình
thảnh sỏi thận và bị các triệu chứng, dấu hiệu liên quan, như lá con đau quặn thận, đau vùng
thận, hoặc đau bên hông.
Cảc yếu tố nguy cơ cho bệnh sỏi thận gồm: hình thănh sỏi trước đó, tiền sử gia đình có bệnh
sỏi thận vả tăng calci niệu. Các yếu tố nguy cơ nảy không thể dự đoán một cảch đáng tin cậy
vỉệc hinh thảnh sòi trong khi điếu trị topiramat Hon nữa, bệnh nhân đang dùng thuốc khảo có
thể gây sỏi thận thì nguy cơ có thể tăng (Xem T ưong tác với các thuốc khác vò các Ioại tương
tác khác— Các Ioại tương Lác khác, Các thuốc có khả năng gây .SỎÍ lhận).
Suv 2an
Ở người suy gan, topiramat nên được dùng thận trọng, vì độ thanh thải của topiramat có thế
bị giâm. (Xem Liều dùng vả cảch dùng— Bệnh nhân đặc biệt, Suy gan & Đặc lỉnh dược động
học— Dản sỏ đặc biệt, Suy gan)
Cân thi cấp và Glôcôm góc đỏna thứ Dhảt
Một hội chứng bao gổm cận thị cấp với Glôcôm góc đóng thứ phát dã đuợc báo cáo ở bệnh
nhân uống TOPAMAX. Các triệu ehứng bao gồm con giảm thị lực cắp kịch phát vặ/hoặc đau
mắt. Cảo biếu hiện khi khảm mắt bao gôm: cận thị, tiền phòng nông, xung huyết mắt (đỏ mắt)
và tãng áp lực nội nhãn. Có thể có hoặc không gỉăn đồng tư Hội chứng nảy có thể liên quan
với trản dịch trên mi dẫn đển chiếm chỗ phía trước thủy tinh thế và mõng mắt với Glôcôm
góc đóng thứ phát. Cảo triệu chứng điền hinh thuờng xảy ra trong vòng ! thảng đầu dùng
TOPAMAX. Trái với Glôcôm góc hẹp nguyên phảt rất hiểm gặp ở người dưới 40 tuổi,
Glôcôm góc đóng thứ phảt liên quan tới topiramat gặp ở bệnh nhân nhỉ cũng như ở người
F)
%_,I opamax_Zĩ. ư`J’ng__ĩJGDS oỏJtzaúiĩitiì_ aiỉfs.
. .aỢ ' "M
A
\ ",
\' | \ư
lớn. Điều trị bao gồm ngững TOPAMAX cảng nhanh cảng tốt theo quyết định cùa bác sĩ điều
trị và hạ nhân áp bằng cảc biện pháp thích hợp. Những biện pháp nảy thường giúp hạ nhãn
a
Tẳng nhãn ảp do bất kỷ nguyên nhân nảo, nếu không được điểu trị đểu có thể dẫn đến di
chứng nghiêm trọng bao gôm mất thị lực vĩnh viễn
Cảo khiem khuvết thi giảc
Cảo khiếm khuyết thị giảc mã không liên quan tới tăng nhãn áp đã được bảo cáo ở nhữn
bệnh nhân được điếu trị bằng tOpiramat. Trong các thử nghiệm lâm sảng, hẫu hết cảc biến co
nây đă có thể hồi phục sau khi ngừng dùng topiramat. Nếu vân đề về thị giảc xảy ra bất cứ
thời điểm nảo trong suốt quá trình đỉều trị bằng topiramat, nên xem xét đề ngừng dùng thuốc
Toan chuvển hóa
clo trong mảu, không có khoảng trống anion, toan chuyến hóa (ví dụ: giảm bicarbonat
huyễt tương dưới mức giới hạn bình thường mà không có kiếm hô hẩp) có liên quan với việc
điều trị với topiramat. Giảm bicarbonat huyết tương lả do hiệu quả ức chế cùa topiramat trên
men carbonic anhydrase thận. Nhìn chung tình trạng giảm bicarbonat nảy xảy ra ở giai đoạn
sớm cúa việc điều trị mặc dù nó vẫn có thể xảy ra tại bẩt kỳ thời điếm nâo trong khi điều trị.
Mức độ giảm thường từ nhẹ tới trung bình (giảm trung bình là 4 mmol/L ở liều 100 mg/ngảy
hay nhiều hơn ở người lớn vả khoảng 6 mg/kg/ngảy ở bệnh nhân nhi). Hiếm khi mức độ giảm
đểu trị số còn dưới 10 mmol/L. Cảc tình trạng hay việc trị liệu có thể dẫn đến nhiễm toan
(như là bệnh thận, rối loạn hô hấp nặng, trạng thái động kinh, tiêu chảy, phẫu thuật, chế dộ ăn
sinh ketone, hoặc sử dụng một sô thuốc nhất định) có thề lảm tăng thêm tảc động giảm
bicarbonat của topiramat.
Toan chuyền hóa mạn tính ở bệnh nhân nhi có thề lảm giảm tốc độ phát triến. Ành hướng của
topiramat lên sự tăng trường và những dị tật liên quan đến xương chưa được kiểm tra một
cảoh hệ thống ở bệnh nhân nhi hoặc người iớn.
Phụ thuộc vảo tứng hoản cảnh mà cảc đánh giá thích hợp bao gồm cả đảnh giá mức độ
bỉcarbonat huyết thanh được khưyến cảo khi điều trị với topiramat. Nếu toan chuyền hóa xuất
hiện và kéo dải, cân nhắc giảm iiều hoặc có thể ngừng sử dụng topỉramat (ngừng liều giảm
dẩn).
Bổ sung chất dinh dưỡng 0)1
Có thể xem xét việc cung cấp thực phấm bổ sung hoặc tăng chế độ ăn, nếu bệnh nhân giảm
cân trong khi dùng thuốc nảy.
Suỵ giảm nhân thức
Suy giảm nhận thức trong bệnh động kinh là do nhiếu yếu tố, có thể do bệnh lý nền, do bệnh
động kinh hoặc do điều trị động kinh. Đã có những bảo cáo trong y văn về suy giảm chức
năng nhận thức ở người lớn khi điều trị với tOpiramat mã đã phải yêu cầu giảm liếu hoặc
ngừng điếu trị. Tuy nhiên, những nghiên cứu vê tảc động lên nhận thức ở trẻ em đã được điều
trị với topiramat là chưa đầy đủ và ảnh hướng cùa nó cân được Iảm sáng tó.
Lăng ammoniac huvết vả bênh não
Tăng ammoniac huyết có hay không có liên quan đến bệnh não được báo cảo khi điếu trị với
topiramat (xem Tác dụng khong mong muốn) Nguy cơ tăng ammoniac huyết khi dùng
topiramat xảy ra liên quan đến liều.
Tăng ammoniac huyết được báo cảo thường xuyên hon khi dùng đồng thời topỉramat với acid
valproic (Xem T ương tác với cảc Lhuốc khác và các Ioại tương tác khác).
Các triệu chứng lâm sâng của bệnh não do tăng ammoniac huyết gôm các thay đổi cấp tính
mức độ tinh tảo vả/hoặc chửc năng nhận thức với biến hiện lả tình trạng hôn mê Trong đa số
các trường hợp, bệnh não do tăng ammoniac huyết giảm khi ngừng điếu trị. Cảc bệnh nhân
xuất hiện trạng thải hôn mê không rõ nguyên nhân, hoặc nhũng thay đồi trạng thái tâm thẩn
do điều trị kết hợp hoặc đơn trị liệu với topiramat, nên nghĩ đến bệnh nâo do tăng ammoniac
huyết vả đo nồng độ ammoniac
PL _To,fvamax_J2ỏ. ỏiìmụ_ CC DS t’JôJ t…ịù Lẻầ_vl b='315
Bất dung nao lactose
Viên nén TOPAMAX chứa lactose. Không nên dùng thuốc nảy trên các bệnh nhân không có
khả năng dung nạp lactose trong các bệnh về di truyen hiếm gặp, thiếu hụt Lapp lactose hoặc
rối loạn hấp thu glucose- -galactose
TƯONG TÁC VỚI CÁC THUỐC KHÁC VÀ cÁc LOẠI TƯONG TÁC KHÁC
(Đối với mục tiêu của phẩn nảy, lỉều không gây ảnh hưởng là liều không lảm thay đổi quá
15%)
Tác động của TOPAMAX với các Lhuốc chống đọng kinh khảo
Việc phỏi hợp thêm TOPAMAX khi đang điều trị với cảc thuốc chống động kinh khác
(phenytoin, carbamazepin, acid valproic, phenobarbital, primidon) không ảnh hướng đến
nồng độ đạt trạng thải ôn định trong huyết tương cúa các thuốc nảy, ngoại trừ ở vải bệnh
nhân, việc phối hợp thêm TOPAMAX khi đang điều trị với phenytoin có thế Iảm tăng nồng
độ cùa phenytoin trong huyết tương. Điếu nảy có thế là do sự ức chế của một enzym đặc hiệu
dạng đồng phân đa hình (CYP2C19). Vì vậy, bất cứ ngưòi bệnh nảo đang dùng phenytoin có
những dấu hiệu hoặc triệu chứng lâm sảng của độc tinh thuốc, thì nên kiểm tra nông dộ của
phenytoin.
Có một nghiên cứu về tương tác dược động học trên bệnh nhân động kinh đã cho thấy nếu
đang dùng lamotrigỉn, khi thêm topiramat ở liếu 100-400 mg/ngảy cũng không ảnh hướng lên
nộng …độ lamotrigin ở trạng thái ôn định trong huyết tương. Hơn nữa, cũng không thấy thay
đối về nồng độ topỉramat ở trạng thái òn định trong huyết tương trong khi hoặc sau khi ngừng
điếu trị với lamotrigin (lỉều trung bình là 327 mg/ngảy).
Tác động của các lhuốc chống động Itinh khác trên TOPAMAX
Phenytoin vả carbamazepin lảm giảm nồng độ huyết tương của TOPAMAX. Khi phối hợp
thêm hoặc ngừng phenytoin hay carbamazepin trong khi đang điều trị với TOPAMAX có thế
cần chỉnh liều dùng của TOPAMAX. Việc chinh liều nảy nên tiến hảnh dựa vảo hiệu quả iâm
sảng. Dùng thêm hoặc ngừng acid valproic không lảm thay đổi đảng kể về mặt lâm sảng nồng
độ trong huyết tương của TOPAMAX và do đó, không cần điều chinh liều dùng của
TOPAMAX. Ộ1
Các tương tác nảy được tóm tắt như sau: ,
Dùng chung các thuốc Nồng độ cảc thuốc chống Nồng độ TOPAMAX
chống động kinh khác động kinh khác
Phenytoin <—›" ị (48%)
Carbamazepin (CBZ) <-› Jr (40%)
Acid Valproic <-› L->
Lamotrigin <-› +—›
Phenobarbital <-> NS
Primidon <…) NS
<~› = Không ảnh hưởng trên nồng độ huyết tưong (thay đổi s 15%)
** = Nồng độ gia tăng tùy từng cá nhân
~L = Nồng độ giảm
NS = Không có nghiên cứu
Các Lương tảc thuốc khảc
Digoxin
PI_T opamAr_2õ ỏímợ _CCDS i'JôJaLnl LG vi "3 '²'~`
Trong nghiến cứu đơn iiều, diện tích dưới đưòng cong (AUC) cùa nồng độ dìgoxỉn trong
huyết thanh giảm 12% khi dùng đồng thời với TOPAMAX. Tương quan vẻ mặt lâm sảng của
quan sảt nảy chưa được thiết lập Khi TOPAMAX được phối họp thêm vảo hay ngừng dùng
ở nhũng ngưòi bệnh đang điều trị với digoxin, cẩn chú ý kiếm tra thường kỳ digoxin trong
huyết thanh.
Các thuốc ức chế hê thẩn kinh trung ương
Việc dùng chung TOPAMAX vởi ruọu hoặc các thuốc ủc chế hệ thần kinh trung ương khác
chưa được đánh giá trong các nghiên cứu lâm sảng, vì vậy khuyến cảơ TOPAMAX không
dùng chung với rượu hoặc cảc thuốc ức chế hệ thần kinh trung ương khảo
Cảo thuốc tránh thai đườan uốnE
Trong nghiến cứu tương tác dược động học ở những ngưòi tình nguyện khoẻ mạnh đang sử
dụng đồng thời với các thuốc trảnh thai đưòng uông dạng kết hợp chứa ] mg norethindron
(NET) và 35 mcg ethinyl estradiol (EE), TOPAMAX được sử dụng đơn thuần với liều 50-
200 mg/ngảy không Iảm thay đối đáng kể có ý nghĩa thống kê trong phoi nhiễm trung binh
(AUC) cùa các thảnh phần có trong thuốc ngừa thai uỏng. Trong ] nghiên cứu khảo, phoi
nhiễm với EE gỉảm có ý nghĩa thống kê ở liều 200,400 vả 800 mg/ngảy (tưong ứng iả 18%,
21% và 30%) khi sử dụng phối hợp ở những bệnh nhân đang uống acid valproic. Ở cả 2
nghiên cứu, TOPAMAX (SO mg/ngảy đến 800 mg/ngảy) không ảnh hưởng đảng kế lên phơi
nhiễm với NET. Mặc dù trong` khoảng liều TOPAMAX tù 200- 800 mgr’ngảy, phơi nhiễm EE
có sự suy giảm phụ thuộc iiều, nhưng trong khoảng liều TOPAMAX từ 50- 200 mg/ngảy,
phơi nhiễm EE không bị thay đối phụ thuộc liều đảng kề Chua quan sảt thấy ý nghĩa lâm
sảng của những thay đổi nảy. Khả năng lảm giảm hiệu quả cún thuốc trảnh thai đường uống
và tăng nguy cơ xuât huyết dột xuất nên được chú ý ở bệnh nhân đang dùng thuốc trảnh thai
đường uỏng đồng thòi với TOPAMAX. Bệnh nhân đang dùng thuốc tránh thai co' chứa
estrogen nên dược dặn dò về việc báo cáo bất kỳ sự thay đối nảo trong vấn đề xuất huyết của
họ Hiệu quả của thuốc trảnh thai có thế giảm thậm chí khi không có xuất huyết. ®"i
L___ithium _
Trên người tình nguyện khỏe mạnh, quan sát thẳy có sự giảm phơi nhiễm hệ thống với
Iỉthium (18% diện tích dưới đường cong nổng độ huyết thanh ~— AUC), khi dùng cùng
topiramat 200 mg/ngảy. Ở nhũng bệnh nhân bị rôi loạn lưỡng cực, dược động học cùa lithium
không bị ảnh hướng trong thời gian điếu trị với topiramat 200mg/ngảy; tuy nhiên, sau khi
dùng topiramat tới mủc 600 mglngảy thi có tăng phơi nhiễm hệ thống (26% AUC) Khi dùng
chung với topiramat, cần phải theo dõi nồng độ lithium
Risoeridon
Cảc nghiên cứu tưong tác giũa thuốc - thuốc trên người tinh nguyện khỏe mạnh và người
bệnh bị rôi loạn lưỡng cực, trong điếu kiện dùng đơn lìều, và đa liều, cho kết quả tương tự
nhau. Khi dùng chung vởi topiramat, ở những iiều topỉramat tăng từng nấc lả 100, 250 và 400
mg/ngây, thì thấy có giảm phơi nhiễm hệ thống (16% vả 33% AUC ở trạng thải hằng định,
với các liếu lần lượt là 250 vả 400 mg/ngảy) của risperidon (liền từ 1 đến 6 mg/ngảy). Có
thay đổi rất ít về dược động học cùa toản bộ phần bản hoạt tính (risperidon và 9-
hydroxyrísperidon), vả không thấy có thay đối về dược động học của 9- h-ydroxyrispcridon.
Không có thay đổi có y nghia lâm sảng trong phơi nhiễm hệ thống của toản bộ phần bản hoạt
tính của risperidon, hay topiramat, do vậy tương tác thuốc giữa hai thuốc nảy không có ý
nghĩa lâm sảng.
Hvdrochlorothiazid ( HC iZ)
Một nghiên cứu về tương tác thuốc- thuốc ở trên ngưòi tình nguyện khóe mạnh, nhằm đánh
giá dược động học trong trạng thải ốn định cùa HCTZ (iiều 25 mg mỗi 24 giò) vả topiramat
(96 mg mỗi 12 giờ), khi dùng đon dộc, hay kết hợp vởi nhau. Kết quả nghiên cứu cho thấy
Cmax cúa topiramat tăng 27% và AUC tãng 29% khi phối hợp thếm với HCTZ Ý nghĩa lâm
sảng của những thay dôi nảy chưa rõ Diều trị phối hợp HCTZ với topiramat có thế cân phải
PI__Topamax_25 ỏiìmg_tỉLljUềỉ ỦỔJL.ƯìÊÍỀiỔ_L/i J 1²3
1 úì1— . .Ả
chình liều topiramat Dược động học ở trạng thái ồn định cùa HCTZ không bị ảnh hưởng
đảng kế bới dùng đổng thời topiramat Kết quả xét nghiệm iâm sảng cho thẳy có giảm kaiỉ
huyết thanh sau khi dùng topiramat hay HCTZ, mức giảm nhiến hớn khi hai thuốc nảy dùng
cùng túc với nhau
Metformin
Một nghỉên cứu tương tác thuốc - thuốc được thực hiện ở ngưòi tình nguyện khỏe mạnh để
đảnh giá vẽ được động học trạng thái ốn định cùa metformin vả topiramat trong huyết tương
khi dùng metformỉn đơn dộc hay dùng đổng thòi metformin vả topiramat Kết quả cúa nghiên
cứu cho thẳy Cmax vả AUCo- m, trung binh cùa metformin tăng lần lượt là 18% vả 25%, trong
khi giá trị CLÍF trung bỉnh giảm 20% khi metformin được dùng đổng thời vởi topiramat
Topiramat không ảnh hướng lên tmax của metformin Ý nghĩa lâm sảng của tác động cùa
topiramat lên dược động học của metformin iả chưa rõ Sự thanh thải qua huyết tưong khi
uỏng topiramat giảm khi dùng kèm với metformin. Mức độ thay đối cùa sự thanh thâi thì
không được biết rõ. Ý nghĩa [âm sảng của tảo động của metformin đối với dược động hợc của
topiramat thi không rõ. Khi 'IOPAMAX được dùng phối hợp hay ngừng ở bệnh nhân đang
điều trị metformin, phải đặc biệt chủ ý theo dõi thường xuyên để kiếm soát thich hợp tình
trạng bệnh tiếu đường
Pioglitazon
Nghiên cứu tương tảc thuốc - thuốc được thực hiện ở người tình nguyện khỏe mạnh để đánh
giá dược động học ở trạng thải ổn định của piogiitazon vả topiramat khi dùng đơn độc hay
dùng đống thời. Quan sát thấy giảm 15% AUC,ss cùa pioglitazon mả không thay đối vê
Cmaxss- Kết quả nảy không có ý nghĩa thống kẽ. Thêm vảo đó, thẳy có giảm 13% Cmam vả
16% AUC… cúa chất chuyến hóa hydroxy có hoạt tính, và giảm 60% Cmax,s vả AUC,_,, cùa
chất chuyến hóa keto có hoạt tính Y nghĩa lâm sảng của những phát hỉện nảy không biết rõ
Khi đang điếu trị pioglitazon mả thêm TOPAMAX, hay khi đang điếu trị TOPAMAX mả
thêm piogiitazon, thi phải chủ ý theo dõi bệnh nhân thường xuyên để kiếm soát tình trạng
bệnh tỉếu đưòng một cảch thích hợp @,
Givburid ]
Nghiên cứu tương tảc thuốc - thuốc được thực hiện ở bệnh nhân tiền đưòng tuýp 2 dế dánh
giả vê dược động học ở trạng thái ỏn định cùa glyburid (5 mg/ngảy) dùng đơn độc hay dùng
đồng thời với topiramat (150 mg/ngảy) Thấy có giảm 25% AUCỵ của glyburid trong khi
dùng topiramat. Phơi nhiễm hệ thống của cảc chẫt chuyền hóa có hoạt tính, 4- Lram- -hydroxy-
glyburid (MI) vả 3-cis-hydroxyglyburid (M2), cũng bị gỉảm iẳn iưọt là 13% vả 15%. Dược
động học ở trạng thái ôn định cùa topiramat không bị ảnh hưởng khi dùng dồng thòi với
glyburid Khi đang điều trị giyburid mả thêm topiramat, hay khi đang điều trị topiramat mả
thêm glyburid, thi phải theo dõi chặt chẽ bệnh nhân đều đặn, nhầm kiểm soát tinh trạng bệnh
tỉếu đường một cách thich hợp.
Các Ioại tương Lác khác
Các thuốc có khả nãan gâv sỏi thân
TOPAMAX khi dùng đồng thời vởi các thuốc có khả năng gây sòi thặn thì có thế lảm tăng
nguy cơ bị sói thận. Trong khi dùng TOPAMAX, nên tránh dùng đồng thời với cảc thuốc nảy
vì chúng có thế tạo ra môi trường sinh lý, lảm tãng nguy cơ hinh thảnh sỏi thận.
Acid Vaiproỉc
Khi dùng chung topiramat với acid valproic trên bệnh nhân vốn dung nạp với tứng thuốc nếu
dùng đon độc, người ta thấy có hiện tượng tăng amoniac máu có thế có hoặc không kèm theo
bệnh nâo. Trong đa số các trường hợp, các triệu chứng và dấu hiệu sẽ giảm bói đi khi ngùng
một trong hai thuốc (xem Cảnh báo vả Thận LrỌng vả Tác dụng khóng mong muốn) Phán
ứng bẩt lợi nảy không phải iả do tương tác dược động học.
Pi_Toparnax_ZỦ -Ệif`LnngCCDS JfflLLLL2ffl t“: __th1 ô"3£ị
Giảm thân nhiệt, được định nghĩa là sự giảm không có chủ đich nhiệt độ cơ thể xuống dưới
35°C, đã được báo cáo có liên quan dến việc sử dụng đổng thời topiramat vả acid valproic
(VPA) có hoặc không kết hợp với tăng ammoniac máu. Phán ứng bất lợi nảy ở những bệnh
nhân dùng đồng thời topiramat vả valproat có thể xảy ra sau khi băt đẩu điếu trị với topiramat
hoặc sau khi tăng liếu hảng ngây cùa topiramat.
Các nghiên cứu tương tảc dươc đông hoc thuốc bổ sung
Các nghiên cứu lâm sảng được thực hiện để đánh giá cảc tương tảc dược động học có thế có
giữa topiramat và các thuốc khác. Sự thay đổi Cmax hay AUC do tương tác được tỏm tắt dưới
đây. Cột thứ 2 (nồng độ cảc thuốc phối hợp) mô tả những thay đổi đối với nồng độ của các
thuốc phối hợp được liệt kê trong cột 1 khi dùng kết hợp với topiramat. Cột thứ 3 (nồng độ
topiramat) mô tả sự dùng chung của các thuốc được liệt kê trong cột 1 sẽ ảnh hưởng nồng độ
topiramat như thế nảo.
Pl_Topamax_25. SOmg_CCDS OôJLLLL20 15__v1 9 ².31
~
Tỏm tắt cảc kết auả từ cảc nghiên cửu tương tảc dược động hợc thuốc bô sung
Thuốc phối hợp Nồng độ các thuốc phôi họpI Nồng độ topiramat'
Amitriptylin ` <-› NS
Tảng 20% nông dộ cực đại và
diện tỉch dưới đường cong của
chẩt chuyến hóa nortriptylin
Dihydroergotamỉn «› <—›
(Đường uõng vả tiêm dưới da)
Haloperidol <…) NS
Tảng 31% điện tỉch dưới đường
cong cùa chât chuyên hóa bị giảm
Propranoiol <—› Tăng 9% vả 16% nồng độ cục đại,
Tảng 17% nồng độ cục đại đối Tăng 9% và 17 % điện tich dưới
với 4-OH propranolol (TPM đường cong (tương ứng với 40mg vả
50mg mỗi 12 giờ) 80mg propranolol môi 12giờ)
ư
Sumatriptạn <—› NS
(Đường uõng và tiêm dưới da) Oầj'
Pizotifen (__) (_, ,
Diltiazem Giảm 25% diện tich dưới đường T ãng 20% diện tích dưới đường j
cong cùa díltìazem vả gỉảm 18% cong
trong DEA, vả <—› cho DEM*
_
Venlafaxin ẹ—> <—›
Flunarizin Tăng 16% điện tích dưới dường <->
cong
(TPM so mg mỗil2 giờ)b
“ Giá trị phẩn trăm là thay đồi cùa nỗng độ cực đại hoặc diện tich dưới đường cong trung bình tương ứng
với đơn trị iiệu
e—›= Không ảnh hưởng trên nồng độ cực dại và diện tich dưới dường cong (thay đối S 15%) so với hoạt
chẳt ban đằu
NS= Không có nghiên cứu
*DEA= des acetyl dỉltiazem, DEM= N- -demethyl diltiazem
bDiện tỉch dưới đường cong của Fiunarizin tãng 14% ở những bệnh nhân uống tiunarizin dơn độc. Việc
gia tăng nảy có thế do tich iũy thuốc trong suốt thời gian đạt được trạng thải on định trong huyết tương
PHỤ NỮ có THAI VÀ CHO CON BÚ
Phụ nữ có Lhai
Topiramat gây quái thai ở chuột nhắt, chuột cống vả thò. Ở chuột cống, topìramat qua được
hảng rảo nhau thai.
Dữ iiệu từ tổ chủc kiểm soát thai sản cùa Anh và tổ chức kiếm soát thai sản có điếu trị thuốc
chống động kinh cùa Bắc Mỹ (NAAED) chi ra rằng trẻ sơ sinh khi dã phơi nhiễm với
topiramat đon trị liệu trong 3 thảng dầu thai kỳ có thế bị tảng nguy cơ dị tật bấm sinh (ví dụ
khuyết tật sợ và mặt như sút moi/hớ vòm miệng, dị tật lỗ tiếu thấp, và những bất thường iiẽn
quan đến các hệ thống khác của cơ thế). Dữ liệu từ tổ chúc kiểm soát thai sản NAAED chi ra
i-“ả i"~nernag ị“fv :ẹĩ²mfg_víịfìDổ t'Jỏănní JỊJif—` ti“ Jf.`i
rằng tỷ 1ệ dị tật bấm sinh của nhóm dùng topiramat đơn trị liệu cao gấp 3 lần nhóm không
dùng thuốc chống động kính. Hơn nữa, tỷ lệ trẻ sơ sỉnh nhẹ cân (< 2500 g) trên nhóm điều trị
bằng topiramat cũng cao hơn so với nhóm tham chiếu.
Ngoải ra, dữ liệu từ các tổ chức nảy và từ các nghiên cứu khảc đã chi ra rằng, có sự tặng nguy
cơ quải thai [iên quan đến đến việc sử dụng thuốc chống động kinh trong nhóm điếu trị kêt
hợp so với nhóm đơn trị iiệu.
Khuyến cảo phụ nữ trong độ tuổi sinh sản nên sử dụng các biện pháp trảnh thai phù họp vả
lựa chợn các liệu phảp thay thế.
Phụ nữ cho con bú
Nghiên cứu trên động vật dã chi ra rằng topiramat được bải tiết trong sữa. Sự bải tiết cùa
topiramat vảo trong sữa mẹ chưa được đánh giá ở nhũng thử nghiệm có đối chứng. Ở một số
ít bệnh nhân cho thấy có sự tiết nhiếu topiramat vảo sữa mẹ. Vì nhiều thuốc được bải tiết qua
sữa mẹ, nên cần quyết định lả ngừng/ tránh dùng topiramat hay ngừng cho con bứ, tuỳ theo
tẩm quan trọng của thuốc đối với người mẹ (Xem mục Cánh báo và Thận trọng).
Chỉ định động kinh
Trong thời kỳ mang thai, topiramat nên được kê đơn sau khi thông báo đầy đủ cho ngưòi mẹ
về nguy cơ của chứng động kinh không kiếm soát đối với phụ nữ mang thai vả nguy cơ tiềm
tâng với bảo thai do thuốc.
Chỉ định dự phòng đau nửa đầu ,
Topiramat chống chỉ định với phụ nữ có thai và phụ nữ trong độ tuối sinh sản nếu không sử
dụng các phương pháp trảnh thai hiệu quả (Xem mục Chống chỉ định vả Tương Lác với các
Lhuốc khác và các loại lương Lác khác).
ẨNH HƯỚNG TRÊN KHẢ NĂNG LÁ] XE VÀ VẬN HÀNH MÁY MÓC
TOPAMAX gây ánh hướng nhẹ hoặc trung bình lên khả năng lái xe vả vận hảnh mảy móc.
TOPAMAX tác động trên hệ thần kinh trung ương, có thể gây buồn ngù, chóng mặt hoặc cảc
triệu chứng liên quan khác. Nó có thể gây ra cảc rối loạn thị giác vả] hoặc nhìn mờ. Nhũng
tác dụng bẩt lợi nảy có thể gây nguy hiếm cho người bệnh khi lải xe hay vận hảnh máy móc,
dặc biệt cho đến khi kinh nghiệm dùng thuốc trên từng bệnh nhân được thiết lập.
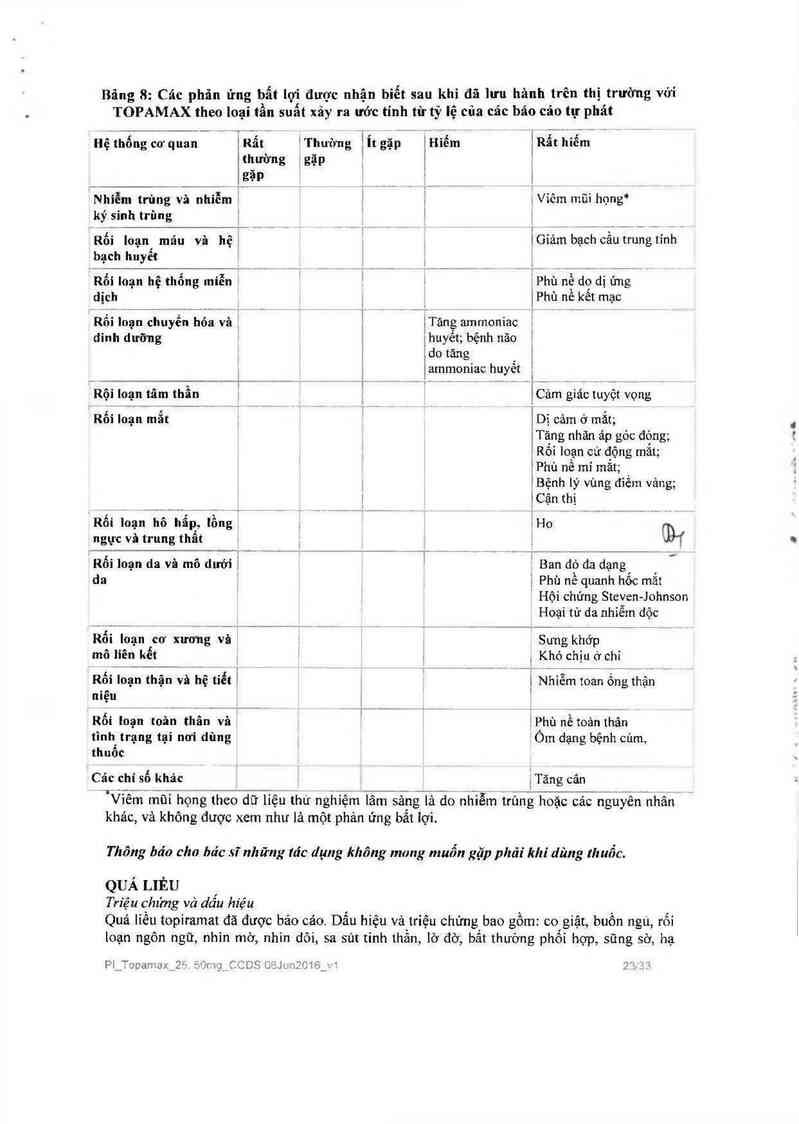
TÁC DỤNG KHÓNG MONG MUÔN
Cảc phản ứng bất lợi được trình bảy thông qua phần nảy. Cảo phản ứng bất iợi lả cảc biến cố
bất lợi đã được cân nhắc có sự liên quan hợp lý với việc sử dụng topiramat dựa trên đảnh giả
toản diện cảc thông tin biến cố bất lợi có sẵn. Mối quan hệ nhân- quả của topiramat không
thế được thiết lập một cảch tin cậy với các trường hợp riêng rẽ. Hơn nữa, bởi vì cảc thử
nghiệm lâm sảng được thực hiện dưới các diều kiện biến đối rộng rãi, tỷ lệ các phản ứng bất
lợi được quan sát thấy trong các thử nghiệm lâm sảng cùa thuốc không thế so sánh trực tiếp
với tỷ lệ trong các thử nghiệm lâm sảng cùa thuốc khác và có thế không phản ảnh cảc tỷ lệ
quan sát được trong thực hảnh [âm sảng.
Dữ liệu thử nghiệm lâm sảng
Tinh an toản cùa TOPAMAX đã được đánh giả qua cảc dữ liệu thử nghiệm lâm sảng gồm
4111 bệnh nhân (3182 dùng TOPAMAX vả 929 dùng giả dược) từ 20 thử nghiệm mù đôi, và
2847 bệnh nhân từ 34 thử nghiệm nhãn mờ, tương ứng, trong điều trị các cơn co cứng- co
giật toản thề nguyên phát, cảc con khởi phát cục bộ, các cơn co giật liến quan với hội chứng
Lennox- Gastaut, cảc thể động kinh mới hoặc vừa mới được chân đoán, hoặc đau nửa đầu.
Thông tin trình bảy trong mục nảy được lấy từ dữ lỉệu chung.
Đa sô các phản ứng bất lợi là ở mức độ từ nhẹ cho tới trung bình.
Pl_icpamax_2ỉ ’tửinig_tìCDS OỏJtưi..O Lổ_ :1 "…ớ3
Dữ liêu nghiên cứu mù L_ĩõỉ. có L_Lô'ị cha_an với gi_ảjươc tL;LLLLECLưIIW_ẸLWLPẬỌỆ
hgn bênh đông kinh— ở bênh nhân người Iởn
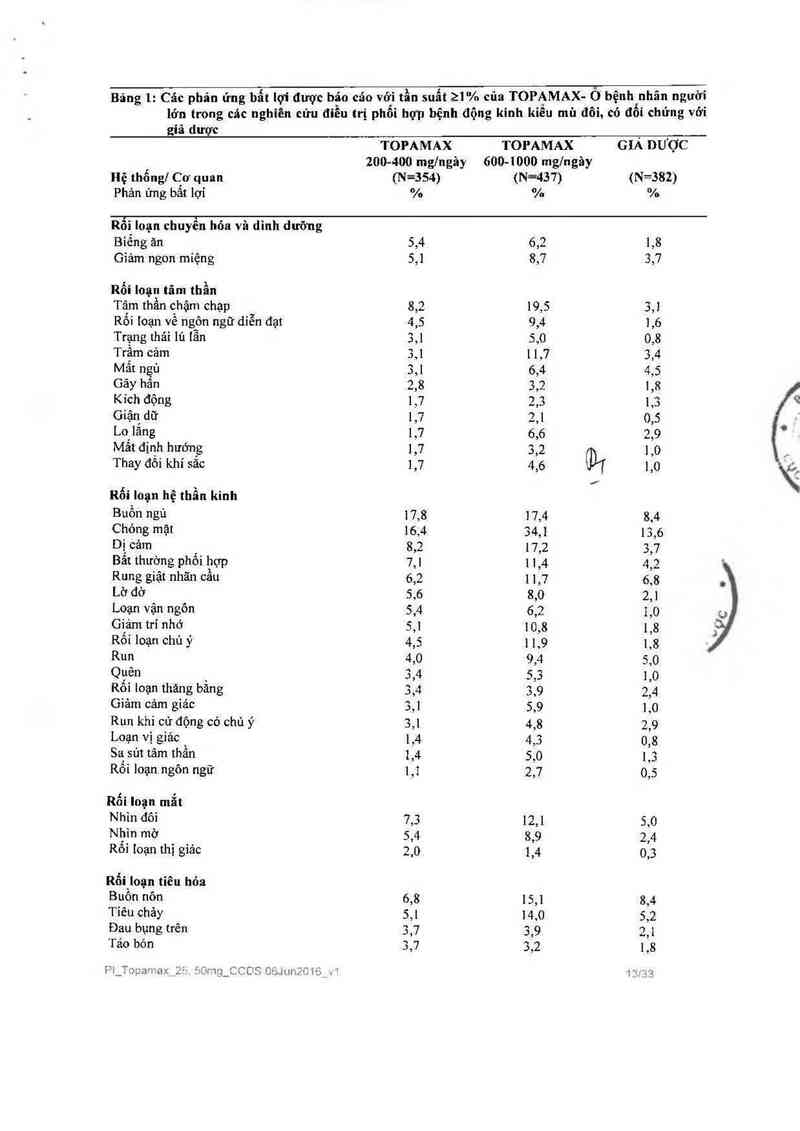
Các phản ứng bât lợi của thuôc được báo cáo _>_ 1% trên bệnh nhân người lớn điểu trị bằng
TOPAMAX trong cảc thử nghiệm đỉếu trị phối hợp bệnh động kinh kiến mù đôi, có đối
chứng với giả dược, được trình bảy trong Bảng 1. Cảc phản ứng bất lợi cùa thuốc có tần suất
>5% ở phạm vi liều khuyến cáo (200 tới 400 mg/ngảy) trên người lớn trong các nghiên cứu
điều trị phối hợp bệnh động kinh kiếu mù đôi, có đối chứng với giả dược, xếp theo thứ tự tần
số giảm dần lả: buồn ngủ, chóng mặt, mệt mỏi, kích thích, giảm cân, tâm thần chậm chạp, dị
cảm, nhìn đôi, bất thường về phối hợp vận động, buổn nôn, rung giật nhãn cầu, lờ đờ, biếng
ăn, rối loạn vận ngôn, nhin mờ, giảm ngon miệng, suy giảm trí nhớ và tiêu chảy.
PI_Topamax_ 25 50mg_CCDS OôJun2íJtỏ_vi 1233
~
Bảng 1: Các phản ứng bẩt lợi được báo cáo với tần suất 21% của TOPAMAX— Ồ bệnh nhãn người
lởn tmng các nghiên cứu điều trị phổi hợp bệnh dộng kinh kiều mù đôi, có đổi chứng với
giã dược ,, _
TOPAMAX TOPAMAX GIA DUỢC
200-400 mglngảy 600-1000 mglngèy
Hệ thốngl Cơ quan (N=354) (N-437) (N=382)
Phản ứng bất lợi % % %
Rối Ioạn chuyển hỏa vả dinh dưỡng
Biếng ăn 5,4 62 1,8
Giảm ngon miệng 5,1 8,7 3L7
Rối loạn tâm thần
Tâm thẩn chậm chạp 8,2 19,5 3,1
Rối ioạn về ngôn ngữ diễn đạt 4,5 9,4 1,6
Trạng thải lú iẫn 3,1 5,0 0,8
Trầm cảm 3,1 11,7 3,4
Mất ngủ 3,1 6,4 4,5
Gây hấn 2,8 3,2 1,8
Kich động 1,7 ,3 1,3
Giận dữ 1,7 2,1 0,5
Lo lẳng 1,7 6,6 2,9
Mất định hướng 1,1 3,2 1,0
Thay đồi khí sắc 1,7 4,6 ỄD1 1,o
Rối loạn hệ thẫn kinh
Buồn ngủ 17,8 17,4 8,4
Chóng mặt 16,4 34,1 13,6
Dị cảm 8,2 17,2 3,7
Bất thường phối hợp 7,1 L 1,4 4,2
Rung giật nhãn cầu 6,2 1 1,7 6,8 .
Lờ đờ 5,6 8,0 2,1
Loạn vận ngôn 5,4 6,2 1,0 Ụ
Giảm trí nhớ 5,1 10,8 1,8 ,
Rối loạn chủ ý 4,5 11,9 1,8
Run 4,0 9,4 5,0
Quến 3,4 5,3 1,0
Rối loạn thăng bằng 3,4 3, 2,4
Giảm cảm giảc 3,1 5,9 1,0
Run khi cử động có chùý 3,1 4,8 2,9
Loạn vị gỉác 1,4 4,3 0,8
Sa sút tâm thần 1,4 5,0 1,3
Rối loạn ngôn ngữ 1,1 2,7 0,5
Rối loạn mắt
Nhìn đôi ,3 12,1 5,0
Nhìn mờ 5,4 8,9 2,4
Rối ioạn thị giác 2,0 1,4 0,3
Rối loạn tiêu hóa
Buồn nôn 6,8 15,1 8,4
Tiêu chảy 5,1 14,0 5,2
Đau bụng trên 3,7 3,9 2,1
Táo bón 3,7 3,2 1,8
PE_Topamax_íầ'ể 'ỄỦM`Ig_CCỮỈẾ ỦỂDJUI'12ỮỄCL_ 13133
Bảng 1: Các phản ứng bẩt lợi được báo cáo với tần suất 21% của TOPAMAX- Ở bệnh nhân người
lớn trong cảc nghiến cửu điều trị phổi hợp bệnh động kinh kiểu mù đôi, có đổi chứng vứi
giả dược 7 _
TOPAMAX TOPAMAX GIA DUỢC
200-400 mg/ngảy 600-1000 mglngây
Hệ thổng/ Cơ quan (N=354) (N=437) (N=382)
Phản ứng bất lợi % % %
Khó chịu vùng dạ dảy 3,1 3,2 1,3
Khó tiêu 2,3 3,0 2,1
Khô miệng 1,7 3,7 0,3
Đau bụng ] 1 2,7 0,8
Rối loạn hệ cơ xương và mô liên kết
Đau cơ 2,0 2,5 1,3
Co thắt cơ 1,7 2,1 0,8
Đau cơ xương vùng lồng ngực 1,1 1,8 0,3
Rối Ioạn toăn thân và tinh trạng noi
dùng thuốc
Mệt mòi 13,0 30,7 1 1,8
Kích thich 9,3 14,6 3,7
Suy nhược 3,4 3,0 1.8
Rối loạn dáng đi 1,4 2,5 Oì’ị 1,3
Các chỉ số khảo ,
Giám cân 9,0 1 1,9 4,2
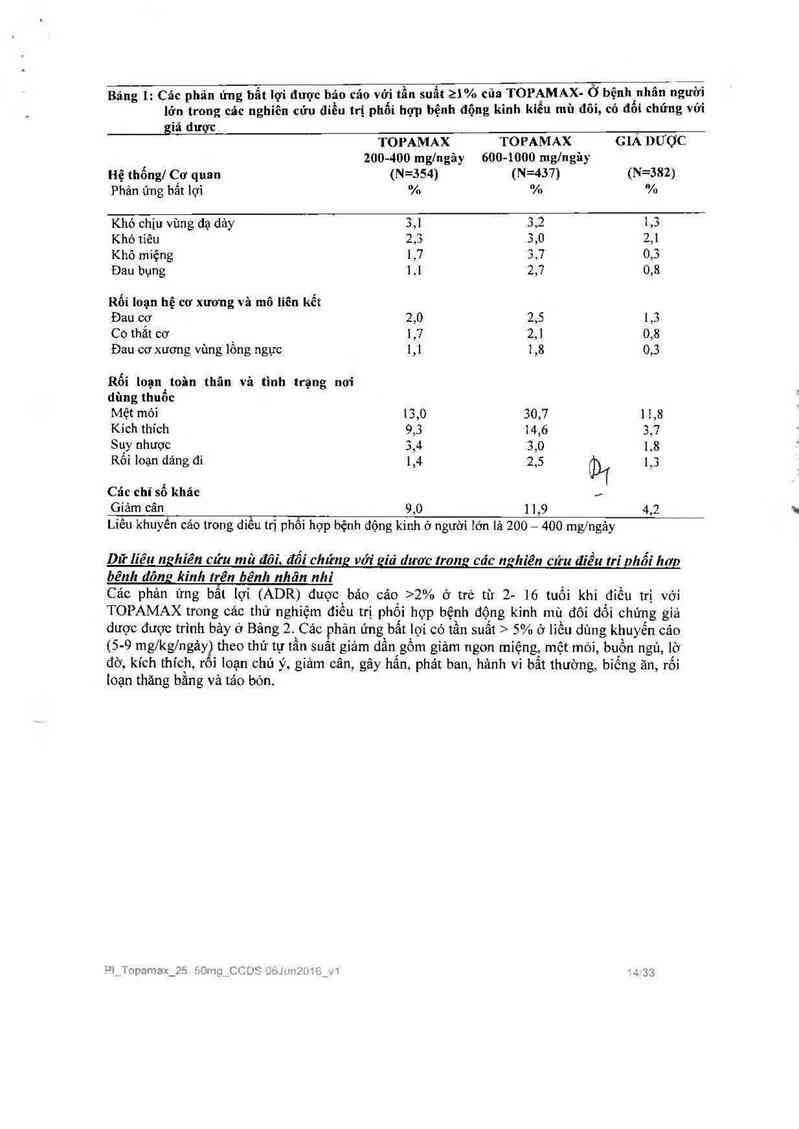
Liêu khuyến cảơ trong diếu trị phối hợp bệnh động kinh ở người iớn là 200 — 400 mg/ngảy
Dữ liêu nghiên cửu mù đôi. LỊối chửng với giả dươc trong các nghiên cứu điều trì phối hơn
bênh dõng kình trên bênh nhân nhi
Các phản ứng bắt iợi (ADR) được báo cáo >2% ở trả tù 2- 16 tuốì khi điếu trị với
TOPAMAX trong các thứ nghỉệm điểu trị phối hợp bệnh động kinh mù đôi đối chủng giả
dược được trình bảy 0 Bảng 2. Cảc phản ứng bất iợi có tần suất > 5% ở liều dùng khuyến cáo
(5- 9 mg/kgfngảy) theo thủ tự tần suât giảm dẩn gồm giảm ngon miệng, mệt mòi, buồn ngù, lờ
đờ, kich thich, rối loạn chủ ý, giảm cân, gây hấn, phảt ban, hảnh vỉ bẩt thường, biếng ăn, rối
loạn thăng bằng và táo bón.
Jì_T°iìamỡx_ỷổ fềOmg_CfflJỂ Gwiiwủ²ítiíỵ v—t vẹ, 33
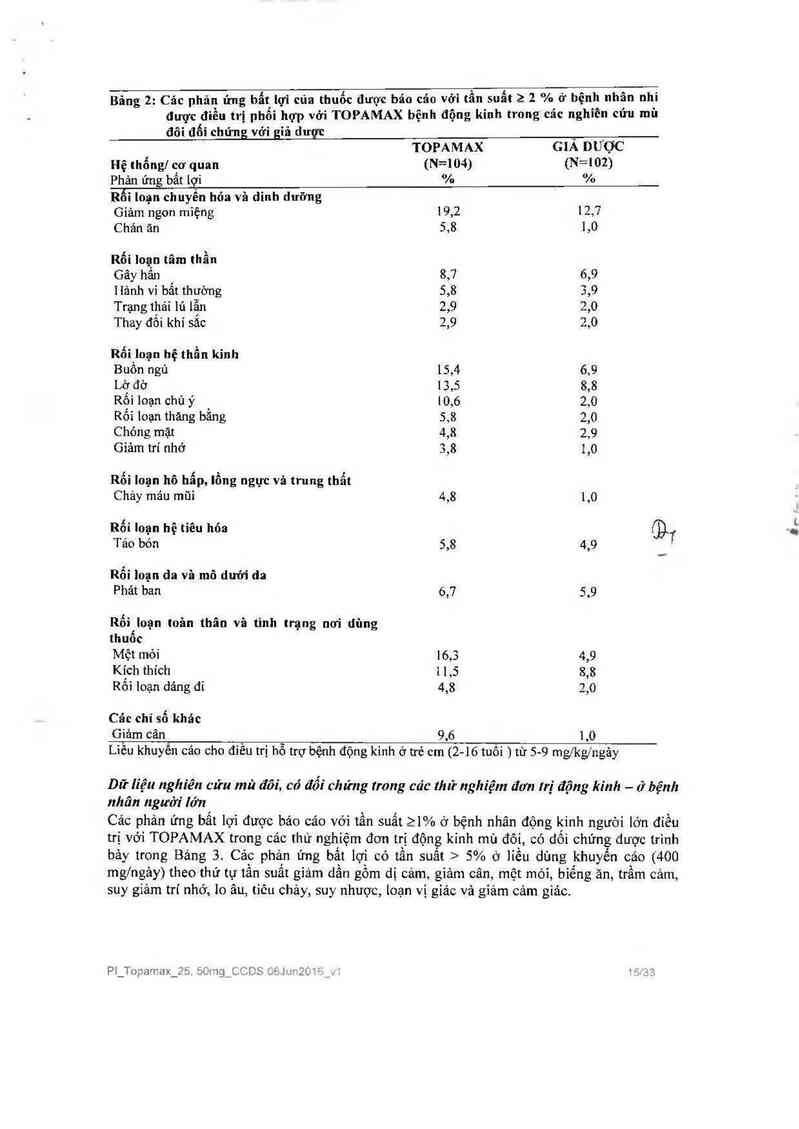
Bảng 2: Các phản ửng bất lợi của thuốc đuợc bảo cáo vởi tẩu suất ›. 2 % ở bệnh nhân nhi
đuợc điều trị phổi hợp với TOPAMAX bệnh động kinh trong cảc nghiẻn cứu mù
đôi đối chứng với giả dược
TOPAMAX GIẢ DƯỢC
Hệ thổng/ cơ quan (N=104) (N=102)
Phản ứng bât iợi % %
Rối Ioạn chuyến hóa và dinh dưỡng
Giảm ngon miệng 19,2 12,7
Chản ãn 5,8 1,0
Rối loạn tâm thần
Gây hân , 8,7 6,9
Hảnh vi bât thường 5,8 3,9
Trạngthải lú 1ận 2,9 2,0
Thay đôi khi săc 2,9 2,0
Rối luạn hệ thần kinh
Buồn ngủ 15,4 6,9
Lờ đờ 1 3,5 8,8
Rội loạn chủ ý ` 10,6 2,0
Rôi ioạn thả.ng băng 5,8 2,0
Chóng mặt 4,8 2,9
Giảm trí nhớ 3, 1,0
Rối loạn hô bấp, lồng ngục và trung thẩt
Chảy máu mũi 4,8 1,0
Rối logn hệ tiêu hóa Q),
Tao bon 5,8 4,9
Rối loạn da vả mô dưới da
Phát ban 6,7 5,9
Rối Ioạn toân thân vã tình trạng nơi dùng
thuốc
Mệt mời 16,3 4,9
Kịch thich 11,5 8,8
Rôi loạn dáng đi 4,8 2,0
Các chỉ số khác
Giảm cán` _ _ 9,6 1,0
Liêu khuyên cảơ cho đỉêu trị hô trợ bệnh động kinh ở trẻ cm (2-16 tuôi ) từ 5-9 mg/kg/ngảy
Dữ liệu nghiên cửu mù đôi, có đối chứng trong ca'c thử nghiệm đưn Irị động kinh — ở bệnh
nhân người lớn
Các phản ứng bất lợi được báo cáo với tần suất 21% ở bệnh nhân động kinh người lớn điếu
trị với TOPAMAX trong các thử nghiệm đơn trị động kinh mù đôi, có dối chứng được trinh
bảy trong Bảng 3. Cảc phản ứng bất lợi có tẩu suất > 5% ở liều dùng khuyến cáo (400
mgfngảy) theo thứ tự tẩn suất giảm dần gồm dị cảm, gỉảm cân, mệt mỏi, biếng ãn, trầm cảm,
suy giảm trí nhớ, 10 au, tiêu chảy, suy nhuợc, ioạn vị giác và giảm cảm giác.
L,
í;J
Pi_Topamax_ìổ. ổOLng_LCOS OELifJ'LZC›Ưt_L
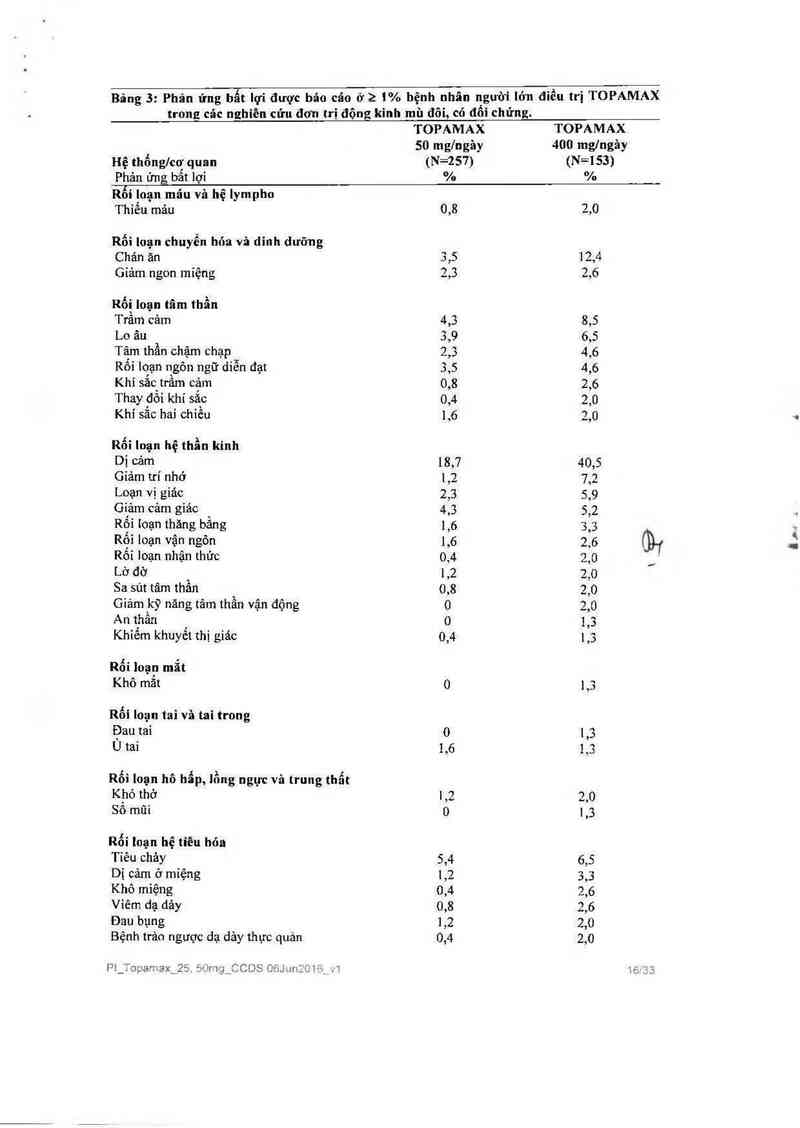
Bảng 3: Phản ửng bẩt lợi được báo cáo ở 2 1% hệnh nhân IìgU’ỜỈ lớn điếu trị TOPAMAX
trong các nghiên cứu đơn trị động kỉnh mù đôi, có đoi chứng.
TOPAMAX TOPAMAX
50 mg/ngèy 400 mglngảy
Hệ thốnglcơ quan (N=257) (N=153)
Phản ửng bẫt lợi % %
Rối Ioạn máu và hệ lympho
Thiếu mảu 0,8 2,0
Rối Ioạn chuyển hỏa vả dinh dưỡng
Chán ăn 3,5 12,4
Giảm ngon miệng 2,3 2›6
Rối loạn tâm thẵn
Trầm cảm 4,3 8,5
Lo âu 3,9 6,5
Tâm thần chậm chạp 2,3 4,6
Rối loạn ngõn ngữ diễn đạt 3,5 4,6
Khi sắc trầm cảm 0,8 2,6
Thay đổi khi sắc 0,4 2,11
Khí sắc hai chiếu 1,6 2,11
Rối loạn hệ thần kinh
Dị cảm 18,7 40,5
Giảm trí nhớ 1,2 7,2
Loạn vị giác 2,3 5,9
Giảm cảm giác 4,3 5,2
Rối ioạn thảng bằng 1,6 3,3
Rối Ioạn vận ngõn 1,6 2,6 ffl1
Rối loạn nhận thức 0,4 2,11 _
Lờ đờ 1,2 2,0
Sa sủt tâm thần 0,8 2,0
Giảm kỹ năng tâm thẩn vận động 0 2,0
An thần 0 1,3
Khiểm khuyết mị giác 11,4 1,3
Rối loạn mắt
Khô mắt 0 1,3
Rối loạn tai vả tai trong
Đau tai 0 1,3
Ù tai 1,6 1,3
Rối loạn hô hẩp, lồng ngực và trung thắt
Khó thờ 1,2 2,0
sớ mũi 0 1,3
Rối loạn hệ tiêu hỏa
Tiêu chảy 5,4 6,5
Dị cảm ở miệng 1,2 3,3
Khô mỉệng 0,4 2,6
Viêm dạ dảy 0,8 2,6
Đau bụng 1,2 2,0
Bệnh trảo ngược dạ dảy thực quản 0,4 2,0
Pl_i'opamax_25 ELLÌJri-LgWCCDS (`Jồtitịnịặa’J '1^_ .'“) `t€- ’.33
I›.
Chảy mảu lợi 0 l,3
Rối loạn da và mô dưới da
Phảt ban 0,4 39
Rụng tóc 1,6 3,3
Ngứa 0,4 3,3
Giảm cảm giác mặt 0,4 2,0
Ngứa toân thân 0 1,3
Rối loạn hệ cơ xương khớp mô liên kết
Co cơ 2,7 3,3
Đau khởp 1,9 2,0
Co gìật cơ 0,4 1,3
Rối Ioạn thận và hệ tiết niệu
Sòi thận 0 2,6
Tíểu khó 0,8 2,0
Đải dắt 0,8 2,0
Rối Ioạn hệ sinh sản Vũ Vũ
Rối Ioạn cương 0,8 1,3
Rối loạn toản thân vã tình trạng nơi dùng
thuốc
Mệt mòi 15,2 14,4
Suy nhược 3,5 5,9 @,
Kích thỉch 3,1 3,3
Các chỉ số khác .
Giỉm câná 7,0 l7,0 '.
Liêu khuyên cáo cho đơn trị liệu ở người lớn là 400 mglngảy
Dữ lỉệu nghiên cứu mù đôi, có đổi chứng trong cảc thử nghiệm đơn trị động kinh — ở bệnh
nhân nhi
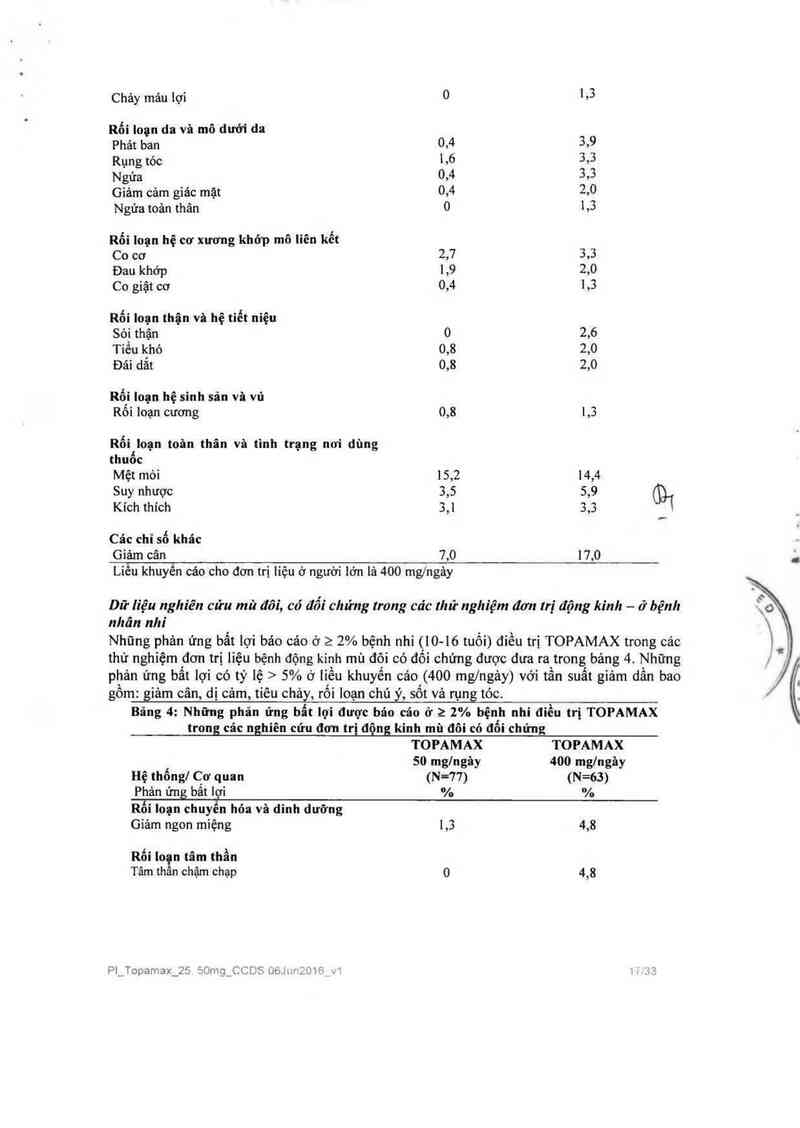
Nhũng phản ứng bẩt lợi bảo cáo ở 2 2% bệnh nhỉ ([0- lô tuổi) điều trị TOPAMAX trong cảc
thử nghiệm đơn trị liệu bệnh động kinh mù đôi có đối chứng được đưa ra trong bảng 4. Những
phản ứng bất lợi có tỷ lệ > 5% ở liều khuyến cảo (400 mg/ngảy) với tần suất giảm dần bao
gôm: giảm cân, dị cảm, tiêu chảy, rối loạn chú ý, sốt vả rụgg tóc.
Bãng 4: Những phản ứng bất lọi được báo cáo ở 2 2% bệnh nhi đỉều trị TOPAMAX
trong các nghiên cứu đơn trị động kinh mù đôi có đối chứng
TOPAMAX TOPAMAX
50 mg/ngây 400 mglngèy
Hệ thống] Cơ quan (N-77) (N=63)
Phản ứng_bất Igì % %
Rối loạn chuyến hóa và dinh dưỡng
Giảm ngon miệng 1,3 4,8
Rối lo n tâm thần
Tâm th n chậm chạp 0 4,8
Pl__Topamax_25 ỏOmg_CCDS ….JurJr1fì ,
Thạy đồi khí sắc 1,3 4,8
Trâm cảm 0
Rối Ioạn hệ thần kinh
Dị cảm 3,9 15,9
Rôỉ loạn chủ ý 3,9 7,9
Rối loạn tai và tai trong
Chỏng mặt 0 3,2
Rối Ioạn hô hẩp, lồng ngực và trung thất
Chảy máu mũi 0 3,2
Rối loạn hệ tiêu hóa
Tiêu chảy 3,9 9,5
Nôn 3,9 4,8
Rối loạn da và mô dưới da
Rụng tóc 0 6,3
Rối Ioạn toãn thân và tình trạng nơi
dùrng thuốc
SỔt 0 6,3
Suy nhược 0 4,8
Các chỉ số khác Oì'T
Giảm cân 7,8 20,6
Hoãn cảnh xã hội
Mất khả năng học tập 0 3,2
Liễu khuyến cảo cho đơn trị liệu ở trẻ em từ 10 tuổi trở lên là 400 mg/ngảy
Dữ liệu mù đôi, có đối chửng giả dược trong các thử nghiệm dự phòng đau nứa đẩu — ở
bệnh nhãn người lớn
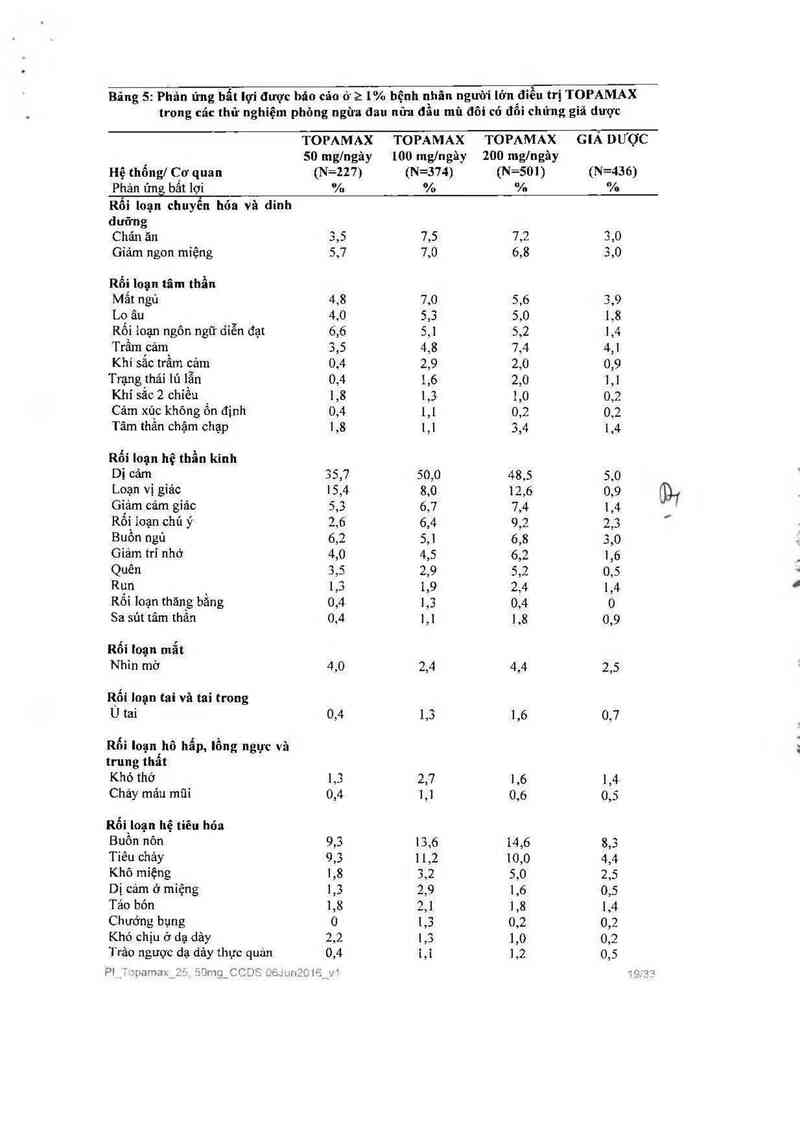
Phản ứng bất lợi được bảo cáo ở 21% bệnh nhân người lớn điểu trị TOPAMAX trong cảc thử
nghiệm phòng ngừa đau nứa đầu mù đôi có đối chứng giả dược được dưa ra trong Bảng 5.
Những phản ứng bất lợi có tần suất >5% ở liều khuyến cảo (100 mg/ngảy) theo thứ tự tần
suất giảm dần bao gồm: dị cảm, mệt mòi, buồn nộn, tiêu chảy, gìảm cân, Ioạn vị gìảc, chản
ăn, giảm ngon miệng, mất ngù, giảm cảm giác, rối Ioạn chú ý, lo âu, buồn ngủ vả rôì Ioạn
ngôn ngữ diễn đạt.
LĨJ
Pl_Topamax_ầb t…ĨJn1gf. C DS CJô ,: 1.11121J 1 ổ_vt
ox .
Bãng 5: Phản ủng bẩt lợi được háo cản ở 2 1% bệnh nhân người lớn điều trị TOPAMAX
trong cảu: thử nghỉệm phòng ngừa đau nửa đầu mù đôi có đổi chứng giả dược
TOPAMAX TOPAMAX TOPAMAX GIẢ DƯỢC
50 mg/ngây 100 mglngãy 200 mglngảy
Hệ thổng/ Cơ quan (N=227) (N=374) (N=501) (N=436)
Phản ứng bẩt lợi % % % %
Rối Ioạn chuyển hóa và dinh
dưỡng
Chản ăn 3,5 7,5 7,2 3,0
Gỉảm ngon mỉệng 5,7 7,0 6,8 3,0
Rối loạn tâm thẫn
Mắt ngủ 4,8 7,0 5,6 3,9
Lo âu 4,0 5,3 5,0 1,8
Rối ìoạn ngôn ngữ diễn đạt 6,6 5,1 5,2 1,4
Trầm cảm 3,5 4,8 7,4 4,1
Khí sắc trầm cảm 0,4 2,9 2,0 0,9
Trạng thải 1ủ lẫn 0,4 1,6 2,0 1,1
Khí sắc 2 chíều 1,8 1,3 1,0 0,2
Cảm xúc không ồn đinh 0,4 1,1 0,2 0,2
Tâm thần chậm chạp 1,8 1,1 3,4 1,4
Rối Ioạn hệ thẫn kinh
Dị cảm 35,7 50,0 48,5 5,0
Loạn vị giác 15,4 8,0 12,6 0,9
Gỉảm cám giáo 5,3 6,7 7,4 1,4
Rối loạn chú ý 2,6 6,4 9,2 ,3
Buồn ngủ 6,2 5,1 6,8 3,0
Giảm trí nhớ 4,0 4,5 6,2 1,6
Quên 3,5 2,9 5,2 0,5
Run 1,3 1,9 2,4 1,4
Rối loạn thăng bằng 0,4 1,3 0,4 0
Sa sủt tâm thần 11,4 1,1 1 ,8 0,9
Rối loạn mắt
Nhìn mờ 4,0 2,4 4,4 2,5
Rối Ioạn tai và tai trong
U tai 0,4 1,3 1,6 0,7
Rối Ioạn hô hẫp, lồng ngực và
trung thất
Khó thở l,.› , 1,6 1,4
Chảy máu mũi 0,4 1,1 0,6 0,5
Rối loạn hệ tiêu hóa
Buổn nôn 9,3 13, 14,6 8,3
Tiêu chảy 9,3 11,2 10,0 4,4
Khô miệng 1,8 3,2 5,0 2,5
Dị cảm ở miệng 1,3 2,9 1,6 0,5
Tảo bón 1,8 2,1 1,8 1,4
Chưởng bụng 0 1,3 0,2 0,2
Khó chịu ở dạ dảy 2,2 1,3 1,0 0,2
Trảo ngược dạ dảy thực quản 0,4 1,1 1,2 0,5
F’1 "11113ơ131_.14 *11’11111g_CCDÊ íJẺJL<í1ĨỄĨJIẾ_
Rối lqạn hệ cơ xương và mô
liên kêt
Co giật cơ 1,8 1,3 1,8 0,7
Rối loạn toân thân và tình
trạng nơi dùng thuốc
Mệt mòỉ 15,0 15,2 19,2 1 1,2
Suy nhược 0,9 2,1 2,6 0,5
Kích thỉch 3,1 1,9 2,4 0,9
Khảt 1,3 1,6 1,0 0,5
Các chỉ số khác
Giảm cân 5,3 9,1 10,8 1,4
Liễu khuyến cáo trong phòng ngừa dau nửa dâu là 100 mg/ngảy
Căc dữ liệu thử nghiệm lãm sảng khác — bệnh nhân người Ió’n
Các phản ứng bất lợi được báo cáo ở bệnh nhân người Iởn điều trị TOPAMAX với tần suất
<1% trong cảc thử nghiệm mù đôi có đối chứng hoặc ở bất kỳ tần suất nảo trong cảc nghiên
cứu nhãn mở được trình bây (1 Bảng 6.
Bảng 6: Các phân ứng bat lợi được báo cáo ở bệnh nhân người Iởn điều trị TOPAMAX với tần
suất 400 mglkg/ngảy. Ở thò, độc
tinh ở thò mẹ liến quan với liêu Iưọng được ghi nhận ở liều thấp tới 10 mg/kg/ngảy với độc
tính trên phôi thai/bảo thai (tử vong tăng) ở liếu thắp đển 35 mg/kg/ngảy, và tác động gây
quái thai (dị tật ở đốt sống vả xương sườn) ở liếu 120 mglkg/ngảy.
Tảc động gây quải thai ở chuột cống và ở thỏ thì giống nhau so với những điều được gặp với
các chẩt ức chế anhydrase carbonic, mã không có liến quan đến những dị tật ở người. Cảo tác
động trên sự tãng trưởng cũng được cho thấy bời trọng lượng khi sinh thấp vả trong suốt giai
đoạn bú mẹ lả những con chuột cống mẹ dùng thuốc ở liều 20 hoặc 100 mglkg/ngảy trong
suốt giai đoạn thai kỳ và cho con bú Ở chuột cong, topiramat qua được hảng rảo nhau thai
Pl_Topamax_2ổ 50mg_CCDS OE›J L1ĩì2Ùiổ_V1 132133
\°z ,
Trên những con chuột cống nhò, việc cho dùng topiramat uống ở liếu tới 300 mg/kg /ngây
trong suôt thời kỳ phảt triển tương ứng với thời sơ sinh, thời niên thiếu và thời dậy thi, đã gây
ra độc tính tương tự ở động vật trường thảnh (giảm ăn uống kèm theo giảm cân nặng, phi đại
tế bảo gan dạng trung tâm tiếu thùy, và phi đại nhú tiêu (urothclial) nhẹ ở bên trong bảng
quang). Không có một tảc dụng đảng kề nảo lên sự phảt triên của xương dải (xương chầy)
hoặc đậm độ khoảng của xương (xương đùi), thời kỳ trước khi cai sữa, và sự phát triên của cơ
quan sinh sản, sự phát triến về thần kinh (bao gồm cả việc đảnh giá về trí nhớ và khả năng
học tập), khả năng giao phối vả thụ thai, hay các thông số mở tử cung
Khả năng sinh sản
Mặc dù ở liều thấp 8 mg/kg/ngảy gây độc tính trên chuột cống bố và mẹ, nhưng không quan
sát thấy ảnh hướng trên khả năng sinh sản ở chuột công đực và cái ở liều lên đến 100
mglkg/ngảy.
TỈNH TƯONG KY
Không có.
HẠN DÙNG ' Ơà'l
24 tháng kể từ ngảy sản xuât.
Xem hạn dùng trên vỏ hộp.
ĐIỀU KIỆN BẢO QUẢN
Bảo quản ở nhiệt độ không quá 300 C. Bảo quản trong bao bì gốc.
Không bảo quản thuốc lẫn vởi thức ăn.
Để xa tẩm nhìn vả lẩm tay trẻ em.
QUY cÁcn ĐÓNG GÓI
Vi bấm nhôm/nhôm chứa 10 viên nén được dóng trong hộp. Hộp 6 ví x 10 viên.
Sản xuất tại: CILAG AG
Địa chỉ: Hochstrasse 20], 8200 Schaffflausen, THỤY SĨ.
Công ty đăng ký: JANSSEN—CILAG Ltd., Thải Lan
Mọi câu hỏifflảo cảo tác dụng ngoại ỷ/ Than phiến chẩt lượng sản phẫm xin Iỉên hệ:
VPĐD Janssen- Cilag Ltd., TP Ho Chi Minh.
ĐT: +84 8 382148²8
E-mail: [email protected]
Phiên bản: CCDSOỔJunZOIỔ; số: 016.
PI_Topammg_25, 50mg_CCDS 06.1un2016 _. ›
Ngảy sừa đỏi: 05/0 7/2016
Q. CỤC …
P.TRUỜNG PHÒNG
Jiẫztgén Jfễtợ; JÍ'ễìny
PI_Topamax_ 25 >1mq_ CC. DS 0611…2015 vi Ĩ.'›3 33
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng