
















ỉi.».taogẠjrộiqigs LIMITI 1D
12 tuổi và _35 kg)
Dối với điều trị HIV- ] ở bệnh nhi 12 tuổi trở iên có thẻ trọng >35 kg (>77 Ib): Liều dùng là
một viên nén 300 mg ngảy 1 lần được dùng bằng đường uỏng, bắt kể liên quan dến bữa ăn
Hiện tại khỏng có dữ liệu thích hợp cho bệnh nhi bị viêm gan B mãn tính.
Điều chinh lỉều dùng khi bị suy chức năng thận
Phơi nhiễm thuốc tăng đảng kể khi dùng tenofovir cho bệnh nhân suy chức năng thận trung
bình đến trầm trọng (xem ĐẶC TÍNH DƯỢC ĐỘNG HỌC VÀ DƯỢC LỰC HỌC). Vì
vậy, nên điều chinh khoảng cảch dùng tenofovir cho bệnh nhân có độ thanh thải creatinine cơ
bản <50 lephút theo cảc khuyến cáo trong Bảng bên dưới. Các khuyến các khoảng cảch
dùng thuốc nảy dựa trên loại dữ liệu dược động học liều đơn ở người khỏng nhiễm HIV vả
không nhiễm HBV với nhiều mức độ suy chức nãng thận khảo nhau, gồm cả bệnh thặn giai
2/27
đoạn cuối cần phải thẩm phân mảu. Tính an toản và hiệu quả của các khuyến cảơ điều chinh
khoảng cảoh dùng thuốc nây chưa được đảnh giả trên lãm sảng ở bệnh nhân suy chức nãng
thận trung binh hoặc trầm trọng, vì vậy đảp ứng lâm sảng đối với điếu trị và chức năng thận
nên được theo dõi chặt chẽ ở cảc bệnh nhân nảy (xem CẢNH BÁO VÀ THẶN TRỌNG).
Không cần thiết chinh liều cho bệnh nhân suy chức nảng thận nhẹ (độ thanh thải creatinine
50— 80 mL/phủt). Giảm sảt thường quy về độ thanh thải creatinine vả phosphorus huyết thanh
đã được dự tính ở cảc bệnh nhân suy chức năng thận nhẹ (xem CANH BAO VÀ THẶN
TRỌNG).
Bảng: Điều chỉnh liều dùn ' cho bệnh nhân có độ thanh thâi creatinine bị thay đỗi
Độ thanh thải creatinine _
tmL/phút)Ì Bệnh nhân thấm phân máu
2 50 30-49 10-29
Khoảng cách dùng tliilỗễ Môi 24 Mỏi 48 2 lần ` Mỗi 7 ngảy hpặc sau một dợt thâm
300 mg được khuyên cảơ giờ giờ một tuân phân toản phân khoảng 12 giỉf
'Được tinh toán băng cách sử dụng cân nặng cơ thể lý tường (không tính phần mỡ).
² ’Ihông thường hằng tuần có ba đợt thẩm phân máu, một đợt kéo dải trong khoảng 4 giờ.
Dùng tenofovir sau khi hoản tắt thẩm phân.
Dược động học của tenofovir chưa được đảnh giả ờ_bệnh nhân không thẩm phân có độ thanh
thải creatinine <10 mL/phút; vì vậy, không có khuyến cảơ lỉêu dùng cho các bệnh nhân nảy.
Người cao luồi. Không có dữ liệu thích hợp đề có khuyến cáo liều dùng cho cảc bệnh nhân
trên 65 tuồỉ. ỹ
Suy chúc năng gan. Không cần thiết chinh liều cho bệnh nhổy chức năng gan (xem
CANH BÁO VA THẶN TRỌNG).
Nếu dừng sử dụng tenofovir ở bệnh nhân viêm gan B mản tinh có kèm hoặc không kèm
nhiễm với HIV, nên giảm sảt chặt chẽ cảc bệnh nhân nảy về bằng chứng đợt kịch phát viêm
gan (xem CẨNH BÁO VÀ THẶN TRỌNG).
sử DỤNG ở CÁC Đói TƯỢNG ĐẶC BIẸT’
' Thai kỳ
Cảo nghiên cứu sinh sản ờ chuột cống và thờ ở cảc liều lên đến 14 và 19 lẳn liều cho người
dựa trên so sánh diện tích bề mặt cơ thể cho thấy không có bầng chứng suy giảm khả năng
thụ tinh hoặc gây hại cho thai nhi do tenofovir Tuy nhiên, không có các nghiên cứu thích
hợp và có đối chứng tốt ở phụ nữ có thai. Vì cảc nghiên cứu trên động vật không phải luôn
Iuôn phản ánh đáp ưng ở người, nên sử dụng tenofovir trong thai kỳ chí khi thật cân thiết.
0 Cho con bú
Khuyến cảơ các bả mẹ nhỉễm HIV ] không được cho con bú sữa mẹ để trảnh nguy cơ
truyền HIV-l sau khi sinh. Cảo nghiên cứu ở chuột cống chứng minh rằng tenofovir được
bải tiết trong sữa Không biểt 1ả tenofovir có bải tiết vảo sữa người hay không. Vì cả khả
nãng truyền HIV- 1 và khả nãng phản ứng phụ trầm trọng ở trẻ bú sữa mẹ, hướng dẫn cảc bả
mẹ không được cho con bú bằng sữa mẹ nểu họ đang dùng tenofovir.
3/27
o Trẻ cm
Bệnh nhi từ 12 tuốí trở lên.
Tính an toản của tenofovir ở bệnh nhi tuổi từ 12 đến <18 tuối được chứng minh bời dữ liệu
từ một nghiên cứu ngẫu nhiên dã được bảo cảơ trong đó dùng tenofovir cho người nhỉễm
HIV- 1 đã được điều trị trước đây Trong nghiên cứu nảy, dữ liệu dược động học cùa
tenofovir tương tự như dược động học đã được phảt hiện vê tinh an toản và hiệu quả trong
cảc thử nghiệm lâm sâng ở người trường thảnh dã dược bảo cảo.
Trong một nghiên cứu đã được bảo cảo, 87 người đã được điều trị tuổi từ 12 đến <18 tuối
được điều trị với tenofovir (N= 45) hoặc vởi giả dược (N= 42) phối hợp với một phảc đổ cơ
bản được tối ưu hóa (optimìzed background regimen- OBR) trong 48 tuần. Số lượng tế bảo
CD4 cơ bản trung bình lả 374 tê bảo/mm vả HIV- ] RNA huyết tương cơ bản trung binh là
4, 6 log… phiên bảnlmL. Ở mức cơ bản, 90% người tiềm ấn cảc gốc thế liên quan đến đề
kháng NRT] ở các chùng phân lập HIV- !. Về tổng thề, thử nghiệm thất bại cho thẩy một sự
khảo biệt về đáp ứng virus học giữa cảc nhóm được điếu trị với tenofovir và giả dược. Các
phân tích nhóm nhỏ gợi ý tình trạng thiểu sự khác biệt về đáp ứng virus học có thế lả do mất
cân bằng giữa cảc phác đồ điếu trị ở tính nhạy cảm virus ở mức cơ bản giữa tenofovir vả
OBR.
Mặc dù các thay đối về HIV-l RNA ở những người đã được điều trị ít được lường trước, khả
năng so sánh vê dược động học vả dữ lìệu tinh an toản quan sảt được ở người trưởng thảnh
chứng minh việc sử dụng tenofovir ở bệnh nhi > 12 tuồi có cân nặng_ > 35 kg và chùng phân
lập HIV— ] được cho là nhạy cảm với tenofovir (xem CẨNH BẢO VÀ THẶN TRỌNG,
TÁC DỤNG KHÔNG MONG MUÔN vả ĐẶC TÍNH DƯỢC ĐỌNG HỌC VÀ DUỢC
LỰC HỌC)
Tính an toản và hiệu quả ở bệnh nhi dưới 12 tuổi chưa được thiết lập. ỵ
0 Người cao tuổi
Cảc nghiên cứu lâm sảng đã được bảo cảơ của tenofovir không đủ số lượng người từ 65 tuối
trở lên rằng họ đáp ứng có khác biệt so với người trẻ hơn hay không Thông thường, thận
trọng lựa chọn liều dùng cho bệnh nhân cao tuôi, luôn ghi nhờ ở người cao tuổi có tần suất
cao hơn về giảm chức năng gan, giảm chức năng thận, hoặc giảm chức nãng tim vả họ có
bệnh đồng thời khảc hoặc đang sử dụng đổng thời trị liệu thuốc khảc.
o Suy chửc nãng thận
Khuyến cảơ điếu chỉnh khoảng cảoh dùng thuốc ở bệnh nhân có độ thanh thải creatinine <50
lephút hoặc ở bệnh nhân có bệnh thận giai đoạn cuối cần phải thẳm phân (xem LIỂU
LƯỢNG VÀ CÁCH DÙNG vả ĐẶC TÍNH DƯỢC ĐỘNG HỌC VÀ DƯỢC LỰC
HỌC).
CHỐNG CHỈ ĐỊNH ² . _
Viên nện TEVIR (Tenofovir DF)ỳchông chỉ định ớbệnh nhân trước đây đã có quả mẽ… với
hoạt chât hoặc với bất cứ thảnh phân nảo của sản phâm.
CẢNH BÁO VÀ THẶN TRỌNG' ²
Nhiễm acid lactic/Phì đại gan kèm gan nhiễm mỡ
Nhìễm acid lactic kèm phì đại gan vả gan nhiễm mỡ, gổm có những trường hợp từ vong, đã
được bảo cáo khi sử dụng cảc đồng dẳng nucleoside, gôm cả tenofovir, phối hợp với cảc
khảng retrovirus khảc. Phần iớn cảc trường hợp nảy lá ở phụ nữ. Béo phì vả phơi nhiễm
4/27
nucleoside kéo dải có thế là các yếu tố nguy cơ. Đặc biệt thận trọng khi dùng các đồng đẳng
nucleoside cho bất kỳ bệnh nhân nảo đã biết các yếu tố n uy cơ vê bệnh gan; tuy nhiên, các
trường hợp đã dược báo cáo ở bệnh nhân không có cảc yeu tố được biết Nên dứng tạm thời
điều trị với tenofovir ở bất kỳ bệnh nhân nảo phảt triền các biểu hiện trên lâm sảng hoặc cặn
lâm sảng gợi ý nhiễm acid 1actic hoặc ngộ độc gan (có thể gồm phi đại gan vả gan nhiễm mỡ
ngay cả không tăng transaminase đảng kể)
Dợt kịch phát viêm gan
Triệu chứng dột ngột trám trọng rrong khi díều trị Đợt kịch phảt tự phát ở viêm gan B mãn
tính thương xảy ra n1ột cảch tương đối và được biều thị bởi tăng A1 T huyết thanh thoảng
qua Sau khi khời đâu trị liệu khảng vìrus, ALT huyết thanh có thẻ tăng ở một sô bệnh nhân
Ó bệnh nhân có bệnh gan còn có thể bù được, tăng ALT huyết thanh nảy thường không kẻm
tãng nồng độ bilirubin huyết thanh hoặc mất bù gan. Bệnh nhân xơ gan có thế có nguy cơ cao
hơn mẩt bù gan sau đợt kịch phảt viêm gan, và vì vậy nên giám sảt chặt chẽ trong thời gian
tri Iiêư.
Triệu chứng đột ngột trầm trọng suu khi dùng đíều trị: Đợt kịch phát cẳp viêm gan củng đă
được bảo cáo ở bệnh nhân dừng trị liệu viêm gan B. Đợt kịch phảt sau điều trị thường lỉên
quan với tăng HBV DNA, và phẩn lớn dường như tự giới hạn. Tuy nhiên đợt kịch phảt trầm
trọng, gồm có cả tử vong, đã được bảo cảo. Giảm sảt định kỳ chức nãng gan cả theo dõi lâm
sâng vả cận lâm sảng sau ít nhất 6 tháng sau khi dừng trị liệu viêm gan B. Nếu thích hợp, bắt
đầu sử dụng lại trị liệu viêm gan B có thế được đảm bảo. Ó bệnh nhân bệnh gan tiên triển
hoặc xơ gan, không khuyến cảơ dứng diếu trị vì đợt kịch phảt viêm gan sau điều trị có thể
dẫn đến gan mất bù.
Triệu chứng trên gan đột ngột trầm trọng thường là đặc biệt trầm trọng, và đôi khi tử vong ở
bệnh nhân có bệnh gan mất bù.
Nhiễm đồng thời viêm gan C hoặc D ~
Không có dữ liệu trên hiệu lực cùa tenofovir ở bệnh nhân nhiêm đồng thời virus gây viêm
gan C hoặc D.
Nhiễm đồng thời vói HỊV- lvả viêm gan B
Vi nguy cơ phảt triến đề khảng HIV, chỉ nên sử dụng tenofovir disoproxil fumarate như lá
thảnh phần cùa một phác đồ phối hợp kháng retrovirus thích hợp ở bệnh nhãn nhiễm đồng
thời HIV/HBV. Bệnh nhân đã có sẵn, bất thường chức năng gan gồm viêm gan hoạt động
mãn tính, tăng tần suất bất thương chức nãng gan trong khi trị liệu khảng retrovirus phối hợp
và nên giảm sải các bệnh nhân nảy theo thực hảnh chuẩn. Nếu có bằng chứng bệnh gan xâu
đi ở cảc bệnh nhãn nảy, nên cân nhắc tạm dứng điếu trị hoặc dứng điếu trị hằn. Tuy nhiên,
nên lưu ý rằng tăng ALT có thể là thảnh phần cùa thanh thải HBV trong khi trị liệu với
tenofovir (xem Đợt kịch phát viêm gan).
Thực hiện kỉềm tra khảng thế HIV—l cho tắt cả bệnh nhân nhiễm HBV trước 14%) trong 48 tuần Trong 28 người dùng tenofovir trong 96
tuần, Z- -scores giảm -0, 341 đối với cột sông thẳt lưng và -0, 458 đối với toản thân Sự phảt
triến khung xương (chiếu cao) dường như không bị ảnh hướng Chi dẳu cùa tải cắu trúc
xương ở bệnh nhi được điều trị với tenofovir từ 12 tuồi trở lên gợi ý tăng tái cấu trúc xương,
phù hợp với tảc động đã được quan sảt ở người trường thảnh. p"?
Không biết sự tảc động của sự thay dối liên quan đến tenofoviMe BMD vả chỉ đấu Sinh hóa
trên thế chắt xương và tinh trạng găy xương trong tương lai.
Các trường hợp nhuyễn xương (liên quan với bệnh ống thận gần vả có thể góp phần vảo sự
gãy xương) đã được bảo cáo là có liên quan đến việc sử dụng tenofovir (xem TÁC DỤNG
KHÔNG MONG MUÔN)
Tác động trên xương cùa tenofovir chưa được nghiên cứu ở các bệnh nhân nhiễm HBV mản
tinh.
Hoại từ xương
Mặc dù nguyên nhân được cho là gồm nhiếu yểu tố (gồm việc sử dụng corticosteroid dùng
rượu, bị ức chế miễn dịch trầm trọng, chí số khối cơ thể cao), cảc trường họp hoại từ xương
đã được báo cảo đặc biệt ở bệnh nhân bệnh HIV tiến trìền vảlhoặc phơi nhiễm lâu dải với trị
liệu khảng retrovirus phối hợp (CART). Khuyên bệnh nhân đi khảm bệnh nếu họ bị đau và
nhức khớp, sưng khớp hoặc khó di chuyền.
7/27
Tâi phin bố mớ
Ồ bệnh nhản nhiễm HIV tải phân bốltich lũy mỡ trong cơ thể gổm tích tụ mở ở bụng, phi đại
phấn cổ—iưng (bướu trâu), tay chân khẳng khiu, mặt hốc hác. n ực to, vá “biếu hiện cushing"
đã được báo cáo ở bệnh nhân đùng trị lỉệu kháng retrovirus ph i hợp. Cơ chế vá hậu quả lãu
dải của các biến cố nây hỉện tại khỏng được bỉểt. Mồi liên hệ nhân quả chưa được thiết lặp.
Hội chửng tái lặp miến địch
Hội chứng tái 1ặp miễn dịch đã được báo cảo ở bệnh nhân nhiễm HIV được điều trị với trị
liệu kháng retrovirus phối hợp, ồm tcnofovir. Trong thời kỳ khời đầu điều trị kháng
retrovirus phối hợp. sự đáp ứng miễn dich của bệnh nhân có thể phát triển một đáp ửng viêm
khỏng đau hoặc nhiễm trùng cơ hội tiếm ấn [như nhiễm Mycobacteríum avium.
cytomcgalovirus, viêm phổi do Pneumocystis jirovecil (PCP), hoặc nhỉễm Iao], có thể cần
thiềt đánh giá và điều trị sâu hơn.
Thất bại với tri lỉện khâng virus giai đ n sớm
Các n hiên cứu lâm sảng ở bệnh nhán nhiem HIV chứng minh râng phác dồ chi chứa ba chất
ửc chẵmen phiến mã ngược ('NRTI) thông thường ít hiệu quả hon phác đồ ba thuốc chứa hai
NRTIs phối hợp hoặc với một chất ức chế men phiến mã ngược không phải nucleoside hoặc
vởi một chẩt ức chế protcasc l-1lV-I. Đậc biệt. thất bẹỉ với trị liệu kháng virus giai đoạn sớm
vả u lệ cao ca'c gốc mẻ dẻ khảng as được báo cáo. Vi vặy, nên sử đụng thặn trọng phảc đồ ba
thuốc. Bệnh nhân đang được điểu trị sử dụng một phảc đồ ba thuốc nucleoside nên được
giảm sát chặt chẽ vả cân nhắc thay đổi điều ui.
K
Rối Ioụn chửc niing ty thế /
Các đồng đảng nucleoside vá nucleotide dã được chứng inh in vừro và in vìvo gây tồn
thưong ty thể với mửc độ khác nhau. Có các báo các rối Ioạn chức năng ty thể ở trẻ cm âm
tính với HIV phơi nhiễm các đồng đắng nucleoside tmng tử cung in mam vả/hoặc sau khi
sinh. Các tác dụng phụ chinh đi được báo các lá rổi loạn huyết học (thiếu máu, giảm bạch
cẩu trung tính). rối Ioạn chuyến hóa (táng lactate huyết, tãng lipase huyết). Cảc tảc dụng phụ
náy thường lù tụm thời. Một số rổi Ioạn thẩn kình khời phát muộn ơă được báo các (tảng
trương lực, co giặt, bất thường cách cư xử). Hiện tại khòng biểt các rổỉ loạn thần kinh ná lả
thoáng qua hay lâu dâi. Bất kỳ trẻ em nâo phơi nhiễm từ trong tử cung in utero với các đong
đẳng nucleoside vả nucleotide, ngay cả trẻ ãm tinh với HIV, nén được theo dõi lâm sảng vả
xẻt n hiệm cặn lâm sảng vá nén được nghiên cứu đẩy đủ về khả nâng gáy rối loạn chức nãng
ty thề trong trường hợp có các đấu hiệu vả triệu chửng tương quan. Các biều hiện nùy không
ánh hưởng đến câc khuyến cảơ quốc gia hiện tại khi sử dụng trị liệu kháng retrovirus ở phụ
nữ có thai để dự phòng sự truyền HIV theo chiều thằng đứng.
Tủc động trên khi ning lâi xe vả vặn hânh miy mỏc
Không có các nghiên cứu về tác động trẻn khả nãng lái xe vá vận hảnh máy móc. Tuy nhỉên,
bệnh nhân nên được thông báo rằng choáng vảng đã được báo cáo trong khi điều trị với
tcnofovir disopmxil fumarate.
Viên min ngvtn chứa Iactosc vả vi vặy không nên sử dụng cho bệnh nhãn có các vấn aè di
truyên về bât dung nạp gaiactosc. thiếu mcn Lapp lnctasc hoặc kẻm hấp thu glucose-
gaiactose.
TƯONG TÁC muơc²
Các nghiên cứu tương tác thuốc chỉ được bảo cảo ở người trướng thânh.
8/27
Dựa vảo các kết quả thử nghiệm in vitro vả đường đảo thái đã được biết của tcnofovir, khả
năng tương tác qua tmng gian CYP450 gồm cả tenofovir với các thuốc khác lả thấp.
Sử dụng dống thởt' khỏng đuợc khiợến cảo:
Không dùng tcnofovir với bất kỳ thuốc nảo chứa tcnofovỉr disoproxil rummte.
Khỏng đùng tenofovir đồng thời với adet'ovir dipivoxil.
Didanosine: Không khuyến cáo sử dụng đỏng thời tcnoi'ovir disoproxil fumarate vả
didanosine (xem Bảng bẻn dưới).
Các rhuốc dm dảo thái qua mạ… Vi tenofovir được đâo thâi chủ yểu bới thặn. sử đụng
đồng thời tenofovir disoproxil fumaratc với các thuốc lâm giâm chửc nãng thận hoặc cạnh
tranh trên sự tiết chủ động qua ống thận thông qua protein vận chuyến hOAT 1, hOAT 3
hoặc MRP 4 (như cidofovir) có thế iâm tăng nỏng độ huyết thanh của tenofovir vảth các
thuốc dùng đồng thời.
Nên trânh sử dụng đồng thời hoặc gẩn đây có sử dụng thuốc gây độc thận kèm với tcnofovir
đisoproxil fumaratc. Một số vi đụ gồm. nhưng không có giới hạn, aminoglycosidcs.
amphotericin B. foscamct, ganciclovir, pentamidine, vnncomycỉn. cidofovir hoặc intericukin—
2 (xem ciưva BÁO VÀ THẶN TRỌNG).
Tacrolimus có thể ánh hưởng chức năng diện, khuyến cáo giảm sảt chặt chế khi được dùng
đồng thời với tcnofovir disoproxil fumaratc.
Các mưng rác khảc:
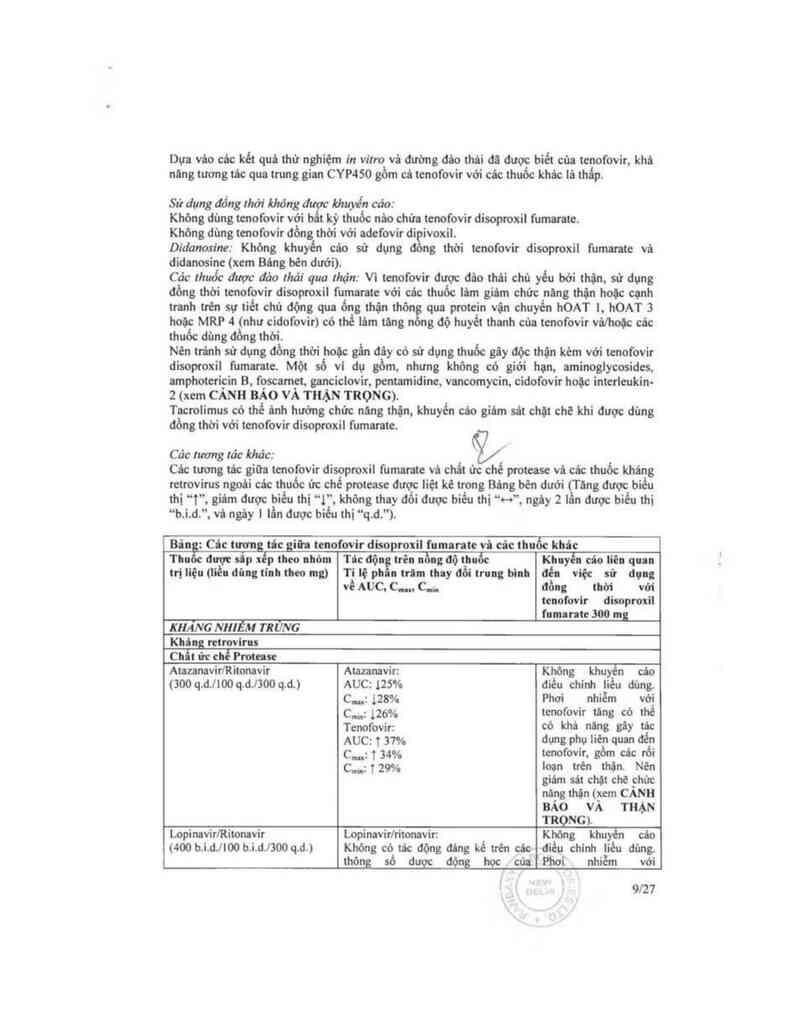
Các tương tác giữa tenofovir disoproxil fumaratc vả chất ửc chế proteasc vù các thuốc khảng
retrovirus ngoâi các thuốc ức chế pmtcasc được liệt kê trong Báng bèn dưới (Tãng được biếu
thi “t". giảm được biểu thi “1”, không thay đổi được biểu thị —…—, ngèy z lằn được biểu thị
“b.i.d.". vả ngáy ] lần được biểu thị “q.d.“).
Bân : Cớc tương tủc giữ: tenofovir disoproxil fumarate vi câc thuốc khâc
Thu được sip xếp theo nhỏm Tic độn trên nồng độ thuốc Khuyến cảo liên quan
trị liệu (liền dùng tilh theo mg) Tỉ lệ phia trint thay đổi trung binh đến việc sử dụng
về AUC, c.... c., đồng um với
tenofovir disoproxil
l'umnrnte 300 mg
KHĂNG NHIỂM TRUNG
Khing retrovirus
Chít ức chế Proteue
AtazanavirlRitonavir Atamnavir: Khỏng khuyên cão
(300 q.d.llOOq.đ.l3OO q.d.) AUC: tzsv. điều chỉnh liều dùng.
c...,: 128% Phơi nhiễm vởị
c…; lzóoỵ, tenofovir tãng có thẻ
Tenofovir. CÓ khẺ HẮnS gây lệC
AUC: t 37% dụng phụ liên quan den
c_; 1 uy, tcnofovir, gồm các rổi
C…: T 29% loạn trèn thận. Nén
giảm sảt chặt chẽ chủc
năng thận (xem CANH
BẢO VÀ THẶN
TRỌNG).
LopìnavirlRỉtonavir Lopỉnavirlritonavir: Khỏng khuyên cáo
(400 b.ì.d.llOO b.i.ơJaoo q.d.) Không có tảc động đáng kể tren cảc điều chinh iiều dùng.
thông số dược động hợc của Phơi nhiẻm với
9l27
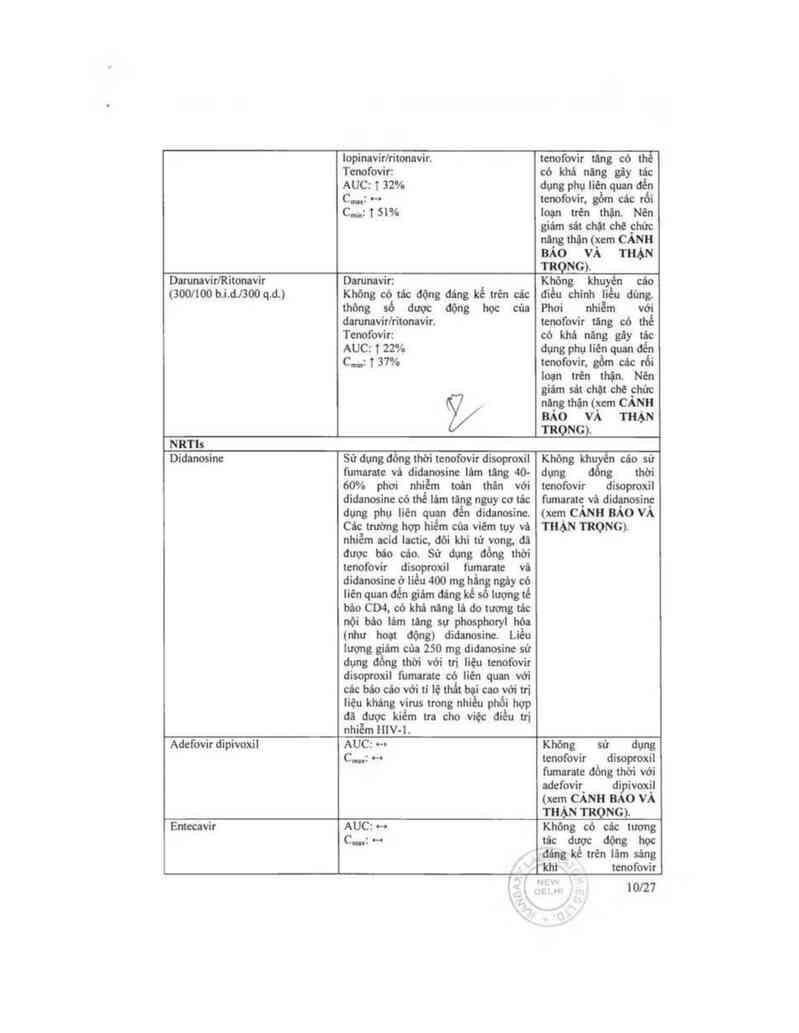
lopinnvirlritonavir.
Tcnofovỉr:
AUC: 1 32%
C…: …
C…: 151%
tcnofovir tăng có thẻ
có khá ning gãy tác
đụng phụ Iién quan đến
tenofovir. gồm các rối
loạn trên thận. Nén
giám sát chặt chẽ chửc
nảngthận(xem CẢNH
BẢO vÀ THẶN
TRỌNG).
Damnavìr/Rỉtonavir
(3001100 b.i.dJ300 q.d.)
Dantnavir:
Không có tác động đáng kế trén các
thõng số dược động học của
damnavirlritonavir.
Tenofovir:
AUC: T 22%
C…: T 37°Ío
%
Khõng khuyến cảơ
đỉều chinh liều dùng.
Phơi nhiễm với
tenofovir tăng có thể
có khá nãng gây tảc
dt…s Phụ lien quan đến
tcnofovit. gồm các rới
loạn ttẽn thận Nên
giám sát chặt chẽ chủc
nãng thặn (xem CẢNH
BẨO vA Tl-IẶN
TRỌNG).
NRTls
Didanosine
Sử dụng đỏng thời tcnofovir dìsoptoxii
fumaratc vả didanosinc lâm tãng 40-
60% phơi nhiễm toén thân với
didanosinc có thề lim tăng nguy cơ tác
dụng phụ liên quan đển didanosine.
Cảc trường hợp hiếm của viếm tụy vá
nhiễm acid lnctic. đới khi tử vong, đi
được bâo cáo. Sử dụng đống thời
tenofovir disoproxil fuv_nmtc vù
đidancsinc ở liều 400 mg hãn ngảy có
liên quan đển giim đáng kể Iuợng tế
bảo CD4, có khi nâng lá do tương tác
nội bảo lâm ting sự phosphoryl hóa
(như hoạt động) didanosin Liều
lượng giâm của 250 mg didanosinc sử
dụng đồng thời với trị liệu tcnofovit
disoproxil fumarate có Iiẽn quan với
cácbáocảovớitỉlệthấtbạicaovớitri
liệu khảng virus trong nhiều phới hợp
đã được kiếm tra cho việc điếu tri
nhiềm HIV—l.
Khõng khu n các sử
dụng ng thời
tcnofovir disoproxi1
fumaratg vả didanosỉn_c
240 mgdL) 19% 40%
12/27
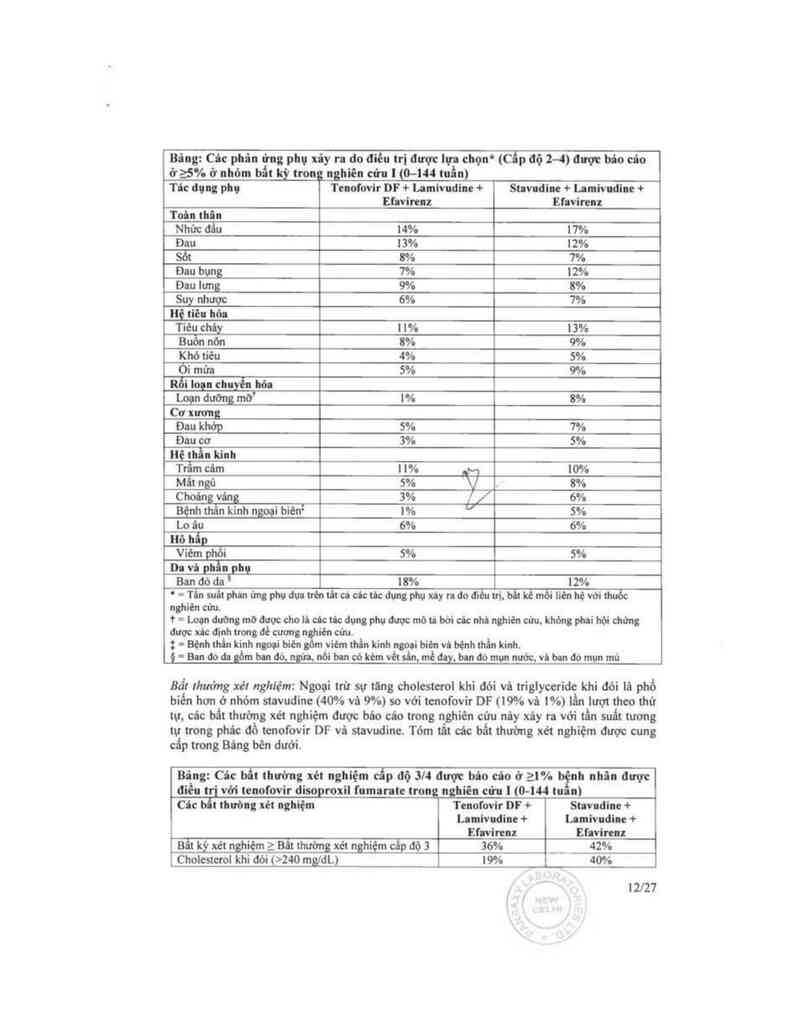
Bậng: Các bẩt thường xét nghiệm cấp độ 3/4 được báo cáo ở 21% bệnh nhãn được
điêu trị với tenofovir disoproin fumarate trong nghiên cứu ] (0—144 tuần)
Các hẫt thường xẻt nghiệm Tcnoi'ovir DF + Stavudine +
Lamivudinc + Lamivudine +
Efavỉrenz Efavirenz
Creatine Kinase (M: >990 U/L; F: >845 UlL) 12% 12%
Amy1ase huyêt thanh (>175 UlL) 9% 8%
AST (M: >180 UÍL; F: >170 UlL) 5% 7%
ALT (M: >215 UIL; F: >170 U/L) 4% 5%
Huyết niệu (>100 RBC/HPF) 7% 7%
Bạch câu trung tinh (<750/mm’) 3% 1%
'I`riglyceride khi dỏi (>750 mg/dL) 1% 9%
Nghiên cứu 11 đã dược báo cảơ — Cảc tác dụng phụ xảy ra do diếu trị: Trong một nghiên cứu
11 đã được bảo cáo, 511 bệnh nhân trước đây chưa được điều trị hoặc với tenofovir DF +
emtricỉtabine phối hợp với efavirenz hoặc zidovudỉncllamivudine được dùng phối hợp với
efavirenz. Cảc tác dụng phụ được báo cảơ trong nghiên cứu nảy thường phù hợp với các tác
dụng phụ được báo cảơ trong các nghiên cứu trước đây ở bệnh nhân trước đây chưa được
điều trị hoặc đã được điều trị (xem bảng bên duới).
Bãng: Cảc tâc dụng phụ xậy ra do đĩếu trị được lựa chọn*(cặp độ 2-4) được báo cáo ở
25% trong bất kỳ nhỏm điêu trị trong nghiên cứu II (0-144 tuãni
Tảc đụng phụ Te›nofovirÝ + Zidovudine/Lamìvudine
Emtricitabine + + Efavirenz
Efavirenz
.Rội'lQạnégfẻậỵziiộf. __ …
Tiêu chảy FU , 9% 5%
Buổn nôn Ỉ`,/ 9% 7%
Oi mủ*a V 2% _ 5%
Rỏi Ioạn toản thân và tình trạng tại nơi dùng Ihuỏc ,
Mệt mòi 9% i 8%
Nhiễm khuân vả nhìẻm ký sinh Irìmg '
Viêm xoang 8% 4%
Nhiêm trùng dường hô hâp trên 8% 5%
Viêm mủi họng 5% 3%
Ro'ì loạn hẹ” thẫn kinh
Nhức đâu 6% 5%
Choáng vảng 8% 7%
Rối Ioạn tâm thần
Trâm cảm 9% 7%
Mất ngủ 5% 7%
Rồi loạn da và mỏ dưới da
Ban đò dat 7% 9%
* = Tẩn suất của cảc tảo dụng phụ dựa vảo các tảc dụng phụ xáy ra do diều trị, bảt kê môi liên hệ với thuốc
nghiên cứu.
† = Từ các tuần 96 đến 144 của nghiên cứu, bệnh nhân dùng công thức phối hợp cố định liều cùa cmtricitabinc
— tenofovir DF kèm efavirenz thay cho tcnofovir + cmtricitabine kèm efavirenz.
I = Ban đỏ da gồm ban đỏ da tróc vảy, ban đỏ toản thân, vết ban đò, nổi ban kẻm dảt sần, ban đỏ ngứa vả ban
đỏ mụn nước.
13/27
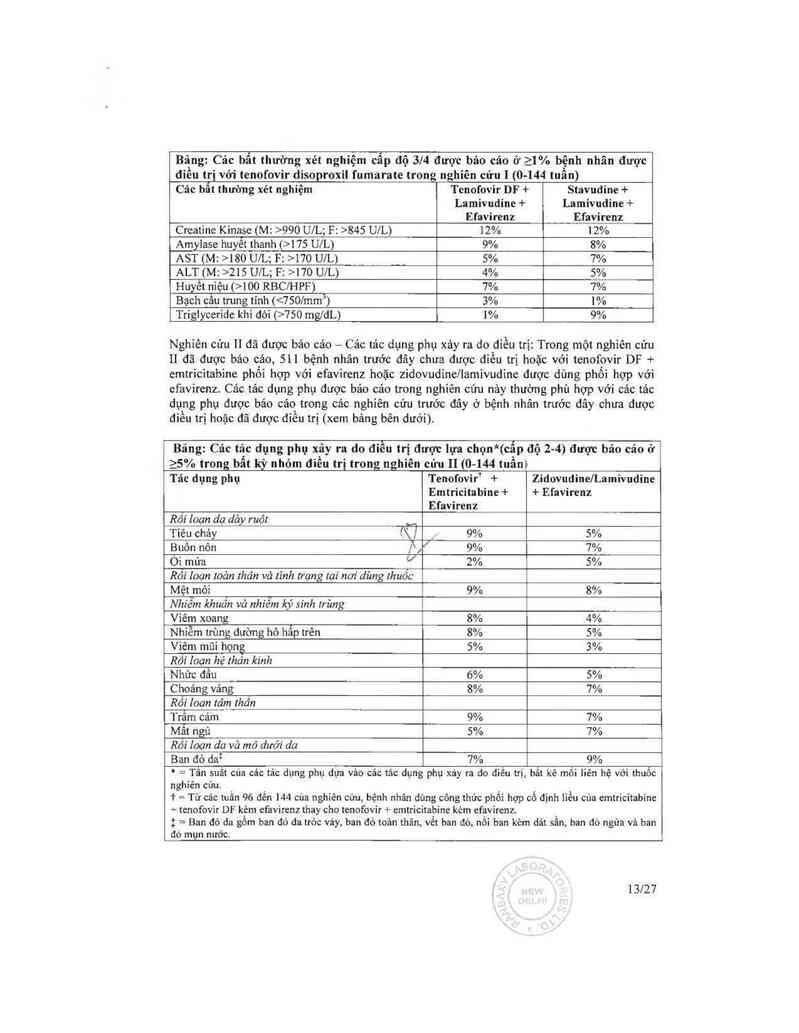
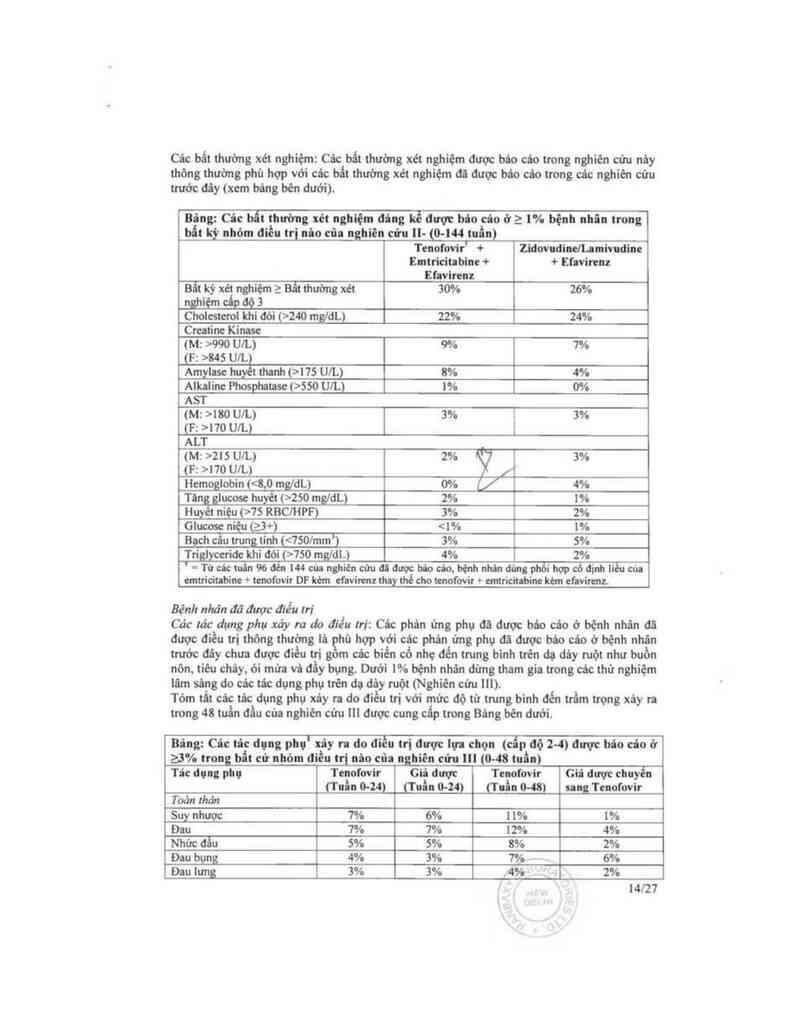
Các bất thường xét nghiệm: Các bất thường xét nghiệm được báo cáo tmng nghiên cứu nảy
thòng thường phù hợp với các bất thường xét nghiệm đã được háo cáo trong các nghiến cứu
trước đãy (xem bđng bẽn đưới).
Bing: Củc bắt thường xét nghiệm đủng kế được báo của ở a 1% bệnh nhin trong
bất kỳ him… ơièu tri nho cũa nghiên cứu ll— (o.… tnần)
Tenofovir' + Zidovndildanindint
Emtricitabine + + Ehvitcnz
Ehvirenz
Bẩt kỳ xét nghiệm z Bất thường xét 30% 26%
_nghiệm dp oọ 3
Choicsteml khi đói (>240 mg/dL) 22% 24%
Cmatinc Kinasc
( M: >990 UlL) 9% 7%
(F: >845 UlL)
Amylase huỵềt thanh (>i75 UlL) 8% 4%
Alkaiinc Phosphatasc (>550 UlL) 1% 0%
AST
( M: >180 UlL) 3% 3%
(F: >170 UỆL
ALT
(M: >215 un.) 2% ý 3%
(F: ›no UlL) /
Hemoglobin (<8,0 mgỊdL) 0% V 4%
Tin lumsc huyêt (>250 mg/dL) 2% 1%
Huyet niệu (>75 RBCJHPF) 3% 2%
Glucosc niệu (z3+) <1% 1%
Bạch cầu ưung tinh (750 mgil.) 4% 2%
= Tử etc iutn 96 đùi … của nghiên cứu ai được hùo cto. bệnh nhin đủng phỏỉ họp có đinh liều cù:
cmtricittbinc + tcnol'ovit DF kèm cfwircnz thuy thể cho tenofovir + cmtriciuhine kèm efaviran
Bệnh nhãn đã đuợc điếu m“ _
Cảc rác dụng phụ xáy ra do đìẻu tri: Các phản ứng phụ đã được báo cảo ờ bệnh nhân đã
được điểu trị thông thường lả hủ hợp với các phán ứng phụ đã được báo cáo ở bệnh nhân
trước đây chưa được điều trị gẵm các biến cố nhẹ đến tmng binh trên đa đây một như buồn
nôn, tiêu cháy. ói mửa vả đầy bụng. Dưới 1% bệnh nhân đừng tham gìn trong các thử nghiệm
lâm sâng do các tác dụng phụ trên da đèy ruột (Nghiên cửu 111).
Tóm tắt các tác dụng phụ xảy ra do điều trị với mức độ từ tmng binh đển ưẩm trọng xảy ra
trong 48 tuẵn ai… của nghiên cửu … được cưng cấp trong Báng bẽn dưới.
Bing: Cic tâc dụng phụ' xây ra đo điều trị được lưu chọn (cẩp độ 2~4) được bio cio ở
23% trong bất cứ nhỏln điều trị nâo cũa nghiên cửu … (0—48 tuân)
Tic dưư PM Tmofovir Giả dược Tenofovir Glâ được chưyên
(Tnần 0-24) (Tnẩn 0-24) Q'ưổn 0—48) sang Tenofovir
Toản Ihản
Suy nhược 7% 6% 11% 1%
Đau 7% 7% 12% 4%
Nhức đẫu 5% 5% 8% 2%
Đau bụng 4% 3% 7% 6%
Đi… lưng 3% 3% 4% _ 2%
14Í27
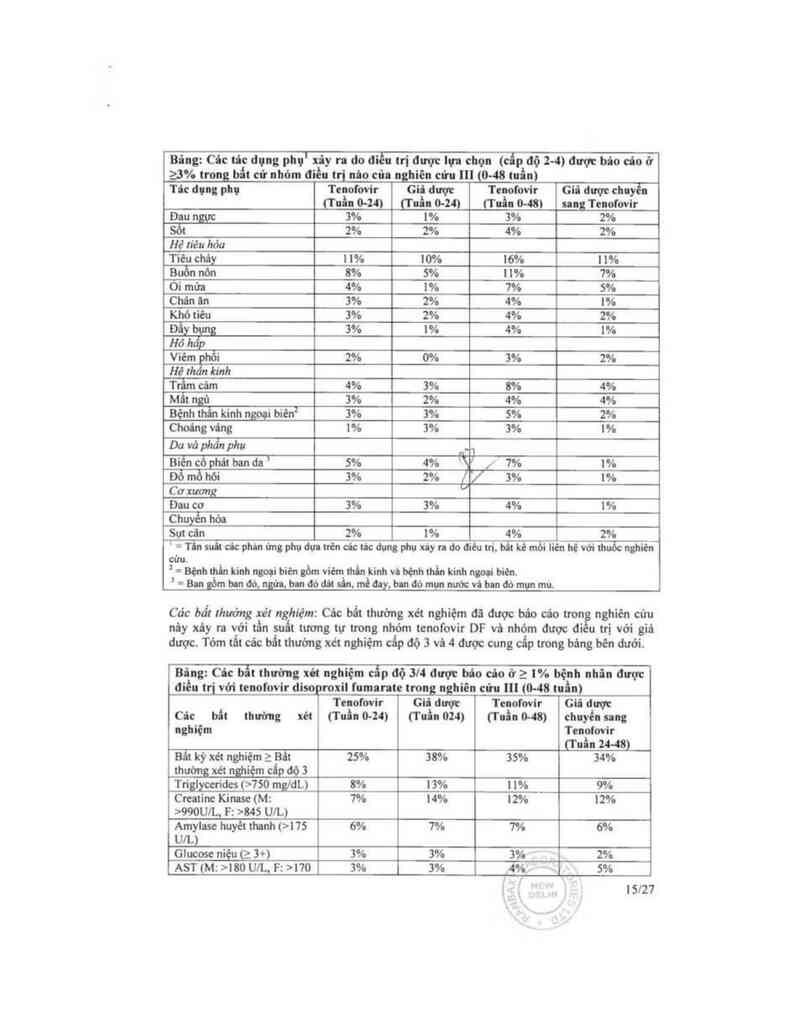
Bâng: Củc … dụng phụ’ xiy … đo điều iri dượt lụa chọn idp độ z—4) am bảo củo ở
2,3% trong bẩt cứ nhỏm điều ttịi nùo cũa nghiên cửu 11! (0-48 tưìn)
Tđc đụng phụ Tcnofovir Giả được Tcnoíovỉr Giữ được chnyễĨ
(Tuần o-ui cruin 0-24) mủ: mi mg Tenofơvỉr
Đau n 3% 1% 3% 2%
Ễt 2% 2% 4% 2%
Hệ riêu hỏa
Tiêuchây 11% 10% 16% 11%
Buồn nớn 8% 5% 11% 7%
Òi mửa 4% 1% 1% 5%
Chán hn 3% 2% 4% 1%
Khó tiêu 3% 2% 4% 2%
Đầy bụng 3% 1% 4% 1%
Hô hăp
Viêm phồi 2% 0% 3% 2%
Hệ thần kinh
Trầm cảm 4% 3% 8% 4%
Mất ngủ 3% 2% 4% 4%
Bệnh thẩn kinh ngoLihien² 3% 3% 5% 2%
Choáng víng 1% 3% 3% 1%
Do vỏ phăn phụ nc1
Biên cỗ phát ban da 1 5% 4% ` ’ / 7% 1%
Đồ mồ hõi 3% 2% 3% 1%
Cơ xuong
Đau co 3% 3% 4% 1%
Chuyến hóa
Sụt cân 2% 1% 4% 2%
' =Tlnsuilcảcphl'nứngphụđmtửncảcticdụngphụúyrldođlêưưi.bitkèmỏi liẻnhệvớithuổcnghỉên
cửu,
² = Bệnhthẫnkinh ngoại hiên gồm viẽmthỗnkinh vùbệnhthến kinh ngoci hien.
’=Blligồmbnnđờ.tgứn,bmđớdildn,mềđny.banđómmnướcvihcnđòmụnmú.
Các bất Ihuỏng xét nghíẻm: Các bất thường xẻt nghiệm đã được bảo cảo trong nghiên cứu
nây xây ra với tẩn suất tương tự tmng nhóm tcnofovir DF vè nhớm được đi u trị với giả
dược. Tỏm tãt các bất thường xẻt nghiệm cắp độ 3 vá 4 được cưng cấp trong bảng bên dưới.
Bing: Các bẩt thường xớt nghiệm cổp độ 3l4 được bio cio ở 2 1% bệnh nhân được
điều trị vởi tcnofovir disc roxil fumaratc tromghiẽn cứu 11] (0—48 tưẦn)
Tcnofovir Gii dược Tcnofovir Giả dược
Câc bất thường xẻt (Tuấn o—z4i cruin ou) mìn 0-48) chưyễn ang
nghiệm Tenonir
mủ u-m
Bất kỳ xẻt nghiệm z Bất 25% 38% 35% 34%
thường xét nghiệm cẩp độ 3
Triglỵccridcs (>750 mgldL) 8% 13% 1 1% 9%
Cmtinc Kimse (M: 7% 14% 12% 12%
>990U1L. F: >845 UlL)
Amylnsc huyểt thanh (>175 6% 7% 7% 6%
UlL)
Glucose niệu (2 3+) 3% 3% 3% 2%
AST (M: >180 UIL, F: >170 3% 3% 4%… x 5%
1, 1sm
`_.
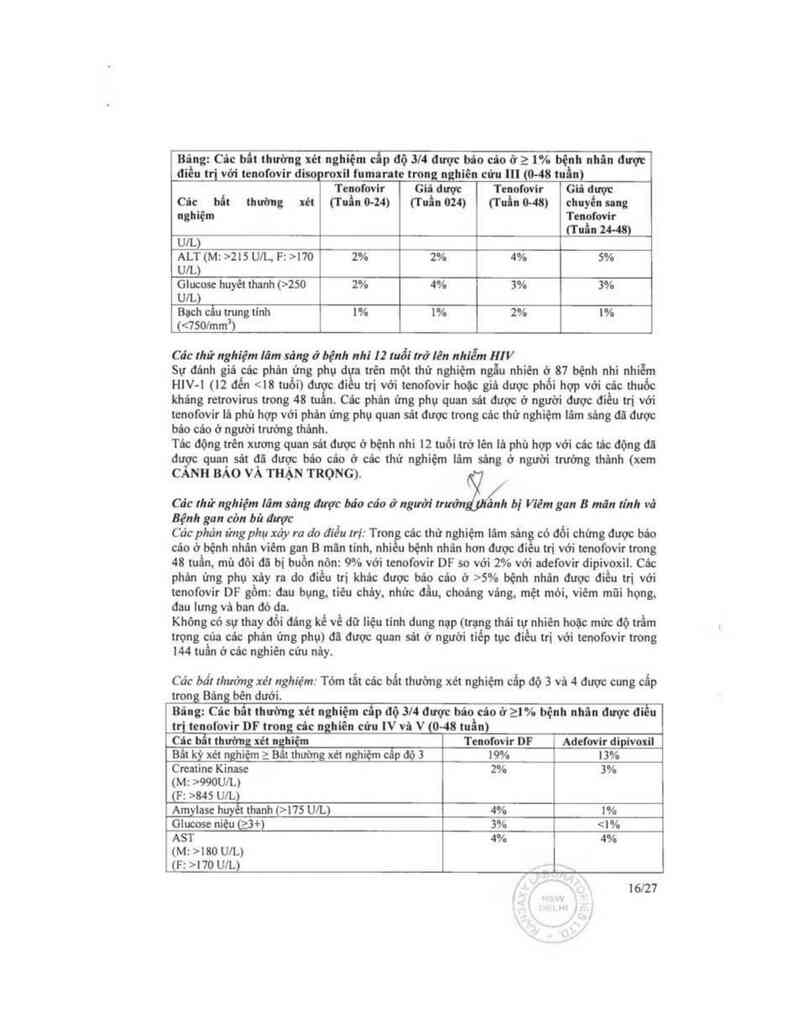
Bing: Cic bất thường xẻt hghiẹm c£p độ 3/4 được bủo củo ở a 1% bệnh nhin được
điều trị vởi tcnofovir điso roin fumaratc tronmhièn cứu … io-4s min)
Tcnofovỉr Giỏ được Tcnofovir Giả được
Các hit thường xét iTuin o-z4i mủ: om ư… o-m chnyễn ung
nghỉệm Tcnol'ơvir
(T nấu 24-48)
un.)
ALT(Mz>215 un… F:>170 2% 2% 4% 3%
UlL)
Glucosc huyềt thanh i›zso 2% 4% 3% 3%
UlL)
Boch cầu trung tính 1% 1% 2% 1%
<<7501mm’1
Các !hữ nghiệm lâm sđng ở bệnh nhi 12 ruổi trở lên nhiễm mv
Sự đánh giá cảc phán ứng phụ đ trên một thử nghiệm ngẫu nhiến ờ 87 bệnh nhi nhiễm
111v-1 112 đến <18 tuồi) ơưỵẹ đi u ui với tenofovir hoạc giả dược phổi hợp với cảc thuốc
khảng retrovirus trong 48 tuan. Các phân ứng phụ quan sát được ờ người được điều trị vời
tenofovir lù phù hợp với phân ứng phụ quan sát được tmng các thử nghiệm iâm sảng đă được
bảo cáo ở người trường thânh.
Tác động trên xương quan sát được ở bệnh nhi 12 tuổi trở lèn iá phù hợp với các tác động đã
được quan sát đã được bảo cáo ở cảc thử nghiệm lám sâng ở người trướng thảnh (xem
cÀnu BẢO VÀ THẬN TRỌNG).
Cảc lhữ nghiệm lâm sảng được bảo cản ở người truth: 'dílt bị Vìêm gan B mãn lỉnh vù
Bệnh gan còn bù dược
Các phản ửng phụ xáy m do điều mx- Trong cảc thử nghiệm lâm sâng có đồi chứng được báo
câo ở bệnh nhân viêm gan B mãn tinh. nhiều bệnh nhân hon được đicu trị với tcnofovir trong
48 tuần, mù đôi đã bị buồn nôn: 9% với tcnofovir DF so với 2% với adcfovir dipivoxil. Các
phán ứng phụ xây ra do điều trị khác được báo cáo ờ >5% bệnh nhân được điều trị với
tcnofovir DF gồm: đau bụng, tiêu chây, nhức đầu, choáng váng. mệt mòi. viêm mũi họng,
đau lưng vả ban đỏ da.
Không có sự thay đổi đáng kể về đủ liệu tỉnh dung nạp (trạng thái tự nhiên hoặc mức độ trầm
trọng cùa các phản ửng phụ) đã được quan sát ở ngưới tiếp tục điều trì với tcnofovir trong
144 tuần ờ các nghiên cứu nảy.
Các bất thường xét nghiệm: Tòm tắt các bất thường xẻt nghiệm cấp độ 3 và 4 đuợc cung cắp
tro_ng Bùngbên dưới.
Bâng: Cic bẫt thường xét nghiệm cẩp độ 3/4 được bảo cáo ở 21 % bệnh nhân được điểu
tri tenofovir DF trong câc nghiên cửu IV vi VJO—48 tuẩn)
Cic bẫt thường xét nghiệm Tcnofovir DF Adefovir dipivoxil
Bất kỳ xẻt nghiẹm z Bât thường xét nghiệm câp độ 3 19% 13%
Cmaiine Kinase 2% 3%
(M: >990UiL)
(F: >845 Ule
Amylasc huyẵhanh (>175 UlL) 4% 1%
Glucosc niệu (;3+) 3% 180 UlL)
(F: >170 UlL)
ALT 10% 6%
(M: ›215 U/L)
ư: ›no UlL) 1
T1 lệ tohn thế về tãng ALT khi điêu trị (được đinh nghĩa lù ALT huyểt thanh >2 lẫn mức cơ
bản vá >10 lẩn giới hạn trẽn của mức binh thường (ULN), kèm hoặc khỏng kèm cảc triệu
chứng có liên quan) lù tương tư giữa tcnofovir DF (2,6%) vá adcfovir dipivoxil (2%). Tảng
ALT bùng phát thộng thường xảy ra trong vờng 4—8 tuần đầu điều trị vả có kèm giảm nồng
dộ HBV DNA. Khòng có bệnh nhản có bằng chứng của mất bù gan. Tttng ALT bùng phát
điền hinh được hồi phục trong vòng 4 đến 8 tuần mã không thay đổi thuốc nghiên cứu.
Thử nghiệm Iđm sảng đã duvc bảo cáo ở người truỡng lhảnh bi Vlẽm gan B mđn linh vả
Bệnh gan mất bù
Trong một thử nghiệm có đối chửng chủ động, mù đỏi, ngẫu nhiên đã được báo cáo. bệnh
nhân có Bệnh viêm gan 13 mãn tính vả bệnh gan mẳt bù được điều tti với tcnofovir hoặc các
thuốc kháng retrovirus khác lên đển 48 tuần. Trong số 45 người đùng tcnofovir, các phản ứng
phụ xảy ra do điều trị được báo cáo thường xuyên nhất với bẩt kỳ mức độ trầm trọng lá đau
bụng (22%), buồn nôn (20%). mất ngủ (18%), ngứa (16%), ỏi mửa (13%), choáng váng
t13%), vit sốt u 1%1. Hai trong số 45 (4%) người tử vong trong suốt tttẳn 48 của nghiên cửu
do ticn triến cùa bệnh gan. Ba trong số 45 (7%) người dừng diều tti do tác dụng phụ. Bốn
tton số 45 iọ%i người tãng creatinine huyết thanh o,s mgldL (! người cũng có phosphorus
huy t thanh < 2mgjdL trong tuần 48). Ba trong số những người nảy (mỗi người trong số nảy
có điểm Chỉ1d-Pugh ; … vit điếm MELD a 14 khi khời đẩu) phit triển suy chức nảng thận.
Vì cá tcnofovir vả hệnh gan mất bù có thế có một tậc độnửén chức nâng thận, sự gỏp phần
của tcnofovir vảo suy chức năng thận trong nhỏm đòi t uẩy lả rẩt khó để xác đinh.
Một trong 45 người bị bệnh gnn bùng phát khi điều trị tro nghỉên cứu 48 tuần.
Kinh nghiệm hộu tiểp thi: Các phản ứng phụ sau đây được phát hiện sau khi tcnot'ovỉr DF
dược phê duyệt sử dụng. Vì các phản ứng phụ hậu tiếp thì được báo cáo một cách tự phát từ
một đối tượng không rõ cớ mẫu, nó khỏng phái luộn iuõn đánh giá tẩn suất đáng tin cậy hoặc
thíết lặp mối liẽn hệ nguyên nhân với sự phơi nhiễm thuốc.
Rối Ioạn hệ míễn dich: phán ứng đị ứng ồm phù mạch
Rối Ioạn chuyến hóa vả dinh duỡng: nhi … acid lactic, hạ kali huyết, hạ phosphate huyết
Rối !oọn hô hốp, tuyển ức vả hệ trung thất: khó thờ
Rối Ioạn dạ dảy ruột: viêm tụy, tãng amylase, đau bụng
Rối Ioạn gan mát: gan nhiễm mỡ, viêm gan, tãng mcn gan (thường 1ả AST, ALT, gamma
GT)
Rối !oạn da vả mỏ duởi' da: phát ban
Rối loạn cơ xuơng vả mỏ liẻn kết: tiêu cơ vân. nhuyễn xương (biếu hiện bời đau xương vả có
thể gỏp phẳn vèo gãy xương), yểu cơ, bệnh cơ
Rối“ Ioạn fhản vả niệu: suy thận cấp, suy thận, hoại tử ống thặn cấp tinh. hội chửng Fanconi,
bệnh ống thận gần, viêm thặn kẽ (gồm các trường hợp cẳp tinh). đái tháo đường do thận giảm
đáp ứng nồng độ vnsoprcssin binh thường. giảm chức nâng thặn, tăng creatinine, protein
niệu, đa niệu
Rồi loạn loản thản vả tình rrợng nơi dùng rhuốc: suy nhược
Cảc phi… ứng phụ sau đây, được liệt kê dưới cảc tiêu đề theo hệ cơ quan ở trên, có thể xây ra
với hệ quả của bệnh ống thận gần: tiêu cơ vãn, nhuyễn xương. hạ kali huyết, yếu co, hệnh co,
hạ phosphate huyết.
17l'27
T11ôNg BÁO CHO BÁC sĩ CÁC TÁC DỤNG KHÔNG MONG MUÔN GẶP PHẨI
KHI su" DỤNG THUỐC.
QUÁ LlỂU'
Đã có kình nghiệm lâm sảng hạn chế ở những liều cao hơn liều trị liệu cùa tenofovir DF 300
mg. Trong nghiên cứu IV, 600 mg tenofovir DF được dùng cho 8 bệnh nhân uống trong 28
ngảy. Không có phản ứng phụ trầm trọng nâo đã được bảo các Không biết cảc tảc động cùa
cảc liếu cao hơn.
Nếu xảy ra quả 1iều, bệnh nhân phải dược giám sát về bằng chứng về ngộ độc, và điều trị hỗ
trợ khi cằn thiết.
Tenofovir được đảo thải hiệu quả bằng thẩm phân mảu với hệ số lọc máu xấp xỉ 4%. Sau liếu
đơn 300mg tenofovir DF, một đợt thẩm phân mảu kéo dải 4 giờ loại bỏ khoảng 10% liếu
dùng tenofovir đã được dùng
ĐẶC TÍNH DƯỢC DỘNG HỌC VÀ DƯỢC LỰC HỌC 1
O Tác động dược lực học
Cơ chế tảc dụng
Tenofovir DF lả một đồng đằng diester phosphonate nucleoside không vờng cùa adenosine
monophosphate. Tcnofovir DF cần sự thùy phân diester ban đầu đề chuyến thảnh tenofovir
và sự phosphoryl theo sau đó bằng cảc mcn tế bâo để tạo thảnh tenofovir diphosphatc, trình
tự kết thủc chuỗi bắt buộc. Tcnofovir diphosphate ức chế hoạt tính cùa men phiên mã ngược
HIV 1 và HBV polymerase bằng cảch cạnh tranh với cơ chất tự nhiên deoxyadenosine 5'-
triphosphatc vả, sau khi sáp nhập vảo DNA, bời trình tự kểt thuc chuỗi DNA Tenofovir
điphosphate là một chất ức chế yếu DNA polymerases ơ, B, ở động vật có vú và DNA
polymerasc y ty lạp thế.
Hoạt tính khảng H] V IÊ/
Hoạ! tính kháng virus
Hoạt tính kháng virus cùa tenofovir trong xét nghiệm cận lâm sảng và ở các chùng phân lập
cùa HIV- 1 đã được đảnh iả ờ cảc dòng nguyên bảo lympho, các tế bảo đơn nhân nguyên
thùyldại thực bảo vả cảc tế bảo lympho trong mảu ngoại biên. Giá trị ECso (nồng độ có hiệu
quả 50%) dối với tenofovir ờ trong khoảng 0 04 ụM đến 8, 5 ụM. Trong các nghiên cứu phối
hợp thuốc cùa tenofovir với các chất ức chế mcn phiên mã ngược nucleoside (abacavir,
didanosine, 1amivudine, stavudine, zalcitabine, zidovudine), cảc chất ức chế men phiên mã
ngược không phâi nucleoside (delavirdine, efavirenz, nevirapine), và các chất ức chế
protease (amprcnavir, indinavir, ncltinavir, ritonavir, saquinavir), bổ sung vảo tác động hiệp
lực đã được quan sảt Tenofovir có hoạt tinh kháng virus ở tế bảo nuôi cây khảng lại cảc Ioải
A, B, C, D, E, F, G, vả O cùa H1V- 1 (giá trị ECso ờtrong khoảng tứ 0, 5 ụM đến 2, 2 pM) vả
chùng có hoạt tinh chuyến biệt khảng HIV-2 (giá trị ECso ở trong khoảng từ 1,6 ụM đến 5,5
ụM),
Đế kháng
Cảo chùng đề kháng HIV 1 giảm. độ nhạy cảm với tenofovir đã được chọn lọc ở tế bảo nuôi
cấy. Cảc virus nảy có một gôc thế K65R ở mcn phiên mã ngược và cho thắy giảm độ nhạy
cảm với tcnofovir 2—4 lẳn.
18/27
Trong nghỉên cứu [ ở bệnh nhân trước đây chưa được điều trị (tenofovir + lamivudine +
efavircnz so vởi stavudine + iamivudine + efavirenz). Cảo nghiên cúu kiểu gen của cảc
chùng phân lặp từ cảc bệnh nhân thất bại với trị liệu khảng virus trong suốt tuần 144 cho thấy
sự phảt triên cảc gốc thể lỉên quan đến để khảng efavirenz vả lamivudine xảy ra thường
xuyên nhất và không có sự khảo biệt giữa cảc nhóm điều trị. Gốc thế K65R xảy ra ở 17% cảc
chùng phân lập bệnh nhân được phân tích ở nhóm điều trị với tenofovir và ở 2/49 (4%) các
chùng phân lặp ở bệnh nhân được phân tích ở nhóm điều trị với stavudine. Trong số 8 bệnh
nhân có virus K65R phát triển ở nhóm tcnofovir trong suốt 144 tuần, 7 trong số nảy xảy ra ở
48 tuần tiên đỉểu trị vả một trường hợp ở tuần 96. Cảo gốc thế khảc cho sự đề kháng với
tenofovir không được phảt hiện trong nghiên cứu nảy.
Trong nghiên cứu 11 ở bệnh nhân trước đây chưa được điếu trị (tenofovir + emtricỉtabine +
efavircnz so với zidovudinc/Iamivudine + cfavircnz), phân tich kiều gen được bảo cáo ở cảc
chủng phãn iập HIV- ] từ cảc bệnh nhân với trị liệu khảng virus với >400 phiên bân/mL của
HIV ] RNA ớ tuần 144 hoặc dừng điểu trị sớm cho thẳy sự phát triến các gốc thế lỉên quan
đến đề khảng với efavirenz xảy ra thường xuyên nhẩt và tương tư giữa cảc nhóm điều trị.
Gốc thế M184V, liên quan đến sự đề khảng với emtricỉtabine vả lamivudine, đã được quan
sảt thấy ở 2/19 cảc chủng phân lập từ bệnh nhân được phân tích ở nhóm tenofovir +
emtricỉtabỉne và ở 10/29 cảc chùng phân lập ở bệnh nhân được phân lập ở nhóm
zidovudine/lamivudine. Trong suốt 144 tuần cùa nghiên cứu 11, không có bệnh nhân nảo có
gốc_thế K65R ở HlV-l được phát hiện như được phân tích trong phân tích kiếu gen tìêu
chuân.
Đế kháng chéo
Để khảng chéo gỉữa một số chất ức chế men phỉên mả ngược nảo đó đã được phát hiện. Gốc
thế K65R được chọn lọc bới tenofovir cũng được chọn lọc ở một số bệnh nhân nhiễm HIV- ]
được điều trị với abacavir, didanosine, hoặc zalcitabine. Cảc chủng phân lập HIV- I với đột
biến nảy cho thấy cũng bị giảm độ nhạy cảm với emtricỉtabine vả Iamivudine. vVì vậy, đề
kháng chéo giữa các thuốc nảy có thể xảy ra ở bệnh nhãn có virus gốc thể KôSR ản nảu. Các
chùng phân lập từ bệnh nhân có HIV- ] biều lộ trung bình 3 gốc thế men phiên mã ngược liên
quan với zidovudine (M4IL, D67N, K7OR, L210W, TZISYJF, hoặc K219QlE/N), cho thẳy
giảm nhạy cảm với tenofovir 3,1 lần. HIV- ! đề kháng đa nucleoside có một gỏc thể chèn gâp
đôi T69S trong men phiên mã ngược cho thẳy giảm nhạy cảm với tenofovir.
Trong cảc nghiên cứu VI vả III dược bảo cáo ở các bệnh nhân đã dược điểu trị (Tenofovir +
Trị liệu nền tiêu chuẩn (Standard Background Thempy - SBT) so với giả dược + SBT) 5% số
bệnh nhân được điều trị với tenofovir thẳt bại với trị iiệu khảng virus trong suốt tuần 96 có
>] ,4 lần giảm độ nhạy cảm (trung bình 2, 7 lần) với tenofovir. Phân tích kiếu gen của cảc
chùng phân lập nến và cảc chùng phân lập thẳt bại cho thấy sự phảt triến gốc thế K65R ở gen
men phìên mả ngược HIV—l.
Đảp ứng virus học đối với trị liệu tenofovir đã được đánh gìả về kiều gen virus nền ớ cảc
bệnh nhân đã được điều trị tham gia trong cảc nghiên cứu VI và III. Trong các nghiên cứu
lâm sảng đã được bảo cảo nảy, 94% nguời tham gia đã được đánh giá có cảc chùng phân lập
HIV- I nên thế hiện ít nhất một đột biến NRTI. Đảp ứng virus học ở những ngưởỉ trong
nghỉên cứu phụ về kiểu gen lả tương tự như cảc kết quả nghiên cứu tống thế.
Nhiều phận tỉch thăm đỏ đã được bảo các đế đảnh giả tảc động cùa các gốc thể chuyên biệt
vả cảc kiêu thê trên kêt quả virus học. Vì sô lượng iớn cảc so sảnh có khả năng xảy ra, xét
19/27
nghiệm có tính thống kế không được báo cáo. Mức độ để khảng chéo khảo nhau đối với
tenofovir đối với cảc gốc thế liến quan đến đề khảng zidovudine tồn tại trước đó (M4ll
D67N, K7OR, L210W, T2! SYIF, hoặc K2l9Q/E/N) đã được quan sát thẳy vả dường như phụ
thuộc vảo số lượng cảc gốc thể chuyên biệt. Các bệnh nhân được điều trị với tenofovir có
HIV- ] cho thấy 3 gổc thế hoặc nhiến hơn liên quan đến đề kháng zidovudine gồm hoặc với
M4lL hoặc với L210W gốc thế men phiên mã ngược cho thấy giảm đáp ứng với trị liệu với
tenofovir; tuy nhiến, cảc đảp ứng nảy vân được cải thiện so với giả dược Sự hiện diện cùa
gốc thế Dó7N, KTOR, T2ISY/F, hoặc K2l9Q/E/N dường như không ảnh Ihướng đáp ứng với
trị liệu tenofovir. Những người có virus có gôc thế [ 74V không có các gốc thế liên quan đến
sự đề khảng zidovudine thì giảm đảp ứng với tenofovir. Dữ liệu bị hạn chế đã có ở những
người có virus thế hiện gốc thế Yi 15F, gôc thế Q]51M,hoặc chèn T69, tất cả chủng có đáp
ứng gìảm.
Trong cảc phân tích đã có đề cương đã được báo cảo, dáp ứng virus học với tenofovir không
giảm ở người nhìễm HIV- ! biểu hỉện gốc thế M184V liên quan đến đề khảng
abacavirlemtricitabine/lamivudìne. Cảo đảp ứng HlV- ] RNA ở những người nảy bến vững
trong suốt tuần 48.
Các phán tích kiều hình nghíên cứu VI vả III
Đảp ứng virus học với trị liệu tenofovir đã được đảnh giả về kiều hình cơ bản ở những bệnh
nhân đã được điếu trị tham gia vảo hai thử nghiệm lâm sảng đã được báo cảo. Phân tich kiều
hinh cùa HIV- ] cơ bản từ những bệnh nhân đã được chứng minh về sự tương quan giữa tính
nhạy cảm cơ bản đối với tenofovir vả đảp' ưng đối với trị liệu tenofovir. Bảng sau đây tóm tắt
đảp' ưng HIV- l RNA bời tính nhạy cảm với tenofovir cơ bản.
Bảng: Đáp ửng HIV-l RNA ỏ tuần 24 bởi tính nhạy cãm với tenofovir cơ bãn
(Phân tích mục đích đỉếu trị)
Tính nhạy câm với tenofovir cơ bãn' Thay đôi vế HIV-l RNAÍ (N)
<] —0,74 (35)
>] và 53 -0,56 (49)
›3 và 54 ' -0,3 (7)
>4 -0,12 (9)
* = Tính nhạy cảm với tenofovir đã đuợc xác định bới thừ nghỉệm dảnh giả đề kháng HIV với các thuôo
khảng retrovirus lheo kỉếu hinh tái tỏ hợp
† = Góp thay đổi tinh nhạy cảm từ chùng hoang dại.
Ị = Thay đôi HlV-l RNA lrung binh từ mức cơ bán trong suốt tuần 24 (DAVGZ4) ờ log… phỉẽn bản/mL.
Hoạ! lỉnh kháng HBV
Hoạt lính kháng virus
Hoạt tính khảng virus của tenofovir kháng HBV đã được đảnh giả trong dòng tế bâo Hch2
2. 2. 15 Giá trị ECso cho tenofovir thay đổi từ 0,14 đến 1,5 ựM, với giá trị CCso (50% nông
độ gây độc tế bảo) >100 ụM. Trong cảc nghiên cứu hoạt tính khảng virus phối hợp ở tế bảo
nuôi cấy của tenofovir với các chất ức chế mcn phiên mã ngược khảng HBV nhóm
nucleoside emtricỉtabine entecavir, Iamivudine vả teibivudine, không có hoạt tính đối khảng
nảo được quan sảt.
Đệ kháng _ _
Đê kháng kiêu gen tích lũy với tenofovir đã được bảo cảo được đánh giá hăng năm với cảc
chuỗi amino acid men phiên mã ngược HBV được ghép đôi cùa cảc chùng trước khi điếu trị
20127
và khi điều trị từ những người dùng đơn trị liệu với tenofovir ít nhẩt 24 tuấn và vẫn còn virus
trong mảu với HBV DNA >400 phiên bản/mL vảo cuối mỗi năm nghiên cứu (hoặc khi dừng
đơn trị liệu với tenofovir) sử dụng một phân tích khi đang được điếu trị. Từ bốn thử nghiệm
đang dùng tenofovir đã được báo cảơ (ba nghiến cứu ở bệnh nhân có bệnh gan còn bù, vả
một nghiên cứu ở người có bệnh gan mất bù), 10% người dùng tenofovir với bệnh gan còn
bù dùng thuốc lên đến 144 tuần vởi đơn trị liệu với tenofovir và 18% người dùng tcnofovir
với bệnh gan mất bù dùng đơn trị liệu với tenofovir lên đến 48 tuần vẫn còn virus trong mảu
vảo thời điếm cuối cùng cùa đơn trị liệu với tenofovir. Ó nhóm đối tượng dương tính với
HbeAg trước đây chưa được điều trị với HEPSERA từ một nghiên cứu đã được bảo cảo, 74%
số người có HBV DNA >400 phìên bảnlmL tại thời đìếm cuối cùng của đợt dơn trị lìệu với
tenofovir có mức tải vỉrus ở mức cơ bản >9 log… phiên bản/mL Cảo gốc thể amino acid xảy
ra do điếu trị ở mcn phiên mã ngược HBV được phảt hiện ở 46% người trong cảc nghiến cứu
đã được báo cáo với dữ liệu kiếu gen được ghép đôi có thế đảnh giá được; không có cảc gốc
thể đặc hiện xây ra ở tần suất đủ liến quan đến sự đề khảng với tenofovir (cảc phân tich kiếu
gen hoặc kiếu hinh).
Để kháng chéo
Đế khảng chéo đã được bảo cảơ giữa các chắt ức chế men phiến mả ngược thuộc đồng đẳng
HBV nucleosidc/nucleotidc. Trong cảc thử nghiệm dựa vảo tế bảo, các dòng HBV biếu iộ
cảc gốc thế rtV]73L, rtLl 80M, vả rtM204I/V có liên quan đến sự để khảng với lamivudine
vả telbivuđine cho thấy tính nhạy cảm thay dối từ 0, 7 đến 3, 4 lằn virus hoang dại. Cảo gốc
thế kép rtLISOM vả rtMZO4IN giảm tính nhạy cảm với tcnofovir 3, 4 lần.
Cảo dòng HBV biếu lộ các gốc thế nLISOM, rtT184G, rtSZOZG/I, ano4v, vả ansov có
liên quan đến đề kháng với entecavir cho thấy tinh nhạy cảm với tenofovir thay đổi từ 0,6
đến 6,9 lằn tính nhạy cảm cùa virus hoang dại. Một dòng HBV biếu lộ đống thời rtLISOM,
rtT184G, rtSZO2i vả rtM204V giảm 6,9 lần độ nhạy cảm với tenofovir.
Các dòng HBV có các gốc thể rtAISIV vảlhoặc rtN236T dề kháng liên quan dến adefovir
cho thắy giảm tinh nhạy cảm với tenofovir từ 2,9 đến 10 lần virus hoang dại.
Cảc đòng có gốc thế rtA ! 81T cho thấy sự thay đối tính nhạy cảm với tenofovir từ 0,9 đến 1,5
lần virus hoang dại.
Trong bốn nghiên cứu điếu trị với tenofovir đã được bảo cảo, trước khi điều trị với tenofovir,
M, 15, vả 2 người có ẩn chửa HBV hoặc cảc gốc thế iiên quan đến đề khảng ađcfovir
(rtAISIT/V vả/hoặc rtN236T) hoặc các gốc thế liên quan đển đế khảng lamivudine
(rtMZO4IJV), hoặc cả hai, theo thứ tự. Sau 144 tuần đìếu trị với tenofovir, ll trOng số l4
người có HBV đế khảng với adefovir, I2 trong số 15 người có HBV đề kháng với
Iamivudinc, vả ! trong 2 người có HBV đề kháng cả adefovir- vả lamivudine dạt được sự ức
chế virus học (HBV DNA <400 phiên bản/mL). Hai trong số 5 người có virus ẩn chứa cả gốc
thế rtAl8lT/V vả rtN236T và một trong sô 5 người có virus ấn chứa cảc gốc thế nảy vả một
gốc thế rtMZO4I vẫn còn virus trong mảu sau 32 tuần dùng đơn trị iiệu với tenofovir
o Dược động học
Dược động học cùa tcnofovir DF đã được đảnh giả ở người tình nguyện khóe mạnh và cảc cả
nhân nhiễm HIV- I. Dược động học tenofovir là tương tư giữa cảc đối tượng nảy
1enofovir DF là một tiến dược dicster tan trong nước của hoạt chất tcnofovir. Sinh khả dụng
đường uống của tenofovir từ tenofovir DF ở những bệnh nhân khi đói lả khoảng 25% Sau
khi cho bệnh nhân nhiễm HIV-l uống liều đơn tenofovir DF 300 mg khi bụng đói, nổng độ
21/27
tối đa trong huyết thanh (c..….) đạt được trong 1,0 :t o.4 giờ. Các giá ui c,… vả AUC lẩn iượt
lả 0,30 * 0,09 pg/mL vả 2,29 # 0,69 ịtg—hrlmL.
Dược động học của tenofovir lã tỉ lệ với liều dùng ở ưến khoáng liếu tcnofovir DF từ 75 đểu
600 mg vè khỏng hi ânh hướng bời liều lặp lại.
Trên in vilro sự gắn kểt tenofovir với protein huyết thanh hoặc huyết tương người lả lần lượt
dưới o.1 vả 1,2%. ờ trẽn khoáng nồng độ tenofovir thay đối o.ou đến 25 ựglmL. Thể tích
phân bố ở tình trạng cãn băng là 1.3 * 0,6 ng vả I.2 t 0,4 ng, sau khi tiêm tenofovir với
liều t,o mglkg vả 3,o mglkg.
Các nghiên cứu in vilro cho thấy không phâi tenofovir disoproxil cũng khỏng phải tenofovir
lả cảc cơ chất của các enzyme CYP.
Sau khi liêm tĩnh mạch tenofovir, khoảng 70—80% liều đùng được hồi phục trong nước tiếu ở
đạng tenofovir khòng đổi trong vòng 72 gỉờ dủng thuốc. Sau khi dùng liều đơn, khi uổng
tenofovir DF, thời gian bản thải giai đoạn cuối của tenofovir lá khoảng !? iờ. Sau khi uống
liều đa tenofovir DF 300 mg ngảy ] lấn (khi ở tinh trạng no), 32 ² 10% liỄu đùng được hồi
phục tmng nước tiểu trèn 24 giờ.
Tcnofovir được đâo thải bới sự phổi hợp của lọc cầu thận vả tiết chủ động qua ổng thận. co
sự cạnh tranh về đâo thải với các hợp chất khác cũng được đảo thải qua thận.
Dùng tenofovir DF sau bữa ãn có nhiến chất béo (—700 đểu 1000 kcal chứa 40 đến 50% chất
béo) iâm tăng sinh khả đụng đường uống, với tâng AUCg.,z của tcnofovir khoảng 40% và
tãng C… khoảng 14%. Tuy nhiên. đùng tcnot'ovir DF với bữa ãn nhẹ không có tác động
đảng kể trên dược động học của tenofovir khi so với dùng thuốc khi đỏi. Thức ăn lảm chậm
thời gian đạt C,… của tcnofovir khoảng ! giờ. C,… vả AUC của tenofovir là 0,33 i 0,I2
ụg/mL vã 3,32 t 1,37 ụg~hrlmL sau đa liếu tcnofovir DF 300 mg ngảy | Iẳn khi ở tinh trạng
no, khi thảnh phần bữa ăn không được kiểm soát.
Các dỗi lượng aạc biệt /
— Chúng lộc: Không đủ số lượng iớn từ các nhóm chùng tòc vã đìn tộc ngoảì người da
trắng để xác định sự khâc biệt thích hợp giữa các đối tượng nảy.
~ Giỏi n'nh: Dược động học cùa tenofovir lả tương tự ở bệnh nhân nam vả nữ.
~ Bénh nhi 12 luỏi mở !ẽn: Dược độn học cùa tcnoforvir ờ tinh trạng cân bắng đă được báo
cáo về đánh giá ở 8 bệnh nhi nhi HlV-l (12 đến <18 tuối). Trung bình (* Độ lệch
chuẩn) C… vá AUC… lằn Iượt & 0,38 t 0,13 ụg/mL vả 3,39 i- l,22 ựg~hrlmL. Phơi
nhiễm tcnofovir đã được ở các bệnh nhi nảy uống tcnofovìr hằng ngây với liếu 300 mg iâ
tương tự như phơi nhiễm đạt được ở người trướng thânh đùng tcnoi'ovir hằng ngùy vởi
liều 300 mg. Các nghiên cứu dược động học chưa được thực hiện ở bệnh nhi < 12 tuòi.
— Bệnh nhản lả người cạo tuỏi: Các nghiên cứu được động học chưa được tiến hânh ở
người cao tuối (>65 tuôi).
— Suy chức năng rha'n: Dược động học của tcnofovir bị thay đối ở bặih nhãn suy chủc nãng
thận. Ở bệnh nhản có độ thanh thải creatinine <50 lephút hoặc có bệnh thặn giai đoạn
cuối cấn phải thẩm phân, c...... vả AUCủ của tenofovir tăng (xem Báng bẽn dưới).
Khuyển các thay đổi khoáng cảch dùng tenofovir DF ở bệnh nhân có độ thanh thải
creatinine <50 mL/phủt hoặc ở bệnh nhãn có bệnh thặn giai đoạn cuồi cấn thấm phản.
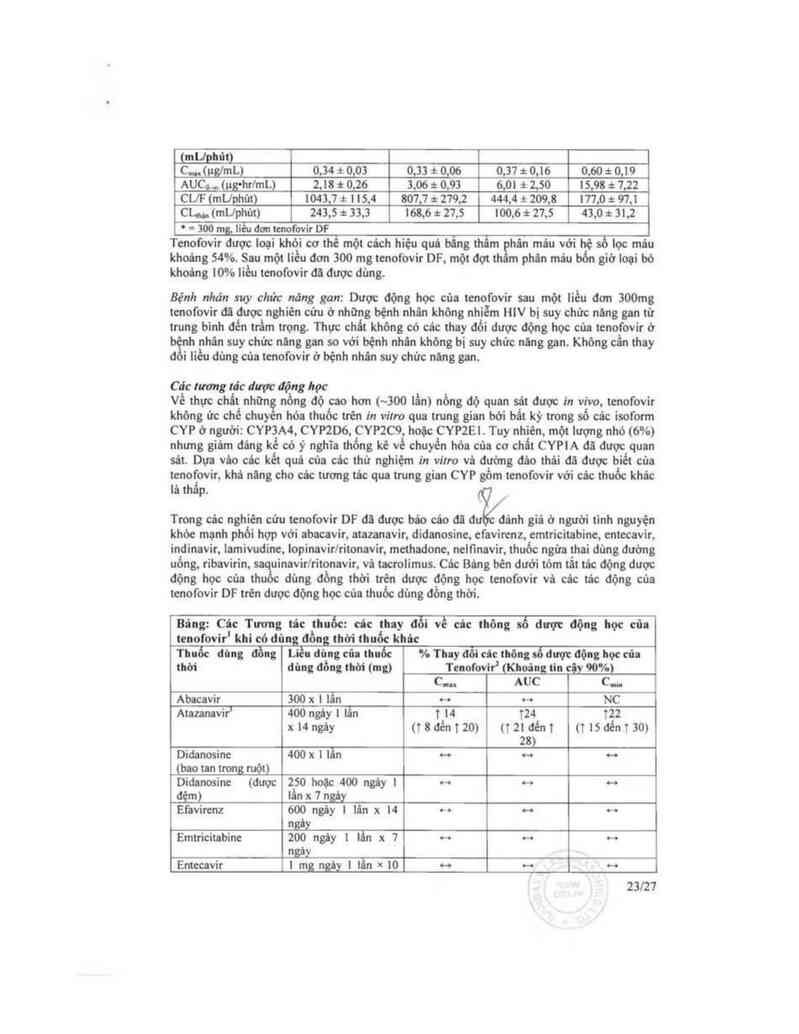
Bâng: Câc thông số được động học (Trung bìnhtĐộ lệch chuẫu) của Tenofovir'ờ
bệnh uhâu cỏ múc độ suy chín nãng thận khủc nhau
Dộ thanh thii >80 50—00 30-49 l2—29
creatinine cơ bin
22127
(mlJphút)
c..., (ưg/mL) o,sa * 0.01 0.33 1: o,oe o,:w z o,us 0.60 ² 0,I9
AUCb (ựhrlmL) 2,18 # 0,26 3,06 :t 0,93 6,0l i 2,50 l5,98 đ: 7,22
CUF (mUphủt) 1043,7 :t 1 l5,4 807,7 * 279,2 444,4 t 209,8 l77,0 & 97,1
Chi,, (mllphủt) 243,5 * 33,3 Ì68,6 * 27,5 l00,6 * 27,5 43,0 # 31,2
’ ~ 300 fflg, liễu đơn tmofovir DF
Tcnofovir được Ioại khỏi cơ thể một cách hiệu quả bẳng thâm găin máu với hệ số lọc máu
khoảng 54%. Sau một liếu đơn 300 mg tenofovir DF. một đọt th phán máu bổn giờ loại bỏ
khoảng 10% lỉều tenofovir đă được đùng.
Bệnh nha'n suy chút nãng gan: Dược động học của tcnofovỉr sau một liều đơn 300mg
tcnofovỉr đã được nghiên cửu ở những bệnh nhân không nhiễm HIV bị suy chửc nũng gan từ
trung binh đến trầm trọng. Thục chất không có các thay đồi dược động học của tenofovir ờ
' h nhân suy chửc nãng gan so với bệnh nhân khỏng bị suy chửc năng gan. Không cần thay
đoi liều đùng của tcnofovir ở bệnh nhán suy chức nang gan.
Cảc tương lảc dupv: đệng học
Về thục chất nhữn nồng độ cao hơn (~300 lần) nồng độ quan sát được in vỉvo, tcnofovir
khỏng ức chế chuyến hóa thuốc trẻn in vitro qua trung gian bới bắt kỳ trong số các isoform
CYP Ở người: CYP3A4, CYP2D6, CYP2C9, hoặc CYP2El . Tuy nhiên, một lượng nhỏ (6°/o)
nhưng giám đáng uẻ có ý nghĩa thống kê về chuyển hỏa cùa cơ chất CYPIA aa được quan
sãt. Dựa vác các kết quả của các thử nghiệm in vitro vá đường đâo thâỉ đă được bìết của
tenoẵovir, khả nãng cho cảc tương tảc qua trung gỉan CYP gồm tcnofovir với các thuốc khác
lả th p.
Trong các nghiên cứu tenofovir DF đã được bảo cảơ đã đtiẺánh giả ờ người tinh nguyện
khỏe mạnh phổi hợp với abacavir, atazmavir, didanosinc, cfavirenz, cmtricitabine, cntccavir,
indinavir, iamivuđine, Iopinavirlritonavỉr, mcthadonc. nclfmavir, thuốc ngửa thai đùng đường
ưống, ribavirin, saquinavirlritonavir, vả tacmlimus. Các Bảng bên dưới tóm tắt tác động được
động học của thuốc dùng đồng thời trên dược động học tenofovir vả các tác động của
tcnofovir DF trẽn dược động học cùa thuốc đủng đồng thời.
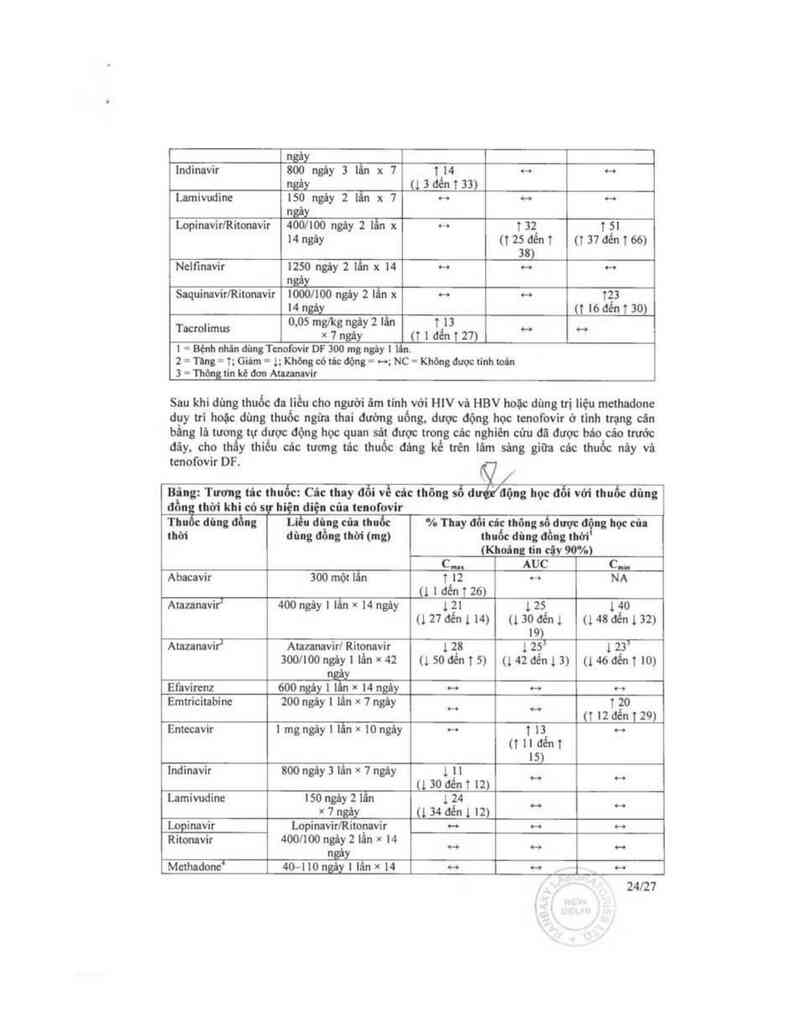
Bâng: Câc Tương … thuốc: cảc thay đỗi về … thông số dược động học cũ:
leuofovir' Ithi cỏ dũng đồng thời thuốc khic
Thuốc đùng ơi…; Liều đùng cia thuốc % Thy … … thông số dược động học của
um dủng đồng thời (mg) T…fovtr' (Khoâng lln cộy mm
c.... AUC c...
Abacavir 300 x ! lẫn H … NC
Atlumvir’ 400 ngây | lần 1 M 124 ĩ22
xt4ngây (tSđént20) (T²lđếnt msaénizo)
zs›
Didanosine 400 x ] lẫn o- … ~
(bao tan tmng ruột)
Diđanosinc (được 250 hoặc 400 ngây I … … …
đệm) lấn x 1 ngá_y
Efavitenz 600 ngáy ! lân x H … … o-o
ngảy
Emtricitabine zoo ngảy ! lẩn x 1 … … …
fmảL
Entccavir | mg_ngây | lẫn * i0 -o … o-o
23l27
ngây
Indinavir 800 nặy 3 lằn x 7 1 14 … …
ngây (1 3 đến 1 33)
anivuđine ISO ngảy 2 lẩn x 7 ~ ~ ~
n
LọpinavirlRitonnvir 4oonoo ngây 2 11… x … 1 32 1 51
14ngùy nzsơém (137đếntóó)
38)
Nclftncvir 1250 ngây 2 lân x 14 … ~ ~
ngăỵ
anưinavirlRitonavir 10001100 ngùy 2 lẫn x ~ ~ T23
14ngùy « toaẻan)
. 0.05 mg/kg ngiy 2 lấn T 13 … _
T°“°"ms x 1 11 y (1 1 đển 1 27)
1 = Bộnh nhân đùng Tcnofovir DF 300 mg ngiy 1 1 n.
2 = Tlng = †; Giđm - l; Khờngcớtđc động= o-o;NC= Khđngđưọctinhtcin
3 = Thớngtin kẻđơn Atlzanlvir
Sau khi đùng thuốc đa liều cho người 5… tinh với HIV vá HBV hoặc dùng trị liệu mcthađonc
duy trì hoặc đùng thuốc ngừa thai đường uống, dược động học tenofovir ờ tinh trạng cán
bằng lá tươn tự được động học quan sát được trong cảc nghiên cửu đã được bâo cáo trước
đãy. cho th y thiếu cảc tương tác thuốc
tcnofovir DF
đáng kể … lâm sùng giữa các thuốc nảy vã
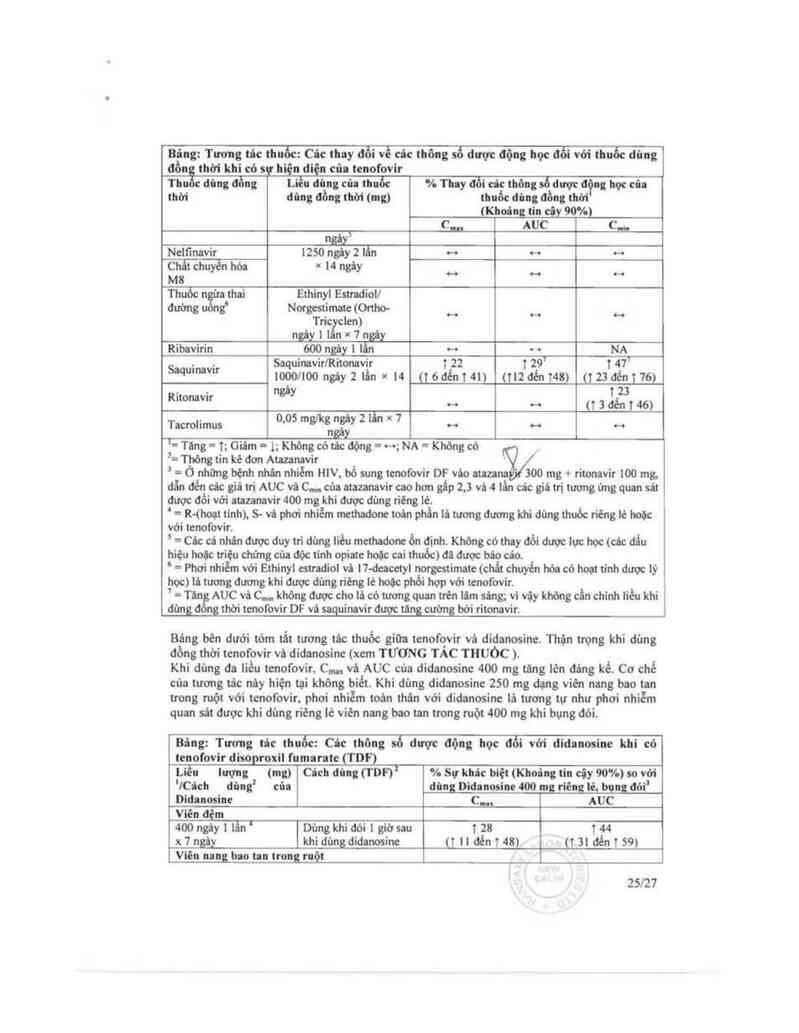
Bâng: Tương tủc thưốc: th thay đổi về các thông số dưỪđỊộng học đối với thuốc đủng
đồn thời khi có s hiệu điện cũa tenofovir
Thu đt`mg đồng LỄu đùng cũa thuốc % Tth đổi cả: thông cố được động học cũ
thời đủltg đồng thời (lng) thuốc đing đồng thời
(Khođng tin clv 90%)
c,,m AUC cu
Abacavir 300 một lẩn T12 … NA
u 1 đển t 26)
Amanavif aoo ngây 1 lân x 14 ngãy 1 21 1 zs 1 ao
(121ơén114) usoơént (148đến132)
19)
Auzanavi? Ataunavirl Ritonavir 1 28 1 25“ 1 23“
300/100ngây11ẩni42 usoơẻnis) uauéniz)
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng