


















BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC
ĐÀ PHÊ DUYỆT
\
Lân đi…i... míha’f ~ ?V—
WV'IONEJ.
Aịt/Ri9/
i sưmum x I. :10 xoa
SB1EVL GầlVOJ'W'IH
SỊGỊQB_L ô… om eu1pnAịuie1
is 6… 008 OỊBJEUHH |ỊXOJdOSỊCl JịAoiouel
WV'IONEJ.
euựnpew uondụosmd 28
TENOLAM
Douge : As direde by the physldan.
Store in a cool dry place. below 30°C.
Protect hom Ilght
Keep out of reach oi children.
before use.
WV'IONBL
Product Spodflcdllonl : ln~house.
Moth ptck lnunlnsldu.
Mfg Lic. No.: AD/Oli
Batch No.:
Mĩg. Dae: ddlmmlyy
Exp. Date: ddlmmlyy
Compultlon :
Each fllm ooated tablet contains :
Tenofovir Disoomxii Fumarate .......... 300 mg.
Lamivuđine U.S.P. ............................ 100 mg.
cdours : Sunset Yellơa. Thanlum Dioxide
Cataiully read the aecompanying instrudions
Rx- Thuốc bán theo đơn
Viên uén bIO phim TENOLAM
Mỗi viên chứa:
Tenofovir disoproxil fumarate .......... 300 mg
Lamivudine ..................................... 100 mg
Hộp ] vi x10 viên smc:
Chỉ định, Câch dùng, Chõng chi đinh vả eẻc tbòng
tin khác: xin đọc tờ hướng dẫn sử đựng kèm theo
sỏ lô sx, NSX, HD xem “Bach No.". ^~Mfg Date"
“Exp. Date“ ưẽn bao bì
Bảpquânnoikhóma't,dưới 30°C,túnhảnhsáng
Đê za Iẳm tay mị em,
Đọc kỹ hưởng ủn .rừ dụng !rưáic khi dùng
Sin xuất bới: Am Phlrmnccudcals Limited - Ẩn Độ
DNNK:
For lndleatiom. Contn-Iudleations. Dougo.
Skin EM. Aúnlnlmnlon & Preuutlons.
Manufacturod by:
ATRA PHARMACEUTICALS LIMƯED
Plot No. H19, MIDC Arca Waiuj
Aurangabad 431133. Mahafashtm Steto, INDIA.
1} Prescription Medicine
TENOLAM
Tenoiovir Disoproxỉl Fumarate 300 mg &
Lamivudine 100 mg Tablets
Compolhlon :
Enuh flm coetod … contains :
T… Disopmxl Fumamto 300 mg.
Luniwđino U.S.P. ............................ 100 mg.
Colous : Sunsot Ydlow. Tkanium Dioxide
Dmgo : As difectod by the phychen.
Stofc1n n cool dry pboo. bolow 30'C.
Protod im… iight
Keep out of medi ot ehildren.
Careiully rend the ncoompenying …uctionl
uu.
Ptoduct Spoclllcatiom : In—house,
Fu Indieatiom. Conừn-lndlcưlonc. Dougo,
Sldo Effectn. Adminimmon & Pmutủnc.
Mot to pack Incon lmldo.
Mtg. Lic. No.:AD 1011
Manufactumd by:
ATRA PHARIIACEUTICALS LIIIITED
Piot No. H19. MIDC Area Waluị
Aurangabad 431133. Maharashtra State. INDIA.
Mlg. Dntezdd/imtiyy Exp. Dub:
Batch No.:
ẤÃIWW/W zowo ~đxa W ²W0 ®…
i
"
_____1
'ViũNl 'ỒWÍS BJNgẾJỂWW 'SSUEV MEỒUBJUV -umpuuo » uon: |0 mo đeaỵ
_ỈI'IIBM BĐIV OOlW '6lH 'ON lold
03fflrl s1VOlmaomumd WLV 111611 10011! DBWJd
ĩ^q DOJMOBJWBW 'o.oc Min 'eơeid Am 100° 0 U! …s
uoiuva 'an 6…
~uninidud out Aq mmup =v = duoc
mcuq uuuị nad o; Jqu
'suonnWđ 1 uomniuiww'mnua OPIS Bumio …mtmu. mm tmns : =moioo
'duoo 'summpuruwoo 'cuompui mg ~6m 001 ............................ d'S'n meun
`…Ou-Ul ² uuonuupuds Pan 'BW 001: 9thn:i iixcudoqo 11…1
“n M : 5111qu 1011… PN… Wlti ®03
suonnnnsu BuMuodiuoose ma peiu ẤỊIHJUBQ : uomoodwoo
stalqel 6… om eumnngum
g ôui oos 0181²111nj|1X0100510JỊAOJOUĐl
WV'IONBJ.
euioịpew uondụoseud 18
T liuốc miy chỉ dùng theo sự kê toa cún thầy rhuốc
Đọc kỹ hương dẫn sư dụng trươc khi dùng.
Thông báo cho bác sĩ các tác dung phụ gặp phải khi dùng thuốc.
Để thuốc xa tầm với của trẻ em.
TENOLAM Viên nén bao phim
THÀNH PHÀN:
Mỗi vìên nén bao phỉm chứa:
Tenofovir Disoproin Fumarat ........................... 300 mg
Lamivudine .................................................. 100 mg
Tá dược.
Cellulose vi tinh thể, Dibasic Calci Phosphat, Lactose, Polyvinylpyrrolidone K- 30, Polysorbat
80, Tinh bột ngô, Crosscarmellose natri, Magnesi Stearat, Tale tinh khiết, Colloidal Silica
khan, Tinh bột Natri Glycolat, Natri Lauryl sulfat, Instacoat Universal A05R00959 vả
Instacoat SOL (IC—S-223 White).
DƯỢC LỰC HỌC
Nhỏm tác dụng điều trị: Các thuốc kháng retrovirus điều trị nhiễm HIV, dạng phối hợp.
Cơ chế hoạt động và các tác động dư c lực học:
Tenofovir disoproxil fumarat lả muoi fumarat cùa tiền dược tenofovir disoproxil. Tenofovir
disoproxil được hấp thu và chuyển hóa thảnh dạng hoạt tính tenofovir, là một đồng đảng
nucleosid monophosphat (nucleotid). Sau dó tenofovir được chuyển thảnh chất chuyến hóa có
hoạt tinh tenofovir diphosphat, bởi cảc emzyme tế bảo thông qua hai phản ửng phosphoryl hóa
trong cả tế bảo T hoạt hỏa và không hoạt hóa. Tenofovir diphosphat có thời gian bán hủy là 10
giờ trong các tế bảo đã hoạt hóa và 50 gỉờ trong cảc tế bảo bạch câu đơn nhân không ho t hóa
trong mảu ngoại vi.
Tenofovir diphosphat ức chế polymcrase virus bằng sự cạnh tranh gắn kết trực tiếp với chất nền
tự nhiên deoxyribonucleotid vả bới sự kết thúc chuỗi DNA sau khi hợp nhất vâo DNA.
Tenofovir dìphosphate là một chất ức chế yếu cảc polymerase tế bảo a, B, và v, với hằng số ức
chế động học (K.) cao hơn gấp 200 lần so với DNA polymerase cùa tế bảo ơ người (5, 2 umol/l)
và cao hơn gấp 3000 lần so với DNA polymerase của tế bâo B và y người (81, 7 và 59, 5 umol/I
tương ứng), hơn Ki cùa enzyme sao chép ngược HIV- l (0, 02 nmol/l). Ở nông độ lên đến 300
ụmol/i, tenofovir cho thắy không tác động trên sự tổng hợp của DNA ty iạp thế hoặc sự sản xuất
acid lactic trong thử nghiệm in vitro.
Các dữ lỉệu liên quan đến HIV:
Hoạt động kháng virus H] V trên in viiro: Nồng độ yêu cầu cùa tenofovir để ức chế 50% ( EC so)
chủng HIV-l um cận lâm sảng loại hoang dại là 1-6 ụmol/l trong cảc dòng tế bảo bạch huyết và là
1,1 ụmolll đối với cảc chùng phân lập HIV- ] phân nhóm B trong cảc tế bảo bạch cầu dơn nhân
trong máu ngoại vi Tenofovir cũng có hoạttính chống lại HIV- ] phân nhóm A, C, D, E, F, G, và
0 và chống lại HIVBaL trong cảc tế bảo bạch cầu đơn nhân to nguyên thùy/ đại thực bảo nguyên
thủy. Tenofovir chi ra có hoạt tinh trên in viiro chống lại HIV— 2, với ECso là 4, 9 ị.imol/l trong cảc
tế bảo MT-4.
Kháng thuốc: Cảo chùng HIV-l có tính nhạy cảm giảm 3-4 lẩn đối với tenofovir và một đột biến
K65R trong sao chép ngược đã được ghi nhận trên in viiro và ở một số bệnh nhân (xem các kết
quả lâm sảng). Tenofovir disoproxil fumarat nên trảnh dùng ở những bệnh nhân đã từng dùng
khảng retrovirus với chùng đột biến KôSR.
Cảc nghiên cứu lâm sảng ở những bệnh nhân đã trải qua việc điếu trị được đảnh giá hoạt động
chống 1ại HIV của tenofovir disoproxil 245 mg (dưới dạng fumarat) đối với cảc chùng HIV—l
1
ẤẢiiẺ^fiòx\
khảng thuốc ức chế nucleosid. Cảo kết quả chỉ ra rẳng những bệnh nhân mả HIV có 3 hay nhìếu
hơn cảc đột biến kết hợp đồng đẳng thymidine (TAMs) mà kể cả đột biến enzyme sao chép
ngược hoặc M41L hoặc L210W đã cho thắy giảm tính đảp ứng vởi trị liệu tenofovir dìsoproxil
245 mg (dưới dạng íumarat).
Hiệu quá và íính an ioản lâm 11ảng: Hiệu quả của tenofovir disoproxil fumarat ơ những người lợn
bị nhỉễm HIV- 1 đã timg và chưa từng bao gỉờ điều trị với tenofovir đã được chứng minh trong
cảc thử nghiệm iâm sảng 48 tuần vả 144 tuần, tương ửng
Trong nghiên cứu GS- 99- 907, 550 bệnh nhân đã từng điều trị được điếu trị với giả dược hoặc
tcnofovir disoproxil 245 mg3 (dưới dạng fumarat) trong 24 tuần. Số lượng tế bảo CD4 ban đầu
trung bình là 427 tế bảo/mmẵ RNA HIV- 1 trong huyết tương ban đầu trung bình là 3 ,4 iogio bán
sao/ml (78% bệnh nhân có tải lượng virus lá nhỏ hơn 5000 bản sao/ml) và thời gian đỉều trị HIV
trước đó tmng bình là 5, 4 năm. Phân tích cấu trúc di truyền ban đầu của cảc chủng HIV phân lập
từ 253 bệnh nhân cho thấy 94% bệnh nhân có HIV- ] mang cảc đột bỉến liên quan tới cảc thuốc
NRTI, 58% bệnh nhân có cảc đột biến liên quan tới cảc thuốc ức chế proteasc và 48% bệnh nhân
có các đột biến lỉên quan tới cảc thuốc NNRTI.
Ở tuần 24, sự thay đối trung bình theo thời gian so với giá trị ban đầu về nồng độ RNA HIV- 1
trong huyết tương iogm (DAVG24) là -0, 03 log… bản sao/ml và -0, 61 log… bản sao/ml tương
ứng ở những bệnh nhân dùng giả dược và tenofovir disoproxil 245 mg (dưới dạng fumarat) (p <
0 ,0001) Người ta thấy có sư khảo biệt có ý nghĩa thống kẽ với ưu thế nghiêng về nhóm tenofovir
disoproxil liếu 245mg (dưới dạng fumarat) được quan sát thấy về biến đối trung binh số 31ượng tế
bảo CD4 theo thời gian vảo tuần thứ 24 (DAVG24) so vởi lúc ban đầu (+13 tế bảioỉmm3 ở nhóm
tenofovir disoproxil liếu 245mg (dưới dạng fumarat) so vởi— —ll tế bảo/mm3 ở nhóm 1a được, giá
trị p=0,0008). Ộ/
Đảp ứng chống virus của tenofovir disoproxil fumarat là bến vững suốt 48 tuần (DAVG48 lả -
0,57 log… bản sao/ml, tỉ lệ bệnh nhân có RNA HIV-l dưới 400 hoặc 50 bán sao/ml 121 41% và
18% tương ứng). 8 bệnh nhân (2%) điếu trị với tenofovir disoproxil 245 mg (dưới đạng fumarat)
đã phảt sỉnh đột bỉến KôSR trong vòng 48 tuần đầu.
Pha có đối chứng hoạt tinh, mù đôi, 144 tuần cùa nghiên cứu GS— 99 903 đã đảnh giá hỉệu lực và
tính an toản của tenofovir disoproxil 245 mg (dưới dạng fumarat) so với stavudin khi được dùng
kết hợp với lamivudin vả efavirenz để điều trị cho những bệnh nhân nhiễm HIV- ] dùng thuốc
kháng retrovirus lẩn đầu. Số lượng tế bảo CD4 ban đẳu trung bình là 279 tế bảo/mm, RNA
H1V-l huyết tương ban đầu trung bình là 4, 91 login bản sao/ml, 19% số bệnh nhân nảy nhiễm
HIV-l có triệu chứng và 18% đã bị AIDS. Cảc bệnh nhân được phân loại dựa trên số lượng RNA
HJV- 1 và CD4 ban đẫư.4 43% số bệnh nhân có tải lượng virus lớn hơn 100000 bản saolml và 39%
số bệnh nhân có số lượng tế bảo CD4 nhỏ hơn 200 tế bảo/ml
Bằng phân tích quá trình điều trị (các dữ liệu bị mất và việc chuyến phảc đồ đìều trị kháng
retrovirus được xem như thất bại), tỉ lệ bệnh nhân có RNA HIV-l dưới 400 bản sao/m] vả 50 bản
sao/m] ở tuân điêu trị thứ 48 tương ứng là 80% vả 76% trong nhóm điều trị bằng tenofovit
disoproxil 245 mg (dưới dạng fumarat), so với 84% và 80% trong nhóm đỉếu trị bằng stavudín
Ở tuần thứ 144, tỉ lệ bệnh nhân có RNA HIV- ] dưới 400 bản sao/ml và 50 bản sao/ml tương ứng
là 71° xo và 68% trong nhóm điếu trị bằng tenofovir disoproxil 245 mg (dưới dạng fumarat), so
với 64% vả 63% trong nhóm điếu trị bằng stavudin.
Bìến đổi trung bình so với ban đầu về sô lượng RNA HIV- ] vả CD4 ớ tuần điếu trị thứ 483121
tương đương ở cả 2 nhóm điếu trị (-3, 09 vả -3, 09 login bản saolml; +169 vả +167 tế bảo/mm ở
các nhóm điếu trị bằng tenofovir disoproxil 245mg (dưới dạng fumarat) vả stavudin, tương ứng).
Ở tuần điều trị thứ 144, sự biến đối trung bình so với ban đầu vẫn tương tự ở cả 2 nhóm điều trị
(- 3, 07 và -3 ,03 login bản sao/ml; +263 vả +283 tế bảolmm3 tương ứng ở cảc nhỏm điều t1ị bằng
tenofovir disoproxil 245mg (dưới dạng fumarat) và nhóm stavudin) Người ta thấy rằng đáp ửng
bền vững với phảc đổ tenofovir disoproxil 245mg (dưới dạng fumarat) không lìên quan tới sô
lượng RNA HIV- 1 và CD4 ban đầu.
2
`fu..ỵ
Tỳ 1ệ xuất hiện đột biến KôSR ở các bệnh nhân nhóm tenofovir disoproxil fumarat hơi cao hơn
nhóm đối chứng hoạt tinh (2, 7% so với 0 ,.7%) Trong tất cả cảc trường hợp sự đề kháng với
cfavirenz hoặc với lamivudin đã có từ trước hoặc xuất hiện đồng thời với sự xuất hỉện cùa K65R.
Có 8 bệnh nhân nhiễm HIV mang đột biến K65R trong nhóm tenofovir disoproxil 245 mg (dưới
dạng fumarat), 7 trong số nây đã xuất hiện đột biến 48 tuần đầu điếu trị và trường hợp còn lại
xuất hiện ở tuần 96. Khộng có thêm trường hợp đột biến KÓSR nảo cho đến tuần thứ 144. Từ
phân tích kiếu gen và kiểu hỉnh cho thấy không có bằng chứng về các nguyên nhân khác cùa sư
đề kháng tenofovir.
Nhớm bệnh nhân nhí: Trong nghỉên cửu GS- US- 104 0321, 87 bệnh nhân nhiễm HIV- 1 tuối từ
12 đến < 18 đã từng điếu trị khảng retrovirus được dùng tenofovir disoproxil fumarat (n = 45)
hoặc giả dược (n— = 42) kết hợp với một phảc đồ tối ưu (OBR) trong 48 tuần. Số iượng tế bảo
CD4 ban đầu trung binh 1ả 374 tế bảo/mm và nồng độ RNA HIV- 1 trong huyết tương ban đầu là
4,6 login bản sao/ml.
Lamivudin
Lamivudin là một chất đổng đẳng nưcleosỉd có hoạt tính chống lại virus gây suy giảm mìễn dịch
ở người (HIV) và virus viêm gan B (HBV). Chất nảy được chuyến hóa trong tế bảo thảnh dạng
hoạt động lamivudin S’-triphosphate Cơ chế tảo dụng chính cùa thuốc là kết thủc chuỗi sao chép
ngược của virus Dạng trỉphosphate có tảo dụng ức chế chọn lọc đối với sự sao chép của HIV- 1
vả HIV- 2 trên in vitro; nó cũng có hoạt tính chống lại các chùng HIV đề kháng với zidovudin
phân lập được trên iâm sảng Lamivudin kết hợp với zidovudin cho tác đụng hiệp đồng khảng
HIV chống lại cảc chùng phân lập trên lâm sảng được nuôi cấy tế bảo ẳÌJ
Sự đề khảng của HIV- 1 đối với lamivudỉn là do có sự thay đổi amino acid M184V gi 1 tn hoạt
động cùa men sao chép ngược cùa vỉrus (RT). Biến thể nảy xuất hiện cả trên in vitro vãi trên bệnh
nhân nhiễm HIV-l được đỉều trị với thuốc khảng retrovirus có chứa lamivudỉn. Đột biên M184V
lảm giảm mạnh tính nhạy cảm với lamỉvudin vả iâm giảm khả năng sao chép cùa virus trên in
viiro. Các nghìên cứu in vitro cho thấy các chùng phân lập virus khảng zidovudin có thể trở nên
nhạy cảm với zidovudin khi chúng khảng đồng thời với lamivudin. Tuy nhiên, sự iiên quan cùa
những phảt hiện nảy trên lâm sảng chưa được xác định rõ.
Sự đế khảng chẻo do đột biến M184V ở men sao chép ngược mang lại chỉ giới hạn trong phạm
vi nhóm thuốc khảng retrovirus dạng ức chế nucleosid. Zỉdovudin vả stavudin vần duy trì hoạt
tinh kháng retrovirus chống lại HIV- ] khảng lamivudin Abacavir vẫn giữ được hoạt tính kháng
retrovirus chống 1ại HIV- 1 khảng lamivudin chỉ mang đột biến M184V. Đột biến M184V ớ men
sao chép ngược lảm giảm sự nhạy cảm đối với didanosine vả zalcìtabine dưới 4 lẳng ý nghĩa lâm
sảng của những phảt hỉện nảy chưa được biết. Cảo thử nghiệm nhạy cảm in vitro không được
chuẩn hóa vả kết quả có thể thay đối theo các yếu tố phương pháp học.
Lamivudìn thế hiện độc tính tế bảo thấp đối với tế bảo lympho mảu ngoại vi, dối với cảc dòng tế
bảo bạch cẩu đơn nhân to- đại thực bảo vả tế bảo lympho, vả đối với tế bảo tiền thân tuy xương
trên in vitro.
Kỉnh nghiệm lâm sang:
Trong các thử nghiệm lâm sảng, lamivudin kết hợp với zidovudin đã lảm giảm tải lượng virus
HIV 1 vả tăng sô lượng tế bảo CD4. Các dữ liệu lâm sảng cho thắy lamivudin kết hợp với
zidovudin lảm giảm có ý nghĩa nguy cơ phát triến bệnh và tử vong.
Chứng cứ từ cảc nghiên cứu lâm sảng cho thẳy lamivudin cộng với zidovudin lảm chậm sự xuất
hiện cảc chùng virus khảng zidovudin ơ cảc bệnh nhân không trị liệu khảng retrovirus trước đó.
Lamivudin được dùng rộng rãi như một thảnh phần trong trị liệu kết hợp kháng retrovirus với
các iảc nhân kháng retrovirus khác cùng nhóm (các thuốc NRTI) hoặc khác nhớm (các thuốc ức
chế protease, cảc thuốc NNRTI)
Trị liệu khảng retrovirus đa thuốc chứa iamivudin đã cho thấy có hỉệu quả ở những bệnh nhân
chưa từng bao giờ dùng khảng retrovirus trước đó cũng như ở những bệnh nhân hiện tại mang
virus chứa đột biến M184V.
3
DƯỢC ĐỌNG HỌC
Hấp thu
Sau khi uống tenofovir disoproxil fumarat ở những bệnh nhân nhiễm HIV, tenofovir disoproxil
fumarat được hấp thu nhanh và được chuyển hóa thảnh tenofovir. Dùng nhiều liếu tenofovir
disoproxil fumarat cùng với thức ăn ở những bệnh nhân nhiễm HIV dẫn đến oảo giá trị trung
bình (%CV) của Cmax, AUCOm, vả Cmm của tenofovir tương ứng là 326 (36,6%) ng/ml, 3324
(41,2%) ng hrlml và 64, 4 (39, 4%) ng/m1. Nồng độ tối đa cùa tenofovir trong huyết thanh đạt
được trong vòng 1 giờ khi dùng trong tình trạng đói và 2 giờ khi dùng với thức ăn. Sinh khả
dụng đường uỏng của tenofovir từ tenofovir disoproxil fumarat ở những bệnh nhân nhịn đói
khoảng 25%. Dùng tenofovir disoproxil fumarat với bữa ăn có lượng chất béo cao Iảm tăng sinh
khả dụng đường uông, với sự tăng AUC cùa tenofovir khoảng 40% và C,… khoảng 14%. Sau
liều đầu tiên cùa tenofovir disoproxil fumarat ở những bệnh nhân đã ăn, Cmax trung bình trong
huyết thanh thay đổi từ 213— 375 ng/ml. Tuy nhiên, dùng tenofovir disoproxil fumarat với bữa
ãn nhẹ không có sự ảnh hưởng có ý nghĩa trên dược động học của tenofovir.
Lamivudin được hấp thu tốt qua dường tiêu hóa, và sinh khả dụng đường uống ở người lớn thông
thường từ 80- 85%. Sau khi uỏng, thời gian trung bình (t,…) để đạt nông độ tối đa trong huyết
thanh (Cmax) là khoảng 1 giờ. Dùng đồng thời lamivudin với thức ăn dẫn đến việc lảm chậm tmav
vả C ,… thấp hơn (giảm 47 %). Tuy nhiên, mức độ lamivudin được hấp thu không bị ảnh hưởng
(dựa trên AUC).
Phân bố
Sau khi uống, tenofovir được phân bố đến hầu hết các mô với nồng độ cao nhất ở thận, gan và
lòng ruột (cảc nghiên cứu tiền lâm sảng). Trên in vitro, mức độ gắn kết của tenofovir với protein
huyết tương hoặc huyết thanh là ít hơn 0, 7 và 7,2%, tương ứng, với nồng độ của tenofovir nằm
trong khoảng từ 0, 01- 25 ựg/ml.
Thể tich phân bố trung binh của tenofovir là 1,3 l/kg. Thời gian bán hủy là 5— 7 giờ. Độ thanh
thải toản thân trung binh khoảng 0, 32 l/giờ /kg, vởi độ thanh thải chủ yêu qua thận 1ả lớn hơn 70
% qua hệ vận ohuyến cation hữu cơ
Lamivudin có dược động học tuyến tinh trong khoảng liều điều trị và có sự gắn kết hạn chế với
protein albumin huyết tương (< 16 % - 36 % đối với albumin huyết thanh trong các nghiên cứu
in vitro).
Cảo dữ lỉệu còn hạn chế cho thấy lamivudin thâm nhập được vảo hệ thần kinh trung ương và đến
dịch não tủy (CSF). Tỉ lệ trung bình của nồng độ 1amivudin trong dịch não tùy và trong huyết
thanh sau khi uống 2- 4 giờ là khoảng 0,12. Mức độ thâm nhập thật sự hoặc mối quan hệ với hỉệu
quả lâm sảng chưa được biết.
Chuyển hóa
Trong cảc nghiên cứu in vitro đã xác định rằng cả tenofovir disoprợxil fumarat lẫn tenofovir đều
không phải lả chất nền cùa hệ enzyme CYP450. Hơn nữa, ở cảc nông độ cao hơn (khoảng 300
lẩn), tenofovir đã không ức ohế sự chuyến hóa thuốc trên in vitro giản tiếp qua bất kỳ đồng dạng
nảo cùa CYP450 người liên quan đến sự biến đổi sinh học thuốc (CYP3A4, CYP2D6, C YP2C9
CYP2EI, hoặc CYPIAl/2). Tenofovir disoproxil fumarat ờ nồng độ 100 ựmolll không ảnh
hưởng trên bât kỳ đồng dạng nảo của CYP450, ngoại trừ CYPIAl/2, mà sự giảm nhỏ (6%)
nhưng oó ý nghĩa thống kê trong chuyền hóa chất nền CYPIAl/2 dã được ghi nhận Dựa trên
những dữ liệu nảy, không chắc rằng sự tương tảo oó ý nghĩa lâm sảng liên quan đến tenofovi1
disoproxil fumarat và các sản phấm thuốc được chuyến hóa bời CYP450 sẽ xảy ra.
Thời gian bản hủy pha cuối oủa lamivudin triphosphat trong tế bảo kéo dải (16 - 19 giờ) so với
thời gian bản hủy của lamivudin trong huyết tương (5- 7 giờ).
Lamivudin được thải trừ ohú yếu ở dạng khộng thay dối bới sự bải tiết qua thận. Khả năng xảy ra
sự tương tác chuyển hóa cùa lamivudin với cảc thuốc khảo là thắp do mức độ chuyền hóa qua
gan nhỏ (5-10%) và sự gắn kết protein huyết tương thấp.
Tliải trừ
4
\c..
Tenofovir được bải tiết ohú yểu qua thận bằng cả con đường lọc ở cầu thận và qua hệ thống vận
chuyến chủ động ở ống thận, khoảng 70- 80% liều dùng đường tĩnh mạch được bải tiết qua nước
tiểu dưới dạng không đổi. Độ thanh thải toản phần ước tính là khoảng 230m1/giờlkg (khoảng
300mI/phủt). Độ thanh thải qua thận ước tính là khoảng 160 ml/giờlkg (khoảng 210m1/phút), tốc
độ thanh thải tenofovir oao hơn nhiều so với tốc độ lọc ớ cằn thận. Điều nảy chi ra răng bải tiết
chủ động qua ống thận đóng vai trò quan trọng trong việc thải trừ tenofovir. Thời gian bán hủy
pha cuối cùa tenofovir sau khi uống khoảng 12 - 18 giờ.
Cảo nghiên oứu đă xảo định đường thải trừ chủ động cùa tenofovir qua ống thận là đi vảo ống
lượn gân nhờ chất vặn chuyến anion hữu cơ người (hOAT) 1 và 3 và thải ra nước tiếu nhờ
protein vân ohuyến dòng ra (protein đế khảng đa thuốc- MRP 4)
Cảo nghiên cứu ở những bệnh nhân suy thận cho thấy sự thải trừ của lamivudin bị ảnh hưởng bới
sự rối loạn chức năng thận. Một ohế độ Iiều khuyến oáo cho những bệnh nhân có độ thanh thải
creatinine dưới 50m1/phút được chi ra trong mục iiều dùng.
Sự tương tảo với trimethoprim, một thảnh phần oủa co-trimoxazole, lảm tăng 40% sự hấp thu của
lamivudin ớ cảc liều trị liệu. Điều nảy không yêu cẩu chinh liều trừ khi bệnh nhân cũng có sưy
thận. Việc dùng co-trimoxazole với lamivudin ở những bệnh nhân suy thận nên được đảnh giả
cân thận.
Glo'l tmh.
Các dữ liệu hạn chế về dược động học ở phụ nữ cho thấy không có sự ảnh hướngửlíếu cùa gỉới
tinh.
Tính cách sắc tộc:
Dược động học chưa được nghỉên cứu một cảoh cụ thể ở các nhóm dân tộc khảo nhau.
S uy thận
Các thông số dược động học của tenofovir được xác định sau khi dùng 1iều duy nhất tenofovir
disoproxil 245 mg cho 40 bệnh nhân không nhiễm HIV có oảo mức độ suy thận khác nhau được
xác định dựa vảo độ thanh thải creatinine ban đầu (CrC1) (chức năng thận binh thường khi
CrCl> 80 ml/phủt; suy thận nhẹ khi CrC1 = 50-79m1/ph1'1t; suy thận tmng binh khi CrC1 = 30-49
mllphủt và suy thận nặng khi CrC1 = ]0-29 mllphủt).
Khi so với những bệnh nhân có chức năng thận bình thường, độ hấp thu trung binh cùa tenofovir
(%CV) tăng từ 2185 (12%) ng—giờ/ml ở những bệnh nhân có CrC1> 80mI/phút đến 3064 (30%)
ng- giờ/ml, 6009 (42%) ng giờ/ml và 15985 (45%) n - giờ/ml tương ứng ở những bệnh nhân suy
thận nhẹ, trung binh và nặng. Sự khuyến cảo vế lieu dùng ở những bệnh nhân suy thận với
khoảng cảoh giữa 21ần dùng thuốc tăng oó thể dẫn đến nồng độ đinh trong huyết tương cao hơn
vả nông độ Cmin thâp hơn ở những bệnh nhân suy thận so với bệnh nhân có chức năng thận bình
thường. Sự liên quan oùa vấn đề nảy trên lâm sảng chưa được biết.
Ở những bệnh nhân bệnh thận giai đoạn cuối (ESRD) (CrC1 < 10 ml/phút) đang yêu cầu thấm
phân mảu, nông độ tenofovir giữa các lần thấm tách tăng đáng kể trong suốt 48 giờ đạt được
C,…ư trung binh là 1032 nng và AUCo.48h trung binh là 42857 ng giờlmi.
Khoảng oách liểu cùa tenofovir disoproxil 245mg (dưới dạng fumarat) được khuyến cáo giám
nhẹ ở những bệnh nhân có độ thanh thải creatinine < SOmI/phút hoặc ở những bệnh nhân oó bệnh
thận giai đoạn cuối và yêu oầu thẩm tách.
Dược động học oùa tenofovir ở những bệnh nhân không thầm phân máu có độ thanh thải
creatinine < lOml/phút và ở những bệnh nhân có bệnh thận giai đoạn cuối được kiếm soát bằng
thẩm phân mảng bụng hoặc cảc hình thức khác của thẩm phân không được nghiên cứu.
Nồng độ Lamivudin tăng ở những bệnh nhân suy thận trung binh đến nặng do độ thanh thải
giam.
Suy gan
Liêu duy nhât 245mg tenofovir disoproxil được dùng cho những bệnh nhân không nhiễm HIV có
oảo mức độ suy gan khảo nhau được xảo định theo sự phân loại Child-Pugh-Tưrcotte (CPT).
5
Dược động học cùa tenofovir về cơ bản không bị thay đối ở những bệnh nhân suy gan gợi ý rằng
không cân điều chinh liếu ở những bệnh nhân nảy. Giá trị Cm ma,, trung binh (hệ sô biên thiên -
CV%) vả AUCo. … trung binh (%CV) lả 223 (34,8%) ng/rnl vả 2, 050 (50, 8%) ng giờ ’m1,tương
ứng, ở những bệnh nhân bình thường so với 289 (46%) ng/ml và 2,310 (43,5%) ng- gỉờ Íml ớ
những bệnh nhân suy gan trung bình, và 305 (24,8%) ng/rnl và 2,740 (44%) ngh/ml ở những
bệnh nhân suy gan nan g
Dược động học của lamivudin không bị ảnh hưởng đảng kế bởi sự suy chức năng gan.
CHỈ ĐINH
Viên kết hợp liếu oố định Tenofovir disoproxil fumarat 300mg/Lamivudin 100mg đuợc chỉ định
trong điếu trị nhiễm Vỉrus HIV- 1 gây suy giảm mỉễn dịch ở người lớn vả thanh thiếu niên (từ 12
tuổi trở iên vả cân nặng 2 3Skg)
LIÊU DÙNG VÀ CÁCH DÙNG
Nên bắt đầu điều trị với một thầy thuốc có kinh nghiệm điếu trị nhiễm HIV.
Trong các trường hợp ngoại lệ ở những bệnh nhân nưốt đặc biệt khó khăn, có thể dùng sau khi
cho rã viên thuốc Tcnofovir/Lamivudin trong ít nhất 1001111 nước, nước cam hoặc nước nho
Liều lượng:
Người lớn: Liều khuyến cáo cùa viên kết hợp liếu cố định Tenoiovir disoproxil ưmarat 300
mg/Lamivudin 100mg (1 viên) lả ] lần mỗi ngảy, được dùng đường uống với thức ăn Đề hấp
thu tốt nhắt tenofovir, viên kết hợp liếu cố định Tenofovir disoproxil fumarat 300mg/Lamivuđin
100mg được khuyến cảo nên được dùng vởi thức ăn.
Khi có chỉ định ngừng điều trị với một trong cảc thảnh phần cùa viên kết hợp lỉều cố dịnh
Tenofovir đisoproxil fumarat 300mg/Lamivudìn 100mg hoặc cân thay đồi liều thi có thể dùng
cảc thuốc có thảnh phần tenofovir disoproxil fumarat vả iamivudin đơn chất.
Nếu bệnh nhân quên một lỉều viên kết hợp 1iếu cố định Tenotovir disoproxil fưma1at
300mg/Lamívudin 100mg trong vòng 12 giờ, bệnh nhân nên uổng viên kết hợp liếu cố định
Tenofovir disoproxil fumarat 300mg/Lamỉvudin 100mg với thức ăn cảng sớm cảng tốt và lại tiếp
tục dùng thuốc theo thời gian biếu bình thường cùa họ. Nếu bệnh nhân quên một liếu vỉên kết
hợp lìều oố định Tenofovir disoproxil tumarat 300mg/Lamìvudin 100mg sau hơn 12 giờ và gần
đến giờ cho liếu kế tiếp, bệnh nhân nên bỏ liếu đã quên và lại tiêp tục dùng thuốc theo thời gian
bíếu binh thường của họ.
Nếu bệnh nhân nôn trong vòng 1 giờ sau khi uống viến kết hợp liếu cố định Tenofovir đisoproxil
fumarat 300mg/Lamivudin 100mg, bệnh nhân nên uống lại một viên kết hợp. Nếu bệnh nhãn nôn .
sau 1 giờ sau khi uỏng vìên kết hợp liều cố định Tenofovir đisoproxil fumarat 300mg/Lamiwdin .
100mg thì bệnh nhân không oần uỏng lại viên kết hợp
Bệnh nhân nhi: Viên Tenofovir disoproxil fumarat không được khưyến cảơ dùng cho trẻ em
Dữ liệu lâm sảng sẵn có ở những thanh thỉếu niên bị nhiễm HIV- 1 không đủ để hỗ trợ cho việc
dùng tcnofovir disoproxil fumarat ở bệnh nhân nhi và hiện nay không có sẵn dữ liệu ở trẻ em
nhỏ hơn.
Người Iởn tuổi: Không có sẵn dữ liệu để đưa ra liếu khuyến cáo cho những bệnh nhân trẻn 65
tuôí
Suy rhận:
Viên kết hợp lỉếu cố định Tenofovir disoproxil fumarat 300mg/Lamivudin 100mg không khuyến
cáo cho bệnh nhân suy thận mức độ trung binh hoặc nặng (độ thanh thải creatinine < SOml/phút).
Những bệnh nhân suy thận mức độ trung bình hoặc nặng mã không thể đạt được kết quả với lỉều
thông thường cùa vỉên thuốc kết hợp, yêu cằn phải đìếu chinh khoảng cảoh liếu dùng.
Suy gan:
Việc điếu ohỉnh liếu của vỉên kết hợp liếu cố định Tenofovir disoproxil fumarat
300mg/Lamỉvudin 100mg lá không cần thiết đối với nhtmg bệnh nhân suy gan mức độ trung
bình hoặc nặng trừ khi có kèm theo suy thận.
CHỐNG CHỈ ĐỊNH ,
Viên kết hợp lìều cố định Tcnofovir disoproxil fumarat 300mg/Lamivudin 100mg được chông
chỉ định ở những bệnh nhân được biết quá mẫn với tenofovir hoặc 1amivuđỉn.
CẨNH BÁO VÀ THẬN TRỌNG ĐẶC BIỆT KHI DÙNG THUỐC:
Viến kết hợp lỉếu cố định Tenofovir disoproxil fumarat 300mg/Lamỉvudin 100mg không nên
dùng cùng với bẩt kỳ thuốc nảo khảo có chừa tenofovir disoproxil fumarat hoặc lamivudin.
Bệnh nhân phải được thông bảo rằng tenofovir disoproxil fumarat chưa được chứng minh là có
thể ngăn ngừa được nguy cờ lây truyền HIV cho những người khác thông qua quan hệ tinh dục
hoặc nhiễm qua máu. Cần tiếp tục ảp dụng những bỉện pháp phòng ngừa thich hợp.
Tenofovir disoproxil fumarat _
Việc dùng đống thời của cảc sản phầm rhuốc khác: ,
- Viên Tenofovir disoproxil fumarat không nên được dùng đồng thời với cảỡ chế phâm
thuốc khảo oó chứa tenofovir disoproxil fumarat.
- Viến Tenofovir disoproxil fumarat không nên được dùng đồng thời với adcfovir
dipivoxil.
- Víệc dùng đồng thời tenofovir disoproxil fumarat vả didanosine không đuợc khuyến cáp.
Vỉệc dùng đồng thời tenofovir disoproxil fumarat vả didanosine lảm tăng 40-60% độ hâp
thu toản thân cùa didanosine mã có thế lảm tăng nguy cơ cảc phản ứng không mong
muốn líên quan đến didanosine. Viêm tụy và chứng nhiễm acid lactic, đôi khi gây tử
vong, được ghi nhận nh1mg hiếm. Việc dùng đồng thời tenofovir disoproxil fumarat vả
didanosinc ở liếu 400 mg mỗi ngảy lảm giảm đáng kể số lượng tế bảo CD4, có thế do sự
tương tảo nội bảo lảm tâng sự phosphoryl hóa didanosìne. Đã có những báo cảo vế tỉ lệ
thắt bại cao về virus học khi dùng liếu 250mg didanosine đồng thời với tenofoviy
disoproxil fumarat trong phạm vi một số phảc đồ phối hợp thuốc được thử nghiệm đê
đìều trị nhỉễm HIV-l.
Suy thận: Tcnofovir được thải trừ chủ yếu qua thận. Suy thận, chức năng thận kém, tăng
creatinine, hạ phosphat huyết và bệnh lý ở ống lượn gần (kể cả hội chứng Fanconi) đã được ghi
nhận với việc dùng tenofovir đisoproxil fumarat trong thực nghiệm lâm sảng.
Sự an toản đối với thận của tenofovir chỉ được nghiên cứu ở một mức độ rất giới hạn ở những
bệnh nhân suy ohức năng thận (độ thanh thải creatinin < 80ml/phút).
Khuyến cảơ nên đo lường độ thanh thải creatinine ờ tẳt cả cảc bệnh nhân trước khi điều trị với
tonofovir disoproxil fumarat và giám sảt chửc nãng thận (độ thanh thải creatinin vả phosphat
huyết thanh) mỗi 4 tuần trong suốt 1 năm đầu đỉếu trị, và sau đó iả mỗi 3 thảng. Ở nhfmg bệnh
nhân có nguy cơ suy thận, kể cả những bệnh nhân đã có những vấn đề về thận trước đó trong khi
dùng adefovir dipivoxil, cần xem xét theo dõi chức năng thận thường xuyên hơn.
Những bệnh nhân có độ thanh thâi' creatinin < 50mI/phủl, kể cả những bệnh nhân chạy ihc_in
nhăn lạo: Những dữ liệu về sự an toản vả híệu quả cùa tenofovir disoproxil furnarat bị giới hạn Ở
những bệnh nhân suy chửc năng thận. Do đó, tenofovir disoproxil fumarat chỉ nên được dùng
nếu những lợi ich của việc điếu trị vượt hờn hẳn những nguy cơ có thể xảy ra. Khỏng khuyến cản
dùng tenofovir ở những bệnh nhân suy thận nặng (độ thanh thải creatinin < 30m1/phủt) và ở
những bệnh nhân cân chạy thận nhân tạo. Nếu không có sẵn đìếu trị thay thế thì phải điếu chinh
khoảng cách giữa 2 lần dùng thuốc và nên theo dõi chặt chẽ chức năng thận.
Nếu phosphat huyết thanh nhỏ hơn 1,5mg/dl (0, 48mmolli) hoặc độ thanh thải creatinin bị gìảm
xuống dưới 50ml/phút, nên đảnh giá lại chức năng thận trong vòng 1 tuần, baọ gồm việc định
lượng glucose huyết, kali huyết vả nông độ glucose trong nước tiếu, và nên điếu chỉnh khoảng
cảoh giữa 2 lần dùng thuốc Tenofovir disoproxil fumarat. Nên xem xét tạm ngừng diều trị với
7
\ :
tenofovir disoproxil fumarat ở những bệnh nhân có độ thanh thải creatinin bị giảm xuống dưới
SOmI/phủt hoặc gỉảm phosphat huyết thanh xuống dưới lmgldl (0,32mm01/1). _
Trảnh dùng tenofovir disoproxil fumarat khi dang dùng hoặc vừa mởi dùng một thuôo có độc
tính trên thận (như aminoglycosides, amphotericin B, foscamet, ganciciovir, pentamidine,
vancomycin, cidofovir hoặc interleukin-2). Nên theo dõi chức nãng thận hảng tuần nếu việc dùng
đồng thời tenofovir disoproxil fumarat và các thuốc có độc tinh trên thận không thể trảnh được.
Tenofovir disoproxil fumarat không được đánh giá iâm sảng ở những bệnh nhân đang dùng các
thuốc mà được bải tiết bới cùng oon đường qua thận, kể cả bằng cảc protein vận chuyến anion
hữu cơ người (hOAT) ] vả 3 hoặc MRP 4 (như adefovir dipivoxil; cidofovir, một thưốc có độc
tinh trên thận đã biết) Các protein vận chuyến ớ thận nảy có thể chịu trảch nhiệm cho sự bải tiết
ở ống thận và một phần sự thải trừ ớ thận cùa tenofovir, adefovir vả cidofovir. Do đó, dược động
học của những thuốc mà được bải tiết qua cùng một con đường“ 0 thận kể cả bằng các protein vận
chuyến hOAT 1 và 3 hoặc MRP có thế bị thay đổi nếu chủng được dùng đồng thời. Trừ khi thật
cân thiết, không khuyến khích dùng đổng thời những thuốc nảy, nhưng nêu việc di… đồng thời
nảy không thế trảnh được thì cân theo dõi chức năng thận hảng tuần. Ồ“
Cảo tác động trên xương: Trong một nghiên cứu lâm sảng có kiếm soát 144 tuến so sảnh
tcnofovir disoproxil fumarat với stavưdin khi dùng kết hợp với 1amivudin vả efavirenz đế điếu trị
cho những bệnh nhân lấn đẳu dùng thuốc khảng retrovirus, ở những bệnh nhân nhiễm HIV có sự
giảm nhẹ mật độ chất khoáng trong xương hông và xương sông ở cả 2 nhóm điếu trị. Sự giảm
mật độ chất khoảng trong xưong ớ xương sông và những thay đổi trong chắt đảnh dắu sinh học ở
xương tử trước khi điếu trị lớn hơn đảng kế ở nhóm điều trị với tenofovir disoproxil fumarat ớ
tuần thứ 144 Sự giảm mật độ chất khoảng trong xương hông lớn hơn đáng kế ở nhóm nảy cho
đến tuẫn thứ 96. Tưy nhiên, không có sự tăng nguy cơ gãy xương hay chứng cứ cho thắy cảc bắt
thường về xương liên quan đến lâm sảng trong suốt 144 tuần.
Cảo bắt thường về xương (hiếm khi gỏp phần vảo sự gãy xương) có thể kèm theo bệnh lý ống
lượn gần ' ,
Nên hỏi ý kiên bảo sĩ nêu nghi ngờ hoặc phảt hiện cảc bắt thường về xương.
Bệnh về gan: Cảo dữ liệu vê sự an toản và hiệu quả ở nhũng bệnh nhãn ghép gan rất hạn chế.
Các đữ liệu về sự an toản và hiệu quả của tenofovir disoproxil fumarat ở những bệnh nhân bị
nhìễm viêm gan siêu vi B có bệnh gan mắt bù và có chi sỏ Child- Pugh- Turcotte (CPT) lớn hơn 9
bị hạn chế. Những bệnh nhân nảy có thế có ngưy cơ có các phản ứng không mong muốn nặng
trên thận và gan cao hơn. Do đó, cảo thông số thận và gan mật nên được theo dõi chặt chẽ ở
những bệnh nhân nảy.
Đợi cấp của viêm gan:
Sự bimg phát irong khi điều trị: Cảo đợt cấp tự phảt của viêm gan B mãn tính lả khá phổ bỉển và
thường đặc tnmg bởi sự tảng thoảng qua ALT huyết thanh. Sau khi trị lìệu khảng virus bắt đầu,
ALT huyết thanh có thể tăng ở một sô bệnh nhân. Ở những bệnh nhân có bệnh gan bù, sự tâng
ALT huyết thanh thường không đi kèm với sự tảng nồng độ bilirubin huyết thạnh hoặc sự mắt bu
gan Những bệnh nhân xơ gan có thể có nguy cơ mât bù gan cao hơn sau đợt cấp vỉêm gan, vả do
đó nến được theo dõi chặt ohẽ suốt đợt đỉếu trị.
Sư bùng phát sau khi ngùng điều trị: Đợt oấp viêm gan cũng đã được ghi nhận ở những bệnh
nhân đã ngừng điếu trị viêm gan B. Cảo đợt câp sau địều trị thường đi kèm vởi việc tăng HBV
DNA và đa sô xuất hiện hạn chế. Tuy nhiên, các đợt cấp nặng, kể cả tử vong, đã dược ghi nhận
Chức năng gan nên được giảm sảt định kỳ cả về lâm sảng vả cặn lâm sảng trong ít nhắt 6 tháng
sau khi ngưng điếu trị viêm gan B Nếu thich hợp, có thể bắt đằu lại việc điếu trị viêm gan B. Ở
những bệnh nhân xơ gan hoặc bệnh gan tiến triển, việc ngừng điếu trị không được khuyến cảo vì
đợt câp cua viêm gan sau điếu trị có thể dẫn đến sự mất bù gan.
Sự bùng phát bệnh gan đặc biệt nghiêm trọng, vả đôi khi gây tử vong ở những bệnh nhân có
bệnh gan mắt bù.
Nhiễm đồng thời viêm gan C hoặc D Không có dữ liệu về hiệu quả cùa tenofovir ở những bệnh
nhân nhiễm đồng thời viêm gan C hoặc D.
Nhiễm đồng ihời Hỉ V ] và viêm gan B: Do nguy cơ xuất hiện sự đề kháng cùa HIV, tenoi'ovh
disoproxil fumarat chỉ nên được dùng như một phẩn của chế độ điếu trị kháng retrovirus kết hợp
ở những bệnh nhân nhiễm đồng thời HIV và viếm gan siêu vi B. Những bệnh nhân đã có suy
giảm chức năng gan trước đó kê cả viêm gan thể hoạt động mãn tính có sự tăng tần số xuất hiện
các bắt thường chức năng gan trong suốt thời gian điếu trị khảng retrovirus kết hợp và nên được
giám sảt theo thực hảnh tìêu chuẩn. Nếu có chứng cứ oho thấy bệnh gan trở nên xâu hơn ở những
bệnh nhân nảy, nến xem xét tạm ngừng hoặc ngừng việc điêu trị. Tuy nhiên, nên chủ ý rằng sự
tảng men gan ALT có thế là một phân cùa sự thanh thải virus viêm gan B trong thời gian điêu trị
với tenofovir.
Lamivudin
Suy thận: Ở những bệnh nhân suy thặn trung bình đến nặng, thời gian bản hùy pha cuối trong
huyết tương của lamivudin tăng do độ thanh thải giảm; vì thế cần điều chinh liếu 0 những bệnh
nhân nảy
Bệnh gan: Những bệnh nhân bị viêm gan B hoặc C mạn tinh và được điếu trị với tqlx'ệu khảng
retrovirus kết hợp sẽ tăng nguy cơ các phản ứng phụ trên gan nặng vả có khả năng gây tử vong.
Trong trường hợp trị liệu kháng virus đổng thời cho điếu trị viêm gan B hoặc C, vui lòng tham
khảo thông tin sản phầm liên quan cho những thuốc nảy.
Nếu viên Lamivudin không được tiếp tục dùng cho những bệnh nhân bị nhiễm đổng thời với
viêm gan B, cẩn theo dõi định kỳ các xét nghiệm chức nãng gan và cảc dấu hỉệu cùa sự tái tạo
virus viếm gan B, vì sự ngừng lamivudin có thể dẫn đến một đợt bộc phải cẩp tinh cùa viếm gan.
Ở những bệnh nhân, bị suy giảm chức năng gan trước đớ, kể cả viêm gan thể hoạt động mãn tinh
đã có sự tăng tần số các bất thường chức năng gan trong thời gian trị liệu kháng retrovirus kết
hợp, vả nên được theo dõi theo thực hảnh chuẩn. Nếu có chứng cứ cho thắy bệnh gan trở nên xẩu
hơn ở nhũng bệnh nhân nảy, nẻn xem xét tạm ngừng hoặc ngưng điếu trị
Sự an toản vả hiệu quả của viên kểt hợp liều cố định Tenofovir disoproxil fumarat
300mg/Lamìvudin 100mg chưa được thiết iập ở những bệnh nhân có các rối loạn gan dưới mức
ý nghĩa.
Chứng nhỉễm acid lactic: Chứng nhiễm acid lactỉc, thường kèm với nhiễm mở ở gan, đã được
ghi nhận khi dùng cảc thuốc đổng đẳng nucleosid. Các dữ liệu lãm sảng vả tìến lãm sảng gợi ý
rằng nguy cơ xảy ra chứng nhiễm acid iactio, một tảo dụng ngoại ý chung của cảc đồng đắng
nucleosid, là thấp đối với tenofovir disoproxil fumarat. Tưy nhiên, vì tenofovir có câu trúc liên
quan đến các đồng đẳng nucleosid, nên nguy oơ nảy không thế loại trừ. Cảo triệu chứng sớm
(tăng 1actat huyết oó triệu chứng) kể cả cảc triệu chứng tiêu hóa nhẹ (buổn nôn, nôn và đau
bụng), mệt mỏi không đặc hiệu, vả giảm sự thèm ăn, giảm oân, các triệu chứng hô hấp (thờ
nhanh vả/hoặc thờ sâu) hoặc các triệu chứng thẳn kinh (kể cả kém vận động) Chứng nhiễm acid
1actic oó ti 1ệ tử vong oao vả có thế đi kèm viêm tụy, suy gan hoặc suy thận. Chứng nhiễm acid
lactic thường xảy ra sau một vải tháng hoặc nhiếu thảng điều trị
Nên ngừng điếu trị bắng cảc đồng đẳng nucleosid nêu có sự tăng iactat huyết có triệu chứng và
nhiễm acid lactic/nhiễm acid chuyền hóa, chứng gan to tiến triến, hoặc sự tăng nhanh nông độ
aminotransferasc.
Nên thận trọng khi dùng các đồng dẳng nucleosid cho bất kỳ bệnh nhân nảo (đặc bìệt 121 phụ nữ
béo phi) có chứng gan to, viêm gan hoặc cảc yếu tố nguy cơ được biết khác về bệnh gan và
chứng nhiễm mở ở gan (bao gổm cả một số thuốc nhắt định và cồn). Những bệnh nhân bị nhiễm
đông thời với viêm gan C vả được điều trị với aipha íntcrferon vả rìbavirin có thể tạo thảnh một
nguy cơ đặc bỉệt.
Những bệnh nhân có nguy cơ cao cần được theo dõi chặt chẽ.
Lỉệu pháp điểu trị vơi 3 thuốc nucleosid: Tỉ lệ thẳt bại cao về virus học và sự xuất hiện khảng
thuốc ở giai đoạn đầu đã được ghi nhận khi lamivudỉn được kết hợp với tenofovir dìsoproxii
9
fumarat vả abacavir cũng như với tenofovir disoproxil fumarat vả đỉdanosine khi dùng liều một
lằn mỗi ngảy.
Nhiễm trùng cơ hội: Những bệnh nhân đang dùng viên kết hợp liều cố định Tenofov' 11
disoproxil fumarat 300mg/Lamivudin 100mg hay bất kỳ trị 1ỉệu khảng retrovirus nảo khác đếu có
thể tiếp tục mắc cảo nhiễm trùng cơ hội vả các biến chứng khác cùa bệnh nhiễm HiV, và vì thế
nến tiêp tục được những thầy thuốc có kinh nghiệm trong điếu trị những bệnh liên quan đến HIV
theo dõi lâm sảng ohặt chẽ
Sụ lây Iruyển HI V Những bệnh nhân nên được khuyến rằng trị liệu kháng retrovirus hiện tại, kể
cả viên kết hợp iiếu có định Tenofovir disoproxil fumarat 300mg/Lamivudin 100mg, không được
chứng minh là ngăn ngừa được nguy cơ lây truyền HIV cho những người khác thông qua quan
hệ tình dục hay sự nhiễm qua mảu. Các biện pháp phòng ngừa thích hợp vẫn nên tíêp tục thưc
hiên.
Viêm tụy: Hiếm xảy ra cảc trường hợp viêm tụy. Nên ngừng ngay việc điếư trị với viên kết hợp
lỉều cố dịnh Tenofovir disoproxil fumarat 300mg/Lamivuđỉn 100mg nểu thây xuất hiện các dân
hiệu, triệu chứng lâm sảng hay cảc bắt thường cận lâm sảng gợi ý viêm tụy xảy ra. đV
Loạn ehức nãng ty lạp rhễ: Cảo đồng đẳng nucleosid vả nucleotide đã được oht’mg niinh trên in
vitro và in vivo là gây ra sự phá hủy ty lạp thế ở mức độ khác nhau Có những báo cảo cùa sự
ioạn chức năng ty lạp thế ở những trẻ sơ sinh am tính với HIV đã phơi nhỉễm trong tử cung vả!
hoặc sau sinh với cảc đồng đẳng nucleosid. Các phản ứng phụ chinh yêu đã được ghi nhận lả cảc
rối loạn về huyết học (thiểu mảu, giảm bạch câu trung tinh), rối loạn chuyến hóa (tăng 1ạctat
huyết, tăng lipid huyết). Các phản ứng phụ nảy thuờng lả thoáng qua Một sô rối loạn thần kình
bùng phải muộn đã được ghi nhận (tăng trương lựo, co giật, hảnh vi bất thường). Các rối loạn
thần kinh là thoáng qua hay vĩnh viễn hiện tại chưa được biết. Bắt kỳ đứa trẻ nảo đã phơi nhiễm
trong tử cung với các đồng đẳng nucleosid vả nucleotide, ngay cả những đứa trẻ âm tính với
HIV, nên được theo dõi vê lâm sảng và cận lâm sảng vả nến được khảm xét đầy đủ do loạn chức
năng ty lạp thế có thể xảy ra trong trường hợp các dấu hiệu hoặc các triệu chứng liên quan xảy
ra Cảo phát hiện nảy không ảnh hưởng đến sự khuyến cáo hỉện tại dùng trị liệu retrovirus ở phu
nữ mang thai để ngăn ngừa sự lây trưyến dọc HIV.
Loạn dưỡng mỡ: Ở những bệnh nhân HIV trị liệu kháng retrovirus kết hợp có sự phân bố lại mở
trong cơ thể (loạn dưỡng mờ). Hậu quả lâu dải cùa những trường hợp nảy hiện tại chưa được
biết. Sự hiếu biết vệ cơ ohế thi không đẩy đủ Có giả thuyết cho rãng có sự liên quan gỉữa bệnh 11
mở nội tạng với cảc chất ức chế protease và sự loạn dưỡng mở với cảc chất ức chế men sao chép
ngược nucleosid Nguy cơ cao hơn cùa sự loạn dưỡng mở được đi kẻm với cảc yếu tố cả nhân
như lớn tuổi, và các yêu tố liên quan đến thưốc như thời gian điếu trị với thuốc kháng retrovirus
dải hơn vả có rối loạn chuyến hóa đi kèm. Nên kiềm tra lâm sảng kể cả việc đảnh giá các dấu
hiện thế chất của sự phân bố lại mỡ. Nên đo lipid huyết thanh vả glucose huyết lủc đới. Cảo rối
loạn về mở cẩn được điếu trị lâm sảng phù hợp.
Hội clnmg phục hồi miễn dịch: Ở những bệnh nhân nhỉễm HIV bị suy giảm miễn dịch nặng vảo
thời điếm khỏi đầu trị 1iệu khảng retrovirus kết hợp (CART), một phản ứng vìêm đổi với cảc tác
nhân gây bệnh cơ hội có hoặc không có triệu chứng có thề nảy sinh và gây những tình trạng lãm
sảng ngưy hiếm, hoặc 1ảm trầm trọng thêm triệu chứng bệnh. Các phản ứng tiêu bỉếu như thế đã
được quan sât thấy trong vải tuần hoặc vải tháng đầu của trị lìệu khảng retrovirus kết hợp Các ví
dự liên quan lả viêm võng mạc virus cụ bảo, nhỉễm trùng toản thân vả/ hoặc sự nhiễm trùng đo
mycobacterỉum, và viêm phối do Pneumocystis jirovecii Bất kỳ trỉệu chứng viêm nảo cũng nên
được đánh giả và điếu trị khi cằn thiết
Hoại từ xương: Mặc dù khoa nghiên cứu nguyện nhân bệnh đã xem ert đến nhiếu yếu tế (kể cả
việc dùng corticosteroid, uỏng rượu, ức chế miên dịch nặng, chỉ sô khôi co thế cao), cảc trường
hợp hoại từ xương đă được ghi nhận đặc biệt ở những bệnh nhân bị bệnh HIV trước đó vả/hoặc
dùng trị liệu kháng retrovirus kết hợp thời gỉan dải (CART). Nên khuyên bệnh nhân gặp thẩy
thuốc nếu họ bị đau và nhức khớp, cứng khớp hoặc khó khăn trong việc di chuyến
10
Người lớn Iuỗi: Vìên kết hợp liếu cố định Tenofovir disoproxil fumarat 300mg/Lamivưdin
100mg không được nghiên cữu ở những bệnh nhân trên 65 tuôi. Những bệnh nhân lớn tuôi có thế
có chức nảng thận gỉảm nhiếu hơn; do đó cằn thận trọng khi điếu trị cho những bệnh nhân lớn
tuối bằng tenofovir disc roin fumarat.
TƯONG TÁC VỚI CAC THUỐC KHÁC VÀ cÁc DẠNG TƯONG TÁC KHẢC:
Cảo nghiên cứu về tương tác chỉ được thực hiện ở người lớn.
Tenofovir disoproxil fumarat
Dựa trên kết quả thực nghiệm in vit… vả con đường thải trừ được biểt của tenofovir, khả năng
tương tảo qua trung gian CYP450 của tenofovir vởi cảo thuốc khảo là thắp.
11ẹc dùng đống ihời không được khuyến cảo.
Viên Tenofovir disoproxil fumarat khỏng nên được dùng đồng thời với cảc thuốc khảo có chứa
tenofovir disoproxil t`ưmarat
Viên Tenofovir disoproxil fưmarat không nên được dùng đồng thời với adefovir dipivoxil.
Didanosine: Dùng đồng thời tenofovir disoproxil fumarat vả didanosine không được khuyến cáo
Cảo ilmổc được rhái trừ qua thận: Vi tenofovir được thải trừ chủ yếu qua thận, việc dùng đồng
thời tenofovir disoproxil furnarat với các thuốc mà 1ảm giảm chức năng thận hoặc cạnh tranh sự
bải tỉết chủ động qua ông thận thông qua các protein vận chuyến hOAT 1, hOA'I 3 hoặc MRP 4
(như cidofovir) có thể lảm tăng nông độ trong huyết thanh cứa tenofovir vâfhoặc các thuốc dùng
chung. ẵJ
Trảnh dùng tenofovir disoproxil fưmarat khi đang dùng hoặc vữa mới dùng một thư có độc
tính trên thận Một số ví đụ gôm, nhưng không bị giới hạn aminoglycosìdcs, amphotericin B
foscamet, ganciclovir, pentamidine, vancomycin, cidofovir hoặc interleukin-2
Vì tacrolimus có thể ảnh hướng đến chức năng thận, cần theo dõi chặt chẽ khi dùng đồng thời
thuốc nảy với tenofovir disoproin fumarat.
Các iương rác khác: Các tương tác gỉữa tenofovir disoproxil fumarat vả cảc thuốc ức chế
protease vả cảc tảo nhân khảng retrovirus khác với cảc thuốc ức chế protease được liệt kê trong
bảng 1 bên dưới (sự tăng được chỉ bởi dấu “T’,’ sự giảm được chi bới dấu “ị”, không thay đối
được chỉ bởi dẳu 'c—›", 2 lần mỗi ngảy được chỉ bằng chữ “b.' 1. d., ” vả 1 lằn mỗi ngảy được chi
bằng chữ “q.d.”).
Bảng 1: Sự tương tác giữa tenofovir đisoproxil fumarat và các thuốc khác
Thuốc theo nhóm trị liệu
Các tảo động trên nồng độ
Khuyến cáo liên quan đễn
(liều(mg)) thuốc việc đùng đồng thời với
Thay đỗi trong AUC, Cmax, tenofovir disoproxil fu marat
Cmin (% trung bình) 300mg
KHẢNG VIỂM
Kháng retrovirus
Các thuốc ửc chế Protease
Atozanavìr/Ritonavir Atazanavir: Không cần điếu ohinh liếu. Độ
(300mg 1 lần mỗi ngảyl 100mg AUC: ị25% hấp thu của tenofovir tăng có
1 lần mỗi ngảy/300mg 1 lần Cmax; 1 28% thể lảm tăng cảo phản 1'mg phụ
mỗi ngảy) Cmin: 1 26% lìên quan đến tenofovir, kế cả
Tenofovir: cảc rỏi loạn ở thận Nên theo
AUC : T 37% dõi chặt chẽ chức năng thận.
Cmax: T 34%
Cmin: ị 29%
LopinavirlRitonavir
(400mg 2 lần môi ngảy/lOOmg
2 lần mỗi ngảyỉ300mg ] lần
Lopinavir/ritonavír:
Tảo động không có ý nghĩa
trên các thông sô được động
Không cần đỉếu chinh liếu. Độ
hấp thu của tenofovir tăng có
thể lảm tăng cảc phản ứng phụ
11
mỗi ngảy)
học của lopinavir/ritonavir.
Tenofovir:
liên qưạn đên tenofovir, kế cả
cảc rôi loạn ở thận. Nên theo
AUC: T 32% dõi chặt chẽ chức năng thận.
Cmax: H
Cmin: T 51%
Damnavir/Ritonavir Damnavir: Không oần điếu chinh iiếu. Độ
(300/100mg 2 lẩn mỗi Tác động không có ý nghĩa hấp thu của tenofovir tăng có
ngảyf300mg 1 lần mỗi ngảy)
trên cảc thông sô dược động
học cùa darunavir/ritonavir
Tcnofovir:
AUC: T 22%
Cmin: T 37%
thế iâm tăng cảc phản ứng phụ
liên quan đến tenofovir, kể cả
cảc rõi loạn ở thặn. Nên theo
đôi chặt chẽ chức nãng thận.
THUỐC Ức CHẾ SAO CHÉP NGƯỢC NUCLEOSID (NRT
1)
Didanosine
Việc dùng đổng thời tenofovir
disomoxil fumarat vả
didanosine lảm tăng 40-60%
độ hấp thu toản thân của
didanosine mã có thể lảm tăng
nguy cơ cảc phản t'mg không
mong muốn liên quan đến
didanosine. Vìêm tụy vả
chứng nhiễm aoid laotic, đôi
khi gây ohết, đã được ghi nhận
nhưng híếm. Việc dùng đồng
thời tenofovir disoproxil
fumarat vả didanosine ờ liếu
400 mg mỗi ngảy 1ảm giảm có
ý nghĩa số lượng tế bảo CD4,
có thế do tương tác nội bảo
lảm tãng phosphoryl hóa
didanosỉne. Đã có những báo
cảơ vế tỉ lệ thất bại cao về
virus học khi didanosine lỉếư
250 mg được dùng đổng thời
với tenofovir disoproxil
furnarat.
Việc dùng đồng thời tenofovir
đisoproxil fumarat vả
didanosine không được
khuyến cáo.
Adefovir dipivoxil
AUC: <-›
Cmax= H
Tcnofovir disoproxil fumarat
không nên được dùng đông
thời với adefovir dipivoxil.
Entecavir
AUC: ơ—›
CmaxỄ f"'
Không có nhũng tương tác
dược động học có ý nghĩa lãm
sảng khi tenofovir disoproxil
fumarat được dùng đồng thời
với enteoavir.
Các nghiên cứu được thực hiện với các ihuốc khảc: Không có những tương tảo dược động học có
ý nghĩa lâm sảng khỉ tenofovir disoproxil fumarat được dùng đông thời với emtricỉtabine,
lamivudin, indinavir,
efavirenz,
nclfmavir, saquinavir,
methadone,
ribavirỉn, rỉfmnpioỉn,
tacrolimus, hoặc thuốc trảnh thai hormon norgestimate/ethinyl oestradiol.
12
Tenofovir disoproxil fumarat phải được uống với thức ăn vì thức ăn lảm tảng sình khả dụng của
Tenofovir.
Lamivudin
Cảo nghỉên cứu về tương tảo chi được thực hiện 0 người iớn
Không khưyến cảo dùng đổng thời lamivudin với ganciclovir hoặc foscarnet đường tĩnh mạch.
Khả năng có tương tảo trong chuyến hóa thấp do mức độ chuyến hỏa và sự gấm kết vơi protein
huyết tương lả thắp và hầu hết thải trừ qua thận.
Việc dùng trimethoprim|sulfamethoxazol lóOmg/8ỌOmg dẫn đến tăng 40% độ hấp thu của
lamívudin, do thảnh phẳn trimethoprìm; thảnh phần sulfamethoxazol không tương tảo. Tuy
nhiên, trừ khi bệnh nhân suy thận, không cần thiết phải điếu chinh liếu cưa ]amivudìn.
Lamivudỉn không ảnh hưởng lên dược động học cùa trimethoprim hay sulfamethoxazol Khi việc
dùng đồng thời lả xác đảng, bệnh nhân nên được theo dõi lâm sảng. Nên trảnh dùng đồng thời
lamivudin với các liếu cao cùa co- trimoxazol để điều trị vỉêm phổi do Pneumocysit's can'nii và
bệnh do toxoplasma
Nên xem xét khả nảng tương tảo với cảc thuốc khảo khi dùng đồng thời, đặc biệt khi đường thải
trừ ohính của những thuốc nảy được bải tiết chủ động qua thận thông qua hệ thống vận chuyến
cation hữu cơ như trimethoprim. Cảo thuốc khảo (như ranitidin, cimetìdin) được thải trừ chỉ một
phần theo cơ chế nảy và đã cho thấy không tương tảo với 1amivudin. Các đồng đẳng nucleosid
(như dỉdanosin) giông như zidovudin không được thải trừ bằng cơ chế nảy vả không thể xảy ra
tương tảo với lamivudin.
Nồng độ Cmax (28%) cùa zidovudin tăng vừa phải khi dùng kết hợp với lamivudin, tuy nhiên mức
độ hắp thu toản thân (AUC) thi không thay đối đáng kế. Zidovudin không ảnh hướng lên dược
động học cùa lamivudin.
Sự chuyển hóa của lamivudin không liên quan đến CYP3A, sự tuơng tảo với cảc thuốc được
chuyến hóa bời hệ thống nảy (như cảc thuốc ức chế protease) lá không thể xảy ra.
KHẢ NĂNG SINH SÁN, PHỤ NỮ MANG THAI VÀ CHO CON BỦ ,
Tenofovir disoproxil fumarat
Thời kỳ mang ihai
Một lượng dữ liệu trung bình ti'êl'l phụ nữ mang thai (khoảng từ 300-1000 kết quả mang thai) chi
ra không có cảo dị tật hoặc cảc độc tinh trên bảo thai/ trẻ sơ sinh do tenofovir disoproxil fumarat.
Cảo nghiên oứu trên động vật không chỉ ra các độc tính trên khả năng sinh sản. Việc dùng
tenofovir disoproxil fumarat có thế được xem xét trong thai kỳ nếu Cần thiết.
Thời kỳ cho con bú
Tenofovir được bải tỉết vảo sữa người. Không đủ thông tin về oảo tác động của tenofovir trên trẻ
sơ sinh/ nhũ nhi. Do đó viên Tenofovir disoproxil fưmarat không nên dùng trong thời gian cho
con bú.
Theo nguyên tắc chung, những phụ nữ bị nhiễm HIV và viêm gan siêu vi B được khuyến cáo
không cho con bú để trảnh 1ây truyền HIV vả viêm gan sìêu vi B cho con.
Khả năng sinh sản
Các dữ liệu lâm sảng về mặt tảo động cùa tenofovir disoproxil fumarat trên khả năng sỉnh sản
cờn hạn chế. Cảo nghiên cứu trên động vật không chỉ ra tảo động có hại của tenofovir đisoproxil
fumarat trên khả năng sinh sản.
Lamivudin
Thời kỳ mang ihai. Một lượng dữ lỉệu iớn trên phụ nữ mang thai (hơn 1000 kết quả phơi nhiễm)
chi ra không có các độc tinh gây dị tật. Viên Lạmivuđỉn có thế được dùng suốt thai kỳ nêu thấy
cẳn thiết.
Đối với những bệnh nhân bị nhiễm đống thời với viêm gan mà đang điều trị với lamivudin vả rồi
sạn đó mang thai, nên xem xét khả năng tải phát cùa viêm gan khi ngừng lamivưdin.
Loạn chửc năng ty lạp rhể: Cảo đổng đẳng nucleosid vả nucleotide đã được chứng minh trên in
vitro và in vivo lả gây ra sự phá hùy ty lạp thế ở mức độ khảo nhau. C 6 những bảo cảo của sự
13
loạn chức nảng ty lạp thế ở những trẻ sơ sinh đã phơi nhiễm trong tử cung vả/ hoặc sau sinh với
cảc đồng đẳng nucleosid.
Thời kỳ cho con bú:
Sau khi dùng đường uống, lamivudin được bải tiết vảo sữa ở nổng độ tương đương với nống độ
trong huyết thanh. Vi lamivudin và virus ohuyến qua sữa nên người mẹ đang dùng viên
Lamivudin được khuyến cảo không cho con bú. Người mẹ nhiễm HIV được khuyến cảo không
cho oon bú trong bất kỳ hoản cảnh nảo để tránh lây truyền HIV cho con.
TÁC ĐỌNG TRÊN KHẢ NĂNG LÁ] XE VẬ SỬ DỤNG MÁY MÓC:
Không có cảc nghiên cứu về tảo động oủa thuốc lên khả năng lải xe hay việc sử dụng mảy móc
được thực hiện với viên kết hợp liếu cố định Tenofovir disoproxil fumarat 300mg/Lamivudin
100mg. Bệnh nhân nên được thông bảo rằng chóng mặt đã được ghi nhận trong thời gian điếu trị
với tenofovir disoproxil fumarat.
TẢC DỤNG KHÔNG MONG MUÔN
Lamivudin
Cảo trường hợp nhiễm acid lactic, đôi khi gây chết, thường đi kèm với chứng phì đại gan nặng vả
chứng nhiễm mở ở gan, đã được ghi nhận khi dùng oảo đông đắng nucleosid.
Tenofovir disoproxil fumarat
a Tỏm tắt sơ lược về sự an toăn
HIV- ] vả viêm gan B: Ổ những bệnh nhân đang dùng tenofovir disoproxil fumarat, suy thận. hư
thận, và bệnh ong lượn gân (kê oả hội chứng Fanconi) đôi khi dẫn đến cảc bẩt thường ở xương
(hiếm khi góp phân vảo việc gãy xương) hiếm khi được ghi nhận. Cẩn theo dõi chức nảng thận ớ
những bệnh nhân đang dùng viên Tenofovir Disoproxỉl Fumarat.
HIV-J: Khoảng 1l3 so bệnh nhân có thể xảy ra các phản ứng không mong muốn sau khi điếu trị
bằng tenofovir disoproxil fumarat kết hợp với cảc thuốc kháng retrovirus khảo. Cảo phản img
nảy thường là cảc phản ứng về tiêu hóa nhẹ đến trung bình. Khoảng 1% số bệnh nhân được điều
trị với tenofovir disoproxil fumarat đã ngừng điếu trị do các vân đề về tiêu hóa.
Chứng nhiễm acid lactic, chứng gan to kèm theo nhiễm mỡ nặng và loạn dưỡng mờ đi kèm với
việc điếu trị bằng tenofovir disoproxil fumarat.
Việc dùng đồng thời Tenofovir Disoproxỉl Fumarat vả didanosine thi khộng được khuyến cáo vi
điếu nảy có thể dẫn đển tăng nguy cơ cảc phản ứng không Imong muôn. Viêm tụy vả chứng
nhiễm acid laotỉc, đôi khi gây chết, đã được ghi nhận nhưng hiếm.
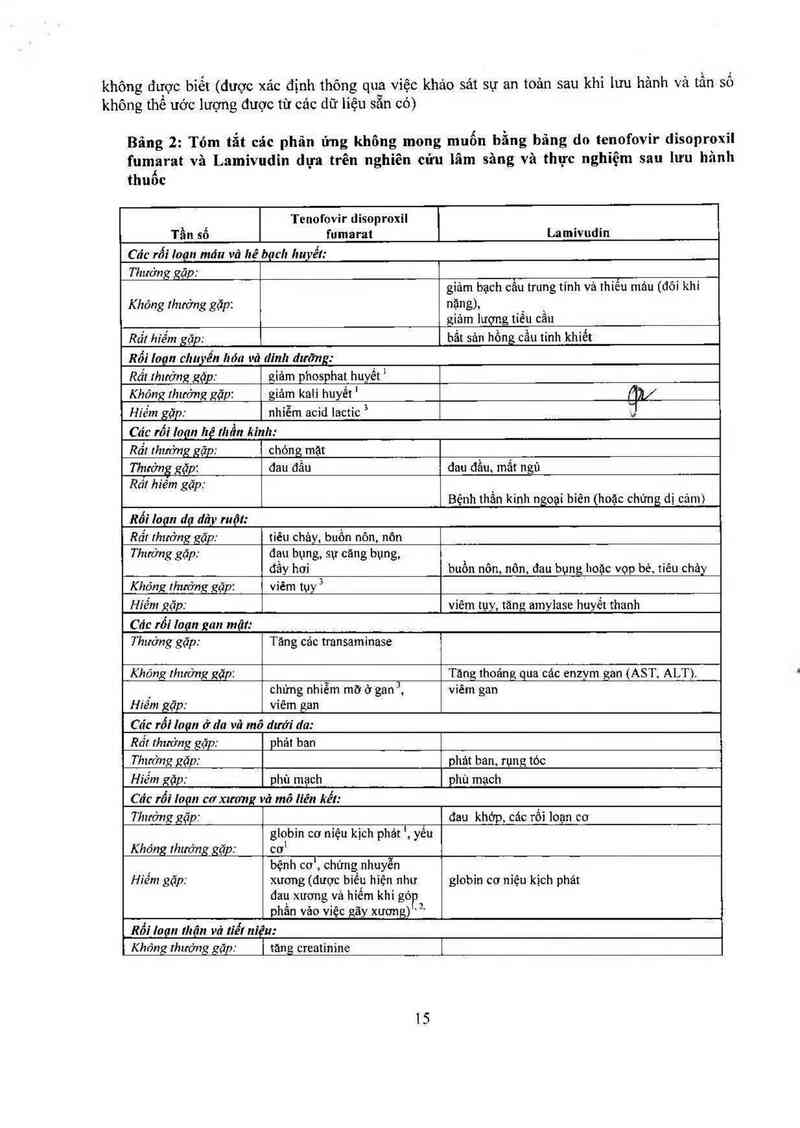
b. Tóm tắt các phản ứng không mong muốn bằng bãng.
Đánh giá cảc phản ứng không mong muốn của tenofovir disoproxil fumarat dựa trên cảc dữ liệu
an toản từ oác nghiên cứu lâm sảng và thực nghiệm sau lưu hảnh thuốc. Tẩt cả các phản ứng
không mong muốn được trinh bảy ở bảng 2.
Các nghiên cửu lâm sảng HIỹ-I: Việc đảnh giá cảc phản ứng không mong muốn dựa trên thực
nghiệm sau khi lưu hảnh thuôo và thực nghiệm trong 2 nghiên cứu trên 653 bệnh nhân đã từng
điếu trị đang được điều trị với tenofovir disoproxil fumarat (n— = 443) hoặc giả dược (n— = 210)
trong kết hợp với cảc thuốc khảng retrovirus khảo trong 24 tuần và cũng trong 1 nghiên cứu có
kiềm soát so sảnh mù đôi trên 600 bệnh nhân không có tiến sử điều trị khảng retrovirus được
điếu trị với tenofovir disoproxil 245 mg (như lá fumarat) (n= 299) hoặc stavudin (n= — 301) trong
kết hợp với lamivudin vả efavirenz trong 144 tuần.
Cảo phản ứng không mong muốn sau được ghi nhận trong thời gian điều trị bệnh HIV với
Tenofovir disoproxil fumarat, Lamivudin
Những phản ứng phụ nghi ngờ (it khả năng nhất) có mối liên hệ với việc điều trị được liệt kế bên
dưới theo hệ cơ quan và tần sô xuất hiện tuyệt đối. Với mỗi nhóm tần số, các phản ứng không
mong muốn được sắp xếp theo tính ohất nghiêm trọng giảm dần. Tần số được xảo định lả rât
thường gặp (ì 1/10), thường gặp (2 1/100, < 1/10), không thường gặp (2 1/1000, < 1/100), hiếm
gặp
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng