





















BỘ Y TẾ
crc QL'AN LÝ DL'ỢC
Ạl THÀNH Pm
HO c… MINH .
BỘ Y TẾ
4ívK %
CL'C f" ' ' "
" QLAAN LY DLỢC
ĐA PHE DUYỆT @
{.án đáu:ẳếIJ…lẢhfflẵể… '
'
_QN
mm
UIU
n :
m—
Wu
P uoc ssnsz-uu-so … … m… …… … uoc ssoaun-so … t … J…fn n… um…mtm
POM 300 n M lmdnw lmi mun. whdì PoM HM iv ! Ỉủ'ụd p:
& u nquurimt … 245 mg ul Imlmảl nnmn:l & AUROBIUDO MARIIA UHIVED
. Cdun. l'nmun dmldc. . , LIII II. W NH 313| 314 Bva Vìllne
Tenofovu- … … …… …… so°c Compn mes ẵ`ẩâm nam. w …» mau «…
. . Knn mu cuu… mv M
Dlsoproxul x……m……………… de Fumarate W…uụ….
hdvquuru. Wummn I hocuml: … mc I ' ẵdptỉcốM ml Hn… … OI
Fumarate …u…………… de Tenofovnr
um vo sxcem nưscnưo oosms » .
Tablets … Dlsoproxd vummmm …
' Joo ma du w… « mu… Wu. …
un I'aumuhm de 245 m n mm dmơoml
30 ĨdJlets W'“ ' “"““ °' ““ 30 Comprỉmés —
A cơumr h um um… … dnuunl
pu 30'C
J llnlml In &… Mi 3
AUHOWNIXì h… han &… ponhndnu wudumhnu ^\UHUHINIK)
Z'ẵo'ĩề'ĩ'ììzl'ỉ'ả'Jmổ' " “"m' '"
\ IE PAS DEPASSHI U MS! HỉSWTE
B:
Tenofovir Disoproxỉl
Funame ĩủlds l
Cotmfimẻs de fumarate
de ĩénoíov'ư Disoproxỉl
u hblm : Cmnprinủs
Als: 52 x 64 x 88 mm \ J
I Pantone Blue 0720 I Black
Pmnl llm ù…num lu cu: Mc & Thơ
3 Tenolovir Disoproin Canon (30`s) mm 23.0&2012 & 230 pm
AUROBINDO cum Vmill m. m: u … mm numu by
' Pamm Dm°°mm Peptar anam (AN's) on Submission
Tum Lulu K Ram Gupal mnndon l:dun :
Illlllllu Pntap 52 x 64 x 88 mm
n n om: …
mu Vlsiou Graphic Hmm cu: 22-— . anlnne … I
Mdỉliml lllomlallnn :
Sign & Dam
Elch lllm conlod nh… conulnn:
300 mg of tonolovir disoptoxil 0umlrete. which is
oquivalenl la 245 mg of tonolovir disoproxil
Colour: Titanium dioxide.
Do not :loro Iban 30°C.
Keep lho connincr tightly closed.
Kan out 01 thu reach nnd sight of children
lndỉcniono, Worning: & Pmclutions: Rud tho
plcknqe luflot bolore uu.
NOT T0 EXCEED PRESCRIBED DOSAGE
chlquc comprlmú pelliculó contient:
300 mg de fumuruc de ténofovir disoproxil, qui ou
NDC 65862—421—30
POM
Tenofovir Disoproxỉl
Fumarale Tablets !
Comprimés de Fumarate
de Ténofovir Disoproxỉl
I'óqunvnlont da 245 mg do ténofovit dmoproxil 30 Tableìs | Comprìmés
Colornnl : dnoxydo da titlne
A conlurver & une tcmpomtum nu dópunm pls 30°C.
Moinlenir lo ílncon fermó )
Tonir hon de II ponée ot do II vu du enllnu, AUROBINDO
Indiclticnl. min: en glrdo ot procaulionl: live
lu notico uvanl utilisuion.
NE PAS DEPASSER LA DOSE PRESCRITE,
“l
Als:115x40mm
Bnch No /Lot
Mlg. Dltef
Dnn Do an
Expưy Dam
D… De pórlmptmn :
M.L. No.] Licean Flb, N“: ISIHDIAPISSIFIR
Mlnuhclulod by I Flbrlqud plr
AUROBINDO PHARMA LIMITED
Um III. Survey No 313 & 314 Bachupally Vcllage. Outhubullapar MandaL
Rung: Rlddv District, lA.PJ INDIA
Commth Offlce | Slùqn locill:
Plol No.2. Maulnvihar Complex. Hydoơsbad. 500 038 (A.P.) INDIA
P141
UHHIH III r
I Pantone Blue 0720 I Black
Pruduct Name Compononl Item cm Date & Tlmo
. ..3 Tenofovir Disoproxỉl Label (30's) P141 23.08.201² & 230 DN
AUROBINDO Goumry leon No. Ruson ot Ian Rovlowod IApprovod by
Packaging Development Pepfar Vietnam (Arv's) 00 Submission
Tum Loadu K Ram Gopal Dlmonslnns l:nluurs : _ _
lnlllatut Pratap 115 X 40 mm / —-’
Arllsl Vision Graphic Pharm cm: 22— : Pẵnzlcỉne Blue 072C ( / jỄ'
AlldlIlonal lnlormaIlon : f Ỉ Ễ
. \\ t
Slgn & Date \ \ r
- . — /ỡ/Ề'x
NHAN PHỤ TIENG VIẸT /ẵ … PHỌNG\ÊỊ\
[lễ … ĐẠIpIẸN ĂẮÌị
< lẬĩ IHANH PHO )'D'
Rx Thuốc bán theo đơn \ủW/
* //
Tên thuốc : TENOFOVIR DISOPROXIL FUMARATE 300MG TA `E'l'Ễ
Hoạt chất, hâm lượng : Mỗi viên nén bao phim chứa:
~ Tenofovir Disoproin Fumarate ............... 300mg
tương đương với 245mg Tenofovir Disoproxỉl
Quy câch đỏng gói : Hộp x \ lọ x 30 vỉên nén
Chỉ định, câch dùng, chống chỉ định: Xín đọc trong tờ hướng dẫn sử dụng kèm theo.
Dạng bâo chế : Viên nén bao phim
SĐK : Số lô sản xuất:
Ngây sản xuất : Hạn dùng:
Điều kỉện bâo quân : Bảo quản ở nhỉệt độ không quá 30°C. Ộ/
Công ty sản xuất : Aurobindo Pharma Limited
Địa chỉ : Unit-Hl, Survey. No.3 | 3 & 314, Bachupally Village,
Quthubullapur Mandal, Ranga Reddy District, Andhra Pradesh, India
Công ty nhập khẩu
Địa chí
Xuất xứ : Án Độ
Các rhông tin khác đề nghị xem Irong tờ hướng dẫn sử dụng kèm theo. Đọc kỹ hướng dẫn sữ dạng
trước khi dùng.
Để xa tẩm Iay trẻ em.
TỜ HƯỚNG DẢN sử mmc.
Viên nẻn tenofovir disoproxil fumarat 300 mg
Thuốc nảy chỉ dùng Iheo đơn của bác sỹ.
Tên thuốc:
Viên nén tenofovir disoproxil fumarat 300 mg
Thảnh phần, công thức cho một đơn vị đỏng gỏi nhỏ nhất:
Mỗi viên nén bao film chứa:
' Tenofovir disoproxil fumarat ............. 300 mg
tương đương với 245 mg tenofovir disoproxil.
ỚV
Croscarmellose natri, lactose monohydrat, cellulose vỉ tỉnh thể, tính bột tiền gelatỉn hóa, magnesí
Tá dược:
stearat, Opadry II white 321418425 (gổm có lactose mohohydrat, hypromellose, titan dioxid vả
triacetin).
Dạng bảo chế của thuốc:
Víên nén tenofovir disoproxil fumarat lả viên nén bao film mảu trắng đến trắng nhạt, khẳc chữ “I“
trẻn một mặt vả “36“ trên mặt kia.
Quy cảch đóng gỏi: Hộp x ] lọ x 30 viên
Chỉ định:
' u\ . « A . ` .; . ` \ .
Viên nén tenofovir disoproin fumarat được sử dụng đê đueu trị vưus gay suy g1am mưcn dl_Ch ơ ngươi
(HIV) cho người từ 18 tuồì trở lên.
` * "“ ` '” ' 'rus
Viên nén tenofovir disoproxil fumarat cũng dược sư dụng đe đan II'Ị vnem gan B mạn tmh do …
viêm gan B (HBV) ở người lớn.
Liều dùng, cách dùng, đường dùng:
Líều dùng."
' 'Ầ ' ` " an tính.
Nên khởi đầu đỉều tri vởỉ bảc sỹ có kinh ngh1ệm đleu tn HIV valhoặc v1em gan B m_
Người lớn:
.`
' ' -Ầ ~ …. › ` A un A Ă \ K .
Liều khuyên cáo đê dleu trị HIV hoặc vuem gan B mạn tmh la mọt vxen x mọt lan/ngay, uong cung
với thức ăn.
Viêm gan B mạn linh:
Thời gian diều tri tối ưu chưa được biết rõ. Ngưng điều trị có thể được xem xét như sau:
' Vởi các bệnh nhân HBeAg dương tính không có xơ gan, điều trị nên ít nhất là 6-12 thảng sau
khi đã có chuyển trạng thải HBe huyết tương (HBeAg vả HBV DNA âm tính, kháng HBE
dương tính) hoặc thấy thuốc không có hiệu quả (xem phần 4.4). Cần kiểm tra ALT vả HBV
DNA huyết thanh thường xuyên tiểp theo sau khi ngưng điều trị dễ phát hiện bất kỳ tái phát
nảo cùa virus.
' Với cảc bệnh nhân HBeAg dương tính không có xơ gan, điều trị nên ít nhất là cho đến khi có
chuyền trạng thải HBe huyết tương hoặc có bằng chứng thuốc không có hiệu quả. Với điều trị
kéo dải trong hơn 2 năm, cần thường xuyên đánh giá lại để xác nhận việc tiếp tục điều trị vẫn
còn thích hợp cho các bệnh nhân.
Đối với lre’ em và rhanh thiếu niên: @/
Không được dùng viên nén tenofovir cho trẻ em vả vị thảnh niên dưới 18 tuổi do chưa có đủ dữ lìệu
về an toản và hiệu quả của tenofovir disoproxil fumarat.
Người giả:
Không có dữ lìệu dể đưa ra liều khuyến cáo đối với bệnh nhân trên 65 tuối.
Suy thận:
Tenofovir được thải trừ qua thận và nồng độ của tenofovir tăng lên ở những bệnh nhân có chức năng
thận suy giảm. Chỉ có những dữ lỉệu hạn chế về an toản vả hiệu quả cùa tenofovir disoproxil fumarat
ở bệnh nhân suy thận vừa và nặng (thanh thải creatinin < SOmI/phút) và các dữ liệu an toản dải hạn
chưa được đánh giá cho bệnh nhân suy thận nhẹ (thanh thải creatinin 50—80 mI/phủt). Do đó, ở bệnh
nhân suy thận tenofovir disoproxil fumarat chỉ nên sử dụng nếu lợi ích cùa điều trị lớn hơn nguy cơ
tiềm tảng. Nên điều chinh khoảng cách giữa cảc lần dùng cho các bệnh nhân có thanh thải creatinin <
50 mllphủt.
Suy thận nhẹ (thanh rhải creatinin 5 0-80 mI/phút):
Các dữ liệu hạn chế từ các nghìên cứu lâm sảng ủng hộ dùng liều tenofovir disoproin fumarat một
Iần/ngảy ở bệnh nhân suy thận nhẹ.
Suy thận độ vừa (thanh thải creatinine 30-49 ml/phút):
Khuyên dùng 245 mg tenofovir disoproxii (dạng fimarat) mỗi 48 giờ dựa trên mô hình của các dữ
liệu dược động học đơn liều ở các cá thế không nhiễm HIV và không nhiễm HBV với mức độ suy
thận khảc nhau, bao gồm cả bệnh thận giai đoạn cuối đòi hòi phải thấm tách máu, nhưng chưa được
xác nhận trong các nghiên cứu lâm sảng. Do vậy, phải theo dõi chặt chẽ đáp ứng lâm sảng với đỉều
trị và chức năng thận ở những bệnh nhân nảy.
Suy thận nặng (thanh thải creatinin < 30 ml/phủ!) vả bệnh nhân thẩm tảch máu:
Khó điều chinh liều cho thoả đáng vi không có các hảm lượng khảo, do đó không khuyên dùng cho
nhóm bệnh nhân nảy. Nếu không có trị liệu thay thế, có thể kéo dải khoảng cách giữa các liều như
sau:
' Suy thận nặng: 245 mg tenofovir dísoproxỉl (dạng fumarat) mỗi 72-96 giờ (dùng liều hai
lần/một tuần).
' Bệnh nhân thấm tách máu: 245 mg tenofovir disoproxil (dạng f'umarate) dùng 7 ngảy một lần
. 4
JG \
Những điểu chinh liều lượng nây chưa được xảc nhận trong các nghiên cứu lâm sảng. Mô phóng oho
sau khi hoản thảnh một phiên thẩm tảch máu”.
thấy rằng kéo dải khoảng cách giữa các liều không phải là tối ưu và có thể dẫn đến tăng độc tínhỈỢt9x` ẵ)
đáp ứng có thể không đầy đủ. Do vậy, phải theo dõi chặt chẽ đáp ứng lâm sảng vởi điều trị và chẳtc/
năng thận ở nhửng bệnh nhân nảy. /
* Nói chung, dùng một lần/tuần với giả định ba buồi thấm tách máu mỗi tuần, mỗi lần thẳm tách mảu
khoảng 4 giờ hoặc sau 12 giờ thẩm tách mảu tích lũy. Không có khuyến cáo về liều nảo cho các bệnh
nhân không thẩm tách mảu với thanh thải creatinin < 10 milphủt.
Gan: ẹ\/
Không cần phải điều chinh liều ở bệnh nhân suy gan.
Nếu ngừng dùng tenofovir disoproxil fumarat ở bệnh nhân viêm gan B mạn tính có hoặc không có
dồng nhiễm HIV, những bệnh nhân nây cần được giám sát chặt chẽ các biểu hiện bộc phát viêm gan.
Cách dùng vả đường dùng:
Luôn Iuôn sử dụng viên nén tenofovir disoproxil fumarat đủng như hướng dẫn cùa bác sỹ. Nếu không
nhớ, cần hỏi lại bác sỹ hoặc dược sỹ.
Liều thông thường viên nén tenofovir disoproxil f'umarat cho người lớn lả một viên x một Iần/ngảy
cùng với bữa ăn hoặc bữa ăn nhẹ. Không dùng cho trẻ em dưới 18 tuồi. Nếu bạn khó nuốt viên thuốc,
có thể dùng thìa nghiền viên thuốc vả trộn bột thuốc với khoảng lOOmI nước, nước cam hay nước
bười vả uống ngay.
- Phải Iuôn dùng đúng liều chỉ định.
~ Nếu có vấn đề về thận, bảo sỹ có thể chỉ định dùng ít lần hơn.
' Không được ngừng bất kỳ thuốc chống HIV được kê đơn nảo khi bắt đầu dùng viên nén
tenofovir disoproxil fumarat nếu bị nhiễm cá HIV vả HBV.
- Nếu bị nhiễm HBV, bác sỹ có thể yêu cầu lảm xét nghiệm HIV xem có bị mắc cả HIV vả
HBV không.
Xem hướng dẫn sử dụng cảc thuốc kháng retrovirus khác để biết cách dùng các thuốc nây.
Nếu bạn uống nhiều viên nén tenofovir disoproxil fumarat hơn liều đã kê:
Nếu bạn vô tình uống quá nhiều thuốc, bạn nên thông báo cho bác sỹ cùa bạn hoặc liên hệ với khoa
cấp cứu bệnh viện gần nhất để có lời khuyên phù hợp. Giữ lọ thuốc để có thể kể lại minh đã uống bao
nhiêu.
Nếu bạn quên uống viên nén tenofovir disoproxil fumarat
Nếu bạn quên không uống thuốc, hảy uống lại ngay khi bạn nhớ ra, sau đó tiểp tục sử dụng thuốc như
trước. Không được uống gấp đôi liều để bù lại cho liều đã quên.
Nếu bị nôn trong vòng 1 giờ sau khi uống viên nén tenofovir disoproxil fumarat, uống thêm 1 viên Jr
khác. Không cần uống thêm nếu bị nôn sau | gỉờ.
Nếu ngừng dùng viên nén tenofovir disoproxil fumarat: W '
. Không được ngừng dùng viên nén tenofovir disoproin fumarat mã không có ý kiển cùa bác Ề
sỹ. Ngừng dùng viên nén tenofovir disoproin fumarat có thế lảm giảm hiệu quả trị liệu. ";
Thông báo cho bác sỹ khi định ngừng dùng viên nén tenofovir disoproxil fumarat vì bất kỳ lý
do nảo, đặc biệt khi bị các tác dụng bất lợi hoặc bị bệnh khảo. Hỏi bác sỹ khi định dùng lại
viên nén tenofovir disoproxil fumarat.
Nếu bị viêm gan B hay đồng nhiễm HIV và viêm gan B:
' Không được ngừng viên nén tenofovir disoproxil fumarat trừ khi đã hỏi bảc sỹ. Xét nghiệm
máu hay các triệu chứng ở một số bệnh nhân cho thẳy chứng viêm gan nặng hơn khi ngừng
dùng viên nén tenofovir disoproxil fumarat. Có thể cần thử máu vải tháng sau khi ngừng viên
nén tenofovir disoproxil fumarat. Thông báo ngay cho bảo sỹ về các triệu chứng mới hay bất
thường sau khi ngừng trị liệu, đặc biệt cảc triệu chửng liên quan tới viêm gan B.
Nếu có bất kỳ câu hòi nảo, liên hệ ngay với bác sỹ.
Chống chỉ định:
Chống chỉ định cho những bệnh nhân mẫn cảm với tenofovir hoặc với bắt cứ thânh phần nảo cùa
thuốc.
Thận trọug khi dùng thuốc:
Thuốc nảy không chữa lảnh nhiễm HIV. Khi uống viên nén tenofovir disoproin fumarat, vẫn có thể
xuất hỉện các nhiễm khuẩn và các bệnh khác liên quan tới nhiễm HIV. Cũng vẫn có thể lây truyền
HIV và HBV sang người khảc, do đó cần thận trọng để trảnh iây nhiễm sang người khác.
K hông sử dụng Vỉên nén Tenofovir disoproxilfumarate:
' Nếu bạn bị quá mẫn cảm (dị ứng) với tenofovir disoproxil f'umarat hoặc với bất kỳ thảnh phẩn
nảo có trong viên nén tenofovir disoproin fumarat liệt kê trong tờ hướng dẫn nảy. Nếu bạn bị
mẫn cảm, hãy bảo thẩy thuốc ngay và đừng dùng viên nén tenofovir disoproxil fumarat.
Những cảnh báo và đề phòng đặc biệt khi sử dụng thuốc: Ộ7/
Bảo cho bác sỹ nếu bạn đã từng bị bệnh thận hay có vấn đề về thận. Viên nén tenofovir disoproxil
fumarat có thề ánh hướng đến thận. Trước khi bắt đầu điều trị, bác sỹ có thế cần xét nghỉệm mảu đề
kiểm tra chức năng thận và có thể chỉ định uống ít lẩn hơn. Bác sỹ cũng có thể cần xét nghiệm mảu
trong thời gian diều trị để kiềm tra chức năng thận.
Viên nén tenofovir disoproxil fumarat thường không dược dùng cùng với cảc thuốc có thể gây tổn
thương thận (xem dùng các thuốc khảo). Nếu bắt buộc phải dùng, bác sỹ sẽ kiềm tra chức năng thận
mỗi tuần một lẩn.
Thông bảo cho thấy thuốc nếu bạn trên 65 tuối. Viên nén tenofovir diSOproxil fumarat chưa dược
nghiên cứu ở bệnh nhân trên 65 tuổi. Nếu bệnh nhân trên 65 tuổi cần dùng viên nén tenofovir
disoproxil fumarat, bảc sỹ cần kiềm soát bệnh nhân chặt chẽ.
Không dùng viên nén tenofovir disoproxil fumarat cho trẻ em dưới 18 tuồi.
Thông bảo cho bác sỹ nếu có tiền sử bệnh gan, bao gồm cả viêm gan. Bệnh nhân bị viêm gan B hoặc
C mạn vả điều trị với cảc thuốc khảng retrovirus có nguy cơ cao hơn bị các tác dụng bẩt lợi về gan
nặng có thể gây tử vong. Nếu bị viêm gan B, bảc sỹ sẽ cân nhắc liệu pháp điểu trị tốt nhất. Nếu có
tiền sử bệnh gan hoặc viêm gan B mạn tính, bảc sỹ sẽ xét nghiệm mảu đề theo dõi chức nãng gan.
Chú ý các dấu hiệu nhiễm acid lactic khi bắt đầu uống viên nén tenofovir disoproxil fumarat. Các dắu
hiệu nhiễm acid Iactic bao gồm:
I Thờ nhanh, sâu
' Ngủ gả
AN .Lb
F1âl D
1ỂHẮxẢ
iỎ C…
_ Ý
ủ
' Buồn nôn, nôn và đau dạ dảy
Hiếm khi xảy ra phi đại gan nặng vả đôi khi gây tử vong. Nhiễm acid lactic thường xảy ra hơn ớ phụ
nữ, đặc biệt người béo phì. Người bị bệnh gan có nguy cơ lớn hơn. Khi dùng viên nén tenofovir
disoproxil fumarat, bác sỹ phải theo dõi cẳn thận cảc triệu chứng nhiễm acid lactic.
Thận trọng để không lây nhiễm sang người khác: viên nén tenofovir disoproxil fumarat không lảm
giảm nguy cơ lây truyền HIV hay HBV sang người khác qua quan hệ tình dục hay truyền máu, do đó
phải cẩn thận để trảnh lây nhiễm. ậ/
Các Ihận !rọng khác:
Trong điều trị HIV, trị liệu phối hợp kháng retrovirus (bao gồm cả viên nén tenofovir disoproxụiiịf\
fumarat) có thể Iảm tăng dường huyết, lipid huyết, thay đổi mỡ cơ thề, vả tính kháng insulin (xeọễ\\cìt\
phần: Tác dụng không mong muốn). iịễHò' ị )
Nếu bạn bị tiều đường, du cân hay cholesterol cao, hãy bảo cho bác sỹ. iỉNH //` “y
/
Kiềm tra cảc dấu hiệu nhiễm khuẩn: bệnh nhân bị HIV tiến triến (AIDS) và bị nhiễm khuẩn khizbắỉ/
đầu dùng viên nén tenofovir disoproxil fumarat có thể xuất hiện các triệu chứng nhiễm khuẩnỉĨâ
viêm, hoặc nặng thêm các triệu chứng. Ngay khi dùng viên nén tenofovir disoproxil fumarat, phải
kiềm tra các dấu hiệu nhiễm khuẩn. Nếu thẩy có dấu hiệu viêm, hay nhiễm khuẩn, bảo ngay cho bác
sỹ.
Cảc vấn đề về xương:
Một số bệnh nhân HIV dùng trị liệu phối hợp kháng retrovirus có thể bị hoại từ xương. Thời gian trị
liệu, sử dụng corticosteroid, uống rượu, suy giảm miễn dịch nặng, chỉ số khối cơ thể cao...có thể nắm
trong số nhiều yếu tố nguy cơ xuất hiện bệnh nảy. Dấu hiệu hoại từ xương gồm cứng khớp, đau khớp
(đặc biệt khớp hông, đầu gối vả vai) vả khó vặn động. Nếu thấy có các triệu chứng nảy phải báo ngay
cho bác sỹ.
Các vấn đề về xương (đôi khi dẫn đến gãy xương) có thể xảy ra do tốn thương tế bảo ống thận (xem
phần: Tác dụng không mong muốn).
Dùng các thuốc khác:
Không dùng viên nén tenofovir disoproxil fumarat nếu đang uống một thuốc khác chứa tenofovir
disoproxil fumarat. Không dùng cùng lủc viên nén tenofovir disoproxil fumarat vả adefovir dipivoxil.
Thông báo cho bác sỹ nểu bạn đang hay vừa dùng cảc thuốc khác, bao gồm cả cảc thuốc không cần
kê đơn.
Đặc bỉệt phải thông bảo cho bác sỹ nếu đang dùng các thuốc khác có thể gây hại thận, bao gồm:
6
' Aminoglycosid, pentamidin hay vancomycin (để chống nhiễm khuẩn)
* Amphotericin B (để trị nhiễm nẩm)
' Foscarnet, ganciclovir, hay cidofovir (để trị nhiễm virus)
' lnterleukin-2 (điều trị ung thư)
' Adefovir dipivoxil (điều trị HBV) Ở/
' Tacroiimus (ức chế miễn dịch)
' Các thuốc khác chứa didanosin (dùng điều trị HIV): Dùng viên nén tenofovir diSOproxii
fumarat với các thuốc khảng virus chứa didanosin có thể lảm tăng nồng độ didanosin trong
mảu và giảm tể bâo CD4. Hiểm khi có viêm tụy và nhiễm acid lactic đôi khi gây từ vong đã
được báo cáo khi dùng đổng thời các thuốc chứa tenofovir disoproin fumarat vả dìdanosin.
Bác sỹ cần thận trọng khi dùng kết hợp tenofovir vả didanosin.
- Không ngừng dùng các thuốc chống HIV khác mà bác sỹ đã kê khi bắt đầu dùng viên nén
tenofovir disoproxil fumarat cả cho nhiễm HIV và HBV.
' Nên dùng viên nén tenofovir disoproxil fumarat cùng với thức ăn.
Sử dụng trên phụ nữ có thai và cho con bú
Hòi bác sỹ trước khi dùng bất kỳ thuốc gì khi mang thai hoặc cho con bú.
Không nên dùng viên nén tenofovir disoproxil fumarat khi mang thai trừ khi đã thảo luận kỳ với bảc
sỹ. Không có dữ liệu sử dụng viên nén tenofovir disoproxil fumarat cho phụ nữ mang thai vả không
nên dùng trừ khi thực sự cần thiết.
Không nên có thai khi đang dùng viên nén tenofovir disoproxil fumarat. Nên dùng biện pháp tránh
thai.
Hãy thông báo cho bác sỹ của bạn biết nếu bạn đang có thai hoặc dự định có thai dề đảnh giá về cảc
tác dụng bẩt lợi tiềm tảng, các nguy cơ và lợi ích của đỉều trị kháng retrovirus cho người mẹ vả thai
nhi.
Nếu dùng viên nén tenofovir disoproxil fumarat trong thời kỳ mang thai, bác sỹ cần lâm cảc xét
nghiệm máu định kỳ và các chẩn đoán khác đề kiểm tra sự phát triến của thai nhi. Với các trẻ em có
mẹ dùng các thuốc giống viên nén tenofovir disoproxil fumarat (NRTI) trong khi có thai, lợi ich
phòng nhiễm vỉrus lả lớn hơn nguy cơ tác dụng bất lợi.
K hông nên cho con bú khi dùng viên nén tenofovir disoproxilfumarat:
Không biểt tenofovir disoproxil fumarat có thế đi vảo sữa mẹ không. Cảo phụ nữ nhiễm HIVIHBV
không nên cho con bú đề trảnh nguy cơ truyền vỉrus sang con.
Ẩnh hưởng của thuốc khi lái xe và vận hânh máy móc:
7
5
c
Viên nén tenofovir disoproxil fumarat có thể gây chóng mặt. Nếu bạn thấy chóng mặt khi dùng viên
nén tenofovir disoproxil fumarat, đừng Iải xe hạy vận hảnh mảy móc.
Cảc thông tin về các thânh phần trong viên nén tenofovir disoproxil fumarat: Viên nén tenofovir
disoproxil f`umarat chứa lactose. Thông bảo cho bác sỹ nếu bạn không dung nạp dược lactose hay cảc
đường khảc.
Tương tác của thuốc vởi các thuốc khác và các loại tương tác khác: Ở/
Các nghỉên cứu tương tác thuốc mới chỉ được thực hiện ở người lớn.
Dựa vảo kết quả thí nghiệm in vitro vả đường thải trừ dược biết của tenofovir, khả nảng tương tảc qua
trung gian CYP450 giữa tenofovir với cảc thuốc khác lả thấp.
Các phối họp không nên sử dạng: '
Viên nén tenofovir disoproxil fumarat không nên dùng với bất kỳ thuốc nảo khác có chứa tenofovir
w FJHC
disoproxil fumarat. t;._~_. DIẺ
Viên nén tenofovir disoproxil fumarat không được dùng đồng thời với adefovir dipivoxil. Không nên Gj'HNH
' .` —t: M
dùng cùng tenofovir disoproxil fumarat vả didanosin. \__
Các Ihuốc lhải rrừ qua thận:
Do tenofovir chủ yếu thái trừ qua thận, dùng cùng tenofovir disoproxil fumarat với các thuốc lảm
giảm chức năng thận hoặc cạnh tranh bải tiểt tích cục qua ống thận thông qua các protein vận chuyền
hOATI, hOAT3 hoặc MRP 3 hay 4 (ví dụ như cidofovir) có thề Iảm tăng nồng độ trong huyết thanh
cùa tenofovir vảlhoặc các thuốc dùng đồng thời.
Nên trảnh việc sử dụng tenofovir disoproxil fumarat đồng thời hoặc gần đồng thời với các thuốc gây
dộc thận, ví dụ như aminoglycosid, amphotericin B, foscamet, ganciclovir, pentamidin, vancomycin,
cidofovir hoặc interleukin-2.
Vì tacrolimus có thề ánh hưởng đến chức năng thận, cần giám sát chặt chẽ khi dùng phối hợp với
tenofovir disoproxil fumarat.
Cóc tương tác khác:
Tương tảc giữa tenofovir disoproxil fumarat và các thuốc ức chế protease vả cảc thuốc kháng
retrovirus khác được liệt kê trong bảng 1 dưới đây (tăng được ký hiệu là "T“, giảm là "1", không có
thay đổi là "H". hai lần/ngây lả "bỉd", và một lần/ngảy lả "qd").
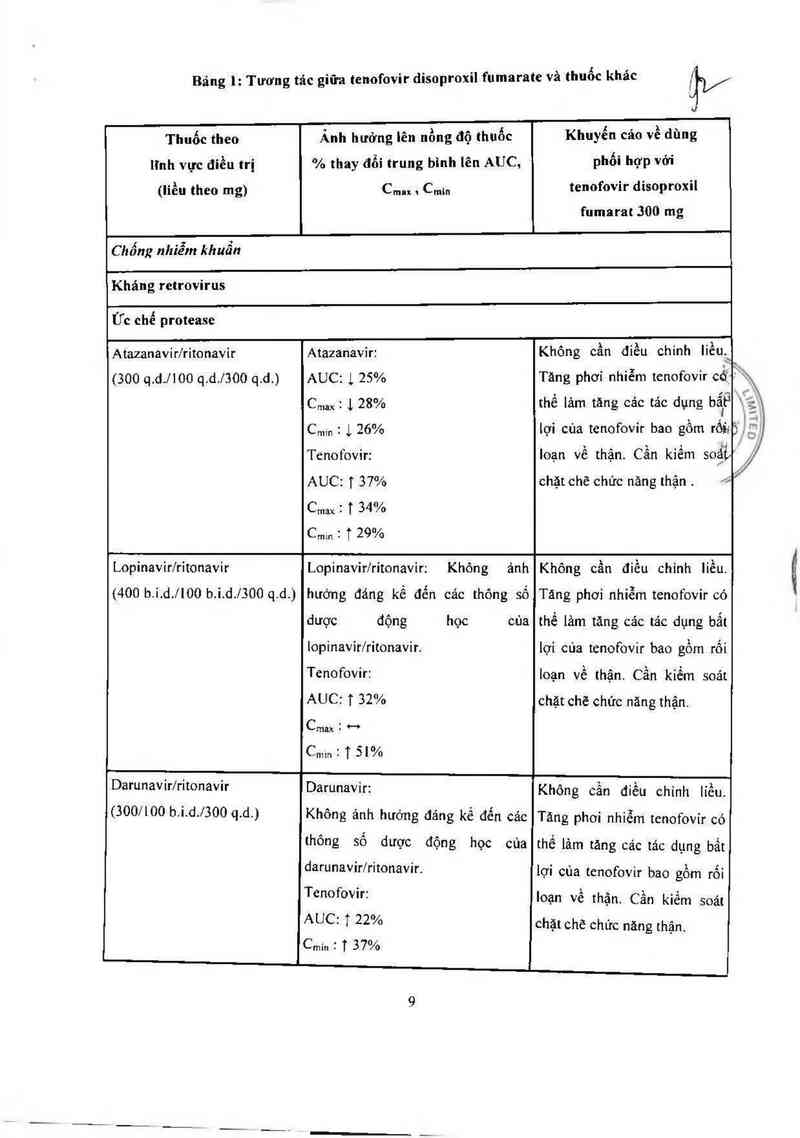
Bảng 1: Tương tảc giữa tenofovir disoproxil fumarate và thuốc khảc
ịy
\]
Thuốc theo
lỉnh vực điều trị
(liều theo mg)
Ẩnh hưởng Iẽn nồng độ thuốc
% thay đổi trung bình lên AUC,
Cmax \ Cmln
Khuyển cảo về dùng
phối hợp vởi
tenofovir disoproxil
fumarat 300 mg
Chống nhiễm khuẩn
Kháng retrovirus
Ức chế protease
Atazanavir/ritonavir
(300 q.d.llOO q.d.l3OO q.d.)
Atazanavir:
AUC: L 25%
Cmax : 1, 28%
Crmn : ị 26%
Tenofovir:
AUC: T 37%
Cmax : T 34%
C…… : ị 29%
Không cần điều chinh iièu.`
Tăng phơi nhiễm tenofovir cđíỀf **
thế iảm tăng cảc tác dỤng bẵítỂ —.
lợi của tenofovir bao gồm rốii
Ioạn về thận. Cân kiêm soặif ,
chặt chẽ chức nảng thận .
Ụvj
Lopinavir/rỉtonavir
(400 b.i.d./IOO b.i.d./3OO q.d.)
Lopinavir/ritonavir: Không ảnh
hưởng đảng kế đển các thông số
học của
dược động
lopinavir/ritonavir.
Không cần điểu chinh liều.
Tảng phơi nhiễm tenofovir có
thề lảm tăng các tảc dụng bất
lợi của tenofovir bao gôm rối
(300/100 b.i.d./3OO q.d.)
Tenofovir: Ioạn về thận. Cẩn kiểm soát
AUC: T 32% chặt chẽ chức năng thận.
Cmax : H
Darunavir/ritonavir Darunavir: Không cần điều chinh líều.
Không ảnh huớng đáng kể đến các
thông số dược động học của
darunavir/ritonavir.
Tenofovir:
AUC: ị 22%
Cmin ? T 37'Vỏ
Tăng phoi nhiễm tenofovir có
thế lảm tảng các tác dụng bất
lợi cùa tcnofovir bao gồm rối
loạn về thận. Cẩn kiểm soát
chặt chẽ chức năng thận.
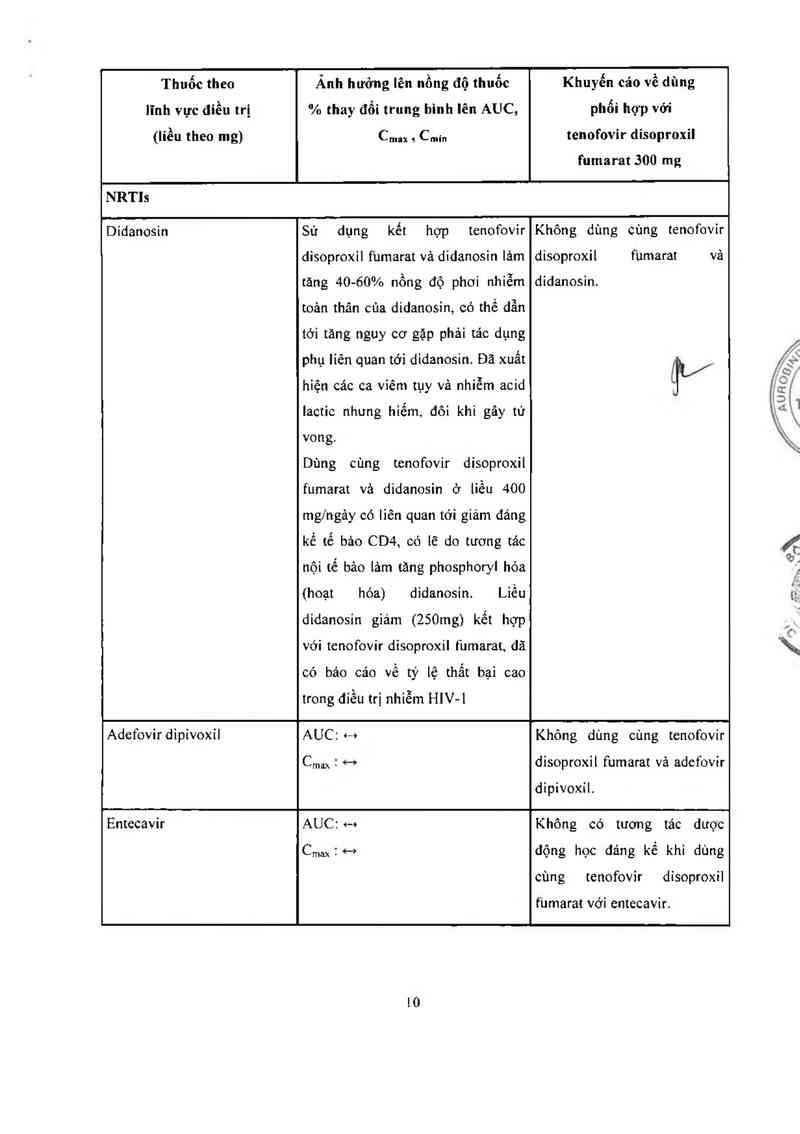
Thuốc theo
lĩnh vực điều trị
(liều theo mg)
Ánh hưởng lên nồng độ thuốc
% thay đổi trung hinh lên AUC,
Cmax s Cmin
Khuyến cáo về dùng
phối hợp vởi
tenofovir disoproxil
fumarat 300 mg
NRTls
Didanosin
Sử dụng kết hợp tenofovir
disoproxil fumarat vả didanosin lảm
tăng 40-60% nồng độ phơi nhiễm
toản thân cùa didanosin, có thể dẫn
tới tảng nguy cơ gặp phải tảo dụng
phụ liên quan tới didanosin. Đã xuất
hiện các ca vỉêm tụy vả nhiễm acid
lactic nhưng hiếm đôi khi gây tử
vong.
Dùng cùng tenofovir disoproxil
fumarat vả didanosin ở liều 400
mg/ngảy có lỉên quan tởi giảm đáng
kể tế bâo CD4, có lẽ do tương tác
nội tế bảo lảm tăng phosphoryl hóa
(hoạt hóa)
didanosin gìảm (250mg) kết hợp
didanosin. Liêu
với tcnofovir disoproxil fumarat, đã
có báo cáo về tỷ lệ thẳt bại cao
trong điều trị nhiễm HlV-l
Không dùng cùng tenofovir
disoproxil fumarat vả
didanosin.
1v
Adefovirdỉpivoxỉl AUC: <—+ Không dùng cùng tenofovir
Cmax c—› disoproxil fumarat vả adefovir
dipivoxil.
Entecavir AUC… Không có tương tác dưọc
C…ax … động học dảng kể khi dùng
cùng tenofovir disoproxil
fumarat với entecavir.
Các nghiên cứu thực híện với các thuốc khác:
Không có tương tác dược động học đảng kế trên lâm sảng khi dùng cùng tenofovir disoproxil fumarat
với emtricỉtabin, Iamivudin, indinavir, efavirenz, nelfinavir, saquinavir (có kèm ritonavir),
methadone, ribavỉrin, rifampicin, tacrolimus, hoặc các thuốc tránh thai hormon như norgestrel/
ethinyl oestradiol.
Tenofovir disoproxil fumarat phải được uống với thức ản, vi thức ăn giúp tăng khả dụng sinh học của
tenofovir.
Tác dụng không mong muốn:
Như tất cả cảc thuốc khác, viên nén tenofovir disoproxil fumarat cũng có thể gây các tác dụng không
mong muốn ở một số người:
Rất hay gặp (>l/IO bệnh nhân):
' Tiêu chảy, nôn, buồn nôn, chóng mặt
' Giảm phosphat huyết
Hay gặp (<1/10, >1/100 bệnh nhân):
~ Đau đầu, đau dạ dảy, mệt mói, chướng bụng, đầy hơi
Hiếm gặp <<…ooo bệnh nhân):
' Nhiễm acid lactic.
Cảo triệu chửng nhiễm acid lactic bao gồm:
' Thở nhanh vả sâu
' Ngủ gả
' Buồn nôn, nôn và đau dạ dảy.
Nếu bạn thấy có các triệu chứng nhiễm acid lactic, đến bác sỹ ngay.
' Đau vùng bụng do viêm tụy
' Thay đồi nước tiếu và đau lưng do vắn đề ở thận, bao gồm cả suy thận
- Nổi ban
' Tăng creatinin máu
' Các vấn đề về gan và tụy
Rất hiếm gặp t 100 000 bản saolml vả 39% có số lượng tế bảo < 200 tế bảo/ml.
Bằng phân tích quá trinh điều trị (các số liệu bị mẳt vả việc chuyền phảc đồ điều trị kháng retrovirus
(ART) dược coi là thất bại), tỷ lệ phần trăm bệnh nhân có RNA HIV-l dưới 400 bản sao/ml vả 50 bản
sao/ml vảo tuần điều trị thứ 48 tương ứng là 80% và 76% trong nhỏm dùng tenofovir disoproxil 245
mg (dạng fumarat), so sánh với 84% và 80% trong nhớm dùng stavudin. Ờ tuần thứ 144. tỷ lệ phẳn
trăm bệnh nhân có RNA HIV-l dưới 400 bản saolml vả 50 bản saofml tương ứng là 71% vả 68%
trong nhỏm dùng tcnofovir disoproxil 245 mg (dạng fumarat), so sảnh vởi 64% và 63%
dùng stavudin.
trong nhóm
Biên đôi trung bình so với ban đầu về RNA H1V-l vả tế bảo CD4 ở tuần điều trí thứ 48 là tương
đương ở cá hai nhóm (- 3.09 vả — 3,09 iog… bản sao/ml; + 169 và + [67 tể hảo/mm3 tương ứng ở các
nhom tenofovir disoproxil 245 mg (dạng furnarat) vả nhóm stavudin)
cim trung binh so với ban đầu vẫn tương tự ở cả hai nhóm đỉều tri (
+263 vả + 283 tể bảoJmm² .
. O tuân điều trị thứ 144, sự biến
’ -3,07 vả -3,03 logio bản sao/ml;
tương ưng o cac nhóm tenofovir disoproxil 245 mg (dạng fumarat) vả
14
nhóm stavudin). Người ta thấy là đáp ứng lâu dải với phác đồ tenofovir disoproxil 245 mg (dạng
f'umarat) không liên quan tới số iượng CD4 vả RNA HiV-l ban đẫu.
Tỷ lệ xuất hiện đột biến K65R ở nhóm bệnh nhân dùng tenofovir disoproin fumarat hới cao hơn so
với nhóm đối chứng (khoảng 2,7% so với 0,7%). Trong tẩt cả các trường hợp đề khảng với efavirenz
hoặc iamivudin có từ trước hoặc xuất hiện đồng thời với sự xuất hiện đột biến K65R. Có tảm bệnh
nhân nhiễm HIV mang đột biển K65R thuộc nhóm tenofovir disoproin 245 mg (dạng f`umarat),'ỉ
trong số đó xuất hiện đột biến trong 48 tuần điểu trị đầu tiên vả trường hợp còn lại xuất hiện vâo tuần
96 Không có thêm trường hợp đột biển nảo cho tới tuần 144.1`ừ phân tích kiểu gen và kiều hinh
Tác dụng với HB V: qv/
Hoạt tính kháng HB V in vitro: 4 \>\
Hoạt tính kháng HBV trong ổng nghiệm của tenofovir đã được đánh giá trong dòng tế bảo He BGỀ\
2 2.15. Các giá trị ECSO cho tenofovir trong khoảng 0,14-1,5 ụmol/l, với giá trị CCSO (nổng độ độc tqẫ i)
1'i10 O ị
bảo 50%) › 100 ttmoi/i. 1H / /
/
/
Kháng thuốc:
không thắy có bằng chứng nảo về các nguyên nhân khảo gây đề kháng với tenofovir.
Không có đột biến HBV nảo iiên quan với kháng tenofovir disoproxil fumarat đã được xác định (xem
kết quả lâm sảng). Trong thử nghiệm trên tế bảo, các chủng HBV có đột biến nme, rtLISOM, vả
rtM204l/V liên quan đến kháng lamivudin vả telbivudin cho thấy tính nhạy cảm với tenofovir khảc
nhau. từ 0,7- đến 3,4 lần so với các chùng vi rút hoang dại. Các chủng HBV có đột biến itLlSOM,
rtTl 84G, itSZOZG/i, rtM204V vả rtMZSOV liên quan đến kháng entecavỉr cho thấy tinh nhạy cảm với
tenofovir khác nhau, từ 0,6-đển 6,9 lần so với các chủng vi rút hoang dại. Các chùng HBV có đột
biến nA 1 81 V và rtN236T kháng adefovir cho thấy tính nhạy cảm với tenofovir khác nhau, từ 2,9 đển
10 lần so với cảc chủng vi rủt hoang dại. Vi-rút có chứa đột biến rtA1 81T vẫn nhạy cảm với tenofovir
với ECSO bằng 1,5 lẳn so với các chùng vi rút hoang dại.
Kết quả lâm sảng:
Các lợi ích của tenofovir đisoproxil fumarat được dựa trên mô học, virus học, đáp ứng sinh hóa vả
huyết thanh chủ yếu ở người lớn viêm gan B mạn tính với bệnh gan có bù chưa từng điều trị. có
HBeAg dương tính hoặc HBeAg âm tinh.
Kình nghiệm ở những bệnh nhân bị bệnh gan có bù:
Kêt quả qua 48 tuần từ hai nghiên cứu mủ đôi ngẫu nhiên, pha 3, so sánh tenofovir disoproxil fumarat
với ạdefovir dipivoxil ở những bệnh nhân bị bệnh gan có bù được trinh bảy trong Báng 2 dưới đây.
15
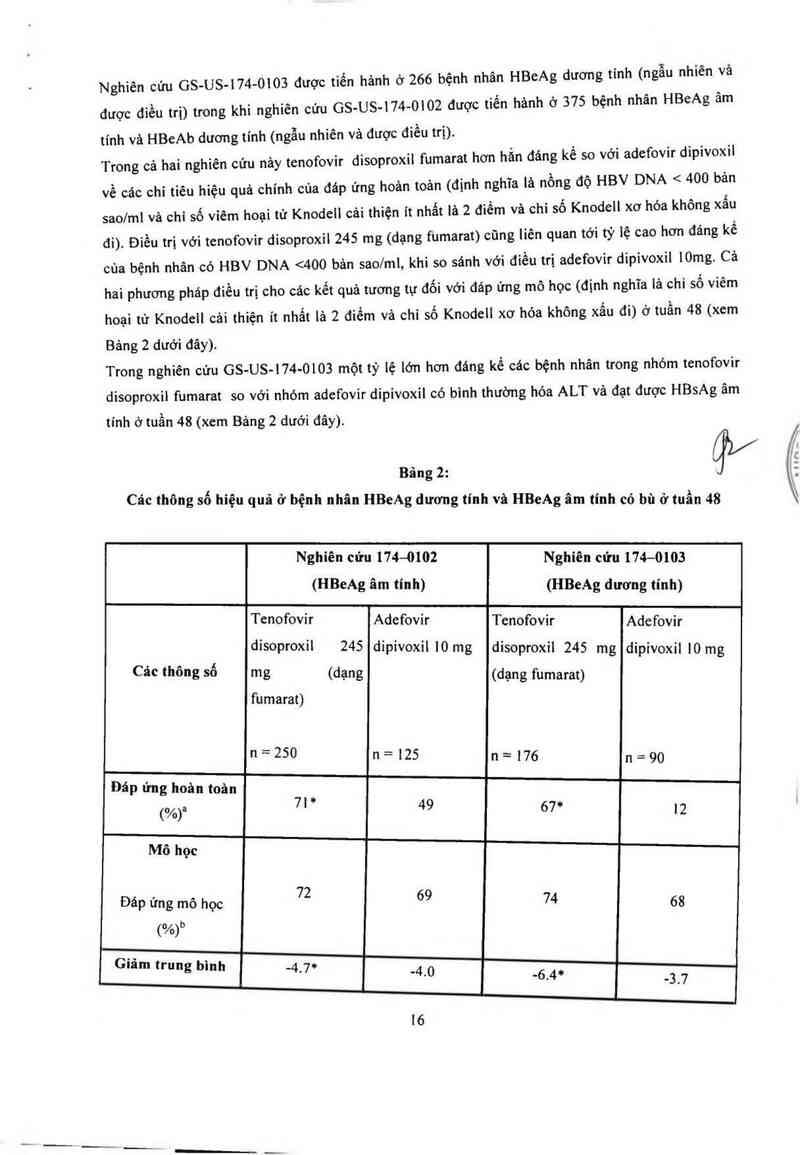
Nghiên cứu GS- US—174- 0103 được tiến hảnh ở 266 bệnh nhân HBeAg dương tinh (ngẫu nhiên vả
được điều trị) trong khi nghiên cứu GS- US-174- 0102 được tiến hảnh ở 375 bệnh nhân HBeAg âm
tính và HBeAb dương tính (ngẫu nhiên vả được điều trị).
Trong cả hai nghiên cứu nảy tenofovir disoproxil fumarat hơn hắn đáng kể so với ạdefovir dipivoxil
về các chi tiêu hiệu quả chính của đáp ứng hoản toản (định nghĩa là nồng độ HBV DNA < 400 bản
saolml và chỉ số viêm hoại tử Knodell cải thiện ít nhất lả 2 điểm và chỉ số Knodell xơ hóa không xấu
đi). Điều trị với tenofovir disoproxil 245 mg (dạng fumarat) cũng liên quan tới tỷ lệ cao hơn đáng kể
của bệnh nhân có HBV DNA <400 bản sao/ml, khi so sảnh với điều trị adefovir dipivoxil lOmg. Cả
hai phương pháp điều trị cho các kết quả tương tự đối với đảp ứng mô học (định nghĩa là chi số viêm
hoại tử Knodell cải thiện it nhất là 2 điếm vả chỉ số Knodell xơ hóa không xấu đi) ở tuần 48 (xem
Bảng 2 dưới đây).
Trong nghiên cứu GS—US—l74—0103 một tỷ lệ lớn hơn đáng kể các bệnh nhân trong nhóm tenofovir
disoproin fumarat so với nhóm adefovir dipivoxil có bình thường hóa ALT và đạt được HBsAg âm
tính ở tuần 48 (xem Bảng 2 dưới đây).
Bảng 2: qs/
Các thông số hiệu quả ở bệnh nhân HBeAg dương tinh và HBeAg âm tính có bù ở tuần 48
Nghiên cứu 174—0102 Nghiên cứu 174—0103
(HBeAg âm tỉnh) (HBeAg dương tính)
Tenofovỉ r Adefovir Tenofovir Adefovir
disoproxỉ1 245 dipivoxil 10 mg disoproxil 245 mg dipivoxil 10 mg
. !
Cảc thong so mg (dạng (dạng fumarat)
fumarat)
n=250 n=125 n=176 n=90
Đáp ứng hoản toản
(%)a 71 * 49 67* 12
Mô học
Đáp ứng mô học 72 69 74 68
t%›°
Giâm trung binh —4.7* -4 o
- -6.4* -3_7
iV
Nghiên cứu 174—0102 Nghiên cứu 174—0103
(HBeAg âm tinh) (HBeAg dương tmh)
Tenofovir Adefovir Tenofovir Adefovư
' ' ' ' '1 10 m
disoproxil 245 dipivoxil 10 mg disoproxtl 245 mg dlprOX1 g
Các thông số m g (dạng (dạng fumarat)
fumarat)
- = 0
n=250 n=125 n—176 n 9
HBV DNA so với
ban đầuc
(iogin bản sao/ml)
HBV DNA (%)
93* 63 76" 13
< 400 bản saolml
(< 69 IU/ml)
ALT (%)
76 77 68“ 54
ALT bình thường
hỏađ
Huyết thanh học
("/0)
Nf^ NIA zzm lim
HBeAg mấtlđảo
huyết thanh
HBsAg mẩt/đảo
h ² h h 0f0 oxo 3… oxo
uyett an
* Giá trị p so với adefovir dipivoxil < 0,05.
" Đáp ứng hoản toản định nghĩa là nồng độ HBV DNA < 400 bản saolml và chỉ số viêm hoại tử
Knodell cải thiện it nhắt lả 2 điếm vả chỉ số Knodell xơ hóa không xấu đi.
” Chỉ số viêm hoại tử Knodell cải thiện ít nhắt iả z điềm vả chỉ số Knodell xơ hóa không xấu đi.
vin P
ĐAI [
Ai ThAi
HÔ Chi
t
° Trung binh thay đối từ mức ban đằu HBV DNA phản ảnh sự khác biệt gìữa mức ban đâu HBV
DNA và giới hạn phảt hiện thẳp nhất (LOD) cùa xét nghiệm.
“ Dân số đươc sử dụng để phân tich ALT bình thường hóa bao gồm chi cảc bệnh nhan với ALT tren
mức giới hạn bình thường cao nhất ở lúc ban dầu.
Tenofovir đìsoproxil fumarat có tỷ lệ cao hơn đáng kể các bệnh nhân không phát hiện đượ
1ả giới hạn định lượng của xẻt nghiệm HBV Cobas Roche
c HBV
DNA (<169 bản sao/m1 [<29 1U/mi];
Taqman), khi so sảnh với adefovir dipivoxil (nghiên cứu GS-US-l74-OlOl; 91%, 56% và nghiên cửu
GS-US-l74-OIO3; 69%, 9%), một cách tương ứng.
Đảp ứng cùa điều trị với Tenofovir disoproin fumarat là tương tự ở các bệnh nhãn đã tùng dùng cảc
thuốc nucleosid và chưa từng dùng nucleosid (n = 375) vả ớ bệnh nhân có ALT bình thường (n = 21)
vả ALT bất thường (n = 405) Ở lúc ban đầu khi kểt hợp 2 nghiên cứu GS-US-l74-OIOZ vả GS-US-ỸZ/
174-0103. 49 trong 51 bệnh nhân đã từng dùng các thuốc nucleosid trước đây được điều trị bầng \
lamivudin. 73% bệnh nhân đã từng dùng các thuốc nucleosid và 69% bệnh nhân chưa từng dùng cảỆ , \
thuốc nucleosid đạt được đảp ứng hoản toản với điều trị; 90% bệnh nhân chưa từng dùng cảc thuôo › 1 i
nucleosid và 88% bệnh nhân đã từng dùng cảc thuốc nucleosid đạt được ức chế HBV DNA < 400 bẵẸẾ ? /
sao/mi. Tất cả cảc bệnh nhân với ALT binh thường Iủc ban đầu vả 88% bệnh nhân với ALT hinh" ,~"
thường 1ủc ban đầu đạt được ức chế HBV DNA <400 bản sao/ml.
Trong một nghiên cứu ngẫu nhiên, mù đỏi. có kiềm soát 48-tuẳn dùng tenofovir disoproxil 245 mg
(dạng fumarat) ở bệnh nhân đồng nhiễm HIV-l và viêm gan B mạn tính đã từng dùng lamivudin
(nghiên cứu ACTG 5127), trung bình HBV DNA huyết thanh lúc ban đấu ớ những bệnh nhân ngẫu
nhiên dùng tenofovir là 9,45 logIO bản saolml (n = 27). Điều trị vởi tenofovir disoproxil 245 mg
(dạng fumarat) lảm thay đồi có ý nghĩa HBV DNA huyết thanh so với ban đẩu ớ các bệnh nhân điều
trị đủ 48 tuần, xuống 5,74 10g10 bản sao/ml (n = 18). Ngoải ra, 61% bệnh nhán cỏ ALT bình thường
ở tuân 48.
Kinh nghiệm ở bệnh nhân có virus sao chép dai dẳng:
Cảc hiệu quả vả an toản cùa 245 mg tenofovir disoproxil (dạng fumarat) hoặc 245 mg tcnofovir
dísoproxil (dạng fumarat) cộng với 200 mg emtricỉtabin đang được đánh giá trong môt nghiên cứu
ngân nhiên, mù đôi [GS-US -174-0106), với bệnh nhân HBeAg dương tính vả HBeAg âm tinh có
v1rus trong mảu dai dăng (HBV DNA a 1000 bản sao/ml) khi dùng 10 mg adefovir dipivoxil cho hơn
24 tuân, Nói chung ở tuần 24, điếu trị với chế độ có tenofovir dẫn đến 77% (46/60) bênh nhân có
HBV DNA <400 bản sao/ml (<69 iU/ml) vả 62% (371’60) bệnh nhân không phát hiên đươc HBV
DNA (dưới 169 bản sao/ml [<29 IU/ml]; lả giới hạn định lươn
g của thử nghiệm HBV C
TaqMan). Ngoài ra, lúc 24 tuấn, Obas ROChe
tỷ lệ bệnh nhân có ALT bình thường là 68% (42/62).
18
Kháng thuốc trên lâm sâng:
426 bệnh nhân có HBeAg âm tinh (GS-US-l74-OIOZ, n = ., 4
y đổi kiểu gen trong HBV polymerase. Đảnh gia kicu
250) và HBeAg dương tính (GS-US-l74—
0103, n = 176) đã được đảnh giá về những tha x . đ—
gen đươc thưc hiện trên tất cả các bệnh nhân HBV DNA> 400 bản sao/ml ờ tuan 48. Khong có ọt
biến nảo iiên quan đến kháng tenofovir disoproxil fumarat đã được xác định.
Dược động học:
Tenofovir disoproxil i`umarate là một tiền chất dạng cstc tan được trong nước và trong cơ
chóng chuyền thảnh tenofovir vả formaldehyd. Trong tế bảo, tenofovir được chuyển thảnh tenofovir
Hốp thu:
Sau khi cho bệnh nhân nhiễm HIV uống tenofovir disoproxil fumarat, tenofovir disoproxil fumarat
thể nhanh
monophosphate vả thảnh chất có hoạt tính tenofovir diphosphat.
được hấp thu nhanh chóng và chuyền thảnh tenofovir. Khi uống vảo bữa ăn, cảc liều tenofovir
disoproxil fumarat cho các giá trị trung bình nồng độ tcnofovir (%CV) Cmax, AUCo.m vả Cmin tương
ứng lả 326 (36,6%) ng/ml, 3,324 (41,2%) ng.giờ/ml và 64.4 (39,4%) ng/ml. Cảo nổng độ tenofovir tối
đa trong huyết thanh đạt được trong vòng 1 giờ sau khi uống iủc đói và 2 giờ sau khi uống kèm thức
ăn. Sinh khả dụng đường uổng cùa tenofovir từ tcnofovir đisoproxil fumarat ở bệnh nhân uống lủc
đói là khoảng 25%. Việc uống tenofovir disoproxil fumarat với bữa ăn nhiều chất béo có ảnh hưởng
tới sinh khả dụng đường uống cùa thuốc, trong đó AUC của tcnofovir tăng khoảng 40% vả Cmax tăng
khoảng 14%. Khi bệnh nhân được uống iiều tenofovir disoproxil fumarat đẳu tiên vảo lủc đã ăn no.
giá trị Cmax trong huyết thanh trung bình nằm trong khoảng từ 213 đến 375 ng/ml. Tuy nhiên, uống
tenofovir disoproxil fumarat cùng bữa ăn nhẹ không ảnh hướng đảng kế tởi dược dộng học cùa
tenofovir.
Phân bố:
Sau khi truyền tĩnh mạch, thể tích phân bố ở trạng thái ổn định cùa tenofovir được ước tinh là khoảng
800 mllkg. Sau khi uống tcnofovir disoproxil fumarat, tcnofovir được phân bố chủ yếu ở các mô, với
nổng độ cao nhất lá ở thận, gan và đường ruột (theo cảc nghiên cứu tiền iâm sảng). Trong ống nghiệm
mức đó gắn kểt với protein huyết tương hoặc huyết thanh tương ứng 1ả dưới 0,7 và 7,2%, với nổng độ
tenofovir nằm trong khoảng từ 0,01 đến 25 ug/ml.
Chuyển hoả:
Các nghiên cứu in vitro đã xác định rắng cả tenofovir disoproxil fumarat lẫn tenofovir đều không
chuyên hóa qua hệ enzym CYP450. Hơn nữa, ở nổng độ cao hơn đáng kể (gấp khoảng 300 lần) so với
19
' ' A … .
~ … . . . . , A A … C… n h1ẹm m a
nông độ đạt được tren Iam sang, tenofovư khong ưc che sự chuyen hóa thuoc trong g g
có xúc tác lá các đồng phân CYP450 chinh iiên quan đến chuyển dạng sinh học của thuốc ở người
(CYP3A4, CYP2D6, CYP2C9, CYP2€1 hoặc CYP1AII2). ớ nồng độ 100 ụg/ml,
disoproxil fumarat không ảnh hướng tới bất kỳ loại CYP450 nâo, trừ CyplAl/2, trong đó cộ sự giảm
nhẹ (6%) nhưng có ý nghĩa thống kê về chuyền hóa chất nền của CYPIA 1/2. Dựa trên các sô liệu nảy
áng kể về mặt lâm sảng giữa tenofovir dìsoproxil fumarat
tcnofovir
thì không có khả năng xuất hiện tương tác đ
và các thuốc chuyền hỏa nhờ hệ thống CYP450.
Thăi' rrừ:
Tcnofovir được thải trừ chủ yếu qua thận bằng cả con đường lọc thận và qua hệ thống vận chuyến
chủ động ớ ống thận với khoảng 70-80%11ềutruyềntĩnh mạch được bải tiết qua nước tiểu dưới dạng
không đổi. Độ thanh thải toản bộ ước tinh khoảng 230m1/giờlkg (khoảng 300 mllphủt). Độ thanh thải
qua thận ước tính 1ả khoảng 160m1/giờlkg (khoảng 210 m1/phủt), cao hơn nhiều so với tốc độ iọc ờ
cẩu thận. Điều nảy chi ra rằng bải tiết chủ động qua ống thận đóng vai trò quan trọng trong quá trình
thải trừ tenofovir. Thời gian bản thải cùa tenofovir sau khi uống là khoảng 12 — 18 giờ.
T i'nh chất ruyến tính/không iuyến tỉnh:
Dược động học cùa tenofovir không phụ thuộc vảo liều của tenofovir disoproxil fumarat trong
khoảng liều từ vs dến 600mg vả không bị ảnh hướng khi dùng liều lặp lại ớ bất kỳ mửc liều nảo.
Tuổi tác vả giới mm.-
Các dữ liệu còn hạn chế về dược động học cùa tenofovir ở phụ nữ chỉ ra rằng không có ảnh hướng
lớn cùa giới tính.
Các nghiên cứu dược động học chưa được tiến hảnh trên đối tượng trẻ em, vị thảnh niên (dưới 18
tuối) vả người cao tuối (trên 65 tuổi).
Chưa có các nghiên cứu cụ thể về dược động học ở cảc nhóm chủng tộc khác nhau.
Suy Ihận:
Các chi sô dược động học của tenofovir được xác định sau khi cho uống môt liều đơn tenofovir
disoproxil 245 mg đôi với 40 bệnh nhân không nhiễm HIV có các mức đó suy thân khác nhau xác
định dựa vao độ thanh thải creatinin ban đầu (CrC1) (chức năng thận lả binh thường nểu chỉ số CrC1 >
80m1/phút; suy thận nhẹ nếu CrC1 =
so—79 mll hút; t , = ›
chl = p …ng binh nếu CrC1 3049 mllphut vả nặng nén
10-29 ml/phút). So với các bệnh nhân có chức nảng thận binh thường
tĨnofovư trung bình (%CV) đã tăng từ 2185 (12%) ng.giờ/ml ở các đối tươn
lan lượt lả 3064 (30%) ng.giờ/ml, 6009 (42% .
mức độ phơi nhiễm
g có CrCl>80 m1/phủi lên
) ng.g1ò/mi vả 15985 (45%) ng.giờ/ml ở các bênh nhân
20
' ' “ ` ' ` cach
suy thân mức độ nhẹ, trung bình và nậng. Liều khuyên cảo cho bẹnh nhan suy thạn, với khoang
Ó sẽ tan ra nồng độ đinh trong huyết tương cao hơn va nong độ
`ữ hai lần dùng thuốc kéo dải hơn, ' ` ,
gi a hận bình thường. Anh hương 1am
cmin thấp hơn ớ bệnh nhân suy thận so với bệnh nhân có chửc năng t
sảng cùa nó hiện còn chưa rõ. X
Ở những bệnh nhân bị bệnh thận giai đoạn cuối (ESRD) (CrC1 < 10 m1/phut) can
các nồng đô tenofovir giữa các lần thẩm tách tăng đáng kể trong suốt 48 giờ, đạt Cmax trung binh 1032
ng/m1 vả AUCo.4sh trung bình 42857 ng.giờlml. .
Điều nảy khuyến cáo rằng nên điều chinh khoảng cách giữa hai lần dùng tenofovư disoproxn 245 mg
(dang fumarat) ở những bệnh nhân có độ thanh thải creatinin < 50 mllphủt hoặc những bệnh nhân đã \
phải thấm tách mảu,
bị ESRD và cần thẩm tách máu. ửđ ))…ẵ ;_i
Hiện chưa có nghiên cứu về dược động học của tenofovir ở những bệnh nhân không thâm tảch iẸạồilị
có độ thanh thải creatinin < 10 ml/phủt và ở các bệnh nhân bị ESRD được điều trị bằng thâm tách/
~.
phủc mạc hoặc các kiều thầm tách khác.
Suygam q/ .
Liều tenofovir disoproxil 245 mg được dùng cho các bệnh nhân không nhiễm HIV có cảc mức đó suy
gan khác nhau được xác định theo cách phân loại ChiId-Pugh-Turcotte (CPT). Dược động học của `_ J D
tenofovir thực chất không bị ảnh hướng ở các đối tượng bị suy gan, diển nảy gợi ý rằng không cần
điều chinh liều ớ các bệnh nhân nảy. Các giá trị trung bình nổng độ tenofovir (%CV) C…,x vả AUC…
tương ứng lả 223 (34,8%) nng và 2050 (50,8%) ng.giờlml ở những bệnh nhân chức năng gan binh
thường, so với 289 (46,0%) ng/m1 và 2310 (43,5%) ng.giờlml ở những bệnh nhân suy gan mức độ
tmng bình vả 305 (24,8%) nng và 2740 (44,0%) ng.giờlml ở những bệnh nhân suy gan nặng.
Dược động học nội tế bảo:
Trong bạch câu đơn nhân không sinh sản trong mảu ngoại vi của người (PBMC) thời gían bán hùy
của tenofovir disoproxil vảo khoảng 50 giờ, trong khi thời gian bán hủy trong tế bảo PBMC được
kích thich băng phytohaemaglutinin là khoáng 10 gỉờ.
Quá liều và cách xử trí:
T .Ă . , Ẩ o
rong trường hợp quá lieu, cần theo dõi cac dau hiệu ngộ độc và áp dụng điều tri hổ trơ tỉêu chuẩn
T » 1 ~ . . . Z
enofovư có the được loại bo bơi tham tách máu. thanh thái thẩm tách máu tmng binh của tcnof '
1 v › . ov'
lả l34ml/phut. Thanh thai cua tenofovir bời thẩm tảch mảng bung chưa đươc xác đ' h r
. _ in .
Các dấu hiệu lưu ý và khuyến cáo:
' Đề xa tẩm tay trẻ em
21
' Đoc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin xin hòi ý kiến bác sỹ
Điều kiện bảo quản:
Bảo quản ở nhiệt độ không quá 30°C.
Hạn dùng của thuốc:
24 tháng kế từ ngảy sản xuất.
Tên, địa chỉ của tổ chức, cá nhân chịu trách nhiệm về thuốc:
Thông tin nhả sản xuất: @/
AUROBINDO PHARMA LIMITED
Địa chỉ: \
Văn ghòngz Plot No. 2 Maitrivihar Complex, Ameerpet. Hyderabad, 500 038 Andhra jẵỀạđÊh.
India L N G\Ễ
iPHÓ/
. '11N
Nhã máỵ: Unit - 111, Survey. No. 313 & 314, Bachupally Village, Quthubuliapur Mand _ạlịẾaýiga
Reddy District, Andhra Pradesh. India.
Cõng ry nhập khẩu vả phân phối:
TM AUROBINDO PHARMA LIMITED
PHÓ CỤC TQUỜNG
Jiíợuyễn 'Ĩ/ãn Ễễ/ắanắ)
22
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng