

























W
ẵffl®ẵ
®ffl
ffllMylah ị
Rx Tenofovir
oozososc
L
M
[iiiễổilfflffliĩÍffl …ễắ'ẳ
zaovwa
1mnmnmnmnmxumr ' ou NI19 _
lmlixoulcmxunnnqxol DN |!uis _
WMAMJ 'dq
MM…mP »…
01103ẵ01
lolom'Offl' `101
www iii,Jiiiii rf.ưTi
Disoproxỉl
Fumarate/
Lamivudine/Efavirenz
Tablets
300 mg/3OO mg/õOO mg
-—w
30 Tablets
Each film coated iablei (outains
Tenciovư dưoproxli ii,rniJirattI 300 mq
Lamivudine USP 300 mg
l:tavirenz USP 600 mq
Do not storeabove 30'C
Stote In the otlginai containet.
Protect trom Ilght.
Dosage: As directed by the physictan.
NOT T0 EXCEED PRESCRIBED DOSAGE.
KEEP OUT OF THE REACH AND SIGHT OF
CHILDREN.
Indicatlons. Wamlngs & Precauttons:
Read me package leaf\et betore use.
Chaque tomprimé peiỉlcuié_contienl
I'umarate de lénoíovlr disoproxil 300 rrg
lamlvudine USP 300 mg
Elavlrenz USP 600 mg
À conserveơ a une températute ne
dépassant pas 30°C.
A consetveơ dans l'emballage d'onglne.
Protéget de la tumière.
Poseiogõe: Comme dirigé par votre
médecin.
NE PAS DEPASSER LA DOSE PRESCRITE.
TENIR HORS DE LA PORTÉE ET DE LA vUE
DES ENFANTỉ
Indlcations. Mlses en garde et Précautions:
nỆ²P "3²1
artv1
l'Ể_b"“/ l'ẵ
.
` L> fg~_.
ỦMYIaIÌ vwa myi.… [ …ii \\ừ ' ợề
' Ĩ
Fumarate de Ténofovir
Disoproin/
Lamivudine/Efavirenz
Comprimés iii III lllili'
300 mg/3OO mg/GOO mg 8 voaoọs aoosot.
NAFDAC Regn. No.: A4-5090
PP Tanzania Regn. No: T210H053
Zambia Regn. No…` 014l030
Vietnam Regn. No.: VN_…
Mfg. Lic. NoJLic. Fnb. No.: NKDIBD
Mfd, by:] Flb. par.
Mylan Laboratorles Umited
F-4 & F-I2, MlDC. Malegam. Sinmr,
Mylm Nashlk - 421 m. Mahmmm. IMJIA
30 Comprimés
… Thuũc ki dơn
Vien nen ban phim?enntơvtrùmpmul Fununưl
lelvudan Efwtnnz Tablets !mean
SĐK:
MN Mn Khử
Tenduverlsnpuml Fume .mnu
LAmlvudln ................... Jmmq
Ehwưnz, .....................
Chlqnh. chũng chi am Mu tiùnq vả
tk men; tln Ithk: Iln doc tờhlbng dln IÚdUW
OUy tách đóng gól: HQpl lo !0 vlèn
56 lô SK NSK. HD,xem 'Mdl Nnfi'Mig.dllf
and~aụ.mrutn bao bL
Bảo nuln mm 30 'C.Gừtmỏctmw bao bl gót.
Trinh Anh sống
SIn xu! bm: wlan Labornlmin Limthd
F—4 lv M 2. MIDC. Maquon Slnnir. Nithk~lỉJìll
Mnhuuhlm Ấn 00
0le lãm tư li! em
ou kỷ hương dln lđdung wa km m…;
lcnnx I
—’ `Ử
_@l—
3
. ",
__-fnlmu ..pips
1 …v .» 5 …_ ..— …—ã..
...:.ẳ ……..……au ….— ,
.ả.4
~ .IKỄ .a.. .
J, .. .. , .n.› »
.ỉ, .
... n .ọ… A…7 J.Ér..
. ,a .….1Ểả ,….A .
:. .. .. ut W. . .
Ả: r., . . . . ., .
. . .. .Ĩ ~ , , .
.. . v
. ..
… : ỉ... c. .. ể. .ữ…. . . . f. : ..:1JẺ. 19 :. ..H W…
VưJỄÃ., uễ ở…. . . ..: !. ... t. ... .
.. › 2 C: . L., ã>ẳầnrtẵ…..ẳf …6. b. .
, .…. Ễ .. , . ìrơĩ.. ...ơf. A .
. ...a!r.éz..1v …. .:.... … c . . í. .. . v&:đ3 4. . ....ÝnL F
.ìllĩlu». 1% ›. ,› iii ., tbía ..
nu vc J. o.iư lĩtr . iẫAAÉ.J Êoẵưd.ẵ.mhiấis .
. uẾ..ỉ r-ẺM5. u..ẵJĩầt _
, , .. .. ...v , . .. . .
Núầẵ... IC .. Êm. 4.51 ..? .ư... . ở . .. ,al. n.. #
ti -t , - . ẫ ẫẵễ
›d-i nhe
…lAn
`lll Mylan
Laboratorỉes Limited
~ Putkoging Development
artwork - 100%
E Unwinding Direction
..< ….er .,._,,
ụ… u….m. … N
1 m —,~ỉ
u.…uu uav … 'rq
Do vui II… 15… W
knlnùơvndruuim ma…lw
M…
…
m›mnoơ mí mưu mo suc…or cmumu
u…u thmol | nmub…
llnd … m. Inlu … …
w… ư*nvnvơự m.…unm
› f.v ne
… ỉ
u....nm . mu Nq
A n»… 1 uu u mm nu …
At…lHdemhíqlduiýnWửhhulư
<… dlvht vnusn m
Ni NS ueussn u DDìl FUS(IIYỈ
TỈNIHÙSMLAMIEI'VMLAVIẮDHHI'ANIS
lnd›umx m… cn qua n Muưm
… h mun mu m…
artwork - 150%
\
NAỈDAC Mn Nc:MSM
Tuuuiu Mn DIeJUIMI
llnùhũqn No OIWN
vbuum Mn No.-
Đ.W
[[u1Mylan
www mvial z um
wa… ddlmmlyy
mu ddlmmlyy
75050009
WLKNBJULFIÀ m.;mum
nưan
…
vunulx.nùụnunu
W- …JuIILM -
30 Tiblets/C0m primés
fFach ủlrr` cnaleđ Iab\eĩ cnntzins
Taroinv : d …uroml h.maralu ]00 mg
Lamwudme U3P 300 mq
FOav ven: USP 600 mg
Do not slnre above 30'C.
Stth in the ollgỉnll container. PM… hom Iighl.
Dosage: As derd by the physldan.
NOT TO EXCEED PRFSCRIBED DOSAGE.
KE€P OƯT OF THE REACH AND SIGHT OF CHILDREN,
lndicaũons. Wamings & Pmcauticns:
Read the peckage Ieaũel before use.
Chaque compmrr— pellưulẻ mmipnt
Furnarate de senufov ' c:mnrcxbl 300 mg
Lamwudme USP 300 mg
Efav ưenz USP 600 mg
Ầ muservev ! une Iemptmure ne depzsmư pas !ơ'C
Ầ conurvu dans l'embailnge đorlợne. FMégef de ll lurnim.
Posologie: Come diligé par votle médedn.
NE PAS DEPASSEII LA DOSE PRESCRITE
TENIR HORS OE LA PORTÉE EY DE LAVUE DES ENFANTS.
lndiations. Mises en garde et Frécautỉons:
Lire la mlke avanl utilisation.
NAFDAC Regn. No.: A4-5090 l
ffllMylan
www,mylan.com
Vietnam Regn. No.-
BNolLot:
Tenofowr Disoproin Funarate
Lamảwdme Efavírenz
E …-ư ' ` ' ,
.umarate de lenofowr Dssopro IÌ'
. ddlmmlyy
Mfde b-
Lamivudme `Efavưenz a
Tabletsiompnmès
300 mg 300 mg/ôOO mg
Exp…- dd/mm/yy
Mfg. Uc. No.!Lic. Fab. No.~ NKD/B9
MH. by: lFib. pir.
Mylan Laboratories Limited
SChedme 2 PP @ F-IIF—1lMIDC.NOQĐM.SinNL
Mylgn Nuhik - 41? \13. ủnsMn, NDIA
30 Tablets/Comprimés
_
Tanania Regn. No.: 1110H053
Zambia Regn. No. : 0141030
75050009
\ lllll
! _—l—-O
""… ' ’… iHụ_,ị_ _
’ | >-; uE_ ư
- g)
. .....H . -_. ......_,q
. ..v`
.
, .
(
. ... ,. . › ___. __ …-^r _, ,N '. .. !
'l'm … ›UQu1W_ .] l \1. OJãn ___
u ’— .[Ill' o ! 'ịHHI ._- _-
I" «. `, ,0'..'f A'.n_ _ _. _ . _1 nụ. -__ . — ›Í-ỀỤ
, -. _ - . . --uu- Á: 1_ Lb r'“, .. -——~
___… —… J ….… … — ::.:
Ỉ . :- | _ — l _ _Í,
" " r … ' ' . ~!
“* -t::z—z
' . lr q…“ "H . ~z.z~z
' M
' m
_ n 14.
. _ um~_w, …—24:
* ' ì.n.— 1qu . .
_ u . t—a—P
- . —. gu
" _ u-Z~=-—d ’
ủ” ? _ư …“ n « ~, : s _
: Ở'Ộ-IQ-* _ JJ. » LD. _
l›
—,pợ _.
m " `! -.f
“ c.———-—__ _ _ _
o ~— 'invlwd ,zAG, " uu;
.J.szwu.u ; .-q
jWẦfE!IJ
Rx - Thuốc bản theo đơn
Tenofovir disoproxil fumarate/Lamivudine/Efavirenz
300mg/300mg/600mg
THÀNH PHÀN
Mỗi viên nén bao phỉm chứa:
Hoạt chẩt:
Tenofovir disoproxil fumarat 300mg
Lamivudin 300mg
Efavirenz 600mg
Tá dược:
Cellulose vi tinh thể, natri croscarmellose, hydroxypropyl cellulose, natri |auryl sulfat, natri clorid,
magnesỉ stearat, lactose monohydrat
CHỈ ĐỊNH
Vìên kết hợp liều cố định (tenofovir/lamivudin/efavirenz) được chỉ định để điều trị nhiễm HlV-l
cho người lớn trên 18 tuổi.
LIÊU DÙNG VÀ CÁCH DÙNG ệ/
Việc điều trị nên được khỏi đầu bởi thầy thuốc có kinh nghiệm trong việc kiếm soát nhiễm HIV.
Người lớn: Liều khuyến cảo của thuốc kểt hợp liều cố định (tenofovir/lamivudin/efavirenz
300mg/300mg/600mg)1ả ] viên, ] lần mỗi ngảy.
Nên uống thuốc kểt hợp liều cố định (tenofovir/lamivudin/efavỉrenz 300mg/300mg/600mg) lúc
bụng đói Vì thức ăn có thề Iảm tăng nổng độ của efavỉrenz, điều nảy có thế Iảm tăng tần số xuất
hiện cảc phản ứng phụ. Nên uống thuốc kết hợp liều cố định vảo buổi tối để giảm các phản ứng phụ
trên hệ thần kinh trung ương.
Trẻ em: Tính an toản và hiệu quả của thuốc kểt hợp liều cố định (tenofovir/Iamivudinlefavirenz
300mg/300mg/600mg) ở bệnh nhân dưới 18 tuổi chưa được thiết lập. Thuốc kết hợp liều cố định
(tenofovir/Iamivudinlefavìrenz 300mg/300 mg/600mg) không được dùng cho trẻ em cho đến khi có
thêm cảc dữ liệu về tính an toản vả hỉệu quả cùa thuốc kểt hợp liều cố định
(tenofovỉr/Iamivudin/efavirenz 300mg/300mg/600mg) ở bệnh nhân dưới 18 tuổi. Vì vậy, thuốc kết
hợp lỉều cố định (tenofovirllamivudin/efavirenz 300mg/300mg/600mg) không được khuyến cảo
cho trẻ em.
Người lởn tuổi: Không có sẵn dữ Iìệu để đưa ra liều khuyến cảo cho những bệnh nhân trên 65 tuồi.
Suy thận:
Vỉên kết hợp liều cố định (tenofovir/lamivudin/efavỉrenz 300mg/300mg/600mg) không khuyến cảo
cho bệnh nhân suy thận mức độ trung binh đến nặng (độ thanh thải creatinin < 50 mllphủt). Những
bệnh nhân suy thận mức dộ trung bình hoặc nặng yêu cằu phải đỉều chinh khoảng cách thòi gian
giữa cảc liều dùng nên viên nén kết hợp liều cố định nảy không phù hợp.
Suy gan:
Việc đỉều chinh liều của viên kểt hợp liều cố định (tenofovir/lamivudìn/efavirenz 300mg
l300mg/600mg) lá không cẩn thiết dối với những bệnh nhân suy gan trung bình hoặc nặng trừ khi
có kèm theo suy thận.
CHỐNG CHỈ ĐỊNH
Viên kết hợp lỉếu cố định (tenofovir/lamivudin/efavỉrenz) được chống chỉ định ở những bệnh nhân
được bỉết quá mẫn vởi tenofovir hoặc lamivudin hoặc efavìrenz hoặc bât kỳ thảnh phân nảo của
thuốc.
CẢNH GIÁC VÀ THẶN TRỌNG
Viên kềt hợp lỉếu cố định (tcnofovir/lamỉvudin/efavỉrenz) không được dùng vởỉ bất kỳ thuốc nảo
khác có chứa tenofovir disoproxil fumarat hoặc iamivudin hoặc cfavirenz.
Viên kết hợp liều cố định (tenofovỉr/lamivudỉn/efavìrenz) chưa được nghỉên cứu ở những bệnh
nhân dưới 18 tuổi.
Suy Ihận:
Viên kết hợp liễu cố định (tenofovir/lamivudinlefavirenz 300mg/300mg/600mg) không khuyến cảo
cho bệnh nhân suy thận mức độ trung bình đến nặng (độ thanh thải creatinin < 50mllphủt). Những
bệnh nhân suy thận mức độ trung bình hoặc nặng yêu cầu phải điều chỉnh khoảng cảch thời gian
gìữa các ]ỉều dùng để đảm bảo nồng độ đạt ngưỡng điều trị cùa viên kết hợp liều cố định.Viên kết
hợp liều cố định (tenofovỉr/lamivudin/efavirenz 300mg/300mg/600mg) không khuyến cáo cho
bệnh nhãn suy thận mửc độ trung bình đến nặng (độ thanh thải creatinin < SOmh’phủt). Những bệnh
nhân suy thận mức độ trung bình hoặc nặng yêu cầu phải điều chinh khoảng cách thời gỉan giũa cảc
lỉều dùng nên viến nén kết hợp lỉếu cố định nảy không phù hợp.
Suy thận, kể cả giảm photphat huyết đã được ghi nhận trong các thử nghiệm lâm sảng sử ụng
tcnofovir disoproxil fumarat.
Theo dõi chức năng thận (độ thanh thải creatinin vả photphat huyết thanh) được khuyến cảo trước
khi dùng viên kết hợp iỉều cố dịnh (tcnofovir/iamìvudin/cfavỉrenz 300mg/300mg/600mg), mỗi 4
tuần trong nãm đầu, và sau đó [ả mỗi 3 tháng. Cẩn theo dõi chức năng thận thường xuyên hơn ở
những bệnh nhân có nguy cơ, hoặc có tỉến sử suy chức năng thận vả những bệnh nhân suy thận.
Viến kết hợp lỉếu cố định (tcnofovỉrliamivudìnfcfavirenz 300mg/300mg/600111g) không được đảnh
gỉả ở những bệnh nhân đang dùng cảc thuốc có độc tính trên thận (như aminoglycosid,
amphotericin B, foscarnct, ganciclovir, pentamidin, vancomycin, cidofovir hoặc interleukin-2). Nên
trảnh dùng viên kết hợp líều cố định (tenofovir/lamivuđinJefavirenz 300mg/300mg/600mg) đồng
thời hoặc dùng gần với các cảc thuốc có độc tính trên thận. Cẩn theo dõi chức năng thận hảng tuần
nếu việc dùng đồng thời viên kết họp !iều cố định (tenofovir/Iamivudin/efavirenz
300mg/300mg/600mg) vả cảc thuốc có độc tính trên thận không tránh được.
Viên kết hợp liều cố định (tenofovirllamìvudỉn/cfavỉrenz 300mg/300mg/600mg) không được đảnh
giá lâm sảng ở những bệnh nhân đang dùng những thuốc mã được bải tỉết qua cùng chắt vận
chuyến ờ thận, chất vận chuyến l anion hữu cơ của người (HOATI) (như adefovir dipivoxil;
cidofovir, một thuốc được biết gây độc thặn).
Viên kết hợp ]ỉểu cố định (Tenofovir/LamivudinclEfavircnz 300mg/300mg/600 mg) nên tránh dùng
ở những bệnh nhân đã từng điều trị với thuốc khảng retrovirus co' chùng đột biến KôSR.
Viên kết hợp liếu cố định (tenofovir/lamivudin/efavirenz 300mg/300mg/600mg) không đuợc
nghiên cứu ở nhũng bệnh nhân trên 65 tuốỉ. Những bệnh nhân lớn tuổi có khả nảng bị suy giảm
chức năng thận nhỉều hơn; vì thế, nên thận trọng khi điều trị cho những bệnh nhân iớn tuổi bằng
vỉên kết hợp lỉếu cố định (tenofovỉr/lamivudin/cfavircnz 300mg/300mg1600 m g).
Bệnh gan:
Một nghiên cứu dược động học đã được thực hỉện ở những bệnh nhân khỏng bị nhiễm HIV vởi cảc
mức độ suy gan khác nhau. ở những bệnh nhân nảy sự thay đối về dược động học là không đáng
kê.
1`
Những dữ Iỉệu về sự an toản vả hỉệu quả của viên kết hợp liếu cố định
(tenofovỉr/lamivudin/efavirenz 300mg/300mg/600mg) bị hạn chế ở những bệnh nhân rối loạn chức
năng gan dưới mức ý nghĩa. Những bệnh nhân bị viêm gan B hoặc C mân tính và được điều trị với
trị liệu kháng retrovirus kết họp có nguy cơ tăng cảc phản ứng không mong muốn ở gan nặng và có
thể gây tử vong. Trong trường hợp trị liệu kháng virút kết hợp cho viêm gan B hoặc C, vui lòng
tham khảo thông tỉn sân phẩm iiên quan cho nhũng thuốc nảy.
Những bệnh nhân có suy chức năng gan trưởc dó kể cả viêm gan mãn tính thể hoạt động có sự tâng
tần số xuất hỉện các bắt thường về chửc năng gan trong suốt thời gian trị liệu kháng retrovirus kết
hợp vả nên được theo dõi theo thực tế. Nếu có chứng cứ của bệnh gan trở nên xấu hon ở những
bệnh nhân nảy, phải cân nhắc để gỉán đoạn hoặc ngưng điều trị.
Chứng nhiễm acid Iactic: Chừng nhiễm acid lactic, thường kèm với chứng gan to vả chứng nhiễm
mở ở gan, đã được ghi nhận khi dùng các thuốc đồng đẳng nucleosid. Cảo dữ liệu lâm sảng vả tỉền
lâm sảng gợi ý rằng nguy cơ xảy ra chứng nhiễm acid lactic, một tảc động cùa các đồng đẳng
nucleoside, thi thắp đối với thuốc kết họp lỉều cố định (tenofovir/lamivudìn/efavirenz
300mg/300mg/600mg). Tuy nhỉên, vì tenofovir có cẳu trúc liên quan đến cảc đồng đắng nucleosid
nên nguy cơ nảy không thế loại trù. Cảo triệu chứng sởm (tăng lactat huyết có triệu trứng) kể cả các
triệu chứng tiêu hóa nhẹ (buồn nôn, nôn và đau bụng), sự khó ở không rõ rảng, vả giảm sự thẻm ăn,
giảm cân, các triệu chứng hô hẳp (thớ sâu vả/hoặc nhanh) hoặc các triệu chứng thần kinh (kể cả
kém vận động). Chứng nhiễm acid iactỉc có tỉ lệ tử vong cao vả có thế đi kèm viêm tụy, suy gan
hoặc suy thận. Chứng nhiễm acid lactic thường xảy ra sau một vải thảng hoặc nhiếu thảng điều trị.
Việc đỉều trị với cảc đổng đắng nucleosid nên được ngưng nếu có sự tăng lactat huyết có triệu
chứng vả nhiễm acid lactic/nhiễm acid chuyến hóa chứng gan to tiến triến, hoặc sự tãng nhanỹ
nông độ aminotransferase.
Nên thận trọng khi dùng các đồng đẳng nucleosid cho bất kỳ bệnh nhân nảo (đặc biệt là phụ nữ ẻo
phì) có chứng gan to, viêm gan hoặc cảc yếu tố nguy cơ được bìết khác cho bệnh gan và chứng
nhiễm mở ở gan. Những bệnh nhân bị nhỉễm đồng thời với viêm gan C và được đỉều trị với alpha
interferon vả ribavirin có thể tạo thảnh một nguy cơ đặc bỉệt.
Những bệnh nhân có nguy cơ cao cằn được theo dõi chặt chẽ.
Hội chửng phục hồi miễn dịch: ở nhũng bệnh nhân nhỉễm HIV bị suy gỉảm miễn dịch nặng vảo
thời điểm trị liệu kháng retrovirus kết hợp (CART), một phản ứng viêm đối vởi những mầm bệnh
không có triệu chứng hoặc những mầm bệnh cơ hội còn lại có thể nảy sinh và gây những tình trạng
lâm sảng nguy hiếm, hoặc lảm trầm trọng thếm triệu chứng bệnh. Những phản ứng tiêu biếu như
thế đã được quan sảt thấy trong vòng vải tuần hoặc vải thảng đầu cùa trị liệu kháng retrovirus kểt
hợp. Cảo ví dụ liên quan lả viếm võng mạc virút cụ bảo, nhiễm trùng toản thân vả/ hoặc sự nhiễm
trùng do mycobacterỉum, và viêm phổi do Pneumocyslis carinỉi. Bất kỳ triệu chứng viêm nảo nên
được đảnh giá và điều trị khi cằn thiết.
Dùng đồng thời thuốc kết hợp liếu cố định (tenofovir/Iamivudin/efavirenz 300mg/300mg |600mg)
vả didanosin lảm tăng 40—60% sự phơi nhỉễm toản thân cùa didanosin mả có thể lảm tãng nguy cơ
cảc phản ửng phụ liên quan đến didanosin. Cảo trường hợp viếm tụy và nhiễm acid lactic, đôi khi
gây tử vong, hiếm được ghi nhận.
Liệu pháp điều !rị với 3 thuốc nucleosid: Tỉ lệ thất bại về virút học cao và sự xuất hìện kháng
thuốc ở gỉai đoạn đè… đã được ghi nhận khi thuốc kết hợp liếu cố định
(tenofovirỉlamivudin/efavirenz 300mg/300mg/600mg) được kết hợp với [amivudỉn vả abacavir
cũng như với lamivudin vả dỉdanosín khi dùng liều một lần mỗi ngảy.
Nhiễm trùng cơ hội: Những bệnh nhân đang điều trị bằng thuốc kết hợp liếu cố định
(tenofovir/lamỉvudin/efavirenz 300mg/300mg/600mg) hay bất kỳ trị liệu kháng retrovirus nảo khác
đếu có thế tỉếp tục mắc các nhỉễm trùng cơ hội và cảc bỉến chứng khảo của bệnh nhỉễm HIV, vả vì
lì...
thế nên duy trì việc theo dõi lâm sảng chặt chẽ bởi những thầy thuốc có kinh nghiệm trong điều trị
những bệnh liên quan đến HIV.
Sự lây truyền HIV: Bệnh nhân phải được khuyên rằng trị liệu kháng retrovirus, kể cả thuốc kết hợp
liếu cố định (tenofovirllamivudin/efavirenz 300mg/300mg/600mg), không ngăn ngừa được nguy cơ
lây truyền HIV cho những người khảc thông qua quan hệ tình dục hay sự nhiễm qua mảu. Cần phải
tiếp tục thận trọng
Viêm tụy: Hiểm xảy ra cảc trường hợp viêm tụy. Nên ngưng ngay việc điếu trị với thuốc kết họp
liều cố định (tenofovìr/lamivudin/efavirenz 300mg/300mg/600mg) nểu thấy xuất hiện các dẩn hiệu
lâm sảng, triệu chứng hay cảc bất thường cận lâm sảng gợi ý viêm tụy xảy ra.
Loạn chửc nãng ty lạp thể: Cảo đồng đẳng nucleosid vả nucleotid đã được chứng minh trên in
vitro và in vivo là gây ra sự phá hùy ty lạp thể ở mức độ khác nhau. Có những bảo cảo của sự loạn
chức năng ty lạp thế ở những trẻ sơ sinh âm tính với HIV đã phơi nhiễm trong tử cung vả! hoặc sau
sinh với các đồng đằng nucleosid. Các phản ứng phụ chính đã được ghi nhận là các rối Ioạn về
huyết học (thiếu máu, giảm bạch cầu trung tinh), rối loạn chuyến hóa (tăng lactat huyết, tăng lipid
huyết). Cảc phản ứng phụ nảy thường là thoảng qua. Một số rối Ioạn thần kinh bùng phát muộn đă
được ghi nhận (tăng trưong lực, co giật, hảnh vi bất thường). Cảc rối loạn thần kinh là thoáng qua
hay vĩnh cữu hiện tại chưa được biết. (ẵÌ/
Loạn dưỡng mỡ vả những bất thường về sự chuyển hóa: Ở những bệnh nhân HIV trị liệu ang
retrovirus kết hợp có sự phân bố lại mở trong cơ thể (Ioạn dưỡng mỡ). Hậu quả lâu dải của những
trường hợp nảy hiện tại chưa được biết. Những hiếu biết về sự chuyển hóa thì không đầy đù.
Có giả thuyết cho rằng có sự liên quan giữa bệnh u mỡ nội tạng với cảc chất ức chế protease (Pls)
và sự loạn dưỡng mở với cảc chất ức chế enzym sao chép ngược nucleosid (NRTIS). Nguy cơ cao
hơn của sự loạn dưỡng mỡ được đi kèm với cảc yếu tố cá nhân như lớn tuối, vả các yếu tố liên quan
đến thuốc như thời gian điều trị với thuốc kháng retrovirus dải hơn và có rối loạn chuyền hóa đi
kèm. Nên kiểm tra lâm sảng kể cả việc đánh giá các dấu hiệu thể chất của sự phân bố lại mỡ. Nên
đo lipid huyết thanh và glucose huyết Iủc nhịn ản. Nên kiếm soát sự rối loạn lipid như là một chỉ
định lâm sảng.
Hoại rử xương: Mặc dù khoa nghiên cứu nguyên nhân bệnh đã xem xét đến nhiếu yếu tố (kể cả
việc dùng corticosteroid, uống rượu, sự ức chế miễn dịch nặng, chỉ số khối cơ thể cao), các trường
hợp hoại từ xương đã được ghi nhận đặc biệt ở những bệnh nhân bị bệnh HIV trước đó vảIhoặc trị
iiệu kháng retrovirus kết hợp thòi gian dải (CART). Nên khuyên bệnh nhân gặp thầy thuốc nểu họ
bị đau vả nhức khớp, cứng khớp hoặc khó khăn trong việc di chuyền.
Phá! ban: Phảt ban nhẹ đến trung bình đã được ghi nhận trong các nghiên cứu lâm sảng vởi thuốc
kết hợp iiểu cố định (tcnofovirllamivudin/efavirenz 300mg/300mg/600mg) và thường quyết định
tiếp tục đỉều trị. Cảc thuốc kháng histamin vả/hoặc các corticosteroid có thể cải thiện sự dung nạp
và mau chóng lảm mất đi triệu chứng phát ban. Phát ban nặng kèm với mụn nước, sự tróc vảy chảy
mủ hay loét đã được ghi nhận ở it hơn 1% Số bệnh nhân điểu trị với efavirenz. Ti iệ mắc hồng ban
đa dạng hoặc hội chứng Stevens-Johnson khoảng 0,1%. Phải ngưng dùng thuốc kết họp liếu cố
định (tenofovir/lamivudin/cfavirenz 300mg/300mg/600mg) ở những bệnh nhân bị phảt ban nặng
kèm với mụn nước, tróc vảy, lan tòa đến cả niêm mạc hay sốt. Nếu vỉệc trị liệu vởi thuốc kết hợp
liều cố định (tenofovirllamivudin/efavỉrenz 300mg/300mg/600mg) bị ngưng, cũng nên cân nhắc
giản đoạn việc trị liệu với các tác nhân kháng retrovirus khảc đế trảnh sự phảt triến cùa cảc vỉrút
kháng thuốc.
Những bệnh nhân đã phải ngưng đỉều trị với cảc NNRTI khảo do phát ban có thể có nguy cơ phảt
ban cao hơn khi điều trị với thuốc kết hợp liều cố định (tenofovir/lamỉvudinlefavirenz
300mg/300mg 600mg).
Các triệu chửng tâm thần: Các phản ứng có hại tâm thần đã được ghi nhận ở nhũng bệnh nhân
điếu trị vởi thuốc kết hợp Iiếu cố định (tenofovir/Iamivudinlefavirenz 300mg/300mg/600mg).
Những bệnh nhân có tiền sử rối loạn tâm thần trước đó sẽ có nguy cơ về các phản ứng có hại tâm
thần nghiêm trọng cao hơn. Đặc biệt, trầm cảm nặng thường gặp nhiều hơn ở những bệnh nhân có
tỉền sử về trằm cảm. Cũng có các báo cáo về trầm cảm nặng, chết do tự sát, ảo giảc vả hânh vi
giống như rối Ioạn tâm thần sau khi lưu hảnh thuốc. Nên khuyên bệnh nhân gặp bác sĩ ngay nếu họ
có các triệu chứng như trầm cảm nặng, rối ioạn tâm thần hay có ý nghĩ tự sảt đề đảnh giá khả năng
những triệu chứng nảy cớ iiên quan đến việc dùng thuốc kết hợp liều cố định nảy hay không, và
nếu có, xác định xem những nguy cơ của việc tiếp tục điều trị có hơn hẳn những lợi ích mang lại
hay không.
Ca'c triệu chửng trên hệ thẩn kinh trung ương: Cảo triệu chứng gồm, nhưng không hạn chế,
chóng mặt, mất ngủ, buồn ngù, kém tập trung và ác mộng iả những phản ứng không mong mưốn
được ghi nhận thường xuyên ở những bệnh nhân dùng ] viên kết hợp liều cố định
(tenofovirllamivudin/cfavirenz 300 mg/300mgIÓOOmg), ] lẩn mỗi ngảy trong cảc nghiên cứu lâm
sảng. Cảo triệu chứng trên hệ thần kinh trung ương thường xuất hiện khi bắt đầu điều trị I-2 ngảy
đầu và thường biến mất sau 2—4 tuần điếu trị đầu tiên. Nếu chủng xảy ra, bệnh nhân nên được biết
rằng những triệu chứng thường gặp nảy có thể cải thiện với sự ngưng thuốc vả không thể tiến đoán
được đợt bùng phát kế tiếp của bất kỳ triệu chứng tâm thấn ít thường xuyên nâo. ỸV
Động kinh: Co giật hỉểm khi được quan sát ở những bệnh nhân dùng thuốc kết hợp liều cố đ h
(tenofovir/lamivudin/cfavirenz 300mg/300mg/600mg), thường thấy ở những bệnh nhân đã có tiền
sử động kinh do thuốc đã bỉết. Những bệnh nhân đang dùng đồng thời với thuốc chống co giật được
chuyến hóa chủ yếu qua gan, như phenytoin, carbamachin vả phcnobarbital, có thế yêu cằu theo
dõi nồng độ trong huyết tương định kỳ. Trong một nghiên cứu về tương tảc thuốc, nồng độ trong
huyết tương của carbamazepin giảm khi carbamachin được dùng đổng thời với thuốc kết hợp Iiếu
cố định (tenofovir/iamivudinlefavirenz 300mg/300mg/600mg). Phải thận trọng ở bệnh nhân đã có
tiền sử động kinh.
Ẩnh hưởng của thức ãn: Việc dùng thuốc kết hợp liếu cố định (tenofovir/lamivudin/cfavirenz
300mg/300mg/600 mg) với thức ăn có thế lảm tăng sự phơi nhiễm cùa efavircnz vả có thể dẫn đển
iâm tãng tần số xuất hiện cùa các phản ứng không mong muốn. Thuốc kết hợp iiều cố định
(tcnofovir/Iamivudin/efavirenz 300mg/300mg/600 mg) được khuyến cảo uống vảo lủc bụng đới, tốt
nhất lả trước khi đi ngù.
Lactose: Viến kết hợp liếu cố định (tcnofovir/iamivudin/efavircnz) không thích hợp cho những
người có rối loạn di truyền hiếm gặp cùa chứng Ioạn chuyển hóa cacbon hydrat bẩm sình hoặc hội
chứng kém hấp thu glucoselgalactose.
TƯONG TÁC VỚI CÁC THUỐC KHÁC VÀ CÁC DẠNG TƯỢNG TÁC KHÁC
Vi thuốc kết hợp liếu cố định (tenofovirllamivudinlefavircnz 300mg/300mg/600 mg) bao gồm
tenofovir, lamivudin vả efavirenz, nên bất kỳ tương tác nảo đã được xác định với từng thảnh phần
riêng biệt trong đó đều có thể xảy ra với thuốc kết hợp liếu cố định (tenofovir/lamivudinlefavirenz
300mg/300mg/600 mg).
Các nghiên cứu về tương tảc chi được thực hiện ở người iớn.
Dựa trên kết quả thực nghiệm in vitro và con đường thải trừ được biết của tenofovir, khả năng
tương tảc qua trung gian CYP4SO của tcnofovir với cảc thuốc khác là thấp.
Tenofovir được bải tiết qua thận, cả sự lọc qua cầu thận và sự bải tiết chủ động qua hệ vận chuyến
anion (HOATI). Dùng đồng thời thuốc kết hợp lìều cố định (tcnofovir/lamivudin/efavirenz
300mg/300mg/600 mg) với cảc thuốc khảc mà cũng được bải tiết chủ động qua hệ vận chuyển
anion (như cidofovir) có thế Iảm tăng nồng độ cùa tenofovir hoặc các thuốc dùng chung.
Is. .
Lamỉvudin có thế ức chế sự phosphoryl hóa nội bảo của zalcitabin khi hai thuốc nảy được dùng
đồng thời. Vì thế, không nên sử dụng phối hợp thuốc kết hợp iiều cố định
(tenofovir/lamivudin/efavirenz 300mg/300mgl600mg) với zalcitabin
Không khuyến cáo dùng đồng thời thuốc kết hợp liều cố định (tenofovir/lamivudin/efavirenz
300mg/300111g/600mg) với gancỉclovỉr hoặc foscarnet đường tĩnh mạch.
sư dụng trimethoprim/sulfamethoxazol 160 mg/SOO mg đồng thời với thuốc kết hợp lỉếu cố định
(tenofovirllamivudin/efavirenz 300mg/300mg/600mg) dẫn đến tăng 40% sự phoi nhiễm cùa
lamivudin, do thảnh phần trimethoprim; thảnh phần sulfamethoxazol không tương tác. Tuy nhiên,
trừ khi bệnh nhân suy thận, không cần thiết phải điều chỉnh liều của Iamỉvudin. Thuốc kết hợp liều
cố định (tenofovir/lamivudỉn/efavirenz 300mg/300mg/600mg) không ảnh hưởng lên dược động học
của trimethoprỉm hay sulfamcthoxazol. Khi việc dùng đồng thời được đảm bảo, bệnh nhân nên
được theo dõi lãm sảng. Nên tránh dùng đồng thời thuốc kết họp liếu cố định
(tenofovir/lamìvudin/efavirenz 300mg/300mg/600mg) với cảc liều cao của co-trimoxazol đế đỉều
trị viêm phổi do Pneumocyslt's carinii vả bệnh do toxoplasma.
Tăng vùa phải Cmax (28%) cúa zidovudin đã quan sảt được khi dùng cùng với thuốc kết hợp liều cố
định (tenofovir/iamivudin/efavỉrenz 300mg/300mg/600mg), tuy nhiên sự phơi nhiễm toản thân
(AUC) thi không thay đối đáng kế.
Sự chuyến hớa cùa lamivudin không iiên quan đến CYP3A, sự tương tảc với các thuốc được
chuyến hóa bời hệ thống nảy (như ca'c PI) iả không thể xảy ra.
Efavirenz là một tác nhân gây cảm ứng CYP3A4 vả là một chất ức chế một số isozym CYP kể cả
CYP3A4. Nồng độ trong huyết tương cùa các hợp chất mã là chất nến của CYP3A4 có thế giảm
khi dùng đồng thời với thuốc kết hợp liếu cố định (tenofovir/lamivudinlcfavirenz
300mg/300mg/600mg). Sự phơi nhiễm cùa efavirenz cũng có thế bị thay đối khi được dùng với cảc
thuốc hay thức z… (như dịch chiết nho) mả ảnh hướng đến hoạt động của CYP3A4.
Thuốc kết hợp liếu cố định (tenofovir/lamỉvudỉn/cfavirenz 300mg/300mg/600mg) không được
dùng đồng thời với terfenadin, astemỉzol, cisaprid, mìdazolam, triazolam, pimozid, bepridil hoặc
các alkaloid nấm cựa gả (ví dụ, ergotamin, dihydrocrgotamin, ergonovin, vả methylergonovin) vì
sự ức chế sự chuyến hóa cùa chúng có thể dẫn đến các trường hợp nghiêm trọng, de dọa tính mạng.
Các tác nhân khảng retrovirus kểt hợp
.C_as.C.hatJach_ểmgtsLư_fủl
Amgrenavir: Không cần thiết điều chinh liếu nếu thuốc kết hợp liều cố định
(tcnofovir/iarnivudỉnlcfavỉrcnz 300mg/300mg1600mg) được dùng kết hợp vởi amprcnavir (600 mg,
2 lần mỗi ngảy) vả ritonavir (100 hoặc 200 mg, 2 lằn mỗi ngảy).
Hơn nữa, nếu thuốc kết hợp Iìều cố định (tenofovỉrllamivuđin/efavirenz) được dùng kết hợp với
amprcnavir vả nelfinavir, không cằn thíết phải đỉều chinh Iỉều cho bất cứ thuốc nảo. Không khuyến
cảo điều trị kết hợp thuốc kết hợp liều cố định (tenofovir/lamivudin/efavircnz) với amprenavir vả
saquinavir, vì sự phơi nhỉễm đối với các Pi giảm đáng kể.
Atazanavir: Dùng đồng thời thưốc kểt hợp lỉếư cố định (tcnofovirllamivudỉnlcfavircnz) vả
atazanavỉr trong sự kết hợp vởi ritonavir có thể dẫn đển tãng sự phơi nhỉễm của efavirenz mã có thế
lảm cho sự dung nạp cúa cfavirenz trở nên tệ hơn. Dùng đổng thời thuốc kết hợp Iiểu cố định
(tenofovir/Iamivudìn/efavỉrenz) với atazanavỉr trcng kết hợp với ritonavir iiều thấp iâm giảm đảng
kể sự phoi nhiễm của atazanavir, cần phải đìếu chỉnh Iiểu cùa atazanavỉr.
Indinavir: Không cần phải đỉều chinh liều cùa efavircnz khỉ thuốc kết hợp liều cố định
(tenofovir/lamivudin/efavirenz) dược dùng với indinavir hoặc indinavir/rỉtonavir.
Loninavir/ritonavir: Khi được dùng đống thời với thuốc kết họp líếu cố định
(tenofovirflamivudin/cfavỉrenz), nên cân nhắc tăng 33% liều của iopinavir/ritonavỉr (4 viên
i“
nangl~ó,S ml, 2 lần mỗi ngảy thay vì 3 viên nanng ml, 2 lần mỗi ngảy). Cần phải thận trọng vì việc
điều chinh liếu nảy có thế không đủ ở một số bệnh nhân.
Nelfmavir: Không cần điều chinh liểu khi nclfinavir được dùng kết hợp với thuốc kết hợp liều cố
định (tenofovir/lamivudinlefavirenz).
Ritonavir: Khi thuốc kểt hợp liều cố định (tenofovir/Iamivudin/efavirenz) được dùng với ritonavỉr
500 mg hoặc 600 mg, 2 lần mỗi ngảy, sự kết hợp nảy không được dung nạp tốt (ví dụ, chóng mặt,
buồn nôn, cảm giác khảo thường và tăng enzym gan đã xảy ra).
Saguinavir: Dùng thuốc kết hợp liếu cố định (tenofovir/lamivudin/efavirenz) trong sự kết hợp với
saquinavir như lá Pi duy nhất không được khuyến cáo.
Saguinavirlritonavir: Không có sẵn cảc dữ lỉệu về khả năng tương tác cùa thuốc kết hợp liếu cố
định (tenofovir/iamivudin/efavirenz) với sự kết hợp với saquinavir vả ritonavir.
Các NRTI: Cảc tương tác có ý nghĩa lâm sảng không có thể xảy ra vì các chất ức chế enzym sao
chép ngược nucleosid (NRTIs) được chuyến hóa qua một con đường khảc so với thuốc kết hợp liều
cố định (tenofovirllamivudin/efavirenz) và không có thể xảy ra cạnh tranh cảc enzym chuyến hóa
và con đường thải trừ giống nhau.
Các NNRTI: Không có cảc nghiên cứu được thực hiện với thuốc kết hợp liều cố định
(tenofovir/lamívudin/efavirenz) trong sự kết hợp với các NNRTI khảo và khả năng tương tác dược
động học hay dược lực học chưa được biết. q7/
Các tác nhân khảng vi sinh vât:
Rifamicin: Rifampicin lảm giảm AUC cùa efavirenz 26% và Crnax 20% ở những người tinh nguyện
không bị nhiễm. Liều của efavirenz phải được tăng lên 800 mg/ngảy khi dùng với rifampicin. Việc
đỉếu chinh liếu cùa rifampicin không được khuyến cáo khi được dùng với thuốc kết hợp liếu cố
định (tenofovir/lamivudin/efavirenz).
Trong một nghiên cứu ở những người tình nguyện không bị nhiễm, thuốc kết hợp liếu cố định
(tenofovir/iamivudin/efavirenz) Iảm giảm Cmax của rifabutin 32% và AUC của rifabutin 38%.
Rifabutỉn không ảnh hướng đáng kể lên dược động học cùa thuốc kết hợp liều cố định
(tenofovir/lamivudin/efavirenz). Những dữ liệu nảy gợi ý rằng liều hằng ngảy của rifabutin nên
tăng 50% khi đuợc dùng với thuốc kết hợp liếu cố định (tenofovir/lamivudin/efavirenz) và liều
rifabutin có thể tăng gấp đôi nếu rifabutin được dùng 2 hoặc 3 lần mỗi tuần trong kết hợp với thuốc
kết hợp Iiếu cố định (tcnofovir/iamivudinlefavirenz).
Các kháng sinh nhóm macrolid:
AJzithromỵcin: Không cần điếu chinh liếu khi azithromycin được dùng trong sự kết hợp với thuốc
kêt hợp liêu có định (tenofovir/Iamivudỉnlefavirenz).
Clarithromỵcin: Không khuyến cảo điếu chinh liều cùa efavirenz khi thuốc kết hợp liếu cố định
(tenofovir/lamivudin/efavirenz) được dùng với clarithromycin.
Cặc khác `sinhmacrolid khác, như erythromycin, chưa được nghiên cứu trong sự kểt hợp với thuốc
kêt hợp lỉêu có định (tenofovir/lamivudin/efavirenz).
Các tác nhân kháng nấm:
W: Chống chỉ định dùng đồng thời thuốc kết hợp liều cố định
(tenofovirliamivudin/efavirenz) vả voriconazol.
ltraconazol: Việc dùng đồng thời ] viên thuốc kết hợp liều cố định
(tenofovir/iamivudin/cfavircnz) một lần mỗi ngảy với itraconazol (200 mg đường uống mỗi 12
giờ) ở những người tinh nguyện không bị nhiễm đã lâm giảm AUC, Cmax, vả Cmm của itraconazol ở
trạng thái ốn định là 39%, 37%, và 44%, tương ứng, và của hydroxyitraconazoi là 37%, 35%, vả
43%, tương ứng, so với itraconazol được dùng một mình. Vì không có liều khuyến cáo cho
itraconazol nên cần xem xét dùng các thuốc khảng nấm khác.
Các tảc nhân khảng nấm khảc: Không có tương tảc dược động học có ý nghỉa lâm sảng được
thắy khi fiuconazol vả thuốc kết hợp liếu cố định (tenofovir/lamivudin/cfavircnz) được dùng đồng
thời ở những người tình nguyện không bị nhiễm. Khả năng tương tảc giữa thuốc kết hợp liều cố
định (tenofovir/lamivudin/efavirenz) vả cảc thuốc kháng nấm imidazol vả triazol khác, như
itraconazol vả ketoconazol, không được nghiên cứu.
Carbamazenin: Việc dùng đổng thời [ viên thuốc kết họp liều cố định
(tenofovir/lamivudin/efavirenz), một lần mỗi ngảy với carbamazepin (400 mg một lẩn mỗi ngảy) ở
những người tinh nguyện không bị nhiễm dẫn đến sự tưong tác hai phia. AUC, Cmax và C…… ở trạng
thái ón định cùa carbarnazepin giảm 27%, 20% và 35%, tương ứng, trong khi AUC, Cmax vả Cmm ở
trạng thải ồn định của efavirenz giảm 36%, 21%, và 47%, tương ửng. AUC, Cmax vả Cmm ở trạng
thái ổn định của chẳt chuyền hớa epoxide carbamazepin có hoạt tính không thay đổi. Nổng độ trong
huyết tương của carbamazepỉn nến được theo dõi định kỳ Không có dữ liệu về việc dùng đồng thòi
các liều cao hơn cùa efavỉrenz hoặc carbamazepin; vì thế, không có liếu khưyến cáo vả nên cần cân
nhắc thay thế điếu trị với thuốc chống co giật khác.
Các thuốc chống co eiât khác: Khỏng có sẵn dữ liệu về khả năng tương tác giữa thuốc kết hợp
lỉều cố định (tenofovir/lamivudin/efavirenz) vả phenytoin, phcnobarbital, hoặc cảc thuốc chống co
giật khảc mã là chất nến của isozym cvp4so. Khi thuốc kết hợp iỉều cố định
(tenofovir/Iamivudin/cfavirenz) được dùng đồng thời với những tảc nhân nảy, có thế có sự giảm
hoặc tăng nồng độ trong huyết tương cùa mỗi thuốc; vì thế, nên tiến hănh theo dõi nồng độ trong
huyết tướng định kỳ. Cảo nghiến cứu về tương tảo đặc biệt không được thực hiện với thuốc kết họp
liều cố định (tenofovirllamivudin/cfavircnz) vả vigabatrin hoặc gabapcntin. Cảc tương tác có ý
nghĩa lâm sảng sẽ không xảy ra vi vỉgabatrin vả gabapentỉn được thải trù riêng biệt ở dạng không
thay đối qua nước tiểu và sẽ không thể xảy ra cạnh tranh các enzym chuyến hóa giống nhau vả ác
con đường thải trừ giống efavỉrenz. t\xw
Cảc tảc nhân lảm eiảm linid: ị
Việc dùng đổng thời thuốc kết hợp lìều cố định (tcnofovir/lamivudinfefavirenz) với chẳt ức chế
men khử HMG — CoA như atorvastatin, pravastatin, hoặc simvastatin đã cho thấy lảm giảm nồng
độ trong huyết tương của statin ở những người tinh ngưyện không bị nhỉễm. Nên theo dõi định kỳ
nồng độ choiesterol. Có thế cần phải điều chỉnh liếu cùa các statin.
Các tương tương khác:
Thuốc khảng acid/famotidin: Cả cảc thuốc khảng acid nhôm/magncsi hydroxid lẫn famotidin đến
không lâm thay đối sự hắp thu của efavirenz ở những người tinh nguyện không bị nhiễm. Các dữ
liệu nảy gợi ý rằng sự thay đối pH dạ dảy bởi các thuốc khác sẽ không thể ảnh hướng đến sự hấp
thu của cfavirenz.
Cảc thuốc trảnh thai đường uống: Chi có thảnh phẳn cthinylocstradiol của các thuốc trảnh thai
đường ưống được nghiên cứu AUC sau khi dùng liếu duy nhắt ethinyloestradiol, tăng 37% sau
nhiến liếu cfavircnz. Sự thay đối không có ý nghĩa được quan sát ở Cmax của ethinyloestradiol. Ý
nghĩa lâm sảng của những tác động nảy không được bíết. Không có sự ảnh hướng của liếu duy nhất
ethinyloestradiol iên Cmax hoặc AUC của efavỉrenz. Vi khả năng tương tảc của efavirenz với các
thuốc tránh thai đường uống không được mô tả đầy đú, nến phải dùng một phương phảp tránh thai
mảng ngăn đảng tin cậy kèm với thuốc trảnh thai đường uống.
Methadon: Trong một nghiên cứu ở những bệnh nhân HIV là người nghiện tiêm chich ma túy,
dùng đồng thời efavirenz vởi methadon lảm giảm nồng độ trong huyết tuong của methadon và dẫn
đến các dẩn hiệu cai nghỉện thuốc phỉện. Liều methadon phải được tăng trung binh 22% để lảm
giảm bớt hội chứng cai. Bệnh nhân nên được theo dõi các dẫu hiệu cai nghiện vả liếu methadon cần
được tăng để lảm gỉảm bót hội chứng cai.
Dươc thâo St. John’wort ịHỵgericum ger[oratumịz Nồng độ trong huyết tương cùa efavircnz có
thể bị giảm khi dùng đồng thời thuốc kết hợp liều cố định (tenof0vir/lamivudin/efavirenz) với cảc
chế phẩm thảo dược St. John’wort (Hypericum perforalum). Điều nảy là do sự cảm ứng của các
enzym chuyển hóa thuốc vả/ hoặc vận chuyển protein bới St. John's wort. Cảc chế phẩm thảo dược
chứa St. John's wort không được dùng đồng thời với thuốc kết hợp iiểu cố định
(tcnofovirllamivudin/efavircnz). Nếu một bệnh nhân đang dùng St. John's wort, nên ngưng St.
John's wort, kiếm tra mật độ virút và nếu có thể kiềm tra luôn nổng độ cùa efavirenz. Nồng độ của
efavirenz có thế tãng khi ngưng St. John's wort vả iiều cùa efavirenz có thề cằn được điều chinh.
Tác động gây ra cùa St. John's wort có thế vẫn còn tổn tại it nhất 2 tuần sau khi ngưng điều trị.
Cảc thuốc chống trầm cảm: Không có những ảnh hướng có ý nghĩa lâm sảng iên cảc thông số
dược động học khi paroxetin và thuốc kết hợp liếu cố định (tenofovirllamivudin/efavirenz) được
dùng đồng thời. Không cần điều chinh liều cho cfavirenz hoặc cho paroxctin khi những thuốc nảy
được dùng đồng thời. Sertralin, một chất nến cùa CYP3A4, không lảm thay đối có ý nghĩa dược
động học cùa efavirenz. Thuốc kết hợp liều cố định (tenofovir/lamivudin/efavirenz) lâm giảm Cmax,
C24 vả AUC của sertralin từ 28,6 - 46,3%. Liều cùa sertralin nên được tăng theo đáp ứng lâm sảng.
Cetirizin: Không cần điếu chinh liều cho efavirenz hoặc cho cetirizin khi thuốc kết hợp liều cố
định (tenofovir/lamivudinlefavirenz) được dùng đồng thời với cetirizin.
Lorazepam: Thuốc kết hợp Iiếu cố định (tenofovir/lamivudin/cfavirenz) Iảm tãng C,… và AUC
của lorazepam l6,3% và 7,3% tương ứng. Những thay đổi nảy không được xem xét để biết có ý
nghĩa lâm sâng hay không. Không cần thiết phải điều chinh liếu.
Các thuốc chen kênh calci: Không cẩn thiết phải điểu chinh liều efavirenz khi thuốc kết hợp liều
cố định (tenofovir/lamivudin/efavirenz) dùng đồng thời với diltiazem.
Không có sẵn cảc dữ liệu về khả năng tương tảc cùa thuốc kết hợp iiếu cố định
(tenofovir/lamivudin/efavirenz) với cảc thuốc chẹn kênh calci khác mà là chất nến của enzym
CYP3A4 (như verapamil, felodipin, nifedipin, nicardipin). Khi thuốc kết hợp lỉều cố định
(tcnofovir/Iamivudin/efavirenz) được dùng đồng thời với một trong những tác nhân nảy, có khả
năng lảm giảm nồng độ trong huyết tương của các thuốc chẹn kếnh calci. Việc điều chinh lỉếu nên
được hướng dẫn theo đáp ứng lâm sảng (tham khảo tớm tắt đặc tính sản phẩm cùa các thuốc chẹn
kênh calci).
PHỤ NỮ MANG THAI VÀ CHO CON BÚ ql/
Phu nữ mang thai
Không nên sử dụng thuốc kết hợp liều cố định (tenofovir/lamivudinlefavirenz) trong thời kỳ mang
thai trừ khi thật sự cần thiểt (khi không có sự iựa chọn nảo phù hợp hơn).
Phụ nữ được điểu trị với thuốc kết hợp liều cố định (tenofovir/Iamivudinlefavirenz) nên tránh có
thai. Phương phảp tránh thai vảch ngăn nên dược dùng kèm với cảc phương phảp trảnh thai khác
(ví dụ, thuốc tránh thai hormon đường uống hoặc đường khảo). Phụ nữ có khả năng sinh con nên
khảm thai trước khi dùng thuốc kểt hợp liều cố định (tenofovir/lamivudinlefavirenz).
Không có những nghiên cứu đầy đủ và kiểm soát tốt trên thuốc kết hợp liều cố định
(tenofovir/lamivudin/efavirenz) ở phụ nữ mang thai. Trong kinh nghiệm sau khi thuốc ra thị trường
thông qua một cơ quan đăng ký khảm thai, nhiếu hơn 200 thai phụ dùng cfavircnz trong 3 thảng
đẫu như một phẩn cùa chế độ khảng retrovirus kết hợp đã được ghi nhận là không có mẫu dị tật nảo
điến hinh. Một số nhỏ trường hợp bị thiếu hụt ống thần kinh, kể cả thoảt vị mảng tủy-tùy sống, đã
được ghi nhận nhưng nguyên nhân chưa được thiết lập. Cảc nghiên cứu ở động vật đã chi ra độc
tính trên khả năng sinh sản kể cả những tác động quái thai rõ rảng.
Phu nữ cho con bú
sv
Cảo nghiến cứu ở chuột cống đã chỉ ra rằng efavirenz vả tcnofovir được bải tiết vảo sữa; nồng độ
efavircnz trong sữa cao hơn nhiều so với trong huyết tương mẹ.
Vì thế, những người mẹ đang được điếu trị với thuốc kết hợp liều cố định
(tenofovirllamỉvudinlefavirenz) được khuyến cáo khớng cho con bú. Theo nguyên tắc chung,
những phụ nữ bị nhiễm HIV được khuyến cáo không cho con bú trong bất kỳ hoản cảnh nảo để
tránh iây truyền HIV cho con.
TÁC ĐỌNG TRÊN KHẢ NĂNG LÁI XE VÀ VẶN HÀNH MÁY MÓC
Không có các nghiến cứu về tác động cùa thuốc lên khả năng lải xe và việc dùng mảy móc dược
thực hỉện. Tuy nhiên, bệnh nhân nến được thông báo rằng chớng mặt đã được ghi nhận trong thời
gian dìều trị với tenofovir disoproxil fumarat. Efavircnz có thể gây chớng mặt, giảm tập trung,
vả/hoặc buổn ngú. Bệnh nhân nên được biết rằng nếu họ có các triệu chứng nảy thì họ nến trảnh
những công việc có khả năng nguy hiểm như lái xe và vận hảnh mảy móc.
PHẢN ỨNG KHÔNG MONG MUÔN
Dữ liệu về các tác dụng phụ cùa thuốc kết họp liếu cố định (tcnofovir/lamivuđinlefavircnz) hỉện
còn hạn chế. Vì thuốc kết hợp liếu cố định (tcnofovirflamivuđinlefavirenz) có chứa tcnofovir,
lamivudin, vả cfavirenz nên cảc tác dựng phụ cùa từng thảnh phần thuốc nảy đều có thể xảy ra khi
sử dụng viên thuốc kết hợp.
Trong nghiên cứu lâm sảng và sau khi thuốc được sử dụng rộng rãi trên thị trường, các tảc dụng
phụ do tùng thảnh phần cùa thuốc kết họp iiều cố định (tenofovir/iamivudin/efavirenz) trong phác
đồ điều trị phối hợp khảng retrovirus được liệt kê trong bảng bên dưới theo hệ cơ quan vả tần số
xuất hiện tuyệt đối.
Tẩn số được xác định lả rất thường gặp hay rẫt hiếm gặp t< 1/10,000) kể cả các báo
cảo độc nhất,hoặc không được biết (dược xảo định thông qua việc khảo sải sự an toản sau khth
hảnh và tân sô không thế được ước lượng từ cảc dữ liệu sẵn cớ) i
Các tác dụng phụ kết hợp từ từng thảnh phần trong viên kết hợp liều cố định
(tenofovir/lamivudin/efavirenz) dựa trên thử nghiệm lâm sâng và thông tin hậu mãi:
Tenofovir disoproxil
Lamivudin Efavirenz
fu ma rat
Các rổi Ioạn vê máu vả hệ bạch huyết
Giảm bạch cầu trung
Không thường gặp: tinh và thiêu mảu, giảm
lượng tiếu câu.
Rắt hiếm gặp: Bất sản hổng cầu
Các rõ:“ !oạn hệ miên dịch
Không thường gặp: Ouá mẫn
Rối ioạn chuyển hóa vả dinh dưỡng
Rất thưòng gặp Giảm phosphat huyết
Hiếm gặp Nhiễm acid lactỉc
Các rôi Ioạn râm thân
Thường gặp: Lo âu, trầm cảm
Không thường gặp:
Dễ xúc động, gây gồ, tâm
trạng khoan khoái, ảo
giác, tính gân, bệnh
hoang tướng, cố gắng tự
tử, cóy' định tự tử
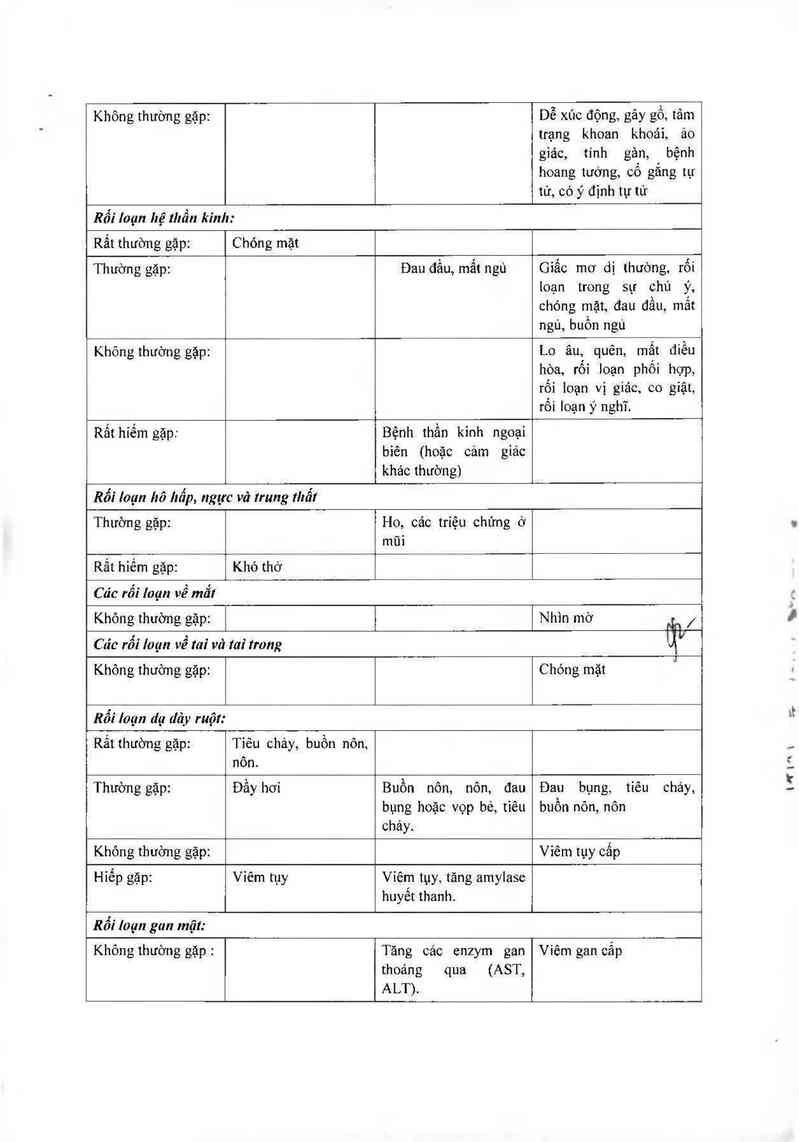
Rối loạn hệ thẫn kỉnlt:
Rất thường gặp: Chỏng mặt
Thường gặp: Đau đầu, mấtngủ Giấc mơ dị thường, rối
ioạn trong sự chú ý,
chóng mặt, đau đâu, mât
ngù, buôn ngủ
Khỏngthường gặp: Lo âu, quên, mặt điếu
hòa, rôi loạn phôi hợp,
rối loạn vị giác, co giật,
rối loạn ý nghĩ.
Rắthiếm gặp: Bệnh thần kinh ngoại
bỉên (hoặc cảm giác
khác thường)
Rối Ioạn hô Itẩp, ngực vả !rung tltẫi
Thường gặp:
Ho, cảc triệu chứng ở
mũi
Rất hiếm gặp:
Khó thở
Các rõi loạn về ma“!
Không thường gặp:
Nhin ITIỜ Ẩn /
Cảc rôi !oạn về tai vả
tai trong
iịv
Không thường gặp:
Chóng mặt
Rỗi loạn dạ dảy ruột:
Rất thường gập: Tiếu chảy, buồn nôn,
nôn.
Thường gặp: Đầy hơi Buồn nôn, nôn, đau Đau bụng, tiêu chảy,
bụng hoặc vọp bẻ, tiêu buôn nỏn, nôn
chảy.
Không thường gặp: Viêm tụy cẳp
Hiếp gặp: Viêm tựy Viếm tụy, tăng amylase
huyết thanh.
Rỗi Ioạn gun mật:
Không thường gặp :
Tăng cảc enzym gan
thoảng qua
ALT).
(AST,
Viếm gan cấp
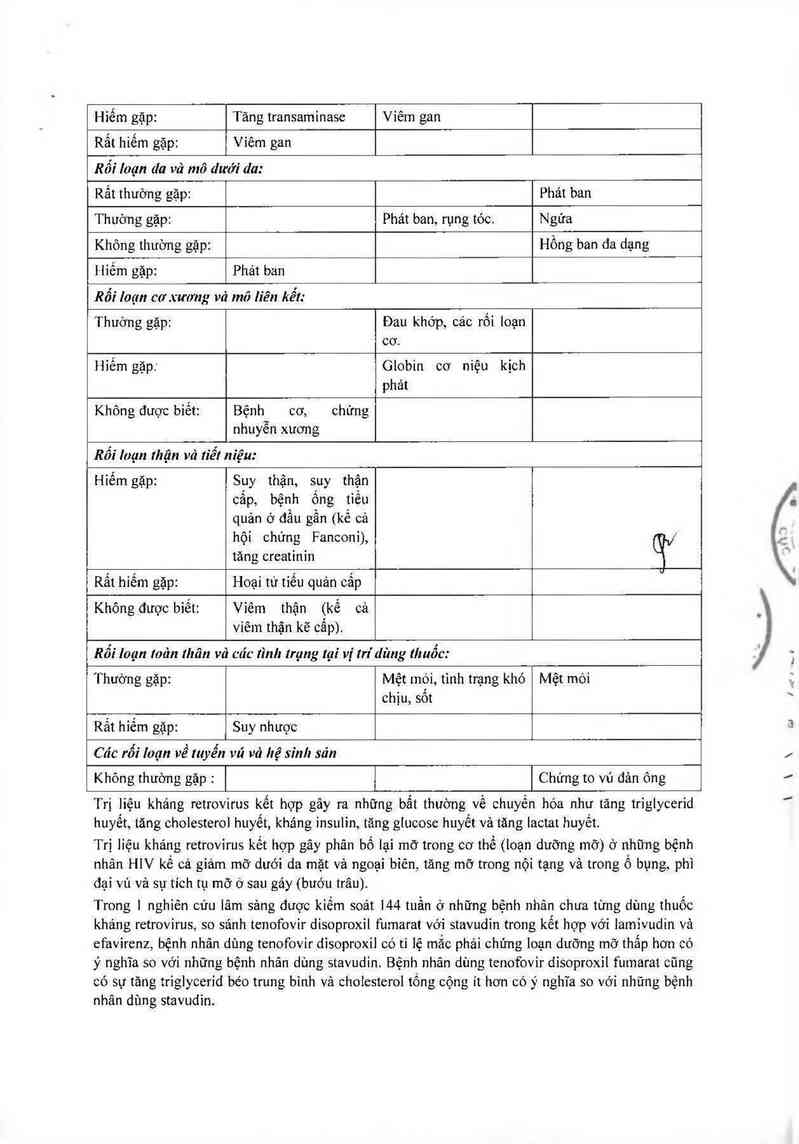
`…t
it
l'fl"\
Hiếm gặp: Tăng transaminasc Viêm gan
Rất hiếm gặp: Viếm gan
Rối Ioạn da vả mõ dưới da:
Rất thường gặp: Phát ban
Thường gặp: Phảt ban, rụng tớc. Ngứa
Không thường gặp: Hồng ban đa dạng
i-iỉếm gặp: Phát ban
Rối !oạn cơxương vả mô liên kết:
Thường gặp: Đau khớp, các rối loạn
cơ.
Hiếm gặp: Globin cơ niệu kịch
phảt
Không được biết: Bệnh cơ, chứng
nhuyễn xương
Rôí !oạn thận vả tiêl niệu:
Hiếm gặp: Suy thận, suy thận
cấp, bệnh ống tiếu
quản ở đầu gần (kể cả
hội chứng Fanconi), qc/
tăng creatinin
Rất hiếm gặp: Hoại tư tiếu quản cấp
Không được biết: Viếm thận (kể cả _
viêm thận kẽ cẩp).
Rôi loạn Irlản lhân vả căc tình trạng tại vị m'dùng thuõc:
Thường gặp: Mệt mới, tình trạng khó Mệt mòi .(
chịu, sôt `
Rắt hiếm gặp: Suy nhược ²
Các rổí Ioạn về luyến vú vả hệ sinh sản /
Khỏng thường gặp : Chứng to vú đản ông ’
Trị liệu kháng retrovirus kết hợp gây ra những bất thường về chuyến hóa như tăng triglycerid
huyết, tăng cholesterol huyết, kháng insulin, tãng glucose huyết và tăng lactat huyết.
Trị liệu khảng retrovirus kết hợp gây phân bộ lại mở trong cơ thể (loạn dưỡng mỡ) ở nhũng bệnh
nhân HIV kể cả giảm mỡ dưới da mặt và ngoại biên, tăng mỡ trong nội tạng vả trong ổ bụng, phì
đại vú và sự tich tụ mỡ ờ sau gáy (bướu trâu).
Trong ] nghiên cứu lãm sảng được kiềm soát 144 tuần ở những bệnh nhân chưa từng dùng thuốc
khảng retrovirus, so sánh tcnofovir disoproxil fumarat với stavudin trong kết hợp với lamivudin vả
cfavircnz, bệnh nhãn dùng tenofovir dìsoproxil có tỉ lệ mắc phải chứng loạn dưỡng mỡ thắp hơn có
ý nghĩa so với những bệnh nhân dùng stavudin. Bệnh nhân dùng tcnofovir đỉsoproxil fumarat cũng
có sự tăng triglycerid béo trung binh và choiesterol tống cộng ít hơn có ý nghĩa so vởi những bệnh
nhân dùng stavudin.
Ở nhũng bệnh nhân nhiễm HIV bị suy giảm miễn dịch nặng vảo thời đỉếm khời đầu trị liệu kháng
tcttợvitưs kết hợp (CART), một phản ứng viêm đối với những mầm bệnh không có triệu chứng bị
bệnh hay những mẩm bệnh cơ hội còn lại có thế nảy sinh.
Các trường hợp nhiễm acid iactic, đôi khi gây chết, thường đi kèm với chứng gan to nặng và chứng
nhiễm mở ở gan, đã được ghi nhận khi dùng các đồng đẳng nucleosid.
Các trường hợp hoại từ xương đã được ghi nhận, đặc bỉệt o nhũng bệnh nhân có cảc yếu tố nguy cớ
đă được thừa nhận, đã bị HIV trước đó hoặc dùng kháng retrovirus kết hợp thời gian dải. Tần số
xuất hiện chưa được biết.
Hội chứng phục hồi miễn dịch: Ở những bệnh nhân nhỉễm HIV bị suy giảm mỉễn dịch nặng vảo
thời điếm khởi đẩu trị liệu kháng retrovirus kết hợp (CART), một phản ứng viêm đối với những
mầm bệnh không có triệu chứng hay những mầm bệnh cơ hội còn lại có thề nảy sinh.
Các bẩt thường trong thử nghiêm cân lâm sảng
Các enzvm ean: Aspartat aminotransferasc (AST) vả alanin aminotransferase (ALT) tăng iớn hờn
5 lần so với giới hạn trên cùa mức bình thường (ULN) được thấy ờ 3% trong số 1008 bệnh nhân
được điều trị với 600 mg efavirenz (5-8% sau khi điều trị lâu dải trong nghỉên cứu 006). Sự tăng
tương tự được thấy ở những bệnh nhân được đỉểu trị với chế độ kiếm soát (5% sau khi điều trị iâu
dải). Sự tăng gam…a-glutamyltransfcrase (GGT) iớn hơn 5 lần so vởi giới hạn trên cùa mức bình
thường được quan sát thấy ở 4% trong số tất cả cảc bệnh nhân được điếu trị với 600 mg cfavirenz
vả 1,5-2% số bệnh nhân được điểu trị với chế độ kiếm soát (7% số bệnh nhân được điếu trị với
cfavircnz vả 3% số bệnh nhân được điếu trị với chế độ kiếm soát sau khi đỉểu ttị lâu dải). Sự tăng
độc nhẩt GGT ở những bệnh nhân dùng efavircnz có thể phản ảnh sự cảm ứng men. Trong nghiên
cứu lâu dải (006), 1% số bệnh nhân trong mỗi nhánh điếu trị đã ngưng thuốc do cảc rối ioạn hệ gan
hoặc mạt gV
Trong tập hợp các dữ liệu lâu dải từ nghiến cứu 006, 137 bệnh nhân đã điều trị với chế độ có hứa
efavirenz (thời gian điếu trị trung bình 68 tuần) và 84 bệnh nhân điều trị với chế độ kiếm soát (thời
gian trung binh 56 tuần) thì có huyết thanh dương tính với viêm gan B (dướng tính khảng nguyên
bề mặt) vả/hoặc C (dương tính kháng thể viêm gan C). Trong số những bệnh nhân bị nhiễm cả hai,
sự tãng AST lớn hơn 5 lần so với giới hạn trên của mức binh thường được thẳy ở 13% số bệnh
nhân đùng cfavỉrcnz và 7% số bệnh nhân kiếm soát, vả sự tãng ALT iớn hơn 5 lần so với giới hạn
trên cùa mức bình thuờng được thấy ở 20% số bệnh nhân dùng efavỉrcnz và 7% số bệnh nhân kiềm
soát. Trong số những bệnh nhân bị nhiễm cả hai, 3% bệnh nhân đã điếu trị với chế độ có chứa
efavircnz và 2% bệnh nhân điếu trị với một chế độ kiếm soát đã ngưng thuốc do cảc rối ioạn hệ gan
hoặc mật. Lý do cho việc ngưng thuốc của những bệnh nhân bị nhiễm cả hai dùng efavỉrenz kể cả
các bắt thường cnzym gan; không có sự ngưng thuốc do viêm gan ứ mật, suy gan hoặc gan nhiễm
mở được ghi nhận trong nghiên cứu nảy.
Amvlase: Trong thử nghiệm iâm sảng 1008 bệnh nhân, sự tăng không triệu chứng nồng độ amylase
trong huyết thảnh lớn hon 1, 5 lần so với giới hạn trên của mức bình thường được gặp ở 10% sô
bệnh nhãn được điều trị với efavirenz và 6% số bệnh nhân được điều trị với chế độ kiếm soát. Ý
nghĩa lâm sảng cùa sự tâng không triệu chứng của amylase trong huyết thanh chưa được biết.
Lỉnids: Tăng cholesterol toản phần 10 - 20% dã được quan sát ở một số nguời tình nguyện không
bị nhiễm dùng efavirenz. Trong các thử nghiệm lâm sảng cảc chế độ có chứa efavirenz khác nhau ở
các bệnh nhân chưa điếu trị trước đó, cholesterol toản phần, HDL-cholesterol, vả triglycerid tăng
sau 48 tuần điếu trị (21 - 31%, 23 — 34%, vả 23 - 49%, tương ứng). Phần bệnh nhân có tỉ 1ẹ
cholesterol toản phần lHDL-cholesteroi lớn hon 5 thì không thay đối. Cường độ của sự thay đối
nống độ lipid có thế bị ảnh hưởng bới cảc yếu tố như thời gian đỉều trị vả cảc thảnh phần khảo của
thuốc khảng retrovirus.
ln_
ẹ
\fA\
\
Tương tác với xét nghiêm cần sa ịCannabinoid): Efavirenz không gắn kết với các reccptor
cannabinoid. Thử nghiệm cannabinoid nước tiếu dương tính giả đã được ghi nhận ở nhũng ngưòi
tinh nghuyện không bị nhiễm mà dùng efavirenz. Kết quả thử nghiệm dương tinh gỉả chi được quan
sát với thử nghiệm THC đa nồng độ CEDIA DAU, mã được dùng cho việc sảng lọc, và không được
quan sát với các thử nghiệm cannabinoid khác kể cả thử nghiệm được dùng cho việc chứng thực
kết quả dưong tỉnh.
Kinh nghỉệm sau lưu hânh với efavircnz cho thấy cảc phản ửng phụ sau xảy ra kèm với chế độ
điếu trị khảng retrovirus chứa efavirenz: ảo gỉảc, chứng vú to đản ông, suy gan, loạn thần kinh chức
năng, viêm da quang dị ứng, rối loạn tâm thần và tự tử.
QUÁ LIÊU
Đã ghi nhận một số bệnh nhân chẳng may uống cfavirenz 600 mg, 2 lẩn mỗi ngảy đã tăng cảc triệu
chứng hệ thần kinh. Một bệnh nhân bị co cơ không tùy ỷ.
Nếu quá liều xảy ra bệnh nhân phải được theo dõi cảc dẩn hiệu ngộ độc và được áp dụng các biện
phảp điếu trị hỗ trợ chuẩn khi cần thiểt.
Có thế cho bệnh nhân uống than hoạt tính để hỗ trợ ioạỉ bò efavirenz chưa được hấp thu. Không có
thuốc giải độc đặc hiệu khi dùng quá iiếu efavirenz. Do cfavircnz được gắn kết cao với protein, nên
thẩm tảch không thể loại bỏ được lượng thuốc đảng kế từ máu.
Tenofovir có thế đưọc loại bộ bằng sự thầm phân mảu; độ thanh thải thấm phân máu trung bình của
tenofovir lả l34ml/phủt. Sự thải trừ của tenofovir bởi sự thầm phân mảng bụng chưa được nghiên
cứu. Vi lamivudin có thế được thẳm tảch, sự thẩm phân máu liên tục có thể được dùng trong điều
trị quá iiếu, mặc dù diếu nảy chưa được nghiên cứu.
CÁC ĐẶC TÍNH DƯỢC LỰC HỌC ĂV
Cơ chế hoạt động:
Tenofovir disoproxil fumarate là muối fumaratc cùa tiền dược tenofovir disoproxil. Tcnofovir
disoproxil được hấp thu và chuyến hóa thảnh dạng hoạt tính tcnofovir, mã là một đồng đẳng
nucleoside monophosphate (nucleotide). Sau đó tenofovir được chuyển thảnh chất chuyến hóa có
hoạt tinh tenofovir dìphosphatc, bới các emzymc tế bảo thông qua hai phản ứng phosphoryl hóa
trong cả tế bảo không hoạt động tích cực và tế bảo T đã hoạt hóa. Tcnofovir diphosphatc có thời
gian bán thải là 10 giờ trong các tế bảo đã hoạt hóa vả 50 giờ trong các tế bảo bạch cầu đơn nhân
trong mảu ngoại vi không hoạt động tich cực.
Tenofovir diphosphat ức chế polymerase virút bới sự cạnh tranh gắn kết trực tiểp với chất nến tự
nhiên deoxyribonucicotid vâ, sau khi hợp nhẩt vảo DNA, bời sự kết thủc chuỗi DNA. Tcnofovir
diphosphat iả một chất ức chế yếu các poiymerase tế bảo u, B, và y, với hằng số ức chế động học
(K.) mả cao hơn gấp 200 lần so với DNA polymerase của tế bảo 01 người (5,2 ịtmol/l) và cao hon
gấp 3000 lần so với DNA polymerase cùa tế bảo 13 và y người (81,7 và 59,5 ựmoI/I, tương ứng) hon
Ki cùa enzym sao chép ngược HiV-l (0,02 ựmol/l). Ở nồng độ lến đến 300 ịtmolll, tcnofovỉr cho
thấy không ảnh hướng trên sự tổng hợp của DNA ty lạp thế hoặc sự sản xuất acid lactic trong thử
nghiệm in vỉlro.
Lamivudin lả một đổng đẳng nucleosid mã có hoạt tính chống lại virút gây suy giảm miễn dịch ở
người (H IV) và virút viêm gan B (HBV). Nó được chuyến hòa trong tế bâo thảnh một chất có hoạt
tinh, lamivudin 5'—triphosphat. Phương thức hoạt động chính của nó như lá chất kết thúc chuỗi sao
chép ngược của virút.
Efavirenz là một chất ức chế sao chép ngược non-nucleosid (NNRTI) cùa HIV-l. Efavirenz là một
chất ức chế không cạnh tranh enzym sao chép ngược cùa HlV-l và không ức chế có ý nghĩa enzym
sao chép ngược của HIV-2 hoặc DNA polymerase của tế bảo (ư, 13, Y hoặc ồ).
H oạt động kháng virút:
Tenofovir có hoạt tính khảng virút in vilro chống iại retrovirus vả hepadnavirus.
Nồng độ yêu cẩu cùa tenofovir đế ức chế 50% (ICso) chủng HIV-lmB cận lâm sảng ioại hoang dại
iả 1-ộ ịưnom trong cảc dòng tế bảo dạng bạch huyết và iả 1,1 ụmol/l đối với các chùng phân lập
HIV-l nhớm dưới B trong các tế bảo bạch cầu đơn nhân trong mảu ngoại vi. Tenofovir cũng có
hoạt tính chống lại HiV-l nhóm A, c, D, E, F, G, vả o và chống lại HIV… trong các tế bảo bạch
cầu đơn nhân to/ đại thực bảo nguyên phát. Tcnofovir chi ra có hoạt tính trên in vitro chống iại
HIV-2, với ICso lả 4,9 ụmol/l trong cảc tế bảo MT—4 vả chống lại virút viêm gan B với iCso là 1,1
ựmol/l trong cảc tế bảo HepGZ 2.2.15.
Hoạt tinh cùa tenofovir vẫn duy trì trong giới hạn gấp 2 lần [Cso loại hoang dại chống lại HlV-l tái
tổ hợp dề khảng didanosin (L74V), đế khảng zalcitabin (T69D), và đột biến (phức hợp 015 IM) đề
kháng thuốc đa nucleosid. Hoạt tính của tcnofovir chống lại cảc chùng HIV-l với các đột biến liên
hợp với zidovudin xuất hiện tùy thuộc vảo loại vả số iượng cảc đột bỉến đế khảng nảy. Với sự có
mặt cùa đột biến TZISY, đã quan sát thắy ICsn tãng gấp 2 lần Trong 10 mẫu có đa đột biến liên
hợp với zidovudin (trung bình 3 ,4), đã quan sát thắy ICso tăng trung bình gấp 3, 7 lấn (thay đối từ
0,8 đến 8,4).
Lamivudin được chuyến hớa trong tế bảo thảnh một chẳt có hoạt tính, lamivudin 5'-triphosphat.
Triphosphat có hoạt tính ức chế chọn lọc chống lại sự sao chép cùa HIV-l vả HIV-2 trên in vitro;
nó cũng có hoạt tính chống lại các chủng phân lập lâm sảng của HIV kháng zidovudin. Lamivudin
trong kết hợp với zidovudin có hoạt tính hiệp lực khảng HIV chổng lại cảc chủng phân lập lâm
sảng trong nuôi cắy tế bảo.
Nồng độ tự do của cfavirenz yêu cầu đế ức chế 90 - 95% loại hoang dại hoặc phân lập lâm sảng vả
cận lâm sảng khảng zidovudin trên in virro thay đối từ 0,46 — 6,8 nhi trong các dòng tế bảo u
nguyên bảo lympho, cảc tế bảo đơn nhân mảu ngoại vi (PBMCs) và sự nuôi cấy đại thực bảo/bạch
cầu đơn nhân to. _,
Kháng thuốc: iSi'
HIV-i đề kháng đa nucleosid với sự gắn đôi T69S đã lâm giảm tinh nhạy cảm đối với tcnofovir
(Ing lớn hơn 10 lần). Tcnofovir đã chi ra hoạt tính chống lại HiV-l kháng thuốc ức chế men sao
chép ngược non-nucleosid với các đột biến KlO3N hoặc YISIC. Sự khảng thuốc chéo với các đột
biến gây kháng thuốc với ức chế protease lá không thể ra xảy ra do các enzyme dich của virút khác
nhau.
Cảc chủng HIV-l có tính nhạy cảm giảm 34 lẳn đối với tenofovir và đột biến KộSR trong sao chép
ngược đã được ghi nhận trên in vizro. Đột biến KôSR trong sao chép ngược cũng có thế được ghi
nhận bời zalcitabin, didanosin, vả abacavir, và gây giảm tính nhạy cảm đối với zalcitabin,
didanosin, abacavir, vả lamivudin (14, 4, 3, vả 25 lần, tương ứng). Tenofovir disoproxil fumarat
nên trảnh dùng ở những bệnh nhân đã từng dùng kháng retrovirus với chùng đột biến KôSR.
Sự đế khảng HIV-I đối với Iamìvudin là do sự thay đối amino acid M184V gần vị trí hoạt động của
sự sao chép ngược cùa virút. Biến thế nảy xuất hiện cả trên in vítro và bệnh nhân nhiễm HIV-l
được điếu trị với thuốc kháng retrovirus có chứa lamivudin.
sư đột biến M184V lảm giảm tinh nhạy cảm với lamivudin vả lảm giảm công suất sao chép cùa
virút trên in vitro. Trong các nghiên cửu in vilro cho thắy các chủng phân lập virút khảng zidovudin
có thể trở nên nhạy cảm với zidovudin khi chủng đề kháng đồng thời với lamivudin. Tuy nhiên, sự
liên quan của những phát hiện nảy trên lâm sảng chưa được xác định rõ.
v).
.\1
\ `\\lel`ntul x.
Hoạt tỉnh của efavirenz trong nuôi cấy tế bảo chống lại cảc biến thế virút với sự thay thế amino acid
ở các vị trí 48, 108, 170, 181 hoặc 236 trong sao chép ngược hoặc cảc bỉến thế với sự thay thế
amino acid trong protease thì tương tự với các chùng virút dại. Sự thay thể đơn điểm mà dẫn đến sự
đề kháng cao nhất với efavirenz trong nuôi cắy tế bảo tương tự với sự thay đồi leucin thảnh
isoleucin ở vị trí 100 (L1001, đề kháng l7—22 lần) vả Iysin thảnh asparagin ở vị trí 103 (KlO3N, đề
kháng 18—33 lần). Giảm hơn 100 lần tính nhạy cảm chống lại cảc biến thế HIV mang KtosN đã
được quan sảt, thêm vảo đó còn có sự thay thế amino acid khác trong sao chép ngược.
KIO3N lả sự thay thế trong sao chép ngược thường gặp nhất trong phân lập virút từ các bệnh nhân
mà từng hồi phục có ý nghĩa trong việc tải virút trong các nghiên cứu của efavirenz trong kết họp
với indinavir hoặc zidovudin + lamivudin. Đột biến nảy quan Sát thấy Ở 90% bệnh nhân dùng
efavirenz có sự thắt bại về vìrút học. Sự thay thế ở cảc vị trí sao chép ngược 98, 100, 101, 108,
138, 188, 190 hoặc 225 cũng đã quan sát thẩy, nhưng tần số thấp hơn, vả thường kết hợp với
KlO3N. Mô hinh thay thế amino acid trong sao chép ngược kết hợp vởi sự đề kháng với efavirenz
lá không phụ thuộc vảo các thuốc khảng virút khảo được dùng trong kết hợp với cfavirenz.
Đề kháng chéo:
Sự đề kháng chéo mang lại bời sao chép ngược M184V bị hạn chế trong phạm vi các tác nhân
khảng retrovirus ức chế nưcleosidc. Zidovudin vả stavudin duy trì hoạt tính kháng retrovirus chống
iạỉ HiV-I đề kháng lamivudin. Abacavir duy trì hoạt tinh kháng retrovirus chống lại HiV-l chi
chứa đột biến M184V đế khảng lamivudinc. Đột biến sao chép ngược M184V lảm giảm ít hơn 4
lần sự nhạy cảm đối với didanosin vả zaicitabin; ý nghĩa lâm sảng của những phát hiện nảy chưa
được biết. Các thử nghiệm nhạy cảm in vitro không được chuẩn hóa và kết quả có thể thay đồi theo
các yếu tố phưong phảp học.
Đề kháng chéo đối với efavỉrenz, nevirapin vả delavirdin trong nuôi cấy tế bảo oho thấy thay thế
K103N lảm giảm tinh nhạy cảm đối với 3 NNRTI. 2 trong 3 chùng phân iập từ lâm sảng đề kháng
vởi delavirdin đã kiềm tra thi đề khảng chéo với efavirenz vả đã chứa sự thay thế K103N. Một phẳn
ba chúng phân lập mà mang sự thay thế ở vị trí 236 trên sao chép ngược thì khỏng đế khảng ohé
với cfavirenz.
Sự phân iập virút phục hồi từ oác tế bảo đơn nhân mảu ngoại vi cùa những bệnh nhân trong òác
nghiên cứu lâm sảng mà đã chi ra chứng cứ thắt bại điếu trị (sự phục hồi tải lượng virút) đã được
đánh giá tính nhạy cảm đối với các NNRTI. 13 phân lập đã mô tả trước đó lá để khảng với
efavirenz thì cũng đề kháng với ncvirapin vả delavirdin. 5 trong số 13 phân lập đế khảng với
NNRTI nảy nhận thấy có KIO3N hoặc có sự thay thế valin thảnh isoleucin ở vị trí 108 (V1081)
trong enzym sao chép ngược 3 trong số những phân lặp thất bại điếu trị với efavirenz vẫn duy trì
sự nhạy cảm với efavirenz trong nuôi oấy tế bảo và cũng nhạy cảm với nevirapin vả dclavirdin.
Khả năng đề kháng chéo giữa efavirenz vả oác Pi iả thẳp do cảc đich cua cnzyme khảo nhau. Khả
năng đề kháng chéo giữa efavirenz vả oác NRTI là thấp do các vị trí gắn kết trên đich vả cơ chế
hoạt động khác nhau.
Hiệu quả lâm sảng:
Hiệu quả của tenofovir disoproxil fumarat ờ nhũng ngưòi lớn bị nhiễm HlV-l đã từng và chưa từng
điều trị với tenofovir đã được chứng minh trong cảc thử nghiệm lâm sảng 48 tuần ở những ngưòi
lớn bị nhỉễm HiV-l đã từng điếu trị với tcnofovir.
Trong nghiên cứu GS-99-907, 550 bệnh nhân đã từng điếu trị được điếu trị với giả được hoặc
tenofovir disoproxil 245 mg (như lá fumarat) trong 24 tuần. Số lượng tế bâo CD4 trung bình lả 427
tế bảolmmẵ RNA HiV-l trong huyết tương trung binh là 3,4 loglo bản saofml (78% bệnh nhân có
sức tải virút iả nhỏ hơn 5000 bản sao/ml) và thời gian điếu trị HIV trước đó trung binh là 5,4 năm.
Phân tích cấu trúc di truyền HIV phân lập tư 253 bệnh nhân đã cho thẳy rằng 94% bệnh nhân có
cảo đột biến kháng HIV—i kèm với các thuốc ức chế sao chép ngược nucleosid, 58% bệnh nhân có
'.l
'^n/
\V.._\_z
các đột biến kem với các thuốc ức chế protease và 48% bệnh nhân có các đột biến kèm với các
thuốc ức chế sao chép ngược non-nucleosid.
Ở tuần 24, sự thay đối trung bình từ vạch ranh giới trong nồng độ RNA HlV-l huyết tượng iogịn
(DAVGZ4) lả -0,03 log… bản sao/m] và -0,61 logto bản sao/ml đối với những người nhặn giả dược
vả tenofovir disoproxil 245 mg (như lả fumarat) (p < 0,0001). Những bệnh nhân mà HIV có 3 hay
nhiến hơn cảc đột biến kết hợp đồng đẳng thymidin (TAMs) mả kế oả đột biến enzym sao chép
ngược hoặc M4lL hoặc L210W đã cho thấy giảm tinh nhạy oảm với trị liệu tenofovir disoproxil
245 mg (như lá fumarat). Sư đáp ửng virút học về cơ bản bị giảm ở những bệnh nhân có các chùng
virút khảng phenotip zidovudin hơn 10 lần. Đảp ứng chống virút cúa tenofovir disoproxil fumarat
thì bến thông qua 48 tuần (DAVG4S là -0,57 Iogtn bản sao/ml, tỉ lệ bệnh nhân có RNA HiV-l dưới
400 hoặc 50 bản saolml lả 41% và 18% tương ửng). 8 bệnh nhân (2%) điếu trị với tenofovir
disoproxil 245 mg (như lá fưmarat) đã biếu lộ đột biến K65R trong vòng 48 tuẫn đầu.
Nghiên cửu có kiếm soát hoạt tinh, mù đôi, 144 tuần GS-99-903 đã đảnh giá hiệu quả vả tinh an
toản cùa tenofovir disoproxil 245 mg (như lá fumarat) so với stavudin khi được dùng kết hợp với
lamivudin vả efavirenz ở những bệnh nhân nhiễm HIV-l chưa từng trị iiệu khảng retrovirus. Số
lượng tế bảo CD4 trung bình là 279 tế bảo/tnmĩ RNA HIV-l huyết tương trung binh là 4,01 1oglo
bản saợfmi, 19% số bệnh nhân nhiễm H1v-i có triệu ohứng vả 180/o số bệnh nhân bị AIDS. Các
bệnh nhân được xếp thânh tằng theo RNA HIV-l và số lượng CD4. 43% số bệnh nhân có tải lượng
virút lớn hơn 100000 bản sao/m] và 39% số bệnh nhân có số lượng tế bảo CD4 nhớ hon 200 tế
bảo/ml.
Thay đồi trung bình từ vạch ranh giới đối với RNA HiV-l vả số lượng CD4 trong 48 tuần điếu trị
thì tương tự oả ờ 2 nhóm điều trị (-3,00 và -3,09 1oglo bản sao/ml; +169 vả 167 tế bản/mm² ờ các
nhóm điếu trị bằng tenofovir disoproxil 245 mg (như lá fumarat) vả stavudin, tương ửng).
Ở 144 tuấn điếu trị, thay đồi trung binh từ vạch ranh giới vẫn duy trì tương tư cá ở 2 nhóm điếu trị
t-s,07 và -3,03 logzo bản sao/ml; +263 vả +283 tế bảohnm² ớ oác nhớm điếu trị bằng tenofovir
disoproxil 245 mg (như lá fumarat) vả stavudin, tương ứng). Một đảp ứng kiên định đối với đỉếu trị
bằng tenofovir disoproxil 245 mg (như là fumarat) đã được quan sát bất kế vạch ranh giới Ri)LA
HiV-l RNA vả sô lượng CD4.
Đột biến K65R đã xảy ở một ti lệ phẩn trăm số bệnh nhân nhóm tenofovir disoproin fumarab hơi
cao hơn nhớm kiếm soát hoạt tinh (2,7% so với 0,7%). Sự đề kháng với cfavirenz hoặc với
lamivudin hoặc lả đến trước hoặc là trùng khớp với sự phát triển cùa KGSR trong tất cả cảc trường
hợp. 8 bệnh nhân bị HIV mả thế hiện K65R trong nhảnh tenofovir disoproxil 245 mg (như lá
fumarate), 7 trong số 8 bệnh nhân nảy đã xảy ra trong suốt 48 tuần đẩu điếu trị và một bệnh nhân
cuối cùng xảy ra ở tuần 96. Không quan sát thấy có sự phát triến thêm nữa oùa KôSR đến tuấn thứ
144. Từ cả phép phân tich genotìp vả phenotip cho thấy không có chứng cứ cho cảc con đường
khảo oủa sự đề kháng tenofovir.
Trong các thử nghiệm lâm sảng, iamivudin trong kết hợp với zidovudin đã lảm giảm tải lượng virút
111v-1 và tăng số lượng tế bảo CD4. Các dữ liệu lâm sảng cho thấy lamivudin trong kết họp với
zidovudin, lảm giảm có ý nghĩa nguy cơ phảt triến bệnh và tử vong.
Chứng cứ từ cảc nghiên oứu lâm sảng cho thấy lamivudin cộng với zidovudin lảm chậm sự đề
kháng với zidovudin phân lập ở các cá nhân không trị liệu kháng retrovirus trước đó.
Lamivudin dược dùng rộng rãi như một thảnh phần trong trị liệu kểt hợp kháng retrovirus với các
tảo nhân kháng retrovirus khác cùng nhớm (các NRTI) hoặc khảo nhóm (các Pl, cảc chất ức chế sao
chép ngược không nucleosid).
Trị [ỉệu khảng retrovirus đa thuốc chứa lamivudin đã cho thấy có hỉệu quả ở những bệnh nhân chưa
từng dùng khảng retrovirus trước đó cũng như những bệnh nhân hiện tại mang virút chửa đột bỉến
M 184V.
Mối quan hệ gỉữa sự nhạy cảm oùa HIV đối với lamivudin trên in viIro và sự đáp ứng lâm sảng đối
với trị liệu chứa iamivudin vẫn còn đang nghỉên cứu.
Lamivudin ở iiều 100 mg một lần mỗi ngảy cũng chỉ ra có hiệu quả trong điều trị người lớn nhiễm
viêm gan siêu vi B (HBV) mãn tinh (chi tiết cùa các nghiên cứu lâm sảng, vui lòng xem thông tin
kê toa cùa Zeftìx). Tuy nhiên, đế điều trị nhiễm HIV, chỉ cần liều lamivudin 300 mg mỗi ngảy
(trong kết hợp với cảc tác nhân khảng retrovirus khảo) cũng chỉ ra có hiệu quả.
Lamivudin không được nghiên cứu một cảoh cụ thể ở bệnh nhân nhiễm đồng thời HIV vả HBV.
Một nghiên cứu lâm sảng đã chứng minh sự không thua kém giữa các chế độ Iamivudin một lẩn
mỗi ngảy (300 mg, một lần mỗi ngảy) vả lamivudin hai lần mỗi ngảy (300 mg, 2 lần mỗi ngăy).
Những kết quả nảy đạt được trong nhóm bệnh nhân chưa từng đìều trị bao giờ với thuốc kháng
retrovirus, chủ yếu gồm các bệnh nhân nhỉễm HIV không triệu chứng.
Efavircnz không được nghiên cứu trong các nghiên cứu có kiểm soát ở những bệnh nhân bị HIV
trước đó, cụ thể là ở các bệnh nhân có số lượng CD4 < 50 tế bảolmmẵ hoặc ở những bệnh nhân đã
từng đỉều trị với Pi hoặc NNRTI . Kinh nghiệm lâm sảng trong cảc nghiên cứu có kỉểm soát với các
thuốc kểt hợp kể cả didanosin hoặc zalcitabin còn hạn chế.
2 nghiến oứu có kiếm soát (006 và ACTG 364) kéo dải khoảng 1 năm với efavirenz trong kết hợp
vởi các NRTI vả] hoặc các Pl, đã cho thắy giảm tải lượng virút dưới ngưỡng phát hiện và tăng
lượng tế bảo lympho CD4 ờ những bệnh nhân nhiễm HIV đã từng điểu trị với NRTI và những bệnh
nhân chưa từng điều trị với liệu pháp kháng retrovirus. Nghiên cứu 020 trên 24 tuần đã chi ra hoạt
tinh tương tự ở những bệnh nhân đã từng điếu trị với NRTI. Ở những nghiên cứu nảy liếu cùa
efavirenz lả 600 mg một lần mỗi ngảy; iiếu của ỉndinavir là 1000 mg mỗi 8 giờ khi được dùng cùng
với efavircnz và 800 mg mỗi 8 giờ khi được dùng không có efavirenz. Liều cùa neltinavir là 750
mg, 3 lần mỗi ngảy. Liều chuẩn của các NRTI mỗi 12 giờ được dùng trong mỗi nghiên cứu nảy.
CÁC ĐẶC TÍNH DƯỢC ĐỌNG nọc
Viên kết hợp liếu cố định (tenofovir/lamivudin/efavirenz) có liệu pháp điếu trị tương đương với
dạng thuốc riêng lẻ.
Hấp thu
Sau khi dùng đường uống tenofovir disoproxil fumarat ở những bệnh nhân nhiễm HIV, tenofovir
disoproxil fumarat được hấp thu nhanh và được ohuyến hóa thânh tenofovir. Tenofovir được
chuyển hóa trong tế bảo thảnh tenofovir monophosphat vả thảnh phần có hoạt tính tenofovir
diphosphat.
Dùng cảc liều đa cùa tcnofovỉr disoproxil fumarat cùng với bữa ăn ở những bệnh nhân nhỉễm HIV
dẫn đển các giá trị trung bình cùa Cnm (%CV), AUCọ.co (%CV), vả Cmin (%CV) cùa tenofovir là 326
(36,6%) ng/ml, 3324 (41,2%) ng-hr/ml và 64,4 (39,4%) ng/ml, tương ứng. Nổng độ tối đa của
tenofovir trong huyết thanh được quan sảt trong vòng 1 giờ khi dùng trong tình trạng dới và 2 giờ
khi dùng với thức ăn. Sinh khả dụng đường uống oùa tenofovir từ tenofovir disoproxil f'umarat ở
những bệnh nhân nhịn đới khoảng 25%. Dùng tenofovir dìsoproxil fumarat với bữa ăn có lượng
chất béo cao lảm tăng sinh khả dụng đường uống, với sự tăng AUC khoảng 40% và Cmax khoảng
14%. Sau iiều đầu tiến cùa tenofovir disoproxil fumarat ở những bệnh nhân đã ăn, Cmax trung bình
trong huyết thanh thay đồi từ 213 - 375 ng/ml. Tuy nhiên, dùng tenofovir disoproxil fumarat với
bữa ăn nhẹ không có sự ảnh hướng có ý nghĩa trên dược động học của tenofovir.
Lamivudin được hắp thu tốt qua đường tiêu hóa, và sỉnh khả dụng đường uống ở người lởn bình
thường từ 80-85%. Sau khi uống, thời gian trung binh (tmax) để đạt nồng độ tối đa trong huyết thanh
(Cmax) là khoảng 1 giờ. Dựa trên các dữ liệu từ một nghiên cửu ở những ngưòi tinh nguyện khòc
mạnh, ở lỉều điếu trị 150mg 2 lần mỗi ngây, cmax (%CV) vả cmm (%CV) ở trạng thái ốn định trung
\" 41- st\
Í." 70 %) qua hệ vận chuyến cation hữu cơ.
Lamivudin có dược động học tuyến tinh đối với khoảng liều trị liệu và oó sự gắn kết hạn chế với
protein albumin huyết tương (< 16 % - 36 % đối với albumin huyết thanh trong các nghiên cứu in
vitro).
Các dữ liệu còn hạn chế cho thấy Iamivudin thâm nhập vảo hệ thần kinh trung ương và đến dịch
năo tùy (CSF). Tỉ lệ trung bình cùa nồng độ lamivudin trong dịch năo tủy vả trong huyết thanh sau
khi uống 2-4 giờ là khoảng 0,12. Mức độ thâm nhập thật sự và mối quan hệ với hiệu quả lâm sảng
chưa được biết.
//'
l
Efavirenz gắn kết cao với protein huyết tương người (khoảng 99,5 — 99,75%), chủ yếu là albumin.
ờ bệnh nhân nhiễm HlV-l (n = 9) dùng 200 - 600 mg một lần mỗi ngảy trong it nhất một thảng,
Nống độ trong dịch não tùy thay đổi từ 0,26 — 1,19% (trung binh 0,69%) nồng độ trong huyết tương
tương ứng. Phẩn nảy cao hơn khoảng 3 iần so với phần efavirenz trong huyết tương không gắn kết
với protein.
Sự biến đổi sinh học
Trong các nghiên cứu in vilro đã xảo định rằng cả tenofovir disoproxil filmđrat lẫn tenofovir đến
không phải là chất nền của hệ enzym CYP4SO. Hơn nữa, ở các nồng độ cao hơn (khoảng 300 lần),
tenofovir đã không ức ohế sự chuyển hóa thuốc trên in vilro gỉán tiếp qua bất kỳ đồng dạng nảo cùa
CYP4SO người trong sự biến đổi sinh học thuốc (CYP3A4, CYP2D6, CYP2C9, CYP2EI, hoặc
CYPIAl/2). Tenofovir disoproxil fumarat ở nồng độ 100 ựmol/l đã không ảnh hưởng trên bất kỳ
đồng dạng nảo của CYP4SO, ngoại trừ CYPIAl/2, một lượng nhỏ (6%) nhưng sự giảm oó ý nghĩa
thống kê trong chuyến hóa chất nền CYPIAl/2 đã được ghi nhận. Dựa trên những dữ liệu nảy,
không chắc rằng sự tương tảo có ý nghĩa iâm sảng liên quan đến tcnofovir disoproxil fumarat và
các sản phẩm thuốc được chuyến hóa bời CYP4SO sẽ xảy ra.
Thời gian bản hủy cùa lamivudin triphosphat trong tế bảo kéo dải (16 - 19 giờ) so với thời gian bán
hủy của lamivudin trong huyết tương (5 - 7 giờ). Trong 60 người lớn tinh nguyện khớe mạnh,
lamivudin 300 mg một lần mỗi ngảy được chứng minh là có dược động học tương đương với
lamivudin 150 mg hai lần mỗi ngảy ờ trạng thái ốn định đối với AUCụ vả Cmax oủa triphosphat
trong tế bâo.
Lamivudỉn được thải trừ chủ yếu dạng không thay đối bời sự bải tiết qua thận. Khả năng xảy ra sự
tương tác chuyền hóa cùa lamivudin với các thuốc khảo là thấp do mức độ chuyến hóa qua gan nhỏ
(5-10%) và sự gắn kết protein huyết tương thấp. (ầ/
Cảo nghiên oứu ở người vả cảc nghiên cứu in vitro dùng microsome gan người đã cho t ấy
efavỉrenz chủ yếu được chuyến hóa bời hệ thống oytochrom P450 thảnh ohất chuyển hóa hydroxyl
với sự glucuronid hóa tiếp theo những ohất chuyền hóa hydroxyl nảy. Cảo chất chuyến hóa nảy cơ
bản không có hoạt tinh chống lại HiV-l. Trong các nghiên cứu in vitro cho thấy CYP3A4 vả
CYPZB6 lả những isozym chính chịu tránh nhiệm chuyến hóa efavirenz và nó ức chế các isozym
P450 2C9, 2C19, vả 3A4. Trong các nghiến cứu in vitro, efavirenz đã không ức chế CYP2EI vả ohi
ức chế CYP2D6 vả CYPIA2 khi mà nồng độ của chủng vượt quá nồng độ oó tác dụng lâm sảng.
Efavirenz đã cho thấy cảm ứng enzym P450, dẫn đến sự cảm ứng của các chất chuyền hóa. Ở
những người tinh nguyện không bị nhiễm HIV, cảc liếu 200-400 mg chia nhiếu lần mỗi ngảy trong
10 ngảy dẫn đến giảm mức độ tích tụ dự đoán (thấp hơn 22—42%) và thời gian bán hủy cuối cùng
ngắn hơn 40-55 giờ (thời gỉan bán hủy cùa liều duy nhắt 13 52-76 giờ).
ThảỈ trừ
Tcnofovir được bâỉ tiểt chủ yểu qua thận bằng cả con đường lọc ở cầu thận và qua hệ thống vận
chuyến chủ động ở ống thận, khoảng 70—80% liếu dùng đường tĩnh mạch đuợc bải tiết qua nước
tiếu dưới dạng không đổi. Độ thanh thải tổng cộng ước tính 1â khoảng 230 ml/h/kg (khoáng 300
m1/phút). Độ thanh thải cùa thận ước tinh là khoảng 160 mI/h/kg (khoảng 210 ml/phút), tốc độ
thanh thải tenofovir cao hơn nhiếu so với tốc độ lọc ớ cẩu thận. Điều nảy chi ra rằng bải tiết chủ
động qua ống thận đóng vai trò quan trọng trong việc thải trừ tenofovir. Thời gian bán hùy cuối
cùng cùa tenofovir sau khi uống khoảng 12 - 18 giờ.
Sự tương tác với trimethoprim, một thảnh phần của co-trimoxazol, lảm tăng 40% sự phơi nhiễm
của lamivudin ở cảc liếu trị liệu. Điều nảy không yêu cầu chỉnh liều trừ khi bệnh nhân cũng có suy
thận. Việc dùng co-trimoxazole với lamivudin ở những bệnh nhân suy thận nên được đánh giá cẩn
thận.
\s.
141Q1
ổ
2
ÍJ_+Ízfi
Efavirenz có thời gian bán hủy cuối cùng tương đối dải 52 - 76 giờ sau khi dùng 1ièư duy nhất và
40-55 giờ sau khi dùng đa liều. Khoảng 14-34% liếu được đảnh dấu phóng xạ cùa efavirenz được
tìm thấy trong nước tiếu vả it hơn 1% liếu được bải tỉết vảo nước tiếu ở dạng efavircnz không thay
đếi.
Trong nghiên oứu riêng biệt bệnh nhân bị suy gan nặng (Child Pugh Grade C), thời gian bản hùy
cùa efavỉrenz nhỉều gấp đôi chỉ ra mức độ tich tụ lón hơn nhỉếu.
Giới, chúng tộc, tuổi
Các dữ liệu còn hạn chế về dược động học cũa tenofovir ở phụ nữ cho thấy không oó sự ánh hướng
nhiểu của giới tính. Các nghiên cứu dược động học không được thực hiện ở trẻ em (dưới 18 tuồi)
hoặc người iớn tuối (trên 65 tuối).
Dược động học của tenofovir khỏng được nghiên cứu một cảoh cụ thể ở oác nhóm dân tộc khác
nhau.
Dược động học cùa efavirenz lả tương tự nhau giữa nam và nữ và giữa các nhớm chủng tộc đã
nghiên cứu. Mặc dù cảc dữ iiệu hạn chế nhưng vẫn gợi ý cho thấy rằng các bệnh nhân châu Á vả
đảo Thái Binh Dương có thế có độ phoi nhiễm efavirenz cao hom, nhưng sự dung nạp của efavirenz
không ít hơn. Các nghiến oứu về dược động học không được nghiên cứu ở người giả.
Suy thận
Cảo thông số được động học cúa tonofovir được xảo định sau khi dùng liều duy nhất tenofovir
đisoproxil 245 mg cho 40 bệnh nhân không nhiễm HỈV có cảc mức độ suy thặn khác nhau được
xảo định theo độ thanh thải creatinin (CrC1) (chức nãng thận bình thường khi CrCi> 80 m1/phút;
suy thận nhẹ khi CrC1 = 50-79 mlỉphút; suy thận trung bình khi CrC1 = 30-49 mllphút và suy thận
nặng khi CrC1 = 10-29 m1/phút). Khi so với những bệnh nhân có chức năng thận bình thường, độ
phơi nhiễm trung bình oùa tonofovir (%CV) tãng từ 2185 (12%) nghlmi ở những bệnh nhân có
CrCl> 80 mllphút đến 3064 (30%) ng-h/ml, 6009 (42%) ng-h/ml vả 15985 (45%) ng—h/mi tương
ứng ở những bệnh nhân suy thận nhẹ, trung bình và nặng. Sự khuyến cảo liều ở những bệnh nhân
suy thận với khoảng cách liều tăng có thể dẫn đến nồng độ đinh trong huyết tương oao hơn và nổng
độ Cmin thẩp hon ở những bệnh nhân suy thận so với bệnh nhân có chửc nãng thận bình thườn .ẵỊ
liẻn quan của vấn đề nảy trên iâm sảng chưa được biết. ỂỀL
Ở những bệnh nhân bệnh thận giai đoạn cuối (ESRD) (CrC1 < 10 mlfphút) đang yêu cầu thẩm p ãn
máu, về oăn bản nồng độ tenofovir thầm tảch tăng trên 48 giờ đạt được C.,mịx trung bình lả 1032
ng/mi vả AUCo-4gh trung bình 1ả 42857 ngh/m].
Khoảng cách lỉếu cùa tcnofovir disoproxil 245 mg (như lá furnarat) được khuyến cảo giảm nhẹ ở
những bệnh nhân có độ thanh thải creatinin < 50 mllphủt hoặc ở những bệnh nhân có bệnh thận giai
đoạn cuối và yêu cầu thấm tách.
Dược động học của tenofovir ở những bệnh nhân không thẳm phân máu có độ thanh thải oroatinin
< 10 ml/phút vả ở những bệnh nhãn có bệnh thặn giai đoạn cuối được kỉếm soát bằng thẳm phân
mảng bụng hoặc các hình thức khác của thấm phân không được nghiên cứu.
Suy gan
Liều duy nhất 245 mg tenofovir dis0proxii được dùng cho những bệnh nhân không nhiễm HIV có
các mức độ suy gan khác nhau được xác định theo sự phân loại Chiid-Pugh-Turcotte (CPT). Dược
động học cùa tenofovir về cơ bản không bị thay đổi ở những bệnh nhân suy gan gợi ý cho thấy rằng
không cần điều ohinh liều ở những bệnh nhân nây. Giá trị cm,, ttưng bình (%CV) vả AUC… trung
binh (%CV) iả 223 (34,8%) nglml và 2,050 (50,8%) ng-h/ml, tượng ứng, ở những bệnh nhân hình
thường so với 289 (46%) ng/ml và 2,310 (43,5%) ng-hlml ở những bệnh nhân suy gan trung binh,
và 305 (24,8%) nng và 2,740 (44%) ng-h/ml ở những bệnh nhân suy gan nặng.
Dược động học rrong rể bảo
/ẩỈ/A`I
…
Ọ'
\
1
Trong oác tế bảo đợn nhân máu ngoại vi người không tăng sinh (PBMCS), thời gian bán hủy của
tenofovir diphosphat khoảng 50 giờ, trong khi thời gian bán hùy trong cảc tế bảo đơn nhân máu
ngoại vi không tảng sinh được kich thich bởi ngưng kết tố hổng cầu thực vật chỉ khoảng 10 giờ.
Cảo dữ liêu tiến lâm sờnư
Các nghiên cứu tiến iâm sảng cùa tenofovir disoproxil filmarat đã thực hỉện trên chuột cống, chó và
khi đã phát hiện cảo tác động trên cơ quan dich ở đường tiếu hớa, thận, xương và giâm nồng độ
phOSphat trong huyết thanh. Độc tinh xương được chẳn đoản như lá loảng xưong (61 khi) vả giảm
mật độ chất khoáng trong xưong (ở chuột cống và chó). Các phải hiện trong các nghiến cứu trên
chuột cống và khi chỉ ta rằng có sự giảm hấp thu phosphat ờ ruột gây giảm thứ phát mật độ chắt
khoáng trong xương. Tuy nhỉến, cơ chế của độc tính nảy chưa được hỉếu bỉết đầy đủ.
Dùng Iamivudin lỉều cao trong cảc nghiên cứu độc tính ở động vật không gây bất cứ độc tinh trên
cơ quan chinh nảo. Ó iiều cao nhất, cảc tác đỏng nhỏ trên chức năng gan vả thận đi kèm với vỉệc
giảm khối lượng gan. Cảo tác động Iiến quan đến iâm sảng là giảm số lượng hồng cẳu và giảm bạch
cẩu trung tinh.
Đã quan sát thấy tăng sản đường mật ở khi cynomolgus khi sử dụng efavirenz trên I năm với liếu
1ượng để có giá trị AUC trung binh lớn khoảng gấp 2 lần giá trị AUC trung binh ở người khi dùng
liếu khuyến cáo. Sự tăng sản đường mật giảm sau khi chắm dt'tt lìếu đỉều trị. Xơ hóa đường mật đã
phát hiện thấy ở chuột cống. Không có trường hợp co giật dai dẳng nảo được phát hiện ở khi khi
dùng efavirenz trên 1 năm, với liều lượng đế có giá trị AUC huyết tương lón gấp 4- 13 lần giá ttị ớ
ngưởi khi dùng liều khuyến cáo.
Các nghiên cứu về khả năng sinh sản cùa tenofovir disoproxil fumarat đã được thực hiện trên chuột
cống và thớ. Không oó cảc tảo động trên các thông số giao phối và khả năng sinh sản hoặc trên bất
kỳ thỏng số thai kỳ hay bảo thai nảo. Không có sự thay đồi mô mếm hay mô xương của bảo thai.
Tcnofovir dis0proxil fumarat lảm giảm chỉ số sống sớt và trọng lượng cùa con trong các nghiến cứu
độc tinh sau sinh.
Efavirenz gây tiêu thai ở chuột lớn. 3 trong 20 trường hợp bảo thail mới sinh bị dị tật dã được phát
hìện ớ khi Cynomoigus dùng efavirenz với lỉếu lượng để đạt được nồng độ cfavirenz trong huyết
tương tương đương với nồng độ trến người. Thai vỏ sọ và thiếu một mắt kèm theo phì đại iưỡi thử
phảt đã được ghi nhận thấy ở một bảo thai, viếm mắt vì thế được phảt hiện thẳy ở một bảo thai
khác, và hờ hảm thấy ở bảo thai thứ ba. Không có dị dạng thai nảo được phát hiện ở chuột cốn ’ vả
thỏ khi điếu trị bằng cfavircnz. xố
Cảo nghiến cứu độc tính gen đã chi ra rằng tenofovir disoproxil fumarat thì âm tinh trong thử
nghiệm vì nhân tùy xương ở chuột nhắt nhưng dương tính trong thử nghiệm tế bảo 11 1ympho chuột
nhắt LS 178Y in vitro với sự có mặt hay khỏng cùa sự hoạt hóa chuyến hớa S9. Tenofovir
disoproxil fumarat thi dương tính trong 2 trên 3 nghiên cứu trong thử nghiệm Ames, một khi có mặt
của 89 (tăng gấp 6,2 — 6,8 iần) và một khi không có mặt oùa S9. Tenofovir disoproxil fumarate thi
cũng dưong tinh nhưng yếu trong thử nghiệm tồng hợp DNA không quy định thời hạn in vivo / in
vitro trên tế bảo gan chuột cống nguyên thủy.
Lamivudin không gây đột biến trong cảc thử nghiệm vi khuẳn, nhưng giống như các đồng đắng
nucleosid, đã chi ra hoạt tinh trong thư nghiệm di truyền học tế bảo in vitro và thử nghiệm u
lympho ở chuột nhắt. Lamivudin không gây độc tinh gen in vivo ở các liếu mả cho nồng độ trong
huyết tương cao hơn khoảng 40-50 lẳn nổng độ trong huyết tương trên lâm sảng đã biết. Vi hoạt
tính gãy đột biến cúa lamivudin trên in vilro không thể chứng thực trong cảc thử nghiệm in vivo,
iamivudin được kết luận lá không nến đại diện cho một mối nguy hiểm độc tinh gen đối với bệnh
nhân điếu trị với lamivudin.
Một nghỉến oứu độc tinh gen qua nhau thai đã thực hiện trên khi so sảnh zidovudin dùng một minh
với sự kết hợp zidovudin vả lamivudin ở sự phơi nhiễm tương ứng ở người. Nghiên cứu cho thấy
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng