

















. ( gl\lL
gJ
BỘ Y TẾ
QUẢN LÝ DUỌC
PHÊ DUYỆT
AVMỸỮ
_r
Lân [ỈũUỞỮÍJL/ẮÍ
m”uỀ
'L'ffl
… …
ulalsolmuufa r.n wrẵu-fmu moma
pOM Ủể'ẩề'mm …hm: … m " POM … bvl thué …
uoc asaaz-ss4-so MM đsmũ m…… … mũ qumm uoc ssssz-asq—ao maoamoo
“°“…mmwmm maouuuonunmuumo
Ri der: Tlullun Mc. &
. _ Do … m, ,… an=c. _ tm-m, Survey mm 8. 314,
Tenofovư Ềằằầf'Ềẵẳỉẫ' _ Tenofovnr MỀ wnuee,mmwalm u…
_ Mr g oi . . Range DỈSỪẺ Á— : NDỈẨ-
DISOpI'OXỈI ưeen … of me rach and slght d“ dmren. DỈSOPI'OXIl Wỉ| Ẹịduz
, : … d the
Fumarate et d' Ủẵẵửẵẳẩả.”MW ' Fumarate and j²~mlmmme
E tri ỉt bin ”°“WẺWW MẸ E tfi itabi ”"MWMW
m C .a ' e ũnquc nunưlmủ pullmli …mmum m C ne
W
Oompn mes ỉ“ẫẻ J.“…ằ'ầ'ẵ“ ""ẳỉẳ’" … … Tablets Hủ
300mg/²00mg …………z……ư … 300mg/200mg * …
A c… ả une Iunpenlure ne dẻmmnt
pm30'C.
A cmnuver dans ì'ẵl'wrbẳlage d'or1gìne.
Mũ | M .
30 Compnmù …fflè'ãeuủaaewuwhnủ som… lllllilllWlllllll'
lndìcl\íens. … … ganh nt prenul1ms: la h
… mmmum.
NE PAS DGPASSER LA WE mm
81
TW …
… lnt
EIIMÙIHM Tffldl
WMIMI
T… W
… d . .
d' … MM . . .
WM _ TỆ. THANH PHU 0
30hHohlc«nựlmù \\ '0 0… M…"
\\ _
AJszszxs4xaamm _…mllll
ừlntDnc 350 CIPnntnne 3²75 C . Pantone Blue 07²C I Pantone 172 C I Black _
Product Name Cfflponỳeỳnt I!em Code Dale & Tlme
N Edetabỉne & Tenofovir Carton [30'51 02.31.2015 & 10:50 AM
AUROBINDO Customerl Country Version No. Reuon Of b… Rwlewed ! vaeđ by
Packaglng Development ARV's_Vieưmm 04
Team Loadư Pratap Sahu _ DjpẸnjlom Colours :
lnltlaủr Subramanyam 52 X 64 X 88 mm No ot Coldun: 05
Artist 2 iS ion Pharmucode
Graphic Dcsỉgucrs —
Mđitioual lnfotmation : 501355 Slm lDdl
—l
Eudt film ooated tablet oontalus:
Emtricitabine 200 mg
TenofovIr dlsoproxil fumarate 300 mg equivakent m tenofovir
dlsoproxỉl 245 mg.
Colour: Titanium Dioxìde.
Do nơ_t st re abqve 30°C.
Store ln e ongmal package.
Keep the container tightiy dosed.
Keep cut of the reach and slght of chlldren.
Indications, Warnings & Preautions: Read the paddl fumarate vả
1
\
emtricỉtabìne 300/200 mg cùng vởí thức ăn. Thậm chí một bữa ăn nhẹ cũng cải thỉện được sự hắp thu của
tenofovir trong viên nén kết hợp.
Trong trường hợp có chỉ định ngưng điều trị bằng phác đổ với một trong cảc thảnh phần cùa viên nén Tenofovir
đisoproxil fumarate vả emtricitabine 300/200 mg hoặc khi cần thiết thay đối lỉều, luôn sẵn có các chế phẳm chỉ
chứa emtricỉtabine hoặc tenofovir disoproxil fumarate riêng rẽ.
Trẻ em vả trẻ vị rhảnh niên:
Không nên dùng vìên nén Tenofovir disoproxil fumarate vả emtricỉtabỉne 300/200 mg cho trẻ dưới 18 tuổi do
chưa có dữ lìệu đẳy đủ về tính an toản củng như hiệu quả của thuốc.
Nguời giả:
Hìện không có dữ liệu để đưa ra lìều khuyến cảo đối với bệnh nhân trên 65 tuối. Tuy nhìên, không cần thỉết điều
chỉnh lỉều khuyến cáo dùng hảng ngảy cho người trưởng thảnh m`r khi có dâu hỉện suy thận.
Suy thận:
Emtrỉcitabine vả tenofovir được thải trừ chủ yếu lả bải tỉết qua thận và nồng độ của emtricỉtabine vả tenofovir có
thể tăng lên đảng kể khi sử dụng viên nén Tenofovir disopr0xì] fumarate vả emtricỉtabine 300/200 mg trên các
bệnh nhãn suy thận mức độ vừa đến nặng. qư
Chỉ có những dữ liệu hạn chế từ cảc nghiên cứu trên lâm sảng chứng mỉnh cho mức lìều dùng một lần hảng ngảy
của tenofovir disoproxil fumarate với emtricỉtabine trên cảc bệnh nhân suy thận nhẹ (độ thanh thải creatinin lả 50-
80 mllphút). Tuy nhỉên cần điều chỉnh khoảng cảoh giữa cảc lần dùng viên nén Tenofovir disoproxil fumarate vả "
emtricỉtabine 300/200 mg trên tất cả bệnh nhân suy thận vừa (độ thanh thải creatinin trong khoảng 30- 49-
ml/phủt). Nguyên tắc điều chình khoảng cảch giũa cảc lấn dùng trên cảc bệnh nhân nảy dưa trên dữ lỉệu về dược ổ
động học dùng một liều duy nhất trên những bệnh nhân không nhiễm HIV có mức độ suy thận khảo nhau. Khỏn0 g/
có dữ lỉệu về tính hỉệu quá cũng như tính an toản trẽn cảc bệnh nhãn có độ thanh thải creatinin trong khoảng 30- '"
49 mlíphủt đỉều trị bằng tenofovir disoproxil fumarate kết hợp vớì emtricỉtabỉne có điều chỉnh khoảng cách gỉữa
\ . , , , , , . , , , … , Ậl
cảc lân dùng. Do đó, nên theo dỒl chặt chẽ đáp ưng lam sang va chưc năng thạn tren cac bẹnh nhan nay. %
\
Độ thanh thâi creatinin (mllphủt)* .. ă
50-80 30—49
Khoảng cách giữa cảc lẩn 24 gíờl lằn 48 gỉờl lần
dùng theo khuyến cảo ` ` ,
(không yêu câu đỉêu chỉnh)
* Tính loán liều dùng dựa trên cân nặng
Viên nén Tenofovir dísoproxil fumarate vả emtricỉtabine 300/200 mg không khuyến cáo sử dụng cho các bệnh
nhân suy thận nặng (độ thanh thải creatinin < 30mE/phủt) và trên các bệnh nhân cần chạy thận nhân tạo bởi vì
không thể gìảm liền cho thích họp vởi vỉên nén kểt họp. ĩ
Suy gan:
Dược động học của vìên nẻn Tenofovir disoproin fumaratc vả emtricỉtabỉne 300/200 mg vả emtricỉtabìne chưa
được nghiên cửu trên cảc bệnh nhân suy gan. Dược động học của tenofovir đã được nghiên cứu trên cảc bệnh
nhân Suy gan và không cần đỉểu chỉnh khoảng cảch giữa cảc lần dùng thuốc tenofovir disoproxil fumarate trên
2
những bệnh nhãn nảy. Do emtricỉtabine chuyển hoá rẳt ít qua gan vả đường thải trừ lả qua thặn, khỏng cần thiết
phải điều chỉnh liều vỉên nén Tenofovir disoproin fumarate vả emtricỉtabine 300/200 mg trên bệnh nhân suy giảm
chítc năng gan.
Nền ngưng dùng vìên nén Tenofovir dìsoproxil fumarate vả emtricỉtabỉne 300/200 mg trên bệnh nhân bị nhiễm
đồng thời cả HIV vả HBV, theo dõi chặt chẽ dắu hỉệu bệnh gan nặng thêm trên cảc bệnh nhân nảy.
C ảch dùng.-
Nếu bệnh nhân gặp khó khăn khi nuốt, thì có thê nghìền nảt thuốc pha vảo xắp xỉ 100 ml nước, nước ép trải cam
hoặc nho rồi uống ngay.
Chống chỉ định:
Bệnh nhân quả mẫn vởi emtricỉtabine, tenotbvir, tenof0vir disoproxil fumarate hoặc với bất kỳ thảnh phần nảo
của thuốc.
Thận trỌng khi dùng thuốc:
Không nên dùng đồng thởi vỉên nẻn Tcnofovir disoproxil fumarate vả emtricỉtabine 300/200 mg với các thuốc
khảc có chứa emtricỉtabine, tenofovir diSOpr0xỉl (dạng l`umarate) hoặc cảc thuốc đồng đẳng cytidin khảc, chẳng
hạn lamivudin vả zalcỉtabin.
Phác đồ J… !huốc vởi nucleosid/nucleolid: ỹì
Đã có bảo cảo tỷ lệ thất bại cao_về vìrus và xuất hìện khảng thuốc sở… khi kết hợp tenofovir disoproxil fumarate -
với Iamivudỉn vả abacavỉr cũng như vởỉ lamivudin vả dìdanosin khi dùng một liều mỗi ngảy. Có một sự tương tự
về cắn trúc gỉữa lamivudin vả emtricỉtabỉne và sự tương tự về dược động học vả dược lực học của hai thuốc nảy.
Bởi vậy, cùng gặp cảc vẳn đề tương tự nếu dùng viên nén Tenofovir disoproxil fumarate v”a emtricỉtabine 300/200
mg vởi một đổng đắng hucleosid thứ ba.
Bệnh nhân được điều trị bằng viên nén Tenofovir disoproxil fumarate vả emtricỉtabine 3_00|200 mg hay bắt kỳ
phác đồ khảng retrovirus nảo khác có thế vẫn tiếp tục bị nhiễm khuẳn cơ hội vả bị cảc bỉến ohứng khảo của nhiễm
HIV và do vậy bệnh nhân nẻn được bác sĩ có kỉnh nghìệm điều trị cho bệnh nhân mắc cảc bệnh lìên quan đến
HIV giám sảt chặt chẽ trên lâm sảng.
Bệnh nhân cần phải được tư vấn về cảc thuốc khảng retrovirus bao gốm cả viên nén Tenofovir disọmoxìl
fumarale vả emtricỉtabìne 300/200 mg, Ìâ các thuốc nảy chưa được chứng minh gỉúp ngăn ngừa nguy cơ truyền
nhiễm HIV cho ngưòi khác qua đường tình dục hoặc truyền mảu. Phải tỉếp tục sử dụng các bỉện pháp phòng ngừa
thích hợp.
Suy thận:
Emtricitabine vả tenofovir được thải trừ chủ yếu qua thận qua sự kết hợp lọc cầu thận vả bải tiểt tích cực qua ống
thận. Đã ghi nhận trường hợp suy thận, tổn thương thận, tảng creatinin, giảm phosphat huyết vả bệnh lý ống lượn
gân (bao gồm hội chứng Fanconì) khi dùng tenofovir disoproxil fumarate trong thực tỉễn lâm sảng.
Khuyến cảo nên tính độ thanh thải creatinin cho tất cả bệnh nhân trước khi bắt đầu đỉều trị bằng vỉên nén
Tenofovir disoproxil fumarate vả emtricỉtabỉne 300/200 mg vả theo dõi chức năng thận (độ thanh thải creatinin vả
phosphat huyết thanh) 4 tuần một lần trong năm đỉểu trị đầu tiên vả sau đó là 3 thảng một lần. Ở những bệnh nhân
có nguy cơ bị suy thận, nên cân nhắc tần suất theo dõi chức năng thận một cách thưởng xuyên hơn.
3
Nồng độ emtricỉtabine vả tenofovir có thế tãng đáng kể ở những bệnh nhản suy thận thể vừa hoặc nặng và cần
thiết phải điều chinh khoảng cảch giữa cảc lằn dùng thuốc trên những bệnh nhân có độ thanh thải creatinin nắm
trong khoảng 30 - 49 mlfphủt. Tinh an toản và hiệu quả cùa viên nén Tenofovir disoproxil fumarate vả
emtricỉtabine 300/200 mg trên cảc bệnh nhân có độ thanh thải creatinin trong khoảng 30 - 49 mllphủt chưa được
thiết lập vả do vậy lợi ích tiềm tảng của thuốc cằn được dảnh giá cùng vởi rùi ro tiềm tảng độc tính với thận. Theo
dõi cẩn trọng cảc dẳư hiệu nhìễm độc, ví dụ suy giảm chức năng thặn vả thay đổi nồng độ virus trên những bệnh
nhân có tốn thương thặn trưởc đó, khi bắt đẳu đùng viên nén Tenofovir disoproxil fumarate vả emtricỉtabine
300/200 mg với khoảng cách gỉĩta cảc ]ẳn dùng thuốc kéo dải. Không khuyến cáo sử dụng viên nén Tenofovir
disoproxỉi fumarate vả emtricỉtabinc 300/200 mg trên cảc bệnh nhân có độ thanh thải creatinin < 30mllphút hoặc
trên cảc bệnh nhân cần chạy thận, việc điều chỉnh liều etntricitabine vả tenofovir disoproxil fumarate lá không thể
thực hiện nếu bệnh nhân dùng vỉên nén kết hợp Tenofovir dỉs<›proxil fumarate vả emtricỉtabine 300/200 mg.
Nếu phosphat huyết thanh giảm <] ,5 mng (0,48 mmol/l) hoặc độ thanh thải creatinin giảm <50 ml/phủt trên cảc
bệnh nhân đang dùng viên nén Tenofovir disoọroxii funnarate vá emtricỉtabỉne 300/200 mg, cần phải đánh giá iạỉ
chức năng thận trong vòng | tuấn, bao gồm nồng độ glucoza huyết, kali huyết và nồng độ glucoza trong nước
tiểu. Nên điều chỉnh khoảng cảoh giữa cảc lần dùng viên nén Ienofovir disoproxil funnarate vả emtricỉtabine
300/200 mg nếu độ thanh thải creatinin giảm < 50 ml/phút Cũng nên cân nhắc ngưng đỉều trị bắng viên nén
Tenofovir disoproxil fumarate vả emtricỉtabine 300/200 mg trên cảc bệnh nhân có độ thanh thải creatinin giảm
<50 mllphủt hoặc nồng độ phosphat huyết thanh giảm < I Omg/di (0,32 mmolll).
.—
Nên trảnh dùng viên nén Tenofovir disoproxil fumarate vả emtricỉtabine 300/200 mg cho các bệnh nhân dùng
đồng thời hoặc mởi dùng gần đây một thuốc gây độc thận.
Nên tránh dùng viên nén Tenofovir disoproxil fumarate vả emtricỉtabine 300/200 mg trên các hệnh nhân đã có
tiền sử dùng thuốc khảng retrovirle nhiễm HiV-i với thể đột biến K65R.
Trong một nghiên cứu lâm sảng có kiếm chứng kéo dải 144 tuần so sảnh tenofovir disoproxil fumảrate với
stavudìn kết hợp với lamivudin vả efavirenz trên cảc bệnh nhân dùng thuốc khảng retrovirus iần dằu, thắỳ có sự
giảm nhẹ tỷ trọng xương ở xương hông và cột sống trong cả hai nhóm điều trị. Ở tuần 144, sự giảm tỷ trọng
xương ở cột sống và biến đổi các chỉ số sinh học cùa xương so với mức cơ sở ở nhóm điều trị bằng tenofovir
disoproxil fumarate ]ởn hơn đảng kể so vởi nhóm kia. Ở nhóm nảy, sự giảm tỷ trọng xương ở hông cũng…iớn hơn
đảng kể so với nhóm kia cho tởi tuần thứ 96. Tuy nhiên, sau 144 tuần điều trị, không có gia tăng nguy cơ gãy
xương hoặc dấu hiệu bắt thường về xương trên iâm sảng. Nên hỏi ý kiến bác sỹ nếu nghi ngờ có bất thường về
xương. '
Đồng nhiễng Hỉ V vả viêm gan B hoặc C:
Bệnh nhân bị viêm gan B hoặc C mạn tỉnh được điều trị thuốc khảng retrovirus có nguy cơ tảng câc phản ứng bất
lợi gây trên gan nghiêm trọng và có nguy cơ gây tử vong.
Bác sỹ điều trị nên tham khâo cảc nguyên tắc điểu trị HIV hiện nay để đưa ra phương phảp đìều trị tối ưu cho
bệnh nhân đồng nhiễm HIV vả vỉrus vỉêm gan B (HBV).
Trong trường hợp dùng đồng thời thuốc kháng retrovirus dối vởi viêm gan B hoặc C, đề nghị xem thông tỉn tỏm
tắt đặc tinh sản phầm cùa cảc thuốc điều trị có liên quan.
Tính an toản vả hiệu quả của viên nén Tenofovir disoproxil fumarate vả emtricỉtabine 300/200 mg vẫn chưa được
thiết lập trong điều trị nhiễm HBV mạn tính. Emtricitabine vả tenofovir disoproxil dùng riêng rẽ vả kểt hợp đều
cho thấy hoạt tính khảng HBV trong cảc nghiên cứu dược lực học. Kinh nghiệm lâm sảng hạn chế gợi ý là
.
emtricỉtabine vả tenofovir disoproxil fumarate có hoạt tinh khảng HBV khi sử dụng trong phảc đồ kết hợp kháng
retrovirus để kiếm soát nhiễm HIV.
Có thể bệnh viêm gan sẽ bị nặng ]ẽn ở những bệnh nhãn đồng nhỉễm HIV vả HBV sau khi ngưng điều trị bằng
tenovaỉr disoproin fumarate. Đã thắy có cảc trường hợp bệnh nặng thêm nảy sau khi ngưng diểu trị bằng
cmtricitabỉne ở bệnh nhân nhiễm HBV nhưng không đổng nhiễm HIV vả được phát hiện chủ yếu do tăng alaninc
aminotransferaza huyết thanh (ALT) cộng với việc tải xuất hiện ADN của HBV. Trên một vải trường hợp, sự tải
kich hoạt HBV có kèm theo bệnh gan nặng hơn, kể cả suy gan và suy gan mất bù. Bệnh nhânHlV đồng nhiễm
HBV cẩn được theo dõi chặt chẽ trên lâm sảng cũng như cậu lâm sảng trong ít nhắt vải thảng sau khi ngưng điếu
trị bằng viên nén Tenofovir disoproxil fumarate vả emtricỉtabinc 300/200 mg. Không có đủ bằng chứng để xảo
định là việc bắt đầu lại tenofovir disoproxil fumarate hay emtricỉtabỉne có thay đối xu hướng nặng lên cùa bệnh
viêm gan sau điều trị hay không.
Bệnh gan:
Tính an toản vả hìệu quả cùa viên nén Tenofovir disoproin fumarate vả emtricỉtabine 300/200 mg chưa được
thiết lập trên cảc bệnh nhân có rối loạn chức năng gan dáng kể. Dược dộn g học cùa viên nén Tenofovir dìsoproxii
fưmarate vả emtricỉtabine 300/200 mg vả emtricỉtabine chưa được nghiên cứu trên các bệnh nhãn suy gan. Dược
động học của tenofovir đã được nghiên cứu trên bệnh nhân suy gan vả không cần điều chỉnh liền trên cảc bệnh
nhãn nảy. Vi emtricỉtabine cltuyểtrhóâ tối thiểu qua gan vả đường thải trừ qua thặn, không cẳu đỉều chinh liều
viên nén Tcnofovìr disoproin fumaratc vả emtricỉtabinc 300/200 mg trên cảc bệnh nhân suy gan.
Bệnh nhân có tiền sử rối loạn chức nảng gan bao gồm viêm gan mạn tính hoạt động, thì gia tăng tần suất bất
thường xét nghiệm chức năng gan trong quá trình diều trị bằng phảc dỗ khảng retrovirus kết hợp vả cần theo dõi
bệnh nhân chặt chẽ theo quy trình chuẩn. Nếu có bằng chứng cho thấy diễn biến xắu hơn cùa bệnh gan trên những
bệnh nhân nảy, cần cân nhắc tạmthời ngưng hoặc ngưn g diều trị. CỸ1/
Nhiêm Ioan laclic:
ý
Nhiễm toan lactic, thường có kèm theo gan nhiễm mỡ, đã được bảo cảo khi sử dụng cảc chất đề_ự '
- . :. … … . , x , … , … , - >. … .. &
nucleosưi. Cac dau hiẹu sơm (tang lactat mau) bao gom cac triẹu chưng tieu hoa nhẹ (bưon non,_non ạ,,
bụng), mệt mòi không đặc hỉệu, ãn kém ngon, gìảm cân, các triệu chứng hô hắp (thở nhanh vả/hoặc sâur)rỷềể ác
triệu chứng thần kinh (kể cả yếu vận động). Nhiễm toan lactic có tỷ lệ tử vong cao vả có kèm theo viê u suy
gan hoặc suy thận. Nhiễm toan lactic thường xuất hiện sau một vải hoặc nhiều thảng điều trị.
Nên ngưng điều trị bằng cảc chẳt đồng đẳng nucleosid khi có các dấu hiệu tăng lactat máu vả nhiễm toan
lactic/chuyền hóa, phi đại gan tiến triển, hoặc tãng nhanh aminotransferaza.
Cần thận trọng khi dùng cảc chẩt đồng đắng nucleosid cho bất kỳ bệnh nhân nảo (đặc biệt lả phụ nữ béo phi) bị
phì đại gan, viêm gan hoặc cảc-yếu tố nguy cơ đã biết đối vởi bệnh gan vả gan nhỉễm mỡ (kể cả một số thuốc nhất
định vả rượu). Cảc bệnh nhân đồng thời nhiễm viêm gan C và được điều trị bằng alpha interferon vả ribavỉrin có
thế có nguy cơ đặc biệt.
Cần theo dõi chặt chẽ cảc bệnh nhân có nguy cơ cao.
Loạn dưỡng mỡ:
Liệu phảp khảng retrovirus kết hợp thường kèm theo tinh trạng phân bố iại mỡ trong cơ thể (hội chứng loạn
dưỡng mỡ) ở bệnh nhân HIV. Hiện còn chưa biết rõ hậu quả lâu dải của những tình trạng nảy. Chưa có thông tin
đằy đủ về cơ chế. Có giả thuyết rằng có mối lìên hệ giữa tình trạng tích mỡ nội tạng với cảc thuốc ức chế proteaza
S
và tình trạng teo mô mở với cảc thuốc ức chế men sao chép ngược. Nguy cơ gặp hội chứng loạn đường mỡ
thường cao hơn khi kèm theo những yếu tố cá nhân như tuổi cao, và cảc yếu tế liên quan đến thuốc như thời gian
điều trị khảng retrovirus kéo dải vả CảC rối loạn chuyền hóa kèm theo. Thăm khảm lâm Sảng nên bao gồm cả đảnh
giá cảc đẳu hiệu thực thể của tình trạng tái phân bố mỡ. Cần xem xét đến việc xảo định nồng độ iipid huyết tương
và glucoza mảu lủc đói. Cần có kiểm soát thích hợp trên lâm sảng đối vởi cảc rối loạn iỉpid..
Tenofovir có cẳu trúc giống các chất đồng đẳng nucleosid do đó không thể bỏ qua nguy cơ gặp hội cht’mg ]oạn
dưỡng mõ“. Tuy nhỉên, dữ lỉệu lâm sảng 144 tuấn thứ từ cảc bệnh nhân dùng thuốc khảng retrovirus iẩn đằu chỉ ra
rằng nguy cơ loạn dưỡng mỡ của tenofovir disoproxil fumarate thắp hơn so với stavudin khi dùng kết hợp với
lamivudin vả efavìrenz.
Rối ioạn chút nãng ly lhẽ:
Đã chứng minh in vitro và in vivo tằng cảc chẳt đồng đẳng nucleosid vả nucleotid có gây hủy hoại ty thể ở mức
độ khác nhau. Đã có cảc bảo cảo về rối ioạn chửc nãng ty thế ở trẻ sơ sỉnh HIV âm tính bị phơi nhỉễm cảc chất
đồng đẳng nucleosid tù trong tử cung vảJhoặc sau khi sinh. Cảo phản ứng ngoại ý chính được bảo cáo iả rối loạn
huyết học (thiểu máu, gỉảm bạch cầu trung tính), rối loạn chuyển hóa (tảng lactat mảu, tãng lipaza mảu). Những
phản ứng nảy thường chỉ lả tạm thời. Đệ có bảo cảo về một số rối loạn về thần kinh khởi phảt muộn (tăng trương
lực cơ, động kinh, hảnh vì bất thưòng). Hiện còn chưa rõ lả các rối loạn thần kinh là tạm thời hay lâu dải. Bắt ký
trẻ em nảo phơi nhiễm từ trong bảo thai với các nucleosid vả cảc đồng đẳng nucleosid, kể cả những trẻ em HIV
âm tính, đều phải được theo dõi về lâm sảng vả cặn lâm sảng, và nên kiểm tra dầy đủ về khả nãng rối loạn chức
nãng ty thể trong trường hợp có cảc dắu hiệu hoặc triệu chứng liên quan. Nhũng phảt hiện nảy không ảnh hưởng
tới khuyến cáo quốc gỉa hiện nay về vỉệc sử dụng cảc thuốc kháng retrovirus cho phụ …~r có thai để ngăn ngừa lây
truyền HIV từ mẹ sang con.
Hội chứng tải hoạt miễn dịch: ỀV
Ở những bệnh nhân nhiễm HIV bị suy giảm miễn dịch nghiêm trọng, vảo lủc khởi đầu điều trị bằng phác đồ thuốc
khảng retrovirus kết hợp (CART), phản ứng viêm có thể xuất hiện đối vởi cảc mẩrn bệnh cơ hội tồn lưu hoặc
không có triệu chứng, và gây ra các tình trạng bệnh lý lãm sảng nghiêm trọng, hoặc Iảm trầm trọng thêm cảc triệu
chứng đã có, Đặc biệt, những phản ứng như vậy đã được quan sát thẳy trong vải tuần hoặc thảng đầu tiên điều trị
bằng phảc đồ thuốc kết hợp Những ví dụ của cảc phản ứng nảy lả viêm võng mạc do cylomegalovirus, nhiễm
mycobaclerz'um rộng vả/hoặc khu trú và viêm phối do Pneumocysiis carinii. Bất kỳ triệu chứng viêm nảo cũng
phải được đảnh giả và điều trị nếu cằn. ’Ể
%
Hoại Iứxương: \
Mặc dù nguyên nhân gây bệnh được coi lả do nhiều yếu tố (bao gồm cả việc sử dụng corticosteroid, nghiện rượu,TẾ
suy giâm miễn dịch nặng, chỉ số trọng lượng cơ thể cao), các trường hợp hoại từ xương đã được bảo cảo, đặc biệt\k
ởbệnh nhân nhiễm HIV tiến triển vả/hoặc phơi nhíễm lâu dải với phảc đồ khảng retrovirus kết hợp (CART) `
Bệnh nhân cần được khuyên hòi bảc sĩ nếu thẳy đau khớp và chứng đau, tê cứng khóp hay khó vặn động.
Kếl hợp tenofovir disoproxilfumarate vò didanosin: Không khuyến cảo.
Dùng đồng thời tenofovir disoproxil fumarate vả didanosin lảm gia tăng 40-60% nồng độ didanosin toản thân mà
có thể iâm tăng nguy cơ các tảc dụng bất lợi của didanosin. Hiếm gặp trường hợp viêm tụy và nhiễm toan lactic,
đôi khi gãy tử vong. Dùng đồng thời tenofovir disoproxil fumarate vả didanosin vởi lỉểu 400 mg lngảy iâm giảm
đảng kể số tế bảo CD4, có thể do một tương tảc nội hảo tăng phosphoryi hóa didanosin (dạng hoạt động). Một
liều giảm didanosin 250 mg-cùng với tenofovir disoproin fumarale ghi nhận tỷ lệ thắt bại cao về virus trong số
cảc phác đồ thuốc kết hợp đã thử nghỉệm.
Viên nén Tenofovir disoproxil fumarate vả emtricỉtabinc 300/200 mg có chứa lactoza monohydrat. Do vậy, bệnh
nhân có những vẳn đề hiếm gặp về di truyền như không dung nạp được galactoza, thiếu hụt enzym Lapp lactaza,
hoặc kém hấp thu glucoza-galactoza thì không nên sử dụng thuốc nảy.
Sử dụng trên phụ nữ có thai vả cho con bú:
le nữ có lhai:
Không có dữ liệu về sử dụng cmtricitabine vả tenofovir dísoproxil fumarate khi đang mang thai.
Cảc nghiên cứu trên động vật khõng chỉ ra tác hại trực tiếp hOặc gỉán tiếp của emtricỉtabine hay tenofovir
đis0proxil fumarate đối vởi quá trình mang thai, sự phát triền bảo thai, sự sinh nở hoặc sự phảt trỉên sau khi sinh.
Tuy vậy, không nên sử dụng viên nén Tenofovir disoproin fumarate vả emtricỉtabine 300/200 mg trong thời gian
mang thai trừ khi khỏng còn thuốc thay thế nảo khảo.
Sử dụng viên nén 'I’enofovir disoproxil fumarate vả emtricỉtabine 300J'200 mg phải luôn kèm theo các biện pháp
trảnh thai hỉệu quả. -
Phụ nữ cho con bú:
Hiện chưa rõ emtricỉtabine hoặc tenofovir có băi tiết qua sữa mẹ hay không.
Do đó, khuyến cảo người mẹ nhiễm HIV không nẽn cho con bú trong bắt kỳ hoản cảnh nâo để trảnh lây trụyền
HIV từ mẹ sang con. ' !
Anh hưởng của thnôc khi lái xe vả vận hảnh máy móc: - qư
Không có nghiên cứu nảo về ảnh hưởng iên khả năng lái xe và vận hảnh mảy móc. Tuy nhiên, bệnh nhăn phải
được thông báo là có khả năng bị chóng mặt khi điều trị bằng emtricỉtabine vả tenofovir disoproxil fưmarate.
.
o
Tương tác cũa thuốc với cảc thuốc khác và cảc loại tương tác khác:
Cảc nghiên cứu tương tảc thuốcmời chỉ được thực hiện ở người trường thảnh. _
Dược động học của emtricỉtabine vả tenofovir ở trạng thải ổn định không bị ảnh hưởng khi sử dụng emtricỉtabinc ,.
kết hợp vói tenofivir disoproxil fumarate so vởi sử dụng rỉêng từng thuốc. "Ji”
. ,< . … , . , i , . ,. , x , . l Pf
Dựa vao ket qua nghien cưu_zn vưro va_ tương tac dược đọng học Iam sang cho thay kha nãng tương tac qua trung' D
gian CYP4SO giữa emtricỉtabine vả tenofivir disoproxil fumarate vời cảc thuốc khác là thẳp. ~ gAN
ìdí |
Tương lác Iiẻn quan tới emtricỉtabine:
_
0
In virro, emtricỉtabine không ức chế chuyển hoá qua trung gian bắt kỳ dạng CYP4SO nảo của người sau đây: ]A2,
2A6, 286, 2C9, 2C19, 2D6 vả 3A4. Emtricitabỉne không ức chế enzym chuyến hoả giucuronid hóa.
Không có tương tác đáng kể có ý nghĩa trên lâm sảng khi dùng đồng thời emtricỉtabine vởi indinavir, zidovudin,
stavudin hoặc famciclovir.
Emtricỉtabine thâi trừ chủ yếu qua sự lọc cầu thận và bâi tiết tich cực qua ống thận. Ngoại trừ famciclovir vả
Tcnofovir disoproxil fumarate, tảc dụng khi dùng đồng thời emtricỉtabine với cảc thuốc khác thải trừ qua thận
hoặc cảc thuốc khảo đã biết lá có ảnh hưởng tởi chức năng thận, vẫn chưa được đảnh giả. Sử dụng đồng thời viên
7
nén Tcnofovir disoproxil fumaratc vả emtricỉtabine 300/200 mg vởi các thuốc thải trừ’qua bải tiết tích cực qua
ống thận có thể lắm tăng nồng độ trong huyết thanh của emtricỉtabine hoảc thuốc dùng đồng thời do sự cạnh tranh
đ ưò'ng thải trừ.
Không có kinh nghiệm lâm sảng dùng đồng thời emtricỉtabine vả các đồng đẳn g cytidin. Do vậy, không nẽn phối
hợp sử dụng viên nén Tenofovir disoproxil fumaratc vả emtricỉtabine 300/200 mg với iamỉvudin hoặc zalcìtabỉn
dễ điều trị nhiễm HIV.
Tương tác liên quan tới !enofovír:
Không có tương tảc trên lâm sảng khi dùng đồng thời lamivưdin, ininavir, efavirenz, neltinavir hoặc saquinavir
(có kèm ritonavir) vởi tenofovir đisoproxil fumarate.
Khi dùng đồng thời tenofovir disoproxil fumarate vởỉ Iopinavirlritonavir, nhận thắy không có thay đồi về dược
động học của [opinavir/ritonavir. AUC cùa tenofovir tãng xắp xỉ 30% khi dùng tenofovir disọpmxỉl fumarate
củng vởi iopinavỉrlritonnvir. Nồng dộ tenofovir cao hơn có thế lảm tăng cảc tảc dụng bất lợi của tenofovir, kể cả
rối loạn về thận.
Khi sử đụng viên nang kháng dịch dạ dảy didanosin trước 2 giờ hoặc sử dụng' đồng thời vởỉ tenofovir disoproxil
fumarate, AUC cùa didanosin tãng tương ứng trung bình 48% vả 60%. Mức tăng AUC trung binh của didanosin
là 44% khi sử dụng viên nén đệm ! giờ trước khi dùng tenofovir. Trong cả hai trường hợp, các thông số dược
động học cùa tenofovir“ uống kèm một bữa ăn nhẹ là khõng thay đồi. Không khuyến cảo sử dụng dồng thời
tenofovir vả didanosin.
Khi dùng đồng thời tenofovir đisoproxil fumarate với atanazavir, nhặn thẳy nồng độ atanazavir giảm (AUC
atanazavir giảm 25% vả C…… giảm 40% so với khi dùng atanazavir ở liễu 400 mg). Khi phối hợp thêm ritonavir
với anazatavir, tác động bất lợi cùa tenofovir dối với C…… của atazanavir giảm đi đáng kể, trong khi đó niức giảm
AUC lả tương tự (AUC giâm 25% vả C,… gỉảm 26% tương ứng so vởỉ atazanavỉr/ritonavir 300/100 mg). Dùng
đồng thời atazanavir/ritonavir với tenofovir iâm tảng nồng độ của tenofovir. Nồng độ tenofovir cao hơn có thế
iâm tăng các tảc dung bất lợi của tcnofovir bao gồm rối loạn về thặn. …
Tenofovir thải trừ qua thận, cả lọc và bải tiết tỉch cực qua chắt vận chuyển anion hữu cơ I của người (hOATL).
Dùng dồng thời tenofovir disoproxil fumarate vởi cảc thuôo khảc cũng bải tỉết tich cực qua chắt vặn chuyến anion
(ví dụ cidofovir) có thẻ ]ảm tãng nồng độ tenofovir hoặc lảm tăng nồng độ của thuốc dùng phối hợp.
Tenofovir disoproxil fumarate chưa được đảnh giả trên cảc bệnh nhân đang sử dụng cảc thuốc gây độc trên thận
(ví dụ aminoglycosid, amphotericin B, foscarnet, ganciclovir, pentamidine, vancomycin, cidofovir hoặc
interleukin—2). Nên trảnh sử dụng tenofovir đisoproxii fumarate đồng thời hoặc gần thời điềm khi dùng cảc thuốc
gây độc thận. Nếu trường hợp bẩt khả khảng phải sử dụng dồng thời viên nén Tenofovir disoproxil fumarate vả
emtricỉtabine 300/200 mg vả các thuốc gây độc thận, cần theo dõi chức năng thận hảng tuần.
Không có tương tảc dược động học đảng kể khi sử dụng đồng thời tenofovir disoproxil t`untarảte với methadon,
ribavirin, rỉfampìcin, adefovir dipivoxil hoặc các thưốc trảnh thai hormone như norgestrel/ ethinyl oestradio].
Tuơnz lác Iién quan tới viên nén Tenofovir disoproin fùmarale vả emlricítabỉne 300/200 mg :
Không có tương tác đáng kể có ý nghĩa trên lâm sảng khỉ đùng đồng thời tacrolỉmus vởi viên nén kết hợp
Tenofovir disoproxil fumarate vả emtricỉtabỉne 300/200 mg .
Tảc dụng không mong muốn:
fĩ
M
P!
it
Trong một nghiên cứu lâm sảng tỉến hảnh ngẫu nhiên nhãn-mở (open-iabel) trẽn cảc bệnh nhãn chưa từng điều trị
khảng retrovirus (GS-Ol-934), bệnh nhãn được điều trị bằng emtricỉtabỉne, tenofovir dísoproxii fumarate vả
efavirenz trong 144 tuần (sử dụng viên nén phối hợp Tenofovir disoproxil fumarate vả emtricỉtabine 300/200 mg
cùng với efavirenz từ tuần thứ 96). Thỏng tin về tinh an toản của emtricỉtabỉne vả tenofovir dis0proxil fumarate iả
thống nhất vởi kinh nghiệm sử dụng các thuốc nảy trưởc đó khi sử dụng riêng từng thuốc với các thuốc kháng
retrovirus khảc. Cảo tảo dụng bất lợi hay gặp nhất đã ghi nhận được xem là có thể hoặc chắc chắn liên quan tởi
emtricỉtabine vả/hoặc tenofovir dis0proin fnmarate iả buồn nôn (12%) vả tiêu chảy (7%).
Các phản ứng bắt lợi được coi là ít nhất có thể iiên quan tới phác đồ điều trị vởi các thảnh phần cùa viên nén
Tenofovir disoproxil fumarate vả erntricitabỉne 300/200 mg từ kỉnh nghỉệm trong thử nghiệm lâm sảng vả sau khi
đưa ra thị trường được liệt kê dưới đây theo hệ thống các cơ quan trong cơ thế và tẩn suất tuyệt đối, trong mỗi
! l 1 I ! & ắ ~ - . A ; › . ì À › › › A
nhom tan suat cac tac dụng khong mong muon nay được hẹt ke theo thư tự giam dan ve mưc đọ nghiem trọng.
Cảc tằn suất được xảc định là rất hay gặp em 0), hay gặp (>…00, 400 bản sao/ml ở tuần thứ 48, 96 hoặc ]44 hoảc ở thời điểm mới ngưng dùng
thuốc. Ở tuần thứ 144:
- Đột biến MI84V/I xuất hiện ở 2/19 (10.5%) thể phân iập được phân tích thuộc nhóm bệnh nhãn sử dụng viên
nén Tenofovir disoproxil fumarate vả emtricỉtabine 300/200 mg và xuất hiện ở 10129 (34,5%) thể phân lập
được phân tích thuộc nhóm sử dụng lamivudin/zìdovudin/efavirenz (giá trị p <0,05; test độ chinh xác Fisher
so sảnh tắt cả đối tượng giữa nhóm sử dụng emtricỉtabĩne + tenotbvir dis0proxìl fumarate và nhóm sử dụng
iamivudin/zidovuđin).
- Qua phân tích không có virus nảo mang đột biến KôSR.
… Khảng thuốc kiều gen đối với efavirenz, chủ yếu lả đột biến KIO3N, xuất hiện ở vìrus trẻn 13/19 (68%) các
bệnh nhân thuộc nhóm sử dụng emtricỉtabineftenof0vir disoproxil fưmarate/efavirenz và ở virus trên 21/29
(72%) bệnh nhân thuộc nhóm so sảnh.
Kinh nghiệm lám sảng:
Trong nghiên cứu lâm sảng ngẫu nhiên mở-nhãn (GS—Ol-934) tiến hảnh trên cảc bệnh nhân nhiễm HlV-l chưa
từng điều trị kháng retrovirus được dùng emtricỉtabine, tcnofovir disoproxil fumarate vả efavirenz (n=255) x ]
lần/ngảy hoặc thưốc phối hợp lamivudin vả zidovudin iỉều cố đinh (combivir) x 2 lằn/ngảy vả efavirenz x !
lần/ngảy (n=254). Bệnh nhân thuộc nhóm emtricỉtabine vả tenofovir disoproin fumarate được dùng vỉên nén
Tenof0vir diSOpr0xi] fumarate vả emtricỉtabinc 300/200 mg vả efavirenz từ tuần 96 đến tuần 144. Ở đường cơ sở
cảc nhóm chọn ngẫu nhiên tuong tự nhau về nồng độ trung binh ARN của HIV-l trong huyết tương (5,02 và 5,00
login bản sao/ml) và số lượng tế bảo CD4 (233 vả 241 tế bảo/mm” Điếm kết thúc hiệu lực đầu tiên cùa nghiên
cún nảy lả sự dạt được vả duy trì nồng độ ARN cùa HIV- 1 được xảc định <400 bản sao/ml trong hơn 48 tuần
Hiệu lực thứ cắp đảnh giả tmng 144 tuần bao gồm một số bệnh nhân có nồng độ ARN cùa HIV- I <400 hoặc < 50 '
bản sao/ml, vả thay đổi số lượng tế bảo CD4 so vời mức cơ sở. w
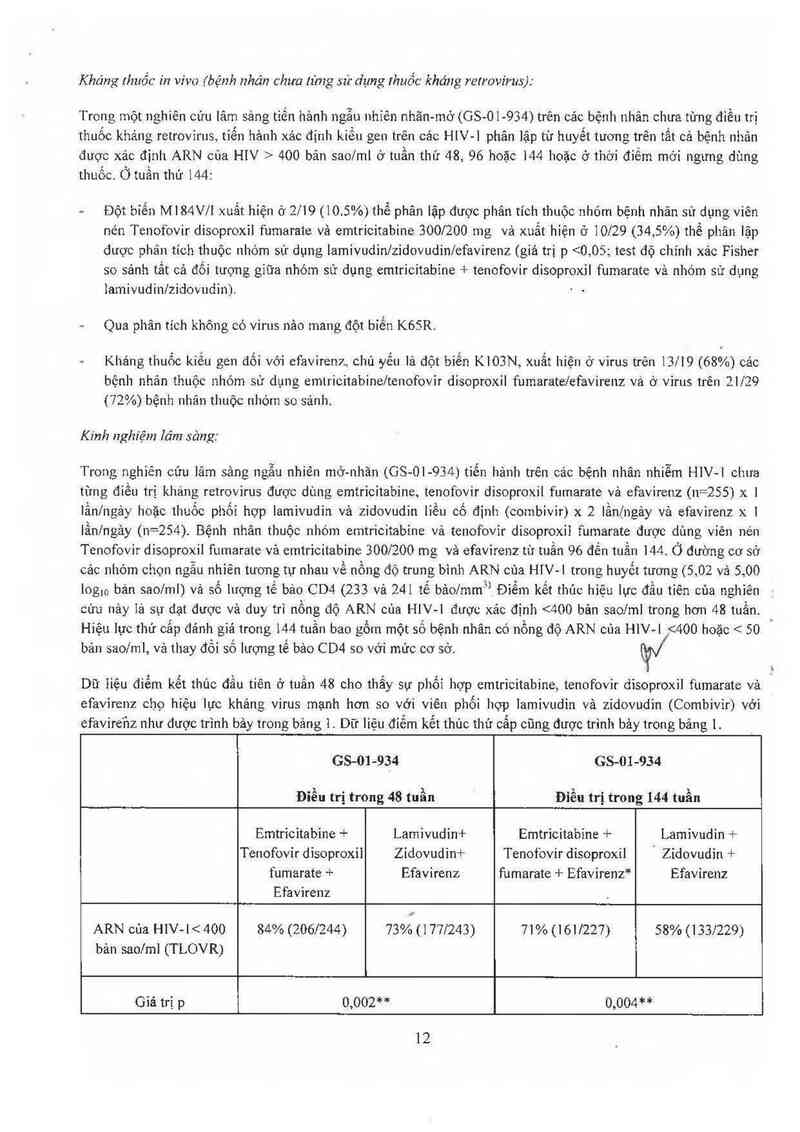
Dữ liệu điếm kểt thúc đẳu tiên ở tuần 48 cho thấy sự phổi hợp emtricỉtabine, tenofovir đisoproin fumarate vả
efavỉrenz cho hiệu lực khảng virus mạnh hơn so với viên phối hợp lamivudin vả zidovudin (Combivir) vởỉ
efavire'ùz như được trình bảy tr0ng bảng 1. Dữ liệu điểm kết thủc thứ cẳp cũng được trinh bảy trong bảng 1 .
GS-01-934 GS-OI-934
Điểu trị trong 48 tuần Điều trị trong 144 tuần
Emtricitabine + Lamivudin+ Emtricitabine + Lamivudin +
Tenofovir disoproxil Zidovudin+ Tenofovir dis0proxil ' Zidovuđin +
fumarate + Efavirenz fumarate + Efavirenz* Efavirenz
Efavirenz
ARN cùa HIV- [ < 400 84% (2061244) 73% (1771243) 71% (161/227) 58% (133/229)
bản saolml (TLOVR)
Giá trị p 0,002** 0,004**
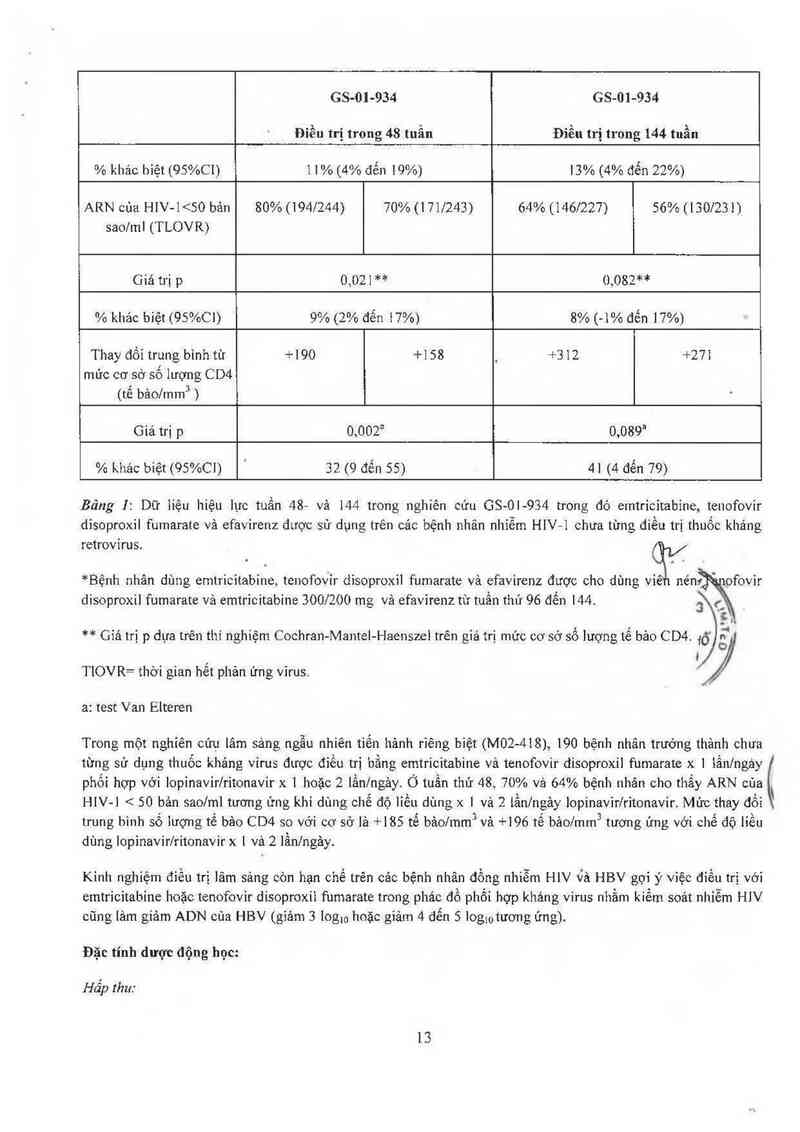
12
GS—01-934
Điều trị trong 48 tuần
GS-01-934
Đỉều trị trong 144 tuần
% khảo hiệt (95%C1)
l 1% (4% đển 19%)
13% (4% đển 22%)
ARN cùa HIV-I 65
tuôi).
14
Suv Ihán:
Dược động học của emtricỉtabine vả tenofovir sau khi dùng đổng thời hai chế phẳm riêng biệt hay dạng viên nén
phối hợp Tenofovir dis0proxil fumarate vả emtricỉtabine 300/200 mg chưa được nghiên cứu trên bệnh nhân suy
thận. Các thông số dược động học được xác định sau khi cho uống liều duy nhất emtricỉtabine 200 mg hoặc
tenofovir disoproxil 245 mg đối với 40 bệnh nhãn khỏng nhiễm HIV suy thận ở mức độ khác nhau. Mức đó suy
thận dược xảo định dựa vảo độ thanh thải creatinin cơ sở (CrC1) (chức nãng thận lả bình thường nếu chỉ số CrC1 >
80mI/phút; suy thận nhẹ nếu CrC1 = 50 - 79 ml/phủt; trung binh nếu CrC1 = 30 - 49 m1/phút và nặng nểu cic1=
10 - 29 mllphút).
Nồng độ trung binh của emtricỉtabỉne tăng từ 12 (25%) ụg.giờfml ở bệnh nhân có chửc nãng thận binh thường,
đến 20 (6%) ưg.giờ/ml ở bệnh nhãn suy thận nhẹ, 25 (23%) ụg.giờ/ml ở bệnh nhân Suy thận trung bình vả 34
(6%) pg.giờlmi ờ cảc bệnh nhân Suy thận nặng.
Nồng độ tenofovir trung bình (%CV) đã tăng từ 2185 (12%) ụggiờ/ml ở bệnh nhân có chửc năng thận bình
thường, lên 3064 (30%) ng.giờlml ở bệnh nhân suy thận nhẹ, 6009 (42%) ng.gỉờ/ml ở bệnh nhân sny thặn'trung
bình vả 15985(45%)11g.giờlm1 ở cảc bệnh nhân suy thặn nặng.
Khoảng cảch giữa hai lần dùng thuốc kéo dải hơn đối với viên nén Tenofovir disoproxil fumarate vả emtricỉtabine
300/200 mg được cho là sẽ tạo ra nồng độ đỉnh trong huyết tương cao hơn vả nồng độ Cmin thẳp hơn ở bệnh nhân
suy thặn mức trung bình so vởi bệnh nhân có chức nãng thận bình thường. Ý nghĩa lâm sảng của phát hiện nảy
hiện chưa rỏ.
Ở những bệnh nhân bị bệnh thận giai đoạn cuối (ESRD) (CrC1 < 10 lnl/phủt) cần phải thẩm tảch mảu, nồng độ
thuốc giữa các lần thẩm tách tăng đáng kể trong 72 giờ lẽn tới 53 (19%) ưg.giờfml đối với emtricỉtabine vả tmng
hơn 48 giờ iên tới 42857 (29%) ng.giờlml đối với tenofovir.
Nên điều chỉnh khoảng cách giữa hai lần dùng viên nén Tenofovir disoproxil fumaratẹ vả emtricỉtabine 300/200
mg ở những bệnh nhân có độ thanh thải creatinin nằm trong khoảng 30 - 49 mllphút. Viên nén Tcnofovir
disoproxil t`umarate vả emtricỉtabine 300/200 mg không thích hợp sử dụng trên các bệnh nhân có CrC1 <30
mllphủt vả các bệnh nhân thẳm phân lọc máu,
Suy gan: _ ' . <Ỹ/
Dược động học viên nén Tenofovir disoproin fumarate vả emtricỉtabine 300/200 mg khôrig được nghiên cứu trên
bệnh nhân suy gan. Tuy nhiên, không cần phâi điều chỉnh liều viên nén Tenofovir disoproin fumarate vả
emtricỉtabine 3001200 mg trên các bệnh nhân suy gan.
Không nghiên cứu dược động học của emtricỉtabine trên cảc bệnh nhân không nhiễm HBV suy gad'mức độ khác
nhau. Nhin chung dược động học cũa emtricỉtabine tương tự nhau trên cảc bệnh nhân nhiễm HBV, cảc đối tượng
khoẻ mạnh và bệnh nhân nhiễm HIV.
Một Iiều duy nhất tenofovir disoproxil 245 mg được dùng cho cảc bệnh nhân không nhìễm HIV suy gan mức độ
khảo nhau được xảc định theo cảoh phân loại Child-Pugh-Turcotte (CPT). Dược động học cùa tenofovir thực chẳt
không bị thay đổi đảng kể ở cảc đối tượng bị suy gan, điều nảy gợi ý rầng không cần điều chinh liều ở các bệnh
nhân nảy. Cảc giá trị trung bình nồng độ tenofovir (%CV) Cmax vả AUC… tương ứng là 223 (34,8%) ng/ml vả
2050 (50,8%) ng.giờhnl ở những bệnh nhân chức năng gan binh thường, so vởi 289 (46,0%) ng/mi vả 2310
(43,5%) ng.giờlml ở những bệnh nhân suy gan mức độ trung bình và 305 (24,8%) 11ng và 2740 (44,0%)
ng.giờlml ở những bệnh nhân suy gan nặng.
15
z.'IẸC \…
C ảc sô Ìíệu an Ioản tíên Ìâm sảng:
Không có dữ iiệu lâm sảng cùa emtricỉtabine cho thấy có rủi ro đặc biệt cho con người dựa trẽn các nghiên cứu
thông thường về độ an toản, dược lý, độc tinh khi dùng iiều nhắc lại và độc tính trên gen. Emtricitabine không cho
thẳy khả năng gây ung thư trên cảc nghiên cứu về khả nãng gây ung thu khi dùng thuốc theo đường uống tiến
hảnh trong thời gian dải trên chuột nhắt vả chuột cống.
Cảo nghiền cứu tiền lâm sảng của tenofovir disoproxil trên chuột cống, chó vả khi cho thẳy tảo dụng lên các cơ
quan đỉch lả đường tiêu hoả, thận, xương và giảm nồng dộ phosphat huyết thanh. Độc tính với xương được chẩn
đoán lá nhuyễn xương (khỉ) và gỉảm tỷ trọng xương (chuột cống và chó). Những phảt hiện ở chuột cống và khi
chỉ ra rằng có sự gìảm hấp thu phosphat liên quan đến tenofovir trong hấp thu phosphat ở ruột, dẫn đến giảm tỷ
trọng xương thứ phát. Tuy nhiên, hiện chưa hiểu rõ hoản toản về cơ chế của cảc độc tính nảy.
Cảo nghiên cứu về độc tinh trên sinh sản đã được tiến hảnh vởi emtricỉtabine vả tenofovir disoproxil fumaratc cho
thẩy khỏng có rủi ro dặc biệt cho người.
Cảo nghiên cứu độc tính trên gen chỉ ra rằng tenofovir disoproxil fumarate dương tính trong hai trong số ba thử
nghiệm in vilro, nhưng âm tinh với thử nghiệm vì nhân in vt'vo,
Tenofovir disoproxil fumarate không cho thắy bất kỳ khả năng gây ung thư nảo trong nghiên cứu gây ung thu
dùng đường uống kéo dải ở chuột cống… Một nghiên cứu gây ung thư dùng đường uống kéo dải ở chuột nhắt cho
thấy một tỷ lệ thấp 11 tả trảng, được coi là có khả năng iiên quan đến nồng độ cao cùa tenofovir disoproxil
fumarate trong đường tiêu hóa với liều 600 mg/kg/ngảy. Trong khi cơ chế hinh thảnh khối u lả khộng chẳc chắn,
những phát hiện nảy ít có khả năng liên quan đẽn con người.
Trong thử nghiệm về ung thư hạch bạch hưyết tiến hảnh trên chuột nhắt t'n vitro với emtricỉtabine vả tenofovir
disoproxil fumarate, kết quả thu dược tương dương với kết quả thu dược khi tiến'hảnh với riêng tcnof`ovir
dỉsoproxìl i'umaratc. Viên phối hợp Tenofovir disoproxil fumarate vả emtricỉtabine 300/200 mg cho kết quả âm
lính trong thử nghiệm tinh đột biến ngược ở vi khuẩn (thử nghiệm Ames). (ỉ/
Một nghiên cứu trên chó tiến hảnh trong 1 thảng cho thẳy viên nén phối hợp emtricỉtabitie va enofovir disoproxil
fumarate không lảm tảng độc tính so vởi khi dùng riêng biệt tùng thảnh phần.
Quá liền và cách xử trí:
'1'rong trường hợp quá liều, cân theo dõi cảc dâu hiệu ngộ dộc vả ảp dụng dìẽu trị hỗ trợ tiêu chuẩn nẻu cần.
Khoảng 30% emtricỉtabine vả xấp xỉ 10% tenofovir có thế được loại bỏ bởi thấm phân iọc máu Chưa rõ iả liệu
emtricỉtabine hay tenofovir có thể được loại bỏ bởi thẩm tách mảng bụng hay không.
Điều kiện bảo quân:
Bảo quản ở nhiệt dộ không quá 30°C.
Hạn dùng của thuốc:
24 thảng kể từ ngảy sản xuất.
Tên, địa chỉ của tô chửc, cá nhân chịu trảch nhiệm về thuốc:
'l`hông tin nhà sản xuât
16
Ớll
* -fùnO [
AUROBINDO PHARMA LIMITED
Địa chỉ:
Văn phòng: Plot No. 2, Maitrivihar, Ameerpet, Hyderabad - 500 038, Andhra Pradesh, india
Nhà máy: Unit — III, Survey. No.313 & 314, Bachupally Village, Quthubuilapur Mandal, Ranga Redđy District,
(A. P.), lndia
Công ty nhập khẩu và phân phổi: qă/
Ngảy 9.4.2013
Thay mặt Aurobindo Pharma Limited
TUQ. C_ỤC TRUỞNG
P.TR UONG _PHÒNG
Jiỷuyễn inty ininỵ
]7
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng