




















— -…8 iݲt
CL'C Q1'AN LÝ DUOC CF ` Bọ Y TE
.. A A C IL, l «' ’ v.
DA PHE DUYẸT ĐÃ Ệch\ LY Dchc
Ế Pi~iAii E DUỵJẸT
ltiin đẩU:oiếĩJ…lẢ./amitễu L
BỘYTỂ
4 TẬI THÀNH PHÊ
:mgq
nnm
"ÊL'
NDC 65062—421-30 End: Glm cunuđ uth …ủm NDC 65862421—30 " \ Mc lủ fÙ N'ỉ 1'JMDIAPBSFR
g …… rư::zxzưzzmưzrzzmx ;; …… ~:z*-z……a
_ Cdcur: Titliủfll đ'múdm . Unit III. Slưvcy llo. 31.1 L 114 nutmiy Vlaoe.
Tenofovu r Do … st… …… :ưc Comp rlmés Out…th W. mm Reddy Dishict tn pi
_ _ Kup ứu cum… untnly cìxd mm
Dlsoproxll x……mmommumu de Fumarate mmẳỉtn: … n……
. _ _ Flo! No Z ' ` u, Hyđen nơ.
Fumarate '…"t'ỉỉ'ảĩl'hắi’Z'iầrtĩzmm'w’ ""“ "" de Ténofovur ““"”
Tablets "wmm ……m ' Disoproxỉl
CMQInWMMouIM VÌỪ'ỈỦƯHIIIãI'I phụ
3 0 0 m g 300 m 61 Iurame de tcmlovư nmuuxi. qui 3 00 [11 g
en l’mwdml « us mu đc t…… a…nu
30 Ĩab|ets Cdnum dia… út tỉunc 30 COÍI’IĐÍỈMS _”
A cm… ả um lưnnnuuul … lbaunt
pls 30°C.
9 Mn'muir ln ttuccn tuml. iọ
AUHOBINDO ĩmtn nnn n Il mee « I: ll Vu: @ cMmu. AUROBINDO
lnđnutinm. … on nardu ct uocautionr im
* hmun IVIIII uuinlnon. "
ỉ m ns ninsssn u nosz mscanz =
Bt
ĩcnotovir Disopmxil
Fumante Tálds l
Cumptimés de Fumarate
đe Ténotovir Disoproxỉl
300 mg
an nu… I am
“1 |
N5152x64x88m
\JLIlHHHÌIHJ
IPantone .3275 C I Pantone Blue 0720 I Bladt
l___ ỳđ _
Pmluct Ỉlllle CIIIIỊOIIIII nm cua m & mu
Ẩ> Tenutovit Disoproxtt Garton (30’s) P101 23.08.2012 & 2.30 pm
AU ROBINDO t:mntưy thnll llo. R…I ct Im n… | MW W
Pacmm Dmmpmm Pepiat Wetnam (ch) ou Suhtnission
Tum Lnlct K Ram Gopal Dlmnslcns Gulnun :
Inttlatcr Pman 52x64x88 mm IPdrĩcne ma C
M… Vìsion anhíc Pham: mu: 22— I Pantone Blue mzc I Black
Mtlilill'lll InIcnnillon :
Sign & Date
_l
Elch tilm coltod tiblot contains:
300 mg ot tenofovir disoproxil tumurute. which is
equivalent to 245 mg nf tanoiovir disoproxil
Colour: Titanium dioxide.
Do not store ubovc 30“C,
Keop tho container ttghtly closed.
Keep out oi the reach und siuht of children.
lndtcatrons. Warmngs & Frecautions: Read tho
packuge luflet bctcre use.
NOT T0 EXCEED PRESCFIIBED DOSAGE
ChIun comprlmđ pelltcule' contient:
300 mg de tumamtc de ténotovir disoproxil. qui ost
I'équivalent de 245 mg đo tớnotovir discprcxil
Colorant : dioxde dc titano
A conurvor ả une tcmpemturo ne dépassant pas 30°C.
Maintanir le flacon termé.
Tcnir hch de in portđc ct de in vuc dos eniants.
Indicatlons, muscs en gardc ot precautions: lim
NDC 65862—421-30
POM
Tenofovir Disoproxỉl
Fumarate Tablets |
Comprimés de Fumarate
de Ténofovir Disoproxỉl
300 mg
30 Tablets | Comprimés
ể’
AUROBINDO
Batch NoJLct.
Mfg. Date)
Dctc Do Fabr
Expiry Dath
Date De pđremptlcn :
M.L. No.] Ltcence Fab. N“: 19|HDIAPISSIFIR
Munuhclurcđ by I Flhthwđ uu:
AUROBINDO PHARMA LIMITED
Unit III, Survey No. 313 & 314 Bachupatty Village. Outhubutlapar Mandal.
Ranga Rcdđv Distnct. (A.PJ IMDIA
Corpolutc Offlcc | Siògc soclal:
Plct No.2. Maitrivihar Comptex. Hydcrabad. 500 038 (A.P.) INDIA
P141
la noticc uvant utilisction. _ 'ỆỆ
NE PAS DEPASSER LA DOSE PRESCRITE. 3-
1—
A/s : 115 x 40 mm
IPantoma 3275 C I Pantone Blue 072C I Black
Product Name Componont ltcm cm Date & Tlmc
Ả) Tenofovir Disoproxỉl Label (30's) P141 23.08.2012 & 2.30 pm
AUROBINDO Country Vcrslon No. Roason ot Issue Rov1mcd/Approvcd by
Packa “n De 810 m nt
gi g v p 8 PeptarVietnam (Aw's) 00 Submission
Tum Leader K Ram Gopal Dlmcnslons Ctilours :
Ồ\
lnttlator Pratap 115 x 40 mm lt›nnnnc _`;2 ta ,/ _ ụ js\
. I Pantone Btue 0726 , , ,, r Ễ <\\o\\
Artist Vision Graphic Pharma Codcz22— I eiack /f / o. 1 `Ễ xỉ
) l'ì * _Í “
. ;14 15 *: -_ 'f' _,
Ađđltlonal lntormatlon. \\ \ Ẹ % m Ễ . .
Sign&Date " \ f P 2 o 1
.ỉ , ) *
\\… ' /
—Ệ
r/Í
NHÂN PHỤ TIẾNG VIỆT
\\
-® VĂN PHÒNG
fiỰL—ỈO ĐAi`DiÊN Ệ_`
<111Ể1 1HẢNHPHỐ ›
Rx Thuốc bán theo đơn `-.… = HỔ CHị' MINH IÍ
\ * _ )
ù
Tên thuốc : TENOFOVIR DISOPROXIL FUMARATE 300MG TAÉIĨÊTS
Hoạt chẩt, hâm lượng : Mỗi viên nén bao phim chứa:
- Tenofovir Disoproxỉl Fumarate ............... 300mg
tưong đương với 245mg Tenofovir Disoproxỉl
Quy cách đóng gói : Hộp x 1 lọ x 30 viên nén
Chỉ định, cách dùng, chống chỉ định: Xin đọc trong tờ hưởng dẫn sử dụng kèm theo.
Dạng bâo chế : Viên nén bao phim
SĐK : Số lô sản xuất:
Ngảy sản xuất : Hạn dùng:
Điều kiện bảo quản : Bảo quản ở nhiệt độ không quá 30°C. Ộ/
Công ty sản xuất : Aurobindo Pharma Limited
Địa chỉ : Unit-Ill, Survey. No.313 & 314, Bachupally Village,
Quthubuliapur Mandal, Ranga Reddy District, Andhra Pradesh, india
Công ty nhập khẩu
Địa chí
Xuất xứ : Ẩn Độ
Ca'c lhông tin khác đề nghị xem rroug tờ hướng dẫn sử dụng kèm theo. Đọc kỹ hướng dẫn sử dụng
trước khi dùng.
Đế xa tẩm tay trẻ em.
TỜ HƯỚNG DĂN sử DUNG
Viên nén tenofovir disoproxil fumarat 300 mg
Thuốc nảy chỉ dùng theo đơn của bảc sỹ.
Tên thuốc:
Viên nén tenofovir disoproxil fumarat 300 mg
Thânh phần, công thức cho một đơn vị đóng gói nhỏ nhẩt:
Môi viên nén bao film chứa:
' Tenofovir disoproxil fumarat ............. 300 mg
tương đương với 245 mg tenofovir disoproxil. Ộ/
Croscarmellose natri, Iactose monohydrat, cellulose vi tinh thể, tinh bột tiền gelatin hóa, magnesi
Tá dược:
stearat, Opadry 11 white 32K18425 (gồm có Iactose mohohydrat, hypromellose, titan dioxid vả
triacetin).
Dạng bâo chế của thuốc:
Viên nén tenofovir disoproxil fumarat lả viên nén bao film mảu trắng đển trắng nhạt, khắc chủ “1“
trên một mặt và “36“ trên mặt kia.
Quy cách đỏng gói: Hộp x 1 lọ x 30 viên
Chỉ định:
Viên nén tenofovir disoproxil fumarat được sư dụng để điều trị virus gây suy giảm miễn dịch ở ngưòi
(HIV) cho người từ 18 tuổi trở iên.
Viên nén tenofovir disoproxil fumarat cũng được sử dụng để điều trị viêm gan B mạn tính do virus
viêm gan B (HBV) ở người Iởn.
Liều dùng, cách dùng, đường dùng:
Liều dùng:
Nên khời đầu điều trị với bảo sỹ có kinh nghiệm điều trị HIV vả/hoặc viêm gan B mạn tính.
Người Iởn:
Liều khuyến cảo để điều trị HIV hoặc viêm gan B mạn tinh là một viên x một Iầrưngảy, uống cùng
với thức ăn.
Viêm gan B mạn tính:
Thời gian điều trị tối ưu chưa được biết rõ. Ngưng điều trị có thế được xem xét như sau:
' Với các bệnh nhân HBeAg dương tính không có xơ gan, điều trị nên ít nhất lả 6-12 tháng sau
khi đã có chuyển trạng thải HBe huyết tương (HBeAg vả HBV DNA âm tính, kháng HBE
dương tinh) hoặc thấy thuốc không có hiệu quả (xem phần 4.4). Cần kiếm tra ALT vả HBV
DNA huyết thanh thường xuyên tiểp theo sau khi ngưng điều trị để phát hiện bất kỳ tái phát
nảo của virus.
I Với các bệnh nhân HBeAg dương tính không có xơ gan, điếu trị nên ít nhất là cho đến khi có
chuyển trạng thái HBe huyết tương hoặc có bằng chứng thuộc không có hiệu quả. Với điều trị
kéo dải trong hơn 2 năm, cần thường xuyên đảnh giá lại để xác nhận việc tiếp tục điều trị vẫn
còn thích hợp cho cảc bệnh nhân.
Đối với !re’ em vả thanh thiếu niên: ã , '.
Không được dùng viên nén tenofovir cho trẻ em và vị thảnh niên dưới 18 tuổi do chưa có đủ dữ liệu _'—.:r
về an toản và hiệu quả của tenofovir disoproxil fumarat.
Người giâ:
Không có dữ liệu để đưa ra liều khuyến cáo đối với bệnh nhân trên 65 tuổi.
Suy thận:
Tenofovir được thải trừ qua thận vả nồng độ cùa tenofovir tăng lên ở những bệnh nhân có chức năng
thận suy giảm. Chi có những dữ liệu hạn chế về an toản vả hiệu quả cùa tenofovir disoproxil fumarat
ở bệnh nhân suy thận vữa và nặng (thanh thải creatinin < SOml/phút) và các dữ liệu an toản dải hạn
chưa được đánh giá cho bệnh nhân suy thận nhẹ (thanh thải creatinin 50-80 ml/phủt). Do đó, ở bệnh
nhân suy thận tenofovir disoproxil fumarat chỉ nên sử dụng nếu lợi ích của điều trị lớn hơn nguy cơ
tiềm tảng. Nên điều chinh khoảng cách giữa các lần dùng cho các bệnh nhân có thanh thải creatinin <
50 ml/phút.
Suy thận nhẹ (thanh thải creatinin 50-80 mI/phủt):
Các dữ liệu hạn chế từ các nghiên cứu lâm sảng ủng hộ dùng Iiểu tenofovir disoproxil fumarat một
Iầnlngảy ở bệnh nhân suy thận nhẹ.
Suy rhận độ vừa (thanh thải creatinine 30-49 mI/phút):
Khuyên dùng 245 mg tenofovir disoproxil (dạng fumarat) mỗi 48 gỉờ dựa trên mô hình của các dữ
lìệu dược động học đơn liều ở cảc cá thể không nhiễm HIV và không nhiễm HBV với mức độ suy
thận khác nhau, bao gồm cả bệnh thận giai đoạn cuối đòi hỏi phải thấm tách mảu, nhưng chưa được
xác nhận trong các nghiên cứu lâm sảng. Do vậy, phải theo dõi chặt chẽ đáp ứng lâm sảng với điều
trị và chức năng thận ở những bệnh nhân nảy.
Suy thận nặng (thanh thải creatinin < 30 mI/phủl) vả bệnh nhân thẩm tăch máu:
Khó điều chinh liều cho thoả đáng vi không có các hảm lượng khảo, do đó không khuyên dùng cho
nhóm bệnh nhân nảy. Nếu không có trị liệu thay thế, có thể kéo dâi khoảng cách giữa cảc lỉều như
sau:
' Suy thận nặng: 245 mg tenofovir disoproxil (dạng fumarat) mỗi 72-96 giờ (dùng liều hai
iần/một tuần).
' Bệnh nhân thầm tảch mảu: 245 mg tenofovir disoproxil (dạng fumarate) dùng 7 ngảy một lần
sau khi hoản thảnh một phiên thẩm tách máu*. c
Những điều chỉnh liều lượng nảy chưa được xác nhận trong cảc nghiên cứu lâm sảng. Mô phòng cho
thấy rằng kéo dải khoảng cách giữa các liều không phải là tối ưu và có thể dẫn đến tăng độc tính Ỹả
đáp ứng có thế không đầy đù. Do vậy, phải theo dõi chặt chẽ đáp ứng lâm sảng với điều trị vả chữc /
năng thận ở những bệnh nhân nảy.
* Nói chung, dùng một Iần/tuần vởi gỉả định ba buổi thẳm tảch mảu mỗi tuần, mỗi lần thấm tách máu
khoảng 4 giờ hoặc sau 12 giờ thấm tách mảu tích iũy. Không có khuyến cáo về liều nảo cho cảc bệnh
nhân không thấm tách mảu với thanh thải creatinin < 10 ml/phủt.
Gan: W
Không cần phải điều chinh liều ở bệnh nhân suy gan.
Nếu ngững dùng tenofovir disoproxil fumarat ở bệnh nhân viêm gan B mạn tính có hoặc không có
đồng nhiễm HIV, những bệnh nhân nảy cần được giám sát chặt chẽ cảc biều hiện bộc phảt viêm gan.
Cách dùng vả đường dùng:
Luôn Iuôn sử dụng viên nén tenofovir disoproxil fumarat đủng như hướng dẫn của bảc sỹ. Nếu không
nhớ, cần hòi lại bác sỹ hoặc dược sỹ.
Liều thông thường viên nén tenofovir disoproxil fUmarat cho người lớn lả một viên x một lần/ngảy
cùng với bữa ăn hoặc bữa ăn nhẹ. Không dùng cho trẻ em dưới 18 tuối. Nếu bạn khó nuốt viên thuốc,
có thể dùng thìa nghiền viên thuốc và trộn bột thuốc với khoảng 100m1 nước, nước cam hay nước
bười và uống ngay.
- Phải luôn dùng đúng liều chỉ định.
' Nếu có vấn đề về thận, bác sỹ có thế chỉ định dùng ít lần hơn.
' Không được ngừng bẩt kỳ thuốc chống HIV được kê đơn nảo khi bắt đầu dùng viên nén
tenofovir disoproxil fumarat nếu bị nhiễm cả HIV vả HBV.
- Nếu bị nhiễm HBV, bác sỹ có thể yêu cầu lảm xét nghiệm mv xem có bị mắc cả HIV vả
HBV không.
Xem hưởng dẫn sử dụng các thuốc khảng retrovirus khác để biết cảoh dùng cảc thuốc nảy.
Nếu bạn uống nhiều viên nén tenofovir disoproxil fumarat hơn liều đă kê:
Nều bạn vô tình uống quá nhiều thuốc, bạn nên thông báo cho bác sỹ cùa bạn hoặc liên hệ với khoa
cấp cứu bệnh viện gần nhất đế có lời khuyên phù hợp. Giữ lọ thuộc để có thể kể lại mình đã uộng bao
nhiêu.
Nếu bạn quên uống viên nén tenofovir disoproxil fumarat
Nếu bạn quên không uống thuốc, hãy uống lại ngay khi bạn nhớ ra, sau đó tiếp tục sử dụng thuốc như
trưởc. Không được uống gấp đôi liều để bù lại cho liều đã quên.
Nếu bị nôn trong vòng 1 giờ sau khi uống viên nén tenofovir disoproxil fumarat, uống thêm 1 viên
khác. Không cẩn uống thêm nếu bị nôn sau 1 giờ.
Nếu ngững dùng viên nén tenofovir disoproxil fumarat: q\/
' Không được ngừng dùng viên nén tenofovir disoproxil fumarat mả không có ý kiến của bác
sỹ. Ngừng dùng viên nén tenofovir disoproxil fumarat có thế iảm giảm hiệu quả trị liệu.
Thông báo cho bác sỹ khi định ngừng dùng viên nén tenofovir disoproxil fumarat vì bất kỳ lý
do nảo, đặc biệt khi bị các tác dụng bất lợi hoặc bị bệnh khác. Hòi bác sỹ khi định dùng 1ạì
viên nén tenofovir disoproxil fumarat.
Nếu bị viêm gan B hay đồng nhiễm HIV và viêm gan B:
' Không được ngừng viên nén tenofovir disoproxil fumarat trừ khi đã hòi bảc sỹ. Xét nghiệm
mảu hay cảc triệu chứng ở một số bệnh nhân cho thấy chứng viêm gan nặng hơn khi ngừng
dùng viên nén tenofovir disoproxil fumarat. Có thể cần thử máu vải tháng sau khi ngừng viên
nén tenofovir disoproxil fumarat. Thông báo ngay cho bác sỹ về cảc triệu chứng mới hay bất
thường sau khi ngừng trị liệu, đặc biệt các triệu chứng liên quan tới viêm gan B.
Nếu có bất kỳ câu hỏi nảo, liên hệ ngay với bác sỹ.
Chống chỉ định:
Chống chỉ định cho những bệnh nhân mẫn cảm với tenofovir hoặc với bất cứ thảnh phần nảo cùa
thuốc.
Thận trọng khi dùng thuốc:
Thuốc nảy không chũa Iảnh nhiễm HIV. Khi uống viên nén tenofovir disoproxil fumarat, vẫn có thể
xuất hiện các nhiễm khuấn vả cảc bệnh khác liên quan tới nhiễm HIV. Cũng vẫn có thể lây truyền
HIV và HBV sang người khảo, do đó cần thận trọng để tránh lây nhiễm sang người khảc.
Không sử dụng Viên nén Tenofovir disoproxìlfumarate:
' Nếu bạn bị quá mẫn cảm (dị ứng) với tenofovir disoproxil fumarat hoặc với bất kỳ thảnh phần
nảo có trong viên nén tenofovir disoproxil fumarat liệt kê trong tờ hướng dẫn nảy. Nếu bạn bị ² ' i
mẫn cảm, hãy báo thầy thuốc ngay vả đừng dùng viên nén tenofovir disoproxil fumarat.
Những cảnh báo vả để phòng đặc biệt khi sử dụng thuốc: ỘV cả
Bác cho bác sỹ nếu bạn đã từng bị bệnh thận hay có vấn đề về thận. Viên nén tenofovir disoproxil
fumarat có thể ảnh hưởng đến thận. Trước khi bắt đầu điều trị, bác sỹ có thế cần xét nghiệm máu để
kiếm tra chức năng thận và cớ thể chi định uộng ít lằn hon. Bác sỹ cũng có thế cần xét nghiệm máu
trong thời gian điều trị để kiềm tra chức năng thận.
Viên nén tenofovir disoproxil fumarat thường không được dùng cùng với các thuốc có thể gây tổn
thương thận (xem dùng các thuộc khác). Nếu bắt buộc phải dùng, bác sỹ sẽ kiếm tra chức năng thận
mỗi tuần một lần.
Thông báo cho thầy thuốc nếu bạn trên 65 tuổi. Viên nén tenofovir disoproxil fumarat chưa được
nghiên cứu ở bệnh nhân trên 65 tuổi. Nếu bệnh nhân trên 65 tuổi cần dùng viên nén tenofovir
dis0proxil fumarat, bác sỹ cần kiềm soát bệnh nhân chặt chẽ.
Không dùng viên nén tenofovir disoproxil fumarat cho trẻ em dưới 18 tuồi.
Thông báo cho bác sỹ nếu có tiền sử bệnh gan, bao gồm cả viêm gan. Bệnh nhân bị viêm gan B hoặc
C mạn và điếu trị với cảc thuốc kháng retrovirus có nguy cơ cao hơn bị các tác dụng bất lợi về gan
nặng có thể gây tử vong. Nếu bị viêm gan B, bác sỹ sẽ cân nhắc liệu phảp điều trị tốt nhất. Nếu có
tiền sử bệnh gan hoặc viêm gan B mạn tính, bảo sỹ sẽ xét nghiệm máu để theo dõi chức năng gan.
Chú ý các dấu hiệu nhiễm acid lactic khi bắt đầu uống viên nén tenofovir disoproxil fumarat. Các dấu
hiệu nhiễm acid lactic bao gôm:
' Thở nhanh, sâu
' Ngủ gả
' Buồn nôn, nôn và đau dạ dảy
Hiếm khi xảy ra phì đại gan nặng và đôi khi gây từ vong. Nhiễm acid lactic thường xảy ra hơn ở phụ
nữ, đặc biệt người béo phì. Người bị bệnh gan có nguy cơ iớn hơn. Khi dùng viên nén tenofovir
disoproin fumarat, bác sỹ phải theo dõi cần thận các triệu chứng nhiễm acid lactic.
Thận trọng để không lây nhiễm sang người khảc: vỉên nén tenofovir dísoproxil fumarat không lảm
giảm nguy cơ lây truyền HIV hay HBV sang người khác qua quan hệ tình dục hay truyền máu, do đó
phải cần thận để tránh lây nhiễm.
Các thận trọng khác:
éịV
Trong điều trị HIV, trị liệu phối hợp kháng retrovirus (bao gồm cả viên nén tenofovir disoproxằx_
\
fumarat) có thề Iảm tăng đường huyết, lipid huyết, thay đổi mỡ cơ thể, và tính khảng insulin (xẹtọềiixf'iị
phần: Tác dụng không mong muốn). ỄN
= PHỐ
Nếu bạn bị tiếu đường, du cân hay cholesterol cao, hãy báo cho bác sỹ. nNH
đằu dùng viên nén tenofovir disoproxil fumarat có thể xuất hiện các triệu chứng nhiễm khuẩn và
viêm, hoặc nặng thêm các triệu chứng. Ngay khi dùng viên nén tenofovir disoproxil fumarat, phải
kiềm tra các dấu hiệu nhiễm khuẩn. Nếu thấy có dấu hiệu viêm, hay nhiễm khuẩn, báo ngay cho bác
sỹ.
Các vấn đề về xương:
Một số bệnh nhân HIV dùng trị liệu phối hợp khảng retrovirus có thể bị hoại từ xương. Thời gian trị
liệu, sử dụng corticosteroid, uống rượu, suy giảm miễn dịch nặng, chỉ số khối cơ thể cao...có thế nằm
trong số nhiều yếu tố nguy cơ xuất hiện bệnh nảy. Dấu hiệu hoại từ xương gồm cứng khớp, đau khớp
(đặc biệt khớp hông, đầu gối vả vai) và khó vận động. Nếu thấy có các triệu chứng nây phải báo ngay
cho bảo sỹ.
Các vấn đề về xương (đôi khi dẫn đến gãy xương) có thể xảy ra do tổn thương tế bảo ống thận (xem
phần: Tác dụng không mong muốn).
Dùng các thuốc khác:
Không dùng viên nén tenofovir disoproxil fumarat nếu đang uống một thuốc khác chứa tenofovir
disoproxil fumarat. Không dùng cùng túc viên nén tenofovir disoproxil fumarat vả adefovir dipivoxil.
Thông báo cho bác sỹ nếu bạn đang hay vừa dùng cảc thuốc khảc, bao gồm cả cảc thuốc không cần
kê đơn.
Đặc biệt phải thông báo cho bác sỹ nếu đang dùng các thuốc khác có thể gây hại thận, bao gồm:
6
Kiếm tra các dẳu hiệu nhiễm khuẩn: bệnh nhân bị H1Vtiếntríền(AlDS) và bị nhiễm khuẩn khibắt ,
j
1
/
m
@ 1
| "
' Aminoglycosid, pentamidin hay vancomycin (để chống nhiễm khuẩn)
' Amphotericin B (để trị nhiễm nấm)
' Foscarnet, ganciclovir, hay cidofovir (để trị nhiễm virus)
' lnterleukin—Z (điều trị ung thư)
~ Adefovir dipivoxil (điều trị HBV) qi/
' Tacrolimus (ức chế miễn dịch)
I Cảc thuốc khảo chứa dìdanosin (dùng điều trị HIV): Dùng viên nén tenofovir disoproxil
fumarat với cảc thuốc kháng virus chứa didanosin có thề lảm tăng nồng độ didanosin trong
máu và giảm tế bảo CD4. Hiếm khi có viêm tụy và nhiễm acid 1actic đôi khi gây tử vong đã
được báo cáo khi dùng đồng thời các thuốc chứa tenofovir disoproxil fumarat vả didanosin.
Bác sỹ cần thận trọng khi dùng kết hợp tenofovir vả didanosin.
' Không ngừng dùng các thuốc chống HIV khác mà bảc sỹ đã kế khi bắt đầu dùng viên nén
tenofovir disoproxil fumarat cả cho nhiễm HIV và HBV.
I Nên dùng viên nén tenofovir disoproxil fumarat cùng với thức ăn.
Sử dụng trên phụ nữ có thai và cho con bú
Hòi bảo sỹ trước khi dùng bất kỳ thuộc gi khi mang thai hoặc cho con bủ.
Không nên dùng viên nén tenofovir disoproxil fumarat khi mang thai trừ khi đã thảo luận kỳ với bác
sỹ. Không có dữ liệu sử dụng viên nén tenofovir disoproin fumarat cho phụ nữ mang thai và không
nên dùng trừ khi thực sự cần thiết.
Không nên có thai khi đang dùng viên nén tenofovir disoproxil fumarat. Nên dùng biện pháp trảnh
thai.
Hảy thông bảo cho bác sỹ của bạn biết nểu bạn đang có thai hoặc dự định có thai để đánh giá về cảc
tảc dụng bất lợi tiềm tảng, cảc nguy cơ và lợi ích cùa điều trị kháng retrovirus cho người mẹ vả thai
nhi.
Nếu dùng viên nén tenofovir disoproxil fumarat trong thời kỳ mang thai, bác sỹ cần lãm các xét
nghiệm mảu định kỳ vả các chẩn đoán khảo để kiềm tra sự phảt triền cùa thai nhi. Với cảc trẻ em có
mẹ dùng cảc thuốc giống viên nén tenofovir disoproxil fumarat (NRT1) trong khi có thai, lợi ích
phòng nhiễm virus lả Ión hơn nguy cơ tác dụng bất lợi.
Không nên cho con bú khi dùng viên nén tenofovir disoproxilfumarat:
Không biết tenofovir disoproxil fumarat có thế đi vảo sữa mẹ không. Các phụ nữ nhìễm HIV/HBV
không nên cho con bú để tránh nguy cơ truyền virus sang con.
Ấnh hưởng của thuốc khi lái xe và vận hảnh máy móc:
7
Viên nén tenofovir disoproxil fumarat có thể gây chóng mặt. Nếu bạn thấy chóng mặt khi dùng viên
nén tenofovir disoproxil fumarat, đừng lái xe hay vận hảnh máy móc.
Các thông tin về cảc thảnh phần trong viên nén tenofovir disoproxil fumarat: Viên nén tenofovir
disoproxil fumarat chứa lactose. Thông bảo cho bảc sỹ nếu bạn không dung nạp được Iactose hay các
đường khảo.
Tương tác của thuốc với các thuốc khác và các loại tương tác khác: ậ/
Các nghiên cứu tương tác thuộc mới chi được thực hiện ở người lớn.
Dựa vảo kết quả thí nghiệm in vitro và đường thải trừ được biết cùa tenofovir, khả năng tương tác qua
trung gian CYP4SO giữa tenofovir với các thuốc khảc là thấp.
Các phối họp không nên sử dụng:
Viên nén tenofovir disoproxil fumarat không nên dùng với bất kỳ thuốc nảo khác có chứa tenofovir
disoproxil fumarat.
Viên nén tenofovir disoproxil fumarat không được dùng đồng thời với adefovir dipivoxỉl. Không nên
dùng cùng tenofovir disoproxil fumarat vả didanosin.
Các thuốc thải trừ qua thận:
Do tenofovir chủ yếu thải trừ qua thận, dùng cùng tenofovir đisoproxil fumarat với cảc thuốc lảm
giảm chức năng thận hoặc cạnh tranh bải tìết tich cực qua ống thận thông qua các protein vận chuyến
hOATI, hOAT3 hoặc MRP 3 hay 4 (ví dụ như cidofovir) có thề Iảm tăng nổng độ trong huyết thanh
cùa tenofovir vảlhoặc cảc thuốc dùng đổng thời.
Nên tránh việc sử dụng tenofovir disoproxil fumarat đồng thời hoặc gần đồng thời với cảc thuốc gây
độc thận, ví dụ như aminoglycosid, amphotericin B, foscarnet, ganciclovir, pentamidin, vancomycin,
cidofovir hoặc interleukin—2.
Vì tacrolimus có thể ảnh hưởng đến chức năng thận, cần giám sát chặt chẽ khi dùng phối hợp với
tenofovir disoproxil fumarat.
Cảc tương tác khác:
Tương tác giữa tenofovir disoproxil fumarat và các thuốc ức chế protease vả các thuốc kháng
retrovirus khác được liệt kê trong bảng 1 dưới đây (tăng được ký hiệu là "T“, giảm là "1", không có
thay đội là "",… hai Iần/ngảy lả "bid", vả một Iần/ngảy lả "qd").
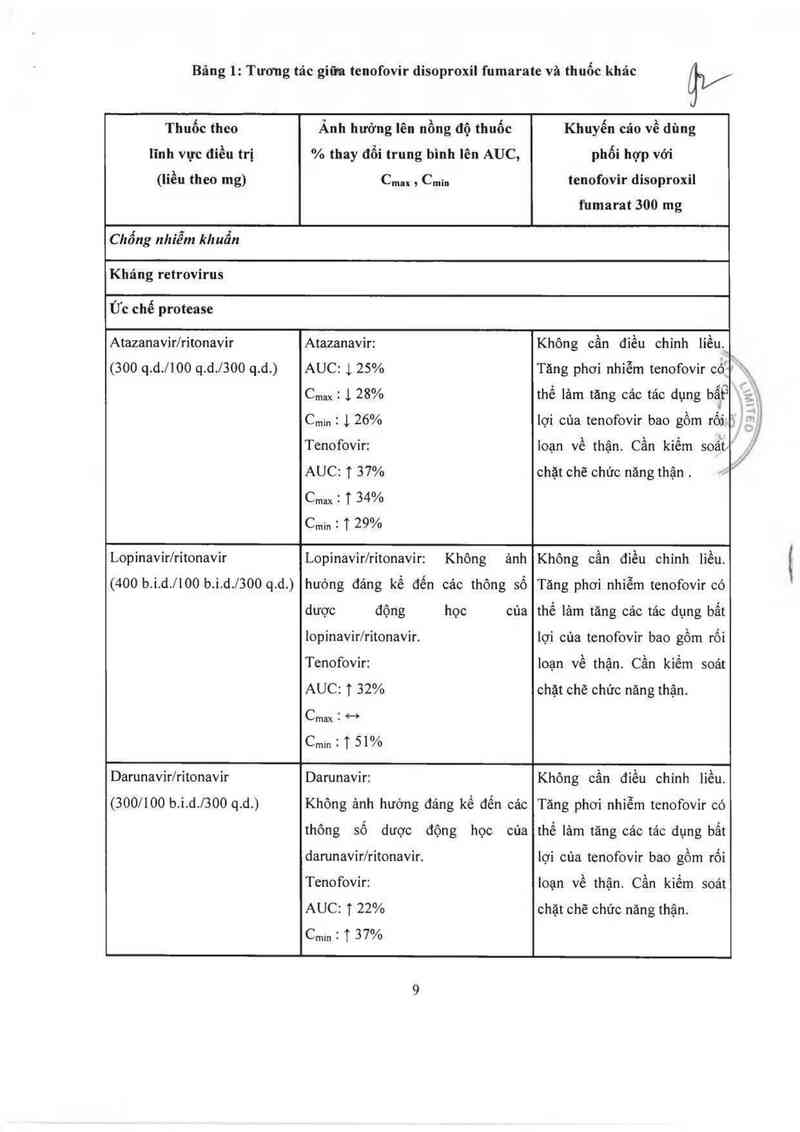
Bảng 1: Tương tác giũa tenofovir disoproxil fumarate và thuốc khảc
iV
Thuốc theo
lĩnh vực điểu trị
Ành hưởng lên nồng độ thuốc
% thay đổi trung bình lên AUC,
Khuyến cáo về dùng
phối hợp với
(liều theo mg) Cmax ; Cmin tenofovir disoproxil
fumarat 300 mg
Chống nhiễm khuẩn
Kháng retrovirus
Ức chế protease
Atazanavir/ritonavir Atazanavir: Không cần điều chinh liều.`
(300 q.d.l100 q.d./3OO q.d.) AUC: 1 25% Tăng phơi nhiễm tenofovir có’
Cmax : 1 28% thế lâm tăng các tác dụng bấỀ
Cmin : 126% iợi cùa tenofovir bao gồm rổii ²1 '
Tenofovir: ioạn về thận. Cẩn kiếm soấtl
AUC: T 37% chặt chẽ chức năng thận .
Cmax : T 34%
Cmin : T 29%
Lopinavir/ritonavir Lopinavir/ritonavir: Không ảnh Không cần điểu chỉnh liếu.
(400 b.i.d./IOO b.i.d.l3OO q.d.)
hưởng đảng kế đến các thông số
dược động học cùa
lopinavir/ritonavir.
Tăng phơi nhiễm tenofovir có
thế iảm tăng các tác dụng bất
~ . . ; Ả-
lỢ1 cua tenofovư bao gom …
Tenofovir: loạn về thận. Cần kiếm soát
AUC: T 32% chặt chẽ chức nãng thận.
Cmax Í °"
Cmm 2 T 51%
Darunavirlritonavir Darunavir: Không cần điều chinh liều.
(300/100 b.i.d./300 q.d.)
Không ảnh hướng đáng kể đến cảc
thông số dược động học của
darunavir/ritonavir.
Tenofovir:
AUC: T 22%
Cmin : ị 37%
Tăng phơi nhiễm tenofovir có
thế lảm tãng cảc tảc dụng bẩt
lợi của tenofovir bao gồm rối
toạn về thận. Cẩn kiềm soát
chặt chẽ chức năng thận.
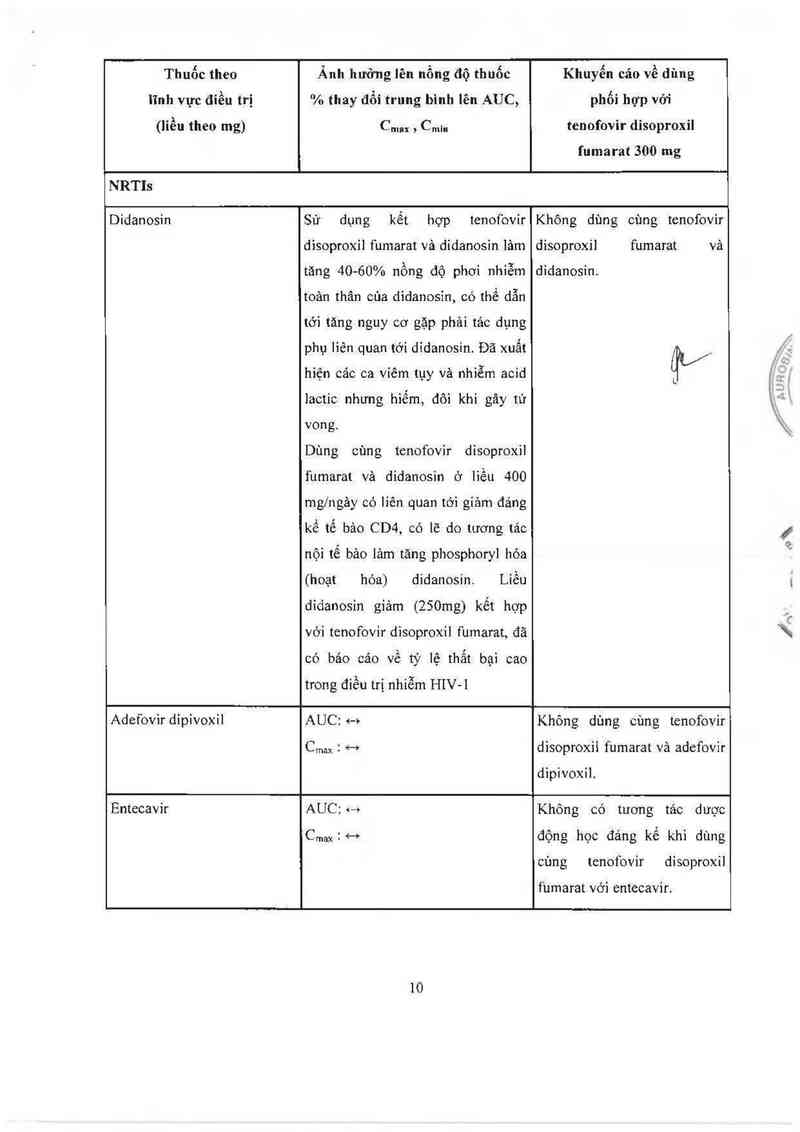
Thuốc theo
lĩnh vực đíều trị
(liều theo mg)
Ảnh hưởng lên nổng độ thuốc
% thay đổi trung binh lên AUC,
Cmax › Cmin
Khuyến cản về dùng
phội hợp vởi
tenofovir disoproxil
fumarat 300 mg
N RTIs
Didanosin
Sử dụng kết hợp tenofovir
disoproxil fumarat vả didanosin lảm
tảng 40-60% nộng độ phơi nhiễm
toản thân của didanosin, có thể dẫn
tới tăng nguy cơ gặp phải tác dụng
phụ liên quan tởi didanosin. Đã xuất
hiện cảc ca vỉếm tụy và nhìễm acid
lactic nhưng hiếm, đôi khi gây tử
vong.
Dùng cùng tenofovir disoproxil
fumarat vả didanosin ở liều 400
mg/ngảy có liên quan tới giảm đáng
kể tế bảo CD4, có lẽ do tương tác
nội tế bảo lâm tăng phosphoryl hóa
(hoạt hóa) didanosin. Liều
didanosin giảm (250mg) kết hợp
với tenofovir disoproxil fumarat, đã
có báo cáo về tỷ lệ thẳt bại cao
trong điếu trị nhiễm HIV-l
Không dùng cùng tenofovir
disoproxil fumarat vả
didanosin.
ựV-
Adefovìr dipivoin
AUC: 4-›
Cmax ễ H
Không dùng cũng tenofovir
dìsoproxii fumarat vả adefovìr
dipivoxil.
Entecavir
AUC: <—+
CmaxịH
Không có tưong tác dược
động học đáng kể khi dùng
cùng tenofovir disoproxil
f“umarat với entecavir.
10
.o\
Các nghiên cửu thực hiện với các thuốc khác:
Không có tương tác dược động học đáng kể trên lâm sâng khi dùng cùng tenofovir disoproxil fumarat
với emtricỉtabin, lamivudin, indinavir, efavirenz, nelfmavir, saquinavir (có kèm rìtonavir),
methadone, ribavirin, rifampicin, tacrolimus, hoặc các thuốc tránh thai hormon như norgestrel/
ethinyl oestradiol.
Tenofovir disoproxil fumarat phải được uống với thức ăn, vì thức ăn giúp tăng khả dụng sinh học cùa
tenofovir.
Tác dụng không mong muốn:
Như tất cả các thuốc khảo, viên nẻn tenofovir disoproxil fumarat cũng có thể gây các tảc dụng không
mong muốn ở một số người:
Rất hay gặp (>1/ 10 bệnh nhân):
' Tiêu chảy, nôn, buổn nôn, chóng mặt
' Giảm phosphat huyết
Hay gặp (<1/10, >1/100 bệnh nhân):
' Đau đầu, đau dạ dảy, mệt mòi, chướng bụng, đầy hơi
Hiếm gặp (<1/1000 bệnh nhân):
~ Nhiễm acid lactic.
Các triệu chứng nhiễm acid 1actic bao gổm:
' Thờ nhanh vả sâu
' Ngủ gả
' Buồn nôn, nôn và đau dạ dảy.
Nếu bạn thấy có các triệu chứng nhiễm acid lactic, đển bảc sỹ ngay.
I Đau vùng bụng do viêm tụy
' Thay đối nước tiếu và đau lưng do vấn đề ở thận, bao gồm cả suy thận
. Nồi ban
' Tăng creatinin máu
' Các vấn đề về gan và tụy
Rất híểm gặp <<…oooo bệnh nhân):
' Thờ nông
' Đau vùng bụng do viêm gan
11
qu
FH
ví… .='
ĐA1 t
Ậ1ThAi
HỔ Ctii'
\
—`:
\ĨẮ
' Cảm thẫy rất mệt mòi
' Tổn thương tế bảo ống thận
Các Iác dụng bất lợi có tltế có khảc:
Có thể có đứt cơ, đau cơ hoặc yếu cơ, mếm xương (đau xương và đôi khi gẫy xương), gan nhiễm mỡ,
viêm thận, tiếu nhiều và khát, giảm kali huyết.
Khi điều trị HIV, trị liệu phối hợp kháng retrovirus (bao gồm viên nén tenofovir disoproxil fumarat)
có thề Iảm thay đổi hinh dảng cơ thể do thay đội phân bộ mỡ. Có thế có mất mở ở chân, tay và mặt,
tăng mở ở bụng vả nội tạng, vú to hoặc bướu mở ở sau cổ (bưởu trâu). Nguyên nhân và hậu quả dải
hạn của các thay đối nảy chưa được biết. Trong điều trị HIV, trị 1iệu phối hợp kháng retrovirus có thế "
Iảm tăng mỡ máu vả khảng insulin. fi
Nếu các triệu chứng nặng hơn, hoặc nếu bị các tảo dụng bất lợi chưa ghi ở đây, hãy bảo ngay cho báềịl
Sỹ“ liiiỉ/i /1
/ …/Í
,J"
J l 1"Jù >_Ịg. ’
(
.'t
/
\
\
Thông bảo cho bác sỹ những tác dụng không mong muốn gặp phăi khi sử dụng thuốc.
Các đặc tính dược lý ậi/
Dược lực học:
Nhóm tác dụng dược lý:
Ức chế enzym sao chép ngược nhóm nucleosid vả nucleotid.
Mã ATC: JOSAFO7
Viên nén tenofovir disoproxil fumarat chứa hoạt chất Tenofovir disoproxil. Hoạt chất nây lả một
thuộc kháng retrovirus dùng để điều trị HIV, HBV hoặc cả hai. Tenofovir là một chất ức chế sao mã
ngược nucleotide (NRTI) vả tác dụng bằng cách ảnh hưởng đến hoạt động bình thường cùa cảc
enzym cẩn thiết cho virus (HIV: reverse transcriptase; virus viêm gan B: DNA polymerase) để tái tạo
chính chúng. Với bệnh nhân HIV, phải dùng viên nén tenofovir disoproxil fumarat kết hợp với các
thuộc khác.
Cơ chế tảc dụng:
Tenofovir disoproxil fumarat lả dạng muối fumarat cùa tiền chất tenofovir disoproxil. Tenofovir
disoproxil được hấp thu vả chuyền thảnh hoạt chất tenofovir, lả một chất đồng đẳng nucleosid
monophosphat (nucleotid). Dưới xúc tác của các enzym trong tế bảo qua hai phản ứng phosphoryl
hóa ở cả các tế bảo T không hoạt động và đã được hoạt hóa tenofovir chuyền thảnh chất chuyến hóa
có hoạt tính, tenofovir diphosphat. Tenofovir diphosphat có thời gian bản thải lả khoảng 10 giờ trong
tế bảo đã hoạt hóa vả khoảng 50 giờ trong tế bảo không hoạt động đối với cảc tế bảo đơn nhân máu
12
ngoại vi (PBMC). Tenofovir diphosphat ức chế polymeras cùa virus bằng cách cạnh tranh gắn trực
tiếp vảo chất nền deoxyribonucleotid tự nhiên, vả kết thúc chuỗi DNA sau khi kết hợp vảo DNA.
Tenofovir diphosphat lả chất ức chế yếu cảc polymeras nội tế bảo u, 13, và y. Trong cảc phép định
lượng in vitro, ở các nồng độ cao tới 300 ụmol/l, tenofovir không thế hiện tác dụng nảo đến quá trình
tổng hợp DNA của ty thế hoặc quá trình sản xuất acid Iactic.
Các lác dụng lên HIV:
Hoạt tính kháng H! V in vitro:
Nồng độ ức chế 50% (leo) cùa tenofovir đổi với chủng HIV-lHtB hoang dại nuôi trong phòng thí
nghiệm là 1—6 ụmol/l ở dòng tế bảo lymphoid vả đối với chùng HIV-l phân nhóm B phân 1ập từ
PBMC là 1,1 umol/l. Tenofovir cũng có hoạt tính chống lại HIV—l phân nhóm A, C, D, E, F, G và 0
và chống lại HIVBaL chủ yếu ở các tế bảo đơn nhân/đại thực bảo. Tenofovir thế hiện hoạt tính in vitro
khảng HIV-2, với ICso là 4,9 ụmol/l ờ cảc tế bảo MT-4.
Người ta đã chọn lọc được trong ống nghiệm và ở vải bệnh nhân (xem kết quả lâm sảng) cảc chủng
K háng rhuốe:
HIV-l có độ nhạy cảm với tenofovir giảm và mang đột biến 1465R ờ enzym sao chép ngược. Không
nên dùng tenofovir disoproxil fumarat cho các bệnh nhân đã điều trị kháng retrovirus mả nhiễm
chùng virus có mang đột biến K65R.
Các nghiên cứu lâm sảng ở các bệnh nhân đã từng dùng các thuốc khảng HIV đã đảnh giả tác dụng
kháng HIV của tenofovir disoproxil 245 mg (dạng fumarat) chống lại các chùng HIV-l kháng với
các thuốc ức chế nucleosid. Cảo kết quả cho thấy bệnh nhân có HIV với 3 hoặc nhiếu đột biển
thymidine-analogue (TAMs) mà bao gồm cả cảc M41 L hoặc L210W bị giảm đảp ứng với tenofovir
disoproxil 245 mg (dạng fumarat).
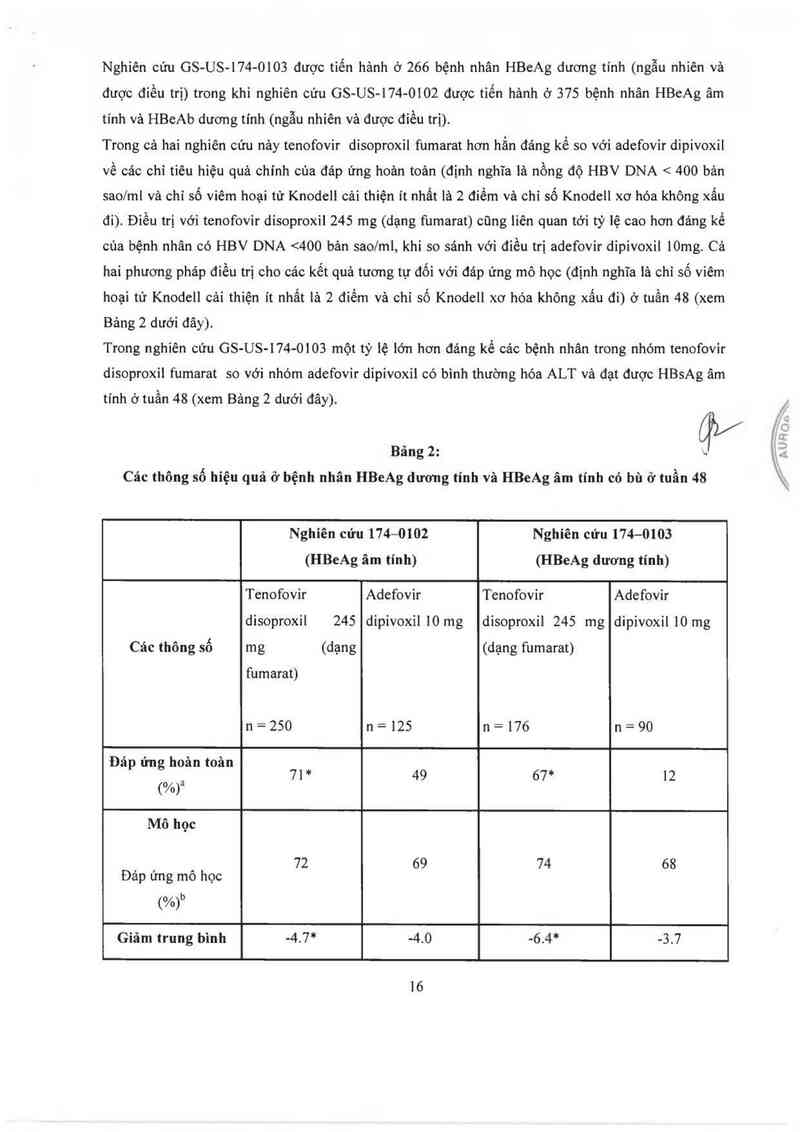
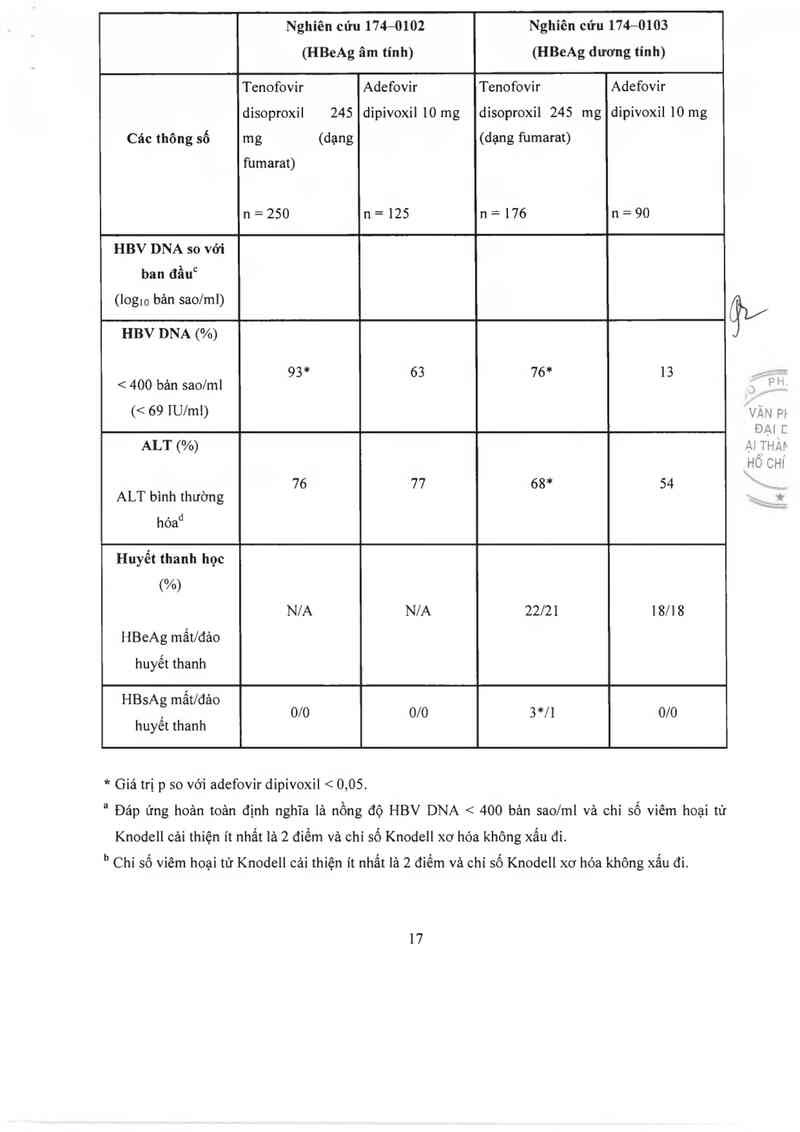
Hiệu quả lâm sảng:
Tảc dụng của tenofovir disoproxil fumarat trên ngưòi trưởng thảnh nhiễm HIV—l đã từng điều trị và
lần đầu điều trị kháng retrovirus được khẳng định qua cảc thử nghiệm kéo dải 48 tuần trên người
trường thảnh nhiễm HIV-l đã từng điều trị kháng retrovirus.
Trong nghiên cứu GS-99-907, 550 bệnh nhân đã từng điều trị kháng retrovirus được sư đụng hoặc
placebo hoặc tenofovir disoproxil 245mg (dưới dạng fumarat) trong 24 tuần. Số lượng tế bảo CD4
ban đầu trung bình lả 427 tể bảo/mmẵ nồng độ ban đầu trung bình RNA cùa HIV-l trong huyết
tương là 3,4 logto bản sao/ml (78% bệnh nhân có nồng độ virus < 5000 bản sao/ml) vả thời gian điều
trị HIV từ trước trung bình là 5,4 năm. Phân tich kiều gen ban đầu của cảc chủng phân 1ập từ 253
bệnh nhân cho thấy 94% bệnh nhân có cảc đột biến liên quan đến các chắt ức chế enzym sao chép
13
ngược, 58% có cảc đột biến liên quan đến chất ức chế protecse và 48% có các đột biến kèm theo đề
kháng với các chất ức chế enzym sao chép ngược không phải nucleotid.
ờ tuần thứ 24 sự biến đội theo thời gian so với giá trị ban đầu về nồng độ RNA cùa HIV-l (DAVGụ)
lả — 0,03 login bản sao/ml vả — 0,61 login bản sao/ml tương ửng ở cảc bệnh nhân dùng placebo vả
tenofovir disoproxil 245mg (dưới dạng fumarat) (p< 0,0001). Những bệnh nhân nhiễm các chùng
HIV có chửa tới 3 đột biến liên quan đến các đổng đắng thymidin (TAM) hoặc nhiều hơn bao gồm
các đột biến hoặc M4IL hoặc L210W ở enzym sao chép ngược đã giảm nhạy cảm với phác đồ
tenofovir disoproxil 245mg (dạng fumarat). Đảp ứng virus thưc chất giảm xuống ở những bệnh nhân
mang chủng virus đề kháng zidovudin theo kỉếu hinh gấp 10 lần. Người ta thấy có sự khác biệt có ý
thời gian vảo tuần thứ 24 (DAVGụ) so với ban đầu về số lượng CD4 (+ 13 tế bảo/mm3 với tenofovir
nghĩa thống kế với ưu thế nghiêng về tenofovir disoproxil 245 mg (dạng fumarat) về sự biến đổi theo Ề/
v
disoproxil fumarat 245 mg so với — 11 tế bảo/mm3 với placebo, p = 0,0008). Đáp ứng virus với
tenofovir disoproxil fumarat lả bền vững trong suốt 48 tuần (DAVGag lả — 0,57 logto bản saolml, tỷ lệ
phần trăm bệnh nhân có RNA H1V-l dưới 400 hoặc 50 bản sao/ml tương ứng là 41% và 18%). Đột
biến KôSR đã xuất hiện ớ tảm bệnh nhân <2%) được đỉều trị bằng tenofovir disoproxil … mg (dạng
fumarat) trong vòng 48 tuần đầu tiên.
Pha có đối chứng hoạt tính, mù đôi 144 tuần của nghíên cứu GS-99-903 đã đảnh giá hiệu lực và tính
an toản cùa tenofovir disoproxil 245 mg (dạng fumarat) so với stavudin khi kết hợp với lamivudin vả
efavirenz để điều trị cho bệnh nhân nhiễm H1V-l dùng thuốc kháng retrovirus lần đầu. Số lượng tế
bảo CD4 ban đầu trung bình là 279 tế bảo/mm², RNA HIV-l trong huyết tương ban đầu trung binh là
4,91 logno bản sao/m], 19% trong số đó nhiễm HIV đă có triệu chứng và 18% đã bị AIDS. Các bệnh
nhân được phân loại dựa trên số 1ượng CD4 vả RNA H1V—l ban đầu. Bốn mươi ba phần trăm bệnh
nhân có nộng độ virus › 100 000 bản sao/ml và 39% có số iượng tế bảo < 200 tể bảo/ml.
Bằng phân tích quá trình điều trị (các số liệu bị mất vả việc chuyển phác đồ điều trị kháng retrovirus
(ART) được coi lả thất bại), tỷ lệ phần trăm bệnh nhân có RNA HIV-l dưới 400 bản sao/ml và 50 bản
sao/ml vảo tuần đỉều trị thứ 48 tương ứng là 80% vả 76% trong nhóm dùng tenofovir disoproxil 245
mg (dạng fumarat), so sảnh với 84% vả 80% trong nhóm dùng stavudin. Ó tuần thứ 144, tỷ lệ phần
trăm bệnh nhân có RNA HIV-l dưới 400 bản sao/ml và 50 bản sao/ml tương ứng là 71% và 68%
trong nhóm dùng tenofovir disoproxil 245 mg (dạng fumarat), so sảnh với 64% và 63% trong nhóm
dũng stavudin.
Biến đổi trung binh so với ban đầu về RNA HIV-1 và tế bảo CD4 ờ tuấn điếu trị thứ 48 1ả tương
đương ở cả hai nhóm (- 3,09 và — 3,09 logto bản sao/ml; + 169 và + 167 tế bảo/mm3 tường ứng ở các
nhóm tenofovir disoproxil 245 m g (dạng fUmarat) vả nhóm stavudin). Ở tuần điều trị thứ 144, sự biến
đồi trung bình so với ban đẩu vẫn tương tự ở cả hai nhóm điều trị (-3,07 và -3,03 logto bản saolml;
+263 vả + 283 tế bảo/mm3 tương ứng ở cảc nhóm tenofovir dis0proxil 245 mg (dạng fumarat) và
14
tH_
. -,
’.
~…
VĂN Pi
oan n
\ITHAh
iỎ cni
\
\.
\ *
\ \.
\ủ.“—
nhóm stavudin). Người ta thấy là đáp ứng lâu dải vói phảc đồ tenofovir disoproxil 245 mg (dạng
f'umarat) không liên quan tới số lượng CD4 vả RNA HIV-l ban đầu.
Tỷ 1ệ xuất hiện đột biến K65R ở nhóm bệnh nhân dùng tenofovir disoproxil fumarat hơi cao hơn so
với nhóm đối chứng (khoảng 2,7% so với 0,7%). Trong tẩt cả cảc trường họp để khảng với efavirenz
hoặc Iamivudin có từ trước hoặc xuất hiện động thời với sự xuất hiện đột biến K65R. Có tảm bệnh
nhân nhiễm HIV mang đột biến K65R thuộc nhóm tenofovir disoproxil 245 mg (dạng fumarat), 7
trong số đó xuất hiện đột biến trong 48 tuần điều trị đầu tiên và trường hợp còn lại xuất hiện vảo tuần
96. Không có thêm trường hợp đột bỉển nảo cho tới tuần 144. Từ phân tích kiểu gen và kiểu hinh
không thấy có bằng chứng nảo về cảc nguyên nhân khác gây đề kháng với tenofovir.
Tác dụng với HB V: gl/
Hoạt tính kháng HBV in vitro: 400 bản sao/ml ờ tuần 48. Không có đột
biến nảo liên quan đến khảng tenofovir disoproxil fumarat đã được xảc định.
Dược động học:
Tenofovir disoproxil fumarate lả một tiền chắt dạng este tan được trong nước và trong cơ thể nhanh
chóng chuyền thảnh tenofovir vả formaldehyd. Trong tế bảo, tenofovir được chuyền thảnh tenofovir
monophosphate vả thảnh chất có hoạt tính tenofovir diphosphat. , . ’
Hấp thu: q›/ (1
Sau khi cho bệnh nhân nhiễm HIV uống tenofovir disoproxil fumarat, tenofovir disoproxil fumarat
được hẩp thu nhanh chỏng vả chuyền thảnh tenofovir. Khi uống vảo bửa ăn, cảc liều tenofovir
disoproxil fumarat cho cảc giá trị tmng bình nồng độ tenofovir (%CV) Cmax, AUCom vả Cmin tương
ứng là 326 (36,6%) ng/ml, 3,324 (41,2%) ng.giờ/ml và 64.4 (39,4%) ng/ml. Các nồng độ tenofovir tội
đa trong huyết thanh đạt được trong vòng 1 giờ sau khi uống lủc đỏi vả 2 giờ sau khi uống kèm thức
ãn. Sinh khả dụng đường uổng cùa tenofovir tù tenofovir disoproxil fumarat ở bệnh nhân uống lúc
đói là khoảng 25%. Việc uống tenofovir disoproxil fumarat với bữa ăn nhiều chắt béo có ảnh hưởng
tới sinh khả dụng đường uống cùa thuốc, trong đó AUC cùa tenofovir tăng khoảng 40% và cmax tăng
khoảng 14%. Khi bệnh nhân được uống liều tenofovir disoproxil fumarat đầu tỉên vảo lủc đã ản no,
giá trị Cmax trong huyết thanh trung bình nằm trong khoảng từ 213 đến 375 ng/ml. Tuy nhiên, uống
tenofovir disoproxil fumarat cùng bữa ăn nhẹ không ảnh hưởng đáng kể tới dược động học cùa
tenofovir.
Phân bố:
Sau khi truyền tĩnh mạch, thể tích phân bố ở trạng thái ổn định của tcnofovir được ước tinh là khoảng
800 mI/kg. Sau khi uống tenofovir disoproxil fumarat, tenofovir được phân bố chủ yểu ở các mô, với
nồng độ cao nhất lá ở thận, gan và đường ruột (theo các nghiên cứu tiền lâm sảng). Trong ống nghiệm
mức độ gắn kết với protein huyết tương hoặc huyết thanh tương ứng lả dưới 0,7 và 7,2%, với nồng độ
tenofovir nằm trong khoảng từ 0,01 đến 25 pg/ml.
Chuyền hoá:
Cảc nghiên cứu in vitro đã xác định rằng cả tenofovir disoproxil fumarat lẫn tenofovir đếu không
chuyền hóa qua hệ enzym CYP4SO. Hơn nữa, ở nổng độ cao hơn đáng kể (gấp khoảng 300 lần) so với
19
nổng độ đạt được trên lâm sảng, tenofovir không ức chế sự chuyển hóa thuốc trong ống nghiệm mà
có xúc tác là cảc đồng phân CYP4SO chính liên quan đến chuyền dạng sinh học của thuốc ở người
(CYP3A4, CYP2D6, CYP2C9, CYP2EI hoặc CYP1A1/2). ờ nộng độ 100 ung1, tenofovir
disoproxil fumarat không ảnh hưởng tới bất kỳ loại CYP4SO nảo, trừ CyplAl/2, trong đó có sự giảm
nhẹ (6%) nhưng có ý nghĩa thống kê về chuyền hóa chất nền của CYP1AI/2. Dựa trên các số liệu nảy
thì không có khả năng xuất hiện tương tảc đảng kể về mặt lâm sảng giữa tenofovir disoproxil fumarat
và các thuộc chuyến hóa nhờ hệ thống cv13450.
Thải trừ: Ớ1/ ,.ẸÊ
Tenofovir được thải trừ chủ yếu qua thận bằng cả con đường lọc thận vả qua hệ thống vận chuyền
chủ động ở ống thận với khoảng 70-80% liều truyền tĩnh mạch được bải tiết qua nước tiều dưới dạng
không đồi. Độ thanh thải toân bộ ước tính khoảng 230m1/giờlkg (khoảng 300 mllphủt). Độ thanh thải
qua thận ước tính là khoảng lõOml/giờlkg (khoảng 210 mllphút), cao hơn nhiều so với tốc độ lọc ở
cầu thận. Điều nảy chỉ ra rằng bải tiết chủ động qua ống thận đóng vai trò quan trọng trong quá. trình
thải trừ tenofovir. Thời gian bán thải cùa tenofovir sau khi uống là khoảng 12 — 18 giờ.
Tính chất tuyến tính/khõng tuyển tính:
Dược động học của tenofovir không phụ thuộc vảo liều cùa tenofovir disoproxil fumarat trong
khoảng liều từ 75 đến 600mg và không bị ảnh hưởng khi dùng liều lặp lại ở bất kỳ mức liều nảo.
Tuổi tác và giới tính:
Cảc dữ liệu còn hạn chế về dược động học của tenofovir ở phụ nữ chỉ ra rằng không có ảnh hướng
lớn cùa giới tính.
Cảc nghiên cứu dược động học chưa được tiến hảnh trên đối tượng trẻ em, vị thảnh niên (dưới 18
tuổi) và người cao tuồi (trên 65 tuổi).
Chưa có các nghiên cứu cụ thể về dược động học ở cảc nhóm chùng tộc khác nhau.
Suy lhận:
Các chỉ số dược động học của tenofovir được xảc định sau khi cho uống một 1iều đơn tenofovir
disoproxil 245 mg đối với 40 bệnh nhân không nhiễm HIV có cảc mức độ suy thận khác nhau, xảc
định dựa vảo độ thanh thải creatinin ban đầu (CrCl) (chức năng thận là bình thường nếu chỉ số CrCl >
80m1/phủt; suy thận nhẹ nếu CrCl = 50-79 mllphút; trung bình nếu CrCl = 30—49 mllphủt và nặng nếu
CrCl = 10—29 m1/phút). So với các bệnh nhân có chức năng thận bình thường, mức độ phơi nhiễm
tenofovir trung bình (%CV) đã tăng từ 2185 (12%) ng.giờlmi ở cảc đối tượng có CrCi>8O mI/phút lên
lần lượt là 3064 (30%) ng.giờ/ml, 6009 (42%) ng.giờlml và 15985 (45%) ng.giờlml ở các bệnh nhân
20
i /-.`.
'ẢN PH
ĐA1 1:…
ÍỈHẨNi
Ô CHit
%
suy thận mức độ nhẹ, trung bình và nặng. Liều khuyến cáo cho bệnh nhân suy thận, vởi khoảng cách
giữa hai lần dùng thuốc kéo dâi hon, sẽ tạo ra nồng độ đinh trong huyết tương cao hơn và nồng độ
Cmin thấp hon ở bệnh nhân suy thận so với bệnh nhân có chức năng thận bình thường. Ảnh hưởng lâm
sảng cùa nó hiện còn chưa rõ.
Ở những bệnh nhân bị bệnh thận giai đoạn cuối (ESRD) (CrCl < 10 ml/phút) cần phải thẩm tách máu,
các nồng độ tenofovir giữa các lần thẩm tách tăng đáng kể trong suốt 48 giờ, đạt Cmax trung bình 1032
nng vả AUCngh trung bình 42857 ng.giờlml.
Điều nảy khuyến cáo rằng nên điều chinh khoảng cách giữa hai 1ần dùng tenofovir disoproxil 245 mg
(dạng f'umarat) ở những bệnh nhân có độ thanh thải creatinin < 50 mI/phút hoặc những bệnh nhân\đã,ỵ
bị ESRD và cần thẩm tách máu.
phúc mạc hoặc các kiếu thấm tách khác.
Suy gan: ' fịếỉ/ VẢN
Liều tcnofovir disoproxil 245 mg được dùng cho cảc bệnh nhân không nhiễm HIV có các mức độ suyJft_ .
gan khác nhau được xác định theo cách phân loại Chi1d- Pugh-Turcotte (CPT). Dược động học cùa\Ch\ HÔVẸ
tenofovir thục chất không bị ảnh hưởng ở các đối tượng bị suy gan, điều nảy gọi ý rằng không cân _
điều chinh iiều ờ cảc bệnh nhân nảy. Các giá trị trung bình nồng độ tenofovir (%CV) Cmax vả AUCg.,o \
tương ứng là 223 (34,8%) ng/ml và 2050 (50,8%) ng.giờlml ở những bệnh nhân chức năng gan bình
thường, so với 289 (46,0%) nglml và 2310 (43,5%) ng.giờ/ml ở những bệnh nhân suy gan mức độ
trung bình và 305 (24,8%) ng/ml và 2740 (44,0%) ng.giờ/ml ở những bệnh nhân suy gan nặng.
Dược động học nội tế bâo:
Trong bạch cầu đơn nhân không sinh sản trong máu ngoại vi cùa người (PBMC) thời gian bán hủy
của tenofovir disoproxil vảo khoảng 50 giờ, trong khi thời gian bán hùy trong tế bảo PBMC được
kích thích bằng phytohaemaglutinin là khoảng 10 giờ.
Quá liều và cách xử trí:
Trong trường hợp quá liều, cần theo dõi các dấu hiệu ngộ độc và áp dụng điều trị hỗ trợ tiêu chuẩn.
Tenofovir có thể được loại bỏ bời thẩm tách mảu, thanh thải thẩm tách máu trung bình của tenofovir
lả 134m1/phút. Thanh thải cùa tenofovir bời thẳm tách mảng bụng chưa được xác định.
Các dấu hiệu lưu ý và khuyến cáo:
' Đế xa tầm tay trẻ em
21
' Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin xin hòi ý kiến bảc sỹ
Điều kiện bảo quản:
Bảo quản ở nhiệt độ không quá 30°C.
Hạn dùng của thuốc:
24 tháng kế từ ngảy sản xuất.
Tên, địa chi của tổ chức, cá nhân chịu trách nhiệm về thuốc:
Thông tin nhả sản xuất: Ộ/
AUROBINDO PHARMA LIMITED
Địa chỉ: )\
Văn ghòng: P1ot No. 2, Maitrivihar Complex Ameerpet Hyderabad, 500 038 Andhra Prầđ`ẹ ,
_JNti \
India. ỄN \\
1PHỐ/ịĩj
Reddy District, Andhra Pradesh India.
Công ty nhập khẩu vả phân phối:
TM AUROBINDO PHARMA LIMITED
ÀN PHONG Ế
ĐAI DiỆi.’ 'ịĨỨi,
. & ~
'ỉ…~=ẹạ_ \_ơ
c" __
,2"
r’/_.z
E
ỉ
ắt
ỉ
13
3.“
O
pch cuc TRUỞNG
Ji’ffltyễn AVcĩn { ỄtmÍ
22
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng