





















=>iGSJ'ON'Sau NA
memmp =onm'dxa
……me =xswamo'ãiw ,
=xs ọi ọsx'ON Itazen
1
1
1
JJIG'IYđIIOOZ/dVffl/ZZ ²'°N '°1’1 'ỈJW
i-i-ẵ
Dímensions : 52 x 52 x 110 mm
Colors : 4
. 80% I’AN'IUNIì 2728 <~
.
. BLACK
1 i _ PANTONE 485 (`
1
2xxxxxx
Fachfttm-coưedtdtietcmttumfflũmgof _
emmcinbimndJfflmgot'tmd'ovirdnquđ
fưnmte. equivalem to 245 mg of tenofovir
disoproxil
Ẻ—²i
` USUAL DOSAGE See package insen for
'ì, . , ,
| 1; N 0 t ip M
Emtricitabine and Tenofovir
Disoproxil Fumarate Tablets
200 mgl300 mg
, Store below 30
30 Tablets
dosoge end administmion
&, . , , ,
1 t N () t b M
Emtricitabine and Tenofovir
Disoproxil Fumarate Tablets
PHARMACIST: Dispense the putient
int” ' eatiet with drug pmduot
zoo mg/3OO mg
protect t'mm moistme.
30 Tablets
Keep out of reach ofchtldren
Rome of ađmmistmtion: ( lml
Í.oolcoouo|cocolũ"znẹp uẹ1
Ở O
>e'ã
':ẵỂ-Ểw
m›²tO
c: 2`<
F
G '<`ỉỂt
~<.=
…c:
fĩi-Q
Ó
Ih-Thlổcbớltheođơn I-lộpllọ30vih
'11’ỉNOIf IỀM
Viên nén boo phim
Emtrỉcỉtnbin 200mg vi Tenofovir
Disoproxil Funnrot 300mg
Mỗi vien nén boo phim chứa 2ng
emtricitabin vả 300mg tenofovir
disopmxil fumamt. tunng đương 245
mg tenofovir đisoproxil. Chỉ định, *
oỏch đủng. chống ohi định vả các
thỏng tin khảo: Xem Huớng tưn sử
đung kem theo. Dọc ltỹ um ah
ứ đợlg tước khi đing._ Bâo quán ớ
nhiệt độ đuới 30°C. tninh Am. nt titnỏc
ngoủltđm tty trẻem
Doanh nghiệp nhập khẩu:
Manufactutcd hylSiin xuất tai Àn-độ hời:
Te1nngatta` INDIA
HhTEROI ARS uwm›
Unit-lll. zz-no. |.DA.
Jeedimetia. Hyderabad - soo oss.
;ị
ề
Mỗi vièn nén boo phim chín 2ng
emtricitlbill \Ì !ng tonofovit
Thuốc hớn theo 6…
| I~N( )l’ lí M
Vien nén @ phim Emtricitabin
200mg vù Tenofovir Disoproxii
Fu… 300 mg
Lọ 30 viên
Mt';` Lic No wmvưrzoowawoc
Bllcll NoJSỏ io sx
MthudNSX ddlmmlyyyy
Enp … đđlmmlyyyy
vu Rog NoISĐK
bylSin xuitu tAn-đỏ bới
NETFRUI “95 1 lMll'l D
Doanh nghiệpnhinkhẩu Umtiil 22 no IDA
lceđlmotlu. Hyđenhđ 500055
Size: 120x40 mm
COIOurz4 -… i…. ,…
Spec.:
i.
1—
ted on 80 GSM Fasson fas print permanent (HITAC) ofAvery Dennison with
Aqua Vamis 62 GSM release paper, in roll form with number printed on release paper.
iiộ Y TẾ
` CỤC QL'ẨN LÝ Dược
ĐÀ PHÊ DUYỆT
íLến đâu:.D.ểiJ…Qẫ/…ÁỦẤẨ
oễỗlể
GƯR/AOO gth
TENOF EM
' vã Tenofovir Disoproxỉl Fumarat 200mg/300mg)
HƯỚNG DÁN sử DỤNG
Đọc kỹ Hướng dẫn sử dụng trưởc khi dùng. Nếu cần thêm thông tinxin hỏi bảo sĩ. Thuốc bán
theo đơn.
Thi…h phần:
Mỗi viên nén bao phim chứa 200mg emtricỉtabin vả 300mg tenofovir disoproxil fumarat tương
đương với 245 mg tenofovir disoproxil.
Tá dược: Pregeitanized staroh, lactose monohydrate, microcrystalline cellulose (Avicel pH 102).
crosoarmellose sodium, magnesium stearate. opadry 11 blue 32K]0849.
Mô tả thuốc:
TENOF EM lá thuốc dùng đường uống.
Tên hóa học của emtricỉtabin lả 4-amino-S-tiuoro-l—[(ZR, SS)-2—(hydroxymethyl)-L 3- oxathiolan~5—
yl]-2(lH)-pyrimidinone. Emtricitabin là một chất bột mảu từ trắng đến tr’ g nhạt với độ hòa …
khoảng 112 mg/mL trong nước ở 25°C. Công thức phân tử cùa nó 1 OFN303S với trọng lượng
phân từ là 247,25. Công thức cấu tạo cùa omtricitabin được biền diễn như dưới đây.
NH;
F \ N
|
… ano
Ở
0
Tenofovir disoproxil fumarat có tên hóa học là [[(1R)-2-(6-amino-9H-purin—9-yI)-l- methylethoxyl
methyl] phosponic acid disoproxil fumarat. Tenofovir Disoproxỉl Fumarat có mảu từ trắng đến trắng
nhạt ở dạng bột tinh thể với độ hòa tan là 13,4 mglmL trong nước cất ở 25°C. Tenofovir disoproxil
fumarat có hệ đệm octanol/phosphat (pH 6.5) hệ số phân chia (log p) là 1,25 ở 25°C. Công thức phân
tử cùa nó là CI9H3ONSOIOP.C4H404 với trọng lượng phân từ là 635,51. Công thức cấu tạo cưa
tenofovir disoproxil fumarat được biếu diễn như dưới đây.
Mmủ
lù
.xFTỂD-
Dược lý học:
Đặc tính dược lực học:
Nhóm dược lý: Thuốc khảng virus đường toản thân; thuốc khảng virus để điều trị nhiễm HIV, cảc
liệu phảp diều trị kết hợp. Mã ATC: .IOSARO3
C ơ chế tác dụng và hiệu lực dược lực học:
Emtricitabin lả một đồng đắng nucleosid cùa cytidin. Tenofovir disoproxil fumarat được chuyến đối
ín vivo thảnh tenofovir, một đổng đẳng nucleosid monophosphat (nucleotid) cùa adenosin
monophosphat. C ả emtricitabin vả tenofovir đều có hoạt tính đặc hiệu đối với virus gây suy giảm
miễn dịch ở người (HIV-l vả HIV-2) và virus viêm gan B.
Emtricitabin vả tenofovir được p osphoryl hóa bới các enzym trong tế bảo để tạo thảnh emtricitabin
triphosphat vả tenofovir diphospha tương ứng. Các nghiên cứu in vitro đã chi ra rằng cả emtricitabin
vả tenofovir đến có thế bị
yi hóa hoản toản khi được dùng kết hợp với nhau trong tế bảo.
Emtricitabin triphosphat vả tenofovir diphosphat ức chế cạnh tranh men sao chép ngược HIV-l, dẫn
dến lảm kết thúc chuỗi DNA.
Cả emtricitahin triphosphat vả tenofovir diphosphat đều là chất ức chế yếu đối với polymerase DNA
của động vật có vú và không có dấu hiệu độc tính đối với ty thế ở cả in vitro và in vívo.
Hoạ! tính kháng vírus in vitro: Hoạt tinh hiệp đổng khảng virus dã dược quan sát thấy ở thuốc kết
hợp emtrioitabìn vả tenofovir in vitro. Tác dụng bổ sung vảo cảc hoạt tính hiệp đồng cũng đã được
quan sảt thấy trong các nghiên cứu kết hợp thuốc với các thuốc ức chế protease và với cảc thuốc ức
chế men sao chép ngược HIV nucleosid và không nucleosid.
Khúng Jhuốc: Tính khảng thuốc đã được quan sảt thấy in vitro và ở một số bệnh nhân nhiễm HiV—l
do có sự xuất hiện của đột biến Ml84V/l với emtricitabin hoặc đột biến K65R với tenofovir. Cảo
virus kháng emtricitabin mang đột biến M184V/1 cũng thế hiện tính khảng chéo với Iamivudin.
nhưng vẫn duy tri độ nhạy cảm với didanosin, stavudin, tenofovir vả zidovudin. Đột biến K65R cũng
có thế dược chọn iọc bới abacavir hoặc didanosin vả lảm giảm độ nhạy cảm với các chất nảy cũng
như với lamivudin, emtricitabin vả tenofovir. Trảnh dùng tenofovir disoproxil fumarat cho những
bệnh nhân nhiễm chủng HIV-l có mang đột biến K65R. Ngoài ra, một đột biến thay thế K7OE trong
men sao chép ngược HIV-l cũng được chọn bởi tenofovir vả iảm giảm một mức thấp độ nhạy ct'tm
với abacavir, emtricitabin, lamivudin vả tenofovir.
Những bệnh nhân bị nhiễm HIV-l có 3 hoặc nhiều hơn 3 đột biến liên quan đến cảc đồng đắng
thymidin (TAMs) bao gồm hoặc đột biến M41L hoặc đột biến L210W trên men sao chép ngược thế
hiện sự gỉảm tính nhạy cảm với tenofovir disoproxil fumarat.
Kinh nghiệm kháng thuốc in vivo (đối vởi bệnh nhân chưa từng điều !rị với thuốc kháng virus suu
chép ngược trưởc đó): Trong một nghiên cứu iâm sảng ngẫu nhiên mờ (GS-Oi-934) ở bệnh nhân
chưa từng điếu trị với thuốc khảng virus sao chép ngược trước đó, xét nghiệm kiếu gen đã được thực
hiện trên cảc chùng HIV-l trong huyết tương từ tất cả những bệnh nhân có xảo nhận RNA HIV > 400
bản sao/ml ở cảc tưần 48, 96 hoặc 144 hoặc tại giai đoạn đấu cúa nghiên cứu ngưng dùng thuốc. Tinh
tại thời điếm tuấn 144:
. Đột biến M184V/1 xuất hiện ở 2/19 (10,5%) ohủng đã được phân tich từ bệnh nhân trong nhóm điềtt
trị với emtricitabỉnltenofovir disoproxil fưmarat/efavirenz và ở 10/29 (34,5%) chủng đă được phân
tích ở nhóm bệnh nhân điếu trị với lamivudinlzidovudin/efavironz (trị số p < 0.05. dựa theo kết qtttt
kiếm định Fisher's Exact so sánh giữa nhóm bệnh nhân đỉều trị với emtricitabin+tenofovir disoproin
fumarat và nhóm bệnh nhân điều trị với lamivudin/zidovudin trên tất cả các bệnh nhân).
~ Không có chùng vỉrus nảo được phân tích có ohứa đột biến K65R hoặ K7OE
. Đề khảng kiểu gen với efavirenz, chủ yếu là đột biết K103N, xuất h' tr n chùng virus cùa 13/19
(68%) bệnh nhân trong nhóm đỉều trị với emtricitabin/tenofovir disoproxđ fumarat/efavirenz vả trẻn
chủng virus oùa 21/29 (72%) bệnh nhân trong nhóm còn lại.
Tt’nh an toản vả hiệu quả trên lâm sâng:
Trong một nghiên cứu lâm sảng ngẫu nhiên nhãn mớ (GS-Ol—934), bệnh nhân nhiễm HIV-l trước
đây chưa từng dùng thuốc khảng virus sao chép ngược được điều trị hoặc vởi phảc để mỗi ngảy một
lần với emtricitabin, tenofovir diSOproxil fumarat vả efavirenz (n=255) hoặc với một phác dồ dùng
viên nén kết hợp lamivudin vả zidovudin (Combivir) uống hai 1ần một ngảy kèm với eiavirenz uống
một lần một ngảy (n=254). Bệnh nhân trong nhóm điều trị với emtricitabin vả tenofovir disoproin
fumarat dùng TENOF EM cùng với efavirenz từ tuần 96 tới tuần 144. Tại thời điếm ban đầu. cúc
nhóm ngẫu nhiên có mức HlV—l RNA trong huyết tương trung bình tương tự nhau (5.02 và 5.00 Iog…
bản sao/ml) và số lượng CD4 đếm cũng tương tự nhau (233 và 241 tế bảo/mms). Tiêu chí dảnh giá
hiệu quả chính cùa nghiên cứu nảy là đạt được và duy trì được nồng độ HIV-l RNA được xảc nhận lù
< 400 bản sao/ml trong thời gian hơn 48 tuần. Các chỉ tiêu phân tích tinh hiệu quả thứ cấp trong thới
gian hơn 144 tuần bao gồm tỷ iệ bệnh nhân có nồng độ HIV-l RNA < 400 hoặc < 50 bản sao/ml, và
sự thay đối về số lượng tế bảo CD4 đếm được so với ban đẩu.
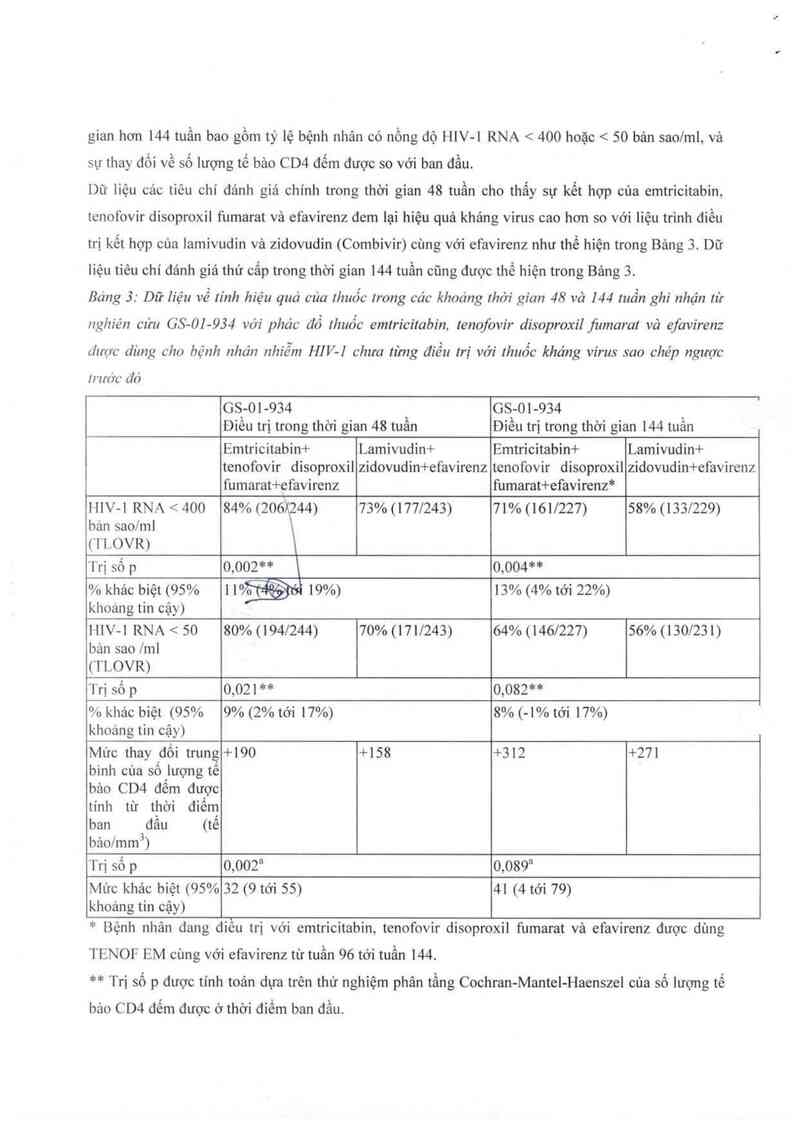
Dữ iiệu các tiêu chí dảnh giá chinh trong thời gian 48 tuần cho thấy sự kết hợp của emtricitabin.
tenofovir disoproxil fumarat vả efavirenz đem lại hiệu quả khảng virus cao hơn so với liệu trình điều
trị kết hợp của iamỉvudin vả zidovudin (Combivir) cùng với efavirenz như thế hiện trong Bảng 3. Dữ
liệu tiêu chí đảnh giả thứ cấp trong thời gian 144 tuần cũng được thế hiện trong Bảng 3.
Báng 3: Dữ liệu về lính hiệu quả của thuốc trong các khoảng thời gían 48 và 144 tuần ghi nhận từ
nghiên cứu GS-OI-934 vởi phảc đồ thuốc emtricitabin, tenofovir disoproxil jìtmarat vả efavírenz
LỈII'Ọ'C dùng cho bệnh nhán nhiễm HIV—I chưa từng điều trị với thuốc kháng virus sao chép ngược
trước đó
GS-Oi—934
Điều trị trong thời gian 48 tuần
GS—O 1 —934
Điều trị trong thời gian 144 tuần
Emtricitabin+
tenofovir disoproxil
Lamivudin+
zidovudin+efavirenz
Emtricitabin+
tenofovir disoproxil
Lamivudin+
zidovudỉn+efavirenz
fumarat+efavirenz fumarat+efavirenz*
HlV-l RNA < 400 84% (206 44) 73% (177/243) 71% (161/227) 58% (133/229)
bản sao/ml
(TLOVR)
Trị số p 0.002** \ 0,004**
% khác biệt (95% iitỷỀới 19%) 13% (4% tới 22%)
khoáng tin cậy)
HIV-l RNA < 50 80% (194/244) 70% (171/243) 64% (146/227) 56% (130/231)
bản sao /ml
(TLOVR)
Trị số p 0,021 ** 0,082**
% khác biệt (95% 9% (2%tới 17%) 8% (-l%tới 17%)
khoảng tin cậy)
Mức thay _đối trung +190 +158 +312 +271
binh cùa sôiượng tế
bảo CD4 đêm được
tinh từ thời điêtn
ban đâu (tê
bảo/mmj)
Trị số p 0,002a 0,089a
Mức khác biệt (95% 32 (9 tới 55) 41 (4 tới 79)
khoảng tin cậy)
* Bệnh nhân đang điều trị với emtricitabin, tenofovir disoproxil fumarat vả efavirenz được dùng
TENOF EM cùng với efavirenz từ tuần 96
tới tuần 144.
** Trị số p được tính toản dựa trên thử nghiệm phân tằng Cochran-Mantel-Haenszel oùa số lượng tế
bảo CD4 đếm được ở thời điếm ban đầu.
TLOVR= Thời gian mất đáp ứng virus học
a: Thử nghiệm Van Elteren
Trong một nghiên cứu iâm sảng ngẫu nhiên riêng biệt (MO2-418), 190 người lớn chưa từng điều trị
với thuốc khảng virus men sao chép ngược trước đó đã được điều trị với TENOF EM dùng mỗi ngảy
một lần trong liệu trình điều trị kết hợp với Iopinavir/ritonavir dùng mỗi ngảy một hoặc hai lần. Soo
48 tuần, 70% và 64% bệnh nhân đạt kết quả HlV-l RNA < 50 bản sao/ml khi điều trị với cảc phác đồ
lopinavir/ritonạvir lần lượt một hoặc hai lần mỗi ngảy. Sự thay đối trung binh cùa số iượng tế bảo
CD4 đếm được kể từ thời điểm bao đầu là +185 tế hảo/mm² vả +196 tế hớo/mm3 tương ứng với cảc
phảc đồ lopinavir/ritonavir dùng một hoặc hai lần mỗi ngảy.
Kinh nghiệm lâm sảng hạn chế ớ bệnh nhân đồng nghiễm HN và HBV cho thấy việc sử dụng
emtricitabin hoặc tenofovir disoproxil fumarat trong cảo liệu pháp điều trị kết hợp khảng virus sno
chép ngược để kiếm soát lây nhiễm HIV cũng giúp lảm giảm lượng virus HBV thoo chỉ số HBV
DNA (lần lượt giảm 3 login hoặc giảm 4 đến 5 log…) (xem mục Cảnh báo và thận trọng khi dùng
thuốc).
Nhóm bệnh nhân nhi:
Chưa có dữ iiệu về tính an toản và hiệu quả của TENOF EM khi sử dụng ở trẻ em dưới 18 tuổi.
Đặc tính dược động học:
Hấp thu:
Tinh tương đương sinh học của một TENOF EM so với một viên nang Cú'l c tricitabin 200 mg vai
một viên nén bao phim tenofovir disoproxil fumarat 245 mg đã được n u ở những người khoc
mạnh sau khi dùng thuốc ở liều đơn lẻ vảo lủc đói. Sau khi áp dụng thuốc emtricitabin vả tenofovir
disoproxil fumarat dạng viên nén bằng đường uống ở những đối tượng khỏe mạnh trên, emtricitabin
vả tenofovir disoproxil fumarat được hấp thụ nhanh chóng, và tenofovir disoproxil fumarat dược
chuyển hóa thảnh tenofovir. Nồng độ emtrioitabin vả tenofovir trong huyết thanh đạt mức tối da trong
khoảng thời gian từ 0,5 đến 3,0 giờ sau khi dùng thuốc vảo lúc đói. Sử dụng thuốc TENOF EM với
thực phấm chứa nhiếu chất béo hoặc bữa ăn nhẹ sẽ lảm chậm thời gian tenofovir đạt nồng độ_tối đa
khoảng 45 phủt, đồng thời lảm tăng cảc giá trị diện tich dưới đường cong (AUC) và nồng độ thuốc
tối đa (C…) cùa tenofovir lên lằn lượt khoảng 35% và 15%, so với khi dùng thuốc vảo lủc đói. Đề tối
ưu hóa mức độ hấp thu của tenofovir, người bệnh nên được khuyến cảo điếu trị bằng TENOF EM với
thực phấm.
Phản bố:
Sau khi tiêm tĩnh mạch, thể tich phân bố của emtricitabin vả tenofovir lần lượt xấp xỉ là 1,4 llkg vả
800mI/kg. Sau khi dùng emtricitabin hoặc tenofovir disoproxil fumarat bằng đường uống.
N) i.".
\Ẩf-Ấu…
entiricitabin vả tenofovir được phân bố rộng khắp cơ thể. Mức độ gắn kết in vitro của emtricitabin
với protein huyết tương người là < 4% vả không phụ thuộc vảo nồng độ trong phạm vi từ 0,02 đến
200 ụg/ml. Độ gắn kết protein in vitro cùa tenofovir với protein huyết tương hoặc huyết thanh iấn
lượt dưới 0,7 và 7.2%, trong khoảng nồng độ tenofovir từ 0,01 đến 25 ụg/ml.
('huyẻn hóa sinh học:
Sự chuyến hóa cùa emtricitabin rất hạn chế. Quá trình chuyến đổi sinh học của emtricitabin bao gồm
sự oxy hóa phân nừa thiol để tạo thảnh cảc 3'-sulphoxide diastereomer (xấp xi 9% liều dùng) và kết
hợp với acid glucuronic để tạo thảnh 2'-O-glucuronide (khoáng 4% liếu dùng). Cảo nghiên cứu in
vit… đã cho thấy tenofovir disoproxil fumarat hay tenofovir dều không phải là chất nền cùa cảc các
enzym CYP4SO. Cả emtricitabin vả tenofovir đểu không gây ức chế sự chuyến hóa in vitro cùa thuốc
dược trung gian bời bất kỳ đồng dạng chính nảo cùa CYP4SO ở người trong quá trình chuyến đối sinh
học của thuốc. Ngoài ra, emtricitabin cũng không lảm ức chế uridine-S'-diphosphogluouronyl
transferase. enzym có vai trò glucuronid hóa.
'l'luti trừ:
l’ĩmtricitabin chủ yếu ợc bải tiết qua thận với liều được thu hồi hoản toản trong nước tiểu (khoảng
86%) và phân (khoảng %>. Có 13% iièu emtricitabin được thu hồi trong nước tiểu dưới dạng ba
chất chuyến hóa. Độ than thải hệ thống của emtricitabin trung binh là 307 mllphủt. Sau khi được
dùng bằng đường uống, th` '. gian bán thải cùa emtricitabin là khoáng 10 giờ.
Tcnofovir cũng chủ ợc bải tiết qua thận thông qua quá trình lọc và hệ thống đảo thải chủ động
ở ống thận với khoảng 70-80% liều dùng được bải tiết dưới dạng không đồi trong nước tiếu sau khi
tiêm tĩnh mạch. Độ thanh thải biều kiển cùa tenofovir trung binh khoảng 307 ml/phút. Mức độ thanh
thai qua thận ước tinh khoảng 210 milphủt, cao hơn tốc độ iọc cầu thận. Điều nảy cho thấy sự đảo
thái chủ động qua ống thận đóng vai trò quan trọng trong quá trinh bải tiết tenofovir. Sau khi dùng
đường uống, thời gian bản thải cùa tenofovir là khoảng 12 đến 18 giờ.
Người cao tuổi:
Hiện chưa có nghiên cứu dược dộng học nảo về emtricitabin hoặc tenofovir được thực hiện ở người
cao tuổi (trên 65 tuối).
Giới tính:
Cảo đặc tinh dược động học cùa emtrioitabin vả tenofovir ở bệnh nhân nam giới vả nữ giới là tương
tự như nhau.
C li ủng tộc:
Không có sự khảo biệt dược động học lâm sảng đảng kế nảo liên quan đến chùng tộc đối với
emtricỉtabin. Cảo đặc tính dược động học cùa tenofovir vẫn chưa được nghiên cứu cụ thế ở các nhóm
chùng tộc khác nhau.
Nhóm bệnh nhân nhỉ:
Nhin chung, cảc dặc tỉnh dược động học cùa emtricỉtabin ở trẻ sơ sinh, trẻ nhỏ và thanh thiếu niên (từ
4 thảng đến 18 tuổi) tương tự như ở người lớn. Hiện chưa có nghiên cứu dược động học nảo về
tenofovir được thực hỉện ở trẻ nhỏ và thanh thiếu niên (dưới 18 tuồi).
Bệnh nhân suy thận:
Những dữ liệu dược động học về việc điều trị đồng thời giữa emtricỉtabin vả tenofovir như hai loại
dược phẩm riêng biệt hoặc được kết hợp trong thuốc TENOF EM ở bệnh nhân suy thận vẫn còn hạn
chế. Các thông số dược động học chủ yếu được xảo định sau khi điều trị đơn liều với emtricỉtabin 200
mg hoặc tenofovir disoproxil 245 mg đối với những bệnh nhân không nhiễm HIV bị suy thận ớ nhiến
mức độ khảo nhau. Mức đó suy thận được xảo định dựa trên trị số thanh thải creatinin (CrC 1) cơ bản
(người có chức năng thận bình thường: CrCI > 80 ml/phủt; bệnh nhân sưy thận nhẹ: CrCl = 50—79
mllphủt; bệnh nhân suy thận ở mức độ trung binh: CrCl = 30—49 ml/phút và suy thận nghiêm trọng:
CrCl = 10—29 ml/phút).
Mức độ phơi nhiễm thuốc tmng bình (%CV) cùa emtricỉtabin tăng từ 12 (25%) pgơgiờ/ml ở những
người có chức năng thận bình thường, 1ần lượt lên tới 20 (6%) ng giờ/ml 25 (23%) g' giờ/ml và 34
(6%) ụgo giờlml đối với bệnh nhân suy thận ở mức độ nhẹ, trung binh
Mức độ phơi nhiễm thuốc trung bình (%CV) cùa tenofovir tăng từ 2.1 %) ngơgiờ/mi ở những
người có chức năng thận bình thường, lần lượt lên tới 3.064 (30%) ngtgiờ/mi. 6.009 (42%) ngt
giờ/ml và 15.985 (45%) ngơ giờlml đối với bệnh nhân suy thận ở mức độ nhẹ, trung bình và nghiêm
trọng.
Việc kéo dải khoảng cách giữa cảc liều thuốc TENOF EM đối với bệnh nhân sưy thận ở mức độ
trung binh được dự bảo sẽ lảm tăng nồng độ đinh trong huyết tương và giảm nồng độ thuốc tối thiếu
(Cmin) so với những người có chức năng thận binh thường. Các tảo động lâm sảng cưa tình trạng nảy
vẫn chưa được biết đến.
Trong quá trinh thấm tách mảu ở bệnh nhân mắc chứng suy thận giai đoạn cuối (ESRD) cẩn chạy
thận nhân tạo, mức độ phơi nhiễm thuốc cùa emtricỉtabin tăng đáng kể trong vòng 72 giờ iên tới 53
(19%) ịtg~giờ/ml, và mức độ phơi nhiễm thuốc cùa tenofovir tãng tới 42.857 (29%) ng'giờ/ml trong
vòng 48 giờ.
Cần điều chinh khoảng cảoh giữa cảc iiều thuốc TENOF EM ở những bệnh nhân có độ thanh thải
creatinin từ 30 đến 49 ml/phút. Thuốc TENOF EM không thích hợp điều trị dối với bệnh nhân có dộ
thanh thải creatinin CrCI < 30 m1/phút hoặc những bệnh nhân chạy thận nhân tạo (xem mục Liều
lượng và cách dùng).
Một nghiến oứu lâm sảng nhớ đã dược tiến hảnh nhằm đánh giá độ an toản, hoạt tính kháng virus và
czic dặc tinh dược dộng học cùa tenofovir disoproxil fumarat khi điếu trị kết hợp với emtricỉtabin ở
những bệnh nhản suy thận nhiễm HIV. Ở một phân nhóm bệnh nhân được ảp dụng 1 liều đơn mỗi
ngả_v và có trị số thanh thải creatinin cơ bản từ 50 đến 60 mllphủt, mức dộ phơi nhiễm với tenofovir
được ghi nhận tăng gấp 24 lần và có triệu chứng suy giảm chức năng thận nặng hơn.
Bệnh nhân suy gan:
Các đặc tinh dược động học cùa TENOF EM vẫn chưa được nghiên cứu ở bệnh nhân suy gan. Tuy
nhiên, không cần thiết phải diếu chinh liều với TENOF EM ở nhóm bệnh nhân nảy.
Các dặc tinh dược động học cùa emtricỉtabin cũng vẫn chưa được nghiên cứu trên bệnh nhấn không
nhiễm virus viêm gan B và suy gan ở nhiều mức độ khảo nhau. Nhìn chung, đặc tính dược động học
cưa emtricỉtabin ở những ệnh nhân nhiễm virus viêm gan B tương tự như ở người khỏe mạnh bình
thường và những đối tượng nhiễm HIV.
Một liều đơn tenofovir disoproxil 245 mg đă được áp dụng ở những bệnh nhân không nhiễm HIV vả
suy gan ớ nhiếu mức độ hảo nhau, được xảo định dựa theo phân Ioại Child-Pugh-Turcotte (CPT).
Các đặc tinh dược động h c của tenofovir không thay đổi đảng kế ở những bệnh nhân suy gan. Điều
nảy cho thấy không cần t iết phải điều chỉnh liền 6 nhóm bệnh nhân nảy. Các giá trị trung bình của
tcnofovir (%CV) bao gồ
lượt là 223 (34,
(46.0%) ng/ml và
nồng độ thuộc tối đa (C,…) và diện tích dưới dường cong (AUC…) lẩn
ng/ml và 2.050 (50,8%) ngtgiờ/ml ở người khỏe mạnh bình thường, so vởi 289
0 3,5%) ngơgiờ/ml đối với bệnh nhân sưy gan ở mức độ trung bình, và 305
(24,8%) ng/ml vả 2.740 (44,0%) ng—giờ/ml đối với những đối tượng suy gan nghiêm trọng.
Chỉ định điểu trị:
Thuốc TENOF EM lả dược phấm kết hợp liều cố định giữa emtricỉtabin vả tenofovir disoproxil
fumarat. Thuốc được chỉ định trong các iiệu pháp kết hợp kháng virus sao chép ngược khi điều trị
nhiễm HIV-l ở người lớn từ 18 tuổi trở lên.
Những bằng chứng về lợi ích của việc kết hợp điều trị giữa emtricỉtabin vả tenofovir disoproxil
fumarat trong liệu phảp khảng virus sao chép ngược đã được ghi nhận trong cảc nghiên cứu ở những
bệnh nhân điếu trị lằn đầu (xem mục Đặc tinh dược động học).
Liều lượng và cách dùng:
1.iệu trinh điều trị phải được bắt đầu thực hiện bởi một bảo sỹ có kinh nghiệm trong điều trị nhiễm
HIV.
Liều lượng:
Người Iỏ7t: Liều khuyến oảo của TENOF EM 1ả 1 viênllẩn/ngảy bằng đường uống. Đế tối ưu hóa
mức độ hấp thu tenofovir, bệnh nhân được khuyến cảo nên áp dụng thuốc TENOF EM với thực
phấm. Ngay oả một bữa ăn nhẹ cũng giúp cải thiện độ hấp thu tenofovir có trong dược phẩm kết hợp
dạng viên nén nảy (xem mục Đặc tính dược động học).
Trong trường hợp được chi định ngưng điếu trị với một trong các thảnh phần cùa TENOF EM hoặc
khi cần điếu chinh liều thuốc, bệnh nhân có thề ảp dụng emtricỉtabin vả tenofovir disoproxil fumarat
như 2 loại dược phấm riêng biệt dã được bảo chế sẵn. Vui lòng tham khảo mục Tóm tắt đặc tinh của
sản phấm khi sử dụng cảc loại thuốc trên.
Nếu bệnh nhân bỏ lỡ một liều thuộc TENOF EM trong vòng 12 giờ so với thường lệ, nên dùng thuốc
kết hợp với thực phấm cảng sớm cảng tốt và tiếp tục lịch trình liều iượng như bình thường. Nếu bệnh
nhân bỏ lỡ một liều hơn 12 giờ và gần dến thời gian dùng liều tiếp theo, không nên ảp dụng liều đã
bỏ lỡ mà chỉ cần tiếp tục 1ịch trinh liếu lượng như binh thường.
Trường hợp bệnh nhân bị nôn trong vòng 1 giờ sau khi điều trị với TENOF EM, nên dùng một viên
thuốc khảo để thay thế. Nếu bệnh nhân bị nôn ở thời gian hơn 1 giờ sau khi dùng thuốc, không cẩn
phải thay thế bằng một liều khác.
Nhóm bệnh nhân đặc biệt:
Người cao tuồi: Hiện chưa có dữ liệu nảo về liều khuyến cảo dảnh cho bệnh nhân từ 65 tuổi trở lên.
Tuy nhiên, không khuyến cảo điều chinh iiều hảng ngảy ở nhóm bệnh nhân nảy, trừ trường hợp bệnh
A ! o 1 . . «
nhan co bteu h1ẹn suy thạn.
1êm với
Bệnh nhăn suy thận: Emtricitabin vả tenofovir được bải tiết qua đường thận. Mứ đ phơi
emtricỉtabin vả tenofovir tăng ở những bệnh nhân bị rối loạn chức năng thận. N ũ ệu về độ tin
toản và hiệu quả cùa TENOF EM đối với những bệnh nhân suy thận ở mức độ trung binh và nghiêm
trọng (độ thanh thải creatinin < 50 ml/phút) còn hạn chế. Dữ liệu về tinh an toản lâu dải cùa thuộc
cũng chưa được đảnh giả ở bệnh nhân suy thận nhẹ (độ thanh thải oreatỉnin 50—80 ml/phủt). Do đó.
chỉ nên dùng TENOF EM ở bệnh nhân suy thận nếu những lợi ích tiềm năng từ việc điều trị được ghi
nhận là nhiến hơn so với các rùi ro tiềm ẩn đối với bệnh nhân. Cần theo dõi chặt chẽ chức năng thận
ở bệnh nhân suy thận (xem mục Cảnh báo và thận trọng khi dùng thuốc). Việc điều chỉnh khoảng
cảoh giữa các liều được khuyến cảo đối với những bệnh nhân có độ thanh thải creatinin từ 30 dến 40
mllphút. Sự điều chinh về liều lượng nảy vẫn chưa được xác nhận trong cảc thử nghiệm lâm sảng vả
cần theo dõi chặt chẽ cảo phản ứng lâm sảng ở bệnh nhân khi điếu trị (xem mục Cảnh báo vả thận
trọng khi dùng thuốc và Đặc tính dược động học).
Bệnh nhân suy thận nhẹ (độ thanh thải creatinin 5 0—80 mI/phút): Dữ liệu từ cảc nghiên cứu lâm sảng
ở những bệnh nhân suy thận nhẹ sử dụng TENOF EM 1 1iều/ngảy còn hạn chế (xem mục Cảnh bảo
vả thận trọng khi dùng thuốc).
Bệnh nhân suy thận ở mức độ trung bình (độ thanh thải creatinin 30-49 mI/phút): Khuyến cảo điều
trị với TENOF EM mỗi 48 giờ, dựa trên mô hình về dữ liệu dược động học khi ảp dụng liều đơn cùa
cmtricitabin vả tcnofovir disoproxil fumarat ở những bệnh nhân không nhiễm HIV và mắc bệnh suy
thận ở nhiều mức độ khác nhau (xem mục Cảnh bảo và thận trọng khi dùng thuốc).
Bệnh nhán suy thận nặng (độ thanh thải creatinin < 30 mI/phút) vả chạy thận nhán tạo: Không
khuyến cáo điếu trị với TENOF EM ở bệnh nhân suy thận nghiêm trọng (độ thanh thải creatinin < 30
ml/phút) và những người chạy thận nhân tạo do không thế giảm liều phù hợp đối với dược phẩm kết
hợp dạng viên nảy.
Bệnh nhún suy gun: Các dặc tính dược động học cùa TENOF EM vẫn chưa được nghiên cứu ở bệnh
nhân suy gan. Đặc tính dược động học của tenofovir đã dược nghiên cứu ở những bệnh nhân suy gan
và cho thấy không cần điều chinh liều tenofovir disoproxil fumarat ở nhóm bệnh nhân nảy. Do
cmtricitabin được ohuyến hóa rất it ở gan và bải tiết qua đường thận nên không cần điều chinh liều
với TENOF EM ở bệnh` nhân suy gan (xem mục Cảnh báo và thận trọng khi dùng thuốc và Đặc tinh
dược động học).
Nếu ngưng dùng TENO ~ EM ở những đối tượng đồng nhiễm HIV và virus viêm gan B, cần theo dõi
chặt chẽ cảc biếu hiện củ đợt kịch phảt viêm gan đối với những bệnh nhân nảy (xem mục Cảnh bảo
và thận trọng khi
Mui… bệnh nĨzẳn nhi: Tính an toản và hiệu quả của TENOF EM ớ trẻ em dưới 18 tuổi vẫn chưa được
chứng minh (xem mục Đặc tính dược động học).
Cách dùng:
'1`ENOF EM nẻn dược dùng 1 lần mỗi ngảy bằng đường uống, kết hợp với thực phấm.
Nếu bệnh nhân cảm thấy khó nuốt, có thế 1ảm rã TENOF EM trong khoảng 100 ml nước, nước oam
hoặc nước nho và uống ngay sau đó.
Chống chỉ định:
Qt'1a mẫn với hoạt chất hoặc bất kỳ thảnh phần nảo của thuốc.
Tưong tác thuốc:
Do '1`ENOF EM có chứa etntricitabin vả tenofovir disoproxil fumarat, bất kỳ sự tương tảo nảo đã
dược xảo định xảy ra riêng biệt với cảc chất nảy đều có thể gặp phải với TENOF EM. Cảo nghiên cứu
về tương tác thuốc mới chỉ được thực hiện ở người lớn.
Dược động học ở trạng thái ổn định cùa emtricỉtabin vả tcnofovir không bị ảnh hướng khi
emtricỉtabin vả tenofovir disoproxil fumarat được dùng kểt hợp với nhau so vởi khi sử dụng đơn 1e.
ln vítro vả cảc nghiên cứu tương tảo dược động học lâm sảng cho thắy tiềm năng xảy ra tương tảo
giữa các thuốc được chuyến hóa qua trung gian CYP4SO có liên quan đển emtricỉtabin vả tenofovir
disoproxil fumarat với cảc thuốc khảo là thấp.
Không khuyến cáo sử dụng đồng thời:
Do có tính tương đồng với emtricỉtabin, TENOF EM không được sử dùng đồng thời với các chất
đồng đắng thuộc nhóm cytidin khác, như iamivudin (xem mục Cảnh báo và thận trọng khi sử dụng
thuốc).
TENOF EM 1ảthuốc kết hợp cố định nên không được dùng đồng thời với các dược phấm khảc có
chứa thảnh phần emtricỉtabin hoặc tenofovir disoproxil fumarat.
TENOF EM không được dùng đồng thời với adefovir dipivoxil.
Didanosin: Không khuyến cảo dùng đồng thời TENOF EM với didanosin (xem mục Cảnh háo vit
thận trọng khi dùng thuốc và Bảng 1).
Các Ioại thuốc được thái trừ qua thận: Do emtricỉtabin vả tenofovir được thải trừ chủ yếu qua thận.
việc dùng đồng thời TENOF EM với Các thuốc Iảm giảm ohức năng thận hoặc cạnh tranh bải tiết chủ
động ở ống thận (như oidofovir) có thề lảm tăng nồng độ trong huyết thanh oủa emtricỉtabin,
tenofovir vảlhoặc cùa các thuốc dùng đồng thời.
Trảnh dùng TENOF EM đồng thời hoặc sau khi mới sử dụng cảc thuộc gây độc ch t ậ . _t số ví
dụ thuốc bao gồm, nhưng không giới hạn, như aminoglycosid, amphotericin B, t`oscamet, ganciclovir.
pentamidin, vancomycin, cidofovir hoặc interleukin-Z (xem mục Cảnh bảo và thận trọng khi dùng
thuốc).
Các tương tác khác:
Sự tương tác gỉữa các thảnh phần của TENOF EM với oảo thuốc ức chế protease và các thuốc ức chế
men sao chép ngược nucleosid, được trình bảy trong Bảng 1 bên dưới (sự gia tăng được biếu diễn
theo ký tự “1”, sự giảm được biếu diễn như “1", không có thay đối được biếu diễn là "".4—› hai lần
một ngảy được ký hiệu là “b.i.d.” và một 1ần một ngảy được ký hiệu là “q.d."). Khoảng tin cậy 90%
được ghi trong ngoặc, nếu có.
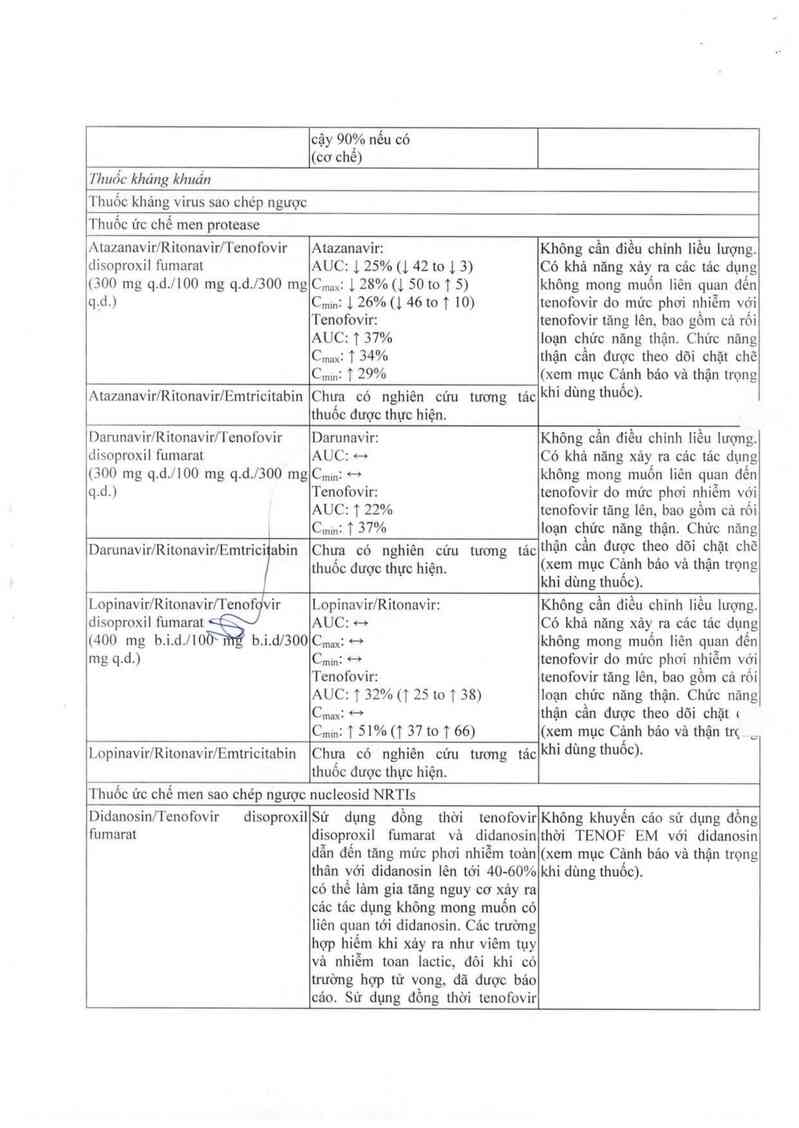
Bảng 1: Sự tương tảo giữa cảo thảnh phần độc lập cùa TENOF EM với các thuốc khác
Dược phấm theo lĩnh vực điềutrị Ành hướng trên nồng độthuốc Khuyển cảo lưu ý khi diều trị
Phần trăm thay đổi trung binh cùa đồng thời với TENOF EM
diện tich dưới đường cong AUC,(emtricitabin 200 mg. tenofovir
nồng độ thuốc tối đa Cmax, nồng độ disoproxil fumarat 300 mg)
thuộc tối thiếu cm… với khoảng tin
cậy 90% nếu có
(cơ chế)
Thuốc kháng khuẩn
Thuốc kháng virus sao chép ngược
Thuốc ức chế men protease
Atazanavir/Ritonavir/Tenofovir Atazanavir: Không cần điếu chỉnh liều lượng.
disoproxil fumarat
(300 mg q.d./IOO mg q.d./3OO mg
q._d.i
AUC: 125%(142t013)
Cmax: l 28%(1 5010 T 5)
C…: 1 26% (1 46 toT 10)
Tenofovir:
AUC: T 37%
Cmax: 1 34%
CinmĨ T 29%
Atazanavir/Ritonavir/Emtricitabin
Chưa có nghiên cứu tương tác
thuốc được thực hiện.
Có khả năng xảy ra cảc tảo dụng
không mong muốn liên quan đến
tenofovir do mức phơi nhiễm với
tenofovir tăng iên, bao gồm cả rối
loạn chức năng thận. Chức nãng
thận cẩn được theo dõi chặt chẽ
(xem mục Cảnh báo và thận trọng
khi dùng thuốc).
Darunavir/Ritonavir/Tenofovir
disoproxil fumarat
(300 mg q.d.llOO mg q.d.l3OO mg
q.d.)
1
Darunavir:
AUC: 4—t
Cmin: "'
Tenofovir:
AUC: T 22%
Cmmz “[ 37%
DarunavirlRitonavir/Emtric7abin
Chưa có nghiên cứu tương tảo
thuôo được thực hiện.
Không cần điều chinh liều iượng.
Có khả năng xảy ra cảc tảo dụng
không mong muốn liên quan đến
tenofovir do mức phơi nhiễm với
tenofovir tăng lên, bao gồm cả rối
loạn chức năng thận. Chức năng
thận cần được theo dõi chặt chẽ
(xem mục Cảnh báo vả thận trọng
khi dùng thuốc).
Lopinavir/Ritonavir/Tenof vir
disoproxil fumarat
(400 mg b.i.d./IO
mg q.d.)
b.i.dl3OO
Lopinavir/Ritonavir:
AUC: <-›
Cman 4—›
Cminz H
Tenofovir:
AUC: 1 32% (1 25 to T 38)
Cmax: H
c……: 1 51% (1 37 to 1 66)
Lopinavir/Ritonavir/Emtrioitabin
Chưa có nghiên cứu tương tác
thuốc được thực hiện.
Không cần đỉếu chinh liều lượng.
Có khả năng xảy ra cảc tác dụng
không mong muốn liên quan đến
tenofovir do mức phơi nhiễm với
tenofovir tăng lên, bao gổm cả rối
loạn chức năng thận. Chức năng
thận cần được theo dõi chặt t
(xem mục Cảnh bảo và thận trc_
khi dùng thuốc).
Ụ
Thuốc ức chế men sao chẻp ngược
nucleosid NRTIs
Didanosin/Tenofovir
fumarat
disoproxil
Sử dụng đồng thời tenofovir
disoproxil fumarat vả didanosin
dẫn đến tăng mức phơi nhiễm toản
thân với didanosin lên tới 40-60%
có thế lảm gia tăng nguy cơ xảy ra
các tảo dụng không mong muốn có
iiên quan tới didanosin. Cảo trường
hợp hiếm khi xảy ra như viêm tụy
và nhiễm toan lactic, đôi khi có
trường hợp tử vong, đã được bảo
cáo. Sử dụng đồng thời tenofovir
Không khuyến cảo sư dụng đồng
thời TENOF EM với didanosin
(xem mục Cảnh bảo và thận trọng
khi dùng thuốc).
disoproxil fumarat vả didanosin với
liều 400 mg hảng ngảy được ghi
nhận lảm giảm đảng kể số lượng tế
bảo CD4, khả năng do có sự tương
tảo nội bảo Iảm tăng phosphoryl
hóa (hoạt chất) cùa didanosin. Cảo
trường hợp tỷ lệ cao về thất bại
virus học trong một vải sự kết hợp
thử nghiệm để điều trị nhiễm HIV-
1 đã được bảo cảo khi gỉảm liều
didanosin xuống còn 250 mg vả sư
dựng động thời với tenofovir
disoproxil fumarat.
DidanosỉnlEmtricitabin Chưa có nghiên cứu tương tác
thuôo được thực hiện.
Các nghiên cứu được thực hiện với các săn phẩm thuốc khác
Emtricitabin: In vitro, emtricỉtabin không ức chế sự chuyền hóa qua trung gian bởi bất kỳ một đồng
dạng nảo cùa CYP4SO ở người được liệt kế sau đây: 1A2, 2A6, 2136, 2C9, 2C19, 2D6 vả 3A4.
Emtricitabin không ức chế enzym chịu trảch nhiệm trong quá trình glucuronid hóa.
Không ghi nhận có tương tảo dược động học lâm sảng đảng kể khi sử dụng đồng thời emtricỉtabin với
indinavir, zidovudin, stavudin hoặc famciclovir.
Tenofovir disoproin fi4marat: Sử dụng đồng thời lamivưdin, indinavir, efavirenz, neiiì avir ho'
saquinavir (ritonavir boosted), methadon, ribavirin, rifampicin, adefovir dipivoxil h _ ẺẨ
trảnh thai nội tiết tố norgestimat/ethinyl oestradioi với tenofovir disoproxil fumarat không ây ra bắt
kỳ sự tương tác dược động học iâm sảng đáng kể nảo.
TENOF EM: Sử dụng đồng thời tacrolimus với TENOF EM không gây ra bắt kỳ sự tương tác dược
dộng học lâm sảng đảng kề nảo.
Cãnh báo và thận trọng khi dùng thuốc:
Sử dụng đồng thời với các thuốc khác
Không dùng đồng thời TENOF EM với oảo thuốc khác có chứa emtricỉtabin, tenofovir disoproxil
(như fumarat) hoặc cảc dồng đẳng thuộc nhóm cytidin khảo, ví dụ Iamivudin (xem mục Tương tác
thuốc). Không dùng đồng thời TENOF EM với adefovir dipivoxil.
Sử dụng kết họp tenofovir disoproxil fumarat với didanosin: Không khuyến cáo. Sử dụng kết hợp
tenofovir disoproxil fumarat vả didanosin dẫn đến tăng mức phơi nhiễm toản thân với didanosin iên
tới 40-60% có thế 1ảm gia tăng nguy cơ xảy ra cảc tảo dụng không mong muốn có liên quan tới
didanosin (xem mục Tương tảo thuốc). Các trường hợp hiếm khi xảy ra như viêm tụy vả nhiễm toan
lactic, đôi khi có trường hợp tử vong, đã được báo cáo. Sử dụng kết hợp tenofovir disoproxil fumarut
với didanosin ở liều 400 mg hảng ngảy 1ảm giảm đảng kể số lượng tế bảo CD4, khả năng do có sự
tương tảo nội bảo Iảm tăng phosphoryl hóa (hoạt chắt) của didanosin. Khi giảm liều didanosin xuống
cờn 250 mg trong liệu phảp điều trị kết hợp với tenofovir disoproxil fưmarat ghi nhận oó tỷ lệ cao
thắt bại virus học trong một vải sự kết hợp thử nghiệm.
Liệu pháp nucleosid bộ ba:
Đã có cảc bảo cảo về tỷ lệ thất bại virus học cao và sự xuất hiện các trường hợp khảng thuốc ở giai
đoạn đầu khi tenofovir disoproxil fumarat được sử dụng kết hợp với lamivudin vả abacavir cũng như
với lamivudin vả didanosin trong phác dồ diếu trị mỗi ngảy một lần. Do có sự tương đồng chặt chẽ về
cấu trúc giữa Iamìvudin vả emtricỉtabin củng như cảc sự tương đồng trong dược động học và dược
lực học cùa hai chất nảy, nên cảc trường hợp tương tự cũng có thể xảy ra khi sử dụng dồng thời viên
lamivudin với một đồng đắng thứ ba cùa nucleosid.
Một số bệnh nhiễm trùng cơ hội:
Bệnh nhân được điều trị với TENOF EM hoặc với bất kỳ liệu phảp điếu trị khảng virus sao chép
ngược nảo khảo có thế,tiếp tục gặp phải cảc bệnh nhiễm trùng cơ hội và cảc biến chứng khảo do
nhiễm 1—11v. Do đó, bệ
nhân cần được giảm sảt lâm sảng chặt ohế bới oảo bảo sĩ có kinh nghiệm
trong việc diều trị cho 11 ửng bệnh nhân mắc phải oảo bệnh liên quan đến 111v.
Lả_v nhiễm HIV:
Mặc dù tảo dựng ức ch ' virus trong các liệu phảp điều trị kháng virus sao chép ngược dã được chứng
kế nguy cơ lây truyền qua đường tình dục, rủi ro tồn dư vẫn không thế bị loại
trừ. Cần biện phảp phòng ngừa nhằm ngăn chặn sự lây nhiễm cần được thực hiện theo cảo hướng dẫn
cấp quốc gia.
Suy thận:
1-lmtricitabin vả tenofovir chủ yểu được đảo thải qua thận bới sự kết hợp cùa lọc oầu thận và bải tiết
chủ động ở ống thận. Các trường hợp suy thận, suy giảm chức năng thận, nồng độ creatinin tăng cao.
giảm phosphat huyết và bệnh ống thận gấn (bao gồm cả hội chứng Fanconi) đã được ghi nhận liên
quan đến việc sử dụng tenofovir disoproxil fumarat trong thực hảnh lâm sảng (xem mục Tác dụng
không mong muốn).
Khuyến cáo kiềm tra độ thanh thải creatinin cho tất cả cảc bệnh nhân trước khi bắt đầu điều trị với
TF.NOF EM đồng thời cần theo dõi chức năng thận (độ thanh thải creatinin và nồng độ phosphat
trong huyết thanh) sau từ 2 dến 4 tuần bắt đầu điều trị, sau 3 thảng điều trị và cứ 3 đến 6 thảng một
lần sau đó ở những bệnh nhân không có cảc yếu tố nguy cơ gây suy thận. Ở những bệnh nhân có
nguy cơ bị suy thận, chức nãng thận cần được giảm sảt thường xuyên và chặt chẽ hơn.
Bệnh nhản suy thận (độ thanh thải creatinin < 80 mI/phủt). bao gồm cả bệnh nhân chạy thận nhún
lạo: Độ an toản cho thận cùa TENOF EM mới chỉ được nghiên oứu với một mức độ rất hạn chế 6
một số bệnh nhân bị suy giảm chức năng thận (độ thanh thải creatinin < 80 mllphút). Khuyến cảo
điều chinh khoảng cảoh giữa các iiều ở những bệnh nhân có độ thanh thải creatinin 30-49 m1lpht'tt
(xem mục Liều lượng vả cách dùng). Dữ liệu nghiên cứu lâm sảng hạn chế cho thấy rằng khoảng
cảoh dùng thuộc giữa cảc liếu kéo dải không phải lả tối ưu và oó thể dẫn đến Iảm tăng độc tinh cũng
như phản ứng có thế không đầy đù. Hơn nữa, trong một nghiên cứu lâm sảng nhò, một nhóm nhớ
bệnh nhân có độ thanh thải creatinin từ 50 đến 60 mI/phút được dùng tenofovir disoproxil i`umarat kết
hợp với emtricỉtabin mỗi 24 giờ có mức độ phơi nhiễm với tenofovir cao hơn gắp 2—4 lần và lảm suy
yếu chức nãng thận hơn (xem mục Đặc tính dược động học). Do đó, cần thặn trọng đảnh giá cảc lợi
ich-nguy cơ tiếm năng có thể xảy ra khi sử dụng TENOF EM ở bệnh nhân oó độ thanh thải creatinin
< 60 mllphút, và đồng thời giảm sát chặt ohế chức năng thận cùa người bệnh. Ngoài ra. cần theo dõi
chặt chẽ đảp ứng lâm sảng đội với điều trị 6 những bệnh nhân dùng TENOF EM với một khming
cảoh giữa các lỉếu kéo dải. Không khuyến cảo sử dụng TENOF EM ở bệnh nhân bị suy thận nghiêm
trọng (độ thanh thải creatinin < 30 milphút) và ở bệnh nhân oấn chạy thận nhân tạo kế từ khi khòng
thể đạt được mức giảm liều phù hợp với viên nén kết hợp (xem mục Liều lượng & cảch dùng và Đặc
tính dược động học). |
Nếu nồng độ phosphat trong huyết thanh < 1,5 mng (0,48 mmol/l) hoặc độ thanh thải cần gin…
xuống còn < 50 ml/phút ở bệnh nhân đang điều trị với TENOF EM, cần kiếm tra lại cả ang thận
trong vòng 1 tuần, bao gồm cả đo chỉ số đường huyết, nồng độ kali trong mảu và nồng độ glucose
trong nước tiểu (xem mục Tảo dụng khỏng mong muốn, bệnh lý ở ống thận gấn). Cần cân nhắc tạm
dừng điều trị với TENOF EM ở những bệnh nhân có độ thanh thải creatinin giảm xuống còn < 50
mllphủt hoặc nồng độ phosphat trong huyết thanh giảm xuống còn < 1,0 mng (0,32 mmol/I). C ũng
cằn xem xét tạm dừng điều trị với TENOF EM trong trường hợp suy giảm chức năng thận mà không
có bất kỷ nguyên nhân nảo khác được xảo định.
Trảnh sử dụng TENOF EM động thời hoặc sau khi mới dùng các loại dược phẩm gây độc cho thận
(xem mục Tương tác thuốc). Cần theo dõi chức năng thận hảng tuần nếu bắt bưộc phải sử dụng đồng
thời TENOF EM với cảc chẩt gây độc cho thận.
Các trường hợp suy thận cấp sau khi bắt đầu điều trị với liều cao hoặc với nhiều loại thuộc chộng
viêm không steroid (NSAIDS) đã được bảo cảo ở bệnh nhân được điều trị với tenofovir disoproxil
fumarat kèm theo cảc yếu tố nguy cơ bị rối ioạn chức năng thận. Chức năng thận cần được theo dõi
đầy đủ nếu bệnh nhân được điều trị động thời TENOF EM với một loại thuộc chống viêm không
steroid.
Một nguy cơ suy thận cao đã được ghi nhận ở bệnh nhân dùng tenofovir disoproxil fumarat kết hợp
với chất ức chế protease được tăng cường với ritonavir hoặc cobicỉstat. Cần theo đôi chặt chẽ chức
nảng thận ở những bệnh nhân nảy (xem mục Tương tảc thuốc). Cần đảnh giá cấn thận khi điểu trị
đồng thời với tenofovir disoproxil fumarat và một chất ức chế protcase tăng cường ở bệnh nhân có
_véu tố nguy cơ bị bệnh thận.
Bệnh nhân nhiễm H! V mang đột biến:
Tránh điều trị với TENOF EM ở những bệnh nhân nhiễm HIV-i mang đột biến K65R đã từng điều
trị khảng virus sao chép ngược trước đó (xem mục Đặc tinh dược động học).
Ảnh hưởng đến xương:
Trong một nghiên cứu iâm sảng đối chứng kéo dải 144 tuần nhằm so sảnh tenofovir disoproxil
t'umarat với stavudin trong liệu trình kết hợp với lamivudin vả efavirenz ở bệnh nhân chưa từng điều
trị kháng virus sao chép ngược trước đó. một mức giảm nhỏ ở mật độ khoảng xương ở hông và cột
sống đã được ghi nhận ở cả 2 nhóm điều trị.
Giam mật dộ khoảng xương cột sống vả cảc thay đổi trong chi dấu sinh học ở xương so với thời điềm
ban đầu được ghi nhận tăng lên đáng kể ở nhóm bệnh nhân điếu trị với tenofovir disoproxil fumarat ở
tuần thứ 144. Giảm ật độ khoảng xương ở hông cũng được ghi nhận tăng lên đảng kế ở nhóm bệnh
nhím nảy ở tuần thứ . Tuy nhiên. khỏng có sự gia tăng nguy cơ gãy xương hoặc những bằng chứng
cho thấy bất thường ở ương có liên quan về mặt lâm sảng sau 144 tuần điều trị.
Bất thường ở x khi gây ra găy xương) có thể kèm theo bệnh lý ống thận gấn (xem mục Tảo
dụng không mong muốn). Cần thực hiện cảc kiếm tra thích hợp nếu nghi ngờ có bất thường ở xương.
Bệnh nhân đồng nhiễm III V và virus viêm gan B hoặc virus vỉêm gan C:
Bệnh nhân mắc viêm gan B hoặc viêm gan C mãn tinh được điếu trị bằng liệu pháp khảng virus sao
chép ngược có nguy cơ gia tăng các phản ứng bắt lợi nghiêm trọng cho gan và có khả năng gây tử
vnng.
Cảc bảo sĩ nên tham khảo hướng dẫn về diều trị HIV hìện hảnh dề đạt được kiềm soát tối ưu khi điều
lrị cho những bệnh nhân đổng nhiễm HIV và virus viêm gan B (HBV).
Trong trường hợp cần thực hiện liệu phảp điều trị khảng virus cho bệnh nhân đồng nhiễm viêm gan B
hoặc viêm gan Ci vui lòng tham khảo thêm Hướng dẫn sử dụng cùa cảc loại thuốc liên quan.
Tính an toản và hiệu quả cùa TENOF EM chưa được thiết lập trong điều trị nhiễm HBV mãn tính. Cả
cmtricitabin vả tcnofovir khi được sử dụng đơn lẻ cũng như trong cảc liệu trình điều trị kết hợp đều
cho thắy hoạt tinh kháng HBV trong các nghiên cứu dược lực học (xem mục Đặc tính dược động
học). Kinh nghiệm lâm sảng hạn chế chỉ ra rằng emtricỉtabin vả tenofovir disoproxil fumarat có hoạt
tinh kháng HBV khi được sử dụng trong liệu phảp điều trị kết hợp để kiếm soát tình trạng nhiễm
HIV.
Ngưng sử dụng TENOF EM ớ bệnh nhân động nhiễm HIV và HBV có thể dẫn đến cảc đợt viêm gan
cấp tính trầm trọng. Cần theo dõi chặt chẽ cả trên lâm sảng và trên kết quả xét nghiệm it nhất ] vải
thảng sau khi ngưng điều trị với TENOF EM ở bệnh nhân đồng nhiễm HIV và HBV. Nếu cằn thiết.
bệnh nhân có thể tiếp tục lại liệu phảp điều trị viêm gan B sau khi ngưng thuốc. Không khuyến cảo
ngưng điều trị ở bệnh nhân mắc bệnh gan tiến triển hoặc xơ gan. do cảc đợt viêm gan sau khi ngưng
điều trị có thể dẫn tới xơ gan mất bù.
Bệnh gan:
Tính an toản vả hỉệu quả cùa TENOF EM chưa được thỉết lập ở bệnh nhân có cảc triệu chứng rối
loạn gan nghiêm trọng tiềm ẩn. Dược động học của TENOF EM chưa được nghiên cứu ở bệnh nhỉ…
suy gan. Đặc tinh dược động học của tenofovir đã được nghiên cứu ở bệnh nhân bị suy gan vả ghi
nhận không cần điều chinh liều ở nhóm bệnh nhân nảy. Do emtricỉtabin chuyển hóa ở gan rất ít vả
được bải tiết qua thận, khả năng không cần điều chỉnh liều khi điều trị với TENOF EM ớ bệnh nhân
bị suy gan (xem mục Đặc tính dược động học).
Bệnh nhân đã bị rối loạn chức năng gan trước đây, bao gồm cả viêm gan hoạt động mãn tính. sẽ có
một sự gia tăng tần suất gặp phải cảc bất thường chức năng gan trong quả trinh đỉều trị với liệu p “p
kết hợp khảng virus sao chép ngược (CART). Những bệnh nhân nảy cần được theo Ề_ _
cảc tiêu chuẩn thực hảnh y. Nếu có bất kỳ dấu hiệu cho thấy bệnh gan trở nên trầ
trọng hơn ở
những bệnh nhân nảy, cần xem xét tạm dùng hoặc ngưng điều trị.
Loạn dưỡng lipid:
Liệu phảp điều trị kết hợp khảng virus sao chép ngược liên quan đến sự tải phân bố mỡ trong cơ thể
(Ioạn dưỡng lipid) ở bệnh nhân nhiễm HIV. Hậu quả lâu dải cùa các trường hợp nảy hiện vẫn chưa
được biết rõ. Chưa có kểt luận đầy đủ về cơ chế nảy. Có giả thuyết đã được đưa ra về mối iiẻn hệ
giữa tình trạng quả phát u mỡ nội tạng với các chẩt ức chế protease và tình trạng teo mô mở với các
chất ức chế men sao chép ngược nucleosid.
Một nguy cơ cao gặp phải tình trạng Ioạn dưỡng lipid được ghi nhận có Iỉên quan đến các yếu tố cá
nhân như tuồi cao, và cảc yếu tố có liên quan đến thuốc ví dụ như khoảng thời gian điều trị kháng
virus sao chép ngược kéo dải hơn cũng như có liên quan đến các rối loạn chuyền hóa. Kiếm tra lâm
sảng cần bao gồm cả việc đảnh giả các dấu hiệu thể chất về tái phân phối chất béo. Cần cân nhắc
kiểm tra nồng độ lipid trong huyết thanh và đường huyết lúc đói. Các tình trạng rối loạn lipid cằn
được kiềm soát lâm sảng thích hợp (xem mục Tác dụng không mong muốn).
Do tcnofovir có cấu trúc tuong tự như cảc đồng dạng của nucleosid nên nguy cơ mắc phải loạn
dưỡng lipid lá không thể Ioại trừ. Tuy nhiên, dữ liệu lâm sảng qua IM tuần ở nhóm bệnh nhân chưa
từng điều trị khảng virus sao chép ngược trước đó chi ra rằng nguy cơ gặp phải loạn dưỡng lipid khi
dùng tenofovir disoproxil fiJmarat thấp hơn khi dùng stavudin với liệu trinh kết hợp với lamivudin vả
efavirenz.
Rối Ioạn chức nãng !y lạp Ihễ:
Cảc dồng dạng cùa nucleosid vả nucleotid đã được chứng minh in vitro vả in vivo là gây ra tốn
thương cho ty lạp thể ở nhiều mức độ. Đã có cảc bảo cáo về tinh trạng rối Ioạn chức năng ty lạp thể
phát hiện ở trẻ sơ sinh âm tính với HIV bị phơi nhiễm trong tử cung vả/hoặc sau khi sinh với cảc
dồng dạng cùa nucleosid. Cảc tảc dụng không mong muốn chinh được ghi nhận là các rối loạn huyết
học (thiếu máu, giảm bạch cầu trung tính)i các rối loạn chuyển hóa (tăng nồng độ iactat máu, tăng
nồng độ lipase máu). Các tảc dụng nây thường là tạm thời. Một vải trường hợp rối loạn hệ thần kinh
khới phát muộn cũng dã dược báo cảo (tảng trương lực cơ. co giật. hảnh vi bất thường). Cảc rối loạn
thằn kinh nảy lả thoảng qua hay lâu dải hiện vẫn chưa được biết rõ. Bất kỳ trẻ em nảo phơi nhiễm
trong tử cung với các đồng dạng cùa nucleosid vả nucleotid, kể cả trẻ em âm tính với HIV, cần được
theo dõi chặt chẽ trên | m sảng cũng như trên cảc kết quả xét nghiệm và cần được kiềm tra đầy đủ để
đảnh giá khả nảng bị r'i loạn chức năng ty lạp thế trong trường hợp xuất hiện cảc dấu hiệu hoặc triệu
chứng liên quan n phảt hiện nảy không Iảm ảnh hưởng đến cảc khuyến nghị quốc gia hiện hảnh
trong việc sư ụng i_u pháp điều trị kháng virus sao chép ngược ở phụ nữ mang thai đế ngản chặn
iâ_v nhiễm HIV từ mẹ sang con.
Hội chửng tái kỉc/z hoạt miễn dịch:
Ồ bệnh nhân nhiễm HIV bị suy giảm miễn dịch trầm trọng tại thời điếm bắt đầu điều trị khảng virus
sao chép ngược, phản ứng viêm đối với tác nhân gây bệnh cơ hội không triệu chứng hoặc còn sót lại
có thế phát sinh và gảy ra các tình trạng lâm sảng nghiêm trọng, hoặc lảm cho cảc triệu chứng trở nên
xấu hơn. Thỏng thường, những phản ứng nảy được quan sảt thấy trong vòng một vải tuần hoặc một
vải thảng dằu sau khi bắt đầu điều trị liệu pháp khảng virus sao chép ngược. Cảc trường hợp có liên
quan đã xảy ra như viêm võng mạc do vius cytomegalovirus (CMV), nhiễm vi khuẩn mycobacterium
toản thân vả/hoặc tại chỗ, và viêm phối do Pneumocystísjirovecii. Cần kỉếm tra đánh giá khi có bất
kỳ triệu chứng viêm nảo được phảt hiện và thiết lập điều trị nếu cần thiết.
Các rối loạn tự miễn dịch (như bệnh Graves) cũng đã được ghi nhận xảy ra trong trường hợp có sự tái
kích hoạt miễn dịch; tuy nhiên, thời gian khời phát được bảo cảo rất khảc nhau và cảc rối loạn nảy có
thể xảy ra nhiều tháng sau khi đã bắt đầu điều trị.
Bệnh nhân đồng nhiễm HIV và virus viêm gan B có thể gặp phải cảc đợt viêm gan cấp tính cùng với
hội chứng tải kich hoạt miễn dịch sau khi bắt đấu điều trị với liệu pháp kháng virus sao chẻp ngược.
Hoại từ xương:
Mặc dù nguyên nhân cùa trường hợp nảy được cho là do nhiều yếu tố (bao gồm cả việc sử dụng
thuốc có chứa thảnh phần corticosteroid, thói quen uống rượu, suy giảm mìễn dịch trầm trọng, chí số
khối cơ thể cao), cảc trường hợp hoại từ xương đã được bảo cảo đặc biệt xảy ra ở bệnh nhân nhiễm
HIV giai đoạn tiến triển vả/hoặc trải qua thời gian điều trị liệu phảp kháng virus sao chép ngược kéo
dải. Bệnh nhân cần dược tư vấn thăm khảm y tế ngay nếu cảm thấy đau nhức khớp xương. cứng khớp
hoặc đi chuyền khó khăn.
Người cao Iuổi:
Chưa có nghiên cứu sử dụng TENOF EM ở bệnh nhân từ 65 tuối trở lên. Bệnh nhân cao tuối có khả
năng gặp phải tình trạng suy giảm chức nảng thận cao hơn, do đó cần thận trọng khi diều trị với
TENOF EM ở nhóm bệnh nhân nây.
Lactose monohydrat:
TENOF EM có chứa lactose monohydrat. Do đó, không nên dùng thuốc nảy ở những bệnh nhân có
các vấn đề về di truyền hiếm gặp như không dung nạp galactose, thiếu hụt lactase Lapp, hoặc kém
hấp thu glucose-galactose.
Thời kỳ maug thai và cho con bú:
Phụ nữ mang thai:
Lượng dữ lỉệu trung binh về sử dụng thuốc ở phụ nữ có thai (từ 300 đến 1.000 trường h_ an , Yai)
cho thấy không có trường hợp dị tật hoặc độc tính với thai nhi/trẻ sơ sinh nảo iiên qua… sử
dụng emtricỉtabin vả tenofovir disoproxil fumarat. Các nghiên cứu trên động vật với emtricỉtabin vù
tenofovir disoproxil fumarat không cho thấy có độc tính sinh sản. Do đó, cẩn xem xét về việc sử dụng
TENOF EM trong thời kỳ mang thai, nếu cần thiết.
Phụ nữ cho con bủ:
Emtricitabin vả tenofovir dã được chứng minh là bải tiết trong sữa mẹ. Chưa có đủ thông tin về ảnh
hưởng của emtricỉtabin vả tenofovir ở trẻ sơ sinh. Do đó, không nên sử dụng TENOF EM trong thời
kỳ cho con bú.
Tuy nhiên, theo khuyến cáo chung phụ nữ bị nhiễm HIV không nên cho con bú trong bắt kỳ trường
hợp nâo nhằm trảnh lây nhiễm HIV cho em bé.
Khả nãng sinh sản:
Chưa có dữ liệu ở người về ảnh hưởng lên khả năng sinh sản cùa TENOF EM. Các nghiên cứu trên
động vật không ghi nhận có các ảnh hưởng có hại của thuốc lên khả năng sinh sản ở động vật.
Tác dụng không mong muốn:
Tóm tắt mức độ an toa`n của thuốc:
Trong một thử nghiệm lâm sảng ngẫu nhiên và mang tính mở (GS-Ol-934, xem mục Đặc tính dược
động học)` các tác dụng không mong muốn thường gặp nhắt đã quan sát thẳy được cho iả có khả
năng hoặc có thể liên quan đến emtricỉtabin vả/hoặc tenofovir disoproxil fumarat bao gồm buồn nôn
tlZ°/ớ) và tiêu chảy (7%). Tính an toản của emtricitabin vả tenofovir disoproxil fumarat trong nghiên
cứu nảy hoản toản phù hợp với những kinh nghiệm trước đó khi sử dụng đồng thời từng loại thuốc
trẻn với cảc thuốc khảng virus sao chép ngược khảo. Cảc tảc dụng không mong muốn hiếm gặp được
ghi nhận ở những bệnh nhân đang điều trị vởi tenofovir disoproxil fumarat là suy thận, suy giảm chức
năng thận và bệnh lý ống thận gần (bao gổm cả hội chứng Fanconi) đôi khi dẫn đến những bắt
thường ở xương ( it khi gây ra gãy xương). Do vậy, cằn thường xuyên theo dõi chức nãng thận ở
những bệnh nhản đang điếu trị với TENOF EM (xem mục Cảnh bảo và thận trọng khi dùng thuốc).
Chứng loạn dưỡng lipid cũng có liên quan dến việc điểu trị với tenofovir disoproxil fumarat vả
cmtricitabin (xem mục Cảnh bảo và thận trọng khi dùng thuốc và Tác dụng không mong muốn).
Khòng khuyến cáo điều trị đồng thời với tenofovir disoproxil fumarat vả didanosin do sự kết hợp nảy
có thể lảm tăng nguy cơ xảy ra cảc tảc dụng không mong muốn (xem mục Tương tảc thuốc). Chứng
viêm tụy và nhiễm acid lactic, đôi khi dẫn đến tử vong hiếm khi dược ghi nhận (xem mục Cảnh báo
vải thận trọng khi dùng thuộc . Việc ngưng điều trị với TENOF EM ớ những bệnh nhân động nhiễm
HIV và virus viêm ga có thể gây ra những đợt kịch phảt viêm gan cấp tính nghiêm trọng (xem
mục Cảnh bảo và thận trọng k i dùng thuốc).
Bảng tóm !ắt các tác dụng không mong muốn:
Cảc tảc dụng không mong muốn được cho lả phần nảo có khả năng liên quan đến việc điều trị với
TENOF EM ghi nhặn từ cảc thử nghiệm lâm sảng vả kinh nghiệm hậu lưu hảnh được iiệt kê trong
Bảng 2 dưới đây, dựa theo hệ thống cảc bộ phận trên cơ thế và tần suất xảy ra. Trong mỗi nhỏm được
phân loại dựa trẻn tấn suất, các tác dụng không mong muốn được sắp xếp theo thứ tự mức độ nghiêm
trọng giảm dần. Tần suất được xảc định theo quy ước sau: rất phổ biến (ì l/lO), phổ biến (2 1/100
đến < l/IO), không phổ biến (z … .000 đến < tnoo› hoặc hiếm gặp (z mo.ooo đến < … .000).
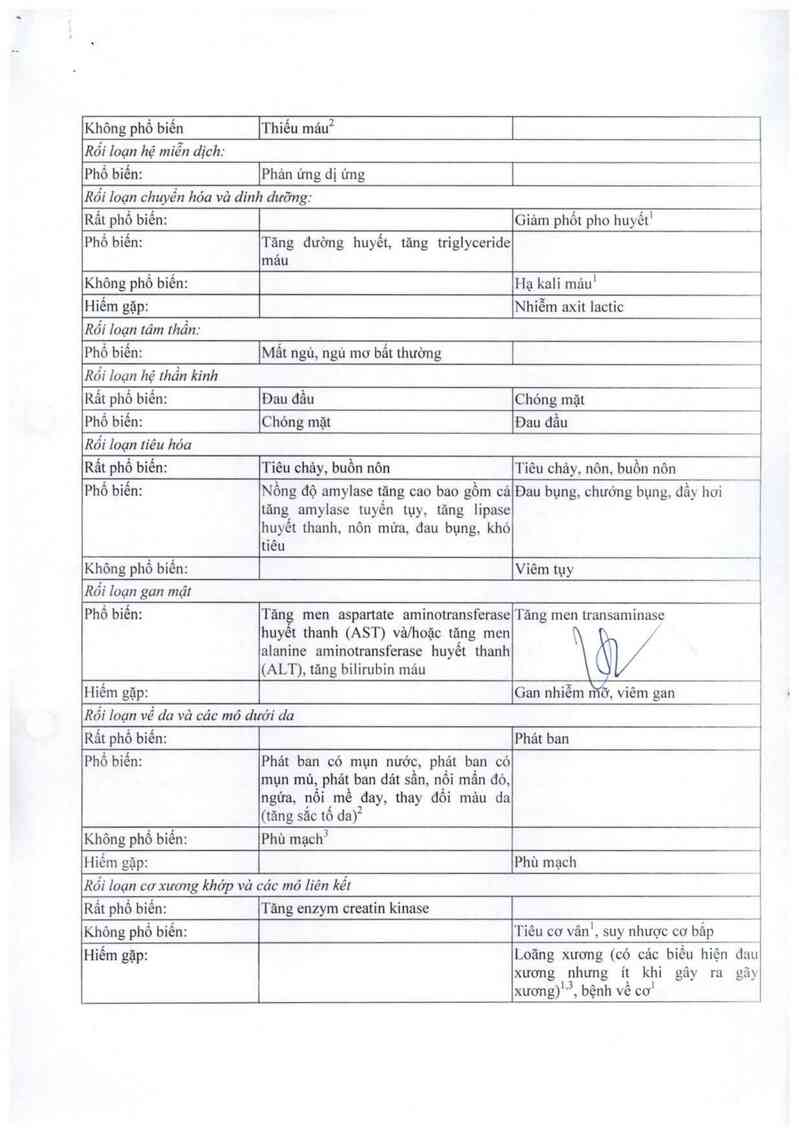
Búng 2: Bảng tóm Iắt các lác dụng khóng mong muốn Iiẻn quan đến những thảnh phần riêng biệt của
thuốc Emiricifabin vả Tenofovir Disoproxỉl F umaral dạng viên nén dựa lrén nghiên cứu lâm sảng và
kinh nghiệm hậu lưu hảnh
Tần suất xây ra ịEmtrỉcitabin ITenofovir disoproxil fumarat
Rối loạn máu vả hệ bạch huyết:
Phổ biến IGiảm bạch cầu trung tính |
Không phổ biến
|Thiêu máu²
|
Rối loạn hệ miễn dịch:
Phổ biến: |Phản ứng dị ứng [
Rối Ioạn chuyền hóa và dinh dưỡng:
Rất phổ biến: Giảm phốt pho huyếtI
Phổ biến: Tăng đường huyết, tăng triglyceride
mau
Không phổ biến: Hạ kali mául
Hiếm gặp: Nhiễm axit lactic
Rối Ioạn tảm thần:
Phổ biến:
Mất ngủ, ngủ mơ bất thường
Rối Ioạn hệ thần kinh
Rất phổ biến: Đau đầu Chóng mặt
Phổ biến: Chóng mặt Đau đầu
Rối Ioạn !iêu hóa
Rất phố biển: Tiêu chảy, buồn nôn Tiêu chảy, nôn, buồn nôn _
Phổ bỉến: Nồng độ amylase tặng cao bao gồm cả Đau bụng, chướng bụng, đầy hơi
tăng amylase tuyên tụy, tãng lipase
huyết thanh, nôn mừa, đau bụng, khó
tiêu
Không phổ biến: Viêm tụy
Rỏi Ioạn gan mật
Phổ biến:
Tăn men aspartate aminotransferase
huyet thanh (AST) vả/hoặc tăng men
alanine aminotransferase huyết thanh
(ALT), tăng bilirubin mảu
Tăng men transaminase
\Ồi/
Hiếm gặp: Gan nhiễm m/ỡ viêm gan _
Rối loạn về da và các mỏ dưới da
Rắt phổ biến: Phảt ban
Phổ biến: Phảt ban có mụn nước, phảt ban có
mụn mùa phát ban dảt sần, nổi mẩn đò,
ngứa, nội mề đay, thay đội mảu da
(tăng săc tố da)2
Không phổ biến: Phù mạch3
Hiếm gặp: Phù mạch
Rối Ioạn cơ xương khóp và các mô liên kêl
Rất phổ biến: Tăng enzym creatin kinase
Không phổ biến: Tiêu cơ vân', suy nhược cơ bắp
Hiếm gặp: Loãng xương (có các bỉều hiện đnu
xương nhưng ít khi gây ra gãy
1.3 . › ]
xương) , bẹnh ve cơ
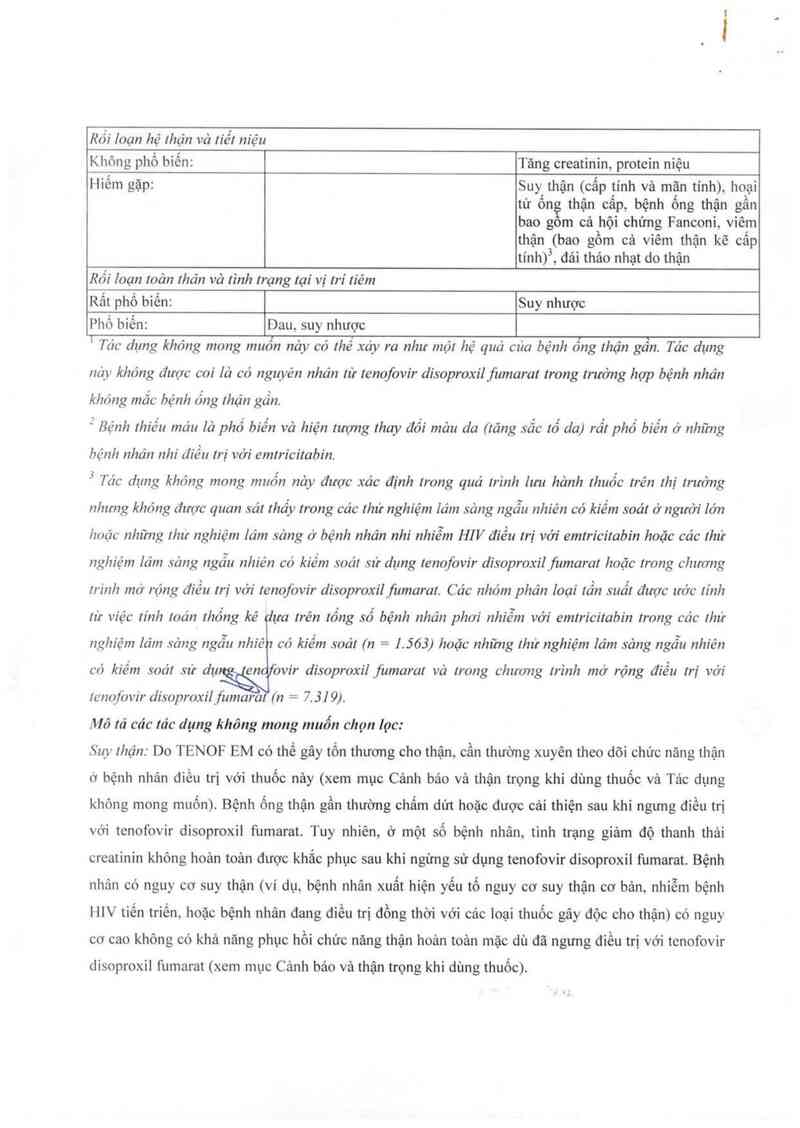
Rối Ioạn hệ Ihận vả tiết niệu
Không phổ biến: Tăng creatinin, protein niệu
Hiếm gặp: Suy thận (cấp tính và mãn tính), hoại
. K A [ n A A ).
tư on thạn cap, bẹnh ong thạn gan
bao gom cả hội chứng Fanconi, viêm
thận (bao gồm cả vỉêm thận kẽ câp
tinhỷ, đải thảo nhạt do thận
Rối loạn toản lhản vả tình Irạng tại vị trí Iiẻm
Rất phổ biến: Suy nhược
Phổ biến: Dau, suy nhược
I Túc dụng khỏng mong muốn nảy có thẻ xáy ra như một hệ quả cúa bệnh ống thận gẫn. Tăc dụng
nảy khỏng được coi lá có nguyên nhản từ tenofovir disoproxilfumarat trong trường họp bệnh nhăn
khóng mắc bệnh ống thận gần.
: Bệnh Ihiếu máu là phổ biến vả hiện tượng thay đồi mâu da (tãng sẳc tố da) rất phổ biến ở những
hệnh nhán nhi điểu trị với emtricỉtabin.
3 Tác dụng khỏng mong muốn nây được xác định lrong quá Irình lưu hảnh thuốc trẻn Ihị trường
nhưng khỏng được quan sát rhấy trong các Ihừ nghiệm lâm sảng ngẫu nhiên có kiếm soát ở người lớn
hoặc những lhư nghiệm lám sảng ở bệnh nhán nhi nhiễm H] V điều trị với emtricỉtabin hoặc ca'c thử
nghiệm Iảm sảng ngẫu nhiên có kíếm soát sử dụng Ienofovir dísoproxilfixmarai hoặc trong chương
rrinh mở rộng điều trị vởi lenofovir disoproxilfumaral. Các nhóm phân loại lần suất được ưởc tính
từ víệc tính mún lhống kẻ ựa trên tổng số bệnh nhân phơi nhíễm với emtricỉtabin trong các lhứ
nghíệm lâm sảng ngẫu nhiê có kiềm soái (n = 1.563) hoặc những lhử nghiệm lâm sảng ngẫu nhiên
có kiếm soát sử dụ en ovir disoproxil fizmaral vả Irong chương trình mở rộng điều trị với
Jenọfòvir di.s~oproxilfumara (n = 7.319).
Mô rả các tác dụng không mong muốn chọn lọc:
Suy thận: Do TENOF EM có thể gây tổn thương cho thận, cần thường xuyên theo dõi chức năng thận
ở bệnh nhân điều trị với thuốc nảy (xem mục Cảnh báo và thận trọng khi dùng thuốc và Tác dụng
không mong muốn). Bệnh ống thận gần thường chấm dứt hoặc được cải thiện sau khi ngưng điều trị
với tenofovir disoproxil fumarat. Tuy nhiên, ở một số bệnh nhân, tinh trạng giảm độ thanh thải
creatinin không hoản toản được khắc phục sau khi ngừng sử dụng tenofovir disoproxil fumarat. Bệnh
nhân có nguy cơ suy thận (ví dụ, bệnh nhân xuất hiện yếu tố nguy cơ suy thận cơ bản, nhiễm bệnh
HIV tiến triến. hoặc bệnh nhân đang điều trị đồng thời với cảc loại thuốc gây dộc cho thận) có nguy
cơ cao không có khả năng phục hồi chức năng thận hoản toản mặc dù đã ngưng điểu trị với tenofovir
disoproxil fumarat (xem mục Cảnh bảo và thận trọng khi dùng thuốc).
Tương tác với didanosin: Không khuyến cảo điếu trị đồng thời với tenofovir disoproxil fumarat vả
didanosin do sự kết hợp nảy sẽ lảm tăng 40-60% mức độ phơi nhiễm toản thân với didanosin. từ đó
sẽ lảm tăng nguy cơ xảy ra cảc tảo dụng không mong muốn liên quan đến didanosin (xem mục Tương
tảc thuốc). Chứng viêm tụy và nhiễm acid lactic, dôi khi dẫn đến từ vcng, hìếm khi được báo cáo.
Các bất thường về lipid, Ioạn dưỡng lipid vả chuyền hóa: Điều trị với liệu phảp kết hợp khảng virus
sao chép ngược (CART) được ghi nhận gây ra những bất thường về chuyến hóa như tãng triglyccrid
máu, tăng cholesterol mảu, chứng kháng insulin, tăng đường huyết và tăng lactat mảu (xem mục
Cảnh bảo và thận trọng khi dùng thuốc).
Liệu phảp điều trị kết hợp khảng vỉrus sao chép ngược (CART) cũng dẫn đến hiện tượng tái phân
phối mỡ trong cơ thể (chứng loạn dưỡng lipid) ở những bệnh nhân nhiễm HIV, bao gồm giảm lượng
mỡ ngoại vi và iượng mỡ dưới da trên khuôn mặt, tăng lượng mở ở vùng bụng và nội tạng, phì đại vú
và tich tụ mở ở phía sau cổ giữa hai vai (bướu trâu) (xem mục Cảnh báo và thận trọng khi dùng
thuốc).
Hội chứng tái kích hoạt míễn dịch: ó bệnh nhân nhiễm HIV bị suy giảm miễn dịch trầm trọng tại thời
điểm bắt đẩu điều trị khảng virus sao chép ngược, một phản ứng viêm nhiễm trùng cơ hội không triệu
chứng hoặc còn sót lại có thể xảy ra. Các rối Ioạn tự mỉễn dịch (ví dụ như bệnh Graves) dã được báo
cáo; tuy nhiên, thời gian khời phảt được ghi nhận rất đa dạng và cảc phản ứng nảy có thể xảy ra nhiều
thảng sau khi bắt đầu điều trị (xem mục Cảnh bảo và thận trọng khi dùng thuốc).
Chủng hoại Iử xương: Cảo trường hợp mắc chứng hoại từ xương dã được bảo cáo. đặc iệt ở hững
bệnh nhân xuất hiện những yếu tố nguy cơ chung đã được biết đến. bệnh nhân nhiễ iai đoạn
tiến triến hoặc phơi nhiễm với cảc liệu pháp điều trị kết hợp kháng virus sao chép ngược (C ART)
trong thời gian dải. Tần suất cùa cảc trường hợp nảy vẫn chưa được xảc định (xem mục Cảnh báo \ ù
thận trọng khi dùng thuốc).
Nhóm bệnh nhân nhi:
Hiện chưa có đủ dữ liệu về tính an toản cùa thuốc đối với trẻ em dưới 18 tuốì. Không khuyến cáo
điều trị bằng TENOF EM cho nhóm bệnh nhân nảy (xem mục Liều lượng và cảch dùng).
Các nhóm bệnh nhân đặc biệt khác:
Người cao tuốt“: TENOF EM vẫn chưa được nghiên cứu ở nhóm bệnh nhân từ 65 tuối trở lên. Bệnh
nhân cao tuối có nhiều khả nãng suy giảm chức năng thận hơn; do vậy, cần thận trọng khi điểu trị với
TENOF EM cho nhóm bệnh nhân nảy (xem mục Cảnh bảo và thận trọng khi dùng thuốc).
Bệnh nhân suy rhận: Do tenofovir disoproxil fumarat có thể gây độc cho thận. khuyến cảo theo dòi
chặt chẽ chức năng thận ở những bệnh nhân suy thận điều trị với TENOF EM (xem mục Liều lượng
và cách dùng, Cảnh bảo và thận trọng khi dùng thuốc và Đặc tính dược động học).
Bệnh nhán đồng nhiễm HIV/virus viẻm gan B hoặc virus viêm gan C : Nghiên cửu GS-Ol-934 chi
dược thực hiện trên một số it bệnh nhân đồng nhiễm virus viêm gan B (n=13) hoặc virus viêm gan C
(n=26). Các tảc dụng không mong muốn liên quan đến emtricỉtabin vả tenofovir disoproxil fumarat
ghi nhận được ở bệnh nhân dồng nhiễm HlV/virus viêm gan B hoặc HIV/virus viêm gan C tương tự
như cảc tảc dụng đã quan sảt thấy ở cảc đối tượng nhiễm HIV và không đồng nhiễm cảc bệnh khảc.
'l`uy nhiến. như dã được dự báo ở nhóm bệnh nhân nảy, tinh trạng tăng men aspartate
ztminotransferase huyết thanh (AST) vả men alanine aminotransferase huyết thanh (ALT) xuất hiện
thường xuyên hơn so với những bệnh nhân nhiễm HIV thông thường.
Dợl kịch phá! viêm gan sau khi ngưng đíều trị: Ở những bệnh nhân động nhiễm HIV và viêm gan B,
các bằng chứng lâm sảng và dựa theo kết quả xét nghiệm về bệnh viêm gan đã được ghi nhận xảy ra
sau khi ngưng điều trị (xem mục Cảnh báo và thận trọng khi dùng thuốc).
Báo cáo về các lác dụng không mong muốn !iềm năng:
Việc bảo các các tác dụng không mong muốn tiềm nãng sau khi sử dụng cảc sản phấm dược phấm iả
rắt quan trọng. Nhờ đói việc theo dõi thường xuyên mức độ cân bằng giữa lợi ích/nguy cơ cùa dược
phấm trờ nẻn dễ dảng hơn. Các chuyên gia chăm sóc sức khỏe có trảch nhiệm bảo các bất cứ tảc
đụng không mong muốn tiềm ẩn nảo có thể xảy ra thông qua hệ thống bảo cáo quốc gia.
Thông báo cho bảc sĩ điều trị bẩt kỳ tảc đụng không mong muốn nâo gặp phải khi dùng thuốc.
Ánh hướng lên khá nãng lải xe và vận hânh máy mỏc:
Hiện chưa có nghiên c'“ nảo được thực hiện về những ảnh hưởng của thuốc đến khả năng lải xe và
vận hảnh cảc loại mảy óc. Tuy nhiên, bệnh nhân cần được bảo trước về hiện tượng chóng mặt đã
dược ghi nhận xáy ra tron quá trình đỉếu trị với cả emtricỉtabin vả tenofovir disoproxil fumarat.
Qúa liều:
Trong trường hợp bện nhân dùng thuốc quá liều, cần theo dõi cảc biều hiện cùa tình trạng ngộ độc
(xem mục 'i`ảc dụng không mong muốn), đổng thời áp dụng cảc biện phảp hỗ trợ điếu trị tiêu chuẩn
khi cần thiết.
Có tới 30% liều emtricỉtabin và gần 10% iiều tenofovir có thể bị loại bỏ nếu bệnh nhân thực hiện
chạy thận nhân tạo. Việc emtricỉtabin hay tenofovir có khả năng bị Ioại bò bời thấm phân phủc mạc
hay không vẫn chưa được chứng minh.
Bảo quản: Bảo quản ở nhiệt dộ dưới 30°C vả trảnh ẫm.
Hạn dùng: 36 tháng kế từ ngảy sản xuất. Không sử dụng thuốc đã hết hạn sử dụng ghi trên bao bi.
Quy cách đỏng gói: Hộp | lọ x 30 viên.
Nhà sản xuất: HETERO LABS LIMITED, Unit-HI, 22-1 ' . ~ Jeedimetla, Hyderabad -
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng