



















moụhunmnqru
m qu MI I liu… …uw muh !»qu
JA
thn In lu
-uwmdcmg
…wsunvmumnunhnu
'…vaklnlnnq
mmmsmna-v—m
I'IIIWd
:ms wuan
np~uuzwmnpluưư | wma; …: Wa ms
ums
un … SVWGI 30H VMDISu XOũd "WM ỈWỮJ
!. I n W! ummmd
ặqe-fỉgJ
ả z ị ĩ
ẳ! O " ,
Ẻ'ỂỄiẵ
: w : ỉ
NqD
ã ẵ
i
m zpan nou
'UL :Oummmpwwaouuppưnmưnunmum
"°N WD
zsemoz
ZCẾG9D Wu #n; W"²°S
ì
ấ² =
eẵị :
ị ² ²
:ỉẹ:
' \
.::Ễ
'ãỉ
ễỄ:`
- _.
°i:!
:=:
'IỄỂ o—e-a
Ễa
`
sma samsm oz
®…l'ỡ
zzẹịẹm ::::s
ỆẸ=ỄỄẵ ẫỄ
;i ậậẳảầ ẫằẽẽ
Ễẳ sg Ễ sỄCỄ
* “ e' :
ẳ °² ậễ
ả 9~
²ỉ ị 3 g a
Ễẵ .Ề : :Ề
Ễ ị fa
E 3 ẵ
1² 1 Ia
: ấả
ẽ Ủ E 3
mwms zm …: [
(6òsớvÌ
M ỹí/ l;V
Nhăn phụ
(đươc dán sau khi nhập khẩu)
au uu om ụ sqn …… .» ur … ỉỤỌ.
"1
uu; my nuụnmlbumpg m um; luuug vumm
*» na na bu a…a Ma :ụx um un
l…u w Mlu … … ml .iow. .ax :. .um. …- xs w
Win "II nọ… MM… uw … h …; um An
Iưw |_n up um u um »; niu mm in ẽưv»a nm …
n ỵqs ›… n… uọu y :p _› uw uukuuùu um um …: :t
Jilũf
g….
un uu 0…
Wimez
l…wạ
SHHVAONtư
_qk . II D 0
sự:s sẹ: cqnsúea gz
lầiJmũaqjg
niuVAON'ư
Lln
crtunc
_ =an mm-nnmnm:
… _ Ot-ũsudgmsm'un.
…am _mmwnlnn
_ _ oyuựmtnamhnunustmq
mhuwM #:.
F r_gmuuùm
muon W_AÙQHDJAJỒSUDD
Z acou-Oiơlmơmmtm
c »noỌnlolaoueơbnuo-nm
< DưaIụ
> _mmpam ct…ơơnílOllm
' muun,uị,d ủuxfũủn_…m.g
'Ỉ J.oi uỢum.mzm
; ua…ơnỵhuMụanouụnmthnỵ
-.mAÙz
HiHVAUN'ư
* D D . 0 .
m'Wư
ỄỄEJmẸmãẸỦ
HiUVAONGH
Ỉ
WITL'EVWm
lậẮHGẸHdYG :
aỏnu n NYHỒ aha —
;: A 08
4—-
' IO-
+ . _ v—. , .
| | l
: I I 2 fÀỈ"
; : - | ': '—
ễễ e _ ỄỄ g : ỄỄỄ .A .
* Ế :: Ể | € p- '
\. z :., I \_J ":lị “J P
_Novartus Pharma Stein AG. THUY SĨ llẸỒỈJMFBMPD
“ L
LOTIM F DI EXP
naồặfă ầein AG. Thuy s:
… i… \: L
T
|
|
..
TẠIT 'AnữPnư …)
uoc:i…ifư
I`m
^’v\ _ .\.
wJả _mmt "g
_'í’/Lowomưìu 1 x 109/L
giai đoạn mạn tính khảng vảlhoặc tiểu cầu › so x m°fL.
lại hoặc không dung nạp
với liều dùng 400 mg. 2 3. Nếu số lượng tế bảo máu vẫn ở mức thấp,
có mẻ cần phải giảm liều xuống 400 mg,
lến] ~
8 ngay 1 Iần/ngảy.
Bệnh bạch cầu tủy mạn ANC* < 0,5 x qu/L _
giai đoạn cấp tinh khảng vảjhoặc số lượng tiếu !. Ngừng Tasigna và theo dõi số lượng tế bảo
lại hoặc không dung nạp cầu < IO x I09/L mảu
ỈfỉỊ/llefl dung 400 mg, 2 2. Điều trị trở lại trong vòng 2 tuần với liều
² “gay dùng trước đó nếu ANC › 1,0 x 10%
vảfhoặc tiều cầu > 20 x lOglL.
3. Nếu số lượng tế bảo mảu vẫn ở mức thấp,
có thể cần phải giảm liều xuống 400 mg,
| Iần/ngảy.
*ANC = số lượng bạch cẩu trung tính tuyệt đối
Nếu xảy ra dộc tính không phải về huyết học trung bình hoặc nặng có ý nghĩa lâm sảng, phải
ngừng dùng thuốc và có thể điều trị trở lại với lỉêu 400 mg, ! lần/ngảy một khi độc tính đã
được xử tri. Nếu thích hợp trên lâm sảng, nên xem xét tăng trở lại liều 300 mg (bệnh bạch cầu
tùy mạn với nhiễm sắc thể Philadelphia dương tính giai đoạn mạn tính (Ph+ CML- CP) mới
wt» l
Vo:—
được chấn đoản) hoặc 400 mg (bệnh bạch cầu tủy mạn với nhiễm sắc thể Philadelphia dưtmg
tính giai đoạn mạn tinh (Ph+ CML- CP) và giai đoạn cấp tính (Ph+ CML- AP) khảng lại hoặc
không dung nạp), 2 Iằn/ngảy.
Tăng lipase huyết thanh: Đối với trường hợp tăng lipase độ 3 đến độ 4, cần giảm liều xuống
400 mg, 1 Iần/ngảy hoặc ngưng dùng thuốc. Hảng thảng nên kiềm tra nổng độ lipase huyết
thanh hoặc khi có chỉ định lâm sảng (xem phần CÀNH BÁO VÀ THẶN TRỌNG ĐẶC BIỆT
KHI SỬ DỤNG vả TÁC DỤNG KHÔNG MONG MUÔN).
Tăng bilirubin vả các transaminạse gan: Đối với trường hợp tăng bilirubin hoặc cảc
transaminase gan độ 3 dến độ 4, cần giảm liều xuống 400 mg, 1 lần/ngảy hoặc ngưng dùng
thuốc. Hảng tháng nên kiếm tra nổng độ bilirubin và các transaminase gan hoặc khi được chỉ
định trên lâm sảng (xem phẩn TÁC DỤNG KHÒNG MONG MUÔN).
Nếu quên mọt liều, bệnh nhán không được dùng thêm ] liều mà phải dùng Iiều kế tiếp thường
lệ như đã được kê đơn.
Trẻ em và thiếu niên
Tính an toản và hiệu quả ở trẻ em và thiếu nỉên dưới 18 tuối chưa được xảc định.
Bệnh nhân cao tuổi
Khoảng 12% và 30% bệnh nhân trong các nghiên cứu lâm sảng (bệnh bạch cầu tủy mạn với
nhiễm sắc thể Philadelphia dương tính giai đoạn mạn tính (Ph+ CML- CP) mới được chẩn
đoán và bệnh bạch câu tùy mạn với nhiễm sắc thể Philadelphia dương tính giai đoạn mạn tính
(Ph+ CML- CP) và giai đoạn cấp tính (Ph+ CML- AP) kháng lại hoặc không dung nạp) từ 65
tuôi trở lên Không quan sảt thấy sự khảc nhau chủ yêu vê an toản vả hiệu quả ở bệnh nhân >
65 tuổi so với người lớn từ 18 đến 65 tuổi.
Bệnh nhân suy thận
Chưa có các nghiên cứu lâm sảng được thực hiện trên bệnh nhân bị suy chức năng thận. Cảc
nghiện cứu lâm sảng đã ioại trừ những bệnh nhân có nông độ creatinỉne huyêt thanh cao hơn
1,5 lân giới hạn trên của mức binh thường.
Vì nỉlotinibyả các chắt_chuyền hóa cùa nó không dược bải tiết qua thận, sự giảm độ thanh
thải toản phân cùa cơ thế không được dự đoán ở bệnh nhân bị suy thận.
Bệnh nhân suy gan
Suy gan có ảnh hưởng trung bình đến dược động học cùa nilotinib. Không cần xem xét điều
chỉnh liều ở những bệnh nhân bị suy gan, nhưng cân thận trọng khi điêu trị cho những bệnh
nhân nảy (xem phan CẢNH BẢO VÀ THẬN TRỌNG ĐẶC BIỆT KHI SỬ DỤNG).
Rối loạn tim
Trong các nghiên cửu lâm sảng, nhưng bệnh nhân bị bệnh tim không được kiểm soát ii c
bệnh tim nặng bao gồm mới bị nhồi máu cơ tim, suy tim sung huyết, đau thắt ngực khộn ổn
định hoặc nhịp tim chậm có ý nghĩa lâm sảng bị loại trừ.
Can thận trọng khi sử dụng cho bệnh nhân bị_các rổi ioạn tim có ý nghĩa (Xem phẩn CẢNH
BAO VA THẶN TRỌNG ĐẶC BIỆT KHÍ SƯ DỤNG).
CHỐNG cni ĐỊNH
Đã biết quá mẫn với nilotinib hoặc với bất kỳ thảnh phấn nảo của tá dược.
CẢNH BÁO vÀ THẶN TRỌNG ĐẶC BIẸT KHI sử DỤNG
Đọc kỹ hưởng dẫn sử dụng lrưởc khi dùng. Nếu cần !hẽm thông It'n, xin hỏi ý kiến bác sỹ.
Th uốc nảy chi dùng theo sự kê đơn của bác sỹ.
Ức chế tủy xương
Điều trị bằng Tasigna thường liên quan với giảm tiểu cầu, giảm bạch cầu trung tính và thiếu
mảu (Tiêu chuẩn nhiễm độc thông thường theo Viện Ung thư quốc gia— NCI CTC độ 3/4),
thường gặp hơn ở bệnh nhân bị bệnh bạch cầu tùy mạn kháng lại hoặc không dung nạp
imatinib vả đặc biệt ở bệnh nhân bị bệnh bạch câu tùy mạn giai đoạn cấp tính (CML—AP).
C an phải tiến hảnh kiềm tra công thức máu toản bộ mỗi 2 tuần trong 2 thảng đầu điều trị và
sau đó hảng tháng, hoặc khi được chi dịnh trên lâm sảng. Ức chế tủy xương thường có thế hổi
phục được và thường được xử trí bằng cảch tạm thời ngừng dùng Tasigna hoặc giảm liều
(xem phần LIÊU LƯỢNG VÀ CÁCH DÙNG).
Kéo dải khoảng QT
Cảc dữ liệu in virro cho thấy là nilotinib có khả nảng iảm kéo dải sự tải phân cực tâm thất cùa
tim (khoảng QT).
Trong một nghiên cứu Phase III trên bệnh nhân bị bệnh bạch cầu tủy mạn với nhiễm sắc thể
Philadelphia dương tinh giai doạn mạn tính (Ph+ CML-CP) mới được chấn đoán, sự thay đồi
khoảng QTcF trung bình theo thời gian ở trạng thái on định so với mức cơ bản được quan sát
thấy ở nhóm dùng nilotinib 300 mg, 2 lầnlngảy là 6 miligiây. Ở liều khuyến cảo 300 mg, 2
lần/ngảy, không quan sảt thấy bệnh nhân nảo có QTcF tuyệt dối > 480 miligiây và không
thấy có các cơn xoắn đỉnh (Torsade de Pointes).
Trong một nghiên cứu Phase II trên bệnh nhân bị bệnh bạch cầu tủy mạn kháng lại hoặc
không dung nạp imatinib giai đoạn mạn tính và giai đoạn cấp tính, được điều trị với nilotinib
400 mg, 2 iần/ngảy, sự thay đổi khoảng QTcF trung binh theo thời gían ở trạng thải ốn định
so với mức cơ bản là 5 miligiây và 8 miligiây tương ứng. Đã quan sát thẩy QTcF > 500
miligiây ở 4 bệnh nhân (<1% cùa số bệnh nhân nảy).
Trong một nghiên cứu trên những người tình nguyện khỏe mạnh có mức tiếp xúc với thuốc
tường tự như mức tiếp xúc quan sảt được ở bệnh nhân, sự thay đổi so với mức cơ bản cùa
khoảng QTcF trung bình theo thời gian đã loại trừ sự thay đổi do giá dược (placebo—
subtracted) là 7 miligiây (khoảng tin cậy (CI) d: 4 miligiây). Không người nảo có QTcF > 450
miligiây. Ngoài ra, không quan sảt thấy loạn nhịp có ý nghĩa lậm sảng trong suốt thời gian
tiến hảnh thử nghiệm Đặc biệt, không quan sát thấy các cơn xoắn đinh (thoáng qua hoặc kéo
dải).
Kéo dải khoảng QT đáng kể có thể xảy ra khi sử dụng không thích hợp Tasigna với thức ăn,
vả/hoặc cảc thuốc ức chế mạnh CYP3A4 vâlhoặc các thuốc được biết có khả năng kéo dải
khoáng QT. Do đó, phải trảnh dùng cùng với thức ăn và nên tránh dùng đổng thời với cảc
thuốc ức chế mạnh CYP3A4 vảfhoặc các thuốc được biết có khả năng kéo dải khoảng QT
(xem phần CÀNH BÁO VÀ THẬN TRỌNG ĐẶC BIỆT KHI SỬ DỤNG: Ảnh hưởng của
thức ản và phần TƯỚNG TẢC THUỐC). Giảm kali huyết và giảm magnesỉ huyết có thề lâm
tăng ảnh hướng nảy (xem phần LIÊU LƯỢNG VÀ CẢCH DÙNG).
Phải thận trọng khi dùng Tasigna cho những bệnh nhân có hoặc có nguy cơ cao về khoảng
QTc kéo dải như những người:
. có hội chứng QT kéo dải,
0 bị bệnh tim không được kiềm soát hoặc bệnh tim nặng bao gổm mới bị nhồi mảu cơ tim,
suy tim sung huyêt, đau thắt ngực không on định hoặc nhịp tim chậm có ý nghĩa lâm sảng.
' 1
\
nhĩ:
Đột tử
Trong cảc thử nghiệm lâm sảng, đã có báo cảo về một số trường hợp đột tử ít gặp (0, 1- -1%) ờ
những bệnh nhân bị bệnh bạch cầu tủy mạn giai đoạn mạn tính và gíai đoạn cấp tính khảng
lại hoặc không dung nạp imatinib dùng Tasigna mã có tiền sử bệnh tim hoặc yêu tố nguy cơ
về tim đáng kề. Các bệnh đi kèm cộng thêm vảo bệnh ác tính hiện có củng thường xảy ra khi
dùng đồng thời cảc thuốc. Những bất thường về tái phân cực tâm thất có thế là những yếu tố
gớp phần. Dựa trên theo dõi hậu mãi vê mức tíếp xức theo số bệnh nhân- năm, tỷ lệ bảo cáo
ước tính của các bảo cảo tự phảt về đột từ là 0 ,02%lbệnh nhân- năm. Không có báo cảo nảo
về cảc trường hợp đột tử trong nghiên cứu Phase Hi trên bệnh nhân bị bệnh bạch cầu tùy mạn
với nhiễm sắc thê Philadelphia dương tính giai đoạn mạn tính (Ph+ CML- CP) mới được chấn
doản.
Tương tảc thuốc
Nên trảnh dùng Tasigna với cảc thuốc là những chất ức chế mạnh CYP3A4 vả cảc thuốc có
thề kẻo dải khoảng QT như cảc thuốc chống loạn nhịp (xem phần LIÊU LƯỢNG VÀ CÁCH
DÙNG và phần TƯONG TÁC THUỐC) Nếu việc điều trị với bất kỳ thuốc nâo trong các
thuốc trên lá cân thiểt, nên ngưng điếu trị với Tasỉgna nếu có thể (xem phần TƯONG TÁC
THUỐC). Nếu không thể tạm thờin nỄưng điều trị với Tasigna, cẩn theo dõi sảt bệnh nhân về
sự kéo dải khoảng QT (xem phần LI U LƯỢNG VÀ CÁCH DÙNG, TƯONG TÁC THUỐC
vả DƯỢC ĐỘNG HỌC).
Sử dụng đồng thời Tasigna với các thuốc là những chất cảm ứng mạnh CYP3A4 có thề 1ảm
giảm mức tiêp xúc với nilotinib đến một mức độ có ý nghĩa lâm sảng. Do đó, ở những bệnh
nhân đạng dùng Tạsignạ, nên lựa chọn việc sử dụng đồng thời với cảc thuốc điều trị khác có
ít khả năng cảm ứng CYP3A4 hơn (xem phần TƯONG TÁC THUỐC).
Ảnh hưởng của thửc ăn
Sinh khai dụng cùa nilotinib tặng iên do thức ăn. Không đượcdùng Tasigna cùng với thức ặn
(xem phân LIEU LƯỢNG VA CACH DUNG vả TƯỢNG TAQTHUOJC) và nên dùng thuôc
2 gỉờ sau khi ăn. Không nên dùng thửc ăn ít nhât ! giờ sau khi uỏng thuôo.
Đối với những bệnh nhân khỏng thề nuốt viên thuốc, có thể pha bột của viên thuốc vảo 1 thìa
cà phê táo nghiền nhuyễn và cân dùng ngay. Không nên dùng hơn 1 Ihìa cà phê táo nghiền
nhuyễn và khóng được dùng Ihức ăn khác ngoải táo nghiền nhuyễn (xem phần LIE U LƯỢNG
VÀ CA C H DÙNG)
Nên trảnh dùng nước bưới vả cảc thức ăn khảc đã biết lả ức chế CYP3A4 ở bất kỳ thời điềm
nảo.
Suy gan
Suy gan có ảnh hưởng trung binh đển dược động học của nilotinib. Dùng liều đơn nilotinib
dẫn đến diện tích dưới đường cong (AUC) tăng 35% ở bệnh nhân suy gan nhẹ, 35% ở bệnh
nhân suy gnn trung bình vả 19% ở bệnh nhân suy gan nặng so với nhóm chứng là những
người có chức năng gan binh thường. Nồng độ cao nhất trong huyết tương (C,…) của
nilotinib ở trạng thải ổn định theo dự đoán tăng 29% ở bệnh nhân suy gan nhẹ, 18% ở bệnh
nhân suy gan trung binh và 22% ở bệnh nhân suy gan nặng. Cảc nghiên cứu lâm sảng đã loại
trừ những bệnh nhân có ALT vả/hoặc AST > 2,5 lẩn (hoặc > 5, nêu có liên quan đên bệnh)
giới hạn trên cùa mức bình thường vả/hoặc bilirubin toản phần › 1,5 lần giới hạn trên cùa
mức binh thường. Nilotinib chuyển hỏa chủ yếu ở gan. Cần thận trọng ở bệnh nhân suy gan
(xem khuyến cáo theo dõi trong phần LIÊU LƯỢNG vÀ CÁCH DÙNG).
0
In“
Lipase huyết thanh
Đã quan sát thấy tăng Iipase trong huyết thanh. Khuyến cáo thận trọng dối với bệnh nhân có
tiến sứ bị viêm tụy. Trong trường hợp tăng lipase có kèm theo các triệu chứng đau bụng, cần
ngưng dùng thuốc vả nên xem xét các biện phảp chẩn đoản thích hợp để loại trừ viêm tụy
(xem phần LIÊU LƯỢNG VÀ CẢCH DÙNG).
Cắt toản bộ dạ dây
Sinh khả dụng của nilotinib có thế bị giảm ở những bệnh nhân bị cắt toản bộ dạ dảy (xem
phần DƯỢC ĐỘNG HỌC). Cần theo dõi thường xuyên hơn ở những bệnh nhân nảy.
Hội chứng ly giải khối u
Đã có bảo cáo về các trường hợp hội chứng ly giải khối u ở bệnh nhân được điểu trị bằng
Tạsigna Về các khuyến cảo theo dõi, xin xem phần LIÊU LƯỢNG VÀ CẢCH DÙNG.
Lactose
Vì viên nang có chứa lactose, không khuyên đùng Tasigna cho bệnh nhân có vấn đề về không
dung nạp galactose di truyền hiếm gặp, thiếu hụt lạctạse nặng hoặc kém hẫp thu glucose-
galactose.
TƯỢNG TÁC THUỐC
Những thuốc có thế lảm tăng nồng độ nilotinib trong huyết thanh
Nilorinib được chuyển hóa chủ yếu ở gan. vả còn lả một cơ chất đối với P-glycoprotein (ng)
lả bơm đẩy rhuốc ra của nhiều thuốc. Vì vậy, sự hẩp thu vả thái trừ sau đó của nilotinib đã
được hấp n… toân thân có mề bị ảnh hưởng bởi các thuốc ánh hưởng đến CYP3A4 vả/hoặc
ng.
Trong một nghiên cứu Pha [, nilotinib được dùng đồng thời với imatinib (iả một cơ chất và
chắt đíều tiết P—gp vả CYP3A4), cả 2 thuốc có ảnh hướng ức chế nhẹ lên CYP3A4 vả/hoặc
PgP. Khi 2 thuốc được dùng đồng thời, diện tích dưới đường cong (AUC) của imatinib tăng
từ 18% dến 39% và diện tích dưới đường cong của nilotinib tăng từ 18% đến 40%.
Sinh khả dụng cùa nilotinib ớ người khôe mạnh tảng gấp 3 1ần khi được dùng phối hợp với
ketoconazole là chất ức chế mạnh CYP3A4. Vì vậy nên tránh điều trị đồng thời với chất ức
chế mạnh CYP3A4 (bao gồm nhưng không giới hạn với ketoconazole, itraconazole,
voriconazole, ritonavir, clarithromycin vả telithromycin) (xem phần LIÊU LƯỢNG VÀ
CÁCH DÙNG vả CÀNH BẢO VÀ THẶN TRỌNG ĐẶC BIỆT KHI SỬ DỤNG liên quan
đển sự kéo dải khoảng QT). Nên xem xét thay đổi cảc thuốc dùng đồng thời khác không gây
ức chế hoặc ức chế tối thiều CYP3A4.
Những thuốc có thế lâm giảm nồng độ nilotinib trong huyết thanh
Những thuốc gây cảm ứng hoạt tính của CYP3A4 có thế lảm tăng sự chuyển hóa cùa
nilotinib và do đó lảm giảm nồng độ nilotinib trong huyết tương. Dùng đồng thời với cảc
thuốc gây cảm ứng CYP3A4 (ví dụ phenytoin, rifampicin, carbạmazepine, phenobarbital vả
cò St. John’ s Won) có thề lảm giảm mức tiêp xúc với nilotinib. Ở những bệnh nhân được chỉ
định dùng cảc thuốc gây cảm ứng CYP3A4, nên xem xét dùng các thuốc khảc ít có khả năng
gây cảm ứng enzyme.
Ở những người khòe mạnh dùng rifampicin lá thuốc gây cảm ứng CYP3A4, ở liều
600 mg/ngảy trong 12 ngảy, mức tiếp xúc toân thân (diện tích dưới đường cong — AUC) với
nilotinib giảm xuống khoảng 80%.
m°x~
-A
lả'f '+’mL… `a
Độ hòa tan cùa nilotinib phụ thuộc vảo pH, độ hòạ tan thẩp hơn ở pH cao hơn. Ở những
người khóc mạnh dùng esomeprazole liếu 40 mg, [ iân/ngảy trong 5 ngảy, pH dạ dảy tăng lên
rõ rệt, nhưng sự hấp thu cùa nilotinib chỉ giảm trung binh (Cmax giảm 27% và AUCg.cm giảm
34%). Tasigna có thể dùng đổng thời với esomeprazole hoặc các thuốc ức chế bơm proton
khác khi cân thiết.
Trong một nghiên cứu ở những người khỏe mạnh, không quan sát thấy sự thay đối đáng kể về
dược động học cùa nilotinib khi dùng một liều đơn Tasigna 400 mg. 10 giờ sau và 2 giờ trước
khi dùng famotidine. Vì vậy, khi cân sử dụng đồng thời với một thuốc phong bế H2, thuốc đó
có thể được dùng khoảng 10 giờ trước và khoảng 2 giờ sau khi đùng liều Tasigna.
Trong nghiên cứu tương tự như trên, sữ dụng một thuốc khảng acid (nhôm hydroxide
/magnesi hydroxide/simethicone) 2 giờ trước hoặc sau khi dùng ! liểu đơn Tasigna cũng
không lảm thay đổi dược động học cùa nilotinib. Vì vậy, nếu cân thiết, có thể dùng một thuốc
khảng acid khoáng 2 giờ trước hoặc khoảng 2 giờ sau khi dùng liều Tasigna.
Những thuốc có thể bị thay đổi nồng độ toân thân do nilotinib
Nilotỉnib được xác định là một chất ức chế cạnh tranh của CYP3A4, CYP2C8, CYP2C9_,
CYP2D6 vả UGTIA in vitro, với trị số Ki thấp nhất đối với CYP2C9 (Ki= o,13 microM) 0
những người khóc mạnh, nilotinib ờ nồng độ liên quan đến lâm sảng không Iảm thay đổi
dược động học hoặc dược lực học của warfarin là một cơ chất nhạy cảm với CYP2C9
Tasigna có thế được dùng đồng thời với warfarin mã không [ảm tăng tảc dụng chống đông
máu. Ngoải ra, dùng liều đon Tasigna với midazolam cho những người khóe mạnh Iảm tăng
mức tiêp xúc với midazolam 30%, tuy nhiên tỷ lệ chuyển hóa cùa l- -hydroxy-midazolam trên
midazolam không thay đổi.
Các thuốc chống loạn nhịp và các thuốc khảc có thể kéo dăi khoảng QT
Cần tránh sử dụng đồng thời Tasigna với các thuốc chổng loạn nhịp (bao gồm nhưng không
giới hạn với amíodarone, disopyramide, procainamidc, quinidine vả sotalol) vả cảc thuốc
khác có thẻ kéo dải khoảng QT (bao gổm nhưng không giới hạn vởi chloroquine, halofantrine,
clarithromycin, haloperidol, methadone, moxifloxacin, bepridil vả pimozide) (xem phần
CÀNH BÁO VÀ THẶN TRỌNG ĐẶC BIỆT KHI SỬ DỤNG).
Những tương tác khảc có thể ảnh hưởng đến nồng độ thuốc trong huyết thanh
Sự hấp thu Tasigna tăng nếu được dùng cùng với thức ăn, dẫn đến nồng dộ thuốc trong huyết
thanh cao hơn (xem phần LIÊU LƯỢNG VÀ CẢCH DÙNG, CÀNH BÁO VÀ THẶN
TRỌNG ĐẶC BIỆT KH! SỬ DỤNG vả DƯỢC ĐỘNG HỌC).
Nên trảnh dùng nước bưởi và các thức ản khác đã biết là ức chế CYP3A4 ở bất kỳ thời điểm
nảo.
PHỤ NỮ có THAI VÀ CHO CON BỦ
Phụ nữ có thai
Chưa có dữ liệu đầy đủ về việc sử dụng Tasigna ở phụ nữ có thai Cảc nghiên cứu trên động
vật không cho thấy tính gây quải thai nhưng đã thấy độc tính với phôi vả thai ờ cảc liều gây
độc cho vật mẹ (xem phần CAC DỮ LIỆỤ AN TOAN TIÊN LÂM SÀNG). Không nên dùng
Tasigna trong thai kỳ trừ khi cần thiết. Nếu thuốc được dùng trong khi mang thai, phải thông
báo cho bệnh nhân vê nguy cơ có thể có đối với thai.
Phụ nữ có khả năng mang thai
Phụ nữ có khả năng mang thai phải được khuyên dùng biện phảp trảnh thai có hiệu quả trong
thời gian điều trị bằng Tasigna.
Cho con bú
C hưa r_õ nilotinib có được bảj tiết vảo sữa mẹ hay không. Cảc nghiên cứu trên động vật đã
cho thây lả thưôc được bải tiêt vảo sữa mẹ. Phụ nữ đang dùng Tasigna không được cho con
bú vì không thế loại trừ nguy cơ đôi với trè.
Khả năng sinh sân
Ó chuột cống đực và cái được thử nghiệm cho dùng liều cao nhất gấp khoảng 5 lần liều
khuyến cảo cho người, khôn thấy ảnh hưởng trên sự chuyền độngjsố lượng tinh trùng và
trên sự thụ tinh (xem phẩn CAC DỮ LIỆU AN TOÀN TIỂN LÂM SÀNG).
TÁC ĐỌNG CỦA THUỐC TRÊN KHẢ NĂNG LẨl XE VÀ VẶN HÀNH MÁY MÓC
Chưa có nghiên cứu được thực hiện về tác động của nilotinib trên khả năng lải xe vả vận
hảnh máy móc. Những bệnh nhân bị chóng mặt, giảm thị giác hoặc có cảc tảc dụng không
mong muốn khác mà có khả nảng ảnh hướng đến sự an toản khi 1ải xe hoặc vận hảnh mảy
móc thì nên ngừn những hoạt động nảy chừng nảo cảc tác dụng phụ trên vẫn còn (xem phần
TÁC DỤNG KHONG MONG MUÔN).
TÁC DỤNG KHÔNG MONG MUÔN
Ở bệnh nhân mới được chẩn đoán bệnh bạch cầu tủy mạn vởi nhiễm sắc thể
Philadelphia dương tính giai đoạn mạn tính (Ph+ CML-CP)
Cảc dữ liệu được bảo cảo dưới đây phản ảnh mức tiếp xúc với Tasigna trong một nghiên cứu
phase 111 ngẫu nhiên ờ bệnh nhân mới được chẩn đoản bệnh bạch câu tùy mạn với nhiễm sắc
thể Philadelphia dương tính giai doạn mạn tinh (Ph+ CML- CP), được điều trị với liều khuyến
cảo 300 mg, 2 1ần/ngảy (n=279). Thời gian điều trị trung binh là 36, 4 tháng (trong khoảng từ
0,1 — 46, 7 thảng).
Các phản ứng phụ cùa thuốc (ADRs) không phải về huyết học đã được báo cảo rất thường
gặp (> 10%) lá nôi ban, ngứa, nhức đầu, buồn nôn, mệt mòi và đau cơ. Hầu hết các phản ứng
phụ nảy ở mức độ từ nhẹ đến trung bình (độ 1 hoặc 2). Đau vùng bụng trên, rụng tóc, táo bón,
tiêu chảy, da khô, co thăt cơ, đau khởp, đau bụng, phù ngoại biên, nôn, đau ở các chi, khó
tiêu và suy nhược it gặp hơn (<10% vả 2 5%) vả ở mức độ nhẹ đến tmng bình, có thế xử trí
được vả thường không cẩn giảm liều. Trản dịch mảng phổi và trản dịch mảng ngoải tim -
không kể đến tính nhân quả - xảy ra ở 1% vả < 1% bệnh nhân tương ứng dùng Tasigna 300
mg, 2 lần/ngảy. Xuất huyết dạ dảy-ruột - không kể đến tính nhân quả - đã được báo cảo ở
2, 5% số bệnh nhân nảy.
Thay đối khoảng QTcF trung binh theo thời gian ờ trạng thái òn định so với mức cơ bản khi
dùng liều khuyến cảo nilotinib 300 mg, 2 lần/ngảy là 6 miligiây. Ờ nhóm dùng nilotinib 400
mg, 2 Iằn/ngảy vả nhóm dùng imatinib 400 mg, 1 lần/ngảy, khoảng QTcF trung binh theo
thời gian ở trạng thái ốn định là 6 miligiây và 3 miligiây tương ứng. Không quan sát thấy
bệnh nhân nảo có QTcF tuyệt đối > 500 miligiây ở các nhóm điều trị và không thấy có các
cơn xoắn đinh (Torsade de Pointes). Đã quan sảt thấy tăng QTcF vượt quá 60 miligiây so với
mức cơ bản ở 4 bệnh nhân khi đang dùng thuốc nghiên cứu (một bệnh nhân trong nhóm điều
trị với 300 mg, 2 lần/ngảy và 3 bệnh nhân trong nhóm điều trị với 400 mg, z lần/ngảy).
Không có bệnh nhân nảo ở các nhóm điếu trị có phân suất tống máu thẩt trải (LVEF) < 45%
trong thời gian điều trị. Ngoài ra, không có bệnh nhân nảo có mức giảm phân suât tông máu
thất trải 2 15% so với mức cơ bản.
Không có báo cảo nảo vê đột tử trong các nhóm trị liệu.
~ i
Ỉ'ạ1dụụ-
Ó nhóm dùng nilotinib 300 mg, 2 lần/ngảy, các phản ứng phụ của thuốc về huyết học bao
gổm cả ức chế tùy xương: giảm tiều câu (18%). giảm bạch câu trung tính (15%) vả thiếu máu
(7%). Xem Bảng 3 về cảc bất thường xét nghiệm độ 3/4.
Ngừng dùng thuốc do cảc phản ứng phụ của thuốc được quan sảt thấy ở 10% bệnh nhân.
Ở bệnh nhân bị bệnh bạch cầu tủy mạn vởi nhiễm sắc thể Philadelphia dương tinh giai
đoạn mạn tính (Ph+ CML- CP) và giai đoạn cấp tính (Ph+ CML- AP) kháng lại hoặc
không dung nạp
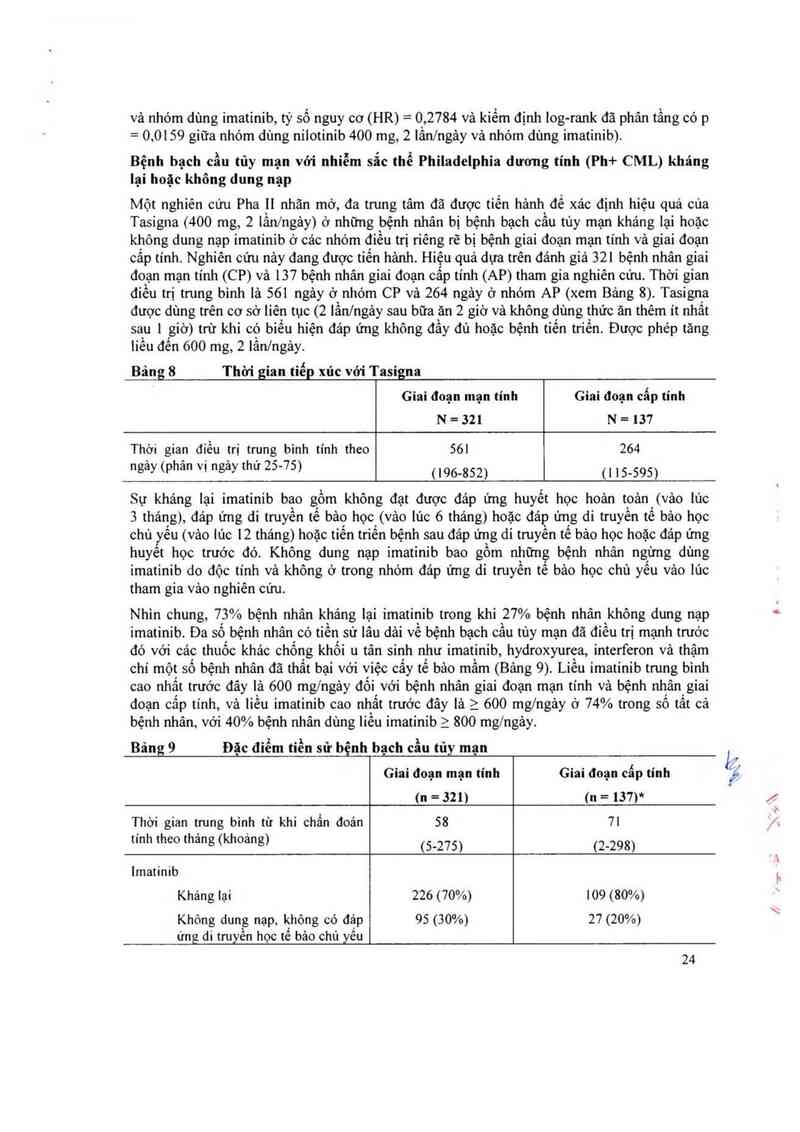
Cảc dữ liệu được báo cảo dưới đây phản ảnh mức tiếp xúc với Tasigna ở 458 bệnh nhân bị
bệnh bạch cầu tùy mạn với nhiễm sắc thể Philadelphia dương tính giai đoạn mạn tính (n=321)
và giai đoạn câp tính (n=137) khảng lại hoặc không dung nạp với ít nhắt một trị liệu trước đó
bao gôm cả imatinib trong một nghiên cứu nhãn mở, đa trung tâm, với liều khuyến cáo 400
mg, 2 lần/ngảy.
Cảc phản ứng phụ của thuốc không phải về huyết học đã được báo cảo thường gặp nhất
(> 10% ở cảc nhóm bệnh nhân bị bệnh bạch cầu tủy mạn giai đoạn mạn tính vả giai đoạn cấp
tính) là nối ban, ngứa, buồn nôn, mệt mỏi, nhức đầu, tảo bón, tiêu chảy, nôn và đau cơ. Hằu
hết những phán ứng phụ của thuốc nảy ở mức độ từ nhẹ đến trung binh. Rụng tóc, co thẳt cơ,
giảm sự ngon miệng, dau khởp, đau xương, đau bụng, phù ngoại biên và suy nhược it gặp
hơn (<10% vả 2 5%) và có mức độ từ nhẹ đến trung binh (độ 1 hoặc 2).
Trản dịch mảng phổi và trản dịch mảng ngoải tim cũng như cảc biến chứng ứ dịch xảy ra ở
<1% bệnh nhân dùng Tạsigna. Đã quan sát thấy suy tim ở < 1% bệnh nhân. Xuất huyết dạ
dảy-ruột vả xuất huyết ở hệ thần kinh trung ương được báo cáo ở 1% và < 1% bệnh nhân
tương ứng.
Đã quan sảt thấy khoảng QTcF vượt quá 500 miligiây ở 4 bệnh nhân trong nghiên cứu nảy
(< 1%). Không thấy có các cơn xoắn đinh (Torsade de Pointes) (thoảng qua hoặc kéo dải).
Cảc phản ứng phụ cùa thuốc về huyết học bao gồm suy tủy xương: giảm tiểu cẳu (31%),
giảm bạch câu trung tính (17%) vả thiếu máu (14%). Xem Bảng 3 vé cảc bất thường xét
nghiệm độ 3/4.
Đã quan sảt thấy ngừng dùng thuốc do cảc phản ứng phụ của thuốc ở 16% bệnh nhân giai
đoạn mạn tính vả 10% bệnh nhân giai đoạn câp tính.
Các phản ứng phụ của thuốc đã được báo cáo thường gặp nhất
Các phản ứng phụ cùa thuốc không phải về huyết học (không kể các bất thường về xét
nghiệm) đã được bảo các ít nhất ở 5% bệnh nhân trong cảc nghiên cứu lậm sảng với Tasigna
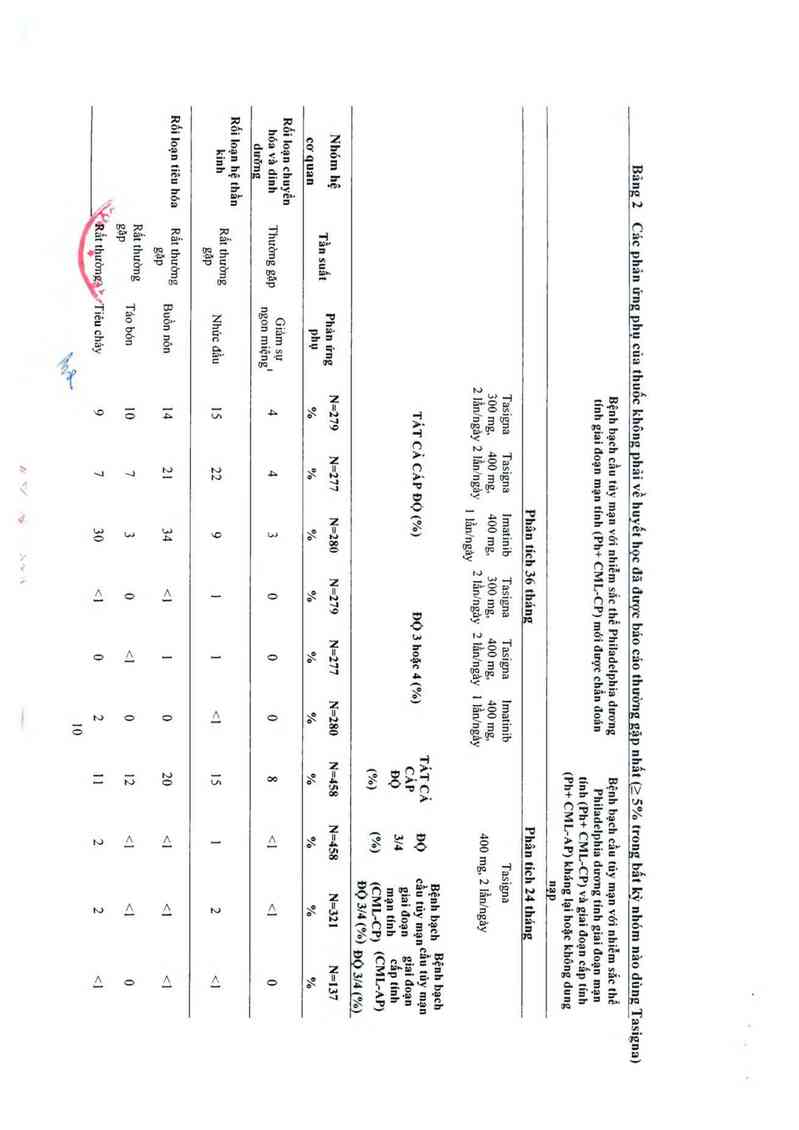
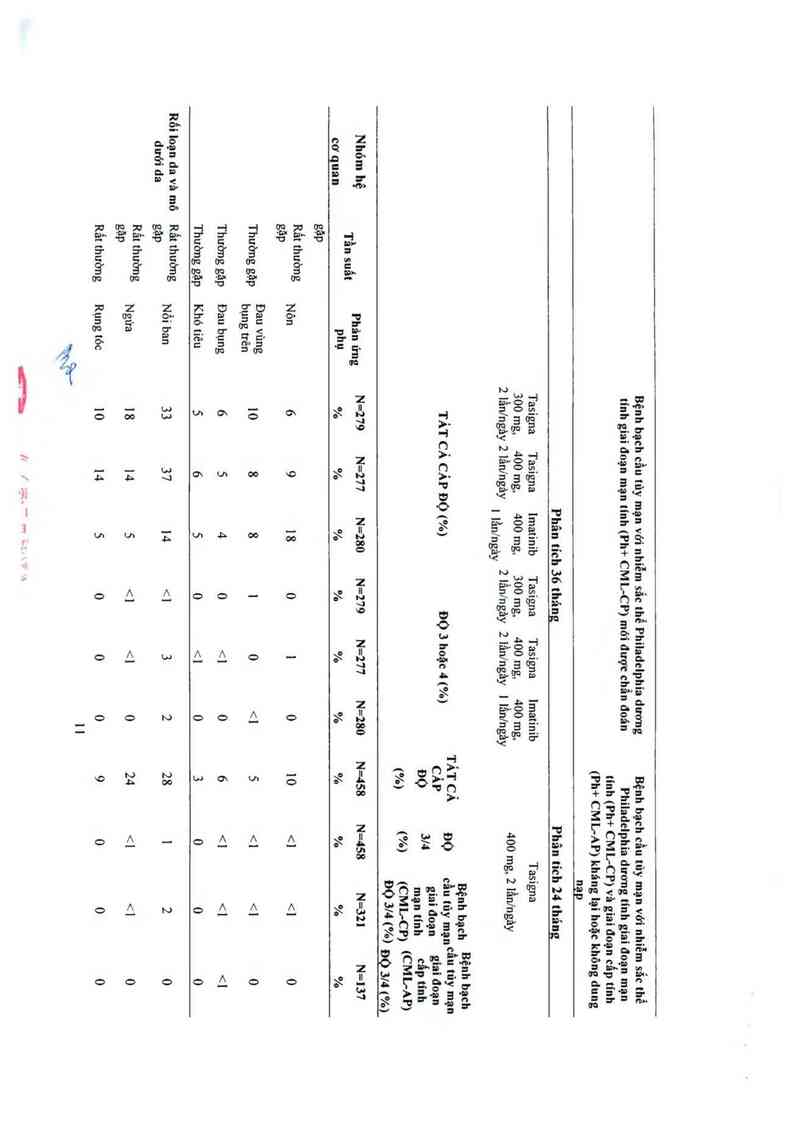
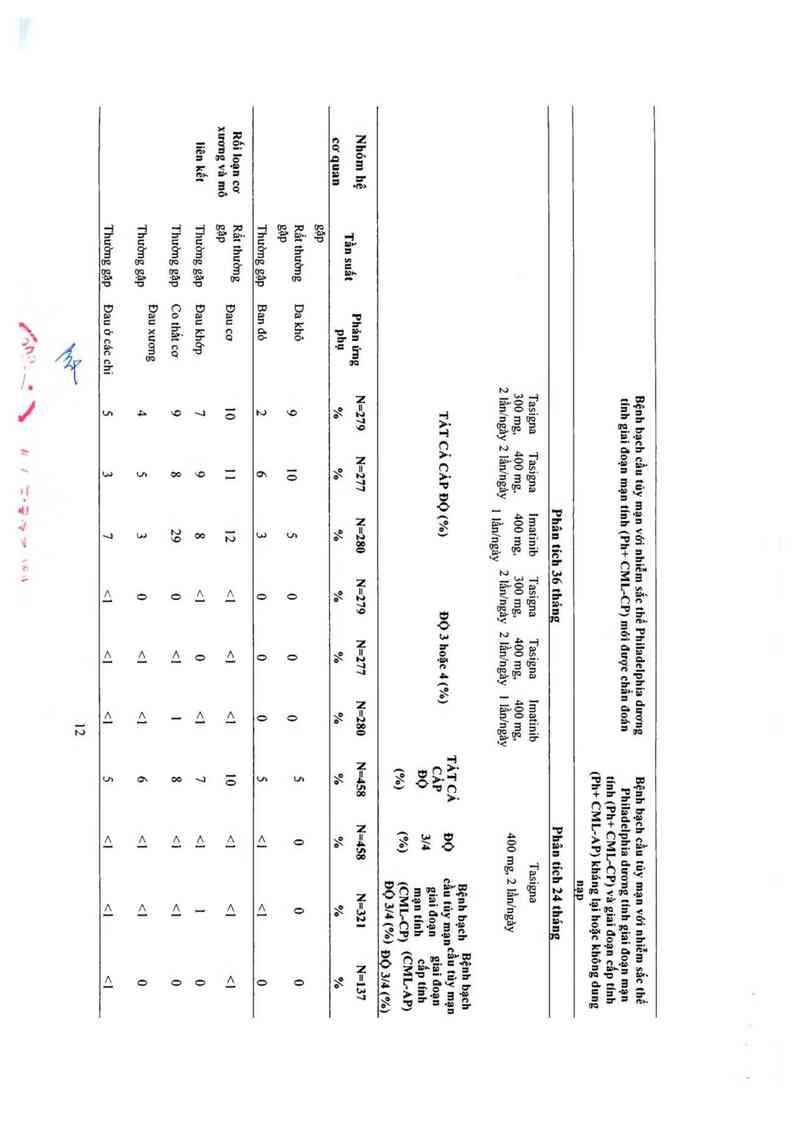
được biếu thị ở Bảng 2. Các phản ứng phụ được liệt kê theo nhóm tần suất, đẩu tiên lá thường
gặp nhất, sử dụng quy ước sau đây: rât thường gặp (> 1/ 10) hoặc thường gặp (>1/100, <1/10).
Tần suất dựa trên tỷ lệ cao nhất đối với bất kỳ nhóm nảo dùng Tasigna trong 2 nghiên cứu.
"i.“ị-r ’('
W….ẵ … Own ….Ễ: .….ẵ E.... n...» :::..n E....ẵ …...w. <… Ểụ.m~ Ển .…w. mẵ.ă ơwo Sổ Ê:Ểm m.…ẽ .:.». W mexe :.oẵ ỉ: Ế ...:…E :wo .:....» Hu……maẵ
u….z. ....ắ. e.... ...... ...... ẳ ..ẫ... ……n ...… .....ẵzẵ… ...:...n
::: m…»… .…2..: :..Ề :.... Ễư+ QSF-ÔJ :.9. Q:.Qn nẵ: .…o»:
w…ỉ. ư…Ễ. nw: :..ụ. :õ: <Ề ::…m... …wo :.…
E.:Ềnỉỉ» .Ểẵw zì. w…ì ae…ẵ :...ẵ
...... ...ỉ er-n3 &. …... ….ẵ. &... ......
AE.+ QSE->J E.»:m ỉ… ….ẵa E.…ẵw .Ểẵ
..….ẽ
É.mẵ …Ễ. ua Ê….ẵm E.…ẩ zo: na ::.:ũ
.….mm…wễ .….mmữẵ ẩm.…ỉơ .….mmấễ 48…mẳ :..ẵỉơ 4»…Ể.»
…oo Em. ễo :.w. Ềo 3m. …oo Em. Ềo :.m. ổo :.w. ..
… …waìmỡ. … ỉỉ:mể _ ...Ễ...m……v` … .…..ìmỡ. …… .…..ỉẵwư. _ .…..aìmẵ Ẻo :.m. … ỂỄmỡ.
w…ì. g.….. w…ỉ. ư…Ễ.
ã.ắ O... n›.. ….o ...x... …õ … ẫ. .. .ẵ qễ. n› …õ a.... ...... .:.... %.… ẵ ......
O>1 m…»… na»: m.….. aễ:
ỤỘ uì :.…ẵ zì. Ê…. .:.:
Aeồv Ae\ev AÔỄ—LuAu-vv AÔz—Ln>—J
ỦỒ uì Ae\ev ÙỒ uỀ A….ềv
ză... ..… 1 … ẫ... ..::… zuẵ. 2u3. zuẵ. zu…ẽ zn…3 2uằ. zu..…m zuầ. zuun. Zuẵ
N: m..- n
8 ...:... ...... .x. ..x. ..x. ..x. .x. ..x. ..x. 3 .x. ..x.
F... .oẾ nỂụủ: ©Ế: …:
ỉ…» «» .::: d.:ơsm m…...u : o.. ::.…. . …. > … o o c … A. A. o
..:.ẵ … .. .…
%? :.Ể ..… ẽw: .
...... Ễ….……ẫ zỄ …... .… …… ớ . . A. .… . … A.
» o> »
z... .ẵ. ..... .ẫ .…..Mửẫ .ẵ. ...... .. …. …. A. . .. ….. A. A. A.
.ế .....ẵ ẫ %. .o . … .. A. .. .… A. A. ..
« Ă…m: oỉ..< o q ……o A. 0 N _ . … … A…
:…
w…ỉ. ư...n.. n»: 25. ...... 13 ::.…3 …wn ...… I....ằaỉỉ. nẫm u…ẵ. ...n: o….z …...v. .:.... E E.»..n ĩ… ..oun E.…ẵm ...:.m
..»u
…...m: ...nr u.… .….»Ểi ….ễ: .…nư na :.…ẵm
...»…Ể.» ...…Ể.» .:.ằỉơ .….ẵmẫ 48…m... ::......ơ Ế…Ổ...
…oo :.m. ổo Em. ổo Em… …oo :.w. ễo :.m. ềo ....m.
. . . .oo ..... … .….ãổầ
… ....ẫ... … ....ẵỄ . . ......Ễ … ......mầ … .ẵẵ... . Ễ..Ễ
. . u…ì. gn: W…:-.. go:
Ế.ắ n› O.... ….0 ..x.. uo .. .:....` . ...... Ế... n> 2… ...... ...… .:.... .. Ê ......
0>1 E... .…8: m.... ÊỄ.
ÚỒ UỀ :ổ: 2:ư nmũ QB:
Aexov Ae\ev AÔỄrÔ—J AÔỄ—tn>vv
…õ ….. ..x.. ….0 ….. ......
z..ẵ ..v . zu…ê zn... zu…ề znẵ. zu.3 zu…ễ z…ẳ. zaằ. zuỂ zuẵ
… ,..w: …:». E.»: .:.w
8 ...:... ...... .... ..x. .... ..x. .... .... .... .x. .... ....
…...
.….. .....ẵ z... . …. .. .. . .. .. A. A. .
…...
.....Ể …... .....wumểm :. .… .. . .. A. … A. A. ..
4Ểơum mề @... ơE.m @ …. .. o A… 0 a A. A. A.
.....cẩm mẵ ễ.ợ ……m: … o … 0 A… o … o o o
...... ...... ... .. .... ..…. ......ẳ ..
...ẫ ….. m…..u 29 ơn.. …… …. 1 A. … … …m . … o
›
.... .....ẫ z…ã .. .. … A. A. .. …. A. A. ..
…...
...... ...:ẩm .::..… a. ... .. … o o o . o o o
. .
42.1
Wm.... ...:... nw.. ...... ...... J ....Ền ... ..own ....aẵ ...:.m
..mU
…...wa ...... ua .....ẵm .v..v: ..o.. NA ..:...m
..ẵm... ..….mấ... ......Ểơ Ế…Ể... ...»..m... ......Ểơ ...…Ể...
…oo ...m. ễo ...m. ềo ...m. …ềo ...m. ổo ...m. ..oo ...w. .
… .…..ỉmờ. … .»..ìwẵ . … ......ìw3. … .»...zmỡ. . .....Ễmẵ ổo ...w. … .»..ìwỡ.
. .mỄ.mẵ
. . ...... ...... w…...… ......
.:... Q.. Q.... ..o ...... …õ … ...... . ..è ..›.… n› .6 …... ..... ...... .… ..... ......
n>.. … › n.... ......5 m.... ....Ế
…uO . ...... ...... nm.. ......
Ae\o. Aa\ev AỒỄFìÔ—J AAHỄFì›_VV
g UỀ Ae\ev ÚỒ UỀ Ao\o.
2...…:. ..m ...y ». .v..v: .…..m Znuqo ZHNQQ Zuqu Zuuqc 2an4 2uume Zu&…m Znamm 2uuN. 2u.u<
.... …:
8 .:.... ...... .... ..... .... ..x. .... .... ..x. ..x. ..x. ...
…...
» ..
W.. .....ẩm U. .….5 o .o … c c c … c c ..
…...
.....cẩm m.... mẵ ...... m … …… o o o … A. A. o
...... ...... 8 ..…. ....ẫm
.....ẵmễ ..... m.... UEẦQ :. .. .… A. A. A. 5 A. A. A.
..…. ..…. ......ẵm w... Um: .n..ẵ .. o .… A . .. A . ,. A. . ..
......ẵw m…... no ...... 8 o …… mo o A. . …… A. A. ..
U…E Ềẵm
.....cơsm mề .. … … .. A. A. … A. A. ..
.....zẩm m... O....Ểầ o... … … .. A. A. A. … A. A. A.
ẤW.li .…
.:.... ...... ...... ...... ...... i... ......ă …... ...… .....ẫaẵ. ...ẫ. .…..z. ...... .….. ...... ...... ả. ::.….. …... ....
...... m... .…c... ...... ...... .....+ ÔỄF-ÔJ .:.... ..:...n n..…..: ....Ề. .:....ẵlvỉw .....ỄN :.... n...… .....z ......
...... .....+ QS.ảOJ J ....Ễm ... .....n ...:...n ...:.m
.....
....m... ..n.. ua ...…ẵm #:... ...... …. ...»..ml
......m... ......m... ......ỉ... ....mữ... Ế…Ể... ::......ơ ...»…Ể...
…oo ...m. ềo ...m. ổo Em… …oo ....m. ổo ...... ềo ..... ., .
. . . . . , . . ......o 3% … ...:...wẵ.
… ...:...wỡ. … ....ỉm... . .…..ầsmẳ … .….Ểã... … .ẵzmỡ. . ...:...mỡ.
.. . .… . ..…wẫ .…..n: ….ẳẵ ...n:
q…ắ o› D...v wo .ẳ ….o … ...... . .ẳ ›. › ..o .... ..... ......e... .... ......
Ô.»... n.... ae»: m.... me...
..o .... ...... ...... &. ......
...... .ẵ .erõ... ..…ZTỀ.
…vỒ uÌ Ae\ev va uỀ Ae\ev
zã... ...… ,...... …:... .:.... ...... zu…ầ zuS. zu…ẫ zu….. zu... zuễ. zu... zu.…. zuuu. zu.u.
8 ...::. ...... .... .... .... .... .... .... …... .... .... ....
..ẵ. ...... ...... ẵ. .....ẵm. , ,
...»: <» ...... m…... ...... ...... .. .o .o 0 A. A. .. . . A.
...... .». o....
...:... ...::... .....Ể …... …... ....ẵ . … .… A. A. .. . .. .. ..
.....ẫ …... ..…….….…. ...…o... … . .. A.. .. .. .. .. .. ..
. Omẵ ơ.ỗ m...... n...... …: .. ..:... ...mn …...Qo ... .....os
.…
Các dữ liệu bổ sung từ các thử nghiệm lâm sâng
Cảc phản ứng phụ cùa thuốc sau đây đã được báo cảo ở những bệnh nhân trong các nghiên
cứu lâm sảng với Tasigna ở các liều khuyến cáo với tần suất < 5% (thường gặp là > 1/100 vả
< 1/ 10 ít gặp lả 2 M .000 và < 1/100; các trường hợp riêng lẻ được ghi nhận lả tần suất
không rõ). Đối với các bất thường về xét nghiệm, cảc phản ứng phụ rất thường gặp (> 1/ 10)
không bao gồm trong Bảng 2 cũng được báo cảo. Những phản ứng phụ nảy được bao gôm
dựa vảo ý nghĩa lâm sảng vả được xếp theo thứ tự mức độ nghiêm trọng giảm dằn trong môi
nhỏm.
Nhiễm trùng và nhiễm ký sinh trùng
Thường gặp: Viêm nang lông, nhiễm trùng đường hô hấp trên (bao gồm viêm họng, víêm
mũi-họng, viêm mũi). Ít gặp: Viêm phổi, víêm phế quản, nhiễm trùng đường tiết niệu, nhiễm
virus herpes, nhiễm nẩm Candida (bao gồm nhiễm nâm Candida miệng), viêm dạ dảy- -ruột.
Tằn suất không rõ: Nhiễm khuấn, ảp- xe dưới da, ảp-xe hậu môn, nhọt, bệnh nấm da chân
U tân sinh lảnh tính, ác tính và không xác định
Thường gặp: U nhủ ở da. Tần suất không rõ: U nhủ ở miệng, chứng paraprotein huyết.
Rối Ioạn máu và hệ bạch huyết
Thường gặp: Giảm bạch cẳu trung tính có sốt, giảm toản thể huyết cầu, giảm bạch cẩu
lympho. Tần suất không rõ: Tăng tiêu cằu, tảng bạch câu, tăng bạch câu ưa eosin.
Rối loạn hệ miễn dịch
Tần suất không rõ: Quá mẫn.
Rối loạn nội tiết
Ít gặp: Tảng năng tuyến giảp, thiểu năng tuyến giáp. Tần suất không rõ: Tăng năng tuyến cận
giảp thứ phảt, viêm tuyên gỉáp.
Rối loạn chuyển hóa và dinh dường
Rắt thường gặp: Giảm phosphat huyết (bao gổm giảm phospho huyết). Thường gặp: Mất cân
bằng điện giải (bao gồm gỉảm magnesị huyết, tảng kali huyết, giảm kali huyết, giảm natri
huyết, giảm calci huyết, tăng calci huyết, tăng phosphat huyết), đái thảo đường, tăng đường
huyết, tăng cholesterol huyết, tăng lipid huyết. Ít gặp: Bệnh gủt, mất nước, gíản1 sự ngon
miệng, tăng sự ngon miệng. Tần suât không rõ: Tảng acid uric huyết, hạ đường huyết, rối loạn
lipid huyết.
Rối loạn tâm thần
Thường gặp: Trầm cảm, mất ngủ, lo âu. Tần suất không rõ: Mất định hướng, tình trạng lủ lẫn,
quên, khó ở.
Rối loạn hệ thần kính
Thường gặp: Chóng mặt, bệnh thần kinh ngoại biên, giảm cảm giác, dị cảm.
Ít gặp: Xuất huyết nội sọ, đau nửa đầu (migraine), mất ý thức (bao gồm ngất), run, rối loạn sự
chú ý, tăng cảm giác. Tần suất không rõ: Phù não, viêm thần kinh thị gìác, ngủ lịm, rối loạn
cảm gíảc, hội chứng chân không yên.
14
xă \
I.J~f … ~
Rối loạn mắt
Thường gặp: Xuất huyết ở mắt, phù quanh hốc mắt, ngứa ở mắt, viêm kết mạc, khô mắt (bao
gôm bệnh khô mắt). Ít gặp: Suy giảm thị giác, nhìn mợ, giảm thị lực, phù mí mắt, lóa mắt,
sung huyết (cùng mạc, kết mạc, mắt), kích ứng mắt, xuất huyết kết mạc. Tẩn suất không rõ:
Phù gai thị, song thị, sợ ảnh sáng, sưng mắt, viêm bờ mi, đau mắt, bệnh mảng mạch— —võng mạc,
viêm kểt mạc dị ứng, bệnh ở bề mặt mắt.
Rối loạn tai vả mê đạo
Thường gặp: C hóng mặt. Tần suất không rõ: Giảm thính giác, đau tai, ù tai.
Rối loạn tim
Thường gặp: Đau thắt ngực, Ioạn nhịp (bao gổm block nhĩ thất, cuồng động tim, ngoại tâm
thu, rung nhĩ, nhịp tim nhanh, nhịp tim chậm), đảnh trống ngực, khoảng QT kéo dải trên diện
tâm đồ. Ỉt gặp: Suy tim, trản dịch mảng ngoải tim, bệnh động mạch vảnh, xanh tím, tiểng thồí
ở tim. Tần suât không rõ: Nhồì mảu cơ tím, rôi loạn chức năng tâm thất, viêm mảng ngoải tim,
giảm phân suất tống mảu.
Rối Ioạn mạch
Thường gặp: Tăng huyết ảp, đỏ bừng mặt. Ít gặp: Cơn tăng huyết áp, bệnh tắc nghẽn động
mạch ngoại biến, khổi tụ máu. Tần suât không rõ: Sốc do xuất huyết, hạ huyết áp, huyết khối
xơ cứng động mạch.
Rối loạn hô hấp, ngực vả trung thẩt
Thường gặp: Khó thờ, khó thở`khi gắng sức, chảy r_nảu cam, ho, khó phảt âm, Ỉt gập: Phù phổi,
trản dịch mảng phôi, bệnh phôi kẽ, đau mảng phôi, viêm mảng phôi, đau họng-thanh quản,
kích thích họng. Tân suât không rõ: Tảng áp phôi, thở khó khế, đau vùng họng miệng.
Rối loạn tiêu hỏa
Thường gặp: V1em tụy, khó chịu ở bụng, chưởng bụng, khó tiêu, rối loạn vị giác, đầy hơi. Ít
gặp: Xuất huyết dạ dảy ruột, đi cầu phân đen, loét miệng, trảo ngược dạ dảy-thực quản, viêm
mỉệng, đau thực quản, khô miệng, răng nhạy cảm. Tần suất không rõ: Thùng ổ Ioét dạ dảy
một, xuất huyết sau mảng bụng, nôn ra mảu, loét dạ dảy, viêm loét thực quản, tắc ruột đoạn
dưới, viếm dạ dảy, viêm ruột non và ruột giả, trĩ, thoát vị khe thực quản, xuất huyết trực trảng,
viêm lợi.
Rối Ioạn gan mật
Rất thường gặp: Tăng bilirubin huyết. Thường gặp: Chức năng gan bất thường. Ít gặp: Nhiễm
độc gan, viêm gan do nhiễm dộc, vảng da. Tần suât không rõ: Ử mật, gan to.
.g,ỉ
Rối Ioạn da và mô dưới da
Thường gặp: Đố mồ hôi về đêm, eczema, nối mề đay, ban đỏ, tăng tiết mồ hôi, thâm tím, mụn
trứng cả, viêm da (bao gồm viêm da dị ứng, viêm da tróc vảy và viêm da dạng mụn trứng cá),
da khô. Ít gặp: Ban tróc vảy, ban do thuốc, đau ở da, bầm máu, sưng mặt. Tần suất không rõ:
Bệnh vảy nên, ban dò đa dạng, ban đỏ nổt, Ioét da, hội chứng vết ban dó mất cảm giác ở lòng
bản tay-bản chân, đốm xuất huyết, nhạy cảm ánh sáng, bóng nước, u nang bì, tâng sản tuyến
bã nhờn, teo da, da đổi mảu, da tróc vảy, tăng sắc tô da, phì đại tế bảo da, chứng dảy sừng.
Rối Ioạn co xương khởp và mô liên kểt
Thường gập: Đau ngực cơ xương, đau cơ gương khớp, dau lưng, đau cổ, đau sườn. Ít gặp:
Ct'mg cơ xương khớp, yếu cơ, sưng khớp. Tân suât không rõ: Viêm khớp.
Rối loạn thận và tiết niệu
Thường gặp: Tiều dắt. Ít gặp: Khó tịều, thôi thúc đi tiều, tiếu đêm Tần suất không rõ: Suy
thận, huyết niệu, tiền không tự chủ, sắc níệu.
Rối Ioạn hệ sinh sản và tuyến vú
Ít gặp: Đau vú, chứng vú to ở nam giới, rối Ioạn cương dương. Tần suất không rõ: Xơ cứng
mô vú, đa kinh, sưng núm vú.
Rối Ioạn toân thân và …… trạng tại chỗ dùng thuốc
Thường gặp: Sốt, đau ngực (bao gồm đau ngực không do tim), đau, khó chịu ở ngực, khó ở. Ít
gặp: Phù mặt, phủ theo trọng lực, bệnh giông củm, ớn lạnh, cảm giảc thay đổi thân nhiệt (bao
gôm cảm giảc nóng, cảm giảc lạnh). Tần suât không rõ: Phù khu trú.
Xét nghiệm
Rất thường gặp: Tảng alanine aminotransferase, tăng aspartate aminotransferase, tăng lipasc.
Thường gặp: Giảm hemoglobin, tãng amylase mảu, tăng gamma-glutamyltransferase, tăng
creatine phosphokinase máu tăng phosphatase kiềm trong máu, giảm cân, tăng cân. Ít gặp:
Tảng lactate dehydrogenase mảu, tảng urê máu, gỉảm globulin. Tẩn suất không rõ: Tăng
troponin, tảng bilirubin không lỉên hợp trong máu, tăng insulin mảu, giảm insulin mảu, giảm
insulin C- peptide, tăng lipoprotein (bao gôm Iipoprotein tỷ trọng rất thấp và lipoprotein tỷ
trọng cao), tăng hormone tuyên cận giảp trong mảu.
Cảc bất thường về xét nghiệm
Các bất thường có ý nghĩa lâm sảng hoặc nặng về trị số xét nghiệm huyết học hoặc sinh hóa
thông thường được trình bảy ờ Bảng 3.
Bảng 3 Các bẩt thường về xét nghiệm độ 3/4
Bệnh bạch cầu tủy mạn với nhiễm sẳc thể Nhiễm sắc thể
Philadelphia dương tính giai đoạn mạn tính Philadelphia dương tính.
(Ph+ CML-CP) mởi dược chẩn doán kháng lại hoặc không
dung nạp
`v ,:
L,
Tasigna Tasigna lmatinib Bệnh bạch Bệnh bạch
……g, ……g, ……g, cịẹgiủgojj" Cầg'ggif'gogg"
2 Iần/ngây 2 Iần/ngây ] Iần/ngây mạn tính cấp tính
N=279 N=277 N=280 1CML’CP1 1CML’AP1
N=JZI N=137
Các thông số huyết học
Ức chế túy xương
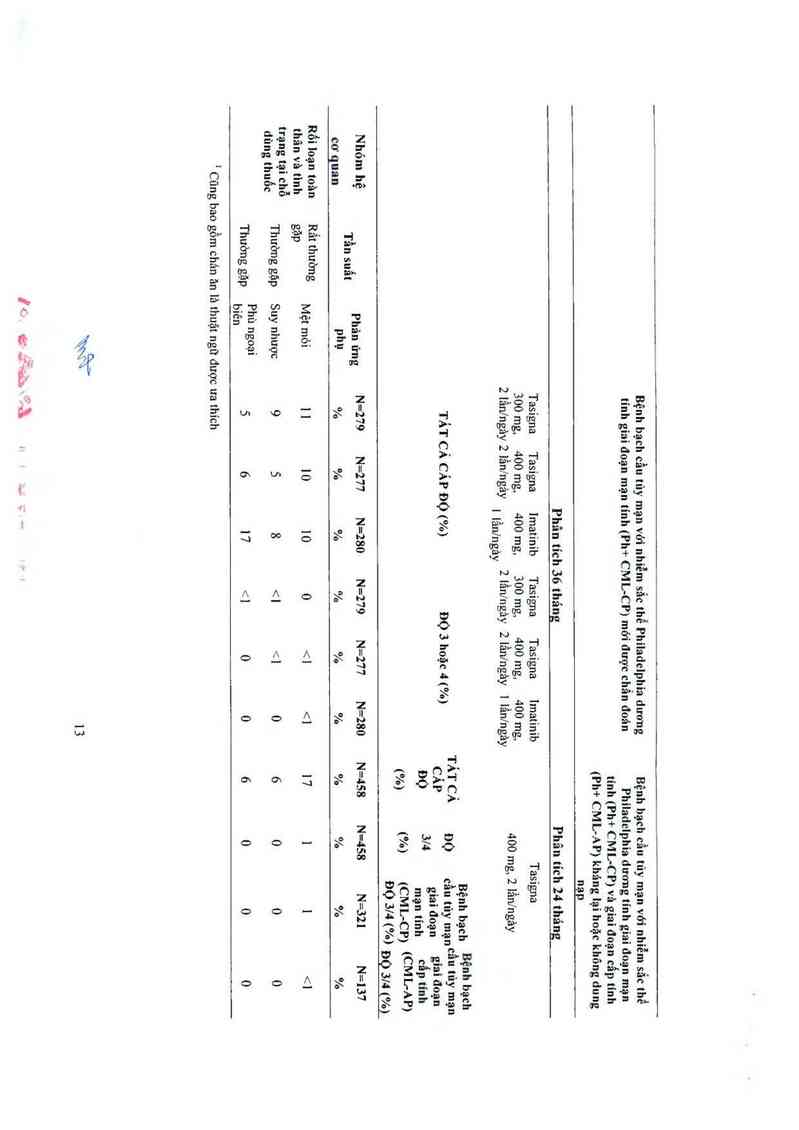
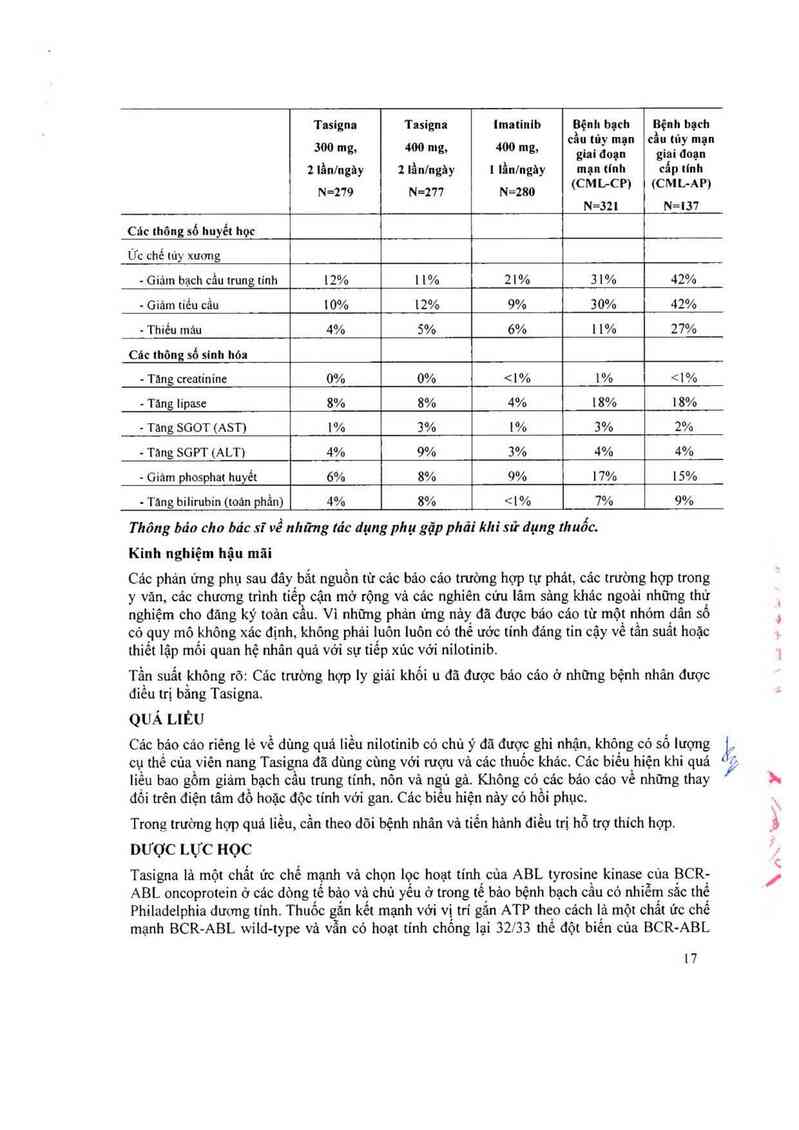
- Giảm bạch cầu trung tính 12% 11% 21% 31% 42%
~ Giảm tiều cầu 10% 12% 9% 30% 42%
— Thiếu máu 4% 5% 6% 1 1% 27%
Các thông số slnh hỏa
- Tăng creatininc 0% 0% <1% 1% <1%
- Tăng Iípase 8% 8% 4% 18% 18%
- Tang SCìOT (AST) 1% 3% 1% 3% 2%
- Tăng SGPT (ALT) 4% 9% 3% 4% 4%
- Giam phosphat huyết 6% 8% 9% 17% 15%
. Táng bilirubin (toản phần) 4% 8% < | % 7% 9%
T hông báo cho bác sĩ về những tác dụng phụ gặp phải khi sử dụng thuốc.
Kinh nghiệm hậu mãi
Cảc phản ứng phụ sau đây bắt nguồn từ cảc báo cáo trường hợp tự phảt, các trường hợp trong
y văn, ca'c chương trình tiếp cận mở rộng và cảc nghiên cứu lâm sảng khác ngoải những thử
nghiệm cho đăng ký toản câu Vì những phản ưng nảy đã được báo cáo từ một nhóm dân số
có quy mô không xảc định, không phải luôn luôn có thể ước tính đảng tin cậy về tần suất hoặc
thiết lập môi quan hệ nhân quả vởi sự tiếp xúc với nilotinib.
Tặn suất `không rõ: Các trường hợp ly gỉáí khối u đã được báo cáo ở những bệnh nhân được
điêu trị băng Tasigna.
QUÁ LIẺU
Cảc báo cáo riêng lẻ về dùng quá liều nilotinib có chủ ý đã được ghi nhận, không có số lượng
cụ thể cùa viên nang Tasigna đã dùng cùng với rượu và cảc thuốc khảo Các biểu hiện khi quá
liều bao gồm giảm bạch câu trung tinh, nôn và ngủ gả. Không có cảc bảo cáo về những thay
đối trên điện tâm đồ hoặc độc tính với gan. Các biều hiện nảy có hồi phục
Trong trường hợp quá liều, cần theo dõi bệnh nhân và tiến hảnh đỉều trị hỗ trợ thích hợp.
DƯỢC LỰC HỌC
Tasỉgna là một chất ức chế mạnh và chọn lọc hoạt tính của ABL tyrosine kinase của BCR-
ABL oncoprotein ở cảc dòng tế bảo vả chủ yêu ở trong tế bảo bệnh bạch câu có nhiễm sắc thể
Philadelphia dương tính. Thuốc gắn kết mạnh với vị trí gắn ATP theo cảch là một chất ức chế
mạnh BCR- ABL wild- -typc và vân có hoạt tính chống lại 32/33 thể đột biến cùa BCR-ABL
17
,.
~x.EỀ
\\ "
n—"`
khảng imatỉnib. Kết quả của hoạt động sinh hóa nảy lả nílotinib ức chế chọn lọc sự tăng sinh
và tạo ra sự chết tế bảo theo chương trình trong các dòng tế bảo vả chủ yêu trong tế bảo bệnh
bạch cầu với nhiễm sắc thể Philadelphia dương tính ở bệnh nhân bị bệnh bạch cầu tủy mạn
(CML) Trong mô hinh chuột bị bệnh bạch câu tủy mạn, nilotinib dùng liều đơn lảm giảm
gánh nặng khôi u và kéo dâi sự sống còn sau khi dùng đường uống.
Tasigna có it hoặc không có tảc dụng chống lại da số cảc protein kinase khảo đã được kiếm
tra bao gồm Src, ngoại trừ cảc kinase có thụ thể với PDGF, KIT, CSF- IR, DDR vả Ephxin
mà nó ức chế ở nổng độ trong mức đạt được sau khi dùng đường uống với Iiếu điều trị được
khuyến cáo để điếu trị bệnh bạch cầu tùy mạn (xem Bảng 4).
Bảng 4 Dữ liệu về Kinase của Nilotinib (Phosphoryl hóa leo nM)
BCR—ABL PDGF R KIT
20 69 210
Các nghiên cứu lâm sâng
Bệnh bạch cầu tủy mạn với nhiễm sắc thể Philadelphia dương tính giai đoạn mạn tính
(Ph+ CML CP) mới được chẩn đoán
Một nghiên cứu Phase III ngẫu nhiên, nhãn mớ, đa trung tâm đã được tiển hảnh để xảc định
hiệu quả cùa Tasigna so với Imatinib ở bệnh nhân người lớn bị bệnh bạch cầu tủy mạn với
nhiễm sắc thể Philadelphia dương tính giai đoạn mạn tính (Ph+ CML- CP) mới được chấn
đoán đã được xảc định về di truyền tế bảo học Cảc bệnh nhân đã được chẩn đoán trong vòng
6 tháng và trước đây chưa được điều trị về bệnh bạch cầu tùy mạn giai đoạn mạn tinh, ngoại
trừ điểu trị với hydroxyurea vả/hoặc anagrelide. Ngoài ra, cảc bệnh nhân được phân tầng theo
thang điếm nguy cơ Sokal vảo lủc chẩn đoán.
Hiệu quả dựa trên tổng số 846 bệnh nhân (283 bệnh nhân ở nhóm dùng imatinib 400 mg,
1 lần/ngảy, 282 bệnh nhân ở nhóm dùng nilotinib 300 mg, 2 lần/ngảy, 281 bệnh nhân ở nhóm
dùng nilotinib 400 mg, 2 lần/ngảy).
Các đặc điểm cơ bản cân bằng nhau giữa ba nhóm. Tuổi tnmg bình là 46 …ối ở nhóm dùng
imatinib và 47 tuổi ở cả hai nhóm dùng nilotinib, với 12,4%; 12,8% và 10% bệnh nhân
> 65 tuổi ở nhóm dùng imatinib, nilotinib 300 mg, 2 lần/ngảy vả nilotinib 400 mg, 2 lần/ngảy
tương ửng. Số bệnh nhân nam hơi nhiều hơn bệnh nhân nữ ở tất cả cảc nhóm (55, 8%; 56% và
62, 3% ở nhóm dùng imatinỉb, nilotinib 300 mg, 2 lần/ngảy vả nilotinib 400 mg, 2 lần/ngảy
tương ứng). Hơn 60% trong tất cả bệnh nhân là người da trắng vả 25% là người châu Á.
Thời diềm phân tích dữ liệu ban đầu là khi tất cả 846 bệnh nhân hoản tất 12 tháng điều trị
(hoặc ngừng sớm hơn) Cảc phân tích sau đó phản ảnh khi bệnh nhân hoân tất 24 tháng và 36
tháng điều trị (hoặc ngừng sớm hơn). Thời gian điều trị trung binh khoảng 36 thảng 0 tất cả 3
nhóm điếu trị. Liều dùng thực sự trung binh lả 400 mglngảy ở nhóm dùng imatinib, 594
mg/ngảy ở nhóm dùng nilotinib 300 mg, 2 lần/n ảy vả 778 mg/ngảy ở nhóm dùng nilotinib
400 mg, 2 lần/ngảy. Nghiên cứu nây đang được tiep tục.
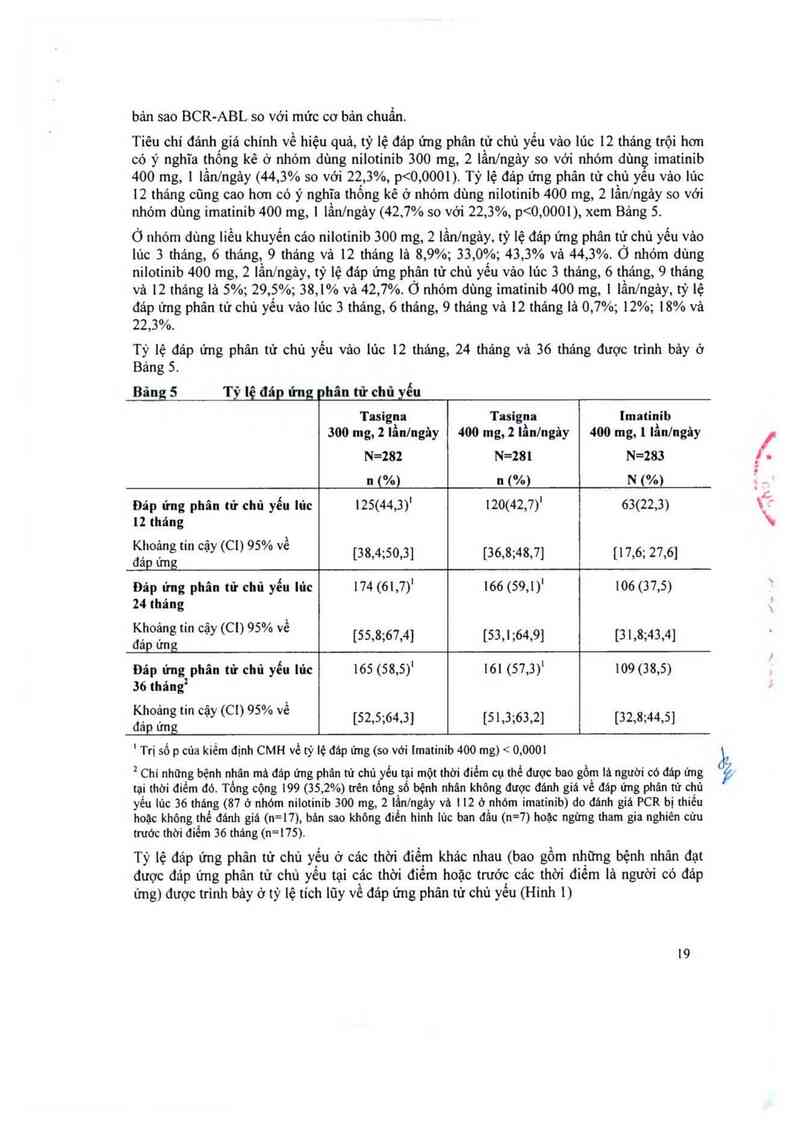
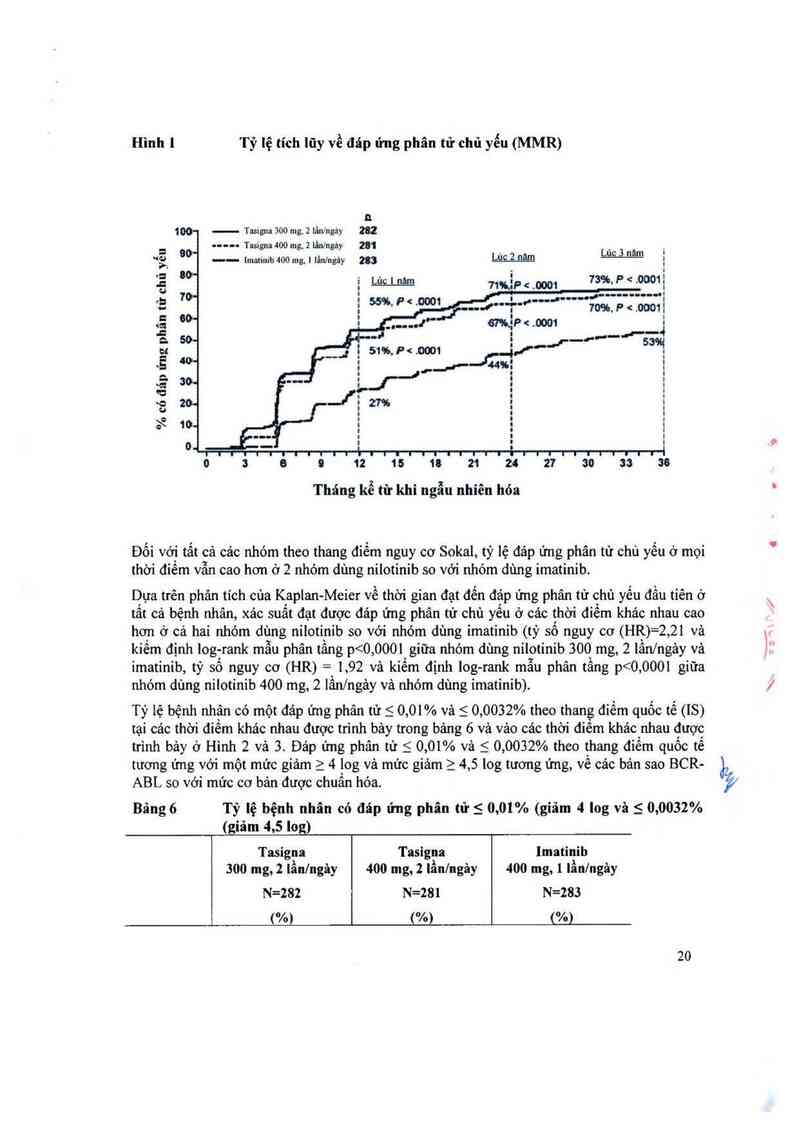
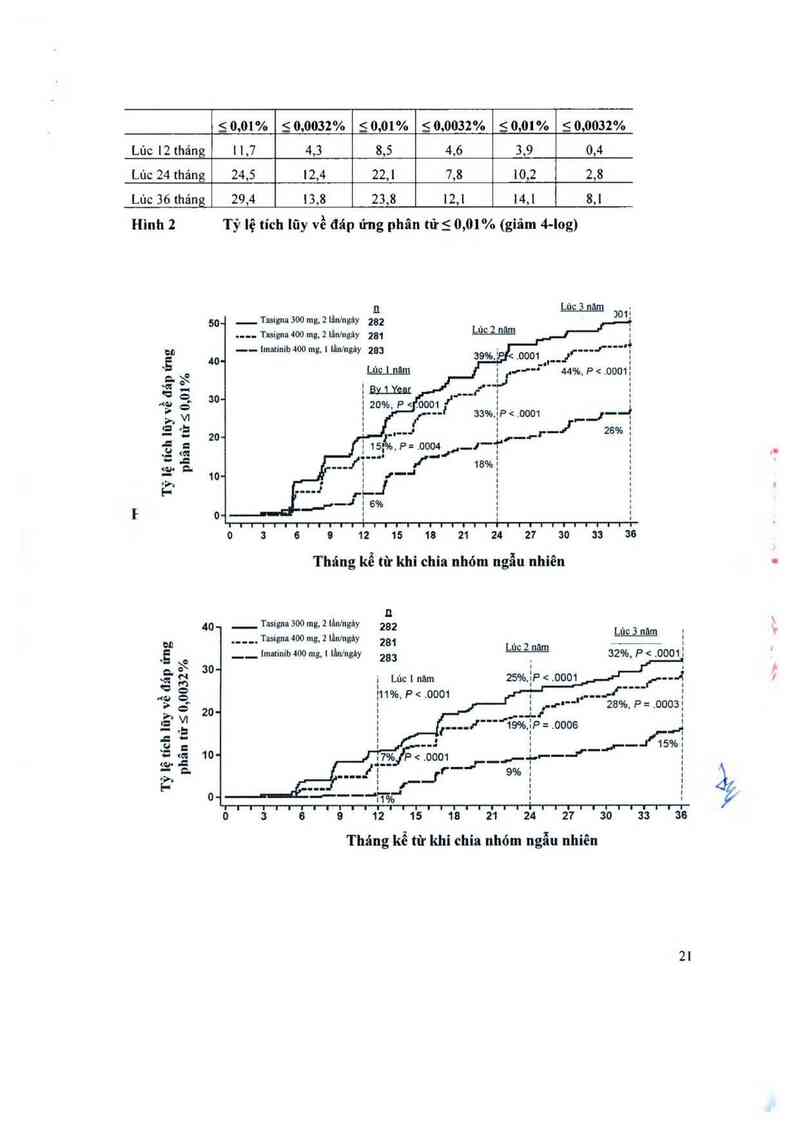
Đáp ửng phân từ chủ yếu (MMR)
Biến số hiệu quả ban đầu là đảp ứng phân từ chủ yếu vảo lủc 12 thảng sau khi bắt đầu dùng
thuôc nghiên cứu. Đảp ứng phân tư chủ yêu được định nghỉa lả 5 0,1% tỉ lệ % cùa BCR—
ABL/ABL theo thang điêm quỏc tế được đo bởi RQ-PCR, tương ứng với sự giảm 2 3 log cùa
' 18
ậr
bản sao BCR-ABL so với mức cơ bản chuẩn.
Tiêu chí đánh giá chính về hiệu quả, tỷ lệ đáp ứng phân từ chủ yếu vảo lúc 12 thảng trội hơn
có ý nghĩa thống kê ở nhóm dùng nilotinib 300 mg, 2 lần/ngảy so với nhóm dùng imatinib
400 mg, 1 lần/ngảy (44, 3% so với 22,3%, p 600 mg/ngảy ở 74% trong số tất cả
bệnh nhân, với 40% bệnh nhân dùng liều imatinib> _ 800 mg/ngảy.
Bảng 9 Đặc điếm tiền sử bệnh bạch cầu tủy mạn
Giai đoạn mạn tính Giai đoạn cẫp tính
(n=321) (n=137)*
Thời gian tnmg bình từ khi chẩn đoán ss 71
tính theo thảng (khoảng) (5_275) (2-298)
lmatinib
Khảng lại 226 (70%) 109 (80%)
Không dung nạp, không có đáp 95 (30%) 27 (20%)
ưng di truyền học tế bảo chủ yêu
24
(MCyR)
Thời gian điều trị imatinib trung bình 976 857
tinh theo ngảy (phân vị ngảy thứ 25-75) (519 _ 1,488) (424 _ 1,497)
Điểu trị trước với Hyđroxvurea 83% 91%
Điều trị truớc với lnterferon 58% 50%
Ghép tạng trước đó 7% 8%
* 1 bệnh nhân thiếu thông tin về tinh trạng kháng lại/dunggạp imatinib
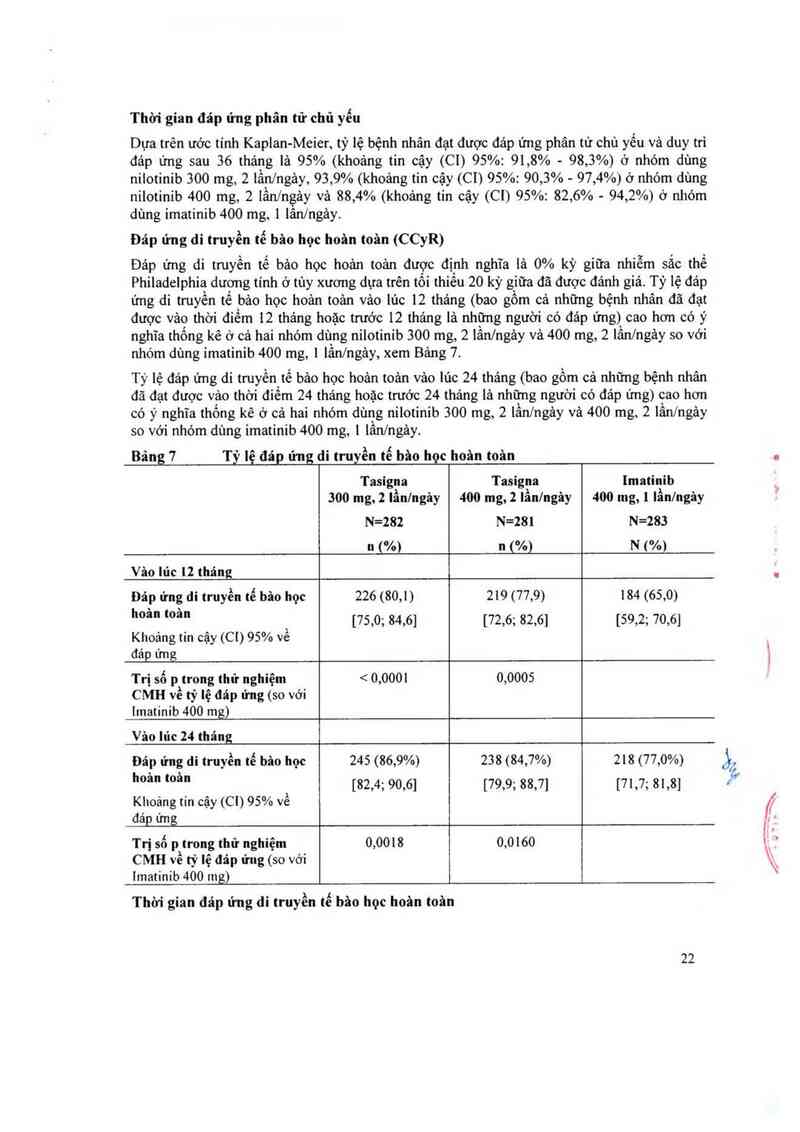
Tiêu chí đảnh giả chính đầu tiên ở cảc bệnh nhân giai đoạn mạn tính là đảp ứng di truyền học
tế bảo chủ yểu (MCyR), được định nghĩa là sự 1oại bò (đảp ứng di truyên tế bảo học hoân
toản-CCyR) hoặc giảm đáng kể <35% kỳ giữa nhiễm sắc thể Philadelphia dương tính (Ph+)
(đảp ửng di truyền tế bảo học một phần) của tế bảo tạo huyết có Ph+. Đảp ứng huyết học hoản
toản (CHR) ở bệnh nhân giai đoạn mạn tính đã được đảnh giả như là một tiêu chỉ phụ. Tiêu
chí đảnh giả chính đầu tiên ờ các bệnh nhân giai đoạn cấp tính là đảp ứng huyết học (HR) đã
được xảc định toản bộ được định nghĩa là đảp ứng huyet học hoản toản, không có dấu hiệu
bệnh bạch cầu hoặc 1ảtrờ về giai đoạn mạn tính.
Giai đoan man tính: Tỷ lệ đảp ứng di truyền tế bảo học chủ yếu (MCyR) ở 321 bệnh nhân
giai đoạn mạn tính là 59%. Hầu hết người có đảp ứng đạt được đảp ứng di truyền tế bảo học
chủ yếu nhanh trong vòng 3 thảng (trung bình là 2, 8 tháng) kế từ bắt đầu điều trị bằng
Tasigna và những đảp ứng nảy được duy trì. Tỷ lệ đảp ứng di truyền tế bảo học hoản toản là
44%. Thời gian trung bình đê đạt đáp ứng di truyền tế bảo học hoản toản chỉ hơn 3 tháng
(trung binh 3, 3 tháng). Trong số những bệnh nhân đạt đảp ứng di truyền tế bâo học chủ yêu,
77% vẫn duy trì đảp ứng vảo 11'1c 24 tháng (khoảng tin cậy (C1) 95%: 71% — 84%). Không đạt
được khoảng thời gian trung bình đảp ứng đi truyền tế bảo học chủ yếu. Trong sô những bệnh
nhân đạt đảp ứng di truyền tế bâo học hoản toản, 84% vẫn duy trì đảp ứng sau 24 tháng
(khoảng tin cậy (C1) 95%: 77% - 91%). Không đạt được khoảng thời gian trung bình đáp ứng
di truyên tế bảo học hoản toản. Những bệnh nhân có đáp ứng huyết học hoân toản ớ lủc ban
đầu đạt được đảp ứng di tmyến tế bảo học nhanh hơn (1,4 tháng so với 2, 8 thảng). Trong số
bệnh nhân không có đáp ứng huyết học hoản toản ở mức cơ bản, 76% đạt được đảp ứng huyết
học hoản toản và thời gian trung binh đạt được đáp ứng huyết học hoản toản là 1 tháng vả thời
gian trung bình cùa đáp ứng huyết học hoản toản thì chưa đạt được.
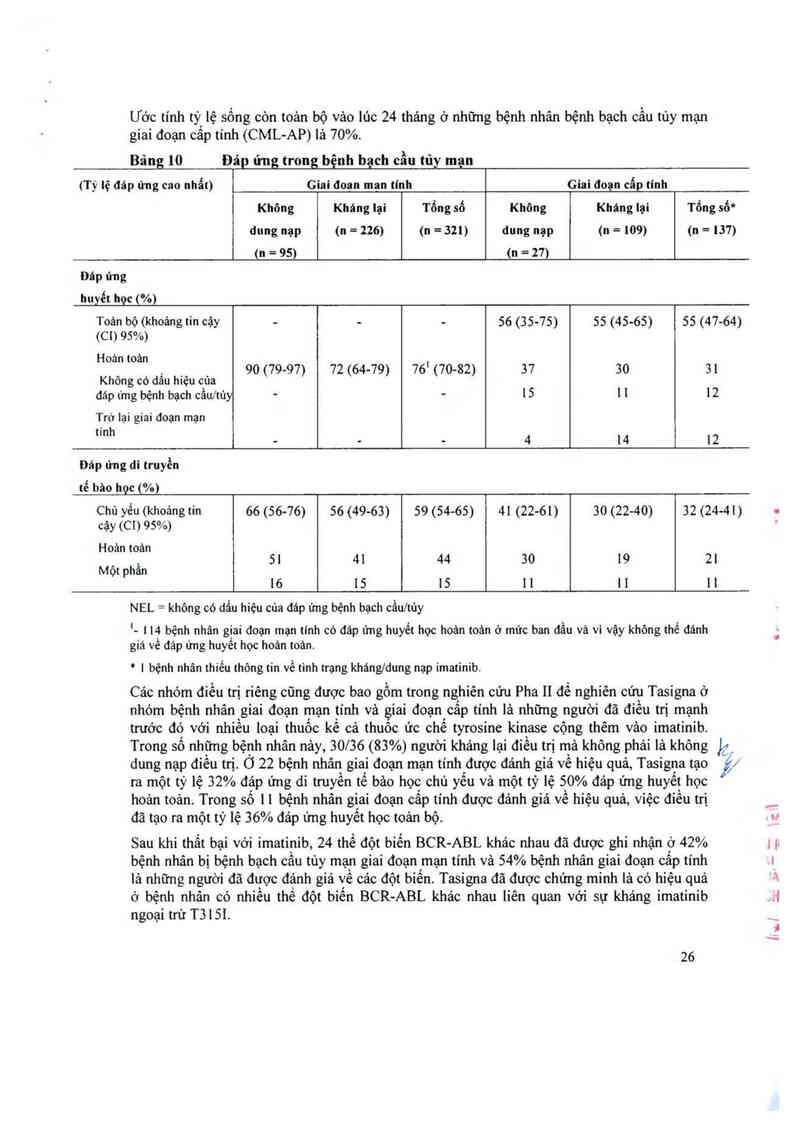
Ước tính tỷ lệ sổng còn toản bộ vảo lức 24 tháng ở những bệnh nhân bị bệnh bạch cầu tùy
mạn giai đoạn mạn tính (CML-CP) là 87%.
Giai đoan cẩp tính: Tỷ lệ đảp t'mg huyết học được xảc định toản bộ ở 137 bệnh nhân giai f
đoạn cấp tính là 55%. Hầu hết người có đảp ứng đạt được đảp ứng huyết học sớm với điều trị
bằng Tasigna (trung bình là 1 tháng) và những người nảy có thể kéo dải trong một thời gian
lâu (thời gian trung binh của đảp ứng huyết học được xảc định là 21,5 thảng). Trong số
những bệnh nhân đạt được đảp ứng huyết học, 49% vẫn duy tri đáp ứng vảo 1ủc 24 tháng
(khoảng tin cậy (C1) 95%: 35% - 62%). Tỷ lệ đảp ứng di truyền tế bảo học chủ yếu là 32%
với thời gian trung bình dẫn đến đáp ứng là 2, 8 thảng. Trong sô những bệnh nhân đạt đảp 1’mg
di truyền tế bảo học chủ yếu, 66% vẫn duy tri đảp ửng vảo lúc 24 thảng (khoảng tincậy (C1)
95%: 50% - 82%). Không đạt được khoảng thời gian trưng binh đáp ứng di truyền tê bâo học
chủ yếu. Tỷ lệ đáp ứng đối với 2 nhóm điều trị được bảo cảo ờ Bảng 10.
25
Ước tinh tỳ, lệ sống còn toản bộ vâo lủc 24 thảng ở những bệnh nhân bệnh bạch cẳu tủy mạn
giai đoạn câp tính (CML—AP) lả 70%.
NEL = không có đẻ… hiệu cùa đảp ứng bệnh bạch cầultủy
1- 1 14 bệnh nhân giai đoạn mạn tính có đáp ứng huyết học hoản toản ở mức ban đầu vả vì vậy không thể đánh
giá về đáp ứng huyêt học hoản toân.
’ 1 bệnh nhân thiếu thông tin về tinh trạng khángidung nạp ímatinib.
Các nhóm điều trị riêng cũng được bao gồm trong nghiên cứu Pha 11 để nghiên cứu Tasigna ở
nhóm bệnh nhân giai đoạn mạn tinh và giai đoạn câp tinh là những người đã điều trị mạnh
trước đó với nhiều loại thuốc kể cả thuôc ức chế tyrosine kinase cộng thêm vảo imatinib.
Trong số những bệnh nhân nảy, 30/36 (83%) người khảng lại điều trị mã không phải là không
dung nạp điều trị Ở 22 bệnh nhân giai đoạn mạn tính được đánh giá về hiệu quả, Tasigna tạo Ễ
ra một tỷ lệ 32% đảp ứng di truyền tế bâo học chủ yếu và một tỷ lệ 50% đảp ứng huyết học
hoản toản. Trong sô 1 1 bệnh nhân giai đoạn câp tính được đánh giá về hiệu quả, việc điều trị
đã tạo ra một tỷ lệ 36% đảp 1'mg huyết học toản bộ.
Sau khi thất bại với imatinib, 24 thể đột biến BCR—ABL khảc nhau đã được ghi nhận ờ 42%
bệnh nhân bị bệnh bạch cầu tùy mạn giai đoạn mạn tinh và 54% bệnh nhân giai đoạn cấp tinh
là những người đã được đánh giá về cảc đột biến. Tasigna đã được chứng minh là có hiệu quả
ở bệnh nhân có nhiễu thế đột biến BCR-ABL khác nhau 1iên quan với sự khảng imatinib
ngoại trừ T3151.
26
/.
Bâng 10 Đảp ứng trong bệnh bạch cầu tủy mạn
(Tỷ lệ đáp ứng cao nhất) Giai đoan man tính Giai đoạn cấp tính
Không Kháng lại Tổng số Không Kháng lại Tổng số"
dung nạp (n = 226) (11 =321) dung nạp (n = 109) (11 = 137)
(11 = 95) (11 = 27)
Đáp ủng
huyết học (%)
Toản bộ (khoảng fin cậy - - - 56 (35-75) 55 (45-65) 55 (47-64)
(C 1) 95%)
Hoả… toản 1
. _ 90 (79-97) 72 (64—79) 76 (70—82) 37 30 31
Không có dâu htệu cùa
đáp ứng bệnh bạch cầultùy — - 15 1 1 12
Trở lại giai đoạn mạn
'mh … - - 4 14 12
Đáp ứng di truyền
tế bảo học (%)
Chủ yếu (ldìoảng tin 66 (56-76) 56 (49—63) 59 (54-65) 41 (22-61) 30 (22—40) 32 (24-41) 1
cậy (C1) 95%) .
Hoản toân
_ , 51 41 44 30 19 21
Mọt phan
16 15 15 1 | 1 1 l 1
DƯỢC ĐỌNG HỌC
Hấp thu
Nồng độ đinh cùa nilotinib đạt được sau khi uống 3 giờ. Sự hấp thu nilotinib sau khi uống
khoảng 30%. Sinh khả dụng tuyệt đối cùa nilotinib chưa được xảc định Khi so sảnh với một
dung dịch thức uống (pH 1 ,2— 1,3), sinh khả dụng tương đối của viên nang nilotinib khoảng
50%. Ở những người tinh nguyện khỏe mạnh, nông độ cao nhất trong huyết tương (C,…) tăng
lên 112% và díện tich dưới đường cong (AUC) của nilotinib tăng 82% so với tinh trạng đỏi
khi Tasigna được dùng cùng với thức ăn. Dùng Tasigna sau khi ăn 30 phứt, sinh khả dụng của
nilotinib tăng 29% hoặc sau khi ản 2 giờ sinh khả đụng của nilotinib tăng 15% (xem phần
LIÊU LƯỢNG VÀ CÁCH DÙNG, CANH BÁO VÀ THẶN TRỌNG ĐẶC BIỆT KHI SỬ
DỤNG vả TƯONG TÁC THUỐC). Sự hấp thu nilotinib (sinh khả dụng tương đối) có thế bị
giảm xuống khoảng 48% ở những bệnh nhân cắt dạ dảy toản bộ và 22% ở những bệnh nhân bị
cắt dạ dảy một phần.
Dùng liều đơn 400 mg nilotinib, sử dụng 2 viên nang 200 mg mả bọt thuốc của mỗi viên được
pha vảo ] thìa cả phê táo nghiền nhuyễn cho lhấy có sự lương đương sinh học với việc sử
dụng- 7 viên nang 200 mg nguyên vẹn.
Phân bố
Tỷ số nilotinib máufhuyết tương lả 0,68. Gắn kểt với protein khoảng 98% trên cơ sở cảc thử
nghiệm in vitro.
Biến đổi sinh học
Đường chuyền hóa chính đã được biết ở người khỏe mạnh là oxy hóa và hydroxyl hóa.
Nilotinib lả thảnh phần lưu thông chính trong huyết thanh. Không có chắt chuyển hóa nảo góp
phần đảng kế vảo hoạt tinh được lý cùa nilotinib.
Thải trừ
Sau khi dùng một liếu đơn nilotinib có gắn phóng xạ cho những người khỏe mạnh, trên 90%
liều dùng được thải trừ trong vòng 7 ngảy, chủ yếu qua phân. Thuốc ở dạng ban đầu chiếm
69% liếu nảy.
Sự tuyến tính I không tuyến tính
Mức tiếp xúc với nilotinib ở trạng thải ổn định phụ thuộc liều và ít hơn sự tăng mức tiếp xúc
toản thân tỷ lệ với liếu khi dùng các mức liều cao hơn 400 mg, | lần/ngảy. Mức tiếp xúc với
nilotinib trong huyết thanh hảng ngảy khi dùng 400 mg, 2 1ần/ngảy ở trạng thái ôn định cao Ẩĩ
hơn 35% so với khi dùng 800 mg, 1 lần/ngảy. Mức tiêp xúc toản thân (diện tích dưới đường j
cong- AUC) cùa nilotinib ở trạng thải on định khi dùng mức liếu 400 mg, 2 lần/ngảy cao hơn
khoảng 13,4% so với khi dùng 300 mg, 2 Iần/ngây. Nổng độ đảy vả nổng độ đinh trung binh
cùa nilotinib sau 12 thảng cao hơn khoảng 15,7% và 14,8% sau khi dùng Iiểu 400 mg, 2
lần/ngảy so với khi dùng 300 mg, 2 lần/ngảy. Không có sự tăng có ý nghĩa về mức tiêp xúc
với nilotinib khi tăng liếu từ 400 mg, 2 lần/ngảy đến 600 mg, 2 lân/ngảy.
27
Cảc đặc điểm ở bệnh nhân
Các tình trạng ở trạng thải ổn định cơ bản đạt được vảo ngảy thứ 8. Sự tăng về mức tiếp xức
với nilotinib trong huyết thanh giữa liều dùng đầu tiên và ở trạng thái ốn định gấp khoảng 2
lần khi dùng hảng ngảy và gấp khoảng 3, 8 lằn khi dùng 2 lẳnlngảy. Thời gian bán thải biều
kiến ước tính khi dùng protein kinase đa liều hảng ngảy vảo khoảng 17 giờ. Sự biến thiên về
nồng độ protein kỉnase của nilotinib giữa các bệnh nhân lò từ trung bình đến cao.
cÁc DỮ LIẸU AN TOÀN TIỀN LÂM SÀNG
Nilotinib đã được đánh giá trong các nghiên cứu về dược lý an toản, độc tinh liếu lặp lại, độc
tinh gen, độc tính đối với sinh sản, độc tính ánh sảng và một nghiên cứu về khả năng gây ung
thư trên chuột cống.
Nilotinib không có tảc dụng trên hệ thần kinh trung ương hoặc chức năng hô hấp. Cảc nghiên
cứu về an toản đối với tim in virro đã cho thấy một dấu hiệu tiền lâm sảng về khoảng QT kéo
dải. Chưa thấy tảc dụng nảo khi đo điện tâm dỗ cho chó hoặc khi được cho dùng thuôc đến 39
tuần hoặc trong một nghiên cứu đo từ xa (telemetry) đặc biệt trên chó.
Cảc nghiên cứu về độc tính khi dùng liều lặp 1ại trên chó cho đến 4 tuần và trên khi
cynomolgus cho đến 9 tháng đã phát hiện gan là cơ quan đích đầu tiên bị nhiễm độc nilotinib.
Cảc thay đối bao gổm tăng hoạt tính cùa alanine aminotransferase vả phosphatase kíềm vả các
dấu hiệu về mô bệnh học (chủ yếu lả tăng sảnlphi đại tế bảo mao mạch hinh sin (sinusoidal)
hoặc tế bảo Kupffer, tăng sản ông mật và xơ hóa quanh tĩnh mạch cứa). Nói chung những
thay đổi về hóa lâm sảpg có thể phục hồi hoản toản sau một giai đoạn phục hồi trong 4 tuần,
còn cảc thay đổi về mô học chỉ cho thấy sự phục hổi một phần. Mức tiêp xúc khi dùng mức
liếu thắp nhất đã ghi nhận có ảnh hướng trên gan thi thấp hơn mức tiếp xúc ở người khi dùng
1 liếu 800 mg/ngảy. Chi thấy các thay đổi nhỏ ở gan trên chuột nhắt hoặc chuột cong được
điếu trị đến 26 tuân. Sự gia tăng nông độ choiesterol có thể hồi phục được chủ yêu gặp ở
chuột cống, chó và khi. Trong một nghiên cứu 2 năm về khả nảng gây ung thư trên chuột
cống, cơ quan đích quan trọng đối với cảc tổn thương không phải khối u tân sinh là tử cung
(giãn, giăn mạch, tăng sản tế bảo nội mô, viêm vả/hoặc tăng sản biếu mô).
Các nghiên cứu về độc tính gen ở các hệ thống vi khuẩn in vírro, ở động vật có vú in vitro và
ở cảc hệ thống … vivo có và không có sự hoạt hóa về chuyền hóa đã không phát hiện bất kỳ
dấu hiệu nảo vẻ khá nâng gây đột biến của nilotinib.
Không có bằng chứng về khả năng gây ung thư trong một nghiên cứu 2 năm về khả năng gây
ung thư ở chuột công khi dùng nilotinib với liếu 5,15 và 40 mglkg/ngảy Mức tiếp xúc (về
diện tích dưới đường cong- AUC) khi dùng mức liếu cao nhất đại diện cho khoảng 2iần đến
31ấn mức tiếp xúc hảng ngảy ở trạng thái ôn định trên người (dựa trên AUC) với nilotinib ớ
1iếu 800 mg/ngảy.
Nilotinib không có tính gây quải thai nhưng đã cho thấy có độc tính với phôi vả thai ở các liều
cũng cho thẳy độc tính đối với vật mẹ. Đã quan sát thấy tăng mất phôi sau khi cấy trong một
nghỉên cứu về khả năng sinh sản khi điếu trị cho cả vật đực và cái, và trong một nghiên cứu
vệ độc tính với phôi khi điêu trị cho vật cái. Đã gặp chêt phôi và tác dụng đôi với thai (chủ
yếu là giảm trọng iượng thai, thay đồi về nội tạng và bộ xương) trên chuột cống và tăng tiếu
thai và cảc thay đổi vê xương trên thò trong các nghiên cứu về độc tính với phôi. Mức tiếp
28
x,,
xức với nilotinib ở vật cải ớ nồng độ không quan sảt thấy tác dụng có hại nói chung lả ít hoặc
băng với mức tiếp xức ở người khi dùng liêu 800 mg/ngảy.
Trong một nghiên cứu trước vả sau sinh, dùng nilotinib đường uống cho chuột cống cải từ
ngảy thứ 6 của thời kỳ thai nghén đến ngảy thứ 21 hoặc 22 sau sinh dẫn đến những ảnh hưởng
tới chuột mẹ (giảm hấp thu thức ăn vả tăng cân ít hơn) và thời gian thai nghén kéo dải hơn ở
liếu 60 mg/kg. Chuột mẹ dùng liều 60 mg/kg lảm giảm cân nặng của chưột con và có sự thay
đổi một sô thộng số phảt triến thể chất (thời gian trung binh cùa hình thảnh tai ngoải, mọc
răng và mở mắt sớm hơn). Nồng độ không quan sát thấy tác dụng có hại lên chuột công mẹ và
con là liếu dùng 20 mg/kg cho chuột mẹ.
Trong một nghiên cứu về sự phảt triến ở chuột cổng chưa trường thảnh, nilotinib được dùng
bằng ong đưa qua miệng vảo dạ dảy cho chuột công chưa trưởng thảnh từ tuấn thứ nhất sau
sinh đến khi trướng thảnh (ngảy thứ 70 sau sinh) ở liếu 2, 6 vả 20 mg/kg/ngảy. Các tác dụng
giới hạn ở liếu 20 mglkg/ngảy, bao gồm giảm thông số cân nặng và sự tiêu thụ thức ăn vả hồi
phục sau khi ngừng thuốc. Nồng độ không quan sảt thấy tảc dụng có hại lên chuột cống chưa
trướng thảnh được xem xét là 6 mg/kg/ngảy. Nhìn chung, dữ liệu về độc tinh ở chuột cống
chưa trưởng thảnh tương tự như quan sát thấy` ơ chuột công trướng thảnh.
Nilotinib cho thấy hấp thu ánh sáng ở mức tia UV- B và UV- A, và được phân bố vảo da, cho
thẳy khả năng có độc tinh ảnh sáng in vitro. Tuy nhiên, không quan sảt thấy độc tính ảnh sáng
inyivo. Vì vậy nguy cơ nilotinib gây nhạy cảm ánh sáng trên các bệnh nhân được cho là rât
thâp.
TẢ DƯỢC
Viên nang cứng 150 mg
Cảc chất trong viên nang: Lactose monohydrat, crospovidone, poloxamer 188, silic dạng keo
khan/silicon dioxid dạng keo, magnesi stearat.
Vỏ nang: Gelatin, titan dioxid (E171), oxid sắt mảu đò (E 172), oxid sắt mảu vảng (13172)
Mực in: Oxid sắt mảu đen (E172)
Viên nang cứng 200 mg
Cảc chất trong viến nang: Lactose monohydrat, crospovidone, poloxamer 188, silic dạng keo
khan/silicon dioxid dạng keo, magnesi stearat.
Vỏ nang: Gelatin, titan dioxid (E171), oxid sắt mảu vảng (15172))
Mực in: Oxid sắt mảu đó (12172)
Công thức dược phấm có thề khảc nhau giữa cảc nước.
TƯONG KY
Chưa được ghi nhận.
HẠN DÙNG
Viên nang cửng 150 mg: 36 thảng kể từ ngảy sản xuất.
Viên nang cứng 200 mg: 36 tháng kể từ ngảy sản xuất.
BẢO QUẢN
29
Không bảo quản trên 30°C.
Giữ thuốc trong bao bì gốc.
Không dùng Tasigna quá hạn sử dụng được ghi “EXP” trên bao bi.
HƯỚNG DẤN sử DỤNG VÀ XỬ LÝ
Lưu ý: Tasigna phải để xa tầm tay và tầm nhìn cũa trẻ em.
QUY CÁCH ĐÓNG GÓI
Hộp 7 vi x 4 viên nang.
NHÀ SẢN XUẤT
Novartis Pharma Stein AG ' ’
Schaffltauserstrasse
CH—4332 Stein, Thụy Sỹ.
Tờ hướng dẫn sử đụng cho quốc tế
Ngảy phát hảnh thông tin: Tháng 7, 2012
® = nhản hiệu đã đảng ký
Novartis Pharma AG, Base1, Switzerlan
30 /’
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng