














/1 M 1 %
PREPRESS - INFORMATION PREPRESS- ROCHE BASEL CUSTOMER
Control Proof Ne P of C t“
Format 46 x 36 x 120 mm w '° °"ec 'ons
Register Nr. 10.046 Date: ............................ Date: ............................ om: ............................
NP 2012
17 03 2011 01~30—24…——___ Visa: ............................ Vìsa: ............................ Visa: ............................
Gru dschrift 1;5> R…tkì
( 1 ( Ql' (A 1 Ý D1JƯC` OK for Printing Control File OK for Printing
` …. 'A , . , ^,U , Date: ............................ Date: ............................ Date: ............................
_1 m 1'Hh 111 `t m
1 q1/ Visa: ............................ Visa: ............................ Visa: ............................
I I | AJ n
1; 1.1… thitiz.A.Ọk….ÊẺt ...Qềfflẵí
10129378 F 10129378 FE 011 9378 FE 10129378 FE 10129378 FE
FILM 1 VON.S_ FILM 2 VON 5 FIL 3 VON 5 FILM 4 VON 5 FILM 5 VON 5
Pantone Black PMS 300 485 PMS 199 PMS 216
17.03.11 17.03.11 17.03.11 1703.11 17.03.11
MedtCll'iel keep out of reach of children Each tablet contains 150 mg ertotimb (as erlottnib Á
ẫ Dosage and admmistration: see package insert hydrochlonde). ,/
Do not store above 30 °C Also contains lactose
Mỏ“ _, - n' 150 , › , THUỐC cnỉ BẢN THEO DơN Ịl _
1v1nnentmơphum c ưa mg Erotmb OE XA TẦM TAYCỦATRẺ EM __
(đươu dang erlotimb hydrochlonde)
…o'
@ HÔp chứa 3 vi. mò: vi 10 vien oọc KỸ HƯỚNG DÀN sứ DỤNG mước xui“ Ế
m ẵ Dùng đương uỏng DUNG < =
m , Ẹ _ ~
> g o Ẹ Chỉ dinh. cn_óng chi ơmn. Itèu vá ca'ch dùng … xem trong ẵóẵảgg kimá _ … , Ềv -'
8 c E 3 tờ hướng dân sử đụng n n án “ -\`y _ ẳ “«
-- E & hô bả trẻ so°
5 ồ . o 'Ễ K ng 0 quán Ở nhiệt dó n C Sản xuêl bời Roche S.p.A. _ `:
M t '“ ~ NSX, HD sò iớ sx xem phán MFD EXP. sỏ lò tn ttẻn bao V'ẽ M°fỉth ², ²0090 Segrate (Milano). Y
|:- uJ 0 bi Ngáy né1hạn tả ngáy 01 cúa Ỉha'ng Đong got bói F. Hoffmann—La Roche Ltd
CH-4303 Kaisecaugst. Thụy Sỹ
I I I
&…
aieiõas aus uouanpotd
ueuw 'V'd'S auJOb
.. Áq ’pueụazww; ’;aseg
'. .~, pt1 anou 91-uueuugoH “j
- =\ i?ẳỆả”
. _ , , _ — " zmz
Ệ
~ 'ịiitli ' P . i )
. / _f /
O 30 fiIm-coated tablets
Tarceva®
Erlotinib
0 30 film-coated tablets
IGI'COVâ `lbU mg
Patext halbmanuell OK for Printing Control File OK for Printing
G rundschrift 8 Punkt
Date: ............................ Date; ............................ Date: ............................
Visa: ............................ Visa: ............................ Visa: ............................
ịỆfflổậậẵ,ffl Zelchnung 04.4.3844 Tarce_va°
chwarz Erlotinib
1 50 mg
05.02.09
Art-Nr, 20f5-Code
1 x pro
- @
Zylmder-Umfang
" T ® 150 mg T ® 1 50 mg T ® ›—
arceva arceva arceva
Erlotinib Erlotinib Erlotinib
150 mg T ® 150mg T ® 150mg
arceva arceva f—,
Erlotinib Edotinib ẵ
T Ở 1 50 mg T ® 1 50 mg T @ s
arceva arceva arceva =
Erlotinib Erlotinib Erlotinib ỉ
150mg 150 mg 150mg —
TarcevafflJ Tarceva® “
Erlotinib Erlotinib _ _ _
15°…9 15°…9 w Wii ~JA1 DIEN
Tarceva® Tarceva® Ta “ ’. .;
- Erlotinib Ertotinib E TAI WiiH %
150mg 150mg 15 - ' ~ …"
Tarceva® Tarceva® \\ H A N [)|
Erlotinib Erlotinib ,} ` '
150mg 150mg x'." 1,
Tarceva® Tarceva® TarceiìùẬ %
Ertot1mb Erlotinib Erlotinib "Ệ
150mg 150mg 150mg s
Tarceva® Tarceva® ị
Erlotinib Erlotinib g
T ® 1 50 mg T @ 1 50 mg T ® …
arceva arceva arceva
Erlotinib Erlotinib Eriotmib
150 mg 150mg 150mg
— Tarceva® Tarceva® ,—, —
Erlotinib Erlotinib
1 50 mg 1 50 mg
Tarceva® Tarceva® —, Tarceva®
Erlotinib Erlotinib Erlotinib ẵ
150mg 150 mg 150mg 3
Tarceva® Tarceva® =
Erlotinib Erlotinib —
— T ® 150mg T ® 150mg T ® !
arceva … arceva arceva
ẳ2%*123 <_…… ảtftiig ẵ
mg
Tareeva® Tatceva®
Erlotinib Erlot1mb <'Ẹỳ
T ® 1 50 mg T @ 1 50 mg T ®
arceva arceva arceva
Erlotinib Erlotinib Erlotinib
150 mg 150mg 150mg
Tarceva® Tarceva® ,—
Erlotinib < Roche) Erlotinib ( MW)
T ® 1 50 mg T ® 1 50 mg T ®
arceva arceva arceva
—— Erlotinib Erlotinib Erlotinib -—
150 mg 150mg 150mg
Tarceva® Tarceva® ,—,
Erlotinib Erlotinib <……>
T ® 1 50 mg T @ 1 50 mg T ®
arceva arceva arceva
Ệrsltồtiniẵ <…Ộ Ẹrsltỗiinib <…) Ẹịcãm1b
… mg mg
Tarceva® Tarceva®
Erlotinib Erlotinib <…)
T ® 1 50 mg T @ 1 50 mg T ®
arceva arceva arceva
Eriotimb Erlotinib Ertotmib
150mg T ® 150mg T ® 150mg
— arceva arceva —
Erlotinib Ertotmib <…>
T ® 1 50 mg T @ 150 mg T ®
arceva arceva arceva
E_rtotimb Ẹr_lotinib Erlotinib
®
Tarceva 1'Ả11 i.…i'tii % DiỄ11
› "ưh'J …"
Erlotinib Tf_.1 Thi… Pn0
2
E
?
w
_ … »— ỉ1'ẦNỘỈ …
l. MOTA Ồx.J @
*
1.1 Nhỏm điều trị | dược lý
Thuốc khảng ung thư
1.2 Dạng trình bảy
Tarceva viên nén bao phim lSOmg
. A I - ! ` .', Ả \ ` - - Ă . i A .. - . . …
V1en nen bao phim co mau trang cho đen vang nhạt, tron, hat mạt 101, mau nhuọm chư … tren v1en
thuốc tuỳ theo hảm lượng viên thuốc.
Hoặc viên nén bao phim có mảu trắng cho đến vảng nhạt, tròn, hai mặt lồi, với hinh khẳc “T150’
khẳc trên viên thuốc.
1.3 Đường dùng
Uống
1.4 Thông tin về chất vô trùng | có hoạt tính phỏng xạ
Không phù hợp
1.5 Thănh phần định tính và định lượng
Hoạt ohất chính: erlotinib hydrochloride
'»
Một viên nén bao phim có chứa erlotinib hyđrochlorid, tương ứng với lSOmg erlotinib.
"… "
Thãnh phần tá dược
Lõi thuốc Ộ/ 3'1 '-.'
Lactose monohydrat phù hợp dược điền châu Âu | Mỹ / Nhật
Cellulose vi tinh thể phù hợp dược điển châu Âu | Mỹ / Nhật
Natri starch glycolat phù hợp dược diền châu Ảu / Mỹ / Nhật
Natri laurilsulfat phù hợp dược điền châu Âu | Mỹ / Nhật
Magiê stearat phù hợp dược điền châu Âu / Mỹ / Nhật
Bao thuốc
Hydroxypropyl cellulose phù hợp dược điếu châu Âu / Mỹ / Nhật
Titan dioxid phù hợp dược điển châu Âu / Mỹ | Nhật
Marcogol 400 phù hợp dược điền châu Âu | Mỹ / Nhật
Hydroxypropyl methylcellulose phù hợp dược điển châu Ẩu / Mỹ / Nhật
2. CÁC ĐẶC TỈNH LÂM SÀNG
2.1 Chỉ định điều trị
Ung thư phổi không phải tế bảo nhỏ:
Tarceva dược chỉ định để điều trị duy trì ớ bệnh nhân ung thư phổi không phải tế bảo nhớ (NSCLC)
tiến triền tại chỗ hoặc di căn đã không đảp ứng với hóa trị liệu bưởc một.
Tarceva được chỉ định để điều trị những bệnh nhân ung thư phối không phải tế bảo nhớ tiến triến
tại chỗ hoặc di căn sau khi thất bại với ít nhất một chế độ hoá trị liệu trước đó.
Ung thư tụy:
Tarceva phối hợp với gemcitabin được chỉ định để điều trị bước một cho những bệnh nhân ung thư
tụy tiến triển tại chỗ, không cắt bỏ được hoặc di căn.
2.2 Liều lượng và cách đùng
Liều chuẩn ạ/
Ung thư phối không phải tế bảo nhò:
Liều dùng hảng ngảy được khuyến cáo cùa Taroeva lả 150mg dùng ít nhất một giờ trước hoặc hai
giờ sau khi ăn.
Ung thư tụy:
Liều hảng ngảy được khuyến cảơ cùa Tarceva lả lOOmg dùng ít nhất một giờ trước hoặc hai giờ sau
khi ăn, phối hợp với gemcitabin (xem hướng dẫn sử dụng cùa gemcitabin cho chỉ định ung thư tụy).
2.2.1 Các hưởng dẫn liều dùng đặc biệt
Có thể cần phải điều chinh liều khi dùng cùng với cảc cơ chất và chất điều hòa đối với hệ CYP3A4
(xem phần 2.4.3 Tương tảo với các thuốc khảo và cảc hình thức tương tác thuốc).
Khi cần phải điều chinh liếu, nên giảm so mg mỗi lần (xem phẩn 2.4 Cảnh bảo và thận trọng vả'
2.4.3 Tương tảo với các thuốc khác và các hình thức tương tảc thuốc).
Suỵ gan: Erlotinib được đảo thải bời chuyến hoá ở gan vả sự bải tiết mật. Mặc dù nồng độ erlotinib
giống nhau ở những bệnh nhân bị suy chửc năng gan mức trung bình (điểm Child-Pugh 7-9) so với
những bệnh nhân có chức năng gan binh thường, nên thận trọng khi dùng Tarceva cho những bệnh
nhân bị suy gan. Nên cân nhắc giảm liếu hoặc ngưng Tarceva nếu phản úng ngoại ý nặng xảy ra.
Tính an toản vả hiệu quả cùa Tarceva chưa được nghiên cứu ở những bệnh nhân suy gan nặng (xem
phần 2.4.1 Cảnh báo vả thận trọng [viêm gian, suy gan] và 3.2.5 Dược động học ở những nhóm
bệnh nhân đặc bỉệt).
Suv thân: Tính an toản và hiệu quả của Tarceva chưa được nghiên cứu ở những bệnh nhân suy thận
(xem phần 3.2.5 Dược động học ở những nhóm bệnh nhân đặc biệt).
Dùng cho trẻ em: Tính an toản vả híệu quả cùa Tarceva chưa được nghiên cứu ở những bệnh nhân
dưới 18 tuổi.
Người hủt thuốc lả: Hút thuốc lá có thề lảm 50-60% giảm phân bố thuốc eriotinib. Liều Tarceva tối
đa được dung nạp ở bệnh nhân ung thư phối không phải tế bảo nhỏ còn hút thuốc là 300 mg. Hiệu
. s ! t … \ ~ , - - À ~ Ă 1 ~ À !. , , -
qua va tinh an toan lau dat VO'I heu cao hơn lieu khơi đau được khuyen cao vẫn chưa được xac định
2
đối với những bệnh nhân tiếp tục hút thuốc (xem phần 2.4.3 Tương tác với cảc thuốc khác và các
hinh thức tương tảo thuốc và 3.2.5 Dược động học ở những nhóm bệnh nhân đặc biệt).
2.3 Chống chỉ định
Tarceva được chống chỉ định ở những bệnh nhân quả mẫn trầm trọng với eriotinib hoặc với bất kỳ
thảnh phần nảo cùa Tarceva.
2.4 Cảnh bảo và thận trọng đặc bỉệt khi sử dụng
2.4.1 Thận trọng chung ậ/
Bệnh phổi kẽ: Cảo trường hợp gìống bệnh phổi kẽ (ILD), bao gồm những trường hợp tử vong, đôi
khi được báo cảo ở những bệnh nhân dùng Tarceva để điều trị ung thư phối không phải tế bảo nhỏ
(NSCLC), ung thư tụy hoặc các khối 11 đặc tiển triển khác. Trong một nghiên cứu then chốt BR 21
ở NSCLC, tỉ lệ biến cố giống ILD nặng lả 0,8% trong nhóm dùng giả dược lẫn nhóm dùng Tarccva.
Trong nghiên cứu ung thư tụy phối hợp với gemcitabin, tỉ lệ biến cố giống ILD là 2,5% trong nhóm
Tarceva phối hợp với gemcitabin so với 0,4% ở nhóm dùng giả dược phối hợp với gemcitabin. Tỉ
1ệ chung ở những bệnh nhân được điếu trị bằng Taroeva từ tất cả cảc nghiên cứu (bao gồm các
nghiên cứu không đối chứng và các nghiên cứu dùng hoá trị lỉệu đồng thời) là khoảng 0,6%. Chấn
đoản được ghi nhận ở những bệnh nhân bị nghi ngờ có bệnh giống ILD bao gổm viêm phối, viêm
phối do xạ trị, viêm phổi quả mẫn, viêm phối kẽ, bệnh phổi kẽ, viêm phế quản tắc nghẽn, xơ hoả
phối, hội chứng suy hô hấp cấp, thâm nhiễm phổi, và viêm phế nang. Các biến cố giống ILD nảy
bắt đầu từ một vải ngảy đến một vải thảng sau khi bắt đầu điểu trị Tarceva. Phần lớn cảc trường
hợp đi kèm với các yếu tố gây nhiễu hoặc cảc yếu tố góp phần như là hoả trị liệu đồng thời hoặc
trước đó, xạ trị trước đó, bệnh nhu mô phổi có từ trước, bệnh phổi di căn, hoặc nhiễm trùng phồi.
Ở những bệnh nhân có xuất hiện cảc triệu chứng mới cấp tính vả] hoặc những triệu chứng về phổi
không giải thích được đang tiến triến, như là khó thớ, ho và sốt, nên ngừng điếu trị bằng Tarceva
trong khi chờ đảnh giá về chẩn đoản. Nếu được chẩn đoản lả ILD, nên ngừng dùng Tarceva vả điếu
trị thích hợp tùy tình hình (xom phần 2.6 Các tác dụng không mong muốn).
Tiêu chảy, mất nước, rối Ioạn điện giải vả suy thặn: Tiêu chảy đã xảy ra ở những bệnh nhân dùng
Tarceva và tiêu chảy trung binh và nặng nên được điếu trị bằng loperamide. Trong một vải trường
hợp, nên giảm liểu. Trong trường hợp tiêu chảy nặng hoặc dai dẳng, buồn nôn, chém ăn hoặc nôn
gây mất nước, nên ngứng dùng Tarceva và có các biện phảp thích hợp để điều trị mất nước (xem
phần 2.6 Cảo tảo dụng không mong muốn). Đã có một số trường hợp hiếm gặp bị giảm kali máu và
suy thận (có cả tử vong). Một vải ca suy thận là do mất nước nặng vì tiêu chảy, nôn vả/hoặc chán
ãn trong khi những ca khảo thông tin bị nhiễu bời hóa trị đồng thời. Trong những trường hợp tiêu
chảy nặng hoặc kéo dải, bệnh nhân bị mất nước, đặc biệt ớ những nhóm bệnh nhân có yếu tố nguy
cơ 1ảm nặng bệnh (dùng thuốc khảo đồng thời, triệu chứng hoặc bệnh hoặc cảc tình trạng thúc đẳy
bao gồm tuối cao), nên tạm ngưng Tarceva vả ảp dụng cảc biện pháp thích hợp để bù nước tích cực
cho bệnh nhân bằng đường tĩnh mạch. Ngoài ra, nên theo dõi chức năng thận và điện giải trong
huyết thanh bao gồm kali ở những bệnh nhân có nguy cơ mất nước.
Viêm gan, suy gan: Một số trường hợp hiếm gặp bị suy gan (có thế tử vong) đã được bảo cáo trong
khi dùng Tarceva. Các yếu tố gây nhiễu gồm bệnh gan có từ trước hoặc dùng thuốc độc cho gan
đồng thời. Vì vậy nên xét nghiệm chức năng gan định kỳ cho những bệnh nhân như vậy. Nên
3
ngưng Tarceva nếu có thay đổi nhiều về chức nãng gan (xem phần 2.6 Các tác dụng không mong
muốn).
Thủng đường tiêu hóa: Bệnh nhân sử dụng Tarceva bị tăng nguy cơ thủng đường tiêu hóa, tuy ít
khi được quan sảt thẳy. Bệnh nhân điều trị đồng thời với thuốc chống sinh mạch, corticosteroid,
NSAID, vả/ hoặc hóa trị nhóm taxane , hoặc những người có tiền sử viêm loét dạ dảy hoặc bệnh
nhân có túi thừa, là những bệnh nhân có nguy cơ cao. Tarceva nên dược ngưng hẳn ở những bệnh
nhân bị thủng đường tiêu hóa (xem phần Tảo dụng không mong muốn).
Bóng nước, tróc da và các rối loạn da : Bóng nước, phồng rộp và tình trạng tróc da đã được báo
cáo, trong đó có rắt ít trường hợp nghĩ tới hội chứng Stevens-Johnson/ hoại tử nhiễm độc biếu bi,
mả trong một số trường hợp dã tử vong (xem phần Tác dụng không mong muốn). Nên tạm ngừng
hoặc ngừng hẳn điểu trị với Tarceva nếu bệnh nhân bị nổi bóng nước nghiêm trọng, phồng rộp hoặc
xuất hiện tình trạng tróc da.
Rối Ioạn mắt: Rất hiếm trường hợp bị Ioét hoặc thùng giác mạc được bảo cảo trong quá trình sử
dụng của Tarceva. Rối loạn khảo bao gồm tăng trướng lông mi mắt bất thường, viêm kết mạc sừn g
hoả hoặc viêm giảc mạc đă được quan sảt với bệnh nhân điều trị bằng Tarceva đó cũng lả yếu tố
nguy cơ xuất hiện thủng/ loét giác mạc. Nên tạm ngừng hoặc ngừng hẳn điều trị bằng Tarceva nếu °-
bệnh nhân có biếu hiện rối loạn ở mắt cấp/ nặng hơn như đau mắt (xem phần Tác dụng không .,
mong muốn ). '
Tương tác thuốc: Tarceva có tiễm năng tương tác thuốc có ý nghĩa về mặt lâm sảng (xem phần
2.4.3 Tương tảo với các thuốc khác và cảc hinh thức tương tảo thuốc)
2.4.2 Khả năng lải xe và vận hânh mảy móc Cl
Không có nghiên cứu về tác động lên khả năng lái xe và vận hảnh máy móc được tiến hảnh, tuy
nhiên, erlotinib không gây giảm khả năng trí tuệ.
2.4.3 Tương tảo với các thuốc khác và cảc hình thức tương tác thuốc
Erlotinib được chuyền hoá ở gan bới hệ cytochromc gan ở người, chủ yếu bời CYP3A4 vả ít hơn
bới CYPIA2, vả CYPIAI đồng dạng ở phối. Khả năng tương tác có thể xảy ra với những thuốc
được chuyển hoá bới, hoặc lả những thuốc ức chế hoặc kích thích những enzyme nảy.
Các chắt ức chế mạnh hoạt tính CYP3A4 lảm giảm sự chuyến hoả cùa erlotinib vả lảm tăng nồng
độ huyết tương của erlotinib. Ketoconazole ức chế sự chuyển hoá CYP3A4 (200mg uống hai lần *
mỗi ngảy trong 5 ngảy) lảm tăng nồng độ erlotinib (nồng độ phân bố trung vị erlotinib [AUC] tảng
86%) và Cmax tăng 69% khi so sảnh với việc dùng erlotinib đơn thuần. Khi dùng Tarceva cùng lúc
với ciprofloxacin, thuốc ức chế cả hệ CYP3A4 lẫn CYPIAI, mức độ phân bố crlotinib [AUC] và
nồng độ tối đa (Cmax) tăng lấn lượt lả 39% và 17%. Vì vậy nên thận trọng khi dùng Tarceva với
những thuốc ức chế mạnh CYP3A4 hoặc ức chế phối hợp CYP3A4/CYPIAI. Trong những trường
hợp nảy, nên giảm liều Tarceva khi ghi nhận có độc tính.
Các thuốc kích thích mạnh hoạt tính CYP3A4 lảm tăng chuyến hoá erlotinib vả lảm giảm nổng độ
huyết tương erlotiníb một cách đáng kề. Rifampicin kích thích sự chuyến hoả CYP3A4 (600mg
uống mỗi ngảy trong 7 ngảy) lảm AUC trung vị của erlotinib giảm 69%, sau khi dùng Tarceva liếu
150mg, so sánh với khi dùng Tarceva đơn thuần.
Điều trị trước đó hoặc dùng đồng thời rifampicin với liều duy nhất 450mg Tarceva lảm AUC với
erlotinib giảm còn 57.5% so vởi giá trị khi dùng liều đơn 150mg Tarceva mã không dùng kèm
rifampicin. Nếu có thể nên cân nhắc chế độ điều trị thay thế không dùng các thuốc kích thích mạnh
CYP3A4. Đối với những bệnh nhân cần điều trị đồng thời Tarceva với một thuốc kích thích mạnh
CYP3A4 như rifampicin, nên cân nhắc tăng liếu lên 300mg trong khi theo dõi sảt tính an toản (xem
phẩn 2.4.1 Thận trọng chung), và nếu dung nạp tốt trong hơn 2 tuần thì có thể tăng đến 450mg
đồng thời theo dõi chặt chẽ về an toản. Chưa có nghiên cứu dùng liều cao hơn trong trường hợp
nảy.
Điều trị tnrớc đó hoặc dùng đồng thời với Tarceva không lảm thay đổi thanh thải cùa cảc cơ chẳt
tiêu biếu của CYP3A4 lả midazolam vả erythromycin. Vì vậy ít có khả nãng tương tảo thuốc quan
trọng xảy ra với cảc cơ chất khảo cùa CYP3A4. Độ khả dụng sau khi uống midazolam có vẻ bị
giảm tới 24%, tuy nhiến không phải là do tác dụng trên hoạt tinh CYP3A4.
Độ hòa tan của erlotinib là phụ thuộc vảo độ pH. Hòa tan cùa eriotinib giảm khi pH tăng. Cảo loại
thuốc lảm thay đồi độ pH cùa đường tiêu hoá trên có thể thay đổi độ hòa tan cùa erlotinib và do đó
ảnh hưởng tới khả dụng sinh học cùa nó. Sử dụng đồng thời Tarceva với omeprazole, một chất ức
chế bơm proton, giảm nồng độ erlotinib (AUC) và nồng độ tối đa lần lượt là 46% và 61%. Không
có thay đối về 'I`max hoặc thời gian bản thải. Dùng đồng thời Tarceva với 300 mg ranitidìne, một
chất dối kháng thụ thể 112, giảm nồng độ erlotinib [AUC] và nồng độ tối đa lần lượt là 33% và
54%. Vì vậy, cần trảnh dùng kèm cảc thuốc giảm acid dạ dảy với Tarceva nếu có thề. Tăng lỉều
Tarceva khi sử dụng đồng thời với các thuốc như vậy khó có thể bù trừ được cho sự giảm nổng độ.
Tuy nhiên, khi Tarceva được dùng một cảch so le 2 giờ trước hoặc 10 giờ sau khi sử dụng lSOmg
ranitidine, nồng độ erlotinib [AUC] vả Cmax chỉ giảm đi lần lượt là 15% và 17%. Nếu bệnh nhân
cần được điều trị với oảo thuốc như vậy, thì một chất đối khảng thụ thể H2 như ranitidine cần được
xem xét và sử dụng một cách so le. Bệnh nhân phải uống Tarceva ít nhất 2 giờ trước hoặc 10 giờ
sau khi dùng thuốc đối khảng thụ thể 112.
Tăng Tỉ số chuẩn hoá quốc tế (INR) và các trường hợp chảy mảu bao gồm chảy mảu đạ dảy (xem
phần 2.6 Cảo tảo dụng không mong muốn) đã được ghi nhận trong cảc nghiên cứu lâm sảng, một
vải trường hợp dùng cùng với warfarin. Bệnh nhân dùng warfarin hoặc cảc thuốc chống đông dẫn
xuất của coumarin nên được theo dõi một cách thường xuyên để phảt hiện bất kỳ sự thay đổi nảo về
thời gian prothrombin hoặc INR.
Những người hút thuốc lá nên được khuyên ngưng hút vi khói thuốc lá, vốn kích thỉch cvp1 A1 và
CYPIA2, được nghiên cứu cho thấy lảm giảm nồng độ phân bố erlotinib khoảng 50—60%. (Xem
các phần 2.2.1 Cảo hướng dẫn liều dùng đặc biệt, 3.2.5 Dược dộng học ở những nhóm bệnh nhân
đặc biệt).
Trong một nghiên cứu pha Ib, không có tảo dụng đảng kể của gemcitabin đối với dược động học
cùa erlotinib cũng như không có tảo dụng đảng kế của erlotinib lên dược động học của gemcitabin.
25 Sử dụng ở những nhóm bệnh nhân đặc biệt
2.5.1 Phụ nữ có thai
Không có nghiên cứu thích hợp hoặc có dối chứng tốt ở những phụ nữ có thai đang dùng Tarceva.
Cảo nghiên cứu ở động vật đã oho thấy một vải độc tính sinh sản (xem phần 3.3.3 Giảm khả nảng
5
sinh sản và 3.3.4 Tính sinh quải thai). Nguy Cơ tiềm ẩn cho người chưa được biết. Những phụ nữ có
khả năng mang thai phải được khuyên trảnh có thai khi dùng Tarceva. Nên dùng cảc biện pháp
trảnh thai thích hợp trong quả trinh điều trị, và it nhẩt 2 tuần sau khi kết thức điều trị. Vìệc điếu trị
chỉ nên tiếp tục ở những phụ nữ có thai nếu lợi ich mang lại cho mẹ cao hơn hắn nguy cơ cho thai.
2.5.2 Phụ nữ cho con bú
Người ta không biết liệu crlotinib được tiết qua sữa mẹ hay không. Do khả nảng gây hại cho nhũ
nhỉ, người mẹ không nên cho con bú trong khi dùng Tarceva.
2.5.3 Suy gan
Nồng độ erlotinib trong mảu giống nhau ở những bệnh nhân bị suy giảm chức nảng gan trung binh
(điềm Child-Pugh 7-9) so với những bệnh nhân có chức năng gan binh thường trong đó có những
bệnh nhân bị ung thư gan nguyên phảt hoặc di căn gan (xem phần 2.4.1 Cảnh bảo vả thận trọng).
Chưa có nghiên cứu về tính an toản vả hiệu quả ở những bệnh nhân bị suy gan nặng.
2.6 Các tác dụng không mong muốn
Thông bảo cho cảc bác sỹ những tác dụng không mong muốn gập phải khi sử dụng thuốc
2.6.1 Các thử nghiệm lâm sảng
Đảnh giá tính an toản cùa Tarceva dựa trến các dữ liệu từ hơn 1200 bệnh nhán đỉều trị với ít nhắt
một liếu 150mg Tarceva đơn trị liệu, và hơn 300 bệnh nhân được điếu trị Tarceva 100 mg hoặc
150mg kết hợp với gemcitabin.
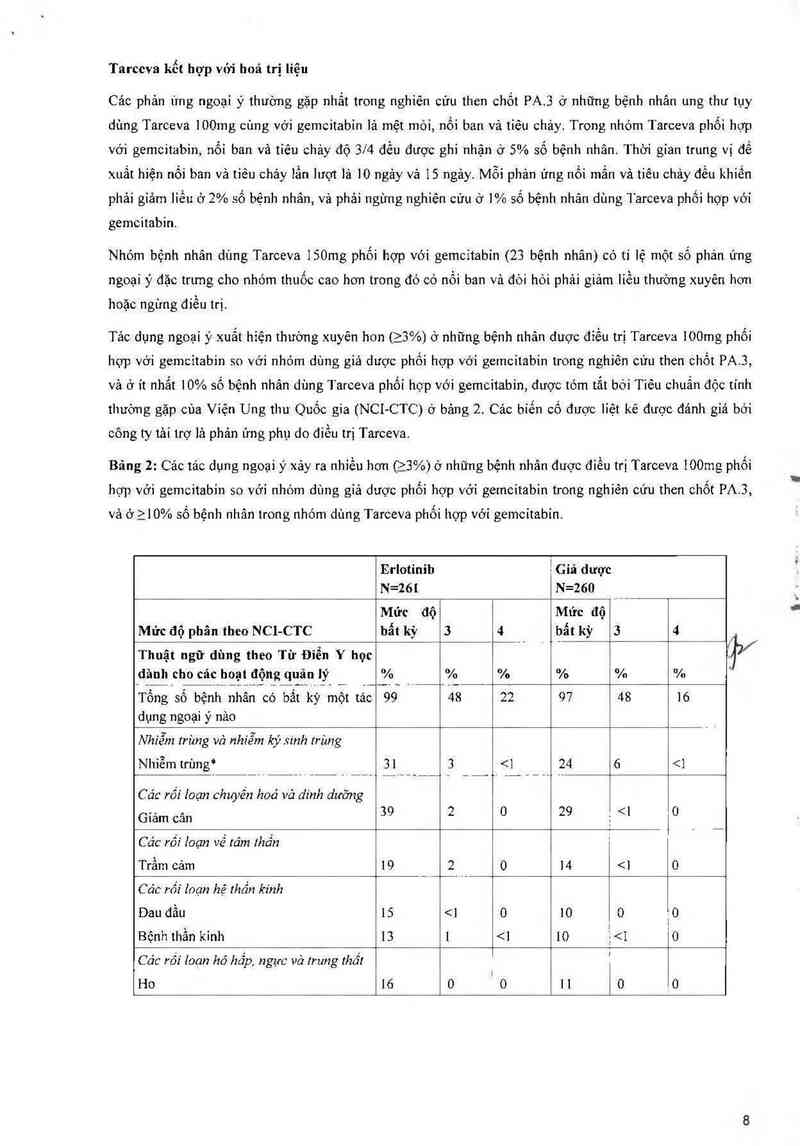
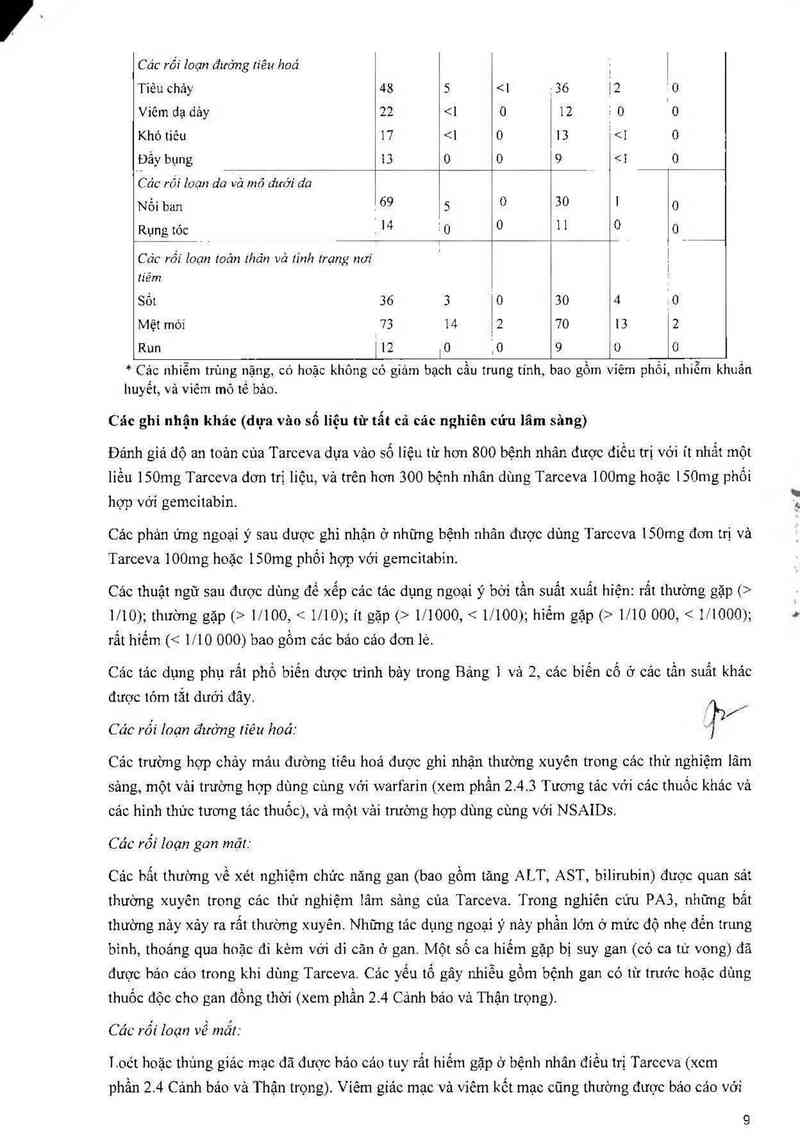
Tỷ lệ tảo dụng không mong muốn cùa thuốc (ADRs) với Tarceva đơn trị liệu hoặc kết hợp vởi hớa
trị liệu được tóm tắt trong bảng dưới đây và được dụa trên dữ liệu từ cảc thừ nghiệm lâm sảng. Các
ADRs được 1iệt kê lả những ADRs gặp trong ít nhắt 10% số bệnh nhân (trong nhóm Tarceva) vả
xảy ra thường xuyên hớn (2 3%) ớ bệnh nhân điều trị bằng Tarceva so với nhớm điều trị kết hợp.
Tarceva đơn trị liệu (
Trong một nghiên cứu mù dôi ngẫu nhiên (BR.21) được tiến hảnh ở 17 nước, 731 bệnh nhân bị
NSCLC tiển triến tại chỗ hoặc di căn sau khi thất bại it nhất một phảc đồ hoả trị trước đó được
chọn ngẫu nhiên 2:1 dược diều trị bằng Tarceva lSOmg hoặc giả dược, Thuốc nghiên cứu được
uống hảng ngảy cho dến khi bệnh tiến triến hoặc không thể chịu nồi độc tinh.
Nổi ban (75%) và tiêu chảy (54%) là những tảo dụng ngoại ý thường gặp nhất không kể nguyên
nhân. Phần lớn ở mức độ 1 hoặc 2 và có thể kiếm soát được mả không cẳn can thiệp. Nồi ban vả
tiêu chảy mức độ 3f4 xây ra lần lượt trong 9% vả 6% những bệnh nhân được điều trị bằng Tarceva
vả mỗi tảo dụng phụ lảm ngừng nghiên củu ở 1% số bệnh nhân. Cần phải giảm liều vì nối ban vả
tiêu chảy, lần lượt trong 6% và 1% số bệnh nhân. (3 nghiên cứu BR.21, trung vị thời gian lảm xuất
hiện nồi ban là 8 ngảy, và trung vị thời gian lảm xuất hiện tiêu chảy là 12 ttgảy.
Các phản ửng ngoại ỷ xảy ra thường xuyên hơn (2 3%) ở những bệnh nhân được điều trị bẳng
Tarceva hơn ở nhóm dùng giả dược trong nghiên cứu thon chốt BR.21, vả ở it nhất 10% số bệnh
nhân ở nhóm dùng Tarceva, được tóm tắt theo mức độ NCI-CTC ớ Bảng ].
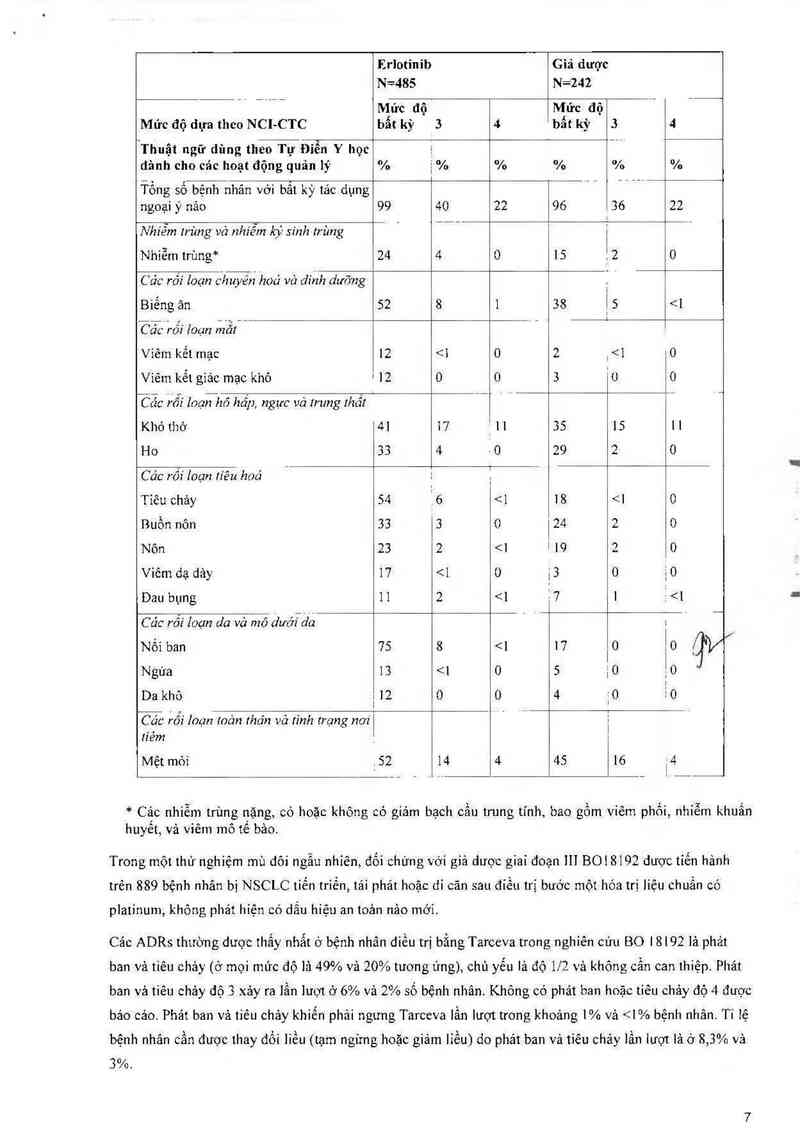
Bảng 1: Cảo phản ứng ngoại ỷ xảy ra nhiều hơn (2 3%) ở nhóm dùng Tarceva so với nhóm dùng
giả dược vả ở ặlO% số bệnh nhân trong nhóm dùng Tarceva trong nghiên cứu BR.21
Erlotinib Giả dược
=485 N=242
_ ’ _ “ Mức độ Mức độ ’
Mức độ dựa theo NCl-CTC bất kỳ 3 4 bất kỳ 3 4
Thuật ngữ dũng theo Tự Điển Y học 1 _
dảnh cho các hoạt động quản lý % 1% % % % %
Ĩ`ồng số bệnh nhãn với bất kỳ tác dụng ` ` ’ “`
ngoại ý nảo 99 40 22 96 _ 36 22
Nhíễm trùng và nhiễm ký sinh trùng ` __ _ 1
Nhiễm trùng* 24 4 0 15 Ẹ 2 0
W'hỉyỗi hoá vả đinh dưỡng
Biếng ăn 52 8 1 38 1 5 <1
ỈìcỈcế’rổi ỉoạn rn`ẳt’ " ’ ’ i
Viêm kết mạc 12 <1 0 2 ,<1 0
Vìê1n kết giác mạc khô 12 o 0 3 ` 0 0
Ĩẵc rỗi Ioạn_hó hẩp, ngực vả Irung Ihầt _ ' D _
Khó thớ 41 17 . 11 35 15 11
Ho 33 4 Ả 0 29 2 0
M hoá _
Tiêu chảy 54 i 6 <1 18 <1 0
Buồn nôn 33 '3 0 24 2 0
Nôn 23 2 <1 ! 19 2 0
viêm đạ dảy 17 <1 () j3 0 10
Dau bụng 11 2 <1 Ễ7 1 Ễ <1
Wỉỗ dnớĩđđ ’ | ' “|
Nối ban 75 8 <1 17 0 0 q*V
Ngứa 13
1/10); thường gặp (> 1/100, < 1/10); ít gặp (> 1/1000, < 11'100); hiếm gặp (> 1/10 000, < 1/1000);
tất hiếm (< 1710 000) bao gồm cảc báo cảo đớn 16.
Các tác dụng phụ rắt phổ biến dược trình bảy trong Bảng ] vả 2, oảo biến cổ ở oảo tần suất khảo
.ữfỵx’
Ắ1
Cảo trường hợp chảy máu đường tiêu hoá được ghi nhận thường xuyên trong các thử nghỉệm lâm
được tóm tắt dưới đây.
Các rót“ loạn đường lfêu hoá:
sảng, một vải trường hỌp dùng cùng với warfarin (xem phần 2.4.3 Tương tác với cảc thuốc khảo và
cảc hỉnh thức tương tác thuốc), vả một vải trường họp dùng cùng với NSAIDS.
Các rổí Ioạn gan mặt:
Các bất thường về xét nghiệm chức năng gan (bao gồm tăng ALT, AST, bilirubin) được quan sải
thường xuyên trong cảc thử nghiệm iâm sảng của Tarceva. T rong nghiên cửu PA3, những bắt
thường nảy xảy ra rất thường xuyên. Những tảo dụng ngoại ý nảy phần lớn ở mức độ nhẹ đến trung
bình, thoảng qua hnặc đi kèm với di căn ở gan. Một số ca hiếm gặp bị suy gan (có ca tử vong) đã
được bảo cảo trong khi dùng Tarceva. Cảo yếu tố gây nhiễu gồm bệnh gan có từ trước hoặc dùng
thuốc độc cho gan đồng thời (xem phần 2.4 Cảnh bảo vả Thận trọng).
Các rối“ loạn về mắt:
1.oẻt hoặc thùng giảc mạc đã được bảo cảơ tuy rất hiếm gặp ở bệnh nhân đíểu trị Tarceva (xom
phần 2.4 Cảnh báo vả Thận trọng). Viêm giảc mạc và viêm kết mạc cũng thường được báo cáo với
9
Tarceva.
Mọc lông mi bất thường bao gồm: lông mi mọc vảo trong, lông mi mọc nhiến vả rậm đă được bảo
cảo (xem phần 2.4 Cảnh bảo và Thận trọng).
Các rối loạn về hô hấp, lồng ngực và trung thất:
Có những bảo cảo không thường xuyên về biến cố nặng giống viêm phổi kẽ, (đã có ca từ vong), ở
những bệnh nhân dùng Tarveva để điều trị NSCLC hoặc những khối u đặc tiến triến khác (xem
phần 2.4 Cảnh bảo và Thận trọng).
Các trường hợp bị chảy mảu cam cũng thường được bảo cảo trong cảc thử nghiệm lâm sảng
NSCLC lẫn ung thư tụy.
Các rói loạn da vả mô dưới da:
Phảt ban được bảo cảo rẩt phổ biến ở bệnh nhân dùng Tarceva và nói chung, biểu hiện dưới dạng
hồng ban và sấn mù mức độ nhẹ hoặc vừa, có thể xảy ra hay nặng lên ở những vùng da tiếp xúc ánh
sảng mặt trời. Có thế khuyên những bệnh nhân có tiếp xúc ảnh nắng nên sử dụng quần ảo bảo vệ vả
/ hoặc dùng kem chống nắng (ví dụ Ioại chứa khoáng chất). Mụn trứng oả, viêm da dạng tn'mg cá
và viêm nang lông xuất hiện khả thường xuyên, hầu hết những sự kiện nảy là nhẹ hoặc vừa phải và
không nghiêm trọng. Các phản ứng nhẹ như da tăng sắc tố cũng đã được bảo cảo tuy ít gặp (trong
số dưới 1% bệnh nhân).
Bóng nước, phồng rộp và tình trạng tróc da đã được bảo cảo, bao gồm một số rất it trường hợp gợi
ý chấn đoản hội chứng Stevens-Johnson x hoại từ biểu bi nhiễm độc, trong đó có vải trường hợp đã
tử vong (xem phần Tác dụng không mong muốn 2.6).
Thay đối tóc và móng , hầu hết không nghiêm trọng, đã được báo cảơ trong cảo thử nghiệm lâm
sảng, ví dụ như viêm quanh móng vả rậm lông, thay đổi lông mi / lông mảy vả móng tay dễ gãy
hoặc dễ tróc đã được bảo oảo tuy ít gặp.
2.6.2 Sau khi thuốc được tu… hânh W
Các rối Ioạn da và mô dưới da: ~
Các thay đổi khảo về tóc và móng, đa phấn không nghiêm trọng, đã được ghi nhận xảy ra không
thường xuyên từ giảm sảt sau khi thuốc được lưu hảnh trên thị trường, vd: rậm lông, thay đổi lông
mi/lông mảy, viêm quanh móng, móng dòn dễ bong.
2.7 Quá liều
Liều đơn Tarveva lên tới 1000mg ở những đối tượng khoẻ mạnh và lên tới 1600mg ở những bệnh
nhân ung thư đã được dung nạp. Liều nhắc lại hai lần một ngảy 200mg ở những đối tượng khoẻ
mạnh bị dung nạp kém chỉ sau một vải ngảy dùng. Dựa vảo cảc số liệu từ những nghiến cứu nảy,
cảc tảo dụng ngoại ý nặng như tiêu chảy, nối ban, và tăng men transaminase gan có thể xảy ra ở
liếu trên liều khuyến cáo. Trong trường hợp nghi ngờ có quá liều Tarveva, nên ngừng dùng và điều
trị ưiệu chứng.
10
3 HIỆU QUẢ VÀ CÁC ĐẶC TÍNH DƯỢC HỌC
3.1 Các đặc tính dược lực học
3.1.1 Cơ chế tác dụng
Erlotinib ức chế mạnh sự phosphoryl hoá nội tế bảo của HERl/EGFR. HERl/EGFR được bộc lộ
trên bề mặt cùa những tế bảo bình thường và những tế bảo ung thư. Trong những mô hinh phi lâm
sảng, sự ức ohế EGFR phosphotyrosine gây kìm hãm vả/hoặc gây chết tế bảo.
3.1.2 Hiệu quả] Các nghiên cứu lâm sảng
Ung thư phổi không phải tế bâo nhỏ (T arceva được dùng đơn chất):
Điều trị duy !rì bước một
Hiệu quả và an toản cùa TARCEVA dùng điều trị duy trì NSCLC đã được chửng minh trong một
thử nghiệm ngẫu nhiên mù đôi có so sảnh với giả dược (8018192). Nghiên cứu nảy được tiến hảnh
ở 889 bệnh nhân với NSCLC tíến trỉến tại chỗ hoặc di căn, những bệnh nhân nảy không bị tiến triến
trong khi điều trị 4 chu kỳ hóa trị 2 thuốc có platinum. Bệnh nhân được chọn ngẫu nhiên 1:1 uống
Tarceva 150 mg hoặc giả dược mỗi ngảy một lần. Mục tiêu chính của nghiên cứu lả sống thêm
bệnh không tiến triển (PFS) trong tất cả cảo bệnh nhân và những bệnh nhân có bướu dương tính với
xét nghiệm hoả mô miễn dịch EGFR. Cảo đặc điểm dân số và bệnh lý ban đầu được cân bằng giữa
hai nhảnh diều trị.
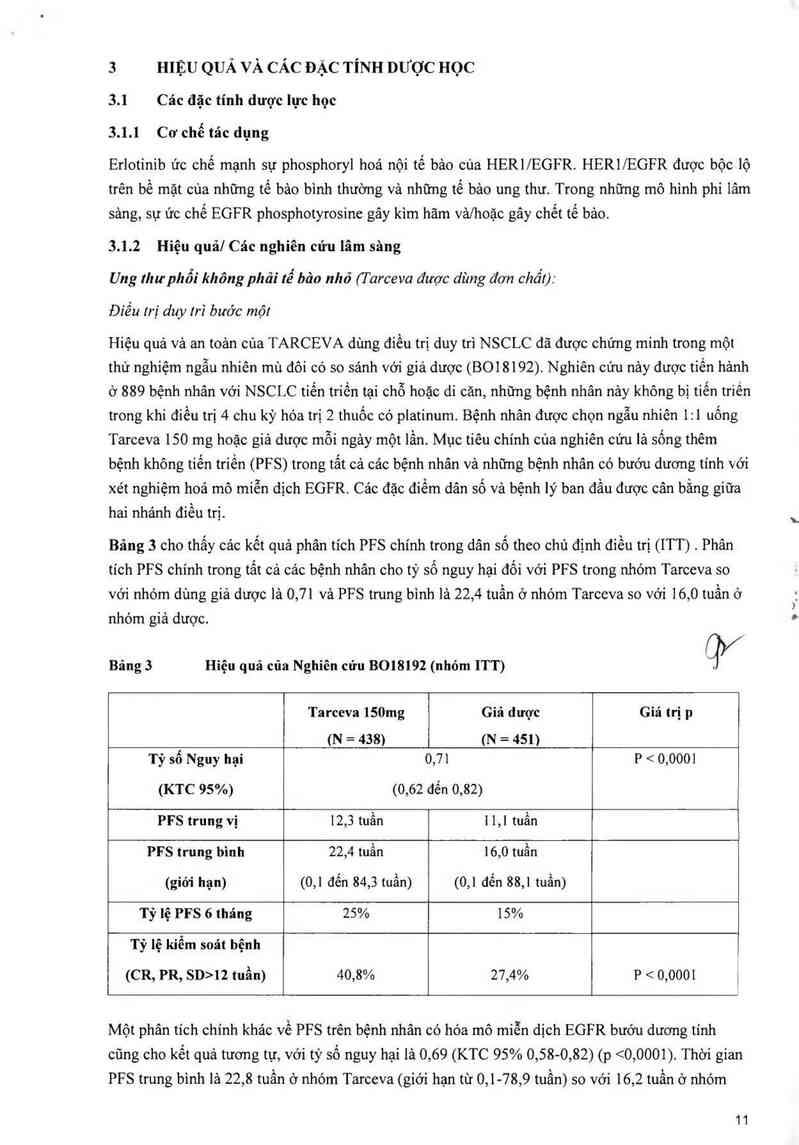
Bảng 3 cho thắy cảc kết quả phân tích PFS chính trong dân số theo chủ định điều trị (ITT) . Phân
tích PFS chính trong tất cả cảc bệnh nhân cho tỷ số ngưy hại đối với PFS trong nhóm Tarceva so
với nhóm dùng giả dược lả 0,71 và PFS trung binh là 22,4 tuần ở nhóm Tarceva so với 16,0 tuần ở
nhóm giả dược.
Bảng 3 Hiệu quả oủa Nghiên cứu B018192 (nhóm ITT) q›/
Tarceva 150mg Giả dược Giá trị p
(N = 438) (N = 4511
Tỷ số Nguy hại 0,71 P < 0,0001
(KTC 95%) (0,62 đến 0,82)
PFS trung vị 12,3 tuần 1 1,1 tuần
PFS trung bình 22,4 tuần 16,0 tuần
(giới hạn) (0,1 đến 84,3 tuần) (0,1 đến 88,1 tuần)
Tỷ lệ PFS 6 tháng 25% 15%
Tỷ lệ kiểm soát bệnh
(CR, PR, sn›1z tuần) 40,8% 27,4% P < 0,0001 1
Một phân tích chính khảo về PFS trên bệnh nhân có hóa mô miễn dịch EGF R bướu dương tính
cũng cho kết quả tương tự, với tỷ số nguy hại là 0,69 (KTC 95% 0,58—0,82) (p <0,0001). Thời gian
PFS trung bình là 22,8 tuần ở nhóm Tarceva (giới hạn từ 0,1-78,9 tuần) so với 16,2 tuần ở nhóm
11
v._
giả dược (từ 0,1 -88,1 tuần). Tỷ lệ bệnh nhân không bị tiến tríển tại thời điếm 6 thảng 1ần tượt lả
27% và 16%.
Hiệu quả được thế hiện nhất quản trên các phản nhóm dựa trên các yếu tố phân tẩng và lâm sảng.
Lợi ích cũng dã dược quan sát thẳy trôn cảc phân nhớm có đặc tinh sinh học không bị ảnh hướng
bởi IHC EGFR , FISH EGFR, EGFR đột biến hoặc tinh trạng đột biến K-ras. Nếu như tinh trạng
dột biến EGFR có thể xác định nhóm bệnh nhân được lợi ích nhiều nhất (HR = 0,09), những đột
biến nảy khộng phải lả một điều kiện tiên quyết để điếu trị có hiệu quả, do lợi ich cũng được ghi
nhận ở bệnh nhân có EGFR loại tự nhiên (HR = 0,81). Phân tích chất lượng cuộc sống không ghi
nhặn tác dụng bất lợi khi dùng erlotinib so với giả dược.
Điểu Irị bước 2/bước 3:
Tính hiệu quả vả an toản cùa Tarceva dược chứng minh trong cảc thử nghiệm có đối chứng với giả
dược, mù đội, ngẫu nhiên (BR.21). Nghiên cứu nảy được tiến hảnh ớ 17 nước, 6 731 bệnh nhân hị
NSCLC di căn hoặc tiến triền tại chỗ sau khi thẳt bại it nhất một chế độ điếu trị bằng hoá trị liệu.
Bệnh nhân được chọn ngẫu nhiên theo tỷ lệ 2:1 dùng Tarceva 150mg hoặc uống giả dược ngảy một
lằn. Số liệu nghiên cứu bao gổm sống thêm toản bộ, thời gian đến khi cảc triệu chứng có liên quan
dến nng thư phổi xắu đi (ho, khó thờ và đau), tỉ lệ đảp tmg, thời gian đảp ứng, sống thêm bệnh
không tiên triên, và độ an toản. Kêt cuộc chinh là sông thêm.
Do tỉ lệ chọn ngẫu nhiên lả 2:1, 488 bệnh nhân đuợc chợn ngẫu nhiên dùng Tarceva vả 243 bệnh
nhân dùng giả được. Các bệnh nhân không được chọn dụa trên tình trạng HER/EGFR, giới tính,
chùng tộc, tiến sử hút thuốc và phân loại mô học. CP/
Cảo đặc diểm dân số được cân bằng giữa hai nhóm điếu trị. Khoảng 2 phẩn 3 số bệnh nhân lả n
và khoảng một phần ba có điếm về tình trạng hoạt động cơ thể (PS) ban dầu theo ECOG lả 2 và 9
có ECOG ban đầu là 3 chiếm 93% vả 92% số bệnh nhân trong nhỏm Tarceva và nhóm giả dư' ,
theo thứ tự, đã được điếu trị có chứa platinum trước đó vả lẩn 1ượt 36% và 37% số bệnh nhản đ ợo
điều trị bằng taxane trước đó. 50% số bệnh nhân chi dược điều trị bằng một phác đồ hoả trị trước
đớ.
Tỉ lệ sống thếm được đảnh giả ở dân số theo chủ định điều trị. Sống thêm toản bộ trung vị đuợc cải
thiện 42,5% vả lả 6,7 thảng ở nhóm dùng Tarceva (KTC 95%, 5,5-7,8 tháng) so với 4,7 thảng ớ
nhóm dùng gỉả dược (KTC 95%, 4,1 đến 6,3 tháng). Phân tinh chính về sổng thêm được điều chỉnh
cho các yếu tố phân tầng như đã được bảo oáo tại thời điếm chọn ngẫu nhiên (PS theo ECOG, đáp
ứng tốt nhất với ohế độ đỉều trị trước đó, số phảc đồ điều trị trước đó, đã dùng platinum trước đó)
và tình trạng HERl/EGFR. Trong phân tích chinh nảy, tỉ số nguy hại hiệu ohính liên quan tử vong
trong nhóm dùng Tarceva so với nhớm dùng giả dược lả 0,73 (KTC 95%, 0,60 đến 0,87) (p=0,001 ).
Tỉ lệ bệnh nhân còn sống tại thời điềm 12 thảng lần lượt in 31,2% vả 21 ,5%.
Lợi ích về sống thêm khi dùng Tarceva được ghi nhặn ở hầu hết cảc phân nhóm bệnh nhân. Nhiếu
phân nhóm bệnh nhân xảo định bời các giá trị cùa các yếu tố phân tầng tại thời điếm chọn ngẫu
nhiên vả 1úc bắt đầu, tình trạng HERl/EGFR, dùng taxane trước đó, tiến sứ hút thuốc, giới tinh,
tuốì tảo, mô học, sụt cân trước đớ, thời gian giữa lần chẩn đoán đầu tiên vả chọn ngẫu nhiên, vả vị
trí địa lý được dảnh giá trong nhũng phân tích đơn bìến thăm dò đế đảnh giá mức độ tin cậy cùa kết
quả sống thêm toản bộ. Hầu hết giá trị tỉ số nguy hại (HR) ở nhóm điều trị bằng Tarceva so với
12
nhóm dùng giả dược dưới 1,0, gợi ý cho thấy lợi ich sống thêm từ Tarceva nhất quản ở cảc phân
nhóm. Dáng lưu ý là lợi ích sống thêm cùa Tarceva giống nhau ở những bệnh nhân có ECOG PS
lủc ban đầu lả 2-3 (HR = 0,77) hoặc PS là 0-1 (HR = 0,73) vả bệnh nhân đã được điểu trị một phảo
đồ hoả trị trước đó (HR = 0,76) hoặc hai hoặc nhiều phác đồ (HR = 0,76).
Lợi ích sống thêm oùa Tarceva cũng được quan sát ở những bệnh nhân không có đáp ứng khối u
một cáoh khảch quan (theo tiêu chí RECIST). Diều nảy rõ rảng khi tỉ số nguy hại 1iến quan tử vong
là 0,82 trong số những bệnh nhân những người có đảp ứng tốt nhắt lả bệnh ốn định và là 0,85 0
những người bị bệnh tiến triến.
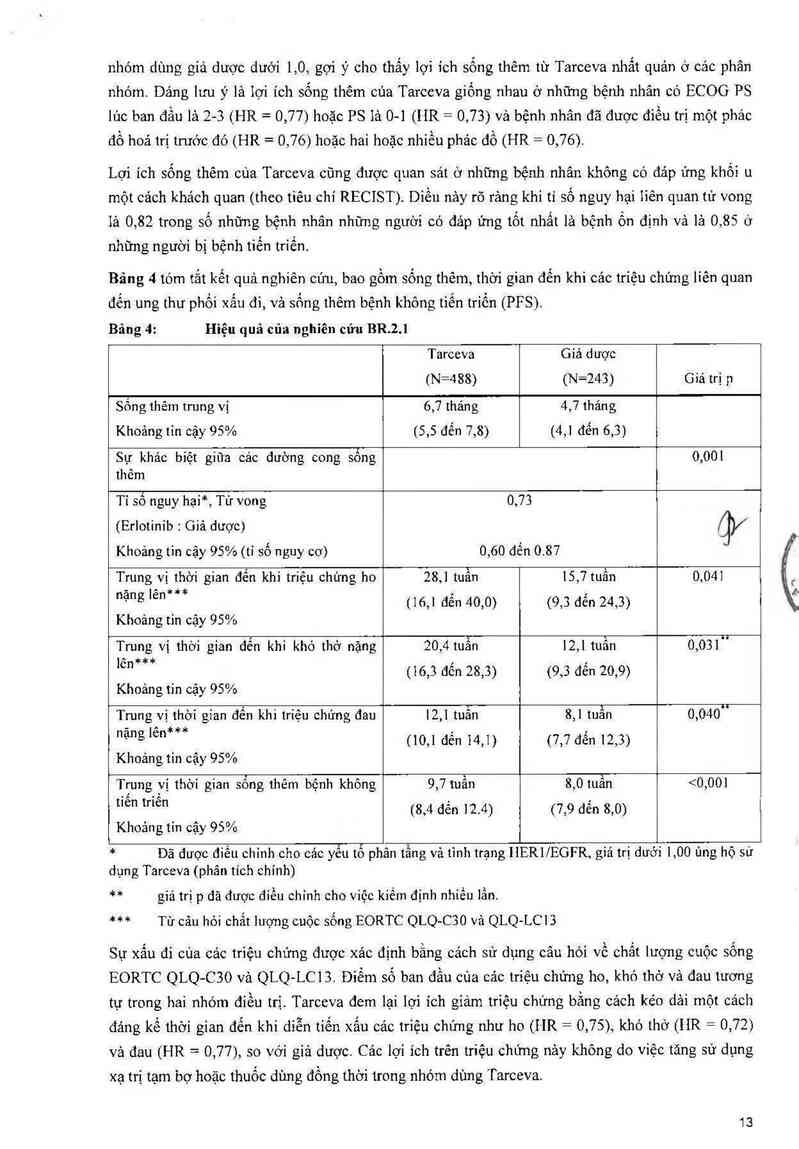
Bảng 4 tớm tắt kết quả nghiên cún, bao gồm sống thêm, thời gian đến khi cảc triệu chứng liên quan
đến ung thư phối xấu đi, vả sống thêm bệnh không tiến triển (PFS).
Bâng 4: Hiệu quả oủa nghiên cứu BR.2.I
Tarceva Gíả dược
(N=488) (N=243) Giá trị p
Sống thêm trung vị 6,7 tháng 4,7 thảng
Khoảng tin cậy 95% (5,5 đển 7,8) (4,1 đến 6,3)
Sự khảo biệt giũa các đường cong sống 0,001
thêm
Tỉ số nguy hại*, Tử vong 0,73
(Erlotinib : Giả dược) gV
Khoảng tin cậy 95%(t1 số nguy cơ) 0,60 đến 0.87
Trung vị thời gian đến khi triệu chứng ho 28,1 tuẫn 15,7 tuần 0,041
— ~ =1u1=* , '
"ạ“g 1²²" (16,1 đên 40,0) (9,3 đên 24,3)
Khoảng tin cặy 95%
Trung vị thời gian đến khi khó thở nặng 20,4 tuần 12,1 tuần 0,031u
" *** , :
'“ (16,3 đên 28,3) (9,3 đên 20,9)
Khoảng tin oậy 95%
Trung vị thời gian đền khi ttiệti chứng đau 12,1 tuẳn 8,1 tuần 0,040"
— ^ 4…14 . '
"ạ“g 1“ (10,1 đên 14,1) (7,7 dên 12,3)
Khoảng tin cậy 95%
Trung vị thời gian sống thêm bệnh khỏng 9,7 tuần 8,0 tuân <0,001
“°“ t"°“ (8,4 đến 12.4) (7,9 đến 8,0)
Khoảng tin cậy 95%
* Dã được điếu chinh cho các yếu tố phản tầng vả tình trạng IiERl/EGFR, gỉá trị dưới 1,00 ủng hộ sử
dụng Tarceva (phân tich chính)
** giá trị p đã được điểu chính cho việc kiếm định nhiều lần.
*** Từ câu hòi chẳt lượng cuộc sống EORTC QLQ-C3O vả QLQ-LC 1 3
Sự xấu đi cùa cảc triệu chứng được xác định bằng cảch sử dụng câu hỏi về chắt lượng cuộc sống
EORTC QLQ-C3O vả QLQ-LCI 3. Điểm số ban đầu cùa các triệu chứng ho, khớ thớ và đau tương
tự trong hai nhớm điều trị. Tarceva đem lại lợi ích giảm triệu chứng bằng cảch kéo dải một cách
đảng kế thời gian đến khi diễn tiến xấu cảc triệu chứng như ho (HR = 0,75), khó thở (HR = 0,72)
vả đau (HR = 0,77), so với giả dược. Cảo lợi ich trên triệu chứng nảy không do việc tăng sử dụng
xạ trị tạm bợ hoặc thuốc dùng đổng thời trong nhóm dùng Tarceva.
13
g_’\
Trung vị thời gian sống mả bệnh không tiến triền là 9,7 tuần ở nhóm dùng Tarceva (khoảng tin cậy
95%, 8,4 - 12,4 tuần) so với 8 tuần ở nhóm dùng giả dược (khoảng tin cậy 95%, 7,9 đển 8,1 tuần).
Ti số nguy hại đối với tiển triền cùa bệnh, đã được đỉếu chỉnh cho các yếu tố phân tầng vả tinh
trạng HERl/EGFR, lả 0,61 (khoảng tín cặy 95%, 0,51 đến 0,73) (p < 0,001). Tỉ lệ sống thêm mà
bệnh không tiển triển ở thời điềm 6 thảng tuần tự là 24,7% và 9,3% cho nhóm dùng Tarceva và
nhóm chứng.
Tỉ lệ đảp ứng khảch quan theo RECIST trong nhóm dùng Tarceva là 8,9% (khoảng tin cặy 95%,
6,4 đến 12%). Thời gian đáp ửng trung vị là 34,3 tuần, trong khoảng từ 9,7 đến 57,6+ tuần. Hai
trường hợp đáp ứng (khoảng tin cậy 95%, 0,9%, 0,1 dển 3,4) được bảo cảo trong nhóm dùng giả
dược. Tỉ lệ bệnh nhân có đảp ứng hoản toản, dảp ứng một phần hoặc bệnh ổn định lần lượt là 44%
vả 27,5% cho nhóm dùng Tarceva vả nhóm dùng giả dược (p=0,004).
Ung thư tụy (Tarceva được dùng đồng thời với gemcitabin) gi/
Hiệu quả và độ an toản cùa Tarceva khi phối hợp với gemcitabin như điều trị bưởc một được dánh
giả qua một thử nghíệm lâm sảng có đối chứng với giả dược, mù đôi, ngẫu nhiên ở 569 bệnh nhân
bị ung thư tụy tiển triền tại chỗ, không phẫu thuật được hoặc di căn. Bệnh nhân được chọn ngẫu
nhiên 1:1 đề được dùng Tarceva (100 mg hoặc 150mg) hoặc giả dược ngảy một lần dùng liên tục
phối hợp với gemcitabin TM (lOOOmg/mz, liệu trinh 1 - ngảy thứ 1, 8, 15, 22, 29, 36 và 43 cùa liệu
trình 8 tuần; liệu trình 2 và cảc liệu trinh tiếp theo - ngảy thứ 1, 8 vả 15 của liệu trình 4 tuần (về liều
và lịch trình điều trị đã được phê chuẩn cho ung thư tuỵ, xem Tóm tắt đặc tính thuốc cùa
gemcitabin). Tarceva hoặc giả dược được uống ngảy một lần cho đến khi bệnh tiền triền hoặc có
độc tính không chấp nhận được. Cảc kết cuộc nghiên cứu bao gồm sống thêm toản bộ, tỉ lệ đáp ứng
và tỉ lệ sống bệnh không tiển trìền. Thời gian đảp ứng cũng được đánh giá. Kết cuộc chính là sống
thêm. Tổng số 285 bệnh nhân được chọn ngẫu nhiên để dùng gemcitabin kểt hợp với Tarceva (261
bệnh nhân trong nhóm dùng 100mg và 24 bệnh nhân trong nhóm dùng 150mg) và 284 bệnh nhân
được chọn ngẫu nhiên dùng gemcitabin kểt hợp với giả dược (260 bệnh nhân trong nhóm dùng
100mg và 24 bệnh nhân trong nhóm dùng 150mg). Khó có thề rủt ra kết luận gì từ một nhóm quả
nhỏ dùng lSOmg.
Đặc tính dân số ban đầu và đặc điếm bệnh cùa bệnh nhân lả tương dương giữa hai nhóm điều trị,
100mg Tarceva phối hợp với gemcitabin hoặc giả dược phối hợp vởi gcmcitabin, trừ tỉ lệ bệnh
nhân nữ hơi nhiều hơn trong nhóm Tarceva (51%) so với nhóm giả dược (44%). Trung vị thời gian
từ lúc chẩn đoán ban đầu tới khi chọn ngẫu nhiên là khoảng 1 tháng. Khoảng một nửa số bệnh nhân
có điềm hoạt động cơ thể (PS) ban đầu theo tiêu chí ECOG là 1, vả 17% có đỉếm ECOG ban đầu là
2. Phẩn lớn bệnh nhân có biểu hiện ung thư tụy di căn ngay từ đầu khi vảo nghiên cứu (77% trong
nhóm dùng Tarceva, 76% trong nhóm dùng giả dược).
Sống thêm được đảnh gíả trong nhóm bệnh nhân theo chủ định điều trị ban đầu dựa trên số liệu
theo dõi sống còn bao gồm 551 ca tử vong. Kết quả được trình bảy cho nhóm dùng 100mg (504 ca
tử vong). Tỉ số nguy hại về tử vong được điều chinh trong nhóm Tarceva so với nhóm giả dược là
0,82% (KTC 95%, 0,69 đến 0,98) (p=0,028). Tỉ lệ bệnh nhân sống 12 tháng là 23,8% trong nhóm
dùng Tarceva so vởi 19,4% trong nhóm dùng giả dược. Trung vị thời gian sống thêm là 6,4 thảng
trong nhóm Tarceva so với 6 tháng trong nhóm dùng giả dược.
Bảng 5 tóm tắt kết quả của nghiên cứu
14
.5>\
Ẹ_x
Bảng 5 Kết quả nghiên cứu 1…
Tarceva 100mg phổi Giả dược phổi hợp Giá trị p
hợp gemcitabin gemcỉtabỉn
(N = 261) (N=260)
Trung vị sống thêm 6,4 tháng 6 thảng
Tỉ số nguy hại, tử vong 0,82
(erlotinibzgỉã dược) p = 0.028
(khoảng tin cậy 95%) (0,69 đến 0,98]
% bệnh nhân sống dược 12 tháng 23.8 19.4
Trung vị thời gian sống mà bệnh không tiến triến lả 3,81 thảng (16,5 tuần) trong nhóm dùng
Tarceva (khoảng tin cặy 95%, 3,58 đển 4,93 tháng) so với 3,55 thảng (15,2 tuần) trong nhóm dùng
giả dược (khoảng tin cậy 95%, 3,29 đến 3,75 thảng) (p=0,006).
Trung vị thời gian đảp ứng là 23,9 tuần, trong khoảng 3,71 đến 56+ tuần. Tỉ lệ đảp ứng khảch quan
(đảp ửng hoản toản vả đảp ứng một phần) là 8,6% ở nhóm Tarceva và 7,9% ở nhóm chứng. Tỉ lệ
bệnh nhân có đáp ửng hoản toản, đảp t'mg một phần hoặc bệnh ổn định lần lượt là 59% vả 49,4%
cho nhóm Tarceva và nhóm chúng (p=0,036).
3.2 Các đặc tỉnh dược động học ẳ\/
Nồng độ rrong máu: I
Sau liều uống 150 mg Tarceva, ở trạng thải ổn định, trung vị thời gian đến khi đạt nổng độ đinh
trong huyết tương vảo khoảng 4 giờ với trung vị nồng độ đinh huyết tương đạt được là 1995
ngme. Ở thời điếm 24 giờ trưởc khi dùng liểu kế tiếp, trung vị nồng độ tối thiều huyết tương lả
1238 ng/mL. Trung vị AUC đạt được trong suốt quãng thời gian giữa cảc liều ở trạng thải ồn định
là 41300 mcg*giờme.
3.2.1 Hấp thu
Erlotinib uống được hấp thu tốt vả có giai đoạn hắp thu kéo dải, với nồng độ đĩnh huyết tương
trung bỉnh đạt được sau khi uống 4 giờ. Một nghiên cửu ở những người tình nguyện khoẻ mạnh
bình thường cho thẳy độ sinh khả dụng ưởc tính khoảng 59%. Nồng độ sau khi uống có thế tãng
bời thức ăn.
Sau khi hắp thu, cr1otinib gắn kểt cao trong mảu, khoảng 95% gắn với các thảnh phần máu, chủ yếu
vởi protein huyết tương (ví dụ albumin vả acid alpha-l glycoprotein [AAG]), vởi khoảng 5% ở
dạng tự do.
3.2.2 Phân bố
Erlotinib có thể tích phân bố trung bỉnh lả 232 L và phân bố vảo trong mô khối 11 người. Trong một
nghiên cứu 4 bệnh nhân (3 bệnh nhân bị ung thư phối không phải tế bảo nhỏ (NSCLC), và một
bệnh nhân bị ung thu thanh quản) uống Tarceva líều hảng ngảy lả150 mg, mẫu bệnh phầm 1.1 có từ
phẫu thuật cắt bỏ vảo ngảy điều trị thứ 9 eho thẳy nổng độ erlotinỉb ớ khối u đạt trung bình 1,185
ng/g mô. Giá trị nảy tương ứng với giá trị trung bình nói chung cùa 63% cảc nổng độ đỉnh huyết
tương ghi nhận ở trạng thải ổn định. Cảo chất chuyển hoá có hoạt tính chỉnh hiện dìện trong khối u
tại nồng độ trung bình là 160 ng/g mô, tương ứng với giá trị trung bình chung cùa 113% các nồng
15
độ đỉnh huyết tương ở trạng thải ổn định. Cảc nghiên cứu phân bố ở mỏ sư dụng cách chụp đồng vị
phóng xạ toản thân sau khi uống erlotinib dánh dấu bằng MC ở chuột trụi không có tuyến ức có sự
cấy u khảc loải HNS cho thắy sự phân bố ở mô rộng và nhanh với nồng độ tối đa của thuốc đã được
đảnh dắu phóng xạ (khoảng 73% nồng độ trong huyết tương) quan sảt được sau 1 giờ.
3.2.3 Chuyển hoá
Erlotinib được chuyền hoá tại gan bởi cảc men cytochrome P450 tại gan ở người, chủ yểu bời
CYP3A4 vả chuyền hoả ít hơn bời CYP1A2. Chuyền hóa ngoải gan bời CYP3A4 ở ruột, CYPi A1
ở phổi, và CYPIBl 6 mô khối u có khả năng dóng gớp vảo thanh thải chuyền hóa erlotinib. Cảc
nghiên cứu in vitro chi ra khoảng 80-95% crlotinib chuyền hoả bởi men CYP3A4. Có ba con
đường chuyển hoá chính được xảc định: 1) sự khử O-methyl cùa từng chuỗi bên hoặc cả hai, sau đó
dược oxy hoá thảnh acid carboxylic; 2) oxy hoá một nứa acetylene sau đó thuỷ phân thảnh acid aryl
carboxylic; và 3) sự hydroxyl hoá vòng thơm cùa gốc phenyl-acetylenc. Những chẳt chuyền hoá
chinh cùa erlotinib tạo bời sự khử O-methyl cùa từng chuỗi bên có hiệu lực tương đương với
erlotinib trong các nghiệm pháp ỉn vitro tiền lâm sảng và các mẫu mô in vivo. Chủng có mặt trong
huyết tương với nống độ < 10% erlotinib và có dược động học tương tự như erlotinib.
3.2.4 Thãi trừ
Cảc chất chuyền hoá và lượng rất nhỏ cùa erlotinib được bải tiết chủ yểu qua phân (>90%), với sự
bải tiết tại thận chỉ chiếm một lượng nhỏ liều uống vảo.
Độ thanh Ihảí: ẩi’lV
Phân tích dược động học ở 591 bệnh nhân dùng Tarceva đơn thuần cho thấy độ thanh thải trung
bình là 4,47 l/giờ với thời gian bản huỷ trung bình là 36,2 giờ. Vì vậy, thời gian dự kiến đề đạt
được nồng độ huyết tương ở trạng thái ổn dịnh xảy ra trong khoảng 7-8 ngảy. Không có mối quan
hệ có ý nghĩa giữa độ thanh thải được dự đoán và tuổi của bệnh nhân, trọng lượng cơ thể, giởi tính,
vả chùng tộc.
Cảo yếu tố cùa bệnh nhân có liên quan đến dược động học cùa erlotinib lả bilirubin huyết thanh
toản phần, nổng dộ AAG và tình trạng hút thuốc. Nồng độ bilirubin toản phần huyết thanh tăng vả
nồng độ AAG tăng di kèm với tốc dộ thanh thải cùa erlotinib chậm hơn. Những người hủt thuốc có
tốc độ thanh thải erlotinib nhanh hơn. (xem phần 2.4.3 Tương tảc với các thuốc khác và cảc hình
thức tương tác thuốc).
Một phân tích thứ hai về dược động học được tiến hảnh trong đó số liệu cùa erlotinib được tổng
hợp từ 204 bệnh nhân ung thư tụy được dùng erlotinib phối hợp gcmcitabỉn. Phân tích nảy cho thấy
cảc đổng biến số có ảnh hưởng đến độ thanh thải erlotinib ớ những bệnh nhân từ nghiên cứu tụy
cũng giống như những gì ghi nhận được trong phân tích dược động học thuốc dùng đơn chất trước
đây. Không xảc dịnh thêm có hiệu quả của các biến số mởi. Gemcitabin dùng đồng thời không tảc
động lên độ thanh thải huyết tương của erlotinib.
3.2.1 Dược động học ở những đối tượng đặc biệt
Không có cảc nghiên cứu chuyên biệt cho trẻ em hoặc bệnh nhân lớn tuối.
Suy gan: Erlotinib được đảo thải chủ yếu bởi gan. Nồng độ erlotinib trong máu giống nhau ở những
bệnh nhân bị suy giảm chức năng gan trung bình (điểm Child-Pugh 7-9) so với những bệnh nhân có
16
nf'
chức năng gan bình thường trong đó có những bệnh nhân bị ung thư gan nguyên phát hoặc di căn
gan.
Suy thận: Erlotinib vả cảc chất chuyến hoả cùa nó không được bải tiết qua thận một cách đảng kế,
dưới 9% liều đơn được tiểt ở nước tiếu. Chưa có nghiên cứu lâm sảng mềm được tiển hảnh ở những
bệnh nhân có chức nãng thận bị suy giảm.
Những ngỵời hút lhuốc: Nghiên cứu dược động học ở những người khoẻ mạnh không hút thuốc và
còn đang hút thuốc cho thẩy khói thuốc lá lảm tăng độ thanh thải và giảm nồng độ cùa erlotinib.
AUCO.VÔcục ở người hút thuốc vảo khoảng 1/3 so với người chưa bao giờ | đã từng hủt thuốc (n=lô
trong mỗi nhóm hủt thuốc và chưa bao giờ/ đã từng hủt thuốc). Sự giảm nồng độ nảy ở người còn
hút thuốc có thế do kích thích mcn CYPIAl ớ phối và CYPIA2 ớ gan.
Trong nghiên cứu then chốt pha III trong NSCLC, những bệnh nhân còn đang hủt thuốc đạt nồng
độ đáy huyết tương ở trạng thải ốn định lả 0,65 mcg/mL (n=16) thấp hơn khoảng 2 lần so với
những người chưa từng hoặc đã từng hút thuốc (1,28 mcg/mL, n=108). Tác động nảy đi kèm với sự
gia tăng 24% về thanh thải huyết tương của erlotinib.
Trong một nghiên cứu tãng liều pha 1 ở bệnh nhân bị NSCLC còn dang hút thuốc, phân tích dược
động học ở trạng thái ốn định cho thấy có sự tăng nồng độ erlotinib tỷ lệ thuận với liều khi liều
Tarceva được tảng từ 150 mg lên đến liều tối da được dung nạp lả 300mg. Nồng độ đảy huyết
tương ở trạng thái ổn định khi dùng 300 mg ở những người còn hủt thuốc trong nghiên cứu nảy lả
1,22 mcg/mL (n=17) (xem phần 2.2.1 Các hướng dẫn liểu dùng đặc biệt, 2.4.3 Tương tác với các
thuốc khảo và cảc hình thức tương tảc thuốc).
3.3 An toân tiền lâm sảng ậỉ/
3.3.1 Khả nãng sinh ung thư
Bằng chửng về khả năng sinh ung thư chưa được ghi nhận ở các nghiên cứu tiền lâm sảng.
Erlotinib không gây độc gene cũng như lảm hư hại nhiễm sắc thể trong cảc nghiên cứu gây độc
gene. Các nghiên cứu về khả năng sinh ung lâu dải ở chuột lớn và chuột nhắt đã được tiến hảnh, tuy
nhiên cảc sang thương tăng sinh tiểu ung thư chưa được ghi nhận trong những nghiên cứu độc tính
mãn tính kéo dải đến 6 tháng.
3.3.2 Khả năng gây đột biến
Erlotinib cho kết quả âm tính trong bộ mẫu thử chuẩn cùa nghiệm phảp gây dộc gene.
3.3.3 Giảm khả nãng sinh sản
Giảm khả năng sinh sán chưa được ghi nhận trong các nghiên cứu ở chuột đực vả chuột cái ở cảc
mức liểu gần liều tối đa được dung nạp (MTD).
3.3.4 Khả năng gây dị dạng thai
Số liệu từ các thử nghiệm độc tính 1ẽn khả nảng sinh sản ở chuột và thỏ cho thấy sau khi dùng
erlotinib vởi liều gần MTD vả/hoặc liều có độc tính cho mẹ, có sự nhiễm dộc phôi, nhưng không có
bằng chứng cùa sự suy giảm khả năng sinh sản, tính gây quải thai, hoặc sự phảt triền bất thường về
hảnh vi hoặc thể chắt trước hoặc sau đẻ. Độc tính cho mẹ ở cả chuột vả thờ trong những nghiên cứu
nảy xảy ra với nồng độ trong huyết tương tương tự như nồng độ ở người sau khi dùng erlotinib liều
lSOmg.
17
3.3.5 Khác
Hiệu quả khi dùng lâu dải đã được ghi nhận ở ít nhất một loải động vật hoặc nghiên cứu bao gồm
tảc động lên giảc mạc (teo, loét), da (thoải hoá và vỉêm nang lông, đò da, và rụng tóc), buồng trứng
(teo), gan (hoại tử gan), thận (hoại tử nhủ thận và dãn ống thận), vả đường tiêu hoá (chậm tiêu ở dạ
dảy và tiêu chảy). Số lượng hồng cầu, hematocrit vả hemoglobin giảm và reticulocytes tăng. Bạch
cầu, chủ yếu là bạch cằn trung tính, lại tảng. Có sự tăng liên quan đến điều trị về alanine
aminotranferasc (ALT), aspartate aminotransferase (AST), vả bilirubin.
Cảo nghiên cứu in vitro về erlotinib dã chỉ ra sự ức chế kênh hERG tại nồng độ cao hơn ít nhất 20
lần nồng độ thuốc ở trạng thải tự do ở người ở liều điều trị. Cảc nghiên cứu ở chó không cho thấy
có kéo dải khoảng QT. Sự xem xét lại một cảch hệ thống cảc số liệu ECG từ 152 đối tượng từ 7
nghiên cứu với những người tình nguyện khoẻ mạnh đã không tìm thấy bằng chứng có kéo dải
khoảng QT, vả cảc nghiên cứu lâm sảng không tìm thấy bằng chứng loạn nhịp, đi kèm với kéo dải
khoảng QT.
4. CÁC ĐẶC TÍNH DƯỢC HỌC
4.1 Bảo quản
Tính ổn định
Không nên dùng Tarceva sau ngảy hết hạn (EXP) ghi trên hộp.
Hạn dùng: 48 thảng kể từ ngảy sản xuất.
Không bảo quản thuốc ở nhiệt độ trên 30°C.
Chú ý đặc biệt khi bảo quản qỵ
Không có yêu câu đặc biệt nảo cho bảo quản
4.2 Hướng dẫn đặc biệt khi sử dụng
Không có yêu cầu đặc biệt nảo
4.3 Đóng gói
Viên nén 150mg. Hộp 3 vì x 10 viên nén
Thuốc: Đế xa tầm tay của trẻ /
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần biết thêm thông tin xin hỏi ý kiến bác sỹ
Chỉ sử dụng thuốc theo sự kê đơn của bác sỹ
Lưu hảnh tháng 3 năm 2009
Sản xuất cho F.Hoffmann-La Roche Ltd., Basel , Thụy Sỹ
bới Roche S.p.A.
Via Morclli 2, 20090 Segrate (Milano) , Ý
Đóng gói bời F .Hoffmann-La Roche Ltd., CH—4303 Kaiseraugst , Thụy Sỹ
18
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng