


















PREPRESS - INFORMATION
Bộ Y TẾ
CỤC QUẢN1.ÝDƯỌC
ĐÃ PHÊ DUYỆT
Lầt dẩuzẢSJ…ẫ…J…… . f
PREPRESS - ROCHE BASEL
Ai…i/gi
CUSTOMER
Control Proof New Proof Corrections
Format 52 x 18 x 130 mm
Reglster NY. 86.4.2258 Date: ............................ Date: ............................ Date: ............................
NP 7812
og_oq_zogg 12:²0:28 Visa: ............................ Visa: ............................ Visa ............................
Grundschrltt 7 Punkt
OK for Printing Control File OK for Printing
Date: ............................ Date: ............................ Date: ............................
Visa: ............................ Wsa: ............................ Visa: ............................
J
10107176 FE-E 10107176 FE—E 10107176 FE—E 10107176 F"t:-E
FILM1VON 4 FILM 2 VON 4 FILM 3 VON 4 FILM z: VON 4
Schwarz PMS 300 PMS 327 PMS 130
08.04.09 08.04.09 08.04.09 08.1 >4.09
_1.
/
:
Medicine: keep out ot reach of children
Dosage and administration: see package insert
1 caps = 75 mg oseitamivir … the form of oseltamivlr
phosphate
1 vlèn nang = 16 mg oultamlvlr
duới deng muói osellamwư phosphat
Dùng dường uỏng
Hộp chứa 10 viên nang ttong 1 ví
Chiđnh. chóng chi tinh` liều vả cách dùng: 11… xem trcng tờ
huớng dăn sủ đụng
NSX, HD. sỏ 10 sx xem phấn MFD. EXP. Batch No 1nirèn
bao bi Ngáy hét han lả nợảy 01 của Ihảng
sò ơăng ký
Sản xuất cho F. Hottmannia Roche … . Basel,
CENEXI SAS.
52 tuc Marcel et Jacques Gaucher
94120 Fontenay—SousBois. Pháp
Đỏng gòi bời. F.Holtmann-La Roche Ltd
-i- %
Bảo quản ở nhiệt độ uuớu 30°C CH~4303 Kaiseraugst. Thuỵ Sỹ
Duởi su cho phép oùa. Gilead Sciences
muoc cnt aAN meo ami. Thènh phó Foster. Caiiiomia. Mỹ
ĐỂ XA J'AM nv của TRẺ EM.
ĐỌC KY HƯỚNG DẦN sử DỤNG TRƯỚC KM! nùuc Nhé nhâp ttháu:
|
C. 10 capsules
I
I
Tamiflu'
Oseltamiw
G 10 upsules
. PREPRESS - INFORMATION PREPRESS - ROCHE BASEL CUSTOMER
136 mm breit, 1 Nutzen Control Proof New Proof Corrections
BỈỈSỈĐI’9I'ỒSSG 124 X 48 mm Date: ............................ Date: ............................ Date: ............................
Streudruck
23_07_2008 10:57:00 Visa: ............................ Visa: ............................ Wsa: ............................
PATEXT halbmanuell
Grundschrift 9.6 Punkt OK for Printing ' Control File OK for Printing
Date: ............................ Date: ............................ Date: ............................
Visa: ............................ Visa: ............................ Visa: ............................
10095148 … Art-Nr Code und Zelchnung TamiflỤ’.
ỄanNẶẬẮON ` Code-Ễteuermarke 99.4.3674 @ ỆỆỆ'JỆm'V"
23_07_08 1 x pro Zyllndcr-Umfang A
<Ễo>
_i Tamiflu® <ủì> Tamiflu® Tamiflu®
Oseltamivir Oseltamivir Oseltamivir
75 mg _ ® 75 mg _ ® 75 mg
@ ễỉiỉ'ảẵi'i. ễỉãi'ẳiii.
Tamiflu® 75 mg Tamiflu® 75 mg Ta ' ®
Oseltamivir @ Oseltamivir @) Os_ị ám_ivir -
75 mỉ Tamiflu® 75 mg Tamiflu® 7 nig
<"Ẹ’ỳ Oseltamivir Oseltamivir
Tamiflu® 75 "3 Tamiflu® 75 mỉ
— Oseltamivir @) Oseltamivir Oseltamivir
Tamiflu® 75 mg Tamiflu® 75 Ế
Oseltamivir @) Oseltamivir <Ề> Oseltamivir
75 mg Tamiflu® 75 nỂ. Tamiflu® 75 mg
<Ễ> ẹẫeitamivir ẹẫeltamivir
' c mỉ ~ @ mg - c '
ễỄểỄẳỈẵiđv <ưư> ễỄểẫ'ắẵiổa. <® ễẳ'áỉ`ảẵiiđv Ể
_ 75 mg Tamiflu® 75 mi Tamiflu° 75 mg =
<Ễì (7)ễeitamivir <Ủ> ẹẫeltamivir <ỄỒ ẵ
' ® mg ' @ mg ' @
ễỄểiễẳẵiiđn ® ễỄằ'ẳĨắiđn <® ễỄẩTắẵiề. ẳ
75 '“9 Tamiflu® 75 '“3 Tamiflu® 75 '"9 8-
<Ệ Oseltamivir Ổ°Ẹ> Oseltamivir Ế
Tamiflu® 75 nỉ Tamiflu® 75 nẾ~ Tamiflu® Ễ
Oseltamivir <ỀỂ) Oseltamivir Oseltamivir Ề
75 mg Tamiflu® 75 mg Tamiflu® 75 mg
— <Ệ C7)ễeltamivir @ ẹẫeltamivir @ —
. mg . ® mg . ®
ễỄểẫ`ẳỈẵiỏĨ <® ễỄẵ`ẳẵiii. <…Ệ> ẫỄẳ'ẳỈiih 0
75 mg Tamiflu® 75 mg Tamiflu® 75 Tỉ Ễ
<Ễ> ẹẵeltamivir ẹẫerlftìagmỉvìr <Ề> ẵ Ế
. mg . ® . ® Ê :
Ịệ.tiỉitỉ @ Ịi.itiilh Oseltamivir <ủ>
_ 75 mg 75 mg
†
@
. \fc,
ưiiJz—ziii 111 i11i11 \a
iỉạ1Ĩl-ĩẢNH Phò 1
41131 NỌ1 ;
].
1.1 m ỷÍ trị
Tamifiu lả ' c khâng vi rủt
1.2 Dạng dược phẫm
Viên nang cứng
Viên nang 75 mg gồm thân nang mờ đục mảu ghi có in chữ "ROCHE“ vả nắp mờ đục mảu vảng nhạt có in
"75mg”. Chữ in mảu xanh.
1.3 Đường dùng
Đường uống.
1.4 Tinh vô trùng | Bức xạ
Không áp dụng.
1.5 Thảnh phần định tính và định lượng
Hoạt chất: oseltamivir phosphat.
Mỗi viên nang 75mg chứa 98,5mg oseltamivir phosphat, tương đương với 75mg oseltamivir.
Danh sách tả dược
Sorbitol và natri benzoat
Tả dược trong viên nang: Tinh bột hồ hóa sơ bộ, Povidine K 30, Natri carboxymetyl cellulose mạch cầu,
khoảng vật magìê hydrat silicat, Natri stearyl fumarat.
2. CÁC ĐẶC TỈNH LÂM SÀNG
2.1 Chỉ định điều trị
Tamiflu được chỉ định để điều trị bệnh củm ở người lớn và trẻ em bao gồm cả trẻ sơ sỉnh đủ thảng (Xem mực
2.2.1 Những hướng dẫn iiêu dùng đặc biệt, 2.4 Những Cảnh bảo và Thận trọng vả mục 3.3 Tính an toản tiên
lâm sảng)
Tamiflu được chỉ định để phòng ngừa bệnh cúm ở người iớn và trẻ em từ một tuổi trở iên.
2.2. Liều lượng và Cách dùng
Tamifiu có thể được dùng kèm hoặc không kèm theo thức ăn. (Xem mục 3.2 Cỷc đặc tinh dược động học).
Tuy nhiên, dùng Tamiflu kèm với thức ăn có thẻ iâm tăng khả năng dung nạp thuôc ở một sô bệnh nhân.
Trong trường hợp huyền dich uống Tamiflu không sẵn có, người lớn, thanh thiếu niên và trẻ em không thế
nuốt víên thuốc vẫn có thể uống đúng líều iượng (xem phần Hưởng dẫn pha trộn ở cuối tờ hướng dẫn sử dụng
nảy). Pha chế tại hiệu thuốc là lựa chọn tốt nhất.
Liều chuẩn:
Điều trị bệnh cám
Nên bắt đầu đỉều trị vảo ngảy thứ nhất hoặc ngảy thứ hai khi xuất hiện cảc tríệu chứng đầu tiên của bệnh cúm.
Người lớn vả thanh thiếu niên:
Ớ_người iớn và thanh thiếu niên từ 13 tuổi trở lên, liều khuyên dùng lả uống viên nang Tamiqu 75mg hai iần
môi ngảy, trong 5 ngảy. Trong trường hợp không thể nuốt được viên nang, có thể dùng dạng huyên dịch với
liều 75mg Tamifiu hai lần môi ngảy, trong 5 ngảy.
T re' em:
63² -1 =
J—fn
.\
Íl'ễiởAfi/V "\
Trẻ có cân nặng trên 40 kg nếu có thể nuốt đuợc viên nang, cũng có thế được điều trị với liều uống viên nang
75mg hai lần mỗi ngảy hoặc một viên nang 30mg cộng với một viên nang 4Smg hai lần môi ngảy, thay vì
dùng Tamiflu dạng huyền dịch vởi liễu khuyên dùng như bảng duởi đây.
Liều uốngr đươc khuvên dùng của T amifl u cho trẻ lừ mỏ! tuốt“ trở lên:
Trọng lượng cơ thể Liều khuyên dùng trong 5 ngảy Lượng huyền dịch uống (6mg/ij
S 15 kg 30 mg hai lần mỗi ngảy 5,0 ml hai iẩn mỗi ngảy
>15 kg đển 23 kg
> 23 kg đến 40 kg
> 40kg
Trẻ em dưới 1 Iuổi:
45 mg hai iần mỗi ngảy
60 mg hai lần mỗi ngảy
75 mg hai lần mỗi ngảy
7,5 ml lmi lằn mỗi ngảy
10,0 ml hai lần mỗi ngảy
12,5 m] hai lần mỗi ngảy
Liều uống Tamifiu khuyến cảo cho trẻ từ 0 đến 12 thảng 'lả 3` mg/lgg hai lần một ng_ảy, dùng trong 5 ngây. Liều
dùng khuyên cáo nảy không ảp dụng cho trẻ sơ sinh có sô tuân tuôi dưới 36 tuân kê từ khi thụ thai.
Liêu dùng đuờng uỏng của Tamiflu đươc khuvén cảo cho trẻ dưới mỏi mói lả:
Trọng Iưọng cơ thể Liều khuyên dùng trong 5 ngảy Lượng huyền dịch uống (ómg/mL)
3 kg 9 mg hai iẳn mỗi ngảy 1,5 ml hai lẩn mỗi ngảy
4 kg 12 mg hai lần mỗi ngảy 2,0 ml hai lần mỗi ngảy
5 kg 15 mg hai lần mỗi ngảy 2,5 ml hai lẩn mỗi ngảy
6 kg 18 mg hai lần mỗi ngảy 3,0 ml hai lấn mỗi ngảy
7 kg 21 mg hai lần mỗi ngảy 3,5 m] hai lần mỗi ngảy 'Ề/
8 kg 24 mg hai lằn mỗi ngảy 4,0 ml hai lấn mỗi ngảy
9 kg 27 mg hai lẳn mỗi ngảy 4,5 m] hai iần mỗi ngảy
10 kg 30 mg hni lần mỗi ngảy 5,0 ml hai 1ần mỗi ngây
*Bảnư nảv không bao gồm tất cả cảc số liêu về cân nãng có thể có trong đó tuổi nảv. Đối vởi tắt cả các bênh
nhân dưới môt môi. liêu 3mg ]kg đươc dùng đê tinh liêu cho moi bênh nhi.
Bõt Tamiflu dùng pha huvền dich uống nên đươc pha bới dươc sỹ trước khi phảt cho bênh nhân ( xem muc 4.2
Hướng dân đăc biẻt trong Sử dung)
Phòng ngừa bệnh cúm
Ngwời lÓ7’i vả thanh thiểu níẻn:
Liều uống Tamifiu khuyên dùng để phòng ngùa bệnh củm sau khi tiếp xúc vởi người bị nhỉễm củm lả 75mg
ngảy một lân, trong 10 ngảy Nên bãt đâu việc sử dụng trong vòng hai ngảy sau khi tiêp xúc vói nguôn bệnh.
Liều khuyên dùng để phòng bệnh củm trong suốt thời gian có dịch ở cộng đồng là dùng 75mg ngảy một lần.
Tinh an toản và hiệu quả của việc dùng thuốc đã được chứng minh cho tới 6 tuần. Chùng nảo vân còn dùng
thuốc thì thời gian bảo vệ cùa thuốc vân còn.
Trẻ em lừl tuốt“:
Trẻ có cân nặng trên 40 kg nếu có thể nuốt duợc viên nang, cũng có thế được điều trị phòng bệnh cúm vởi
viên nang 75mg một lần môi ngảy hoặc một viên 30 mg cộng với một viên 45 mg một lần môi ngảy, trong 10
ngảy, thay vì dùng Tamiflu dạng huyền dịch vởi liều khuyên dùng như bảng dưới đây.
Liều uổng đươc khuvẻn dùng của Tamiflu để phòng ngừa bẽnh cúm cho lré lử mô! tuồi trở lẻn:
T rọng Iu'gmg cơ thể Liều khuyên dùng trong 10 ngảy Lượng huyền dịch uống (6 Jng/mL)
s 15 kg 30 mg ngảy một 1ầ11 5,0 m| ngảy một lẩn
> 15 kgđến 23 kg
› 23 kg đến 40 kg
> 40kg 75mg ngảy một lẩn
45 mg ngảy một lần 7,5 mi ngảy một lần
60mg ngảy một lằn 10,0 ml ngảy một lần
12,5 ml ngảy một lần
Tamiiiu dạng_bột pha huyền dịch uống nên được pha chế bởi dược si trước khi dùng cho bệnh nhân (Xem mục
4.2 Hướng dân đặc bỉệl cho việc Sử dụng, Báo quăn vả Hủy bỏ ihuôc).
2.2.1 Những hướng dẫn liồư dùng đặc biệt:
\\
Bệnh nhân suy thận
Điểu trị bệnh cúm
Không cần điều chinh iiều cho nhũng bệnh nhân có độ thanh thải creatininc trên 60 m1/phủt Ở nhũng bệnh
nhân có độ thanh thải creatininc từ 30- 60 mI/phút, cần giảm liều Tamiflu xưống 30mg uỏng hai lần một ngảy,
trong 5 ngảy Ở những bệnh nhân có độ thanh thải creatinine từ 10—30 mI/phút, cân giảm liều Tamitiu xuông
30mg ưộng ngảy một iần, trong 5 ngảy. Ở những bệnh nhân đang thẳm phân máu định kỳ, nếu triệu chứng
củrn xuất hiện trong khoảng thời gian 48 giờ giữa hai lằn thẩm phân mảu có thể dùng ]ỉều khởi đẫu 30 mg
Tamiiiu trước khi bắt đầu thẩm phân mảu. Để znổng độ thuốc trong huyết tương được duy tri trong khoảng trị
liệu, nên dùng một liều 30 mg Tamifiu sau môi 1ần thẳm phân máu. Đối vói thẩm phân phủc mạc, nên dùng
một liều 30 mg Tamiqu truớc khi bắt đầu thấm phân mảu và sau đó bổ sung cảc liều 30 mg mỗi 5 ngảy (Xem
mục 3 2.5 Đặc tinh Dược động học ở những đối tượng đặc biệt và mục 2. 4 Nhũng Cảnh bảo vả Thận trọng).
Dược động học của oseltamivir chưa được nghiên cứu ở những bệnh nhân “bệnh thận giai đoạn cuối” (tức là
độ thanh thải creatinin < lOmll phủt) không đang thẩm phân mảu. Do đó, không có liều khuyên dùng cho
nhóm bệnh nhân nảy.
Phỏng ngửa bệnh củm
Không cẳn điều chinh liều cho những bệnh nhân có độ thanh thải creatinine trên 60 mllphút. Ở những bệnh
nhân có độ thanh thải creatininc từ 30- 60 milphút, liều dùng Tamifiu nên được giảm xướng còn 30mg, một
ngảy uống một lằn. Ở những bệnh nhãn có độ thanh thải creatinine từ 10- 30 mlfphút, cân giảm liều Tamitiu
xuông 30mg uống cách ngảy một lần. Ở những bệnh nhân đang thầm phân mảu định kỳ, có thể dùng liều khòi
đẩu 30 mg Tamiflu trưởc khi bắt đằu thẳm phân máu. Đề nông độ thuốc trong huyết tuơng được duy trì trong
khoảng trị iiệu, nên dùng một liều 30 mg Tamiflu sau mỗi những lẳn thẩm phân mảu xen kẽ. Đối vởi thấm
phân phúc mạc, nên dùng ] liều 30 mg Tamiflu trước khi bắt đẳu thẳm phân mảu và sau đó bổ sung cảc liều
30 mg môi 7 ngảy. (Xem mục 3. 2.5 Đặc tính Dược động học ở những đối tượng đặc biệt và mục 2. 4 Những
Cảnh bảo và Thận trọng). Dược động học cùa oseltamivir còn chưa được nghiên cứu ở những bệnh nhân
“bệnh thận giai đoạn cuối” (tức là độ thanh thải creatinin < 101n1/ phủt) không đang thẳm phân mảu Do đó,
không có liều khuyên dùng cho nhóm bệnh nhân nảy.
Bệnh nhân suy gan
Không cần điểu chinh liều cho những bệnh nhân bị rối loạn chức năng gan nhọ hoặc vừa khi được điều trị
hoặc phòng ngừa bệnh cúm (Xem mục 3.2.5 Đặc tính Dược động học ở những đôi tượng đặc bỉệt). Độ an toản
và đặc tinh dược động học ở bệnh nhân suy gan nặng chưa được nghiên cứu.
Bệnh nhân suy gỉảm miễn dịch
Vjệc dự phòng cúm mùa cho bệnh nhân suy giảm miễn dịch từ ] tuổi trở iên được khuyên lả 12 tuần. Không
cân điêu chĩnh iiêu (xem mục 2.2).
Người giá
Không cần điều chinh liều chợ nguời giả khi được điểu trị hoặc phòng ngừa bệnh cúm (Xem mục 3.2.5 Đặc
tính Dược động học ở những đôi tượng đặc biệt)
T rẻ em
Tinh hiệu quả cùa Tamiiiu ở trẻ dưới một năm tuối chưa được xác lập (Xem mục 3 2 5 Đặc tính Dược động
học ở những đỗi tượng đặc biệt) Các dữ iiệu dược động học chỉ ra răng liều 3 mg/kg hai lần một ngảy ở trẻ từ
0 đến 12 thảng tuôi cho nồng độ tiền chẩt vả chẳt chuyển hoá có hoạt tinh trong huyết tương ở đa sô bệnh nhi
tưong tự như nồng độ có hiệu quả lâm sảng ở trẻ lớn hơn và người lởn (Xem mục 2.1 Chỉ định điều trị)
2.3 Chổng chỉ định
Quả mẫn với oseitamivir phosphate hoặc với bất kỳ thảnh phẳn nảo của thuốc.
2 4 Những Cảnh bảo và Thận trọng
Co giật và cảc biến cố tâm thẩn kinh giống như mê sảng đã đuợc ghi nhặn ở nhũng bệnh nhân cúm dùng
Tamitiu, chủ yếu xảy ra ở trẻ em và thanh thiếu niên. Trong một vải trường hợp rất hiếm gặp, cảc biển có nảy
gậy nên chấn thương do tai nạn Vai trò của Tamifiu đối với cảc biến có nảy hiện vẫn chưa biểt rõ và các biến
có nảy cũng đã đuợc ghi nhận ở những bệnh nhân bị củm mã không dùng Tamiiiu. Ba nghiên cứu dịch tễ học
quy mô lớn độc lập đã khẳng định răng cảc bệnh nhân nhiễm cúm đang dùng Tamifiu không có nguy cơ xảy
ra các biến cố về tâm thần kinh cao hơn so với những bệnh nhân nhỉễm củm không đùng thuốc khảng vi rút
3
(xem phần 2.6.2 Sau khi lưu hảnh thuốc).
Bệnh nhân (đặc biệt trẻ em vả thanh thỉếu niên), cằn được theo dõi chặt chẽ các dấu hiệu hảnh vi bắt thường.
Không thắy bằng chứng về hiệu quả cùa Tamifiu trong bắt kỳ bệnh nảo gây bởi cảc tảc nhân không phải vi
rút cúm type A vả B.
Để điều chinh líều cho những bệnh nhân bị suy thận, xin xem mục 2.2.1 Những hưởng dẫn liều dùng đặc biệt
vả mục 3. 2. 5 Đặc tính Dược động học ở những đôi tượng đặc biệt
Một lọ Tamifiu 30g để pha huyền dịch uống có chứa 25 ,713g sorbitol. Một liều 4Smg oseltamivir uống hai lần
mỗi ngảy sẽ đưa vảo cơ thể 2 ,6g sorbitol. Với những bệnh nhân không dung nạp fructose di truyền, liều nói
trên vượt quá mức sorbitol tối đa được khuyên dùng hảng ngảy.
2.4.1 Tảc động lên khả năng lái xe và vận hãnh máy mỏc
Tamifiu không có tác dụng phụ nảo lên khả năng lảỉ xe vả vận hảnh mảy móc.
2.4.2 Tương tác với các thuốc khác và các hình thức tương tác khác
Thông tin từ những nghiên cứu về dược [ý và dược động học cùa oseltamivir phosphate cho thấy không có
khả năng xảy ra cảc tương tác thuôc có ý nghĩa vẻ mặt lâm sảng.
Một lượng lớn oseltamivir phosphate được chuyền hoá thảnh hợp chẳt có hoạt tỉnh nhờ esterasc, xảy ra chủ
yếu ở gan Cảc tương tảo thuốc do sụ cạnh tranh vởi esterase vân chua đuợc bảo cảo nhiều trong y văn. Do
oseltamivir vả chắt chuyền hóa có hoạt tính đều gắn kết kém với protein huyết tuong, khả năng tuơng tác do
chiếm chỗ cùa thuốc khó có thể xảy ra.
Cảo nghiên cửu in vỉtro cho thấy cả oseltamivir phosphate lẫn chất chuyển hoá có hoạt tính đều không phải là
chất nền tốt cho men oxidase có chức năng hỗn họp P450 hoặc cho men glucuronyl transferases. (Xem mục
3.2. Các đặc tinh dược động học). Không có cơ sở nằm về mặt cơ chế cho thấy có sự tương tác vởi thuốc ngừa
thai dùng đường uống.
Cimetidine, một chất ức chế không đặc hiệu của cảc đồng dạng cytochrome P450 vả iả chẳt cạnh tranh với
những thưôc gôc ba-zơ hoặc thuôc cationrhoả dêv bải tiêt qua ông thận, không có ảnh hưởng gì lên nông độ
trong huyêt tương cùa oseltamivir hoặc chât chuyên hoá có hoạt tính của nó.
Xét về mặt lâm sảng, cảc tưong tảo thuốc quan trọng có liên quan đến sự cạnh tranh để bải tiết qua ống thận
khó có thể xảy ra do gìởỉ hạn an toản đã được bìết của hầu hết các thuốc, đặc điềm thải trừ cùa chẳt chuyển
hoá có hoạt tính (sư lọc ở vi cầu thận vả bải tiềt ở ống thặn dưới dạng anion) vả khả nãng thải trừ của những
đường nảy. Dùng thuốc đổng thời vởi probcnecid sẽ lảm tăng nồng độ cảc chất chuyển hoá có hoạt tính lên
gân gâp đôi do ]ảm giảm sự bải tiết chủ động của chúng ở ông thận. Tuy vặy, nhờ giởi hạn an toản cùa chất
chuyển hoá có hoạt tính rất rộng nên không cần thiết phải điều chỉnh liều khi dùng thuốc chung vởi
probenecid.
Dùng thuốc đồng thời với amoxỉcìllin không lảm thay đổi nồng độ cùa cả hai loại thuốc trong huyết tương,
điêu nảy cho thây rảng sự cạnh tranh đê được bảỉ tiẽt dưới dạng anion lả rât yêu.
Dùng thuốc đồng thời với paracetamol không lảm thay đổi nồng độ trong huyết tương của oseltamivir, chẳt
chuyên hoá có hoạt tính của nó, hoặc paracetamoi.
Khỏng có tương tảc thuốc về dược động học giữa oseltamivir hoặc chất chuyển hoá chính của nó đưọc ghi
nhận khi dùng chung oseltamivir với paracetamol, acid acetyl- salicylic, cimetìdine hoặc cảc thuốc kháng acid
(magnesium vả hydroxid nhôm và carbonate canxi), warfarin, rimantadíne hoặc amantadinc.
Trong các nghỉên cứu lâm sảng đỉều trị và dự phòng pha 111, người ta đã dùng Tamiqu chung vởi cảc thuốc
thông dụng khác như thuốc ức chế men chuyền (cnalaprỉl, captopril), cảc thìazide lợi tiểu (bendroíluazide),
khảng sinh (penicỉllin, cephalosporin, azithromycin, erythromycin vả doxycycline), thuốc chẹn thụ thể H2
(ranìtidine, cimetìdine), chẹn beta (propranolol), các xanthine (theophyllinc), thuốc giống gỉao câm
(pscudoephedrine), chế phẳm thuốc phiện (codeinc), corticosteroids, thuốc giăn phế quản dạng hít, và thuốc
gỉảm đau (aspirin, ibuprofcn vả paracctamol). Không thấy có sự thay đổi nảo vê phản ứng phụ hoặc tần suất
xuất hiện cảc phản ứng phụ khi dùng Tamìflu chung vởí các thuốc nảy.
2.5. Sử dụng ở cảc đối tượng đặc biệt
2.5.1 Phụ nữ có thai
Những nghiên cứu về tảc động cùa thuốc lên sự sinh sản ở động vật, được tiến hảnh trên chuột và thò, không
ghi nhận hiện tượng quái thai nảo. Những nghiên cứu về khả năng sinh sản và độc tính sinh sản đã được tiến
4
H
hảnh trên chuột. Không thấy có bằng chứng về ảnh hưởng của thuốc lên khả năng sinh sản ở tất cả cảc liều
oseltamỉvir được nghiên cứu. Ở chuột và thỏ, người ta thấy nồng độ của thuốc ở phôi thai khoảng 15—20%
nống độ thuốc cùa thú mẹ.
Không có cảc thử nghiệm iâm sảng có đối chứng được tiến hảnh về việc sử dụng oseltamivir ở phụ nữ mang
thai; tuy nhiên có bằng chứng từ các bảo các sau khi lưu hảnh thuốc vả các nghiên cứu quan sảt cho thấy lợi
ích của phảc đồ dùng thuốc hiện nay ở đối tượng bệnh nhân nây. Kểt quả từ các phân tích dược động học cho
thấy sự tiếp xúc thấp hơn với chất chuyển hóa có hoạt tính, tuy nhỉên việc điều chinh liều không được khuyến
cảo cho phụ nữ có thai trong việc điều trị hoặc phòng ngừa bệnh củm (xem phần 3.2.5 Đặc tính dược động
học ở những đối tượng đặc bỉệt) Những dữ liệu nảy kết hợp với cảc nghiên cứu trên động vật không cho thấy
những tác hại trực tiếp hoặc gián tiếp đối với thai kỳ, sự phát triến phôi/thai hoặc sau khi sinh (xem mục 3.3
An toản tiền lâm sảng). Phụ nữ có thai có thể uống Tamiflu, sau khi cân nhắc thông tin an toản sẵn có, khả
năng gây bệnh của chùng vi rủt cúm hiện hảnh và thể trạng của người phụ nữ có thai,
2.5.2 Bà mẹ cho con bú
Ó chuột cho con bủ, oseltamivir và chất chuyến hoá có hoạt tính được bải tiết vảo trong sữa. Có rất ít thông tin
về trẻ em được nuôi bằng sữa của mẹ đang dùng oseltamivir và về sự bải tiết của oseltamivir vảo sữa mẹ. Cảc
dữ liệu hạn chế đã chi ra rằng oseltamivir và chất chuyến hoá có hoạt tính của nó đã được tìm thấy trong sữa
mẹ, nhưng ở nồng độ thấp, dưới mức đạt được ở liều điểu trị cho trẻ em. Sau khi cân nhắc thông tin nảy, tính
gây bệnh của chùng vi rút củm hiện hảnh và tình trạng sửc khoẻ của bá mẹ cho con bủ, có thể xem xét đến
việc sử dụng oseltamivir.
2.5.3 Sử dụng ở trẻ em
Xem mục 2.2.1 Những hướng dẫn liều dùng đặc biệt và 3.2.5 Đặc tính dược động học ở những đối tượng đặc
biệt.
2.5.4 Sử dụng ở người iớn tuổi
Xem mục 2.2.1 Những hướng dẫn liều dùng đặc biệt và 3.2.5 Đặc tính dược động học ở những đối tượng đặc
biệt.
2.5.5 Suy thận
Xem mục 2.2.1 Những hướng dẫn iiều dùng đặc biệt và 3.2.5 Đặc tính dược động học ở những đối tượng đặc
biệt.
2.5.6 Suy gan
Xem mục 2.2.1 Những hướng dẫn liều dùng đặc biệt và 3.2.5 Đặc tính dược động học ở những đối tượng đặc
biệt.
2.6. Cảc tác dụng không mong muốn
Thông báo cho bảo sỹ những tảc dụng không mong muốn gặp phải khi sử dụng thuốc.
2.6.1 Các thử nghiệm lâm sảng
Thông tin an toản chung cùa Tamiflu được dựa trên dữ lỉệu từ hơn 2647 bệnh nhân người lớn/thanh thiểu niên
và 858 bệnh nhân trẻ em bị cúm, và dựa trên dữ liệu từ hơn 1945 bệnh nhân người lớn/thanh thiếu niên vả 148
bệnh nhân trẻ em được dùng Tamiqu để dự phòng củm trong các thử nghiệm lâm sảng. Trong cảc nghiên cứu
điều trị ở người lớn/thanh thiếu niên, cảc phản ứng ngoại ý hay gặp nhất là buồn nôn, nôn và đau đầu. Phần
lởn các phản ứng ngoại ý nảy được báo cảo chỉ xuất hiện một lần, xảy ra trong ngảy điều trị đầu tiên hoặc thứ
hai và tự hết trong vòng 1-2 ngảy sau đó. Trong cảc nghiên cứu dự phòng ở người lớnlthanh thỉếu niên, đa số
cảc phản ứng ngoại ý được bảo cảo lả buồn nôn, nôn ói, đau đầu và đau. Ở trẻ em, phản ứng ngoại ý thường
gặp nhất là nôn ói. Ở phần Iởn bệnh nhân, những phản ứng nảy không dẫn đển ngừng sử dụng Tamiflu.
Điều Irị vả dựphòng cúm ở người lớn vả thanh thiếu niên
Trong cảc nghiên cứu điều trị và dự phòng ở người lớnlthanh thiếu niên, cảc phản ứng ngoại ỷ xuất hỉện
thường xuyên nhất (21%) ở liều khuyến cảo (75 mg, ngây 2 lần, trong 5 ngảy để đỉều trị và 75 mg ngảy một
lần, có thể kéo dải đến 6 tuần để dự phòng), và tỷ lệ xuất hiện cảc phản ứng ngoại ý cao hơn ít nhẩt lả 1% ở
nhóm Tamiflu so với giả dược, được nêu trong bảng 1.
mai “1
\O. ,
. Nhóm dân số trong các nghiên cửu điều trị cúm có cả nhũng người lởnlthanh thiếu niên khoẻ mạnh và những
bệnh nhân “có nguy cơ” (những bệnh nhân có nguy cơ cao gặp cảc biến chứng có liên quan với củm, chẳng
hạn như các bệnh nhân lởn tuổi vả cảc bệnh nhân bị bệnh tim/bệnh hô hấp mạn tính). Nói chung, thông tin về
độ an toản ở cảc bệnh nhân “có nguy cơ” là tương đương về cảc loại phản ứng ngoại ỷ so với nhóm những
người lónlthanh thiếu niên khoẻ mạnh.
Các thông tin về độ an toân được bảo cảo ở cảc đối tượng uống Tamiqu vởi liều khuyến cảo để dự phòng (75
mg ngảy một lân có thẻ kéo dải đên 6 tuân) cũng tương tự vẽ các loại phản ứng ngoại ý như những gì thây
được ở các nghiên cứu điều trị (Bảng 1), cho dù thời gian sử dụng thuốc trong cảc nghiên cứu dự phòng kéo
dải hơn.
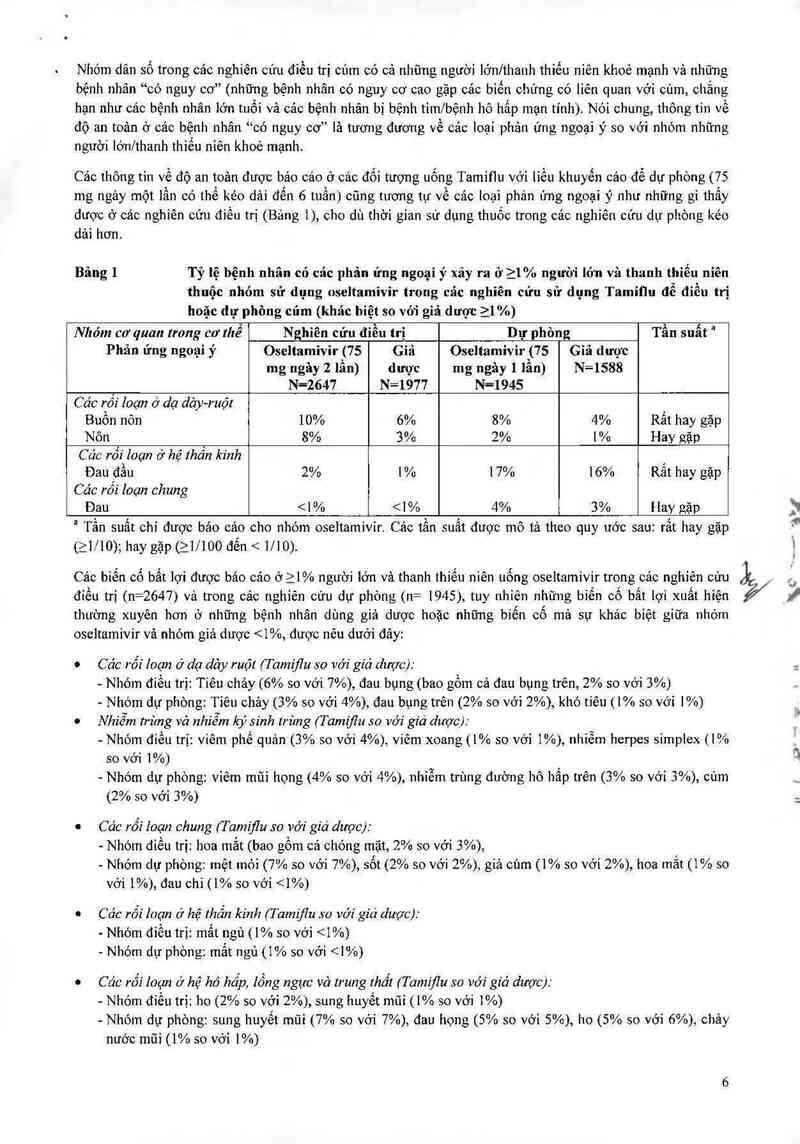
Bảng 1 Tỷ lệ bệnh nhân có các phản ứng ngoại ý xảy ra ở 21% người lớn và thanh thiếu niên
thuộc nhóm sử dụng oseltamỉvir trong cảc nghiên cứu sử dụng Tamiũu để điều trị
hoặc dự phòng cúm (khác biệt so với gỉả dượt: ìl %)
Nhóm co' quan trong cơ lhể Nghiên cứu điều trị Dự phòng Tần suất “
Phân ứng ngoại ý Oseltamivir (75 Giá Oseltamivir {75 Giã dược
mg ngây 2 lần) dược mg ngây 1 lần) N=1588
N=2647 N=1977 N=1945
Các rối Ioạn ở dạ dảy-ruột
Buồn nôn 10% 6% 8% 4% Rất hay gặp
Nôn 8% 3% 2% 1% Hay gặp
Các rối loạn ở hệ thần kinh
Đau đầu 2% 1% 17% 16% Rất hay gặp
Các rối loạn chung
Đau 1% nhóm trẻ từ 1 — 12 tuối được dùng oseltamivir trong cảc thử
nghiệm lâm sâng để điều trị củm mãc phải tự nhiên (n= 858) và có tỷ lệ xuất hiện ở nhóm Tamiflu cao hơn it
nhất 1%, so với nhóm giả dược (n= 622), là nôn ói (16% ở nhóm oseltamivir so với 8% ở nhóm giả dược).
Trong số 148 trẻ được uỏng Tamiflu với liều khuyến cáo ngảy một lần trong một nghiên cứu dự phòng tại nhà
sau phơi nhiễm củm (n=99), và trong một nghiên cứu khảc dự phòng cho trẻ em trong 6 tuần (n=49), nôn ói
cũng là phản ứng ngoại ý hay gặp nhất (8% ở nhóm oseltamivir so vởi 2% ở nhóm không dự phòng). Tamiflu
được dung nạp tốt trong cảc nghiên cứu nảy vả cảc biến cố bất lợi được ghi nhận hoản toản phù hợp với
những gì đã quan sảt thấy ở cảc nghiên cứu điều trị cho trẻ em bằng Tamiflu trưóc đó
%
Các biến cố bất lợi được bảo cảo ở >1% trẻ em được uống oseltamívir trong cảc nghiện cứu đỉều trị (n= 858)/
hoặc_ > 5% số trẻ em trong các nghiên cứu dự phòng (n= 148), tuy nhiên những biển cố bắt lợi xuất hiện
thường xuyên hơn ở những bệnh nhi dùng giả dượclkhông dự phòng hoặc những biến cổ mà sự khảo biệt giữa
nhỏm oseltamivir và nhóm giả dượclkhông dự phòng <1%, được nêu dưới đây:
0 Các rối Ioạn dạ dăy ruột (T amíjlu so với giả dược):
- Nhóm điều trị: tiêu chảy (9% so với 9%), buồn nôn (4% so vói 4%), đau bụng (bao gồm cả đau bụng
trên, 3% so với 3%)
o Nhiễm trùng và nhiễm ký sinh trùng (T amijlu so vởi giả dược):
- Nhóm điêu trị: viêm tai giữa (5% so với 8%), viêm phế quản (2% so với 3%), viêm phổi (1% so với
3%), viêm xoang (1% so vởi 2%)
0 Các rổi Ioạn ở hệ hô hẩp. lồng ngực và trung Ihẩt (T amiqu so với giả dược):
- Nhóm điểu trị: hen (bao gồm cả hen trầm trọng, 3% so với 4%), chảy mảu cam (2% so với 2%)
- Nhóm dự phòng: ho (12% so vởi 26%), sung huyết mũi (| 1% so với 20%)
0 Các rồi loạn ở da vả mô dưới da (T amijlu so vởi giá dược):
- Nhóm điểu trị: viêm da (bao gồm cả dị ứng và víêm da dị ứng, 1% so với 2%)
0 Các rối Ioạn ở tai vả mê đạo tiển đình (T amij7u so vởi gỉả dược):
- Nhóm điêu trị: đau tai (1% so với 10001T / 37 ,80C) cộng với một triệu chứng về hô hấp (ho hoặc sô
mũi), khi đang có sự hiện diện của vi rút cúm trong cộng đồng. Trong nghiên cứu nảy, 67% bệnh nhi nhiễm vi
rủt cứm type A và 33% nhiêm vi rút cúm type B.
Diều trị bằng Tamiflu, bắt đầu trong vòng 48 giờ khi có triệu chứng đầu tiên, đã lảm giảm đảng kể thòi gian
bệnh khoảng 35,8 giờ so với giả dược Thời gỉan bệnh được xác định lả thời gian cho đến lúc giảm cảc triệu
chứng ho, sung huyết mũi, hết sổt vả trở về tinh trạng sức khoẻ và hoạt động bình thường. Tỷ lệ bệnh nhân bị
viêm tai giữa cấp gíảm khoảng 40% ở những bé được điều trị bằng Tamifiu so vởi dùng giả duợc Nhũng bé
được điều trị bằng Tamifiu cũng trở về tình trạng sức khoẻ và hoạt động bình thuờng sớm hơn khoảng hai
ngảy so với những bé được dùng giả dược.
Một nghiên cứu thứ hai đã hoản tất ở 334 bé bị hen phế quản từ 6 đến 12 tuổi, trong đó 53,6% có vi rút cúm
dưong tính. Ở nhóm đuợc điều trị bằng oseltamivir, thời gian bệnh trung bình không được giảm đáng kể. Vảo
ngảy thứ 6 (ngảy điều trị cuối cùng), FEV. tăng khoảng 10, 8% ở nhỏm được điều trị bằng oseltamivir, trong
khi ở nhóm dùng giả duợc chỉ tăng 4,7% (p=0,0148).
Các thử nghiệm phòng bệnh cám
Phòng bệnh củm ở nguời lón vả lhanh thiểu niên.
Tính hiệu quả của Tamiflu trong việc phòng bệnh củm A và B mắc phải tự nhiên, đã được chứng minh trong
ba nghiên cửu pha 111 riêng biệt.
Trong một thử nghiệm pha 111 ở người lớn và thanh thiếu niên tiểp xúc với người bị cúm sống trong cùng một
nhả, Tamiflu được bắt đầu dùng trong vòng 2 ngảy từ khi những đối tượng nảy có triệu chứng cúm đầu tiên và
dùng liên tục trong 7 ngảy, đã Iảm giảm đáng kể tỷ lệ mắc củm do tiếp xúc khoáng 92%.
Trong một nghiên cứu mù đôi, có đối ohứng với gìả dược được tiến hảnh ở nhưng người truớng thảnh khóe
mạnh chưa được tiêm ohùng, tuối từ 18- 65, Tamifiu ]ảm giảm đáng kể tỷ lệ măc bệnh cúm có biền hiện lâm
sảng khoảng 76%, trong suốt thời gian có dịch củm tại cộng đồng. Nhũng đối tượng trong nghiên củu nảy đã
dùn g Tamiflu trong 42 ngảy.
Trong một nghiên cứu mù đôi, có đối ohứng với giả dược ở những người giả sống trong nhà dưỡng lão, 80%
tr0ng sô họ được tiêm chũng vảo mùa củm khi nghiên cứu nảy được tiến hảnh, Tamiflu lảm giảm đáng kể tỷ
lệ mắc bệnh cúm có bỉểu hiện lâm sảng khoảng 92%. Cũng trong nghiên oứu nảy, Tamiqu ]ảm giảm đáng kể
tỷ lệ viêm phế quản, viêm phối và viêm xoang có liên quan đến bệnh cùm khoảng 86%. Những đối tượng
trong nghiên cứu nảy đã dùng Tamiqu trong 42 ngảy.
Trong cả ba thứ nghỉệm lâm sảng trên, khoảng 1% số đối tượng dùng Tamifln để phòng củm đã bị cúm trong
quá trinh dùng thuôc.
Trong cảo thử nghiệm lâm sảng pha III nảy, Tamiflu cũng lảm giảm đáng kể tỷ lệ phát tản vi rút và ngăn chặn
sự lan truyện vi rút trong gia đinh một cáoh thảnh công.
Phòng bệnh cúm ở Ire’ em
Tinh hiệu quả của Tamiflu trong việc ngăn ngừa bệnh củm mắc phải tự nhiên đã được chứng minh trong một
nghiên cứu phòng bệnh cúm sau khi tiếp xúc vởi nguồn nhiễm Nghiên cứu nảy được tiến hảnh tại nhà vả gồm
nhưng bé từ 1 đển 12 tuổi, cả nhũng trường hợp chỉ đỉếm lẫn những trường hợp tiếp xủc trong gia đình. Thông
sô chính để đảnh giá tinh hiệu unả của thuốc trong nghiên cứu nảy là tỷ lệ măc bệnh cúm trên lâm sảng có kết
quả xét nghiệm dưong tỉnh vởi vi rút. Trong nghiên cứu nảy, 'l`amifủ dạng huyền dịch uống vởi liền từ 30mg
đến 75mg, môi ngảy một lần, Itrong 10 ngảy đã được dùng cho nhũng bé chưa bị phát tán vi rút lúc ban đẳu
cho thấy đã lảm giảm tỷ lệ mắc bệnh cúm có biểu hiện lâm sảng xảo nhận bằng xét nghiệm dương tính với vi
rủt từ 21% (151'70) ở nhóm trẻ không được điều trị dự phòng so với 4% (2/4'7) ở nhóm trẻ được điều trị dự
phòng.
Phòng bệnh cúm ở những bệnh nhân suy giảm miễn dịch
Một nghiên cứu mù đôi có đối chứng giả dược được tiển hảnh để dự phòng bệnh oúm theo mùa ở 475 đối
tượng suy giảm mỉễn dịch, trong đó có 18 trẻ em từ 1 — 12 tuồi. Người ta đảnh giả bệnh cúm có biến hiện lâm
sảng được xác nhận bầng xét nghiệm, theo định nghĩa là dương tính với phản ứng RT-PCR kèm theo thân
nhiệt đo ở miệng >99,00F/ 37,20C kèm theo ho vả/hoặc sổ mũi, tắt cả được ghi lại trong vòng 24 giờ. Trong
số cảc đối tượng chưa phảt tản vi rút Iủc ban đầu, Tamiflu lảm giảm tỷ lệ mắc phải bệnh củm có biểu hiện lâm
sảng được xác nhận bằng xét nghỉệm từ 3% (7/231) trong nhóm không được điều trị dự phòng xuống còn
0,4% (11232) trong nhóm được đỉểu trị dự phòng.
Sự đề kháng của vi rút
Sự giảm nhạy cảm cúa men neuramim'dase của vi rút
Cảc nghiên cưu lâm sâng. Nguy cơ xuất hiện các chùng vi rút cùm với tỉnh nhạy cảm giảm hay để khảng
oseltamivir đã được nghiên cứu kỹ trong các nghiến cứu lâm sảng do Roche tải trợ Tất cả cảc bệnh nhân
mang vi rút khảng oscltamivir chi cho thẳy đề kháng thoảng qua, họ vẫn thải trừ được vi rút như bình thường
và không có diễn tiến xắn về triệu chửng.
Bệnh nhân mang vi rút có đột biến đề kháng (%)
Nhỏm bệnh nhân _ __
Kiểu hình* Kiêu hinh vả kiêu gcn*
Người lớn và thanh thiểu niên 4/1245 (0,32%) 5/1245 (0,4%)
Trẻ e1n(1-12 tuồi) ]9/464 (4,1%) 251464 (5,4%)
* Toản bộ cảc kiến gen không được thực hiện trong tất cả cảc nghiên cứu.
Cảc nghiên cứu lâm sảng được tiến hảnh cho đển nay trong việc phòng bệnh cùm sau tiếp xúc (7 ngảy)i Sau
tiếp xúc trong gia đình (10 ngảy) và phòng bệnh củm theo mùa (42 ngảy) không cho thẳy có bằng chứng nảo
10
%
về sự khảng thuốc liên quan đến việc sử dụng Tamifiu ở những bệnh nhân có khả năng miễn dịch tổt. Không
thây có sự kháng thuôc nảo trong một nghiên cưu dự phòngl 2 tưân ở những đôi tượng suy giảm miên dịch.
Các dữ liệu Iám tảng và theo dõi. Cảc chủng đột biển tự nhiên giảm nhạy cam với oseitamivir in vitro đã
được phảt hiện ở vi rút cúm A và cúm 13 phân lập từ bệnh nhân chua từng nông osehamivir. Ví dụ, năm 2008
đề kháng oscltamivir do sự thay thế H²75Y đã đuợc tim thấy ở > 99% các mâu phân lập cúm H1Nì lưu hảnh
ở châu Ảu năm 2008, trong khi cúm HlNl nảm 2009 (“cúm lợn”) gần như đều nhạy cảm hoản toản với
oseltamivir. Cảo chủng đề kháng cũng được phân lập tù cả những bệnh nhân có miễn dịch tốt lẫn nhũng bệnh
nhân suy giảm miên dịch đuợc điều trị bằng oseltamivir. Sự nhạy cảm với ose1tamivir và tỉ lệ măc các vi rủt
đề kháng dường như thay đổi theo mùa cũng như theo địa lý. Cũng đã có báo cảo về sự đề kháng oscltamivir
khi điều trị lẫn khi dự phòng ở những bệnh nhân bị cúm trong dịch cúm 111N].
Tỷ lệ xuất hiện đề khảng có thể cao hơn ở nhũng nhóm tuổi nhỏ nhất, vả trong nhóm cảc bệnh nhân suy giảm
miên dịch Cảo vi rủt đề kháng oseltamivir phân lập đuợc từ cảc bệnh nhãn điều trị bằng oscltamivir vả oác
chùng vi rút củm kháng oscltamivir chọn lọc trong phòng thí nghiệm đều oho thẳy có mang đột biến ở các
ncuraminidase Ni và N2. Các đột biến kháng thuốc có xu hướng đặc trưng theo phân nhóm vi rút.
Cảo bác sỹ nên cân nhắc thông tin hiện có về các dạng nhạy cảm với thuốc oủa vi rút cúm cho tùng mùa trưởc
khi quyêt định dùng Tamiflu hay không (đề có thông tin mới nhât, xin xem trên website cùa WHO vả/hoặc
chính quyên sở tại).
3.2 Các đặc tính dược động học
3.2.1 Hấp thu
Oseltamivir được hấp thu nhanh ohóng ở đường tiêu hóa sau khi uống oseltamivir phosphate và một phần lớn
thuốc được chuyển hóa thảnh chắt có hoạt tinh, chủ yếu nhờ men estcrasc ở gan. Nổng độ trong huyết tương
cùa chất chuyến hỏa có hoạt tính oó thể đo được trong vòng 30 phút, đạt gần nồng độ đỉnh 2-3 giờ sau khi ,
dùng thuốc và cao hơn đáng kể (> 20 lằn) nồng độ của tiền dược. Có ít nhất 75% lượng thuốc uống vảo được
tuần hoản dưới đạng chẳt chuyến hóa có hoạt tính. Nồng độ của chẳt chuyển hóa có hoạt tỉnh trong huyêt _
tương tỷ lệ với liều dùng vả không bị ảnh hưởng bởi thức ăn dùng cùng (Xcm mục 2.2 Liều lượng vả Cảch ,-
dung) 'ệ .
3.2.2 Phân bố ý" c
Thế tỉch phân bố trung binh (Vss) oùa chất chuyển hóa oó hoạt tinh là khoảng 23 lít ở người.
Gốc có hoạt tính tới được tất cả cảc vị trí quan trọng bị nhiễm vi rủt cúm qua nghiên cún trên chồn, chuột vả
thớ. Trong những nghiên cứu nảy, người ta đã thấy nồng độ chất ohuyến hóa có hoạt tính kháng vi rút tập
trung ở phối, dịch rủa phế quản—phế nang, ohất nhầy ở mũi, tai giũa và khí quản sau khi uống oseltamivir
phosphatc.
Mức độ gắn kểt cùa chất chuyến hóa có hoạt tính với protein huyết tượng ở người lá không đảng kế (xắn xỉ
3%). Mức găn kẽt của tiên được với protein huyêt tương người là 42%. Với mức nảy thì ohưa đủ đê gây ra cảc
tương tác thuôc có ý nghĩa.
3. 2. 3 Chưyển hóa
Một lượng 1ớn oseltamiyir phosphate được chuyến hóa thảnh chất chuyển hóa có hoạt tính nhờ mcn cstcrase, ]
men nảy khu trú ohù yếu ở gan. Cả oscltamivir lẫn ohất chuyến hóa có hoạt tính đều không phải 1ả cơ chắt
hoặc chất' ưc chế cùa cảc đồng dạng cytochromc P450 (Xem mục 2. 4. 2 Tuong tác với các thuốc khác và cảc
hình thức tuơng tảo thuốc)
3. 2. 4 Thải trừ
Oscltamivir sau khi hấp thu đuợc thải trừ phần lớn (> 90%) bằng cách chuyển thảnh chất chuyển hóa có hoạt
tinh. Chất nảy không bị chuyển hóa tiếp mả bị thải trừ qua nước tiểu. Nồng độ đinh của chẳt chuyền hớa có
hoạt tính trong huyết tuong giảm dằn vởi thời gian bản thải tù 6 đền 10 giờ trong đa số trường hợp.
Thuốc có hoạt tính được thải trừ toận bộ (> 99%) qua thận. Độ thanh thải thận (18,8 lítfgiờ) vượt quá mức lọc
cầu thận (7, 5 lít/giờ) cho thấy thuốc còn đuợc thải trù tiểp qua ống thận. Dưới 20% liều uống có đánh dấu
phóng xạ được thải trừ qua phân.
3.2.5 Đặc tính dược động học ở những đối tượng đặc biệt
Bệnh nhân suy lliận
11
Sau khi dùng lOOmg Tamiflu, 2 lần / ngây, trong thời gian 5 ngảy cho những bênh nhân bị suy thặn ở cảc mức
độ khác nhau, người ta thấy nổng độ chất chuyển hóa có hoạt tính tỷ lệ nghịch với sự suy giảm chức năng
thận.
Đìều trị bệnh cúm
Không cần điều chinh liều cho những bệnh nhân có độ thanh thải creatinine trên 60 m1/phủt. Ở những bệnh
nhân có độ thanh thải creatinine từ 30- 60 ml/phút, cẩn giảm liều Tamiflu xuống 30 mg uỏng ngảy hai lần,
trong 5 ngảy. Ở những bệnh nhân có độ thanh thải creatinine từ 10— 30 m1/phủt. cân giảm liếu Tamit1u xuống
30 mg uỏng ngảy một lần, trong 5 ngảy. Ở những bệnh nhân đang thẩm phân mảu định kỳ, có thể dùng liều
khởi đầu 30 mg Tamiflu trưởc khi bãt đầu thẩm phân mảu nếu triệu chứng củm xuất hiện trong khoảng thời
gỉan 48 giờ giữa hai lần thẩm phân máu. Đế nồng độ thuốc trong huyết tương được duy tri trong khoảng trị
liệu, nên dùng một liều 30 mg Tamif1u sau môi chu trình thầm phân mảu Đối với thẩm phân phúc mạc, một
liều 30 mg Tamiflu trước khi bắt đầu thẩm phân mảu và bổ sung cảc liều 30 mg mỗi 5 ngảy (Xem mục 3 2.5
Đặc tính Dược động học ở những đối tượng đặc biệt và mục 2. 4 Nhũng Cảnh bảo và Thận trọng). Dược động
học của oseltamivir còn chưa được nghiên cứu ở nhũng bệnh nhân “bệnh thận giai đoạn cuối” (tức lả, độ
thanh thải creatinin < 10m1/ phút) không đang thầm phân mảu. Do đó, không oó liều khuyên dùng cho nhóm
bệnh nhân nảy.
Phỏng ngừa bệnh cúm
Không cần diều ohinh liền cho những bệnh nhân có độ thanh thải creatinine trên 60 mI/phủt. Ở những bệnh
nhân có độ thanh thải creatinine từ 30—60 ml/phủt, cần giảm liều Tamitìu xuống còn 30 mg uống ngảy một
1ẳn, trong 5 ngảy.Ỏ những bệnh nhân có độ thanh thải creatinine từ 10-30 mI/phút, cẩn giảm lỉều Tamitìu
xuống còn 30 mg, cảch một ngảy uống một lần. Ở nhũng bệnh nhân đang thầm phân máu định kỳ, có thể dùng
liều khời đầu 30 mg Tamiflu trưởc khi bắt đầu thầm phân máu. Để nông độ thuốc trong huyết tương được duy
tri trong khoảng trị liệu, nên dùng một liều 30 mg Tamit1u sau mỗi 1ẩn thẩm phân máu xen kẽ Đôi vói thẩm
phân phúc mạc, nên dùng một liều 30 mg Tamitiu trước khi bắt đầu thẳm phân máu và bổ sung cảc liều 30 mg
mỗi 7 ngây (Xem mục 3. 2. 5 Đặc tính Dược động học ở những đối tượng đặc biệt và mục 2. 4 Những Cảnh bảo
và Thận trọng). Dược động học oủa oseltamivir còn chưa được nghiên cửu ở những bệnh nhân “bệnh thận giai
đoạn cuối” (tức lả, độ thanh thái creatinin < IOmI/ phủt) không đang thẩm phân máu. Do đó, không có liều
khuyên dùng cho nhóm bệnh nhân nảy. cử
Bệnh nhân suy gan
Dựa trên những nghiên cứư ttong phòng thí nghiệm và trên động vật, ở những bệnh nhân suy gan nhẹ hoặc
trung bình, gia tăng đảng kê nông độ oseltamỉvir vả chât ohuyên hóa có hoạt tính không được_ghi nhận và đỉều
nảy đã được xảc định lại trong các nghiên cứu lâm sảng (Xem mục 2.2.1 Những hưởng dân lỉêu dùng đặc
biệt). Độ an toản vả đặc tính dược động học ở bệnh nhân suy gan nặng chưa được nghiên cứu.
Người giả
Ở người lớn tuối (từ 65 đến 78 tuối), nồng độ của chất chuyến hóa có hoạt tính ở trạng thải òn định cao hơn
khoảng 25- 35% so vởi người trẻ khi dùng cùng một liều Tamif1u. Thời gian bán thải của thuốc ở người giá
tương tự như ở ngườitrè. Căn cứ vảo nông độ của thuốc và khả năng dung nạp, không cạn địều chỉnh liều cho
người giả khi được điêu trị hoặc phòng ngừa bệnh cúm (Xem mục 2.2.1 Những hướng dân liêu dùng đặc biệt)
Phụ nữ có thai
Một phân tích gộp dược động học trên dân số chỉ ra rằng với phảc đồ liều lượng sử dụng Tamiflu mô tả ở mục
2.2 Liều lượng và cảch dùng thì sự tiếp xúc với chất chuyển hóa có hoạt tính ở phụ nữ có thai thấp hơn khi so
vởi phụ nữ không có thai(trung bình 30% ở cả 3 tam cả nguyệt). Tuy sự hấp thu thẳp hơn dự đoán nhưng vẫn
duy trì nồng độ cao hơn nồng độ ức chế (giá trị 1C95) và ở ngưỡng điều trị một loạt các chủng vi rút củm.
Ngoài ra có bằng chứng từ cảc nghiên cứu quan sát cho thấy lợi ỉch của phác đồ dùng thuốc hiện nay ở đối
tượng bệnh nhân nảy. Vì vậy việc chinh liếu không được khuyến cảơ cho phụ nữ có thai khi điếu trị hoặc
phòng ngừa bệnh củm (xem phần 3.2.5 Đặc tính dược lực học ở những đối tượng đặc biệt).
T rẻ em lừ ] tuôi
Dược động học của Tamifiu đã được đảnh giả trong một nghiên cứu dược động học liều đơn ở trẻ em từ 1 đến
16 tuồi. Dược động học đa liều củng đã được nghíên cứu ở một số ít trẻ từ 3 đến 12 tuổi trong một thử nghiệm
lâm sảng. Trẻ nhỏ tuổi có mức độ thải trừ cảc chẳt chuyến hóa có hoạt tính nhanh hơn so với người lớn, Iảm
cho nồng độ thuốc trở nên thấp hơn nếu xét theo liều được cho tính bằng mg/kg. Liều 2mg/kg và các liều
30mg vả 45mg khi dùng cho trẻ cm theo khuyến cáo ở mục 2.2 cho nồng độ tảo dụng của oseltamivir
12
carboxylate tương tự với nồng độ đạt được ở người lởn dùng liều đơn viên nang 75mg (xấp xỉ 1mg/kg). Dược
động học của oseltamivir ở trẻ em trên 12 tuồi tương tự như ở người Iởn.
Trẻ em dưới 1 Iuỗi
Dược lực học, dược động học và tính an toản của Tamifiu đã được đảnh giả ở hai nghiên cứu nhản mở ở một
tuôi (n=124). Tỷ lệ thanh thải trong chuyến hóa, tương thich cân nặng, được điều chỉnh giảm với độ tuổi dưới
1 năm Các dữ liệu hiện có chỉ ra sau khi uống liều 3 mg/kg ở trẻ 0-12 thảng tuối rằng nồng độ chất chuyến
hóa có họat tính đạt đến hiệu quả điều trị tương đương với cảc dữ liệu an toản đạt được ở trẻ lớn hơn và người
lớn đang uống liều được phê chuẩn. Cảo tác dụng không mong muốn được bảo cáo phù hợp với những thông
tin về an toản đã thiết lập ở trẻ lớn hơn.
3. 3 Tính an toân tiền lâm sảng
Những dữ liệu tỉền lâm sâng không cho thấy mối nguy hiểm đặc biệt nâo của thuốc cho người dựa trên các
nghiên cứu thông thường về dược học an toản, độc tính liều lặp lại và độc tính trên gen.
3.3.1 Tính sinh ung thư
Ba nghiên cứu về khả nãng gây ung thư (cảc nghiên cứu hgaỉ năm ở chuột nhắt vả ohuột lớn vởi oseitamivir, vả
thử nghiệm sản thảng về trao đổi gen ngAC ở chuột nhãt được tiến hảnh vởi chât chuyến hóa có hoạt tính)
cho kêt quả âm tính.
3.3.2 Tính gây đột biến
Oseltamivir vả ohất chuyền hóa có hoạt tính cho kết quả âm tính trong 1ôthứ nghiệm chuẩn gây độc trên gen.
3.3.3 Suy giãm khả nãng sinh sản
Nghiên cứu về khả năng sinh sản ở chuột với liều lên tới 1500mg/kg/ngảy đã chứng minh không có tâc động
có hại nảo lên Cả hai giới. Ở
3. 3. 4 Tính gây quái thai
Cảc nghỉên cứu về quái thai đã được tiến hảnh với Iiếu lên tới lSỌOmg/kg/ngảy ở ohuột vả 500mg/kg/ngảy ở
thò. Không ghi nhận được tảo động nảo của thuốc lên sự phảt triền cùa phôi thai. Trong các nghiên cứu chu
sinh ở chuột, quá trình chuyến dạ kéo dải dược ghi nhận ở lìếu lSOOmg/kglngảy: giới hạn an toản giữa liểu
điều trị ở người vả liều cao nhất không gây hại (SOOmg/kg/ngảy) ở chuột là gâp 480 lẩn đối với oseltamivir và
gấp 44 lần đối với chất chuyến hóa có hoạt tính. Nồng độ thuốc ở phôi chuột và phôi thò xấp xỉ 15 đến 20%
nồng độ ở mẹ.
3.3.5 Đặc tính khác
Ở chuột cho con bủ, oseltamivir và chất chuyến hoá có hoạt tính được bải tiết vảo trong sữa Ở người, vẫn
chưa biết liệu oseltamivir và chất chuyển hoá có hoạt tính có được bải tiết vảo trong sữa mẹ hay không. Thế
nhưng từ phép ngoại suy của cảo dữ liệu ở động vật, có thể dự đoán có khoảng 0 ,Olmg oseltamivir và 0 ,3mg
chất chuyển hoá có hoạt tính được bải tiết vảo trong sữa mẹ mỗi ngảy.
Khả nãng da nhạy cảm với oseltamivir được ghi nhận trong một xét nghiệm tối đa hóa” ở chuột lang. Sau khi
gây kích ứng với dị nguyên những con vật thí nghiệm nảy, người ta thấy có khoảng 50% con vật được điều trị
với hoạt chât ohính đơn thuần có xuất híện ban đó Sự gây kích ứng có hồi phục ở mắt thỏ cũng đã được phảt
hiện.
Trong khi liều rất cao oseltamivir phosphat dùng đường uống đã không gây ra một biến cố bất lợi nảo ở chuột
trưởng thảnh, thì liều nảy lại gây độc tính ở chuột con 7 ngảy tuối, kể cả tử vong. Những biển cố bất lợi nảy đã
được ghi nhận với liều 657 mglkg và cao hơn. Ở liều 500 mglkg, không có biến cố bất lợi nảo được ghi nhận,
kể cả khi điều trị lâu dải (chuột 7 đến 21 ngây tuổi dùng liều 500 mg/kglngảy).
4. CÁC ĐẶC TÍNH DƯỢC HỌC
4.1 Bảo quản
Viên nang: Hạn dùng 60 tháng. Bảo quản thuốc ở nhiệt độ dưới 30°C.
Bột pha huyển dịch uống: không bảo quản thuốc ở nhiệt độ trên 30°C.
Huyền dịch đã được pha: bảo quản thuốc ở nhiệt độ phòng (không quá 25°C) trong 10 ngây hay trong ngăn
mảt tủ lạnh <2°c — 8°C) trong 17 ngảy.
r
4.2 Hướng dẫn đặc biệt cho việc sử dụng, hủy bỏ thuốc
Huỷ bỏ thuốc không sử dụng/hết hạn
Cần hạn chế việc thải bỏ dược phẩm ra mõi trường. Không thải bỏ dược phẩm qua hệ thống nước thải
và tránh vứt bỏ vảo rác thải sinh hoạt. Hãy sử dụng “hệ thống thu gom” ở địa phương, nếu oó.
Độ ổn định
Không nên sử dụng thuốc sau ngảy hết hạn được ghi ở vỏ hộp.
Cách sử dụng và hũy bô
Chuẩn bi bót T amiflu cho dang huvền dich uống f6 mz/mL)
Bột Tamifiu cho dạng huyền dịch uống nên được pha bòi dược sĩ trước khi đưa cho bệnh nhân (Xem mục 2.2
Liều lượng và Cách dùng):
1. vỏ vảo 1ọ thuốc đóng kín vải lần để thuốc tơi ra.
Đong 55 ml nước. Sử dụng cốc lường nước (được cung cấp sẵn) và đong nước đến mức đã chỉ định.
2
3. Đồ 55 ml nước vảo lọ thuốc để pha thuốc và lắc kỹ lọ thuốc đã được đóng kín trong 15 giây.
4 Mở nắp lọ thuốc (loại bảo vệ không cho trẻ mở) vả ấn bộ phận tiếp hợp vảo cổ lọ thuốc.
5
Đóng nắp bảo vệ lọ thưốc lại thật chặt. Điếu nảy giúp cố định đủng chỗ bộ phận tiếp hợp ở lọ thuốc vả
khả năng bảo vệ của năp lọ thuôc.
Tờ hướng dẫn sử đụng vả ống lấy thuốc sẽ được đưa oho bệnh nhân. Nên viết ngảy hết hạn của huyền dịch đã
pha ưên nhãn thuôc. @
Pha khẩn cấp hỗn dich uổn từ vỉên nan Tami u Nổn đó cuối cùn 6 m /mL .
Dang hỗn dich của Tamiflu (6 mdmL) đươc ưa chuông cho các bênh nhân trẻ em và người lởn gảg khó khăn
trong viêc nuốt cảc viên nang hoãc cần dùng liều thấp hơn. Trong trường hop Tamiflu dang hỗn dich không có
săn, dươc sĩ có thẻ pha hôn dich (6 mQImL) từ viên nang Tamỉfiu.
Pha chế hỗn dích lai nhà thuốc (6 mz/mL)
Ouv trình sau đây mô tả viêc pha chế môt dung dich 6 mg/ml tai nhà thuốc sẽ cung cấp đủ liều thuốc cho 1
bênh nhân dùng trong đot điêu tri 5 nnủ
Dươc sỹ có thể nha chế môt huvền dich (6 mglmlì từ viên nang Tamiflu 30 mg` 45 mg hoãc 75 mg và nước có
chứa 0.05% sodium benzoate đươc thêm vảo đê bảo guản.
Trước tiên. tinh tổng thể tích cần Ẹ chế và đưa cho từng bênh nhân. Tống thể tích cẳn thiết đươc xảo đinh
bang cân năng cùa bênh nhân dưa theo khuyến cảơ trong bảng dưới đây:
Thể tích huvền dich (6 me/ml) cẩn pha chế tai hiêu thuốc cho môt đot điều tri 5 n2ảv dưa trên cân năng của
bênh nhân:
Cân nặng (kg) Tổng thể tích huyền dịch (ml)
< 6 kg 25 mL
6 đến < 7 kg 30 mL
7 đến 10 kg 50 mL
lOđếnlS kg SOmL
> 15 đến 23 kg 75 mL
› 23 đến 40 kg 100 mL
> 40 kg 125 mL
14
\x-«.
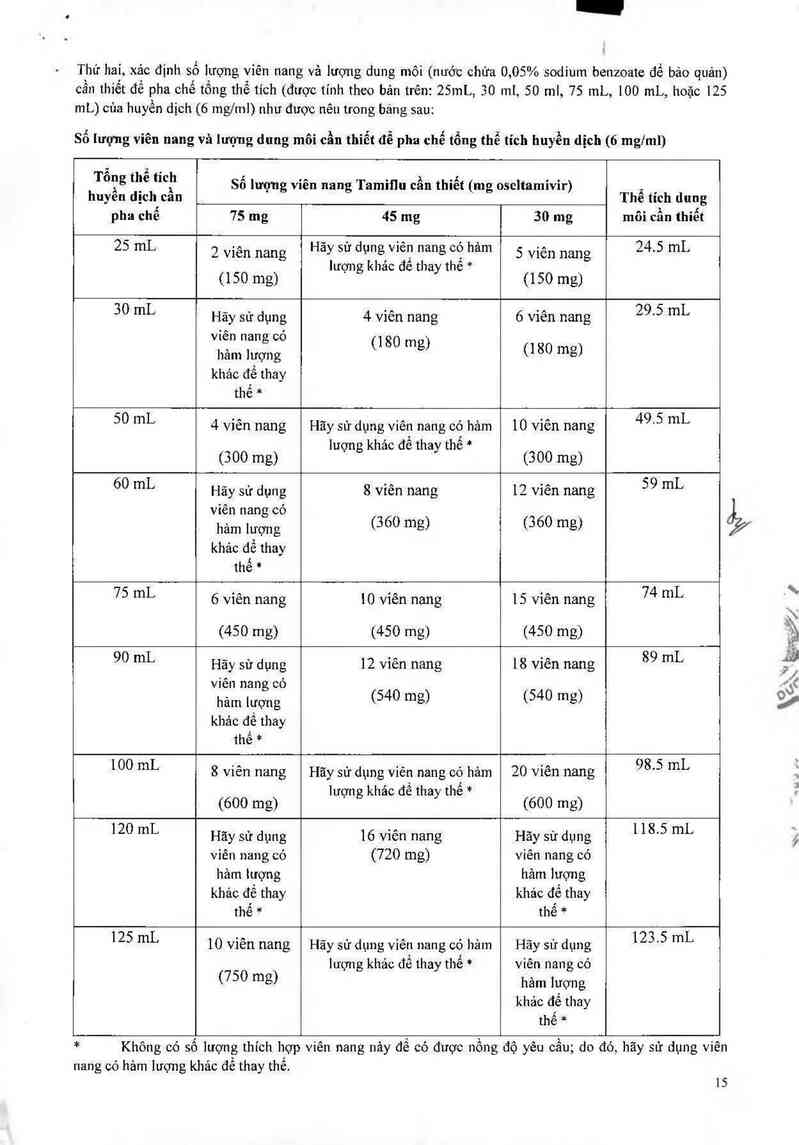
Thứ hai, xác định số lượng viên nang và lượng dung môi (nước chứa 0,05% sodium benzoatc đề bảo quản)
cân thiêt đê pha chế tông thế tích (được tính theo bản trên: 251nL, 30 ml, 50 ml, 75 mL, 100 mL, hoặc 125
mL) cùa huyền dịch (6 mg/ml) như được nêu trong bảng sau:
Số lượng viên nang và lượng dung môi cần thiết để pha chế tổng thể tích huyền dịch (6 mg/ml)
Tông tlfê tích Số lượng vỉên nang Tamiqu cần thỉết (mg oscltamivỉr) ,
huyen dịch'can The tích dung
pha chê 75 mg 45 mg 30 mg môi cần thiết
25 mL 2 viên nang Hãy sử dụng vỉẽn nang cớ hảm 5 viên nang 24.5 mL
lượng khảc để thay thế *
(150 mg) (150 mg)
30 mL Hãy sử dụng 4 viên nang 6 viên nang 295 mL
viên nang CÓ 180 m
hâm lượng ( g) (180 mg)
khảc để thay
thế *
50 mL 4 vỉên nang Hãy sử dụng viên nang có hảm 10 Viên nang 495 mL
lượng khảo để thay thế *
(300 mg) (300 mg)
60 mL Hãy sử dụng 8 viên nang 12 viên nang 5 9 mL
viên nang có
hảm lượng (360 mg) (360 mg) _/
khảo để thay
thế *
75 mL 6 viên nang 10 viến nang 15 viên nang 74 mL
(450 mg) (450 mg) (450 mg)
90 mL Hãy sử dụng 12 viên nang 18 viên nang 89 mL
viên nang có
khảo để thay
thế *
100 mL 8 viên nang Hãy sử dụng viên nang có hảm 20 viên nang 98'5 mL
lượng khảo để thay thế *
(600 mg) (600 mg)
120 mL Hãy sử dụng 16 vỉên nang Hãy sử dụng 118'5 mL
viên nang có (720 mg) viên nang có
hảm 1ượng hảm lượng
khảo để thay khảc để thay
thế * thế *
125 mL 10 vỉên nang Hãy sử dụng viên nang có hảm Hãy sử dụng 1235 mL
lượng khảo để thay thế * viên nan g có
(750 mg) hảm lượng
khảc để thay
thế *
* Không có số lượng thich hợp viên nang nảy đế có được nồng độ yêu cầu; do đó, hãy sử dụng viên
nang có hảm lượng khảo để thay thế.
15
Thứ ba, tuân theo quy trình dưới đây để pha trộn huyền dịch (6 mg/ml) từ viên nang Tamiflu:
1. Chuyển toản bộ lượng thuốc có trong số lượng viên nang yêu oầu vảo chai và thêm lượng dung dịch
sodium benzoate theo yêu câu (Bảng trên)
2. Đậy nắp chai vả lắc trong hai phút.
3. Dán nhãn phụ lên chai ghi rõ “Lắc nhẹ trưởc khi dùng”
4. Hướng dẫn cha mẹ hoặc người chăm sóc bỏ đi bất kỳ dung dịch nảo còn thừa sau khi bệnh nhân đã
hoản thảnh đọt điều trị.
5. Dản nhãn ghi hạn dùng thích hợp tuỳ theo điều kiện bảo quản (xem dưới đây).
Bảo quản huvền dich thuốc (6 mg/mlì pha ohế ở nhà thuốc:
Điều kiện bảo quản ở nhiệt độ phòng: Ôn định trong 3 tuần (21 ngảy) khi được bảo quản ở nhiệt độ phòng
“không quá 25°C”.
Điều kiện bảo quản lạnh: Ôn định trong 6 tuần khi được bảo quân ở nhiệt độ từ 2OC đến 800
Dản nhãn của nhả thuốc trên chai ghi rõ tên bệnh nhân, hưởng dẫn sử dụng, ngảy hết hạn, tên thuốc và bắt kỳ
thông tin bắt buộc nảo khác theo quy định về dược phẩm của địa phương.
Liều hỗn dich pha chế tai nhả thuốc (6 mg/ij
Tham khảo Phần 2.2 Liều lượng vả cách dùng để có chỉ đẽ… liều dùng đầy đủ
Liều thuốc phù hợp sẽ được người chăm sóc trộn với lượng tương tư đồ uống ngọt, như nước đường, si rô
socholate, si rô anh đảo, kem phủ bảnh (như caramel hoặc sốt kem bơ) để che dấu vị đắng. ệ
Chia liều huyền dịch nảy bằng xy lanh có vạch lường thuốc uống để đong những lượng huyền dịch nhỏ.
4.3 Đỏng gói
Viên nang 75 mg. Hộp 1 ví chứa 10 viên.
Thuốc: Để xa tầm với của trẻ em
Đọc kỹ hưởng dẫn sử dụng trưởc khi dùng. Nếu cần biết thêm thông tpLĩin hỏi ý kiểu bác sĩ oủa bạn.
Lưu hảnh thảng 03 năm 2014
Sản xuất bởi Cenexi SAS
52, rue Marcel et Jacques Gauchcr
94120 Fontenay—sous—Bois, Pháp
Tel: 33 1 43 94 88 00
Fax: 33 1 43 94 88 76 PHÓ CỤ TPUỞNG
if : 0% ^
Đóng gói bới F. Hoữmann-La Roche Ltd. GV Ồỹ’aắi’ffl’ l/t,ef CÍẩUZỹ
CH-4303 Kaiseraugst, Switzerland
Tel:41616881111
Fax: 41 61 688 93 91
. -_ .-v
…i ý
.
.
l
.
l
5.
!
,Ir“ ~.'›
lụa hv Q›.r up
.:
lu— f—ý
…
-
u › Q
; 1’ `Ấ
’.lJ ; ' .
— I
1
-. _;—
’Ụ
c_'A- _,J.
.- -.v …
:s-_uvt
I
`.
.-` bu—
I.
J
-›I
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng